Efectos metabólicos e inmunológicos del ayuno intermitente en una dieta cetogénica
Efectos metabólicos e inmunológicos del ayuno intermitente en una dieta cetogénica que contiene triglicéridos de cadena media en perros sanos
 Y. Becca Leung1*
Y. Becca Leung1*  Nick J. Cueva1
Nick J. Cueva1  Axel Heiser2
Axel Heiser2  Patricio J. B. Edwards3
Patricio J. B. Edwards3  A. Jonathan R. Godfrey3
A. Jonathan R. Godfrey3  Tim Wester4
Tim Wester4- 1Facultad de Ciencias Veterinarias, Universidad de Massey, Palmerston North, Nueva Zelanda
- 2AgResearch, Centro de Investigación de Pastizales, Instituto de Investigación de Hopkirk, Palmerston North, Nueva Zelanda
- 3Facultad de Ciencias Fundamentales, Universidad de Massey, Palmerston North, Nueva Zelanda
- 4Facultad de Agricultura y Medio Ambiente, Universidad de Massey, Palmerston North, Nueva Zelanda
En varias especies, se ha demostrado que el ayuno intermitente (AI) tiene efectos beneficiosos, como el retraso del envejecimiento, el aumento de la esperanza de vida, el aumento de la sensibilidad a la insulina, la reducción del daño tisular isquémico, el retraso en la aparición de enfermedades neurodegenerativas y la mejora de la reparación neuronal después de una lesión. Sin embargo, los efectos metabólicos e inmunológicos del ayuno intermitente no han sido bien establecidos en perros. El objetivo de este estudio fue examinar los efectos de un régimen de ayuno intermitente de 48 h utilizando una dieta baja en grasas y alta en grasas en perros sanos mediante la cuantificación de los cambios metabólicos, hormonales e inmunológicos. Planteamos la hipótesis de que los perros con ayuno intermitente tendrían concentraciones más altas de cetonas y grelina en sangre, concentraciones más bajas de leptina, insulina y glucosa en sangre, y signos de inmunosupresión en comparación con los perros que comen a diario. Diez perros adultos sanos fueron aleatorizados en tres grupos y se sometieron a tres regímenes de alimentación en un diseño de 3 × 3 cuadrados latinos: dos veces al día alimentándose con un bajo contenido de grasa (23% de energía proveniente de grasa; LF), 48 h de ayuno con una dieta baja en grasas, y 48 h de ayuno con una dieta alta en grasas enriquecida con triglicéridos de cadena media (68% de energía a partir de grasas; IC). Se midió el peso corporal, la ingesta de alimentos, la actividad, la glucemia, el β-hidroxibutirato, la leptina, la grelina y la insulina. La proliferación de linfocitos y la fagocitosis de neutrófilos/macrófagos y el estallido respiratorio se midieron como marcadores de la función inmune. Se utilizó la espectroscopia de resonancia magnética nuclear para cuantificar relativamente los metabolitos plasmáticos. Cuando los perros seguían una dieta de HF, tenían la mayor concentración de cetonas en sangre (media de 0,061 mmol/L, DE 0,024), mientras que tenían la concentración más baja (media de 0,018 mmol/L, DE 0,004) cuando se alimentaban diariamente. Las concentraciones de glucosa e insulina en sangre fueron más bajas en los perros con ayuno intermitente con una dieta de IC en comparación con la alimentación diaria o el ayuno intermitente con una dieta de baja tensión. Hubo un aumento en las concentraciones plasmáticas de β-hidroxibutirato y una reducción en las concentraciones de glucosa e insulina cuando los perros estaban con ayuno intermitente en una dieta de IC. Solo hubo una disminución en los parámetros inmunológicos estudiados cuando los perros estaban FI en una dieta LF, lo que no se observó cuando estaban en la dieta HF. Los resultados de este estudio indican el potencial del FI para ser investigado más a fondo como un régimen de alimentación potencialmente beneficioso para los perros.
Introducción
Todavía no se han establecido regímenes de alimentación óptimos para pacientes hospitalizados tanto veterinarios como humanos. La subalimentación es común durante la hospitalización y se asocia con inmunidad deprimida, aumento de las tasas de reingreso y aumento de la mortalidad (1-4). Sin embargo, también se ha demostrado que la sobrealimentación de pacientes en estado crítico tiene efectos nocivos (5-7). En particular, la hiperglucemia iatrogénica puede provocar un deterioro de la cicatrización de heridas, disfunción neuronal, aumento de la producción de las citocinas inflamatorias interleucina-6 (IL-6) y factor de necrosis tumoral α (TNF-α), inhibición de la función leucocitaria, vasculitis y, en última instancia, un peor resultado clínico (8-13). Algunos de estos efectos pueden anularse cuando se normaliza la glucosa en sangre (9, 14). Por lo tanto, mientras que los médicos quieren proporcionar una nutrición adecuada a los pacientes hospitalizados, deben establecer los mejores medios para hacerlo, evitando al mismo tiempo la hiperglucemia.
Un régimen de alimentación potencialmente efectivo para lograr estos objetivos agnósticos es el ayuno intermitente. El ayuno intermitente es el proceso de reducir la frecuencia de las comidas con el fin de prolongar el período de ayuno entre comidas, pero sin restringir necesariamente la ingesta calórica total cuando se expresa durante un período de tiempo más largo. Se ha descubierto que extender el período de ayuno entre comidas aumenta la sensibilidad a la insulina, reduce la fructosamina sérica, reduce la proliferación de células cancerosas, reduce las concentraciones de citocinas proinflamatorias IL-6, IL-1β y TNF-α en circulación, retrasa el envejecimiento y mejora la reparación neuronal después de una lesión en comparación con la alimentación continua (15-25). En ratones sanos, las concentraciones de glucosa e insulina en sangre se redujeron después de un período de ayuno intermitente (21). Se han propuesto varios mecanismos, incluida la reducción de las especies reactivas de oxígeno derivadas de las mitocondrias, la activación de las sirtuinas y la promoción asociada de la autofagia y la limpieza celular, y la disminución de la expresión de la proteína quinasa activada por mitógenos p38, un mediador de la apoptosis (18, 26-28). Estos mecanismos potenciales permitirían una reducción del estrés oxidativo y una respuesta de reparación más personalizada después de una lesión.
Un régimen de ayuno intermitente es de particular interés en pacientes con enfermedad de la columna vertebral, ya que se ha demostrado que reduce el tamaño de la lesión y mejora la recuperación en modelos de lesiones de la columna vertebral en roedores en comparación con la alimentación diaria (21-23). Las cetonas, que aumentan durante el período de ayuno, regulan al alza la sirtuina 3 dependiente de nicotinamida adenina dinucleótido (NAD) y la superóxido dismutasa, aumentan la expresión de la proteína promotora de la autofagia O3a y reducen la lesión neuronal en la corteza cerebral de las ratas después de la hipoglucemia inducida experimentalmente (29, 30). Además, la grelina, un péptido orexigénico secretado por el estómago en ayunas, protege a las neuronas de la isquemia y la lesión por reperfusión in vivo, y disminuye la expresión del TNF-α y la IL-1β de las células microgliales en cultivos de células neuronales mesencefálicas modeladas con Parkinson (31, 32). Por lo tanto, el ayuno intermitente puede ser una estrategia de alimentación que promueve la recuperación neuronal y, al mismo tiempo, evita la hiperglucemia.+
Aunque el ayuno intermitente tiene muchos beneficios potenciales, también hay posibles consecuencias perjudiciales. Se sabe que las funciones inmunes humorales y celulares disminuyen en un estado de ayuno, lo que es en parte el resultado de una caída en la adipoquina plasmática, la leptina (33, 34). La leptina aumenta la quimiotaxis de los neutrófilos y la fagocitosis de los macrófagos, y afecta a la maduración de las células T (35). El ayuno a corto plazo en varias especies reduce las respuestas mediadas por células T y el número de células inmunitarias esplénicas y periféricas (17, 36, 37). La inyección de leptina en ratones ob/ob en ayunas o deficientes en leptina revierte la supresión de la diferenciación de linfocitos, la fagocitosis de los macrófagos y las respuestas de hipersensibilidad de tipo retardado causadas por la deficiencia de leptina (34, 38, 39). Sin embargo, las ratas que consumen una dieta alta en grasas atenúan la caída de leptina durante el ayuno y aumentan la producción de cetonas entre comidas (40, 41). Además, la alimentación con triglicéridos de cadena media (MCT) promueve la formación de cetonas en el estado alimentado (42, 43). Después de comer, la mayoría de los ácidos grasos de cadena media se absorben a través de la circulación portal y son metabolizados por los hepatocitos en cetonas (44, 45). Por lo tanto, alimentar con una dieta alta en grasas enriquecida con MCT puede tener el doble beneficio de mantener la concentración sérica de leptina y, al mismo tiempo, promover la cetogénesis durante los cortos períodos de ayuno. Por lo tanto, el ayuno intermitente con una dieta alta en grasas enriquecida con MCT puede ser preferible.
El objetivo principal de este estudio fue determinar los efectos metabólicos e inmunológicos de un régimen de ayuno intermitente de 48 h en perros sanos. Nuestra hipótesis principal era que los perros sometidos a ayuno intermitente tendrían concentraciones plasmáticas más altas de β-hidroxibutirato y grelina, y concentraciones más bajas de glucosa, insulina y leptina en comparación con los perros alimentados diariamente. Nuestra hipótesis secundaria fue que los perros sometidos a un régimen de ayuno intermitente con una dieta alta en grasas enriquecida con triglicéridos de cadena media tendrían mayores concentraciones de β-hidroxibutirato y leptina en sangre en comparación con los perros que ayunaban intermitentemente con una dieta baja en grasas.
Materiales y métodos
Animales
Después de un examen físico completo, se utilizaron 10 perros adultos sanos de la Unidad de Nutrición Canina de la Universidad de Massey en este estudio. Los perros eran de dos razas: Harrier Hounds (n = 7) y New Zealand Huntaways (n = 3), y estaban compuestos por cuatro machos castrados y seis hembras espiadas. Los perros tenían una edad media de 7,1 (DE 2,1) años, un peso corporal medio de 27,8 (DE 3,1) kilogramos y una puntuación media de condición corporal (BCS) de 4,2 (DE 0,4). El protocolo del estudio fue aprobado por el Comité de Ética Animal de la Universidad de Massey (MUAEC #16/130).
Diseño del estudio
Una semana antes del comienzo del estudio, todos los perros fueron sometidos a una dieta seca comercial alta en carbohidratos y baja en grasas para permitir la aclimatación. Los perros fueron alimentados para satisfacer sus necesidades energéticas de mantenimiento basándose en los datos históricos de la colonia. Después de este período de aclimatación, los perros fueron asignados al azar en uno de los tres grupos que se sometieron a cada régimen de prueba de alimentación en un diseño de 3 × 3 cuadrados latinos con una duración de «lavado» de una semana en el medio. Los tres regímenes de alimentación fueron los siguientes: (1) alimentación diaria con una dieta baja en grasas (LF) y alta en carbohidratos (BID), (2) ayuno intermitente (alimentación una vez cada 48 h) con la misma dieta LF (IF LF) y (3) ayuno intermitente (alimentación una vez cada 48 h) con una dieta alta en grasas (HF). Ambas dietas utilizadas en este estudio fueron formuladas para cumplir con los requisitos nutricionales para perros adultos definidos por la Asociación Estadounidense de Funcionarios de Control de Alimentos (AAFCO). Un alimento seco comercial1 fue elegida como la dieta baja en grasas y alta en carbohidratos. La dieta alta en grasas se creó utilizando la misma dieta comercial seca con la adición de proteína de suero de leche en polvo, sebo de res, aceite de girasol, aceite de coco y una mezcla multivitamínica / mineral2 para asegurar la suficiencia de la dieta total. La cantidad total de triglicéridos de cadena media (C8, C10, C12) del aceite de coco y del sebo de vacuno ascendió al 14,7% de las calorías totales de la dieta cuando se utilizó una energía de 6,8 kcal/gramo para los MCT (46). Los perfiles nutricionales de ambas dietas se presentan en la Tabla 1.
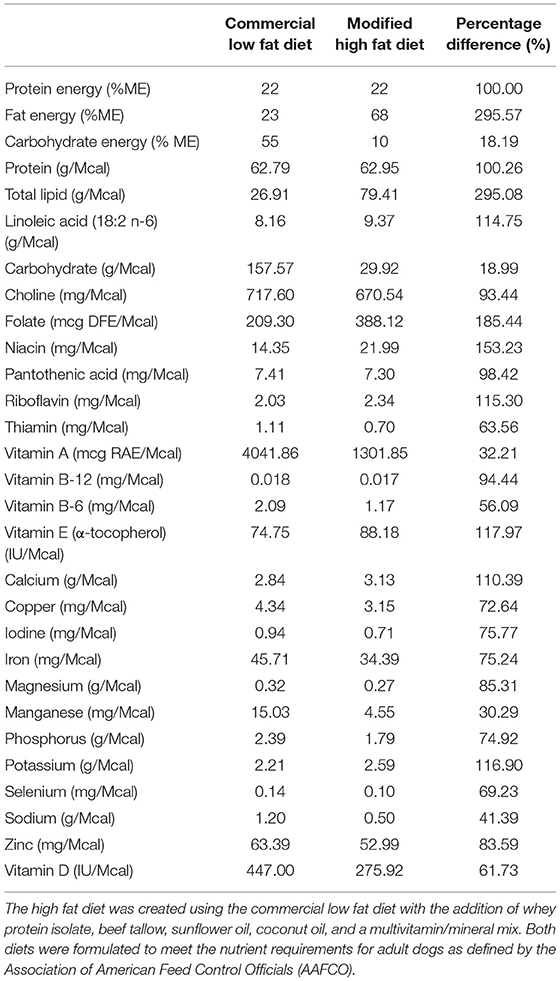 TABLA 1. El perfil nutricional de la dieta comercial baja en grasas y la dieta alta en grasas modificada.
TABLA 1. El perfil nutricional de la dieta comercial baja en grasas y la dieta alta en grasas modificada.
Cuando los perros estaban en el régimen de alimentación diaria, se les ofrecía su requerimiento de energía de mantenimiento dividido en partes iguales en dos comidas que se proporcionaban por la mañana y por la tarde. Cuando los perros estaban en el régimen de ayuno intermitente, se les ofreció el doble de su requerimiento de energía de mantenimiento por la mañana cada dos días. A los perros se les permitió hasta 3 h para consumir su comida, después de lo cual se retiró la comida y se pesó. Durante el período de lavado entre los regímenes de alimentación, todos los perros fueron colocados en la dieta seca comercial alta en carbohidratos y baja en grasas y alimentados dos veces al día durante 1 semana.
En los días 1, 3, 5 y 7 de un período de prueba, se recolectó una muestra de sangre en ayunas (12 ml en total) en heparina de litio y vacutainers rojos simples3 de todos los perros por venopunción yugular antes de que se les ofreciera comida. El día 1 representó una muestra basal en ayunas nocturnas, mientras que las muestras recolectadas en los días 3, 5 y 7 representaron un ayuno de 12 horas cuando los perros comían diariamente o un ayuno de 48 horas cuando los perros ayunaban intermitentemente. Inmediatamente después de la extracción de sangre, un inhibidor de la proteasa4 se añadió a la muestra en el vacutainer rojo liso para evitar la degradación de la grelina. Todas las muestras se colocaron en hielo hasta que se centrifugaron y se extrajeron el suero y el plasma. Se registró la ingesta diaria de alimentos, el peso corporal semanal y la puntuación de la condición corporal de todos los perros. Para comparar la ingesta calórica de los perros en los diferentes regímenes de alimentación, el total de calorías ingeridas cada 2 días (es decir, días 1 y 2, días 3 y 4, días 5 y 6) se dividió por el peso inicial semanal de cada perro a la potencia de 0,75 para expresar la ingesta como kcal por 48 h/kgBWT0.75. Además, se midió la actividad diurna (de 5 a 20 horas) y nocturna (de 20 a 5 horas) de los perros mediante un acelerómetro triaxial5 ajustado a su cuello.
Después de la toma de muestras de sangre en el día 7, todos los perros fueron colocados en el régimen de alimentación de «lavado». Después de un lavado, cada grupo fue alimentado de acuerdo con su siguiente régimen de alimentación asignado, y se tomaron muestras de sangre como se describió anteriormente. Esto se repitió una vez más, de modo que todos los grupos se sometieron a cada uno de los tres regímenes de alimentación diferentes con un período de lavado en el medio.
β-hidroxibutirato, glucosa y metabolómica
Dentro de 1 h después de la recolección, se recolectó plasma de los vacutainers de heparina después de la centrifugación durante 10 min a 3,000 rcf a 4 °C. La glucosa plasmática se analizó con un glucómetro de mano6 que ha sido previamente validado para su uso en perros (47). El plasma restante se almacenó a -80 °C hasta su posterior análisis.
El β-hidroxibutirato se analizó en muestras de plasma de los días 3, 5 y 7 de cada régimen mediante un ensayo colorimétrico7 de acuerdo con las instrucciones del fabricante. Las muestras de plasma descongeladas se desproteinaron inicialmente utilizando columnas de centrifugación de 10 kD8 y centrifugado a 10.000 rcf durante 10 min. A continuación, se prepararon las muestras y se midió la absorbancia a 450 nm utilizando un lector de microplacas9.
La resonancia magnética nuclear (RMN) se utilizó para la metabolómica plasmática. Las muestras se prepararon con base en el protocolo descrito en un estudio previo (48). Brevemente, se desproteinaron 300 μL de plasma con 600 μL de metanol y se incubaron a -20 °C durante 30 min. A continuación, las muestras se centrifugaron a 13.400 rcf durante 30 min y el sobrenadante se retiró y se colocó en un evaporador rotativo durante 3,5 h a 20°C. Cualquier sobrenadante restante en las muestras se secó completamente mediante liofilización. A continuación, las muestras secas se almacenaron en viales con tapa de rosca10 a -80 °C hasta el análisis. El día del análisis, se preparó una solución tampón fosfato disolviendo 928,6 mg de NaH anhidro2P04 y 320,9 mg de Na anhidro2HPO4 en 100 g de D20, y se utiliza con una modificación adicional del pH. Las muestras secas se reconstituyeron utilizando 600 μL de D tamponado con fosfato2O, junto con dos patrones [0,5 mM de sal sódica de 2,2-dimetil-2-silapentano-5-sulfonato (DSS)11 y 5 mM de imidazol12] para permitir ajustes en los cambios químicos y el pH. A continuación, las muestras se transfirieron a tubos de RMN de 5 mm13 y se analizó utilizando un espectrómetro Bruker Avance de 700 MHz equipado con cyroprobe (Bruker Biospin, Rheinstetten, Alemania) que opera a 700,13 MHz. Las muestras se midieron a 25 °C utilizando una secuencia de pulsos 1D NOESY estándar con presaturación de la señal de agua residual. Los espectros se registraron utilizando 58k puntos y un tiempo de adquisición de 3,5 s, seguido de un retardo de relajación de 1,5 s. 1Espectros de RMN H. La fase y la corrección de la línea de base de todos los espectros de RMN se verificaron manualmente.
Endocrinología
Los vacutainers rojos simples se centrifugaron durante 10 min a 3.000 rcf a 4 °C y se extrajeron el suero dentro de 1 h después de la recolección. El suero se almacenó a -80° C hasta el análisis. La leptina, la grelina y la insulina se analizaron mediante un inmunoensayo multiplex comercial14. Las muestras se prepararon siguiendo las instrucciones del fabricante. Brevemente, se añadieron 50 μL de suero a una placa de 96 pocillos a la que se añadió un tampón y perlas conjugadas con anticuerpos. Las placas se agitaron suavemente durante la noche a 4 °C. A continuación, se lavaron las placas, se añadieron anticuerpos de detección y, finalmente, se analizaron mediante un lector multiplex15.
Ensayos inmunológicos
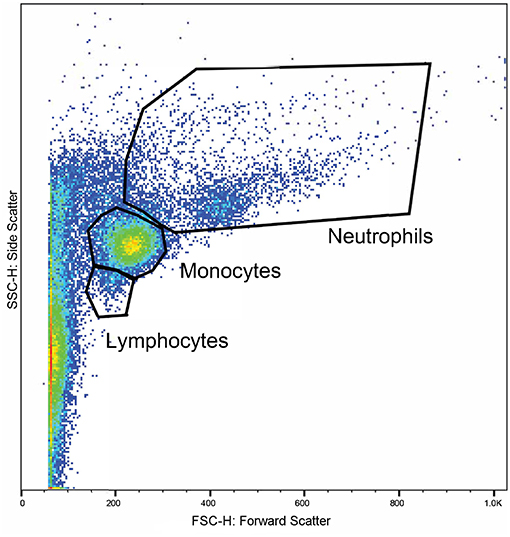
La sangre entera de los vacutainers de litio se utilizó dentro de una hora después de la recolección. La fagocitosis leucocitaria y el estallido respiratorio se analizaron mediante citometría de flujo utilizando un analizador celular16 y marcadores fluorescentes para fagocitosis17 y estallido oxidativo18. Se utilizó un protocolo modificado que se basó en trabajos publicados previamente (49, 50). Se prepararon cuatro tubos de citometría de flujo para cada muestra. En cada tubo, se incubaron 100 μl de sangre total a 37 °C durante 30 min con 10 μl de solución de DHR de 143 μM, 50 μl de pHrodo™, ambos compuestos o nada añadido. Después de la incubación, se añadieron 2,7 mL de agua desionizada para lisar los eritrocitos. A los 2 minutos de añadir el agua desionizada, se añadieron 300 μL de PBS 10X y las muestras se centrifugaron a 600 rcf durante 7 min. El sobrenadante se decantó y se repitió el proceso con 3 mL de PBS. A continuación, se añadió formaldehído al 3% en PBS y las muestras se incubaron a temperatura ambiente durante 5 min para su fijación. Finalmente, se añadieron 2 mL de PBS y las muestras se centrifugaron a 350 rcf durante 7 min. Se retiró el sobrenadante y se suspendió el gránulo en 200 μL de PBS con suero fetal de ternero (FCS) al 2% en tubos de fondo redondo de poliestireno de 5 mL19. Las muestras se adquirieron con un citómetro de flujo20 hasta que se recopilaron al menos 10.000 eventos. Las poblaciones de linfocitos, monocitos y neutrófilos se identificaron en función del tamaño y la granularidad en un diagrama de dispersión frontal y lateral (Figura 1). Los cuadrantes para células positivas simples y dobles se demarcaron utilizando el conjunto de muestras de control (Figura 2). Los resultados de las poblaciones cerradas se expresaron como el porcentaje positivo para las células sometidas a fagocitosis y/o estallido respiratorio, y su intensidad media de fluorescencia.
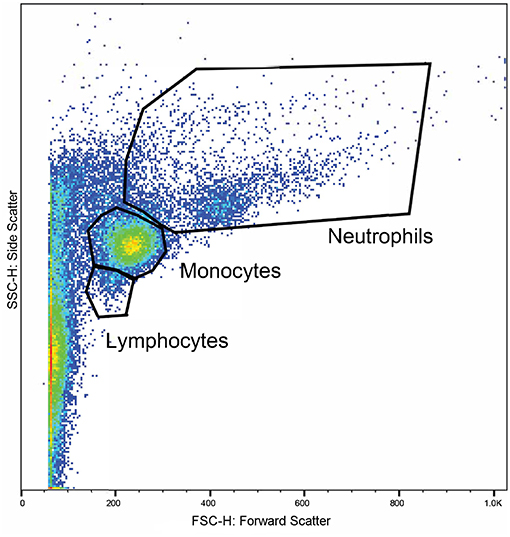 FIGURA 1. Un gráfico representativo que muestra las propiedades de dispersión de citometría de flujo de los leucocitos en una muestra. La dispersión directa (eje x) corresponde al tamaño de las celdas y la dispersión lateral (eje y) corresponde a la granularidad de las celdas. Las regiones se cerraron alrededor de grupos de células correspondientes a las ubicaciones esperadas para linfocitos, monocitos y neutrófilos.
FIGURA 1. Un gráfico representativo que muestra las propiedades de dispersión de citometría de flujo de los leucocitos en una muestra. La dispersión directa (eje x) corresponde al tamaño de las celdas y la dispersión lateral (eje y) corresponde a la granularidad de las celdas. Las regiones se cerraron alrededor de grupos de células correspondientes a las ubicaciones esperadas para linfocitos, monocitos y neutrófilos.
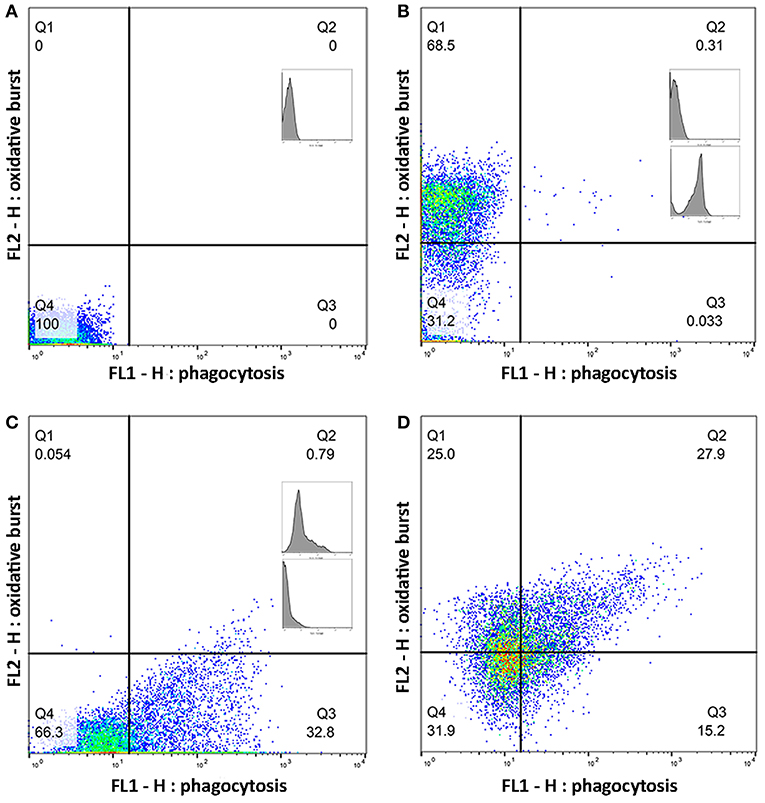 FIGURA 2. Los cuadrantes para células positivas simples y dobles se establecieron utilizando un conjunto de muestras de control. Los gráficos (A-D) muestran una muestra representativa de monocitos cerrados de una muestra. El número en cada cuadrante es el porcentaje de celdas. (A) Monocitos sin flurocromo añadido. (B) Monocitos con solo dihidrorodamina (DHR) 123 añadida. (C) Monocitos con solo pHrodo™ Red S. Añadió Aureus. (D) Monocitos con DHR y pHrodo™ Red S. aureus añadidos.
FIGURA 2. Los cuadrantes para células positivas simples y dobles se establecieron utilizando un conjunto de muestras de control. Los gráficos (A-D) muestran una muestra representativa de monocitos cerrados de una muestra. El número en cada cuadrante es el porcentaje de celdas. (A) Monocitos sin flurocromo añadido. (B) Monocitos con solo dihidrorodamina (DHR) 123 añadida. (C) Monocitos con solo pHrodo™ Red S. Añadió Aureus. (D) Monocitos con DHR y pHrodo™ Red S. aureus añadidos.
La proliferación linfocitaria se realizó en sangre total heparinizada. Para cada muestra, se transfirieron 25 μL de sangre a ocho pocillos en una placa de 96 pocillos en U. A continuación, se añadieron 200 ng/mL de solución de enterotoxina B (SEB)/lipopolisacáridos (LPS) de Staphylococcus a cuatro de los pocillos. A continuación, las placas se incubaron a 37 °C con 5 % de CO2 atmósfera humidificada durante 3 días. A continuación, se utilizaron 50 μL de 3A cada pocillo se le añadió H-timidina de una solución madre de 10 μCi/mL. La placa se incubó durante 4 h a 37°C en CO al 5%2 atmósfera humidificada durante 4 h y luego almacenada a -80 °C hasta el análisis. A continuación, las células se cosecharon y contaron mediante centelleo líquido.
Tamaño de la muestra
Se realizó un análisis de potencia a priori utilizando una diferencia de medias deseada y desviaciones estándar publicadas previamente para metabolitos y hormonas clave. La diferencia de medias y la desviación estándar (DE) utilizadas en el análisis de potencia fueron: β-hidroxibutirato 0,05 (DE 0,01 mmol/L), grelina 75 (DE 53 pg/mL), leptina 3.000 (DE 3.000 pg/mL) e insulina 220 (DE 150 pg/mL). Esto indicó que sería necesario un tamaño de muestra de 10 perros para un nivel de significación (α) de 0,5 y un poder del 80% para detectar una diferencia en β-hidroxibutirato, grelina, leptina e insulina.
Análisis estadístico
Metabolómica
Para el análisis, los espectros de RMN se dividieron en cubos espectrales de 0,04 ppm, donde se excluyeron las regiones correspondientes al agua y al DSS (4,68 a 4,88, -0,1 a 0,1 ppm, respectivamente), junto con las siguientes regiones adicionales 5,51 a 5,84, 5,92 a 6,07 y 6,11 a 6,31. Todos los espectros fueron normalizados por intensidad total.
La relación entre los grupos de dieta y el metaboloma se exploró mediante el análisis de componentes principales (ACP), el análisis discriminante de mínimos cuadrados parciales (PLS-DA) y el análisis discriminante de mínimos cuadrados parciales ortogonales (OPLS-DA) se realizaron mediante SIMCA v13.0 (Umetrics, Suecia). Estos métodos estadísticos pueden revelar la agrupación de muestras en diferentes agrupaciones en función de las diferencias de las concentraciones de metabolitos en la población de la muestra. La PCA es un método no supervisado y es quizás el más robusto. PLS-DA y OPLS-DA son los llamados métodos supervisados y utilizan un conocimiento a priori de la pertenencia al grupo para ajustar los datos y maximizar la separación de los datos de estos grupos. Se utilizó la escala de Pareto para los modelos supervisados y los modelos PLS se validaron mediante pruebas de permutación para descartar el sobreajuste. Los cubos espectrales que contribuyeron a la mayor varianza en las muestras se identificaron a partir de parcelas de carga y posteriormente se asignaron a sus metabolitos asociados utilizando la biblioteca de metabolitos Chenomx v8.3 (Chenomx Inc., Alberta, Canadá). A continuación, las concentraciones de metabolitos se cuantificaron mediante el ajuste manual de los picos espectrales en la suite de RMN de Chenomx. Las concentraciones plasmáticas de β-hidroxibutirato medidas por el ensayo colorimétrico se compararon con las concentraciones obtenidas a partir de los espectros ajustados utilizando el paquete «BlandAltmanLeh» v0.3.1 (51) en el software estadístico R Studio v1.1.456 (52).
Modelado
Se utilizó el paquete «lme4» (53) del software estadístico R Studio v1.1.456 (54) para realizar un análisis lineal de efectos mixtos de la relación entre las variables de resultado [cambio en el peso, la ingesta, la actividad, la glucosa, el β-hidroxibutirato, la leptina, la grelina, la insulina, la evaluación del modelo homeostático (HOMA), los metabolitos de la RMN, la proliferación de linfocitos y los resultados de la citometría de flujo] y las variables fijas (tiempo, dieta, edad, sexo y BCS). Se ajustaron modelos separados para cada variable de resultado. El perro se incluyó como un efecto aleatorio para tener en cuenta las medidas repetidas. Las interacciones entre las variables fijas, y entre la dieta y la secuencia de la dieta, no fueron significativas, por lo que no se incluyeron en los modelos finales.
Si la inspección visual de los gráficos cuantil-cuantil residual y la prueba de Shapiro-Wilk de los residuos indicaban una desviación de la normalidad u homocedasticidad, se realizaban transformaciones de la variable dependiente en un intento de mejorar la consistencia de los supuestos del modelo. Sin embargo, la transformación no condujo a un cambio en la interpretación de los modelos ni en nuestras conclusiones. Por lo tanto, para simplificar, los gráficos y el modelo final se informan con los datos no transformados.
Se realizó una comparación post-hoc por pares de las medias marginales estimadas con la corrección de Tukey cuando la dieta fue significativa en el modelo final. Los resultados de los modelos de efectos mixtos se presentan como las medias y el error estándar de las medias. P ≤ 0,001 se consideraron indicativos de evidencia muy sólida, p ≤ 0,01 de evidencia sólida, p ≤ 0,05 de evidencia moderada, p ≤ 0,1 de evidencia débil y p ≤ 0,1 de evidencia insuficiente (55).
Resultados
Ingesta, peso corporal, puntuación de condición corporal y actividad
No hubo diferencias en ninguno de los parámetros basales antes de que los grupos comenzaran su régimen de alimentación asignado en ninguna de las semanas de tratamiento (P > 0,5). Todos los perros se mantuvieron en un BCS de 4 o 5 de 9 durante todo el estudio. Cuando se alimentaron diariamente, los perros tuvieron una mayor ingesta de alimentos en comparación con cuando se alimentaron de forma intermitente (P < 0,001), sin embargo, no hubo diferencia en la ingesta entre los perros cuando se alimentaron intermitentemente con las dietas LF o HF (P = 0,395, Tabla 2). Los perros machos consumieron más comida por kgBWT0.75 que las perras (media 277 ± 67 vs. 226 ± 50 kcal/kgBWT0.75). Los perros perdieron más peso cuando ayunaron intermitentemente con una dieta baja en grasas, pero no hubo diferencias en el porcentaje de cambio de peso corporal cuando los perros fueron alimentados diariamente en comparación con cuando ayunaron intermitentemente con un régimen de dieta alta en grasas (Tabla 2). Además, cuando los perros fueron alimentados diariamente, fueron más activos por la noche en comparación con cuando fueron alimentados intermitentemente con la dieta LF (P = 0,028) y la dieta HF (P = 0,012).
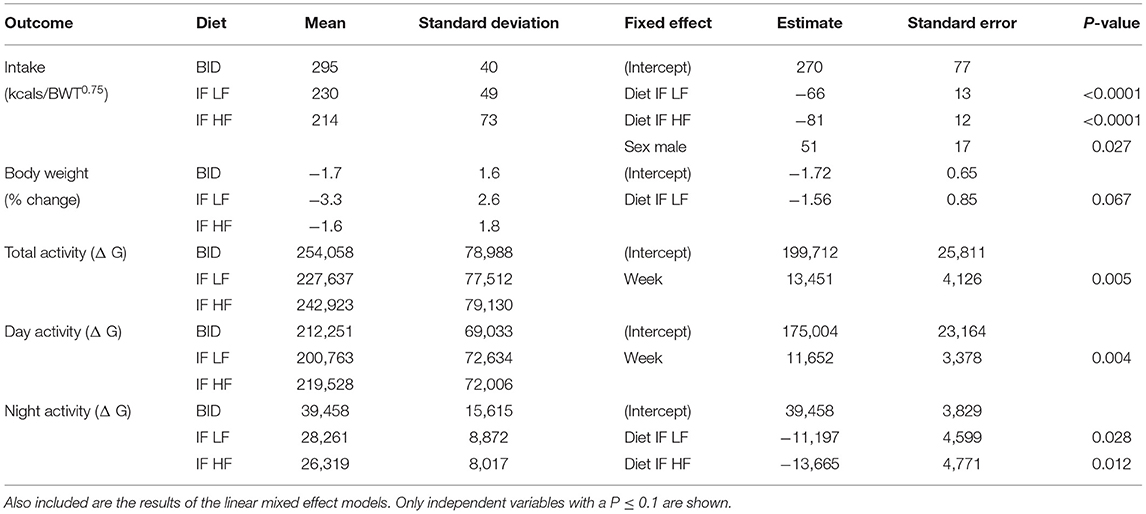 TABLA 2. Las medias y desviaciones estándar de la ingesta de alimentos, el cambio en el peso corporal y la actividad en 10 perros alimentados diariamente (BID) y ayunados intermitentemente con una dieta baja en grasas (IF LF) y una dieta alta en grasas (LF HF) en un diseño de cuadrado latino.
TABLA 2. Las medias y desviaciones estándar de la ingesta de alimentos, el cambio en el peso corporal y la actividad en 10 perros alimentados diariamente (BID) y ayunados intermitentemente con una dieta baja en grasas (IF LF) y una dieta alta en grasas (LF HF) en un diseño de cuadrado latino.
Metabolitos
Metabolómica
El análisis de componentes principales indicó cierta separación entre los grupos de dieta, siendo los dos primeros componentes principales los que explicaron el 45,6 y el 9,1% de la varianza, respectivamente. Los análisis posteriores con un modelo discriminante de mínimos cuadrados parciales ortogonales supervisados mostraron una separación completa del grupo alimentado diariamente y los grupos con ayuno intermitente, y un agrupamiento de los dos grupos con ayuno intermitente (Figura 3). Los metabolitos asociados a los cubos espectrales que separaron los diferentes regímenes de alimentación fueron el β-hidroxibutirato, lactato, alanina y glucosa.
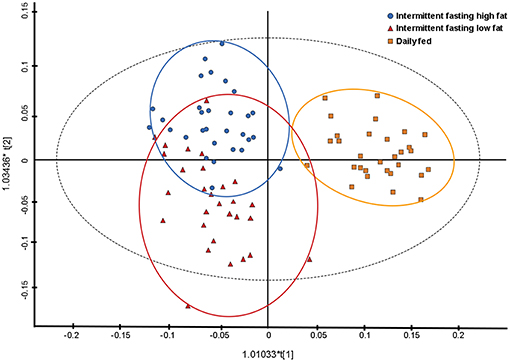 FIGURA 3. Gráfico de mínimos cuadrados parciales ortogonales con análisis discriminante (OPLS-DA) que ilustra el efecto de tres regímenes de alimentación sobre el metaboloma plasmático de 10 perros. Cada punto representa una sola muestra con los círculos azules que representan a un perro que ayuna intermitentemente con una dieta alta en grasas, los triángulos rojos que representan a un perro que ayuna intermitentemente con una dieta baja en grasas y los cuadrados naranjas que representan a un perro alimentado diariamente con una dieta baja en grasas.
FIGURA 3. Gráfico de mínimos cuadrados parciales ortogonales con análisis discriminante (OPLS-DA) que ilustra el efecto de tres regímenes de alimentación sobre el metaboloma plasmático de 10 perros. Cada punto representa una sola muestra con los círculos azules que representan a un perro que ayuna intermitentemente con una dieta alta en grasas, los triángulos rojos que representan a un perro que ayuna intermitentemente con una dieta baja en grasas y los cuadrados naranjas que representan a un perro alimentado diariamente con una dieta baja en grasas.
Ensayo de β-hidroxibutirato a través de un kit y RMN
Las concentraciones plasmáticas de β-hidroxibutirato en los días 3, 5 y 7 fueron más altas cuando los perros fueron ayunados intermitentemente con la dieta HF, y más bajas cuando los perros fueron alimentados diariamente (Figura 4). No hubo efecto del día. El ayuno intermitente aumentó las concentraciones plasmáticas de β-hidroxibutirato independientemente de la dieta administrada, y una puntuación más alta de la condición corporal se asoció con una disminución del β-hidroxibutirato plasmático (Tabla 3). No hubo asociación entre la pérdida de peso y las concentraciones plasmáticas de β-hidroxibutirato (P = 0,198). Hubo una concordancia razonable entre las concentraciones de β-hidroxibutirato obtenidas del kit colorimétrico y de la RMN (Figura 5, Bland Altman).
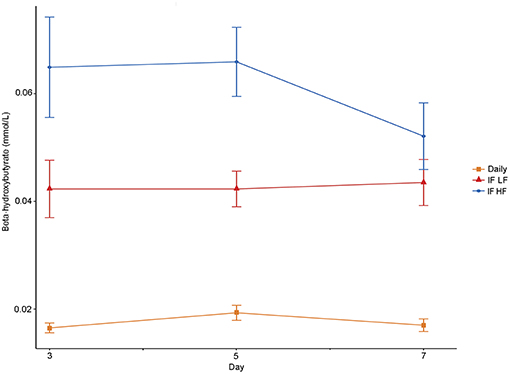 FIGURA 4. Concentraciones medias (±EE) de beta-hidroxibutirato plasmático en ayunas en 10 perros alimentados diariamente (cuadrado) y ayunados intermitentemente con una dieta baja en grasas (triángulo) y alta en grasas (círculo) en un diseño de cuadrado latino.
FIGURA 4. Concentraciones medias (±EE) de beta-hidroxibutirato plasmático en ayunas en 10 perros alimentados diariamente (cuadrado) y ayunados intermitentemente con una dieta baja en grasas (triángulo) y alta en grasas (círculo) en un diseño de cuadrado latino.
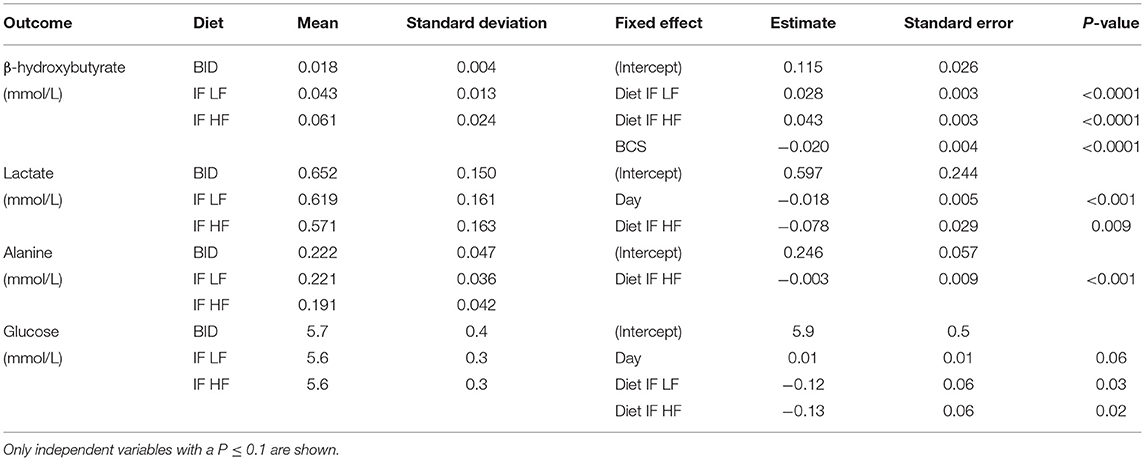 TABLA 3. Las medias y desviaciones estándar para el β-hidroxibutirato, lactato alanina y glucosa, y los resultados de los modelos lineales de efectos mixtos, de 10 perros alimentados diariamente (BID), y ayunados intermitentemente con una dieta baja en grasas (IF LF) y una dieta alta en grasas (LF HF) en un diseño de Cuadrado Latino.
TABLA 3. Las medias y desviaciones estándar para el β-hidroxibutirato, lactato alanina y glucosa, y los resultados de los modelos lineales de efectos mixtos, de 10 perros alimentados diariamente (BID), y ayunados intermitentemente con una dieta baja en grasas (IF LF) y una dieta alta en grasas (LF HF) en un diseño de Cuadrado Latino.
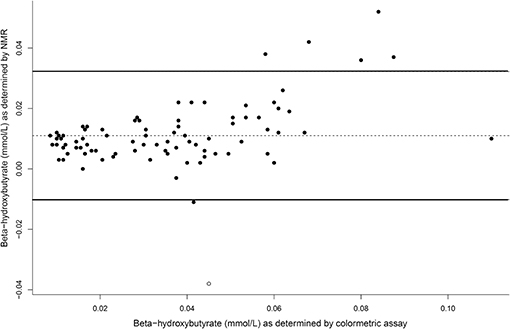 FIGURA 5. Un gráfico comparativo de Altman de las concentraciones de beta-hidroxibutirato mediante el kit colormétrico y la resonancia magnética nuclear (RMN). En y = 0, esto indica un acuerdo perfecto, con la línea media como el acuerdo real. Las líneas continuas representan los límites del 95% de concordancia de los datos.
FIGURA 5. Un gráfico comparativo de Altman de las concentraciones de beta-hidroxibutirato mediante el kit colormétrico y la resonancia magnética nuclear (RMN). En y = 0, esto indica un acuerdo perfecto, con la línea media como el acuerdo real. Las líneas continuas representan los límites del 95% de concordancia de los datos.
Lactato y alanina por RMN
Tanto las concentraciones de lactato como las de alanina fueron más bajas cuando los perros fueron ayunados intermitentemente con una dieta alta en grasas (Figura 6). Además, las concentraciones de lactato disminuyeron con el tiempo (P = 0,009; Tabla 3).
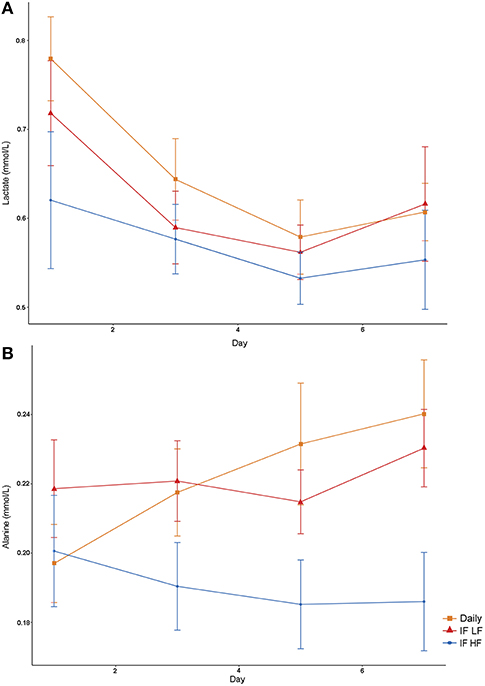 FIGURA 6. Concentraciones medias (±EE) de lactato (A) y alanina (B) plasmáticas en ayunas en 10 perros alimentados diariamente (cuadrado) y ayunados intermitentemente con una dieta baja en grasas (triángulo) y alta en grasas (círculo) en un diseño de cuadrado latino.
FIGURA 6. Concentraciones medias (±EE) de lactato (A) y alanina (B) plasmáticas en ayunas en 10 perros alimentados diariamente (cuadrado) y ayunados intermitentemente con una dieta baja en grasas (triángulo) y alta en grasas (círculo) en un diseño de cuadrado latino.
Glucosa
Las concentraciones de glucosa en sangre aumentaron con el tiempo desde el día 3 hasta el día 7, y fueron más altas en los perros alimentados diariamente (Figura 7). No hubo diferencias en las concentraciones de glucosa cuando los perros fueron ayunados intermitentemente con las dietas LF e HF (P = 0,98). Tampoco hubo efecto de la BCS sobre la glucemia (P = 0,24; Tabla 3).
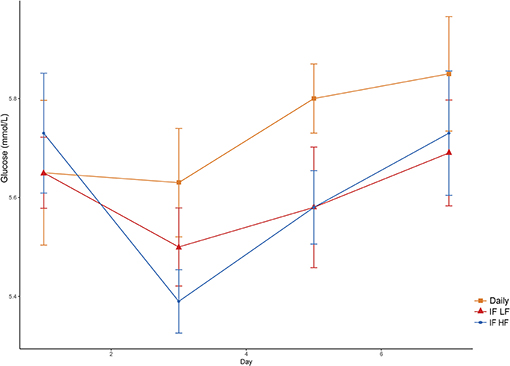 FIGURA 7. Concentraciones medias (±EE) de glucosa plasmática en ayunas en 10 perros alimentados diariamente (cuadrado) y ayunados intermitentemente con una dieta baja en grasas (triángulo) y alta en grasas (círculo) en un diseño de cuadrado latino.
FIGURA 7. Concentraciones medias (±EE) de glucosa plasmática en ayunas en 10 perros alimentados diariamente (cuadrado) y ayunados intermitentemente con una dieta baja en grasas (triángulo) y alta en grasas (círculo) en un diseño de cuadrado latino.
Hormonas Insulina, Leptina y Grelina, y HOMA
Tanto las concentraciones de insulina como las puntuaciones HOMA fueron más bajas cuando los perros fueron ayunados intermitentemente con una dieta alta en grasas (Figura 8). Una mayor condición corporal se asoció con menores concentraciones de insulina y puntuaciones HOMA (Tabla 4).
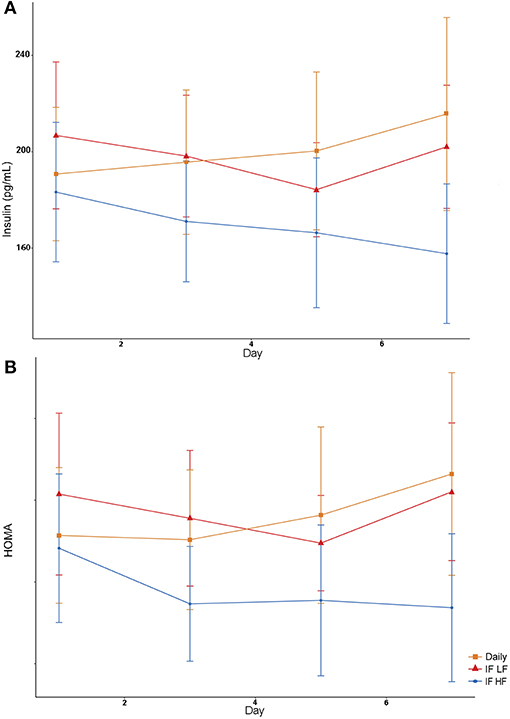 FIGURA 8. Concentraciones medias (±EE) de insulina sérica en ayunas (A) y puntuación HOMA (B) en 10 perros alimentados diariamente (cuadrado) y ayunados intermitentemente con una dieta baja en grasas (triángulo) y alta en grasas (círculo) en un diseño de cuadrado latino.
FIGURA 8. Concentraciones medias (±EE) de insulina sérica en ayunas (A) y puntuación HOMA (B) en 10 perros alimentados diariamente (cuadrado) y ayunados intermitentemente con una dieta baja en grasas (triángulo) y alta en grasas (círculo) en un diseño de cuadrado latino.
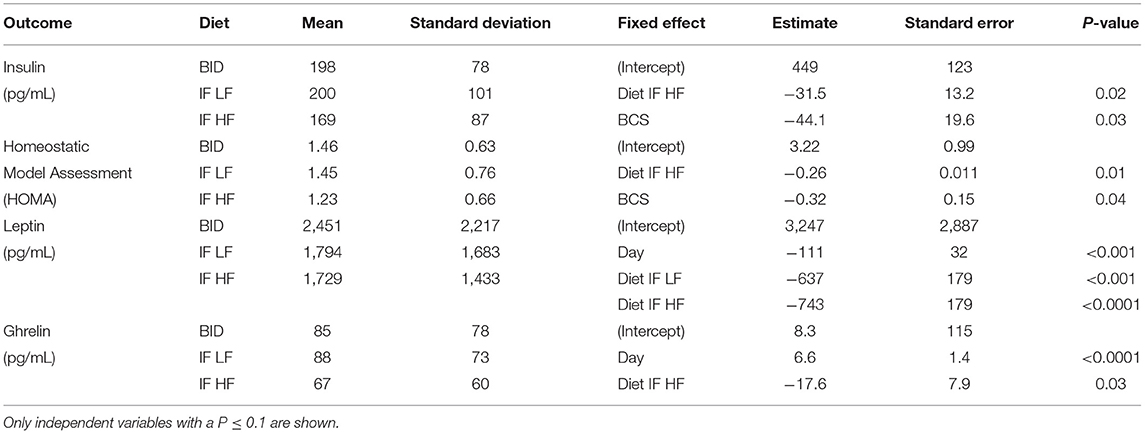 TABLA 4. Se analizaron las medias y desviaciones estándar para insulina, Homeostatic Model Assessment (HOMA), leptina y grelina, y los resultados de los modelos lineales de efectos mixtos, de 10 perros alimentados diariamente (BID), y ayunados intermitentemente con una dieta baja en grasas (IF LF) y una dieta alta en grasas (LF HF) en un diseño de Latin Square.
TABLA 4. Se analizaron las medias y desviaciones estándar para insulina, Homeostatic Model Assessment (HOMA), leptina y grelina, y los resultados de los modelos lineales de efectos mixtos, de 10 perros alimentados diariamente (BID), y ayunados intermitentemente con una dieta baja en grasas (IF LF) y una dieta alta en grasas (LF HF) en un diseño de Latin Square.
La concentración sérica de leptina fue más alta cuando los perros fueron alimentados diariamente (Figura 9). Además, hubo una disminución en las concentraciones de leptina a lo largo del tiempo (Tabla 4). En el caso de la grelina, los perros que ayunaron de forma intermitente con una dieta de IC tuvieron concentraciones séricas más bajas (Figura 9).
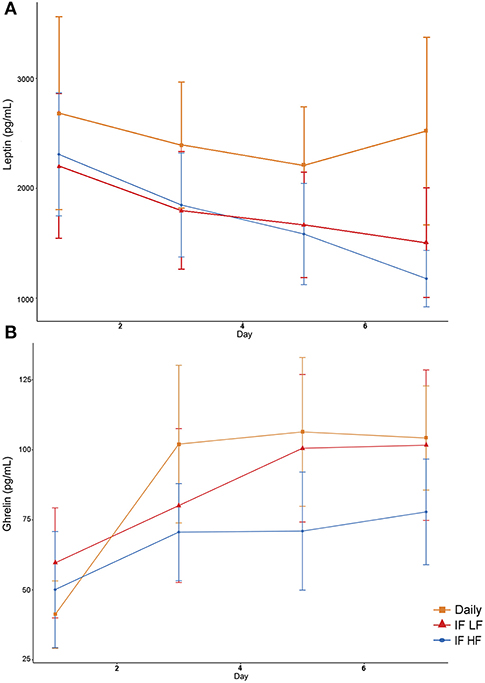 FIGURA 9. Concentraciones medias (±EE) de leptina (A) y grelina (B) séricas en ayunas en 10 perros alimentados diariamente (cuadrado), y ayunados intermitentemente con una dieta baja en grasas (triángulo) y alta en grasas (círculo) en un diseño de cuadrado latino.
FIGURA 9. Concentraciones medias (±EE) de leptina (A) y grelina (B) séricas en ayunas en 10 perros alimentados diariamente (cuadrado), y ayunados intermitentemente con una dieta baja en grasas (triángulo) y alta en grasas (círculo) en un diseño de cuadrado latino.
Inmunoensayos
Proliferación de linfocitos
La proliferación de linfocitos no fue significativamente diferente durante ninguno de los regímenes de alimentación.
Fagocitosis y estallido respiratorio
Cuando los perros fueron ayunados intermitentemente con una dieta LF, tenían un menor porcentaje de neutrófilos y un menor MFI en macrófagos que sufrieron tanto fagocitosis como oxidación (Figura 10; Tabla 5). Además, cuando estaban en el régimen de alimentación de IF LF, los perros también tenían un menor porcentaje de linfocitos que sufrieron un estallido oxidativo respiratorio (Figura 10; Tabla 5).
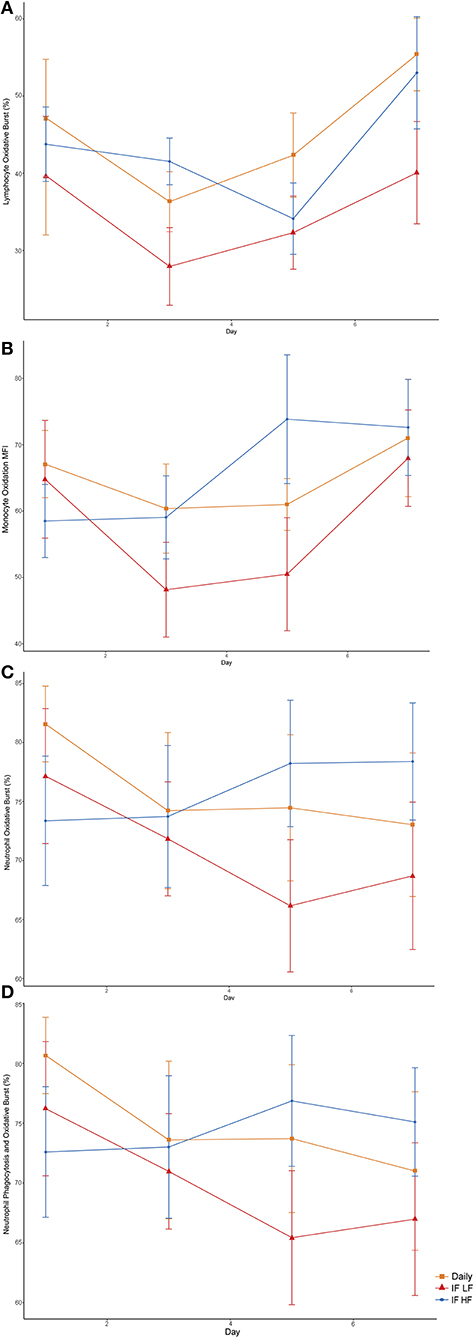 FIGURA 10. Diferencias en los parámetros inmunológicos en 10 perros alimentados diariamente (cuadrado) y ayunados intermitentemente con una dieta baja en grasas (triángulo) y una dieta alta en grasas (círculo) en un diseño de cuadrado latino evaluado por citometría de flujo. (A) Porcentaje total de linfocitos que sufrieron estallido oxidativo. (B) La intensidad media de la floración del estallido oxidativo en monocitos que sufrieron tanto fagocitosis como estallido oxidativo. Este es un método para cuantificar el grado de oxidación. (C) Porcentaje total de neutrófilos que sufrieron estallido oxidativo. (D) El porcentaje de neutrófilos que sufrieron tanto fagocitosis como estallido oxidativo.
FIGURA 10. Diferencias en los parámetros inmunológicos en 10 perros alimentados diariamente (cuadrado) y ayunados intermitentemente con una dieta baja en grasas (triángulo) y una dieta alta en grasas (círculo) en un diseño de cuadrado latino evaluado por citometría de flujo. (A) Porcentaje total de linfocitos que sufrieron estallido oxidativo. (B) La intensidad media de la floración del estallido oxidativo en monocitos que sufrieron tanto fagocitosis como estallido oxidativo. Este es un método para cuantificar el grado de oxidación. (C) Porcentaje total de neutrófilos que sufrieron estallido oxidativo. (D) El porcentaje de neutrófilos que sufrieron tanto fagocitosis como estallido oxidativo.
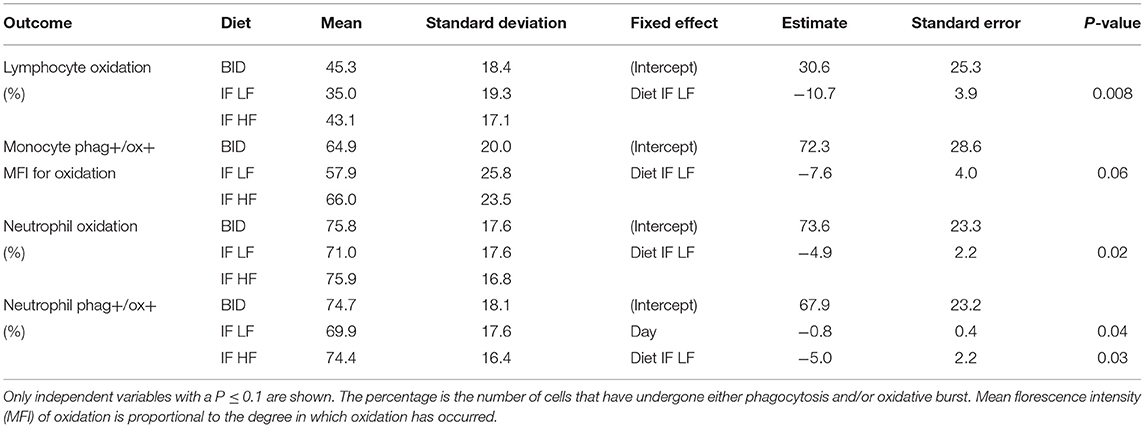 TABLA 5. Los resultados de los modelos lineales de efecto mixto de la actividad de las células fagocíticas, y sus respectivas medias y desviaciones estándar, en 10 perros alimentados diariamente (BID), y ayunados intermitentemente con una dieta baja en grasas (IF LF) y una dieta alta en grasas (LF HF) en un diseño de Cuadrado Latino.
TABLA 5. Los resultados de los modelos lineales de efecto mixto de la actividad de las células fagocíticas, y sus respectivas medias y desviaciones estándar, en 10 perros alimentados diariamente (BID), y ayunados intermitentemente con una dieta baja en grasas (IF LF) y una dieta alta en grasas (LF HF) en un diseño de Cuadrado Latino.
Discusión
El ayuno intermitente y la promoción de la formación de cetonas pueden ser un régimen de alimentación beneficioso para los perros hospitalizados, especialmente para los pacientes con columna vertebral. Nuestra hipótesis principal era que los perros sanos que ayunaban intermitentemente tendrían concentraciones más bajas de glucosa en sangre, insulina y leptina en ayunas, y mayores concentraciones de β-hidroxibutirato y grelina en ayunas en comparación con cuando comían a diario. Nuestra hipótesis secundaria fue que los perros en ayunas intermitentes que consumen una dieta alta en grasas enriquecida con triglicéridos de cadena media tendrán concentraciones más altas de β-hidroxibutirato y leptina en sangre en comparación con los perros en ayunas intermitentes que consumen una dieta LF. Encontramos que los perros en ayunas durante 48 h con una dieta de IC enriquecida en triglicéridos de cadena media promovieron concentraciones más altas de β-hidroxibutirato en sangre y concentraciones de insulina más bajas que cuando se alimentaron diariamente o ayunaron con una dieta LF. La leptina no se mantuvo durante el ayuno intermitente mediante el uso de una dieta de IC; sin embargo, no hubo diferencia en los parámetros inmunológicos estudiados entre el momento en que los perros fueron alimentados con la dieta HF y el momento en que fueron alimentados diariamente. Las concentraciones de grelina en ayunas fueron más bajas cuando los perros fueron ayunados intermitentemente con una dieta de IC. En general, estos hallazgos indican que un régimen de ayuno intermitente en una dieta alta en grasas enriquecida en triglicéridos de cadena media aumenta las concentraciones plasmáticas de β-hidroxibutirato sin causar inmunosupresión, sin embargo, no anuló la caída de la leptina ni aumentó las concentraciones de grelina durante el ayuno.
En este estudio se eligió una croqueta LF disponible comercialmente como dieta de control. Cuando los perros comían la dieta LF de forma intermitente, consumían menos calorías y perdían más peso en comparación con cuando comían la dieta HF. Existen numerosos estudios en varias especies que también muestran este fenómeno (56). En un estudio, los perros alimentados ad libitum con una dieta alta en grasas (51% de energía proveniente de grasas) ganaron más peso que los perros alimentados ad libitum con una dieta baja en grasas (23% de energía de grasas) (57). Por lo tanto, para evitar la pérdida de peso en un régimen de ayuno intermitente, es probable que se requiera un alimento rico en grasas y denso en energía para garantizar que un perro consuma todos sus requerimientos. Sin embargo, existen asociaciones epidemiológicas entre el alto consumo de grasas en la dieta y la pancreatitis en perros (58). En los primeros modelos experimentales, los perros alimentados con una dieta alta en grasas frente a una dieta alta en proteínas y carbohidratos provocaron signos clínicos más graves y cambios patológicos en el páncreas (59, 60). Sin embargo, es poco probable que las dietas hayan sido raciones completas y equilibradas, por lo que otras deficiencias de nutrientes pueden haber confundido los resultados. Dar las sobras de la mesa y consumir alimentos desechados en la basura también se han identificado como factores de riesgo para el desarrollo de pancreatitis en perros (61). Sin embargo, es difícil especular cuál era el contenido de grasa de esos artículos. Por el contrario, alimentar a un grupo de perros sanos con dietas con diferentes contenidos de grasa, incluidos triglicéridos de cadena media, no tuvo un efecto sobre la inmunorreactividad sérica canina similar a la tripsina (cTLI), la inmunoactividad pancreática de la lipasa (cPLI) o las concentraciones de gastrina (62). Sin embargo, la dieta más alta en grasas en este estudio contenía solo ~ 40% de grasa sobre una base energética. Aún así, existen numerosos estudios e informes de dietas para perros de trineo en las que los perros fueron alimentados con una dieta con un contenido de grasa similar a nuestra dieta HF sin causar pancreatitis (63-68).
Las cetonas proporcionan una fuente alternativa de energía para las neuronas y se ha demostrado que reducen la degeneración neuronal y mejoran la recuperación en modelos de lesiones cerebrales y espinales en roedores (30, 69-71). Mientras que las concentraciones de β-hidroxibutirato fueron más altas en los perros cuando ayunaron intermitentemente con la dieta HF, las concentraciones obtenidas (media 0,061, DE 0,024 mmol/L) fueron mucho más bajas en comparación con los roedores (0,8-2 mmol/L) y los humanos (1,67 mmol/L) ayunados durante un tiempo similar (22, 72, 73). Nuestro hallazgo es consistente con otros estudios publicados en los que el perro no alcanza la misma concentración de cetonas en sangre que otras especies después de ayunos comparables (74-76). Sin embargo, se ha demostrado que la tasa de producción total de cetonas es similar entre perros y hombres después de un ayuno de 48 h (77, 78). Además, De Bruijne y Van den Brom (74) establecieron que los perros tienen una tasa más alta de aclaramiento de cetonas plasmáticas que el hombre. Por lo tanto, la concentración aparentemente baja de β-hidroxibutirato en los perros no se debe a la reducción de la producción de cetonas, sino más bien a las tasas más altas de utilización periférica en comparación con los roedores y los humanos. Además, aunque una sola muestra de sangre es indicativa de la concentración de un metabolito en ese momento, no describe su flujo (producción y utilización) (78). La concentración de β-hidroxibutirato en el cerebro y el líquido cefalorraquídeo (LCR) es proporcional a la concentración encontrada en el plasma, y aumenta a medida que continúa la duración del ayuno (72, 79, 80). Cuando está disponible, las neuronas utilizan preferentemente el β-hidroxibutirato sobre la glucosa, el lactato y el piruvato como sustrato energético (81). Por lo tanto, incluso un pequeño aumento en las concentraciones plasmáticas de cetonas podría proporcionar una gran contribución de energía para el cerebro y las neuronas.
En nuestro estudio, todos los perros tenían concentraciones de glucosa en sangre en ayunas dentro del rango normal de referencia, sin embargo, se obtuvieron valores más bajos cuando los perros estuvieron en ayunas durante 48 h frente a 12 h. Esto refleja la diferencia en la duración del ayuno más que la composición de macronutrientes de las dietas. De manera similar, en un estudio de perros que comían una dieta libre de carbohidratos o alta en carbohidratos, las concentraciones de glucosa en sangre eran las mismas después de un ayuno de 24 horas en ambos grupos de perros. Las concentraciones más bajas de insulina se observaron cuando los perros fueron ayunados intermitentemente con la dieta HF, lo que indicó una disminución en la producción de insulina y/o un aumento en la sensibilidad a la insulina. Las puntuaciones de resistencia a la insulina HOMA también fueron más bajas cuando los perros estaban en este régimen de alimentación, lo que es un reflejo de las bajas concentraciones de glucosa e insulina en ayunas. Tanto la restricción calórica como la reducción de la masa grasa mejoran la sensibilidad a la insulina en perros con sobrepeso (83-86). En nuestro estudio, los perros con ayuno intermitente que seguían una dieta HF perdieron menos peso que cuando ayunaban intermitentemente con una dieta LF y, sin embargo, tenían concentraciones de insulina más bajas. Por lo tanto, parece que el ayuno intermitente en una dieta alta en grasas puede reducir la producción de insulina o mejorar la sensibilidad a la insulina independientemente de la pérdida de peso.
La alanina y el lactato fueron dos metabolitos gluconeogénicos identificados por la OPLS como diferentes entre los regímenes de alimentación. Durante la etapa temprana del ayuno, la proteólisis del músculo libera alanina para la gluconeogénesis en los hepatocitos (87, 88). En un estudio de perros que consumieron una dieta libre de carbohidratos, la tasa de recambio de alanina y su conversión de alanina en glucosa plasmática aumentaron después de un ayuno de 48 horas (89). El lactato es transportado por los mismos transportadores de monocarboxilato (MCT) que las cetonas, y también sirve como fuente de energía para las células, incluidas las neuronas, en ayunas (90, 91). La alimentación de ratas con una dieta alta en grasas aumentó la expresión de MCT1 por parte de las células endoteliales cerebrales (92). Además, las concentraciones de lactato aumentan en el cerebro de los seres humanos en ayunas durante 2 días (72). Por lo tanto, la reducción tanto de la alanina como del lactato en los perros cuando ayunan intermitentemente con una dieta de IC puede deberse a un aumento de la absorción por parte del hígado, el cerebro y los riñones.
La adipoquina, la leptina, tiene muchas funciones en el cuerpo, incluida la activación de la fagocitosis por monocitos y la quimiotaxis de los neutrófilos y la generación de radicales oxidativos (93-95). En nuestro estudio, encontramos que las concentraciones de leptina eran más bajas en los perros que ayunaban intermitentemente, independientemente del contenido de grasa de la dieta. Se sabe que tanto el ayuno como la reducción de la masa grasa disminuyen la producción de leptina (96, 97). Durante el transcurso de nuestro estudio, los perros perdieron algo de peso; Sin embargo, no hubo diferencias en las concentraciones iniciales de leptina al comienzo de cada semana de estudio en ninguno de los perros. Por lo tanto, la reducción en las concentraciones de leptina fue el resultado del régimen de ayuno, y no de la pérdida de masa grasa. Además, aunque la leptina no se mantuvo durante el ayuno alimentándolos con una dieta de IC, no hubo diferencia entre los parámetros inmunológicos estudiados en esos perros y cuando los perros fueron alimentados diariamente. Sí encontramos una reducción en el porcentaje de leucocitos que sufrían fagocitosis y estallido respiratorio cuando los perros estaban en ayunas intermitentes con una dieta LF. Esto sugiere que los cambios inmunológicos no fueron mediados por leptina. Sin embargo, el efecto supresor no fue consistente en todos los parámetros inmunes estudiados, y se desconoce el significado clínico de esta reducción.
Limitaciones
Ambas dietas utilizadas en este estudio se formularon para cumplir con los requisitos de la AAFCO, y aunque se hicieron todos los intentos para crear perfiles de nutrientes similares excluyendo el contenido de grasas y carbohidratos, las dietas diferían entre sí en algunos micronutrientes. Además, cuando los perros fueron ayunados intermitentemente con la dieta LF, perdieron más peso que en los otros regímenes de alimentación, lo que indica que los perros estaban en un estado catabólico mayor. Sin embargo, un aumento en la proteólisis y la oxidación de ácidos grasos no se reflejó en un aumento en las concentraciones plasmáticas de alanina y cetonas de los perros durante el régimen de ayuno intermitente de la dieta LF. Además, la concentración plasmática de cetonas no se asoció con la pérdida de peso en este estudio. Se realizó una semana de lavado utilizando el régimen de alimentación de control entre cada período de estudio, y ninguno de los parámetros de resultado fue significativamente diferente en los perros al comienzo de cada período de estudio. Además, se examinó el orden de la dieta en el modelo multivariado que no mostró ningún efecto. Nuestros resultados sugieren que las diferencias en los perfiles de la dieta y una mayor pérdida de peso durante el régimen de ayuno intermitente de la dieta LF probablemente tuvieron un efecto mínimo, sin embargo, se requeriría un estudio más exhaustivo para determinar si ese es realmente el caso.
En nuestro estudio, no se observaron efectos nocivos cuando los perros fueron ayunados intermitentemente con la dieta alta en grasas. La alimentación aguda con una dieta alta en grasas en otras especies puede conducir a un aumento de las citoquinas proinflamatorias circulantes, como la interleucina 1β y la necrosis tumoral-α, pero esto no se ha demostrado de manera consistente (98). Curiosamente, se ha demostrado que un régimen de ayuno intermitente mejora la expresión de genes relacionados con la proinflamación en los hepatocitos durante la alimentación rica en grasas a largo plazo en ratones (99). Actualmente se desconocen los efectos del ayuno intermitente sobre los marcadores de inflamación durante la alimentación rica en grasas en perros. No medimos las citocinas inflamatorias en nuestro estudio, sin embargo, es posible que en estudios futuros deseen hacerlo. Además, una diferencia en la inmunidad entre los regímenes de alimentación fue evidente solo cuando los perros fueron ayunados intermitentemente con la dieta LF. Se desconoce la importancia de este efecto inmunitario, pero puede haber una mayor implicación de esto en un entorno clínico.
Para promover la formación de cetonas, el aceite de coco se utilizó en la dieta HF como una rica fuente de triglicéridos de cadena media. Sin embargo, el principal componente de triglicéridos de cadena media en el aceite de coco es el ácido dodecanoico (ácido láurico, C12), con el ácido decanoico (ácido cáprico, C10) y el ácido octanoico (ácido caprílico, C8) como el gran resto (100). Cuando se administra en cantidades iguales, la ingesta de ácido decanoico y ácido octanoico conduce a una mayor producción de cetonas postprandialmente que el ácido dodecanoico (101, 102). Por lo tanto, para aumentar el efecto de los triglicéridos de cadena media sobre la cetogénesis, se puede administrar un aceite concentrado con una mayor cantidad de ácido decanoico y octanoico en lugar de aceite de coco.
La evaluación del modelo de homeostasis (HOMA) se desarrolló para proporcionar una medida de la resistencia periférica a la insulina de la glucosa y la insulina en ayunas. Las puntuaciones se correlacionan bien con un modelo de pinza euglucémica en humanos, y se han utilizado para detectar mejoras en la sensibilidad a la insulina con la pérdida de peso y el ayuno en humanos (103-105). En nuestro estudio, los perros que ayunaron intermitentemente con una dieta de IC tuvieron la puntuación HOMA más baja en comparación con cuando fueron alimentados diariamente o ayunados intermitentemente con la dieta LF. Sin embargo, se ha encontrado que HOMA es variable confiable en animales de compañía para detectar la resistencia a la insulina (106-108). Por lo tanto, si bien encontramos una diferencia con las puntuaciones HOMA en los diferentes regímenes de alimentación, cualquier interpretación en la sensibilidad periférica a la insulina debe confirmarse utilizando una pinza euglucémica.
Conclusión
En este estudio, encontramos que el ayuno de hasta 48 horas en perros sanos no causa inmunosupresión, y que el ayuno con una dieta alta en grasas enriquecida con triglicéridos de cadena media promovió una mayor concentración de cetonas plasmáticas que cuando los perros ayunaron después de comer una dieta baja en grasas. Sin embargo, las concentraciones obtenidas en perros son significativamente menores que las reportadas en otras especies ayunadas durante un período de tiempo similar. Por lo tanto, se requiere un estudio de cinética de cetonas para obtener una comprensión más completa del flujo de cetonas en perros durante ayunas de diferentes duraciones, y si este régimen de alimentación podría ser factible en perros hospitalizados que se recuperan de una lesión neuronal. Además, los perros que ayunaron intermitentemente con una dieta baja en grasas, consumieron menos calorías y perdieron más peso que cuando se alimentaron con una dieta alta en grasas. Por lo tanto, cualquier aplicación práctica de este tipo de régimen de alimentación requeriría la modificación de la dieta en sí (por ejemplo, aumentar la densidad energética de la dieta para reducir el volumen y el llenado intestinal) y/o reducir el número de días o la duración del ayuno. En definitiva, aunque hemos demostrado la posibilidad de que este tipo de régimen de alimentación sea factible y produzca cetonas sin efectos nocivos en perros sanos, su aplicación en perros hospitalizados aún está por determinar.
Declaración de disponibilidad de datos
Los conjuntos de datos generados para este estudio están disponibles previa solicitud al autor correspondiente.
Declaración de Ética
El estudio en animales fue revisado y aprobado por el Comité de Ética Animal de la Universidad de Massey (MUAEC #16/130).
Contribuciones de los autores
YL y NC conceptualizaron y diseñaron el estudio. YL fue el investigador principal, con la ayuda de NC. YL organizó la recolección de datos, completó la preparación de laboratorio de las muestras de sangre, realizó el análisis estadístico y escribió el primer borrador del manuscrito. AH supervisó los ensayos inmunológicos. PE realizó el análisis de RMN. AG revisó el diseño del estudio y el análisis estadístico. TW contribuyó con la lectura y revisión del manuscrito. Todos los autores contribuyeron a la revisión del manuscrito y aprobaron la versión enviada.
Financiación
Este trabajo descrito en este manuscrito fue financiado internamente.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Reconocimientos
Los autores desean agradecer a Brittnee Southland por su ayuda en la elaboración y distribución de las dietas y la recolección de muestras de sangre.
Notas
1. ^Eukanuba Control de peso de razas grandes secas, Mars Incorporate, McLean, Virginia, EE. UU.
2. ^Balance IT Canine, DVM Consulting Incorporated, Davis, California, EE. UU.®
3. ^BD Vacutainer, Plymouth, Reino Unido.®
4. ^Inhibidor de Millipore DPP-IV, Darmstadt, Alemania.®
5. ^Heyrex, Say Systems, Wellington, Nueva Zelanda.®
6. ^Accu-check Performa, Roche Diagnostics Limited, Mannheim, Alemania.®
7. ^beta HB Assay Kit, catálogo #ab83390, Abcam, Cambridge, Reino Unido.
8. Columna giratoria ^10kD, catálogo #ab93349, Abcam, Cambridge, Reino Unido.
9. ^Lector de microplacas VersaMax™, Molecular Devices LLC, San José, California, EE. UU.
10. ^Cryo.S, Greiner Bio-One™, Frickenhausen, Alemania.
11. ^DSS, Sigma-Aldrich, St. Louis, MI, EE. UU.
12. ^Imidazol, Sigma-Aldrich, St. Louis, MI, EE. UU.
13. Tubos de muestra de RMN de ^ 5 mm, Wilmad-LabGlass, Vineland, Nueva Jersey, EE. UU.
14. ^Panel de cuentas magnéticas de hormona intestinal canina Milliplex MAP, Millipore, Burlington, Massachusetts, EE. UU.®
15. ^Luminex 200™, Merck, Darmstadt, Alemania.
16. ^BD FASCSCalibur™, BD Sciences, San José, California, EE. UU.
17. ^pHodo™ Red S. aureus Biopartículas™, número de catálogo A10010, Invitrogen, Carlsbad, California, EE. UU.®
18. ^Dihidrorodamina 123, número de catálogo D23806, Invitrogen, Carlsbad, California, EE. UU.®
19. ^Tubos BD Falcon™, BD Biosciences, San José, California, EE. UU.
20. ^FACSCalibur™, BD Biosciences, San José, California.
Referencias
1. Remillard RL, Darden DE, Michel KE, Marks SL, Buffington CA, Bunnell PR. Una investigación de la relación entre la ingesta calórica y el resultado en perros hospitalizados. Vet Ther Res Appl Vet Med. (2001) 2:301–10.
2. Hiesmayr M, Schindler K, Pernicka E, Schuh C, Schoeniger-Hekele A, Bauer P, et al. La disminución de la ingesta de alimentos es un factor de riesgo de mortalidad en pacientes hospitalizados: la encuesta NutritionDay 2006. Clin Nutr. (2009) 28:484–91. doi: 10.1016/j.clnu.2009.05.013
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Lim SL, Ong KCB, Chan YH, Loke WC, Ferguson M, Daniels L. La desnutrición y su impacto en el costo de la hospitalización, la duración de la estancia, el reingreso y la mortalidad a los 3 años. Clin Nutr. (2012) 31:345–50. doi: 10.1016/j.clnu.2011.11.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Agarwal E, Ferguson M, Banks M, Batterham M, Bauer J, Capra S, et al. La malnutrición y la ingesta deficiente de alimentos se asocian con una estancia hospitalaria prolongada, reingresos frecuentes y una mayor mortalidad intrahospitalaria: resultados de la Encuesta del Día de la Atención Nutricional 2010. Clin Nutr. (2013) 32:737–45. doi: 10.1016/j.clnu.2012.11.021
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Klein CJ, Stanek GS, Wiles CE. Sobrealimentación de macronutrientes a adultos críticamente enfermos: complicaciones metabólicas. J Am Diet Assoc. (1998) 98:795–806. doi: 10.1016/S0002-8223(98)00179-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Alaedeen DI, Walsh MC, Chwals WJ. La hiperglucemia total asociada a la nutrición parenteral se correlaciona con la ventilación mecánica prolongada y la estancia hospitalaria en los lactantes sépticos. J Pediatr Surg. (2006) 41:239–44. doi: 10.1016/j.jpedsurg.2005.10.045
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Reid C. Frecuencia de subalimentación y sobrealimentación en pacientes de UCI con ventilación mecánica: causas y posibles consecuencias. J Dieta Hum Nutr. (2006) 19:13–22. doi: 10.1111/j.1365-277X.2006.00661.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Nishikawa T, Edelstein D, Du XL, Yamagishi SI, Matsumura T, Kaneda Y, et al. La normalización de la producción de superóxido mitocondrial bloquea tres vías de daño hiperglucémico. Naturaleza. (2000) 404:787–90. doi: 10.1038/35008121
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Grupo de Investigación de Ensayos de Control y Complicaciones de la Diabetes. Efecto del tratamiento intensivo de la diabetes en el desarrollo y progresión de las complicaciones a largo plazo en la diabetes mellitus insulinodependiente. N Engl J Med. (1993) 329:997–86. doi: 10.1056/NEJM199309303291401
10. Gore DC, Chinkes D, Heggers J, Herndon DN, Wolf SE. Asociación de la hiperglucemia con el aumento de la mortalidad después de una lesión por quemadura grave. J Cirugía de Cuidados Agudos de Trauma. (2001) 51:540–4. doi: 10.1097/00005373-200109000-00021
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Esposito K, Nappo F, Marfella R, Giugliano G, Giugliano F, Ciotola M, et al. Las concentraciones de citoquinas inflamatorias aumentan agudamente por la hiperglucemia en los seres humanos: el papel del estrés oxidativo. Circulación. (2002) 106:2067–72. doi: 10.1161/01.CIR.0000034509.14906.AE
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Ceriello A, Quagliaro L, Piconi L, Assaloni R, Da Ros R, Maier A, et al. Efecto de la hipertrigliceridemia e hiperglucemia postprandial sobre las moléculas circulantes de adhesión y la generación de estrés oxidativo y el posible papel del tratamiento con simvastatina. Diabetes. (2004) 53:701–10. doi: 10.2337/diabetes.53.3.701
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Jellinger PS. Consecuencias metabólicas de la hiperglucemia y la resistencia a la insulina. Insulina. (2009) 4:2–14. doi: 10.1016/S1557-0843(09)80003-1
14. Van den Berghe G, Wouters P, Weekers F, Verwaest C, Bruyninckx F, Schetz M, et al. Terapia intensiva con insulina en pacientes críticos. N Engl J Med. (2001) 345:1359–67. doi: 10.1056/NEJMoa011300
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Rogozina OP, Bonorden MJL, Seppanen CN, Grande JP, Cleary MP. Efecto de la restricción calórica crónica e intermitente sobre la adiponectina sérica y la leptina y la tumorigénesis mamaria. Cáncer Prev Res. (2011) 4:568–81. doi: 10.1158/1940-6207.CAPR-10-0140
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Horne BD, Muhlestein JB, Anderson JL. Efectos del ayuno intermitente en la salud: ¿hormesis o daño? Una revisión sistemática. Am J Clin Nutr. (2015) 102:464–70. doi: 10.3945/ajcn.115.109553
17. Faris MA, Kacimi S, Al-Kurd RA, Fararjeh MA, Bustanji YK, Mohammad MK, et al. El ayuno intermitente durante el Ramadán atenúa las citoquinas proinflamatorias y las células inmunitarias en sujetos sanos. Nutr Res. (2012) 32:947–55. doi: 10.1016/j.nutres.2012.06.021
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Tikoo K, Tripathi DN, Kabra DG, Sharma V, Gaikwad AB. El ayuno intermitente previene la progresión de la nefropatía diabética tipo I en ratas y cambia la expresión de Sir2 y p53. FEBS Lett. (2007) 581:1071–8. doi: 10.1016/j.febslet.2007.02.006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Ahmet I, Wan R, Mattson MP, Lakatta EG, Talan M. Cardioprotección mediante ayuno intermitente en ratas. Circulación. (2005) 112:3115–21. doi: 10.1161/CIRCULATIONAHA.105.563817
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Katare RG, Kakinuma Y, Arikawa M, Yamasaki F, Sato T. El ayuno intermitente crónico mejora la supervivencia después de la isquemia miocárdica grande mediante la activación de la vía de señalización BDNF/VEGF/PI3K. J Mol Cell Cardiol. (2009) 46:405–12. doi: 10.1016/j.yjmcc.2008.10.027
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Anson RM, Guo Z, de Cabo R, Iyun T, Ríos M, Hagepanos A, et al. El ayuno intermitente disocia los efectos beneficiosos de la restricción dietética sobre el metabolismo de la glucosa y la resistencia neuronal a las lesiones causadas por la ingesta de calorías. Proc Natl Acad Sci USA. (2003) 100:6216–20. doi: 10.1073/pnas.1035720100
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Plunet WT, Streijger F, Lam CK, Lee JHT, Liu J, Tetzlaff W. La restricción dietética iniciada después de una lesión de la médula espinal mejora la recuperación funcional. Exp Neurol. (2008) 213:28–35. doi: 10.1016/j.expneurol.2008.04.011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Jeong M, Plunet W, Streijger F, Lee JHT, Plemel JR, Park S, et al. El ayuno intermitente mejora la recuperación funcional después de una lesión medular por contusión torácica en ratas. J Neurotrauma. (2011) 28:479–92. doi: 10.1089/neu.2010.1609
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Arum O, Saleh JK, Boparai RK, Kopchick JJ, Khardori RK, Bartke A. Preservación de la homeostasis de la glucosa en sangre en ratones deficientes en somatotrismo de senescencia lenta sometidos a ayuno intermitente iniciado en la mediana edad o en la vejez. Edad. (2014) 36:1263–90. doi: 10.1007/s11357-014-9695-3
25. Mafauzy M, Mohammed WB, Anum MY, Zulkifli A, Ruhani AH. Un estudio de los pacientes diabéticos en ayunas durante el mes de Ramadán. Med J Malasia. (1990) 45:14–7.
26. Derde S, Vanhorebeek I, Güiza F, Derese I, Gunst J, Fahrenkrog B, et al. La nutrición parenteral temprana evoca un fenotipo de deficiencia de autofagia en el hígado y el músculo esquelético de conejos críticamente enfermos. Endocrinología. (2012) 153:2267–76. doi: 10.1210/en.2011-2068
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Alirezaei M, Kemball CC, Flynn CT, Wood MR, Whitton JL, Kiosses WB. El ayuno a corto plazo induce una autofagia neuronal profunda. Autofagia. (2010) 6:702–10. doi: 10.4161/auto.6.6.12376
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Descamps O, Riondel J, Ducros V, Roussel AM. Producción mitocondrial de especies reactivas de oxígeno e incidencia de linfoma asociado a la edad en ratones OF1: efecto del ayuno en días alternos. Dev. Mech Ageing. (2005) 126:1185–91. doi: 10.1016/j.mad.2005.06.007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Yin J, Han P, Tang Z, Liu Q, Shi J. La sirtuina 3 media la neuroprotección de las cetonas contra el accidente cerebrovascular isquémico. J Cereb Flujo sanguíneo metab. (2015) 35:1783–9. doi: 10.1038/jcbfm.2015.123
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Julio-Amilpas A, Montiel T, Soto-Tinoco E, Gerónimo-Olvera C, Massieu L. La protección de la muerte neuronal inducida por hipoglucemia por β-hidroxibutirato implica la preservación de los niveles de energía y la disminución de la producción de especies reactivas de oxígeno. J Cereb Flujo sanguíneo metab. (2015) 35:851–60. doi: 10.1038/jcbfm.2015.1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Moon M, Kim HG, Hwang L, Seo J-H, Kim S, Hwang S, et al. Efecto neuroprotector de la grelina en el modelo de ratón de 1-metil-4-fenil-1,2,3,6-tetrahidropiridina de la enfermedad de Parkinson mediante el bloqueo de la activación microglial. Neurotox Res. (2009) 15:332–47. DOI: 10.1007/S12640-009-9037-X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Miao Y, Xia Q, Hou Z, Zheng Y, Pan H, Zhu S. La grelina protege la neurona cortical contra la isquemia/reperfusión focal en ratas. Biochem Biophys Res Commun. (2007) 359:795–800. doi: 10.1016/j.bbrc.2007.05.192
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Briet F, Twomey C, Jeejeebhoy KN. Efecto de la desnutrición y la realimentación a corto plazo en la actividad del complejo mitocondrial I de células mononucleares de sangre periférica en humanos. Am J Clin Nutr. (2003) 77:1304–11. doi: 10.1093/ajcn/77.5.1304
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Fujita Y, Yanagida H, Mimori T, Jin Z-X, Sakai T, Kawanami T, et al. Prevención de la atrofia de la médula ósea mediada por el ayuno mediante la administración de leptina. Cell Immunol. (2012) 273:52–8. doi: 10.1016/j.cellimm.2011.11.007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. La Cava A, Matarese G. El peso de la leptina en la inmunidad. Nat Rev Immunol. (2004) 4:371–9. doi: 10.1038/NRI1350
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Xu D-L, Wang D-H. El ayuno suprime la inmunidad mediada por células T en jerbos mongoles hembras (Meriones unguiculatus). Comp Biochem Physiol A Mol Integr Physiol. (2010) 155:25–33. doi: 10.1016/j.cbpa.2009.09.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Ben-Nathan B, Drabkin N, Heller D. El efecto de la inanición en la respuesta inmune de los pollos. Avian Dis. (1980) 25:214–7. doi: 10.2307/1589845
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Señor GM, Matarese G, Howard JK, Baker RJ, Bloom SR, Lechler RI. La leptina modula la respuesta inmunitaria de las células T y revierte la inmunosupresión inducida por la inanición. Naturaleza. (1998) 394:897–901. doi: 10.1038/29795
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Loffreda S, Yang SQ, Lin HZ, Karp CL, Brengman ML, Wang DJ, et al. La leptina regula las respuestas inmunitarias proinflamatorias. FASEB J. (1997) 12:57–65. doi: 10.1096/fasebj.12.1.57
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Deng P, Jones JC, Swanson KS. Efectos de la composición de macronutrientes dietéticos en el metaboloma plasmático en ayunas de gatos adultos sanos. Metabolómica. (2014) 10:638–50. doi: 10.1007/s11306-013-0617-7
41. Tisdale MJ, Brennan RA, Fearon KC. Reducción de la pérdida de peso y el tamaño del tumor en un modelo de caquexia mediante una dieta alta en grasas. Hno. J Cáncer. (1987) 56:39–43. doi: 10.1038/bjc.1987.149
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. Grancher D, Jean-Blain C, Frey A, Schirardin H, Bach A. Estudios sobre la tolerancia de los triglicéridos de cadena media en perros. J Parenter Enter Nutr. (1987) 11:280–6. doi: 10.1177/0148607187011003280
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Cotter R, Taylor CA, Johnson R, Rowe WB. Una comparación metabólica de una emulsión lipídica pura de triglicéridos de cadena larga (LCT) y varias emulsiones combinadas de triglicéridos de cadena media (MCT)-LCT en perros. Am J Clin Nutr. (1987) 45:927–39. doi: 10.1093/ajcn/45.5.927
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Yeh YY, Zee P. Relación de la cetosis con los cambios metabólicos inducidos por la alimentación aguda con triglicéridos de cadena media en ratas. J Nutr. (1976) 106:58–67. doi: 10.1093/jn/106.1.58
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Seaton TB, Welle SL, Warenko MK, Campbell RG. Efecto térmico de los triglicéridos de cadena media y cadena larga en el hombre. Am J Clin Nutr. (1986) 44:630–4. doi: 10.1093/ajcn/44.5.630
Resumen de PubMed | Texto completo de CrossRef | Google Académico
46. Ingle DL, Driedger A, Traul KA, Nakhasi DK. Valor energético de los triglicéridos de cadena media en la dieta. J Ciencia de los alimentos. (1999) 64:960–3. doi: 10.1111/j.1365-2621.1999.tb12259.x
47. Kang MH, Kim DH, Jeong IS, Choi GC, Park HM. Evaluación de cuatro medidores portátiles de glucosa en sangre en perros y gatos diabéticos y no diabéticos. Veterinario Q. (2016) 36:2–9. doi: 10.1080/01652176.2015.1092617
Resumen de PubMed | Texto completo de CrossRef | Google Académico
48. Nagana Gowda GA, Gowda YN, Raftery D. Ampliación de los límites de la cuantificación de metabolitos sanguíneos humanos mediante espectroscopia de RMN. Química anal. (2015) 87:706–15. doi: 10.1021/ac503651e
Resumen de PubMed | Texto completo de CrossRef | Google Académico
49. Viana KF, Aguiar-Soares RDO, Roatt BM, Resende LA, Da Silveira-Lemos D, Corrêa-Oliveira R, et al. Análisis con sangre periférica canina para establecer condiciones in vitro para la diferenciación de monocitos en macrófagos para la infección por Leishmania chagasi y la purificación de subconjuntos de células T. Parasitol veterinario. (2013) 198:62–71. doi: 10.1016/j.vetpar.2013.08.014
Resumen de PubMed | Texto completo de CrossRef | Google Académico
50. Kampen AH, Tollersrud T, Lund A. Medición citométrica de flujo de estallido respiratorio de neutrófilos en sangre bovina total utilizando Staphylococcus aureus vivo. J Métodos Immunol. (2004) 289:47–55. doi: 10.1016/j.jim.2004.03.008
Resumen de PubMed | Texto completo de CrossRef | Google Académico
51. Lehnert B. BlandAltmanLeh: Tramas (ligeramente extendidas) Tramas de Bland-Altman. Paquete de R versión 0.3.1 (2015). Disponible en línea en: https://CRAN.R-project.org/package=BlandAltmanLeh
52. Bland JM, Altman DG. Concordancia entre métodos de medición con múltiples observaciones por individuo. J Biopharm Stat. (2007) 17:571–82. doi: 10.1080/10543400701329422
Resumen de PubMed | Texto completo de CrossRef | Google Académico
53. Bates D, Maechler M, Bolker B, Walker S. Ajuste de modelos lineales de efectos mixtos utilizando lme4. J Stat Softw. (2015) 67:1–48. doi: 10.18637/jss.v067.i01
54. Equipo central de R (2019). R: Un lenguaje y un entorno para la computación estadística. Viena: R Foundation for Statistical Computing. Disponible en línea en: https://www.R-project.org/
55. Ganesh S, Cueva V. Valores p, valores p en todas partes. N Z Vet J. (2018) 66:55–6. doi: 10.1080/00480169.2018.1415604
Resumen de PubMed | Texto completo de CrossRef | Google Académico
56. West D, York B. Grasa dietética, predisposición genética y obesidad: lecciones de modelos animales. Am J Clin Nutr. (1998) 67(Supl. 3):505S–12S. doi: 10.1093/ajcn/67.3.505S
Resumen de PubMed | Texto completo de CrossRef | Google Académico
57. Romsos DR, Hornshuh MJ, Leveille GA. Influencia de la grasa y los carbohidratos de la dieta en la ingesta de alimentos, el peso corporal y la grasa corporal de perros adultos. Proc Soc Exp Biol Med. (1978) 157:278–81. doi: 10.3181/00379727-157-40037
Resumen de PubMed | Texto completo de CrossRef | Google Académico
58. Hess RS, Saunders HM, Van Winkle TJ, Shofer FS, Washabau RJ. Anomalías clínicas, clinicopatológicas, radiográficas y ultrasonográficas en perros con pancreatitis aguda mortal: 70 casos (1986-1995). J Am Vet Med Assoc. (1998) 213:665–70.
59. Brian Haig TH, Haig THB. Pancreatitis experimental intensificada por una dieta alta en grasas. Cirugía Gynecol Obstet. (1970) 131:914–8.
60. Lindsay S, Entenman C, Chaikoff IL. Pancreatitis que acompaña a la enfermedad hepática en perros alimentados con una dieta alta en grasas y baja en proteínas. Arco Pathol. (1948) 45:635–8.
61. Lem KY, Fosgate GT, Norby B, Steiner JM. Asociaciones entre factores dietéticos y pancreatitis en perros. J Am Vet Med Assoc. (2008) 233:1425–31. doi: 10.2460/javma.233.9.1425
Resumen de PubMed | Texto completo de CrossRef | Google Académico
62. James FE, Mansfield CS, Steiner JM, Williams DA, Robertson ID. Respuesta pancreática en perros sanos alimentados con dietas de diversas composiciones de grasa. Am J Vet Res. (2009) 70:614–8. doi: 10.2460/ajvr.70.5.614
Resumen de PubMed | Texto completo de CrossRef | Google Académico
63. Orr NWM. La alimentación de perros de trineo en expediciones antárticas. Hno. J Nutr. (1966) 20:1–12. doi: 10.1079/BJN19660003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
64. Downey RL, Kronfeld DS, Banta CA. La dieta de los beagles afecta la resistencia. J Am Anim Hosp Assoc. (1980) 16:273–7.
65. Reynolds AJ, Fuhrer L, Dunlap HL, Finke MD, Kallfelz FA. Respuestas de metabolitos lipídicos a la dieta y el entrenamiento en perros de trineo. J Nutr. (1994) 124:2754S–9S. doi: 10.1093/jn/124.suppl_12.2754S
Resumen de PubMed | Texto completo de CrossRef | Google Académico
66. Falecka-Wieczorek I, Kaciuba-USciłko H. Respuestas metabólicas y hormonales al ejercicio físico prolongado en perros después de una sola comida enriquecida con grasas. Eur J Appl Physiol Occup Physiol. (1984) 53:267–73. doi: 10.1007/BF00776601
Resumen de PubMed | Texto completo de CrossRef | Google Académico
67. Wyatt HT. Más experimentos sobre la nutrición de perros de trineo. Hno. J Nutr. (1963) 17:273–9. doi: 10.1079/BJN19630030
Resumen de PubMed | Texto completo de CrossRef | Google Académico
68. Reynolds AJ, Dunlap HL, Finke M, Kallfelz FA, Fuhrer L. Efecto de la dieta y el entrenamiento en el almacenamiento y la utilización de glucógeno muscular en perros de trineo. J Appl Physiol. (1995) 79:1601–7. doi: 10.1152/jappl.1995.79.5.1601
Resumen de PubMed | Texto completo de CrossRef | Google Académico
69. Suzuki M, Suzuki M, Kitamura Y, Mori S, Sato K, Dohi S, et al. El beta-hidroxibutirato, un agente que mejora la función cerebral, protege el cerebro de la rata contra el daño isquémico causado por la isquemia cerebral focal permanente y transitoria. Jpn J Pharmacol. (2002) 89:36–43. doi: 10.1254/jjp.89.36
Resumen de PubMed | Texto completo de CrossRef | Google Académico
70. Massieu L, Haces ML, Montiel T, Hernández-Fonseca K. El acetoacetato protege a las neuronas del hipocampo contra el daño neuronal mediado por glutamato durante la inhibición de la glucólisis. Neurociencia. (2003) 120:365–78. doi: 10.1016/S0306-4522(03)00266-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
71. Haces ML, Hernández-Fonseca K, Medina-Campos ON, Montiel T, Pedraza-Chaverri J, Massieu L. La capacidad antioxidante contribuye a la protección de los cuerpos cetónicos contra el daño oxidativo inducido durante condiciones de hipoglucemia. Exp Neurol. (2008) 211:85–96. doi: 10.1016/j.expneurol.2007.12.029
Resumen de PubMed | Texto completo de CrossRef | Google Académico
72. Pan JW, Rothman TL, Behar KL, Stein DT, Hetherington HP. El beta-hidroxibutirato del cerebro humano y el lactato aumentan en la cetosis inducida por el ayuno. J Cereb Flujo sanguíneo metab. (2000) 20:1502–7. doi: 10.1097/00004647-200010000-00012
Resumen de PubMed | Texto completo de CrossRef | Google Académico
73. Hawkins RA, Williamson DH, Krebs HA. Utilización del cuerpo de cetona por el cerebro de rata adulta y lactante in vivo. Biochem J. (1971) 122:13–8. doi: 10.1042/bj1220013
Resumen de PubMed | Texto completo de CrossRef | Google Académico
74. De Bruijne JJ, van den Brom WE. El efecto del ayuno a largo plazo en el metabolismo de los cuerpos cetónicos en el perro. Comp Biochem Physiol. (1986) 83:391–5. doi: 10.1016/0305-0491(86)90386-X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
75. Keller U, Shulman G. Efecto del glucagón sobre la oxidación de ácidos grasos hepáticos y la cetogénesis en perros conscientes. Am J Physiol. (1979) 237:E121-9. doi: 10.1152/ajpendo.1979.237.2.E121
Resumen de PubMed | Texto completo de CrossRef | Google Académico
76. Crandall LA. Una comparación de la cetosis en el hombre y el perro. J Biol Chem. (1940) 138:123–9.
77. Keller U, Cherrington AD, Liljenquist JE. Recambio de cuerpos cetónicos y producción neta de cetonas hepáticas en perros en ayunas y diabéticos. Am J Physiol. (1978) 235:E238-47. doi: 10.1152/ajpendo.1978.235.2.E238
Resumen de PubMed | Texto completo de CrossRef | Google Académico
78. Reichard GA Jr, Paul P, Bortz WM. Producción y oxidación del cuerpo de cetona en humanos obesos en ayunas. J Clin Invest. (1974) 53:508–15. doi: 10.1172/JCI107584
Resumen de PubMed | Texto completo de CrossRef | Google Académico
79. Wiener R, Hirsch HJ, Spitzer JJ. Extracción cerebral de cetonas y su penetración en el LCR en el perro. Am J Physiol. (1971) 220:1542–6. doi: 10.1152/ajplegacy.1971.220.5.1542
Resumen de PubMed | Texto completo de CrossRef | Google Académico
80. Lamers KJ, Doesburg WH, Gabreëls FJ, Romsom AC, Lemmens WA, Wevers RA, et al. Concentración de LCR y proporción de LCR/sangre de componentes relacionados con el combustible en niños después de un ayuno prolongado. Clin Chim Acta. (1987) 167:135–45. doi: 10.1016/0009-8981(87)90366-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
81. Valente-Silva P, Lemos C, Köfalvi A, Cunha RA, Jones JG. Los cuerpos cetónicos compiten eficazmente con la glucosa por la generación neuronal de acetil-CoA en rodajas de hipocampo de rata. RMN Biomed. (2015) 28:1111–6. doi: 10.1002/nbm.3355
Resumen de PubMed | Texto completo de CrossRef | Google Académico
82. Belo PS, Romsos DR, Leveille GA. Influencia de la dieta en la tolerancia a la glucosa, en la tasa de utilización de glucosa y en las actividades enzimáticas gluconeogénicas en el perro. J Nutr. (1976) 106:1465–74. doi: 10.1093/jn/106.10.1465
Resumen de PubMed | Texto completo de CrossRef | Google Académico
83. Kahn SE, Hull RL, Utzschneider KM. Mecanismos que vinculan la obesidad con la resistencia a la insulina y la diabetes tipo 2. Naturaleza. (2006) 444:840–6. doi: 10.1038/nature05482
Resumen de PubMed | Texto completo de CrossRef | Google Académico
84. Blanchard GG, Nguyen P, Gayet C, Leriche I, Siliart B, Paragon B-M. La rápida pérdida de peso con una dieta alta en proteínas y baja en energía permite la recuperación de la composición corporal ideal y la sensibilidad a la insulina en perros obesos. J Nutr. (2004) 134(Supl. 8):2148S–50S. doi: 10.1093/jn/134.8.2148S
Resumen de PubMed | Texto completo de CrossRef | Google Académico
85. German AJ, Hervera M, Hunter L, Holden SL, Morris PJ, Biourge V, et al. Mejora de la resistencia a la insulina y reducción de las adipoquinas inflamatorias plasmáticas tras la pérdida de peso en perros obesos. Domest Anim Endocrinol. (2009) 37:214–26. doi: 10.1016/j.domaniend.2009.07.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
86. Adolphe JL, Silver TI, Childs H, Drew MD, Weber LP. La obesidad a corto plazo da lugar a cambios metabólicos y cardiovasculares perjudiciales que pueden no revertirse con la pérdida de peso en un modelo de perro obeso. Hno. J Nutr. (2014) 112:647–56. doi: 10.1017/S0007114514001214
87. Blackshear PJ, Holloway PAH, Alberti KGMM. Los efectos de la inanición y la insulina en la liberación de sustratos gluconeogénicos de los tejidos extraesplácnicos in vivo. FEBS Lett. (1974) 48:310–3. doi: 10.1016/0014-5793(74)80493-X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
88. Saudek CD, Felig P. Los eventos metabólicos de la inanición. Am J Med. (1976) 60:117–26. doi: 10.1016/0002-9343(76)90540-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
89. Belo PS, Romsos DR, Leveille GA. Influencia de la dieta en el recambio de lactato, alanina y serina y su incorporación a la glucosa en el perro. J Nutr. (1977) 107:397–403. doi: 10.1093/jn/107.3.397
Resumen de PubMed | Texto completo de CrossRef | Google Académico
90. Gjedde A, Crone C. Procesos de inducción en la transferencia sangre-cerebro de cuerpos cetónicos durante la inanición. Am J Physiol. (1975) 229:1165–9. doi: 10.1152/ajplegacy.1975.229.5.1165
Resumen de PubMed | Texto completo de CrossRef | Google Académico
91. Bouzier-Sore AK, Voisin P, Canioni P, Magistretti PJ, Pellerin L. El lactato es un sustrato energético oxidativo preferente sobre la glucosa para las neuronas en cultivo. J Cereb Flujo sanguíneo metab. (2003) 23:1298–306. doi: 10.1097/01.WCB.0000091761.61714.25
Resumen de PubMed | Texto completo de CrossRef | Google Académico
92. Leino RL, Gerhart DZ, Duelli R, Enerson BE, Drewes LR. La cetosis inducida por la dieta aumenta los niveles del transportador de monocarboxilato (MCT1) en el cerebro de rata. Neurochem Int. (2001) 38:519–27. doi: 10.1016/S0197-0186(00)00102-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
93. Dixit VD, Mielenz M, Taub DD, Parvizi N. La leptina induce la secreción de la hormona del crecimiento de las células mononucleares de sangre periférica a través de un mecanismo dependiente de la proteína quinasa C y el óxido nítrico. Endocrinología. (2003) 144:5595–603. doi: 10.1210/en.2003-0600
Resumen de PubMed | Texto completo de CrossRef | Google Académico
94. Caldefie-Chezet F, Poulin A, Vasson MP. La leptina regula las capacidades funcionales de los neutrófilos polimorfonucleares. Libre Radic Res. (2003) 37:809–14. doi: 10.1080/1071576031000097526
Resumen de PubMed | Texto completo de CrossRef | Google Académico
95. Lukács NW, Peters-Golden M, Gottschalk A, Phare SM, Mancuso P, Huffnagle GB. Los ratones deficientes en leptina exhiben una defensa del huésped deteriorada en la neumonía por gramnegativos. J Immunol. (2014) 168:4018–24. doi: 10.4049/jimmunol.168.8.4018
Resumen de PubMed | Texto completo de CrossRef | Google Académico
96. Howard JK, Lord GM, Matarese G, Vendetti S, Ghatei MA, Ritter MA, et al. La leptina protege a los ratones de la atrofia linfoide inducida por la inanición y aumenta la celularidad tímica en ratones ob/ob. J Clin Invest. (1999) 104:1051–9. doi: 10.1172/JCI6762
Resumen de PubMed | Texto completo de CrossRef | Google Académico
97. Weigle DS, Duell PB, Connor WE, Steiner RA, Soules MR, Kuijper JL. Efecto del ayuno, la realimentación y la restricción de grasas dietéticas sobre los niveles plasmáticos de leptina. J Clin Endocrinol Metab. (1997) 82:561–5. doi: 10.1210/jc.82.2.561
Resumen de PubMed | Texto completo de CrossRef | Google Académico
98. Herieka M, Erridge C. Inflamación postprandial inducida por comidas ricas en grasas. Mol Nutr Food Res. (2014) 58:136–46. doi: 10.1002/mnfr.201300104
Resumen de PubMed | Texto completo de CrossRef | Google Académico
99. Yang W, Cao M, Mao X, Wei X, Li X, Chen G, et al. El ayuno en días alternos protege los hígados de los ratones contra la inflamación inducida por la dieta alta en grasas asociada con la supresión de la señalización del receptor tipo Toll 4/factor nuclear κB. Nutr Res. (2016) 36:586–93. doi: 10.1016/j.nutres.2016.02.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
100. Bhatnagar AS, Prasanth Kumar PK, Hemavathy J, Gopala Krishna AG. La composición de ácidos grasos, la estabilidad oxidativa y la actividad de eliminación de radicales de las mezclas de aceite vegetal con aceite de coco. J Am Oil Chem Soc. (2009) 86:991–9. doi: 10.1007/s11746-009-1435-y
101. Castellano C-A, Pierotti T, St-Pierre V, Cunnane SC, Vandenberghe C, Fortier M. La tricaprilina sola aumenta la respuesta a las cetonas plasmáticas más que el aceite de coco u otros triglicéridos de cadena media: un estudio cruzado agudo en adultos sanos. Curr Dev Nutr. (2017) 1:E000257. doi: 10.3945/cdn.116.000257
Resumen de PubMed | Texto completo de CrossRef | Google Académico
102. St-Pierre V, Vandenberghe C, Lowry C-M, Fortier M, Castellano C-A, Wagner R, et al. Respuesta plasmática de cetonas y ácidos grasos de cadena media en humanos que consumen diferentes triglicéridos de cadena media durante una jornada de estudio metabólico. Nutr delantero. (2019) 6:1–8. doi: 10.3389/fnut.2019.00046
Resumen de PubMed | Texto completo de CrossRef | Google Académico
103. Matthews DR, Hosker JP, Rudenski AS, Naylor BA, Treacher DF, Turner RC. Evaluación del modelo de homeostasis: resistencia a la insulina y función de las células β a partir de concentraciones plasmáticas de glucosa e insulina en ayunas en el hombre. (1985) 28:412–9. doi: 10.1007/BF00280883
Resumen de PubMed | Texto completo de CrossRef | Google Académico
104. Harvie MN, Pegington M, Mattson MP, Frystyk J, Dillon B, Evans G, et al. Los efectos de la restricción energética intermitente o continua en la pérdida de peso y los marcadores de riesgo de enfermedades metabólicas: un ensayo aleatorizado en mujeres jóvenes con sobrepeso. Int J Obes. (2011) 35:714–27. doi: 10.1038/ijo.2010.171
Resumen de PubMed | Texto completo de CrossRef | Google Académico
105. Klempel MC, Kroeger CM, Bhutani S, Trepanowski JF, Varady KA. El ayuno intermitente combinado con la restricción calórica es eficaz para la pérdida de peso y la cardioprotección en mujeres obesas. Nutr J. (2012) 11:1–9. doi: 10.1186/1475-2891-11-98
Resumen de PubMed | Texto completo de CrossRef | Google Académico
106. Ader M, Stefanovski D, Richey JM, Kim SP, Kolka CM, Ionut V, et al. Fracaso de la evaluación del modelo homeostático de resistencia a la insulina para detectar una marcada resistencia a la insulina inducida por la dieta en perros. Diabetes. (2014) 63:1914–9. doi: 10.2337/db13-1215
Resumen de PubMed | Texto completo de CrossRef | Google Académico
107. Appleton DJ, Rand JS, Sunvold GD. La insulina plasmática basal y la evaluación del modelo de homeostasis (HOMA) son indicadores de la sensibilidad a la insulina en gatos. J Feline Med Surg. (2005) 7:183–93. doi: 10.1016/j.jfms.2004.12.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
108. Slingerland LI, Robben JH, Van Haeften TW, Kooistra HS, Rijnberk A. Sensibilidad a la insulina y función de las células β en gatos sanos: evaluación con el uso de la pinza de glucosa hiperglucémica. Horm Metab Res. (2007) 39:341–6. doi: 10.1055/s-2007-976541
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: ayuno, cetona, beta-hidroxibutirato, cetogénico, dieta, perro, cadena media, inmunidad
Cita: Leung YB, Cave NJ, Heiser A, Edwards PJB, Godfrey AJR y Wester T (2020) Efectos metabólicos e inmunológicos del ayuno intermitente en una dieta cetogénica que contiene triglicéridos de cadena media en perros sanos. Frente. Vet. Sci. 6:480. doi: 10.3389/fvets.2019.00480
Recibido: 30 de junio de 2019; Aceptado: 06 de diciembre de 2019;
Publicado: 08 Enero 2020.
Editado por:
Véronique Anne Lacombe, Universidad Estatal de Oklahoma, Estados Unidos
Revisado por:
Youssef A. Attia, Universidad Rey Abdulaziz, Arabia
Saudita Christian-Alexandre Castellano, Centro Hospitalario Universitario de Sherbrooke, Canadá
Derechos de autor © 2020 Leung, Cave, Heiser, Edwards, Godfrey y Wester. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Y. Becca Leung, r.leung@massey.ac.nz
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía