Eficacia de un aglutinante multicomponente frente a la exposición combinada a zearalenona y ocratoxina A en cerdos destetados
Eficacia de un aglutinante multicomponente frente a la exposición combinada a zearalenona y ocratoxina A en cerdos destetados
 Panagiotis Tassis1*
Panagiotis Tassis1*  Jog Raj2
Jog Raj2  Dimitrios Floros1
Dimitrios Floros1  Nikolaos Mittas3
Nikolaos Mittas3  Niki Ntarampa1
Niki Ntarampa1  Hunor Farkas2
Hunor Farkas2  Zoe Polizopoulou4
Zoe Polizopoulou4  Marko Vasilievic2
Marko Vasilievic2- 1Clínica de Animales de Granja, Facultad de Medicina Veterinaria, Universidad Aristóteles de Tesalónica, Tesalónica, Grecia
- 2Patent Co, DOO., Mišićevo, Serbia
- 3Laboratorio Hefesto, Departamento de Química, Facultad de Ciencias, Universidad Helénica Internacional, Kavala, Grecia
- 4Laboratorio de Diagnóstico, Facultad de Medicina Veterinaria, Universidad Aristóteles de Tesalónica, Tesalónica, Grecia
Introducción: El objetivo del estudio era evaluar la eficacia de una nueva sustancia multicomponente frente a la exposición combinada a las micotoxinas zearalenona (ZEN) y ocratoxina A (OTA) en lechones destetados.
Métodos: En total, 60 lechones a la edad de 28 días se distribuyeron equitativamente en cuatro grupos experimentales (A-D), formados por ocho lechones hembras y siete machos cada uno (15 animales por grupo, para una duración total del ensayo de 42 días). Los animales del grupo A recibieron un pienso típico para destetados sin micotoxinas ni el producto problema [agente desintoxicante de micotoxinas multicomponente (MMDA)]. Los animales del grupo B recibieron el mismo alimento para destetar contaminado con 0,992 mg de ZEN/kg de alimento y 0,531 mg de OTA/kg de alimento sin la adición de MMDA. Los animales del grupo C recibieron el mismo alimento contaminado que el grupo B con la adición de 1,5 g de MMDA/kg de alimento, mientras que el grupo D recibió el mismo alimento que el grupo B con la inclusión de 3 g de MMDA/kg de alimento. Se evaluaron los signos clínicos y los parámetros de rendimiento [peso corporal (PC), ganancia media diaria de peso (ADWG) y índice de conversión alimenticia (FCR)], mientras que también se evaluaron los residuos de micotoxinas en los tejidos hepático y renal.
Resultados: Los resultados mostraron una mejora de la FCR en el grupo que recibió la mayor dosis del producto de prueba (3 g de MMDA/kg de alimento) en comparación con el grupo que recibió la dosis más baja (1,5 g de MMDA/kg de alimento). Algunos parámetros hematológicos y bioquímicos estaban ligeramente alterados, predominando dentro de los límites normales. El análisis de residuos demostró una reducción de OTA en las muestras de hígado, de a-ZEL en el hígado y del total de muestras analizadas, y un total de ZEN y contenido de metabolitos en todas las muestras del grupo que recibió la mayor dosis de MMDA en comparación con el grupo que recibió las toxinas sin la adición del producto de prueba.
Discusión: Por lo tanto, se sugiere un efecto positivo de la MMDA en el régimen de dosis más alto en la reducción de la biodisponibilidad y la deposición tisular de ZEN y OTA, con un efecto particularmente positivo en la FCR en cerdos destetados, bajo la exposición simultánea de ZEN y OTA in vivo.
1 Introducción
Se ha sugerido que una serie de micotoxinas, como metabolitos secundarios de hongos detectados en los granos utilizados para la alimentación porcina, son perjudiciales para la salud y el rendimiento de los cerdos (1). Las micotoxinas particulares de las especies de Fusarium, como la zearalenona (ZEN), el deoxinivalenol (DON), la toxina T2 y las fumonisinas (FB), y las micotoxinas de las especies de Penicillium y Aspergillus, como las aflatoxinas (AFB) y la ocratoxina A (OTA), se observan con frecuencia en los cereales de todo el mundo (2). La UE ha establecido límites máximos u orientativos para las micotoxinas antes mencionadas. Los niveles orientativos para la contaminación de piensos compuestos para lechones y cerdas jóvenes no deben superar los 0,1 mg de ZEN/kg de pienso (0,25 mg de ZEN/kg de pienso para cerdas y cerdos de engorde) y 0,05 mg de OTA/kg de pienso, respectivamente (3).
Debido a sus propiedades estrogénicas, el ZEN se une a los receptores de estrógeno (RE), compitiendo con el 17-estradiol, y se asocia típicamente con trastornos reproductivos en cerdos como infertilidad, particularmente en primerizas prepúberes, lo que conduce a pseudoembarazos, aumento de reabsorciones letales embrionarias, vulva edematosa hinchada, prolapso vaginal/rectal y reducción del tamaño de la camada (debido a la reabsorción fetal y falla de implantación) (4, 5). Sin embargo, la ZEN también podría presentar hepatotoxicidad, hematotoxicidad, inmunotoxicidad y genotoxicidad (6). Los principales derivados del metabolismo de la ZEN en cerdos son el α-zearalenol (α-ZEL), que es la forma modificada predominante en los cerdos con una actividad estrogénica de 3 a 100 veces mayor que la toxina original, y el β-zearalenol (β-ZEL) (4).
La ocratoxina A es producida por varias especies de Aspergillus y Penicillium y tiene una biodisponibilidad oral de aproximadamente el 60% en cerdos (7). Después de la absorción de la toxina del tracto gastrointestinal, sigue la unión a las proteínas séricas (principalmente albúmina) (8, 9). El ΟTA es hidrolizado enzimáticamente a la α de ocratoxina-(OTα) menos tóxica por los microbios intestinales, mientras que el sistema del citocromo P450 en el hígado está asociado con la hidroxilación de OTA a varias formas de OTA-OH (10, 11). La OTA es un agente nefrotóxico importante, mientras que también puede inducir efectos inmunotóxicos, genotóxicos, neurotóxicos y teratogénicos (7, 12). Los cerdos son significativamente susceptibles a los efectos de la OTA, y su deposición tisular es la siguiente: plasma>pulmón> riñón o músculo > bilis>hígado>grasa (13, 14). Los síntomas clínicos asociados a la OTA incluyen una reducción de la tasa de crecimiento y de la eficiencia alimenticia con o sin la reducción del consumo de alimento, junto con hiperproteinemia y aumento de la urea y creatinina séricas, atribuidas a alteraciones de la función renal (8, 15, 16). Estudios in vitro particulares demostraron efectos citotóxicos combinados después de la administración de ZEN y OTA e inhibición dependiente de la dosis de la viabilidad celular en la línea celular HepG2, con OTA mostrando un mayor efecto citotóxico que α-ZEL y ZEN (17-19).
El número de micotoxinas que mitigan/desintoxican los aditivos alimentarios contra los efectos de ZEN u OTA in vivo se ha informado previamente (20-26). Dichas sustancias incluyen principalmente productos de levadura (por ejemplo, Saccharomyces cerevisiae boulardii y Trichosporon mycotoxinivorans) (25), silimarina y otros extractos de plantas (26-29), probióticos y microbios con capacidad degradante (por ejemplo, Bacillus licheniformis CK1 o una cepa de Bacillus velezensis, denominado A2), bacterias del ácido láctico (BAL), adsorbentes minerales inorgánicos (p. ej., bentonita trioctaédrica) y enzimas (p. ej., lacasas, carboxipeptidasas, hidrolasas y amidasas), así como aminoácidos (selenometionina y N-acetilcisteína), vitaminas y otros adsorbentes sintéticos orgánicos (30, 31).
Los resultados de las pruebas in vivo con exposición combinada a ZEN y OTA a través de la alimentación de cerdos son escasos (32-34). El estudio tuvo como objetivo evaluar la eficacia de dos regímenes de dosificación diferentes de un agente desintoxicante de micotoxinas multicomponente (MMDA, Mycoraid, Patent Co, Misicevo, Serbia) que contiene zeolita modificada (Clinoptilolita), Bacillus subtilis, Bacillus licheniformis, Saccharomyces cerevisiae y silimarina en los piensos frente a la exposición combinada a ZEN y OTA a niveles superiores a los límites recomendados de la UE (3).
2 Materiales y métodos
2.1 Declaración ética
Este protocolo de estudio fue revisado y aprobado de acuerdo con las normas regulatorias pertinentes por el Comité de Ética de la Investigación de la Universidad Aristóteles de Tesalónica (AUTH) con número de aprobación 122184/2021.
2.2 Animales y piensos
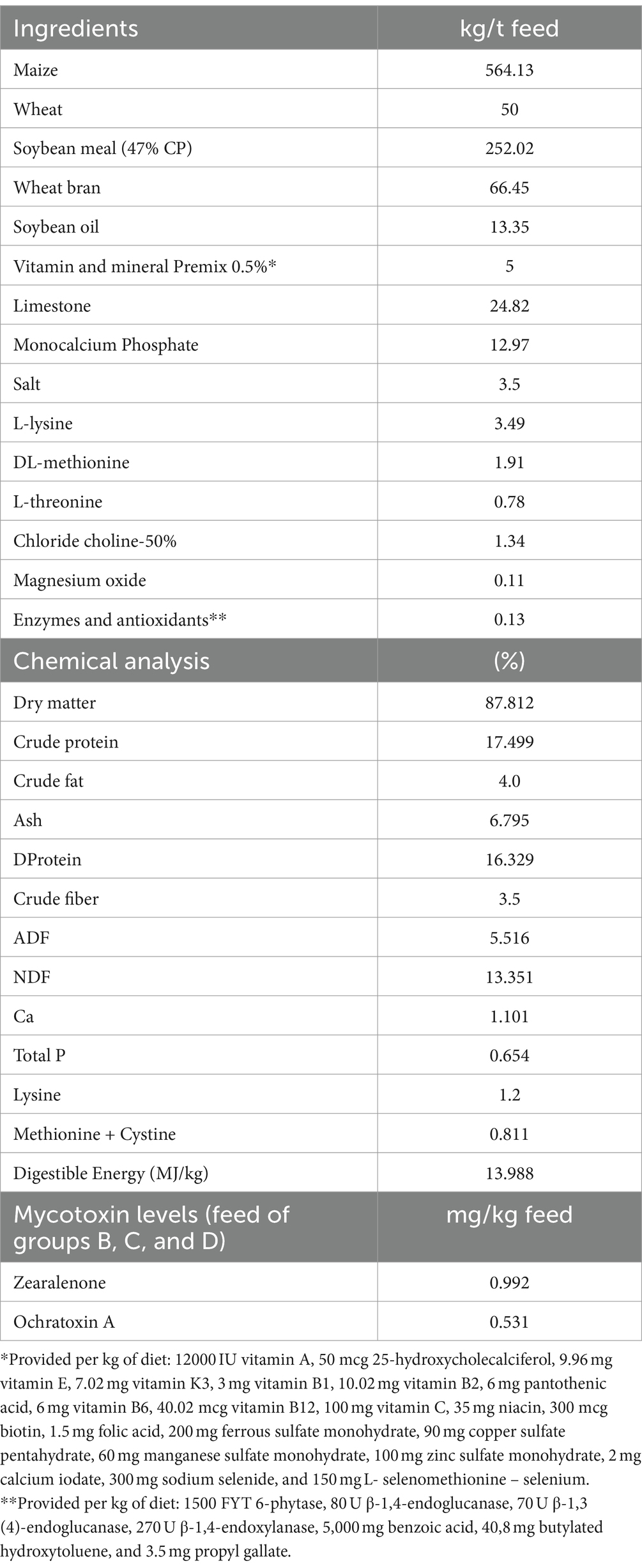
Un total de 60 cerdos destetados a la edad de 28 días fueron incluidos en el estudio. Los animales se compraron en una granja colaboradora de alto estado sanitario desde el parto hasta el final y se vacunaron unos días antes de la compra contra la neumonía enzoótica y el circovirus porcino 2. Se proporcionó a los animales alimento típico para destetados (Tabla 1) durante el período de prueba de 42 días (final del estudio a los 70 días de edad). El ensayo se llevó a cabo en el centro experimental colaborador de la Universidad Helénica Internacional (EL-54-BIOexp-50) en Sindos, Grecia.
Los cerdos se asignaron a cuatro grupos de ensayo de 15 animales (ocho cerdos hembras y siete cerdos machos/grupo). El grupo A recibió alimento de control sin micotoxinas ni MMDA; el grupo B sirvió como control positivo y recibió una dieta contaminada con micotoxinas con 992 μg ZEN/kg de alimento y 531 μg OTA/kg. Los animales del grupo C recibieron la dieta contaminada del grupo B con la inclusión de 1,5 g de MMDA/kg de pienso, mientras que los animales del grupo D recibieron el mismo pienso contaminado con 3 g de MMDA/kg de pienso.
El maíz enriquecido contaminado con 598 mg ZEN/kg y 890 mg OTA/kg fue proporcionado por el patrocinador del estudio para la contaminación de los piensos de ensayo. El análisis y la estandarización de los niveles de contaminación del maíz espigado se realizaron en los laboratorios del patrocinador con el uso de LC-MS/MS. Se realizó un procedimiento estándar para la preparación de las alimentaciones de prueba (27). La mezcla del MMDA y otros materiales de alimentación se realizó con una mezcla muy suave con una formación mínima de polvo. Las dietas se fabricaron en una secuencia de producción adecuada, comenzando con dietas de control del grupo A separadas con una comida neutra mezclada entre cada una de las dietas y la secuencia de producción, seguidas de piensos del grupo B, luego del grupo C y finalmente del grupo D. Se recogieron submuestras de cada dieta experimental para su análisis de acuerdo con el Reglamento (CE) n.º 152/2009 (35).
El análisis de los piensos se realizó en el Laboratorio de Nutrición de la Facultad de Medicina Veterinaria de la AUTH, los resultados de los análisis de los piensos se presentan en la Tabla 1. La alimentación final del ensayo se analizó más a fondo con LC-MS/MS para aflatoxinas (B1, B2, G1 y G2), DON, ZEN, OTA, FB, T2 y HT2 en un laboratorio colaborador (P. Androulakis & Partners Laboratories, Thermi, Grecia). Para la detección de las toxinas AFB1, DON, ZEN, OTA y T2, se siguió el método descrito por Ren et al. (36), con extracción secuencial de muestras homogeneizadas en solución acuosa de acetonitrilo al 80% (v/v), seguida de filtración y purificación con una columna apropiada de MycoSep SPE (Romer Labs, Tulln, Austria) y reconstitución en un disolvente LC/MS–MS adecuado para el análisis. Todos los resultados del análisis de micotoxinas en los piensos de prueba demostraron la ausencia [< límites de cuantificación (niveles de LOQ)] de todas las micotoxinas, excepto ZEN y OTA.
2.3 Observaciones clínicas y parámetros de funcionamiento
Se realizó una evaluación clínica diaria y se examinaron los animales para detectar trastornos conductuales (reducción del vigor) y alimentarios (anorexia), así como signos de micotoxicosis clínica asociados con la ingestión de ZEN u OTA, incluida la presencia de casos de diarrea, vómitos, edema vulvar, prolapso rectal y la aparición de poliuria o polidipsia. Para evaluar la condición corporal y el rendimiento, los animales se pesaron semanalmente, y también se calculó el consumo diario de alimento para evaluar el peso corporal (PC), el índice de conversión alimenticia (FCR), como alimento (kg): ganancia (kg) por período de tiempo, valores promedio de ganancia de peso diaria (ADWG) por período (0-21 y 21-42 días del estudio) y para todo el período de estudio.
2.4 Parámetros hematológicos y bioquímicos séricos
Se realizaron tres muestras de sangre al inicio (día 0), al final de la tercera semana (día 21) y al final del ensayo (día 42), resultando un total de 180 muestras de sangre para la evaluación de parámetros bioquímicos y hematológicos en el Laboratorio de Diagnóstico de la Facultad de Medicina Veterinaria de la AUTH. Las muestras de sangre se recogieron mediante tubos BD Vacutainer (BD-Plymouth, UK) y refrigerado durante 24 h hasta que se realizó la centrifugación a 3000 rpm durante 10 min para su posterior recogida de suero y el análisis de parámetros bioquímicos. Además, se recogieron muestras de sangre utilizando tubos de micromuestras EDTA K3E (Sarstedt, Nümbrecht, Alemania) en los mismos puntos de tiempo para la evaluación de parámetros hematológicos.
Los parámetros bioquímicos séricos se midieron utilizando un analizador flexor automatizado Vitalab (Vital Scientific NV, Dieren, Países Bajos). Los parámetros evaluados fueron proteínas totales, albúminas, alanina aminotransferasa (ALT), fosfatasa alcalina (ALP), aspartato aminotransferasa (AST), gamma-glutamil transpeptidasa (γ-GT), nitrógeno ureico en sangre (BUN) y creatinina (CRE).
Además, las muestras de sangre mencionadas anteriormente se analizaron con el uso de un analizador automatizado (sistema de hematología Advia 120, Bayer Diagnostics, Mfg Ltd., Dublín, Irlanda) para los siguientes parámetros hematológicos: hematocrito (HCT), concentración de hemoglobina (HGB), glóbulos rojos (RBC), plaquetas (PLT), leucocitos (WBC), linfocitos (LYM), neutrófilos (NEUT), monocitos (MONO), eosinófilos (EOS), basófilos (BASO), volumen corpuscular medio (MCV), hemoglobina corpuscular media (MCH), concentración media de hemoglobina corpuscular (MCHC), ancho de distribución de eritrocitos (RDW) y volumen plaquetario medio (VPM).
2.5 Análisis de residuos
Al final del estudio, todos los animales fueron sacrificados humanamente con la aplicación intravenosa de pentobarbital sódico (Repose®, Le Vet Beheer B.V., Países Bajos) después de la introducción a la anestesia con una combinación de ketamina (Ketabel®, Bela-Pharm GmbH and Co., Alemania) y azaperona (Stresnil®, Elanco GmbH, Alemania). Se recogieron muestras de un riñón y 100 g de tejido hepático de cada animal y se almacenaron a -20 °C antes de liofilizarlas. Los tejidos se analizaron más a fondo en busca de residuos de micotoxinas de ZEN y OTA y sus metabolitos, incluidos α y β-ZEL, zearalanona (ZAN), α y β- zearalanol (α-ZAL, β-ZAL) y OTα. Se realizó un método interno de LC-MS/MS (sistema Agilent 6.460 LC-MS/MS) con LOQ para ZEN y OTA a 0,4 μg/kg y para α-ZEL, β-ZEL, α-ZAL, β-ZAL, ZAN y OTα a 4 μg/kg. El método se llevó a cabo con el uso de patrones internos (13C18) ZEN CRM BiopureTM (25 μg/mL) para zearalenona y sus metabolitos (13C20), OTA CRM BiopureTM (10 μg/mL) para OTA y toxina OTα. Se registró una recuperación de más del 75% para todas las toxinas. El método fue lineal de 0,4 a 8 μg/kg para ZEN y OTA, de 4 a 80 μg/kg para α-ZEL, β-ZEL, α-ZAL, β-ZAL, ZAN y toxina OTα. En resumen, las muestras de tejido se molieron finamente y se mezclaron bien con una licuadora. Se retiró una porción de prueba de 2 g para su análisis. A continuación, las muestras se extrajeron utilizando una mezcla de extracción de 10 ml (80% de acetonitrilo, 15% de agua, 5% de ácido fórmico) y agitando la mezcla en un agitador orbital a 200 rpm durante 1 h a temperatura ambiente. Después de la extracción, esta porción se centrifugó a 4200 g durante 5 min, y se retiraron 7 mL de sobrenadante y se colocaron en otro tubo cónico. El extracto de la muestra se limpió añadiendo 2,8 g de MgSO4 y 0,7 g de NaCl al sobrenadante y se agitó en vórtice durante 60 s. Estos tubos se centrifugaron a 4200 g durante 5 min. Se extrajo una solución de 1 mL del sobrenadante y se diluyó con 250 μL de agua. Se realizó una limpieza adicional del extracto de la muestra en el cartucho Captiva EMR-Lipid (Agilent Technologies) (no se requiere acondicionamiento del cartucho): se pasaron 1,25 ml de sobrenadante a través del cartucho (por gravedad) y se recogieron en un tubo de centrífuga de 15 ml. Cuando todo el extracto había pasado por el cartucho, se añadían 400 μL del disolvente de extracción al cartucho y se recogían en el mismo tubo de centrífuga. El extracto en el evaporador (CHRIST RVC 2-18 Cdplus) se evaporó a 1500 rpm a 40 °C. A continuación, se añadieron 500 μL de disolvente para la reconstitución (50% de acetonitrilo, 50% de agua que contenía 0,1% de ácido fórmico) a la muestra evaporada y se colocó un pozo en vórtice. Las muestras preparadas se filtraron a través de una jeringa de membrana de nailon (tamaño de poro de 0,22 μm) en un vial de vidrio y se sometieron a vórtice. Las muestras se analizaron en LC-MS/MS utilizando la columna analítica Agilent ZORBAX Rapid Resolution HD 2,1*50 mm, 1,8 μm, y la columna de protección ZORBAX Eclipse Plus C18, 2,1 mm, 1,8 μm, columna de protección UHPLC.
El producto de prueba administrado en el estudio fue una MMDA que contenía zeolita modificada (clinoptilolita), Bacillus subtilis, Bacillus licheniformis, pared celular de Saccharomyces cerevisiae y silimarina (27).
2.6 Análisis estadístico
Los análisis estadísticos se realizaron utilizando el software estadístico SPSS® Statistics (IBM) versión 25 para la evaluación de los resultados de residuos de micotoxinas (mediciones no repetidas) y el lenguaje de programación estadístico R para el resto de los parámetros (mediciones repetidas) (37). Con fines inferenciales sobre los parámetros referidos a mediciones no repetidas, se utilizó la prueba de Kolmogorov-Smirnov para evaluar si las variables satisfacían el supuesto de normalidad. Sobre la base de los resultados obtenidos, se utilizó el análisis de varianza de una vía (ANOVA) para determinar si había un efecto general de la exposición combinada a micotoxinas en las variables de respuesta, seguido de un análisis post hoc a través de las comparaciones por pares de Tukey o Duncan después del examen de la homogeneidad de la suposición de varianza. En el caso de distribuciones no normales y muy sesgadas se utilizó el análogo no paramétrico del ANOVA de un factor, la prueba de Kruskal-Wallis acompañada de comparaciones pareadas de Mann-Whitney y el enfoque de corrección de Bonferroni. Finalmente, se realizó la investigación de los efectos fijos del tiempo y la exposición a micotoxinas (grupo) sobre los valores medios para el resto de los parámetros referidos a mediciones repetidas mediante el ajuste de modelos lineales de efectos mixtos (LMEMs). Más específicamente, se ajustó un LMEM con los términos principal y de interacción y se probó con el modelo sin el término de interacción, mientras que, en el caso de un término de interacción no significativo, finalmente se seleccionó el modelo más simple que incorporaba solo los efectos principales con fines inferenciales. Se estableció un nivel alfa de 0,05 para todos los procedimientos estadísticos de prueba de hipótesis.
3 Resultados
3.1 Observaciones clínicas y parámetros de funcionamiento
Se detectó la ausencia de diferencias significativas entre los grupos en cuanto al peso corporal para todas las comparaciones y el ADWG para cada parte y el período total de estudio. El grupo C presentó el menor ADWG numérico y el mayor FCR para todo el período de estudio. Por el contrario, los animales del grupo D mejoraron significativamente los valores de FCR en la segunda parte del estudio (es decir, entre los 21 y los 42 días de edad) en comparación con el grupo B. La evaluación clínica de los animales sugirió la ausencia de alteraciones conductuales, diarrea, prolapso rectal o signos de anorexia durante el transcurso del estudio, aunque hubo edema variable de los genitales externos en los grupos B, C y D, que recibieron alimento contaminado con o sin MMDA. Los resultados de los parámetros de calidad de funcionamiento se presentan en el Cuadro 2.
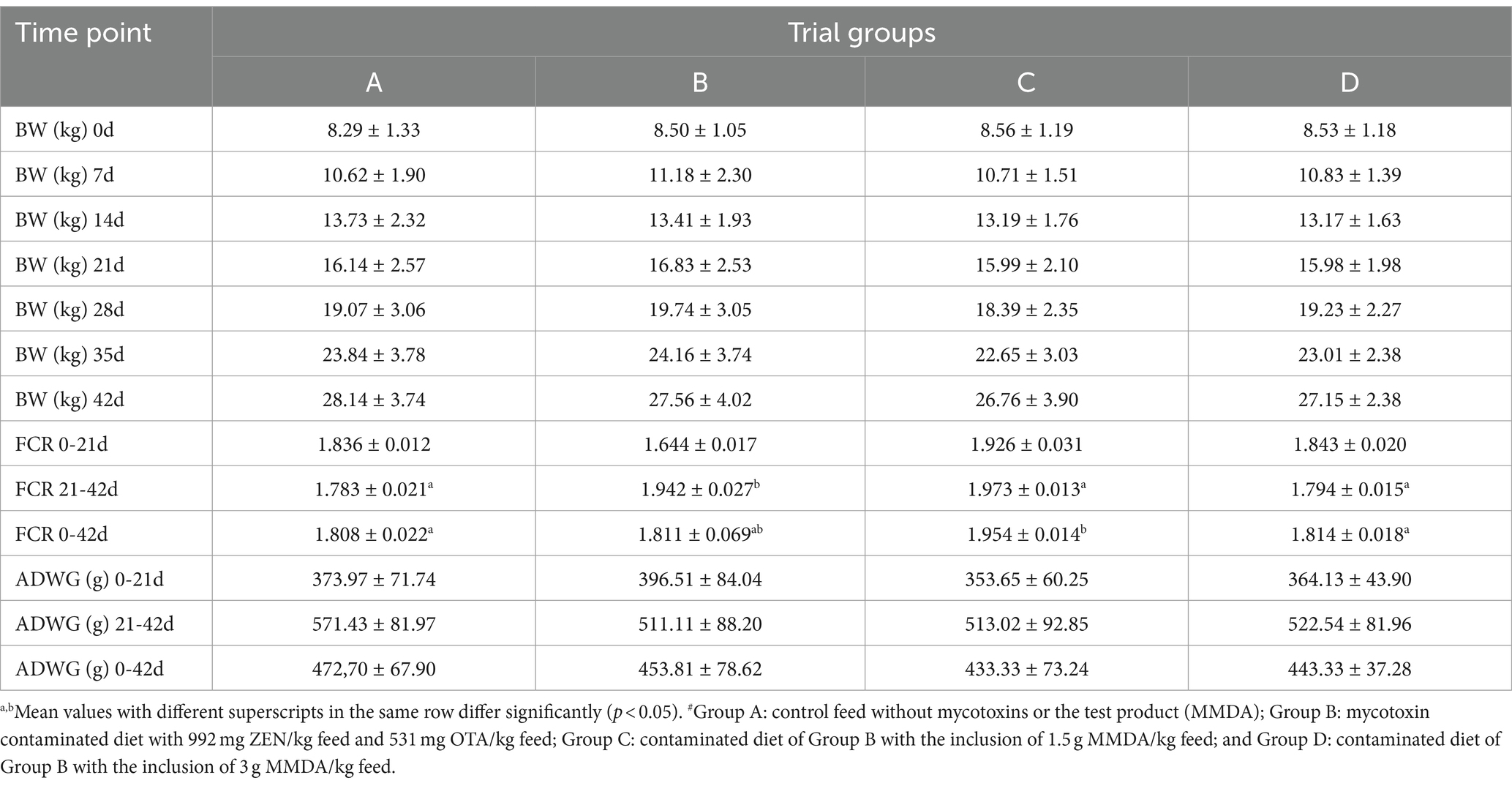 Tabla 2. Parámetros de rendimiento de los grupos de ensayo en cada momento del estudio (media ± DE). #
Tabla 2. Parámetros de rendimiento de los grupos de ensayo en cada momento del estudio (media ± DE). #
3.2 Parámetros hematológicos y bioquímicos
Los resultados de los análisis hematológicos (Tabla 3) no sugirieron ninguna desviación significativa de los límites normales. Sin embargo, en cinco parámetros específicos (HCT, HGB, LYM, MONO y MPV), se presentaron efectos generales significativos, sin interacción tratamiento con tiempo X, en las comparaciones entre los grupos A y C (HCT, HGB y MPV) o B y C (LYM y MONO). Los valores medios en el grupo C se redujeron numéricamente para todos estos parámetros en comparación con los grupos A y B.
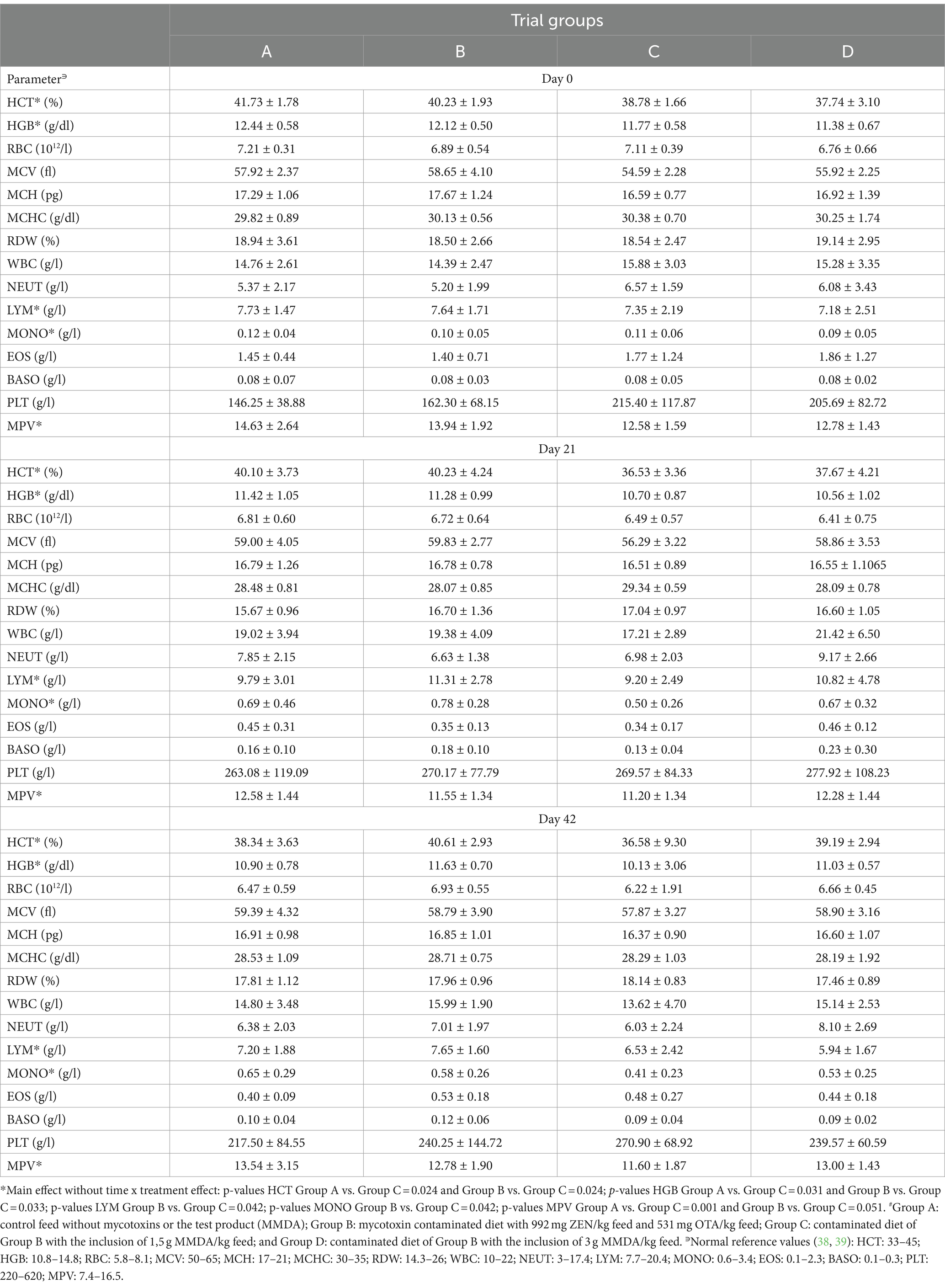 Tabla 3. Los resultados de los parámetros hematológicos en todos los grupos de ensayo durante el estudio (media ± DE).
Tabla 3. Los resultados de los parámetros hematológicos en todos los grupos de ensayo durante el estudio (media ± DE).
En la Tabla 4 se muestran los resultados de los parámetros bioquímicos séricos para todos los grupos en momentos específicos. En el transcurso del estudio se observaron alteraciones en el valor de la FA debido al crecimiento normal de los animales. Las diferencias significativas entre los grupos en cada punto temporal del estudio se encontraban dentro del rango de los límites normales (p. ej., CRE en todos los puntos temporales de muestreo) o muy cerca de los niveles mínimos o máximos limítrofes (p. ej., albúminas en los puntos de tiempo 2º y 3º de muestreo).
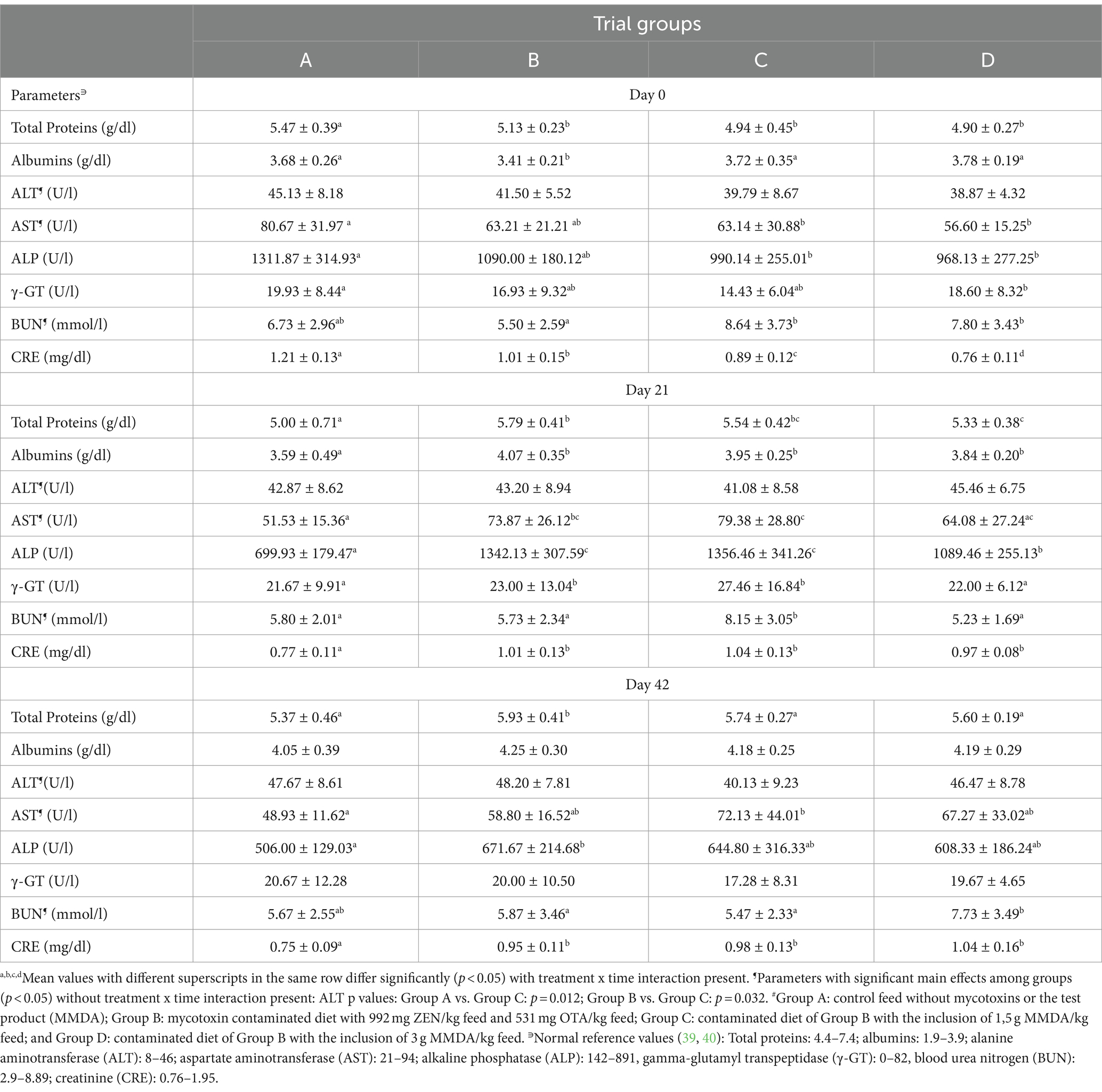 Tabla 4. Parámetros bioquímicos séricos en todos los grupos de ensayo y momentos de muestreo (media ± DE). #
Tabla 4. Parámetros bioquímicos séricos en todos los grupos de ensayo y momentos de muestreo (media ± DE). #
3.3 Residuos tisulares
El análisis de residuos demostró valores reducidos de OTA, ZEN y metabolitos en el hígado y los riñones de los animales que recibieron MMDA. Los resultados se presentan en la Tabla 5 e incluyen comparaciones entre los grupos B, C y D, ya que los valores medios del grupo A para todas las toxinas y metabolitos estaban por debajo de LOQ. Además, los resultados de ZAN, α- y β- ZΑL y ΟΤα fueron < LOQ en todas las muestras de todos los grupos de ensayo analizados.
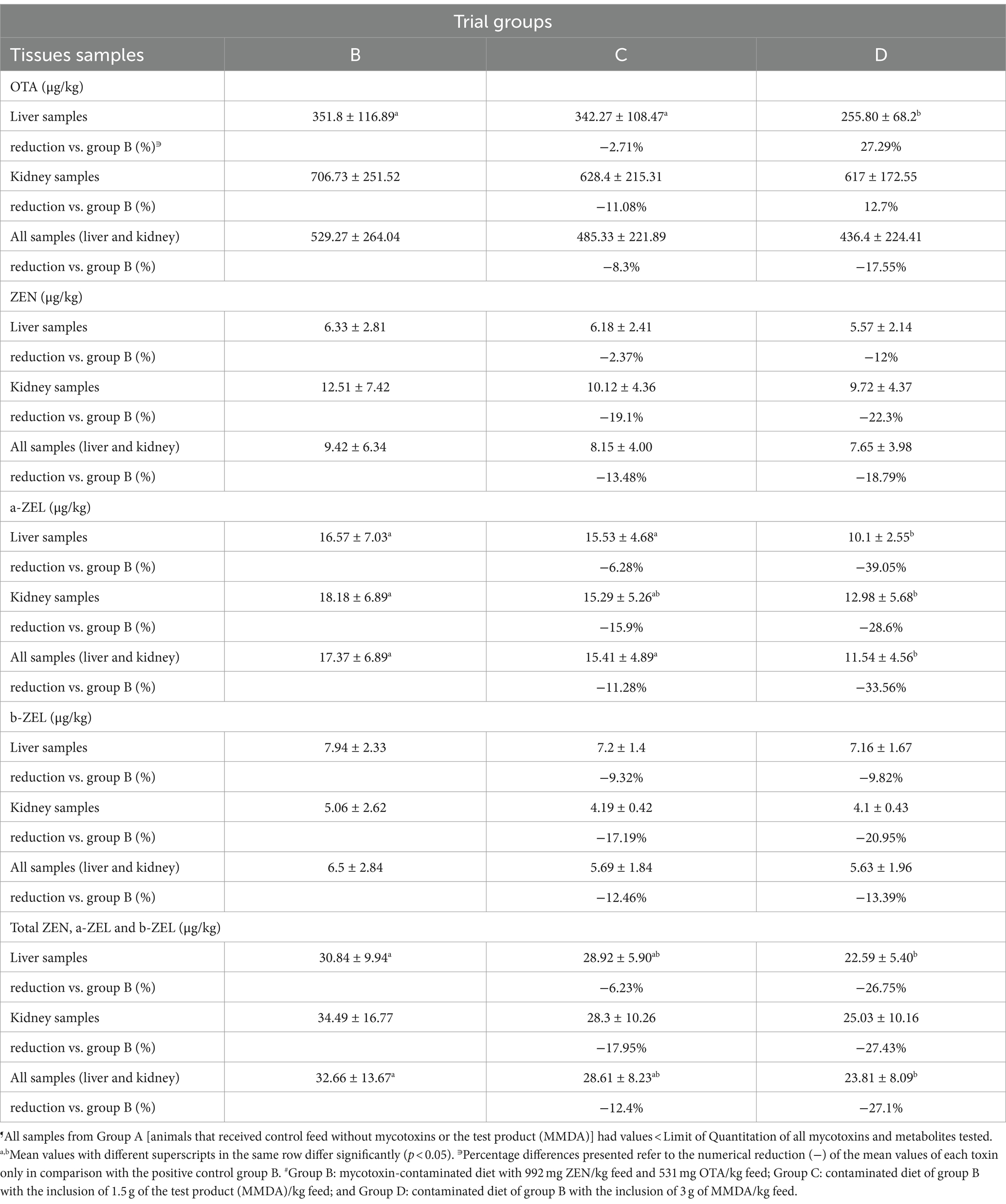 Tabla 5. Residuos de ZEN, OTA, α-ZEL y β-ZEL en las muestras de hígado y riñón de los grupos B, C y D al final del ensayo (media ± DE). ¶
Tabla 5. Residuos de ZEN, OTA, α-ZEL y β-ZEL en las muestras de hígado y riñón de los grupos B, C y D al final del ensayo (media ± DE). ¶
En el grupo D, se reportó una reducción significativa de los valores medios (reducción del 27,29%) de los residuos de OTA en las muestras de hígado en comparación con el grupo B. Los valores medios de los residuos de ZEN (forma parental) y β-ZEL no se alteraron significativamente. Sin embargo, el α-ZEL, el metabolito ZEN predominante en los cerdos, se redujo significativamente en las muestras de hígado del grupo D en comparación con el grupo B. Una reducción similar se observó en el grupo D cuando se compararon los residuos totales de ese metabolito en muestras de hígado y riñón combinadas. En comparación con el grupo B se observó una reducción superior al 26% de los valores medios combinados de ZEN y residuos de metabolitos en muestras de hígado y riñón en comparación con el grupo B (reducción del 26,75% en las muestras de hígado, 27,43% en las muestras de riñón y 27,1% en ambos tejidos del grupo D). Sin embargo, se pudo notificar una reducción numérica de todos los valores medios de las micotoxinas parentales y los residuos de metabolitos detectados en el grupo C, que recibió el nivel de dosis más bajo de MMDA.
4 Discusión
Los resultados de nuestro estudio proporcionan evidencia de la capacidad de la MMDA a nivel de 3 g/kg de alimento para reducir la adsorción, el metabolismo y la deposición tisular de ZEN y OTA en cerdos destetados que recibieron alimento con niveles significativos de contaminación de ZEN y OTA durante un período de tiempo de 42 días. La reducción de los residuos tisulares de ZEN, metabolitos y OTA en el grupo de ensayo D y la mejora de los valores de FCR en la segunda mitad del estudio respaldan la capacidad antes mencionada de la MMDA en cerdos bajo exposición combinada a ZEN y OTA in vivo.
Los hallazgos en la literatura respectiva sobre los efectos de la exposición combinada in vivo a ZEN y OTA en cerdos son escasos. Lusky et al. (41) introdujeron una combinación de piensos contaminados (100 μg de OTA y 250 μg de ZEN/kg de pienso, respectivamente) a cerdos de 50-60 kg durante 90 días e informaron de que el metabolismo o la excreción de OTA se ve influenciado por la administración simultánea de ZEN. Además, se destacó el efecto insignificante de la exposición combinada al peso corporal final de los animales, como también se observó en nuestros resultados. En otros esfuerzos de investigación con el uso de concentraciones similares a las de ZEN y OTA de nuestro estudio, pero con la administración única, no combinada, de cada micotoxina, se demostró que después de alimentar a las cerdas jóvenes destetadas con 1,04 mg de ZEN/kg de alimento durante 35 días (42) o después de la ingestión de alimento contaminado con 500 μg OTA/kg durante 15 días en los productores (14), se presentó una ausencia similar de alteraciones significativas del peso corporal final. Sin embargo, nuestros resultados mostraron diferencias numéricas en la ganancia de peso corporal desde el punto medio hasta el final del estudio. Un aumento aproximado del peso corporal medio durante la segunda parte del estudio (21-42 días) estuvo presente en todos los grupos de ensayo y alcanzó los 12 kg en el grupo control, mientras que el aumento del peso corporal para el mismo período de tiempo en el grupo B fue de 10,73 kg, en el grupo C fue de 10,77 kg y en el grupo D fue de 11,17 kg. La mejora numérica de 440 g de peso corporal medio en el grupo D en comparación con el grupo B podría asociarse con la incorporación de MMDA en la alimentación del grupo D, lo que respalda un resultado global positivo y productivo. Por otro lado, la mejora de los valores de FCR del grupo D en la segunda parte del estudio (21-42 días de estudio) en comparación con el grupo B también podría ser una indicación de un efecto positivo de la MMDA en el rendimiento de los animales del grupo D.
La ZEN experimenta una absorción rápida y extensa de hasta el 80-85% en los cerdos, y partes significativas de su ruta metabólica se llevan a cabo predominantemente en el hígado y el intestino, mientras que la toxina original y sus metabolitos se eliminan relativamente lentamente de los tejidos por la circulación enterohepática (4, 5, 43). Por lo tanto, el hígado es el principal órgano de distribución de ZEN (6), lo que explica las diferencias en los niveles medios de hallazgos de residuos entre las muestras de hígado y riñón en nuestro estudio. La hidroxilación de ZEN a α-ZEL en microsomas hepáticos de cerdo se considera un proceso de activación, ya que la potencia estrogénica del α-ZEL es significativamente mayor que la toxina original en cerdos debido a su mayor afinidad por los receptores de estrógenos, mientras que el β-ZEL representa un metabolito con actividad estrogénica reducida (43). Nuestros hallazgos sobre la distribución de ZEN y los niveles de metabolitos en el tejido hepático concuerdan con los de Zöllner et al. (44), quienes informaron de un predominio de α-ZEL y, en menor medida, de β-ZEL y ZEN en muestras de hígado después de alimentar a los productores con avena contaminada con ZEN. Se demostró una relación de 2,5:1 en el nivel de α-:β-ZEL en las muestras hepáticas de ese estudio. Nuestros hallazgos mostraron una relación α-:β-ZEL bastante comparable de 2,09 en el grupo B y 2,16 en el grupo C, pero solo 1,4 en el grupo D debido a los valores significativamente reducidos de residuos de α-ZEL. Tales hallazgos proporcionan una clara evidencia de una reducción de la captación de ZEN y del metabolismo hacia el α-ZEL. La reducción del metabolito específico en el grupo D fue la mayor en el presente estudio, alcanzando aproximadamente el 39,05% en comparación con el grupo B.
Los hallazgos sobre los residuos de OTA a mayores concentraciones en los riñones que en el hígado en nuestro estudio concuerdan con un estudio previo (41), que informó que se observan mayores residuos de OTA en los riñones después de la ingestión combinada de ZEN y OTA por los cerdos en lugar de la introducción de OTA sola en el alimento. El hígado es el tejido con mayores residuos de OTA después de los riñones cuando se produce la ingestión combinada de alimento ZEN y OTA en los cerdos. La reducción de los residuos de OTA en aquellos reservorios significativos de la toxina estuvo presente en nuestro estudio, siendo estadísticamente significativa en las muestras hepáticas del grupo D, apoyando un efecto mitigante de la MMDA al nivel de dosis utilizado en ese grupo.
Los estudios con la ingestión de concentraciones de ZEN mayores de 1,22 mg ZEN/kg de alimento durante 28 días (31) o 1,3 mg ZEN/kg de alimento (45) durante 24 días informaron un aumento significativo en los parámetros bioquímicos (valores BUN, CRE, AST, ALT y γ-GT), lo que sugiere un posible daño hepático y renal, que se deterioró con la adición de vitamina C o un adsorbente de arcilla de montmorillonita. Nuestros hallazgos después de la ingestión de niveles más bajos de ZEN junto con OTA que los estudios mencionados anteriormente no pueden respaldar una disfunción hepática y renal grave, ya que todos los parámetros probados estaban dentro o cerca de los límites normales. Por otro lado, nuestros resultados al día 21 del estudio demuestran una reducción significativa de la FA y una reducción numérica del parámetro al final del estudio en el grupo D en comparación con el grupo B, apoyando así un posible efecto protector hepático de la MMDA después de 3 semanas de consumo continuo de alimento contaminado. Además, los valores medios de proteínas totales y albúminas en el mismo momento en los grupos B, C y D fueron mayores que en el grupo control, lo que contrasta con los hallazgos in vitro de Abid-Essefi et al. (46) sobre la capacidad de ZEN para inhibir la síntesis de proteínas en células Vero y Caco-2, pero proporciona un terreno para la discusión sobre la posible mejora de la eficiencia de la conversión de proteínas inducida por los efectos metabólicos de ZEN como se sugiere por Su et al. (31).
Aparte de las alteraciones de los parámetros bioquímicos antes mencionadas, Jiang et al. (45) apoyaron un efecto de 1,3 mg ZEN/kg de alimento sobre los valores medios de PLT y HGB de los cerdos destetados. Nuestros hallazgos presentan una ausencia de efecto sobre los valores de PLT, mientras que un efecto principal (sin interacción tiempo x tratamiento) de las toxinas sobre los valores de HGB se detectó en el grupo C en comparación con los grupos A y B. Sin embargo, en nuestro estudio no se puede respaldar un efecto hematotóxico significativo después de la exposición combinada a ZEN y OTA a través de los piensos. Las diferencias en los hallazgos entre los estudios probablemente estén relacionadas con las interacciones entre las dos toxinas utilizadas en nuestro estudio en lugar de una sola administración de ZEN. Además, las alteraciones observadas en los niveles de HCT y HGB en el estudio mencionado se discutieron como transitorias y reversibles después de 14 días de ingesta continua de micotoxinas, lo que apoya una explicación del principal efecto observado sobre el HCT y el HGB en nuestro estudio, a pesar de que todos los valores medios estaban dentro del rango normal.
La importancia de considerar los efectos mixtos de la contaminación por múltiples micotoxinas en la salud y la productividad de los cerdos es innegable. Como se informó anteriormente, los agentes desintoxicantes de micotoxinas que contienen más de un componente para aliviar los efectos tóxicos de las micotoxinas han demostrado más beneficios en comparación con aquellos con componentes individuales (22). El MMDA en el presente estudio, como una combinación de múltiples agentes desintoxicantes de micotoxinas, se ha informado previamente como capaz de reducir el resultado negativo de la exposición combinada a ZEN y T2 en cerdos destetados (27). Se demostró que el MMDA tenía una afinidad dosis-dependiente por la ZEN y, en menor medida, por la toxina T2, proporcionando un mayor efecto al nivel de inclusión de 3 g/kg de alimento. De manera similar, en el presente estudio, se demuestra una afinidad tanto con ZEN como con OTA al mismo nivel de concentración de 3 g/kg de alimento.
Los resultados de la inclusión de MMDA en el pienso se basan en los efectos combinados de sus ingredientes. El efecto combinado de la capacidad de adsorción de la zeolita modificada (Clinoptilolita) y los efectos de desintoxicación de la pared celular de Bacillus subtilis, Bacillus licheniformis, Saccharomyces cerevisiae y silimarina podrían sugerirse como las principales causas de la reducción de la biodisponibilidad de ZEN y OTA y la deposición de tejidos observada en nuestro estudio. Los materiales arcillosos modificados, como la zeolita, han demostrado ser eficaces en las últimas décadas para mejorar los efectos de la ZEN y la OTA, mientras que varias cepas de Bacillus, como B. subtilis, B. licheniformis, B. amyloliquefaciens, B. cereus y B. velezensis, también se han sugerido como agentes biológicos significativos de desintoxicación para la ZEN y la OTA (20, 21). El proceso de desintoxicación biológica incluye la adsorción de la micotoxina en las paredes de las células microbianas o su degradación por las secretasas microbianas. La capacidad de adsorción de la gran mayoría de las cepas de Bacillus spp. es de menor importancia cuando se compara con sus efectos de degradación debido a las secretasas (21). Por otro lado, se ha descrito la capacidad de Saccharomyces cerevisiae para unirse a ZEN a sus paredes celulares, mientras que también se ha destacado la importancia de la cantidad de β-D-glucano en las paredes celulares de S. cerevisiae sobre la capacidad de unión a micotoxinas y una correlación entre el área superficial de la pared celular y la capacidad de eliminación de ZEN y OTA (47, 48). La silimarina es un agente protector del hígado que es capaz de reducir los efectos negativos de la AFB1 en el rendimiento de los pollos de engorde (49), mientras que en ratas, la suplementación con silimarina en la dieta a 100, 200 y 500 mg/kg (50) protegió de la hepatotoxicidad inducida por ZEN y la toxicidad reproductiva. Esta última mejora se atribuyó a la mejora observada de la capacidad antioxidante, la regulación de genes relacionados con el metabolismo ZEN, la síntesis de hormonas, la síntesis de proteínas y los transportadores ABC en los tejidos.
5 Observaciones conclusivas
Los resultados del presente estudio in vivo en cerdos destetados con exposición combinada a concentraciones significativas de ZEN y OTA demostraron que el MMDA ensayado a un nivel de dosis de alimento de 3 g/kg puede reducir los residuos de ZEN y sus principales metabolitos y OTA en el hígado y mejorar los valores de FCR después de 21 días de ingestión de dietas contaminadas. Por lo tanto, se puede sugerir que la MMDA debería considerarse como una estrategia de mitigación para abordar los desafíos mixtos de ZEN y OTA en cerdos.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo/material complementario, las consultas adicionales pueden dirigirse al autor o autores correspondientes.
Declaración ética
El estudio en animales fue aprobado por el Comité de Ética de Investigación de la Universidad Aristóteles de Tesalónica. El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales. Se obtuvo el consentimiento informado por escrito del propietario de la granja de origen de los animales de ensayo.
Contribuciones de los autores
PT: Conceptualización, Curación de datos, Investigación, Metodología, Redacción – borrador original, Redacción – revisión y edición. JR: Conceptualización, Recursos, Escritura – borrador original, Escritura – revisión y edición. DF: Investigación, Metodología, Redacción – revisión y edición. NM: Curación de datos, Análisis formal, Redacción – borrador original, Redacción – revisión y edición. NN: Investigación, Escritura – Revisión y Edición. HF: Investigación, Recursos, Redacción – borrador original, Escritura – revisión y edición. ZP: Investigación, Metodología, Redacción – revisión y edición. MV: Adquisición de fondos, supervisión, redacción, revisión y edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. El estudio fue financiado por Patent Co (Misicevo, Serbia) a través del Comité de Investigación de la Universidad Aristóteles de Tesalónica (Proyecto n.º 72078).
Reconocimientos
Los autores desean agradecer la importante ayuda del personal de laboratorio de los laboratorios Petros Androulakis y asociados (Thermi, Grecia) por sus valiosos esfuerzos en el análisis de micotoxinas. Además, la importante ayuda del personal del Laboratorio de Nutrición y del Laboratorio de Diagnóstico de la Facultad de Medicina Veterinaria de la AUTH es bien reconocida por los autores.
Conflicto de intereses
JR, HF y MV fueron empleados por Patent Co (Misicevo, Serbia).
El resto de los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un potencial conflicto de intereses.
El/los autor/es declararon, en el momento de la presentación, ser miembro del consejo editorial de Frontiers. Esto no tuvo ningún impacto en el proceso de revisión por pares ni en la decisión final.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Kępińska-Pacelik, J, y Biel, W. Riesgo alimentario de micotoxinas para humanos y animales. Toxinas (Basilea). (2021) 13:822. doi: 10.3390/toxinas13110822
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Gruber-Dorninger, C, Jenkins, T y Schatzmayr, G. Ocurrencia global de micotoxinas en piensos: una encuesta de diez años. Toxinas (Basilea). (2019) 11:375. DOI: 10.3390/toxinas11070375
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Comisión de las Comunidades Europeas. Recomendación de la Comisión, de 17 de agosto de 2006, relativa a la presencia de deoxinivalenol, zearalenona, ocratoxina a, T-2 y HT-2 y fumonisinas en los productos destinados a la alimentación animal. Fuera de J Eur Union. (2006) 229:7–9.
4. Dänicke, S, y Winkler, J. Revisión invitada: diagnóstico de la exposición a zearalenona (ZEN) de animales de granja y transferencia de sus residuos a tejidos comestibles (arrastre). Toxicol químico alimentario. (2015) 84:225–49. doi: 10.1016/j.fct.2015.08.009
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Liu, J y Applegate, T. Zearalenona (ZEN) en ganado y aves de corral: dosis, toxicocinética, toxicidad y estrogenicidad. Toxinas (Basilea). (2020) 12:377. DOI: 10.3390/toxinas12060377
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Rai, A, Das, M y Tripathi, A. Aparición y toxicidad de una micotoxina de fusarium, zearalenona. Crit Rev Food Sci Nutr. (2019) 60:2710–29. doi: 10.1080/10408398.2019.1655388
7. Klarić, MS, Rašić, D, y Peraica, M. Efectos nocivos de las combinaciones de micotoxinas que involucran ocratoxina a. Toxinas (Basilea). (2013) 5:1965–87. doi: 10.3390/toxinas5111965
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Battacone, G, Nudda, A, y Pulina, G. Efectos de la ocratoxina a en la producción ganadera. Toxinas (Basilea). (2010) 2:1796–824. doi: 10.3390/toxinas2071796
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Kőszegi, T, y Poór, M. Ocratoxina a: interacciones moleculares, mecanismos de toxicidad y prevención a nivel molecular. Toxinas (Basilea). (2016) 8:111. doi: 10.3390/toxinas8040111
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Heussner, AH, y Bingle, LE. Toxicidad comparativa de la ocratoxina: una revisión de los datos disponibles. Toxinas (Basilea). (2015) 7:4253–82. doi: 10.3390/toxins7104253
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Ding, L, Han, M, Wang, X y Guo, Y. Ocratoxina a: descripción general de los métodos de prevención, eliminación y desintoxicación. Toxinas (Basilea). (2023) 15:565. DOI: 10.3390/toxinas15090565
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Pierron, A, Alassane-Kpembi, I, y Oswald, IP. Impacto de las micotoxinas en la respuesta inmune y consecuencias para la salud de los cerdos. Anim Nutr. (2016) 2:63–8. doi: 10.1016/j.aninu.2016.03.001
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Comisión técnica de contaminantes de la cadena alimentaria de la EFSA (CONTAM). Evaluación del riesgo de las aflatoxinas en los alimentos. EFSA J. (2020) 18:e06040. doi: 10.2903/j.efsa.2020.6040
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Altafini, A, Armorini, S, Zaghini, A, Sardi, L, y Roncada, P. Distribución tisular de la ocratoxina a en cerdos después de la administración de dietas contaminadas de dos niveles. Micotoxina Mundial J. (2017) 10:263–72. doi: 10.3920/WMJ2016.2152
15. Lippoldl, CC, Stothers, SC, Frohlich, AA, Boila, RJ y Marquardt, RR. Efectos de la alimentación periódica de dietas que contienen ocratoxina a sobre el rendimiento y la química clínica de cerdos de 15 a 50 kg de peso corporal. Can J Anim Sci. (1992) 72:135–46. doi: 10.4141/CJAs92-015
16. Marin, DE, Pistol, GC, Gras, MA, Palade, ML y Taranu, I. Efecto comparativo de la ocratoxina a sobre los parámetros de inflamación y estrés oxidativo en el intestino y el riñón de lechones. Regul Toxicol Pharmacol. (2017) 89:224–31. doi: 10.1016/j.yrtph.2017.07.031
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Li, Y, Zhang, B, He, X, Cheng, WH, Xu, W, Luo, Y, et al. Análisis de los efectos individuales y combinados de la ocratoxina a y la zearalenona sobre las células HepG2 y KK-1 con modelos matemáticos. Toxinas (Basilea). (2014) 6:1177–92. doi: 10.3390/toxins6041177
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Wang, HW, Wang, JQ, Zheng, BQ, Li, SL, Zhang, YD, Li, FD, et al. Citotoxicidad inducida por ocratoxina a, zearalenona y α-zearalenol: efectos del tratamiento individual y combinado. Toxicol químico alimentario. (2014) 71:217–24. doi: 10.1016/j.fct.2014.05.032
19. Zheng, N, Gao, YN, Liu, J, Wang, HW y Wang, JQ. Evaluación individual y combinada de la citotoxicidad de zearalenona con ocratoxina a o α-zearalenol mediante diseño factorial completo. Biotecnología de la ciencia de los alimentos. (2017) 27:251–9. doi: 10.1007/s10068-017-0197-9
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Vila-Donat, P, Marín, S, Sanchis, V, y Ramos, AJ. Una revisión de los agentes adsorbentes de micotoxinas, con énfasis en su capacidad de unión múltiple, para la descontaminación de alimentos para animales. Toxicol químico alimentario. (2018) 114:246–59. doi: 10.1016/j.fct.2018.02.044
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Wang, N, Wu, W, Pan, J y Long, M. Estrategias de desintoxicación para la zearalenona usando microorganismos: una revisión. Microorganismos. (2019) 7:208. doi: 10.3390/microorganismos7070208
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Holanda, DM y Kim, SW. Ocurrencia de micotoxinas, toxicidad y agentes desintoxicantes en la producción porcina con énfasis en Deoxinivalenol. Toxinas (Basilea). (2021) 13:171. doi: 10.3390/toxinas13020171
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. Liu, M, Zhao, L, Gong, G, Zhang, L, Shi, L, Dai, J, et al. Revisión invitada: estrategias de remediación para el control de micotoxinas en piensos. J Anim Sci Biotechnol. (2022) 13:19. doi: 10.1186/s40104-021-00661-4
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Gari, J y Abdella, R. Degradación de zearalenona por microorganismos y enzimas. PeerJ. (2023) 11:e15808. doi: 10.7717/peerj.15808
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Alassane-Kpembi, I, Pinton, P, Hupé, JF, Neves, M, Lippi, Y, Combes, S, et al. Saccharomyces cerevisiae Boulardii reduce la alteración del transcriptoma intestinal inducida por Deoxinivalenol. Toxinas (Basilea). (2018) 10:199. doi: 10.3390/toxinas10050199
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Qin, X, Cao, M, Lai, F, Yang, F, Ge, W, Zhang, X, et al. Estrés oxidativo inducido por zearalenona en células de la granulosa porcina y su rescate por curcumina in vitro. PLoS Uno. (2015) 10:e0127551. doi: 10.1371/journal.pone.0127551
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Raj, J, Vasiljević, M, Tassis, P, Farkaš, H y Männer, K. Eficacia de un agente desintoxicante de micotoxinas multicomponente en la exposición simultánea a zearalenona y micotoxina T-2 en cerdos destetados. Livest Sci. (2020) 242:104295. doi: 10.1016/j.livsci.2020.104295
28. Marín, DE, y Pistola, GC. Efecto del extracto de harina de espino amarillo en el alivio del efecto tóxico de la ocratoxina a y la zearalenona en células mononucleares de sangre periférica porcina. Arch Zootech. (2021) 24:84–92. doi: 10.2478/azibna-2021-0007
29. Chen, S, Yang, S, Wang, M, Chen, J, Huang, S, Wei, Z, et al. La curcumina inhibe la apoptosis inducida por zearalenona y el estrés oxidativo en las células de Leydig a través de la modulación de la vía de señalización PTEN/Nrf2/Bip. Toxicol químico alimentario. (2020) 141:111385. doi: 10.1016/j.fct.2020.111385
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Saleemi, MK, Raza, A, Khatoon, A, Zubair, M, Yongping, X, Murtaza, B, et al. Efectos tóxicos de la aflatoxina B1 sobre parámetros hematobioquímicos e histopatológicos de machos juveniles de leghorn blanco y su mejora con vitamina E y Moringa oleifera. Pak Vet J. (2023) 43:405–11. doi: 10.29261/pakvetj/2023.053
31. Su, Y, Sun, Y, Ju, D, Chang, S, Shi, B y Shan, A. El efecto de desintoxicación de la vitamina C sobre la toxicidad de la zearalenona en lechones. Ecotoxicol Environ Saf. (2018) 158:284–92. doi: 10.1016/j.ecoenv.2018.04.046
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. Guerre, P. Exposición mundial a micotoxinas en formulaciones de piensos para cerdos y aves de corral. Toxinas (Basilea). (2016) 8:350. DOI: 10.3390/toxinas8120350
Resumen de PubMed | Texto completo de Crossref | Google Académico
33. Smith, MC, Madec, S, Coton, E y Hymery, N. Co-ocurrencia natural de micotoxinas en alimentos y piensos y sus efectos toxicológicos combinados in vitro. Toxinas (Basilea). (2016) 8:94. doi: 10.3390/toxinas8040094
Resumen de PubMed | Texto completo de Crossref | Google Académico
34. Alassane-Kpembi, I, Schatzmayr, G, Taranu, I, Marin, D, Puel, O y Oswald, IP. Cocontaminación por micotoxinas: aspectos metodológicos y relevancia biológica de los estudios combinados de toxicidad. Crit Rev Food Sci Nutr. (2017) 57:3489–507. doi: 10.1080/10408398.2016.1140632
Resumen de PubMed | Texto completo de Crossref | Google Académico
35. Unión Europea. Reglamento (CE) n.º 152/2009 de la Comisión, de 27 de enero de 2009, por el que se establecen los métodos de muestreo y análisis para el control oficial de los piensos. Fuera de J Eur Union. (2009) 5:1–130.
36. Ren, Y, Zhang, Y, Shao, S, Cai, Z, Feng, L, Pan, H, et al. Determinación simultánea de contaminantes de micotoxinas multicomponentes en alimentos y piensos mediante cromatografía líquida de ultra alta resolución y espectrometría de masas en tándem. J Cromatogr A. (2007) 1143:48–64. doi: 10.1016/j.chroma.2006.12.064
Resumen de PubMed | Texto completo de Crossref | Google Académico
37. Equipo central de R. Un lenguaje y un entorno para la computación estadística. Viena, Austria: R Core Team (2013).
38. Moritz, A, Kraft, W, y Dürr, UM. Klinische Labordiagnostik in der Tiermedizin, vol. 7. Nueva York: Stuttgart Aufl Schattauer (2013). 33 págs.
39. Robinson, NA, y Loynachan, AT. Sistemas cardiovascular y hematopoyético En: DJ Taylor, editor. Enfermedades de los cerdos. 11ª ed. Ames, Iowa: Blackwell Publishing (2019). 224.
40. Carr, J, Chen, SP, Connor, JF, Kirkwood, R, y Segales, J. Salud porcina. 1ª ed. Boca Ratón, FL: CRC Press (2018). 240 págs.
41. Lusky, K, Göbel, R, Lusky, K, Tesch, D, y Doberschütz, K. Untersuchungen zur Tiergesundheit, Leistung und zum Rückstandsverhalten beim Schwein bei gleichzeitiger Aufnahme der Mykotoxine Ochratoxin A, Deoxynivalenol, Zearalenon über das Futter im 90-Tage-Test. Micotoxinas Res. (2000) 16:158–61. doi: 10.1007/BF02940026
42. Liu, X, Xu, C, Yang, Z, Yang, W, Huang, L, Wang, S, et al. Efectos de la exposición a zearalenona en la dieta sobre el rendimiento del crecimiento, la disacharidasa del intestino delgado y las actividades antioxidantes de las cerdas jóvenes destetadas. Animales (Basilea). (2020) 10:2157. doi: 10.3390/ani10112157
Resumen de PubMed | Texto completo de Crossref | Google Académico
43. Ropejko, K, y Twarużek, M. Zearalenona y sus metabolitos: descripción general, ocurrencia y toxicidad. Toxinas (Basilea). (2021) 13:35. doi: 10.3390/toxinas13010035
Resumen de PubMed | Texto completo de Crossref | Google Académico
44. Zöllner, P, Jodlbauer, J, Kleinova, M, Kahlbacher, H, Kuhn, T, Hochsteiner, W, et al. Niveles de concentración de zearalenona y sus metabolitos en muestras de orina, tejido muscular e hígado de cerdos alimentados con avena contaminada con micotoxinas. J Agric Food Chem. (2002) 50:2494–501. doi: 10.1021/jf0113631
Resumen de PubMed | Texto completo de Crossref | Google Académico
45. Jiang, SZ, Yang, ZB, Yang, WR, Jing, G, Liu, FX y Chen, CC. Efectos fisiopatológicos de la zearalenona en lechones hembras post-destete con o sin adsorbente de arcilla montmorillonita. Livest Sci. (2010) 131:130–6. doi: 10.1016/J.LIVSCI.2010.02.022
46. Abid-Essefi, S, Ouanes, Z, Hassen, W, Baudrimont, I, Creppy, E y Bacha, H. Citotoxicidad, inhibición de la síntesis de ADN y proteínas y daño oxidativo en células cultivadas expuestas a zearalenona. Toxicol In Vitro. (2004) 18:467–74. doi: 10.1016/j.tiv.2003.12.011
Resumen de PubMed | Texto completo de Crossref | Google Académico
47. Armando, MR, Pizzolitto, RP, Dogi, CA, Cristofolini, A, Merkis, C, Poloni, V, et al. Adsorción de ocratoxina a y zearalenona por cepas potenciales de Saccharomyces cerevisiae probióticas y su relación con el espesor de la pared celular. J Appl Microbiol. (2012) 113:256–64. doi: 10.1111/j.1365-2672.2012.05331.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
48. Yiannikouris, A, Kettunen, H, Apajalahti, J, Pennala, E y Moran, CA. Comparación de las propiedades secuestrantes del extracto de pared celular de levadura y el aluminosilicato de calcio y sodio hidratado en tres modelos in vitro que tienen en cuenta la biodisponibilidad fisiológica animal de la zearalenona. Food Addit Contam Part A Chem Anal Control Expo Risk Assess. (2013) 30:1641–50. doi: 10.1080/19440049.2013.809625
49. Tedesco, D, Steidler, S, Galletti, S, Tameni, M, Sonzogni, O y Ravarotto, L. Eficacia del complejo silimarina-fosfolípidos en la reducción de la toxicidad de la aflatoxina B1 en pollos de engorde. Poult Sci. (2004) 83:1839–43. doi: 10.1093/ps/83.11.1839
Resumen de PubMed | Texto completo de Crossref | Google Académico
50. Gao, X, Xiao, ZH, Liu, M, Zhang, NY, Khalil, MM, Gu, CQ, et al. La suplementación dietética con silimarina alivia la hepatotoxicidad inducida por zearalenona y la toxicidad reproductiva en ratas. J Nutr. (2018) 148:1209–16. doi: 10.1093/jn/nxy114
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: cerdos, destetados, micotoxinas, zearalenona, ocratoxina A, adsorbente, mitigación, residuos
Cita: Tassis P, Raj J, Floros D, Mittas N, Ntarampa N, Farkas H, Polizopoulou Z y Vasilievic M (2024) Eficacia de un agente aglutinante multicomponente contra la exposición combinada a zearalenona y ocratoxina A en cerdos destetados. Frente. Vet. Sci. 11:1357723. doi: 10.3389/fvets.2024.1357723
Recibido: 18 de diciembre de 2023; Aceptado: 09 de febrero de 2024;
Publicado: 06 Marzo 2024.
Editado por:
Nora Mestorino, Universidad Nacional de La Plata, Argentina
Revisado por:
Aisha Khatoon, Universidad de Agricultura, Faisalabad, Pakistán
Pimiao Zheng, Universidad Agrícola de Shandong, China
Derechos de autor © 2024 Tassis, Raj, Floros, Mittas, Ntarampa, Farkas, Polizopoulou y Vasilievic. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Panagiotis tassis, ptassis@vet.auth.gr
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía