Eficacia de la inyección de liposomal-cannabidiol en perros con osteoartritis
Eficacia terapéutica y farmacocinética de la inyección de liposomal-cannabidiol: un estudio clínico piloto en perros con osteoartritis natural
 Yael Shilo-Benjamini1,2*
Yael Shilo-Benjamini1,2*  Eran Lavy2
Eran Lavy2  Nadav Yair2
Nadav Yair2  Joshua Milgram2
Joshua Milgram2  Daniel Zilbersheid1
Daniel Zilbersheid1  Atara Hod1
Atara Hod1  Dinorah Barasch3
Dinorah Barasch3  Wiessam Abu Ahmad4
Wiessam Abu Ahmad4  Ahuva Cern1†
Ahuva Cern1†  Yechezkel Barenholz1†
Yechezkel Barenholz1†- 1Departamento de Bioquímica, Escuela de Medicina Hadassah, Laboratorio de Investigación de Membranas y Liposomas, Universidad Hebrea de Jerusalén, Jerusalén, Israel
- 2Escuela Koret de Medicina Veterinaria, Facultad Robert H. Smith de Agricultura, Alimentación y Medio Ambiente, Universidad Hebrea de Jerusalén, Rehovot, Israel
- 3La Unidad de Espectrometría de Masas, Facultad de Farmacia, Universidad Hebrea de Jerusalén, Jerusalén, Israel
- 4Centro Médico Hadassah, Universidad Hebrea de Jerusalén, Jerusalén, Israel
Introducción: La osteoartritis es una enfermedad común en los perros que resulta en dolor crónico y disminución del bienestar. Los analgésicos comunes, como los antiinflamatorios no esteroideos, pueden no controlar el dolor y pueden producir efectos adversos importantes. Los objetivos del estudio fueron evaluar la farmacocinética, la eficacia terapéutica y la seguridad del liposoma-cannabidiol subcutáneo (CBD) como terapia analgésica adicional en perros que sufren de osteoartritis natural.
Métodos: Seis de estos perros fueron reclutados después de la aprobación ética y el consentimiento del propietario. A los perros se les administró una única inyección subcutánea de 5 mg/kg de liposoma-CBD. Las concentraciones plasmáticas de CBD, análisis de sangre, datos del collar de monitoreo de actividad, cuestionario de bienestar (propietarios) y puntuación del dolor (veterinario) se realizaron al inicio del estudio y se monitorizaron hasta seis semanas después de la intervención. Los datos de horas extras se compararon con el valor inicial mediante efectos mixtos de regresión lineal. El valor p se estableció en 0,05.
Resultados: Se observaron concentraciones plasmáticas de CBD durante 6 semanas; mediana (rango) de la concentración plasmática máxima (C).max) fue 45,2 (17,8–72,5) ng/ml, tiempo hasta C.max fue de 4 (2-14) días y la vida media fue de 12,4 (7,7-42,6) días. La mediana (rango) de la puntuación de actividad del collar aumentó significativamente en las semanas 5–6; de 29 (17–34) a 34 (21–38). Las puntuaciones de las evaluaciones de bienestar y dolor mejoraron significativamente a las 2-3 semanas; de 69 (52–78) a 53,5 (41–68), y de 7,5 (6–8) a 5,5 (5–7), respectivamente. El principal efecto adverso fue una hinchazón local leve durante varios días en 5/6 perros.
Conclusión: Liposomal-CBD administrado por vía subcutánea produjo concentraciones plasmáticas detectables de CBD durante 6 semanas con efectos secundarios mínimos y demostró una reducción del dolor y un mayor bienestar como parte del manejo multimodal del dolor en perros que sufren de osteoartritis. Otros estudios controlados con placebo son de interés.
1. Introducción
La osteoartritis es una de las enfermedades prevalentes en los perros geriátricos, que generalmente resulta en dolor crónico y disminución o pérdida de la función (1-3). El tratamiento conservador de la osteoartritis canina utiliza fármacos antiinflamatorios no esteroideos (AINE) a largo plazo para reducir la inflamación y controlar el dolor (4-7). Sin embargo, los AINE pueden no ser suficientes para controlar el dolor y su uso a largo plazo puede estar asociado con efectos adversos gastrointestinales, hepáticos y renales (7-9).
El cannabidiol (CBD) y el tetrahidrocannabinol (THC) son los principales derivados de la planta Cannabis sativa. Mientras que el THC es altamente psicoactivo y puede provocar signos neurológicos en perros (10, 11), el CBD no tiene actividad psicoactiva y se puede administrar de forma segura en dosis altas o durante largos períodos (10, 12, 13). Se informó que el CBD alivia el dolor crónico en personas (14-16), y recientemente se informó su efectividad en perros con osteoartritis (17-20). La vía de administración recomendada es por vía oral con una frecuencia de dos veces al día (17, 19). En las personas, se considera que la biodisponibilidad del CBD es tan baja como 6% (21). En perros, la biodisponibilidad puede ser mejor, aunque, dependiendo de la formulación y la dosis utilizada, los niveles plasmáticos pueden ser variables entre estudios y dentro de un estudio entre perros individuales (13, 17, 20, 22, 23). Otra preocupación con las preparaciones orales de CBD a base de aceite es la palatabilidad de la preparación, lo que puede disminuir el cumplimiento del tratamiento por parte del perro (24).
Recientemente se informó una vía alternativa inyectable de administración de CBD utilizando liposomas (25). Los liposomas son vesículas hechas de una o más bicapas de fosfolípidos bien caracterizados. Son atractivos para aplicaciones farmacéuticas porque este sistema de administración es biocompatible, biodegradable y no tóxico (26-28). Además, la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) ha aprobado muchos medicamentos liposomales (28). La formulación inyectable de liposomal de CBD de liberación prolongada permite una ruta de administración más conveniente con un mejor cumplimiento de las mascotas y el propietario, y con el potencial de aumentar la biodisponibilidad del CBD (25).
Los objetivos de este estudio piloto fueron evaluar la farmacocinética, la eficacia terapéutica y la seguridad de una única inyección subcutánea de liposomal-CBD utilizando CBD sintético en perros con osteoartritis natural. Nuestra hipótesis era que el CBD se detectará durante varias semanas, habrá una mejora en la actividad de los perros, el nivel de dolor y el bienestar sin mayores efectos adversos.
2. Métodos
2.1. Animales
El estudio fue aprobado por el Comité Institucional de Cuidado y Uso de Animales (IACUC; protocolo de aprobación MD-21-16,661-2), y se obtuvo un consentimiento informado firmado de todos los dueños de perros o tutores legales. Seis perros que sufren de osteoartritis natural al menos en una articulación fueron reclutados para este estudio. Después de un examen ortopédico, la osteoartritis se confirmó radiográficamente, y se realizó un hemograma completo y un panel de bioquímica antes del inicio del estudio. Los criterios de exclusión incluyeron perros menores de 2 años o mayores de 15 años, recomendación del cirujano ortopédico para cualquier cirugía articular, someterse a un procedimiento quirúrgico 3 meses antes de la intervención o sospecha de enfermedad hepática. Por razones éticas, todos los perros continuaron recibiendo analgésicos y suplementos para las articulaciones que fueron recetados antes del reclutamiento.
2.2. Intervención liposomal-CBD
Formulación liposomal-CBD (CBD Liposome Platform Technology; LPT) se obtuvo de Innocan Pharma™ (Israel). De acuerdo con el certificado de análisis del producto, el Liposomal-CBD se preparó bajo estrictas condiciones asépticas. Antes de su uso, las muestras se enviaron a Hy-Labs (Rehovot, Israel), un laboratorio certificado y acreditado por el Ministerio de Salud de Israel y la FDA, para confirmar que la formulación era estéril y estaba por debajo del límite aprobado de endotoxinas. Los resultados de estas pruebas cumplieron con los requisitos de los fármacos administrados extravasculares en personas.
La formulación liposomal-CBD estaba compuesta de CBD sintético (Purisys LLC., Athens, GA, Estados Unidos; no considerado una sustancia controlada) que se cargó a una concentración de 50 mg / ml en liposomas hidrogenados de fosfatidilcolina de soja (HSPC) (Lipoid GmbH, Ludwigshafen, Alemania).
La inyección se realizó entre los hombros, después del corte del cabello y la preparación aséptica de la piel. Liposomal-CBD se inyectó por vía subcutánea a una dosis de 5 mg / kg (0.1 ml / kg) utilizando una aguja de calibre 21 y 1 pulgada en el área de la piel preparada.
2.3. Seguimiento
2.3.1. Farmacocinética
Se recogió un ml de sangre de una vena periférica (cefálica o safena) para análisis farmacocinético a las 2 y 6 h, 1, 2 y 4 días, y semanalmente de 1 a 6 semanas después de la inyección. La sangre se recogió en tubos de ácido etilendiamina tetraacético (EDTA) de 1 ml y se centrifugó para separar el plasma dentro de los 5 minutos posteriores a la recolección. El plasma se congeló inmediatamente a -20 ° C y luego se mantuvo a -80 ° C hasta el análisis. La cuantificación del CBD se realizó utilizando el método de espectrometría de masas UHPLC-tándem (LC-MS / MS), que fue reportado por los autores recientemente, y se puede encontrar en el material suplementario en: https://www.frontiersin.org/articles/10.3389/fvets.2022.892306/full#supplementary-material (25). Los parámetros farmacocinéticos se calcularon durante 6 semanas después de la inyección mediante un análisis no compartimental con Phoenix WinNonlin (Certara™, NJ, Estados Unidos, Versión 6.3).
En 3/6 perros se colocó un catéter intravenoso en la vena cefálica y se dejó en su lugar durante 24-48 h para facilitar el muestreo de sangre.
2.3.2. Evaluación del dolor
El Inventario de Dolor Breve Canino (CBPI) (29, 30) se utilizó como una evaluación del cuestionario del propietario. Brevemente, este cuestionario incluye evaluaciones de dolor (escala 0-40) y función (escala 0-60), sumadas a una escala total de 0-100, donde 0 = perro que funciona normalmente sin dolor, y 100 = perro que no funciona con el peor dolor posible. Además, se realiza una evaluación global de la calidad de vida de la CBPI utilizando una escala descriptiva: mala, regular, buena, muy buena y excelente. Se utilizó una escala analógica visual interactiva del dolor (iVAS) para la evaluación veterinaria con una escala de 0 a 10; 0 = sin dolor, 10 = peor dolor posible. Ambas evaluaciones se completaron al inicio del estudio antes de la inyección y luego una vez a la semana hasta 6 semanas después de la inyección.
2.3.3. Collarín de seguimiento de la actividad y signos vitales
Al menos dos semanas antes de la intervención, un collar de monitoreo de actividad (PetPace, Burlington, MA, Estados Unidos1) (31, 32) se colocó en el cuello de los perros. Los datos se recopilaron del collar durante 2 semanas antes y 6 semanas después de la inyección de liposomal de CBD. Para cada perro, la puntuación semanal media de cuatro parámetros (puntuación de actividad, puntuación de posición, aceleración de calorías y puntuación de sueño) se obtuvo de la plataforma PetPace y se analizó para todos los perros después de la finalización del estudio.
Los parámetros fisiológicos fueron monitorizados durante todo el período de estudio: frecuencia cardíaca (FC) con estetoscopio, frecuencia respiratoria (fR) mediante la observación de excursiones torácicas, temperatura rectal (RT) mediante termómetro digital y presión arterial media mediante un tensiómetro oscilométrico (CASMED 740; CAS Medical Systems Inc., Branford, CT, Estados Unidos) con el manguito colocado sobre el carpo sobre la arteria radial mientras el perro estaba en reclinado esternal. Los parámetros fisiológicos se midieron al inicio y luego a las 2 y 6 h, 1, 2 y 4 días, y semanalmente 1-6 semanas después de la inyección.
2.3.4. Análisis de sangre
Se recogieron muestras de sangre (1–1,5 ml) en tubos con EDTA para un hemograma completo (CSC; Sistema de Hematología ADVIA 2120i, Siemens Healthineers, Erlangen, Alemania; incluida la evaluación de patología clínica de frotis de sangre) y en tubos que contienen un gel separador (CAT Serum Sep Clot Activator, Vacuette, Greiner Bio-One, Kremsmünster, Austria; 2-2.5 mL) para el panel de bioquímica (cobas 6,000, Roche Diagnostics Corporation, Indianapolis, IN, Estados Unidos) al inicio y luego a 1 y 4 semanas después de la intervención. En dos de los perros, se realizaron análisis de sangre adicionales 2 días después de la inyección.®®
2.3.5. Efectos adversos y seguimiento
Durante las 6 semanas posteriores a la inyección, los perros fueron monitoreados de cerca para detectar efectos adversos; en el hospital durante las primeras 6 h después de la inyección, por el veterinario en cada punto de tiempo de la toma de muestras de sangre para PK, y por los propietarios en casa durante las 6 semanas. Después de la terminación del estudio, los dueños de perros fueron contactados por teléfono una vez al mes durante 6 meses más, y luego cada 3-4 meses. Además, se solicitó a los propietarios que informaran al veterinario tratante de cualquier cambio en el estado de salud de su perro.
2.4. Análisis estadístico
No se realizó un análisis de potencia, ya que por razones de seguridad el número de participantes fue limitado a 6 perros por el IACUC. El análisis estadístico se realizó utilizando el software estadístico Stata/SE versión 15.0 (StataCorp, College Station, TX, Estados Unidos). Debido a que el tamaño de la muestra fue pequeño, las estadísticas descriptivas se expresan como mediana (rango como mínimo-máximo). El análisis de los datos se realizó con medidas repetidas de efectos mixtos con intercepción aleatoria a nivel del perro. Todos los valores en los puntos temporales posteriores a la intervención se compararon con el valor inicial. Además, la asociación entre las concentraciones plasmáticas de CBD y las puntuaciones de CBPI e iVAS se probó mediante regresión lineal de efectos mixtos. Un valor de p <0,05 fue considerado significativo.
3. Resultados
3.1. Animales
Tres hembras esterilizadas y tres perros machos (1 castrado, 2 intactos) con una edad media de 12 (9-14) años y un peso corporal de 34 (26-58) kg fueron reclutados para el estudio y completaron el período de monitoreo de 6 semanas. Las señales de los perros, las articulaciones afectadas, los suplementos osteoartríticos y los analgésicos orales de rutina se presentan en la Tabla 1.
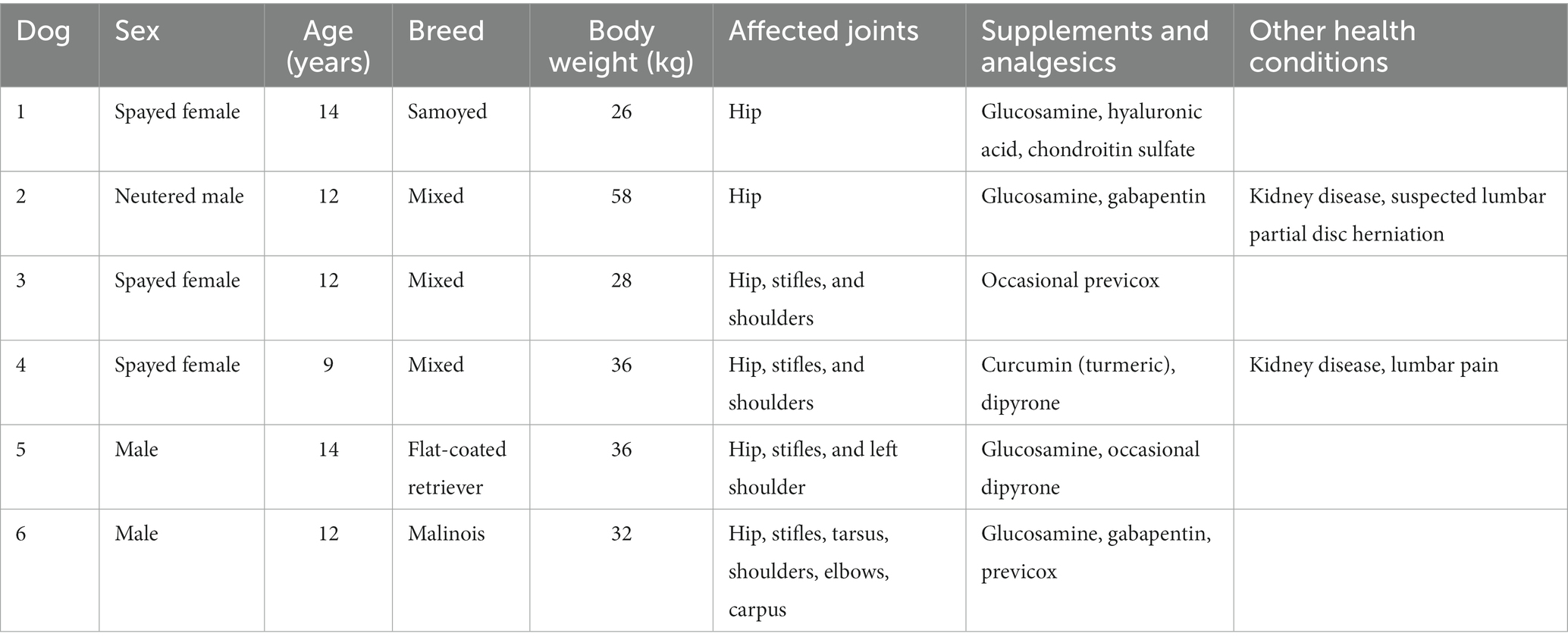 Tabla 1. Datos de 6 perros que sufren de osteoartritis a los que se les administró una sola inyección subcutánea de liposoma-cannabidiol (CBD) además de tratamientos analgésicos de rutina.
Tabla 1. Datos de 6 perros que sufren de osteoartritis a los que se les administró una sola inyección subcutánea de liposoma-cannabidiol (CBD) además de tratamientos analgésicos de rutina.
3.2. Datos farmacocinéticos
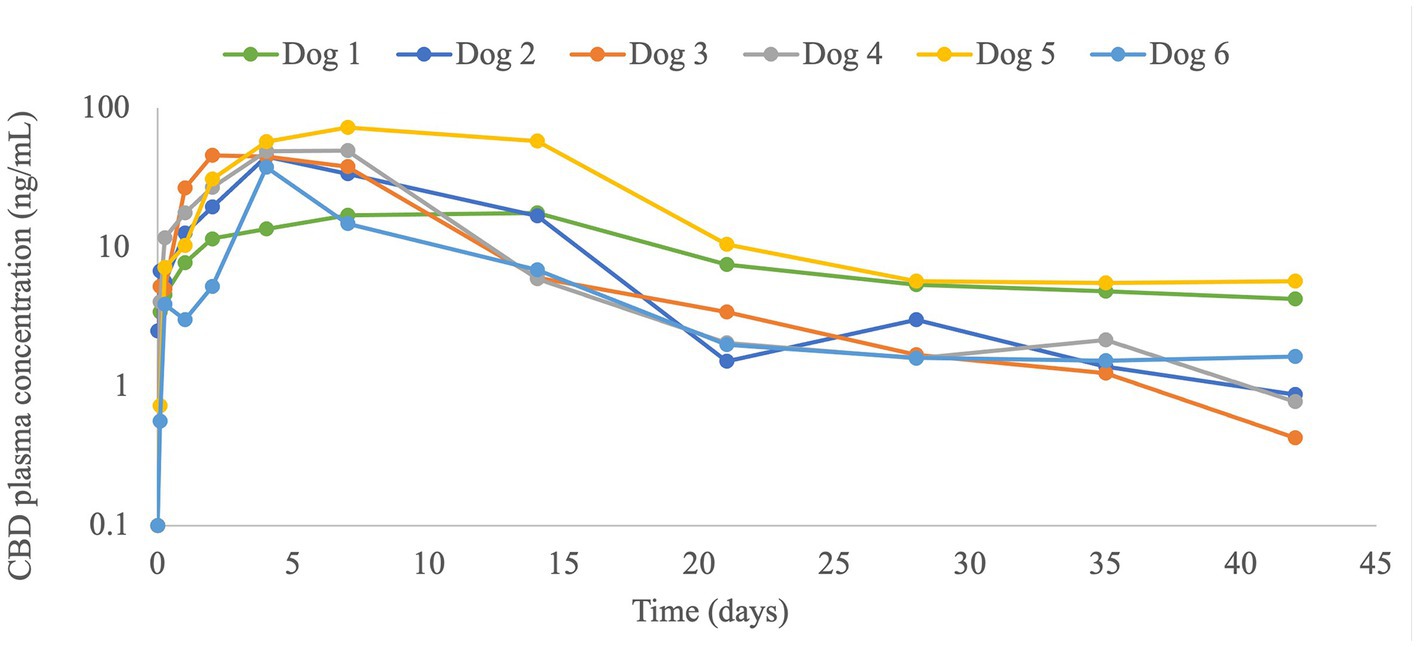
Se observaron concentraciones plasmáticas de CBD durante todo el período de monitoreo de 6 semanas, incluso en el punto de tiempo de 6 semanas (Figura 1; Tabla 2). El perfil plasmático obtenido mostró un aumento gradual del CBD hasta la concentración plasmática máxima de CBD (C.max), y luego una disminución a partir de la mayoría de los perros (4/6) una semana después de la inyección. En el perro número 1 el aumento y la disminución fueron muy graduales, y en el perro número 6 la disminución comenzó antes, después de 2 días desde la inyección (Figura 1). Los datos farmacocinéticos calculados y las concentraciones plasmáticas de CBD a las 3 y 6 semanas después de la inyección se presentan en la Tabla 2.
Figura 1. Concentraciones plasmáticas de cannabidiol (CBD) (ng / ml) en 6 perros con osteoartritis antes y hasta 42 días (6 semanas) después de una sola inyección subcutánea de liposoma-CBD a 5 mg / kg.
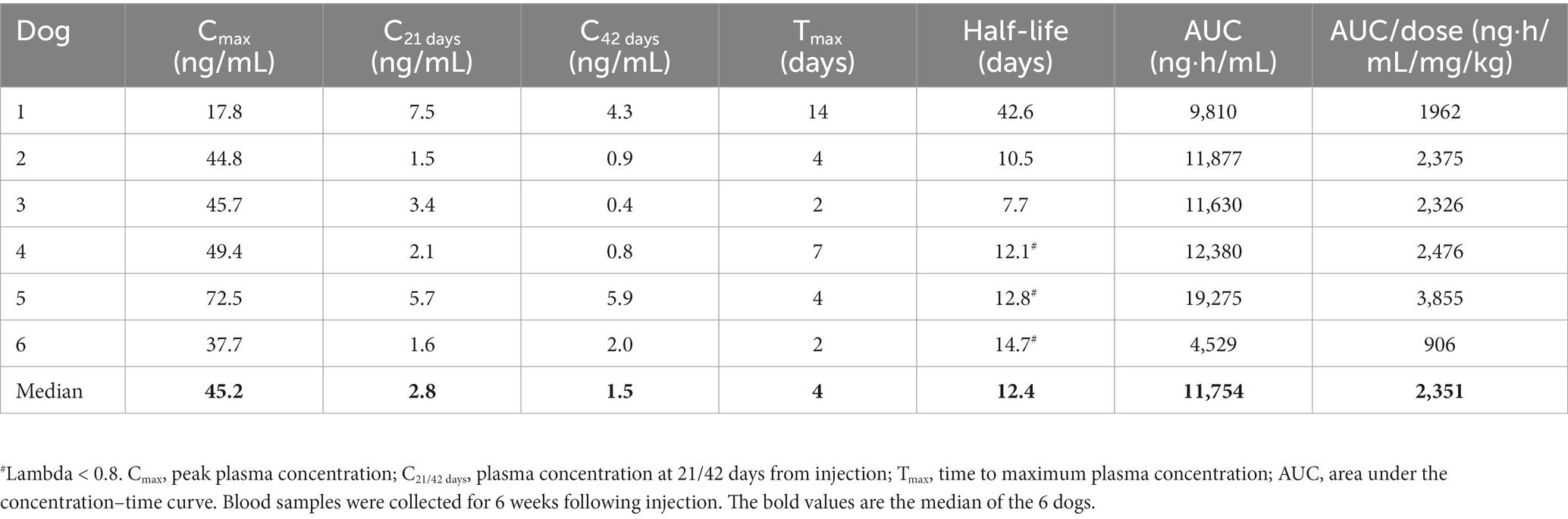 Tabla 2. Datos farmacocinéticos de cannabidiol plasmático (CBD) de seis perros con osteoartritis después de una sola inyección subcutánea de 5 mg / kg de liposomal de CBD.
Tabla 2. Datos farmacocinéticos de cannabidiol plasmático (CBD) de seis perros con osteoartritis después de una sola inyección subcutánea de 5 mg / kg de liposomal de CBD.
3.3. Puntuaciones de dolor
Los perros habían mejorado significativamente las puntuaciones de dolor de CBPI en comparación con el valor basal en las semanas 2-3 (p = 0,011 y 0,031, respectivamente), mejoraron las puntuaciones de función de CBPI en las semanas 2 y 6 (p = 0,004 y 0,026, respectivamente), mejoraron las puntuaciones totales de CBPI en las semanas 2-3 (p = 0,001 y 0,028, respectivamente) y mejoraron la mejoría límite en la semana 6 (p = 0,052), y mejoraron la calidad de vida de CBPI en las semanas 2-3 (p = 0,046 para ambas semanas; Tabla 3). Las puntuaciones de dolor iVAS mejoraron significativamente a las 1–3 semanas (p < 0,001) y a las 4 semanas después de la inyección (p = 0,034; Tabla 3). La mejoría en las puntuaciones de dolor se asoció significativamente con el perfil farmacocinético obtenido; CBPI total en las semanas 1-6 (p < 0,001 a p = 0,039, coeficientes −0,249 a −4,399) e iVAS en las semanas 1 (p = 0,008, coeficiente −0,018), 2 y 3 (p < 0,001, coeficientes −0,09 y −0,326, respectivamente).
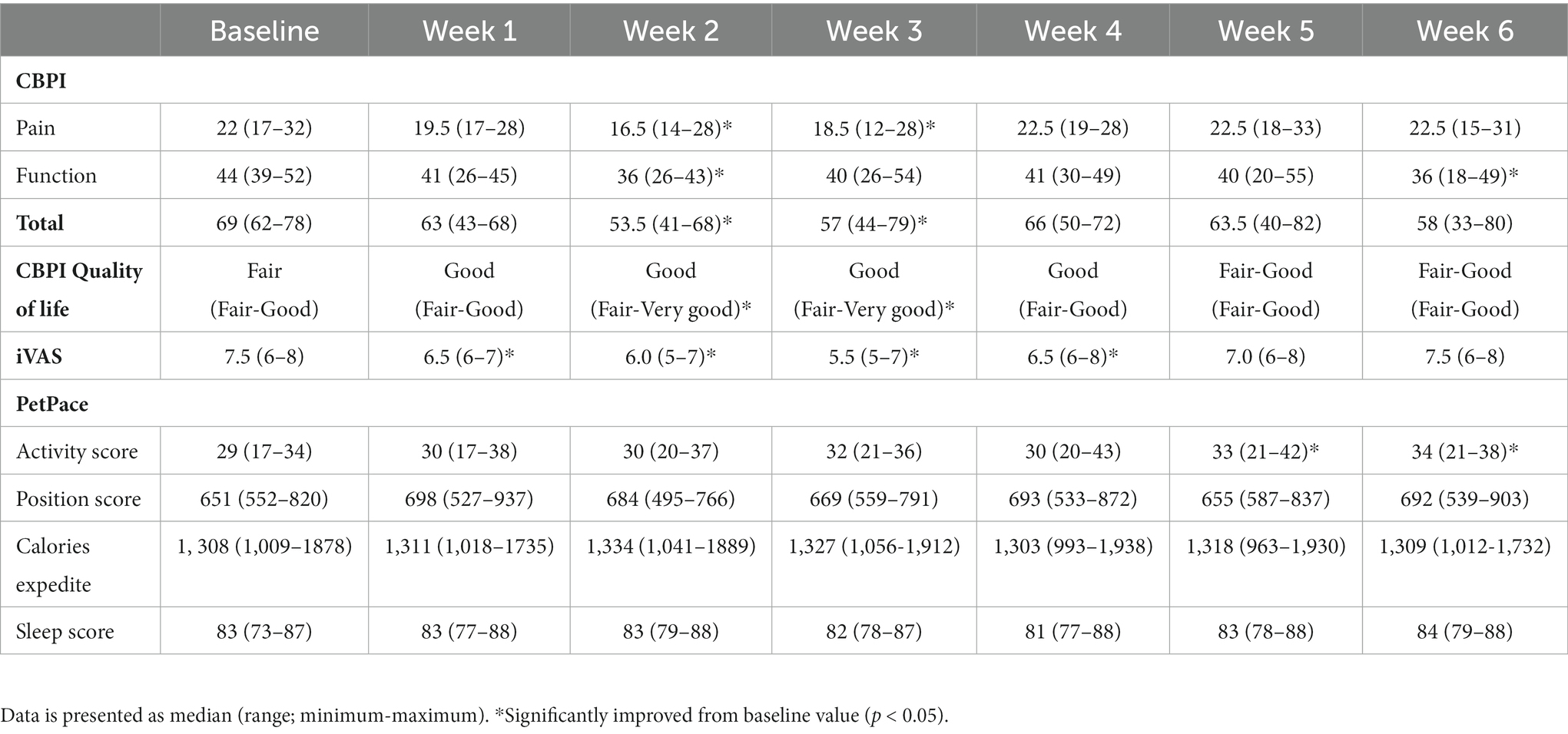 Tabla 3. Puntuación del inventario breve de dolor canino (CBPI; escala de dolor 0-40, escala de funciones 0-60, escala total 0-100; 0 = sin dolor / función normal, 100 = peor dolor / ninguna función, y calidad de vida general: pobre, regular, buena, muy buena y excelente) por propietarios, escala analógica visual interactiva (iVAS; escala 0-10; 0 = sin dolor, 10 = peor dolor) por un anestesiólogo, y puntuaciones de collar de monitoreo de actividad (PetPace) de seis perros con osteoartritis, antes y seis semanas después de la inyección subcutánea de liposoma-cannabidiol (CBD).
Tabla 3. Puntuación del inventario breve de dolor canino (CBPI; escala de dolor 0-40, escala de funciones 0-60, escala total 0-100; 0 = sin dolor / función normal, 100 = peor dolor / ninguna función, y calidad de vida general: pobre, regular, buena, muy buena y excelente) por propietarios, escala analógica visual interactiva (iVAS; escala 0-10; 0 = sin dolor, 10 = peor dolor) por un anestesiólogo, y puntuaciones de collar de monitoreo de actividad (PetPace) de seis perros con osteoartritis, antes y seis semanas después de la inyección subcutánea de liposoma-cannabidiol (CBD).
3.4. Collarín de seguimiento de la actividad y parámetros fisiológicos
Las puntuaciones de actividad del collar aumentaron significativamente en las semanas 5-6 (p = 0,012 y 0,027, respectivamente). Las puntuaciones de posición, la aceleración de calorías y las puntuaciones de sueño no cambiaron significativamente con respecto a los registros iniciales (Tabla 3).
El HR disminuyó significativamente desde el inicio a las 6 h (p = 0,010), 4 días (p = 0,010), 4 semanas (p = 0,022) y 6 semanas desde la inyección (p = 0,017). fR disminuyó significativamente desde el inicio a las 2 h (p = 0,018), 2 y 4 días (p = 0,005–0,008) y 5–6 semanas (p = 0,003–0,008). La PAM disminuyó significativamente desde el inicio a los 4 días de la inyección (p = 0,048), y no se observaron diferencias en la RT durante todo el período de estudio (Tabla 4).
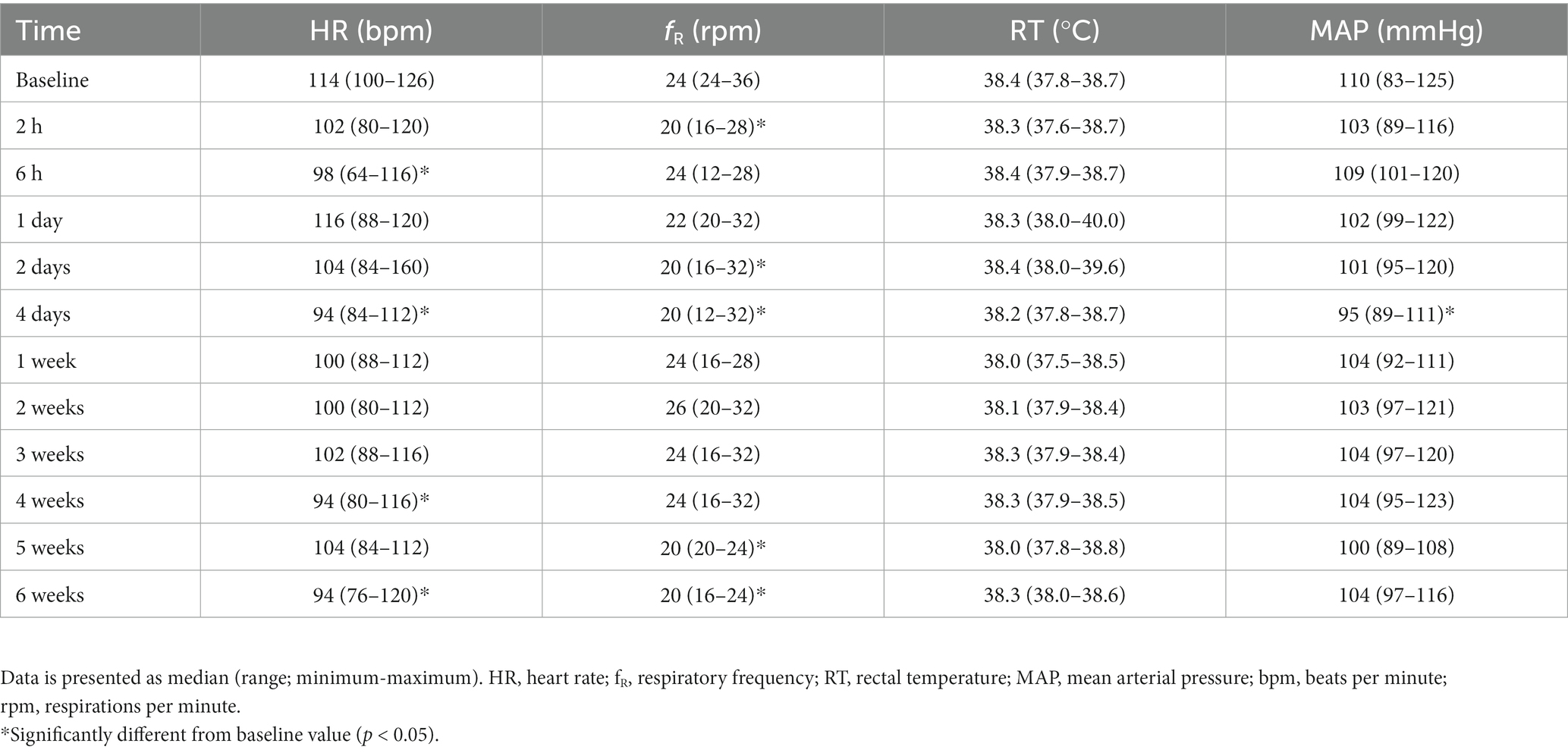 Tabla 4. Parámetros fisiológicos de seis perros con osteoartritis, antes y seis semanas después de la inyección subcutánea de liposoma-cannabidiol (CBD).
Tabla 4. Parámetros fisiológicos de seis perros con osteoartritis, antes y seis semanas después de la inyección subcutánea de liposoma-cannabidiol (CBD).
3.5. Análisis de sangre
La mayoría de los valores medios de hematología y bioquímica estuvieron dentro de los rangos de referencia en todos los tiempos de medición, aunque algunos parámetros cambiaron significativamente desde el inicio. Los glóbulos blancos (leucocitos), los neutrófilos y los monocitos aumentaron significativamente desde el inicio a los 2 días de la inyección (p < 0,001). Estos aumentos se atribuyeron principalmente a un perro que desarrolló flebitis alrededor del catéter intravenoso. A 1 semana después de la inyección, los leucocitos aumentaron en 3/6 perros (en el rango de referencia) y disminuyeron en 1/6 perros sin cambios significativos en general. Los eosinófilos aumentaron significativamente a las 4 semanas (p = 0,009). A la 1 semana, se observó una disminución significativa en hematocrito (p = 0,046), volumen de células empaquetadas (PCV; p = 0,006), volumen corpuscular medio (MCV; p = 0,017) y reticulocitos (p = 0,031). Las plaquetas disminuyeron significativamente a los 2 días (p = 0,046) y aumentaron significativamente a 1 semana (p < 0,001), y el plaquetecrito aumentó significativamente a 1 semana (p = 0,007; Tabla 5).
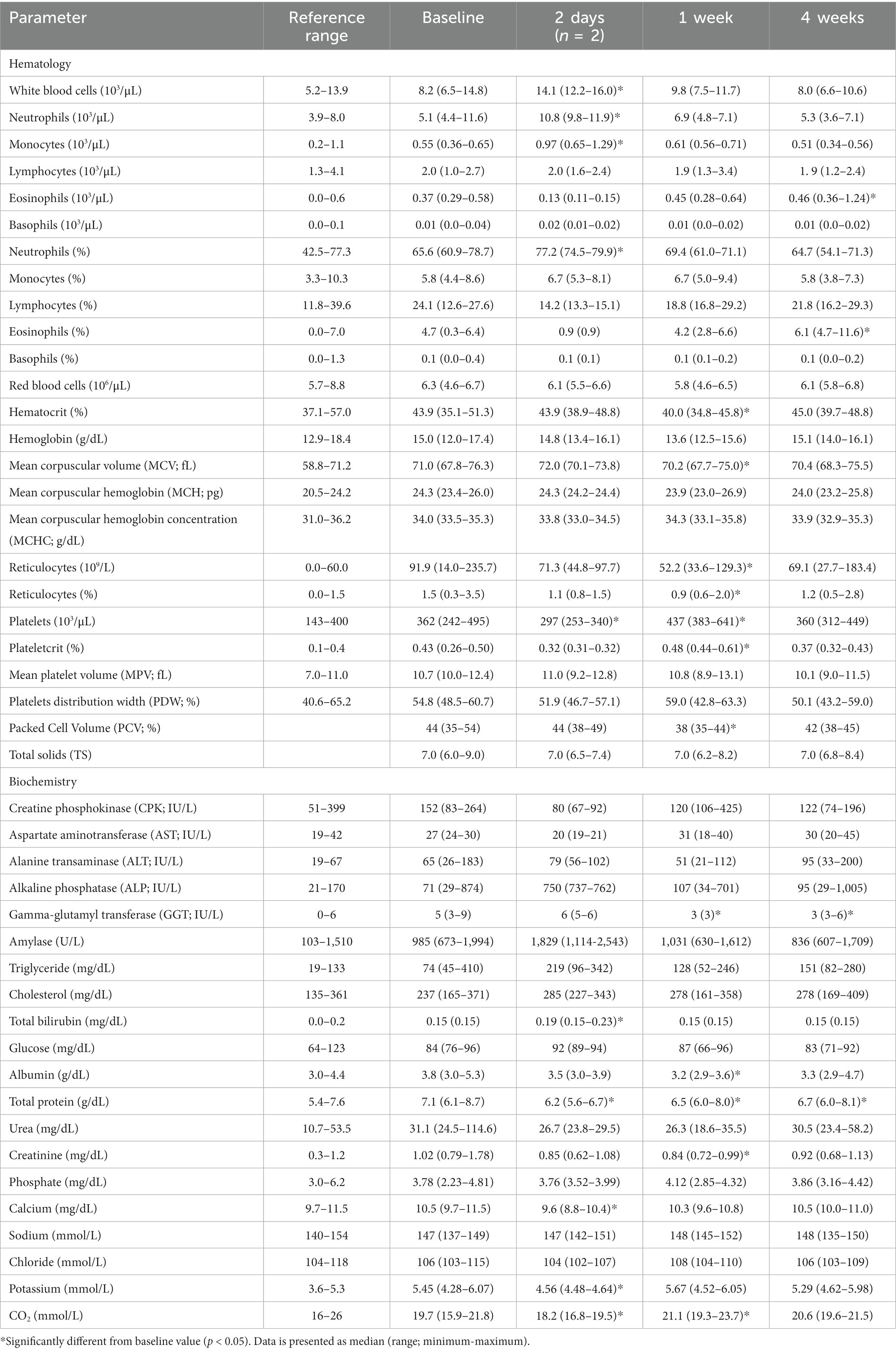 Tabla 5. Conteo sanguíneo completo y panel de bioquímica realizado en seis perros con osteoartritis, antes y después de una sola inyección subcutánea de liposoma-cannabidiol (CBD) a 5 mg / kg.
Tabla 5. Conteo sanguíneo completo y panel de bioquímica realizado en seis perros con osteoartritis, antes y después de una sola inyección subcutánea de liposoma-cannabidiol (CBD) a 5 mg / kg.
La evaluación de la patología clínica de los frotis de sangre reveló neutrófilos maduros no tóxicos al inicio del estudio en todos los perros. Un número leve de neutrófilos se convirtieron en bandas con apariencia tóxica leve en 3 perros diferentes: a los 2 días (1 perro que desarrolló flebitis asociada con el posicionamiento del catéter intravenoso), a la semana (1 perro) y a las 1 semanas (4 perro). Se observó un número leve de monocitos reactivos al inicio del estudio en 1/5 perros, que estuvieron ausentes en la evaluación de 6 semanas en 4 perros y se mantuvieron en uno de estos perros. Se observó un número leve-moderado de linfocitos granulares atípicos al inicio y durante todo el período de monitoreo en 4/5 perros. Aunque ninguno de los perros estaba anémico, se observó policromasia ocasional en 6/5 perros al inicio del estudio y en las siguientes evaluaciones. El perro que no mostró policromasia tuvo poiquilocitosis leve al inicio del estudio, luego esferocitosis leve y poiquilocitosis leve a la semana 6, que no se observaron en la evaluación de 1 semanas.
La fosfatasa alcalina (ALP) no cambió significativamente durante el estudio, sin embargo, un perro (perro número 5) mostró un alto valor de ALP al inicio del estudio, que aumentó aún más en la medición de 4 semanas. Otro perro (perro número 4) tuvo elevación de ALP solo en la medición de 2 días, durante un evento de FC elevado. La gamma-glutamiltransferasa (GGT) disminuyó significativamente desde el inicio a las 1 y 4 semanas de la inyección (p = 0,002 y 0,015, respectivamente). La bilirrubina total aumentó significativamente a los 2 días (p < 0,001). La albúmina disminuyó significativamente a 1 semana (p = 0,008). La proteína total disminuyó significativamente en todos los puntos temporales (p = 0,001, p < 0,01 y p = 0,004, respectivamente). La creatinina disminuyó significativamente desde el inicio a las 1 y 4 semanas de la inyección (p = 0,004 y 0,044, respectivamente). Cuando el perro 2, que tenía una enfermedad renal, fue excluido del análisis de creatinina, la creatinina todavía disminuyó significativamente a 1 semana (p = 0,001). El calcio y el potasio disminuyeron significativamente a los 2 días (p < 0,001 y p = 0,010, respectivamente). CO2 disminuyó significativamente a los 2 días (p < 0,001) y aumentó significativamente a 1 semana (p = 0,010; Tabla 5).
3.6. Efectos adversos y seguimiento
Se observó respuesta local (hinchazón leve y no dolorosa en el lugar de la inyección) en 5/6 perros. La hinchazón se resolvió (es decir, se absorbió completamente) dentro de los 3-6 días posteriores a la aparición sin ningún tratamiento (Tabla 6). Un perro tuvo un aumento de la FC a 140-160 latidos por minuto a partir de aproximadamente 36 h después de la inyección, que se resolvió sin tratamiento un día después. Un ecocardiograma reveló taquicardia sinusal. Otro perro desarrolló fiebre, que se atribuyó a flebitis alrededor de un catéter intravenoso que se dejó durante 24 h para la toma de muestras de sangre. Se retiró el catéter, se iniciaron antibióticos orales y la fiebre se resolvió en 12 h.
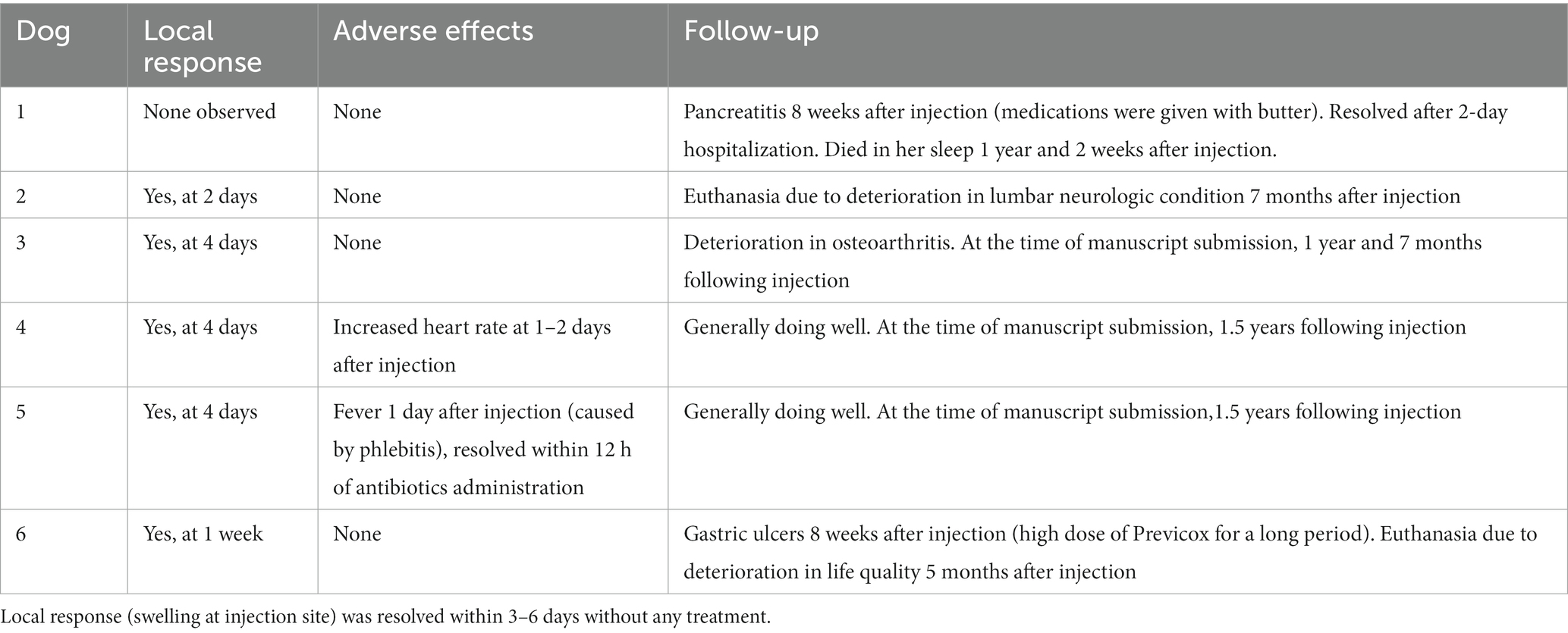 Tabla 6. Efectos adversos y seguimiento de seis perros con osteoartritis después de una única inyección subcutánea de liposoma-cannabidiol (CBD) a 5 mg/kg.
Tabla 6. Efectos adversos y seguimiento de seis perros con osteoartritis después de una única inyección subcutánea de liposoma-cannabidiol (CBD) a 5 mg/kg.
En el momento de la presentación del manuscrito, uno de los perros murió naturalmente más de un año después de la inyección a la edad de 15 años, y dos perros fueron sacrificados 5 y 7 meses después de la inyección debido al deterioro de su condición de enfermedad (Tabla 6).
4. Discusión
4.1. Farmacocinética
Los resultados del presente estudio sugieren que una sola administración subcutánea de liposoma-CBD proporciona una concentración plasmática de CBD y analgesia a largo plazo (es decir, varias semanas). Los sistemas de administración liposomal proporcionan una liberación lenta de varios fármacos encapsulados (26, 28). Además, muchas formulaciones a base de liposomas mejoran la ventana terapéutica de los medicamentos y, por lo tanto, reducen su toxicidad (33). El uso de liposomas como sistema de administración de CBD en el presente estudio, de hecho, proporcionó una liberación lenta del fármaco durante el período probado, como se demostró por el tiempo que tardó en alcanzar C.max (t.max; 2-14 días) y por la vida media larga (7,7-42,6 días) (Tabla 2). En comparación con varias formulaciones orales que contienen CBD que administran una dosis única de 2 mg / kg en perros, la mediana / media C.max, T.max, y la vida media fueron 102,3 ng/mL, 1,5 h y 4,2 h, respectivamente (n = 4) (17); 213 ng/mL, 2,1 h y 2,5 h, respectivamente (n = 6) (11); 301 ng/mL, 1,4 h y 1,0 h, respectivamente, (22); 226 ng/mL, 2.5 h y 3.8 h, respectivamente (34).
En las personas, la biodisponibilidad del CBD es muy baja (6%-10%) y depende de las condiciones de ayuno (21). En los perros, la biodisponibilidad se considera mejor que en las personas, y se informa que es del 13% al 70% dependiendo de la formulación utilizada (23, 35, 36). Se cree que el metabolismo hepático de primer paso es la razón principal de la baja biodisponibilidad del CBD oral (21, 37). Por lo tanto, las vías alternativas de entrega, como la absorción de la mucosa que pasarían por alto el hígado son de interés. Un estudio reciente investigó la farmacocinética de una sola formulación de CBD puro de 1 mg / kg en aceite a través de la administración transmucosa oral (OTM) u oral (6 perros por vía). Media C.max y T.max para OTM y vía oral fueron 200,3 ng/mL y 1,9 h, y 206,8 ng/mL y 2,2 h, respectivamente. La vida media fue de 2,6 h con ambas rutas (37). Curiosamente, no hubo diferencias en los parámetros farmacocinéticos entre las vías de administración, lo que sugiere que la absorción a través de la mucosa oral no fue óptima o que la mayor parte del fármaco se ingirió realmente (37). La administración de CBD también se investigó a través de la mucosa nasal (dosis media de 1,7 mg / kg) o intrarrectal utilizando supositorios (dosis media de 8,3 mg / kg) en comparación con la vía oral (dosis media de 8,3 mg / kg). Después de la administración rectal, los niveles de CBD estaban por debajo del límite de cuantificación. Media C.max y T.max para las vías nasal y oral fueron 28 ng/mL y 0,5 h, y 217 ng/mL y 3,5 h, respectivamente. La vida media de eliminación terminal fue de 7,0 y 15,7 h, respectivamente (38). Según estos estudios, el CBD administrado a través de sitios de la mucosa fue inferior en comparación con la administración oral en perros, aunque se requieren más estudios que utilicen diferentes formulaciones de CBD para la conclusión. Esto se ve reforzado por un estudio en perros con osteoartritis natural que informa una mejora significativa después de OTM CBD en comparación con los perros de control (19).
La administración de Sativex (a base de fitocannabinoides) en aerosol sublingual se investigó en beagles jóvenes sanos, utilizando una dosis aproximada de 0,5 mg / kg. Después de una dosis única, media C®.max y T.max de CBD fueron 10,5 ng/mL y 2 h, respectivamente (39). Cabe señalar que se tomaron muestras de sangre de la vena yugular en el estudio Sativex, lo que puede haber dado lugar a una sobreestimación sesgada de las concentraciones plasmáticas de CBD, porque se informó que el sitio de muestreo yugular afectaba la concentración de fármacos administrados por vía de la mucosa oral (40).®
La administración transdérmica también se investigó en dos estudios; (i) un estudio administró crema transdérmica con infusión de CBD aplicada a las pinnas, que se comparó con dos formulaciones orales (aceite con infusión de CBD o perlas de aceite microencapsuladas). Estas formulaciones se probaron a 5 mg/kg dos veces al día en beagles jóvenes y sanos (n = 10 por tratamiento). Después de una dosis única, media C.max y la vida media alcanzó 625,3 ng/mL y 3,3 h (aceite infundido), 346,3 ng/mL y 1,6 h (perlas de aceite), y 74,3 ng/mL (crema transdérmica), respectivamente. No se pudo determinar la vida media de la crema transdérmica con infusión de CBD debido a la falta de fase de eliminación (23). (ii) El segundo estudio administró un extracto transdérmico de Cannabis sativa bajo en THC de 4 mg / kg frotado en las pinnas dos veces al día durante dos semanas en seis beagles jóvenes sanos. Media C.max fue de 12,8 y 10,6 ng/ml después de 7 y 14 días de administración. Los autores concluyeron que la absorción de CBD a través de la vía transdérmica era generalmente pobre (41).
En el presente estudio C.max fue menor en comparación con las concentraciones plasmáticas/séricas de CBD en estado estacionario después de 2-6 semanas de administración oral de CBD en perros; 60–125 ng/mL (34), 80–160 ng/mL (23), 5–860 (mediana 311) ng/mL (20) y 53–201 ng/mL (12). Esta diferencia en C.max podría ser el efecto de la dosis relativamente más baja utilizada con la formulación liposomal de liberación prolongada, que se basó en la dosis informada probada por vía intravenosa (36). En retrospectiva, se podría haber probado una dosis más alta. Por otro lado, en muchos estudios de CBD oral en perros, C.max entre los individuos fue extremadamente variable, con algunos perros alcanzando solo el 10 de las concentraciones plasmáticas de CBD de otros perros en el mismo estudio utilizando la misma formulación (20, 24, 35, 37). La reducción de la variabilidad entre los perros en el presente estudio sugiere una absorción más uniforme del fármaco en los perros. El CBD inyectado por vía subcutánea tiene el beneficio de la absorción directa y evita la alta proporción de extracción de CBD por el hígado en comparación con la vía oral (21). Además, al evaluar formulaciones de liberación prolongada, el área bajo la curva (AUC) es la herramienta de evaluación más importante, ya que presenta la exposición total al fármaco a lo largo del tiempo (28). Cuando se normaliza a la dosis, el AUC después de la administración de liposomal-CBD en el presente estudio (2.351 ng·h/mL/mg/kg; Tabla 2) fue mayor en comparación con la administración oral de CBD a largo plazo/estado estacionario; 241–480 ng·h/ml/mg/kg después de 28 días, una vez al día 1–12 mg/kg (12), 346–588 ng·h/ml/mg/kg después del extracto de hierbas de cannabis que contiene 1:20 THC:CBD a 2–10 mg/kg (11), o 328–423 ng·h/ml/mg/kg después de 2 mg/kg dos veces al día durante 2 semanas de tres formas diferentes de extracto de cáñamo (34). Por lo tanto, sugiere que la exposición al CBD utilizando la formulación liposomal es superior a la vía oral.
4.2. Dolor y analgesia
Se sabe que el CBD tiene efectos antiinflamatorios y antinociceptivos (42-44) y se describió en los últimos años como un analgésico eficaz en perros que sufren de osteoartritis (17-20). La eficacia terapéutica reportada en el presente estudio es similar a los estudios previos con reducción del dolor y función mejorada en todos los perros. El sistema endocannabinoide desempeña un papel importante en las vías nociceptivas aferentes y eferentes (45). Se considera que el CBD exhibe sus propiedades antiinflamatorias y analgesia a través del receptor cannabinoide 2 (CB2) como un agonista inverso y como un inhibidor de la recaptación del endocannabinoide anandamida (15, 45, 46). Además, se informó que el CBD interactúa con muchos otros receptores y canales que están involucrados en la nocicepción, como la activación de los receptores de serotonina (5-HT1A), activación de canales de potencial receptor transitorio, subfamilia vaniloide (TRPV1), inhibición del factor de necrosis tumoral alfa (TNF-α) e inhibición de transportadores de adenosina (15, 45, 47). Además, la expresión de los receptores CB2 se regula al alza durante la inflamación en el tejido afectado, como ocurre en una articulación osteoartrítica o reumatoide. Por lo tanto, el tratamiento con cannabinoides activa los receptores CB2 y da como resultado la inhibición de la producción de citoquinas, la disminución de la infiltración de leucocitos, la reducción de la destrucción ósea y el alivio del dolor (45).
Desafortunadamente, la curva dosis-respuesta del CBD en plasma en perros aún se desconoce. En el presente estudio, se observó una mejora significativa en las puntuaciones de dolor CBPI e iVAS hasta 3-4 semanas después de la inyección, lo que correspondió a una concentración media de CBD de 2,8 ng / ml. Esto puede sugerir que a esta concentración plasmática de CBD todavía hay un efecto analgésico, aunque es posible que el efecto positivo también se atribuya a la alta exposición general observada.
4.3. Collar de seguimiento de actividad
La movilidad en los perros puede verse afectada por el dolor osteoartrítico, como se informó anteriormente (6, 32, 48). Por lo tanto, se eligió el uso de collares de monitoreo de actividad para proporcionar una medición objetiva de la actividad. PetPace es un collar de monitoreo no invasivo que permite el monitoreo continuo de la actividad, la posición, ciertos signos vitales y la calidad del sueño, y mostró una excelente correlación con variables en tiempo real (31, 49, 50). Recientemente, el collar PetPace se sugirió como un dispositivo de monitoreo para detectar el dolor osteoartrítico, ya que detectó niveles de actividad general y de alta intensidad significativamente más bajos en perros artríticos en comparación con perros sanos (32). En el presente estudio se observó un aumento de la actividad 5-6 semanas después de la intervención, que se retrasó debido a la mejora en las evaluaciones de puntuación del dolor y los niveles plasmáticos de CBD. Otros factores además del dolor pueden desempeñar un papel en el patrón de la actividad diaria de los perros, como las actividades del dueño, los paseos en automóvil o las condiciones ambientales (lluvia / calor extremo). Por lo tanto, los datos de actividad del collar, incluidos los datos del presente estudio, deben interpretarse con precaución.
4.4. Análisis de sangre
Aunque algunos de los valores de análisis de sangre cambiaron significativamente desde el inicio durante el período de monitoreo, la mayoría de los cambios no fueron clínicamente importantes, ya que los valores se mantuvieron dentro del rango de referencia. Los glóbulos blancos aumentaron en algunos de los perros, pero no estaban por encima del rango de referencia, excepto el perro que tenía flebitis. El aumento de glóbulos blancos puede explicarse por una respuesta leve del sistema inmune a la inyección de materiales extraños (51), y se adapta a la respuesta local observada en el lugar de la inyección. Los autores no tienen conocimiento de estudios publicados que evalúen el efecto de otras formulaciones liposomales sobre el recuento de leucocitos administrado por vía subcutánea en perros. La morfina liposomal administrada epiduralmente en perros no mostró una elevación sistémica de los glóbulos blancos, pero el recuento de leucocitos en el LCR fue mayor en el grupo de morfina liposomal (17 ± 18 células/mm3) versus el grupo vehículo liposomal (2 ± 1 células/mm3), con un valor de <20 como rango normal (52). El hematocrito disminuyó una semana después de la inyección, pero fue leve sin importancia clínica. Se informó que la fosfatasa alcalina aumentó significativamente desde el inicio después de la administración a largo plazo (semanas o meses) de CBD oral en perros, que se pensó que era el resultado de la inducción de isoenzimas CYP hepáticas (22, 24). Sin embargo, un estudio reciente informó que el aumento de la ALP se correlacionó con una elevación significativa de la ALP específica del hueso, lo que sugiere que el aumento de la ALP total puede atribuirse en parte a la actividad osteoblástica (13). En el presente estudio, la fosfatasa alcalina aumentó en dos perros (33%); uno de ellos había aumentado los niveles al inicio del estudio, y el otro perro tuvo un aumento solo en la medición de 2 días. El nivel de albúmina disminuyó durante el presente estudio, aunque en el rango de referencia. Un estudio reciente que investigó la administración de CBD a largo plazo en perros informó que la albúmina disminuyó gradualmente y alcanzó una diferencia significativa a los 6 meses desde el inicio de la administración de CBD. Pero los valores de albúmina todavía estaban dentro del rango de referencia (13). El nivel de albúmina puede disminuir debido a los efectos sobre el hígado, pero no se observaron otros cambios relacionados con la función hepática. Otros efectos del liposomal CBD, como proteinuria o inflamación, pueden haber resultado en una disminución de la albúmina y deben investigarse más a fondo.
4.5. Efectos adversos
La hinchazón local mínima en el lugar de la inyección no se diagnosticó más, porque era menor, no requería una intervención médica y era autolimitada. Una formulación liposomal diferente (Exparel, DepoFoam Bupivacaine; hecha de fosfolípidos, colesterol y triglicéridos) se informó previamente para producir respuesta local en el sitio de inyección en perros. Ese estudio utilizó perros experimentales y describió la formación de inflamación granulomatosa después de múltiples inyecciones, caracterizada por un mayor número de células gigantes multinucleadas y macrófagos vacuolados. Los autores del estudio Exparel consideraron la respuesta local como una respuesta normal a los liposomas y no adversa (51).
4.6. Productos farmacéuticos del CBD en medicina veterinaria
En los últimos años, el CBD ha ganado popularidad en el mercado veterinario (13). Sin embargo, la etiqueta de los productos puede ser engañosa, ya que muchos productos de «CBD» son en realidad extractos o extractos enriquecidos de Cannabis sativa y, por lo tanto, contienen cantidades variables de CBD además de muchos otros ingredientes de cannabis químicamente complejos. Un estudio reciente informó que de 29 productos de CBD para perros, las concentraciones medias totales de CBD de su declaración en la etiqueta fueron del 93% (0% -154%) de las declaraciones (53). Las declaraciones válidas de la etiqueta de CBD requieren una caracterización y regulación analíticas rigurosas (53). La FDA ha publicado una guía que explica que los productos de CBD que se comercializan sin receta médica no están aprobados y pueden poner en riesgo a los usuarios (54, 55). En comparación con los productos a base de cannabis, el CBD sintético, que está aprobado por la FDA con un archivo maestro de medicamentos, proporciona un verdadero producto libre de THC y otros cannabinoides. El uso de CBD sintético como ingrediente farmacéutico activo de la formulación liposomal-CBD puede proporcionar un efecto deseado confiable repetidamente.
4.7. Limitaciones
Las limitaciones de este estudio incluyen el tamaño pequeño de la muestra y el diseño del estudio no ciego, que podría haber introducido sesgo en las evaluaciones del propietario y veterinarias. Calculamos la biodisponibilidad basándonos en un estudio que informó la administración intravenosa de CBD de 1988 (36), que puede no ser un cálculo preciso, pero no hay otro estudio disponible en la literatura que informe CBD intravenoso en perros. La mayoría de los perros en este estudio eran geriátricos, lo que potencialmente puede afectar la absorción y eliminación del CBD, y los animales más jóvenes pueden tener un perfil farmacocinético diferente después del CBD liposomal. Aunque, esto también puede ser una fortaleza de este estudio, ya que algunos de los perros tenían estados de enfermedad concurrentes y / o estaban recibiendo medicamentos de rutina, y esta suele ser la población de perros que pueden beneficiarse del tratamiento con CBD.
5. Conclusión
El liposomal de CBD administrado por vía subcutánea tuvo efectos adversos menores, dio lugar a concentraciones plasmáticas de CBD detectables durante 6 semanas y mostró una alta exposición en términos de AUC, lo que se correlacionó con una alta biodisponibilidad y una disminución de las puntuaciones de dolor. Esta formulación liposomal se puede utilizar como un tratamiento adicional como parte de la analgesia multimodal para aumentar el bienestar en perros que sufren de osteoartritis. Los estudios adicionales que incorporen el control con placebo, la curva dosis-respuesta y las inyecciones múltiples (es decir, cada varias semanas) proporcionarían más información sobre la eficacia y seguridad a largo plazo de esta formulación.
Declaración de disponibilidad de datos
Los datos brutos que apoyan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
Los estudios en animales fueron aprobados por el Comité de Cuidado y Uso de Animales Ein-Kerem de la Universidad Hebrea de Jerusalén. Los estudios se realizaron de acuerdo con la legislación local y los requisitos institucionales. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones del autor
YS-B y AC contribuyeron a la concepción del estudio, adquisición de datos e interpretación, y redactaron el manuscrito. NY, JM, DZ, AH y DB contribuyeron a la adquisición de datos. WA analizó los datos. EL y DB interpretaron los resultados. YB contribuyó al estudio de la concepción e interpretó los resultados. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Financiación
Este estudio fue financiado por Innocan Pharma™.
Reconocimientos
Los autores agradecen al Prof. Itamar Aroch por las evaluaciones de hematología.
Conflicto de intereses
DZ, AH y AC son compatibles con Innocan Pharma™. AC e YB tienen una patente pendiente sobre la formulación liposomal-CBD utilizada en este estudio.
Los autores restantes declaran que la investigación se realizó en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Notas
1. ^https://petpace.com/smart-sensing-collar/
Referencias
1. Riley, LM, Satchell, L, Stilwell, LM, y Lenton, NS. Efecto de la terapia de masaje sobre el dolor y la calidad de vida en perros: un estudio transversal. Veterinario Rec. (2021) 189:E586. DOI: 10.1002/VTR.586
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Schachner, ER, y López, MJ. Diagnóstico, prevención y manejo de la displasia de cadera canina: una revisión. Veterinario Med (Auckl). (2015) 6:181–92. doi: 10.2147/VMRR. S53266
3. Alves, JC, Santos, A, Jorge, P, Lavrador, C, y Carreira, LM. Las inyecciones intraarticulares con hexacetonida de triamcinolona, estanozolol, Hylan G-F 20 o un concentrado de plaquetas mejoran los signos clínicos en perros de trabajo policiales con osteoartritis bilateral de cadera. Front Vet Sci. (2020) 7:609889. DOI: 10.3389/FVETS.2020.609889
4. Vijarnsorn, M, Kwananocha, I, Kashemsant, N, Jarudecha, T, Lekcharoensuk, C, Beale, B, et al. La eficacia del compuesto de ácidos grasos de origen marino (PCSO-524) y firocoxib en el tratamiento de la osteoartritis canina. BMC Vet Res. (2019) 15:349. DOI: 10.1186/S12917-019-2110-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Reymond, N, Speranza, C, Gruet, P, Seewald, W, y King, JN. Robenacoxib vs. carprofeno para el tratamiento de la osteoartritis canina; un ensayo clínico aleatorizado de no inferioridad. J Vet Pharmacol Ther. (2012) 35:175–83. doi: 10.1111/j.1365-2885.2011.01297.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Muller, C, Gines, JA, Conzemius, M, Meyers, R, y Lascelles, BDX. Evaluación del efecto de la señalización y el nivel de deterioro informado por el propietario sobre los cambios medidos por el acelerómetro en la actividad en perros osteoartríticos que reciben un antiinflamatorio no esteroideo. Veterinario J. (2018) 242:48–52. doi: 10.1016/j.tvjl.2018.10.005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Barbeau-Gregoire, M, Otis, C, Cournoyer, A, Moreau, M, Lussier, B, y Troncy, E. Una revisión sistemática y metaanálisis de 2022 de dietas terapéuticas enriquecidas y nutracéuticos en la osteoartritis canina y felina. Int J Mol Sci. (2022) 23:10384. DOI: 10.3390/IJMS231810384
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Belshaw, Z, Asher, L, y Dean, RS. Las actitudes de los propietarios y profesionales veterinarios en el Reino Unido ante el riesgo de eventos adversos asociados con el uso de medicamentos antiinflamatorios no esteroideos (AINE) para tratar perros con osteoartritis. Prev Vet Med. (2016) 131:121–6. doi: 10.1016/j.prevetmed.2016.07.017
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Innes, JF, Clayton, J, and Lascelles, BD. Review of the safety and efficacy of long-term NINE use in the treatment of canine osteoarthritis. Veterinario Rec. (2010) 166:226–30. DOI: 10.1136/VR.C97
10. Vaughn, D, Kulpa, J, and Paulionis, L. Preliminary investigation of the safety of increasing cannabinoid dose in healthy dogs. Front Vet Sci. (2020) 7:51. DOI: 10.3389/FVETS.2020.00051
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Chicoine, A, Illing, K, Vuong, S, Pinto, KR, Alcorn, J y Cosford, K. Evaluación farmacocinética y de seguridad de varias dosis orales de un nuevo extracto herbal de cannabis 1:20 THC: CBD en perros. Front Vet Sci. (2020) 7:583404. DOI: 10.3389/fvets.2020.583404
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Vaughn, DM, Paulionis, LJ, y Kulpa, JE. Evaluación aleatorizada, controlada con placebo, de seguridad y farmacocinética de 28 días de la administración oral repetida de cannabidiol en perros sanos. Am J Vet Res. (2021) 82:405–16. DOI: 10.2460/AJVR.82.5.405
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Bradley, S, Young, S, Bakke, AM, Holcombe, L, Waller, D, Hunt, A, et al. La alimentación diaria a largo plazo de cannabidiol es bien tolerada por perros sanos. Front Vet Sci. (2022) 9:977457. doi: 10.3389/fvets.2022.977457
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Fitzcharles, MA, Baerwald, C, Ablin, J, y Hauser, W. Eficacia, tolerabilidad y seguridad de los cannabinoides en el dolor crónico asociado con enfermedades reumáticas (síndrome de fibromialgia, dolor de espalda, osteoartritis, artritis reumatoide): una revisión sistemática de ensayos controlados aleatorios. Schmerz. (2016) 30:47–61. DOI: 10.1007/S00482-015-0084-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Millar, SA, Stone, NL, Bellman, ZD, Yates, AS, England, TJ, y O’Sullivan, SE. Una revisión sistemática de la dosificación de cannabidiol en poblaciones clínicas. H. J Clin Pharmacol. (2019) 85:1888–900. doi: 10.1111/bcp.14038
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. O’Brien, M, y McDougall, JJ. Cannabis and joints: scientific evidence for the alleviation of osteoarthritis pain by cannabinoids. Curr Opin Pharmacol. (2018) 40:104–9. doi: 10.1016/j.coph.2018.03.012
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Gamble, LJ, Boesch, JM, Frye, CW, Schwark, WS, Mann, S, Wolfe, L, et al. Farmacocinética, seguridad y eficacia clínica del tratamiento con cannabidiol en perros osteoartríticos. Front Vet Sci. (2018) 5:165. DOI: 10.3389/fvets.2018.00165
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Verrico, CD, Wesson, S, Konduri, V, Hofferek, CJ, Vazquez-Perez, J, Blair, E, et al. Un estudio aleatorizado, doble ciego, controlado con placebo de cannabidiol diario para el tratamiento del dolor de la osteoartritis canina. Dolor. (2020) 161:2191–202. doi: 10.1097/j.pain.0000000000001896
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Brioschi, FA, Di Cesare, F, Gioeni, D, Rabbogliatti, V, Ferrari, F, D’Urso, ES, et al. Formulación oral de aceite de cannabidiol transmucoso como parte de un régimen analgésico multimodal: efectos sobre el alivio del dolor y la mejora de la calidad de vida en perros afectados por osteoartritis espontánea. Animales (Basilea). (2020) 10:1505. DOI: 10.3390/ANI10091505
20. Mejia, S, Duerr, FM, Griffenhagen, G, and McGrath, S. Evaluation of the effect of cannabidiol on naturally wholearthritis-associated pain: a pilot study in dogs. J Am Anim Hosp Assoc. (2021) 57:81–90. doi: 10.5326/JAAHA-MS-7119
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Perucca, E, y Bialer, M. Aspectos críticos que afectan al cannabidiol Biodisponibilidad oral y eliminación metabólica, e implicaciones clínicas relacionadas. Medicamentos para el SNC. (2020) 34:795–800. DOI: 10.1007/S40263-020-00741-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Deabold, KA, Schwark, WS, Wolf, L, and Wakshlag, JJ. Single-dose pharmacokinetics and preliminary safety assessment with use of CBD-rich hemp nutraceutical in dogs and catsan (Evaluación preliminar de la seguridad con el uso de nutracéutico de cáñamo rico en CBD en perros y gatos sanos). Animales (Basilea). (2019) 9:832. DOI: 10.3390/ANI9100832
23. Bartner, LR, McGrath, S, Rao, S, Hyatt, LK y Wittenburg, LA. Farmacocinética del cannabidiol administrado por 3 métodos de administración en 2 dosis diferentes a perros sanos. Can J Vet Res. (2018) 82:178–83.
24. McGrath, S, Bartner, LR, Rao, S, Packer, RA, y Gustafson, DL. Ensayo clínico controlado aleatorizado ciego para evaluar el efecto de la administración oral de cannabidiol además del tratamiento antiepiléptico convencional sobre la frecuencia de las convulsiones en perros con epilepsia idiopática intratable. J Am Vet Med Assoc. (2019) 254:1301–8. doi: 10.2460/javma.254.11.1301
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Shilo-Benjamini, Y, Cern, A, Zilbersheid, D, Hod, A, Lavy, E, Barasch, D, et al. Un informe de caso de formulación de cannabidiol liposomal inyectada por vía subcutánea utilizada como terapia de compasión para el manejo del dolor en un perro. Front Vet Sci. (2022) 9:892306. DOI: 10.3389/FVETS.2022.892306
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Abu Lila, AS, and Ishida, T. Liposomal delivery systems: design optimization and current applications. Biol Pharm Bull. (2017) 40:1–10. doi: 10.1248/bpb.b16-00624
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Patil, YP, y Jadhav, S. Novel methods for liposome preparation. Lípidos químicos físicos. (2014) 177:8–18. doi: 10.1016/j.chemphyslip.2013.10.011
28. Rahnfeld, L, y Luciani, P. Injectable lipid-based depot formulations: where do we stand? Farmacia. (2020) 12:567. DOI: 10.3390/Pharmaceutics12060567
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Brown, DC, Boston, RC, Coyne, JC, and Farrar, JT. Ability of the canine brief pain inventory to detect response to treatment in dogs with osteoarthritis. J Am Vet Med Assoc. (2008) 233:1278–83. doi: 10.2460/javma.233.8.1278
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Brown, DC, Bell, M, and Rhodes, L. Power of treatment success definitions when the canine brief pain inventory is used to evaluate carprofen treatment for the control of pain and inflammation in dogs with osteoarthritis. Am J Vet Res. (2013) 74:1467–73. doi: 10.2460/ajvr.74.12.1467
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Belda, B, Enomoto, M, Case, BC y Lascelles, BDX. Evaluación inicial del monitor de actividad PetPace. Veterinario J. (2018) 237:63–8. doi: 10.1016/j.tvjl.2018.05.011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Rowlison de Ortiz, A, Belda, B, Hash, J, Enomoto, M, Robertson, J y Lascelles, BDX. Exploración inicial de la capacidad discriminatoria del collar PetPace para detectar diferencias de actividad y variables fisiológicas entre perros sanos y osteoartríticos. Front Pain Res (Lausana). (2022) 3:949877. DOI: 10.3389/FPAIN.2022.949877
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Bulbake, U, Doppalapudi, S, Kommineni, N, and Khan, W. Formulaciones liposomales en uso clínico: una revisión actualizada. Farmacia. (2017) 9:12. DOI: 10.3390/Pharmaceutics9020012
34. Wakshlag, JJ, Schwark, WS, Deabold, KA, Talsma, BN, Cital, S, Lyubimov, A, et al. Farmacocinética de cannabidiol, ácido cannabidiólico, Delta9-tetrahidrocannabinol, ácido tetrahidrocannabinólico y metabolitos relacionados en suero canino después de la dosificación con tres formas orales de extracto de cáñamo. Front Vet Sci. (2020) 7:505. DOI: 10.3389/FVETS.2020.00505
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Corsato Alvarenga, I, Panickar, KS, Hess, H, and McGrath, S. Scientific validation of cannabidiol for Management of dog and cat Diseases. Annu Rev Anim Biosci. (2023) 11:227–46. doi: 10.1146/annurev-animal-081122-070236
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Samara, E, Bialer, M, y Mechoulam, R. Pharmacokinetics of cannabidiol in dogs. Medicamentos Metab Dispos. (1988) 16:469–72.
37. Della Rocca, G, Paoletti, F, Conti, MB, Galarini, R, Chiaradia, E, Sforna, M, et al. Farmacocinética del cannabidiol tras la administración transmucosa oral y oral única en perros. Front Vet Sci. (2023) 9:1104152. doi: 10.3389/fvets.2022.1104152
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Polidoro, D, Temmerman, R, Devreese, M, Charalambous, M, Ham, LV, Cornelis, I, et al. Farmacocinética del cannabidiol después de la administración intranasal, intrarrectal y oral en perros sanos. Front Vet Sci. (2022) 9:899940. DOI: 10.3389/FVETS.2022.899940
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Fernandez-Trapero, M, Perez-Diaz, C, Espejo-Porras, F, de Lago, E, and Fernandez-Ruiz, J. Pharmacokinetics of Sativex in dogs: towards a potential cannabinoid-based therapy for canine disorders. Biomol Ther. (2020) 10:249. DOI: 10.3390/biom10020279 ®
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Hedges, AR, Pypendop, BH, Shilo, Y, Stanley, SD e Ilkiw, JE. Impacto del sitio de muestreo de sangre en los perfiles de fármacos de concentración temporal después de la administración intravenosa o bucal del fármaco. J Vet Pharmacol Ther. (2014) 37:145–50. DOI: 10.1111/JVP.12075
41. Hannon, MB, Deabold, KA, Talsma, BN, Lyubimov, A, Iqbal, A, Zakharov, A, et al. Cannabidiol sérico, tetrahidrocannabinol (THC) y sus derivados ácidos nativos después de la aplicación transdérmica de un extracto de Cannabis sativa bajo en THC en beagles. J Vet Pharmacol Ther. (2020) 43:508–11. DOI: 10.1111/JVP.12896
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. Miranda-Cortes, A, Mota-Rojas, D, Crosignani-Outeda, N, Casas-Alvarado, A, Martinez-Burnes, J, Olmos-Hernandez, A, et al. El papel de los cannabinoides en la modulación del dolor en animales de compañía. Front Vet Sci. (2023) 9:1050884. doi: 10.3389/fvets.2022.1050884
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Fallahi, S, Bobak, L, y Opalinski, S. Cáñamo en dietas animales-cannabidiol. Animales (Basilea). (2022) 12:2541. DOI: 10.3390/ANI12192541
44. Yu, CHJ, y Rupasinghe, HPV. Productos de salud naturales a base de cannabidiol para animales de compañía: avances recientes en el manejo de la ansiedad, el dolor y la inflamación. Res Vet Sci. (2021) 140:38–46. doi: 10.1016/j.rvsc.2021.08.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Mosley, C, Gaynor, J, Cital, S, and Brassard, J. Cannabinoids for pain management In: S Cital, K Kramer, L Hughston, and J Gaynor, editors. Terapia cannábica en medicina veterinaria, una guía completa. Suiza: Springer (2021). 117–42.
46. Dos Santos, RG, Hallak, JEC, y Crippa, JAS. Efectos neurofarmacológicos de los principales fitocannabinoides: una revisión narrativa. Adv Exp Med Biol. (2021) 1264:29–45. DOI: 10.1007/978-3-030-57369-0_3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
47. Legare, CA, Raup-Konsavage, WM, y Vrana, KE. Potencial terapéutico del cannabis, el cannabidiol y los productos farmacéuticos a base de cannabinoides. Farmacología. (2022) 107:131–49. doi: 10.1159/000521683
48. Brown, DC, Boston, RC, y Farrar, JT. Uso de un monitor de actividad para detectar la respuesta al tratamiento en perros con osteoartritis. J Am Vet Med Assoc. (2010) 237:66–70. doi: 10.2460/javma.237.1.66
Resumen de PubMed | Texto completo de CrossRef | Google Académico
49. Ortmeyer, HK, Robey, L, and McDonald, T. Combining Actigraph link and PetPace collar data to measure activity, proximity, and physiological responses in free moving dogs in a natural environment. Animales (Basilea). (2018) 8:230. DOI: 10.3390/ANI8120230
50. Ortmeyer, HK, y Katzel, LI. Efectos de la proximidad entre perros de compañía y sus cuidadores en las medidas de variabilidad de la frecuencia cardíaca en adultos mayores: un estudio piloto. Int J Medio Ambiente Salud Pública. (2020) 17:2674. DOI: 10.3390/IJERPH17082674
Resumen de PubMed | Texto completo de CrossRef | Google Académico
51. Richard, BM, Rickert, DE, Newton, PE, Ott, LR, Haan, D, Brubaker, AN, et al. Evaluación de la seguridad de EXPAREL (DepoFoam bupivacaína) administrada por inyección subcutánea repetida en conejos y perros: comparación de especies. J Droga Deliv. (2011) 2011:467429:1–14. doi: 10.1155/2011/467429
52. Yaksh, TL, Provencher, JC, Rathbun, ML, Myers, RR, Powell, H, Richter, P, et al. Evaluación de la seguridad de la morfina encapsulada administrada por vía epidural en una preparación de liposomas multivesiculares de liberación sostenida en perros. Droga Deliv. (2000) 7:27–36. DOI: 10.1080/107175400266768
53. Wakshlag, JJ, Cital, S, Eaton, SJ, Prussin, R, and Hudalla, C. Cannabinoid, terpene, and heavy metal analysis of 29 over-the-counter commercial veterinary hemp supplements. Veterinario Med (Auckl). (2020) 11:45–55. doi: 10.2147/VMRR. S248712
Resumen de PubMed | Texto completo de CrossRef | Google Académico
54. Hahn, SM. La FDA avanza en el trabajo relacionado con los productos de cannabidiol con un enfoque en la protección de la salud pública, proporcionando claridad en el mercado (2020). Disponible en: https://www.fda.gov/news-events/press-announcements/fda-advances-work-related-cannabidiol-products-focus-protecting-public-health-providing-market.
Palabras clave: analgesia, cannabidiol, CBD, perros, liposomas, artrosis, farmacocinética, liberación prolongada
Cita: Shilo-Benjamini Y, Lavy E, Yair N, Milgram J, Zilbersheid D, Hod A, Barasch D, Abu Ahmad W, Cern A y Barenholz Y (2023) Eficacia terapéutica y farmacocinética de la inyección de liposomal-cannabidiol: un estudio clínico piloto en perros con osteoartritis natural. Frente. Vet. Sci. 10:1224452. doi: 10.3389/fvets.2023.1224452
Recibido: 17 de mayo de 2023; Aprobado: 07 Agosto 2023;
Publicado: 23 agosto 2023.
Editado por:
Robin Temmerman, Colegio Europeo de Farmacología y Toxicología Veterinaria (ECVPT), Bélgica
Revisado por:
Melissa Reynolds, Universidad Estatal de Colorado, Estados Unidos
Federica Alessandra Brioschi, Universidad de Milán, Italia
Derechos de autor © 2023 Shilo-Benjamini, Lavy, Yair, Milgram, Zilbersheid, Hod, Barasch, Abu Ahmad, Cern y Barenholz. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Yael Shilo-Benjamini, shilo.yael@gmail.com
†Estos autores comparten autoría senior
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.