Eficacia y seguridad del cannabidiol para el tratamiento de la osteoartritis canina
Eficacia y seguridad del cannabidiol para el tratamiento de la osteoartritis canina: una revisión sistemática y metanálisis de estudios de intervención en animales
 Chanthawat Patikorn1
Chanthawat Patikorn1  Osot Nerapusee1
Osot Nerapusee1  Kumpanart Soontornvipart2
Kumpanart Soontornvipart2  Kanta Lawonyawut1
Kanta Lawonyawut1  Kachapong Musikpodok1
Kachapong Musikpodok1  Kanisorn Waleethanaphan1
Kanisorn Waleethanaphan1  Puré Anantachoti1*
Puré Anantachoti1*- 1Departamento de Farmacia Social y Administrativa, Facultad de Ciencias Farmacéuticas, Universidad de Chulalongkorn, Bangkok, Tailandia
- 2Departamento de Cirugía Veterinaria, Facultad de Ciencias Veterinarias, Universidad de Chulalongkorn, Bangkok, Tailandia
Introducción: La osteoartritis canina (OA) es una enfermedad degenerativa con inflamación crónica de las estructuras articulares internas y externas en perros. Cannabis spp. contiene cannabidiol (CBD), una sustancia conocida por varias indicaciones potenciales, como el alivio del dolor y el antiinflamatorio en varios tipos de animales, incluidos los perros con OA. Como el CBD está cada vez más en el centro de atención para uso médico, nuestro objetivo fue realizar una revisión sistemática y un metanálisis para evaluar la eficacia y la seguridad del CBD en el tratamiento de la OA canina.
Métodos: Se realizaron búsquedas en PubMed, Embase, Scopus y CAB Direct para obtener estudios de intervención en animales que investigaran los efectos del CBD para la OA canina desde el inicio de la base de datos hasta el 28 de febrero de 2023. Se resumieron las características y los hallazgos de los estudios. Se evaluó el riesgo de sesgo en los estudios incluidos. Los metanálisis se realizaron mediante un modelo de efectos aleatorios para estimar los efectos del CBD sobre las puntuaciones de dolor (0-10), expresadas como diferencia de medias (DM) e intervalo de confianza del 95% (IC del 95%). La certeza de la evidencia se evaluó mediante GRADE.
Resultados: Se incluyeron cinco artículos, que investigaron los efectos del CBD en 117 perros con OA. Todos los estudios se calificaron como de alto riesgo de sesgo. Los productos de CBD variaron sustancialmente, es decir, aceite de CBD oral de espectro completo en cuatro estudios, y aceite de CBD aislado y aceite de CBD liposomal en otro estudio. La duración del tratamiento varió de 4 a 12 semanas. Los metanálisis de tres estudios encontraron que, en perros con OA, el tratamiento con aceite de CBD oral de espectro completo puede reducir las puntuaciones de gravedad del dolor (DM; -0,60; IC del 95%; -1,51 a 0,31, I2 = 45,64%, p = 0,19) y puntuaciones de interferencia del dolor (DM; -1,52; IC del 95%; -3,84 a 0,80, I2 = 89,59%, p = 0,20) pero la certeza de la evidencia fue muy baja. El CBD generalmente se considera seguro y bien tolerado a corto plazo, con pocos eventos adversos leves observados, como vómitos y aumento asintomático en el nivel de fosfatasa alcalina.
Conclusión: El CBD se considera seguro para tratar la OA canina. El CBD puede reducir las puntuaciones de dolor, pero la evidencia es muy incierta para concluir su eficacia clínica. Se necesitan ensayos clínicos de alta calidad para evaluar aún más las funciones del CBD en la OA canina.
1. Introducción
La osteoartritis canina (OA) es una enfermedad degenerativa de la articulación en perros expresada por la inflamación crónica de las estructuras articulares internas y externas. El dolor, la hinchazón y la deformidad articular generalmente se observan entre los pacientes con OA, lo que limita el movimiento y eventualmente conduce a una discapacidad irreversible (1). Hay cinco etapas (0-4) de OA canina según el sistema COAST, que incluyen la etapa 0: perros preclínicos sin factores de riesgo aparentes para OA, la etapa 1: perros preclínicos con factores de riesgo para OA, la etapa 2: perros con OA leve, la etapa 3: perros con OA moderada y la etapa 4: perros con OA grave (2). Se informó que la prevalencia de OA canina era de hasta el 20% en el Reino Unido y los Estados Unidos. La OA canina es una de las principales enfermedades crónicas que afectan la calidad de vida de los perros (3, 4).
La causa de la OA en perros aún se desconoce. Los factores de riesgo asociados con la progresión de la enfermedad se pueden clasificar en dos categorías: factores de riesgo no modificables, como la edad y la cría grande, y factores de riesgo modificables, como el peso (1). La OA es crónica y no se puede curar. El objetivo del tratamiento es retrasar la progresión de la enfermedad, aliviar el dolor y mejorar la calidad de vida del perro (4).
El manejo del dolor a menudo se puede dividir en dos etapas: etapas agudas y crónicas. El dolor leve a moderado en la etapa aguda de OA puede controlarse bien con analgésicos, mientras que el dolor moderado a intenso se maneja con analgesia multimodal, que incluye opioides, medicamentos antiinflamatorios no esteroideos (AINE), anestésicos locales, antagonistas de los receptores de N-metil-D-aspartato (NMDA) y agonistas de los receptores adrenérgicos alfa 2. Las aplicaciones a corto plazo de los AINE se consideran el pilar del tratamiento para las etapas crónicas, junto con las intervenciones no farmacológicas como la acupuntura o la cirugía (5). Sin embargo, los AINE no son efectivos para el dolor crónico y para el uso a largo plazo. Aumentan el riesgo de úlcera péptica e insuficiencia renal, especialmente entre los ancianos y las personas con enfermedades renales y gastrointestinales (6).
Los suplementos dietéticos que utilizan ácidos grasos omega-3 pueden ayudar a controlar la OA canina en la fase crónica. Los estudios mostraron que, en comparación con el grupo de control, los perros que recibieron ácidos grasos omega-3 tuvieron una disminución significativa en la dosis de carprofeno (7). Además, una reciente revisión sistemática y metaanálisis mostró una evidente eficacia analgésica clínica de los ácidos grasos omega-3 en la OA canina (8).
Anteriormente, las especies de cannabis se controlaban estrictamente porque contienen delta-9-tetrahidrocannabinol (THC), un compuesto psicoactivo (9). Debido a las propiedades adictivas del THC, los estudios clínicos previos fueron bastante limitados. Además del THC, otro ingrediente activo clave en Cannabis spp. es el cannabidiol (CBD). El CBD es conocido por varias indicaciones potenciales, como el alivio del dolor, las propiedades antiinflamatorias, antiepilepsias, antineoplásicas y antideprimidas (10-13). Debido a los beneficios positivos del CBD, el Departamento de Agricultura de los Estados Unidos (USDA) promulgó la Ley Agrícola de 2018. Esta legislación eliminó el cáñamo, definido como Cannabis sativa L., con un bajo contenido de THC (menos del 3% de THC en peso seco) de la lista de sustancias controladas (14). Como resultado, los productos de cáñamo y los compuestos activos como los extractos de CBD han surgido en los mercados de la salud humana y animal.
Muchos estudios investigan la actividad farmacológica del CBD en varios tipos de animales, incluidos los perros. El CBD es un antagonista alostérico no competitivo con afinidad por unirse a los receptores cannabinoides. Estos receptores cannabinoides se encuentran en muchos lugares de los perros, como el sistema nervioso central, el sistema nervioso periférico, el sistema cardiovascular, el sistema inmunológico, el sistema gastrointestinal, el sistema reproductivo, la piel y el líquido sinovial (15-17). Como resultado, el CBD podría usarse como una nueva terapia alternativa para aliviar el dolor en perros que sufren de OA. Un estudio farmacocinético de CBD en perros con OA reveló que la vida media (T1/2) de CBD fueron aproximadamente 4 h para CBD 2 mg/kg y 8 mg/kg, que se administraron cada 12 h (18). Muchos factores influyen en la biodisponibilidad y el metabolismo del CBD, incluidas las formulaciones de los productos, las formas de dosificación, las vías de administración y si se administran rápidamente o con alimentos. Se descubrió que la administración conjunta de CBD con alimentos podría aumentar la absorción de CBD (19, 20). La raza, la edad, el porcentaje de grasa y la condición corporal de los pacientes individualizados juegan un papel en la farmacocinética del CBD (18, 21). Sin embargo, los resultados de los estudios farmacocinéticos solos fueron inadecuados para apoyar el uso clínico.
En la actualidad, solo un número limitado de estudios ha evaluado la eficacia y seguridad del CBD en perros con OA. Estos estudios previos informaron unánimemente algunos eventos adversos, que no fueron graves (18, 22-27). La literatura contiene varios artículos de revisión; sin embargo, esas revisiones anteriores no realizaron metanálisis (9, 28, 29). Por lo tanto, este estudio tuvo como objetivo realizar una revisión sistemática y un metanálisis de los ensayos clínicos disponibles para investigar la eficacia y seguridad del CBD en el tratamiento de la OA canina, ya que el CBD está cada vez más en el centro de atención para uso médico.
2. Materiales y métodos
El protocolo de esta revisión sistemática fue registrado en PROSPERO (CRD42023381113) (30). Este estudio se realizó siguiendo el manual Cochrane para revisiones sistemáticas de intervenciones (31) y se informó siguiendo la guía de informes preferidos de 2020 para revisiones sistemáticas y metanálisis (PRISMA), como se muestra en la Tabla Suplementaria S1 (32).
2.1. Criterios de admisibilidad
Se incluyeron los estudios de intervención en animales que cumplieron con los criterios de elegibilidad descritos en el marco de población, intervención, control y resultado (PICO). Población: perros con OA independientemente de la raza, edad, peso, comorbilidad y tratamiento preexistente. Intervención: cualquier forma (vía de administración, dosis y duración) de CBD. Los productos de CBD se clasificaron según el contenido molecular, incluyendo (1) espectro completo; un producto que contiene CBD y compuestos totalmente naturales que se encuentran en la planta de cannabis, (2) de amplio espectro; un producto que contiene CBD y compuestos totalmente naturales, excepto tetrahidrocannabinol (THC), y (3) aislado; un producto contiene solo un compuesto natural de CBD. Comparadores: cualquier comparador. Resultados: cualquier resultado de eficacia de los artículos, como la medición del dolor, las posiciones y el movimiento, y los resultados de seguridad, como los eventos adversos. Se excluyeron los artículos que no tienen un artículo de texto completo disponible.
2.2. Estrategia de búsqueda
Se realizaron búsquedas en PubMed, Embase, Scopus y CAB Direct para obtener estudios relevantes para los criterios de elegibilidad desde el inicio de la base de datos hasta el 28 de febrero de 2023. Nuestros términos de búsqueda fueron; (Cannabis O cáñamo O semillas de cáñamo O semillas de cáñamo O Cannabis O marihuana O Cannabis sativa O cannabinoides O delta-9-tetrahidrocannabinol O cannabidiol O cannabinol O hierba O CBD O THC) Y (perros O perro O canino O caninos) Y (artritis O osteoartritis O OA), que se adaptó para que coincida con las técnicas de búsqueda de cada base de datos. En el cuadro suplementario S2 se muestra una estrategia de búsqueda completa. Para esta revisión sistemática, no hubo limitaciones en el lenguaje. Además, se realizó una búsqueda complementaria mediante el seguimiento de las citas y el examen de las listas de referencias de los artículos relevantes.
2.3. Selección de estudios
Los artículos recuperados mediante la estrategia de búsqueda mencionada se importaron a la versión 20 de EndNote. Se eliminaron los duplicados. Dos revisores evaluaron de forma independiente los títulos y los resúmenes de los estudios para ver si cumplían con los criterios de inclusión. Luego se recuperó el texto completo de los estudios potencialmente elegibles y dos revisores evaluaron de forma independiente su elegibilidad. Si los revisores no estaban de acuerdo sobre la elegibilidad de un estudio, se consultaba a un tercer revisor para resolver el problema.
2.4. Extracción de datos
Se utilizó un formulario estandarizado y prepilotado para extraer los datos de los estudios incluidos. Dos revisores extrajeron de forma independiente los datos de cada artículo. Se extrajeron los siguientes datos; primer autor, año de publicación, diseño del estudio, duración del estudio, características de los participantes, forma de dosificación, concentración, régimen de dosificación, vía de administración y componentes de los productos de CBD, medidas de eficacia y eventos adversos.
2.5. Evaluación de la calidad
Los ensayos controlados aleatorios (ECA) se evaluaron para determinar el riesgo de sesgo mediante una herramienta de riesgo de sesgo para estudios de intervención en animales (herramienta RoB de SYRCLE) (33), que abordó seis tipos de sesgo: (1) sesgo de selección; (2) sesgo de rendimiento; (3) sesgo de detección; (4) sesgo de desgaste; (5) sesgo de notificación; y (6) otros, en 10 dominios. Cada dominio se clasificó como «alto», «incierto» o «bajo» riesgo de sesgo.
Los estudios no aleatorizados fueron evaluados por el índice metodológico para estudios no aleatorizados (MINORS) (34), que definió ocho dominios específicos: (1) objetivo claramente establecido; (2) inclusión de pacientes consecutivos; (3) recopilación prospectiva de datos; 4) criterios de valoración adecuados para el objetivo del estudio; (5) evaluación imparcial del criterio de valoración del estudio; 6) período de seguimiento adecuado al objetivo del estudio; (7) <5% perdido durante el seguimiento; (8) cálculo prospectivo del tamaño del estudio.
2.6. Análisis de datos
Se realizó un análisis descriptivo narrativo para resumir las características de los estudios incluidos. Se realizaron metanálisis mediante un modelo de efectos aleatorios según el método de Dersimonian y Laird para estimar los efectos del CBD en las medidas de eficacia (35). La media y la desviación estándar (DE) en la última visita de los grupos de tratamiento y control de los estudios incluidos se utilizaron para calcular los efectos agrupados del CBD. Los tamaños del efecto se informaron como diferencia de medias (DM) y su intervalo de confianza del 95% (IC del 95%) y se presentaron en un diagrama de bosque. El error de tipo I se corrigió en 5% y de dos lados.
Se evaluó la heterogeneidad evaluada por χ2 y yo2 índice estadístico. El I2 El valor oscila entre 0% y 100% y generalmente se determina bajo cuando <40%, modesto cuando 30%–60%, sustancial cuando 50%–90% y considerable cuando 75%–100% (31). Los metanálisis de sensibilidad se realizaron mediante la eliminación de los estudios evaluados como de alto riesgo de sesgo para evaluar la solidez de los hallazgos. El sesgo de publicación se evaluó mediante la prueba de asimetría de regresión de Egger (36). Los análisis estadísticos se realizaron utilizando STATA versión 18.0.
2.7. Evaluación de la certeza
Se evaluó la certeza de la evidencia (CoE) de los efectos metanalizados del CBD sobre los resultados del dolor. El CoE se evaluó utilizando el enfoque de calificación de recomendaciones, evaluación, desarrollo y evaluación (GRADE), que incluyó la evaluación del riesgo de sesgo, inconsistencia, falta de direccionalidad, imprecisión y sesgo de publicación. GRADE tiene cuatro niveles de CoE, incluyendo muy bajo, bajo, moderado y alto (37).
3. Resultados
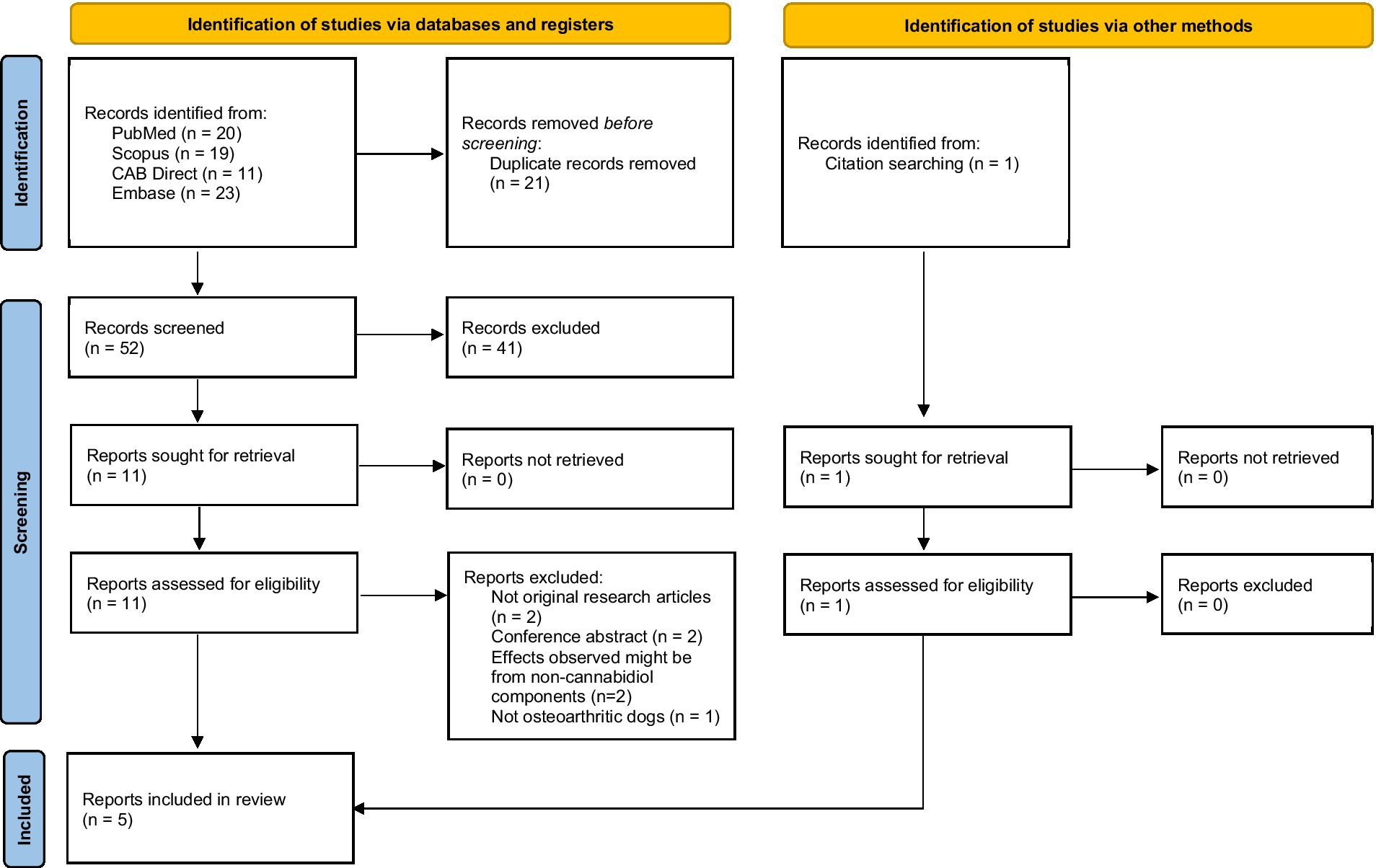
3.1. Selección de estudios
Se identificaron un total de 73 artículos a partir de la búsqueda. Se incluyeron cinco estudios que investigaron la eficacia y la seguridad de los productos de CBD (18, 22, 24, 26, 27). El flujo de selección del estudio se presenta en la Figura 1. En la Tabla Suplementaria S3 se presenta una lista de estudios excluidos con motivos. Excluimos un ensayo clínico que investiga tabletas orales que contienen aceite de CBD de espectro completo y Boswellia serrata Roxb. y Zingiber officinale fitosomizado porque los efectos observados podrían no provenir del CBD (23, 25).
3.2. Características de los estudios
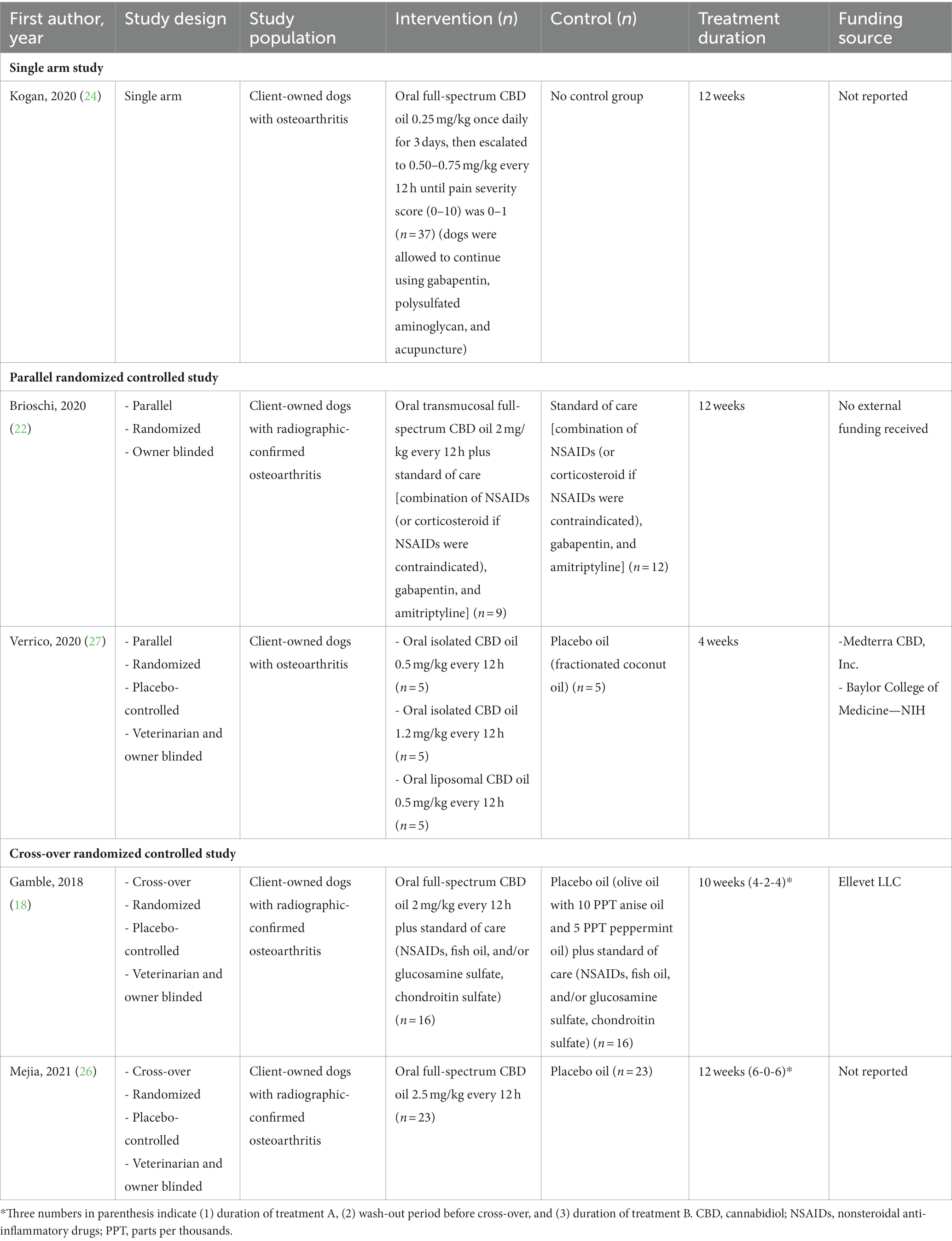
La Tabla 1 resume las características de los estudios incluidos, que incluyeron 117 perros con OA. Dos estudios fueron ECA paralelos (22, 27), mientras que los otros dos fueron ECA cruzados (18, 26). Un estudio fue un estudio de un solo grupo (24). Los perros participantes fueron perros propiedad del cliente con OA, de los cuales tres estudios incluyeron específicamente solo perros con OA confirmada por radiografía (18, 22, 26). Se informaron articulaciones afectadas en 63 perros en tres estudios (18, 22, 26), de los cuales las articulaciones más comúnmente afectadas fueron el codo (57%), cadera (32%), sofocante (27%), hombro (8%), antebraquiocarpiano (2%) y coxofemeral (2%).
La raza del perro se informó en cinco estudios (18, 22, 24, 26, 27), siendo la raza de perro más común las razas de perros grandes, como Labrador Retriever (n = 19), pastor alemán (n = 8) y pastor australiano (n = 5). El peso promedio de los perros reportado en cuatro artículos fue de 28,14 kg (DE 11,99) (18, 22, 24, 27). La edad promedio de los perros informada en cinco estudios fue de 10,9 años (DE 2,86) (18, 22, 24, 26, 27).
Los productos de CBD investigados en los estudios incluidos variaron sustancialmente, es decir, aceite de CBD de espectro completo (n = 4) (18, 22, 24, 26), aceite de CBD aislado (n = 1) (27) y aceite de CBD liposomal (n = 1) (27). La vía de administración fue oral (n = 4) (18, 24, 26, 27) o transmucosa oral (n = 1) (22). Los productos de CBD se usaron solos (n = 2) (26, 27) o como parte de un tratamiento multimodal (n = 3) (18, 22, 24).
La dosis comúnmente utilizada de CBD fue de 2-2,5 mg/kg cada 12 h (n = 3) (18, 22, 26). Un estudio investigó los efectos del aceite de CBD oral de espectro completo de 0,25 mg / kg una vez al día con un aumento de la dosis a 0,50-0,75 mg / kg cada 12 h (24). La duración del tratamiento varió de 4 a 12 semanas.
3.3. Evaluación de la calidad
La evaluación de la calidad se presenta en el cuadro suplementario S4. En general, se consideró que los cinco estudios tenían un alto riesgo de sesgo, ya que al menos un dominio se calificó como de alto riesgo de sesgo. Los ECA cruzados (crossover) se calificaron principalmente como de alto riesgo de sesgo derivado del período de lavado y los efectos de arrastre, y la distribución desigual de las características iniciales (18, 26). Los ECA paralelos se calificaron principalmente como de alto riesgo de sesgo debido a la selección del resultado informado, la distribución desigual del valor inicial y la falta de cegamiento (22, 27). El estudio de un solo grupo se calificó como de alto riesgo de sesgo (11/12 puntos) debido a una evaluación sesgada del criterio de valoración del estudio y al cálculo prospectivo no informado del tamaño del estudio (24).
3.4. Eficacia y seguridad de los productos de CBD
Proporcionamos un resumen de los hallazgos de eficacia y seguridad de los productos de CBD en la Tabla Suplementaria S5. Las medidas de resultado generales de los estudios incluidos se agruparon en cuatro dominios: (1) dolor, (2) actividad y locomoción, (3) calidad de vida y (4) seguridad.
3.4.1. Dolor
Se seleccionaron varias herramientas de evaluación del dolor en los estudios; puntuación de gravedad del dolor (n = 1) (24), inventario breve de dolor canino (CBPI) (n = 3) (18, 22, 26), osteoartritis de Liverpool en perros (LOAD) (n = 1) (26) y puntuaciones de dolor evaluadas por veterinarios (n = 1) (18).
Se realizaron metanálisis para agrupar los tamaños del efecto de los productos de CBD en las puntuaciones de dolor de la misma medición informada en dos o más estudios. El análisis solo fue posible para la puntuación de gravedad del dolor (PSS) de CBPI y la puntuación de interferencia del dolor (PIS) de CBPI informadas en tres estudios (18, 22, 26), como se muestra en las figuras 2, 3. Los resultados de la evaluación del Consejo de Europa se muestran en el cuadro 2. CBPI contenía 11 dominios que cuestionaban a los dueños de perros para evaluar a sus perros en los últimos 7 días. CBPI se puede dividir en tres grupos principales de la pregunta; gravedad del dolor (PSS; 0-10): cuatro dominios para evaluar el dolor de la mascota, la interferencia del dolor con la función (PIS; 0-10): seis dominios para evaluar la actividad general y la calidad de vida (0-5): un dominio para evaluar la calidad de vida general del perro (38). El CBPI PSS y el CBPI PIS informados en una escala de 0-40 y 0-60 se convirtieron en una escala de 0-10 dividiendo los puntajes por 4 y 6, respectivamente.
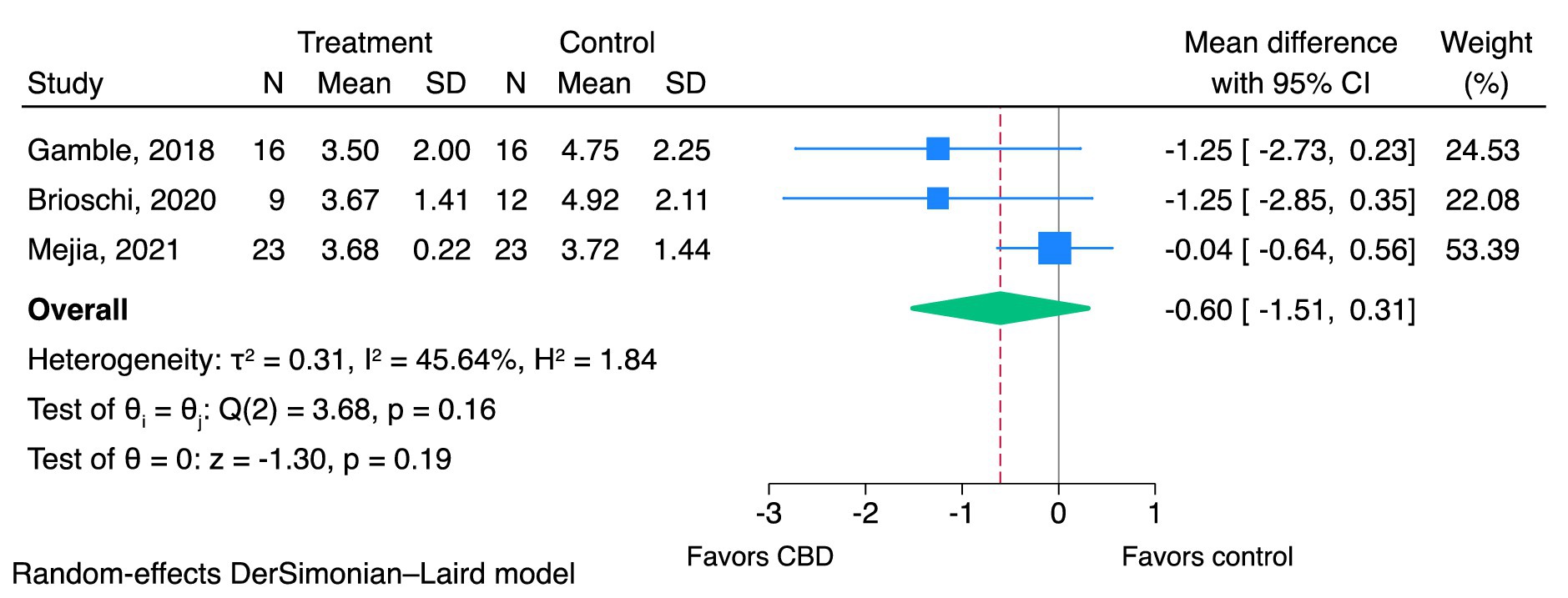 Figura 2. Efectos del CBD sobre la gravedad del dolor usando CBPI-PSS (0-10). CBD: cannabidiol; CBPI: inventario breve de dolor canino; PSS: puntuación de gravedad del dolor.
Figura 2. Efectos del CBD sobre la gravedad del dolor usando CBPI-PSS (0-10). CBD: cannabidiol; CBPI: inventario breve de dolor canino; PSS: puntuación de gravedad del dolor.
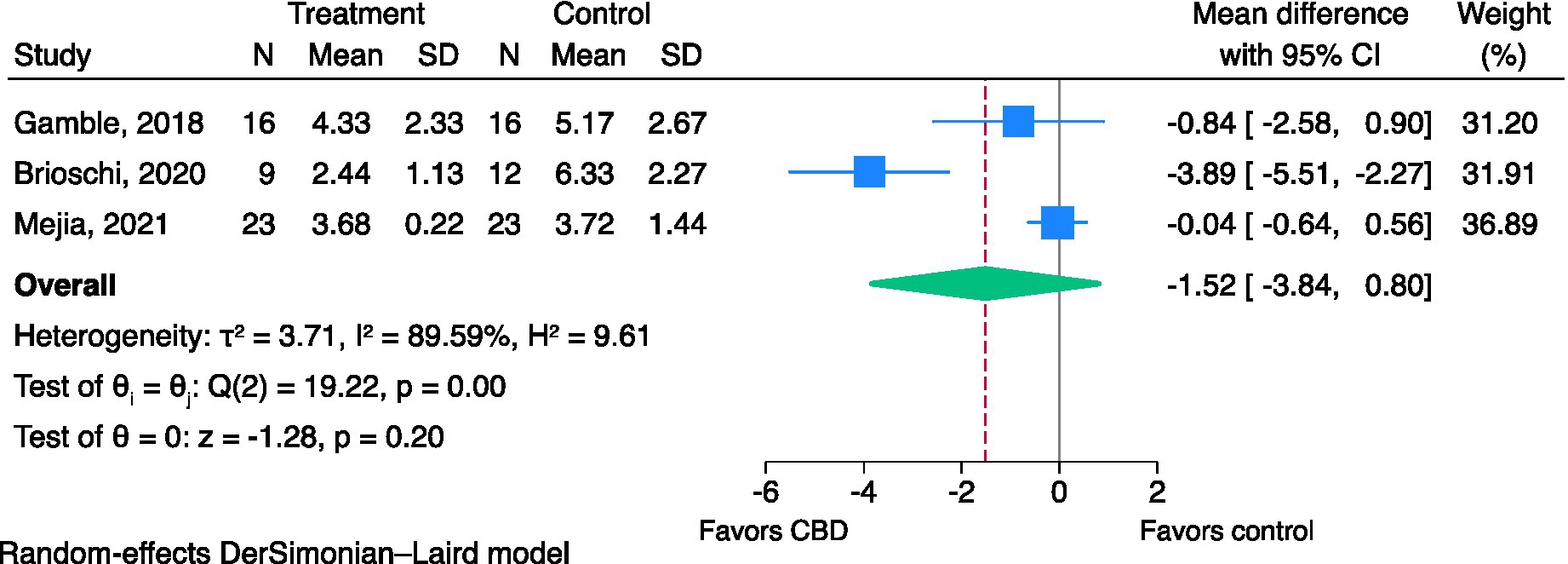 Figura 3. Efectos del CBD sobre la interferencia del dolor usando CBPI-PIS (0-10). CBD: cannabidiol; CBPI: inventario breve de dolor canino; PIS: puntuación de interferencia del dolor.
Figura 3. Efectos del CBD sobre la interferencia del dolor usando CBPI-PIS (0-10). CBD: cannabidiol; CBPI: inventario breve de dolor canino; PIS: puntuación de interferencia del dolor.
3.4.1.1. Puntuaciones de la gravedad del dolor
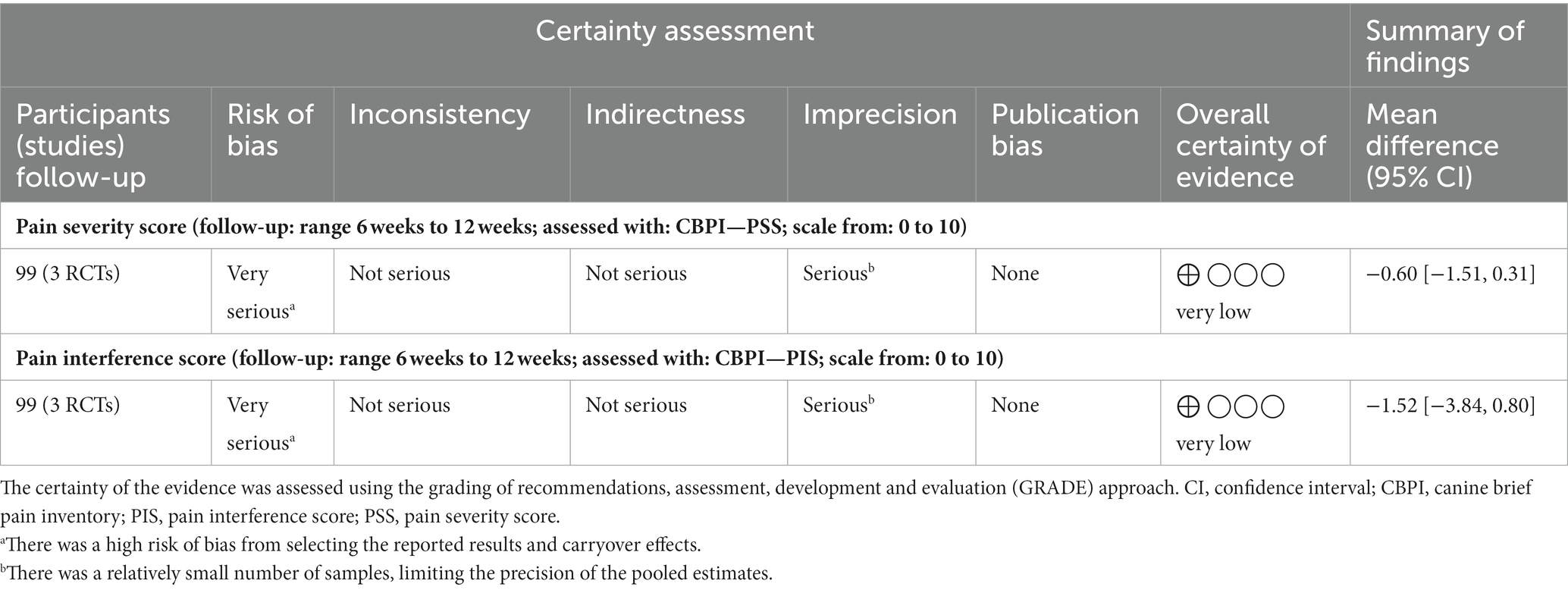
Se incluyeron tres estudios en el metanálisis (18, 22, 26). El CBD puede reducir las puntuaciones de gravedad del dolor, pero la evidencia es muy incierta (CoE muy bajo; MD de CBPI PSS; -0,60, IC del 95%; −1,51 a 0,31, I2 = 45,64%, p = 0,19, Figura 2). La prueba de Egger (p = 0,06) no indicó evidencia de efectos de estudios pequeños. El I2 El valor indicó heterogeneidad moderada entre los tres estudios. No se realizaron metanálisis de sensibilidad, ya que los tres estudios se calificaron como de alto riesgo de sesgo.
Los efectos de los productos de CBD en otras puntuaciones de gravedad del dolor fueron los siguientes. Gamble et al. revelaron que los perros con OA en el grupo de aceite de CBD de espectro completo con el grupo de atención estándar no mostraron una mejora significativa en las puntuaciones de dolor evaluadas por los veterinarios, en comparación con el grupo de atención estándar (18). Kogan et al. (24) encontraron que el aceite de CBD de espectro completo redujo significativamente las puntuaciones de gravedad del dolor en 2,23 unidades (DE 2,3) desde el inicio. Mejia et al. (26) encontraron que los perros con OA en el grupo de aceite de CBD de espectro completo en comparación con el grupo placebo no mostraron una diferencia estadísticamente significativa en términos de LOAD.
3.4.1.2. Puntuaciones de interferencia del dolor
Se incluyeron tres estudios en el metanálisis (18, 22, 26). El CBD puede reducir las puntuaciones de interferencia del dolor, pero la evidencia es muy incierta (CoE muy bajo: DM de CBPI PIS; -1,52; IC del 95%; -3,84 a 0,80, I2 = 89,59%, p = 0,20, Figura 3). La prueba de Egger (p = 0,44) no indicó evidencia de efectos de estudios pequeños. El I2 El valor indicó una heterogeneidad considerable. No se realizaron metanálisis de sensibilidad, ya que los tres estudios se calificaron como de alto riesgo de sesgo.
3.4.2. Actividad y locomoción
La actividad y la locomoción se midieron como recuento de actividad total y análisis objetivo de la marcha (medido como % de fuerza vertical máxima normalizada por el peso corporal y el % de distribución del peso corporal) en un estudio (26), puntuaciones de cojera evaluadas por veterinarios y puntuaciones de soporte de peso en un estudio (18). Sin embargo, no se observó ningún cambio estadísticamente significativo en la actividad y la locomoción entre el grupo de CBD y el grupo de control en estos estudios.
3.4.3. Calidad de vida
La calidad de vida se informó en un estudio, que encontró que los perros con OA en el grupo de aceite de CBD de espectro completo transmucoso oral más el grupo de atención estándar tenían un índice de calidad de vida más alto que el grupo de atención estándar. Sin embargo, esta diferencia no fue estadísticamente significativa (22).
3.4.4. Seguridad
3.4.4.1. Parámetros de laboratorio
No hubo cambios significativos en los parámetros de laboratorio, como el hemograma completo, la prueba de función renal o el panel metabólico, entre los perros con OA en el grupo de CBD y el grupo de control en cuatro estudios (18, 22, 27).
No se observaron cambios en las enzimas hepáticas en tres estudios (22, 27). Sin embargo, se observó una elevación significativa de las enzimas hepáticas en tres estudios (18, 24, 26). El aceite de CBD de espectro completo aumentó significativamente los niveles de fosfatasa alcalina (ALP) de 133.3 U / L al inicio del estudio a 264 U / L en la semana 12, que fue más alto que los valores normales (24). El grupo de aceite de CBD de espectro completo más el grupo de atención estándar tuvo niveles de ALP más altos que el grupo de atención estándar en la semana 4 (323 U / L frente a 175 U / L) (18). Por último, 14 perros en el grupo de aceite de CBD de espectro completo experimentaron una elevación en los niveles de ALP en comparación con un perro en el grupo placebo (61% frente a 4%). Entre los 14 perros, seis habían aumentado los niveles de alanina aminotransferasa (ALT) y tres habían aumentado los niveles de aspartato aminotransferasa (AST). Ninguno de estos perros mostró síntomas clínicos, y el tratamiento concomitante se continuó sin más eventos adversos informados por el propietario (26).
3.4.4.2. Acontecimientos adversos
Los eventos adversos se informaron en tres estudios (22, 26). Los productos de CBD fueron generalmente bien tolerados, con efectos secundarios gastrointestinales leves o ausentes. Brioschi et al. (22) informaron que los perros experimentaron un ptialismo mínimo (2/9, 22%), somnolencia y ataxia leve (1/9, 11%), al recibir aceite de CBD de espectro completo transmucoso oral más el estándar de atención (22). Se notificaron vómitos leves (1/24, 4%) y vómitos que llevaron a la interrupción del tratamiento (1/24, 4%) en perros que recibieron aceite de CBD de espectro completo (26).
4. Discusión
El CBD, un compuesto no psicotrópico que se encuentra en la planta Cannabis sativa L., se ha estudiado con la esperanza de encontrar un tratamiento alternativo para la OA canina. Se realizó una revisión sistemática y un metanálisis para evaluar la eficacia y la seguridad de los productos de CBD en perros con OA. Se identificaron un total de cinco estudios que evaluaron una amplia gama de productos de CBD, incluido el aceite de CBD oral de espectro completo, el aceite de CBD de espectro completo transmucoso oral, el aceite de CBD aislado y el aceite de CBD liposomal. La duración del tratamiento para estos productos varió de 4 a 12 semanas.
Los productos de CBD pueden diferir mucho. Los productos de CBD utilizados en el estudio variaron de las formulaciones de CBD de espectro completo, que contienen otras sustancias activas con efecto sinérgico (39). Esto contrasta con las formulaciones aisladas de CBD que solo contienen CBD (18). Además, las diferentes vías de administración de CBD pueden afectar su biodisponibilidad y absorción. En comparación con la vía oral, la vía transmucosa oral puede reducir el metabolismo de primer paso del CBD y elevar los niveles plasmáticos de CBD en los perros participantes, lo que aumenta su efecto antiinflamatorio en las articulaciones lesionadas y se asocia con mejoras en el control del dolor (22).
Los metanálisis de tres estudios encontraron que el CBD puede reducir las puntuaciones de dolor, pero la evidencia es muy incierta. Hubo un alto riesgo de sesgo al seleccionar los resultados informados y los efectos de arrastre y un número relativamente pequeño de muestras, lo que limitó la precisión de las estimaciones agrupadas. Estos indicaron la necesidad de ensayos clínicos de alta calidad para investigar más a fondo el papel del CBD en el control del dolor en perros con OA.
De acuerdo con el tratamiento de la OA canina en la práctica clínica, necesita tratamiento multimodal, incluyendo fisioterapia, AINE (para el dolor agudo en pacientes crónicos con OA), gabapentina/amitriptilina (para el tratamiento de la alodinia y como tratamiento adyuvante para el dolor) y nutracéuticos (ácidos grasos omega-3) (5). En algunos estudios, se permitió que los perros fueran tratados con terapia multimodal (18, 22, 24). Estas cointervenciones pueden afectar los resultados del tratamiento. Como se muestra en los metaanálisis en las Figuras 2, 3, los estudios de CBD con un tratamiento multimodal (18, 22) mostraron una tendencia a que hubo una magnitud relativamente mayor de la reducción de las puntuaciones de dolor que un estudio de monoterapia con aceite de CBD (26). La administración concomitante de CBD y AINE puede resultar en una duración prolongada de los efectos del CBD. Esto se debe a la participación de la ciclooxigenasa tipo 2 (COX-2) en el metabolismo del CBD. Por lo tanto, los AINE que inhiben selectivamente la COX-2 pueden impedir la descomposición del CBD, lo que lleva a una mayor duración de su actividad farmacológica (40). No obstante, hasta donde sabemos, no hubo ningún estudio en perros que investigara la interacción entre el CBD y la gabapentina, la amitriptilina, el aceite de pescado, el sulfato de glucosamina y el sulfato de condroitina.
El CBD generalmente se considera seguro y bien tolerado, con pocos eventos adversos leves observados, como vómitos. Aunque los niveles de fosfatasa alcalina habían aumentado anormalmente, no se observaron los síntomas adversos clínicos relacionados con ese valor anormal. Además, los niveles de ALT permanecieron sin cambios, apoyando la falta de daño hepatocelular. Por lo tanto, no se puede determinar el potencial hepatotóxico del CBD (18, 24, 26). El aumento de los niveles de ALP podría estar asociado con la inducción del metabolismo oxidativo mediado por el citocromo P-450 del hígado como resultado de recibir extracto de Cannabis spp. (41, 42).
Debido al aumento de los niveles de ALP sin aumento de ALT, no se pueden descartar otras causas asociadas, como colestasis o una progresión de la hiperplasia nodular regenerativa de la vida (18). Por otro lado, el uso concurrente de AINE también podría desempeñar un papel en la elevación de la fosfatasa alcalina. Ocho de los trece perros que recibieron terapia concomitante con AINE durante todo el período de estudio habían aumentado significativamente en los niveles de ALP durante la administración de CBD (26). Aunque la interacción entre el CBD y los AINE no se ha estudiado en perros, se encontró que los AINE están asociados con la elevación de las enzimas hepáticas en perros (6). Los estudios futuros deben centrarse en las enzimas de la función hepática durante un período más largo.
Los hallazgos de esta revisión sistemática y metanálisis deben interpretarse bajo las siguientes limitaciones. Hubo un número relativamente pequeño de perros participantes en los estudios clínicos que podrían no ser suficientes para establecer completamente la eficacia clínica del CBD en el tratamiento de la OA canina. Hubo heterogeneidad en cuanto a los diferentes diseños de investigación entre los estudios incluidos. Los diferentes diseños de estudio (cruzado, paralelo, brazo único), sin rodaje antes de comenzar el ensayo, variando el período de lavado en el estudio cruzado (sin período de lavado y 2 semanas), usando diferentes concentraciones de CBD (menos de 1 mg / kg, 2 mg / kg y 2.5 mg / kg), usando diferentes formas de dosificación (aceite oral, transmucoso y tableta), permiten un tratamiento coexistente (AINE, corticosteroides, Gabapentina, amitriptilina, aceite de pescado, glicosaminoglicanos polisulfatados, sulfato de glucosamina, sulfato de condroitina y acupuntura), duración del estudio (de 4 a 12 semanas) y el uso de un enfoque diferente para cuantificar el resultado primario (informe subjetivo de las puntuaciones de dolor por parte de los dueños de perros, análisis objetivo de la marcha, uso de diferentes mediciones del dolor) entre los cinco estudios incluidos. Además, todos los estudios incluidos se calificaron como de alto riesgo de sesgo, lo que afectó la credibilidad de los hallazgos de los estudios individuales.
Los hallazgos de este estudio pueden alentar el uso clínico potencial y respaldar la comercialización de CBD en el futuro. Sin embargo, se necesita más investigación con un diseño adecuado para proporcionar mejores pruebas más sólidas de la eficacia y seguridad del CBD y facilitar la realización de un metanálisis actualizado en el futuro. Por lo tanto, propusimos algunas características a considerar en los estudios clínicos de productos de CBD. En primer lugar, se prefiere un ensayo paralelo a un ensayo cruzado para evitar el efecto de arrastre. Debido a que todavía no había estudios farmacocinéticos de estado estacionario a largo plazo en perros para determinar un período de lavado apropiado para garantizar la eliminación del CBD, la realización del ensayo cruzado puede plantear un mayor riesgo de efecto de arrastre que el ensayo paralelo. En segundo lugar, se debe intentar enmascarar el olor único del CBD para garantizar el cegamiento del tratamiento para evitar el sesgo de determinación. Por último, se prefieren las medidas objetivas, como el análisis de la marcha de la placa de fuerza (43) y la imagen térmica infrarroja (44), sobre las medidas subjetivas para demostrar la eficacia clínica del CBD
5. Conclusión
El CBD se considera seguro para tratar perros con OA a corto plazo. El CBD puede reducir las puntuaciones de dolor, pero la evidencia es muy incierta para concluir su eficacia clínica. Se necesitan ensayos controlados aleatorios de alta calidad para evaluar más a fondo las funciones del CBD en el tratamiento de la OA canina, especialmente la eficacia a largo plazo. Se recomienda la farmacovigilancia después del lanzamiento inicial del producto para controlar el perfil de seguridad de los productos de CBD
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo / material complementario, las consultas adicionales pueden dirigirse al autor correspondiente.
Contribuciones del autor
CP y PA conceptualizaron el estudio. KL, KM y KW desarrollaron el protocolo de revisión y realizaron la revisión sistemática bajo supervisión de CP, ON, KS y PA. CP realizó análisis estadísticos. CP, KL, KM y KW escribieron el primer borrador del manuscrito. PA, ON y KS revisaron, revisaron y aprobaron la publicación del manuscrito. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Financiación
Este estudio está financiado por el Fondo Ratchadapiseksompotch de la Universidad Chulalongkorn, ReinUni_65_01_33_29. Los financiadores no tuvieron ningún papel en el diseño del estudio, la recopilación de datos, el análisis de datos, la interpretación de datos, la redacción del informe o la decisión de enviarlo para su publicación.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1248417/full#supplementary-material
Referencias
1. Anderson, KL, Zulch, H, O’Neill, DG, Meeson, RL y Collins, LM. Factores de riesgo para la osteoartritis canina y sus artropatías predisponentes: una revisión sistemática. Front Vet Sci. (2020) 7:220. DOI: 10.3389/FVETS.2020.00220
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Cachon, T, Frykman, O, Innes, J, Lascelles, B, Okumura, M, Sousa, P, et al. Validez facial de una herramienta propuesta para la estadificación de la artrosis canina: Canine OsteoArthritis Staging Tool (COAST). Veterinario J. (2018) 235:1–8. doi: 10.1016/j.tvjl.2018.02.017
3. Clements, DN, Carter, SD, Innes, JF y Ollier, WE. Bases genéticas de la artrosis secundaria en perros con displasia articular. Am J Vet Res. (2006) 67:909–18. doi: 10.2460/ajvr.67.5.909
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Pettitt, RA, y German, AJ. Investigación y manejo de la artrosis canina. En la práctica. (2015) 37:1–8. DOI: 10.1136/inp.h5763
5. Monteiro, B, Lascelles, B, Murrell, J, Robertson, S, Steagall, P, and Wright, B. 2022 WSAVA guidelines for the recognition, assessment and treatment of pain. J Small Anim Pract. (2023) 64:177–254. doi: 10.1111/jsap.13566
6. Monteiro-Steagall, B, Steagall, P, and Lascelles, B. Systematic review of nonsteroidal anti-inflammatory drug-induced adverse effects in dogs. J Vet Intern Med. (2013) 27:1011–9. doi: 10.1111/jvim.12127
7. Fritsch, DA, Allen, TA, Dodd, CE, Jewell, DE, Sixby, KA, Leventhal, PS, et al. A multicenter study of the effect of dietary supplementation with fish oil omega-3 fatty acids on carprofen dosage in dogs with osteoarthritis. J Am Vet Med Assoc. (2010) 236:535–9. doi: 10.2460/javma.236.5.535
8. Barbeau-Grégoire, M, Otis, C, Cournoyer, A, Moreau, M, Lussier, B, and Troncy, E. A 2022 systematic review and meta-analysis of enriched therapeutic diets and nutraceuticals in canine and feline osteoarthritis. Int J Mol Sci. (2022) 23:10384. doi: 10.3390/ijms231810384
9. Hazzah, T, André, CM, Richter, G, and Mcgrath, S Cannabis in veterinary medicine: a critical review. AHVMA. (2020). 61:25.
10. Atwood, BK, and Mackie, K. CB2: a cannabinoid receptor with an identity crisis. Br J Pharmacol. (2010) 160:467–79. doi: 10.1111/j.1476-5381.2010.00729.x
11. Hinz, B, and Ramer, R. Anti-tumour actions of cannabinoids. Br J Pharmacol. (2019) 176:1384–94. doi: 10.1111/bph.14426
12. Mcgrath, S, Bartner, LR, Rao, S, Packer, RA, and Gustafson, DL. Randomized blinded controlled clinical trial to assess the effect of oral cannabidiol administration in addition to conventional antiepileptic treatment on seizure frequency in dogs with intractable idiopathic epilepsy. J Am Vet Med Assoc. (2019) 254:1301–8. doi: 10.2460/javma.254.11.1301
13. Zanelati, T, Biojone, C, Moreira, F, Guimarães, FS, and Joca, SRL. Antidepressant-like effects of cannabidiol in mice: possible involvement of 5-HT1A receptors. Br J Pharmacol. (2010) 159:122–8. doi: 10.1111/j.1476-5381.2009.00521.x
14. Association of American Feed Control Officials . (2020). AAFCO guideline on hemp in animal food. Available at: https://www.aafco.org/Portals/0/SiteContent/Announcements/Guidelines_on_Hemp_in_Animal_Food_July_2020.pdf
15. Herkenham, M, Lynn, AB, Little, MD, Johnson, MR, Melvin, LS, De Costa, BR, et al. Cannabinoid receptor localization in brain. Proc Natl Acad Sci. (1990) 87:1932–6. doi: 10.1073/pnas.87.5.1932
16. Pertwee, RG . Cannabinoid receptors and pain. Prog Neurobiol. (2001) 63:569–611. doi: 10.1016/S0301-0082(00)00031-9
17. Valastro, C, Campanile, D, Marinaro, M, Franchini, D, Piscitelli, F, Verde, R, et al. Characterization of endocannabinoids and related acylethanolamides in the synovial fluid of dogs with osteoarthritis: a pilot study. BMC Vet Res. (2017) 13:309. doi: 10.1186/s12917-017-1245-7
18. Gamble, LJ, Boesch, JM, Frye, CW, Schwark, WS, Mann, S, Wolfe, L, et al. Pharmacokinetics, safety, and clinical efficacy of cannabidiol treatment in osteoarthritic dogs. Front Vet Sci. (2018) 5:165. doi: 10.3389/fvets.2018.00165
19. Garrett, ER, y Hunt, CA. Propiedades fisicoquímicas, solubilidad y unión a proteínas de Δ9-tetrahidrocannabinol. J Pharm Sci. (1974) 63:1056–64. DOI: 10.1002/jps.2600630705
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Samara, E, Bialer, M, y Mechoulam, R. Pharmacokinetics of cannabidiol in dogs. Medicamentos Metab Dispos. (1988) 16:469–72.
21. Di Salvo, A, Conti, MB, y Della Rocca, G. Pharmacokinetics, efficacy, and safety of cannabidiol in dogs: an update of current knowledge. Front Vet Sci. (2023) 10:1204526. DOI: 10.3389/FVETS.2023.1204526
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Brioschi, FA, Di Cesare, F, Gioeni, D, Rabbogliatti, V, Ferrari, F, D’urso, ES, et al. Formulación oral de aceite de cannabidiol transmucoso como parte de un régimen analgésico multimodal: efectos sobre el alivio del dolor y la mejora de la calidad de vida en perros afectados por osteoartritis espontánea. Animales. (2020) 10:10. DOI: 10.3390/ANI10091505
23. Gabriele, V, Bisanzio, D, Riva, A, Meineri, G, Adami, R, and Martello, E. Long-term effects of a diet supplement containing Cannabis sativa oil and Boswellia serrata in dogs with osteoarthritis following physiotherapy treatments: a randomized, placebo-controlled and double-blind clinical trial. Nat Prod Res. (2022) 37:1782–6. doi: 10.1080/14786419.2022.2119967
24. Kogan, L, Hellyer, P, y Downing, R. El uso de extracto de aceite de cáñamo rico en cannabidiol para tratar el dolor relacionado con la osteoartritis canina: un estudio piloto. J Am Holist Vet Med Assoc. (2020) 58:35–45.
25. Martello, E, Biasibetti, E, Bigliati, M, Meineri, G, and Bruni, N. Preliminary results on the efficacy of a dietary supplement combined with physiotherapy in dogs with osteoarthritis on biomarkers of oxidative stress and inflammation. Ital J Anim Sci. (2021) 20:2131–3. doi: 10.1080/1828051X.2021.2004249
26. Mejia, S, Duerr, FM, Griffenhagen, G, and Mcgrath, S. Evaluation of the effect of cannabidiol on naturally osteoarthritis-associated pain: a pilot study in dogs. J Am Anim Hosp Assoc. (2021) 57:81–90. doi: 10.5326/JAAHA-MS-7119
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Verrico, CD, Wesson, S, Konduri, V, Hofferek, CJ, Vazquez-Perez, J, Blair, E, et al. Un estudio aleatorizado, doble ciego, controlado con placebo de cannabidiol diario para el tratamiento del dolor de la osteoartritis canina. Dolor. (2020) 161:2191–202. doi: 10.1097/j.pain.0000000000001896
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. De Briyne, N, Holmes, D, Sandler, I, Stiles, E, Szymanski, D, Moody, S, et al. Cannabis, aceites de cannabidiol y tetrahidrocannabinol: ¿qué necesitan saber los veterinarios? Animales. (2021) 11:892. DOI: 10.3390/ANI11030892
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Hartsel, JA, Boyar, K, Pham, A, Silver, RJ y Makriyannis, A (2019). Cannabis en Medicina Veterinaria: Terapias Cannabinoides para Animales. En: Gupta R, Srivastava A, Lall R editors. Nutracéuticos en medicina veterinaria. Springer: Cham. 121–155 DOI: 10.1007/978-3-030-04624-8_10
30. Patikorn, C, Anantachoti, P, Nerapusee, O, Soontornvipart, K, Waleethanaphan, K, Lawonyawut, K, et al. (2023). Efficacy and safety of cannabidiol for the treatment of canine osteoarthritis: a systematic review and meta-analysis of animal intervention studies. PROSPERO Available at: https://www.crd.york.ac.uk/prospero/display_record.php?RecordID=381113. (Accessed June 5, 2023).
31. Higgins, JP, Thomas, J, Chandler, J, Cumpston, M, Li, T, Page, MJ, et al. (editores). Manual Cochrane para Revisiones Sistemáticas de Intervenciones versión 6.4. Cochrane (2023). Disponible en: https://www.training.cochrane.org/handbook
32. Page, MJ, Mckenzie, JE, Bossuyt, PM, Boutron, I, Hoffmann, TC, Mulrow, CD, et al. La declaración PRISMA 2020: una guía actualizada para informar revisiones sistemáticas. BMJ. (2021) 372:N71. doi: 10.1136/bmj.n71
33. Hooijmans, CR, Rovers, MM, De Vries, RB, Leenaars, M, Ritskes-Hoitinga, M, y Langendam, MW. Herramienta de riesgo de sesgo de SYRCLE para estudios en animales. BMC Med Res Methodol. (2014) 14:43. doi: 10.1186/1471-2288-14-43
34. Slim, K, Nini, E, Forestier, D, Kwiatkowski, F, Panis, Y, and Chipponi, J. Índice metodológico para estudios no aleatorizados (MINORS): desarrollo y validación de un nuevo instrumento. ANZ J Surg. (2003) 73:712–6. doi: 10.1046/j.1445-2197.2003.02748.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Dersimonian, R, y Laird, N. Meta-análisis en ensayos clínicos. Ensayos de control Clin. (1986) 7:177–88. doi: 10.1016/0197-2456(86)90046-2
36. Egger, M, Davey Smith, G, Schneider, M, and Minder, C. Bias in meta-analysis detected by a simple, graphical test. BMJ. (1997) 315:629–34. doi: 10.1136/bmj.315.7109.629
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Atkins, D, Best, D, Briss, PA, Eccles, M, Falck-Ytter, Y, Flottorp, S, et al. Calificar la calidad de la evidencia y la solidez de las recomendaciones. BMJ. (2004) 328:1490. doi: 10.1136/bmj.328.7454.1490
38. Brown, DC, Boston, RC, Coyne, JC, y Farrar, JT. Ability of the canine brief pain inventory to detect response to treatment in dogs with osteoarthritis. J Am Vet Med Assoc. (2008) 233:1278–83. doi: 10.2460/javma.233.8.1278
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Marinotti, O, y Sarill, M. Differentiating full-spectrum hemp extracts from CBD isolates: implications for policy, safety and science. J Dieta Suppl. (2020) 17:517–26. doi: 10.1080/19390211.2020.1776806
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Kozak, KR, Crews, BC, Morrow, JD, Wang, L-H, Ma, YH, Weinander, R, et al. Metabolismo de los endocannabinoides, 2-araquidonilglicerol y anandamida, en ésteres de glicerol de prostaglandina, tromboxano y prostaciclina y etanolamidas. J Biol Chem. (2002) 277:44877–85. DOI: 10.1074/JBC. M206788200
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Bornheim, LM, y Correia, MA. Efecto del cannabidiol sobre las isoenzimas del citocromo P-450. Biochem Pharmacol. (1989) 38:2789–94. doi: 10.1016/0006-2952(89)90432-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. Khanna, P, Gupta, M, Gupta, G, Sanwal, G, and Ali, B. Influence of chronic oral intake of Cannabis extract on oxidative and hydrolytic metabolism of xenobiotics in rat. Biochem Pharmacol. (1991) 41:109–13. doi: 10.1016/0006-2952(91)90017-Y
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Brown, D, Boston, R, and Farrar, J. Comparison of force plate gait analysis and owner assessment of pain using the canine brief pain inventory in dogs with osteoarthritis. J Vet Pasante Med. (2013) 27:22–30. DOI: 10.1111/JVIM.12004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: Cannabis sativa , cannabidiol, osteoartritis canina, perros, dolor
Cita: Patikorn C, Nerapusee O, Soontornvipart K, Lawonyawut K, Musikpodok K, Waleethanaphan K y Anantachoti P (2023) Eficacia y seguridad del cannabidiol para el tratamiento de la osteoartritis canina: una revisión sistemática y metanálisis de estudios de intervención en animales. Frente. Vet. Sci. 10:1248417. doi: 10.3389/fvets.2023.1248417
Recibido: 27 de junio de 2023; Aprobado: 31 de agosto de 2023;
Publicado: 15 septiembre 2023.
Editado por:
Pablo E. Otero, Universidad de Buenos Aires, Argentina
Revisado por:
Pablo Alejandro Donati, Clínica Veterinaria UCIcoop, Argentina
Nadia Crosignani Outeda, Universidad de la República, Uruguay
Copyright © 2023 Patikorn, Nerapusee, Soontornvipart, Lawonyawut, Musikpodok, Waleethanaphan y Anantachoti. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Puré Anantachoti, puree.a@pharm.chula.ac.th
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía