El agotamiento de residuos multicomponentes de Gelsemium elegans en tejidos, orina y plasma de cerdos
El agotamiento de residuos multicomponentes de Gelsemium elegans en tejidos, orina y plasma de cerdos
 Yong Wu1
Yong Wu1  Xue-Ming Long2
Xue-Ming Long2  Gao-Feng Liu3
Gao-Feng Liu3  Xia Bai1
Xia Bai1  Sol Zhi-Liang1*
Sol Zhi-Liang1*  Zhao-Ying Liu1*
Zhao-Ying Liu1*- 1Facultad de Medicina Veterinaria, Universidad Agrícola de Hunan, Changsha, Hunan, China
- 2Instituto Provincial de Medicamentos Veterinarios y Control de Piensos de Hunan, Changsha, Hunan, China
- 3Hunan Canzoho Biological Technology Co., Ltd., Liuyang, Hunan, China
Introducción: Gelsemium elegans (G. elegans) como planta medicinal tradicional utilizada en la producción ganadera. El uso de G. elegans en clínicas veterinarias puede plantear riesgos para la salud humana.
Objetivos: El objetivo de este estudio fue investigar la depleción de residuos tisulares en cerdos alimentados con polvo de G. elegans.
Métodos: Se desarrolló por primera vez un método de cuantificación preciso y un método de semicuantificación simultáneo para múltiples componentes independientemente de los patrones en tejidos de cerdo. Los dos métodos fueron validados en términos de especificidad, LOD, LOQ, linealidad, exactitud, precisión y efectos de matriz. A continuación, se aplicaron a un estudio de agotamiento de residuos tisulares después de que se administrara a los cerdos con polvo de G. elegans a una dosis del 2% por kg de alimento.
Resultados: En comparación con la cuantificación precisa, los resultados de la validación del método indicaron que el método de semicuantificación era fiable y aceptable para la cuantificación multicomponente independientemente de los estándares. Muchos alcaloides de G. elegans están ampliamente distribuidos en la mayoría de los tejidos de los cerdos. Los estudios de agotamiento de residuos tisulares indicaron que la 14-hidroxigelenicina, la 11-hidroxigelenicina y la gelemoxonina podrían utilizarse como posibles marcadores de residuos, y que el páncreas, el intestino delgado y los tejidos pulmonares podrían considerarse como posibles tejidos diana de residuos de G. elegans. Además, tanto la orina como el plasma podrían utilizarse para predecir los residuos de 14-hidroxigelenicina y gelemoxonina en el hígado, el páncreas y los tejidos del intestino delgado de los cerdos.
Conclusión: El método de semicuantificación desarrollado se puede aplicar para monitorear la aplicación y el residuo de G. elegans. Los resultados proporcionan evidencia científica para evaluar la seguridad de los alimentos de origen animal de G. elegans para los consumidores y serán útiles para su aplicación y desarrollo futuro.
Introducción
Los aditivos fitogénicos para piensos (PFA) son productos de origen vegetal que se utilizan a menudo en la alimentación animal para mejorar el rendimiento del ganado en la agricultura (1, 2). Los PFA se utilizan principalmente en la producción ganadera en China debido a sus efectos clínicos, como las actividades antioxidantes (3-6) y antibacterianas (1, 2, 7, 8), y la promoción de la eficacia de la promoción de la actividad intestinal (9-11). El problema potencial de los residuos de PFA, en particular los que contienen componentes tóxicos, ha atraído una amplia atención en los últimos años. Sin embargo, todavía hay poca investigación sistemática y científica sobre el riesgo potencial que los residuos de PFA representan para la inocuidad de la producción de alimentos. Los residuos tóxicos de los PFA pueden entrar en el cuerpo humano a través del consumo de productos alimenticios de origen animal o cadenas ecológicas, lo que provoca posibles riesgos de seguridad para la salud humana.
Gelsemium elegans Benth. (G. elegans) es una enredadera leñosa de hoja perenne del género Gelsemium de la familia Loganiaceae, distribuida en áreas aguas abajo del río Yangtze como Guangxi, Guangdong y Fujian (12-14). Como medicina tradicional china, G. elegans tiene efectos terapéuticos farmacológicos sobre el dolor reumatoide y neuropático (15). La estrecha ventana terapéutica limita su uso clínico en medicina humana. Algunos estudios han intentado ampliar la ventana terapéutica demostrando un mecanismo positivo en el tratamiento del cáncer. En los últimos años, muchos investigadores han estudiado los efectos de la dieta de G. elegans en cerdos (16, 17), cabras (18) y peces (19). Los resultados mostraron que G. elegans podía promover el crecimiento del ganado. También se registró en el antiguo compendio de materia médica y en la farmacopea veterinaria china (edición de 2020). Actualmente, G. elegans se utiliza como PFA en clínicas veterinarias en China. Gelsemium elegans es bien conocido por su extrema toxicidad. Recientemente, ha habido informes de envenenamiento y muerte en China debido al consumo inadvertido de G. elegans por la identificación errónea de esta planta tóxica (20, 21). El uso de G. elegans en clínicas veterinarias puede plantear riesgos para la salud humana y animal. Por lo tanto, es necesario investigar el residuo tisular de G. elegans en animales destinados a la alimentación, lo que favorece la protección de la seguridad alimentaria y la salud humana.
La composición de G. elegans es muy compleja. Hasta la fecha, se han aislado e identificado 121 alcaloides de plantas de G. elegans, entre los cuales los alcaloides indoles se consideran los principales componentes activos (13, 14, 22, 23). Las diferentes estructuras químicas de los alcaloides indol han llevado a su división en seis categorías: tipo sarpagina, tipo koumina, tipo gelsedina, tipo humantenina y tipo yohimbane. La gelesmina (perteneciente al grupo de tipo gelsemina), la koumina (perteneciente al grupo de tipo koumina) y la gelsenicina (perteneciente al grupo de tipo gelsedina) son los principales componentes de G. elegans (14, 24). Entre ellos, la abundancia relativa de gelsemina fue la más alta, con ~0,67%, la koumina estaba en el medio y el contenido de gelsenicina fue el más bajo y exhibió la mayor toxicidad. De acuerdo con las curvas de tiempo de fármaco de estos tres alcaloides, su absorción fue rápida en ratas, pero persistieron ciertas diferencias en sus características farmacocinéticas (25-27). Solo un estudio ha informado de la distribución tisular de la gelesmina en ratas, por lo que la gelesmina se distribuyó rápidamente al estómago, el bazo, los riñones, el cerebro, el hígado, el corazón y los pulmones después de la administración intravenosa. Además, la cantidad residual de gelsemina en el estómago y el bazo era alta, mientras que la del cerebro y el hígado era baja (25). Sin embargo, vale la pena señalar que, aunque se han logrado avances significativos en la comprensión de la distribución tisular de la gelesmina y las características farmacocinéticas de los alcaloides, la investigación actual sobre el agotamiento de los residuos de alcaloides de G. elegans en los tejidos animales está lejos de ser satisfactoria. Un solo componente o unos pocos ingredientes activos no pueden reflejar los ingredientes activos colectivos, las características o la eficacia de G. elegans. Este consenso no solo fue aceptado por un número cada vez mayor de farmacéuticos, sino que también estaba en línea con las características esenciales de un enfoque holístico del tratamiento.
El propósito de este estudio fue establecer un método de cuantificación preciso y un método de semicuantificación simultánea para múltiples componentes independientemente de los patrones en tejidos de cerdo por UPLC-MS/MS. A continuación, se aplicaron los dos métodos para el agotamiento de residuos de varios alcaloides de G. elegans en tejidos, orina y plasma de cerdos. Finalmente, se investigó la correlación entre los posibles marcadores de residuos entre tejidos y fluidos biológicos. Los resultados de este estudio proporcionan una base teórica para la aplicación clínica de G. elegans y para garantizar la seguridad alimentaria y la salud humana.
2. Experimental
2.1. Materiales y reactivos
La gelesmina (pureza ≥ 98%), la koumina (pureza ≥ 98%) y la gelsenicina (pureza ≥ 95%) se compraron a Shanghai Kang Biao Chemicals Co. LTD (distrito de Minhang, Shanghai, China). El metanol, el ácido fórmico y el acetonitrilo de grado cromatográfico se obtuvieron de Merck Chemicals Co. (Darmstadt, Alemania). El agua desionizada se preparó utilizando un sistema de purificación de agua Milli-Q (Millipore, Billerica, MA, EE. UU.). Todos los demás productos químicos y reactivos utilizados en los experimentos eran de grado analítico.
2.2. Recolección y pretratamiento de G. elegans
En total, se recolectaron 50 kg de toda la planta de G. elegans en la provincia de Fujian, China. Las muestras fueron autentificadas por el profesor asociado Qi Tang de la Universidad Agrícola de Hunan. Las muestras crudas de G. elegans se secaron y se molieron hasta convertirlas en polvo. A continuación, este polvo se pasó por un tamiz de malla 100 antes de mezclarlo con el pienso. La extracción y purificación de los alcaloides totales de Gelsemium (contenido superior al 80%) ha sido descrita en nuestro estudio previo (28, 29).
2.3. Preparación de la muestra
Se compraron muestras de tejido en blanco (músculo, hígado y riñones de cerdos) en mercados locales (Changsha, China) para obtener tejidos alcaloides libres de Gelsemium, que se utilizaron para las dos validaciones metodológicas. Los tejidos se homogeneizaron en un molinillo de alta velocidad y se almacenaron a -80 °C.
Después de descongelar y volver a temperatura ambiente, las muestras (2,00 ± 0,02 g) se pesaron con precisión en tubos de centrífuga de 50,0 ml. Se añadió acetonitrilo (10,0 mL) e inmediatamente se agitó en vórtice durante 60 s. A continuación, se añadieron 100,0 μL de ácido fórmico y se volvió a vortexizar, y la mezcla se extrajo a 40°C por ultrasonidos durante 30 min. El sobrenadante se transfirió a un tubo de centrífuga nuevo y se centrifugó a 8.000 rpm durante 5 min. Las muestras residuales se volvieron a extraer de la misma manera y se combinó el sobrenadante. A continuación, se evaporaron 10,0 mL del sobrenadante hasta la sequedad utilizando nitrógeno a 35 °C. Se añadieron al tubo aproximadamente 1,0 mL de metanol/ácido fórmico al 0,1% de agua (10:90, v/v) y N-hexano (0,5 mL), y la mezcla se agitó en vórtice durante 30 s. A continuación, la solución se centrifugó a 10.000 rpm durante 5 min. La capa inferior se extrajo con una jeringa de 1,0 mL y a través de una membrana microporosa de 0,22 μm. Posteriormente, se inyectaron 5,0 μL de la solución filtrada en el sistema UPLC-MS/MS para el análisis.
2.4. Preparación de soluciones patrón y curvas patrón adaptadas a matrices
Para una cuantificación precisa, se prepararon soluciones madre estándar (100,0 μg/L) de gelsemina, koumina y gelsenicina por separado en metanol puro. Las soluciones estándar de trabajo que contenían los tres alcaloides se diluyeron con metanol/ácido fórmico-agua al 0,10% (10:90, v/v) hasta un rango de concentración de 0,5 a 200 μg/L. Para el ensayo de semicuantificación, la solución de alcaloide total Gelsemium (1.000,0 μg/L) se preparó por separado en metanol puro y se almacenó a -80 °C en ausencia de luz. Las soluciones estándar de trabajo de los alcaloides totales de Gelsemium se prepararon recién preparadas en las concentraciones deseadas mediante la dilución en serie de las soluciones madre con metanol/ácido fórmico-agua al 0,10% (10:90, v/v).
Para las curvas estándar emparejadas con la matriz, se extrajo tejido en blanco como se describió anteriormente para obtener soluciones de matriz en blanco. A continuación, se obtuvieron soluciones estándar emparejadas con la matriz diluyendo consecutivamente la solución madre de alcaloides totales estándar o Gelsemium con soluciones de matriz en blanco a las concentraciones deseadas.
2.5. Condiciones UPLC-MS/MS
El análisis UPLC-MS/MS se realizó utilizando un sistema de cromatografía Shimadzu-30A (Shimadzu Co., Kyoto, Japón) y un espectrómetro de masas AB Sciex QTRAP 4500 (AB SCIEX, Framingham, EE. UU.). El sistema UPLC estaba equipado con un desgasificador DUG-30A5, una bomba binaria LC-30AD, un controlador de columna CTO-30A y un muestreador automático SIL-30AC. La separación se logró en una columna ACQUITY BEH C18 de Waters (2,1 mm × 100 mm, 1,7 μm) a un caudal constante de 0,3 ml/min a 35 °C. La separación cromatográfica deseable de los alcaloides se logró utilizando la fase móvil A (0,1% de ácido fórmico-agua) y la fase móvil B (acetonitrilo). El programa de elución en gradiente para la cuantificación precisa de los tres alcaloides (gelesmina, koumina y gelenicina) fue el siguiente: 0-2,0 min, 10% B; 2,0–6,0 min, 65 % B; 6,0–8,0 min, 65% B; y 8,0–10,0 min, 90% B. El volumen de inyección de la muestra fue de 20,0 μL. El programa de elución en gradiente para los alcaloides totales de Gelsemium (26 alcaloides) fue el siguiente: 0-1,5 min, 8% B; 1,5–10 min, 40% B; 10,1–12,0 min, 95 % B; y 12,1–14,0 min, 8% B.
La detección por espectrometría de masas se realizó en el modo de ionización positiva por electrospray (ESI) con monitorización de reacciones múltiples (MRM) o monitorización de reacciones múltiples derivadas programadas (sMRM). El control de los instrumentos, la adquisición de datos y el análisis se realizaron con el software Analyst (versión 1.6.3). Las condiciones analíticas detalladas de MS/MS se describen en nuestros métodos publicados anteriormente para plasma (29, 30).
2.6. Validación del método
En el presente estudio, los dos métodos fueron validados en términos de especificidad, LOD, LOQs, linealidad, exactitud, precisión y efectos de matriz. En primer lugar, se desarrolló el método de cuantificación precisa UPLC-MS/MS de los tres compuestos estándar. Debido a la falta de patrones auténticos para muchos componentes en G. elegans, se validó otra semicuantificación simultánea de múltiples componentes independientes de los estándares. A continuación, se comparó el método con la cuantificación precisa para demostrar que el método de semicuantificación era fiable y aceptable para la cuantificación multicomponente. Los dos métodos se determinaron mediante la adición de tejidos en blanco (músculo, hígado y riñones) con tres soluciones estándar de alcaloides y soluciones estándar de alcaloides totales de Gelsemium.
Las especificidades de los dos métodos se evaluaron en función de la presencia de sustancias interferentes alrededor de los tiempos de retención de alcaloides comparando los cromatogramas iónicos MRM de los tejidos en blanco con los de las muestras de tejido con picos correspondientes que contenían los estándares. Los valores de nivel de detalle se definieron como tres veces la relación señal/ruido (S/N) y se establecieron mediante los siguientes pasos. En primer lugar, se analizaron 20 muestras en blanco de tejidos de cerdo y se calculó la relación S/N dentro de la ventana de tiempo de retención en la que se esperaba que cada analito eluyera. Los valores de LOQ se definieron como respuestas de alcaloides que arrojaron valores de S/N > 10.
Se construyeron curvas estándar emparejadas con matrices a 6-8 niveles. Las curvas de calibración se obtuvieron utilizando el método ponderado (1/x2) método de regresión lineal de mínimos cuadrados midiendo el área de pico de cada alcaloide. La ecuación de regresión lineal para cada componente se expresa como y = ax + b, donde y representa el área de pico del analito objetivo y x representa la concentración de cada alcaloide. Para el método de semicuantificación, la concentración de cada alcaloide no fue la concentración real, sino la de los alcaloides totales de Gelsemium.
Los lotes de exactitud y precisión interdiarios e intradiarios comprendieron seis repeticiones de cada tejido en tres rangos de concentración diferentes (baja: 5,0, 10,0, 20,0 y 50 μg/kg; media: 50,0 y 100 μg/kg; alta: 100,0 y 150 μg/kg) y se calcularon mediante la relación entre la concentración medida y la concentración teórica, y se determinó la desviación estándar relativa (DSR) entre las muestras. El efecto de la matriz (ME) sobre la ionización de los analitos se evaluó comparando las áreas de pico de los analitos en la solución patrón con las de la solución de extracto de la matriz.
2.7. Estudio de agotamiento de residuos
Se compraron 2 cerdos machos sanos (20 ± 2 kg) de 1 meses de edad a Xinwufeng Limited Company (Changsha, China). Todos los cerdos fueron observados durante 10 semana antes del experimento. La ingesta de alimentos, la ingesta de agua, las heces y la temperatura se registraron diariamente. Todos los cerdos fueron examinados médicamente por veterinarios experimentados para garantizar su salud. Los animales fueron asignados aleatoriamente a dos grupos, A (30 cerdos) y B (2 cerdos), en los que el grupo A fue alimentado con una ración básica sin el fármaco probado, y al grupo B se le administró G. elegans en polvo a una dosis del 25% por kg de alimento. La temperatura se mantuvo a ~<>°C.
En este experimento, el tratamiento duró 45 días. Un cerdo del grupo A y cinco cerdos del grupo B fueron sacrificados a los 0,25, 1, 3, 7 y 15 d después de la última dosis. En cada momento del sacrificio, se recolectaron muestras de sangre en tubos anticoagulantes de heparina sódica de 5,0 mL y luego se centrifugaron a 3.500 rpm durante 15 min, y el plasma sobrenadante se transfirió a tubos de centrífuga de 2,0 mL. Inmediatamente, se recolectaron tejidos (incluidos músculos, hígado, riñones, corazón, bazo, pulmones, cerebro, glándula suprarrenal, médula espinal, páncreas, intestino delgado, plasma y gónadas) y se colocaron en bolsas de plástico en un baño de hielo. Se recogieron muestras de orina de la vejiga. Todas las muestras se almacenaron a -80 °C hasta el análisis. Todos los ensayos se llevaron a cabo siguiendo la Guía para el Cuidado y Uso de Animales de Laboratorio y fueron aprobados y supervisados por el Comité de Cuidado y Uso de Animales de la Universidad Agrícola de Hunan.
3. Resultados
3.1. Optimización de la preparación de la muestra
En el análisis de residuos de PFAs en tejidos, un punto clave es la etapa de extracción y limpieza de la muestra requerida para el componente de interés de las matrices biológicas. En el presente estudio, los métodos de pretratamiento consistieron en investigar la extracción de muestras utilizando tres alcaloides estándar (gelesmina, koumina y gelsenicina). Para comprender mejor los efectos de diferentes proporciones de disolventes orgánicos mixtos y disolventes acuosos en la eficiencia de extracción de los analitos probados, se probaron 10 ml de disolventes orgánicos y acuosos mixtos en diferentes proporciones a una concentración de pico de 100,0 μg/kg de gelesmina, koumina y gelsenicina. A continuación, los ácidos se fortificaron con disolventes acuosos. Los resultados demostraron que se lograron recuperaciones de más del 80% con acetonitrilo ácido con una proporción de disolvente acuoso de < 5%. Por lo tanto, se utilizó acetonitrilo acidificado como reactivo de extracción. Sin embargo, el reactivo de extracción de ácido fórmico-acetonitrilo al 1% hizo que la matriz se agregara rápidamente, lo que resultó en una dificultad de dispersión y una tasa de recuperación de extracción reducida. Por lo tanto, en este estudio, el acetonitrilo se utilizó por primera vez para la extracción y el ácido fórmico se agregó para la acidificación.
3.2. Validación de los dos métodos propuestos
Hasta ahora, no se ha realizado un análisis de residuos multicomponente de G. elegans debido a la falta de métodos cuantitativos simultáneos potentes y a la dificultad de una cuantificación precisa sin productos estándar puros. Los dos métodos propuestos fueron validados en términos de especificidad, LOD, LOQs, linealidad, exactitud, precisión y efectos de matriz. Se compararon los parámetros precisos de cuantificación de tres compuestos característicos (gelemina, koumina y gelsenicina) con los de la semicuantificación de 22 componentes.
Como se muestra en la figura complementaria 1, no hubo picos que interfirieran con los de los tres alcaloides en la muestra de tejido de cerdo en blanco obtenida por el método de cuantificación precisa. Además, como se muestra en la Figura complementaria 2, no hubo picos que interfirieran con los de los 22 analitos diana en la muestra de músculo de cerdo en blanco obtenida mediante el enfoque semicuantitativo. En las Figuras Suplementarias 3 y 4 se muestran cromatogramas típicos de tejidos hepáticos y renales en blanco y muestras de tejido en blanco enriquecidas con alcaloides totales de Gelsemium. Los resultados mostraron que los dos métodos tenían una buena especificidad.
Las curvas de calibración para el análisis semicuantitativo se construyeron utilizando alcaloides totales de Gelsemium, mientras que las de cuantificación precisa se obtuvieron a partir de patrones químicos. Como se presenta en la Tabla Suplementaria 1, la semicuantificación arrojó coeficientes de correlación satisfactorios (r > 0,9923) en las tres matrices tisulares (músculo, hígado y riñones) y un rango de concentración lineal para los tres compuestos, lo que indica su confiabilidad y rendimiento comparable al de los análisis cuantitativos precisos. En la Tabla 1 se resumen los resultados de LOD y LOQ para todos los alcaloides analizados.
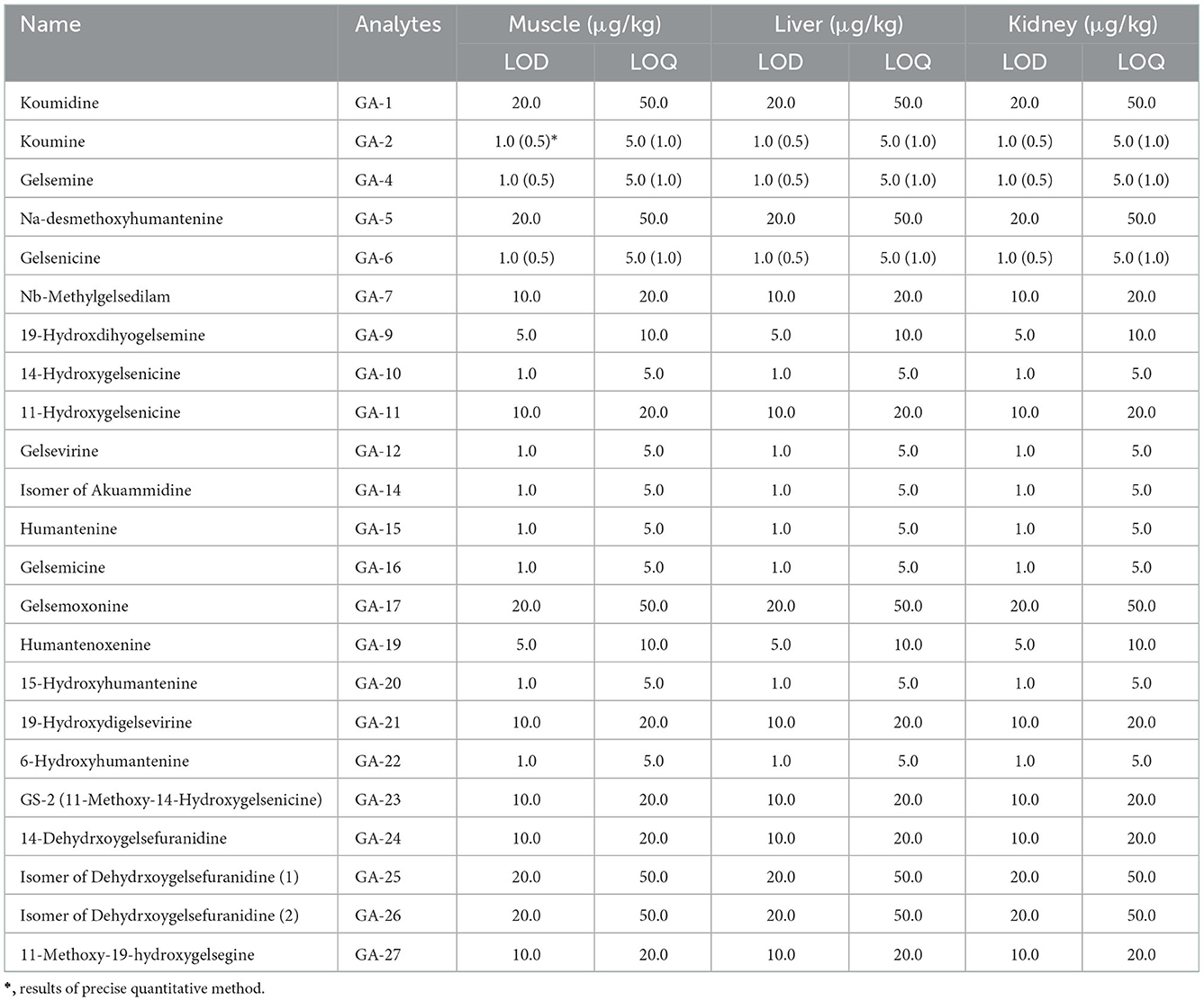 Tabla 1. LODs y LOQs para alcaloides de G. elegans en diferentes matrices (músculo, hígado y riñón).
Tabla 1. LODs y LOQs para alcaloides de G. elegans en diferentes matrices (músculo, hígado y riñón).
Además, los resultados de exactitud y precisión se muestran en forma de mapa de calor en la Figura complementaria 5 y muestran que la precisión de todos los analitos estuvo dentro del 80-120% y la desviación fue < 20%. Los efectos de la matriz de todos los analitos en los tejidos musculares, hepáticos y renales de cerdos se muestran en la Tabla Suplementaria 2. Los resultados mostraron una baja interferencia en la matriz y la RSD de todos los alcaloides detectados fue inferior al 15%. Los resultados anteriores respaldan que el método de semicuantificación es de precisión razonable y es aplicable al análisis cuantitativo multicomponente de los alcaloides de G. elegans.
Después de la validación del método semicuantitativo desarrollado, ampliamos el método para la detección en otros tejidos y realizamos una verificación de métodos simples, como ecuaciones de regresión lineal y LOQs en muestras de orina, bilis y otros tejidos de cerdo; los resultados se muestran en la Tabla 3. En general, los resultados fueron satisfactorios y ponen de manifiesto que este método semicuantitativo podría aplicarse para la cuantificación multicomponente de alcaloides de G. elegans en otros tejidos porcinos.
3.3. Agotamiento de residuos tisulares de múltiples componentes Alcaloides de G. elegans
Para evaluar el agotamiento de residuos de múltiples componentes de los alcaloides de G. elegans en varios tejidos de cerdos durante la alimentación a largo plazo y después de la administración de fármacos a largo plazo, utilizamos dos enfoques eficientes y validados de UPLC-MS/MS. Se detectaron cinco tipos de alcaloides en el hígado, el riñón, el páncreas, el cerebro, el intestino delgado y los tejidos de las glándulas suprarrenales; Se detectaron cuatro tipos de alcaloides en el músculo, el corazón, el bazo, los pulmones, la médula espinal, la bilis y la orina; y solo se detectaron tres tipos de alcaloides en el plasma.
3.4. Agotamiento de residuos en músculo, corazón y bazo
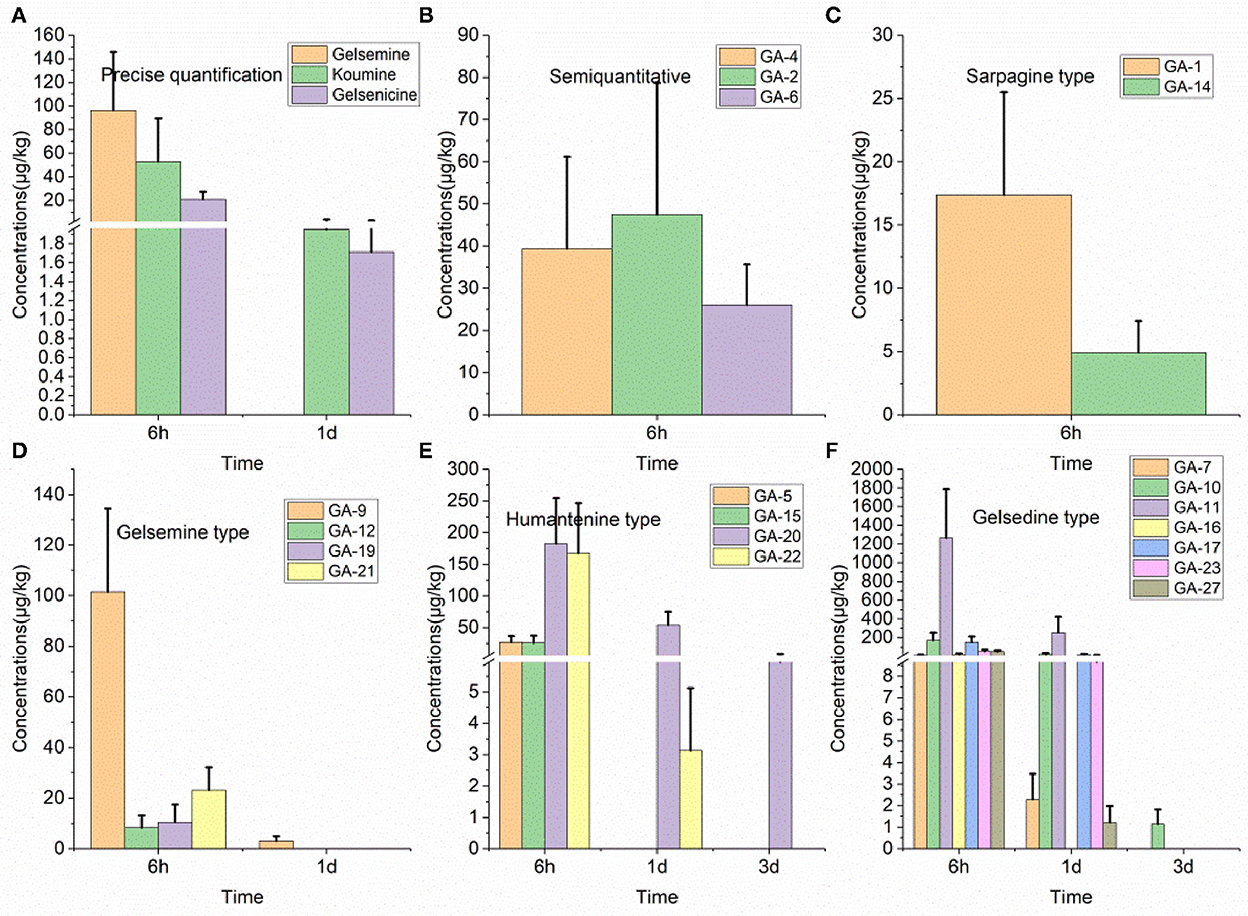
Como se presenta en la Tabla 2, se detectaron 11 alcaloides pertenecientes a los grupos de alcaloides tipo gelemina (19-hidroxihiogelsemina y 19-hidroxidigelsevirina), tipo koumina (koumina), tipo humantenina (15-hidroxihumantenina), tipo gelsedina (14-hidroxigelenicina, 11-hidroxigelinicina, gelemoxonina, GS-2 (11-metoxi-14-hidroxigelsina) y 11-metoxi-19-hidroxigelsegina) en el tejido muscular del cerdo. Encontramos que la 14-hidroxigelenicina, la 11-hidroxigelenicina, la gelemoxonina y la GS-2 tenían los tiempos de residencia más largos en el tejido muscular (1 día), mientras que los otros siete alcaloides no se detectaron 1 día después de la retirada del fármaco. A partir de los resultados analíticos de la muestra de músculo obtenidos con el método establecido, se observó 11-hidroxigelsenicina en el nivel más alto (119,8 μg/kg) en las muestras musculares, y 15-hidroxihumantenina en el nivel más bajo (1,0 μg/kg) en las muestras musculares.
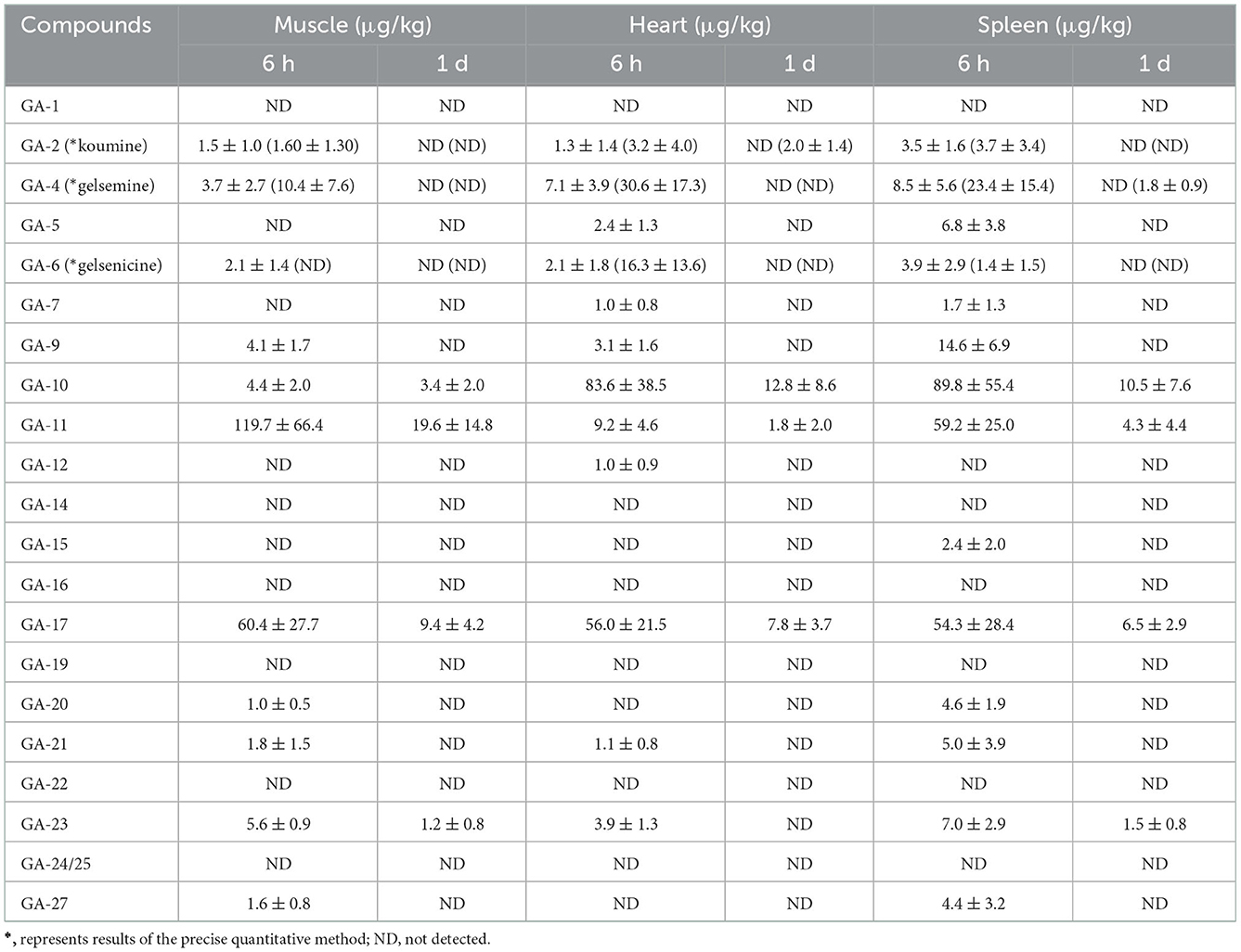 Tabla 2. Concentraciones de alcaloides de Gelsemium en músculo, corazón y bazo de cerdo después de 45 días de administración consecutiva de polvo de G. elegans a una dosis del 2% por kilogramo de alimento (μg/kg) (n = 5).
Tabla 2. Concentraciones de alcaloides de Gelsemium en músculo, corazón y bazo de cerdo después de 45 días de administración consecutiva de polvo de G. elegans a una dosis del 2% por kilogramo de alimento (μg/kg) (n = 5).
Se detectaron un total de 12 alcaloides (alcaloides de tipo gelsemina, tipo koumina, tipo humantenina y tipo gelsedina) en muestras de tejido cardíaco. Entre estos alcaloides, el tiempo de residencia más largo en las muestras de tejido cardíaco fue el de la 14-hidroxigelenicina, la 11-hidroxigelsenicina y la gelsoxonina (1 día), mientras que los otros nueve alcaloides tuvieron un tiempo de residencia de 6 h. Además, la 14-hidroxigelenicina y la Nb-metilgeledil tuvieron los niveles residuales más altos y más bajos, respectivamente, en las muestras de tejido cardíaco 6 h después de la retirada.
Se detectaron catorce alcaloides en las muestras de tejido del bazo (alcaloides tipo gelemina, tipo koumina, tipo humantenina y tipo gelsedina) (Tabla 2). Observamos estos resultados y encontramos que la 14-hidroxigelenicina, la 11-hidroxigelenicina, la gelemoxonina y la GS-2 (pertenecientes al tipo gelsedina) tuvieron el mayor tiempo de residencia (1 d) en las muestras de tejido del bazo, mientras que los otros diez alcaloides permanecieron solo 6 h. La 14-hidroxigelencina y la gelsenicina mostraron las cantidades residuales más altas (89,8 μg/kg) y más bajas (1,4 μg/kg), respectivamente, en el tejido pulmonar 6 h después de la retirada.
3.5. Agotamiento de residuos en el hígado y el riñón
Las concentraciones de alcaloides en muestras de tejido hepático se enumeran en la Tabla 3. Estos resultados revelaron que se detectaron 19 alcaloides en el tejido hepático. Los alcaloides de tipo sarpagina (koumidina), de tipo humanotenina (15-hidroxihumantenina) y de tipo gelsedina (14-hidroxigelenicina y gelsoxonina) seguían siendo detectables en el tejido hepático 3 días después de la retirada, mientras que los alcaloides de tipo gelesmina y koumina no se detectaron más allá de 1 día después de la retirada. Las cantidades residuales de alcaloides tipo sarpagina, tipo humantenina y tipo gelsedina disminuyeron con el aumento del tiempo de retirada. En general, los niveles residuales de los 16 alcaloides fueron bajos en el tejido hepático, con la excepción de la gelesmina, la 19-hidroxihiogelsemina y la 11-hidroxigelenicina. La concentración más alta se observó para la 11-hidroxigelenicina, seguida de la gelsemina (en orden decreciente), la 19-hidroxihiogelsemina, la 6-hidroxihumantenina, la 19-hidroxidigelsevirina, la Nb-metilgeledil y la humana.
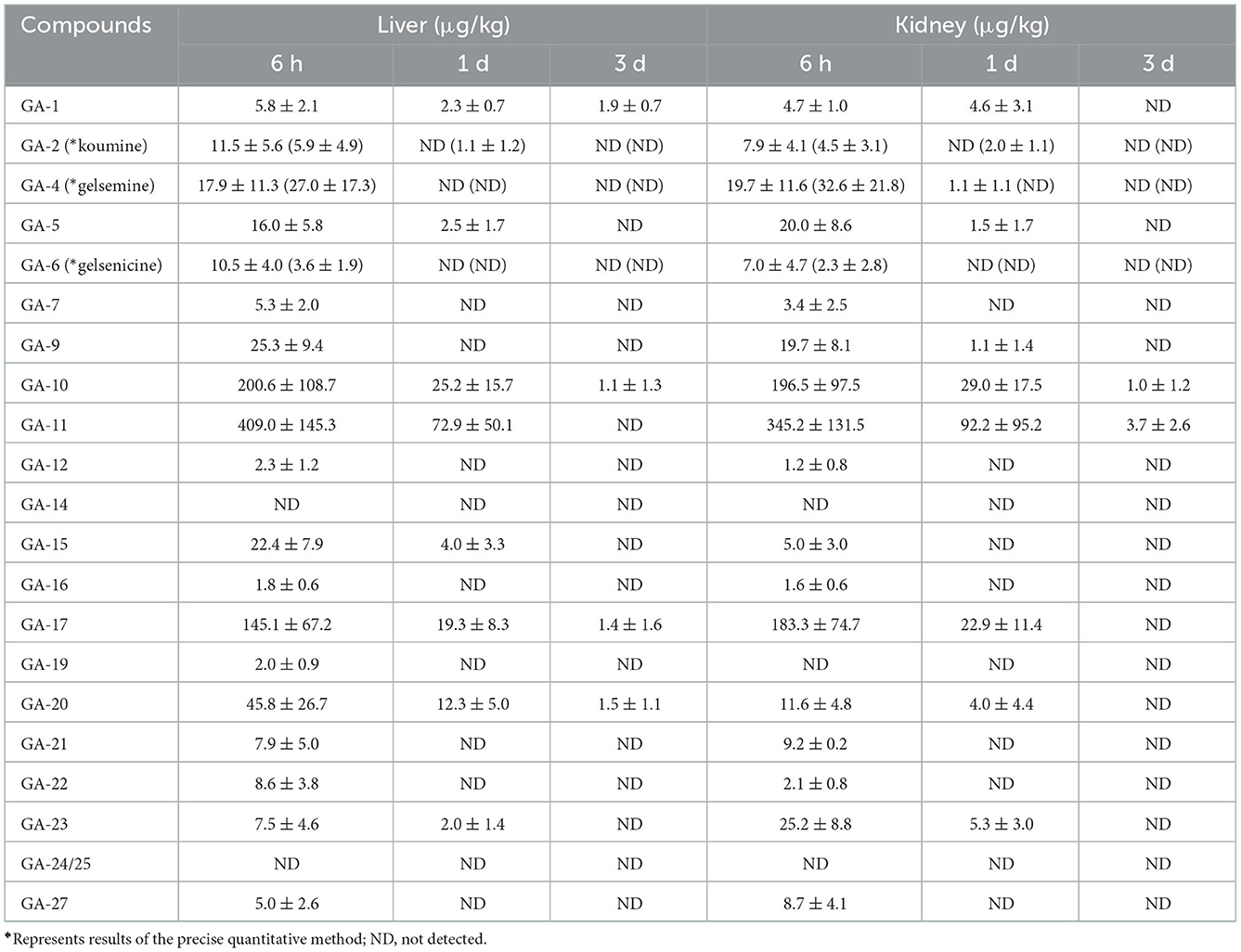 Tabla 3. Concentraciones de alcaloides de Gelsemium en hígado y riñón de cerdo después de 45 días de administración consecutiva de polvo de G. elegans a una dosis del 2% por kilogramo de alimento (μg/kg) (n = 5).
Tabla 3. Concentraciones de alcaloides de Gelsemium en hígado y riñón de cerdo después de 45 días de administración consecutiva de polvo de G. elegans a una dosis del 2% por kilogramo de alimento (μg/kg) (n = 5).
Se detectaron dieciocho alcaloides (incluidos alcaloides de tipo sarpagina, tipo gelesmina, tipo koumina, tipo humantenina y tipo gelsedina) en muestras de tejido renal. En particular, entre los alcaloides detectados, el tiempo de residencia más largo de 3 d se observó para los alcaloides de tipo gelsedina (14-hidroxigelenicina y 11-hidroxigelenicina). Los residuos de alcaloides en las muestras de tejido renal disminuyeron gradualmente con el tiempo. Además, encontramos que el alcaloide más abundante en las muestras renales fue la 11-hidroxigelsenicina (345,2 μg/kg) 6 h después de la retirada, y el más bajo fue la 14-hidroxigelenicina (1,0 μg/kg) 3 d después de la retirada.
3.6. Agotamiento de residuos en el pulmón
Como se muestra en la Figura 1, detectamos 17 alcaloides (alcaloides tipo gelemina, tipo koumina, tipo humantenina y tipo gelsedina) en las muestras de tejido pulmonar. A partir de estos resultados, encontramos que GS-2 permaneció en el tejido pulmonar durante más tiempo (3 días), mientras que cinco alcaloides, incluyendo gelenicina, Nb-metilgelelsedilam, humantenina, gelsemicina y 19-hidroxidigelsevirina, permanecieron en el tejido pulmonar durante solo 6 h. La 14-hidroxigelenicina y la gelevorina exhibieron las cantidades residuales más altas (162,5 μg/kg) y más bajas (1,2 μg/kg), respectivamente. en las muestras de tejido pulmonar 6 h después de la retirada.
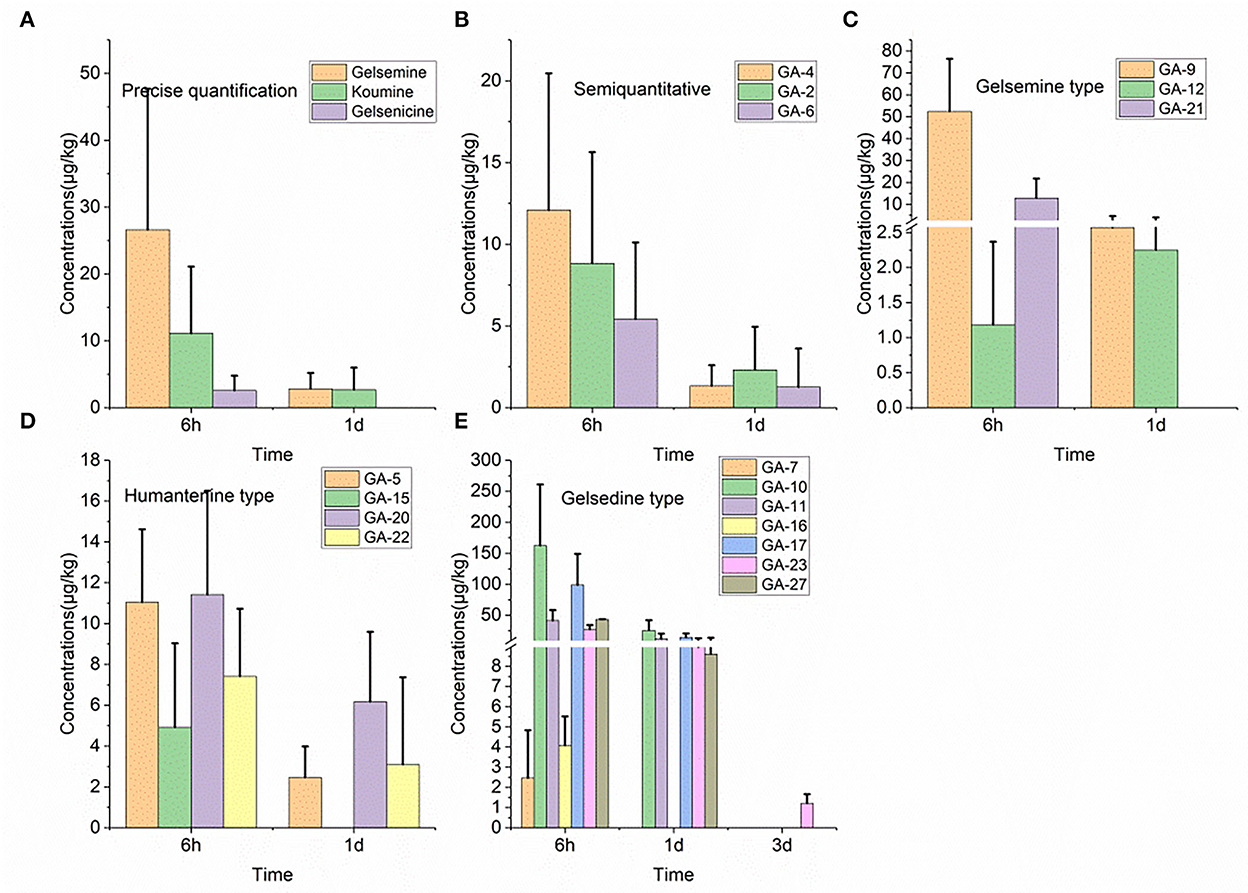 Figura 1. (A-E) Depleción de alcaloides de Gelsemium en pulmón de cerdo después de 45 d de administración consecutiva de polvo de G. elegans a una dosis del 2% por kilogramo de alimento.
Figura 1. (A-E) Depleción de alcaloides de Gelsemium en pulmón de cerdo después de 45 d de administración consecutiva de polvo de G. elegans a una dosis del 2% por kilogramo de alimento.
3.7. Agotamiento de residuos en el páncreas
En la Figura 2 se muestran diecinueve concentraciones de residuos de alcaloides en muestras de tejido pancreático de cerdo. Con base en estos resultados, encontramos que la 14-hidroxigelenicina exhibió el tiempo de residencia más largo (15 d), mientras que nueve alcaloides, incluyendo koumidina, gelesmina, gelsevirina, humantenoxenina, koumina, Na-desmetoxihumantenina, Nb-metilgelelsedilam, gelsemicina y 11-metoxi-19-hidroxigelsegina, tuvieron un tiempo de residencia de solo 6 h. La concentración residual más alta de los diecinueve alcaloides fue la de 11-hidroxigelsenicina (155,7 μg/kg) 6 h después de la retirada, y la humantenina presentó la menor cantidad residual (1,1 μg/kg) a 1 d después de la retirada. Además, la mayoría de los alcaloides se eliminaron 3 días después de la retirada.
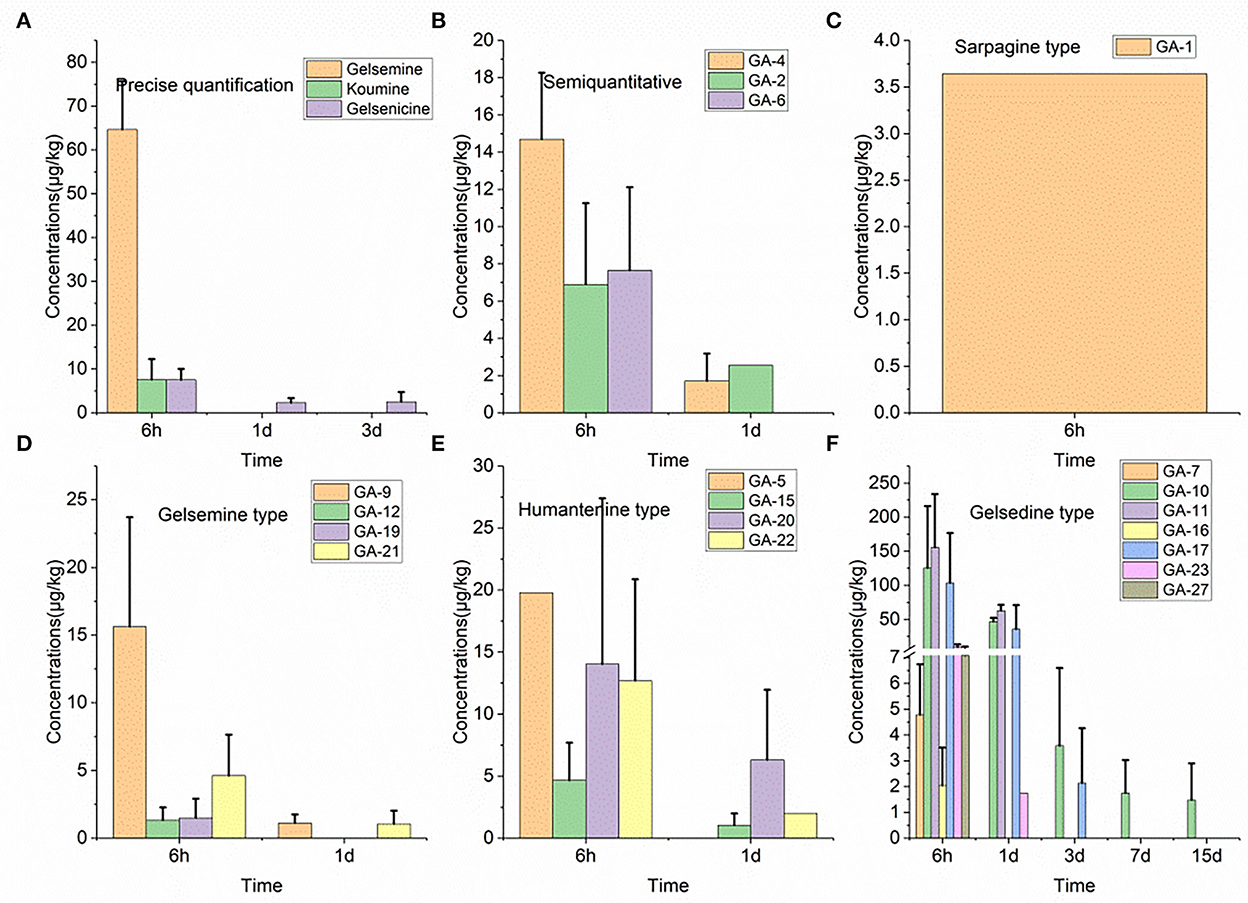 Figura 2. (De la A a la F) Depleción de alcaloides de Gelsemium en páncreas de cerdo después de 45 días de administración consecutiva de polvo de G. elegans a una dosis del 2% por kilogramo de alimento.
Figura 2. (De la A a la F) Depleción de alcaloides de Gelsemium en páncreas de cerdo después de 45 días de administración consecutiva de polvo de G. elegans a una dosis del 2% por kilogramo de alimento.
3.8. Agotamiento de residuos en el cerebro y la glándula suprarrenal
Se detectaron 14 alcaloides en muestras de tejido cerebral de cerdo (Tabla 4). Estos resultados se analizaron exhaustivamente y se observó que se detectaron bajas concentraciones residuales en las muestras de tejido cerebral 3 días después de la retirada. Sin embargo, la mayoría de los alcaloides fueron eliminados del tejido cerebral después de 6 h. Los resultados mostraron que las concentraciones de 14-hidroxigelenicina y 6-hidroxihumantenina a las 6 h fueron las más altas (48,4 μg/kg) y las más bajas (1,5 μg/kg) en las muestras cerebrales, respectivamente.
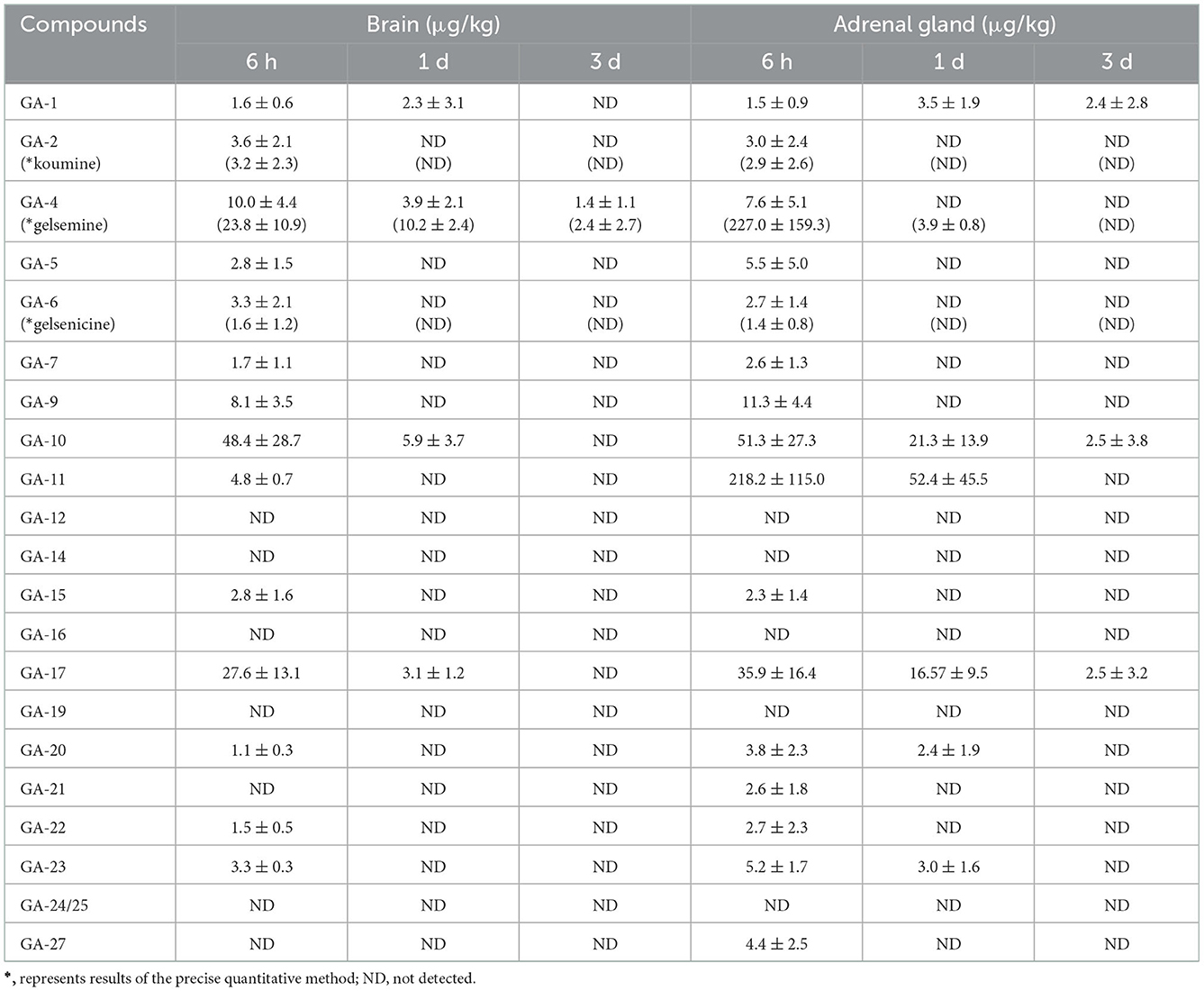 Tabla 4. Concentraciones de alcaloides de Gelsemium en cerebro de cerdo y glándula suprarrenal después de 45 días de administración consecutiva de polvo de G. elegans a una dosis del 2% por kilogramo de alimento (μg/kg) (n = 5).
Tabla 4. Concentraciones de alcaloides de Gelsemium en cerebro de cerdo y glándula suprarrenal después de 45 días de administración consecutiva de polvo de G. elegans a una dosis del 2% por kilogramo de alimento (μg/kg) (n = 5).
Como se describe en la Tabla 4, se detectaron 16 alcaloides en muestras de tejido de glándulas suprarrenales de cerdo. Estos resultados revelaron que la koumidina, la 14-hidroxigelsenicina y la gelemoxonina seguían presentes en el tejido de la glándula suprarrenal 3 días después de la retirada, mientras que los otros alcaloides se eliminaron por completo o por debajo de los LOQ 1 día después de la retirada. Además, la 11-hidroxigelenicina detectada en el tejido de la glándula suprarrenal presentó la mayor cantidad residual 6 h después de la retirada, mientras que la gelsenicina presentó la menor cantidad residual en el mismo momento.
3.9. Agotamiento de residuos en el intestino delgado
Se detectaron veinte alcaloides en las muestras de tejido del intestino delgado de cerdos, que fue el mayor número de alcaloides detectados en cualquiera de los tejidos analizados, como se presenta en la Figura 3. Un análisis posterior de estos resultados reveló que la 14-hidroxigelenicina y la 15-hidroxihumantenina permanecieron en el intestino delgado de los cerdos durante 3 días, mientras que la mayoría de los otros alcaloides no se detectaron después de 1 día. En este estudio de depleción, 6 h después de la retirada, los niveles de residuos de 11-hidroxigelenicina y 14-hidroxigelsenicina fueron más altos (1.265,4 μg/kg) y más bajos (1,2 μg/kg), respectivamente, en el intestino delgado 3 d después de la retirada.
Figura 3. (De la A a la F) Depleción de alcaloides de Gelsemium en el intestino delgado de cerdo después de 45 días de administración consecutiva de polvo de G. elegans a una dosis del 2% por kilogramo de alimento.
3.10. Agotamiento de residuos en la médula espinal
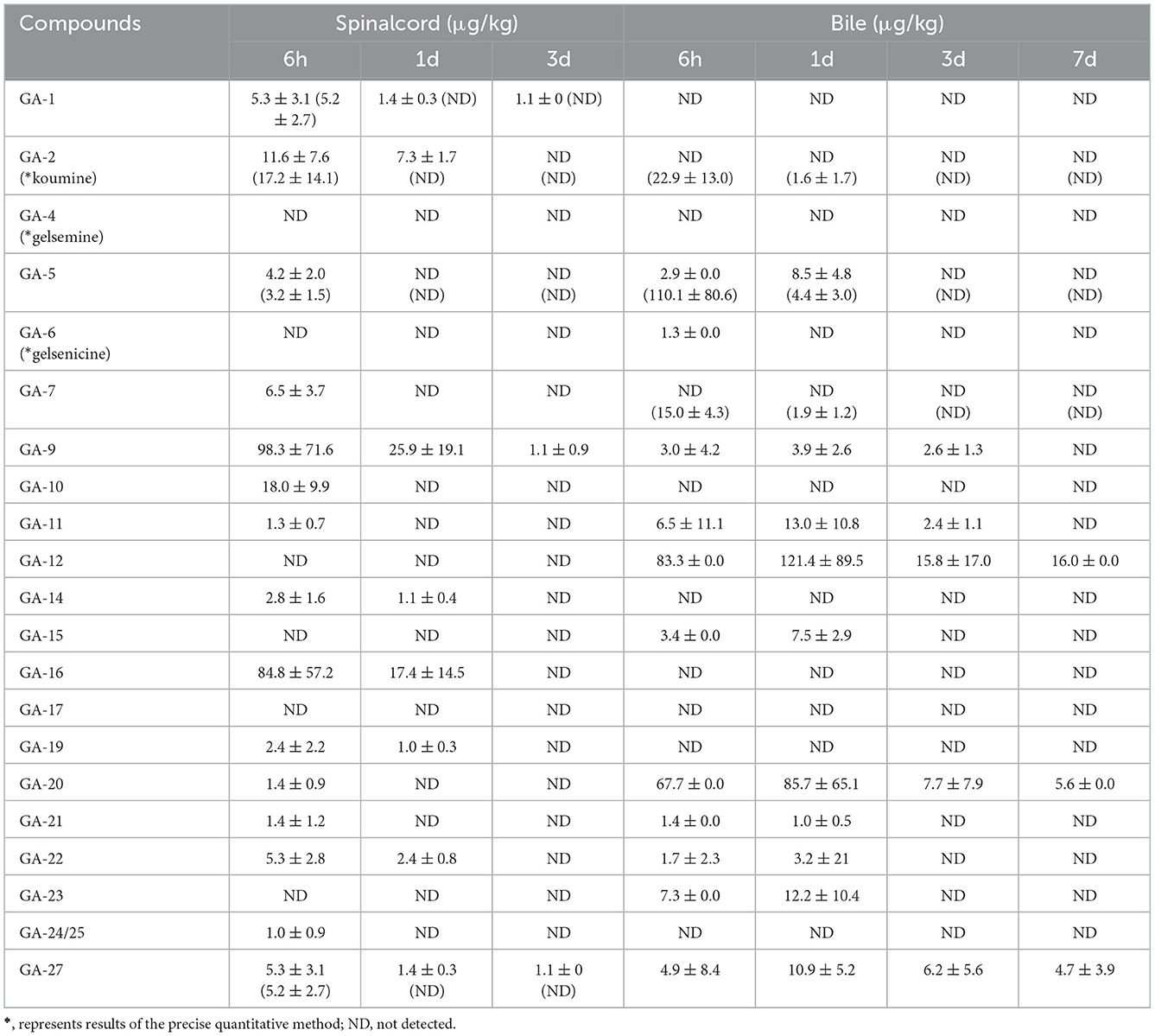
Como se presenta en la Tabla 5, se detectaron 14 alcaloides en muestras de tejido de la médula espinal. Estos resultados indicaron que la 14-hidroxigelenicina, un alcaloide de tipo gelsedina, podía permanecer en la médula espinal hasta 3 días después de la retirada, mientras que los otros 13 alcaloides se eliminaban después de 1 día. El nivel de concentración residual de 14-hidroxigelsenicina fue el más alto (98,3 μg/kg) 6 h después de la retirada, mientras que la 11-metoxi-19-hidroxigelsegina presentó la concentración más baja (1,0 μg/kg) en el mismo momento.
Tabla 5. Concentraciones de alcaloides de Gelsemium en la médula espinal y la bilis de cerdo después de 45 días de administración consecutiva de polvo de G. elegans a una dosis del 2% por kilogramo de alimento (μg/kg) (n = 5).
3.11. Agotamiento de residuos en la bilis
Como se muestra en la Tabla 5, se detectaron 13 alcaloides en muestras de bilis. Entre ellos, la 11-hidroxigelenicina, la gelemoxonina y la GS-2, que son alcaloides de tipo gelsedina, mostraron el mayor tiempo de residencia en la bilis (7 d), mientras que la Na-desmetoxihumantenina de tipo humano presentó el menor tiempo de residencia (6 h). Otros alcaloides fueron eliminados después de 1 y 3 d de retirada. Estos resultados revelaron que la 11-hidroxigelenicina y la tenenonina humana presentaron los residuos más altos (121,4 μg/kg) y más bajos (1,0 μg/kg), respectivamente, en la bilis 1 día después de la retirada.
3.12. Depleción de orina
Se detectaron diecisiete alcaloides en muestras de tejido urinario, como se muestra en la Figura 4. En este estudio, los residuos de alcaloides tipo gelsedina, Nb-metilgeledilam, 14-hidroxigelenicina, 11-hidroxigelenicina y gelemoxonina, en muestras de orina se eliminaron muy lentamente, y su tiempo estimado de extracción fue de 3 d, que fue más largo que el de los otros alcaloides descritos anteriormente. Seis horas después de la retirada, el nivel de residuos de gelsemoxonina fue más alto (1.102,6 μg/kg) en el tejido urinario, mientras que 1 día después de la retirada, la concentración residual de humantenina fue más baja (1,1 μg/kg) en orina.
Figura 4. (A-E) Depleción de alcaloides de Gelsemium en orina de cerdo después de 45 días de administración consecutiva de polvo de G. elegans a una dosis del 2% por kilogramo de alimento.
3.13. Depleción en plasma
Como se muestra en la Figura 5, solo se detectaron siete alcaloides (alcaloides tipo gelsemina, tipo humantenina y tipo gelsedina) en las muestras de plasma. Sin embargo, en el plasma, solo la gelemoxonina de los residuos tipo gelsedina se eliminó lentamente, ya que se detectaron en el plasma 3 d después de la retirada. Los otros cinco alcaloides (gelemina, gelsenicina, 19-hidroxihiogelsemina, humantenina y 15-hidroxihumantenina) permanecieron en el plasma durante solo 6 h. Observamos que 6 h después de la retirada, los niveles de residuos de gelemoxonina y humantenina fueron más altos (321,1 μg/kg) y más bajos (1,0 μg/kg) en las muestras de plasma, respectivamente.
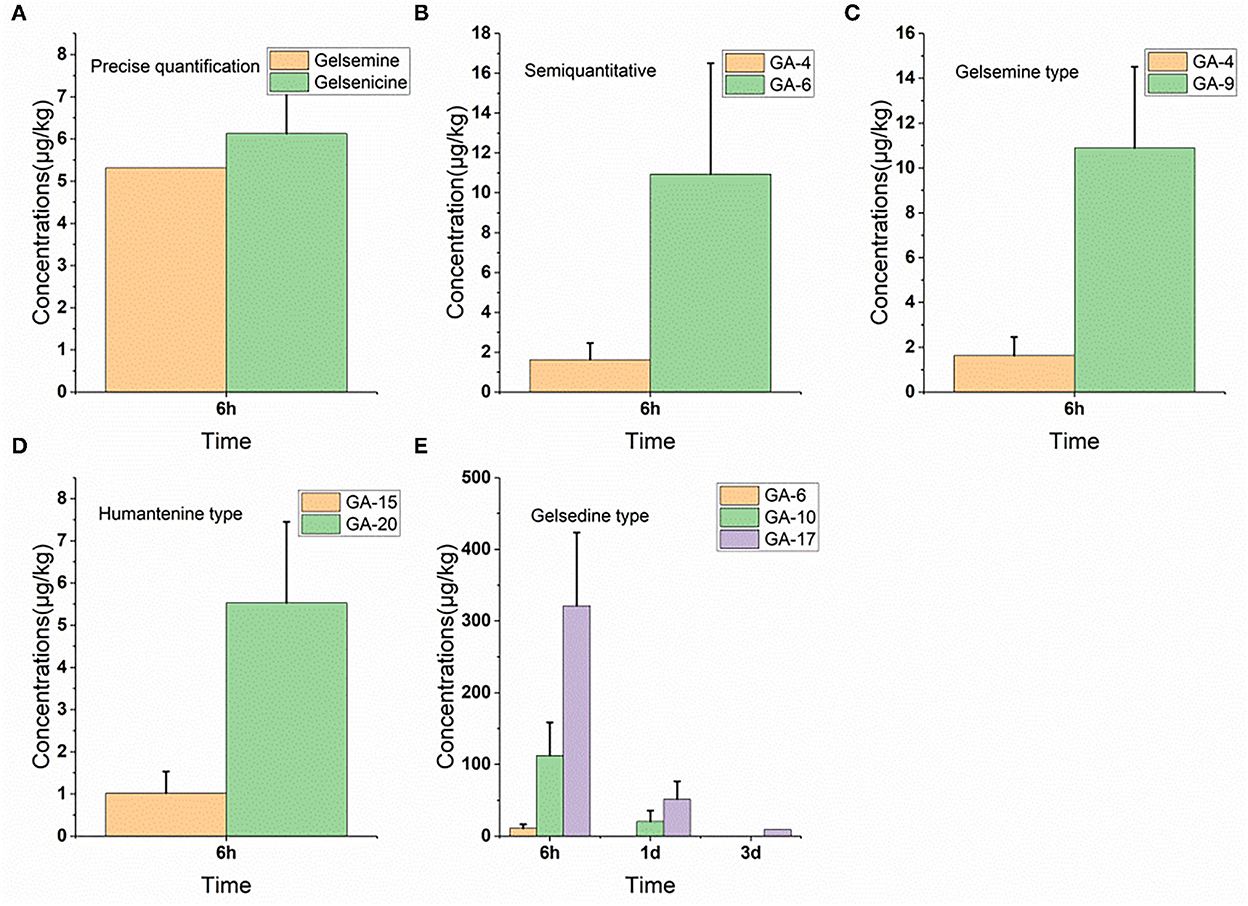 Figure 5. (A–E) Depletion of Gelsemium alkaloids in pig plasma after 45 d of consecutive administered G. elegans powder at a dose of 2% per kilogram feed.
Figure 5. (A–E) Depletion of Gelsemium alkaloids in pig plasma after 45 d of consecutive administered G. elegans powder at a dose of 2% per kilogram feed.
3.14. Agotamiento cuantitativo preciso de residuos tisulares de gelesmina, koumina y gelsenicina
Para confirmar que el nuevo ensayo de semicuantificación proporcionaba mediciones precisas de los residuos de los componentes, se compararon los resultados obtenidos de los tres alcaloides de G. elegans con patrones auténticos en varios tejidos (músculo, hígado, riñones, corazón, bazo, pulmones, páncreas, cerebro, intestino delgado, glándula suprarrenal, médula espinal, bilis, orina, plasma y gónadas) con los de los ensayos de semicuantificación. Los resultados indicaron que el rendimiento cuantitativo de los dos abordajes se mantuvo constante en todas las matrices tisulares, excepto en las de la médula espinal y la bilis. De acuerdo con estos resultados, el método de semicuantificación optimizado descrito en este documento fue confiable hasta cierto punto y adecuado para determinar múltiples residuos de alcaloides de G. elegans en tejidos independientes de los estándares.
3.15. Correlación de la concentración de 14-hidroxigelenicina y gelemoxonina entre los tejidos y los tejidos de los fluidos biológicos en cerdos
En cerdos, se analizaron las correlaciones de las concentraciones de 14-hidroxigelenicina y gelemoxonina en tejidos comestibles con las de orina y plasma mediante regresión lineal. Se observaron excelentes correlaciones cuando se utilizaron ecuaciones funcionales lineales para describir las relaciones entre las concentraciones de 14-hidroxigelsenicina y gelemoxonina en los tejidos comestibles, la orina y el plasma ensayados en cerdos. Los coeficientes de correlación de la 14-hidroxigelenicina oscilaron entre 0,96 y 0,99 entre la concentración en el hígado, los riñones, el intestino delgado y el páncreas y la de la orina (Figuras suplementarias 6A-D), mientras que los coeficientes de correlación de la gelemoxonina oscilaron entre 0,93 y 0,99 entre la concentración en el hígado y el páncreas, y la de la orina (Figuras suplementarias 6E, Además, los coeficientes de correlación oscilaron entre 0,92 y 0,99 para la gelemoxonina entre la concentración en el hígado y el páncreas, y la concentración en el plasma (Figuras suplementarias 6G, H). No se observaron correlaciones para el músculo, el cerebro y los pulmones, ya que la 14-hidroxigelenicina y la gelemoxonina solo se detectaron en los dos primeros momentos de muestreo.
4. Discusión
Los PFA se han convertido en una tendencia en la alimentación animal después de la prohibición del uso de antibióticos como promotores del crecimiento (2, 31, 32). Sin embargo, los investigadores se han centrado principalmente en sus efectos farmacológicos clínicos, como las actividades antioxidantes (6) y antibacterianas (8), y su promoción de la actividad intestinal (11), y creen que los extractos de plantas son seguros de añadir y no tienen efectos adversos. Debido a la complejidad de los extractos de plantas y a la dificultad de cuantificarlos con precisión sin productos estándar, se ha prestado poca atención a sus residuos en los alimentos de origen animal. Nuestro estudio anterior mostró que después de una sola dosis oral de G. elegans a cerdos (1,0 g/kg) y ratas (0,1 g/kg), los alcaloides de la misma se absorbieron rápidamente en cerdos y ratas. Las tasas de eliminación de estos alcaloides en cerdos fueron más lentas que las de ratas (17). Debido a la falta de una variedad de patrones de alcaloides de G. elegans, es difícil estudiar las características de distribución tisular de G. elegans. En la actualidad, la investigación sobre G. elegans se centra principalmente en la farmacocinética y la distribución tisular de los tres compuestos alcaloides en ratas (25-27). Sin embargo, solo unos pocos alcaloides contenidos en G. elegans no reflejan completamente las características generales de la planta. En este estudio, se establecieron y validaron por primera vez métodos para la detección de LC-MS/MS de alcaloides multicomponentes en tejidos, y se realizaron con éxito estudios de depleción tisular utilizando estos dos métodos.
La koumina tenía un contenido más alto que los otros alcaloides en las materias primas, pero su toxicidad era menor que la de otros alcaloides (LD50 en ratones fue de 99 mg/kg) (14). Así, muchos estudios recientes se han centrado en su actividad farmacológica, como ansiolítica (33), ansiolítica (34) y antiinflamatoria (35). Pero pocos estudios se han centrado en su distribución tisular. Sin embargo, en el presente estudio, se detectó koumina en tejidos distintos al plasma. Este alcaloide permaneció en el hígado, los riñones, el corazón, los pulmones, el intestino delgado, la bilis y la orina durante 1 día y se eliminó después de solo 6 h en los otros seis tejidos. Además, los niveles residuales de koumina en los tejidos disminuyeron gradualmente con el tiempo en el intestino delgado, la bilis, la orina, los pulmones, el páncreas, el hígado, la médula espinal, los riñones, el bazo, el cerebro, el corazón, la glándula suprarrenal y el músculo (52,64-1,60 μg/kg). Estos resultados indican que la tasa de depleción de koumina en el tejido del intestino delgado es lenta.
La gelesmina (un alcaloide de tipo gelesmina) también es más abundante que los otros alcaloides en G. elegans, y se han realizado pocos estudios sobre su agotamiento residual. Después de 3 días de retirada, la gelesmina solo se detectó en el tejido cerebral, mientras que no se detectó en los otros tejidos. Además, la gelsemina mostró la mayor concentración (227,0 μg/kg) en los tejidos paranéfricos y la menor concentración (5,32 μg/kg) en el plasma. Además, otros alcaloides de tipo gelesmina, como la 19-hidroxihiogelsemina, la gelevorina, la tenenofina humana y la 19-hidroxidigelsevirina, mostraron tiempos de residencia de < 3 d en todos los tejidos. Entre ellos, la 19-hidroxihiogelsemina exhibió los niveles más bajos de residuos en la mayoría de los tejidos, excepto en el intestino delgado, los pulmones y la orina. La mayor concentración de este alcaloide se observó en el intestino delgado, seguido (en orden decreciente) de los pulmones, la orina, el hígado, los riñones, el páncreas, el bazo, la glándula suprarrenal, el plasma, el cerebro, la médula espinal, los músculos y el corazón, mientras que la 19-hidroxihiogelsemina no se detectó en la bilis. Además, la concentración de gelsevirina en el intestino delgado alcanzó un máximo, mientras que alcanzó un mínimo a las 6 h después de la retirada. No se detectó gelevorina en el músculo, el bazo, el cerebro, la glándula suprarrenal, la bilis ni la orina. No se detectó humantenoxenina en la mayoría de los tejidos, excepto en el hígado, el páncreas, el intestino delgado y la bilis. Además, la concentración de residuos de 19-hidroxidigelsevirina fue baja en la mayoría de los tejidos, excepto en la orina y el intestino delgado. Los resultados anteriores indican que los alcaloides de tipo gelesmina pueden eliminarse rápidamente en la mayoría de los tejidos dentro de 1 día después de suspender la administración del fármaco.
Se ha informado previamente que los alcaloides de tipo gelsedina son los componentes más tóxicos en G. elegans según la LD50 valores de los compuestos (14). Por ejemplo, el LD50 Los valores de gelsenicina y gelsemicina en ratones y ratas fueron de 0,1-0,2 y 0,1-0,3 mg/kg, respectivamente. Se detectaron ocho alcaloides de tipo gelsedina en el hígado, los riñones, los pulmones, el páncreas, el intestino delgado y la orina, mientras que se detectaron siete alcaloides de tipo gelsedina en el corazón, el cerebro y los tejidos de la médula espinal. Además, se detectaron seis alcaloides de tipo gelsedina en los tejidos del corazón, el cerebro y la médula espinal, y cinco alcaloides en el tejido muscular. Sin embargo, solo se detectaron tres alcaloides de tipo gelsedina en el plasma. Hasta donde sabemos, aún no se han reportado residuos de alcaloides de tipo gelsedina. Los resultados de los residuos tisulares muestran que los alcaloides de tipo gelsedina están ampliamente distribuidos en varios tejidos porcinos. La mayoría de los alcaloides de tipo gelsedina se detectaron en la mayoría de los tejidos y excrementos hasta 1 día después de la retirada, y la persistencia más prolongada se observó en el páncreas, ya que la 14-hidroxigelsenicina seguía siendo detectable 15 días después de la retirada. La 14-hidroxigelenicina mostró la mayor concentración residual en los tejidos del corazón, el bazo, los pulmones, el cerebro y la médula espinal en todos los momentos de muestreo, entre los cuales la mayor concentración se produjo en los tejidos pulmonares (162,45 μg/kg) 6 h después de la retirada. Se observaron concentraciones residuales relativamente más altas de 11-hidroxigelenicina en el músculo, el hígado, los riñones, el páncreas, el intestino delgado y la bilis en todos los momentos de muestreo. En particular, la concentración de 11-hidroxigelsenicina en el intestino delgado (1.265,44 μg/kg) fue mucho mayor que la de la bilis (121,36 μg/kg), el páncreas (155,68 μg/kg) y el músculo (119,75 μg/kg). La gelemoxonina exhibió las concentraciones más altas de residuos en la orina y el plasma de todos los alcaloides de tipo gelsedina. Sobre la base de la toxicidad notificada de este tipo de alcaloide, el consumo de productos de origen animal procedentes de piensos para G. elegans plantea riesgos para la salud humana.
El plasma y la orina se pueden utilizar para controlar los residuos de medicamentos en los tejidos comestibles (36, 37). El plasma se considera el fluido biológico más apropiado para la monitorización in vivo de fármacos porque la concentración de fármacos en el plasma representa una concentración instantánea, lo que hace que la concentración tisular estimada sea más significativa para la monitorización rutinaria de residuos. Se observaron buenas correlaciones de las concentraciones de gelemoxonina entre el plasma, el hígado y los tejidos pancreáticos de los cerdos, lo que indica que el plasma podría utilizarse para controlar los residuos de gelsemoxonina en los tejidos comestibles de los cerdos. Se observaron excelentes correlaciones de las concentraciones de 14-hidroxigelenicina y gelemoxonina entre la orina y otros tejidos comestibles de cerdos, lo que demostró que la orina era un método satisfactorio para controlar los residuos de 14-hidroxigelenicina y gelemoxonina.
5. Conclusión
En conclusión, reportamos por primera vez el desarrollo y validación de un método altamente sensible y específico para la determinación de alcaloides multicomponentes independientemente de los estándares. Este método de detección validado se aplicó con éxito a estudios de agotamiento de residuos tisulares y se descubrió que muchos alcaloides de G. elegans estaban ampliamente distribuidos en la mayoría de los tejidos de cerdo. Además, se seleccionaron 14-hidroxigelenicina, 11-hidroxigelenicina y gelemoxonina para el monitoreo de residuos de G. elegans, y se observó que el páncreas, el intestino delgado y los tejidos pulmonares eran los posibles tejidos diana de G. elegans. Además, tanto la orina como el plasma se pueden utilizar para monitorizar la aplicación de G. elegans y predecir las concentraciones tisulares utilizando el método de semicuantificación desarrollado, ya que la recogida de muestras es cómoda e inocua para los animales. Los presentes resultados proporcionan evidencia científica para evaluar la seguridad de los alimentos de origen animal para los consumidores y serán útiles para su aplicación y desarrollo futuro.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio están incluidas en el artículo/Material complementario, las consultas adicionales pueden dirigirse a los autores correspondientes.
Declaración ética
El estudio en animales fue revisado y aprobado por el Comité de Cuidado y Uso de Animales de la Universidad Agrícola de Hunan.
Contribuciones de los autores
Z-LS y Z-YL concibieron la idea y el experimento. Z-YL y YW diseñaron y realizaron los experimentos y escribieron el artículo. Z-YL, YW, X-ML, G-FL y XB analizaron los datos. Todos los autores contribuyeron al artículo y aprobaron la versión enviada.
Financiación
Este estudio contó con el apoyo de la Fundación Nacional de Ciencias Naturales de China (Nº 31972737).
Reconocimientos
Nos gustaría agradecer a Editage (www.editage.cn) por la edición en inglés.
Conflicto de intereses
G-FL fue empleado de Hunan Canzoho Biological Technology Co., Ltd.
El resto de los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un potencial conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2022.1111782/full#supplementary-material
Abreviaturas
PFAs, Phytogenic feed additives; UPLC-MS/MS, Ultra-performance liquid chromatography tandem mass spectrometry; MRM, Multiple reaction monitoring mode; G. elegans, Gelsemium elegans Benth; LOD, Limit of detection; LOQ, Limit of quantitation; S/N, Signal-noise ratio; RSD, Relative standard deviation; ME, Matrix effect.
Referencias
1. Windisch W, Schedle K, Plitzner C, Kroismayr A. Use of phytogenic products as feed additives for swine and poultry. J Anim Sci. (2008) 86:E140–8. doi: 10.2527/jas.2007-0459
2. Yang C, Chowdhury MA, Huo Y, Gong J. Phytogenic compounds as alternatives to in-feed antibiotics: potentials and challenges in application. Pathogens. (2015) 4:137–56. doi: 10.3390/pathogens4010137
3. Wei A, Shibamoto T. Antioxidant activities and volatile constituents of various essential oils. J Agric Food Chem. (2007) 55:1737–42. doi: 10.1021/jf062959x
4. Starčević K, Krstulović L, Brozić D, Maurić M, Stojević Z, Mikulec Ž, et al. Production performance, meat composition and oxidative susceptibility in broiler chicken fed with different phenolic compounds. J Sci Food Agric. (2015) 95:1172–8. doi: 10.1002/jsfa.6805
5. Song ZH, Cheng K, Zheng XC, Ahmad H, Zhang LL, Wang T. Effects of dietary supplementation with enzymatically treated Artemisia annua on growth performance, intestinal morphology, digestive enzyme activities, immunity, and antioxidant capacity of heat-stressed broilers. Poult Sci. (2018) 97:430–7. doi: 10.3382/ps/pex312
6. Pirgozliev V, Mansbridge SC, Rose SP, Mackenzie AM, Beccaccia A, Karadas F, et al. Dietary essential oils improve feed efficiency and hepatic antioxidant content of broiler chickens. Animal. (2019) 13:502–8. doi: 10.1017/S1751731118001520
7. Wati T, Ghosh TK, Syed B, Haldar S. Comparative efficacy of a phytogenic feed additive and an antibiotic growth promoter on production performance, caecal microbial population and humoral immune response of broiler chickens inoculated with enteric pathogens. Anim Nutr. (2015) 1:213–9. doi: 10.1016/j.aninu.2015.08.003
8. Shokraneh M, Ghalamkari G, Toghyani M, Landy N. Influence of drinking water containing Aloe vera (Aloe barbadensis Miller) gel on growth performance, intestinal microflora, and humoral immune responses of broilers. Vet World. (2016) 9:1197–203. doi: 10.14202/vetworld.2016.1197-1203
9. Humer E, Rohrer E, Windisch W, Wetscherek W, Schwarz C, Jungbauer L et al. Gender-specific effects of a phytogenic feed additive on performance, intestinal physiology and morphology in broiler chickens. J Anim Physiol Anim Nutr (Berl). (2015) 99:788–800. doi: 10.1111/jpn.12238
10. Cherian G, Orr A, Burke IC, Pan W. Feeding Artemisia annua alters digesta pH and muscle lipid oxidation products in broiler chickens. Poult Sci. (2013) 92:1085–90. doi: 10.3382/ps.2012-02752
11. Amad AA, Männer K, Wendler KR, Neumann K, Zentek J. Effects of a phytogenic feed additive on growth performance and ileal nutrient digestibility in broiler chickens. Poult Sci. (2011) 90:2811–6. doi: 10.3382/ps.2011-01515
12. Dutt V, Thakur S, Dhar VJ, Sharma A. The genus Gelsemium: an update. Pharmacogn Rev. (2010) 4:185–94. doi: 10.4103/0973-7847.70916
13. Xu Y, Qiu HQ, Liu H, Liu M, Huang ZY, Yang J, et al. Effects of koumine, an alkaloid of Gelsemium elegans Benth., on inflammatory and neuropathic pain models and possible mechanism with allopregnanolone. Pharmacol Biochem Behav. (2012) 101:504–14. doi: 10.1016/j.pbb.2012.02.009
14. Jin GL, Su YP, Liu M, Xu Y, Yang J, Liao KJ, et al. Medicinal plants of the genus Gelsemium (Gelsemiaceae, Gentianales)—a review of their phytochemistry, pharmacology toxicology and traditional use. J Ethnopharmacol. (2014) 152:33–52. doi: 10.1016/j.jep.2014.01.003
15. Ponglux D, Wongseripipatana S, Subhadhirasakul S, Takayama H, Yokota M, Ogata K, et al. Studies on the indole alkaloids of gelsem1um elegans (Thailand): structure elucidation and proposal of biogenetic route. Tetrahedron. (1988) 44:5075–94. doi: 10.1016/S0040-4020(01)86012-9
16. Huang CY, Yang K, Cao JJ, Wang ZY, Wu Y, Sun ZL, et al. Integration of metabolomics and transcriptomicsto comprehensively evaluate the metabolic effects of gelsemium elegans on pigs. Animals: an open access journal from MDPI. (2021) 11:1192. doi: 10.3390/ani11051192
17. Cao JJ, Yang K, Yu H, Long XM, Li YJ, Sun ZL, et al. Comparative toxicokinetic profiles of multiple-components of Gelsemium elegans in pigs and rats after a single oral administration. Toxicon. (2020) 181:28–35. doi: 10.1016/j.toxicon.2020.04.093
18. Cao JJ, Yang K, Huang CY, Li YJ, Yu H, Wu Y, et al. Pharmacokinetic study of multiple components of gelsemium elegans in goats by ultra-performance liquid chromatography coupled to tandem mass spectrometry. J Anal Toxicol. (2020) 44:378–90. doi: 10.1093/jat/bkz100
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Ye Q, Feng Y, Wang Z, Zhou A, Xie S, Zhang Y, et al. Efectos de los alcaloides dietéticos de Gelsemium elegans sobre el rendimiento del crecimiento, las respuestas inmunitarias y la resistencia a las enfermedades de Megalobrama amblycephala. Pescados y mariscos Immunol. (2019) 91:29–39. doi: 10.1016/j.fsi.2019.05.026
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Xiang H, Zhou YJ, Huang PL, Yu CN, Liu J, Liu LY, et al. Envenenamiento letal con Gelsemium elegans en Guizhou, China. Salud pública. (2016) 136:185–7. doi: 10.1016/j.puhe.2016.02.031
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Ng WY, Hung LY, Lam YH, Chan SS, Pang KS, Chong YK, et al. Envenenamiento por plantas tóxicas en Hong Kong: una revisión de 15 años. Hong Kong Med. (2019) 25:102–12. doi: 10.12809/hkmj187745
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Olioso D, Marzotto M, Moratti E, Brizzi M, Bellavite P. Efectos de Gelsemium sempervirens L. en el perfil de expresión génica centrado en la vía en células neuronales. J Etnofarmaco. (2014) 153:535–9. doi: 10.1016/j.jep.2014.02.048
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Wu T, Chen G, Chen X, Wang Q, Wang G. Efectos antihiperlipidémicos y antioxidantes de la gelesmina en conejos alimentados con una dieta alta en grasas. Bioquímica Celular Biophys. (2015) 71:337–44. doi: 10.1007/s12013-014-0203-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Xu YK, Liao SG, Na Z, Hu HB, Li Y, Luo HR. Alcaloides de gelsemium, agentes inmunosupresores de Gelsemium elegans. Fitoterapia. (2012) 83:1120–4. doi: 10.1016/j.fitote.2012.04.023
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Zhang SS, Hu SP, Yang XX, Shen JQ, Zheng XY, Huang KX, et al. Desarrollo de un método de cromatografía líquida con espectrometría de masas para la determinación de gelesmina en plasma y tejido de rata: aplicación a un estudio farmacocinético y de distribución tisular. J Sep Sci. (2015) 38:936–42. doi: 10.1002/jssc.201401168
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Hu YX, Chen MH, Wang ZY, Lan Y, Tang L, Liu MH, et al. Desarrollo de un método UPLC-MS/MS validado para la determinación de humantenmina en plasma de rata y su aplicación en estudios de farmacocinética y biodisponibilidad. Cromatografía Biomédica. (2017) 31:4017. doi: 10.1002/bmc.4017
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Wang L, Wen YQ, Meng FH. Determinación simultánea de gelesmina y koumina en plasma de rata mediante UPLC-MS/MS y aplicación al estudio farmacocinético tras la administración oral de extracto de Gelsemium elegans Benth. Cromatografía Biomédica. (2018) 32:e4201. doi: 10.1002/bmc.4201
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Xiao S, Wu Y, Huang YJ. Determinación del contenido de ingredientes en tres extractos crudos diferentes de Gelsemium elegans. Prog Vet. (2016) 37:72–6. doi: 10.3969/j.issn.1007-5038.2016.06.016
29. Yang K, Long XM, Cao JJ, Li YJ, Wu Y, Bai X, et al. Una estrategia analítica para explorar la farmacocinética multicomponente de la fitoterapia independientemente de los estándares: Aplicación en extractos de Gelsemium elegans. Pharm Biomed Anal. (2019) 176:112833. doi: 10.1016/j.jpba.2019.112833
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Yang K, Long X M, Liu Y C, Chen F H, Liu X F, Sun Z L, et al. Desarrollo y validación interna de un método sensible LC-MS/MS para la cuantificación simultánea de gelsemina, koumina y humantenmina en plasma porcino. J Cromatógrafo B. (2018) 1076:54–60. doi: 10.1016/j.jchromb.2018.01.019
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Zhao P, Li H, Lei Y, Li T, Kim S, Kim I. Efecto de las plantas medicinales fermentadas sobre el rendimiento del crecimiento, la digestibilidad de los nutrientes, las emisiones de gases nocivos fecales y la puntuación de diarrea en cerdos destetados. J Sci Food Agricult. (2016) 96:1269–74. doi: 10.1002/jsfa.7217
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Zhang S, Jung JH, Kim HS, Kim BY, Kim IH. Influencia de la suplementación con fitoncidas en el rendimiento del crecimiento, la digestibilidad de los nutrientes, los perfiles sanguíneos, las puntuaciones de diarrea y la excreción de microflora fecal en cerdos destetados. Asian-Australas J Anim Sci. (2012) 25:1309–15. doi: 10.5713/ajas.2012.12170
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Liu M, Huang HH, Yang J, Su YP, Lin HW, Lin LQ, et al. Los alcaloides activos de Gelsemium elegans Benth. son potentes ansiolíticos. Psicofarmacología. (2013) 225:839–51. doi: 10.1007/s00213-012-2867-x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Xiong BJ, Xu Y, Jin GL, Liu M, Yang J, Yu CX. Efectos analgésicos y mecanismos farmacológicos del alcaloide koumina Gelsemium en un modelo de dolor postoperatorio en ratas. Rep. Científica (2017) 7:14269. doi: 10.1038/s41598-017-14714-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Yuan Z, Matias FB, Wu J, Liang Z, Sun Z. La koumina atenúa la inflamación estimulada por lipopolisacáridos en macrófagos RAW264.7, coincidentemente asociada con la inhibición de las vías NF-κB, ERK y p38. Int J Mol Sci. (2016) 17:430. doi: 10.3390/ijms17030430
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Yang B, Huang L, Wang Y, Liu Y, Tao Y, Chen D, et al. Agotamiento de residuos y correlación tejido-plasma del ácido metil-3-quinoxalina-2-carboxílico después de la administración dietética de olaquindox en cerdos. J Agricult Químico de Alimentos. (2010) 58:937–42. DOI: 10.1021/JF902418K
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Chiesa OA, Von Bredow J, Smith M, Heller D, Condon R, Thomas MH. Correlación tejido renal bovino/fluido biológico para la penicilina. J Vet Pharmacol Therapeutic. (2006) 29:299–306. doi: 10.1111/j.1365-2885.2006.00747.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: Gelsemium, LC-MS/MS, depleción de residuos, gelsedina, tejido diana
Cita: Wu Y, Long X-M, Liu G-F, Bai X, Sun Z-L y Liu Z-Y (2023) El agotamiento de residuos multicomponentes de Gelsemium elegans en tejidos, orina y plasma de cerdo. Frente. Vet. Sci. 9:1111782. doi: 10.3389/fvets.2022.1111782
Recibido: 05 de diciembre de 2022; Aceptado: 28 de diciembre de 2022;
Publicado: 13 enero 2023.
Editado por:
Dapeng Peng, Universidad Agrícola de Huazhong, China
Revisado por:
Xiaofei Shang, Instituto de Ganadería y Ciencias Farmacéuticas de Lanzhou (CAAS), China Shusheng Tang, Universidad Agrícola de China, China
Derechos de autor © 2023 Wu, Long, Liu, Bai, Sun y Liu. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Zhi-Liang Sun,  sunzhiliang1965@aliyun.com; Zhao-Ying Liu,
sunzhiliang1965@aliyun.com; Zhao-Ying Liu,  liu_zhaoying@hunau.edu.cn
liu_zhaoying@hunau.edu.cn
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía