Técnicas de recogida de espermatozoides del epidídimo canino y criopreservación
Estudio comparativo de las técnicas de recogida de espermatozoides del epidídimo canino y criopreservación
 Hiba Ali Hassan1*
Hiba Ali Hassan1*  Penélope Banchi1,2
Penélope Banchi1,2  Guillaume Dominio1
Guillaume Dominio1  Romero El Khoury3
Romero El Khoury3  Rana Chaaya3
Rana Chaaya3  Eline Wydooghe4
Eline Wydooghe4  Katrien Smits1
Katrien Smits1  Ann Van Soom1
Ann Van Soom1- 1Unidad de Biología de la Reproducción, Facultad de Medicina Veterinaria, Departamento de Medicina Interna, Medicina de la Reproducción y de la Población, Universidad de Gante, Merelbeke, Bélgica
- 2Departamento de Ciencias Veterinarias, Facultad de Medicina Veterinaria, Universidad de Turín, Grugliasco, Italia
- 3Facultad de Agronomía y Medicina Veterinaria, Departamento de Medicina Veterinaria, Universidad Libanesa, Dekwaneh, Líbano
- 4Centro de Especialización en Agrotecnología y Biotecnología, Departamento de Biotecnología, Colegio Universitario VIVES, Roeselare, Bélgica
Introducción: Un método de recolección optimizado y un protocolo de congelación para la preservación de los espermatozoides del epidídimo sigue siendo un tema de interés para muchos científicos. El presente estudio se centró en la recolección y preservación de espermatozoides del epidídimo canino. Durante el proceso de recolección de espermatozoides del epidídimo canino, puede ocurrir contenido de sangre, lo que puede afectar la criopreservación de espermatozoides de manera negativa. Aquí, comparamos las dos primeras técnicas de recolección de espermatozoides del epidídimo [picado del epidídimo (EM) y aspiración de espermatozoides del epidídimo de una sola incisión (SESA)]; y a continuación, intentamos resolver el problema del contenido sanguíneo utilizando un tampón de lisis eritrocitaria (ELB).
Métodos: Por lo tanto, los espermatozoides se recolectaron después de pesar los epidídimos, ya sea por EM o SESA, y se evaluó la calidad del esperma antes y después de la congelación (concentración, producción total de espermatozoides (TSO), motilidad, viabilidad y morfología). A continuación, se recogieron nuevas muestras de esperma de ocho epidídimos por EM y se sometieron a un protocolo de congelación estándar o a un protocolo de congelación de tratamiento ELB. Se evaluaron los parámetros espermáticos post-descongelación (concentración, TSO, motilidad, viabilidad y morfología), incluyendo especies reactivas intracelulares de oxígeno (ROS) y peroxidación lipídica. Se evaluó la correlación entre el peso del epidídimo y el TSO en función de la técnica de recolección, y se detectaron diferencias en los parámetros espermáticos tanto dentro de las diferentes técnicas de recolección como entre los diferentes protocolos de tratamiento de precongelación.
Resultados: Hubo una correlación muy fuerte entre el peso del epidídimo y el TSO para la técnica EM (p = 0,002, R2 = 0,6), junto con un aumento de la motilidad de los espermatozoides con EM en comparación con SESA (mediana 80%, rango intercuartílico [RIC] 88-65 y mediana 67,5%, RIC 72,5-52,5, respectivamente; (p = 0,002). Las muestras post-descongeladas sometidas al protocolo de congelación del tratamiento ELB tuvieron menor motilidad y ROS intracelulares más altas en comparación con el protocolo de congelación estándar (motilidad: mediana 56,25%, IQR 60-48,75 y mediana 70%, IQR 72,5-63, respectivamente; p = 0,01; ROS: mediana 78,5%, RIC 81,25-75,5 y mediana 70%, RIC 70,5-68,75, respectivamente; (p = 0,04).
Discusión: Los resultados indicaron que la EM es una mejor técnica para recolectar espermatozoides del epidídimo a pesar de la presencia de algún contenido sanguíneo. Además, el tratamiento ELB no debe implementarse para eliminar esos glóbulos rojos antes de la criopreservación de los espermatozoides del epidídimo en perros.
1. Introducción
Entre los diversos factores que afectan a la conservación del semen, se sabe que tanto el método de recolección como la contaminación con bacterias, glóbulos rojos o leucocitos juegan un papel principal en el resultado final (1). Se han descrito diferentes técnicas para la recolección de espermatozoides eyaculados y epididimarios en perros (1-5). Sin embargo, cuando no es posible la recolección de un eyaculado completo, la cauda del epidídimo representa una fuente clave de espermatozoides maduros y, en la mayoría de los casos, la última oportunidad para la reproducción en animales en peligro de extinción o muertos. Se han descrito varios métodos para recuperar los espermatozoides del epidídimo (6). Estos incluyen, entre otros, el método de lavado retrógrado (enjuague), la aspiración de espermatozoides del epidídimo con una sola incisión (SESA) y la picadura del epidídimo (EM) (2, 3, 7). El método de lavado retrógrado se realiza insertando una aguja de calibre 24 en los conductos deferentes y enjuagando el contenido del conducto con diluyente de semen o aire (3). Este método ha demostrado ser eficaz en varios estudios realizados en perros (2, 3, 7). Se ha demostrado que produce una mayor recuperación de espermatozoides que SESA (7) o EM (3). El método de lavado, aunque eficaz, no se puede utilizar si el conducto deferente se acorta durante una orquiectomía o si el conducto deferente o el conducto epididimario se dañan durante la extracción de los vasos sanguíneos de la superficie del epidídimo (3). En un estudio en el que se compararon diferentes métodos de recogida de espermatozoides del epidídimo canino, se registró un cateterismo defectuoso del conducto deferente en uno de cada diez perros que participaron en el estudio, por lo que es necesario disponer de técnicas alternativas (3).
Se ha sugerido la picadura del epidídimo como una opción de respaldo cuando el método de lavado no es factible (3). Un problema importante cuando se emplea la picadura del epidídimo es la contaminación por eritrocitos, ya que la hemospermia afecta negativamente la estructura y función de los espermatozoides después de la descongelación (1). En concreto, Rijsselaere et al. (8) demostraron que una mezcla de sangre superior al 4% daba lugar a una caída de los parámetros espermatozoides posteriores a la descongelación, como la motilidad de los espermatozoides, la integridad de la membrana y el estado acrosómico; a diferencia del semen canino refrigerado, conservado a 4 °C, donde la adición de sangre hasta un 10% no tuvo un efecto perjudicial sobre las características funcionales de los espermatozoides. La congelación y descongelación de muestras hematospérmicas caninas dio lugar a alrededor del 58% de hemólisis de eritrocitos, lo que a su vez condujo a la liberación de hemoglobina de los eritrocitos rotos. Además, estudios recientes han demostrado que la hemoglobina tiene efectos citotóxicos directos y desempeña un papel importante en la producción de especies reactivas de oxígeno (ROS) dañinas, que pueden causar efectos negativos indirectos (8). Además, el contenido sanguíneo puede interferir con los dispositivos analíticos, como el análisis de espermatozoides asistido por computadora (CASA) durante la evaluación de la calidad del semen. Por lo tanto, la eliminación de eritrocitos antes de la congelación podría ser un paso esencial para mejorar la calidad del semen post-descongelación después de la EM, especialmente en muestras altamente contaminadas. Sin embargo, la centrifugación simple hará que tanto los espermatozoides como los eritrocitos disminuyan en el gránulo; Y por esta razón, los científicos investigaron diferentes técnicas para eliminar eritrocitos (9). Entre estas técnicas, se ha demostrado que la centrifugación en gradiente separa eficientemente los espermatozoides móviles viables de los espermatozoides y eritrocitos inmóviles muertos, pero afecta negativamente el rendimiento de los espermatozoides móviles viables (10). A pesar de que la baja tasa de recuperación de espermatozoides podría ser contrarrestada por múltiples colecciones de semen cuando se considera el semen eyaculado, este efecto representa una desventaja relevante cuando se trata de espermatozoides del epidídimo, que solo se pueden recolectar una vez. Por lo tanto, se necesita un protocolo que garantice la ausencia o una pérdida limitada de espermatozoides durante la separación de espermatozoides y eritrocitos. Verheyen et al. (11) fueron los primeros en describir el uso de un tampón de lisis eritrocitaria (BEL) en muestras hematospérmicas humanas y probaron su toxicidad en espermatozoides de donantes capacitados. Los resultados mostraron que después de una exposición de 5 minutos de los espermatozoides al ELB, la motilidad y vitalidad posteriores de los espermatozoides no se vieron afectadas en una prueba de supervivencia espermática de 48 h (10). Desde entonces, el medio ELB se utiliza de forma rutinaria en la reproducción humana para la preparación de muestras testiculares para la inyección intracitoplasmática de espermatozoides (9) y, hasta donde sabemos, el efecto del ELB aún no se ha probado en el semen de perro. Si se pudiera utilizar para eliminar el contenido sanguíneo antes de la congelación de los espermatozoides del epidídimo, esto sería muy deseable.
La aspiración de espermatozoides del epidídimo (SESA) de una sola incisión, por otro lado, se considera un método ideal para la recuperación de espermatozoides del epidídimo, ya que puede funcionar independientemente de limitaciones como la obstrucción del conducto deferente y la contaminación. Para esta técnica, el epidídimo se corta, en lugar de cortarse en trozos pequeños, con una sola incisión durante la cual se recogen el líquido epididimario y los espermatozoides que fluyen. La comparación de EM y SESA aún no se ha realizado en perros.
Por lo tanto, el objetivo de la presente investigación fue (a) comparar las técnicas SESA y EM para la recuperación de espermatozoides del epidídimo y (b) investigar si el tratamiento de los espermatozoides del epidídimo recolectados con EM con un tampón de lisis de eritrocitos antes de la congelación mejoraría los parámetros de los espermatozoides después de la descongelación.
2. Materiales y métodos
Todos los productos fueron comprados a Sigma (Sigma, St. Louis, Estados Unidos) excepto si se indica lo contrario.
2.1. Comparación de los métodos de recogida
2.1.1. Recogida de muestras
Un total de quince perros sanos de entre uno y seis años de diferentes razas y pesos corporales fueron sometidos a una orquiectomía rutinaria en clínicas veterinarias de Beirut, Líbano, entre enero de 2021 y mayo de 2021. Inmediatamente después de la orquiectomía, los testículos y los epidídimos se colocaron en un medio de retención que consistía en una solución salina fisiológica al 0,9% suplementada con gentamicina (0,1 mg/ml) (12), se mantuvieron fríos en una nevera portátil (4 °C) y se transportaron al laboratorio donde se procesaron dentro de las 24 h posteriores a la recolección. Antes de la recolección de espermatozoides, los testículos se extrajeron del medio de retención, se lavaron con solución salina tamponada con fosfato (DPBS) de Dulbecco y se secaron cuidadosamente con una gasa aséptica. A continuación, cada epidídimo, junto con los conductos deferentes, se diseccionó cuidadosamente del testículo, se pesó en una balanza precisa (BS 300, instrumento PCE, Reino Unido) y los espermatozoides del epidídimo se extrajeron mediante EM o mediante SESA. Los criterios de exclusión fueron: TSO inferior a 200×106 espermatozoides después de la recolección.
Para el método EM, los epidídidos de la cola junto con los conductos deferentes se colocaron en una placa de Petri que contenía 7 mL de DPBS. Los espermatozoides presentes en el conducto deferente se exprimieron en la placa de Petri y la cola del epidídimo se sometió a picado, con una hoja de bisturí, para permitir que los espermatozoides nadaran fuera de la cola (2). Después de 10 min de incubación a 37 °C, el medio que contenía los espermatozoides se recolectó con una pipeta automática y se colocó en un tubo falcon de 15 mL.
Para el método SESA, la cola epidídima se fijó con una pinza homeostática. Con una hoja de bisturí, se realizó una sola incisión en la cola epidídimo, teniendo cuidado de evitar los vasos sanguíneos. A continuación, se recogieron el líquido epididimario y los espermatozoides que fluían con una pipeta automática y se colocaron en un tubo falcon de 15 ml que contenía DPBS (7). Los espermatozoides presentes en el conducto deferente se exprimieron directamente en el mismo tubo.
2.1.2. Evaluación de la calidad espermática
La concentración de espermatozoides se determinó mediante una cámara de recuento de Bürker y se utilizó para calcular la producción total de espermatozoides (TSO) en función del volumen de la muestra.
La motilidad de los espermatozoides se evaluó subjetivamente bajo un microscopio de contraste de fase (i4 Infinity, LW Scientific, Estados Unidos) equipado con una etapa de calentamiento a 37 °C. Dos operadores igualmente experimentados evaluaron a ciegas todas las muestras, y se calculó y registró la media.
La viabilidad y morfología de los espermatozoides se evaluaron en frotis teñidos con eosina/nigrosina bajo un microscopio óptico (Olympus CX23, Tokio, Japón) a 1000 aumentos bajo inmersión en aceite. Se contaron doscientos espermatozoides y se clasificaron como vivos/muertos, y se registraron los porcentajes de espermatozoides normales y anormales (cabeza anormal, cola anormal, gota citoplasmática proximal y gota citoplasmática distal).
2.1.3. Criopreservación y descongelación
Todas las muestras se centrifugaron a 720 x g durante 5 min a 22 °C (13) para desechar el sobrenadante y resuspender el gránulo de esperma en diluyente de congelación I (diluyente a base de ácido cítrico-glucosa TRIS que contiene 20% de yema de huevo), que contiene 3% de glicerol (Uppsala I), hasta una concentración de 400 × 106 se alcanzaron espermatozoides/mL (14). A continuación, las muestras extendidas se enfriaron lentamente a 4 °C durante 90 min y se añadió diluyente de semen II, que contenía un 7% de glicerol y un 1% de pasta Equex STM (Uppsala II), para alcanzar una concentración de 200 × 106 espermatozoides/mL justo antes de la criopreservación (14). Las muestras se cargaron en pajuelas de 0,5 ml, se colocaron a 5 cm por encima de la superficie del nitrógeno líquido durante 10 minutos y finalmente se sumergieron en nitrógeno líquido donde se almacenaron durante al menos 1 semana (15).
La descongelación se obtuvo sumergiendo las pajitas en un baño de agua tibia a 37 °C durante 30 s (16). A continuación, se evaluó la calidad del semen después de 5 minutos de incubación a 37 °C para los mismos parámetros espermáticos que antes de la criopreservación.
2.2. Criopreservación de espermatozoides del epidídimo con y sin tampón de lisis globular
2.2.1. Recogida de muestras
Entre junio de 1 y septiembre de 2021 se presentaron ocho epidídidos de perros de más de 2021 año de edad de diferentes razas y pesos corporales para orquiectomía de rutina en diferentes clínicas veterinarias de Beirut, Líbano. Con base en los resultados anteriores, los espermatozoides del epidídimo de cada epidídimo se recolectaron por EM, como se describió anteriormente, y se colocaron en tubos de halcón de 15 mL. La motilidad, viabilidad y morfología de los espermatozoides se evaluaron después de la recolección, como se describió anteriormente. A continuación, las muestras se dividieron en dos alícuotas iguales y se aplicaron dos protocolos de congelación diferentes en cada una de las ocho muestras; Protocolo normalizado de congelación (grupo de control; como se describe en el punto 2.1.1. Recogida de muestras) y protocolo de tratamiento ELB (grupo de tratamiento).
Ambas muestras se centrifugaron a 720x g durante 5 min a 22 °C, después de lo cual se eliminó el sobrenadante y el gránulo de esperma se resuspendió con diluyente de semen I y se enfrió a 4 °C durante 90 min (protocolo de congelación estándar) o con 2 mL de ELB (10X RBC lysis buffer Multi-species, ThermoFisher Scientific, Estados Unidos). A continuación, las muestras de ELB se centrifugaron a 25,76 x g durante 5 min a 22 °C y el gránulo se resuspendió con 2 mL de DPBS y se centrifugó a 25,76 x g durante 10 min. Después de retirar el sobrenadante, el gránulo se resuspendió con diluyente de semen I y se enfrió a 4 °C durante 90 min. Ambos grupos fueron procesados para su criopreservación, como se describe en el experimento I.
2.2.2. Evaluación de la calidad espermática
Se evaluó la motilidad, viabilidad y morfología de los espermatozoides en las muestras posteriores a la descongelación, como se describió anteriormente. Las especies reactivas de oxígeno (ROS) intracelulares se determinaron con Nitroblue Tetrazolio (NBT) según Raad et al. (17). Nitroblue Tetrazolio es un compuesto de tetrazolio aromático nitrosustituido soluble en agua de color amarillo. Es un método histoquímico que detecta el origen celular de las ROS, en este caso los espermatozoides. El nitroblue tetrazolio reacciona con iones superóxido intracelulares para formar un formazano azul-negro en el citoplasma del espermatozoide (18). Los espermatozoides extendidos descongelados se lavaron primero dos veces con DPBS para eliminar el diluyente. Se añadió una solución de NBT al 0,1% (v:v) a los espermatozoides no extendidos y se incubaron a 37 °C durante 30 min. La mezcla se centrifugó a 250 x g durante 5 min y el gránulo se untó en portaobjetos. A continuación, el portaobjetos secado al aire se tiñó con azul de metileno eosina de Wright (Ref.45253, Sigma, St. Louis, Estados Unidos) y se observó al microscopio óptico (Olympus CX23, Tokio, Japón) con un aumento de 100 x bajo inmersión en aceite. Se contaron doscientos espermatozoides y se clasificaron como NBT positivos o NBT negativos (17). Los espermatozoides se consideraron positivos para NBT cuando se detectó formazano azul-negro.
Se realizó una prueba de sustancias reactivas al ácido tiobarbitúrico (TBARS) para evaluar la resistencia de los espermatozoides al estrés oxidativo. Específicamente, este ensayo mide el nivel de malondialdehído (MDA), un producto final de la peroxidación lipídica, producido después de desafiar a los espermatozoides a un entorno generador de ROS. El malondialdehído reacciona con el ácido tiobarbitúrico (TBA), generando una reacción colorimétrica que puede ser detectada por espectrofotometría. Brevemente, se incubaron 200 μL de espermatozoides lavados con 50 μL de 4 mM de sulfato ferroso y 50 μL de 20 mM de ascorbato de sodio a 37°C durante 90 min en la oscuridad. A continuación, se añadieron 600 μL de ácido tricloroacético al 10% a 4°C y se centrifugó la muestra a 21,13 x g a 4°C durante 15 min. Después de la centrifugación, se mezclaron 500 μL del sobrenadante con 500 μL de TBA y se incubaron a 100 °C durante 15 min. La reacción se detuvo enfriando la muestra en un baño de hielo, y la concentración de TBARS se midió utilizando un espectrofotómetro (Multiskan GO, Thermo Fisher Scientific, Estados Unidos) a una longitud de onda de 532 nm (19). El resultado se expresó como nanogramos de TBARS por millón de espermatozoides. Este ensayo se realizó por triplicado para cada muestra y se calculó la media.
3. Análisis estadístico
El análisis estadístico se realizó utilizando R 4.1.2 (R Inc., Boston, MA, Estados Unidos). La normalidad de la distribución de los datos se evaluó mediante pruebas de Shapiro-Wilk (p < 0,05) y se realizó un análisis estadístico no paramétrico. En concreto, se utilizó la prueba de rangos de Spearman para evaluar la correlación entre el peso del epidídimo y el TSO para cada técnica de recolección. La fuerza de la correlación se consideró según Leclezio et al. (20): menos de 0,2 insignificante, 0,2 a 0,29 débil, 0,3 a 0,39 moderada, 0,4 a 0,69 fuerte y mayor de 0,7 muy fuerte. El efecto de la técnica de recolección sobre los parámetros espermáticos de precongelación y posdescongelación se evaluó mediante la prueba U de Mann-Whitney. Del mismo modo, se evaluó el efecto de los dos protocolos de congelación diferentes (protocolo de congelación ELB y protocolo de congelación estándar) mediante la prueba U de Mann-Whitney. Se consideraron las diferencias estadísticas entre los grupos a p ≤ 0,05.
4. Resultados
4.1. Comparación de los métodos de recogida
Se encontró una correlación muy fuerte entre el peso del epidídimo y el TSO para la técnica EM (p = 0,002, coeficiente de correlación de Spearman (ρ) = 0,73, R2 = 0,6), pero no para la técnica SESA (p = 0,18, ρ = 0,36, R2 = 0,21). Además, la ME produjo más espermatozoides por epidídimo que la técnica SESA (mediana 1,23 ×109 espermatozoides/epidídimo, RIC 18,0–9,5 y mediana 0,70 ×109 espermatozoides/epidídimo, RIC 10,38-4,70, respectivamente; p = 0,01).
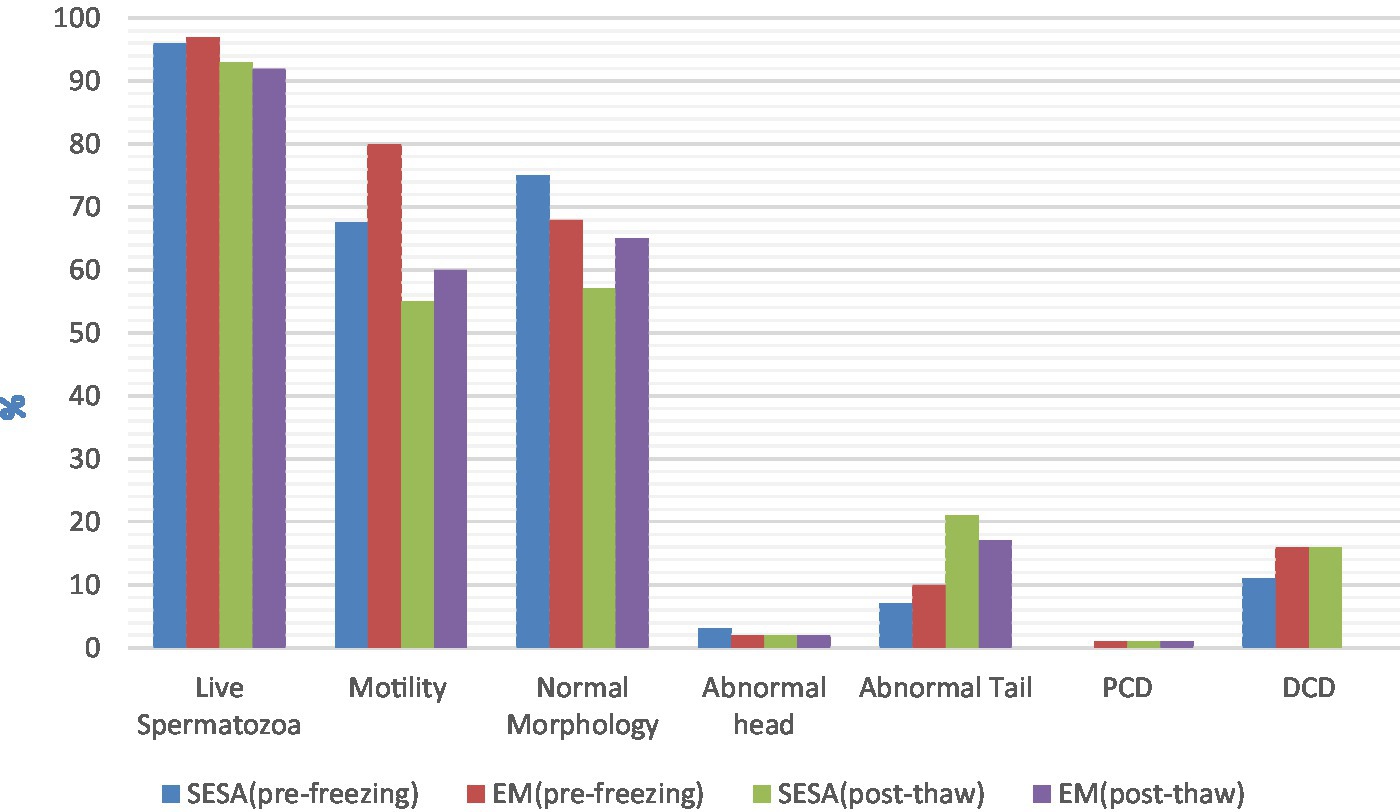
Al comparar los parámetros de los espermatozoides frescos, los espermatozoides recolectados por EM tuvieron una mejor motilidad (mediana 80,0%, IQR 88,0-65,0 y mediana 67,50%, IQR 72,5-52,5, respectivamente; p = 0,02). No se encontraron diferencias significativas para los demás parámetros de semen fresco investigados, ni para ningún parámetro post-descongelación (p > 0,05) (Figura 1). En EM, la presencia de sangre fresca, que se identificó por su color rojo en el examen macroscópico, se informó como consistentemente prevalente (+++), mientras que no se detectó (−) en SESA.
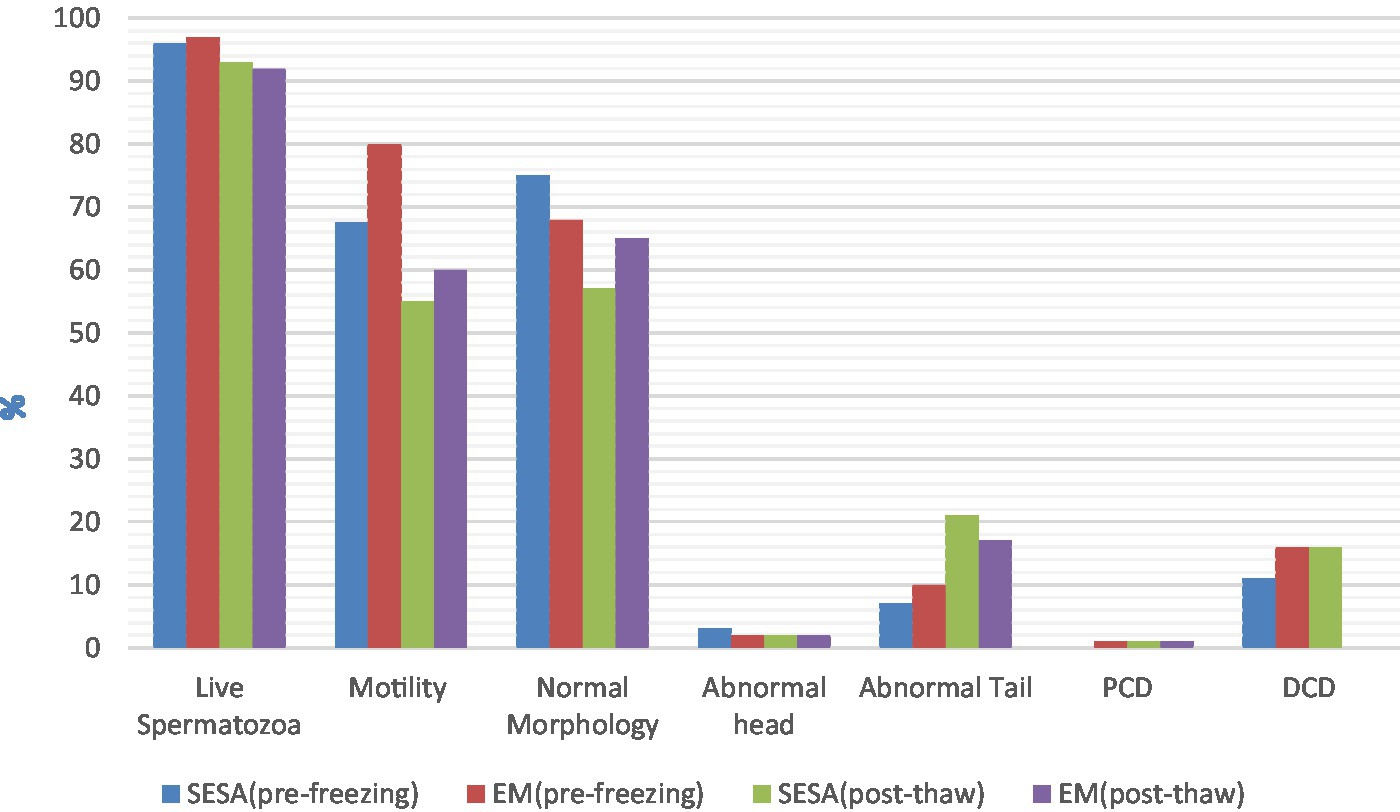 Figura 1. Parámetros espermáticos precongelados y post-descongelados en función de la técnica de recogida (EM, picado del epidídimo; SESA: aspiración de espermatozoides epididimarios de incisión única; DCP: gota citoplasmática proximal; DCD: gota citoplasmática distal).
Figura 1. Parámetros espermáticos precongelados y post-descongelados en función de la técnica de recogida (EM, picado del epidídimo; SESA: aspiración de espermatozoides epididimarios de incisión única; DCP: gota citoplasmática proximal; DCD: gota citoplasmática distal).
4.2. Criopreservación de espermatozoides del epidídimo con y sin tampón de lisis globular
Las muestras criopreservadas con el protocolo de congelación ELB tuvieron una motilidad menor que las muestras criopreservadas con el protocolo de congelación estándar (mediana 56,2%, RIC 60,0-48,7 y mediana 70,0%, RIC 72,5-63,1, respectivamente; p = 0,01). Además, las ROS intracelulares fueron mayores en las muestras criopreservadas con el protocolo de congelación ELB en comparación con el protocolo de congelación estándar (mediana 78,5%, IQR 81,2-75,5 y mediana 70,0% IQR 70,5-68,7, respectivamente; p = 0,04). No se encontraron diferencias significativas para los demás parámetros post-deshielo (p > 0,05) (Tabla 1).
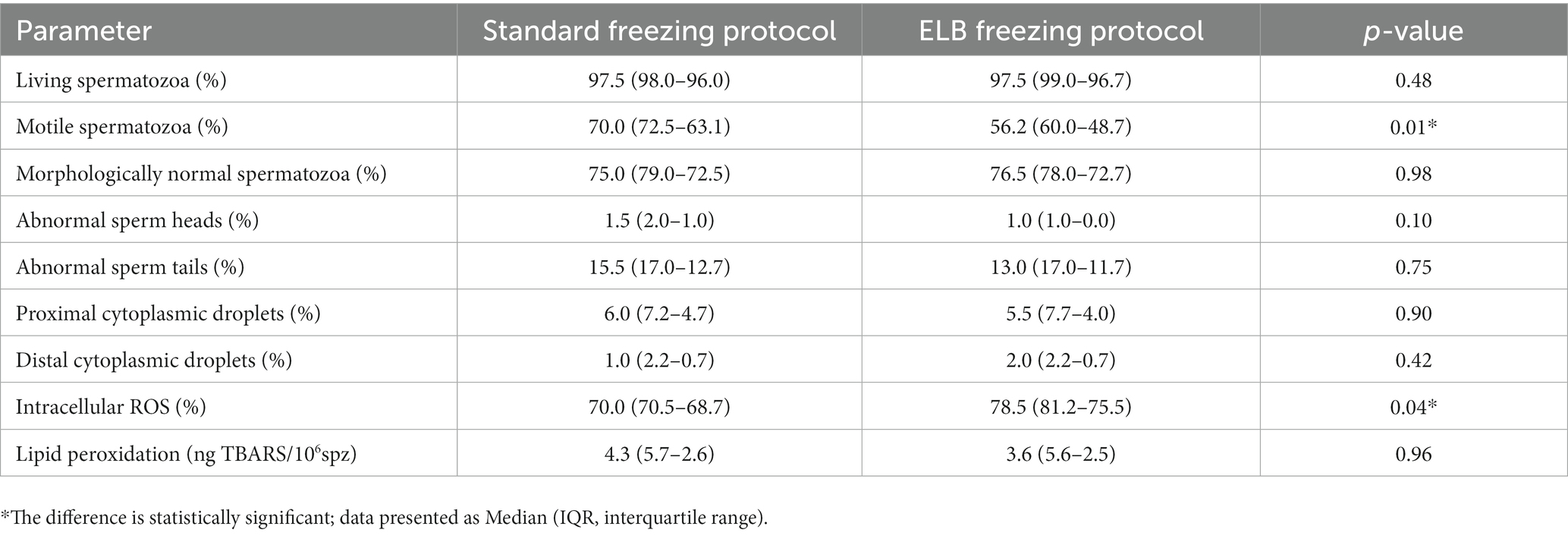 Tabla 1. Parámetros espermáticos post-descongelación de muestras de epidídimo contaminadas con sangre sometidas a un protocolo de congelación estándar o a un protocolo de congelación con tampón de lisis eritrocitaria (ELB).
Tabla 1. Parámetros espermáticos post-descongelación de muestras de epidídimo contaminadas con sangre sometidas a un protocolo de congelación estándar o a un protocolo de congelación con tampón de lisis eritrocitaria (ELB).
5. Discusión
El presente estudio proporciona evidencia de que la recuperación y calidad de los espermatozoides del epidídimo es más eficiente con la técnica EM en comparación con la técnica SESA en el perro. Sin embargo, el inconveniente del contenido sanguíneo de la muestra, inevitablemente presente cuando se aplica la técnica EM, no pudo resolverse empleando el protocolo de congelación ELB sin afectar a los parámetros espermáticos.
Cuando se recolectan espermatozoides del epidídimo, el objetivo es maximizar la recuperación de los espermatozoides, ya que este suele ser el último intento de preservar los gametos de un individuo. La mediana del recuento de espermatozoides y la motilidad de los espermatozoides después de la descongelación fueron de 1,23 × 109 espermatozoides y 60% para EM y 0,70 × 109 espermatozoides y 55% para SESA, respectivamente. Por lo tanto, ambas técnicas arrojaron suficientes espermatozoides de buena calidad para una posterior aplicación en técnicas de reproducción asistida, especialmente porque la inseminación intrauterina con espermatozoides de epidídimo congelados, cuya motilidad post-descongelación osciló entre el 20 y el 30%, resultó en embarazos (tasa de concepción del 80%) y parto de cachorros (Media ± EE: 2,3 ± 0,9) (21). La diferencia en la recuperación de espermatozoides entre las dos técnicas puede explicarse por la forma en que se recogen los espermatozoides. Mientras que los espermatozoides salen de la incisión realizada en los epidídimos con la técnica SESA, se les da tiempo para nadar en el medio de recolección durante el período de incubación posterior a la EM, lo que lleva a la recuperación de más espermatozoides. La diferencia en la motilidad de los espermatozoides también puede estar relacionada con el método de recolección, ya que se ha demostrado que los parámetros de los espermatozoides del epidídimo son similares dentro de los epidídimos emparejados (22). Varesi et al. (2) también demostraron que los espermatozoides recolectados a través de la aspiración percutánea de espermatozoides del epidídimo tenían una motilidad disminuida, aunque no significativa, en comparación con el método de picado. Esta discrepancia en la motilidad puede atribuirse al tiempo de incubación prolongado a 37 °C en la técnica de picado, que puede haber permitido la activación de espermatozoides previamente inactivos (23). Nuestros resultados no revelaron diferencias entre los dos métodos de recolección con respecto a la morfología de los espermatozoides antes de la congelación, ni para todos los parámetros de los espermatozoides posteriores a la descongelación. Dado que los espermatozoides por ambos métodos se obtuvieron del mismo animal, se anticipó que el método de recolección produciría una morfología de espermatozoides comparable.
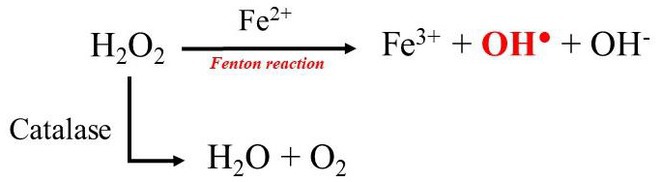
La motilidad de los espermatozoides se evaluó subjetivamente en la mayoría de los estudios con EM, ya que la presencia de eritrocitos puede dar lugar a valores poco fiables cuando se utiliza un dispositivo CASA. De hecho, los eritrocitos pueden identificarse como espermatozoides inmóviles, lo que da lugar a un recuento de espermatozoides exagerado y a una motilidad espermática subestimada (24). Por lo tanto, la posibilidad de eliminar los glóbulos rojos o el uso de un software capaz de diferenciar los espermatozoides de otras células proporcionaría una evaluación objetiva de la motilidad de los espermatozoides en futuros experimentos. También es innegable que el contenido sanguíneo es una desventaja relevante de la técnica EM, ya que la criopreservación de muestras hematospérmicas da como resultado una disminución de la motilidad de los espermatozoides, la integridad de la membrana plasmática y la integridad de los acrosomas después de la descongelación (8). Se cree que esta menor capacidad de congelación es el resultado de la hemoglobina liberada de los eritrocitos durante el proceso de congelación-descongelación (8). La hemoglobina es una rica fuente de moléculas hemo, que contienen hierro, una sustancia potencialmente tóxica (8). En circunstancias normales, el ion hierro en la hemoglobina se encuentra en el férrico (Fe2+), unido a un residuo de histidina y coordinado con el anillo de porfirina hemo a través de cuatro átomos de nitrógeno (25). Cuando Fe2+ reacciona con el peróxido de hidrógeno a través de un proceso llamado reacción de Fenton, los radicales hidroxilo (OH●), que son la forma más inestable de especies reactivas de oxígeno (26) (Figura 2). La catalasa antioxidante enzimática puede prevenir la formación de radicales hidroxilo al catalizar la descomposición del peróxido de hidrógeno en agua y oxígeno (26). Sin embargo, la catalasa no es detectable en el epidídimo de los perros (26), lo que sugiere que los radicales hidroxilo se producen en exceso como resultado.
Por lo tanto, se necesitan protocolos de preservación que incluyan la extracción de eritrocitos antes de la congelación. Cuando se utilizó la centrifugación en gradiente de densidad, el resultado mostró una pérdida de espermatozoides dentro de un intervalo del 51% al 64% en el semen canino eyaculado (19). Dado que cada espermatozoide de buena calidad es esencial en el caso de los espermatozoides del epidídimo, se deben considerar otros enfoques para eliminar los contaminantes celulares.
En este estudio se investigó el uso de un BEF antes de la criopreservación de espermatozoides, pero este tratamiento afectó la motilidad de los espermatozoides después de la descongelación y aumentó la producción de ROS intracelulares después de la descongelación. El efecto sobre la motilidad de los espermatozoides puede confirmar el efecto negativo que la hemoglobina ejerce sobre los espermatozoides, pero es inconsistente con el hallazgo de Soygur et al. (27) quienes no describieron ningún efecto del ELB sobre la motilidad de los espermatozoides después de la descongelación en humanos. Otro estudio en espermatozoides humanos mostró una disminución de la motilidad y viabilidad de los espermatozoides y un aumento de la fragmentación del ADN después del tratamiento con ELB (28), pero el tiempo de exposición del tampón de lisis a los espermatozoides fue mayor en este último estudio y utilizamos un tiempo de exposición de 5 a 10 s, que fue similar al de Soygur et al. (27). La disminución de la motilidad podría estar relacionada con la composición del tampón de lisis. Allahkarami et al. (29) informaron de una correlación negativa significativa entre los niveles de amonio plasmático seminal y la motilidad de los espermatozoides, siendo el amonio un componente crítico del ELB. Además, las muestras tratadas con ELB se sometieron a dos pasos de centrifugación adicionales a baja fuerza g, en comparación con las muestras no tratadas. Específicamente, se sabe que la función y la motilidad de los espermatozoides son sensibles a la fuerza centrífuga en otras especies (30, 31) En perros, la motilidad de los espermatozoides refrigerados disminuirá significativamente con el tiempo, pero no se verá afectada por la fuerza centrífuga, al menos hasta 2.880 x g (13). A pesar de que esto sugiere la insensibilidad del semen canino a la centrifugación, en este estudio, el semen se almacenó a 4 °C y no se criopreservaron (13). Por lo tanto, no se evaluó el posible daño del proceso de centrifugación a los espermatozoides después de la criopreservación.
Los espermatozoides de las muestras tratadas con el ELB exhibieron significativamente más ROS intracelulares que los espermatozoides de las muestras no tratadas. Las especies reactivas de oxígeno pueden ser producidas por los espermatozoides a nivel de la membrana plasmática y/o a nivel de las mitocondrias (18). El estudio encontró que el tratamiento con ELB podría tener un impacto negativo en la actividad mitocondrial y el potencial de los espermatozoides, afectando la motilidad. Sin embargo, no indujo un aumento del estrés oxidativo a los espermatozoides. Ambos métodos de recolección de espermatozoides investigados (EM y SESA) mostraron un alto potencial de criopreservación, siendo la picadura del epidídimo superior en recuperación y motilidad, pero propensa al contenido sanguíneo. La aspiración de espermatozoides del epidídimo con una sola incisión, que produce espermatozoides no contaminados con equipo básico y sin capacitación especializada, puede ser significativa. El estudio desaconseja el uso de ELB para los espermatozoides del epidídimo destinados a la criopreservación y sugiere explorar otros enfoques, como los dispositivos de separación de espermatozoides microfluídicos, para orientar futuras investigaciones.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
No se requirió aprobación ética para el estudio con animales de acuerdo con la legislación local y los requisitos institucionales, ya que las muestras utilizadas en nuestra investigación fueron epidídimos recolectados después de la orquiectomía. El motivo de la castración no estaba directamente relacionado con nuestro estudio; sin embargo, utilizamos estas muestras con fines de investigación en lugar de descartarlas.
Contribuciones de los autores
HA, EW y AS: conceptualización. HA y EW: metodología. HA y RK: investigación. PB: análisis estadístico. EW y RC: recursos. HA: escritura – preparación del borrador original. PB, GD, KS y AS: redacción – revisión y edición. HA y PB: visualización. EW, RC y AS: supervisión. AS: adquisición de fondos. Todos los autores contribuyeron al artículo y aprobaron la versión enviada.
Financiación
Este artículo ha sido financiado por la Agencia Nacional Polaca para el Intercambio Académico en el marco de la Subvención No. PPI/APM/2019/1/00044/U/00001.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Ali Hassan, H, Domain, G, Luvoni, GC, Chaaya, R, Van Soom, A, y Wydooghe, E. Semen epididimario canino y felino: una fuente abundante de gametos. Animales. (2021) 11:2961. doi: 10.3390/ani11102961
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Varesi, S, Vernocchi, V, Faustini, M, y Luvoni, GC. Calidad de los espermatozoides caninos recuperados por aspiración percutánea de espermatozoides del epidídimo. J Pequeña Anim Pract. (2013) 54:87–91. doi: 10.1111/jsap.12020
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Hori, T, Atago, T, Kobayashi, M y Kawakami, E. Influencia de diferentes métodos de recolección de los epidídidos caninos en la calidad del esperma del epidídimo caudal posterior a la descongelación. J Vet Med Sci. (2015) 77:625–30. doi: 10.1292/jvms.14-0421
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Dos Santos, IP, de Oliveira, RF, da Cunha, ICN, Ramos, JLG, Ramos, CLFG, y dos Santos Costa, PC. Combinación de ketamina y xilacina para reducir el dolor durante la electroeyaculación en perros. Pubvet. (2021) 15:1–6. doi: 10.31533/pubvet.v15n08a889.1-6
5. Kutzler, MA. Recogida de semen en el perro. Teriogenología. (2005) 64:747–54. doi: 10.1016/j.theriogenology.2005.05.023
6. Luvoni, GC, y Morselli, MG. Espermatozoides del epidídimo canino: un tesoro escondido con gran potencial. Reprod Domest Anim. (2017) 52:197–201. doi: 10.1111/rda.12820
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Mogheiseh, A, Divar, MR, Vesal, N y Mahdivand Moradloo, F. Efectos de los métodos de recuperación de espermatozoides del epidídimo en las características de los espermatozoides frescos y congelados-descongelados en perros. Reprod Domest Anim. (2022) 57:1038–45. doi: 10.1111/rda.14171
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Rijsselaere, T, Van Soom, A, Maes, D, Verberckmoes, S, y de Kruif, A. Efecto de la mezcla de sangre en la supervivencia in vitro de espermatozoides caninos refrigerados y congelados-descongelados. Teriogenología. (2004) 61:1589–602. doi: 10.1016/j.theriogenology.2003.09.008
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Khodamoradi, K, Kuchakulla, M, Narasimman, M, Khosravizadeh, Z, Ali, A, Brackett, N, et al. Laboratorio y manejo clínico de la leucocitospermia y la hematospermia: una revisión. Su Adv Reprod Health. (2020) 14:263349412092251. doi: 10.1177/2633494120922511
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Phillips, TC, Dhaliwal, GK, Verstegen-Onclin, KM, y Verstegen, JP. Eficacia de los medios de separación en gradiente de cuatro densidades para eliminar eritrocitos y espermatozoides no viables del semen canino. Teriogenología. (2012) 77:39–45. doi: 10.1016/j.theriogenology.2011.07.012
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Verheyen, G, De Croo, I, Tournaye, H, Pletincx, I, Devroey, P, y van Steirteghem, AC. Comparación de cuatro métodos mecánicos para recuperar espermatozoides del tejido testicular. Hum Reprod. (1995) 10:2956–9. doi: 10.1093/oxfordjournals.humrep.a135828
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Fayez, E, El Sayed, M, Rawash, ZM y Salama, A. Influencia de la adición de nanopartículas de óxido de zinc al medio de criopreservación para espermatozoides del epidídimo de perros. El mejor compañero Anim Med. (2023) 52:100736. doi: 10.1016/j.tcam.2022.100736
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Rijsselaere, T, Van Soom, A, Maes, D y de Kruif, A. Efecto de la centrifugación en la supervivencia in vitro de espermatozoides caninos frescos diluidos. Teriogenología. (2002) 57:1669–81. doi: 10.1016/s0093-691x(02)00663-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Peña, A, y Linde-Forsberg, C. Efectos de Equex, dilución en uno o dos pasos y dos tasas de congelación y descongelación en la supervivencia posterior a la descongelación de los espermatozoides de perro. Teriogenología. (2000) 54:859–75. doi: 10.1016/S0093-691X(00)00397-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Talwar, P. Preparación y congelación de espermatozoides para bancos; Springer. Nueva York, NY, EE.UU.: Preservación de la fertilidad (2012).
16. Rijsselaere, T, Maes, D, Van den Berghe, F, y Van Soom, A. Conservación y envío de semen de perro refrigerado y criopreservado. Vlaams Diergen Tijds. (2011) 80:248–53. doi: 10.21825/vdt.87276
17. Raad, G, Mansour, J, Ibrahim, R, Azoury, J, Azoury, J, Mourad, Y, et al. ¿Cuáles son los efectos de la vitamina C en las propiedades funcionales de los espermatozoides durante el procedimiento de swim-up directo? Cigoto. (2019) 27:69–77. doi: 10.1017/S0967199419000030
18. Esfandiari, N, Sharma, RK, Saleh, RA, Thomas, AJ Jr, and Agarwal, A. Utility of the nitroblue tetrazolium reduction test for assessment of reactive oxygen species production by seminal leukocytes and spermatozoa. J Androl. (2003) 24:862–70. doi: 10.1002/j.1939-4640.2003.tb03137.x
19. Domain, G, Ali Hassan, H, Wydooghe, E, Bogado Pascottini, O, Johannisson, A, Morrell, JM, et al. Influence of single layer centrifugation with Canicoll on semen Freezability in dogs. Animals. (2022) 12:714. doi: 10.3390/ani12060714
20. Leclezio, L, Jansen, A, Whittemore, VH, and de Vries, PJ. Pilot validation of the tuberous sclerosis-associated neuropsychiatric disorders (TAND) checklist. Pediatr Neurol. (2015) 52:16–24. doi: 10.1016/j.pediatrneurol.2014.10.006
21. Hori, T, Hagiuda, K, y Endo, S. Inseminación intrauterina unilateral con espermatozoides del epidídimo caudal criopreservados recuperados de epidídidos caninos refrigerados. J Vet Med Sci. (2005) 67:1141–7. doi: 10.1292/jvms.67.1141
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Hori, T, Ichikawa, M y Kawakami, E. Inseminación artificial de espermatozoides epididimarios congelados en perros beagle. J Vet Med Sci. (2004) 66:37–41. doi: 10.1292/jvms.66.37
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Salang, L, Seejorn, K, y Pongsritasana, T. Efecto de la temperatura de incubación sobre los parámetros seminales antes de la inseminación intrauterina. Res. Cuadrado. (2021) 1–9. DOI: 10.21203/Rs.3.RS-843825/V1
24. Finelli, R, Leisegang, K, Tumallapalli, S, Henkel, R, y Agarwal, A. Validez y fiabilidad de los analizadores de semen asistidos por ordenador en la realización de análisis de semen: una revisión sistemática. Trad. Androl Urol. (2021) 10:3069–79. doi: 10.21037/tau-21-276
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Marengo-Rowe, AJ. Relaciones estructura-función de las hemoglobinas humanas. Proc (Bayl Univ Med Cent). (2006) 19:239–45. doi: 10.1080/08998280.2006.11928171
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Angrimani, DSR, Lucio, CF, Veiga, GAL, Silva, LCG, Regazzi, FM, Nichi, M, et al. Maduración espermática en perros: perfil espermático y estado antioxidante enzimático en espermatozoides eyaculados y epididimarios. Andrología. (2013) 46:814–9. doi: 10.1111/and.12154
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Soygur, B, Celik, S, Celik-Ozenci, C y Sati, L. Efecto del medio de separación eritrocito-espermatozoide sobre los parámetros de madurez nuclear, acrosómica y de membrana en espermatozoides humanos. J Assist Reprod Genet. (2018) 35:491–501. doi: 10.1007/s10815-017-1085-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Yazdinejad, F, Heydari, L, Motamed, ZL, Seifati, SM y Agha-Rahimi, A. La aplicación del tampón de lisado de eritrocitos (ELB) tiene efectos perjudiciales sobre los parámetros de calidad del esperma humano, la fragmentación del ADN y la estructura de la cromatina. Andrología. (2020) 52:e13702. doi: 10.1111/and.13702
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Allahkarami, S, Atabakhsh, M, Moradi, MN, Ghasemi, H, Bahmanzadeh, M, y Tayebinia, H. Correlación del ácido úrico, la urea, el amoníaco y la creatinina del plasma seminal con los parámetros seminales y la tasa de fertilización de las parejas infértiles. Avicena J Med Biochem. (2017) 5:76–80. doi: 10.15171/ajmb.2017.14
30. Sharma, RK, Vemulapalli, S, Kohn, S y Agarwal, A. Efecto de la velocidad de la centrífuga, el medio de refrigeración y el medio de lavado de espermatozoides en la calidad del esperma criopreservado después de la descongelación. Arch Androl. (1997) 39:33–8. doi: 10.3109/01485019708987899
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: perro, espermatozoides del epidídimo, método de recolección, picado del epidídimo, aspiración de espermatozoides del epidídimo de una sola incisión, tampón de lisis eritrocitaria
Cita: Ali Hassan H, Banchi P, Domain G, El Khoury R, Chaaya R, Wydooghe E, Smits K y Van Soom A (2023) Un estudio comparativo de las técnicas de recolección de espermatozoides del epidídimo canino y la criopreservación. Frente. Vet. Sci. 10:1181054. doi: 10.3389/fvets.2023.1181054
Recibido: 06 de marzo de 2023; Aceptado: 20 de septiembre de 2023;
Publicado: 24 Octubre 2023.
Editado por:
Amal M. Aboelmaaty, Centro Nacional de Investigación, Egipto
Revisado por:
Diya El-Badry, Instituto de Investigación de la Producción Animal (APRI), Egipto Ali Salama, Universidad de El Cairo, Egipto
Derechos de autor © 2023 Ali Hassan, Banchi, Domain, El Khoury, Chaaya, Wydooghe, Smits y Van Soom. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY). S
*Correspondencia: Hiba Ali Hassan, hiba_alihasan@hotmail.com
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía