El extracto rico en cannabidiol de espectro completo redujo la dosis de propofol necesaria para la inducción anestésica en perros
El extracto rico en cannabidiol de espectro completo redujo la dosis de propofol necesaria para la inducción anestésica en perros: un estudio piloto
 João Lourenço Hasckel Gewehr1*
João Lourenço Hasckel Gewehr1*  María Laura Enzele1
María Laura Enzele1  Lucas Marlon Freiria2
Lucas Marlon Freiria2  Morgana Martins Nunes2
Morgana Martins Nunes2  Júlia Spengler2
Júlia Spengler2  Ana Paula Dondoerfer Teixeira2
Ana Paula Dondoerfer Teixeira2  Erik Amazonas3,4
Erik Amazonas3,4  Vanessa Sasso Padilha3
Vanessa Sasso Padilha3- 1Medicina Veterinaria, Universidad Federal de Santa Catarina (UFSC), Curitibanos, Brasil
- 2Escuela de Clínica Veterinaria (CVE) de la Universidad Federal de Santa Catarina (UFSC), Curitibanos, Brasil
- 3Departamento de Biociencias y Una Salud (BSU), Centro de Ciencias Rurales (CCR), Universidad Federal de Santa Catarina (UFSC), Curitibanos, Brasil
- 4Centro de Desarrollo e Innovación del Cannabis (PODICAN/UFSC), Curitibanos, Brasil
Introducción: Los cannabinoides muestran un gran potencial terapéutico, pero su efecto sobre la anestesia aún no está claro. El uso de cannabis recreativo crónico en humanos sometidos a procedimientos anestésicos tiende a requerir una dosis más alta en comparación con los no usuarios. Por otro lado, estudios en roedores y perros han demostrado que los agonistas cannabinoides pueden potenciar ciertos anestésicos. Este contraste de efectos posiblemente se produce debido a los diferentes tiempos de administración de diferentes fitocannabinoides a diferentes dosis, y sus distintos efectos sobre el sistema endocannabinoide, que también se ve afectado por anestésicos como el propofol y el isoflurano.
Métodos: Se seleccionaron 27 perros machos sanos, propiedad de clientes, con edades comprendidas entre 1 y 7 años y entre 5 y 35 kg, con un peso promedio de 15,03±7,39 kg, con propietarios que ofrecieron voluntariamente sus animales para participar de la investigación realizada en la Universidad Federal de Santa Catarina (UFSC). Los perros fueron aleatorizados en 3 grupos. El grupo control (CON, n = 9), recibiendo solo Aceite de Oliva Virgen Extra, la misma base de aceite utilizada en los grupos de tratamiento. El grupo 2 (G2, n = 9) recibió 2 mg/kg de fitocannabinoides totales, y el grupo 3 (G3, n = 9) recibió 6 mg/kg de fitocannabinoides totales. Todos los grupos recibieron sus tratamientos por vía transmucosa, 75 min antes de su inducción con propofol. Se evaluaron la frecuencia cardíaca y respiratoria, la presión arterial, la temperatura y la sedación antes y a los 30, 60 y 75 minutos después de la administración del extracto rico en fsCBD o extracto placebo. También se incluyó el protocolo de medicación preanestésica en todos los grupos de tratamiento, 15 minutos antes de la inducción. Los datos paramétricos se analizaron con ANOVA de una vía, seguido de Student-Newman-Keuls (SNK) si se encontraron diferencias estadísticamente significativas. Los datos no paramétricos se analizaron mediante la prueba de Friedman, seguida de la prueba de Dunn para realizar comparaciones entre todos los puntos temporales del mismo grupo. Se utilizó Kruskal-Wallis, seguido de Dunn, para las comparaciones entre grupos. La dosis de propofol necesaria para la inducción se analizó mediante ANOVA de una vía seguido de la prueba de comparaciones múltiples de Tukey, utilizando Instat by Graphpad, y las diferencias se consideraron estadísticamente significativas cuando p < 0,05. Nuestro análisis evaluó si había significación estadística entre puntos temporales en el mismo grupo y entre grupos en los mismos puntos temporales.
Resultados: En nuestro estudio, 6 mg/kg de fitocannabinoides totales fueron capaces de reducir la dosis de propofol necesaria para la inducción en un 23% en comparación con el grupo control. El extracto rico en fsCBD no produjo una sedación significativa dentro o entre los grupos, aunque se encontraron diferencias estadísticamente significativas en la frecuencia cardíaca y la presión arterial sistólica.
Discusión: Nuestros hallazgos indican que los fitocannabinoides podrían ser una opción complementaria en la anestesia, aunque se necesita más investigación para confirmar mejor estos datos. Además, se necesita más investigación para determinar la mejor dosis, el método de administración, el tiempo de administración, el perfil molecular ideal para los efectos deseados, la seguridad, las interacciones farmacológicas y los efectos transquirúrgicos.
Introducción
La criminalización del cannabis ha dificultado el estudio del cannabis por parte de los científicos, lo que ha limitado la comprensión de las comunidades científicas y médicas sobre su potencial terapéutico. Los principios modernos de la anestesiología se establecieron durante la prohibición del cannabis y, en gran parte, bajo un completo desconocimiento del sistema endocannabinoide y el papel que puede desempeñar en la anestesia. Por lo tanto, la relación del sistema endocannabinoide (SEC) con los anestésicos aún no se ha estudiado en profundidad y sigue sin estar clara. Sin embargo, cada vez hay más pruebas de que muchos fármacos comúnmente utilizados interactúan con el SEC (1-7) y, por lo tanto, muchos de sus mecanismos pueden estar, al menos parcialmente, mediados por este sistema.
La mayoría de las investigaciones modernas se centraron en el impacto del consumo crónico de marihuana en la inducción anestésica En humanos con uso crónico de altas dosis de tetrahidrocannabinol (THC), un agonista exógeno del receptor cannabinoide 1 (CB1), parece ser necesaria una dosis más alta de propofol en comparación con los no consumidores (8-10), posiblemente debido a una desensibilización o regulación a la baja del receptor. la cual ha sido reportada en roedores y humanos expuestos crónicamente a altos niveles de esta molécula. Por el contrario, las administraciones agudas de THC parecen aumentar la densidad de estos receptores y mejorar su sensibilidad a los endocannabinoides (4). La investigación realizada en ratones ha demostrado que la administración de un agonista cannabinoide sintético en realidad redujo las dosis de propofol (1). Esto también se informó en perros que recibieron fitocannabinoides por vía intraperitoneal (11).
Estos diferentes efectos pueden ser causados por diferentes períodos de tiempo de administración de THC, aunque esto espera más investigación. Lo más probable es que un aumento en la densidad del receptor y/o la sensibilidad mejore los efectos del propofol, ya que los estudios han indicado que el propofol modula indirectamente el CB1 (1-3, 7).
El receptor CB1 se clasifica como un receptor acoplado a proteína G (GPCR) que interactúa con los canales iónicos en las neuronas presinápticas, lo que conduce a su control sobre la neurotransmisión y la modulación del dolor (12, 13). Uno de los ligandos endógenos del receptor CB1 es la N-araquidonoiletanolamina o anandamida (AEA), transportada intracelularmente por las Proteínas de Unión a Ácidos Grasos (FABP) y posteriormente catabolilizada por la enzima Amida Hidrolasa de Ácidos Grasos (FAAH). El propofol parece ser un inhibidor de la FAAH (1, 3, 14), por lo que al reducir la recaptación de anandamida, el propofol permite una mayor disponibilidad de esta molécula. El cannabidiol (CBD), un fitocannabinoide, también inhibe esta enzima y se une a los FABP, lo que reduce la descomposición y recaptación de AEA. Es probable que muchos de los efectos del CBD también estén mediados por estos mecanismos de acción (15). Además de la inhibición enzimática, el CBD también actúa como modulador alostérico de este receptor, que también puede ser uno de sus mecanismos (16).
En esta investigación, evaluamos los efectos de diferentes dosis de fitocannabinoides administrados por vía transmucosa 60 min antes de la premedicación anestésica en las dosis de propofol necesarias para la inducción anestésica.
Materiales y métodos
Extracto rico en cannabidiol de espectro completo y aprobación de la junta de ética
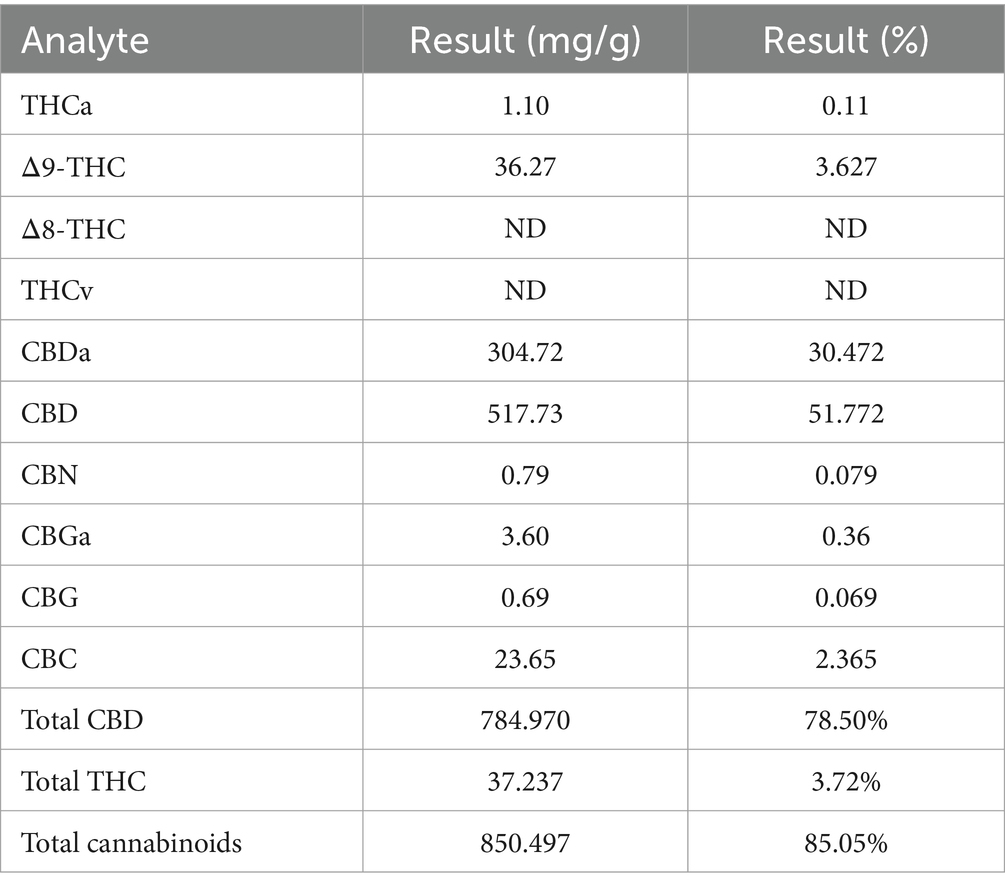
Los extractos de Cannabis (extracto rico en fsCBD) utilizados en este estudio fueron proporcionados por «Cannabis Sem Fronteiras» a través de su proyecto de extensión de fitoterapia veterinaria (número 202213421). El aceite consistía en un extracto de espectro completo rico en cannabidiol (rico en fsCBD) de una proporción de CBD:THC de aproximadamente 21:1, y una proporción CBD:CBDa de 1,6:1 (Certificado de Análisis THCA22021606-01, The Higher Commitment Analytical Lab, Estados Unidos) (Tabla 1). La investigación fue aprobada por el Comité de Ética de la Universidad (número 2065211122), y la autorización para poseer, transportar e investigar extractos de Cannabis fue otorgada mediante el habeas corpus n° 5040089-27.2021.4.04.7200/SC.
Animales
Se seleccionaron 27 perros machos sanos, propiedad de clientes, con edades comprendidas entre 1 y 7 años y entre 5 y 35 kg, con un peso promedio de 15,03 ± 7,39 kg, con propietarios que ofrecieron voluntariamente sus animales para participar de la investigación realizada en la Universidad Federal de Santa Catarina (UFSC). Los perros fueron aleatorizados en 3 grupos. El grupo control (CON, n = 9), recibiendo solo Aceite de Oliva Virgen Extra, la misma base de aceite utilizada en los grupos de tratamiento. El grupo 2 (G2, n = 9) recibió 2 mg/kg de fitocannabinoides totales, y el grupo 3 (G3, n = 9) recibió 6 mg/kg de fitocannabinoides totales. Todos los grupos recibieron sus tratamientos por vía transmucosa, 75 min antes de su inducción con propofol.
Criterios de inclusión y exclusión
A su llegada a la Facultad de Clínica Veterinaria ubicada en la Universidad Federal de Santa Catarina – Campus de Curitibaños, los animales fueron examinados físicamente y evaluados por un veterinario para determinar su nivel de actividad y conciencia, color de la mucosa, tiempo de llenado capilar, tamaño de los ganglios linfáticos, hidratación, frecuencia cardíaca y respiratoria y temperatura rectal. De cada paciente se extrajo sangre y se envió al Laboratorio de Análisis Clínicos de la UFSC (LACLIN). Evaluación hematológica y bioquímica que incluye hemograma completo, leucograma, alanina aminotransferasa (ALT), fosfatasa alcalina (ALP), urea, creatinina, albúmina y niveles de proteínas plasmáticas totales. No se excluyeron los animales que presentaban ligeras elevaciones de la albúmina y de la proteína plasmática total que parecían clínicamente insignificantes. Se excluyeron del estudio los animales que tenían alguna evidencia de enfermedad cardíaca, hepática, renal o metabólica en el análisis de sangre o en el examen físico.
Aleatorización y cegamiento
Los animales fueron asignados aleatoriamente a uno de los tres grupos por el coordinador de la investigación a través del sitio web de randomizer.org. Solo el coordinador y el personal capacitado que administraba el aceite sabían a qué grupo de tratamiento pertenecía cada paciente.
Ensayo clínico
Los animales que cumplieron con los criterios de inclusión fueron seleccionados para participar en la investigación. Se pidió a los propietarios que no proporcionaran comida ni agua a los animales 12 horas antes del procedimiento. A su llegada, se les retiró el pelo de la región de acceso venoso y de la región utilizada para evaluar la presión arterial sistólica, y se permitió que los pacientes se acostumbraran a las perreras de la Clínica Escuela Universitaria (CVE/UFSC) durante 10 minutos antes de su primera evaluación.
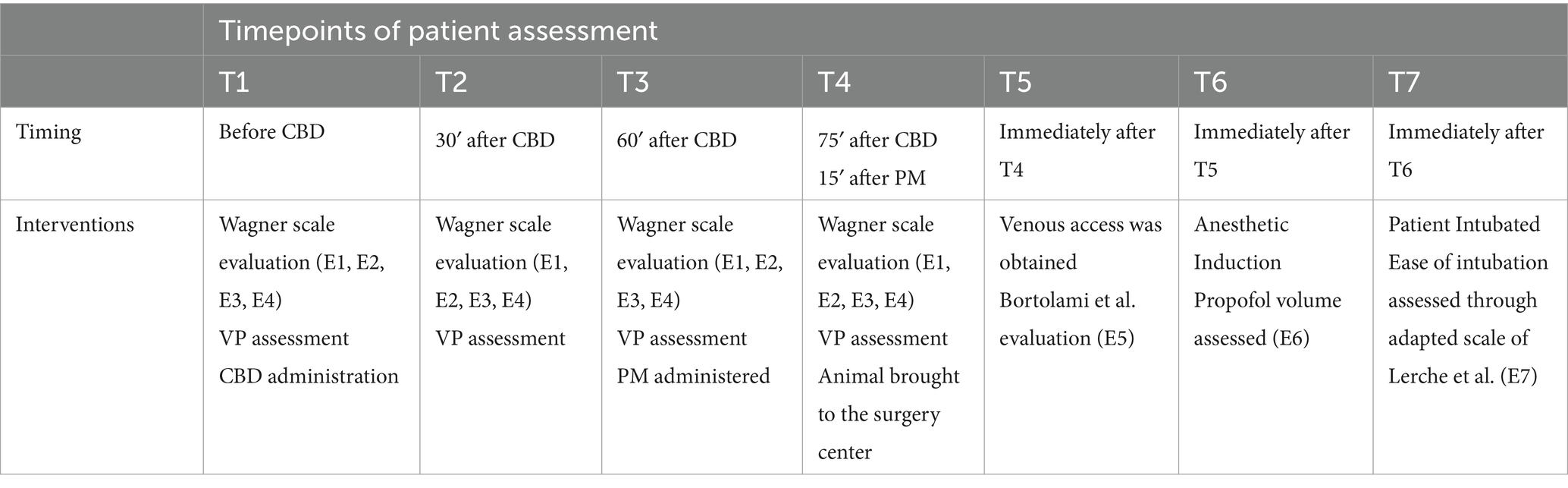
Los pacientes fueron evaluados en siete momentos: inmediatamente antes de la administración de los extractos ricos en CBD (T1), 30 min después de la administración del extracto rico en fsCBD (T2), 60 min después de la administración del extracto rico en fsCBD (T3), 15 min después de la administración de la medicación preanestésica (PM) (T4), en su acceso venoso (T5), en su inducción anestésica (T6) y en su intubación (T7).
El extracto rico en fsCBD y el placebo fueron aplicados a las encías de los pacientes por el mismo personal capacitado inmediatamente después de las evaluaciones en T1, y entre las evaluaciones, los animales se dejaron solos en una perrera tranquila y ligeramente oscura.
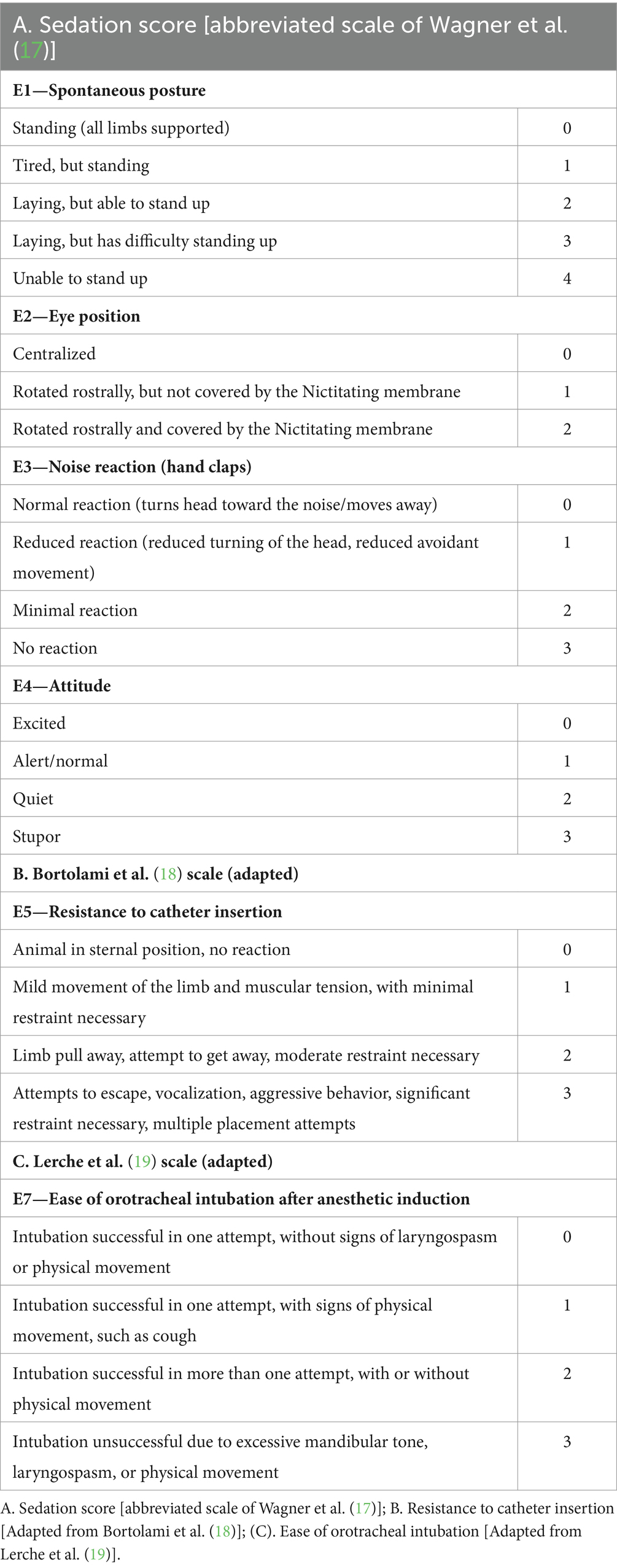
Las evaluaciones realizadas en T1, T2, T3 y T4 consistieron en el nivel de sedación a través de la escala abreviada de Wagner validada (17), que consistió en 4 evaluaciones: postura espontánea (E1), posición del globo ocular (E2), reacción al ruido (E3) y actitud (E4). Durante todos estos puntos de tiempo, los parámetros vitales (VP), incluida la frecuencia cardíaca (FC) y la frecuencia respiratoria (RR), la presión arterial sistólica (PAS) y la temperatura rectal (RT), también fueron evaluados por el mismo veterinario. La FC se evaluó mediante auscultación con estetoscopio, la RR se evaluó mediante inspección visual, la SPB se evaluó mediante un Doppler Parks Modelo 811-B, utilizando manguitos de un tamaño acorde con el animal evaluado (40-50% de la circunferencia de la extremidad del animal), y la RT mediante termómetro.
Inmediatamente después de la evaluación de VP en T3, se administró PM. Consistió en 0,05 mg/kg de acepromazina y 0,2 mg/kg de metadona administrados por vía intramuscular, 60 min después de la administración del extracto rico en fsCBD. Después de las evaluaciones en T4, los animales fueron llevados al centro quirúrgico, en la habitación contigua, listos para su inducción anestésica. El acceso venoso se obtuvo mediante la colocación y fijación de un catéter intravenoso en la extremidad torácica izquierda, y su resistencia se evaluó a través de la escala adaptada de Bortolami et al. (18), consistente en la evaluación 5 en T5.
Inmediatamente después, se administró propofol por vía intravenosa a razón de 2 mg/kg/min a través de una bomba de infusión de jeringa Digiacare, modelo SR31x. La administración se detuvo cuando el paciente perdió el reflejo palpebral y el tono mandibular, lo que permitió la intubación, consistente en la Evaluación 6 (E6) en T6. La intubación se realizó mediante un tubo endotraqueal de tamaño compatible, y su facilidad de colocación se evaluó mediante la escala modificada de Lerche et al. (19), siendo la evaluación 7 (E7), realizada en T7. Las escalas de valoración de los pacientes se muestran en la Tabla 2. Los puntos de tiempo se resumen en la Tabla 3.
Inmediatamente después de la inducción y la intubación, los animales fueron acoplados al sistema anestésico de acuerdo con su tamaño. El mantenimiento anestésico se llevó a cabo mediante la administración del anestésico volátil isoflurano dosis-efecto mediante un vaporizador universal, diluido en O al 100%2. Los signos vitales del paciente se evaluaron a través de un oxímetro de pulso y un termómetro rectal conectados a un monitor multiparamétrico Deltalife, se monitoreó la frecuencia respiratoria visualizando el movimiento torácico del paciente y se midió su presión arterial sistólica utilizando un Doppler Parks Modelo 811-B con un tamaño de manguito compatible, cada 5 min o cuando fuera necesario.
Los pacientes fueron considerados en el plano anestésico quirúrgico adecuado cuando no presentaban reflejo palpebral, no tenían tono mandibular y los globos oculares rotaban rostralmente. El cabello se retiró del sitio quirúrgico y luego se preparó con técnica aséptica con alcohol-yodo-alcohol y bloqueo local realizado con lidocaína al 2%, a dosis de 5 mg/kg, aplicada al cordón espermático. Posteriormente, la técnica de orquiectomía abierta fue realizada por tres cirujanos a lo largo del proyecto. Al final del procedimiento, se apagó el isoflurano y se extubó al paciente cuando había un reflejo de deglución.
Tras la finalización del procedimiento quirúrgico, los pacientes fueron medicados por vía subcutánea con 0,2 mg/kg de Meloxicam, 5 mg/kg de Enrofloxacino y 25 mg/kg de dipirona. Después de que el paciente recuperó la conciencia con una temperatura corporal estable y una coordinación normal, se realizó el alta médica al cliente, con instrucciones para el uso de un collar isabelino hasta que se retiraran los puntos de sutura de piel no absorbibles. A los pacientes se les prescribió Meloxicam 0,1 mg/kg y Dipirona 25 mg/kg, ambos por vía oral, durante 3 y 5 días, respectivamente.
La mayoría de los pacientes regresaron después de 10 a 15 días para la extracción de suturas o el seguimiento. Algunos propietarios decidieron retirar las suturas en clínicas privadas por conveniencia, pero informaron a los investigadores que los animales estaban bien, sin complicaciones aparentes del procedimiento quirúrgico. Algunos pacientes presentaron dehiscencia de suturas debido a que los propietarios no eran consistentes con el uso del collar isabelino. Los propietarios no informaron ninguna otra complicación posquirúrgica importante.
Análisis estadístico
Los datos paramétricos se analizaron con ANOVA de una vía, seguido de Student-Newman-Keuls (SNK) si se encontraron diferencias estadísticamente significativas.
Los datos no paramétricos se analizaron mediante la prueba de Friedman, seguida de la prueba de Dunn para realizar comparaciones entre todos los puntos temporales del mismo grupo. Se utilizó Kruskal-Wallis, seguido de Dunn, para las comparaciones entre grupos. Las diferencias se consideraron estadísticamente significativas cuando p < 0,05, y todos estos análisis se realizaron mediante Instat by Graphpad.
La dosis de propofol necesaria para la inducción se analizó mediante ANOVA de una vía seguido de la prueba de comparaciones múltiples de Tukey, utilizando Instat by Graphpad.
Nuestro análisis evaluó si había significación estadística entre puntos temporales en el mismo grupo y entre grupos en los mismos puntos temporales. De esta manera, evaluamos si los grupos que recibieron extracto rico en fsCBD mostraron algún signo de sedación después de la administración, así como si parecían más sedados después de la administración de la medicación preanestésica en comparación con el grupo control.
Se realizó un coeficiente de correlación intraclase comparando los resultados de ambos evaluadores, evaluando la fiabilidad de la escala.
Resultados
Escala de sedación
La tabla de sedación para todos los grupos se puede encontrar en la Figura 1. A pesar de que ambos evaluadores eran veterinarios, el evaluador 2 es un posgrado en anestesiología, y se considera más experimentado que el evaluador 1.
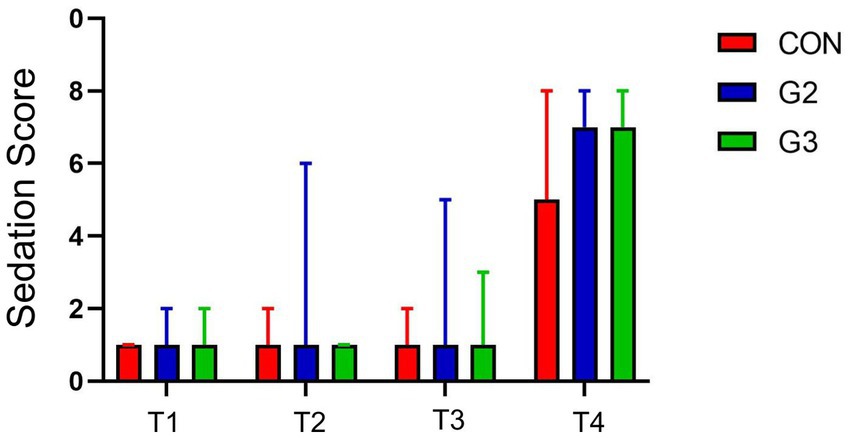 Figura 1. Puntuación de sedación (suma de E1, E2, E3 y E4 de la escala abreviada de Wagner) por punto temporal para todos los grupos: tratados con control (CON), 2 mg/kg (G2) y 6 mg/kg (G3) de fitocannabinoides totales, respectivamente, 75 min antes de la inducción anestésica con propofol.
Figura 1. Puntuación de sedación (suma de E1, E2, E3 y E4 de la escala abreviada de Wagner) por punto temporal para todos los grupos: tratados con control (CON), 2 mg/kg (G2) y 6 mg/kg (G3) de fitocannabinoides totales, respectivamente, 75 min antes de la inducción anestésica con propofol.
El grupo G3, que recibió 6 mg/kg de fitocannabinoides, requirió una dosis de propofol significativamente menor (p < 0,0138) en comparación con el grupo placebo (CON), mediante un ANOVA de un factor seguido de la prueba de comparaciones múltiples de Tukey.
Se encontró significación estadística en todos los grupos (valor de p < 0,0001), al comparar E1, E2, E3 y E4 en T1, T2, T3 con T4 a través de ANOVA de una vía y la prueba de comparaciones múltiples de Student-Newman-Keuls (SNK). Sin embargo, las comparaciones que involucran solo T1, T2 y T3 no han mostrado diferencias estadísticas significativas en todos los grupos. Teniendo en cuenta que la T4 fue de 15 min después de la administración de la medicación preanestésica, se esperaba sedación para todos los pacientes.
Las comparaciones de las puntuaciones de E1, E2, E3 y E4 en T1, T2 y T3 entre diferentes grupos no han mostrado diferencias estadísticamente significativas utilizando el análisis ANOVA de una vía, para ambos evaluadores. T2 tuvo diferencia estadística utilizando esta prueba, pero la prueba de comparaciones múltiples SNK demostró un valor de p de 0,0936, considerado no significativo. El análisis de las puntuaciones totales (suma de todas las evaluaciones realizadas en ese momento) entre los grupos no ha demostrado significación estadística.
Estos resultados indican que las administraciones de 2 mg/Kg o 6 mg/Kg de fitocannabinoides en este extracto rico en fsCBD no tuvieron efectos sedantes significativos en los pacientes, ni amplificaron los efectos sedantes de la combinación de Acepromazina y Metadona.
Frecuencia respiratoria
Las pruebas de ANOVA de una vía y de comparación múltiple SNK no han demostrado diferencias estadísticas en la frecuencia respiratoria entre los puntos temporales de evaluación, en todos los grupos (Figura 2).
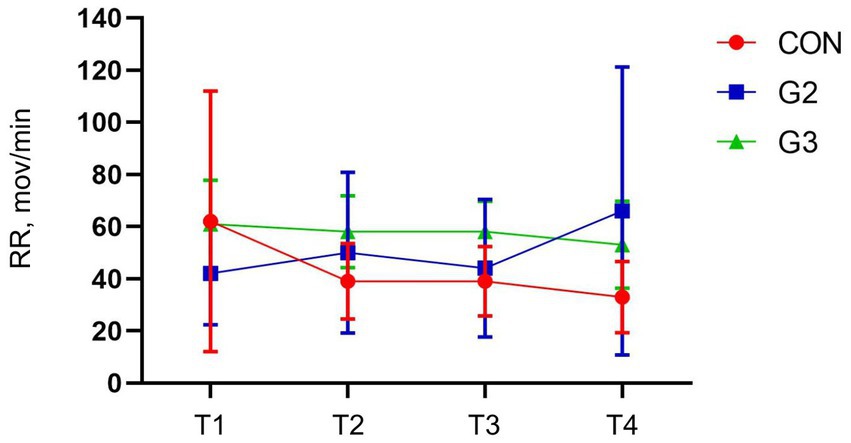 Figura 2. Valores medios y desviación estándar de la frecuencia respiratoria (RR, mov/min) de los perros sometidos a orquiectomía electiva y tratados con control (CON), 2 mg/kg (G2) y 6 mg/kg (G3) de fitocannabinoides totales, respectivamente, 75 min antes de la inducción anestésica con propofol.
Figura 2. Valores medios y desviación estándar de la frecuencia respiratoria (RR, mov/min) de los perros sometidos a orquiectomía electiva y tratados con control (CON), 2 mg/kg (G2) y 6 mg/kg (G3) de fitocannabinoides totales, respectivamente, 75 min antes de la inducción anestésica con propofol.
Polígrafo
El análisis a través de ANOVA de una vía tuvo diferencias estadísticas en CON y G3. Sin embargo, la prueba SNK Multiple Comparisons no ha mostrado diferencias estadísticas para la CON, pero ha confirmado la significación estadística en la frecuencia cardíaca entre T1, T2 y T3 con T4 en la G3 (Figura 3).
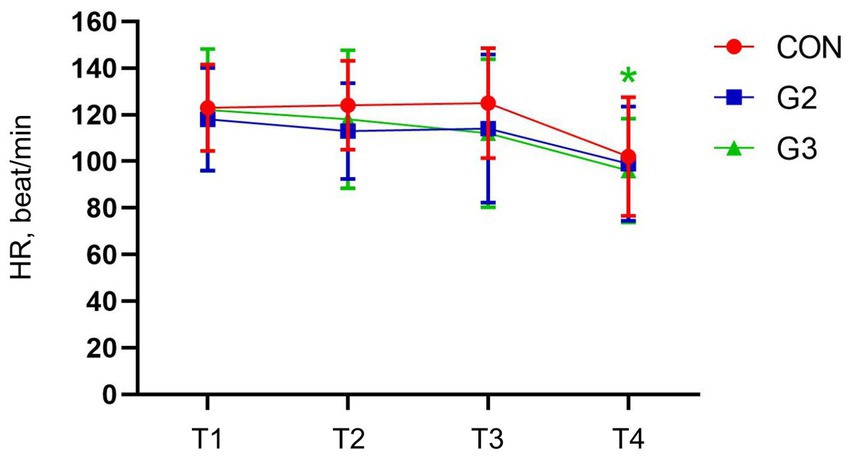 Figura 3. Valores medios y desviación estándar de la frecuencia cardíaca (FC, latido/min) de perros sometidos a orquiectomía electiva y tratados con control (CON), 2 mg/kg (G2) y 6 mg/kg (G3) de fitocannabinoides totales, respectivamente, 75 min antes de la inducción anestésica con propofol.
Figura 3. Valores medios y desviación estándar de la frecuencia cardíaca (FC, latido/min) de perros sometidos a orquiectomía electiva y tratados con control (CON), 2 mg/kg (G2) y 6 mg/kg (G3) de fitocannabinoides totales, respectivamente, 75 min antes de la inducción anestésica con propofol.
Presión arterial sistólica
No hubo diferencias estadísticas entre los puntos temporales de evaluación en el CON. G2, sin embargo, tuvo diferencias significativas entre T1, T2, T3 y T4. El G3 presentó las mismas diferencias que el G2, y también entre el T1 y el T2, antes de la administración de la medicación preanestésica. Todas estas diferencias estadísticamente significativas se confirmaron mediante la prueba de comparaciones múltiples de SNK (Figura 4).
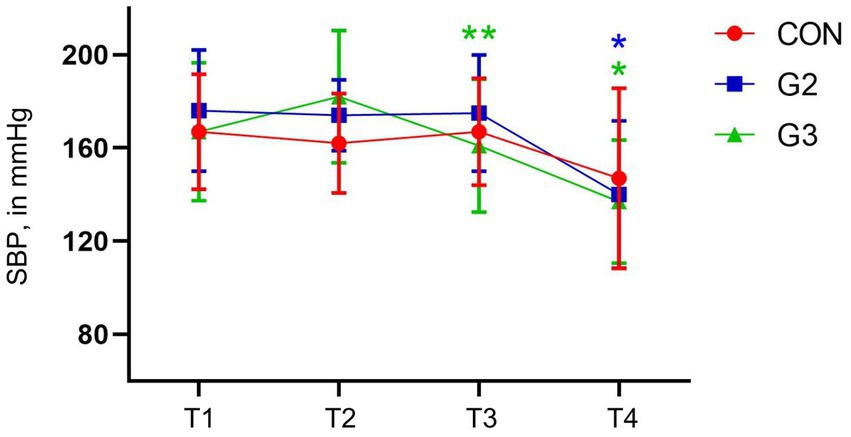 Figura 4. Valores medios y desviación estándar de la presión arterial sistólica (PAS, en mmHg) de perros sometidos a orquiectomía electiva, y tratados con control (CON), 2 mg/kg (G2) y 6 mg/kg (G3) de fitocannabinoides totales, respectivamente, 75 min antes de la inducción anestésica con propofol.
Figura 4. Valores medios y desviación estándar de la presión arterial sistólica (PAS, en mmHg) de perros sometidos a orquiectomía electiva, y tratados con control (CON), 2 mg/kg (G2) y 6 mg/kg (G3) de fitocannabinoides totales, respectivamente, 75 min antes de la inducción anestésica con propofol.
Temperatura
Se encontraron diferencias estadísticas en todos los grupos, entre T1, T2, T3 y T4. El CON también tuvo una diferencia significativa entre T1 y T3, y el G2 tuvo una diferencia significativa entre T1 y T2, y T1 y T3, confirmada a través de la prueba de comparaciones múltiples SNK (Figura 5).
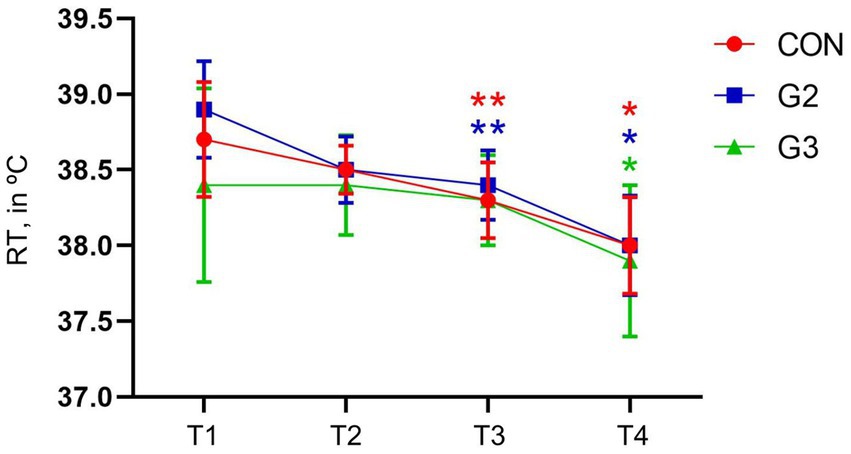 Figura 5. Valores medios y desviación estándar de la Temperatura Rectal (RT, en °C) de perros sometidos a orquiectomía electiva, y tratados con control (CON), 2 mg/kg (G2) y 6 mg/kg (G3) de fitocannabinoides totales, respectivamente, 75 min antes de la inducción anestésica con propofol.
Figura 5. Valores medios y desviación estándar de la Temperatura Rectal (RT, en °C) de perros sometidos a orquiectomía electiva, y tratados con control (CON), 2 mg/kg (G2) y 6 mg/kg (G3) de fitocannabinoides totales, respectivamente, 75 min antes de la inducción anestésica con propofol.
Los valores medios y la desviación estándar para todos los VP evaluados se pueden encontrar en la Tabla 4.
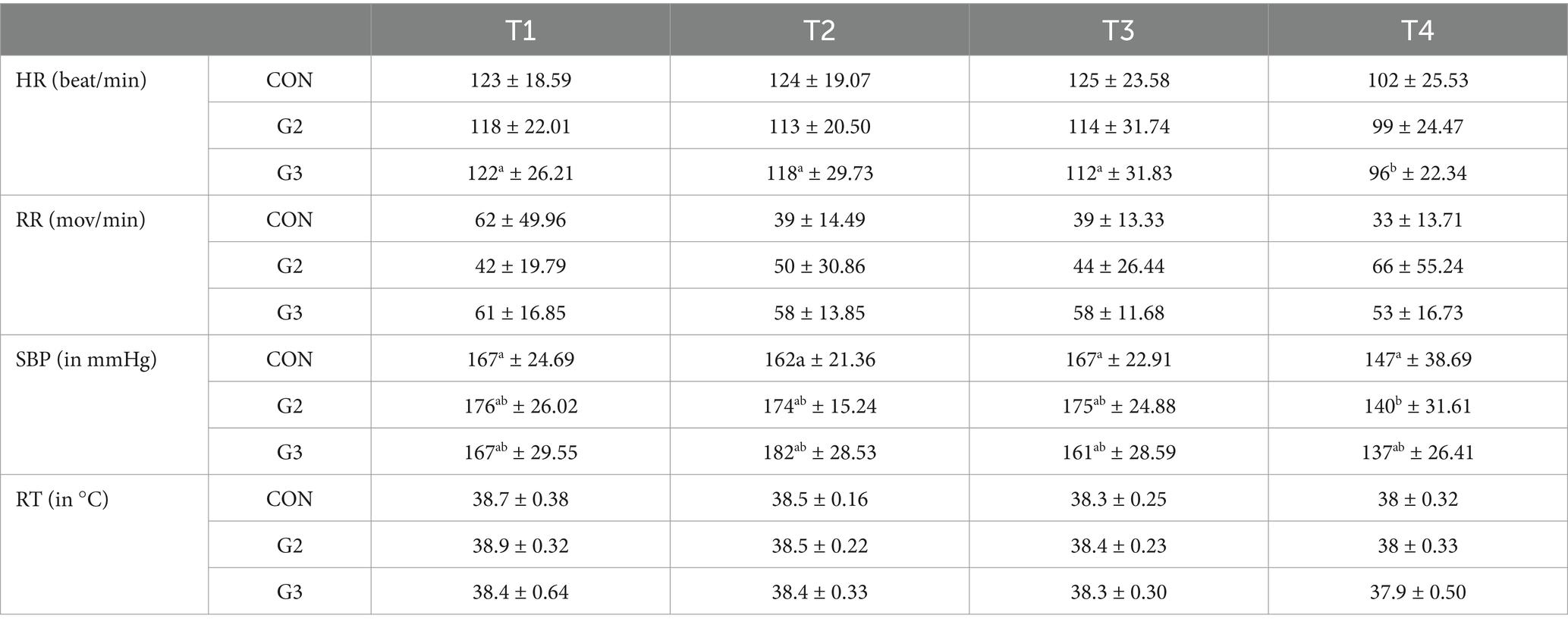 Tabla 4. Los valores medios y la desviación estándar de la frecuencia cardíaca (FC, latidos/min), la frecuencia respiratoria (RR, mov/min), la presión arterial sistólica (PAS, en mmHg) y la temperatura rectal (TR en °C) de los perros sometidos a orquiectomía electiva y tratados con placebo (CON), 2 mg/kg (G2) y 6 mg/kg (G3) de fitocannabinoides totales, respectivamente, 75 min antes de la inducción anestésica con propofol.
Tabla 4. Los valores medios y la desviación estándar de la frecuencia cardíaca (FC, latidos/min), la frecuencia respiratoria (RR, mov/min), la presión arterial sistólica (PAS, en mmHg) y la temperatura rectal (TR en °C) de los perros sometidos a orquiectomía electiva y tratados con placebo (CON), 2 mg/kg (G2) y 6 mg/kg (G3) de fitocannabinoides totales, respectivamente, 75 min antes de la inducción anestésica con propofol.
Resistencia a la inserción del catéter
No se encontraron diferencias estadísticas en el análisis entre los grupos a través del ANOVA de una vía.
Inducción anestésica
El análisis de la dosis de propofol requerida para la inducción mostró una diferencia estadística significativa entre G3 y CON (p < 0,0138) utilizando la prueba de comparación múltiple de Tukey. El análisis entre G3 y G2, y entre G2 y CON no ha demostrado diferencias estadísticamente significativas (Figura 6).
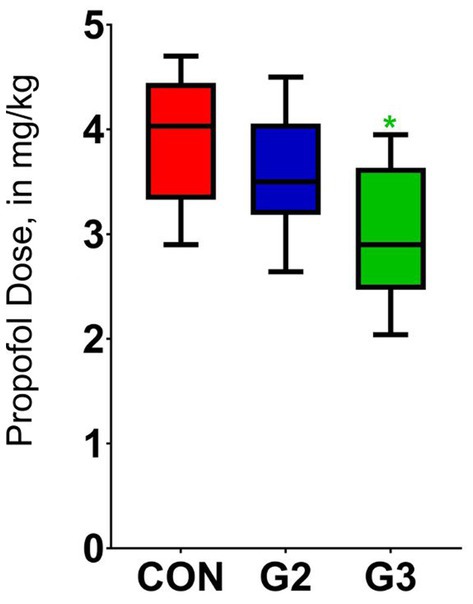 Figura 6. Valores medios y desviación estándar de la dosis de propofol requerida para la inducción anestésica de perros sometidos a orquiectomía electiva, y tratados con control (CON), 2 mg/kg (G2) y 6 mg/kg (G3) de fitocannabinoides totales, respectivamente, 75 min antes de la inducción anestésica con propofol.
Figura 6. Valores medios y desviación estándar de la dosis de propofol requerida para la inducción anestésica de perros sometidos a orquiectomía electiva, y tratados con control (CON), 2 mg/kg (G2) y 6 mg/kg (G3) de fitocannabinoides totales, respectivamente, 75 min antes de la inducción anestésica con propofol.
Facilidad de intubación
No se encontraron diferencias estadísticas en el análisis entre los grupos a través del ANOVA de una vía.
En la Tabla 5 se pueden encontrar las medias del peso, la dosis y el volumen de propofol de los pacientes, así como las medianas de las puntuaciones de su resistencia a la inserción del catéter y la facilidad de intubación.
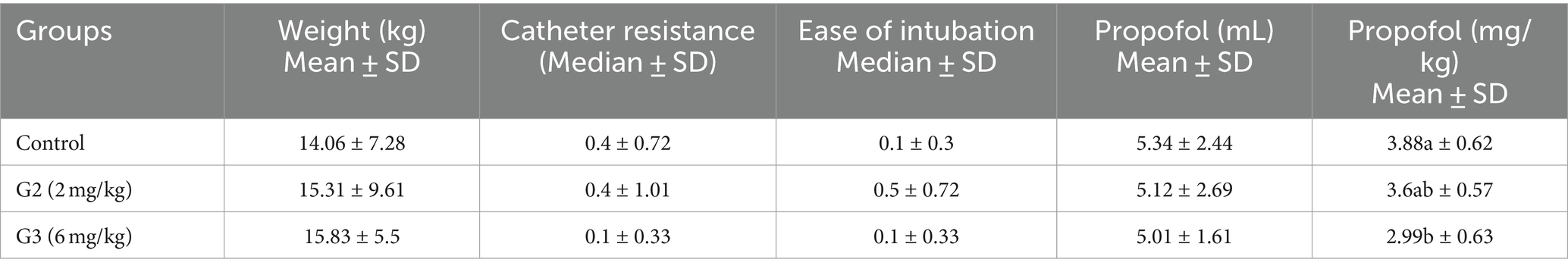 Tabla 5. Medias del peso de los pacientes, dosis y volumen de propofol y mediana de las puntuaciones de su resistencia a la inserción del catéter y facilidad de intubación.
Tabla 5. Medias del peso de los pacientes, dosis y volumen de propofol y mediana de las puntuaciones de su resistencia a la inserción del catéter y facilidad de intubación.
Parámetros transquirúrgicos
Durante la cirugía, los pacientes fueron evaluados con un oxímetro de pulso y un termómetro rectal conectados a un monitor multiparamétrico Deltalife (DL1000). Dado que el mantenimiento anestésico se realizó con isoflurano dosis-efecto administrado con un vaporizador universal bajo la supervisión de un anestesiólogo, no hubo estandarización ni medición de la concentración utilizada. Empíricamente, no hubo evidencia de ningún problema transquirúrgico para ningún grupo.
Discusión
La planta de cannabis se ha utilizado en varias culturas humanas desde la antigüedad, sirviendo para numerosos propósitos, incluida la medicina, la producción de fibra, la alimentación, el uso recreativo y las ceremonias religiosas. La literatura veterinaria informa que el uso histórico del cannabis en animales se remonta al menos al siglo XII (21), y las primeras investigaciones se centraron especialmente en sus efectos en perros (22). A pesar de su amplio uso histórico, siguen existiendo lagunas en nuestra comprensión de las moléculas derivadas del cannabis, especialmente en lo que respecta a su impacto durante la anestesia. La investigación contemporánea ha examinado predominantemente las implicaciones anestésicas del consumo de marihuana en humanos, revelando necesidades alteradas de propofol en usuarios crónicos (8-10). Los fitocannabinoides como el THC y el CBD ejercen una serie de efectos a través de diversos mecanismos (4, 15), ofreciendo un potencial terapéutico en múltiples dominios médicos. Además, tanto el propofol como el CBD inhiben la enzima FAAH (1-3, 7, 14, 15), lo que conduce a un aumento de los niveles del endocannabinoide anandamida, lo que sugiere un mecanismo farmacológico compartido que puede potenciar los efectos del propofol a través del sistema endocannabinoide.
En este estudio, una dosis única de 6 mg/kg del extracto rico en fsCBD produjo una reducción del 23% en la dosis de propofol necesaria para la inducción en perros. Este hallazgo concuerda con otras investigaciones que han demostrado que un extracto de Cannabis indica administrado por vía intraperitoneal en perros redujo la dosis de propofol para la inducción (11). A pesar de que los autores han mencionado la saliva ropy , esto no se observó en el presente estudio. Los hallazgos en roedores confirman aún más estos resultados en los que los agonistas cannabinoides sintéticos redujeron la dosis de propofol, mientras que los antagonistas tuvieron el efecto contrario (1).
La comparación de las puntuaciones de sedación no tuvo diferencias estadísticamente significativas entre los grupos, y entre T1, T2 y T3, para ambos evaluadores. Estos hallazgos sugieren que la administración de 2 mg/Kg o 6 mg/Kg de fitocannabinoides totales del extracto rico en fsCannabidiol utilizado en este estudio no indujo efectos sedantes significativos en los pacientes, ni mejoró los efectos sedantes de la combinación de acepromazina y metadona.
No se describe que el CBD tenga efectos sedantes o psicoactivos, y los estudios informan de dosis que oscilan entre 8 mg/kg (23) y hasta 100 mg/kg (24) en perros sin efectos secundarios importantes. Se ha descrito que el THC causa efectos secundarios neurológicos, como hiperestesia y déficit propioceptivo (25), así como ataxia, letargo e hipotermia (26). Estos efectos se describen como temporales, más probables cuando el THC está en cantidades más altas y en la primera experiencia, ya que los pacientes parecen crear una tolerancia a estos efectos secundarios cuando la dosis se incrementa gradualmente con el tiempo. Esta molécula es un agonista parcial de los receptores CB1 localizados en el sistema nervioso, y su administración a corto plazo aumenta su expresión, además de mejorar la afinidad de unión de los endocannabinoides en el mismo (4).
El THC fue la tercera molécula más concentrada en el extracto rico en fsCBD con una proporción de CBD:THC de aproximadamente 21:1. Aunque son raros, se han descrito efectos secundarios para dosis de THC de 0,1 mg/kg (26). En nuestro estudio, G2 recibió 0,09 mg/kg y G3 recibió 0,28 mg/kg de THC, y nuestro equipo no ha visto ningún efecto secundario neurológico descrito por autores anteriores. La segunda molécula más concentrada en el extracto utilizado en esta investigación fue el ácido cannabidiólico (CBDa), presente en una proporción CBD:CBDa de 1,6:1. La investigación en roedores demuestra que el CBDA parece mejorar la biodisponibilidad del CBD hasta 14 veces (27), y que su presencia en el extracto también mejoró la biodisponibilidad en perros (28, 29).
La presencia de CBDa y THC puede ser responsable, al menos parcialmente, de los resultados que hemos descrito en nuestro estudio. Ambas moléculas podrían haber alterado la farmacodinámica y/o farmacocinética del CBD, y el THC podría haber aumentado la expresión del receptor CB1, potenciando la acción indirecta del propofol sobre él. Sin embargo, estas son las hipótesis de los autores, y aún esperan más investigaciones.
En el presente estudio, el extracto rico en fsCBD se administró en las encías de los pacientes. La administración oral y transmucosa tienen una farmacocinética (PK) prácticamente idéntica, lo que indica que se absorbe a través del tracto gastrointestinal en ambas vías de administración (28). Aunque existen discrepancias entre la farmacocinética del CBD en función de su formulación y factores fisiológicos, las investigaciones indican que su vida media es de 4 a 8 h, y su pico plasmático se alcanza en 2 h (23, 28). Una revisión publicada en 2023 ha afirmado que los productos de cannabis tienen una gran variabilidad, y estos resultados deben interpretarse con cuidado (29). Sin embargo, el tiempo de administración de los extractos se calculó en base a estos estudios de farmacocinética, en los que la administración de PM y propofol coincidió con el pico plasmático de fitocannabinoides.
El análisis de las puntuaciones de sedación ha demostrado significación estadística (valor de p > 0,0001) al comparar T1, T2 y T3 con T4, para ambos evaluadores. Esto era esperable dado que la T4 se produjo 15 min después de la administración de la medicación preanestésica, por lo que se anticipó la sedación para todos los animales, considerando que la acepromazina y la metadona pueden producir una sedación efectiva cuando se asocian en dosis adecuadas (30).
La escala abreviada de sedación de Wagner fue consistente en la descripción de la sedación para ambos evaluadores después de la MP, según lo diseñado. A pesar de que nuestros resultados no mostraron una sedación mejorada para la asociación de fitocannabinoides y PM, esto podría ser una limitación de la escala de sedación que se utilizó. Es posible que sus parámetros no hayan sido representativos para evaluar los cambios en el comportamiento animal que produjeron los extractos ricos en fsCBD, ya que ya se han descrito efectos ansiolíticos (31, 32).
G2 y G3 mostraron una reducción estadísticamente significativa de la FC y la PAS entre T0, T1 y T2 con T3, y G3 también mostró una reducción de la PAS entre T1 y T2, que no ocurrió en la CON. Estas variaciones en estos parámetros pueden haber ocurrido debido a la administración del extracto rico en fsCBD, lo que sugiere posibles efectos ansiolíticos. Para evaluar mejor estos resultados, es probable que sea más apropiada una escala específica para este tipo de análisis.
Estos hallazgos son corroborados por la literatura, que indica que los extractos de Cannabis pueden causar una disminución de la FC y la PAS en animales en situaciones de estrés (31-34).
Otros estudios mencionan un cambio modesto en la variabilidad de la frecuencia cardíaca y una disminución de la frecuencia cardíaca después de la ingestión aguda de CBD en humanos, lo que señala la inconsistencia de esta información en diferentes estudios. Esta inconsistencia de los datos puede ocurrir tanto debido a factores individuales como a variaciones en las presentaciones de los productos (35). Estos cambios en la FC y la PAS pueden ser transitorios y ocurrir rápidamente, y pueden no observarse en estudios a largo plazo dependiendo del momento de la evaluación (33).
No se observaron diferencias estadísticamente significativas en el RR al comparar los puntos temporales y los grupos. Una revisión sistemática menciona información discrepante sobre los efectos hemodinámicos del CBD, donde reduce el RR en momentos de estrés, pero no en condiciones controladas, en varias especies (34).
Todos los grupos mostraron una reducción significativa de la RT. La hipotermia se describe como uno de los efectos secundarios del delta-9-THC, especialmente en dosis más altas, mientras que no se ha demostrado que el CBD cause cambios en la temperatura corporal (26). El SEC está relacionado con el mantenimiento de la temperatura corporal (36).
Por otro lado, el área donde se mantenían los pacientes entre evaluaciones no contaba con control térmico, siendo necesario utilizar un calentador portátil para mantener el ambiente caliente ya que esta investigación se realizó durante el invierno. Esta falta de control preciso de la temperatura puede haber sido un factor significativo en la reducción de la RT identificada en todos los grupos que participaron en la investigación.
Por otro lado, el análisis de FC, RR, PAS y RT entre los grupos no demostró una diferencia significativa.
En conclusión, hemos encontrado que los extractos de Cannabis ricos en fs-CBD tienen el potencial de ser un coadyuvante en los protocolos anestésicos, aunque este es un hallazgo muy inicial. Recomendamos encarecidamente a otros investigadores que investiguen más a fondo estos resultados y sus mecanismos, ya que la comprensión de las interacciones entre los anestésicos, el sistema endocannabinoide y su interacción con los fitocannabinoides, puede permitir descubrimientos en los mecanismos subyacentes de diferentes productos farmacéuticos y el desarrollo de nuevos fármacos o protocolos que mejoren los procedimientos anestésicos.
Limitaciones
Los animales tenían diferentes temperamentos, y la estandarización no era la ideal. Aunque este efecto es minimizado por la aleatorización y todos ellos eran dóciles, esta diferencia de personalidad fue evidente a lo largo de la investigación, ya que algunos animales no estaban acostumbrados al manejo médico personal como los demás. Los animales tampoco tuvieron un largo período de tiempo para acostumbrarse a las perreras, y solo los perros machos se incluyeron en este estudio.
La habitación en la que se mantuvieron los pacientes entre las evaluaciones no tenía temperatura controlada. Se tuvo que utilizar un calentador portátil para mantener a los pacientes calientes durante las temperaturas invernales, y estas diferentes temperaturas podrían ser un factor en su comportamiento y en los cambios observados en la frecuencia cardíaca, la presión arterial sistólica y la temperatura.
La Universidad Federal de Santa Catarina carece de equipos para analizar la cantidad de anestésicos volátiles que se están utilizando en cada paciente, siendo la dosis-efecto el procedimiento estándar. Sin saber con precisión cuánto anestésico volátil se utilizó durante la cirugía, nuestra investigación no pudo sacar ninguna conclusión sobre los efectos de la combinación de isoflurano y el extracto rico en fsCannabidiol. Los parámetros transquirúrgicos deben examinarse mejor en futuros estudios mejor controlados.
Los parámetros de capnografía no fueron evaluados entre los grupos, ya que la Universidad Federal de Santa Catarina no dispone de vaporizador, capnografía y analizador de gases calibrados. Siendo esta una de las principales limitaciones de esta investigación, y aunque todos los pacientes se encontraban bien al final de los procedimientos, recomendamos encarecidamente que otros investigadores confirmen todos los datos aquí descritos, e investiguen más a fondo la seguridad de la administración de extractos ricos en cannabidiol a gran escala antes de la anestesia general a través de estudios bien controlados.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo/material complementario, las consultas adicionales pueden dirigirse al autor correspondiente.
Declaración ética
Los estudios en animales fueron aprobados por el Consejo de Ética Animal de la Universidad Federal de Santa Catarina (número 2065211122). Los estudios se llevaron a cabo de acuerdo con la legislación local, los requisitos institucionales y las directrices internacionales de investigación ética. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
JH: Conceptualización, Análisis formal, Obtención de fondos, Investigación, Metodología, Administración de proyectos, Recursos, Supervisión, Redacción – borrador original, Redacción – revisión y edición. ME: Curación de datos, administración de proyectos, supervisión, redacción, revisión y edición. LF: Administración de proyectos, redacción, revisión y edición. MN: Escritura – borrador original. JS: Escritura – borrador original. AD: Escritura – borrador original. EA: Conceptualización, Curación de datos, Investigación, Metodología, Administración de proyectos, Recursos, Supervisión, Redacción – borrador original, Redacción – revisión y edición. VS: Conceptualización, Curación de datos, Análisis formal, Investigación, Metodología, Administración de proyectos, Supervisión, Validación, Redacción – borrador original, Redacción – revisión y edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. JH recibió una beca de maestría de la Coordinación Nacional de Perfeccionamiento del Personal de Nivel Superior (CAPES). El proyecto fue financiado con recursos privados del equipo. Los extractos de cannabis fueron donados por «Cannabis Sem Fronteiras».
Reconocimientos
Nuestro más profundo agradecimiento a Cannabis sin Fronteras, Vivian Dalla Colleta, Dr. Casara Andre, Dra. Kalinda Gupta y Felipe Antônio Batistella por la ayuda con este proyecto.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Patel, S, Wohlfeil, ER, Rademacher, DJ, Carrier, EJ, Perry, LJ, Kundu, A, et al. El anestésico general propofol aumenta el contenido de N-araquidoniletanolamina (anandamida) en el cerebro e inhibe la amida hidrolasa de ácidos grasos. Hno. J Pharmacol. (2003) 139:1005–13. doi: 10.1038/sj.bjp.0705334
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Ren, Y, Wang, J, Xu, PB, Xu, YJ y Miao, CH. La infusión sistémica o intraamígdala de un antagonista del receptor endocannabinoide CB1 AM251 bloqueó la amnesia anterógrada inducida por propofol. Neurosci Lett. (2015) 584:287–91. doi: 10.1016/j.neulet.2014.11.001
3. Hauer, D, Ratano, P, Morena, M, Scaccianoce, S, Briegel, I, Palmery, M, et al. Patrizia Campolongo; El propofol mejora la formación de la memoria a través de una interacción con el sistema endocannabinoide. Anestesiología. (2011) 114:1380–8. doi: 10.1097/ALN.0b013e31821c120e
4. McPartland, JM, Guy, GW y Di Marzo, V. Cuidado y alimentación del sistema endocannabinoide: una revisión sistemática de posibles intervenciones clínicas que regulan al alza el sistema endocannabinoide. PLoS Uno. (2014) 9:e89566. doi: 10.1371/journal.pone.0089566
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Schuster, J, Ates, M, Brune, K, y Gühring, H. Los cannabinoides R(−)-7-hidroxi-delta-6-tetra-hidrocannabinol-dimetilheptil (HU-210), 2-O-araquidonoilgliceriletero (HU-310) y araquidonil-2-cloroetilamida (ACEA) aumentan la duración del sueño provocada por el isoflurano mediante la activación de los receptores de cannabinoides 1 (CB1) en ratones. Neurosci Lett. (2002) 326:196–200. doi: 10.1016/s0304-3940(02)00302-6
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Schelling, G, Hauer, D, Azad, SC, Schmoelz, M, Chouker, A, Schmidt, M, et al. Efectos de la anestesia general sobre los niveles sanguíneos de anandamida en humanos. Anestesiología. (2006) 104:273–7. doi: 10.1097/00000542-200602000-00012
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Ren, Y, Ya-Jun, X, y Tan, Z-M. Posible implicación del sistema endocannabinoide en el efecto de modulación de la memoria de los anestésicos generales. Hipótesis médicas. (2011) 77:246-9, ISSN 0306-9877,. doi: 10.1016/j.mehy.2011.04.022
8. Imasogie, N, Rose, RV y Wilson, A. Altas cantidades: evaluación de la asociación entre el consumo de cannabis y la anestesia con propofol durante la endoscopia. PLoS Uno. (2021) 16:e0248062. doi: 10.1371/journal.pone.0248062
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Flisberg, P, Paech, MJ, Shah, T, Ledowski, T, Kurowski, I y Parsons, R. Dosis de inducción de propofol en pacientes que consumen cannabis. Eur J Anestesiol. (2009) 26:192–5. doi: 10.1097/EJA.0b013e328319be59
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Twardowski, MA, Link, MM y Twardowski, NM. Efectos del consumo de cannabis en los requisitos de sedación para procedimientos endoscópicos. J Osteop Med. (2019) 119:307–11. doi: 10.7556/jaoa.2019.052
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Kumar, SSH, Dass, LL, y Sharma, AK. Extracto de Cannabis Indica (Bhang) como preanestésico a la anestesia con propofol en perros. J Appl Anim Res. (2010) 37:125–7. doi: doi: 10.1080/09712119.2010.9707109
12. Szabó, GG, Lenkey, N, Holderith, N, Andrási, T, Nusser, Z y Hájos, N. La inhibición presináptica del canal de calcio subyace a la supresión de la liberación de GABA mediada por el receptor cannabinoide CB₁. J Neurosci. (2014) 34:7958–63. doi: 10.1523/JNEUROSCI.0247-14.2014
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Turu, G, y Hunyady, L. Transducción de señales del receptor cannabinoide CB1. J Mol Endocrinol. (2010) 44:75–85. doi: 10.1677/jme-08-0190
14. Di Marzo, V. Manipulación del sistema endocannabinoide mediante anestesia general. Hno. J Pharmacol. (2003) 139:885–6. doi: 10.1038/sj.bjp.0705333
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Deutsch, DG. Una retrospectiva personal: elevación de la anandamida (AEA) dirigiéndose a la amida hidrolasa de ácidos grasos (FAAH) y a las proteínas de unión a ácidos grasos (FABP). Frente Pharmacol. (2016) 7:370. doi: 10.3389/fphar.2016.00370
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Laprairie, RB, Bagher, AM, Kelly, ME, y Denovan-Wright, EM. El cannabidiol es un modulador alostérico negativo del receptor cannabinoide CB1. Hno. J Pharmacol. (2015) 172:4790–805. doi: 10.1111/bph.13250
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Wagner, MC, Hecker, KG y Pang, DSJ. Niveles de sedación en perros: un estudio de validación. BMC Vet Res. (2017) 13:110. doi: 10.1186/s12917-017-1027-2
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Bortolami, E, Murrell, JC y Slingsby, LS. Metadona en combinación con acepromazina como premedicación previa a la castración en el gato. Veterinario Anaesth Analg. (2013) 40:181–93. doi: 10.1111/j.1467-2995.2012.00736.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Lerche, P, Muir, WW, y Grubb, TL. Inducción de la anestesia con máscara con isoflurano o sevoflurano en gatos premedicados. J Pequeña Anim Pract. (2002) 43:12–5. doi: 10.1111/j.1748-5827.2002.tb00003.x
20. Andre, CM, Hausman, JF y Guerriero, G. Cannabis sativa: la planta de las mil y una moléculas. Planta Frontal Sci. (2016) 7:19. doi: 10.3389/fpls.2016.00019
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Dwarakanath, C. Uso del opio y el cannabis en los sistemas tradicionales de medicina en la India. Toro Narc. (1965) 17:15–9.
22. Russo, E. Cannabis en la India: tradición antigua y medicina moderna. En: Mechoulam, R. (eds) Los cannabinoides como terapéutica. Hitos en la terapia farmacológica MDT. Birkhäuser Basel (2005) doi: 10.1007/3-7643-7358-X_1
23. Lauri-Jo, G, Boesch, JM, Frye, CW, Schwark, WS, Sabine, M, Lisa, W, et al. Farmacocinética, seguridad y eficacia clínica del tratamiento con cannabidiol en perros con artrosis. Front Vet Sci. (2018) 5:165. doi: 10.3389/fvets.2018.00165
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Polidoro, Dakir, Temmerman, Robin, Devreese, Mathias, Charalambous, Marios, Ham, LucVan, Cornelis, Ine, et al. Farmacocinética del cannabidiol después de la administración intranasal, intrarrectal y oral en perros sanos, Front Vet Sci, 9:899940 (2022), doi: 10.3389/fvets.2022.899940
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Chicoine, A, Illing, K, Vuong, S, Pinto, KR, Alcorn, J y Cosford, K. Evaluación farmacocinética y de seguridad de varias dosis orales de un nuevo extracto herbal de cannabis THC:CBD 1:20 en perros. Front Vet Sci. (2020) 7:583404. doi: 10.3389/fvets.2020.583404
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Dana, V, Justyna, K y Lina, P. Investigación preliminar de la seguridad del aumento de las dosis de cannabinoides en perros sanos. Front Vet Sci. (2020) 7:51. doi: 10.3389/fvets.2020.00051
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Anderson, LL, Etchart, MG, Bahceci, D, Golembiewski, TA, y Arnold, JC. Los componentes del cannabis interactúan en la bomba de eflujo de fármacos BCRP para aumentar notablemente las concentraciones plasmáticas de ácido cannabidiólico. Sci Rep. (2021) 11:14948. doi: 10.1038/s41598-021-94212-6
Resumen de PubMed | Texto completo de Crossref | Google Académico
28. Giorgia, DR, Fabiola, P, Beatrice, CM, Roberta, G, Elisabetta, C, Monica, S, et al. Farmacocinética del cannabidiol tras la administración oral única y transmucosa oral en perros. Front Vet Sci. (2023) 9:1104152. doi: 10.3389/fvets.2022.1104152
29. Di Salvo, A, Conti, MB, y Della, RG. Farmacocinética, eficacia y seguridad del cannabidiol en perros: una actualización de los conocimientos actuales. Front Vet Sci. (2023) 10:1204526. doi: 10.3389/fvets.2023.1204526
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Monteiro, ER, Figueroa, CDN, Choma, JC, Campagnol, D, y Bettini, CM. Efectos de la metadona, sola o en combinación con acepromazina o xilacina, sobre la sedación y los valores fisiológicos en perros. Veterinario Anaesth Analg. (2008) 35:519–27. doi: 10.1111/j.1467-2995.2008.00412.x
31. Resstel, LB, Joca, SR, Moreira, FA, Corrêa, FM, y Guimarães, FS. Efectos del cannabidiol y el diazepam en las respuestas conductuales y cardiovasculares inducidas por el miedo condicionado contextual en ratas. Behav Brain Res. (2006) 172:294–8. doi: 10.1016/j.bbr.2006.05.016
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. Hunt, ABG, Flint, HE, Logan, DW y King, T. Una sola dosis de cannabidiol (CBD) influye positivamente en las medidas de estrés en los perros durante la separación y los viajes en coche. Front Vet Sci. (2023) 10:1112604. doi: 10.3389/fvets.2023.1112604
Resumen de PubMed | Texto completo de Crossref | Google Académico
33. Stanley, CP, Hind, WH, y O’Sullivan, SE. ¿Es el sistema cardiovascular una diana terapéutica para el cannabidiol? Hno. J Clin Pharmacol. (2013) 75:313–22. doi: 10.1111/j.1365-2125.2012.04351.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
34. Sultan, SR, Millar, SA, Inglaterra, TJ, y O’Sullivan, SE. Revisión sistemática y metaanálisis de los efectos hemodinámicos del cannabidiol. Frente Pharmacol. (2017) 8:81. doi: 10.3389/fphar.2017.00081
Resumen de PubMed | Texto completo de Crossref | Google Académico
35. Williams, NNB, Ewell, TR, Abbotts, KSS, Harms, KJ, Woelfel, KA, Dooley, GP, et al. Comparación de cinco preparados orales de cannabidiol en humanos adultos: farmacocinética, composición corporal y variabilidad de la frecuencia cardíaca. Productos farmacéuticos (Basilea). (2021) 14:35. doi: 10.3390/ph14010035
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: doble ciego, controlado con placebo, estudio clínico prospectivo, cannabis, fitocannabinoide, anestesia
Cita: Hasckel Gewehr JL, Enzele ML, Freiria LM, Nunes MM, Spengler J, Dondoerfer Teixeira AP, Amazonas E y Sasso Padilha V (2024) Extracto rico en cannabidiol de espectro completo dosis reducida de propofol requerida para la inducción anestésica en perros: un estudio piloto. Frente. Vet. Sci. 11:1352314. doi: 10.3389/fvets.2024.1352314
Recibido: 07 de diciembre de 2023; Aceptado: 12 de marzo de 2024;
Publicado: 05 Abril 2024.
Editado por:
Ioannis Savvas, Universidad Aristóteles de Tesalónica, Grecia
Revisado por:
Cristina Sempio, Universidad de Colorado Anschutz Medical Campus, Estados
Unidos Wayne S. Schwark, Universidad de Cornell, Estados Unidos
Derechos de autor © 2024 Hasckel Gewehr, Enzele, Freiria, Nunes, Spengler, Dondoerfer Teixeira, Amazonas y Sasso Padilha. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: João Lourenço Hasckel Gewehr, joaolourencomedvet@gmail.com
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía