El papel de los cannabinoides en la modulación del dolor en animales de compañía
El papel de los cannabinoides en la modulación del dolor en animales de compañía
 Agatha Miranda-Cortés1
Agatha Miranda-Cortés1  Daniel Mota-Rojas2*
Daniel Mota-Rojas2*  Nadia Crosignani-Outeda3
Nadia Crosignani-Outeda3  Alejandro Casas-Alvarado2
Alejandro Casas-Alvarado2  Julio Martínez-Burnes4
Julio Martínez-Burnes4  Adriana Olmos-Hernández5
Adriana Olmos-Hernández5  Patricia Mora-Medina6
Patricia Mora-Medina6  Antonio Verduzco-Mendoza5
Antonio Verduzco-Mendoza5  Ismael Hernández-Ávalos1*
Ismael Hernández-Ávalos1*- 1Departamento de Ciencias Biológicas, Farmacología Clínica y Anestesia Veterinaria, Universidad Nacional Autónoma de México (UNAM), FESC, Ciudad de México, México
- 2Neurofisiología del Dolor, Comportamiento y Evaluación del Bienestar en Animales Domésticos, DPAA, Universidad Autónoma Metropolitana, (UAM), Ciudad de México, México
- 3Departamento de Clínicas y Hospital Veterinario, Facultad de Veterinaria, Universidad de la República, Montevideo, Uruguay
- 4Grupo de Salud Animal, Facultad de Medicina Veterinaria y Zootecnia, Universidad Autónoma de Tamaulipas, Ciudad Victoria, Tamaulipas, México
- 5Departamento de Bioterio y Cirugía Experimental, Instituto Nacional de Rehabilitación-Luis Guillermo Ibarra Ibarra (INR-LGII), Calzada México Xochimilco, Ciudad de México, México
- 6Departamento de Ciencias Pecuarias, Universidad Nacional Autónoma de México (UNAM), FESC, Ciudad de México, México
El uso de cannabinoides tanto en medicina veterinaria como humana es controvertido por razones legales y éticas. No obstante, la disponibilidad y el uso terapéutico de fitocannabinoides naturales o sintéticos, como el Δ9-El tetrahidrocannabidiol y el cannabidiol, han sido el foco de atención en los estudios sobre sus usos médicos. Esta revisión tiene como objetivo examinar el papel de los cannabinoides en la modulación del dolor mediante el análisis de los hallazgos científicos sobre las vías de señalización del sistema endocannabinoide y la discusión de los efectos analgésicos de los cannabinoides sintéticos en comparación con los extractos de cannabinoides y el alcance y la participación de sus receptores. En animales, los estudios han demostrado las propiedades analgésicas de estas sustancias y el papel de los receptores de unión a cannabinoides −1 (CB1) y de unión a cannabinoides −2 (CB2) en el sistema endocannabinoide para modular el dolor agudo, crónico y neuropático. Este sistema consta de tres componentes principales: ligandos endógenos (anandamida y 2-araquidonilglicerol), receptores acoplados a proteínas G y enzimas que degradan y reciclan los ligandos. La evidencia sugiere que su interacción con los receptores CB1 inhibe la señalización en las vías del dolor y causa efectos psicoactivos. Por otro lado, los receptores CB2 se asocian con reacciones antiinflamatorias y analgésicas y efectos sobre el sistema inmunitario. Los extractos de cannabis y sus derivados sintéticos son una herramienta terapéutica eficaz que contribuye al cuidado compasivo del dolor y participa en su manejo multimodal. Sin embargo, el sistema endocannabinoide interactúa con diferentes ligandos y neurotransmisores endógenos, ofreciendo así otras posibilidades terapéuticas en perros y gatos, tal es el caso de aquellos pacientes que sufren convulsiones o epilepsia, dermatitis de contacto y atópica, mielopatías degenerativas, asma, diabetes y glaucoma, entre otras enfermedades inflamatorias. Además, se ha demostrado que estos compuestos poseen propiedades antineoplásicas, estimulantes del apetito y antieméticas. En definitiva, el estudio del sistema endocannabinoide, sus ligandos, receptores, mecanismo de acción y señalización, ha contribuido al desarrollo de investigaciones que demuestran que los derivados del cáñamo y sus derivados sintéticos son una alternativa terapéutica eficaz en el manejo multimodal del dolor en perros y gatos debido a su capacidad para prevenir la sensibilización periférica y central.
Introducción
El uso de cannabinoides en medicina humana y veterinaria ha sido controvertido por razones éticas y legales. A pesar de esto, los compuestos derivados del cáñamo están obteniendo la aprobación médica por sus beneficios. Sin embargo, el uso de drogas se complica por la aplicación de las leyes y regulaciones profesionales de cada país (1), por lo que se necesita más investigación para documentar y respaldar su uso clínico (2). Los cannabinoides son un grupo de compuestos obtenidos del cáñamo (Cannabis sativa L.) que se han utilizado con diferentes fines terapéuticos en perros, gatos y hurones (2, 3): antiespásticos, antieméticos, anticonvulsivos y estimulantes del apetito, o por sus propiedades neuroprotectoras, analgésicas y antiinflamatorias. Otros usos documentados en modelos de roedores son como tratamiento para el cáncer, el asma, la diabetes y la retinosis pigmentaria (3). También podrían ser eficaces para controlar el dolor relacionado con la osteoartritis (2-4), lo que ha llevado a los propietarios de animales de compañía a utilizar los cannabinoides como una alternativa natural con beneficios potenciales (5).
Hace más de 20 años se iniciaron varios ensayos clínicos controlados para tratar diversas patologías utilizando cannabinoides. Estas sustancias se han utilizado para tratar problemas de salud como cefalea, fiebre, infecciones bacterianas, diarrea, dolor reumático o malaria (4, 6). Esto dio lugar a la aprobación de productos a base de cannabis como el dronabinol, la nabilona y un extracto de delta-9-tetrahidrocannabinol (Δ9-THC) y cannabidiol (CBD) (7). La síntesis total de isómeros ópticos (-) y (+) se publicó por primera vez en 1965 (8). Posteriormente, en 1988, tras el descubrimiento de los primeros cannabinoides endógenos, se llevaron a cabo varios estudios que describieron la participación del sistema endocannabinoide en el control de las náuseas y el dolor relacionados con el cáncer o en la reducción de estos signos producidos por los tratamientos antineoplásicos (9, 10).
Esta revisión tiene como objetivo analizar y describir las características farmacocinéticas y farmacodinámicas de los cannabinoides y la distribución espacial de sus receptores, centrándose en su papel en la modulación del dolor en animales de compañía. Se discutirá y comparará el efecto analgésico de los cannabinoides sintéticos y los extractos y se analizarán los hallazgos científicos sobre las vías de señalización del sistema endocannabinoide y el rango y la participación de sus receptores.
Estructura química
Los cannabinoides tienen una estructura química carboxílica con 21 carbonos que constan de tres anillos: ciclohexano, tetrahidropirano y benceno (10, 11). Para estudiar los cannabinoides, los investigadores los han clasificado como sustancias químicas que interactúan con receptores específicos, divididos en tres grupos: cannabinoides herbales (fitocannabinoides), cannabinoides endógenos (endocannabinoides), que se pueden encontrar en organismos humanos o animales, y cannabinoides sintéticos (3, 10, 12). La palabra tetrahidrocannabinol (THC) se usa generalmente para designar el (–)-trans-Δ9-Isómero de tetrahidrocannabinol (dronabinol, anteriormente 1-, 3,4-trans-tetrahidrocannabinol), que puede estar relacionado con la mayoría de los efectos farmacológicos del cannabis, incluidas sus propiedades psicoactivas. Por otro lado, el CBD es el no psicotrópico más estudiado que se encuentra en el cannabis (13, 14).
Hasta la fecha se han identificado 489 compuestos químicos, 70 pertenecientes al grupo de los fitocannabinoides y sus subcategorías. El THC y el CBD han sido especialmente relevantes en la terapia farmacológica. Δ9-El THC tiene una estructura tricíclica de 21 carbonos sin nitrógeno y dos centros quirales en configuración trans; es un aceite viscoso volátil con alta solubilidad lipídica y baja solubilidad acuosa, y un pKa de 10,6 (15). Δ9-Se ha demostrado que el THC interactúa con los receptores de tipo 1 y 2, con una afinidad particular con los receptores de tipo 2. Por el contrario, el CBD tiene una menor afinidad con ambos receptores (16-18). El nombre químico del CBD es 5’metil-2′-(prop-1-en-2il)-1′,2′,3′,4′-tetrahidro-1.1′-bifenil]-2,6-dioles que retienen el trans- (1R,6R) (19).
A nivel fisiológico, los endocannabinoides actúan como ligandos endógenos de los receptores de anandamida y 2-araquidonilglicerol (2-AG), que regulan y modulan la nocicepción, el metabolismo lipídico y las funciones gastrointestinales, cardiovasculares y motoras (19, 20). Los análogos sintéticos tienen una estructura similar a los fitocannabinoides y se sintetizan para imitar sus efectos (21). A medida que aumenta su uso, cada vez son más los estudios que han intentado fabricar diferentes productos con fines médicos, como el HU-210, considerado un agonista CB1 y CB2 (3, 14, 22).
Características farmacocinéticas
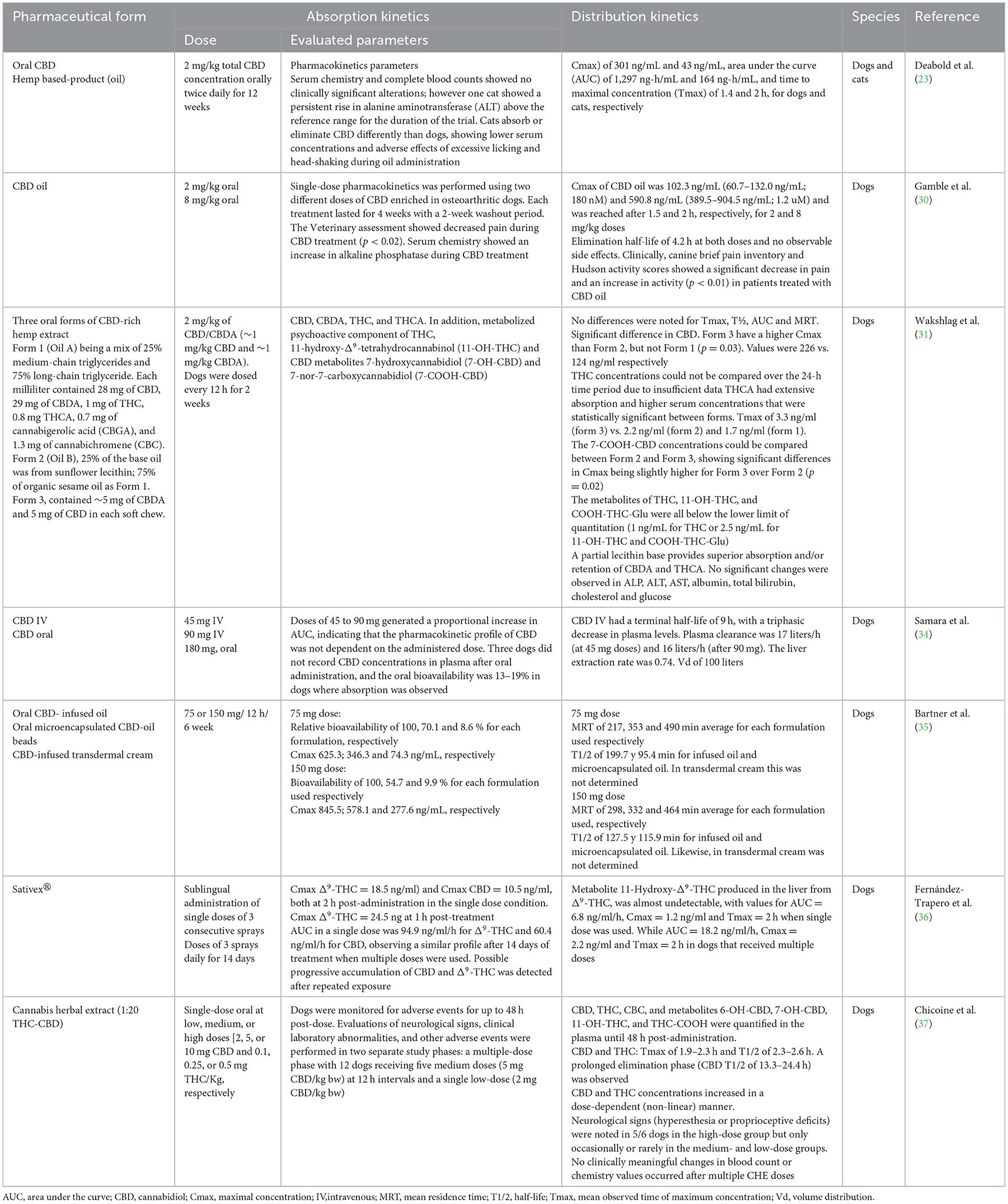
En perros y gatos, los estudios farmacocinéticos de cannabinoides sugieren administrar diferentes dosis de THC, CBD o productos que contengan ambos fitocannabinoides por vía oral, transmucosa, transdérmica, intravenosa y sublingual, donde la mayoría de estos productos están hechos de cáñamo (12, 23, 24). Los principales fitocannabinoides reportados son terpenos, flavonoides, CBD, ácido cannabidiólico (CBDA) y THC, los cuales deben ser considerados como el principal factor que influye en la evaluación de una respuesta farmacocinética ya que la mayoría de los productos no cuentan con una estandarización comercial disponible para su regulación e investigación. A pesar de esta limitación, existen pruebas suficientes de sus características farmacocinéticas (25). Absorción. Los cannabinoides se absorben fácilmente debido a sus propiedades hidrofóbicas y liposolubles (11), aunque son difíciles de excretar sin una biotransformación significativa. Distribución. Los fármacos lipofílicos hacen que un segundo pico plasmático sea común debido al lento vaciado gástrico, la redistribución e incluso las diferentes ventanas de absorción en el tracto gastrointestinal. Cuando estas sustancias se administran por vía oral o intravenosa, se unen a las lipoproteínas, la albúmina y los eritrocitos una vez en el torrente sanguíneo. Los cannabinoides pueden unirse a los receptores CB1 y CB2 en el Sistema Nervioso Central (SNC) y el Sistema Nervioso Periférico (SNP), y los efectos se pueden ver de 0,5 a 2 h después de ser administrados (26, 27). Además, pueden acumularse en el tejido adiposo, el hígado, los pulmones, el bazo, el cerebro y los músculos, con la consiguiente liberación continua después de la rápida reducción inicial de sus niveles plasmáticos. El CBD y el THC pueden alcanzar un estado estable con tratamientos continuos o dosis altas en un corto período de tiempo (3, 7). Metabolismo. Cuando se usan por vía oral, los fitocannabinoides muestran un metabolismo de primer paso. Derivados naturales, como Δ9-Los THC se metabolizan a través de la hidroxilación, la descarboxilación y la conjugación hepática, por la acción de las isoenzimas CYP2C del citocromo 450. También pueden metabolizarse en tejidos extrahepáticos como el intestino y los pulmones. 11-hidroxi-Δ9-El THC (11-OH-THC), que sigue siendo un metabolito activo, se crea debido a esta biotransformación (28-30). Existe evidencia de que el THC y el CBD pueden causar interferencia con la actividad de varias familias de enzimas del citocromo p450 hepático. Por lo tanto, la asociación de fitocannabinoides con terapias administradas simultáneamente puede aumentar los niveles séricos de otros fármacos (28). Excreción. La eliminación de estos compuestos por vía fecal incluye la excreción biliar, por lo que es posible la recirculación enterohepática. Los cannabinoides sufren reacciones de eliminación de β y α antes de la excreción urinaria. Los ensayos clínicos en perros y gatos revelaron una vida media de eliminación de 1,0-1,5 h cuando se administró por vía oral, aunque, en perros con artrosis (OA) tratados con CBD a dosis de 2 mg/kg, se reportan tiempos de 3,8-6,8 h, que no mostraron diferencias cuando se usaron dosis >8 mg/kg, donde la vida media de eliminación fue de 3,8-4,8 h (30). La figura 1 resume la farmacocinética de los fitocannabinoides utilizados en medicina veterinaria (10, 18, 29).
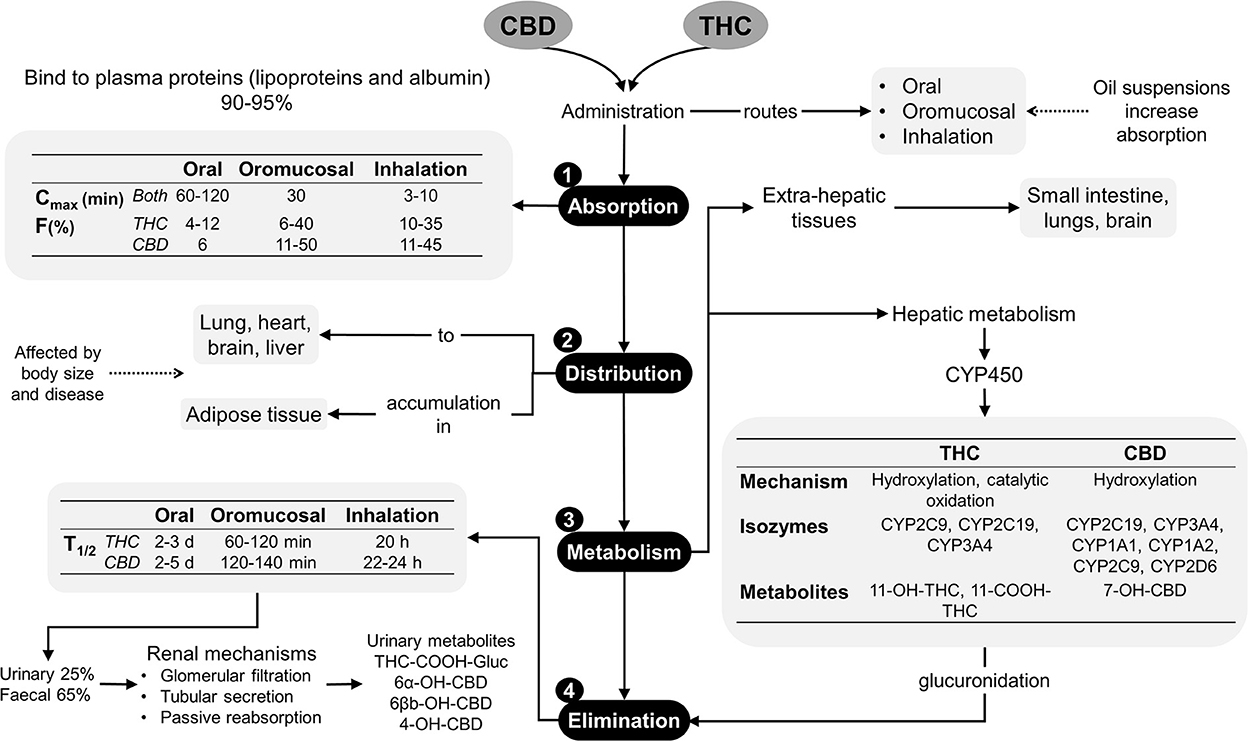 Figura 1. Farmacocinética de los fitocannabinoides (10, 18, 29). CBD, cannabidiol; CYP450, citocromo P450; d, días; F%, biodisponibilidad; h, horas; min, minutos; T1/2, vida media de eliminación; THC, delta-9-tetrahidrocannabinol.
Figura 1. Farmacocinética de los fitocannabinoides (10, 18, 29). CBD, cannabidiol; CYP450, citocromo P450; d, días; F%, biodisponibilidad; h, horas; min, minutos; T1/2, vida media de eliminación; THC, delta-9-tetrahidrocannabinol.
Los parámetros farmacocinéticos pueden verse influenciados por los productos utilizados como materias primas para preparar los extractos (8, 31). Por ejemplo, en un estudio de Deabold et al. (23), se evaluó la farmacocinética de la administración oral (masticables blandos para perros y aceite para gatos) de CBD y CBDA obtenidos del cáñamo a una dosis única de 2 mg/kg (a base de CBD) cada 12 h durante 12 semanas en perros y gatos sanos. Se observó una concentración máxima media (Cmax) de 301 ng/mL en perros y 43 ng/mL en gatos, un área bajo la curva (AUC) de 1.297 ng/h/mL y 164 ng/h/mL, respectivamente. El tiempo para alcanzar la concentración máxima de CBD (Tmax) fue de 1,4 h en perros y 2 h en gatos, lo que indica una diferencia significativa en los parámetros farmacocinéticos entre estas especies (23). Estas diferencias farmacocinéticas también se hicieron evidentes cuando se utilizó un extracto transdérmico rico en CBD-CBDA en perros, donde se examinaron las concentraciones séricas de CBD, CBDA, THC y su derivado ácido tetrahidrocannabinólico (THCA). Una dosis de 4 mg/kg de cannabinoides totales dos veces al día dio como resultado aproximadamente 10 ng/ml de CBD, 21-32 ng/ml de CBDA, trazas de THCA y cantidades no cuantificables de THC en suero al final de 1-2 semanas de tratamiento, concluyendo que el CBDA y el THCA se absorbieron mejor sistémicamente (32). En dosis escalonadas, se estudiaron aceites de cannabis, incluido un aceite con predominio de CBD (2,8-30,5 mg/kg de CBD + 0,1-1,1 mg/kg de THC), un aceite con predominio de THC (3,8-41,5 mg/kg de THC) y un aceite con predominio de CBD/THC (1,2-13 mg/kg de CBD + 0,8-8,4 mg/kg de THC) en gatos (33). Se observó una interacción de CBD y THC, con niveles más altos de cannabinoides y metabolitos plasmáticos tras la administración de productos combinados de CBD/THC. Los gatos parecen tener una concentración sérica más baja y una eliminación de CBD más rápida que los perros (33). En la Tabla 1 se resumen otros estudios clínicos sobre las características farmacocinéticas del CBD (23, 30, 31, 34-37).
Farmacodinamia y receptores en el sistema endocannabinoide
El sistema endocannabinoide es una vía de señalización que se encuentra en la mayoría de los vertebrados (30) y regula varias funciones corporales (38). Este sistema consta de tres componentes principales: ligandos endógenos (anandamida y 2-AG), receptores acoplados a proteínas G y enzimas que degradan y reciclan los ligandos (39). Estas enzimas están ampliamente distribuidas en el organismo en niveles llamados «tono endocannabinoide», que varía según el tejido involucrado (40).
En 1992, la anandamida (N-araquidonoil-etanolamina), el 2-AG y el éter glicerílico 2-araquidonil (2-AGE), la O-araquidonoil etanolamina (virodhamina) y la N-araquidonoil dopamina (NADA) se identificaron como agonistas endógenos de los receptores cannabinoides (35). Estas moléculas se producen localmente en la membrana celular por hidrólisis de ácidos grasos poliinsaturados (41). Cuando se activan los receptores metabotrópicos de glutamato o en respuesta a un aumento del Ca intracelular2+, se liberan de las neuronas postsinápticas debido a la despolarización (3).
La anandamida y los fitocannabinoides se unen competitivamente a los receptores cannabinoides en las membranas presinápticas y postsinápticas de las neuronas que se encuentran en los astrocitos, oligodendrocitos y células de la microglía. Pueden modular la excitabilidad de la neurona postsináptica en la membrana celular (42, 43) y estimular las proteínas Gi/o y las proteínas quinasas activadas por mitógenos (MAPK), causando la inhibición de la adenilciclasa y el Ca dependiente de voltaje2+ canales (Figura 2) (10, 18, 29, 40). Este mecanismo reduce la liberación de noradrenalina, acetilcolina, glutamato, GABA, glicina, aspartato, serotonina (5HT), dopamina, colecistoquinina (9, 44) y la secreción de dinorfinas y β-endorfinas (16, 45).
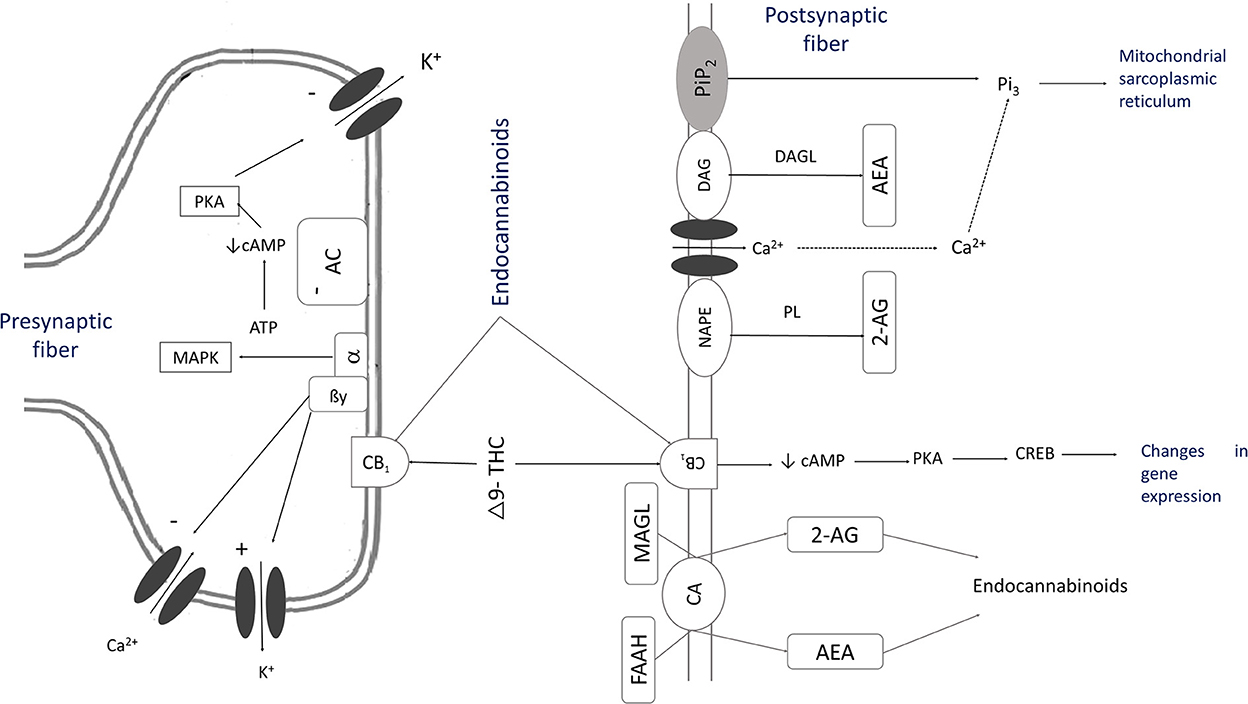 Figura 2. El mecanismo de acción de los cannabinoides [Adaptado de (10, 18, 29, 40)]. Como resultado de la activación del inositol 1,4,5-trifosfato, se produce un aumento transitorio del Ca2+ ionizado intracelular a través de la activación de los canales iónicos que sintetizan cannabinoides endógenos. Este proceso provoca la estimulación de la fosfolipasa (PL) y la hidrólisis de la N-araquidonoil fosfatidiletanolamina (NAPE) para crear anandamida (AEA). La fosfolipasa C (PLC) por fosfatidilinositol 4,5-bisfosfato (PIP2) a diacilglicerol (DAG) y el inositol 1,4,5-trifosfato (IP3) y la diacilglicerol lipasa (DAGL) sintetizan 2-araquidonilglicerol (2-AG). Estas sustancias, THC o CBD, activan los receptores CB1. El AEA se libera en el espacio extracelular mediante un transporte de membrana, y luego se hidroliza para convertirse en ácido araquidónico y etanolamina mediante la amida hidrolasa de ácidos grasos (FAAH). Los portadores de membrana específicos también pueden transportar 2-AG e hidrolizarlo con monoacilglicerol lipasa (MAGL) en ácido araquidónico y glicerol. Esta reacción activa las proteínas Gi/o que estimulan las proteínas quinasas activadas por mitógenos (MAPK), que inhiben la adenilato ciclasa (AC). La secreción de monofosfato de adenosina cíclico (AMPc) se inhibe, dificulta el Ca dependiente de voltaje2+ canaliza y estimula los canales K, permitiendo un flujo de proteína G (GIRK). Los niveles de Camp disminuyen, al igual que la activación de la proteína quinasa A (PKA), lo que provoca una disminución en la fosforilación de los canales K dependientes de voltaje.
Figura 2. El mecanismo de acción de los cannabinoides [Adaptado de (10, 18, 29, 40)]. Como resultado de la activación del inositol 1,4,5-trifosfato, se produce un aumento transitorio del Ca2+ ionizado intracelular a través de la activación de los canales iónicos que sintetizan cannabinoides endógenos. Este proceso provoca la estimulación de la fosfolipasa (PL) y la hidrólisis de la N-araquidonoil fosfatidiletanolamina (NAPE) para crear anandamida (AEA). La fosfolipasa C (PLC) por fosfatidilinositol 4,5-bisfosfato (PIP2) a diacilglicerol (DAG) y el inositol 1,4,5-trifosfato (IP3) y la diacilglicerol lipasa (DAGL) sintetizan 2-araquidonilglicerol (2-AG). Estas sustancias, THC o CBD, activan los receptores CB1. El AEA se libera en el espacio extracelular mediante un transporte de membrana, y luego se hidroliza para convertirse en ácido araquidónico y etanolamina mediante la amida hidrolasa de ácidos grasos (FAAH). Los portadores de membrana específicos también pueden transportar 2-AG e hidrolizarlo con monoacilglicerol lipasa (MAGL) en ácido araquidónico y glicerol. Esta reacción activa las proteínas Gi/o que estimulan las proteínas quinasas activadas por mitógenos (MAPK), que inhiben la adenilato ciclasa (AC). La secreción de monofosfato de adenosina cíclico (AMPc) se inhibe, dificulta el Ca dependiente de voltaje2+ canaliza y estimula los canales K, permitiendo un flujo de proteína G (GIRK). Los niveles de Camp disminuyen, al igual que la activación de la proteína quinasa A (PKA), lo que provoca una disminución en la fosforilación de los canales K dependientes de voltaje.
La evidencia muestra que los cannabinoides endógenos están vinculados a un sistema regulador ubicuo (30) que involucra a un grupo de receptores CB1 (unión a cannabinoides 1) y CB2 (unión a cannabinoides 2) unidos a la proteína G (GPCR) tipo Gi/o (39, 46). Una vez activados, inhibirán retrógradamente neurotransmisores como el ácido gamma-aminobutírico (GABA) y el glutamato. Otros receptores asociados a la proteína G son GPR3, GPR6, GPR12, GPR18, GPR55 y GPR119.
Los estudios muestran que el sistema endocannabinoide se expresa y se vincula a la vía nociceptiva, donde se pueden encontrar receptores en las fibras del dolor ascendentes y descendentes (47). Estos receptores también se han encontrado en el SNC en neuronas GABAérgicas presinápticas y postsinápticas en la superficie dendrítica y somática del cerebelo, el hipocampo, la corteza cerebral y la médula espinal, estructuras involucradas en la modulación del dolor (21, 48). El receptor 55 acoplado a proteína G (GPR55 o CB3) también se encuentra en el SNC, pero en menor medida que el CB1 (49).
Por otro lado, el CB2 se expresa principalmente en tejidos periféricos y células inmunitarias y gliales (3). Como resultado, podrían estar implicados en la sensibilización de las fibras nociceptivas cuando se ha desencadenado una respuesta inmunitaria (50). Los estudios en ratas y perros han demostrado la presencia de receptores denominados receptores alfa, gamma y beta activados por proliferadores de peroxisomas (PPARα, PPARγ, PPARβ), el receptor de potencial transitorio anquirina 1 (TRPA1), el receptor vaniloide (TRPV1, TRPV2, TRPV3, TRPV4), los canales de potencial receptor transitorio (TPR) y el receptor de serotonina 5-HT1A (5-HT1AR) (51, 52).
La investigación en roedores, perros, gatos y monos ha demostrado que los subtipos de receptores cannabinoides, CB1, CB2 y GPR55 (clonados en 1990, 1993 y 1995 respectivamente), están vinculados a receptores acoplados a proteínas G (18, 46). Sin embargo, se han encontrado diferencias entre ellos, como su número de aminoácidos, la distribución tisular y la sensibilidad a agonistas y antagonistas específicos que muestran selectividad para uno u otro receptor (14).
Los receptores CB1, CB2 y GPR55 identificados en perros han dado lugar a extractos de Cannabis sativa para un control eficaz del dolor, como el Δ9-THC y CBD (16). Se ha sugerido que las propiedades lipofílicas de los cannabinoides les permiten cruzar fácilmente la barrera hematoencefálica (53, 54) y causar analgesia, lo que los hace efectivos en el tratamiento del dolor. No obstante, todavía existe cierto debate sobre si el mecanismo de control del dolor de los cannabinoides se produce como resultado del agonismo de los receptores CB1 y CB2 o debido a los efectos causados por la interacción con neuromoduladores y la inhibición de neurotransmisores como el glutamato, la dopamina, las prostaglandinas, la acetilcolina, el GABA, la histamina, la noradrenalina y los péptidos opioides endógenos implicados en la modulación del dolor en perros y gatos (3, 55 y 56).
Se ha informado que los cannabinoides pueden disminuir la tolerancia y mantener la respuesta a otros fármacos después de la administración repetitiva, como los opioides utilizados para tratar el dolor crónico y agudo en modelos de roedores (57, 58). Como resultado, se ha sugerido el uso de cannabinoides como tratamiento multimodal del dolor sin efectos adversos en el tracto gastrointestinal o el filtrado glomerular (57-59). Las dosis deben reducirse cuando los cannabinoides se combinan con otros fármacos que actúan a través de los canales de calcio (como la gabapentina) para evitar una sedación excesiva (7). Los cannabinoides deben evitarse en las gestaciones, los animales lactantes y los animales menores de 8 semanas de edad (60). Los ensayos clínicos controlados y la investigación se centran principalmente en tratamientos innovadores y emergentes para el dolor, en particular para el dolor crónico y neuropático (28, 61), ya que los cannabinoides pueden prevenir y controlar la sensibilización central y periférica (62). Se ha demostrado que aumentan el confort y la actividad física en perros con artrosis, demostrando ser un tratamiento eficaz para el dolor crónico (30, 60, 63, 64).
Distribución espacial de los receptores cannabinoides
En el SNC, se ha encontrado una alta densidad de receptores cannabinoides en el cerebelo, el tronco encefálico y el bulbo raquídeo (65, 66). Sin embargo, CB1 se puede encontrar principalmente en la médula espinal, el gris periacueductal, los ganglios basales, el cerebelo y la corteza cerebral (21, 67). Estudios posteriores en animales mediante inmunohistoquímica han demostrado la presencia de receptores CB1 en el terminal axonal de la membrana presináptica y postsináptica en astrocitos, oligodendrocitos, células microgliales, meninges (la duramadre) y la corteza cerebral (lóbulo frontal, neocórtex y sustancia gris), donde este receptor está relacionado con los procesos de memoria y asociación. Otros sitios donde se han encontrado estos receptores en menor medida son la amígdala, el núcleo accumbens, el hipotálamo, el tálamo, el cerebelo y el mesencéfalo (gris periacueductal); Estos receptores participan en los efectos antinociceptivos y analgésicos centrales (12, 68). Los receptores también se pueden encontrar en el bulbo raquídeo, con una mayor densidad en el núcleo espinal del trigémino y el bulbo olfatorio, donde hay una mayor expresión, y su activación podría estar asociada a la modulación de la ingesta de alimentos. También se han identificado receptores en el núcleo parabraquial, áreas del tronco encefálico y la médula espinal (asta dorsal de la lámina X y el asta ventral en los segmentos cervical, torácico y lumbar), algunas células de Purkinje, nervios periféricos, la parte más externa de la piel, fibroblastos y macrófagos (39, 52, 69-71).
La inhibición retrógrada de la neurosecreción de acetilcolina, dopamina, GABA, histamina, 5HT, glutamina, colecistoquinina, D-aspartato, glicina y noradrenalina ha establecido que los receptores CB1 se encuentran predominantemente en las fibras presinápticas (56, 71, 72). En consecuencia, los agonistas de este tipo de receptores muestran más reacciones adversas psicoactivas en el SNC (hipotermia, ataxia o euforia), por lo que tienen un papel menor en el control del dolor a pesar de que varios estudios en modelos animales muestran que inhiben la producción de ciclooxigenasas (73). Por otro lado, su uso para tratar las convulsiones en modelos de perros y roedores ha aumentado. Se obtuvieron muestras de líquido cefalorraquídeo de perros que sufrían de epilepsia idiopática, donde se observó un aumento del nivel de anandamida y endocannabinoide en comparación con perros sanos (74).
La expresión de los receptores CB2 se encuentra en altas densidades en las células inmunitarias como los linfocitos T y B, CD4 y CD8, lo que inhibe la liberación de interleucina th2, 10, 12 e interferón gamma, células asesinas naturales, mastocitos, macrófagos y neutrófilos (14, 75). Estos receptores se han identificado en el bazo, el páncreas, el timo, los pulmones, las amígdalas, las glándulas parótidas y mandibulares, los parches de Peyer, los ganglios basales, las neuronas entéricas, el cuerpo estriado, la membrana sinovial, los queratinocitos de la piel y las células endoteliales de los vasos sanguíneos (4). Como parte del SNC, se pueden ver en la amígdala, el hipocampo, el cerebelo, la corteza cerebral, el núcleo accumbens, el globo pálido y el cuerpo estriado (76, 77). Además, estos receptores se expresan en la microglía y la astroglía. Así, este descubrimiento ha dado lugar a tratamientos para enfermedades neuroinflamatorias basados en dianas terapéuticas (51). Ha habido un debate en torno a la capacidad psicotrópica de algunos extractos de cannabis o derivados sintéticos debido a la activación de los receptores CB1. Sin embargo, no está claro si los receptores CB2 juegan un papel en este proceso (3, 5, 26).
La expresión de estos receptores en perros y gatos permitió identificar varios receptores, como el GPR55, en el tracto gastrointestinal, concretamente en el moco (lámina propia y células epiteliales) y en las capas musculares, el estómago, el píloro y el colon. Los receptores PPARα, PPARγ y TRPV1 se han encontrado en la lámina propia del píloro, el duodeno, el íleon, el colon, las células enterocromafines del estómago y las células endoteliales de los vasos sanguíneos. Los receptores PPAR se han asociado con efectos antinociceptivos y antiinflamatorios y con la prevención de la hiperalgesia y la alodinia. Los receptores alfa se han utilizado como dianas terapéuticas para el tratamiento de enfermedades cutáneas relacionadas con alergias o eosinofílicas en perros y gatos (51, 52, 78, 79).
Por lo tanto, el sistema cannabinoide regula los procesos fisiológicos y patológicos en humanos y animales, así como los reflejos nociceptivos y los procesos inflamatorios de varios tejidos. Como resultado, el uso de cannabinoides naturales o sintéticos inhibe la secreción de neurotransmisores e iones responsables de la modulación, proyección y percepción del dolor (72, 80), y este uso en animales de compañía se ha convertido en objeto de estudio (67-70).
El papel de los cannabinoides en la modulación del dolor
El tratamiento del dolor agudo, crónico y neuropático utiliza nuevas sustancias que ayudan a los analgésicos tradicionales, como los AINE, los opioides, los anestésicos locales y la ketamina. Por lo tanto, los cannabinoides se sugieren como una alternativa complementaria y eficaz (7). Para controlar el dolor, los fármacos que intervienen en la vía nociceptiva deben utilizarse como parte de un protocolo multimodal (20, 81), lo que se considera una ventaja terapéutica para el sistema endocannabinoide, ya que se expresa en las vías ascendente (percepción) y descendente (modulación) de la periferia y el centro terminal de las aferencias primarias (47). Puede modular estímulos en las láminas Rexed I, II y X del asta dorsal en la médula espinal, donde se pueden encontrar altas concentraciones de receptores CB1 (71).
Varios autores han reportado que el análisis histológico, inmunohistoquímico e inmunofluorescencia revelaron inmunorreactividad en la corteza cerebral, cornu ammonis y giro dentado del hipocampo, donde se encontraron células que reaccionan a CB1, demostrando la presencia y participación de cannabinoides en el control del dolor crónico y pacientes con epilepsia (7, 58). Estos hallazgos confirman que los agonistas sintéticos que se encuentran en los cannabinoides o endocannabinoides previenen la sensibilización central debido a la inhibición de GABA, glutamato y canales dependientes de voltaje (72, 73, 82).
La activación selectiva de los receptores CB2 ha mostrado efectos antinociceptivos, antiinflamatorios y neuroprotectores en modelos animales como roedores, perros y monos con artrosis, inflamación, lesión medular y neuropatías (7, 28). Al activar efectos antialodínicos, inhiben la hiperactividad de las fibras aferentes primarias y disminuyen la liberación de neurotransmisores que actúan sobre los nociceptores (28, 72, 83). Esta expresión en el asta dorsal de la médula espinal crea una regulación positiva en presencia de dolor neuropático e inflamatorio (84, 85). Como resultado, esto confirmaría que en las lesiones inflamatorias que afectan al tejido nervioso, hay modulación por parte de los receptores CB2.
El receptor CB2 está implicado en los procesos inmunes inhibiendo la liberación de citoquinas, controlando así el dolor oncológico y previniendo la progresión de neuropatías, artrosis, arteriosclerosis y enfermedades neurodegenerativas y neuroinflamatorias (86). También, mielopatías degenerativas, meningitis-arteritis, espirocercosis espinal y epilepsia. Un ejemplo lo encontramos en pacientes con lesiones medulares con mayor actividad y presencia de receptores CB2 en la microglía (87).
Los mecanismos que permiten a los receptores CB2 producir analgesia involucran varias vías de señalización con AMP cíclico (AMPc), factor de crecimiento nervioso (NGF), quinasa activada por mitógenos (MAP quinasa), factor nuclear kappa B (NK-KB), calcio a través de JAK-STAT 1, ceramidas, caspasas y quinasas c-Jun N-terminal, que pueden ser activadas por segundos mensajeros como las proteínas Gi/o (14, 36). Todavía se está investigando un mecanismo que consiste en el uso de agonistas sintéticos en ratones, como el AM1241, que estimula la liberación de β-endorfinas que pueden activar los receptores μ-opioides (46).
La implicación de los agonistas CB1 y CB2 en la inflamación y el dolor revela una diana terapéutica prometedora. Sin embargo, a pesar de la evidencia de su uso y eficacia en animales y humanos, sus efectos aún están bajo investigación. El papel de los receptores CB1 y CB2 sigue siendo objeto de estudio, ya que puede asociarse a varios mecanismos intracelulares que modulan la nocicepción (51, 88).
El CBD tiene al menos 76 dianas moleculares de acción diferentes. Por ejemplo, ejerce sus efectos analgésicos mediante interacciones y modulación de los sistemas inflamatorio y nociceptivo (como agonista inverso de TRPV1 o inhibición de COX2). El CBD tiene una alta actividad en otros canales potenciales de receptores transitorios ionotrópicos, como TRPA1, TRPV4, TRPV2 y TRPM8. Otros grupos de receptores a los que se une el CBD son los receptores acoplados a Gi (GPR55, GPR18), los PPAR, como los opioides, los 5-HT o los receptores de dopamina (89, 90).
Eficacia del CBD en el control del dolor
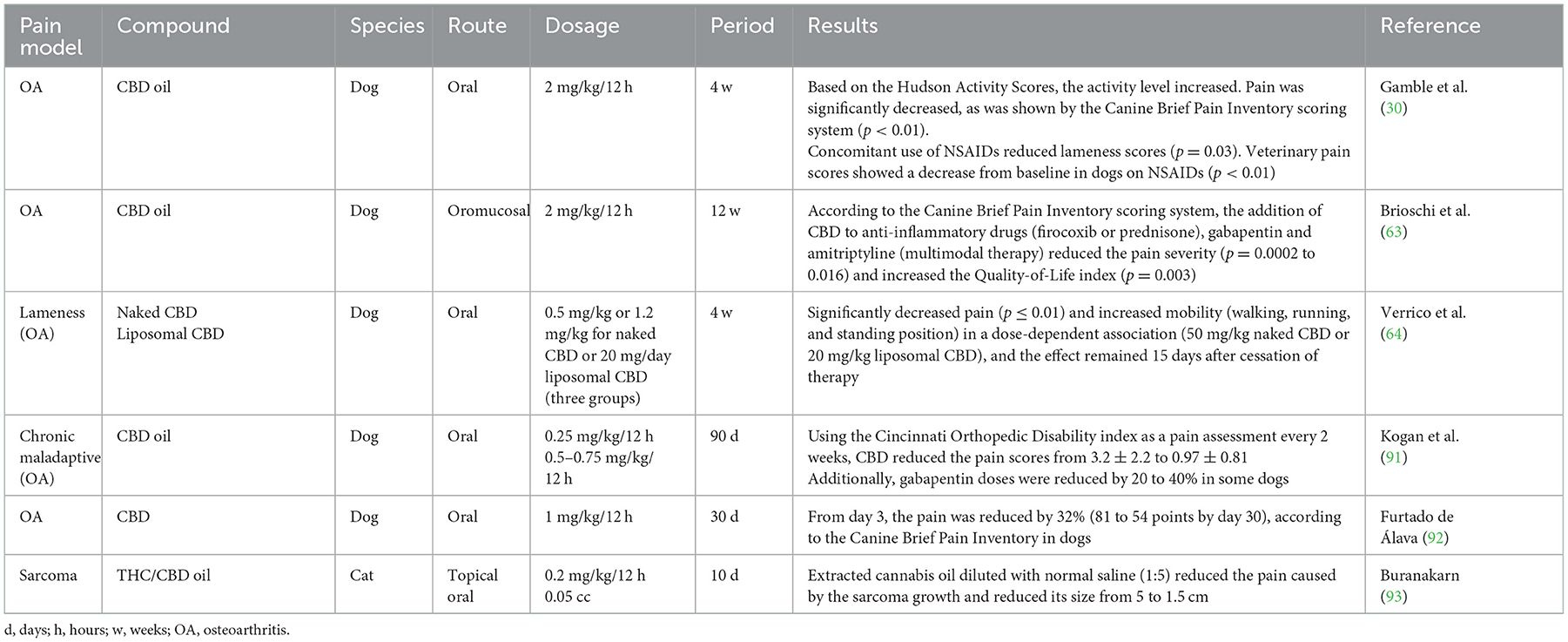
El CBD se ha estudiado para controlar el dolor en animales de compañía en modelos de dolor crónico, principalmente relacionado con la artrosis (12, 30, 46, 63). En la Tabla 2 se resumen algunos estudios clínicos sobre este uso (30, 63, 64, 91-93). Valastro et al. (62) identificaron y cuantificaron endocannabinoides en el líquido sinovial de perros con artrosis. Concluyeron que las rodillas osteoartríticas tenían concentraciones más altas de 2-AG, como la presencia de oleoiletanolamida (OEA), en comparación con las articulaciones contralaterales. Este estudio probó el efecto de la modulación del dolor y la inflamación describiendo la presencia de receptores endocannabinoides en los fluidos sinoviales y los tejidos inflamados adyacentes. Este aspecto es la razón por la que los cannabinoides tratan eficazmente el dolor artrítico en perros, tal y como mencionan Brioschi et al. (63) y Kogan et al. (91), aunque en el primer caso, fue en terapia multimodal. Sin embargo, la eficacia del CBD aún está en discusión, como mencionaron Mejía et al. (94) al medir la seguridad y el efecto del CBD en el control de los signos asociados al dolor causado por la artrosis canina durante 6 semanas. Los autores concluyeron que no había diferencias significativas en la evaluación de la marcha de los animales y el nivel de actividad de los animales, describiendo que el CBD como monoterapia no tiene una eficacia analgésica adecuada para controlar el dolor. Por el contrario, algunos autores sugieren que las propiedades analgésicas del CBD o el THC dependen de la dosis (95, 96).
Efectos adversos de los cannabinoides
La intoxicación por cannabis se considera una condición clínica con buen pronóstico en perros siempre y cuando no existan comorbilidades, complicaciones o co-ingestión de otras sustancias potencialmente intoxicantes. Se menciona que la DL50 (dosis letal media) de THC oral en perros parece ser de >3 g/kg. En cuanto al CBD, no existen datos publicados sobre su DL50, por lo que se puede inferir que hasta ahora, en estudios clínicos controlados, no se ha observado este fenómeno (12). Sin embargo, en cuanto a la seguridad clínica y los efectos adversos en los esquemas de administración multidosis, se ha reportado que dosis altas de 10 mg de CBD + 0,5 mg de THC/kg y dosis medias de 5 mg de CBD + 0,25 mg de THC/kg; Los metabolitos del CBD se detectaron hasta 48 h después. También muestra fases de eliminación lentas acompañadas de signos como hiperestesia (estímulos auditivos/visuales/táctiles) y déficits propioceptivos en las primeras 2 h de administración, que desaparecieron a las 4-6 h posteriores a la presentación (37). Otros eventos adversos observados en el grupo de dosis alta incluyeron ptialismo (1/6 perros), incontinencia urinaria (1/6 perros) y vómitos (3/6 perros). Por otro lado, los animales tratados con cambios neurológicos de dosis única y múltiple (midriasis, ataxia, hiperacusia y respuestas reflejas retardadas) se detectaron 2 h después de administrar la dosis única de 5 mg de CBD/kg. Sin embargo, los signos disminuyeron significativamente o estuvieron ausentes dentro de las primeras 6 h (37).
Por otro lado, Brioschi et al. (63) reportan la presencia de ptialismo mínimo en el 22% de los animales tratados con CBD (2 de 9 perros), además de somnolencia y ataxia leve en 1 de 9 sujetos experimentales. Del mismo modo, Vaughn et al. (97) encontraron efectos adversos leves en el 94,9% de los casos, efectos moderados en el 4,4% de los animales estudiados y solo el 0,8% tuvieron efectos graves, como letargo, hipotermia y ataxia. Cabe mencionar que estos efectos se atribuyeron a un preparado de THC, lo que implica que las características químicas y farmacocinéticas de estos productos podrían ser las principales responsables de la aparición de signos neurológicos adversos. Asimismo, en un estudio similar en perros medicados con una dosis repetida de 12 mg/kg de un extracto de cannabis por vía oral durante 28 días, se generaron signos gastrointestinales leves como hipersalivación, además de un aumento de la fosfatasa alcalina sérica (98). Esto revela que estos efectos adversos están relacionados con el tiempo de exposición, el tipo de producto y la dosis utilizada.
Janeczek et al. (99) informaron de los efectos adversos de la intoxicación por fitocannabinoides en un gato, describiendo trastornos de la conciencia, convulsiones, ataxia, depresión, ansiedad, vocalización, hipersalivación, diarrea, vómitos, bradicardia o taquicardia, hipotermia y midriasis (99). Desde un punto de vista comparativo, estos efectos son similares a los reportados en perros. Sin embargo, según Kulpa et al. (33), la seguridad y tolerabilidad de las dosis orales escalonadas de aceite de cannabis producen efectos adversos leves y transitorios, a pesar de que la administración de aceite de CBD se llevó a cabo a una dosis de 30,5 mg/kg se observó letargo, hipotermia, ataxia y protrusión de la membrana nictitante, que no requirió intervención médica para su resolución. Desafortunadamente, la falta de información relacionada con esta especie es limitada, lo que dificulta comparar la incidencia de efectos adversos reportados en perros y corroborar su seguridad en gatos. De tal manera, es necesario recalcar que a pesar de la utilidad clínica de los cannabinoides, no se pueden ignorar los efectos adversos presentes, los cuales deben ser controlados y resueltos por el veterinario durante su uso.
Perspectivas del estudio, limitaciones de su aplicación clínica y evaluaciones terapéuticas del uso de cannabinoides en modelos de roedores, perros y gatos
Los estudios centrados en los cannabinoides utilizados en medicina veterinaria predominan en animales de laboratorio en lugar de especies domésticas, en particular perros y gatos. Estos estudios han permitido el desarrollo de agonistas sintéticos de los receptores cannabinoides en función de su estructura química y la investigación adicional sobre la distribución específica de los receptores cannabinoides en el SNC. Debido a las limitaciones de estos fármacos, actualmente se están utilizando solo in vitro y en animales de experimentación como ratones, ratas o cobayas para transferirlos a la medicina humana (88). Sin embargo, WIN55,212-2, un agonista sintético, se ha utilizado como anticonvulsivo, y está dirigido a perros que sufren de epilepsia idiopática que han mostrado niveles elevados de anandamida y endocannabinoides en su líquido cefalorraquídeo, en comparación con los animales sanos (67).
Gamble et al. (30) probaron recientemente la seguridad y la eficacia analgésica del aceite de CBD a una concentración de 10 mg/ml de CBD (como una mezcla igual de CBD y CBDA) y 0,24 mg/ml; 0,27 mg/mL de THC y cannabicromeno respectivamente, en perros con dolor crónico causado por artrosis. Cada perro recibió una dosis oral de 2 mg/kg y otra de 8 mg/kg durante 4 semanas y mostró una vida media de eliminación de 4,2 h sin efectos secundarios. Las evaluaciones para evaluar la eficiencia analgésica y las puntuaciones de la actividad de Hudson mostraron una disminución significativa en el grado de dolor con la dosis utilizada. Durante el ensayo, a los perros solo se les permitió recibir AINE, aceite de pescado y/o sulfato de glucosamina/condroitina sin cambiar estos medicamentos durante 4 semanas antes o durante el período de estudio de 10 semanas como estándar de atención para el proceso de la enfermedad. En cuanto a las pruebas clínicas de seguridad y toxicidad, no se observaron diferencias significativas en el BUN, la creatinina o el fósforo entre los perros tratados con aceite de CBD frente al aceite placebo, mientras que el tratamiento con AINE resultó en una mayor concentración de creatinina. En este estudio, también se informó de un aumento de la actividad de la fosfatasa alcalina en nueve perros tratados con CBD, lo que explica que este efecto puede deberse a la inducción del metabolismo oxidativo en el hígado mediado por el citocromo p450.
La eficacia clínica de los cannabinoides para tratar el dolor oncológico en pacientes veterinarios también se ha demostrado después de que se demostrara que las reacciones nociceptivas son el resultado de la estimulación de las vías aferentes viscerales y somáticas que podrían causar dolor neuropático (3, 7). Las reacciones inflamatorias son comunes en el cáncer y se pueden tratar con opioides y AINE (100). Esta afección favorece la presencia de fatiga, disminución de la movilidad, trastornos cognitivos, afecciones urinarias y dolor relacionado con el síndrome paraneoplásico (moderado a intenso). Como resultado, el uso de derivados naturales como los cannabinoides ofrece una alternativa segura para el control del dolor. Además, esta actividad neoplásica sería beneficiosa para controlar las reacciones adversas causadas por los antineoplásicos o el propio cáncer (101).
Johnson et al. (102) realizaron un estudio de seguimiento en 43 pacientes humanos con dolor avanzado relacionado con el cáncer. Se utilizó un spray de THC/CBD para evaluar la eficacia y la tolerabilidad a los opioides durante 3 semanas. Hubo una reducción significativa del dolor, como se vio en las puntuaciones de los cuestionarios que representaban el dolor. No se reportaron problemas de seguridad asociados con el uso de este aerosol. En medicina veterinaria, el CBD ha mostrado resultados prometedores como prescripción única o en combinación con mitoxantrona y vinblastina para el tratamiento de células de carcinoma urotelial canino (103), en tumor cutáneo de mastocitos caninos (104) e incluso como terapia multimodal compasiva para el dolor reportada en un caso de un perro con artrosis y neoplasia testicular que fue medicado con robencoxib, gabapentina, y una formulación de CBD liposomal inyectado por vía subcutánea (105).
Ya se han estudiado interacciones farmacológicas como las mencionadas anteriormente, y el uso de cannabinoides creó un efecto sinérgico con los agonistas opioides (106). Estudios similares revelaron una eficacia analgésica en ratas a las que se les administró una combinación de morfina subcutánea junto con la administración intraperitoneal de THC en dosis altas (100 y 4 mg/kg, respectivamente) y bajas (75 mg/kg y 4 mg/kg), ambas productoras de analgesia. Además, esta combinación evitó la tolerabilidad a los opioides; estos resultados son similares a otros estudios que han utilizado agonistas del receptor CB (57-59). Una explicación para este efecto sinérgico es que ambos fármacos producen analgesia a través de vías de señalización ligadas a segundos mensajeros como la proteína G (14, 107).
En cuanto al desarrollo de productos farmacéuticos, la Universidad de Cambridge fabricó un producto llamado Sativex equivalente a 8,1 mg de Δ®9-THC: 7,5 mg de CBD), que se ha utilizado en medicina humana y actualmente se utiliza para ensayos clínicos controlados en animales como perros y gatos (3, 87).
Además, se ha informado que el CBD puede reducir el consumo de anestésicos inhalatorios en modelos animales. En este sentido, la administración de CBD y opioides puros como la morfina reduce significativamente el consumo de anestésicos inhalatorios (108). Otros estudios indican que una sola dosis de cannabinoides puede modificar la profundidad anestésica con agentes inhalatorios, donde las alteraciones electroencefalográficas pueden ser monitoreadas a través del índice biespectral (BIS) (109). Sin embargo, es necesaria una discusión clara si este beneficio podría exceder el control del dolor proporcionado por esta sustancia (110). En cuanto a otras interacciones, se ha descrito un efecto de potenciación con las benzodiacepinas debido a la afinidad de unión y degradación del GABA. Con la gabapentina, el CBD potencia su efecto analgésico, y se pueden reducir las dosis. Por otro lado, la acción de los cannabinoides sobre los receptores 5HT-1A, 5HT-2A y 5HT-3A puede aumentar los efectos del síndrome serotoninérgico (7). En cuanto a otros anestésicos, estudios en ratas han demostrado que la ketamina puede funcionar como un agonista exógeno del CBD, liberando anandamida (110), y el propofol inhibe las respuestas simpáticas mediadas por CB1 y CB2, por lo que su efecto puede prolongarse (111), al igual que ocurre con los barbitúricos y la alfaxalona (7).
Conclusiones
El estudio del sistema endocannabinoide, sus ligandos, receptores, mecanismo de acción y señalización, ha llevado a investigaciones que demuestran que los extractos de cannabis y los derivados sintéticos son una alternativa terapéutica eficaz para el manejo multimodal del dolor. La evidencia sugiere que los cannabinoides pueden usarse en medicina veterinaria para tratar el dolor agudo, crónico y neuropático debido a su capacidad para prevenir la sensibilización periférica y central (112).
Sin embargo, dado que el sistema endocannabinoide es una vía de señalización que regula varias acciones, su interacción con diferentes ligandos endógenos y la modulación de neurotransmisores puede tener efectos beneficiosos en pacientes que sufren convulsiones, dermatitis de contacto y atópica, epilepsia, mielopatías degenerativas, asma, diabetes, glaucoma, retinosis pigmentaria y enfermedades inflamatorias. Estos compuestos también poseen propiedades antineoplásicas, estimulantes del apetito y antieméticas (3, 90, 113-116).
Según algunos ensayos clínicos, el CBD es un fármaco analgésico potencial para el control del dolor crónico en animales de compañía, aunque parece tener una forma dependiente de la dosis. Estos resultados muestran la importancia de estudiar los cannabinoides y su efecto sobre el SNC y el SNP y la expresión y el papel de sus receptores en animales de compañía como un campo de estudio potencial para que la medicina veterinaria ofrezca beneficios para la salud y el bienestar de futuros pacientes.
Contribuciones de los autores
Todos los autores enumerados han hecho una contribución sustancial, directa e intelectual al trabajo y lo han aprobado para su publicación.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Marcoux RM, Larrat EP, Vogenberg FR. Marihuana medicinal y aspectos legales relacionados. P T. (2013) 38:612–9.
2. Stogdale L. Enero Ética Médica Veterinaria – Cannabinoides para tratar perros y gatos. ¿Puede Vet J. (2019) 60:345.
3. Landa L, Sulcova A, Gbelec P. El uso de cannabinoides en animales y las implicaciones terapéuticas para la medicina veterinaria: una revisión. Veterinario Med. (2016) 61:111–22. doi: 10.17221/8762-VETMED
4. Hollinshead SP, Tidwell MW, Palmer J, Guidetti R, Sanderson A, Johnson MP, et al. Receptor cannabinoide selectivo tipo 2. (CB2): optimización de una serie de purinas que conduce a la identificación de un candidato clínico para el tratamiento del dolor artrósico. J Med Chem. (2013) 56:5722–33. DOI: 10.1021/JM400305D
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Kogan L, Hellyer P, Silcox S, Schoenfeld-Tacher R. Uso y percepciones de los productos de cannabis por parte de los dueños de perros canadienses. ¿Puede Vet J. (2019) 60: 749–55.
6. ElSohly M. Constituyentes químicos del cannabis. En: Grotenhermen F, Russo F, editores. Cannabis y Cannabinoides Farmacología, Toxicología y Potencial Terapéutico. Nueva York, Estados Unidos: Haworth Press (2002). págs. 27-36
7. Copas G, Amazonas E, Brandon S. La farmacología de los cannabinoides. En: Cital S, Kramer K, Hughston L, Gaynor J., editores. Cannabis Terapia en Medicina Veterinaria. Una guía completa. Cham, Suiza: Springer (2021). p. 17–59 doi: 10.1007/978-3-030-68317-7_2
8. Mechoulam R, Hanuš L, A. Reseña histórica de la investigación química sobre cannabinoides. Lípidos de Chem Phys. (2000) 108:1–13. doi: 10.1016/S0009-3084(00)00184-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Mechoulam R, Ben Shabat S, Hanuš L, Fride E, Vogel Z, Bayewitch M, et al. Ligandos cannabinoides endógenos: estudios químicos y biológicos. J Señal de la célula mediata lipídica. (1996) 14:45–9. doi: 10.1016/0929-7855(96)01507-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Fisar Z. Fitocannabinoides y endocannabinoides. Curr Drug Abus Rev. (2009) 2:51–75. doi: 10.2174/1874473710902010051
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Mechoulam R, Devane W, Glaser R. Geometría cannabinoide y actividad biológica. En: Murphy L, Bartke A, editores. Marihuana/Cannabinoides: Neurobiología y Neurofisiología. Florida, Estados Unidos: CRC Press. (1992). p. 1–33 doi: 10.1201/9780429276279-1
12. Coelho RC, de Leme FA, Moreira FE, Branco MT, Melo SM, de Melo E. Revisión actual de los medicamentos a base de cáñamo en perros. J Vet Pharmacol Ther. (2021) 44:870–882. doi: 10.1111/jvp.13016
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Earleywine M. Entendiendo la marihuana: una nueva mirada a la evidencia científica. Nueva York, Estados Unidos: University Press (2002). 1–344 págs.
14. Howlett AC. Los receptores cannabinoides. Prostaglandinas Otros mediatos lipídicos. (2002) 68:619–631. doi: 10.1016/S0090-6980(02)00060-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Sharma P, Murthy P, Bharath MM. Química, metabolismo y toxicología del cannabis: implicaciones clínicas. Irán J Psiquiatría. (2012) 7:149–56.
16. Pertwee RG. Acciones farmacológicas de los cannabinoides. Handb Exp Pharmacol. (2005) 168:1–51. doi: 10.1007/3-540-26573-2_1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. McPartland JM, Glass M, Pertwee RG. Meta-análisis de la afinidad de unión a ligandos cannabinoides y la distribución de receptores: diferencias entre especies. Hno. J Pharmacol. (2007) 152:583–93. doi: 10.1038/sj.bjp.0707399
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Morales P, Reggio PH, Jagerovic N. Una visión general de la química medicinal de los derivados sintéticos y naturales del cannabidiol. Frente Pharmacol. (2017) 8:422. doi: 10.3389/fphar.2017.00422
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Guindon J, Hohmann AAA. El sistema endocannabinoide y el dolor. Disord neurol del SNC – Dianas farmacológicas. (2009) 8:403–21. doi: 10.2174/187152709789824660
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Kenakin T. Nuevos conceptos en eficacia farmacológica en receptores 7TM: Revisión IUPHAR 2. Hno. J Pharmacol. (2013) 168:554–75. doi: 10.1111/j.1476-5381.2012.02223.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Deabold KA, Schwark WS, Wolf L, Wakshlag JJ. Farmacocinética de dosis única y evaluación preliminar de la seguridad con el uso de nutracéuticos de cáñamo ricos en CBD en perros y gatos sanos. Animales. (2019) 9:832. doi: 10.3390/ani9100832
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Yu CHJ, VPH de Rupasinghe. Productos naturales para la salud a base de cannabidiol para animales de compañía: avances recientes en el manejo de la ansiedad, el dolor y la inflamación. Res Vet Sci. (2021) 140:38–46. doi: 10.1016/j.rvsc.2021.08.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Silver R, Silcox S, Loughton D. Selección de productos y consideraciones de dosificación. En: Cital S, Kramer K, Hughston L, Gaynor J, editores. Cannabis terapia en medicina veterinaria. Una guía completa. Suiza: Springer (2021). p. 307–342 doi: 10.1007/978-3-030-68317-7_13
26. Grotenhermen F, Müller-Vahl K. El potencial terapéutico del cannabis y los cannabinoides. Dtsch Aerzteblatt Online. (2012) 3:495. doi: 10.3238/arztebl.2012.0495
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Presley B, Jansen-Varnum S, Logan B. Análisis de cannabinoides sintéticos en material botánico: una revisión de los métodos analíticos y los hallazgos. Ciencia Forense Revsión. (2013) 25:27–46.
28. Huestis MA, Henningfield JE, Cone EJ. Cannabinoides en sangre. I Absorción de THC y formación de 11-OH-THC y THCCOOH durante y después de fumar marihuana. J Toxicol Anal. (1992) 16:276–82. doi: 10.1093/jat/16.5.276
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Grotenhermen F. Farmacocinética y farmacodinámica de los cannabinoides. Clin Pharmacokinet. (2003) 42:327–60. doi: 10.2165/00003088-200342040-00003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Gamble LJ, Boesch JM, Frye CW, Schwark WS, Mann S, Wolfe L, et al. Farmacocinética, seguridad y eficacia clínica del tratamiento con cannabidiol en perros con artrosis. Front Vet Sci. (2018) 5:165. doi: 10.3389/fvets.2018.00165
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Wakshlag JJ, Schwark WS, Deabold KA, Talsma BN, Cital S, Lyubimov A, et al. Farmacocinética del cannabidiol, ácido cannabidiólico, δ9-tetrahidrocannabinol, ácido tetrahidrocannabinólico y metabolitos relacionados en suero canino después de la dosificación con tres formas orales de extracto de cáñamo. Front Vet Sci. (2020) 7:505. doi: 10.3389/fvets.2020.00505
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Hannon MB, Deabold KA, Talsma BN, Lyubimov A, Iqbal A, Zakharov A, et al. Cannabidiol sérico, tetrahidrocannabinol. (THC), y sus derivados ácidos nativos después de la aplicación transdérmica de un extracto de Cannabis sativa bajo en THC en beagles. J Vet Pharmacol Ther. (2020) 43:508–11. doi: 10.1111/jvp.12896
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Kulpa JE, Paulionis LJ, Eglit GM, Vaughn DM. Seguridad y tolerabilidad del aumento de dosis de cannabinoides en gatos sanos. J Feline Med Surg. (2021) 23:1162–75. doi: 10.1177/1098612X211004215
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Samara E, Bialer M, Mechoulam R. Farmacocinética del cannabidiol en perros. Medicamentos Metab Dispos. (1988) 16:469–72.
35. Bartner L, McGrath S, Sangeeta R, Hyatt L, Wittenburg L. Farmacocinética del cannabidiol administrado por 3 métodos de administración en 2 dosis diferentes a perros sanos. Can J Vet Res. (2018) 82:178–83.
36. Fernández-Trapero M, Pérez-Díaz C, Espejo-Porras F, de Lago E, Fernández-Ruiz J. Farmacocinética del sativex en perros: hacia una posible terapia basada en cannabinoides para los trastornos caninos. Biomoléculas. (2020) 10:279. doi: 10.3390/biom10020279®
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Chicoine A, Illing K, Vuong S, Pinto KR, Alcorn J, Cosford K. Evaluación farmacocinética y de seguridad de varias dosis orales de un nuevo extracto de hierbas de cannabis THC:CBD 1:20 en perros. Front Vet Sci. (2020) 7:34041. doi: 10.3389/fvets.2020.583404
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. RJ de plata. El sistema endocannabinoide de los animales. Animales. (2019) 9:686. doi: 10.3390/ani9090686
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Rodríguez de Fonseca F, Del Aarco I, Bermúdez-Silva FJ, Bilbao A, Cippitelli A, Navarro M, et al. El sistema endocannabinoide: Fisiología y farmacología. Alcohol Alcohol. (2005) 40:2–14. doi: 10.1093/alcalc/agh110
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Starowicz K, Finn DP. Cannabinoides y dolor: sitios y mecanismos de acción. Adv Pharmacol. (2017) 45:437–75. doi: 10.1016/bs.apha.2017.05.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Zou S, Kumar U. Receptores cannabinoides y el sistema endocannabinoide: señalización y función en el sistema nervioso central. Int J Mol Sci. (2018) 19:833. doi: 10.3390/ijms19030833
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. Diputado Davis. Cannabinoides en el tratamiento del dolor: CB1, CB2 y ligandos receptores no clásicos. Experto Opin Investig Drugs. (2014) 23:1123–40. doi: 10.1517/13543784.2014.918603
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Heifets BD, Castillo PE. Señalización endocannabinoide y plasticidad sináptica a largo plazo. Annu Rev Physiol. (2009) 71:283–306. doi: 10.1146/annurev.physiol.010908.163149
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Zhang HY, Gao M, Liu QR, Bi GH, Li X, Yang HJ, et al. Los receptores cannabinoides CB 2 modulan la actividad neuronal de dopamina del mesencéfalo y el comportamiento relacionado con la dopamina en ratones. Proc Natl Acad Sci. (2014) 111:5007–2015. doi: 10.1073/pnas.1413210111
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Vasileiou I, Fotopoulou G, Matzourani M, Patsouris E, Theocharis S. Evidencia de la participación de los polimorfismos de los receptores cannabinoides en la fisiopatología de las enfermedades humanas. Objetivos de Opin Ther expertos. (2013) 17:363–77. doi: 10.1517/14728222.2013.754426
Resumen de PubMed | Texto completo de CrossRef | Google Académico
46. Beltramo M. Receptor cannabinoide tipo 2 como diana para el dolor crónico. Mini-Reseñas Med Chem. (2009) 9:11–25. doi: 10.2174/138955709787001785
Resumen de PubMed | Texto completo de CrossRef | Google Académico
47. Svizenska I, Dubovy P, Sulcova A. Receptores cannabinoides 1 y 2. (CB1 y CB2), su distribución, ligandos e implicación funcional en las estructuras del sistema nervioso — Una breve revisión. Pharmacol Biochem Behave. (2008) 90:501–11. doi: 10.1016/j.pbb.2008.05.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
48. Hohmann AG, Briley EM, Herkenham M. Distribución presináptica y postsináptica de los receptores cannabinoides y opioides mu en la médula espinal de rata. Res. Cerebral (1999) 822:17–25. doi: 10.1016/S0006-8993(98)01321-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
49. Ameri A. Los efectos de los cannabinoides en el cerebro. Prog Neurobiol. (1999) 58:315–48. doi: 10.1016/S0301-0082(98)00087-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
50. Marichal-Cancino B, Fajardo-Valdez A, Ruiz-Contreras A, Méndez-Díaz M, Próspero-García O. Avances en la fisiología de GPR55 en el sistema nervioso central. Curr Neuropharmacol. (2017) 15:5441. doi: 10.2174/1570159X14666160729155441
Resumen de PubMed | Texto completo de CrossRef | Google Académico
51. Zhang J, Hoffert C, Vu HK, Groblewski T, Ahmad S, O’Donnell D. Inducción de la expresión del receptor CB2 en la médula espinal de rata de modelos de dolor crónico neuropático pero no inflamatorio. Eur J Neurosci. (2003) 17:2750–4. doi: 10.1046/j.1460-9568.2003.02704.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
52. Galiazzo G, Giancola F, Stanzani A, Fracassi F, Bernardini C, Forni M, et al. Localización de los receptores cannabinoides CB1, CB2, GPR55 y PPARα en el tracto gastrointestinal canino. Histochem Cell Biol. (2018) 150:187–205. doi: 10.1007/s00418-018-1684-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
53. Stanzani A, Galiazzo G, Giancola F, Tagliavia C, De Silva M, Pietra M, et al. Localización de cannabinoides y receptores relacionados con cannabinoides en el tracto gastrointestinal del gato. Histochem Cell Biol. (2020) 153:339–56. doi: 10.1007/s00418-020-01854-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
54. Cabral G, Griffin-Thomas L. Cannabinoides como agentes terapéuticos para la ablación de la enfermedad neuroinflamatoria. Metab endocrino Immune Disord Targets. (2008) 8:159–72. doi: 10.2174/187153008785700118
Resumen de PubMed | Texto completo de CrossRef | Google Académico
55. Walter L, Stella N. Cannabinoides y neuroinflamación. Hno. J Pharmacol. (2004) 141:775–85. doi: 10.1038/sj.bjp.0705667
Resumen de PubMed | Texto completo de CrossRef | Google Académico
56. Tanda G, Goldberg SR. Cannabinoides: recompensa, dependencia y mecanismos neuroquímicos subyacentes: una revisión de datos preclínicos recientes. Psicofarmacología. (2003) 169:115–34. DOI: 10.1007/S00213-003-1485-Z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
57. Cichewicz DL, McCarthy EA. Sinergia antinociceptiva entre el δ 9-tetrahidrocannabinol y los opioides después de la administración oral. J Pharmacol Exp ther. (2003) 304:1010–5. doi: 10.1124/jpet.102.045575
Resumen de PubMed | Texto completo de CrossRef | Google Académico
58. Bailey CP, Connor M. Opioides: mecanismos celulares de tolerancia y dependencia física. Curr Opin Pharmacol. (2005) 5:60–8. doi: 10.1016/j.coph.2004.08.012
Resumen de PubMed | Texto completo de CrossRef | Google Académico
59. Grotenhermen F. Cannabinoides. Curr Drug Target -SNC Neurol Disord. (2005) 4:507–30. doi: 10.2174/156800705774322111
Resumen de PubMed | Texto completo de CrossRef | Google Académico
60. Monteiro BP, Lascelles BDX, Murrell J, Robertson S, Steagall PVM, Wright B. 2022 Directrices de la WSAVA para el reconocimiento, la evaluación y el tratamiento del dolor. J Pequeña Anim Pract. (2022). 35:450.
61. Cox ML, Haller VL, Welch SP. Sinergia entre Δ9-tetrahidrocannabinol y morfina en la rata artrítica. Eur J Pharmacol. (2007) 567:125–30. doi: 10.1016/j.ejphar.2007.04.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
62. Valastro C, Campanile D, Marinaro M, Franchini D, Piscitelli F, Verde R, et al. Caracterización de endocannabinoides y aciletanolamidas relacionadas en el líquido sinovial de perros con artrosis: un estudio piloto. BMC Vet Res. (2017) 13:309. doi: 10.1186/s12917-017-1245-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
63. Brioschi FA, Di Cesare F, Gioeni D, Rabbogliatti V, Ferrari F, D’Urso ES, et al. Formulación de aceite de cannabidiol transmucoso oral como parte de un régimen analgésico multimodal: efectos sobre el alivio del dolor y la mejora de la calidad de vida en perros afectados por artrosis espontánea. Animales. (2020) 10:1505. doi: 10.3390/ani10091505
Resumen de PubMed | Texto completo de CrossRef | Google Académico
64. Verrico CD, Wesson S, Konduri V, Hofferek CJ, Vázquez-Pérez J, Blair E, et al. Estudio aleatorizado, doble ciego y controlado con placebo del cannabidiol diario para el tratamiento del dolor de la osteoartritis canina. Dolor. (2020) 161:2191–202. doi: 10.1097/j.pain.000000000000001896
Resumen de PubMed | Texto completo de CrossRef | Google Académico
65. Cichewicz DL. Interacciones sinérgicas entre analgésicos cannabinoides y opioides. Ciencia de la vida. (2004) 74:1317–24. doi: 10.1016/j.lfs.2003.09.038
Resumen de PubMed | Texto completo de CrossRef | Google Académico
66. Herkenham M, Lynn AB, Little MD, Johnson MR, Melvin LS, de Costa BR, et al. Localización de receptores cannabinoides en el cerebro. Proc Natl Acad Sci. (1990) 87:1932–6. doi: 10.1073/pnas.87.5.1932
Resumen de PubMed | Texto completo de CrossRef | Google Académico
67. Cristino L, Imperatore R, Di Marzo V. Técnicas para la localización celular y subcelular de receptores y enzimas endocannabinoides en el cerebro de mamíferos. Métodos enzimológicos. (2017) 63:61–98. doi: 10.1016/bs.mie.2017.05.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
68. Freundt-Revilla J, Kegler K, Baumgärtner W, Tipold A. Distribución espacial del receptor cannabinoide tipo 1. (CB1) en el sistema nervioso central y periférico canino normal. PLoS UNO. (2017) 12:e0181064. doi: 10.1371/journal.pone.0181064
Resumen de PubMed | Texto completo de CrossRef | Google Académico
69. Martin WJ, Patrick SL, Coffin PO, Tsou K, Walker JM. Un examen de los sitios centrales de acción de la antinocicepción inducida por cannabinoides en la rata. Ciencia de la vida. (1995) 56:2103–9. doi: 10.1016/0024-3205(95)00195-C
Resumen de PubMed | Texto completo de CrossRef | Google Académico
70. Glass M, Faull RL, Dragunow M. Receptores cannabinoides en el cerebro humano: un estudio autorradiográfico anatómico y cuantitativo detallado en el cerebro humano fetal, neonatal y adulto. Neurociencia. (1997) 77:299–318. doi: 10.1016/S0306-4522(96)00428-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
71. Tsou K, Brown S, Sañudo-Peña M, Mackie K, Walker J. Distribución inmunohistoquímica de los receptores cannabinoides CB1 en el sistema nervioso central de ratas. Neurociencia. (1998) 83:393–411. doi: 10.1016/S0306-4522(97)00436-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
72. Rea K, Roche M, Finn DP. Modulación supraespinal del dolor por cannabinoides: el papel del GABA y el glutamato. Hno. J Pharmacol. (2007) 152:633–48. doi: 10.1038/sj.bjp.0707440
Resumen de PubMed | Texto completo de CrossRef | Google Académico
73. Farquhar-Smith WP, Egertová M, Bradbury EJ, McMahon SB, Rice ASC, Elphick MR. Expresión del receptor cannabinoide CB1 en la médula espinal de rata. Neurosci de células molares. (2000) 15:510–21. doi: 10.1006/mcne.2000.0844
Resumen de PubMed | Texto completo de CrossRef | Google Académico
74. Gesell FK, Zoerner AA, Brauer C, Engeli S, Tsikas D, Tipold A. Alteraciones de los endocannabinoides en el líquido cefalorraquídeo de perros con trastorno epiléptico convulsivo. BMC Vet Res. (2013) 9:262. doi: 10.1186/1746-6148-9-262
Resumen de PubMed | Texto completo de CrossRef | Google Académico
75. Echeverría-Villalobos M, Todeschini AB, Stoicea N, Fiorda-Díaz J, Weaver T, Bergese SD. Cuidados perioperatorios de los consumidores de cannabis: una revisión exhaustiva de las consideraciones farmacológicas y anestésicas. J Clin Anesth. (2019) 57:41–9. doi: 10.1016/j.jclinane.2019.03.011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
76. Pertwee RG. Farmacología de los receptores cannabinoides CB1 y CB2. Pharmacol Ther. (1997) 74:129–80. doi: 10.1016/S0163-7258(97)82001-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
77. Galiegue S, Mary S, Marchand J, Dussossoy D, Carriere D, Carayon P, et al. Expresión de receptores cannabinoides centrales y periféricos en tejidos inmunes humanos y subpoblaciones de leucocitos. Eur J Biochem. (1995) 232:54–61. doi: 10.1111/j.1432-1033.1995.tb20780.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
78. Li Y, Kim J. Funciones distintas de los receptores cannabinoides CB2 neuronales y microgliales en el hipocampo del ratón. Neurociencia. (2017) 363:11–25. doi: 10.1016/j.neuroscience.2017.08.053
Resumen de PubMed | Texto completo de CrossRef | Google Académico
79. Miragliotta V, Ricci PL, Albanese F, Pirone A, Tognotti D, Abramo F. Receptores cannabinoides tipos 1 y 2 y receptores activados por proliferadores de peroxisomas α: distribución en la piel de gatos clínicamente sanos y gatos con dermatitis por hipersensibilidad. Veterinario Dermatol. (2018) 29:316–E111. doi: 10.1111/vde.12658
Resumen de PubMed | Texto completo de CrossRef | Google Académico
80. Yao BB, Hsieh GC, Frost JM, Fan Y, Garrison TR, Daza A V, et al. Caracterización in vitro e in vivo de A-796260: un agonista selectivo del receptor cannabinoide CB 2 que exhibe actividad analgésica en modelos de dolor en roedores. Hno. J Pharmacol. (2008) 153:390–401. doi: 10.1038/sj.bjp.0707568
Resumen de PubMed | Texto completo de CrossRef | Google Académico
81. Suzuki R, Dickenson A. Contribuciones espinales y supraespinales a la sensibilización central en la neuropatía periférica. Neuroseñales. (2005) 14:175–81. doi: 10.1159/000087656
Resumen de PubMed | Texto completo de CrossRef | Google Académico
82. Ossipov MH, Morimura K, Porreca F. Modulación del dolor descendente y cronificación del dolor. Curr Opin Support Palliat Care. (2014) 8:143–51. doi: 10.1097/SPC.000000000000000055
Resumen de PubMed | Texto completo de CrossRef | Google Académico
83. Trettel J, Levine ES. Los endocannabinoides median la señalización retrógrada rápida en las sinapsis de las neuronas interneuronales → piramidales del neocórtex. J Neurophysiol. (2003) 89:2334–8. doi: 10.1152/jn.01037.2002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
84. LaBuda CJ, Koblish M, Pequeño PJ. Actividad agonista del receptor cannabinoide CB2 en la incisión de la pata trasera. Eur J Pharmacol. (2005) 527:172–4. doi: 10.1016/j.ejphar.2005.10.020
Resumen de PubMed | Texto completo de CrossRef | Google Académico
85. Milligan ED, Twining C, Chacur M, Biedenkapp J, O’Connor K, Poole S, et al. La glía espinal y las citocinas proinflamatorias median el dolor neuropático de imagen especular en ratas. J Neurosci. (2003) 23:1026–40. doi: 10.1523/JNEUROSCI.23-03-01026.2003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
86. Zogopoulos P, Vasileiou I, Patsouris E, Theocharis SE. El papel de los endocannabinoides en la modulación del dolor. Fundam Clin Pharmacol. (2013) 27:64–80. doi: 10.1111/fcp.12008
Resumen de PubMed | Texto completo de CrossRef | Google Académico
87. Miller LK, Devi LA. Los altibajos de la expresión de los receptores cannabinoides en la enfermedad: mecanismos y sus implicaciones terapéuticas. Pharmacol Rev. (2011) 63:461–70. doi: 10.1124/pr.110.003491
Resumen de PubMed | Texto completo de CrossRef | Google Académico
88. Ibrahim MM, Porreca F, Lai J, Albrecht PJ, Rice FL, Khodorova A, et al. La activación del receptor cannabinoide CB 2 produce antinocicepción al estimular la liberación periférica de opioides endógenos. Proc Natl Acad Sci. (2005) 102:3093–8. doi: 10.1073/pnas.0409888102
Resumen de PubMed | Texto completo de CrossRef | Google Académico
89. Vučković S, Srebro D, Vujović KS, Vučetić C, Prostran M. Cannabinoides y dolor: nuevos conocimientos a partir de moléculas antiguas. Frente Pharmacol. (2018) 9:1259. doi: 10.3389/fphar.2018.01259
Resumen de PubMed | Texto completo de CrossRef | Google Académico
90. Mlost J, Bryk M, Starowicz K. Cannabidiol para el tratamiento del dolor: [0 mm] [4 mm] enfoque en la farmacología y el mecanismo de acción. Int J Mol Sci. (2020) 21:8870. doi: 10.3390/ijms21228870
Resumen de PubMed | Texto completo de CrossRef | Google Académico
91. Kogan L, Hellyer P, Downing R. El uso de extracto de aceite de cáñamo rico en cannabidiol para tratar el dolor relacionado con la osteoartritis canina: un estudio piloto. J Am Anim Hosital Assoc. (2020) 58:1–10.
92. Furtado de Álava A. Cannabis de Uso Medicinal para el Tratamiento de Dolor Crónico de un Labrador Retriever con Osteoartrosis. Relato de Caso Universidad de la República, Facultad de Veterinaria, Montevideo1 (2019).
93. Buranakarn V. Tratamiento del cáncer de sarcoma con aceite de cannabis extraído en gato. Int J Sci Innov Technol. (2020) 3:35–40.
94. Mejía S, Duerr FM, Griffenhagen G, McGrath S. Evaluación del efecto del cannabidiol en el dolor asociado a la osteoartritis de origen natural: un estudio piloto en perros. J Am Anim Hosp Assoc. (2021) 57:81–90. doi: 10.5326/JAAHA-MS-7119
Resumen de PubMed | Texto completo de CrossRef | Google Académico
95. Genaro K, Fabris D, Arantes ALF, Zuardi AW, Crippa JAS, Prado WA. El cannabidiol es un potencial terapéutico para la dimensión afectivo-motivacional del dolor de incisión en ratas. Frente Pharmacol. (2017) 8:391. doi: 10.3389/fphar.2017.00391
Resumen de PubMed | Texto completo de CrossRef | Google Académico
96. Hammell DC, Zhang LP, Ma F, Abshire SM, McIlwrath SL, Stinchcomb AL, et al. El cannabidiol transdérmico reduce la inflamación y los comportamientos relacionados con el dolor en un modelo de artritis en ratas. Eur J Dolor. (2016) 20:936–48. doi: 10.1002/ejp.818
Resumen de PubMed | Texto completo de CrossRef | Google Académico
97. Vaughn D, Kulpa J, Paulionis L. Investigación preliminar de la seguridad del aumento de las dosis de cannabinoides en perros sanos. Front Vet Sci. (2020) 7:51. doi: 10.3389/fvets.2020.00051
Resumen de PubMed | Texto completo de CrossRef | Google Académico
98. Vaughn DM, Paulionis LJ, Kulpa JE. Evaluación aleatoria, controlada con placebo, de 28 días de seguridad y farmacocinética de la administración oral repetida de cannabidiol en perros sanos. Am J Vet Res. (2021) 82:405–16. doi: 10.2460/ajvr.82.5.405
Resumen de PubMed | Texto completo de CrossRef | Google Académico
99. Janeczek A, Zawadzki M, Szpot P, Niedzwiedz A. Intoxicación por marihuana en un gato. Acta Vet Scand. (2018) 60:44. doi: 10.1186/s13028-018-0398-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
100. Looney A. Dolor oncológico en pacientes veterinarios. El mejor compañero Anim Med. (2010) 25:32–44. doi: 10.1053/j.tcam.2009.10.008
Resumen de PubMed | Texto completo de CrossRef | Google Académico
101. Queiroga FL, Pérez-Alenza MD, Silvan G, Peña L, Lopes C, Illera JC. Niveles de Cox-2 en tumores mamarios caninos, incluido el carcinoma mamario inflamatorio: características clinicopatológicas e importancia pronóstica. Res. Anticancerígeno 25:4269–75.
102. Johnson JR, Lossignol D, Burnell-Nugent M, Fallon MT. Un estudio de extensión abierto para investigar la seguridad y tolerabilidad a largo plazo del aerosol oromucoso de THC/CBD y el aerosol de THC oromucoso en pacientes con dolor relacionado con el cáncer terminal refractario a analgésicos opioides fuertes. J Manejo de los síntomas del dolor. (2013) 46:207–18. doi: 10.1016/j.jpainsymman.2012.07.014
Resumen de PubMed | Texto completo de CrossRef | Google Académico
103. Inkol JM, Hocker SE, Mutsaers AJ. Terapia combinada con cannabidiol y quimioterápicos en células de carcinoma urotelial canino. PLoS UNO. (2021) 16:e0255591. doi: 10.1371/journal.pone.0255591
Resumen de PubMed | Texto completo de CrossRef | Google Académico
104. Rinaldi V, Boari A, Ressel L, Bongiovanni L, Crisi PE, Cabibbo E, et al. Expresión de los receptores cannabinoides CB1 y CB2 en mastocitos cutáneos caninos. Res Vet Sci. (2022) 152:530–6. doi: 10.1016/j.rvsc.2022.09.013
Resumen de PubMed | Texto completo de CrossRef | Google Académico
105. Shilo-Benjamini Y, Cern A, Zilbersheid D, Hod A, Lavy E, Barasch D, Barenholz Y. Un informe de caso de una formulación de cannabidiol liposomal inyectada por vía subcutánea utilizada como terapia de compasión para el manejo del dolor en un perro. Front Vet Sci. (2022) 9: doi: 10.3389/fvets.2022.892306
Resumen de PubMed | Texto completo de CrossRef | Google Académico
106. Darmani NA. El delta-9-tetrahidrocannabinol suprime diferencialmente la emesis inducida por cisplatino y los índices de función motora a través de los receptores cannabinoides CB1 en la musaraña más pequeña. Pharmacol Biochem Behave. (2001) 69:239–49. doi: 10.1016/S0091-3057(01)00531-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
107. Elikottil J, Gupta P, Gupta K, Elikkottil J, Elikottil J, Gupta P, et al. El potencial analgésico de los cannabinoides. J Manejo de opioides. (2009) 5:341–57. doi: 10.5055/jom.2009.0034
108. Orden C, Santos M, Ceprian M, Tendillo FJ. Efecto del cannabidiol sobre la reducción de la concentración alveolar mínima de sevoflurano producida por la morfina en ratas. Veterinario Anaesth Analg. (2021) 48:74–81. doi: 10.1016/j.vaa.2020.04.017
Resumen de PubMed | Texto completo de CrossRef | Google Académico
109. Ibera C, Shalom B, Saifi F, Shruder J, Davidson E. Efectos de la premedicación con extracto de cannabis en la profundidad anestésica. Harefuah. (2018) 157:162–6.
110. Ferreira RCM, Castor MGM, Piscitelli F, Di Marzo V, Duarte IDG, Romero TRL. La implicación del sistema endocannabinoide en la acción antinociceptiva periférica de la ketamina. J Dolor. (2018) 19:487–95. doi: 10.1016/j.jpain.2017.12.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
111. Kumar SSH, Dass LL, Sharma AK. Cannabis Indica. Extracto de (Bhang) como preanestésico de la anestesia con propofol en perros. J Appl Anim Res. (2010) 37:125–7. doi: 10.1080/09712119.2010.9707109
112. Mosley C, Gaynor J, Cital S, Brassard J. Cannabinoides para el manejo del dolor. Cannabis Terapia en Medicina Veterinaria. Una guía completa. Cham. Suiza: Springer (2021). p. 117–142 doi: 10.1007/978-3-030-68317-7_5
113. Cámpora, L, Miragliotta V, Ricci E, Cristino L, Di Marzo V, Albanese F, et al. Expresión de receptores cannabinoides tipo 1 y 2 en la piel de perros sanos y perros con dermatitis atópica. Am J Vet Res. (2012) 73:988–95. doi: 10.2460/ajvr.73.7.988
Resumen de PubMed | Texto completo de CrossRef | Google Académico
114. Morris EM, Kitts-Morgan SE, Spangler DM, Gebert J, Vanzant ES, McLeod KR, et al. Alimentación con cannabidiol. Las golosinas que contienen (CBD) no afectaron la actividad voluntaria diaria canina. Front Vet Sci. (2021) 8:5667. doi: 10.3389/fvets.2021.645667
Resumen de PubMed | Texto completo de CrossRef | Google Académico
115. Karler R, Turkanis S.A. Los cannabinoides como potenciales antiepilépticos. J Clin Pharmacol. (1981) 21:437S–48S. doi: 10.1002/j.1552-4604.1981.tb02624.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
116. McGrath S, Bartner LR, Rao S, Packer RA, Gustafson DL. Ensayo clínico aleatorizado, ciego, controlado para evaluar el efecto de la administración oral de cannabidiol además del tratamiento antiepiléptico convencional sobre la frecuencia de las convulsiones en perros con epilepsia idiopática intratable. J Am Vet Med Assoc. (2019) 254:1301–8. doi: 10.2460/javma.254.11
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: analgesia, bienestar animal, receptores cannabinoides, sistema endocannabinoide, marihuana
Cita: Miranda-Cortés A, Mota-Rojas D, Crosignani-Outeda N, Casas-Alvarado A, Martínez-Burnes J, Olmos-Hernández A, Mora-Medina P, Verduzco-Mendoza A y Hernández-Ávalos I (2023) El papel de los cannabinoides en la modulación del dolor en animales de compañía. Frente. Vet. Sci. 9:1050884. doi: 10.3389/fvets.2022.1050884
Recibido: 22 de septiembre de 2022; Aceptado: 13 de diciembre de 2022;
Publicado: 04 Enero 2023.
Editado por:
Caterina Di Bella, Universidad de Camerino, Italia
Revisado por:
Federica Alessandra Brioschi, Universidad de Milán, Italia
Lauri-Jo Gamble, Universidad de Cornell, Estados Unidos
Copyright © 2023 Miranda-Cortés, Mota-Rojas, Crosignani-Outeda, Casas-Alvarado, Martínez-Burnes, Olmos-Hernández, Mora-Medina, Verduzco-Mendoza y Hernández-Ávalos. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Daniel Mota-Rojas, 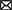 dmota100@yahoo.com.mx; Ismael Hernández-Ávalos,
dmota100@yahoo.com.mx; Ismael Hernández-Ávalos, 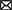 mvziha@hotmail.com
mvziha@hotmail.com
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía