El pelo de cabra como bioindicador de contaminantes ambientales y activación suprarrenal durante la trashumancia vertical
El pelo de cabra como bioindicador de contaminantes ambientales y activación suprarrenal durante la trashumancia vertical
 Stella Agradi1
Stella Agradi1  Albana Munga2
Albana Munga2  Olimpia Barbato3
Olimpia Barbato3  Rupert Palme4
Rupert Palme4  Duygu Tahan5,6
Duygu Tahan5,6  Bengü Bilgiç7
Bengü Bilgiç7  Banu Dokuzeylül7
Banu Dokuzeylül7  Alev Meltem Ercan5
Alev Meltem Ercan5  Mehmet Erman Or7
Mehmet Erman Or7  Gabriele Brecchia1*
Gabriele Brecchia1*  Giulio Crone1*
Giulio Crone1*  Susanna Draghi1
Susanna Draghi1  Daniele Vigo1
Daniele Vigo1  María Laura Marongiu8
María Laura Marongiu8  Marta González-Cabrera9
Marta González-Cabrera9  Laura Menchetti10
Laura Menchetti10- 1Departamento de Medicina Veterinaria y Ciencias Animales, Universidad de Milán, Lodi, Italia
- 2Facultad de Medicina Veterinaria, Universidad Agrícola de Tirana, Tirana, Albania
- 3Departamento de Medicina Veterinaria, Universidad de Perugia, Perugia, Italia
- 4Unidad de Fisiología, Fisiopatología y Endocrinología Experimental, Departamento de Ciencias Biomédicas, Universidad de Medicina Veterinaria de Viena, Viena, Austria
- 5Departamento de Biofísica, Facultad de Medicina de Cerrahpasa, Universidad de Estambul-Cerrahpasa, Estambul, Türkiye
- 6Departamento de Biofísica, Facultad de Medicina, Universidad de Bahcesehir, Estambul, Türkiye
- 7Departamento de Medicina Interna, Facultad de Medicina Veterinaria, Universidad de Estambul-Cerrahpasa, Estambul, Türkiye
- 8Departamento de Medicina Veterinaria, Universidad de Sassari, Sassari, Italia
- 9Instituto de Sanidad Animal y Seguridad Alimentaria, Universidad de Las Palmas de Gran Canaria, Arucas, España
- 10Facultad de Biociencias y Medicina Veterinaria, Universidad de Camerino, Matelica, Italia
Las razas autóctonas de ganado se consideran un recurso genético fundamental para la agricultura, el desarrollo rural y la seguridad alimentaria y nutricional. En los Alpes italianos, las razas ganaderas locales se mantienen utilizando el sistema tradicional de agricultura alpina basado en la trashumancia vertical, con el uso de pastos alpinos desde finales de primavera hasta el otoño y viviendas interiores con una dieta a base de heno durante el resto del año. Debido a su estrecho vínculo con el territorio de origen, las razas locales podrían utilizarse para biomonitorear las contaminaciones ambientales. Además, el bienestar animal también debe controlarse durante la trashumancia de los animales, que están expuestos a un cambio repentino del sistema de cría y a diferentes tipos de factores de estrés. Por estas razones, esta investigación planteó la hipótesis de que el contenido de oligoelementos, metales pesados y cortisol en el pelo de las cabras cambia durante la trashumancia vertical, posiblemente reflejando diferentes contenidos dietéticos y actividad del eje hipotálamo-hipófisis-suprarrenal (HPA). Este estudio tuvo como objetivo evaluar la respuesta de una raza caprina local italiana al cambio de alojamiento interior a pastos alpinos en verano en términos de concentraciones de pelo de (i) oligoelementos y metales pesados y (ii) cortisol. El pelo regenerado de cabras Frisa se recolectó mensualmente durante 2 años consecutivos (n = 10 para metales pesados y oligoelementos y n = 6 para cortisol en 2021 , n = 17 para ambos análisis en 2022), una vez antes de la trashumancia vertical y dos veces después de ese evento. A continuación, se analizó el cabello en busca de oligoelementos, metales pesados y cortisol mediante espectrofotómetro de emisión óptica de plasma acoplado inductivamente (ICP-OES) e inmunoensayo enzimático (EIA), respectivamente. Los datos fueron analizados por modelos multinivel. Los resultados mostraron un aumento en el contenido de As durante el pastoreo alpino (p < 0.01), probablemente reflejando el contenido de As de suelo y agua del área de pastoreo, mientras que Mg, Zn y Al (p < 0.01) siguieron la tendencia opuesta, disminuyendo en el segundo mes después de la trashumancia vertical. Las concentraciones de cortisol capilar aumentaron durante 2 meses de pasto alpino (p < 0,001), lo que indica un aumento en la activación del eje HPA, de acuerdo con estudios previos. Las investigaciones futuras pueden considerar un período de estudio más largo y el desarrollo de indicadores ad hoc de bienestar animal.
Introducción
Desde los primeros eventos de domesticación de animales de ganado hace ~ 12.000 años, el pastoreo se ha extendido por todo el mundo después de las migraciones humanas (1). Incluso en las sociedades agrícolas sedentarias más complejas, la necesidad de una fuente continua de alimento durante el año ha llevado a la práctica de la trashumancia. En concreto, para las poblaciones humanas que viven cerca de regiones montañosas, la trashumancia vertical sigue representando una estrategia fundamental para garantizar un pastoreo de calidad a lo largo de las diferentes estaciones debido a la manipulación de los rebaños y manadas a lo largo de un gradiente altitudinal (2), especialmente si se considera la región alpina de Italia. Sin embargo, a pesar de la importancia socioecológica de la trashumancia vertical y su correspondiente oferta de servicios ecosistémicos, la práctica está desapareciendo gradualmente (3).
El mantenimiento del sistema tradicional de cría semiextensiva de cabras, ovejas y vacas autóctonas en el norte de Italia, que proporciona una dieta basada en heno con alojamiento interior en invierno y forrajes frescos desde finales de primavera hasta otoño a través de pastos alpinos (4, 5), también desempeña un papel útil en una perspectiva de Bienestar Único. De hecho, este sistema genera un estrecho vínculo de interdependencia entre el entorno en el que tradicionalmente se crían estos animales de ganado durante siglos, si no milenios, y la propia raza local. Esto lleva a la oportunidad de utilizar estos animales como bioindicadores, indicando cambios nocivos causados por la contaminación en el ecosistema circundante (6), también debido a la facilidad con la que se pueden obtener observaciones o muestras biológicas. Así, en los últimos tiempos, está creciendo el uso de razas ganaderas autóctonas para monitorizar los niveles de oligoelementos ambientales y metales pesados. Este tipo de moléculas podrían ser tóxicas en concentraciones específicas y representar un riesgo para la salud humana, animal y ambiental (7, 8). Los herbívoros están constantemente expuestos a su absorción a través de la ingestión de pequeñas cantidades de tierra, vegetación contaminada y agua. Sin embargo, debe tenerse en cuenta que las características fisiológicas específicas de la especie (9), así como las variaciones estacionales, ecológicas y etológicas, pueden afectar la exposición y la absorción (10, 11). En cuanto a la parte humana, la vía de la cadena trófica se considera una de las principales vías de exposición (12), y, también por este motivo, es necesario controlar la posible contaminación de productos de origen animal, como el queso o la carne.
Otro aspecto que se vincula positivamente con los pastos alpinos es el bienestar animal. Los estudios han indicado que tanto los consumidores como los agricultores consideran que el acceso del ganado a los pastos es importante debido a la idea compartida de que permitir que los animales expresen su comportamiento natural es fundamental (13). La Unión Europea fomenta estas prácticas a través de la provisión de fondos específicos de la PAC (Política Agrícola Común). El objetivo general es contrarrestar el abandono de las zonas agrícolas de montaña que, si se utilizan y gestionan adecuadamente, pueden contribuir a garantizar una protección real del territorio, la biodiversidad, la prevención del riesgo hidrogeológico y la erosión del suelo y, en consecuencia, la adaptación al cambio climático (4, 14). Sin embargo, la acción del pastoreo también involucra otros aspectos que afectan a los animales y que deben ser considerados, como la calidad y disponibilidad de alimento, la depredación, la parasitosis, las condiciones ambientales y la bioseguridad de las enfermedades transmisibles entre los rebaños y los animales silvestres (15). Por lo tanto, el bienestar animal debe controlarse también en los animales de pastoreo. Un indicador clásico del bienestar es el cortisol (16), producto final de la activación del eje hipotálamo-hipófisis-suprarrenal (HPA), que se libera en respuesta a diferentes tipos de estímulos (es decir, factores estresantes). Las acciones de este sistema hormonal están estrictamente reguladas para garantizar que el cuerpo pueda responder rápidamente a los factores estresantes, adaptarse a estos desafíos y recuperarse a la homeostasis original (16, 17).
Una herramienta útil para evaluar oligoelementos, metales pesados y cortisol en animales es el análisis del pelo. El cabello es una matriz biológica metabólicamente inerte (después de haber salido de la epidermis) y químicamente homogénea (18). Se puede recolectar fácilmente de animales domésticos con una modalidad no invasiva y, debido a su patrón de crecimiento, permite obtener imágenes biológicas retrospectivas del elemento que se está analizando durante unos meses desde el momento de la recolección. Finalmente, el muestreo podría repetirse en la misma área de la piel, lo que permitiría una medición repetida. El análisis del cabello permite determinar la exposición a largo plazo tanto de oligoelementos como de metales pesados debido a la presencia del grupo sulfhidrilo (-SH) de la cisteína capaz de su quelación (18). Por otro lado, la concentración de cortisol en el cabello se considera un buen indicador de la activación a largo plazo del eje HPA, que se utiliza para evaluar el estrés animal, el bienestar y la capacidad para hacer frente a los desafíos ambientales (16). El uso del pelo para la determinación de contaminantes ambientales e indicadores de estrés animal está en perfecta concordancia con los principios de One-Wellness, que invitan a una consideración holística de la salud humana y la protección del medio ambiente de conformidad con el bienestar animal (19, 20).
Planteamos la hipótesis de que el contenido de oligoelementos, metales pesados y cortisol en el pelo de las cabras cambia durante la trashumancia, posiblemente reflejando diferentes contenidos dietéticos y actividades del eje HPA, respectivamente. Por lo tanto, este estudio tuvo como objetivo evaluar la respuesta de una raza caprina local italiana al cambio de alojamiento interior a pasto alpino en verano en términos de concentraciones de pelo de (i) oligoelementos y metales pesados y (ii) cortisol. Los hallazgos podrían respaldar el posible uso del pelo de las razas locales como bioindicadores de la contaminación ambiental de oligoelementos y metales pesados y, al mismo tiempo, como una herramienta no invasiva para evaluar la respuesta adaptativa del animal a los cambios en el sistema agrícola de acuerdo con los principios de One-Wellness.
Materiales y métodos
Animales y colección de pelo
Para este estudio, se inscribieron 24 cabras Frisa hembras. La cabra Frisa o Frontalasca es una raza autóctona de cabra lombarda originaria del Valle de Rezzalo (en el municipio de Frontale). El Registro Anagráfico se activó en 1997 y, a finales de 2016, la población registrada era de 785 cabezas en 51 fincas (21). Es una raza de doble aptitud criada con el sistema de agricultura tradicional alpina. Todos los animales formaban parte del mismo rebaño, que se cría en Val Bregaglia, en la zona alpina de Lombardía, cerca de la frontera con Suiza, una de las zonas de cría típicas y tradicionales. Los animales se mantuvieron bajo un sistema tradicional de cría semiextensiva, con alojamiento interior y una dieta a base de heno a ~650 m.s.n.m. de noviembre a mayo (el heno se compró en la provincia de Pavía, sur de Lombardía) y pastoreo libre en pastos alpinos a ~1400-2000 m.s.n.m. en la parte restante del año (Figuras suplementarias S1, S2). La reproducción se produjo por apareamiento natural, y la temporada de nacimiento tuvo lugar en las dos últimas décadas de diciembre. Por esta razón, las cabras inscritas se encontraban todas en las mismas etapas de lactancia y reproducción (lactante y no preñada). Las cabras fueron ordeñadas dos veces al día, con una máquina de ordeño durante el alojamiento interior y a mano durante el período de pasto alpino, hasta la segunda semana de agosto. La leche se utilizaba íntegramente para la producción de queso. Antes de incluir a los animales en el estudio, se realizó una investigación anamnésica sobre el estado sanitario del rebaño con el criador, y un equipo de veterinarios realizó un examen físico de todas las cabras. Solo se inscribieron animales clínicamente sanos. La puntuación media de la condición corporal fue de 2,7/5 al inicio del estudio. Las cabras nulíparas y primíparas no se inscribieron en el estudio. La media (y la desviación estándar) de la edad fue de 6,2 ± 2,9 años (rango: 2,2-12,3 años). Los animales involucrados fueron muestreados durante 2 años consecutivos (2021 (n = 10) y 2022 (n = 17) para oligoelementos y metales pesados y 2021 (n = 6) y 2022 (n = 17) para cortisol), según el mismo plan experimental y el mismo año. El diseño experimental se repitió en las mismas condiciones (misma finca, misma trashumancia y mismos pastos). La recogida de muestras de pelo de animales vivos se realizó respetando el bienestar animal de acuerdo con la legislación vigente. El estudio se llevó a cabo con la aprobación del Comité Institucional de Cuidado y Uso de Animales de la Università degli Studi di Milano (Permiso OPBA_04_2021). Se recogieron muestras de pelo de la grupa izquierda de cada animal en una región de ~10 cm2 recortado lo más cerca posible de la piel con una maquinilla eléctrica, según el método «afeitado-reafeitado», y almacenado en bolsas de polietileno a temperatura ambiente, protegido de la luz solar hasta el análisis (22). El cabello se afeitó la primera vez antes de 1 mes de trashumancia vertical. A continuación, se tomó el pelo recrecido de la misma zona 1 día antes de la trashumancia vertical (antes del pastoreo) y 1 mes y 2 meses después de la trashumancia vertical. Solo se analizó el cabello recrecido para determinar las concentraciones de oligoelementos, metales pesados y cortisol, ya que solo para este tipo de muestra se conocía el tiempo de rebrote (30 días). El presente protocolo es descrito en detalle por Heimbürge et al. (23).
Análisis capilar
Las concentraciones de cromo (Cr), cobre (Cu), hierro (Fe), magnesio (Mg), zinc (Zn), arsénico (As), boro (B), níquel (Ni), plomo (Pb) y aluminio (Al) se determinaron mediante un espectrofotómetro de emisión óptica de plasma acoplado inductivamente (ICP-OES; Thermo iCAP 6000series) en el Laboratorio de Análisis de Trazas y Elementos Tóxicos del Departamento de Biofísica de la Facultad de Medicina de la Universidad de Estambul-Cerrahpasa (los parámetros del dispositivo se presentan en la Tabla Suplementaria S1 y las longitudes de onda utilizadas para determinar cada elemento se presentan en la Tabla Suplementaria S2). En total, se utilizaron 1000 ppm de cada elemento analizado (Chem-Lab NV, Zedelgem, Bélgica) para preparar las soluciones patrón en agua desionizada. La solución en blanco era agua destilada. Estas soluciones se utilizaron para obtener curvas de calibración reproducibles y lineales y calcular el coeficiente de correlación. El análisis se realizó por triplicado. Para preparar todas las muestras se utilizó el método de descomposición húmeda para las mediciones de elementos traza y metales pesados, utilizando 0,04 g por muestra. El cabello se añadió a 2 ml de HNO al 65%3 (Merck, Darmstadt, Alemania) y 1 ml de HClO al 60%4 (Panreac, Barcelona, España) y disuelto en un horno de secado (Heraeus W.C., Hanau, Alemania) a 180°C. Luego, las muestras se enfriaron a temperatura ambiente y se agitaron en vórtice después de agregar agua destilada hasta alcanzar un volumen de 10 ml. La concentración del elemento se determinó considerando el peso de cada muestra y expresada como μg/g de peso húmedo de las muestras.
Para el análisis del cortisol capilar, se mezclaron 100 mg (0,100 ± 0,0005 g) de cada muestra de cabello con 5 ml de metanol (100%) y se agitaron en una termomezcladora (37 °C durante 24 h). A continuación, las muestras se centrifugaron (15 min a 2.500 g), y 2,5 ml de la solución se transfirieron a otro tubo y luego se secaron (50-60°C bajo una corriente de aire). Posteriormente, los esteroides se volvieron a disolver en 0,5 ml de tampón de inmunoensayo enzimático (EIA) y se agitaron durante 30 min. La solución se transfirió a tubos (Bio-Rad Laboratories, Hércules, EE. UU.) y se almacenó a -20 °C hasta el análisis. En total, se analizaron 25 μl de la muestra almacenada (por duplicado) en un EIA de cortisol. Este EIA se realiza en placas de microtitulación y utiliza un anticuerpo criado en conejos contra el cortisol-3-CMO:BSA y una etiqueta biotinilada. Los detalles de la EIA (incluidas las reacciones cruzadas del anticuerpo) se pueden encontrar en el estudio de Palme y Möstl (24). El ensayo ya se aplicó con éxito para medir el cortisol del cabello en rumiantes (25, 26).
Análisis estadístico
Los datos se presentaron como medias y errores estándar. Se utilizaron gráficos de diagnóstico y pruebas de Kolmogorov-Smirnov para verificar las suposiciones. El Ni, Pb, Al, Fe y cortisol se transformaron en log10(x+1), y los datos brutos se presentan en tablas y figuras. Los cambios a lo largo del tiempo se analizaron utilizando modelos lineales mixtos. El año (2 niveles: 2021 y 2022) y el tiempo (3 niveles: antes del pastoreo, después de 1 mes y 2 meses de pastoreo) se incluyeron en los modelos como medidas repetidas, mientras que los animales se incluyeron como factor aleatorio. Se eligió una estructura diagonal como matriz de covarianza. El análisis preliminar mostró que no hubo influencias significativas de la interacción año o año x tiempo (Figura Suplementaria S3). Por lo tanto, de acuerdo con el objetivo del estudio, solo el tiempo (es decir, los cambios durante la trashumancia) se incluyó finalmente en los modelos como efecto principal. Se utilizó el método Sidak para comparaciones múltiples. El análisis estadístico se realizó con el programa SPSS 25.0 (SPSS Inc. Chicago, USA) y se consideró significativo a un nivel de 0,05.
Resultados
Oligoelementos y metales pesados
Se encontraron cambios significativos a lo largo del tiempo para As (p = 0,006), Cu (p = 0,002), Mg (p = 0,002), Zn (p = 0,004) y Al (p = 0,001; Figura 1).
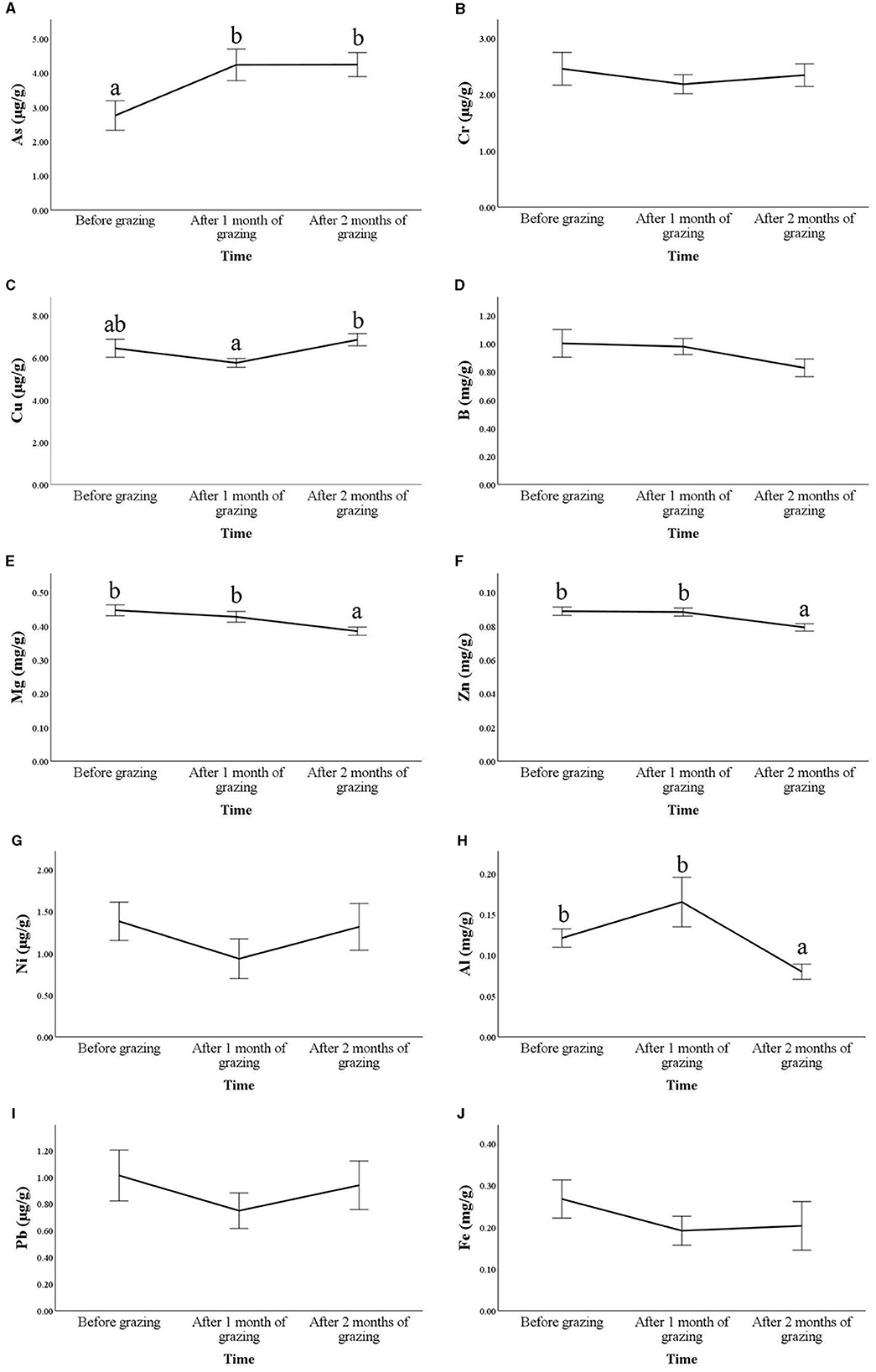 Figura 1. Concentraciones de oligoelementos y metales pesados en el pelo, expresadas en μg/g o mg/g de pelo, de cabras Frisa durante la trashumancia vertical. Las muestras de pelo se recogieron durante 2 años consecutivos (n = 10 en 2021 y n = 17 en 2022), 1 día antes de la trashumancia vertical (antes del pastoreo) y 1 mes y 2 meses después de la trashumancia vertical. Para cada molécula, los puntos de tiempo que no comparten la misma letra son diferentes para p < 0,05. El efecto del tiempo no fue significativo para las moléculas en las que no hay letras. Las figuras muestran los resultados para As (A), Cr (B), Cu (C), B (D), Mg (E), Zn (F), Ni (G), Al (H), Pb (I) y Fe (J). Los valores son medias ± errores estándar (SE).
Figura 1. Concentraciones de oligoelementos y metales pesados en el pelo, expresadas en μg/g o mg/g de pelo, de cabras Frisa durante la trashumancia vertical. Las muestras de pelo se recogieron durante 2 años consecutivos (n = 10 en 2021 y n = 17 en 2022), 1 día antes de la trashumancia vertical (antes del pastoreo) y 1 mes y 2 meses después de la trashumancia vertical. Para cada molécula, los puntos de tiempo que no comparten la misma letra son diferentes para p < 0,05. El efecto del tiempo no fue significativo para las moléculas en las que no hay letras. Las figuras muestran los resultados para As (A), Cr (B), Cu (C), B (D), Mg (E), Zn (F), Ni (G), Al (H), Pb (I) y Fe (J). Los valores son medias ± errores estándar (SE).
Se encontró un aumento después de 1 mes de pastoreo para As, seguido de una estabilización en el segundo mes (p < 0.05). El Cu mostró una tendencia en forma de U donde el incremento fue significativo después de 2 meses de pastoreo en comparación con el mes anterior (p = 0,003), pero el último punto de tiempo no difirió de los valores prepastoreo (p = 0,778).
Por el contrario, el Mg y el Zn mostraron una disminución progresiva con diferencias significativas en comparación con los valores de interior solo después de 2 meses de pastoreo (p < 0,05). Al mostró valores muy variables después de 1 mes de pastoreo y una reducción después de 2 meses en comparación con el prepastoreo (p = 0,012).
No se encontraron diferencias significativas entre los puntos temporales para las otras concentraciones de metales pesados y oligoelementos analizadas.
Cortisol
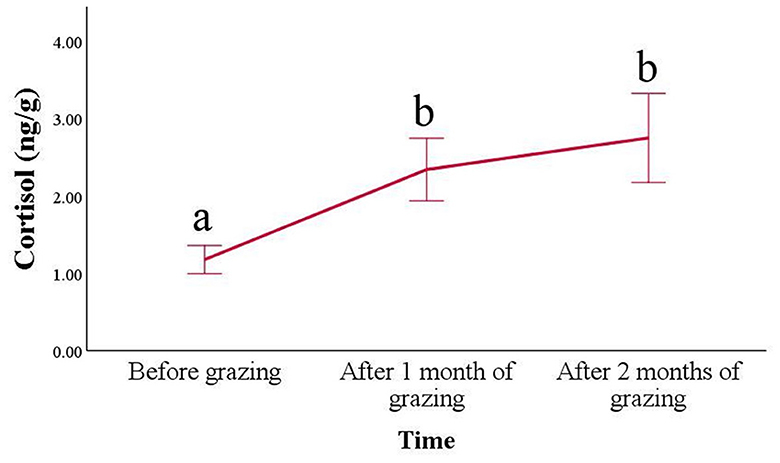
En cuanto a las concentraciones de cortisol en el pelo (Figura 2), se encontró un aumento progresivo en los animales después de colocarlos en el pasto (p < 0,001). Sus valores aumentaron ya después de 1 mes de pasto (2,34 ± 0,41 ng/g) en comparación con los mantenidos en interior (1,18 ± 0,18 ng/g; p < 0,001) y se mantuvo mayor incluso después de 2 meses de pastoreo (2,75 ± 0,58 ng/g; p = 0,004). Durante el pastoreo, también se puede observar un aumento de la variabilidad.
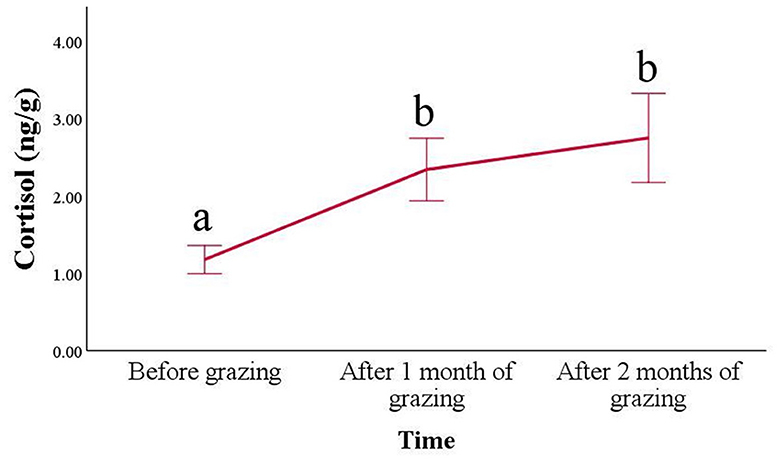 Figura 2. Concentraciones de cortisol en el pelo (media ± SE) de cabras Frisa durante la trashumancia vertical. Las muestras de pelo se recogieron durante 2 años consecutivos (n = 6 animales en 2021 y n = 17 animales en 2022), 1 día antes de la trashumancia vertical (antes del pastoreo), 1 mes y 2 meses después de la trashumancia vertical. Los puntos de tiempo que no comparten la misma letra son diferentes para p < 0,05.
Figura 2. Concentraciones de cortisol en el pelo (media ± SE) de cabras Frisa durante la trashumancia vertical. Las muestras de pelo se recogieron durante 2 años consecutivos (n = 6 animales en 2021 y n = 17 animales en 2022), 1 día antes de la trashumancia vertical (antes del pastoreo), 1 mes y 2 meses después de la trashumancia vertical. Los puntos de tiempo que no comparten la misma letra son diferentes para p < 0,05.
Discusión
Este estudio apoya el uso del pelo de cabra como bioindicador de la contaminación ambiental, ya que su contenido de algunos metales pesados y oligoelementos cambió durante la trashumancia vertical de acuerdo con el cambio en el ambiente y la dieta. Los hallazgos también mostraron un aumento en las concentraciones de cortisol en el cabello, lo que sugiere la activación del eje HPA relacionado con el cambio en el sistema de cultivo.
Como primer objetivo de nuestra investigación, los resultados mostraron un aumento en la concentración de pelo de As después de 1 mes de pastoreo, que también se mantuvo durante el segundo mes. Por otro lado, las concentraciones de Mg, Zn y Al disminuyeron después de 2 meses de pasto alpino. La idoneidad del uso de animales de ganado para controlar las concentraciones de metales pesados y oligoelementos en el medio ambiente se ha demostrado con diferentes matrices biológicas, incluyendo sangre (27-29), hígado y riñón (30) y pelo (28, 29, 31). Hasta la fecha, las investigaciones han abarcado varias especies animales. En particular, se han realizado numerosos estudios en animales salvajes (32), mientras que, entre los animales domésticos, la mayoría de los estudios incluyeron vacas y ovejas (11, 33, 34). Por el contrario, aunque se ha validado el uso de pelo de cabra para monitorizar la contaminación ambiental con metales pesados y oligoelementos (26), la literatura sobre esta especie es escasa. Por esta razón, no existen intervalos de referencia establecidos para las concentraciones de metales pesados y oligoelementos en el pelo de cabra. Sin embargo, en el presente estudio, los valores obtenidos para Zn, Ni, Pb y Fe están en línea con los reportes disponibles (27, 30, 31, 35), mientras que varios autores encontraron valores más bajos para As (35-38). Es importante subrayar que, en cualquier caso, los contenidos de As son muy inferiores a los obtenidos en la arsenicosis crónica inducida experimental o naturalmente (36-38). La explicación de este resultado se encuentra en la distribución espacial específica de As en Italia. De hecho, los Alpes italianos son una de las zonas más enriquecidas en As de la península debido a sus características pedogeoquímicas. En concreto, Val Bregaglia, que es la zona de cría de las cabras inscritas en nuestro estudio, muestra anomalías en los suelos agrícolas y de pastoreo y en el agua de los arroyos, que representan las fuentes de alimentación de los animales inscritos (39). Además, teniendo en cuenta la alta afinidad de los compuestos inorgánicos de As para unirse a los grupos sulfhidrilo y la cantidad de cisteína en la estructura del cabello (40), la alta concentración de As en el pelo de las cabras Frisa podría explicarse fácilmente. La tendencia incremental en la concentración de As durante los pastos alpinos también es atribuible a la diferente distribución de As en el suelo y el agua en la región de Lombardía. De hecho, el heno con el que se alimentaba a los animales durante el período de alojamiento en interiores procedía de Pavía, una provincia de la llanura del río Po donde los sedimentos aluviales también están enriquecidos en As, pero a un nivel inferior con respecto al suelo del arco alpino, según el proyecto GEMAS (Geochemical Mapping of Agricultural and Grazing land Soil) de EuroGeoSurveys (39). Con respecto al Mg, hasta donde sabemos, no hay otros estudios en cabras que investiguen su concentración en el pelo. Sus valores mostraron una disminución significativa después de 2 meses de pasto alpino. En un estudio realizado en Suiza en el que se evaluó la distribución espacial de las formas de Mg disponibles para las plantas en el suelo, se demostró que, en general, los pastizales permanentes tenían una mayor cantidad de formas de Mg disponibles que los pastos alpinos. La diferencia se ha atribuido a la fertilización con abono orgánico, que es una práctica común en el mantenimiento de pastizales permanentes y enriquece el suelo con diversos como el Mg (41). La misma diferencia en el uso de la tierra está presente en nuestro estudio, donde el heno alimentado antes de la trashumancia vertical se produce en los pastizales permanentes del valle del río Po, mientras que durante el pastoreo de verano, la única fuente de alimento es el pasto alpino. En cuanto al Zn, los valores obtenidos en nuestro estudio fueron consistentes con la literatura científica (27, 35). Su patrón temporal era el mismo que el de Mg. En ese caso, según otra investigación sobre el queso de vaca de pastos interiores y alpinos, la variabilidad del contenido de Zn en las matrices biológicas de los animales está sujeta a varios factores (42), incluida la composición del suelo (43), el contenido mineral de las plantas de pastos alpinos (44) y el comportamiento alimentario de los animales (9). Por esta razón, es difícil señalar una única explicación para sus fluctuaciones. Finalmente, la concentración de pelo de Al sigue la misma tendencia temporal que Mg y Zn, disminuyendo después de 2 meses de pasto alpino. Además de ese caso, la principal vía de entrada en el organismo animal es la ingestión de alimentos contaminados. Diferentes actividades antropogénicas son responsables del enriquecimiento del suelo de Al y el consiguiente aumento de la biodisponibilidad de este compuesto en las plantas (45). En un estudio sobre el pelo del corzo (32), los animales que se alimentaban cerca de las zonas urbanas tenían mayores concentraciones de pelo de Al que los animales que se alimentaban en las zonas rurales (32). Del mismo modo, podríamos plantear la hipótesis de que la diferencia en los valores de Al antes y después de la trashumancia vertical podría deberse a los diferentes orígenes del pienso. De hecho, el heno administrado durante el alojamiento en el interior procedía de la provincia de Pavía, que está muy urbanizada si se compara con la zona de pastos alpinos donde se alimentaban las cabras después de la trashumancia. Curiosamente, en el caso de Mg, Zn y Al, se tardó 2 meses en producir algún cambio en el pelo de las cabras, lo que pone de manifiesto la necesidad de una exposición crónica para tener cambios detectables en la matriz del pelo. Por lo tanto, por los resultados obtenidos de nuestro estudio, podemos confirmar que el muestreo de pelo de razas autóctonas de ganado podría ser una herramienta válida como bioindicador de contaminación ambiental por metales pesados y oligoelementos, con implicaciones positivas para la salvaguarda de las personas y la salud ambiental.
Sin embargo, de acuerdo con el enfoque de Un solo bienestar, el bienestar de los seres humanos y el medio ambiente no puede desconectarse del de los animales (19, 20). Así, además de la determinación de contaminantes, se aprovechó el mismo muestreo de pelo, no estresante, para cuantificar un importante indicador fisiológico del bienestar animal, como es el cortisol. También aumentó la innovación del estudio porque aún no se han investigado los cambios en el cortisol del pelo durante la trashumancia de las cabras. Los resultados mostraron un aumento progresivo de la concentración de cortisol capilar tras la trashumancia vertical. Los valores se mantuvieron altos incluso durante el segundo mes de pasto alpino. En cabras, la validación de las concentraciones de cortisol en el pelo como índice de activación a largo plazo del eje HPA ya fue demostrada por Endo et al. (22). Hay que tener en cuenta que la activación del eje no está necesariamente ligada a estímulos negativos y tiene principalmente una función adaptativa (descrita por el clásico Síndrome General de Adaptación, GAS) (17). De hecho, las actividades reproductivas y físicas, los estados emocionales positivos y los procesos metabólicos pueden inducir un aumento en la producción de cortisol por parte de la glándula suprarrenal (23). Además, los factores no animales, incluidos los cambios ambientales y climáticos, así como el riesgo de depredación, enfermedades y conflictos sociales, pueden dar lugar a la activación del eje HPA como respuesta adaptativa (46). En el presente estudio, se eliminaron varios posibles sesgos al incluir solo animales del mismo sexo, grupo de edad, estado fisiológico y color de pelaje. Por lo tanto, principalmente los factores relacionados con la trashumancia permanecen como posibles explicaciones de los cambios en el cortisol. Hasta donde sabemos, no hay otros estudios que investiguen las variaciones en la concentración de cortisol en ninguna matriz biológica de cabras que se mueven de sistemas de cría de interior a exterior. Sin embargo, Comin et al. evaluaron las variaciones en la concentración de cortisol en el cabello en vacas que se trasladaban de granjas del valle a pastos de verano (47). Utilizaron el mismo diseño experimental y sus resultados son muy consistentes con nuestros hallazgos. De hecho, la concentración de cortisol en el pelo aumentó 1 mes después de la trashumancia y se mantuvo constante incluso 2 meses después de la transferencia a las vacas. Los valores obtenidos por estos autores están en línea con los obtenidos en el presente estudio, aunque las vacas presentaron mayores concentraciones basales de cortisol en pelo. Planteamos la hipótesis de que el cambio ambiental durante la trashumancia actúa per se como un estresor [entendido como un estímulo genérico que requiere estrategias de ajuste o afrontamiento (48-50)], determinando la activación del eje GAS y HPA. El mantenimiento de altas concentraciones de cortisol puede ser el resultado de una mayor actividad física asociada con la búsqueda de fuentes de alimento, particularmente en pastos alpinos que cubren un área grande. Esto permitió la interpretación del repertorio conductual del animal y, por lo tanto, debe ser visto positivamente en términos de bienestar animal. Tendemos a descartar la presencia de otros estresores específicos, como los depredadores. De hecho, el lobo (Canis lupus italicus) y el oso (tanto Ursus arctos marsicanus como Ursus arctos arctos), los únicos depredadores en Italia de la cabra doméstica adulta, no estaban presentes en el área considerada (51-53). La parasitosis también parece inverosímil, ya que el período de finales de primavera-verano, durante el cualEn el ensayo experimental, se caracteriza por una tendencia a la disminución de la carga parasitaria en el pasto debido a la reducción progresiva de la humedad y al aumento de la intensidad de los rayos UV (54). También es probable que las interacciones interespecíficas negativas se descarten como causa del aumento del cortisol, ya que los animales no se mezclaron con otros rebaños durante el período de pastoreo alpino y el espacio disponible por cabeza aumentó considerablemente como resultado del paso a un sistema extensivo. Nuestros hallazgos también mostraron una mayor variabilidad de la concentración de cortisol en el cabello durante el pastoreo, lo que indica diferencias individuales en la reactividad del eje HPA y las respuestas subjetivas al cambio en el sistema de cultivo.
Finalmente, se pudo mencionar que el efecto del año y su interacción con la trashumancia no fueron significativos para ninguna de las variables evaluadas. Esto indica que no ha habido cambios relevantes en las concentraciones de metales pesados y oligoelementos en las áreas estudiadas, y el efecto de la trashumancia en el eje HPA no ha cambiado a lo largo de los años. Varias fuentes de contaminación, como la agricultura intensiva y la industria, pueden conducir a cambios en la contaminación del suelo, pero estos son generalmente evidentes a mediano y largo plazo (55, 56). Por lo tanto, 2 años de monitoreo (como el realizado en el presente estudio) pueden ser insuficientes para resaltar la evolución temporal de la acumulación de oligoelementos y metales pesados. Ni siquiera teníamos una justificación para plantear la hipótesis de cambios en las concentraciones de cortisol entre años. Por estas razones, la evaluación de las variaciones temporales estuvo fuera del alcance del presente estudio. Sin embargo, un período de observación más largo, o más bien, el muestreo sistemático de pelo animal, podría ser útil para monitorear la evolución temporal de la distribución de contaminantes y el bienestar animal.
En conclusión, el estrecho vínculo entre las razas ganaderas autóctonas, como las cabras, y el medio ambiente circundante, donde viven, es un factor a explotar para los estudios sobre los cambios ambientales. El pelo es una matriz no invasiva que también puede proporcionar información sobre la activación del eje HPA, el mantenimiento de la homeostasis y el éxito de la adaptación animal. Todo esto cumple con el concepto moderno de Bienestar Único, que enfatiza el vínculo entre el bienestar animal, el bienestar humano y el medio ambiente. El cabello también ofrece beneficios prácticos. Es fácil de recopilar y permitir mediciones repetidas a lo largo del tiempo sobre el mismo sujeto. Además, esta matriz también da resultados acumulativos, lo que permite eliminar cualquier fluctuación diaria, un factor que es especialmente importante a la hora de evaluar el estrés y el bienestar, especialmente en el caso del cortisol. Demostramos las posibles asociaciones entre las concentraciones de oligoelementos ambientales y capilares y metales pesados, específicamente en el caso de As. Además, la concentración de cortisol capilar permitió evaluar la respuesta al estrés durante la trashumancia vertical, y se observó un aumento en la activación del eje HPA durante los primeros 2 meses de la dehesa alpina. La investigación futura debe incluir un período más largo de evaluación tanto para el oligoelemento capilar como para los metales pesados y las concentraciones de cortisol en el cabello. Además, se deben evaluar otros indicadores de adaptación al estrés y bienestar, como la dehidroepiandrosterona, junto con la determinación de oligoelementos y metales pesados en el suelo, el agua y las plantas locales.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio están incluidas en el artículo/Material complementario, las consultas adicionales pueden dirigirse a los autores correspondientes.
Declaración ética
El estudio en animales fue aprobado por el Comité Institucional de Cuidado y Uso de Animales de la Università degli Studi di Milano. El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
SA: Conceptualización, Curación de datos, Investigación, Metodología, Visualización, Redacción: borrador original. AM: Análisis formal, Investigación, Redacción, revisión y edición. OB: Investigación, Metodología, Redacción, revisión y edición. RP: Investigación, Metodología, Redacción, Revisión y Edición. DT: Investigación, Metodología, Redacción, Revisión y Edición. BB: Investigación, Metodología, Redacción, Revisión y Edición. BD: Investigación, Metodología, Redacción, Revisión y Edición. AE: Investigación, Metodología, Redacción, Revisión y Edición. MO: Investigación, Metodología, Redacción, revisión y edición. GB: Conceptualización, Obtención de Financiamiento, Investigación, Metodología, Administración de Proyectos, Recursos, Supervisión, Validación, Redacción, Revisión y Edición. GC: Análisis formal, Recursos, Supervisión, Redacción, revisión y edición. SD: Análisis formal, Investigación, Recursos, Redacción, revisión y edición. DV: Conceptualización, Obtención de Fondos, Recursos, Supervisión, Redacción, Revisión y Edición. MM: Obtención de fondos, investigación, redacción, revisión y edición. MG-C: Análisis formal, Investigación, Supervisión, Redacción, revisión y edición. LM: Software, Redacción, revisión y edición, Conceptualización, Curación de datos, Análisis formal.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Esta investigación fue parcialmente apoyada por el FAR 2020 (Fondo di Ateneo per la Ricerca 2020) de la Universidad de Sassari.
Reconocimientos
Los autores desean agradecer a Afifeh Vakili por el análisis de cortisol en el cabello.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1274081/full#supplementary-material
Referencias
1. Diamond J, Bellwood P. Los granjeros y sus lenguas: las primeras expansiones. Ciencia. (2003) 300:597–603. doi: 10.1126/science.1078208
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Makarewicz CA, Arbuckle BS, Öztan A. Trashumancia vertical de ovejas y cabras identificada por análisis isotópicos secuenciales de carbono (δ13C) y oxígeno (δ18O) intradentales: evidencia del Calcolítico Köşk Höyük, Turquía central. J Archaeol Sci. (2017) 86:68–80. doi: 10.1016/j.jas.2017.01.003
3. Pardini A, Nori M. Sistemas agrosilvopastoriles en Italia: integración y diversificación. Pastoralismo. (2011) 1:26–36. doi: 10.1186/2041-7136-1-26
4. Battaglini L, Bovolenta S, Gusmeroli F, Salvador S, Sturaro E. Sostenibilidad ambiental de las explotaciones ganaderas alpinas. Ital J Anim Sci. (2014) 13:431–43. doi: 10.4081/ijas.2014.3155
5. Agradi S, Curone G, Negroni D, Vigo D, Brecchia G, Bronzo V, et al. Determinación del perfil de ácidos grasos en productos lácteos originales de vacas pardas y relación con el sistema de ganadería de pasturas alpinas. Animales. (2020) 10:1231. doi: 10.3390/ani10071231
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Parmar TK, Rawtani D, Agrawal YK. Bioindicadores: el indicador natural de la contaminación ambiental. Front Life Sci. (2016) 9:110–8. doi: 10.1080/21553769.2016.1162753
7. Vardhan KH, Kumar PS, Panda RC. Una revisión de la contaminación por metales pesados, la toxicidad y las medidas correctoras: tendencias actuales y perspectivas futuras. J Mol Liq. (2019) 290:111197. doi: 10.1016/j.molliq.2019.111197
8. Kincaid RL. Evaluación del estado de los oligoelementos de los rumiantes: una revisión. J Anim Sci. (2000) 77:1–10. doi: 10.2527/jas2000.77E-Suppl1x
9. Hofmann RR. Etapas evolutivas de la adaptación ecofisiológica y diversificación de rumiantes: una visión comparativa de su sistema digestivo. Ecología. (1989) 78:443–57. doi: 10.1007/BF00378733
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Roggeman S, Van Den Brink N, Van Praet N, Blust R, Bervoets L. Patrones de exposición y acumulación de metales en vacas criadas en libertad (Bos taurus) en un área natural contaminada: Influencia del comportamiento espacial y social. Contaminación ambiental. (2013) 172:186–99. doi: 10.1016/j.envpol.2012.09.006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Hui WA, Liu YM, Qi ZM, Wang SY, Liu SX, Xia LI. La estimación de la distribución de los oligoelementos del suelo y el continuo suelo-planta-animal en relación con el estado de los oligoelementos de las ovejas en el área de Huangcheng de los pastizales de la montaña Qilian, China. J Integr Agric. (2014) 13:140–7. doi: 10.1016/S2095-3119(13)60504-3
12. Nkwunonwo UC, Odika PO, Onyia NI. Una revisión de las implicaciones para la salud de los metales pesados en la cadena alimentaria en Nigeria. Sci. Mundo J. (2020) 2020:6594109. doi: 10.1155/2020/6594109
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. von Keyserlingk MAG, DM cansado. Una revisión de 100 años: el bienestar animal en la revista de ciencia láctea: los primeros 100 años. J Lácteos Sci. (2017) 100:10432–44. doi: 10.3168/jds.2017-13298
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Curone G, Filipe J, Cremonesi P, Piccioli-Cappelli F, Trevisi E, Amadori M. Relevancia de la biodiversidad de la vaca lechera en el desarrollo de una ganadería rentable y ambientalmente sostenible. CAB Rev. Persp. Agric. Vet. Sci. Nutr. Nat. Res. (2019) 14:1–11. doi: 10.1079/PAVSNNR201914024
15. Aubé L, Mialon MM, Mollaret E, Mounier L, Veissier I, de Boyer des Roches A. Revisión: evaluación del bienestar de las vacas lecheras en los pastos: medidas disponibles, brechas que abordar y vías para el desarrollo de protocolos ad-hoc. Animal. (2022) 16:95–100. doi: 10.1016/j.animal.2022.100597
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Mormède P, Andanson S, Aupérin B, Beerda B, Guémené D, Malmkvist J, et al. Exploración de la función hipotálama-hipófisis-suprarrenal como herramienta para evaluar el bienestar animal. Physiol Behave. (2007) 92:317–39. doi: 10.1016/j.physbeh.2006.12.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Möstl E, Palme R. Las hormonas como indicadores de estrés. Domest Anim Endocrinol. (2002) 23:67–64. doi: 10.1016/S0739-7240(02)00146-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Perillo L, Arfuso F, Piccione G, Dara S, Tropia E, Cascone G, et al. Cuantificación de algunos metales pesados en el pelo de vacas lecheras alojadas en diferentes zonas de Sicilia como bioindicador de la exposición ambiental: un estudio preliminar. Animales. (2021) 11:2268. doi: 10.3390/ani11082268
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. García R. «Un solo bienestar»: un marco para apoyar la aplicación de las normas de bienestar animal de la OIE. Bulletin de l’OIE. (2017) 2017:2588. doi: 10.20506/bull.2017.1.2588
20. García Pinillos R, Appleby MC, Manteca X, Scott-Park F, Smith C, Velarde A. Un bienestar: una plataforma para mejorar el bienestar humano y animal. Registro Veterinario. (2016) 179:5470. doi: 10.1136/vr.i5470
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. ASSONAPA Associazione Nazionale Della Pastorizia (2023) Disponible en línea en: http://www.assonapa.it/ (consultado el 31 de julio de 2023).
22. Endo N, Yamane H, Rahayu LP, Tanaka T. Efecto de la administración repetida de hormona adrenocorticotrópica sobre la función reproductiva y la concentración de cortisol en el cabello durante el ciclo estral en cabras. Gen Comp Endocrinol. (2018) 259:207–12. doi: 10.1016/j.ygcen.2017.11.027
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Heimbürge S, Kanitz E, Otten W. El uso de cortisol capilar para la evaluación del estrés en animales. Gen Comp Endocrinol. (2019) 270:10–7. doi: 10.1016/j.ygcen.2018.09.016
24. Palme R, Möstl E. Medición de los metabolitos del cortisol en las heces de ovejas como parámetro de la concentración de cortisol en sangre. Zeitschrift für Saugetierkunde. (1997) 18:192–7.
25. Salaberger T, Millard M, Makarem S, El Möstl E, Grünberger V, Krametter-Frötscher R. Influencia de los factores externos en las concentraciones de cortisol capilar. Gen Comp Endocrinol. (2016) 233:73–8. doi: 10.1016/j.ygcen.2016.05.005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Stubsjøen SM, Bohlin J, Dahl E, Knappe-Poindecker M, Fjeldaas T, Lepschy M, et al. Evaluación del estrés crónico en ovejas (parte I): el uso de cortisol y cortisona en el pelo como marcadores biológicos no invasivos. Ron pequeño Res. (2015) 132:25–31. doi: 10.1016/j.smallrumres.2015.09.015
27. Pavlata L, Chomat M, Pechova A, Misurova L, Dvorak R. Impacto de la suplementación a largo plazo de zinc y selenio en su contenido en sangre y pelo en cabras. Veterinario Med. (2011) 56:63–74. doi: 10.17221/1581-VETMED
28. Fazio F, Aragona F, Piccione G, Arfuso F, Giannetto C. Concentración de litio en muestras biológicas y diferencia de género en caballos atléticos. J Equine Vet Sci. (2022) 117:104081. doi: 10.1016/j.jevs.2022.104081
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Giannetto C, Fazio F, Nava V, Arfuso F, Piccione G, Coelho C. Datos sobre el análisis de regresión múltiple entre boro, níquel, arsénico, antimonio y sustratos biológicos en caballos: el papel de los biomarcadores hematológicos. J Biochem Mol Toxicol. (2022) 36:955. doi: 10.1002/jbt.22955
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Mundała P, Szwalec A, Baran A, Kedzior R. Niveles de cadmio y plomo en tejidos seleccionados de cabras y ovejas de áreas sometidas a diferentes presiones antropogénicas. Infrastr Ecol Zonas Rurales. (2016) 2:1337–46. doi: 10.14597/infraeco.2016.4.2.098
31. Rashed MN, Soltan ME. El pelo animal como indicador biológico de la contaminación por metales pesados en zonas urbanas y rurales. Environ Monit Assess. (2005) 110:41–53. doi: 10.1007/s10661-005-6288-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Draghi S, Agradi S, Riva F, Tarhan D, Bilgiç B, Dokuzeylül B, et al. El pelo de corzo (Capreolus capreolus) como bioindicador de la presencia ambiental de elementos tóxicos y traza. Tóxicos. (2023) 11:49. doi: 10.3390/toxics11010049
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Miedico O, Iammarino M, Paglia G, Tarallo M, Mangiacotti M, Chiaravalle AE. Monitoreo ambiental del área circundante a los pozos petrolíferos en Val d’Agri (Italia): acumulación de elementos en órganos bovinos y ovinos. Environ Monit Assess. (2016) 188:338. doi: 10.1007/s10661-016-5317-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. O ME, Kayar A, Kiziler AR, Parkan Ç, Gönül R, Barutçu B, et al. Determinación de los niveles de algunos metales esenciales (hierro, cobre, zinc) y tóxicos (plomo, cadmio) en la sangre de ovejas y en muestras de agua, plantas y suelo en el noroeste de Turquía. Vet Arh. (2005) 75:359–68.
35. Hashem MA, Nur-A-Tomal MS, Mondal NR, Rahman MA. La quema de pelo en las curtidurías es una fuente de contaminación por arsénico, plomo, zinc, manganeso y hierro. Environ Chem Lett. (2017) 15:501–6. doi: 10.1007/s10311-017-0634-2
36. Biswas U, Sarkar S, Bhowmik MK, Samanta AK, Biswas S. Toxicidad crónica del arsénico en cabras: cambios clinicobioquímicos, patomorfología y residuos tisulares. Ron pequeño Res. (2000) 38:229–35. doi: 10.1016/S0921-4488(00)00162-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Rana T, Bera AK, Bhattacharya D, Das S, Pan D, Das SK. Arsenicosis crónica en cabras con especial referencia a su exposición, excreción y depósito en una zona contaminada con arsénico. Environ Toxicol Pharmacol. (2012) 33:372–6. doi: 10.1016/j.etap.2011.12.026
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Patra PH, Bandyopadhyay S, Bandyopadhyay MC, Mandal TK. Potencial inmunotóxico y genotóxico del arsénico y sus especies químicas en cabras. Toxicol Int. (2013) 20:6–10. doi: 10.4103/0971-6580.111533
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Zuzolo D, Cicchella D, Demetriades A, Birke M, Albanese S, Dinelli E, et al. Arsénico: distribución geoquímica y riesgo para la salud relacionado con la edad en Italia. Environ Res. (2020) 182:109076. doi: 10.1016/j.envres.2019.109076
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Shen S, Li XF, Cullen WR, Weinfeld M, Le XC. Unión de arsénico a proteínas. Chem Rev. (2013) 113:7769–92. DOI: 10.1021/CR300015C
41. Frau LJ, Libohova Z, Joost S, Levasseur C, Jeangros B, Bragazza L, et al. Investigación regional de la variabilidad espacio-temporal del magnesio del suelo: un estudio de caso de Suiza. Geoderma Regional. (2020) 21:E00278. doi: 10.1016/j.geodrs.2020.e00278
42. Manzi P, Gabriella M, Costanzo D, Ritota M. Contenido y evaluación nutricional del zinc en quesos DOP y tradicionales italianos. Moléculas. (2021) 26:6300. doi: 10.3390/moléculas26206300
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Cicchella D, Giaccio L, Dinelli E, Albanese S, Lima A, Zuzolo D, et al. Distribución espacial de los elementos químicos en el suelo agrícola y de pastoreo de Italia. J Geochem Explorar. (2015) 154:129–42. doi: 10.1016/j.gexplo.2014.11.009
44. Garmo TH, Froslie A, Hoie R. Niveles de cobre, molibdeno, azufre, zinc, selenio, hierro y managaneso en plantas de pastoreo nativas de una zona montañosa en el sur de Noruega. Acta Agric Scand. (1986) 36:147–61. doi: 10.1080/00015128609436519
45. Kisnieriene V, Lapeikaite I. Cuando la química se encuentra con la biología: el caso del aluminio – Una revisión. Chemija. (2015) 26:148–58.
46. Rubenstein DR, Alcock J. Comportamiento animal, 11ª ed. Oxford: Oxford University Press (2018), p. 548.
47. Comin A, Prandi A, Peric T, Corazzin M, Dovier S, Bovolenta S. Niveles de cortisol en el pelo de las vacas lecheras desde el alojamiento de invierno hasta el pastoreo de verano en las tierras altas. Livest Sci. (2011) 138:69–73. doi: 10.1016/j.livsci.2010.12.009
48. Chu B, Marwaha K, Sanvictores T, Ayers D. Fisiología, reacción al estrés. Londres: StatPearls. (2022).
49. Asociación Americana de Psicología. Diccionario APA de Ficología. Washington, DC: Asociación Americana de Psicología.
50. Selye H. El estrés y el síndrome general de adaptación. Hno. Med J. (1950) 1:1383–92. doi: 10.1136/bmj.1.4667.1383
51. Parque Nacional Molise de los Abruzos y del Lacio. Rapporto Orso 2015 – Natura Protetta. Notiziario del Parco Nazionale d’abruzzo, Lazio e Molise. Notiziario del Parco Nazionale d’Abruzzo, Lazio e Molise, Naturaprotetta, n 19, verano 2016 (speciale orso) (2016). Roma: Grupo Rotostampa SRL. Disponible en línea en: https://www.parcoabruzzo.it/pdf/NaturaProtetta19_RapportoOrso.pdf (consultado el 31 de julio de 2023).
52. Provincia Autónoma de Trento. Grandi Carnivori en Trentino. (2019) Disponible en línea en: https://grandicarnivori.provincia.tn.it/L-orso/Biologia-habitat-e-distribuzione/Distribuzione/In-Trentino-e-nelle-Alpi-Centrali (consultado el 31 de julio de 2023).
53. Istituto Superiore per la Protezione e la Ricerca Ambientale. Resultados: Los resultados del Monitoreo Nacional de Lobos. ISPRA (Istituto Superiore per la Protezione e la Ricerca Ambientale) (2022). Disponible en línea en: https://www.isprambiente.gov.it/en/archive/ispra-events/it/attivita/biodiversita/monitoraggio-nazionale-del-lupo/risultati (consultado el 31 de julio de 2023).
54. Zanzani SA, Gazzonis AL, Alberti E, Neilly TM, Villa L, Manfredi MT. Infecciones por nematodos gastrointestinales en cabras: diferencias entre los recuentos de huevos fecales estrongílicos y las respuestas específicas de anticuerpos a Teladorsagia circumcincta en cabras Nera di Verzasca y alpinas. Parasitol Res. (2020) 119:2539–48. doi: 10.1007/s00436-020-06767-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
55. Gil C, Boluda R, Rodríguez Martín JA, Guzmán M, del Moral F, Ramos-Miras J. Evaluación de la contaminación del suelo y tendencias temporales del contenido de metales pesados en invernaderos en tierras semiáridas. Degradación de la Tierra Dev. (2018) 29:3344–54. doi: 10.1002/ldr.3094
56. Yang L, Ma X, Luan Z, Yan J. La evolución espacio-temporal de la acumulación de metales pesados en los sedimentos marinos a lo largo de la península de Shandong durante los últimos 100 años: impactos antropogénicos y naturales. Medio ambiente. Contaminar. (2021) 289:117894. doi: 10.1016/j.envpol.2021.117894
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: raza autóctona, pequeño rumiante, pastos alpinos, bioindicador, metales pesados, oligoelementos, bienestar animal, cortisol de pelo
Cita: Agradi S, Munga A, Barbato O, Palme R, Tarhan D, Bilgiç B, Dokuzeylül B, Ercan AM, Or ME, Brecchia G, Curone G, Draghi S, Vigo D, Marongiu ML, González-Cabrera M y Menchetti L (2023) El pelo de cabra como bioindicador de contaminantes ambientales y activación suprarrenal durante la trashumancia vertical. Frente. Vet. Sci. 10:1274081. doi: 10.3389/fvets.2023.1274081
Recibido: 07 de agosto de 2023; Aceptado: 16 de octubre de 2023;
Publicado: 09 Noviembre 2023.
Editado por:
Claudia Giannetto, Universidad de Messina, Italia
Revisado por:
Francesca Arfuso, Universidad de Messina, Italia Alberto Elmi, Universidad de Bolonia, Italia Patrizia Licata, Universidad de Messina, Italia Francesco Fazio, Universidad de Messina, Italia
Copyright © 2023 Agradi, Munga, Barbato, Palme, Tarhan, Bilgiç, Dokuzeylül, Ercan, Or, Brecchia, Curone, Draghi, Vigo, Marongiu, González-Cabrera y Menchetti. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Giulio Curone, giulio.curone@unimi.it; Gabriele Brecchia, Gabriele.brecchia@unimi.it
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía