Ensayos de flujo lateral para el diagnóstico de la paratuberculosis
Ensayos de flujo lateral para el diagnóstico de la paratuberculosis bovina
 Marta Alonso-Hearn1*
Marta Alonso-Hearn1*  Ana Ballesteros2
Ana Ballesteros2  Alejandra Navarro3
Alejandra Navarro3  Gerard Badia-Bringué1
Gerard Badia-Bringué1  Rosa Casais3
Rosa Casais3- 1Departamento de Sanidad Animal, NEIKER-Instituto Vasco de Investigación y Desarrollo Agrario, Alianza Vasca de Investigación y Tecnología, Derio, Bizkaia, España
- 2Biolan Health S.L, Parque Tecnológico de Bizkaia, Zamudio, Bizkaia, España
- 3SERIDA, Servicio Regional de Investigación y Desarrollo Agroalimentario, Centro de Biotecnología Animal, Deva, Asturias, España
La paratuberculosis (MAP) es la causa de la paratuberculosis bovina (PTB). El PTB es responsable de importantes pérdidas económicas en los rebaños lecheros de todo el mundo. Se han desarrollado programas de control de PTB que se basan en la realización de pruebas y el sacrificio de las vacas con resultados positivos. Los diagnósticos actuales, como el ELISA para detectar anticuerpos MAP en muestras de suero y la PCR para detectar el ADN MAP en heces, tienen una sensibilidad inadecuada para detectar animales subclínicos. Las tecnologías «ómicas» innovadoras, como la secuenciación de nueva generación (NGS), la secuenciación basada en la tecnología de ARN (RNA-Seq), la proteómica y la metabolómica, pueden utilizarse para encontrar biomarcadores del huésped. Los biomarcadores descubiertos (ARN, microARN, proteínas, metabolitos) pueden utilizarse para desarrollar enfoques nuevos y más sensibles para el diagnóstico de la TBP. Los enfoques tradicionales para medir los anticuerpos y los biomarcadores del huésped, como los ELISA, la transferencia del norte, la reacción en cadena de la polimerasa con transcriptasa inversa cuantitativa (RT-qPCR), los microarrays de ADNc y la espectrometría de masas, requieren mucho tiempo, son costosos y, a veces, presentan poca sensibilidad. Con el rápido desarrollo de la nanotecnología, se han desarrollado dispositivos de monitorización de bajo coste para medir los anticuerpos contra las proteínas MAP en entornos de punto de atención (POC). Se cree que los ensayos de flujo lateral (LFA), en particular, son apropiados para la detección in situ de anticuerpos contra antígenos MAP y/o biomarcadores del huésped. Esta revisión tiene como objetivo resumir los LFA que se han desarrollado recientemente para detectar con precisión los anticuerpos contra los antígenos MAP, así como los beneficios que los biomarcadores del huésped relacionados con la infección por MAP aportan al diagnóstico de PTB. La identificación de estos nuevos biomarcadores podría ser la base para el desarrollo de nuevos LFAs. Es probable que la industria láctea y los productores se beneficien de tecnologías fiables y rápidas capaces de detectar la infección por MAP in situ para establecer un diagnóstico rápido y sensible de PTB.
1. Las consecuencias económicas y sociales de la paratuberculosis bovina (PTB)
La Organización Mundial de Sanidad Animal (OMSA) reconoce la infección causada por Mycobacterium avium subsp. paratuberculosis (PAM) en rumiantes domésticos y silvestres como un problema importante a nivel mundial en materia de sanidad animal por la Organización Mundial de Sanidad Animal (OMSA), que exige a los países miembros mantener la vigilancia epidemiológica y notificar los casos de enfermedad. En el ganado bovino, la infección por MAP induce una emaciación crónica caracterizada por diarrea y pérdida progresiva de la condición corporal (1). Debido a la menor producción de leche, el aumento de los gastos de manejo y el sacrificio prematuro o la muerte por enfermedad clínica, el PTB es responsable de pérdidas significativas en los rebaños lecheros de todo el mundo (2-4). Más de la mitad de los rebaños de ganado lechero en los Estados Unidos y Europa dan positivo para anticuerpos MAP, lo que indica que el PTB bovino es endémico en estas áreas (5-7). Se ha estimado que el impacto económico del PTB en el sector lácteo de EE.UU. oscila entre 250 millones de dólares y 1.5 millones de dólares al año, con un rendimiento neto de más de 100 dólares por vaca menor en un rebaño positivo que en uno negativo (8). El impacto económico anual del PTB en Europa se ha estimado en 364,31 millones de dólares (9). Además, el PAM es resistente a la pasteurización y puede entrar en la cadena alimentaria humana a través de la carne, los productos lácteos y los suministros de agua no tratada (10). Se cree que la PAM es una causa de la enfermedad de Crohn (EC) en humanos y se ha encontrado en muestras de pacientes con EC, colitis ulcerosa y cáncer colorrectal asociado a la enfermedad inflamatoria intestinal idiopática (EII) (11–14). La PAM se ha propuesto como un posible factor desencadenante en varios trastornos autoinmunes humanos, como la artritis reumatoide, la esclerosis múltiple y la diabetes tipo I (15-18).
2. Factores que influyen en el control del PTB
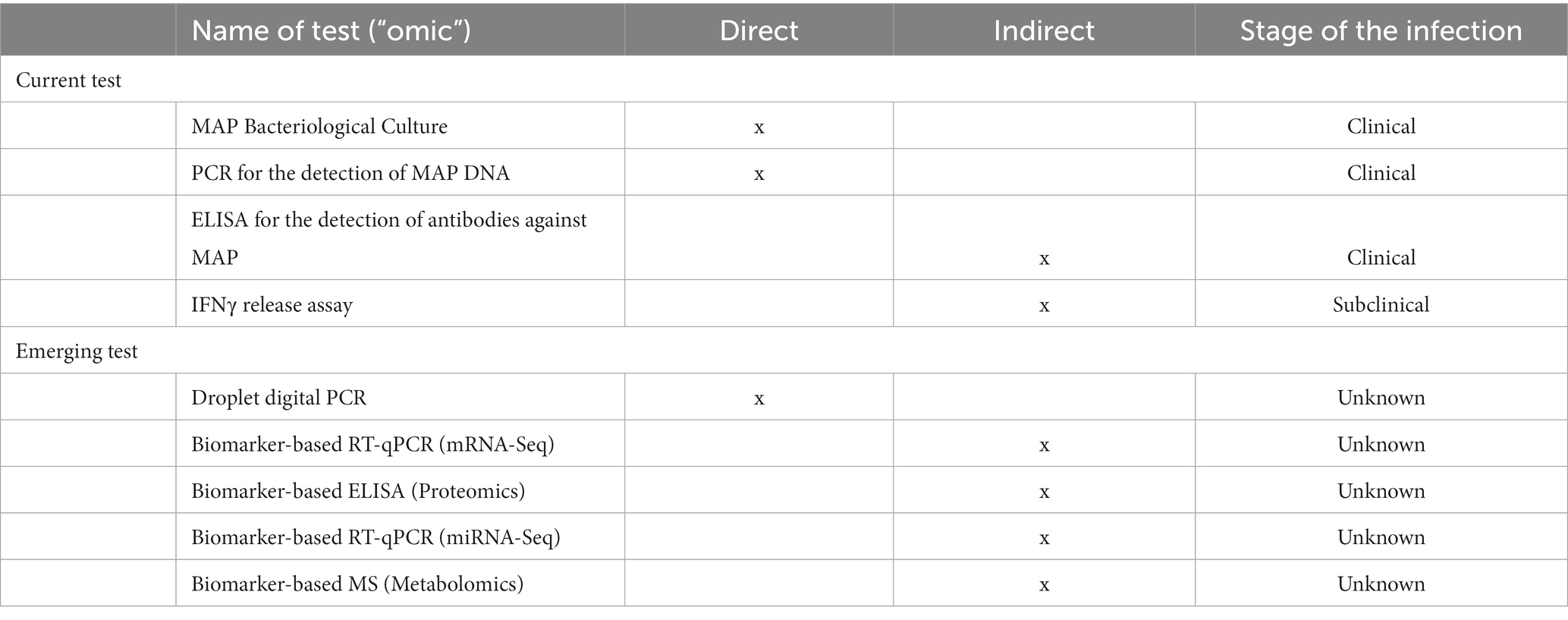
Las vacunas inactivadas disponibles comercialmente contra el PTB bovino son particularmente eficaces para reducir la presencia de MAP en heces y tejidos, así como para aumentar la producción de leche y la vida productiva de las vacas en granjas infectadas (19, 20). Por otro lado, la inmunización con PTB utilizando vacunas inactivadas por calor está prohibida en la mayoría de los países europeos debido a la interferencia con las pruebas de detección de Mycobacterium bovis (21). En la actualidad, el control del PTB se basa en la realización de pruebas y el sacrificio de todas las vacas que han dado positivo en la prueba, así como en la minimización de la transmisión de la PAM a los animales susceptibles mediante la mejora de las medidas de bioseguridad en la granja (22, 23). La falta de cumplimiento de las directrices de manejo, el uso de pruebas con sensibilidades limitadas para detectar todo el ganado infectado y la compra de animales de reemplazo infectados contribuyen al fracaso de dichos programas de control (24). La infección ocurre en los primeros meses de vida, en gran parte a través de la vía fecal-oral, pero el inicio clínico ocurre solo alrededor del parto, cuando los animales tienen 18 meses o más. Las lesiones histológicas asociadas a la TBP se clasificaron en focales, multifocales y difusas (paucibacilares o linfoplasmocíticas difusas, intermedias difusas o multibacilares o histiocíticas difusas) (25, 26). La sensibilidad de las pruebas diagnósticas influye significativamente en el éxito de los programas de control de «prueba y descarte». Los métodos diagnósticos actuales incluyen ensayos de inmunoadsorción enzimática (ELISA), que detectan anticuerpos contra MAP en muestras de suero, y la reacción en cadena de la polimerasa (PCR), que detecta ADN MAP en heces (Tabla 1). En la actualidad, el cultivo fecal se considera la técnica «estándar de oro» para el diagnóstico de la infección por PAM (27). El cultivo fecal individual, por otro lado, es costoso, requiere mucho tiempo (de 5 semanas a 6 meses para que las colonias crezcan en medios sólidos) y, por lo general, detecta formas avanzadas de la enfermedad debido a la aparición tardía de excreción fecal durante el curso natural de la infección por MAP. La sensibilidad del cultivo fecal en animales clínicos es del 70%, pero es solo del 23-29% en animales subclínicos (28). ELISA, que detecta anticuerpos séricos y lácteos contra MAP en animales infectados, se utiliza de forma rutinaria para detectar la infección por MAP. Aunque el ELISA sérico es un método de diagnóstico sencillo, rápido y económico, tiene una baja sensibilidad para detectar animales subclínicos. La sensibilidad sérica al ELISA varía del 50 al 87 % en bovinos con signos clínicos, al 24 al 94 % en bovinos sin signos clínicos pero con excreción de PAM y del 7 al 22 % en bovinos infectados sin signos clínicos y sin excreción (28). El ensayo de liberación de interferón-gamma (IFNγ) (IGRA) detecta respuestas inmunitarias mediadas por células huésped en infecciones por MAP en etapa temprana, pero debe mejorarse porque las preparaciones de antígenos derivados de proteínas purificadas (PPD) utilizadas en la estimulación de sangre total reaccionan de forma cruzada con antígenos de otras especies de micobacterias ambientales (29). Es obvio que la detección de infecciones subclínicas sigue siendo difícil, y se requieren enfoques novedosos para detectar animales infectados con MAP a fin de controlar la propagación de la enfermedad. Se necesitan nuevos biomarcadores del huésped para mejorar la próxima generación de tecnologías de detección de PTB.
3. Tecnologías -ómicas- innovadoras utilizadas para identificar nuevos biomarcadores
La secuenciación de ARN (RNA-Seq) basada en la tecnología de secuenciación de próxima generación (NGS), la proteómica y la metabolómica tienen un inmenso potencial, ya que permiten el estudio de la patogénesis del PTB y pueden utilizarse para descubrir biomarcadores para el desarrollo de herramientas de diagnóstico, fármacos o vacunas innovadoras (30). El perfil transcriptómico, proteómico y metabolómico de las muestras de sangre proporciona biomarcadores para la infección por MAP (ARNm, microARN, proteínas del huésped y metabolitos) que pueden representar todo el espectro de la enfermedad, desde los signos más tempranos hasta las etapas más avanzadas (Tabla 1). Un buen biomarcador para el diagnóstico de TBP debe ser capaz de distinguir entre animales infectados y no infectados con alta sensibilidad y especificidad. Aunque se han encontrado varios biomarcadores del huésped asociados a la infección por MAP mediante análisis transcriptómicos y proteómicos (31-34), no se han validado completamente en bovinos infectados naturalmente en varias etapas de la infección. En un trabajo reciente, se utilizó RNA-Seq para identificar genes del huésped que se expresaban diferencialmente en muestras de sangre periférica (PB) recogidas de animales con lesiones distintas asociadas a PTB (focales y difusas) frente a animales de control sin lesiones en los tejidos intestinales (35). Este análisis de RNA-Seq permitió la identificación de un biomarcador bovino candidato, el miembro 13 de la subfamilia A de casetes de unión a ATP (ABCA13), que se encontró sobreexpresado en el PB de vacas Holstein infectadas con MAP con lesiones focales frente a animales control sin lesiones en los tejidos intestinales. Recientemente, un ELISA diseñado para detectar el ABCA13 mostró un buen poder discriminatorio entre los animales infectados con lesiones focales y los animales no infectados, mejorando así el rendimiento diagnóstico del ELISA IDEXX y otros métodos diagnósticos tradicionales (36). Estos resultados fueron corroborados mediante el uso de un conjunto más grande de muestras de plasma bien caracterizadas de vacas infectadas con MAP (N = 566) y controles negativos (N = 138) (37). Es importante destacar que la ABCA13 bovina se detectó en ausencia de una estimulación previa de derivados de proteínas purificadas (PPD) bovina.
Las diferencias en las concentraciones/niveles de proteínas del huésped en sangre y heces en respuesta a la infección por MAP pueden tener valor diagnóstico. Se han explorado varias plataformas proteómicas. Utilizando iTRAQ, un enfoque de cromatografía líquida y espectrometría de masas en tándem (LC-MS), Seth et al. encontraron transtiretina, proteínas de unión al retinol y catelicidina en muestras de suero de animales infectados con MAP (30). You et al. identificaron seis proteínas reguladas al alza al menos 2 veces en vacas MAP positivas mediante electroforesis en gel de diferencia de fluorescencia dimensional 2D (2D-DIGE), incluida la transferrina, la proteína de unión a actina, el subcomponente C1r del complemento, el componente C3 del complemento, la amina oxidasa-cobre que contiene 3 (AOC3) y la trombina (31). Espinosa et al. midieron los niveles séricos de haptoglobina y amiloide A sérica, dos proteínas inflamatorias de fase aguda, en 190 animales infectados naturalmente clasificados según las formas patológicas de infección (59 animales no infectados sin lesiones, 73 con lesiones focales, 19 con multifocales, 11 con paucibacilares difusos y 28 con lesiones multibacilares difusas) (38). Sus hallazgos revelaron un aumento significativo de los niveles de estas proteínas en el suero de los animales infectados con lesiones focales, baja carga bacteriana y con predominio de respuestas inmunes mediadas por células. Los autores concluyeron que estas proteínas podrían ser útiles como biomarcadores de infección temprana, particularmente para identificar animales subclínicos. Park et al. identificaron la alfa-2-macroglobulina (A2M) como un nuevo biomarcador prometedor para mejorar la detección de MAP (39). Descubrieron que los niveles séricos de A2M eran significativamente más altos en los excredores subclínicos (N = 27), los excredores subclínicos no clínicos (N = 50) y los excredores clínicos (N = 18) que en un grupo de control sano (N = 11) de una granja libre de PTB. A pesar de que el estudio incluyó un número reducido de vacas de control sanas debido a la dificultad de encontrar una granja libre de PTB, A2M ELISA demostró un rendimiento diagnóstico superior (90,4% de sensibilidad y 100% de especificidad) que dos ELISA comerciales para la detección de anticuerpos anti-MAP.
Los biomarcadores incluyen ARN no codificantes del huésped (ncRNA), así como ARNm, proteínas o metabolitos. Los microARN son uno de los tipos de ARNnc más estudiados. Los microARN (de 18 a 25 nucleótidos de largo) son ARN pequeños altamente conservados que regulan principalmente la expresión génica al reducir la estabilidad de sus ARNm diana (40). Debido a que la unión microARN-ARNm da como resultado la escisión del ARNm o la supresión de la traducción, los microARN son importantes reguladores de la función génica. Debido a su importancia en diversas enfermedades y su estabilidad en biofluidos, los microARN han surgido como candidatos prometedores con un vasto potencial diagnóstico. A pesar de varios ciclos de congelación y descongelación o pH extremo, los microARN exhiben una estabilidad notable (41). Además, los microARN se miden con una alta sensibilidad y son candidatos a biomarcadores adecuados en el diagnóstico en comparación con los biomarcadores de proteínas, que se degradan fácilmente con el tiempo. La identificación de microARN expresados diferencialmente entre bovinos infectados y no infectados sugiere que los microARN podrían ser biomarcadores diagnósticos útiles de la infección por MAP (34, 42-44).
La metabolómica mide los fenotipos químicos que son el resultado de la actividad a nivel del transcriptoma y del proteoma. La metabolómica ha surgido como un método para caracterizar los perfiles metabólicos de bovinos infectados con MAP. Los sueros de terneros infectados a las 2 semanas de edad se analizaron mediante espectrometría de resonancia magnética nuclear 1H y se compararon con controles emparejados de edad en un seguimiento mensual durante 17 meses (45). El mismo perfil distintivo se detectó a los 3 meses y a los 12 meses de la infección. Los cambios en las concentraciones de acetona, citrato, glicerol e isobutirato sugirieron escasez de energía y aumento del metabolismo de las grasas en el ganado infectado, mientras que los cambios en la urea y varios aminoácidos indicaron un aumento del recambio proteico. En un estudio prospectivo, cohortes de novillas y vacas (N = 356) fueron seguidas anualmente durante 2-4 años utilizando análisis directo en tiempo real junto con espectrometría de masas de alta resolución (DART-HRMS) (46). Los animales infectados presentaron un aumento de los niveles de triptamina y creatina/creatinina, pero una disminución de los niveles de urea, ácido glutámico y/o ácido piroglutámico. Sin embargo, hasta 200 días después de la infección, los metabolitos identificados por de Buck et al. (45) exhibieron niveles similares entre el ganado infectado por MAP y el de control. Del mismo modo, Tata et al. (46). metabolitos descubiertos con niveles superpuestos entre los grupos infectados, infecciosos y de control. Para examinar los cambios dependientes del tiempo después de la infección por MAP en ganado joven, los terneros Holstein Frisons fueron inoculados experimentalmente con MAP y, junto con 20 terneros de control, se muestrearon quincenalmente hasta los 13 meses de edad y posteriormente mensualmente hasta los 19 meses de edad (47). Los sueros se evaluaron mediante espectrometría de masas de alta resolución por electrospray de infusión de flujo (FIE-HRMS) y, de los 33 metabolitos identificados, seis acilos grasos pudieron distinguir entre grupos experimentales a lo largo del estudio, incluidos el ácido 8, 11, 14-eicosatrienoico y el ácido cis-8, 11, 14, 17-eicosatetraenoico. Además, varios metabolitos que se sugirieron como biomarcadores de MAP en terneras infectadas naturalmente (48) demostraron estar elevados en este estudio en el que se inocularon experimentalmente terneras de terneras.
4. Plataformas de punto de atención (POC)
Los diagnósticos actuales de PTB requieren el transporte de la muestra biológica desde la granja hasta el laboratorio, así como personal de laboratorio altamente capacitado y preparación de varios pasos. Como resultado, el intervalo entre el muestreo y el resultado es largo. Debido al rápido desarrollo de la nanotecnología, ahora es posible desarrollar dispositivos de monitoreo rápidos y económicos que pueden ayudar en la medición de anticuerpos del huésped, microARN y proteínas en entornos POC o instalaciones de recursos limitados (49, 50). La Organización Mundial de la Salud (OMS) ha establecido los criterios ASSURED para un ensayo POC ideal, que significa: asequible, sensible (bajo número de falsos negativos), específico (bajo número de falsos positivos), fácil de usar (fácil de realizar), rápido y robusto, sin equipo y entregable a quienes lo necesitan (51).
Las nanopartículas (NP) ofrecen cualidades únicas, como una alta relación superficie/volumen, alta energía superficial, propiedades de absorción y emisión sintonizables, alta estabilidad y biocompatibilidad, lo que las hace ideales para el diseño de plataformas POC (52). Debido a sus características sobresalientes que dan como resultado la amplificación de la señal, las nanopartículas de oro (AuNP) se han utilizado ampliamente en la biodetección. Sus propiedades de resonancia de plasmón superficial (SPR), en particular, los convierten en excelentes potenciadores del campo electromagnético SPR, lo que resulta en una mayor amplificación y sensibilidad de la señal. La SPR se produce en el rango visible del espectro en las AuNP y es responsable de sus características ópticas sobresalientes, como los cambios de color dependientes del tamaño/agregación y los altos coeficientes de extinción. La agregación de AuNPs da como resultado el acoplamiento del plasmón de la superficie entre partículas, que cambia la banda característica del plasmón de la superficie (~ 520 nm) a longitudes de onda más largas (~ 650 nm). Como resultado, cuando se dispersan en una solución, las AuNP aparecen de color rojizo, cambiando a azulado cuando se agregan. Debido a que este fenómeno ocurre en el rango visible del espectro, estos cambios se pueden detectar con un espectrofotómetro ultravioleta-visible estándar (UV-Vis) o incluso a simple vista, lo que elimina la necesidad de instrumentación adicional costosa, lo que lo hace adecuado para diagnósticos POC.
Debido a su biocompatibilidad innata, baja citotoxicidad y alta estabilidad en fluidos biológicos, las AuNP son excelentes materiales para detectar anticuerpos del huésped, microARN y proteínas en muestras biológicas. Las AuNPs pueden ser fácilmente funcionalizadas con biomoléculas que tienen alta afinidad por estos analitos. Los enfoques basados en la adsorción, los basados en ofertas covalentes y los enfoques basados en la afinidad son los métodos más utilizados para funcionalizar la superficie de las AuNP. El método basado en la adsorción se basa en interacciones electrostáticas o hidrofóbicas entre el ligando y la superficie de las AuNPs. El ligando se adsorbe en la superficie de los AuNPs, formando un enlace no covalente. En el método basado en la unión covalente, el ligando se une covalentemente a la superficie del AuNP utilizando un grupo tiol. Esto se puede lograr mediante la conjugación directa de una molécula que contiene azufre o mediante el uso de un enlazador bifuncional. El enlazador tiene un grupo tiol en un extremo que tiene una alta afinidad por la superficie de AuNP, lo que da como resultado un enlace semicovalente (S-Au), y otro grupo funcional en el otro extremo que permite que otras biomoléculas se unan. El método de modificación de superficie basado en la afinidad implica la funcionalización de la superficie de AuNP con fracciones que proporcionan sitios de unión específicos para el acoplamiento de biomoléculas. Estos sitios de afinidad permiten la unión selectiva de biomoléculas a la superficie de AuNP.
En el caso de los microARN, las AuNP a menudo se funcionalizan con oligonucleótidos que contienen un dominio complementario a la secuencia diana del microARN. En el caso de la detección de proteínas, las AuNPs se funcionalizan con anticuerpos específicos contra la proteína diana. Los biosensores basados en AuNP se clasifican en dos tipos: biosensores basados en soluciones y biosensores basados en soportes sólidos. El primero describe los dispositivos de biodetección que utilizan AuNPs dispersos en solución (por ejemplo, sensores colorimétricos y fluorescentes). En este último grupo, las AuNP se unen a un soporte sólido (por ejemplo, sensores electroquímicos, sensores SPR, sensores basados en portaobjetos de vidrio, ensayos de tiras de flujo lateral).
5. Ensayos de flujo lateral
Los ensayos de flujo lateral (LFA) son ensayos de diagnóstico basados en los principios de las tiras reactivas de flujo lateral inmunocromatográficas. La muestra de prueba fluye a lo largo de un sustrato sólido a través de la acción capilar, que tarda entre 10 y 15 minutos en completarse. Los LFA son ensayos rápidos, que solo requieren unas pocas gotas de una muestra diluida en un tampón. Los LFA se componen de una membrana (con frecuencia hecha de nitrocelulosa), una almohadilla de muestra (hecha de celulosa o fibra de vidrio), una almohadilla conjugada (hecha de fibra de vidrio) y una almohadilla absorbente o absorbente (generalmente un filtro de celulosa), todos los cuales se laminan en una lámina de plástico conocida como tarjeta de respaldo (Figura 1A).
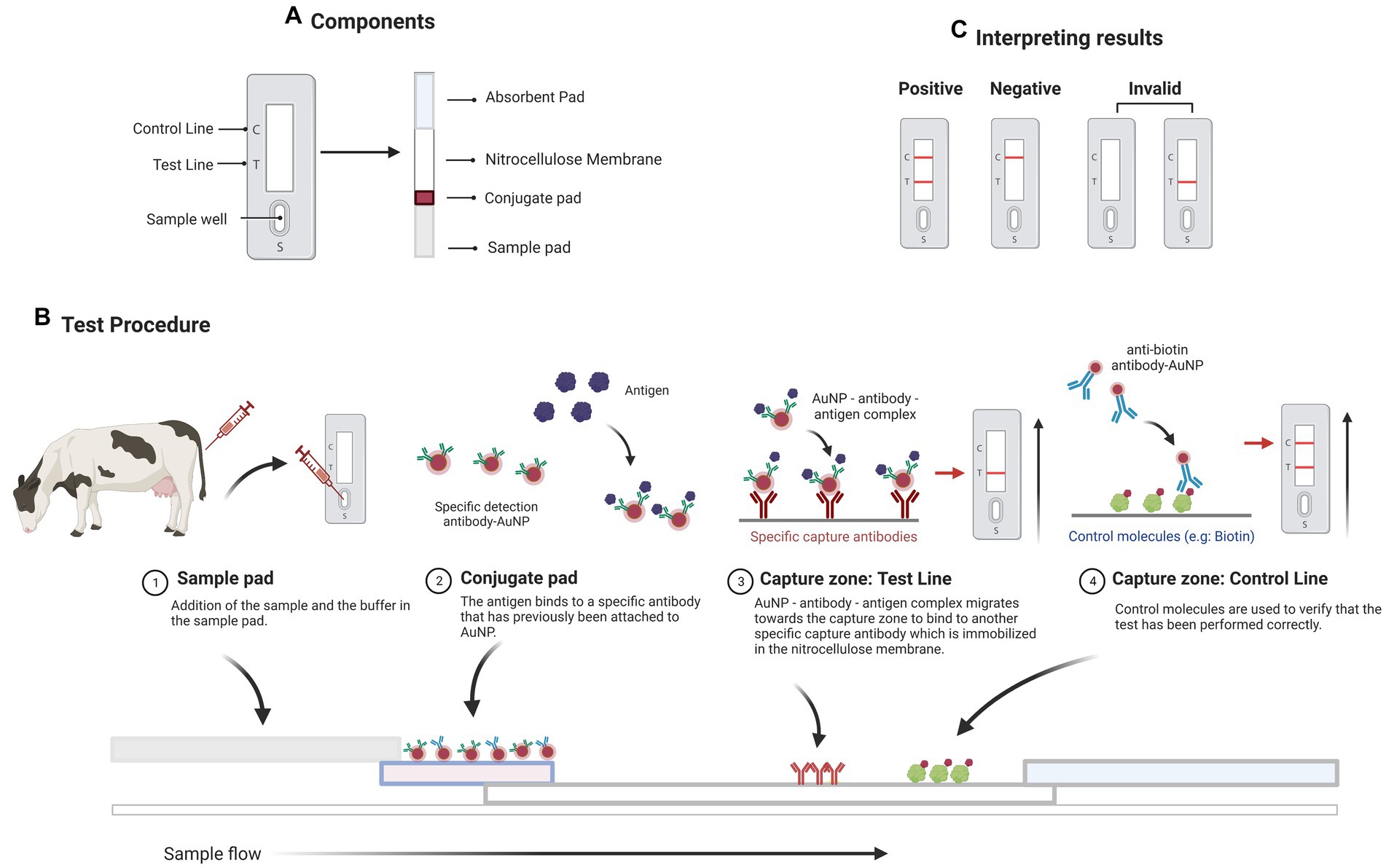 Figura 1. Un inmunoensayo de flujo lateral sándwich (LFI, por sus siglas en inglés). (A) La tira reactiva contiene varios componentes, incluida una almohadilla de muestra, una almohadilla conjugada del detector, una almohadilla de absorción y una membrana de nitrocelulosa con líneas de prueba y control. (B) Representación esquemática del funcionamiento de un LFI para la detección de un antígeno específico. (C) La aparición de dos bandas indica un resultado positivo de la prueba. La presencia de solo la línea de prueba o ninguna línea indica que la prueba no es válida. La presencia de simplemente la línea de control indica un resultado negativo. Creado con BioRender.com.
Figura 1. Un inmunoensayo de flujo lateral sándwich (LFI, por sus siglas en inglés). (A) La tira reactiva contiene varios componentes, incluida una almohadilla de muestra, una almohadilla conjugada del detector, una almohadilla de absorción y una membrana de nitrocelulosa con líneas de prueba y control. (B) Representación esquemática del funcionamiento de un LFI para la detección de un antígeno específico. (C) La aparición de dos bandas indica un resultado positivo de la prueba. La presencia de solo la línea de prueba o ninguna línea indica que la prueba no es válida. La presencia de simplemente la línea de control indica un resultado negativo. Creado con BioRender.com.
Cuando se añade una muestra de prueba que contiene el analito diana (por ejemplo, una proteína) a la almohadilla de muestra, fluye a través de la membrana solubilizando el conjugado (un anticuerpo AuNP) que fluye a su lado (Figura 1B). El conjugado se une a la diana presente en la muestra de prueba, y el complejo diana-conjugado formado es capturado en la línea de prueba por los elementos de captura (un anticuerpo secundario) inmovilizados en esta zona. En la línea de prueba, surge una señal colorimétrica que es proporcional a la cantidad de blanco presente en la muestra. El exceso de la muestra llega a una línea de control con un segundo conjugado (conocido como conjugado de control), confirmando el flujo adecuado del líquido a través de la tira. Finalmente, una almohadilla absorbente absorbe el líquido en el extremo de la tira. Además de observar las bandas de prueba y control, sus intensidades ópticas se pueden determinar utilizando un lector de tiras portátil y el software adecuado (Figura 1C). Los LFA son excelentes herramientas para la detección in situ de anticuerpos, proteínas o microARN del huésped en muestras biológicas debido a sus ventajas intrínsecas, como la facilidad de uso, el bajo coste y la rápida respuesta (53). Se pueden clasificar en dos categorías en función del analito diana: inmunoensayos de flujo lateral (LFI, cuando la diana es un antígeno o un anticuerpo) y ensayos de flujo lateral basados en hibridación de ácidos nucleicos (NALFA, cuando la diana es una secuencia de ADN o ARN). Los LFI se utilizan habitualmente en los formatos sándwich y competitivo (53). En el formato sándwich, el conjugado se une al antígeno diana presente en la muestra y, a continuación, el exceso de muestra interactúa con un conjugado de control y forma un complejo en la línea de control (54). En el formato competitivo, el antígeno de la muestra de prueba compite con el antígeno inmovilizado en la zona de prueba para unirse al anticuerpo conjugado con AuNPs.
En el caso de la detección de microARN, los NALFA suelen ser ensayos sándwich que se basan en la unión complementaria entre la secuencia de microARN diana en la muestra y las sondas de oligonucleótidos inmovilizadas por la membrana y marcadas con AuNP. Las sondas se inmovilizan en la membrana mediante interacciones de alta afinidad entre pares de proteínas, como biotina-avidina/estreptavidina. Típicamente, dos sondas de ADN biotiniladas, la de captura y la de control, se conjugan con estreptavidina y se distribuyen en la membrana de nitrocelulosa, formando las líneas de prueba y control, respectivamente. Una sonda de detección complementaria a la mitad 3′ del microARN diana se conjuga con AuNPs a través de su grupo tiol, y este conjugado ADN-AuNPs se carga en la almohadilla conjugada. Cuando la muestra que contiene microARN se aplica a la almohadilla de muestra, viaja a través de la membrana hasta llegar a la almohadilla conjugada, donde el microARN objetivo se hibrida con la sonda de captura conjugada con AuNPs. La muestra continúa migrando y es capturada por la sonda de control en la línea de control. La acumulación de diana produce una banda roja en la línea de prueba, cuya intensidad es proporcional a la cantidad de microARN diana presente en la muestra. En ausencia del microARN, solo se observa la banda de control, lo que garantiza un flujo de líquido adecuado a través de la NALFA. La detección de microARN para el diagnóstico de POC tiene la desventaja de requerir el aislamiento de microARN de fluidos biológicos antes de la detección. Por otro lado, las tecnologías emergentes para la extracción y detección de microARN en dispositivos portátiles deberían aumentar el uso actual de microARN para el diagnóstico (55).
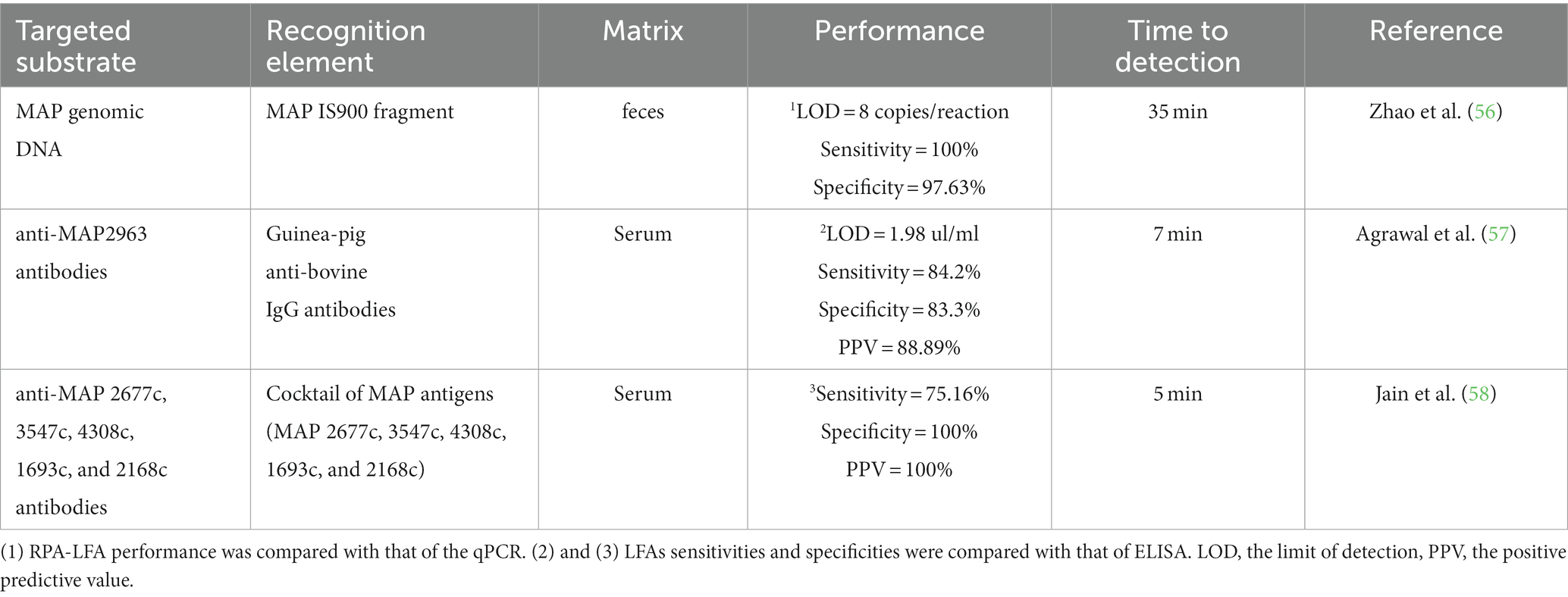
6. LFA para la detección rápida de la infección por MAP
En la Tabla 2 se han resumido los nuevos AGL para la detección rápida de la infección por MAP. Un LFA BASADO EN AMPLIFICACIÓN DE POLIMERASA RECOMBINANTE (RPA-LFA) mostró una sensibilidad y especificidad del 88,24 y 78,75% en comparación con un ELISA comercial para la detección de anticuerpos contra MAP (IDEXX, Estados Unidos) y una sensibilidad del 100% y una especificidad del 97,63% en comparación con un ensayo de qPCR en tiempo real (56). La secuencia MAP IS9000 se detectó en 30 min a 39°C con un límite de detección (LOD) de ocho copias por reacción, equivalente al LOD del ensayo de qPCR en tiempo real. Posteriormente, se analizaron 612 muestras fecales mediante RPA-LFA, que arrojaron una sensibilidad del 100%, una especificidad del 97,63% y una concordancia del 98,44% con los resultados de la qPCR.
Tabla 2. LFAs para la detección de la infección por MAP.
Se desarrolló un LFI basado en AuNPs para la detección de anticuerpos específicos contra MAP2963 proteína (57). En este ensayo, la proteína recombinante MAP2963 (44 kDa) y la proteína A se detectaron en la membrana de nitrocelulosa en las líneas de prueba y control, respectivamente. Las AuNPs se funcionalizaron con anticuerpos IgG antibovinos de cobaya que pueden unirse a anticuerpos anti-MAP2963 bovinos. Los anticuerpos específicos de MAP2963 en la muestra se unen a los anticuerpos conjugados con AuNP IgG antibovina y este complejo es capturado por la proteína recombinante 44 KDa, lo que da como resultado una banda roja en la línea de prueba. La muestra restante se mueve más a través de la membrana de nitrocelulosa y se une a la proteína A, lo que da como resultado un color rojo en la línea de control. El ensayo se probó utilizando 31 muestras de suero recogidas de bovinos con PTB clínico y mostró valores de LOD de 1,98 μg/mL, sensibilidad del 84,2%, especificidad del 83,3% y un valor predictivo positivo (VPP) del 88,89% en comparación con ELISA. Hubo una buena concordancia entre los ensayos ELISA y LFA (valor kappa = 0,66). Este ALF podría completarse en 10 minutos.
Jain et al. desarrollaron un LFI basado en un cóctel de proteínas recombinantes MAP 2677c, 3547c, 4308c, 1693c y 2168c (cada antígeno a 2 mg/mL en el cóctel) (58). Los antígenos MAP estaban en la línea de prueba, mientras que la albúmina sérica bovina biotinilada (BSA) estaba presente en la línea de control. La sensibilidad y la especificidad del LFI fueron del 75,6 y 100%, respectivamente. Seiscientos ocho animales fueron analizados con este LFI, y se determinó que 283 eran positivos. El valor kappa (0,70) reveló una buena concordancia entre el LFI y un ELISA que utilizaba las mismas proteínas secretoras recombinantes que el LFI. En 5 min, se obtuvieron los resultados de LFI.
7. Aplicaciones de los AFL y orientaciones futuras
Aunque los dispositivos POC para la medicina humana han logrado un enorme progreso, debido principalmente a la pandemia de COVID-19, las pruebas POC en animales para animales de granja aún no han alcanzado todo su potencial. Los AGL podrían utilizarse para monitorizar un gran número de animales sobre el terreno y detectar anticuerpos contra antígenos MAP, así como microARN, proteínas o metabolitos bovinos asociados a la infección por MAP utilizando un volumen de muestra relativamente pequeño. Aunque se han desarrollado LFA para detectar anticuerpos contra antígenos MAP, se espera que se desarrolle la próxima generación de LFA basados en biomarcadores del huésped con mayor sensibilidad para detectar casos subclínicos. Además, los LFAs multiplex permitirían la detección simultánea de más de un biomarcador discriminativo, aumentando la detección de los diferentes estadios de la infección. En el futuro, se espera que las técnicas de producción en masa reduzcan significativamente el costo de fabricación de los LFA, haciendo que esta tecnología sea asequible para los productores y veterinarios. Además de la TBP, los AGL serían especialmente útiles para diagnosticar infecciones micobacterianas zoonóticas como la tuberculosis bovina, que es endémica en países de ingresos bajos y medianos con acceso limitado a laboratorios sofisticados. Además, el desarrollo de LFA basados en la firma de biomarcadores del huésped que sean idealmente DIVA (que permitan la vacunación) podría ser un camino prometedor a seguir. La futura aplicación de los AGL requerirá una evaluación y validación previas en cohortes animales más grandes de vacas infectadas experimental y naturalmente.
Contribuciones de los autores
M-AH: Conceptualización, Análisis formal, Obtención de fondos, Metodología, Administración de proyectos, Supervisión, Redacción – borrador original, Redacción – revisión y edición. AB: Análisis formal, Investigación, Metodología, Recursos, Software, Visualización, Escritura – revisión y edición. AN: Investigación, Metodología, Redacción – revisión y edición. GB-B: Metodología, Software, Visualización, Escritura – Revisión y Edición. RC: Análisis formal, Obtención de fondos, Investigación, Metodología, Administración de proyectos, Recursos, Supervisión, Validación, Redacción – borrador original, Redacción – revisión y edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. El apoyo financiero para este estudio ha sido proporcionado por las subvenciones (RTI2018-094192 y PID2021-122197OR) financiadas por el MCIN/AEI/10.13039/501100011033 y por FEDER, «Una manera de hacer Europa» y por los fondos regionales PCTI 2021-2023 (GRUPIN: IDI2021-000102). AN y GB-B han sido becados por MCIN/AEI/10.13039/501100011033 y FSE «Invierte en tu futuro»; Subvenciones PRE2020-096451 y PRE2019-090562, respectivamente.
Reconocimientos
Agradecemos a Kyle P. Hearn por la revisión del manuscrito.
Conflicto de intereses
AB era empleado de Biolan Health S.L.
El resto de los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un potencial conflicto de intereses.
El/los autor/es declararon, en el momento de la presentación, ser miembro del consejo editorial de Frontiers. Esto no tuvo ningún impacto en el proceso de revisión por pares ni en la decisión final.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Clarke, CJ. Paratuberculosis y biología molecular. Veterinario J. (1997) 153:245–7. doi: 10.1016/s1090-0233(97)80059-7
2. Ott, SL, Wells, SJ y Wagner, BA. Pérdidas económicas a nivel de rebaño asociadas con la enfermedad de Johne en las operaciones lecheras de EE. UU. Prev Vet Med. (1999) 40:179–92. doi: 10.1016/S0167-5877(99)00037-9
3. Hasonova, L, y Pavlik, I. Impacto económico de la paratuberculosis en los rebaños de ganado lechero: una revisión. Vet Med (Praga). (2006) 51:193–211. doi: 10.17221/5539-VETMED
4. Smith, RL, Strawderman, RL, Schukken, YH, Wells, SJ, Pradhan, AK, Espejo, LA, et al. Efecto del estado de la enfermedad de Johne sobre la reproducción y el sacrificio en el ganado lechero. J Lácteos Sci. (2010) 93:3513–24. doi: 10.3168/jds.2009-2742
5. Nielsen, SS, y Toft, N. Una revisión de las prevalencias de paratuberculosis en animales de granja en Europa. Prev Vet Med. (2009) 88:1–14. doi: 10.1016/j.prevetmed.2008.07.003
6. Lombardo, JE. Epidemiología y economía de la paratuberculosis. Vet Clin N Am Food Anim Pract. (2011) 27:525–35. doi: 10.1016/j.cvfa.2011.07.012
7. Whittington, R, Donat, K, Weber, MF, Kelton, D, Nielsen, SS, Eisenberg, S, et al. Control de la paratuberculosis: quién, por qué y cómo. Una revisión de 48 países. BMC Vet Res. (2019) 15:198. doi: 10.1186/s12917-019-1943-4
8. Harris, NB, y Barletta, RG. Mycobacterium avium subsp. paratuberculosis en medicina veterinaria. Clin Microbiol Rev. (2001) 14:489–512. doi: 10.1128/CMR.14.3.489-512.2001
9. Rasmussen, P, Barkema, HW, Mason, S, Beaulieu, E, y Hall, DC. Pérdidas económicas debidas a la enfermedad de Johne (paratuberculosis) en el ganado lechero. J Lácteos Sci. (2021) 104:3123–43. doi: 10.3168/jds.2020-19381
10. Alonso-Hearn, M, Molina, E, Geijo, M, Vázquez, P, Sevilla, I, Garrido, JM, et al. Aislamiento de Mycobacterium avium subsp. paratuberculosis a partir de tejido muscular de bovinos infectados de forma natural. Pathog Dis. (2009) 6:513–8. doi: 10.1089/fpd.2008.0226
11. Feller, M, Huwiler, K, Stephan, R, Altpeter, E, Shang, A, Furrer, H, et al. Mycobacterium avium subespecie paratuberculosis y enfermedad de Crohn: una revisión sistemática y metaanálisis. Lancet infecta Dis. (2007) 7:607–13. doi: 10.1016/S1473-3099(07)70211-6
12. Jeyanathan, M, Boutros-Tadros, O, Radhi, J, Semret, M, Bitton, A, y Behr, MA. Visualización de Mycobacterium avium en tejido de Crohn mediante microscopía de inmersión en aceite. Los microbios infectan. (2007) 9:1567–73. doi: 10.1016/j.micinf.2007.09.001
13. Juste, RA, Elguezabal, N, Pavón, A, Garrido, JM, Geijo, M, Sevilla, I, et al. Asociación entre el ADN de Mycobacterium avium subsp. paratuberculosis en sangre y la respuesta inmune celular y humoral en pacientes con enfermedad inflamatoria intestinal y controles. Int J Infect Dis. (2009) 13:247–54. doi: 10.1016/j.ijid.2008.06.034
14. Pierce, ES. ¿Podría Mycobacterium avium subespecie paratuberculosis causar enfermedad de Crohn, colitis ulcerosa… ¿Y el cáncer colorrectal? Infectar el agente cancerígeno. (2018) 13:1–6. doi: 10.1186/s13027-017-0172-3
15. Mameli, G, Cocco, E, Frau, J, Marrosu, MG, y Sechi, LA. El virus de Epstein Barr y los péptidos de Mycobacterium avium subsp. paratuberculosis se reconocen en sueros y líquido cefalorraquídeo de pacientes con EM. Sci Rep. (2016) 6:1–10. doi: 10.1038/srep22401
16. Niegowska, M, Rapini, N, Piccinini, S, Mameli, G, Caggiu, E, Bitti, MLM, et al. Los niños en riesgo de diabetes tipo 1 reconocen en gran medida los epítopos de paratuberculosis de la subespecie Mycobacterium avium, homólogos al Znt8 humano y a la proinsulina. Sci Rep. (2016) 6:2–11. doi: 10.1038/srep22266
17. Bo, M, Erre, GL, Niegowska, M, Piras, M, Taras, L, Longu, MG, et al. El factor regulador del interferón 5 es una diana potencial de la respuesta autoinmune desencadenada por el virus de Epstein-Barr y Mycobacterium avium subsp. paratuberculosis en la artritis reumatoide: investigación de un mecanismo de mimetismo molecular. Clin Exp Rheumatol. (2018) 36:376–81.
18. Yokoyama, K, Cossu, D, Hoshino, Y, Tomizawa, Y, Momotani, E y Hattori, N. Anticuerpos antimicobacterianos en muestras pares de líquido cefalorraquídeo y suero de pacientes japoneses con esclerosis múltiple o trastorno del espectro de la neuromielitis óptica. J Clin Med. (2018) 7:1–11. doi: 10.3390/jcm7120522
19. Juste, RA, Alonso-Hearn, M, Molina, E, Geijo, M, Vázquez, P, Sevilla, IA, et al. Reducción significativa de la excreción bacteriana y mejora de la producción de leche en las explotaciones lecheras tras el uso de una nueva vacuna inactivada contra la paratuberculosis en un ensayo de campo. Notas de BMC Res. (2009) 2:1–6. doi: 10.1186/1756-0500-2-233
20. Alonso-Hearn, M, Molina, E, Geijo, M, Vázquez, P, Sevilla, IA, Garrido, JM, et al. La inmunización del ganado lechero adulto con una nueva vacuna muerta por calor se asocia con una vida productiva más larga antes de que las vacas sean enviadas al matadero con sospecha de paratuberculosis. J Lácteos Sci. (2012) 95:618–29. doi: 10.3168/jds.2009-2860
21. Garrido, JM, Vázquez, P, Molina, E, Plazaola, JM, Sevilla, IA, Geijo, MV, et al. La vacunación contra la paratuberculosis solo provoca una reactividad cruzada limitada en la prueba cutánea para el diagnóstico de la tuberculosis bovina. PLoS Uno. (2013) 8:2–8. doi: 10.1371/journal.pone.0080985
22. Groenendaal, H, Nielen, M, Jalvingh, AW, Horst, SH, Galligan, DT, y Hesselink, JW. Una simulación del control de la enfermedad de Johne. Prev Vet Med. (2002) 54:225–45. doi: 10.1016/S0167-5877(02)00027-2
23. Garry, F. Control de la paratuberculosis en rebaños lecheros. Veterinario Clin América del Norte. (2011) 27:599–607. doi: 10.1016/j.cvfa.2011.07.006
24. Barkema, HW, Orsel, K, Nielsen, SS, Koets, AP, Rutten, VPMG, Bannantine, JP, et al. Lagunas de conocimiento que dificultan la prevención y el control de la infección por paratuberculosis de la subespecie Mycobacterium avium. Transbound Emerg Dis. (2018) 65:125–48. doi: 10.1111/tbed.12723
25. González, J, Geijo, MV, García-Pariente, C, Verna, A, Corpa, JM, Reyes, LE, et al. Clasificación histopatológica de las lesiones asociadas a la infección natural por Paratuberculosis en bovinos. J Comp Pathol. (2005) 133:184–96. doi: 10.1016/j.jcpa.2005.04.007
26. Balseiro, A, Pérez, V, y Juste, RA. Enfermedad inflamatoria intestinal regional crónica: ¿una infección lenta transespecie? Comp Immunol Microbiol Infect Dis. (2019) 62:88–100. doi: 10.1016/j.cimid.2018.12.001
27. Kalis, CHJ, Hesselink, JW, Barkema, HW y Collins, MT. Cultivo de muestras fecales bovinas agrupadas estratégicamente como método para detectar la paratuberculosis en los rebaños. J Vet Diagn Investig. (2000) 12:547–51. doi: 10.1177/104063870001200609
28. Nielsen, SS y Toft, N. Diagnóstico ante mortem de la paratuberculosis: una revisión de la precisión de ELISA, ensayo de γ de interferón y técnicas de cultivo fecal. Microbiol veterinario. (2008) 129:217–35. doi: 10.1016/j.vetmic.2007.12.011
29. Capsel, RT, Thoen, CO, Reinhardt, TA, Lippolis, JD, Olsen, R, Stabel, JR, et al. Caracterización de la composición y potencia de derivados proteicos purificados de Mycobacterium avium subsp. paratuberculosis. PLoS Uno. (2016) 11:1–19. doi: 10.1371/journal.pone.0154685
30. Seth, M, Lamont, EA, Janagama, HK, Widdel, A, Vulchanova, L, Stabel, JR, et al. Descubrimiento de biomarcadores en infecciones micobacterianas subclínicas de bovinos. PLoS Uno. (2009) 4:E5478. doi: 10.1371/journal.pone.0005478
31. Tú, Q, Verschoor, CP, Pant, SD, Macri, J, Kirby, GM y Karrow, NA. Análisis proteómico del plasma de vacas Holstein que dieron positivo para Mycobacterium avium subsp. Paratuberculosis (MAP). Veterinario Inmunol Inmunopatíaco. (2012) 148:243–51. doi: 10.1016/j.vetimm.2012.05.002
32. David, J, Barkema, HW, Mortier, R, Ghosh, S, Guan, LL y De Buck, J. Perfil de expresión génica y biomarcadores putativos de terneros 3 meses después de la infección con Mycobacterium avium subespecie paratuberculosis. Veterinario Inmunol Inmunopatíaco. (2014) 160:107–17. doi: 10.1016/j.vetimm.2014.04.006
33. Park, HE, Shin, MK, Park, HT, Jung, M, Il, CY y Yoo, HS. Perfiles de expresión génica de candidatos a biomarcadores putativos en bovinos infectados con Mycobacterium avium subsp. paratuberculosis. Pathog Dis. (2016) 74:ftw022. doi: 10.1093/femspd/ftw022
34. Malvisi, M, Palazzo, F, Morandi, N, Lazzari, B, Williams, JL, Pagnacco, G, et al. Respuestas de la inmunidad innata bovina a mycobacterium avium subsp. Infección por paratuberculosis revelada por cambios en la expresión génica y los niveles de MicroRNA. PLoS Uno. (2016) 11:1–23. doi: 10.1371/journal.pone.0164461
35. Alonso-Hearn, M, Canive, M, Blanco-Vázquez, C, Torremocha, R, Balseiro, A, Amado, J, et al. El análisis de RNA-Seq de la válvula ileocecal y la sangre periférica del ganado Holstein infectado con Mycobacterium avium subsp. paratuberculosis reveló una desregulación de la vía de señalización CXCL8/IL8. Sci Rep. (2019) 9:14845. doi: 10.1038/s41598-019-51328-0
36. Blanco-Vázquez, C, Alonso-Hearn, M, Juste, RA, Canive, M, Iglesias, T, Iglesias, N, et al. La detección de formas latentes de infección por Mycobacterium avium subsp. paratuberculosis mediante ELISA basados en biomarcadores del huésped mejora en gran medida la sensibilidad diagnóstica de la paratuberculosis. PLoS Uno. (2020) 15:e0236336. doi: 10.1371/journal.pone.0236336
37. Blanco-Vázquez, C, Alonso-Hearn, M, Iglesias, N, Vázquez, P, Juste, RA, Garrido, JM, et al. Uso del casete de unión a ATP de la subfamilia a miembro 13 (ABCA13) para la detección sensible de formas patológicas focales de Paratuberculosis bovina subclínica. Front Vet Sci. (2022) 9:1–14. doi: 10.3389/fvets.2022.816135
38. Espinosa, J, de la Morena, R, Benavides, J, García-Pariente, C, Fernández, M, Tesouro, M, et al. Evaluación de la respuesta proteica en fase aguda asociada a las diferentes formas patológicas de paratuberculosis bovina. Animales. (2020) 10:1–11. doi: 10.3390/ani10101925
39. Park, H-T, Bin, PW, Kim, S, Lim, J-S, no, G y Yoo, HS. Revelación de respuestas inmunitarias en células THP-1 infectadas por Mycobacterium avium subsp. paratuberculosis mediante secuenciación de ARN de una sola célula. PLoS Uno. (2021) 16:e0254194. doi: 10.1371/journal.pone.0254194
40. Duttagupta, R, Jiang, R, Gollub, J, Getts, RC y Jones, KW. Impacto de los miRNAs celulares en las firmas circulantes de biomarcadores de miRNAs. PLoS Uno. (2011) 6:E20769. doi: 10.1371/journal.pone.0020769
41. Chen, X, Ba, Y, Ma, L, Cai, X, Yin, Y, Wang, K, et al. Caracterización de microRNAs en suero: una nueva clase de biomarcadores para el diagnóstico de cáncer y otras enfermedades. Cell Res. (2008) 18:997–1006. DOI: 10.1038/CR.2008.282
42. Shaughnessy, RG, Farrell, D, Riepema, K, Bakker, D, y Gordon, SV. El análisis del suero bioalmacenado a partir de un modelo de infección bovina por mycobacterium avium subsp paratuberculosis confirma la notable estabilidad de los perfiles circulantes de mirna y define un repertorio de suero bovino. PLoS Uno. (2015) 10:1–22. doi: 10.1371/journal.pone.0145089
43. Farrell, D, Shaughnessy, RG, Britton, L, MacHugh, DE, Markey, B, y Gordon, SV. La identificación de MiRNA circulante en suero bovino y su potencial como nuevos biomarcadores de infección temprana por mycobacterium avium subsp paratuberculosis. PLoS Uno. (2015) 10:1–22. doi: 10.1371/journal.pone.0134310
44. Miretti, S, Lecchi, C, Ceciliani, F y Baratta, M. MicroARN como biomarcadores para la salud y el bienestar animal en el ganado. Front Vet Sci. (2020) 7:578193. doi: 10.3389/fvets.2020.578193
45. De Buck, J, Shaykhutdinov, R, Barkema, HW, y Vogel, HJ. Perfil metabolómico en bovinos infectados experimentalmente con Mycobacterium avium subsp. paratuberculosis. PLoS Uno. (2014) 9:e111872. doi: 10.1371/journal.pone.0111872
46. Tata, A, Pallante, I, Massaro, A, Miano, B, Bottazzari, M, Fiorini, P, et al. Perfiles metabolómicos séricos del ganado lechero infectado e infeccioso por paratuberculosis mediante espectrometría de masas ambiental. Front Vet Sci. (2021) 7:625067. doi: 10.3389/fvets.2020.625067
47. Taylor, EN, Beckmann, M, Hewinson, G, Rooke, D, Mur, LAJ y Koets, AP. Cambios metabolómicos en ácidos grasos poliinsaturados y eicosanoides como biomarcadores de diagnóstico en novillas Holstein-Friesian inoculadas con Mycobacterium avium ssp. paratuberculosis (MAP). Res. Veterinaria. (2022) 53:68. doi: 10.1186/s13567-022-01087-0
48. Taylor, EN, Beckmann, M, Villarreal-Ramos, B, Vordermeier, HM, Hewinson, G, Rooke, D, et al. Los cambios metabolómicos en novillas Holstein-frisonas naturalmente infectadas por mapas indican una reprogramación bioquímica inmunológicamente relacionada. Meta. (2021) 11:727. doi: 10.3390/metabo11110727
49. Coutinho, C, y Somoza, Á. Sensores de microARN basados en nanopartículas de oro. Químico Bioanal Anal. (2019) 411:1807–24. doi: 10.1007/s00216-018-1450-7
50. Brito, LF, Oliveira, HR, McConn, BR, Schinckel, AP, Arrazola, A, Marchant-Forde, JN, et al. Fenotipado a gran escala del bienestar del ganado en los sistemas de producción comercial: una nueva frontera en la cría animal. Frente Genet. (2020) 11:1–32. doi: 10.3389/fgene.2020.00793
51. Drain, PK, Hyle, EP, Noubary, F, Freedberg, KA, Wilson, D, Bishai, WR, et al. Pruebas diagnósticas en el punto de atención en entornos con recursos limitados. Lancet infecta Dis. (2014) 14:239–49. doi: 10.1016/S1473-3099(13)70250-0
52. Omidfar, K, Khorsand, F, y Darziani, AM. Nuevas aplicaciones analíticas de nanopartículas de oro como marcaje en sensores basados en anticuerpos. Bioelectrón Biosens. (2013) 43:336–47. doi: 10.1016/j.bios.2012.12.045
53. Manessis, G, Gelasakis, AI y Bossis, I. Diagnóstico en el punto de atención para enfermedades de animales de granja: de los biosensores a los dispositivos integrados de laboratorio en chip. Biosensores. (2022) 12:455. doi: 10.3390/bios12070455
54. Bahadir, EB, y Sezgintürk, MK. Una revisión sobre los biosensores impedimétricos. Artif Cells Nanomed Biotechnol. (2016) 44:248–62. doi: 10.3109/21691401.2014.942456
55. Tribolet, L, Kerr, E, Cowled, C, Bean, AGD, Stewart, CR, Dearnley, M, et al. Biomarcadores de microARN para enfermedades infecciosas: de la investigación básica a la biodetección. Microbiol frontal. (2020) 11:1197. doi: 10.3389/fmicb.2020.01197
56. Zhao, G, Wang, H, Hou, P, He, C y He, H. Detección visual rápida de Mycobacterium avium subsp. Paratuberculosis por amplificación de la polimerasa recombinasa combinada con una tira reactiva de flujo lateral. J Vet Sci. (2018) 19:242–50. doi: 10.4142/jvs.2018.19.2.242
57. Agrawal, A, Varshney, R, Gattani, A, Kirthika, P, Khan, MH, Singh, R, et al. Biosensor inmunocromatográfico basado en nanopartículas de oro para el diagnóstico rápido de la infección por paratuberculosis de la subespecie Mycobacterium avium utilizando proteína recombinante. J Métodos de Microbiol. (2020) 177:106024. doi: 10.1016/j.mimet.2020.106024
58. Jain, M, Singh, AK, Kumar, A, Gupta, S, Polavarapu, R, y Sohal, JS. Rendimiento comparativo de diferentes antígenos en la plataforma de ensayo de flujo lateral (LFA) para el serodiagnóstico rápido de la paratuberculosis. J Métodos de Microbiol. (2022) 192:106367. doi: 10.1016/j.mimet.2021.106367
Palabras clave: Paratuberculosis, ensayos de flujo lateral, biosensores, Mycobacterium avium subsp. paratuberculosis, bovinos, biomarcadores
Cita: Alonso-Hearn M, Ballesteros A, Navarro A, Badia-Bringué G y Casais R (2023) Ensayos de flujo lateral para el diagnóstico de paratuberculosis bovina. Frente. Vet. Sci. 10:1257488. doi: 10.3389/fvets.2023.1257488
Recibido: 25 de julio de 2023; Aceptado: 27 de septiembre de 2023;
Publicado: 12 octubre 2023.
Editado por:
Cleverson D. Souza, Universidad de Florida, Estados Unidos
Revisado por:
Rajesh Kumar, Universidad de Ciencias Veterinarias y Animales Lala Lajpat Rai, India
Gaber S. Abdellrazeq, Universidad Estatal de Washington, Estados Unidos
Copyright © 2023 Alonso-Hearn, Ballesteros, Navarro, Badia-Bringué y Casais. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Marta Alonso-Hearn, malonso@neiker.eus
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía