Desarrollo de nuevos biomarcadores de la calidad de los espermatozoides en bovinos
Desarrollo de nuevos biomarcadores de la calidad de los espermatozoides en bovinos
 Lindsey Fallon1
Lindsey Fallon1  Edgar Díaz-Miranda1,2
Edgar Díaz-Miranda1,2  Lauren Hamilton1
Lauren Hamilton1  Peter Sutovsky1,3,4
Peter Sutovsky1,3,4  Michal Zigo1
Michal Zigo1  Thomas E. Spencr1
Thomas E. Spencr1  M. Sofía Ortega1*†
M. Sofía Ortega1*†- 1División de Ciencias Animales, Universidad de Missouri, Columbia, MO, Estados Unidos
- 2Departamento de Veterinaria, Universidade Federal de Viçosa, Viçosa, MG, Brasil
- 3Departamento de Obstetricia, Universidad de Missouri, Columbia, MO, Estados Unidos
- 4Departamento de Ginecología y Salud de la Mujer, Universidad de Missouri, Columbia, MO, Estados Unidos
Existe una necesidad actual de nuevos biomarcadores de la calidad de los espermatozoides, que identifiquen de manera consistente y correcta los espermatozoides que contribuirán con éxito al desarrollo embrionario posterior. Esto podría mejorar la estandarización del análisis de semen, disminuir la mortalidad embrionaria temprana y utilizar estos biomarcadores como una herramienta de selección antes de atender a las hembras. En este estudio se utilizaron técnicas de imagen para identificar posibles biomarcadores de la calidad del esperma, utilizando toros previamente clasificados como de alto (n = 4) o bajo (n = 4) en la producción de blastocistos in vitro. Los espermatozoides se evaluaron antes y después de un protocolo de purificación de gradiente, para comprender cómo las poblaciones de células se ven afectadas por dichos protocolos y pueden diferir entre el uso in vivo e in vitro. Las muestras previas al gradiente de toros de bajo rendimiento tuvieron una mayor incidencia de daño en el ADN, aunque se encontró que las muestras posteriores al gradiente de toros de alto rendimiento tenían una mayor incidencia de daño en el ADN. Al evaluar la morfología mediante microscopía fluorescente, los defectos más prevalentes en las muestras de pregradiente de toros de alto rendimiento fueron defectos en la cola, que se eliminan con éxito durante el proceso de purificación. Los defectos más prevalentes en las muestras de pre-gradiente de sementales de bajo rendimiento fueron defectos agresomados localizados en la cabeza, que se introducirían en un ovocito tras la fecundación y podrían perjudicar el desarrollo embrionario. Se empleó la citometría de flujo basada en imágenes (IBFC) para cuantificar la prevalencia de defectos con el fin de evaluar un mayor tamaño muestral, disminuyendo la variabilidad que existe en las evaluaciones manuales. Utilizando IBFC, se identificaron nuevamente defectos de agresoma en las cabezas de los espermatozoides de toros de bajo rendimiento. Las muestras post-gradiente de toros de bajo rendimiento tuvieron una incidencia significativamente mayor (p < 0,05) de defectos agresomados que las muestras post-gradiente de toros de alto rendimiento. Además, se utilizó IBFC para evaluar la viabilidad de los espermatozoides después de la purificación en gradiente. Se identificaron distintas poblaciones de espermatozoides. Los toros de alto rendimiento tenían más espermatozoides en la población considerada más viable que los toros de bajo rendimiento. Este estudio demostró que los defectos de los espermatozoides varían en las poblaciones antes y después de la purificación del gradiente, lo que indica que puede ser beneficioso evaluar por separado el semen para su uso in vivo e in vitro. Además, se identificó un defecto prevalente en sementales de bajo rendimiento que podría explicar una discrepancia entre la fertilización exitosa y el desarrollo embrionario. Por lo tanto, dilucidar un mal funcionamiento regulado por el padre, que podría afectar potencialmente el desarrollo embrionario temprano.
Introducción
En la actualidad existe una necesidad imperiosa de identificar biomarcadores fiables de la calidad de los espermatozoides en el ganado bovino. Hasta hace pocos años, las evaluaciones de espermatozoides durante el procesamiento del semen solo incluían la evaluación manual de las características morfológicas crudas y la motilidad. Aunque las evaluaciones basadas en microscopía proporcionan información valiosa sobre la capacidad de los espermatozoides para alcanzar y fertilizar un ovocito, no pueden diferenciar qué espermatozoides contribuirán a un embrión viable más allá de la penetración de la membrana vitelina. Además, el análisis manual de semen es subjetivo y carece de estandarización entre instalaciones y técnicos (1).
La mortalidad embrionaria temprana es un factor primario que contribuye a la pérdida económica en la industria del ganado lechero, ya que hasta el 50% de la pérdida de preñez ocurre dentro de los primeros 7 días después de la fertilización (2). El costo de la pérdida de un solo embarazo se ha estimado en aproximadamente $555 en los Estados Unidos, pero puede variar mucho según el país de producción, y se ha estimado que supera los 5,000 pesos en México (3, 4). Una identificación más precisa de la fertilidad del toro podría ayudar a mejorar este problema, ya que un toro exhibe un gran impacto en el éxito del embarazo durante la fertilización, el desarrollo embrionario preimplantacional, la elongación del conceptus y la placentación (5, 6). Ningún bioensayo por sí solo puede clasificar con precisión la fertilidad de los torales, sin embargo, una combinación de múltiples evaluaciones proporciona una correlación con la capacidad de un toro para producir con éxito un embarazo viable (7, 8).
En los últimos años, el uso de técnicas como el análisis de espermatozoides asistido por ordenador (CASA) y la citometría de flujo han permitido cuantificar de forma más objetiva la calidad del semen (8). El sistema CASA incorpora videos de microscopía de espermatozoides para entrenar programas de software de computadora para evaluar la concentración, motilidad y morfología de los espermatozoides (1). Aunque este sistema reduce el error del técnico en la evaluación manual, los estudios con muestras humanas han demostrado que la precisión de CASA disminuye con la disminución de las concentraciones de espermatozoides y, por lo tanto, con menos células por campo de visión (1, 9). La literatura previa ha descrito la implementación de análisis citométricos de flujo con espermatozoides marcados con fluorescencia en clínicas de fertilidad humana como una forma de aliviar la variación en la precisión debido a la concentración (1, 10, 11). Con esta tecnología, se pueden analizar con precisión decenas de miles de espermatozoides por muestra en busca de una o más características de interés en cuestión de minutos, lo que aumenta significativamente el tamaño de la muestra y disminuye la variabilidad de la evaluación (11). El análisis de espermatozoides por citometría de flujo se está elevando aún más mediante la implementación de algoritmos de aprendizaje automático, utilizados tanto con sondas fluorescentes como con análisis sin marcas, en citometría de flujo convencional o basada en imágenes (12).
Un marcador importante de la calidad del esperma en muestras vivas es la integridad acrosómica, que comúnmente se evalúa utilizando aglutinina (PNA) de maní (Arachis hypogaea) conjugada con fluorescencia, una lectina que se une a los restos de azúcar específicamente presentes en la membrana acrosómica externa (13-15). Recientemente, la distribución de zinc (Zn2+) El eflujo iónico se ha utilizado para monitorear el progreso de la capacitación de los espermatozoides en muestras vivas y se ha asociado con diversos grados de fertilidad masculina (13). Esta correlación con el estado de fertilidad puede deberse a la regulación por parte del zinc de los canales de protones HVCN1 y los canales de calcio Catsper, que son en gran medida responsables de la hiperactivación de la motilidad de los espermatozoides que se logra simultáneamente con la capacitación de los espermatozoides (13, 16). Además, se ha encontrado que los espermatozoides de toro subfértiles e infértiles exhiben una mayor ubiquitinación que puede ser contribuida por el sistema ubiquitina-proteasoma (UPS) junto con la agregación de proteínas durante la espermatogénesis en los testículos y la maduración de los espermatozoides en el epidídimo (15, 17). Además, el aumento de la ubiquitinación de los espermatozoides también se ha correlacionado positivamente con el daño al ADN (15, 18). La proporción de espermatozoides que presentan biomarcadores de fertilidad negativos puede variar ampliamente entre eyaculados. Sin embargo, a través de técnicas de procesamiento de espermatozoides, como la purificación en gradiente, que se usa comúnmente en preparación para la fertilización in vitro (FIV), muchas de estas células se pueden eliminar de la muestra. Por lo tanto, es beneficioso evaluar los espermatozoides tanto antes como después de las técnicas de procesamiento para obtener una mejor comprensión de las diferencias entre la población inicial de espermatozoides y la población de espermatozoides purificados y qué tan bien se pueden eliminar las células defectuosas de la muestra (19).
El uso de biomarcadores efectivos independientes de la tasa de concepción del padre (SCR) podría resultar más beneficioso para la industria debido a que la SCR se determina por embarazos confirmados en el día 70-75 de gestación (20). La SCR se define como la probabilidad de que una determinada unidad de semen de un toro específico dé lugar a una preñez viable en comparación con un toro promedio, y se asigna solo después de que se hayan producido los servicios de AI 300 dentro de un período de 4 años, lo que impide su uso para sementales más jóvenes (21). Un valor positivo de SCR indica un aumento de la fertilidad y un valor negativo indica una disminución de la fertilidad. Por lo tanto, la identificación de biomarcadores independientes de la SCR también permitiría que los biomarcadores se utilizaran como una herramienta de selección de sementales jóvenes antes de atender a las hembras.
Estudios previos en nuestro laboratorio han demostrado que los sementales varían en su capacidad para producir embriones en un sistema de cultivo in vitro, independientemente de su SCR (22). A continuación, se seleccionaron sementales que tenían un rendimiento alto o bajo en la producción de embriones, con valores variables de SCR, para experimentos posteriores con el fin de dilucidar los mecanismos que contribuían a esta variación. No se observaron diferencias entre los grupos de sementales en su capacidad para fertilizar eficazmente los ovocitos y alcanzar la etapa pronuclear, aunque hubo diferencias en la competencia de desarrollo hasta la etapa de blastocisto. En la etapa de desarrollo de 2 a 6 células, los embriones producidos por toros de bajo rendimiento exhibieron un aumento tanto en la producción de especies reactivas de oxígeno (ROS) como en la actividad autofágica en comparación con los embriones producidos por toros de alto rendimiento, lo que indica que estos embriones comienzan a desarrollarse bajo un mayor estrés celular (23).
Estos datos hacen que la evaluación de espermatozoides de toros de alto y bajo rendimiento sea un modelo ideal para identificar nuevos biomarcadores de fertilidad in vitro de toros, independientemente de su SCR. Por lo tanto, el presente estudio buscó investigar si los espermatozoides de toros con diferentes capacidades de producción embrionaria tienen diferencias identificables que podrían ser explotadas para el desarrollo de biomarcadores. Al utilizar este modelo, nuestro objetivo es identificar nuevas características asociadas con la fertilidad de los espermatozoides in vitro en el ganado y dilucidar nuevos mecanismos de contribución paterna que impulsan la variación en el desarrollo embrionario.
Materiales y métodos
Producción embrionaria
Todos los medios para la recolección y maduración de los ovocitos, así como para la producción embrionaria in vitro, se prepararon como se describió anteriormente (6, 24). Brevemente, se recolectaron complejos cúmulo-ovocito (COC) de ovarios derivados de mataderos. Se seleccionaron AOC con al menos tres capas de células cúmulos compactas y citoplasma homogéneo y se colocaron en un medio de maduración de ovocitos calentado a 38,5 °C y equilibrado con aire que contenía 5% (v/v) de CO2. Los AOC, en grupos de 50, se dejaron madurar durante aproximadamente 22 h antes de la fertilización. Las pajuelas de semen utilizadas en todos los experimentos fueron regaladas por Select Sires Inc. (Great Plains, OH, Estados Unidos) y se procesaron en la misma casa comercial. El semen se recolectó de toros Holstein a los 28 meses de edad en promedio. Se seleccionaron cuatro toros de alto rendimiento y cuatro de bajo rendimiento para los experimentos de este estudio con base en la clasificación previa como de alta o baja capacidad para producir embriones in vitro (22). Los espermatozoides se prepararon para la fecundación como se ha descrito anteriormente (6, 24) y se diluyeron en medio de fecundación (FIV-TALP) hasta una concentración final de 1 × 106/mL en la placa de fertilización. Los ovocitos maduros y los espermatozoides se incubaron juntos durante 18-20 h a 38,5 °C con aire que contenía un 5% (v/v) de CO2, tras lo cual, se extrajeron las células del cúmulo y los cigotos putativos se colocaron en un medio de cultivo de líquido oviductal sintético (SOF-BEII) en un ambiente controlado [38,5 °C con una atmósfera humidificada de 5% (v/v) CO₂, 5% (v/v) O₂ y 90% (v/v) N₂]. Las tasas de escisión se evaluaron al tercer día de cultivo embrionario [66-72 h después de la inseminación [HPI]] y las tasas de blastocisto se evaluaron por la mañana en el octavo día de cultivo embrionario (186-192 HPI). Los datos de desarrollo se recogieron a lo largo de 47 rondas de producción embrionaria y se analizaron utilizando un modelo mixto lineal generalizado en el Sistema de Análisis Estadístico versión 9.4 (SAS Institute Inc., Cary, NC, Estados Unidos). Los datos se presentan como medias de mínimos cuadrados (medias LS) ± medias de error estándar (SEM). Las diferencias en las medias se identificaron utilizando la opción pdiff de LSMEANS.
Preparación del semen para el análisis
Para los análisis de espermatozoides se utilizaron pajuelas de semen de los mismos sementales utilizados para el desarrollo embrionario. Todas las pajuelas de semen se descongelaron en un baño de agua a 37 °C durante 40-45 s. Concomitantemente, para las muestras que se sometieron a purificación en gradiente, se pipetearon suavemente 600 μL de gradiente de capa superior de densidad del 50% en 600 μL de gradiente de capa inferior de densidad del 90% (Isolate™, Irvine Scientific), en un tubo de microcentrífuga de 1,5 mL. El semen se extruyó de la paja en el tubo de gradiente y se centrifugó a 700 × g durante 5 min. El gránulo de espermatozoides (100 μL) se extrajo del fondo del tubo, se colocó en un tubo Eppendorf que contenía 1 mL de medio Hepes-TALP tibio (6) y se centrifugó nuevamente a 700 × g durante 3 min. Este paso de lavado se repitió una vez más, para un total de dos lavados en Hepes-TALP por muestra. Para las muestras que no se sometieron a purificación en gradiente, el semen se extruyó de la paja directamente en Hepes-TALP caliente a 37 °C y se lavó dos veces como se describió anteriormente.
Evaluación de daños en el ADN
La integridad del ADN se evaluó utilizando el kit de detección de muerte celular in situ (Roche Diagnostics, Catálogo n 11684809910). Brevemente, los espermatozoides fijos se colocaron en solución salina tamponada con fosfato (PBS) en cubreobjetos recubiertos de poli-L-lisina para que se adhirieran durante 5 minutos. Posteriormente, las células se permeabilizaron durante 40 min a temperatura ambiente (RT) utilizando PBS con Triton X-0 (PBST) al 01,100%. Después de la permeabilización, las células se incubaron en la solución de tinción proporcionada por el fabricante durante 1 h a 37 °C en una cámara de humedad protegida de la luz. A continuación, las células se contratiñeron con 4′,6-diamidino-2-fenilindol (DAPI, 1:200) durante 15 min en RT antes de lavarse durante 5 min en PBS. Por último, los cubreobjetos se montaron en portaobjetos de vidrio utilizando medios de montaje Vectashield (Vector Laboratories, Burlingame, CA, Estados Unidos) y se sellaron con esmalte de uñas transparente. Se analizaron un mínimo de 200 células por muestra con un aumento de 40X y las imágenes se registraron con un microscopio Nikon Eclipse 800 (Nikon Instruments, Melville, NY, Estados Unidos) equipado con una cámara Retiga QI-R6 (Teledyne QImaging, Surrey, BC, Canadá) operada por MetaMorph 7.10.2.240. software (Molecular Devices, San José, CA, Estados Unidos). Para todos los toros, se realizaron evaluaciones de daños en el ADN tanto en la población total de espermatozoides (pre-gradiente) como en la fracción de gránulos separados por gradiente (post-gradiente) y se definieron como con daño en el ADN si se observaba un marcaje TUNEL positivo. Los datos fueron analizados con un modelo de regresión logística binomial, utilizando el procedimiento GLIMMIX de SAS. Los datos se presentan como medias de mínimos cuadrados (medias LS) ± medias de error estándar (SEM). Las diferencias en las medias se identificaron utilizando la opción pdiff de LSMEANS.
Evaluación morfológica mediante microscopía fluorescente
Los espermatozoides fijos se colocaron en tampón KMT (100 mM KCl, 2 mM MgCl2, 10 mM de Tris-HCl, 5 mM de EGTA, pH 7) en cubreobjetos recubiertos de poli-L-lisina para adherir durante 20 min. A continuación, las células se incubaron en una solución de tinción durante 30 minutos a RT protegidas de la luz que contenía sondas fluorescentes que marcaban las proteínas agregadas (kit de detección de agresomas de proteostato, ENZ-51035-K100, 1:2.000), el acrosoma (PNA-FITC, 1:200) y el ADN (DAPI, 1:200), diluidos en PBST. Posteriormente, los cubreobjetos se lavaron dos veces, durante 5 minutos cada uno con PBS, antes de montarlos en cubreobjetos de vidrio con medios de montaje Vectashield y sellarlos con esmalte de uñas transparente. Se obtuvieron imágenes de aproximadamente 110 células por muestra utilizando contraste de interferencia diferencial y epifluorescencia con un aumento de 100x. Las imágenes se grabaron con un microscopio Nikon Eclipse 800 (Nikon Instruments, Melville, NY, Estados Unidos) equipado con una cámara Retiga QI-R6 (Teledyne QImaging, Surrey, BC, Canadá) operada por MetaMorph 7.10.2.240. software (Molecular Devices, San José, CA, Estados Unidos). Se analizaron las siguientes regiones morfológicas para detectar la presencia de defectos: acrosoma (acrosomas interrumpido, ondulado o nudoso), nuclear/cabeza (cresta nuclear, vacuolas nucleares, cabeza cónica, cabeza microcefálica, cabeza macrocefálica, cabeza piriforme, cabeza separada, diadema y cabezas múltiples), pieza media de la cola (disrupción de la vaina mitocondrial, reflejo de la pieza media, cola de muñón, colas rotas y fractura) y pieza principal de la cola (cola fuertemente enrollada, reflejo de la pieza principal, cola abaxial, colas múltiples, cola rota y fractura); y se registró el porcentaje global de células afectadas por cada defecto morfológico. Para todos los toros, se realizaron evaluaciones morfológicas tanto de la población total de espermatozoides (pre-gradiente) como de la fracción de gránulos separados por gradiente (post-gradiente) utilizada para la FIV. Los datos se analizaron con un modelo de regresión logística binomial, utilizando el procedimiento GLIMMIX en SAS, los datos se presentan como medias de mínimos cuadrados (medias LS) ± media de error estándar (SEM). Las diferencias en las medias se identificaron utilizando la opción pdiff de LSMEANS.
Citometría de flujo basada en imágenes con muestras fijas
Después de la preparación del semen, los espermatozoides se fijaron en formaldehído al 2% durante 20 min antes de ser incubados posteriormente durante 30 min en la oscuridad a RT en una solución de tinción que contenía una sonda de agresoma (Proteostat Aggresome Detection Kit, ENZ-51035-K100, 1:10,000), PNA-FITC (1:2,500) y la tinción nuclear Hoescht 33,342 (1,1,000) diluida en PBST. Se utilizó la lectina PNA para validar que se había logrado la permeabilización, de modo que la sonda de agresoma pudiera dirigirse a los agregados de proteínas intracelulares. La fijación fue necesaria para este análisis debido al uso del kit de detección de agresomas de proteostato. Después de la tinción, las muestras se centrifugaron (700 × g, 5 min) para eliminar la solución de tinción y se resuspendieron en PBS para su análisis. A continuación, las muestras se analizaron con un citómetro de flujo por imágenes Amnis FlowSight (AMNIS Luminex Corporation, Austin, TX, Estados Unidos) equipado con un objetivo de microscopio de 20X (apertura numérica de 0,5) con una velocidad de obtención de imágenes de hasta 2.000 eventos/s. El líquido de la vaina era PBS, libre de Ca2+ y Mg2+. El tamaño del núcleo de flujo fue de 10 μm de diámetro y la velocidad fue de 66 mm/s, respectivamente. Las imágenes en bruto se adquirieron utilizando el software INSPIRE® (AMNIS Luminex Corporation). La cámara se ajustó a 1,0 μm por píxel del dispositivo de acoplamiento cargado. La dimensión de visualización de la imagen para el campo de visión era de 60 y 8 μm de profundidad de campo. Las muestras se analizaron utilizando tres láseres simultáneamente: una línea de 405 nm con una intensidad establecida en 10 mW; una línea de 488 nm con una intensidad fijada en 30 mW; y una línea de 785 nm (dispersión lateral) con una intensidad fijada en 50 mW. Un total de 18.000 a 23.000 eventos fueron evaluados por padre. El análisis de los datos de las imágenes en bruto se realizó con el software IDEAS® (Versión 6.3.23.0; AMNIS Luminex Corporation), donde las imágenes electrónicas se compensaron por el cruce de canales mediante el uso de controles de un solo color que se fusionaron para generar una matriz multicolor. A continuación, el archivo de matriz de compensación se aplicó a un archivo de imagen sin procesar (.rif) para crear un archivo de imagen con compensación de color (.cif). Se creó una población focalizada de espermatozoides mediante la activación de células utilizando Gradient RMS para el canal de campo claro. Los eventos de una sola celda se controlaron combinando el diagrama de dispersión de área × relación de aspecto del campo claro, desde el primer paso, con el del canal DAPI. Se utilizó una puerta de población de una sola célula para la visualización en histograma de las intensidades medias de píxeles por frecuencia para los siguientes canales: canales 1 y 9 (campo claro), canal 2 (fluorescencia verde (FITC, 505-560 nm) para capturar el marcaje acrosómico, canal 3 (fluorescencia naranja (544-570 nm) para capturar el etiquetado de agresoma (canal 6 (SSC) y canal 7 (fluorescencia azul (DAPI, 435-505 nm) para capturar el marcaje nuclear. A continuación, se utilizaron histogramas de intensidad para los canales individuales para controlar subpoblaciones con diferentes niveles de intensidad y conformaciones visuales. Se utilizó una región de intensidad de fluorescencia constante de 683 a 10.625 como puerta para cuantificar el contenido de agresomas (solo cabeza de espermatozoide y total) en todos los análisis. El porcentaje de espermatozoides que se encontraban dentro de la región de intensidad de fluorescencia de 683 a 10.625 para cada evaluación se analizó utilizando un modelo mixto lineal generalizado en SAS y se expresa como medias de mínimos cuadrados (medias LS) ± media de error estándar (SEM).
Citometría de flujo basada en imágenes con muestras vivas
Después de la preparación del semen, aproximadamente 5 millones de espermatozoides purificados en gradiente se resuspendieron en medio de lactato Tyrode tamponado con HEPES suplementado con alcohol polivinílico (TL-HEPES-PVA), que contenía 10 mM de lactato de sodio, 5,2 mM de piruvato de sodio, 11 mM de D-glucosa, 0,5 mM de MgCl2y alcohol polivinílico (PVA) al 0,01 % (p/v), y sin Ca2+ y HCO3− iones; pH = 7,2, t = 37°C. La siguiente combinación de sondas se añadió a la suspensión espermática a las concentraciones finales FluoZin-3, AM (1 μM), H33342 (18 μM), Yoduro de propidio (PI, 1 μg∙mL−1), y CellROX™ Deep Red (10 μM). Las muestras de esperma se dejaron incubar durante 40 minutos a 37 °C en la oscuridad.
Las muestras marcadas con fluorescencia se midieron con el mismo citómetro de flujo Amnis FlowSight Imaging utilizado en la evaluación previa de este estudio (AMNIS Luminex Corporation, Austin, TX, Estados Unidos) y como se describió anteriormente (13, 25). Para producir la resolución más alta, la configuración de la cámara fue de 1,0 μm por píxel del dispositivo de carga acoplada. Las muestras se analizaron utilizando cuatro láseres concomitantemente: una línea de 405 nm (20 mW), una línea de 488 nm (60 mW), una línea de 642 nm (75 mW), una línea de 785 nm (70 mW, dispersión lateral) y dos LED (32,57 y 19,30 mW respectivamente). Se observaron señales en los siguientes canales: canales 1 y 9 (campo claro), canal 2 (fluorescencia verde (FITC, 505-560 nm) para capturar el marcaje de zinc, canal 6 (SSC), canal 7 (fluorescencia azul (DAPI, 435-505 nm) para capturar el marcaje nuclear y canal 11 (fluorescencia infrarroja (AF647, DeepRed; 642-745 nm) para capturar el marcado ROS. Un total de 18.000 a 23.000 eventos fueron evaluados por padre, y los datos se analizaron utilizando el software IDEAS® (Versión 6.3.23.0; AMNIS Luminex Corporation, Austin, TX, Estados Unidos). Se utilizó una puerta de población unicelular enfocada con espermatozoides orientados hacia delante y hacia atrás (13) para la visualización en histograma de las intensidades medias de píxeles por frecuencia para los canales recogidos. Esta técnica de compuerta permitió uniformar la orientación de los espermatozoides que fueron analizados en análisis posteriores. A continuación, se utilizaron histogramas de intensidad de canales individuales para dibujar regiones de subpoblaciones con diferentes niveles de intensidad y confirmación visual. La intensidad del marcaje nuclear se utilizó para la normalización del histograma entre las muestras. Esta técnica de compuerta permitió aislar los espermatozoides en poblaciones en función de si eran positivos para el rasgo de interés (zinc, PI, ROS). El porcentaje de espermatozoides dentro de cada población se analizó mediante un modelo mixto lineal generalizado en SAS y se expresa como medias de mínimos cuadrados (medias LS) ± media de error estándar (SEM). Las diferencias en las medias se identificaron utilizando la opción pdiff de LSMEANS.
Resultados
Desarrollo embrionario
Las tasas de escisión y blastocisto se muestran en la Figura 1A. Las tasas de escisión de los embriones producidos por toros de alto rendimiento (76,73 ± 2,57%) fueron significativamente más altas (p = 0,029) que las tasas de escisión de los toros de bajo rendimiento (68,25 ± 2,74%). De manera similar, las tasas de blastocisto de embriones producidos por toros de alto rendimiento (29,04 ± 1,78%) fueron significativamente más altas (p = 0,001) que las tasas de blastocisto de sementales de bajo rendimiento (19,94 ± 1,90%).
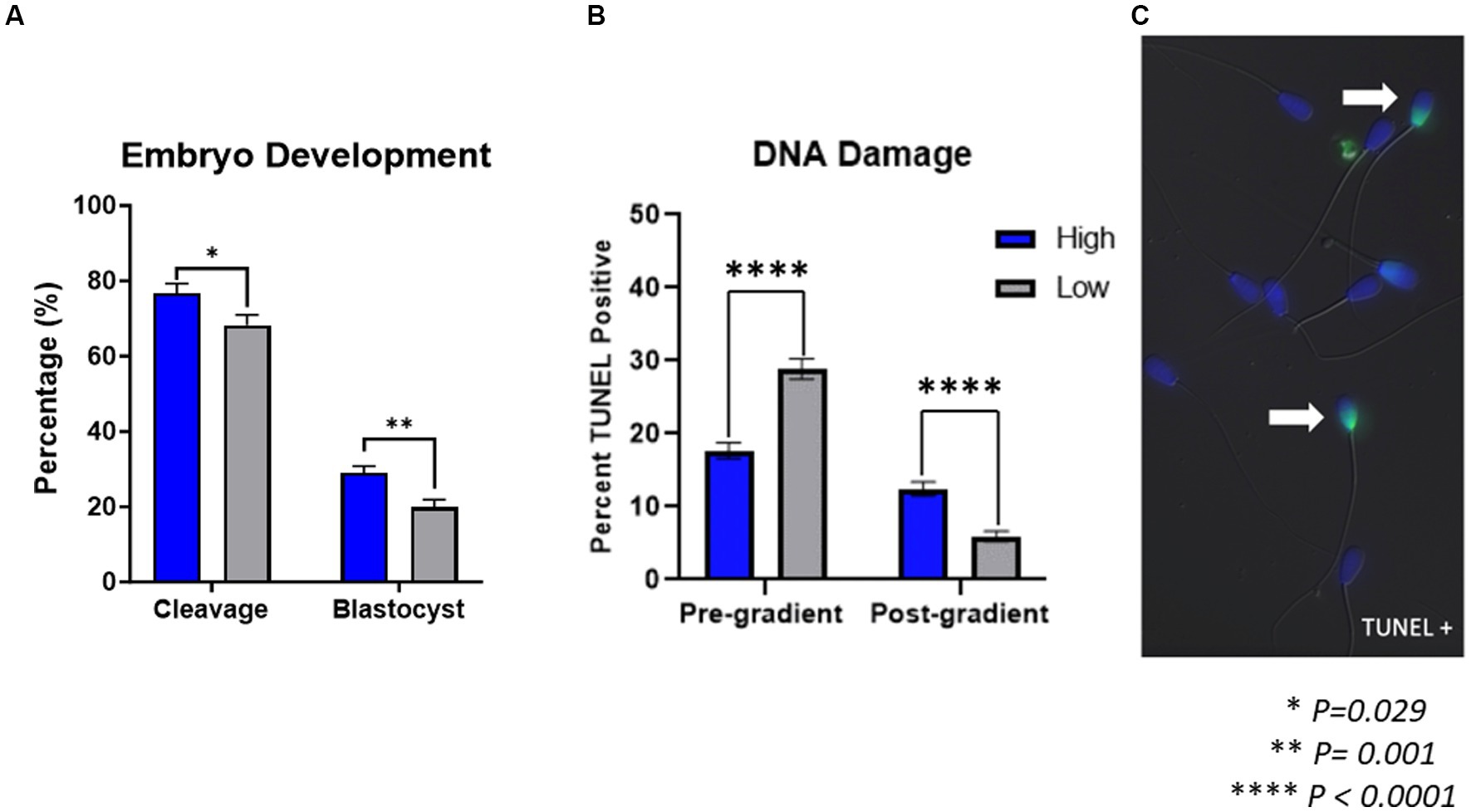 Figura 1. Desarrollo embrionario y daño en el ADN de los espermatozoides. (A) Los embriones producidos por toros de alto rendimiento tuvieron tasas de escisión (p = 0,029) y tasas de blastocisto (p = 0,001) significativamente más altas que los embriones producidos por toros de bajo rendimiento (n = 47 rondas de producción de embriones in vitro). (B) En las muestras previas a la purificación del gradiente, denominadas muestras pre-gradiente, hubo un aumento en el daño del ADN presente (p < 0.0001) en los espermatozoides de sementales de bajo rendimiento en comparación con los de alto rendimiento. Inversamente, en las muestras que siguieron a la purificación del gradiente, denominadas muestras post-gradiente, hubo un aumento en el daño del ADN presente (p < 0.0001) en los toros de alto rendimiento en comparación con los de bajo rendimiento (n = ~ 1,000 células por clasificación). (C) Imagen representativa de los espermatozoides TUNEL positivos.
Figura 1. Desarrollo embrionario y daño en el ADN de los espermatozoides. (A) Los embriones producidos por toros de alto rendimiento tuvieron tasas de escisión (p = 0,029) y tasas de blastocisto (p = 0,001) significativamente más altas que los embriones producidos por toros de bajo rendimiento (n = 47 rondas de producción de embriones in vitro). (B) En las muestras previas a la purificación del gradiente, denominadas muestras pre-gradiente, hubo un aumento en el daño del ADN presente (p < 0.0001) en los espermatozoides de sementales de bajo rendimiento en comparación con los de alto rendimiento. Inversamente, en las muestras que siguieron a la purificación del gradiente, denominadas muestras post-gradiente, hubo un aumento en el daño del ADN presente (p < 0.0001) en los toros de alto rendimiento en comparación con los de bajo rendimiento (n = ~ 1,000 células por clasificación). (C) Imagen representativa de los espermatozoides TUNEL positivos.
Daños en el ADN
El daño en el ADN presente en los espermatozoides de toros de alto o bajo rendimiento se muestra en la Figura 1. El porcentaje de espermatozoides TUNEL-positivos, lo que indica daño en el ADN, en las muestras antes de la purificación del gradiente aumentó significativamente (p < 0,0001) en las muestras de toros de bajo rendimiento (28,85% ± 1,37) en comparación con las de toros de alto rendimiento (17,67 ± 1,09%). Por el contrario, el porcentaje de espermatozoides positivos para TUNEL en las muestras después de la purificación en gradiente aumentó significativamente (p < 0,0001) en las muestras de toros de alto rendimiento (12,44 ± 0,95%) en comparación con las de sementales de bajo rendimiento (5,95 ± 0,71%).
Evaluación morfológica mediante microscopía fluorescente
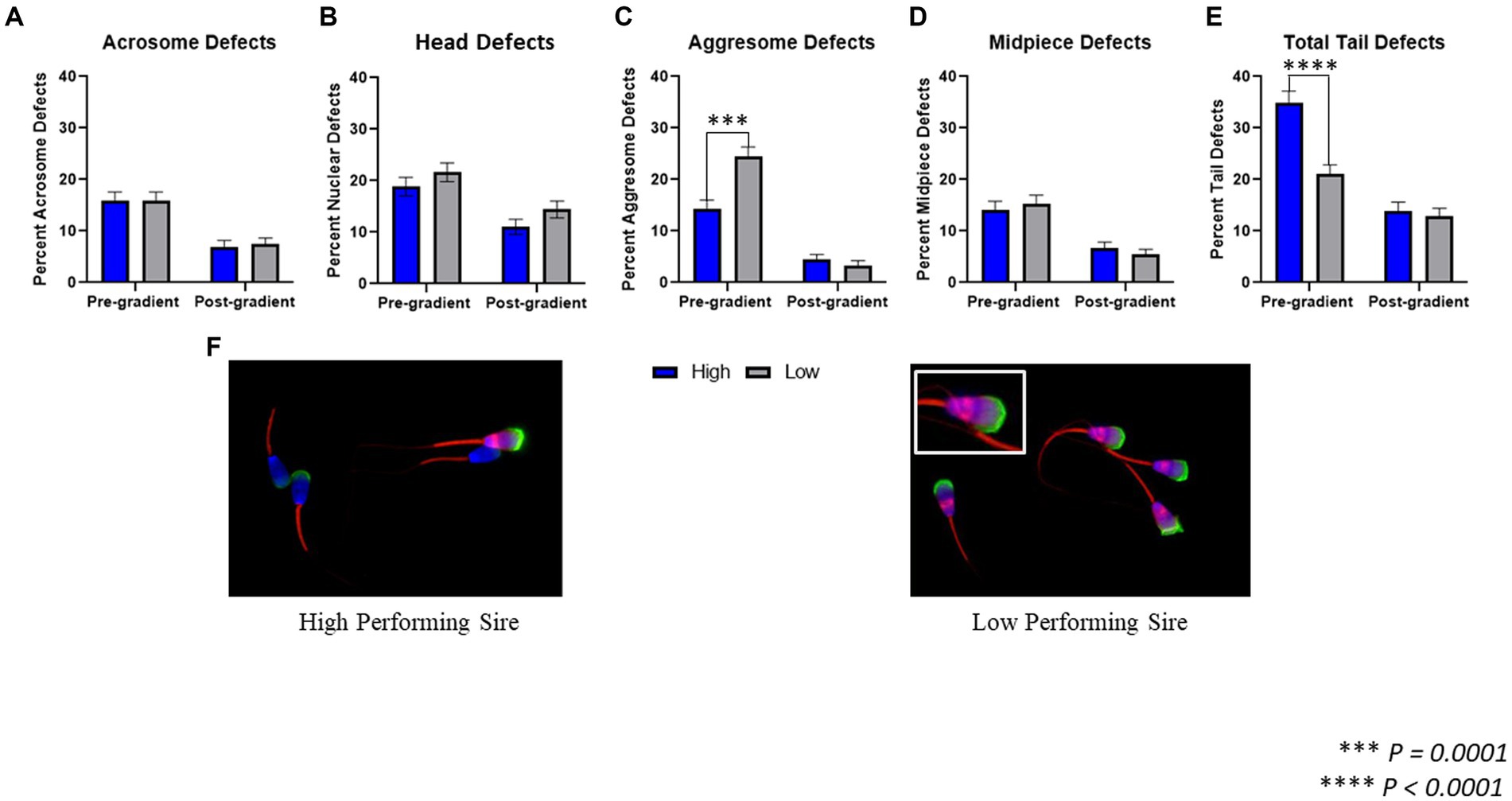
Se evaluaron las siguientes regiones morfológicas para detectar la presencia de defectos y/o acumulación de proteínas agregadas: acrosoma, núcleo/cabeza, pieza media y pieza principal de la cola (Figura 2). En las muestras previas al gradiente, no se observaron diferencias en los defectos acrosomales (p = 0,978) entre los toros de alto rendimiento (15,88 ± 1,69%) y los de bajo rendimiento (15,94 ± 1,62%). Tampoco hubo diferencias en los defectos nucleares (p = 0,284) o defectos en la pieza media (p = 0,601) entre los toros de alto rendimiento (18,88 ± 1,81%; 14,16 ± 1,62%) y los de bajo rendimiento (21,65 ± 1,83%; 15,35 ± 1,60%). En las muestras previas al gradiente, los toros de bajo rendimiento tuvieron una mayor incidencia de defectos agresomados en la cabeza de los espermatozoides (p = 0,0001; 24,41 ± 1,91%) en comparación con los toros de alto rendimiento (14,38 ± 1,63%). Por otra parte, los toros de alto rendimiento tuvieron un aumento de los defectos totales de la cola (p < 0,0001; 34,98 ± 2,20%) en comparación con los toros de bajo rendimiento (21,06 ± 1,81%).
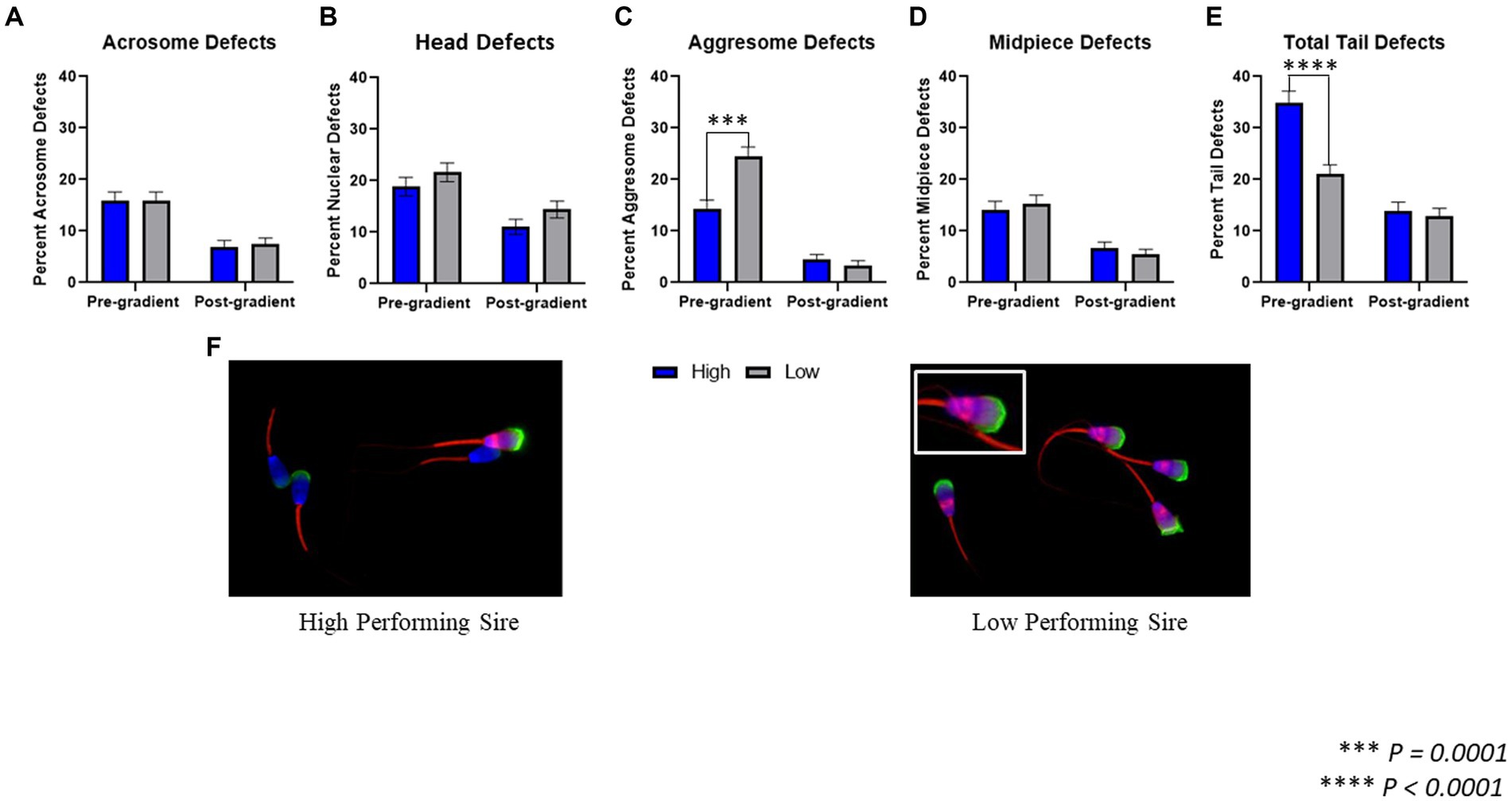 Figura 2. Evaluación morfológica microscopía fluorescente. (A) Al comparar los espermatozoides de toros de alto y bajo rendimiento antes de la purificación en gradiente, denominadas muestras pre-gradiente, así como muestras post-gradiente, no hubo diferencias significativas en la incidencia de defectos acrosomales (p = 0,978; p = 0,795). (B) Tanto en las muestras pre-gradiente como post-gradiente, no hubo diferencias en los defectos nucleares (p = 0,284; p = 0,132) entre toros de alto y bajo rendimiento. (C) En las muestras previas al gradiente, los toros de bajo rendimiento tuvieron una incidencia significativamente mayor de defectos agresome en la cabeza (p = 0,0001) en comparación con los toros de alto rendimiento, sin embargo, en las muestras posteriores al gradiente, no se observó diferencia entre los toros altos y bajos (p = 0,390). (D) Tanto en las muestras pre-gradiente como post-gradiente, no hubo diferencias en los defectos de la pieza media (p = 0,601; p = 0,401) entre toros de alto y bajo rendimiento. (E) En las muestras previas al gradiente, los toros de alto rendimiento tuvieron una incidencia significativamente mayor de defectos en la cola (p < 0,0001) en comparación con los toros de bajo rendimiento, sin embargo, en las muestras posteriores al gradiente, no se observó diferencia entre los toros altos y bajos (p = 0,623; n = ~450 celdas por clasificación para todas las evaluaciones). (F) Imágenes representativas de espermatozoides marcados con fluorescencia de un toro de alto rendimiento (izquierda) y un toro de bajo rendimiento (derecha).
Figura 2. Evaluación morfológica microscopía fluorescente. (A) Al comparar los espermatozoides de toros de alto y bajo rendimiento antes de la purificación en gradiente, denominadas muestras pre-gradiente, así como muestras post-gradiente, no hubo diferencias significativas en la incidencia de defectos acrosomales (p = 0,978; p = 0,795). (B) Tanto en las muestras pre-gradiente como post-gradiente, no hubo diferencias en los defectos nucleares (p = 0,284; p = 0,132) entre toros de alto y bajo rendimiento. (C) En las muestras previas al gradiente, los toros de bajo rendimiento tuvieron una incidencia significativamente mayor de defectos agresome en la cabeza (p = 0,0001) en comparación con los toros de alto rendimiento, sin embargo, en las muestras posteriores al gradiente, no se observó diferencia entre los toros altos y bajos (p = 0,390). (D) Tanto en las muestras pre-gradiente como post-gradiente, no hubo diferencias en los defectos de la pieza media (p = 0,601; p = 0,401) entre toros de alto y bajo rendimiento. (E) En las muestras previas al gradiente, los toros de alto rendimiento tuvieron una incidencia significativamente mayor de defectos en la cola (p < 0,0001) en comparación con los toros de bajo rendimiento, sin embargo, en las muestras posteriores al gradiente, no se observó diferencia entre los toros altos y bajos (p = 0,623; n = ~450 celdas por clasificación para todas las evaluaciones). (F) Imágenes representativas de espermatozoides marcados con fluorescencia de un toro de alto rendimiento (izquierda) y un toro de bajo rendimiento (derecha).
En las muestras post-gradiente, no hubo diferencias en defectos acrosómicos (p = 0,795) o defectos nucleares (p = 0,132) entre toros de alto rendimiento (6,98 ± 1,21%; 11,04 ± 1,49%) y de bajo rendimiento (7,43 ± 1,24%; 14,41 ± 1,67%). Del mismo modo, no hubo diferencias en los defectos de agresoma (p = 0,390) ni en los defectos de la pieza media (p = 0,401) entre los toros de alto rendimiento (4,5 ± 0,98%; 6,76 ± 1,12%) y los de bajo rendimiento (3,38 ± 0,86%; 5,41 ± 1,07%). Finalmente, en las muestras post-gradiente, tampoco hubo diferencia en los defectos totales de la cola (p = 0,623) entre los toros de alto rendimiento (13,96 ± 1,65%) y los de bajo rendimiento (12,84 ± 1,59%).
Evaluación por citometría de flujo basada en imágenes
Muestras fijas
Para cuantificar el contenido de agresomas en espermatozoides de toros de alto y bajo rendimiento, las muestras fijas se tiñeron y analizaron mediante citometría de flujo basada en imágenes (Figura 3; Figura complementaria S1). En las muestras previas a la purificación en gradiente, no hubo diferencia (p = 0,818) entre el contenido de agresomas en las cabezas de los espermatozoides de los toros de bajo rendimiento (58,53 ± 8,53%) en comparación con los toros de alto rendimiento (55,53 ± 8,53%). Además, no hubo diferencia (p = 0,132) entre el contenido total de agresomas en los espermatozoides de los toros de bajo rendimiento (94,42 ± 1,47%) en comparación con los toros de alto rendimiento (97,71 ± 1,47%; Figura complementaria S1A). En las muestras que siguieron a la purificación en gradiente, los espermatozoides de toros de bajo rendimiento tuvieron una incidencia significativamente mayor (p = 0,032) de contenido de agresomas en sus cabezas (55,78 ± 7,24%) en comparación con los espermatozoides de toros de alto rendimiento (28,68 ± 9,23%). Por otra parte, tampoco hubo diferencia (p = 0,217) entre el contenido total de agresomas en los espermatozoides de los toros bajos (90,4 ± 2,39%) en comparación con los toros altos (95,35 ± 3,05%; Figura suplementaria S1B), que indica un etiquetado consistente en la pieza media de la cola.
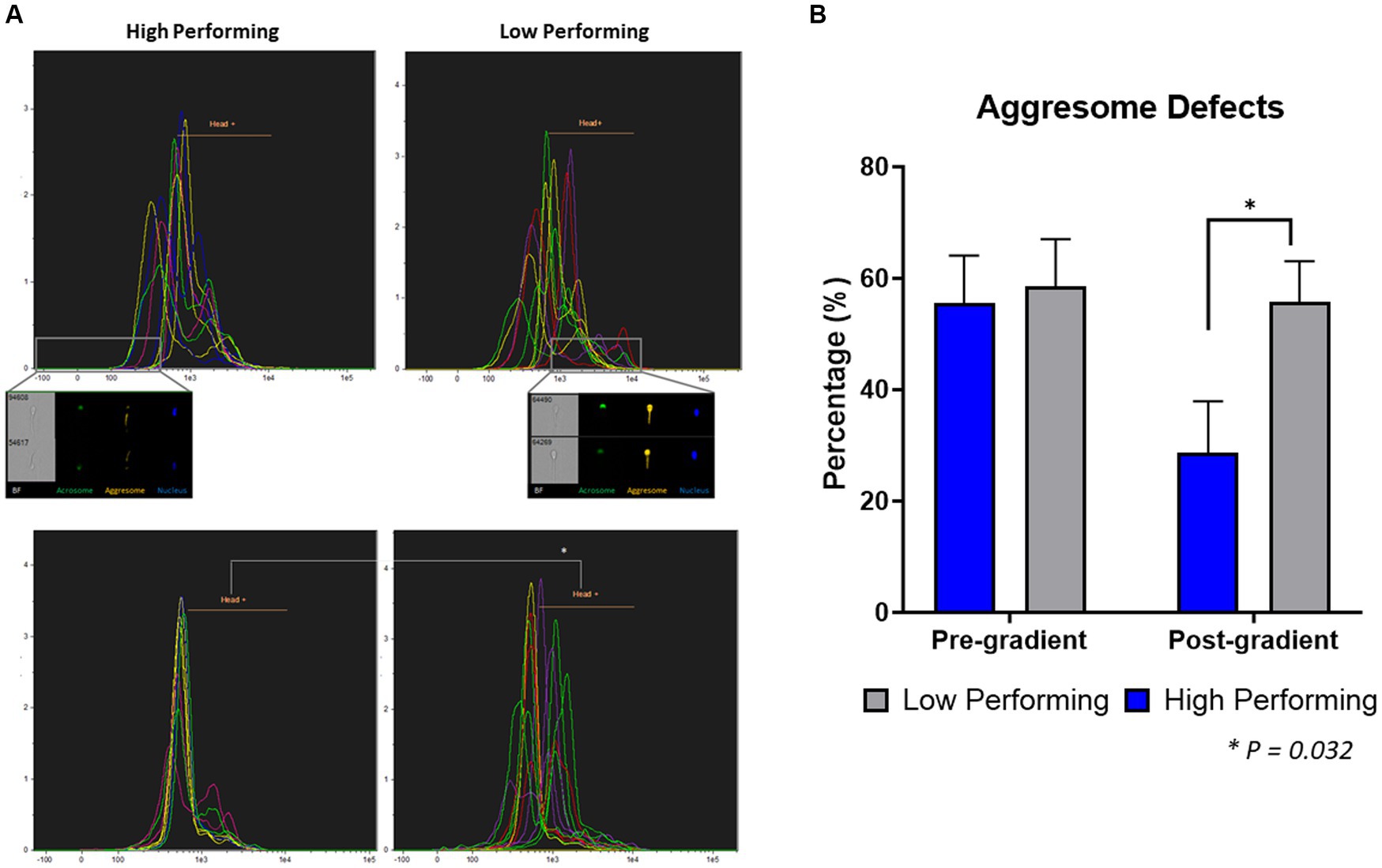 Figura 3. Cuantificación de defectos agresomas en cabezas de espermatozoides. (A) En las muestras previas al gradiente, no hubo diferencia en el porcentaje de espermatozoides con defectos agresomados en la cabeza (p = 0,818) entre los toros de alto y bajo rendimiento. (B) En las muestras posteriores al gradiente, los toros de bajo rendimiento tuvieron una incidencia significativamente mayor de defectos agresomados en la cabeza (p = 0,03) en comparación con los de alto rendimiento (n = ~ 90.000 células por clasificación).
Figura 3. Cuantificación de defectos agresomas en cabezas de espermatozoides. (A) En las muestras previas al gradiente, no hubo diferencia en el porcentaje de espermatozoides con defectos agresomados en la cabeza (p = 0,818) entre los toros de alto y bajo rendimiento. (B) En las muestras posteriores al gradiente, los toros de bajo rendimiento tuvieron una incidencia significativamente mayor de defectos agresomados en la cabeza (p = 0,03) en comparación con los de alto rendimiento (n = ~ 90.000 células por clasificación).
Muestras en vivo
Para evaluar la viabilidad de los espermatozoides vivos después de la purificación en gradiente, los espermatozoides se tiñeron conjuntamente con sondas de iones de zinc, viabilidad y ROS; y se analizaron mediante citometría de flujo basada en imágenes (Figura 4; Figura complementaria S2). Las poblaciones de espermatozoides en estas muestras se segregaron de la siguiente manera: Población 1 (marcaje de zinc en toda la cabeza + pieza media + parte principal, PI-, ROS+), Población 2 (marcaje de zinc en el acrosómico + pieza media, PI+, ROS-), Población 3 (marcaje de zinc solo en la pieza media, PI+, ROS-) y Población 4 (sin marcaje de zinc, PI+, ROS-). En los toros de alto rendimiento, hubo un porcentaje significativamente mayor de la población 1 (33,48 ± 8,91%; p = 0,024) y población 3 (39,63 ± 8,91%; p = 0,008) en comparación con la población 4 (3,17 ± 8,91%). En los toros de bajo rendimiento, hubo un porcentaje significativamente mayor de población 3 (53,95 ± 8,91%) que en todos los demás: población 1 (9,15 ± 8,91%; p = 0,002), población 2 (25,22 ± 8,91%; p = 0,032) y población 4 (4,7 ± 8,91%; p = 0,0007).
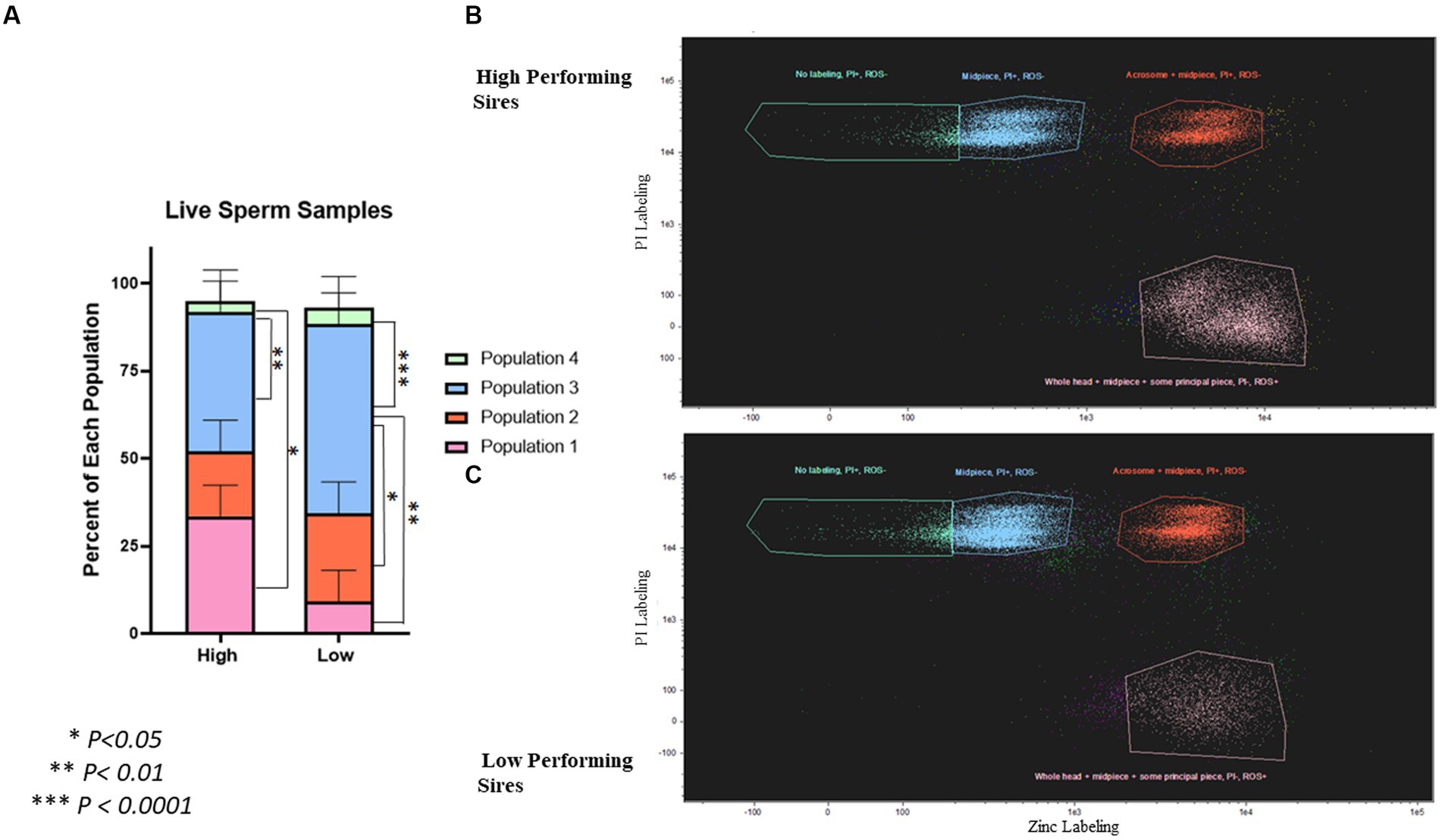 Figura 4. Cuantificación de la viabilidad y el estado de capacitación de los espermatozoides en muestras vivas post-gradiente. (A) Diferencias en las poblaciones de muestras vivas post-gradiente (n = ~ 35.000 células por clasificación) que van desde espermatozoides vivos, no capacitados (Población 1) hasta moribundos, post-capacitados (Población 4). Población 1 = marcaje de zinc en toda la cabeza + pieza media + pieza principal proximal, PI-, ROS+, Población 2 = etiquetado de zinc en el acrosoma + pieza media, PI+, ROS-, Población 3 = etiquetado de zinc solo en la pieza media, PI+, ROS-, y Población 4 = sin etiquetado de zinc, PI+, ROS-. En los toros de alto rendimiento, hubo un porcentaje significativamente mayor de la Población 1 (p = 0,024) y de la Población 3 (p = 0,008) en comparación con la Población 4. En los toros de bajo rendimiento, hubo un mayor porcentaje de Población 3 que en todos los demás: Población 1 (p = 0,002), Población 2 (p = 0,032) y Población 4 (p = 0,0007). (B) Diagrama de dispersión que muestra la segregación de poblaciones en toros de alto rendimiento. (C) Diagrama de dispersión que muestra la segregación de poblaciones en sementales de bajo rendimiento. La segregación por ROS se muestra en la Figura Suplementaria S2.
Figura 4. Cuantificación de la viabilidad y el estado de capacitación de los espermatozoides en muestras vivas post-gradiente. (A) Diferencias en las poblaciones de muestras vivas post-gradiente (n = ~ 35.000 células por clasificación) que van desde espermatozoides vivos, no capacitados (Población 1) hasta moribundos, post-capacitados (Población 4). Población 1 = marcaje de zinc en toda la cabeza + pieza media + pieza principal proximal, PI-, ROS+, Población 2 = etiquetado de zinc en el acrosoma + pieza media, PI+, ROS-, Población 3 = etiquetado de zinc solo en la pieza media, PI+, ROS-, y Población 4 = sin etiquetado de zinc, PI+, ROS-. En los toros de alto rendimiento, hubo un porcentaje significativamente mayor de la Población 1 (p = 0,024) y de la Población 3 (p = 0,008) en comparación con la Población 4. En los toros de bajo rendimiento, hubo un mayor porcentaje de Población 3 que en todos los demás: Población 1 (p = 0,002), Población 2 (p = 0,032) y Población 4 (p = 0,0007). (B) Diagrama de dispersión que muestra la segregación de poblaciones en toros de alto rendimiento. (C) Diagrama de dispersión que muestra la segregación de poblaciones en sementales de bajo rendimiento. La segregación por ROS se muestra en la Figura Suplementaria S2.
Discusión
Este estudio utilizó técnicas de imagen para evaluar los espermatozoides de toros de alto y bajo rendimiento, tanto antes como después de la purificación en gradiente, para identificar biomarcadores candidatos de fertilidad de toros y comprender cómo la presencia de esos biomarcadores puede verse afectada por la purificación en gradiente. Se ha documentado en muchas especies que la utilización de un gradiente de densidad combinado con la centrifugación enriquecerá la población de espermatozoides móviles y morfológicamente normales en una muestra dada (19, 26, 27). Sin embargo, esto también reduce el número total de células que quedan después del proceso. Los espermatozoides de las muestras previas al gradiente de toros de bajo rendimiento tenían un mayor daño en el ADN, sin embargo, en las muestras posteriores al gradiente, se observó lo contrario, y los toros de alto rendimiento tenían un mayor daño en el ADN. Aunque sorprendente, este cambio en la incidencia de daño en el ADN entre los toros de bajo y alto rendimiento antes y después del gradiente podría atribuirse a que la purificación del gradiente tuvo el impacto más sustancial en la eliminación de espermatozoides con daño en el ADN cuando esas células también estaban comprometidas con otros defectos, o ya muertas (28, 29). No se conoce que la purificación en gradiente elimine selectivamente los espermatozoides que contienen daño en el ADN por sí solos. Si un mayor porcentaje de espermatozoides dañados por el ADN de sementales de bajo rendimiento estuvieran muertos al descongelar las pajuelas de semen, habría un mayor número de células eliminadas de la población posterior al gradiente, lo que se observó en este estudio. Esto podría explicar por qué había más daño en el ADN en las muestras post-gradiente de toros de alto rendimiento, particularmente si hay una cohorte discreta de espermatozoides vivos y móviles con daño en el ADN en el semen del toro (30).
Es inesperado marcar aggresomas en las cabezas de los espermatozoides viables, aunque se observó un marcaje consistente en la cabeza en algunas muestras durante este estudio. En las muestras pre-gradiente evaluadas mediante microscopía fluorescente, el defecto más prevalente identificado en los toros de bajo rendimiento fue el aumento del contenido de agresomas en la cabeza, específicamente localizado en la región de la vaina post-acrosómica. Por el contrario, los defectos más prevalentes identificados en los toros de alto rendimiento fueron en la cola, que comúnmente se eliminan con la purificación en gradiente debido a su motilidad alterada (19, 27, 31). Esto puede explicar en parte la discrepancia entre la capacidad de un toro para producir un mayor número de embriones in vitro, siguiendo un protocolo de purificación en gradiente, en comparación con sus tasas de concepción más bajas cuando se utilizan para atender a las hembras in vivo, denotadas por valores más bajos de SCR (6, 22).
Cuando las proteínas desplegadas o mal plegadas no se repliegan correctamente o se degradan de manera eficiente, se da a otras proteínas la oportunidad de interactuar con ellas, lo que a veces conduce a la formación de grandes agregados de proteínas, conocidos como aggresomas (32). Los aggresomas tienen el potencial de formarse en cualquier tipo de célula, están asociados con la muerte celular y se han relacionado con enfermedades neurodegenerativas como el Alzheimer y la enfermedad de Huntington, así como con la amiloidosis sistémica (32, 33). Una vez que los agresomas se forman en una célula, deben eliminarse mediante degradación autofágica para limitar un mayor agrandamiento agregado (32, 34). Si la degradación no se produce de manera eficiente, la proteostasis celular se altera, lo que conduce al daño celular y, potencialmente, a la apoptosis.
Un estudio previo también ha identificado un aumento de los agregados proteicos en los espermatozoides defectuosos (25). Además, se ha demostrado que no todos los tipos de agresomas se eliminan por igual a través de la vía autofágica en las células de neuroblastoma, lo que indica que existe selectividad en esta relación y que algunas células pueden ser más susceptibles a una degradación más lenta que otras (35). Además, los agregados de proteínas densas que se encuentran en la región de la vaina postacrosómica podrían afectar potencialmente la liberación del factor activador espermatozoide-ovocito (SOAF) y/o la degradación de los componentes del citoesqueleto espermático, lo que afectaría a la activación de los ovocitos o al progreso pronuclear masculino durante el desarrollo cigótico temprano (25).
El uso de la citometría de flujo basada en imágenes (IBFC, por sus siglas en inglés) para cuantificar el contenido de agresomas en las cabezas de los espermatozoides permitió evaluar un tamaño de muestra mucho mayor que la evaluación manual por microscopía fluorescente: aproximadamente 90.000 células por clasificación de toros. En las muestras posteriores al gradiente, los toros de bajo rendimiento tuvieron una mayor incidencia de defectos agresomados en la cabeza en comparación con los toros de alto rendimiento. El gran tamaño de la muestra evaluada podría explicar la diferencia en los resultados de la evaluación de microscopía fluorescente e indicar resultados más robustos mediante citometría de flujo. Desde las muestras previas al gradiente hasta las muestras posteriores al gradiente, los toros de alto rendimiento tuvieron una reducción del 30% en las células que contenían este defecto, lo que indica que se eliminaron muchas células positivas durante la purificación del gradiente. Esto dio como resultado una menor variación entre las muestras posteriores al gradiente de los toros de alto rendimiento. Las muestras de toros de bajo rendimiento tuvieron una reducción de apenas el 3% en las células que contenían este defecto desde la evaluación previa a la posterior al gradiente, lo que indica que este defecto por sí solo se ve menos afectado por la purificación del gradiente.
En la evaluación citométrica de flujo de espermatozoides vivos tras la purificación en gradiente, se identificaron cuatro poblaciones distintas en las muestras, siendo la Población 1 la más viable y la Población 4 la menos viable. La comprensión de cómo el etiquetado de zinc indicaba el estado de capacitación en este estudio se basó en la literatura previa de Kerns et al. (13), y permitió distinguir las diferencias entre la capacitación temprana y la tardía. La población 1 estaba compuesta por espermatozoides que no habían iniciado la capacitación asociada al eflujo de zinc, no presentaban alteración de la membrana plasmática indicada por falta de marcaje PI y presentaban presencia de ROS. La población 2 estaba compuesta por espermatozoides en etapa temprana de capacitación, presentaba alteración de membrana (PI+) y tenía menos ROS. La población 3 estaba compuesta por espermatozoides en etapa tardía de capacitación, tenía alteración de la membrana y tenía menos ROS. Finalmente, la población 4 estaba compuesta por espermatozoides que estaban completamente capacitados o muertos, tenían alteración de la membrana y no tenían ROS presentes. Los toros de alto rendimiento tenían significativamente más espermatozoides viables no capacitados en la Población 1; que los espermatozoides no viables, en la Población 4. La mayor proporción de espermatozoides de toros de bajo rendimiento se encontraban en la Población 3 y, por lo tanto, eran menos viables.
La literatura previa ha demostrado que la sensibilidad a la criopreservación puede resultar en capacitación prematura, así como cambios en el Ca mitocondrial2+ y ROS de espermatozoides. Estos cambios moleculares conducen a la activación de un gran canal de conductancia denominado poro de transición de permeabilidad mitocondrial (mPTP), lo que provoca la liberación de Ca2+, ROS y ATP del espermatozoide (36-38). Además, la literatura ha demostrado que en espermatozoides humanos, equinos y bovinos, la presencia de ROS como O2− es necesario para que se produzca la fosforilación, la capacitación y la hiperactivación de la tirosina (39). Es posible que los espermatozoides de toros de bajo rendimiento sean más sensibles a los procesos de criopreservación o post-descongelación, lo que resulta en una alteración de las poblaciones viables. El inicio temprano de la capacitación es perjudicial para la aptitud de los espermatozoides porque pone en marcha los eventos que conducen a la exocitosis acrosómica, seguida poco después por la apoptosis. Por lo tanto, el momento de la capacitación es crucial para el éxito de la fertilización.
Se eligió la citometría de flujo basada en imágenes para estas evaluaciones debido a su capacidad única para analizar con precisión decenas de miles de espermatozoides en busca de una o más características de interés en solo minutos, lo que aumenta significativamente el tamaño de la muestra y disminuye la variabilidad que existe en las evaluaciones manuales (11, 40). Además, el IBFC permite la evaluación de células individuales, a diferencia de los métodos más tradicionales, como la electroforesis en gel de poliacrilamida, la espectrometría de masas y la transferencia occidental. Aunque estos métodos se han utilizado para la identificación de numerosas proteínas espermáticas y los estados de esas proteínas, como la fosforilación, están limitados por informar el promedio de todos los espermatozoides dentro de una muestra y, en consecuencia, carecen de la sensibilidad para diferenciar entre células individuales (40). La evaluación de los valores medios de una población heterogénea puede dar lugar a que se pasen por alto datos biológicamente relevantes. Por lo tanto, este estudio, junto con otros, promueve el uso de IBFC para identificar posibles biomarcadores de la calidad de los espermatozoides (10-13, 40).
Aunque estudios previos de nuestro grupo han demostrado que no hubo diferencias entre los grupos de sementales con valores variados de SCR en su capacidad para fecundar eficazmente los ovocitos y alcanzar el estadio pronuclear (6), sí se observaron diferencias en la competencia del desarrollo y en los indicadores de estrés celular en los embriones posteriores (22). Si el número de espermatozoides de sementales de bajo rendimiento que pueden alcanzar y fertilizar un ovocito se ha reducido debido a la purificación en gradiente, además de tener una mayor proporción de células menos viables, entonces la población que llega al ovocito puede estar enriquecida por defectos como aggresomas localizados en sus cabezas. Al incorporarse al ovocito fertilizado, los agresomas pueden abrumar la maquinaria de degradación de proteínas en el cigoto, lo que podría conducir a la regulación positiva de la actividad autofágica y la producción de ROS que se observó en embriones tempranos producidos por sementales de bajo rendimiento (22) (Fallon et al., presentado). Esto indica que puede resultar beneficioso evaluar el semen por separado para su uso en IA in vivo frente a la producción embrionaria in vitro. La identificación de este fenómeno podría explicar el mal funcionamiento de un mecanismo celular regulado por el padre durante el desarrollo embrionario temprano y podría servir como un biomarcador de la calidad de los espermatozoides y la fertilidad del padre en el futuro.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio están incluidas en el artículo/Material complementario, las consultas posteriores pueden dirigirse al autor correspondiente.
Contribuciones de los autores
LF: Conceptualización, Curación de datos, Análisis formal, Investigación, Metodología, Validación, Visualización, Redacción – borrador original, Redacción – revisión y edición. ED-M: Análisis formal, Investigación, Metodología, Redacción – revisión y edición. LH: Curación de datos, Análisis formal, Investigación, Metodología, Redacción – revisión y edición. PD: Curación de datos, Recursos, Supervisión, Redacción, revisión y edición. MZ: Curación de datos, Análisis formal, Investigación, Metodología, Redacción – revisión y edición. TS: Conceptualización, Obtención de Fondos, Recursos, Supervisión, Redacción – Revisión y Edición. MO: Conceptualización, Curación de datos, Adquisición de fondos, Investigación, Administración de proyectos, Recursos, Supervisión, Visualización, Redacción, revisión y edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este trabajo fue financiado por la subvención de los NIH n.º 1R01HD084353, la beca postdoctoral de la Fundación Lalor y la subvención USDA-NIFA AFRI n.º 2019-67015-28998.
Reconocimientos
Los autores desean agradecer a Bo Harstine y Select Sires por sus generosas contribuciones a este proyecto, y a Missouri Prime Beef Packers por donar los ovarios necesarios para completar este trabajo.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1258295/full#supplementary-material
Referencias
1. Ferrara, F, Daverio, R, Mazzini, G, Bonini, P, y Banfi, G. Automatización del análisis de espermatozoides humanos mediante citometría de flujo. Clin Chem. (1997) 43:801–7. doi: 10.1093/clinchem/43.5.801
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Wiltbank, MC, Báez, GM, García-Guerra, A, Toledo, MZ, Monteiro, PLJ, Melo, LF, et al. Períodos cruciales para la pérdida de preñez durante el primer trimestre de gestación en vacas lecheras lactantes. Teriogenología. (2016) 86:239–53. doi: 10.1016/j.theriogenology.2016.04.037
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Albuja, C, Ortiz, O, López, C, y Hernández Cerón, J. Impacto económico de la pérdida del embarazo en un sistema intensivo de ganadería lechera. Vet México OA. (2019) 6. doi: 10.22201/fmvz.24486760e.2019.1.572
4. De Vries, A. Valor económico de la preñez en el ganado lechero. J Lácteos Sci. (2006) 89:3876–85. doi: 10.3168/jds. S0022-0302(06)72430-4
5. Franco, G, Reese, S, Poole, R, Rhinehart, J, Thompson, K, Cooke, R, et al. Contribución de los sementales a la pérdida de preñez en diferentes períodos de desarrollo embrionario y fetal de las vacas de carne. Teriogenología. (2020) 154:84–91. doi: 10.1016/j.theriogenology.2020.05.021
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Ortega, MS, Moraes, JGN, Patterson, DJ, Smith, MF, Behura, SK, Poock, S, et al. Influencia de la tasa de concepción de sementales en el establecimiento de la preñez en bovinos lecheros. Biol Reprod. (2018) 99:1244–54. doi: 10.1093/biolre/ioy141
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Attia, S, Katila, T, y Andersson, M. El efecto de la morfología de los espermatozoides y la fertilidad de los toros de los toros finlandeses Ayrshire AI. Reprod Domest Anim. (2016) 51:54–8. doi: 10.1111/rda.12645
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Harstine, BR, Utt, MD, y DeJarnette, JM. Revisión: integración de un programa de control de calidad del semen y fertilidad de los toros en una gran organización de inseminación artificial. Animal. (2018) 12:S63-74. doi: 10.1017/S1751731118000319
9. Bar-Chama, N, y Lamb, DJ. EVALUACIÓN DE LA FUNCIÓN DE LOS ESPERMATOZOIDES: ¿qué hay disponible en el laboratorio de andrología moderno? Urol Clin N Am. (1994) 21:433–46. doi: 10.1016/S0094-0143(21)00618-2
10. Da Costa, R, Redmann, K, y Schlatt, S. Detección simultánea de la integridad de la membrana espermática y la fragmentación del ADN mediante citometría de flujo: una herramienta novedosa y rápida para el análisis de espermatozoides. Andrología. (2021) 9:1254–63. doi: 10.1111/andr.13017
11. Perticarari, S, Ricci, G, Granzotto, M, Boscolo, R, Pozzobon, C, Guarnieri, S, et al. Un nuevo método de citometría de flujo multiparamétrico para el análisis de semen humano. Hum Reprod. (2007) 22:485–94. doi: 10.1093/humrep/del415
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Zuidema, D, Kerns, K, y Sutovsky, P. Una exploración del análisis de semen actual y prospectivo y la selección de espermatozoides para la inseminación artificial ganadera. Animales. (2021) 11:3563. doi: 10.3390/ani11123563
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Kerns, K, Zigo, M, Drobnis, EZ, Sutovsky, M y Sutovsky, P. Flujo de iones de zinc durante la capacitación de espermatozoides de mamíferos. Nat Commun. (2018) 9:2061. doi: 10.1038/s41467-018-04523-y
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Rajabi-Toustani, R, Akter, QS, y Almadaly, EA. Mejora metodológica de la tinción FITC-PNA En: P Senger, editor. Vías hacia el embarazo y el parto. Vol. 28. 2ª ed. Grubstake way, Redmond: Current Conceptions Inc. (2019).
15. Sutovsky, P, Aarabi, M, Miranda-Vizuete, A, y Oko, R. Evaluación de la fertilidad masculina basada en biomarcadores negativos: fenotipos espermáticos asociados con anomalías a nivel molecular. Asiático J Androl. (2015) 17:554–60. doi: 10.4103/1008-682X.153847
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Flesch, FM, y Gadella, BM. Dinámica de la membrana plasmática de los espermatozoides de mamíferos en el proceso de fecundación. Biochimica et Biophysica Acta (BBA)—reseñas sobre. Biomembranas. (2000) 1469:197–235. doi: 10.1016/S0304-4157(00)00018-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Cornwall, GA, von Horsten, HH y Whelly, S. Agregados espermatogénicos del epidídimo relacionados con la cistatina en el epidídimo. J Androl. (2011) 32:679–85. doi: 10.2164/jandrol.111.012963
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Sutovsky, P, Neuber, E y Schatten, G. El mecanismo de control de calidad de espermatozoides dependiente de ubiquitina reconoce espermatozoides con defectos en el ADN según lo revelado por el ensayo dual ubiquitina-TUNEL. Mol Reprod Dev. (2002) 61:406–13. doi: 10.1002/mrd.10101
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Maxwell, W, Parrilla, I, Caballero, I, García, E, Roca, J, Martínez, E, et al. Conservación de la integridad funcional de los espermatozoides de toro después de la doble congelación y descongelación mediante centrifugación en gradiente de densidad PureSperm®: doble congelación de espermatozoides de toro. Reprod Domest Anim. (2007) 42:489–94. doi: 10.1111/j.1439-0531.2006.00811.x
20. Kuhn, MT, Hutchison, JL y Norman, HD. Modelización de variables molestas para la predicción de la fertilidad de los toros de servicio. J Lácteos Sci. (2008) 91:2823–35. doi: 10.3168/jds.2007-0946
21. Norman, HD, Hutchison, JL y VanRaden, PM. Evaluaciones de la tasa de concepción de sementales de servicio para inseminaciones de vaquillas y vacas con semen convencional y sexado. J Lácteos Sci. (2011) 94:6135–42. doi: 10.3168/jds.2010-3875
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Lockhart, KN, Drum, JN, Balboula, AZ, Spinka, CM, Spencer, TE, y Ortega, MS. El padre modula la cinética del desarrollo y el transcriptoma del embrión bovino. Reproducción. (2023). doi: 10.1530/REP-23-0030 (En prensa).
23. Fallon, L, Clark, K, y Ortega, MS. 56 Las contribuciones paternas al estrés embrionario temprano afectan el desarrollo en el bovino. Reprod Fertil Dev. (2021) 34:263–4. doi: 10.1071/RDv34n2Ab56
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Ortega, MS, Kurian, JJ, McKenna, R, y Hansen, PJ. Características de los genes candidatos asociados con el desarrollo embrionario en la vaca: evidencia de un papel de WBP1 en el desarrollo hasta la etapa de blastocisto. PLoS Uno. (2017) 12:e0178041. doi: 10.1371/journal.pone.0178041
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Kennedy, CE, Krieger, KB, Sutovsky, M, Xu, W, Vargovič, P, Didion, BA, et al. El patrón de expresión proteica de PAWP en espermatozoides de toro se asocia con la calidad del esperma y la fertilidad después de la inseminación artificial: PATRÓN DE EXPRESIÓN PROTEICA DE PAWP. Mol Reprod Dev. (2014) 81:436–49. doi: 10.1002/mrd.22309
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Eberhardt, M, Prochowska, S, Duszewska, AM, Van Soom, A, Olech, W, y Niżański, W. Influencia de la centrifugación en gradiente de densidad de Percoll® antes de la criopreservación en la calidad de los espermatozoides del epidídimo congelados de Wisent (Bison bonasus). BMC Vet Res. (2022) 18:305. doi: 10.1186/s12917-022-03408-z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Phillips, TC, Dhaliwal, GK, Verstegen-Onclin, KM, y Verstegen, JP. Eficacia de los medios de separación en gradiente de cuatro densidades para eliminar eritrocitos y espermatozoides no viables del semen canino. Teriogenología. (2012) 77:39–45. doi: 10.1016/j.theriogenology.2011.07.012
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Ahlering, P, Sutovsky, M, Gliedt, D, Branson, K, Miranda Vizuete, A, y Sutovsky, P. El contenido de espermatozoides de TXNDC8 refleja la estructura de la cromatina de los espermatozoides, el establecimiento del embarazo y la incidencia de partos múltiples después de la TRA. Syst Biol Reprod Med. (2020) 66:311–21. doi: 10.1080/19396368.2020.1801889
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Tomlinson, MJ, Moffatt, O, Manicardi, GC, Bizzaro, D, Afnan, M y Sakkas, D. Interrelaciones entre los parámetros seminales y el daño del ADN nuclear de los espermatozoides antes y después de la centrifugación en gradiente de densidad: implicaciones para la concepción asistida. Hum Reprod. (2001) 16:2160–5. doi: 10.1093/humrep/16.10.2160
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Dogan, S, Vargovic, P, Oliveira, R, Belser, LE, Kaya, A, Moura, A, et al. El estado de la protamina en los espermatozoides se correlaciona con la fertilidad de los toros reproductores1. Biol Reprod. (2015) 92:124255. doi: 10.1095/biolreprod.114.124255
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Morrell, J, Johannisson, A, Dalin, A-M y Rodríguez-Martínez, H. Morfología e integridad de la cromatina de espermatozoides de sementales preparados por gradiente de densidad y centrifugación de una sola capa a través de coloides de sílice. Reprod Domest Anim. (2009) 44:512–7. doi: 10.1111/j.1439-0531.2008.01265.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. García-Mata, R, Gao, Y-S y Sztul, E. Molestias para sacar la basura: agravantes de agresomas: vía agresomal para la degradación de proteínas. Tráfico. (2002) 3:388–96. doi: 10.1034/j.1600-0854.2002.30602.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Kopito, RR. Aggresomas, cuerpos de inclusión y agregación de proteínas. Tendencias Cell Biol. (2000) 10:524–30. doi: 10.1016/S0962-8924(00)01852-3
34. Driscoll, JJ y Chowdhury, RD. Diafonía molecular entre el proteasoma, los agresomas y la autofagia: potencial traslacional e implicaciones clínicas. Cáncer Lett. (2012) 325:147–54. doi: 10.1016/j.canlet.2012.06.016
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Wong, ESP, Tan, JMM, Soong, W-E, Hussein, K, Nukina, N, Dawson, VL, et al. La eliminación de aggresomas mediada por autofagia no es un fenómeno universal. Hum Mol Genet. (2008) 17:2570–82. doi: 10.1093/hmg/ddn157
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Gualtieri, R, Kalthur, G, Barbato, V, Di Nardo, M, Adiga, SK y Talevi, R. Disfunción mitocondrial y estrés oxidativo causado por la criopreservación en células reproductivas. Antioxidantes. (2021) 10:337. doi: 10.3390/antiox10030337
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Kim, J-S, He, L y Lemasters, JJ. Transición de permeabilidad mitocondrial: una vía común hacia la necrosis y la apoptosis. Biochem Biophys Res Commun. (2003) 304:463–70. doi: 10.1016/S0006-291X(03)00618-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Zinovkin, RA, y Zamyatnin, AA. Fármacos dirigidos a las mitocondrias. Curr Mol Pharmacol. (2019) 12:202–14. doi: 10.2174/1874467212666181127151059
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. O’Flahtery, C, y Scarlata, E. La protección de los espermatozoides de mamíferos contra el estrés oxidativo. Reproducción. (2022) 164:921–31. doi: 10.1530/REP-220200
40. Ortega-Ferrusola, C, Gil, M, Rodríguez-Martínez, H, Anel, L, Peña, F, y Martín-Muñoz, P. Citometría de flujo en espermatología: un futuro brillante por delante. Reprod Domest Anim. (2017) 52:921–31. doi: 10.1111/rda.13043
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: morfología de los espermatozoides, fertilidad paternal, agresomas, procesamiento del semen, citometría de flujo
Cita: Fallon L, Diaz-Miranda E, Hamilton L, Sutovsky P, Zigo M, Spencer TE y Ortega MS (2023) El desarrollo de nuevos biomarcadores de la calidad de los espermatozoides en el ganado. Frente. Vet. Sci. 10:1258295. doi: 10.3389/fvets.2023.1258295
Recibido: 13 de julio de 2023; Aceptado: 25 de septiembre de 2023;
Publicado: 12 octubre 2023.
Editado por:
Sebastián Demyda-Peyrás, Universidad de Córdoba, España
Revisado por:
Ana Josefa Soler, Universidad de Castilla-La Mancha, España
Shahin Eghbalsaied, Universidad Islámica Azad, Isfahán, Irán
Derechos de autor © 2023 Fallon, Díaz-Miranda, Hamilton, Sutovsky, Zigo, Spencer y Ortega. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: M. Sofía Ortega, sofia.ortega@wisc.edu
†Dirección actual: M. Sofía Ortega, Departamento de Ciencias Animales y Lecheras, Universidad de Wisconsin-Madison, Madison, WI, Estados Unidos
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía