Epidemiología genómica del último ganado bovino con infección persistente por el BVDV
«Desvanecimiento»: epidemiología genómica del último ganado bovino con infección persistente por el BVDV en Alemania
 Kerstin Wernike*
Kerstin Wernike*  Florian Pfaff
Florian Pfaff  Cerveza Martín
Cerveza Martín- Instituto de Virología Diagnóstica, Friedrich-Loeffler-Institut, Instituto Federal de Investigación para la Sanidad Animal, Greifswald – Insel Riems, Alemania
El virus de la diarrea viral bovina (BVDV) es uno de los patógenos bovinos más importantes a nivel mundial, causando grandes pérdidas económicas y problemas de bienestar animal. Los programas de erradicación de enfermedades se han implementado en varios países, incluida Alemania, donde desde 2011 está en vigor un programa de control obligatorio a nivel nacional. Dado que la epidemiología molecular se ha convertido en una herramienta esencial para comprender la dinámica de transmisión y la evolución del BVDV, se generan secuencias de la región no traducida (UTR) 5′ a partir de virus presentes en animales infectados de forma persistente desde el inicio del programa de control del BVDV. A continuación, presentamos los resultados de la subtipificación basada en secuencias de cepas de BVDV encontradas entre 2018 y 2022 en terneros nacidos en Alemania. En 2018, 2019 y 2020, los subtipos dominantes fueron los subtipos dominantes de BVDV-1d y 1b, y los casos se extendieron por toda el área que aún no se había declarado oficialmente libre de BVDV en ese momento. Además, en raras ocasiones se detectaron BVDV–1a, −1e, −1f y -1h. A partir de 2021, el subtipo 1d asumió claramente la dominancia, mientras que los otros subtipos podrían eliminarse gradualmente de la población bovina. El éxito de la erradicación no solo se traduce en una reducción drástica de los casos, sino también en una marcada reducción de la diversidad de cepas. Curiosamente, antes de que se prohibiera la vacunación en regiones y granjas con un estado libre de la enfermedad, se detectaron repetidamente dos cepas de virus vivos de la vacuna en muestras de tejido del oído de terneros recién nacidos (n = 14) cuyas madres fueron inmunizadas durante la gestación. Las secuencias de virus de campo son una base importante para el rastreo molecular y la identificación de posibles relaciones entre los últimos brotes en la fase final del programa alemán de erradicación del BVDV, apoyando así las investigaciones epidemiológicas clásicas. Además, el seguimiento de la composición de los subtipos de virus en la cabaña bovina ayuda a mantener métodos de diagnóstico y medidas de control eficaces y es un sistema de alerta temprana para la introducción de nuevos plaguivirus en la población bovina no infectada.
1 Introducción
El virus de la diarrea viral bovina (BVDV) es un patógeno económicamente importante que afecta a las poblaciones bovinas en todo el mundo. Es un pestivirus dentro de la familia Flaviviridae, que también incluye otros virus animales importantes como el virus de la peste porcina clásica (PPC) y el virus de la enfermedad fronteriza (BDV) (1). El BVDV es un virus de ARN monocatenario que se puede dividir taxonómicamente en las especies de virus Pestivirus bovis (comúnmente conocido como BVDV-1), Pestivirus tauri (BVDV-2) y Pestivirus brazilense (BVDV-3 o pestivirus similar a HoBi), que a su vez se subdividen en subtipos basados en el análisis genético (1, 2).
Las manifestaciones clínicas de la diarrea vírica bovina (DVB) van desde infecciones inaparentes hasta enfermedades agudas asociadas a diarrea, fiebre, neumonía, lesiones hemorrágicas o la enfermedad de la mucosa (DM) inevitablemente mortal (3). Además, el BVDV puede causar pérdidas reproductivas, inmunosupresión y predisponer a los animales a infecciones secundarias, lo que conlleva importantes pérdidas económicas en la industria ganadera. La infección durante la gestación a menudo resulta en la transmisión vertical del virus de la madre al feto en desarrollo, lo que, dependiendo de la etapa del embarazo, puede inducir aborto, muerte fetal, efectos teratogénicos o el nacimiento de terneros inmunotolerantes, persistentemente infectados (PI) y virémicos (4, 5). Los animales PI son incapaces de desarrollar una respuesta inmunitaria específica a la cepa específica del BVDV con la que están infectados y, por lo tanto, eliminan grandes cantidades de virus a lo largo de su vida. Por lo tanto, son la fuente principal y epidemiológicamente más relevante para la transmisión y el mantenimiento del virus en las poblaciones bovinas (6-9). Otra causa importante de transmisión del BVDV a granjas hasta ahora no afectadas son las llamadas «vacas troyanas», es decir, madres infectadas durante la gestación temprana y, por lo tanto, preñadas de un feto PI (7, 8, 10-12). Estas «vacas troyanas» son particularmente difíciles para el diagnóstico y el control de la enfermedad, ya que el problema solo se hace visible cuando nace el ternero PI, que podría ser varios meses después de la infección real de la madre.
Para contrarrestar las importantes consecuencias económicas y de bienestar animal de la DVB, se han implementado programas de control en varios países (13, 14). El objetivo común es la eliminación del BVDV mediante la detección y eliminación de los animales PI lo antes posible de la respectiva población bovina, sin embargo, existen dos enfoques diferentes para lograr este objetivo.
El llamado «modelo escandinavo» se basa en la serología de leche a granel a gran escala combinada con una prohibición de vacunación para preseleccionar las granjas con un mayor riesgo de presencia de animales PI. A partir de entonces, todos los animales de estos rebaños se someten a pruebas individuales para identificar y eliminar a los animales PI. Por el contrario, el «enfoque suizo» se basa en la prueba directa del genoma viral o de antígenos de todos los animales sin una preselección serológica de los rebaños bovinos. Este enfoque resultó beneficioso para los países con altas prevalencias iniciales del BVDV, altos niveles de comercio de ganado y cuando se permite la vacunación. Este último enfoque también se ha elegido para Alemania, donde la DVB/MD es una enfermedad de declaración obligatoria desde 2004 y en 2011 se inició un programa obligatorio de erradicación a nivel nacional (15). Las normas básicas definidas son la realización obligatoria de pruebas de detección del antígeno o genoma del BVDV a cada ternero recién nacido, lo que da lugar a casi 5 millones de pruebas diagnósticas del BVDV cada año (15), la eliminación inmediata de todos los animales positivos al virus detectados y el comercio únicamente con animales no sospechosos certificados. De 2011 a mayo de 2016, los terneros tuvieron que ser investigados en los primeros 6 meses de vida y de junio de 2016 a marzo de 2021 en las primeras 4 semanas. Desde abril de 2021, cuando entró en vigor en la Unión Europea (UE) la Ley de Sanidad Animal (AHL) y los reglamentos delegados que la acompañan, todos los terneros deben someterse a pruebas en los primeros 20 días después del parto. La vacunación estaba permitida al principio del programa, pero está prohibida desde 2021 en regiones con estatus libre de enfermedad o con un programa de erradicación aprobado de acuerdo con la legislación de la UE. Se aplicaron varias vacunas inactivadas (preparaciones monovalentes o en combinación con inmunógenos contra otros patógenos) y las dos vacunas vivas Bovela® (Boehringer Ingelheim Vetmedica GmbH, Ingelheim/Rhein, Alemania) y Vacoviron® FS (Merial GmbH, Hallbergmoos, Alemania). Bovela® se basa en las cepas de virus KE-9 (subtipo BVDV-1b) y NY-93 (subtipo BVDV-2a) y Vacoviron® incluye el virus de la vacuna BVDV-1a Oregon C24V, que se ha utilizado desde la década de 1960 en Europa (16, 17).
Desde el inicio del programa alemán obligatorio de control de la BVD en 2011 hasta 2022, la proporción de animales clasificados como IP entre todos los terneros recién nacidos podría reducirse con cada año que pasaba, comenzando con un 0,5 % en 2011 y dando como resultado un 0,001 % (55 terneros IP entre unos 4,3 millones de terneros recién nacidos) en 2022 (18).
La reducción altamente exitosa de los animales PI recién nacidos también condujo a una reducción drástica de las secuencias de BVDV. Dado que la epidemiología genómica se ha convertido en una herramienta importante para comprender la dinámica de transmisión y la evolución del BVDV (19), se ha generado un conjunto completo de datos de secuencia de la región no traducida 5′ (UTR) del genoma viral durante las primeras fases del programa de control alemán. En este contexto, se identificó una variedad considerable de subtipos de BVDV (20). Aquí, presentamos el seguimiento, es decir, los resultados de la subtipificación basada en la secuencia 5′UTR de las cepas de virus restantes encontradas en los casos más recientes de BVD en Alemania. Las secuencias se utilizan para el rastreo molecular de los últimos brotes en la fase final del programa de erradicación del país, ya que la tipificación de los aislamientos virales resultó beneficiosa para la identificación de las relaciones entre los brotes de BVD, identificando así los factores de riesgo para la transmisión del virus.
2 Materiales y métodos
En Alemania, todos los terneros recién nacidos se someten a pruebas de detección del BVDV mediante RT-PCR en tiempo real o ELISA de antígenos. Las pruebas se llevan a cabo en los laboratorios regionales y la mayoría de ellos envían muestras positivas para el BVDV al laboratorio nacional de referencia (NRL) para la DVB/MD para su posterior caracterización de los virus detectados. Las RT-PCR en tiempo real utilizadas en los laboratorios regionales permiten la detección de las tres especies del BVDV (21, 22). Las muestras diagnósticas enviadas al NRL son muestras de ARN viral o de sangre o muestras de muesca de oreja empapadas en tampón ELISA de antígeno o tampón de lisis directa. En casos muy raros, se envían hisopos nasales. En este trabajo se describe la caracterización genética de las cepas de BVDV que se encontraron en animales PI nacidos entre 2018 y 2022.
A partir de las muestras de sangre y los fluidos de hisopo enviados, se extrajo el ARN viral utilizando el QIAamp Viral RNA Mini Kit (Qiagen GmbH, Hilden, Alemania) de acuerdo con las recomendaciones del fabricante. Las muestras de muescas de orejas se recuperaron manualmente de los tubos originales que contenían antígeno-ELISA o tampón de lisis directa, se homogeneizaron en tampón RLT (Qiagen, Hilden, Alemania) y, posteriormente, se extrajo el ARN viral utilizando el RNeasy Mini Kit (Qiagen, Hilden, Alemania). La presencia del genoma de pestivirus fue confirmada por una RT-PCR genérica en tiempo real panpesti publicada previamente (20). Para muestras positivas de RT-PCR en tiempo real, se generó información de secuencia de la 5′UTR como se describió anteriormente en ambas direcciones utilizando los cebadores BVD I (5′-GGT AGC AAC AGT GGT GAG TTC-3′) y UTR51 (5′-CAA CTC CAT GTG CCA TGT AC-3′) (258 pares de bases) o BVD II (5′-AGC GGT AGC AGT GAG TTC ATT-3′) y UTR51 (5′-CAA CTC CAT GTG CCA TGT AC-3′) (257 pares de bases) (23). Las secuencias se ensamblaron y alinearon utilizando la versión 2021.0.1 de Geneious Prime (Biomatters, Auckland, Nueva Zelanda). Las secuencias generadas en este estudio se enviaron a las bases de datos de la Colaboración Internacional de Secuencias de Secuencias de Nucleótidos (números de acceso del GenBank OR710303 a OR710491).1
Para determinar los subtipos de BVDV, se utilizaron secuencias de cepas de referencia representativas disponibles en el NCBI GenBank para la comparación. En los casos de detección de la cepa de vacuna viva modificada KE-9, las deleciones genómicas dobles individuales se confirmaron mediante secuenciación de Sanger como se describió anteriormente (20). Cuando se confirmaron las deleciones genómicas o cuando se identificó otra cepa de vacuna viva mediante secuenciación 5′UTR, las muestras se excluyeron de los análisis de la distribución espacial de los subtipos de BVDV. Cuando se enviaron varias muestras de explotaciones bovinas individuales a la NRL y las secuencias 5′UTR generadas a partir de estas muestras eran idénticas, solo se incluyó en los análisis posteriores de ese año el primer animal PI dentro de un año determinado. Los árboles de máxima verosimilitud se calcularon por separado para cada año desde 2018 hasta 2022 utilizando el modelo de 2 parámetros de Kimura (24) con 1.000 réplicas de bootstrap utilizando el software MEGA X (25).
Para ilustrar la distribución espacial de los subtipos del BVDV, los distritos de nacimiento de los terneros se extrajeron de la base de datos de ganado alemán (HI-Tier) en función del número de crotal de los animales o se indicaron en la carta que acompañaba a las muestras.
3 Resultados
Las cepas de la vacuna viva Oregon C24V (incluidas, por ejemplo, en las vacunas Vacoviron® FS [Merial GmbH, Hallbergmoos, Alemania] y MUCOSIFFA [Ceva Santé Animale, Libourne, Francia]), y KE-9 (Bovela® [Boehringer Ingelheim Vetmedica GmbH, Ingelheim/Rhein, Alemania]) se encontraron en muestras de muescas auriculares de siete terneros recién nacidos cada una. Las cifras por año se presentan en la Tabla 1. Estas muestras se excluyeron de los análisis de la distribución espacial de las cepas circulantes del BVDV.
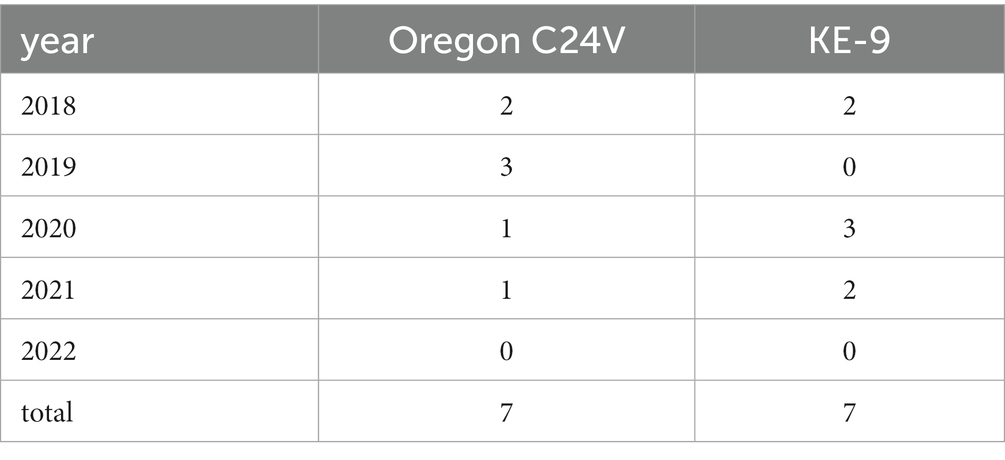 Tabla 1. Número de detecciones de cepas vivas de la vacuna Oregon C24V y KE-9 en terneros recién nacidos después de la vacunación de sus madres al principio de la gestación.
Tabla 1. Número de detecciones de cepas vivas de la vacuna Oregon C24V y KE-9 en terneros recién nacidos después de la vacunación de sus madres al principio de la gestación.
Se pudieron generar secuencias de virus de campo a partir de animales PI nacidos en 85 (año 2018), 56 (año 2019), 24 (año 2020), 11 (año 2021) y 13 (año 2022) granjas bovinas, respectivamente, lo que resultó en un conjunto de datos de 189 secuencias de la región genómica 5′UTR (Figura 1). La disminución anual del número de muestras positivas para el BVDV refleja la disminución general de los rebaños de IP en Alemania debido al eficiente proceso de erradicación (18). El número de explotaciones bovinas a partir de las cuales se generaron secuencias de BVDV representa alrededor del 68 % de todos los rebaños de PI en 2018, el 60 % en 2019, el 49 % en 2020, el 42 % en 2021 y el 54 % en 2022. La distribución espacial de las muestras secuenciadas (Figura 1) refleja la de los casos notificados de DVB, con la presencia de animales IP predominantemente en el oeste y el sur de Alemania (18).
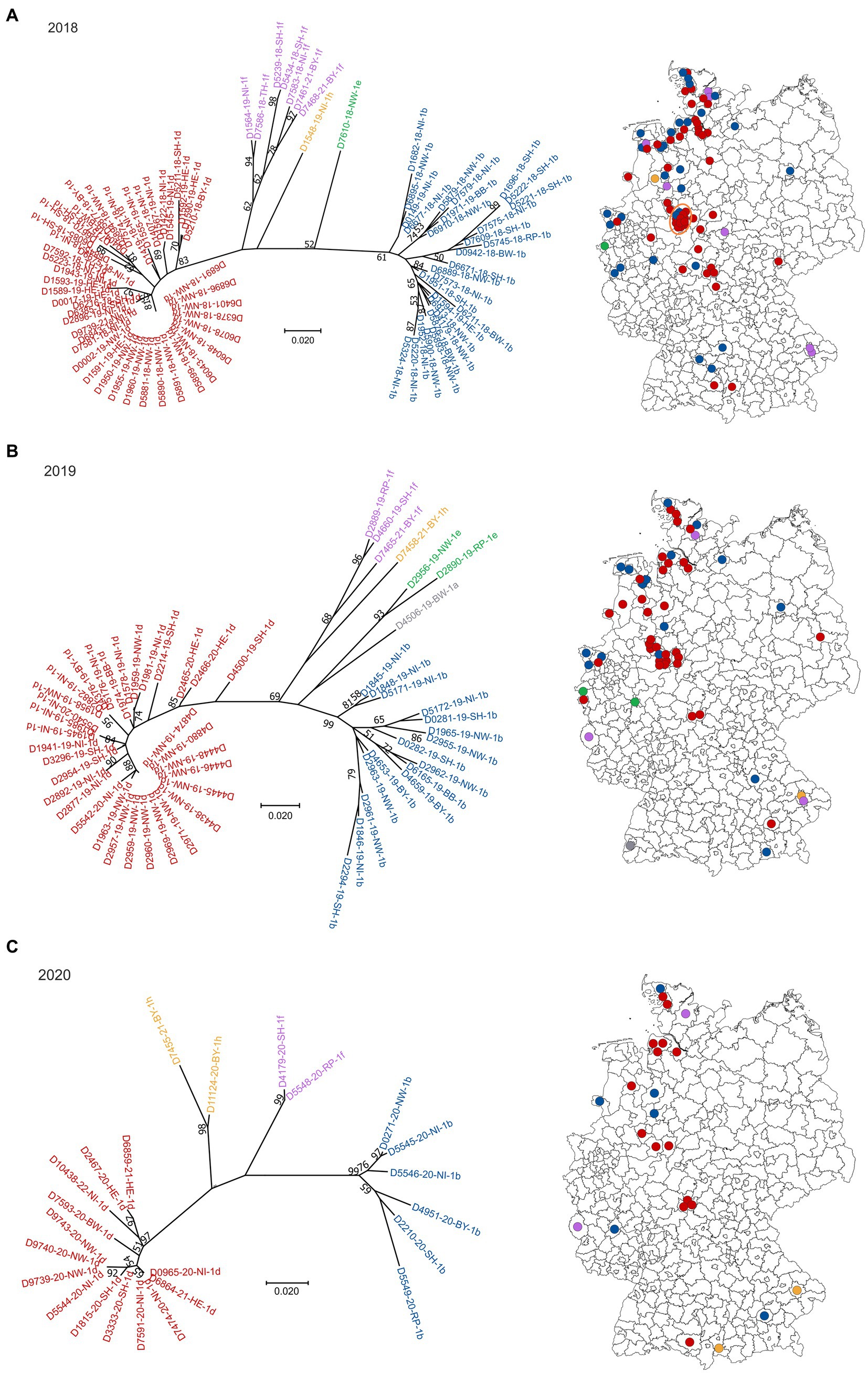
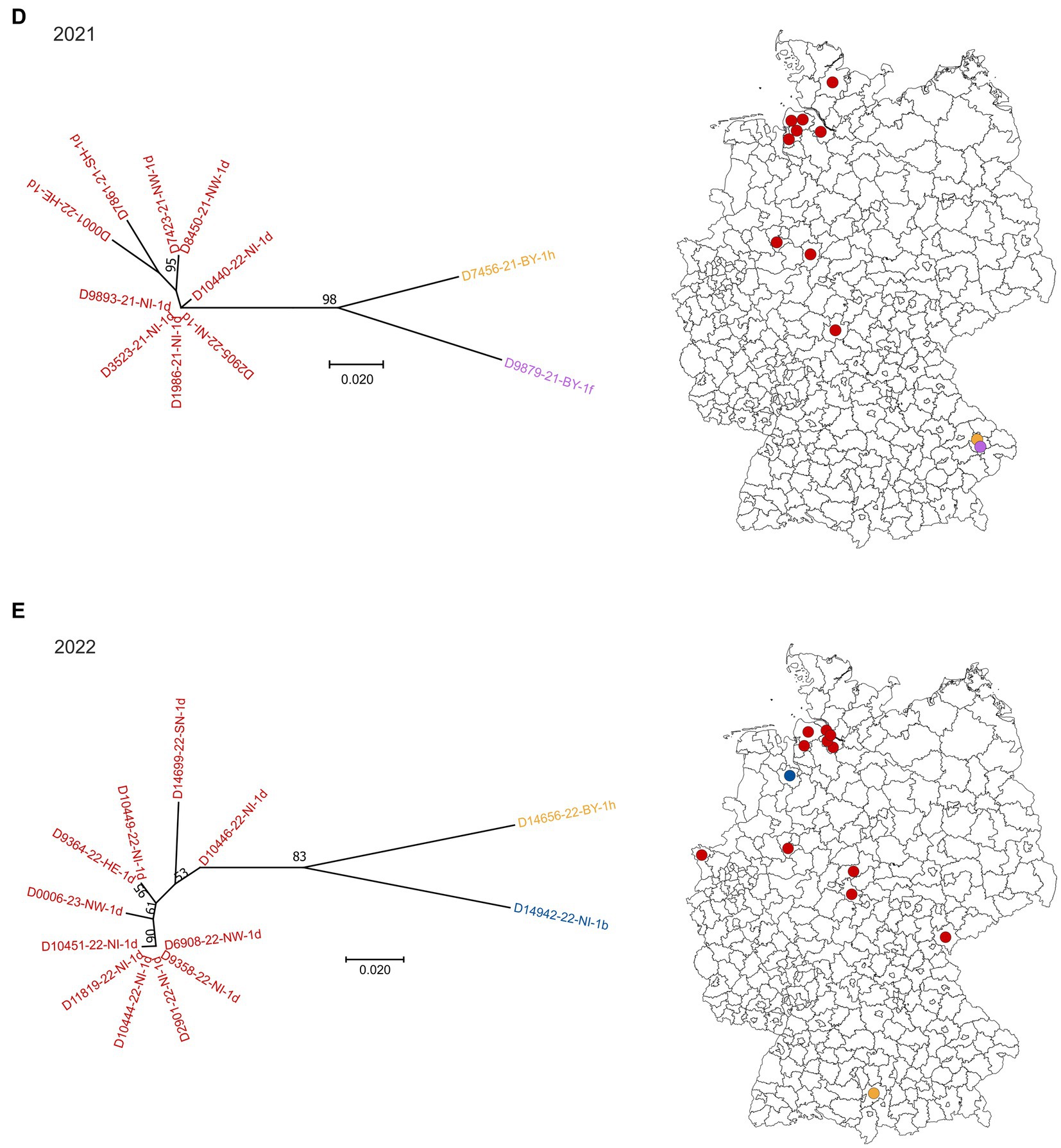 Figura 1. Subtipos de BVDV detectados en terneros PI en Alemania en 2018 (A), 2019 (B), 2020 (C), 2021 (D) y 2022 (E). En el lado izquierdo de cada panel, se representa la clasificación filogenética basada en el 5’UTR. Las cepas que pertenecen al subtipo 1a del BVDV se muestran en gris, 1b en azul, 1d en rojo, 1e en verde, 1f en morado y 1h en amarillo. La distribución de los subtipos dentro de Alemania (derecha) se muestra utilizando los mismos colores. Los puntos se distribuyen aleatoriamente en los distritos, lo que significa que no se puede deducir la ubicación exacta de las granjas dentro del distrito respectivo. El círculo naranja en el panel (A) indica un distrito con un número particularmente alto de explotaciones bovinas infectadas por el BVDV. La base del mapa, en la que se imprimieron los puntos, se recuperó de: Bundesamt für Kartographie und Geodäsie (2022), fuentes de datos: Statistisches Bundesamt (Destatis), Bundesinstitut für Bau-, Stadt-und Raumforschung (BBSR), Data licence Germany – attribution – Version 2.0 (www.govdata.de/dl-de/by-2-0).
Figura 1. Subtipos de BVDV detectados en terneros PI en Alemania en 2018 (A), 2019 (B), 2020 (C), 2021 (D) y 2022 (E). En el lado izquierdo de cada panel, se representa la clasificación filogenética basada en el 5’UTR. Las cepas que pertenecen al subtipo 1a del BVDV se muestran en gris, 1b en azul, 1d en rojo, 1e en verde, 1f en morado y 1h en amarillo. La distribución de los subtipos dentro de Alemania (derecha) se muestra utilizando los mismos colores. Los puntos se distribuyen aleatoriamente en los distritos, lo que significa que no se puede deducir la ubicación exacta de las granjas dentro del distrito respectivo. El círculo naranja en el panel (A) indica un distrito con un número particularmente alto de explotaciones bovinas infectadas por el BVDV. La base del mapa, en la que se imprimieron los puntos, se recuperó de: Bundesamt für Kartographie und Geodäsie (2022), fuentes de datos: Statistisches Bundesamt (Destatis), Bundesinstitut für Bau-, Stadt-und Raumforschung (BBSR), Data licence Germany – attribution – Version 2.0 (www.govdata.de/dl-de/by-2-0).
En 2018, 2019 y 2020, los subtipos dominantes fueron los BVDV-1d y 1b y los casos se distribuyeron por toda el área que se clasificó oficialmente como «no libre de BVD» en ese momento (Figuras 1A a C). El subtipo 1a se detectó solo una vez en 2019, el subtipo 1e una vez en 2018 y dos veces en 2019, y los subtipos 1f y 1h se encontraron varias veces a lo largo de los años. A partir del año 2021, el subtipo 1d fue claramente dominante, ya que todas las secuencias, excepto dos, pertenecían a este tipo de virus en 2021 y 2022, respectivamente (Figuras 1D,E). En los dos casos restantes de ambos años se encontró BVDV de los subtipos 1f y 1h (2021) o 1b y 1h (2022).
Al analizar la distribución espacial en 2018, se destaca un distrito en el centro-oeste de Alemania, donde se vieron afectadas varias granjas (círculo naranja en la Figura 1A). En estos casos, todas las secuencias virales 5′UTR, excepto dos, pertenecían al subtipo BVDV-1d y todas eran idénticas, lo que indica muy claramente una fuente común de infección o una cadena de infección entre las respectivas granjas. Al año siguiente, se observó una distribución similar, pero menos granjas se vieron afectadas y la cepa del virus se encontró además en el distrito vecino. En 2020, sin embargo, el brote más grande ha terminado y solo se generó una secuencia viral 5′UTR por distrito. En ambos casos, las secuencias pertenecían al subtipo BVDV-1d y eran idénticas a las de los años anteriores.
A partir de muestras recogidas en cuatro explotaciones bovinas en 2018/2019, se generaron previamente secuencias del genoma completo (26). La comparación de estas secuencias reveló una identidad nucleotídica muy alta entre las muestras individuales (>99,6%) (26), lo que respalda aún más la suposición de que había una fuente común de infección o una cadena de infección entre las respectivas granjas de este distrito.
4 Discusión
Comprender la diversidad de cepas del BVDV en un área determinada es esencial para mantener herramientas de diagnóstico y medidas de control efectivas. Cuando las estrategias de control incluyen la vacunación o la vacunación se aplica en áreas sin control sistemático de la DVB, hay que tener en cuenta que la vacunación contra la DVB se complica por la amplia diversidad antigénica entre los virus de campo (27). El BVDV existe en tres especies con numerosos subtipos (1, 2) y esta diversidad plantea desafíos en la eficacia de las vacunas, que pueden variar según los subtipos específicos del virus. Por lo tanto, es importante monitorear qué tipos de virus están circulando para seleccionar la vacuna más adecuada para que coincida con las cepas prevalentes en una región determinada. Otro aspecto a tener en cuenta a la hora de implementar estrategias de inmunización contra la DVB es el tipo de vacuna. Se han desarrollado varias formulaciones de vacunas contra las infecciones por BVDV, que van desde las clásicas inactivadas hasta las subunidades, los virus vivos modificados (MLV), los pestivirus quiméricos, los replicones y los clones sintéticos de ADNc infecciosos atenuados (28). Todos ellos tienen sus ventajas y desventajas específicas. Si bien las vacunas inactivadas se consideran libres de riesgos a cualquier edad o fase de la gestación, son menos eficientes, se requieren vacunas de refuerzo en la mayoría de los casos y el alcance de la protección fetal no está claro (29). Por otro lado, las vacunas MLV a menudo inducen una respuesta inmunitaria amplia, robusta y duradera (30, 31), pero pueden representar un riesgo de transmisión vertical a través de la barrera placentaria desde la madre hasta el feto en desarrollo. Cuando las cepas de vacunas vivas persisten durante un período prolongado dentro de los tejidos fetales, posiblemente hasta después del nacimiento, pueden ser detectables en los recién nacidos, como se ha informado anteriormente (20, 32) y se observó repetidamente en nuestro estudio. Teniendo en cuenta el progreso exitoso del programa alemán de control de BVD (18) y sobre la base de un seguimiento de 6 meses de un ternero en cuyo tejido auditivo se encontró la cepa comercial de la vacuna viva KE-9 de BVDV-1 con doble mutación Npro y Erns (32), el impacto epidemiológico de la positividad de ARN/antígeno en la piel de los recién nacidos parece ser muy bajo. Sin embargo, presenta un problema de diagnóstico, que puede llevar a medidas de sacrificio cuando no se realiza un análisis de secuencia para diferenciar las cepas de la vacuna de los virus de campo. Por lo tanto, se debe considerar cuidadosamente si los animales preñados están inmunizados con las vacunas MLV.
Entre los virus de campo, los subtipos 1d y 1b del BVDV fueron los más prevalentes y se detectaron adicionalmente los subtipos 1a, 1e, 1f y 1h, todos ellos pertenecientes a la especie Pestivirus bovis. Curiosamente, entre 2018 y 2022 no se encontraron ni el BVDV-2, que causó un importante brote de enfermedad en Alemania Occidental en 2012/13 (33), ni el BVDV-3 (pestivirus similar al HoBi). El BVDV-3 se aisló originalmente de un suero fetal de ternero brasileño (34) y desde entonces se ha encontrado predominantemente en otros países de América del Sur y Asia, pero también en Italia (35, 36). Pero, afortunadamente, parece que el BVDV-3 aún no se ha introducido en la población bovina alemana y se ha extendido en mayor medida, ya que no se detectó en ninguna de las muestras analizadas en este estudio. No obstante, debe mantenerse la vigilancia y la tipificación de los virus circulantes a fin de detectar lo antes posible cualquier introducción novedosa de diversas variantes del virus o incluso de otras especies de pestivirus en la población bovina ingenua.
Además de la posibilidad de detectar la introducción de plastivirus no endémicos o incluso nuevos, la epidemiología genómica permite un seguimiento de las cepas circulantes, lo que respalda las investigaciones epidemiológicas clásicas de los brotes. Esto es especialmente beneficioso en el caso de la BVD, donde pueden pasar varios meses entre la infección de la madre y el momento en que el problema se hace visible, es decir, cuando nace una cría PI. En consecuencia, estos enfoques moleculares-epidemiológicos se han implementado en numerosos países (19, 37-42). Una limitación de nuestro estudio podría ser que solo se utilizaron secuencias 5’UTR. Secuenciación suplementaria de otras regiones del genoma (p. ej., Npro) o incluso la secuenciación del genoma completo podría aumentar la precisión al proporcionar información genómica más completa. Sin embargo, la secuenciación parcial 5’UTR ofrece varias ventajas sobre la secuenciación del genoma completo, principalmente la rentabilidad y el bajo tiempo de respuesta. Además, la secuenciación 5’UTR se usa más comúnmente que, por ejemplo, Npro secuenciación (19, 40, 41) y, por lo tanto, permite una fácil comparación con las bases de datos existentes y las secuencias publicadas, lo que ayuda en la identificación y subtipificación de cepas. Lo más importante es que la región 5’UTR del BVDV contiene suficiente variación genética para diferenciar los subtipos virales. Aquí, identificamos los virus del punto caliente de infección en el centro-oeste de Alemania como pertenecientes al subtipo 1d del BVDV, lo que concuerda con la subtipificación basada en el genoma completo de un subconjunto de las muestras de esta serie de brotes (26).
La elevada identidad genética de los virus detectados en múltiples animales PI en varias explotaciones indica una fuente común de infección o cadenas de infección entre las explotaciones bovinas afectadas. De hecho, investigaciones epidemiológicas adicionales han identificado una fuente común que podría eliminarse, poniendo así fin a la serie de brotes en combinación con pruebas sistemáticas, la eliminación inmediata de cada animal PI detectado y estrictas medidas de bioseguridad. Desde una perspectiva nacional, la combinación de pruebas, eliminación de animales PI y bioseguridad no solo condujo a la erradicación de focos de infección individuales, sino a una marcada caída general en los nacimientos de animales PI relacionados con el número total de terneros recién nacidos (18) hasta un estado libre de enfermedad de varios estados federales. En este contexto, el número de detecciones de ciertos subtipos (por ejemplo, BVDV-1b) disminuyó notablemente y algunos subtipos de virus (por ejemplo, BVDV-1a y 1e) incluso pudieron eliminarse de la población bovina, reduciendo así la diversidad genética al mínimo. No obstante, existe un riesgo constante de reintroducción, por ejemplo, mediante el comercio de terneros no probados, la importación de ganado con estatus incierto de BVD o la compra de «vacas troyanas». Por lo tanto, es esencial mantener los programas de monitoreo también en las regiones libres de enfermedad para mantener el estatus libre de BVDV. Dado que uno de los resultados de la consiguiente erradicación y prohibición de la vacunación es la presencia de bovinos sin anticuerpos contra el BVDV, debe tenerse especialmente en cuenta el riesgo de infecciones por el virus de la enfermedad fronteriza de las ovejas, como se ha demostrado anteriormente, por ejemplo, en Suiza (43).
En conclusión, el programa nacional alemán de control de la BVD condujo a una reducción altamente eficiente de los animales PI y, como efecto secundario, a la eliminación gradual de ciertos subtipos de BVDV de la población bovina. La subtipificación del virus y las investigaciones moleculares y epidemiológicas pueden ayudar a identificar las cadenas de transmisión, apoyando así la prevención de la transmisión del virus a explotaciones hasta ahora no afectadas y ayudando a mantener las medidas de control.
Declaración de disponibilidad de datos
Los conjuntos de datos presentados en este estudio se pueden encontrar en repositorios en línea. Los nombres de los repositorios y los números de acceso se pueden encontrar en: https://www.ncbi.nlm.nih.gov/genbank/, OR710303 a OR710491.
Declaración ética
No se requirió la aprobación ética para el estudio con animales de acuerdo con la legislación local y los requisitos institucionales, ya que las muestras de los animales fueron tomadas por los veterinarios de granja responsables en el contexto del programa de control obligatorio de BVD alemán y según lo prescrito en el reglamento de BVDV (BVDV-Verordnung in der Fassung der Bekanntmachung vom 27. Juni 2016, BGBl. I S. 1483).
Contribuciones de los autores
KW: Conceptualización, Análisis formal, Investigación, Supervisión, Visualización, Escritura – borrador original. FP: Análisis formal, Investigación, Escritura – revisión y edición. MB: Conceptualización, Supervisión, Redacción – revisión y edición.
Financiación
El/los autor/es declaran/n que no se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo.
Reconocimientos
Agradecemos a Bianka Hillman y Jenny Lorke por su excelente asistencia técnica y a los laboratorios de diagnóstico locales alemanes por proporcionar las muestras positivas para BVDV.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Notas
1. ^www.insdc.org
Referencias
1. ICTV. Familia: Flaviviridae, género: Pestivirus. Disponible en: https://talkictvonlineorg/ictv-reports/ictv_online_report/positive-sense-rna-viruses/w/flaviviridae/361/genus-pestivirus. (2023).
2. Vilcek, S, Paton, DJ, Durkovic, B, Strojny, L, Ibata, G, Moussa, A, et al. El genotipo 1 del virus de la diarrea viral bovina puede dividirse en al menos once grupos genéticos. Arch Virol. (2001) 146:99–115. doi: 10.1007/s007050170194
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Lanyon, SR, Hill, FI, Reichel, MP y Brownlie, J. Diarrea viral bovina: patogénesis y diagnóstico. Veterinario J. (2014) 199:201–9. doi: 10.1016/j.tvjl.2013.07.024
4. Panadero, JC. Las manifestaciones clínicas de la infección por diarrea viral bovina. Vet Clin North Am Food Anim Pract. (1995) 11:425–45. doi: 10.1016/S0749-0720(15)30460-6
5. Brock, KV. La persistencia del virus de la diarrea viral bovina. Biológicos. (2003) 31:133–5. doi: 10.1016/S1045-1056(03)00029-0
6. Ezanno, P, Fourichon, C y Seegers, H. Influencia de la estructura del rebaño y el tipo de introducción del virus en la propagación del virus de la diarrea viral bovina (BVDV) dentro de un rebaño lechero. Res. Veterinaria. (2008) 39:39. doi: 10.1051/vetres:2008016
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Akagami, M, Seki, S, Kashima, Y, Yamashita, K, Oya, S, Fujii, Y, et al. Factores de riesgo asociados con la transmisión dentro de la granja del virus de la diarrea viral bovina y la incidencia de bovinos infectados persistentemente en granjas lecheras de la prefectura de Ibaraki en Japón. Res Vet Sci. (2020) 129:187–92. doi: 10.1016/j.rvsc.2020.02.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Bitsch, V, Hansen, KE y Ronsholt, L. Experiencias del programa danés para la erradicación de la diarrea vírica bovina (BVD) 1994-1998 con especial referencia a la legislación y las causas de infección. Microbiol veterinario. (2000) 77:137–43. doi: 10.1016/S0378-1135(00)00270-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Tråvén, M, Alenius, S, Fossum, C, y Larsson, B. Infección primaria por el virus de la diarrea viral bovina en terneros después del contacto directo con un ternero persistentemente virémico. Zentralbl Veterinarmed B. (1991) 38:453–62. doi: 10.1111/j.1439-0450.1991.tb00895.x
10. Reardon, F, Graham, DA, Clegg, TA, Tratalos, JA, O’Sullivan, P, y más, SJ. Cuantificación del papel de las presas troyanas en la propagación entre rebaños del virus de la diarrea viral bovina (BVDv) en Irlanda. Prev Vet Med. (2018) 152:65–73. doi: 10.1016/j.prevetmed.2018.02.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Albrecht, K, Linder, M, Heinrich, A, Höche, J, Beer, M, Gaede, W, et al. Reintroducción del virus de la diarrea viral bovina en una región libre de enfermedad: Impacto en el hato bovino afectado e implicaciones diagnósticas. Patógenos. (2021) 10:360. doi: 10.3390/pathogens10030360
12. Van Duijn, L, Santman-Berends, I, Biesheuvel, M, Mars, J, Waldeck, F, y van Schaik, G. ¿Por qué realizar pruebas al ganado comprado en los programas de control del BVDV? Frente vet sci. (2021) 8:686257. doi: 10.3389/fvets.2021.686257
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Moennig, V, y Becher, P. Control de la diarrea viral bovina. Patógenos. (2018) 7:29. doi: 10.3390/pathogens7010029
14. Stahl, K, y Alenius, S. Control y erradicación del BVDV en Europa: una actualización. Jpn J Vet Res. (2012) 60:S31–9.
15. Wernike, K, Gethmann, J, Schirrmeier, H, Schröder, R, Conraths, FJ y Beer, M. Seis años (2011-2016) de control obligatorio de la diarrea viral bovina a nivel nacional en Alemania: una historia de éxito. Patógenos. (2017) 6:50. doi: 10.3390/pathogens6040050
16. Coggins, L, Gillespie, JH, Robson, DS, Thompson, JD, Phillips, WV, Wagner, WC, et al. Atenuación del virus de la diarrea (cepa Oregon C24V) con fines vacunales. Veterinario de Cornell. (1961) 51:539–45.
17. Balint, A, Baule, C, Palfi, V y Belak, S. Análisis retrospectivo del genoma de una cepa viva de vacuna del virus de la diarrea viral bovina. Res. Veterinaria. (2005) 36:89–99. doi: 10.1051/vetres:2004053
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Friedrich-Loeffler-Institut. Statistik zur BVD-Bekämpfung in Deutschland: PI-Tiere (Zeitraum 2011–2022). Disponible en: https://wwwflide/de/institute/institut-fuer-virusdiagnostik-ivd/referenzlabore/nrl-fuer-bvdmd/. (2023).
19. Stalder, H, Hug, C, Zanoni, R, Vogt, HR, Peterhans, E, Schweizer, M, et al. Una base de datos nacional que vincula la información sobre los huéspedes con los datos de secuencia de sus cepas virales: una herramienta útil para la erradicación de la diarrea viral bovina (DVB) en Suiza. Virus Res. (2016) 218:49–56. doi: 10.1016/j.virusres.2015.09.012
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Wernike, K, Schirrmeier, H, Strebelow, HG y Beer, M. Erradicación del virus de la diarrea viral bovina en Alemania: diversidad de subtipos y detección de virus de vacunas vivas. Microbiol veterinario. (2017) 208:25–9. doi: 10.1016/j.vetmic.2017.07.009
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Wernike, K, y Beer, M. Diagnóstico en el contexto de un programa de erradicación: resultados del ensayo alemán de competencia en diarrea viral bovina. Microbiol veterinario. (2019) 239:108452. doi: 10.1016/j.vetmic.2019.108452
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Hoffmann, B, Depner, K, Schirrmeier, H, y Beer, M. Un sistema universal de control interno heterólogo para ensayos de RT-PCR dúplex en tiempo real utilizados en un sistema de detección de pestivirus. Métodos J Virol. (2006) 136:200–9. doi: 10.1016/j.jviromet.2006.05.020
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Schaarschmidt, U, Schirrmeier, H, Strebelow, G, y Wolf, G. Detección del virus de la enfermedad fronteriza en un rebaño de ovejas en Sajonia. Berl Munch Tierarztl. (2000) 113:284–8.
24. Kimura, M. Un método simple para estimar las tasas evolutivas de sustituciones de bases a través de estudios comparativos de secuencias de nucleótidos. J Mol Evol. (1980) 16:111–20. doi: 10.1007/BF01731581
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Kumar, S, Stecher, G, Li, M, Knyaz, C y Tamura, K. MEGA X: análisis de genética evolutiva molecular a través de plataformas informáticas. Mol Biol Evol. (2018) 35:1547–9. DOI: 10.1093/molbev/msy096
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. King, J, Pohlmann, A, Dziadek, K, Beer, M y Wernike, K. Conexión con el ganado: epidemiología molecular de los brotes de BVDV a través de la secuenciación rápida del genoma completo de nanoporos de muestras clínicas. BMC Vet Res. (2021) 17:242. doi: 10.1186/s12917-021-02945-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Moennig, V, y Becher, P. Programas de control de pestivirus: ¿hasta dónde hemos llegado y hacia dónde vamos? Anim Health Res Rev. (2015) 16:83–7. doi: 10.1017/S1466252315000092
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Riitho, V, Strong, R, Larska, M, Graham, SP y Steinbach, F. Heterogeneidad de los plaguivirus bovinos y su posible impacto en la vacunación y el diagnóstico. Virus. (2020) 12:1134. doi: 10.3390/v12101134
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Moennig, V, Eicken, K, Flebbe, U, Frey, HR, Grummer, B, Haas, L, et al. Implementación de la vacunación en dos etapas en el control de la diarrea viral bovina (DVB). Prev Vet Med. (2005) 72:109–14. doi: 10.1016/j.prevetmed.2005.08.011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Griebel, PJ. Vacunación contra el BVDV en América del Norte: riesgos versus beneficios. Anim Health Res Rev. (2015) 16:27–32. doi: 10.1017/S1466252315000080
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Plotkin, S.A. Vacunas: el siglo IV. Clin Vacuna Immunol. (2009) 16:1709–19. doi: 10.1128/CVI.00290-09
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Wernike, K, Michelitsch, A, Aebischer, A, Schaarschmidt, U, Konrath, A, Nieper, H, et al. Aparición de una cepa comercial de vacuna viva BVDV-1 con doble mutación N(pro) y E(rns) en terneros recién nacidos. Virus. (2018) 10:274. doi: 10.3390/v10050274
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Gethmann, J, Homeier, T, Holsteg, M, Schirrmeier, H, Sasserath, M, Hoffmann, B, et al. El brote de BVD-2 provoca grandes pérdidas en las explotaciones ganaderas de Alemania Occidental. Heliyon. (2015) 1:E00019. doi: 10.1016/j.heliyon.2015.e00019
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Schirrmeier, H, Strebelow, G, Depner, K, Hoffmann, B y Beer, M. Caracterización genética y antigénica de un aislado de pestivirus atípico, un miembro putativo de una nueva especie de pestivirus. J Gen Virol. (2004) 85:3647–52. doi: 10.1099/vir.0.80238-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Bauermann, FV, y Ridpath, JF. Virus similares a HoBi, el típico ‘pestivirus bovino atípico’. Anim Health Res Rev. (2015) 16:64–9. doi: 10.1017/S146625231500002X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Decaro, N, Lucente, MS, Mari, V, Sciarretta, R, Pinto, P, Buonavoglia, D, et al. Pestivirus similar a Hobi en fetos bovinos abortados. J Clin Microbiol. (2012) 50:509–12. doi: 10.1128/JCM.05887-11
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Luzzago, C, y Decaro, N. Epidemiología de los pestivirus bovinos que circulan en Italia. Frente vet sci. (2021) 8:669942. doi: 10.3389/fvets.2021.669942
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Schoepf, K, Revilla-Fernandez, S, Steinrigl, A, Fuchs, R, Sailer, A, Weikel, J, et al. Evaluación epidemiológica retrospectiva de los datos moleculares y zoológicos en el marco del programa de control del virus de la diarrea vírica bovina (BVDV) en Austria Occidental durante 2009-2014. Berl Munch Tierarztl. (2016) 129:196–201. doi: 10.2376/0005-9366-129-15102
39. Vilcek, S, y Rossmanith, W. El papel de las técnicas de genética molecular en la erradicación del BVDV en Baja Austria. Vet Ital. (2022) 58. doi: 10.12834/VetIt.2595.16049.1
40. Monteiro, FL, Martins, B, Cargnelutti, JF, Noll, JG, Weiblen, R, y Flores, EF. Identificación genética de pestivirus de ganado vacuno de carne en el sur de Brasil. Braz J Microbiol. (2019) 50:557–63. doi: 10.1007/s42770-019-00058-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Wang, L, Wu, X, Wang, C, Song, C, Bao, J y Du, J. Origen y transmisión del virus de la diarrea viral bovina tipo 1 en China revelado por análisis filodinámico. Res Vet Sci. (2019) 128:162–9. doi: 10.1016/j.rvsc.2019.11.015
42. Booth, RE, Thomas, CJ, El-Attar, LM, Gunn, G, y Brownlie, J. Un análisis filogenético del virus de la diarrea viral bovina (BVDV) aislado de seis regiones diferentes del Reino Unido y se vincula con datos de movimiento animal. Res. Veterinaria. (2013) 44:43. doi: 10.1186/1297-9716-44-43
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Braun, U, Hilbe, M, Janett, F, Hässig, M, Zanoni, R, Frei, S, et al. Transmisión del virus de la enfermedad fronteriza de un ternero persistentemente infectado a novillas seronegativas al principio de la gestación. BMC Vet Res. (2015) 11:43. doi: 10.1186/s12917-014-0275-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: virus de la diarrea viral bovina, pestivirus, infección persistente, control, análisis de secuencia, tipificación molecular, epidemiología, filogenia
Cita: Wernike K, Pfaff F y Beer M (2024) «Fading out»: epidemiología genómica del último ganado BVDV persistentemente infectado en Alemania. Frente. Vet. Sci. 10:1339248. doi: 10.3389/fvets.2023.1339248
Recibido: 15 de noviembre de 2023; Aceptado: 14 de diciembre de 2023;
Publicado: 04 Enero 2024.
Editado por:
Camilla Luzzago, Universidad de Milán, Italia
Revisado por:
Mihaela Niculae, Universidad de Ciencias Agrícolas y Medicina Veterinaria de Cluj-Napoca, Rumania
Fernando Bauermann, Universidad Estatal de Oklahoma, Estados Unidos
Derechos de autor © 2024 Wernike, Pfaff y Cerveza. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY). S
*Correspondencia: Kerstin Wernike, kerstin.wernike@fli.de
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía