Establecimiento de un modelo experimental de dermatitis atópica inducida por ovoalbúmina en caninos
Establecimiento de un modelo experimental de dermatitis atópica inducida por ovoalbúmina en caninos
 Ha-Young Shin1,2
Ha-Young Shin1,2  Hyung Jun Jin1,3
Hyung Jun Jin1,3  Hyun-Jin Tae2
Hyun-Jin Tae2  Hong-Geun Oh4
Hong-Geun Oh4  Jeong Ho Hwang1,3*
Jeong Ho Hwang1,3*- 1Grupo de Investigación de Modelos Animales, Instituto Coreano de Toxicología, Jeongeup, República de Corea
- 2Centro de Desarrollo de Nuevos Fármacos para Animales de Compañía, Instituto Coreano de Toxicología, Jeongeup, República de Corea
- 3Facultad de Medicina Veterinaria e Instituto de Investigación sobre Bioseguridad, Universidad Nacional de Jeonbuk, Iksan, Jeollabuk-do, República de Corea
- 4División de Investigación y Desarrollo, HUVET Co., Ltd., Iksan-si, República de Corea
Introducción: Se requiere un modelo estándar fiable para evaluar la eficacia de los nuevos fármacos para los animales de compañía, especialmente los perros. La dermatitis atópica canina (DAc), también conocida como enfermedad inflamatoria alérgica de la piel, es una afección común. Actualmente, el modelo animal de ácaro del polvo doméstico se utiliza en la investigación de la enfermedad de Alzheimer; Sin embargo, este modelo exhibe una variación individual significativa y es difícil de estandarizar. En este estudio, utilizamos la ovoalbúmina como antígeno para sensibilizar y estimular a los perros, estableciendo así un modelo estable que imita la respuesta T-helper 2 (Th2) observada en la dAC. Nuestro objetivo fue crear un modelo de ADCc que pudiera emplearse para evaluar la eficacia de nuevos fármacos e imitar la respuesta alérgica dominante Th2 observada en la patogénesis de la dermatitis atópica de perros.
Métodos: En este estudio se utilizaron seis beagles. Se aplicó solución salina normal a dos animales, y ovoalbúmina a cuatro, en su piel dorsal.
Resultados: Los grupos tratados con ovoalbúmina presentaron síntomas clínicos de ADCc, como prurito y eritema. Además, los niveles plasmáticos de los marcadores de ADCc inmunoglobulina E y quimiocina CCL17 fueron mayores en el grupo tratado con ovoalbúmina que en el grupo control del vehículo. El grosor de la piel de la epidermis aumentó significativamente en el grupo tratado con ovoalbúmina, observándose infiltración de células inflamatorias en la región de la dermis engrosada. En conclusión, el tratamiento de la piel canina con una concentración óptima de ovoalbúmina indujo síntomas típicos similares a los de la enfermedad de Alzheimer, y los análisis histológicos y moleculares confirmaron una mayor respuesta inmunitaria relacionada con Th2.
Conclusión: Por lo tanto, establecimos con éxito una respuesta adecuada de Th2 dominante que imita la dDAC, lo que facilitará la investigación específica de la dermatitis atópica en perros.
1 Introducción
La dermatitis atópica canina (DACc) es una enfermedad inflamatoria común de la piel que implica disfunción de la barrera epidérmica y prurito recurrente en perros (1). La dermatitis atópica (DA) es una enfermedad hereditaria, aunque es posible el desarrollo espontáneo en cualquier individuo. Los factores ambientales, como la exposición a alérgenos, juegan un papel importante en el desencadenamiento de esta afección (2). El tratamiento de la enfermedad de Alzheimer tanto en humanos como en perros implica la utilización de medicamentos que pueden suprimir la respuesta de las células T helper 2 (Th2) (3-6) y mantener el control de la enfermedad a largo plazo (7-10).
Al igual que en los seres humanos, las lesiones cutáneas cAD se caracterizan por la infiltración dérmica de células T CD4 y eosinófilos, conocida como respuesta Th2. La respuesta Th2 es una reacción inmunitaria exagerada desencadenada por alérgenos (11). El sistema inmunitario de los perros genéticamente predispuestos reconoce los alérgenos y activa las células Th2. Las células Th2 activadas migran al sitio de estimulación a través de CCL17, una quimiocina que mueve las células inflamatorias, y estas células estimulan las células B (12). Las células Th2 liberan citocinas de señalización específicas, como la interleucina-4 (IL-4), la interleucina-13 (IL-13) y la interleucina-31 (IL-31). Las citocinas liberadas promueven una respuesta inflamatoria en la piel, lo que conduce a síntomas característicos de la DAc, como prurito, eritema y edema. La diferenciación inflamatoria de las células T y la respuesta inmunitaria Th2 en la piel están reguladas por mediadores inflamatorios, como la COX-2 (13, 14), pero el papel de la COX-2 en la respuesta inmunitaria de la ADc no está claro. Además, el hallazgo de que la inhibición de la expresión de COX-2 en un modelo de ratón atópico alérgico promueve una respuesta Th2 (15) fue un indicador para la construcción del modelo de cAD dominante en Th2.+
La IL-4 y la IL-13 median la hipersensibilidad de los anticuerpos de inmunoglobulina E (IgE) de las células B, que está implicada en las reacciones alérgicas. Los anticuerpos IgE se unen a los mastocitos, que son abundantes en la piel. Tras la exposición posterior al mismo alérgeno, los anticuerpos IgE desencadenan la degranulación de los mastocitos. La degranulación da lugar a la liberación de histaminas y otros mediadores, lo que provoca prurito y la consiguiente inflamación. Sin embargo, las citocinas Th2 varían mucho según la muestra y el momento de la medición. En el caso de CCL17, las quimiocinas relacionadas con Th2 se pueden medir de manera relativamente estable y, por lo tanto, se están estudiando activamente como dianas que pueden determinar la gravedad de enfermedades alérgicas como la EA.
Confirmar la eficacia y la seguridad de los nuevos fármacos desarrollados para el tratamiento de enfermedades, incluida la atopia, en animales diana es esencial para proteger a los animales y garantizar una selección óptima del tratamiento (16). La sensibilización epicutánea con alérgenos, como los ácaros del polvo doméstico (HDM), se ha utilizado ampliamente para establecer modelos de ADC o para estudiar la alergia de contacto (17, 18). Sin embargo, los animales inducidos por HDM muestran variaciones muy individuales, y la estandarización de los protocolos es difícil (19, 20). Por lo tanto, no se dispone de modelos animales fiables para realizar experimentos, estudios no clínicos o estudios clínicos de fase II.
En este estudio utilizamos la ovoalbúmina como antígeno de sensibilización y estimulación para estudiar su eficacia y actividad inmunológica. Dedujimos la concentración óptima de ovoalbúmina necesaria para fines de modelización y establecimos un modelo de ADCc que imita la respuesta de EA dominante Th2. Este modelo servirá como una herramienta valiosa para futuras investigaciones en este campo.
2 Materiales y métodos
2.1 Animales
En este experimento se utilizaron seis beagles machos (Canis lupus familiaris). Los grupos de control vehicular (VC), T1 y T2 estaban compuestos por dos animales cada uno. Todos los perros eran machos de 7 meses de edad con un peso medio de 7,95 kg (rango, 7,2-8,7), y fueron obtenidos de Raon Bio (Yongin, Corea del Sur). Antes del experimento, un período de aclimatación de 7 días fue seguido por una cuarentena veterinaria. Se incluyeron en este estudio animales sanos que no desarrollaron dermatitis ni enfermedades alérgicas durante la cuarentena. Todos los animales fueron alojados en jaulas individuales (120 × 180 × 150 cm3). Durante el período experimental, la temperatura ambiente y la humedad se mantuvieron entre 24 °C (± 2 °C) y 40-60%, respectivamente. La intensidad de la luz fluorescente se mantuvo en 150-300 lx, la tasa de cambio de aire fue de 10-15 veces/h y se mantuvo un ciclo de luz de 12 h. Los animales fueron alimentados con comida seca para perros (sin huevos) y se les permitió beber agua limpia del grifo voluntariamente. No se realizó ningún baño durante el período de estudio para evitar cambios en los parámetros de la condición de la piel. Todos los experimentos con animales se llevaron a cabo de acuerdo con las directrices del Comité Institucional de Cuidado y Uso de Animales de Huvet (número de aprobación de la IACUC: HV 2022-011).
2.2 Diseño del estudio
En este estudio, el grupo VC fue expuesto epicutáneamente a solución salina normal, los grupos T1 y T2 fueron expuestos epicutáneamente a 1 y 5 mg/kg de ovoalbúmina, respectivamente.
El estudio constó de dos fases. En la Fase 1, los beagles fueron sensibilizados epicutáneamente a la ovoalbúmina durante dos semanas. En este momento, se consideró que los perros estaban sensibilizados a la ovoalbúmina, aunque la mayoría de ellos (3 de cada 4) no presentaban lesiones cutáneas. En la Fase 2, los beagles fueron estimulados con ovoalbúmina durante dos semanas.
La ovoalbúmina se aplicó con apósitos transparentes Tegaderm™ (3 M, St. Paul, MN, Estados Unidos). Decidimos utilizar ovoalbúmina en la zona dorsal, que no es una zona típica para el desarrollo de lesiones de ADCc, ya que era probable que los animales eliminaran el Tegaderm mientras se movían. Para crear el modelo de ADCh, la piel dorsal de los animales de experimentación se recortó y desinfectó con alcohol isopropílico al 70%. Los grupos tratados con ovoalbúmina se sensibilizaron con 1 y 5 mg/kg de ovoalbúmina disuelta en suero fisiológico normal todos los días durante 2 semanas. Se administró suero fisiológico normal a los animales VC. Las imágenes macroscópicas se adquirieron en los días 0, 2, 7 y 14.
2.3 Evaluación clínica de las lesiones cutáneas
Se evaluó la gravedad de los síntomas utilizando una versión simplificada del sistema de puntuación de Draize utilizado en estudios toxicológicos y dermatológicos para evaluar la irritación de la piel, con puntuaciones altas que indican inflamación grave, lesión e hinchazón causadas por la ovoalbúmina. El sistema de puntuación de irritación dérmica de Draize (DDISS) se puntúa dos veces por semana (21), donde 0 indica que no hay eritema, escara ni edema, 1 indica eritema, escara y edema apenas perceptibles, 2 indica eritema, escara y edema claramente visibles, 3 indica eritema, escara y edema de moderados a graves, y 4 indica eritema grave y lesiones tisulares levemente profundas de Escara, y edema severo que se extiende más allá del área expuesta.
2.4 Recogida y análisis de muestras
Para analizar el hemograma completo y la química sanguínea, se recolectó sangre total en un tubo anticoagulante de ácido etilendiaminérgico tetraacético (EDTA) y un tubo separador de suero (SST), respectivamente. Un hemograma completo (BC-2800 Vet; Mindray, Shenzhen, China) se realizó utilizando muestras de sangre entera. Las muestras de sangre en SST se centrifugaron durante 10 min a 3.000 rpm, y el sobrenadante se recolectó y se utilizó como suero para el análisis (DRI-CHEM NX700; Fujifilm, Tokio, Japón).
2.5 Histopatología
El día 15, todos los animales fueron anestesiados para obtener muestras de piel en las regiones dorsales. Se recogieron cuatro biopsias utilizando un punzón de biopsia de 8 mm en el área dorsal de cada uno de los seis perros después de la evaluación clínica y el monitoreo de la condición de la piel. Para el examen histopatológico, el 50% de las muestras de piel se fijaron en una solución de formalina tamponada neutra al 10%; para el análisis de citoquinas, el 50% de las muestras conservadas en ARN-posterior (AM7021, Invitrogen, Carlsbad, CA, Estados Unidos) se congelaron instantáneamente en nitrógeno líquido. Los tejidos de la piel se conservaron en formol tamponado neutro al 10% durante la noche y se incluyeron en parafina. A continuación, las muestras de tejido se seccionaron a intervalos de 5 μm. Las muestras seccionadas se desparafinaron y se tiñeron con hematoxilina y eosina para examinar las anomalías estructurales de la piel. La tinción tricrómica de Masson se realizó de acuerdo con las instrucciones del fabricante (Cat. No. IFU-2; ScyTek, Logan, UT, Estados Unidos). Los portaobjetos desparafinados se incubaron en una solución de hematoxilina de hierro de Weigert, una solución de fucsina de ácido escarlata de Biebrich, ácido fosfotúngstico-fosfomolíbdico, azul de anilina y una solución de ácido acético al 1%. El colágeno de los tejidos conectivos se tiñó de azul, el citoplasma se tiñó de rojo o rosa y los núcleos se tiñeron de rojo oscuro o púrpura. Los resultados de la tinción fueron examinados por un histopatólogo.
2.6 Reacción cuantitativa en cadena de la polimerasa con transcriptasa inversa
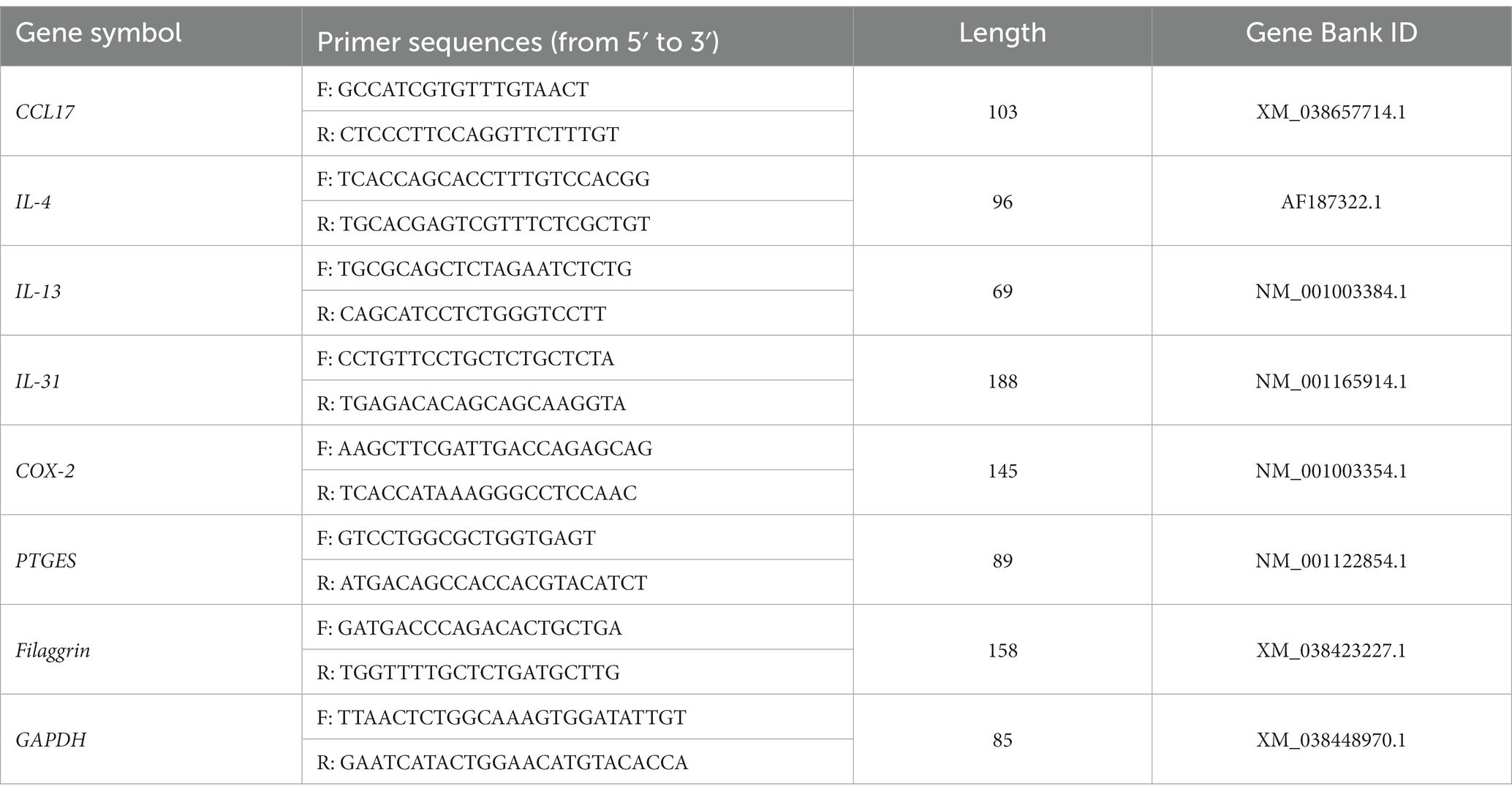
Para medir la cantidad de ácido ribonucleico (ARN) en las muestras, se extrajo ARN de los tejidos de la biopsia de piel utilizando el RNeasy Mini Kit (Qiagen, Hilden, Alemania) y se transcribió inversamente utilizando el QuantiNova Reverse Transcription Kit (Qiagen, Hilden, Alemania). Se prepararon mezclas de reacción de volumen 20 μL para qRT-PCR, que contenían 2 × Power SYBR Green PCR Master Mix (Applied Biosystems, Waltham, MA, Estados Unidos), y las reacciones se realizaron utilizando un sistema de PCR en tiempo real QuantStudio 5 (Applied Biosystems). Se utilizó gliceraldehído-3-fosfato deshidrogenasa (GAPDH) como control endógeno para la normalización. Las reacciones cuantitativas en cadena se realizaron utilizando cebadores que abarcan intrón, cuyas secuencias se enumeran en la Tabla 1. La inducción del plegamiento se cuantificó mediante los 2−ΔΔCT método.
2.7 Ensayo de inmunoabsorción ligado a enzimas
Para analizar las citocinas en las muestras de sangre, se recolectaron muestras de sangre total en tubos anticoagulantes de EDTA y se centrifugaron durante 10 min a 3.000 rpm, y el sobrenadante se recolectó como plasma. Todos los pasos se llevaron a cabo en el rango de temperatura de 2 a 8 °C. Los niveles caninos de IgE, IL-4 e IL-31 se midieron utilizando kits ELISA (Cat. No. CI0014 y CI0041 para IL-4 e IL-31, respectivamente; Neobiolab, Cambridge, MA, EE.UU.; Gato. No. ab157700 para IgE; Abcam, Cambridge, Reino Unido), de acuerdo con los protocolos de los fabricantes.
2.8 Análisis estadístico
Para el análisis estadístico se utilizó el software Prism 8 (GraphPad Software, San Diego, CA, USA). Se utilizó la media ± la desviación estándar (DE) para representar los datos en todos los gráficos. Para el análisis de tejidos, se llevaron a cabo al menos tres experimentos independientes por triplicado. Para el análisis de plasma, se tomó una muestra de sangre de la vena cefálica de dos animales por grupo, y todas las pruebas se realizaron por triplicado técnico. Las comparaciones entre los grupos se realizaron mediante la prueba t de Student. La significación estadística se fijó en un valor de p inferior a 0,05.
3 Resultados
3.1 Perros sensibilizados a la ovoalbúmina con síntomas clínicos similares a las reacciones típicas de la EAc
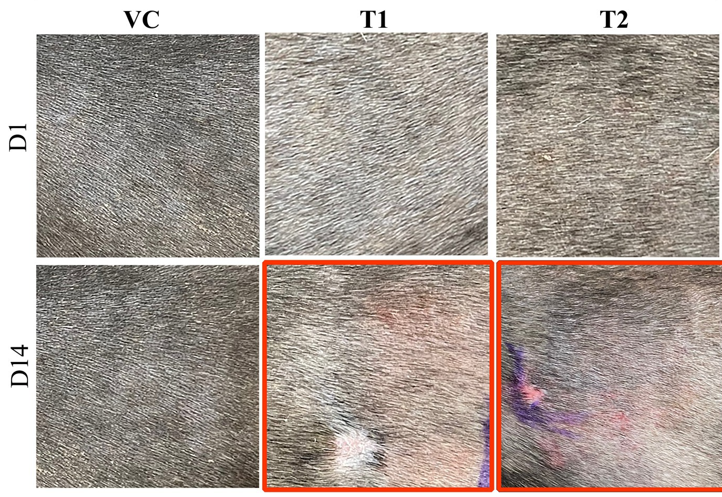
Los síntomas clínicos de la atopia en perros incluyen eritema, edema y excoriaciones cutáneas. Examinamos visualmente las manifestaciones clínicas típicas de la atopia, incluyendo eritema, edema y excoriaciones, en el grupo tratado con ovoalbúmina. Los síntomas se evaluaron y puntuaron mediante los criterios DDISS. En comparación con los del grupo VC, el grupo tratado con ovoalbúmina mostró puntuaciones más altas, observándose un aumento notable en el grupo T1 en comparación con el grupo T2. Además, la puntuación de gravedad de la dermatitis en el grupo T1 (Figuras 1A,B).
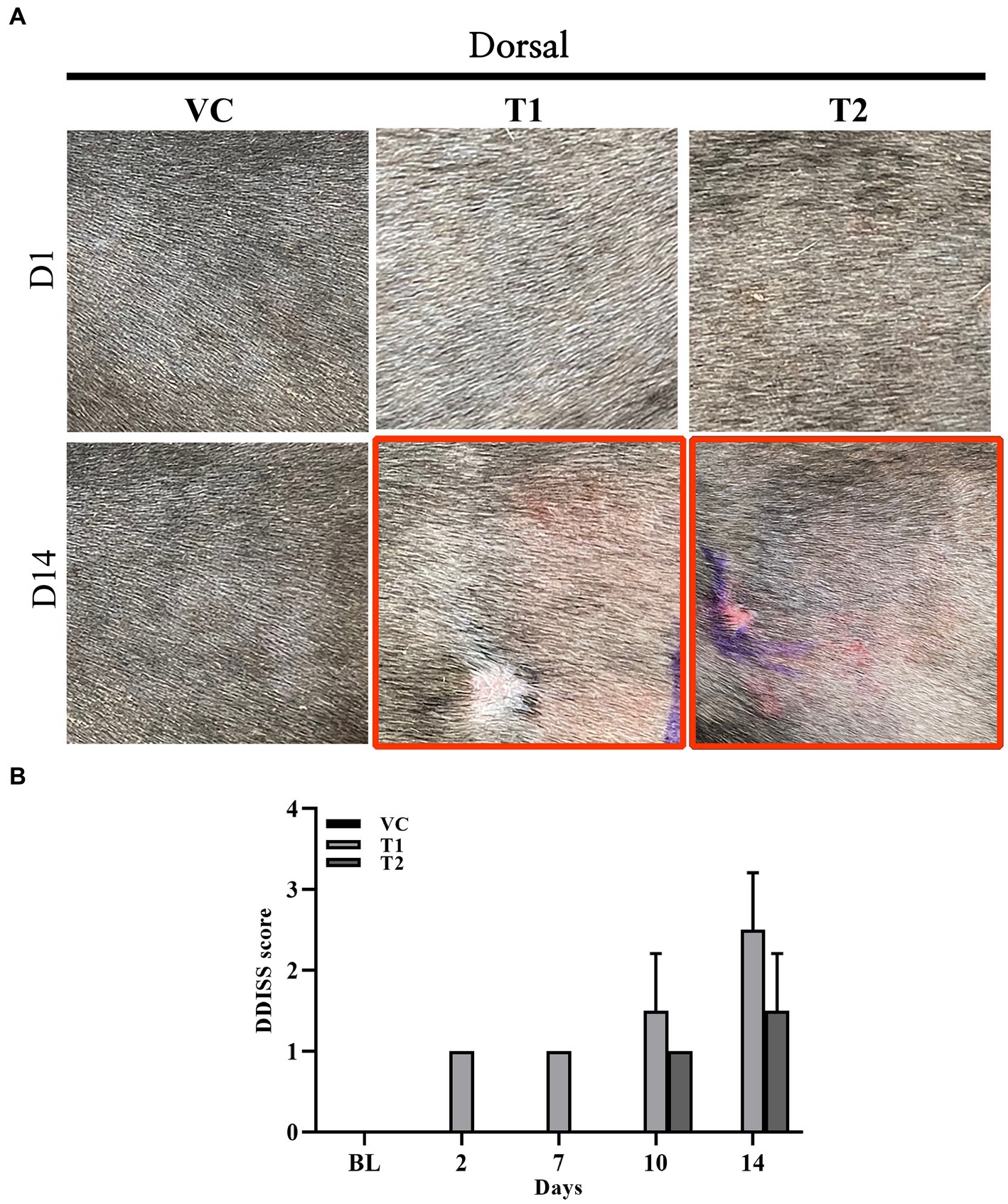 Figura 1. Cambios en las observaciones macroscópicas durante la estimulación con ovoalbúmina. (A) Imagen macroscópica adquirida el día 1 (fila superior) y 14 (fila inferior) (observación macroscópica) durante la estimulación con ovoalbúmina en todos los grupos (VC, T1 y T2). (B) Nivel de irritación de la piel puntuado utilizando el sistema de puntuación de irritación dérmica de Draize (DDISS) en la estimulación de la ovoalbúmina. El grupo tratado con ovoalbúmina mostró síntomas clínicos más pronunciados de formación de eritema en comparación con el grupo de control del vehículo (VC). Las puntuaciones fueron más altas en el grupo T1 (1 mg/mL) en comparación con el grupo T2 (5 mg/mL). Los valores representan la media ± SD. VC, control del vehículo; T1, grupo de tratamiento 1 (tratamiento con ovoalbúmina de baja concentración); T2, grupo de tratamiento 2 (tratamiento con ovoalbúmina de alta concentración) *p < 0,05; **p < 0,01; p < 0,005.
Figura 1. Cambios en las observaciones macroscópicas durante la estimulación con ovoalbúmina. (A) Imagen macroscópica adquirida el día 1 (fila superior) y 14 (fila inferior) (observación macroscópica) durante la estimulación con ovoalbúmina en todos los grupos (VC, T1 y T2). (B) Nivel de irritación de la piel puntuado utilizando el sistema de puntuación de irritación dérmica de Draize (DDISS) en la estimulación de la ovoalbúmina. El grupo tratado con ovoalbúmina mostró síntomas clínicos más pronunciados de formación de eritema en comparación con el grupo de control del vehículo (VC). Las puntuaciones fueron más altas en el grupo T1 (1 mg/mL) en comparación con el grupo T2 (5 mg/mL). Los valores representan la media ± SD. VC, control del vehículo; T1, grupo de tratamiento 1 (tratamiento con ovoalbúmina de baja concentración); T2, grupo de tratamiento 2 (tratamiento con ovoalbúmina de alta concentración) *p < 0,05; **p < 0,01; p < 0,005.
3.2 Histopatología de perros sensibilizados a la ovoalbúmina similar a la ADC típica
Desde el punto de vista histopatológico, la ADc se caracteriza por un engrosamiento de la epidermis como resultado de un aumento de la proliferación de queratinocitos, junto con la infiltración de células inflamatorias, incluidos linfocitos y eosinófilos. En nuestro estudio, observamos una infiltración comparable de células inmunitarias, incluidos linfocitos, eosinófilos y neutrófilos, en el grupo tratado con ovoalbúmina (Figuras 2A, C). Además, observamos infiltración de células inflamatorias y anomalías estructurales que provocan inflamación dérmica linfocítica (inflamación perivascular) con epiteliotropismo focal en la capa dérmica del estrato córneo del grupo tratado con ovoalbúmina (Figuras 2A, B). El examen histológico con hematoxilina y eosina y la tinción tricrómica de Masson revelaron un aumento notable y estadísticamente significativo del grosor de la epidermis en el grupo tratado con ovoalbúmina en comparación con el grupo VC (Figura 2C). Estos hallazgos indican que las características histopatológicas de la EA inducida por ovoalbúmina son muy similares a las que se observan comúnmente en pacientes con EA.
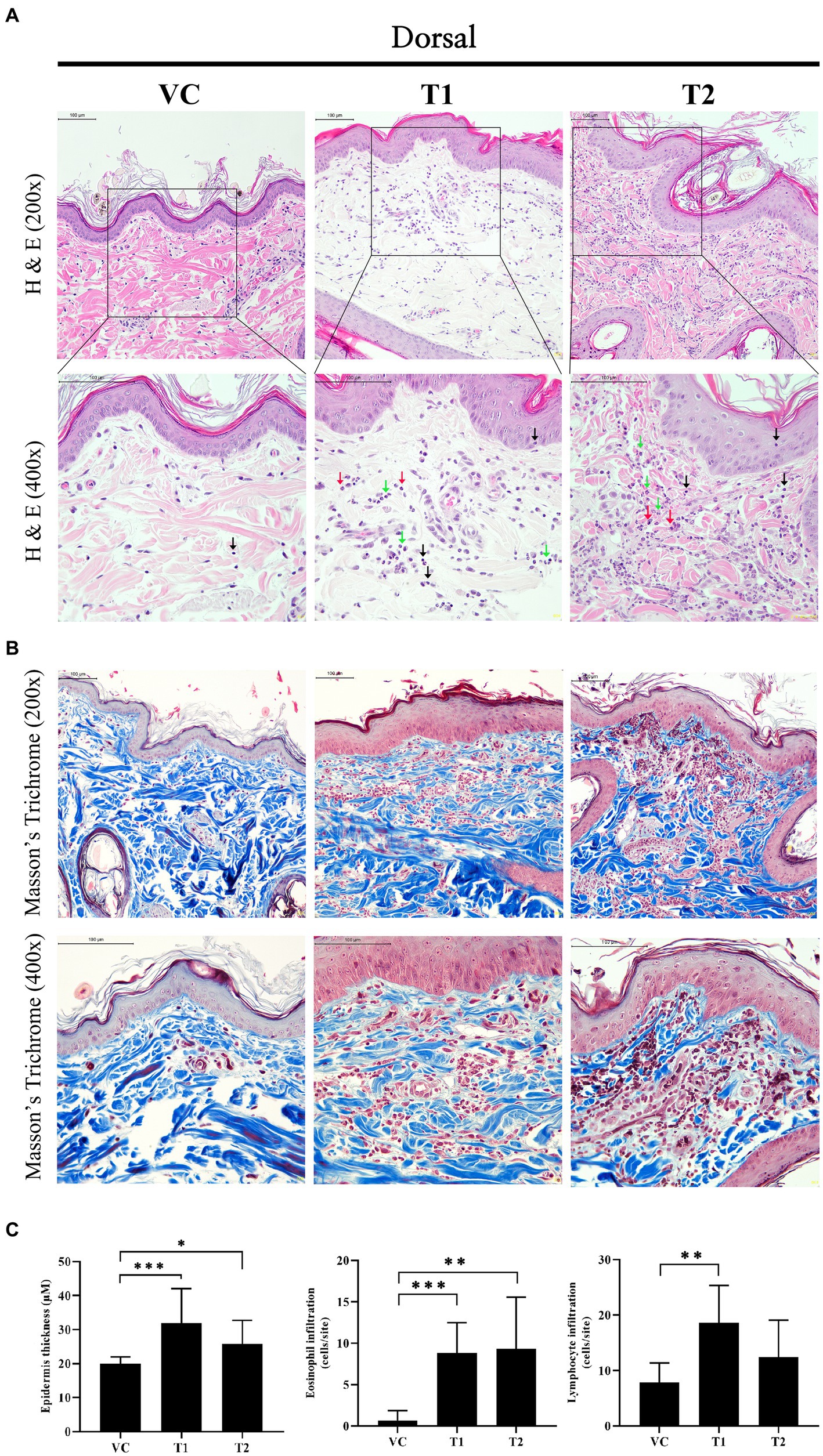 Figura 2. Cambios en la histopatología después de la estimulación con ovoalbúmina. (A) Imagen que muestra el análisis histopatológico de la tinción de hematoxilina y eosina en los tejidos de la piel. Las filas superiores son 200x y la fila inferior es 400x. Barra de escala = 100 μm. Flecha negra: Linfocito; Flecha verde: Neutrófilos; Flecha roja: Eosinófilo. Estrella y flecha amarillas: anomalías estructurales que producen inflamación dérmica linfocítica (inflamación perivascular) con epiteliotropismo focal. (B) Imagen que muestra el análisis histopatológico de la tinción tricrómica de Masson en los tejidos de la piel. Las filas superiores son 200x y la fila inferior es 400x. Barra de escala = 100 μm. (C) Espesor epidérmico y número de células inmunitarias infiltrantes (eosinófilos, linfocitos). Los valores representan la media ± SD. VC, control del vehículo; T1, grupo de tratamiento 1 (tratamiento con ovoalbúmina de baja concentración); T2, grupo de tratamiento 2 (tratamiento con ovoalbúmina de alta concentración) *p < 0,05; **p < 0,01; p < 0,005.
Figura 2. Cambios en la histopatología después de la estimulación con ovoalbúmina. (A) Imagen que muestra el análisis histopatológico de la tinción de hematoxilina y eosina en los tejidos de la piel. Las filas superiores son 200x y la fila inferior es 400x. Barra de escala = 100 μm. Flecha negra: Linfocito; Flecha verde: Neutrófilos; Flecha roja: Eosinófilo. Estrella y flecha amarillas: anomalías estructurales que producen inflamación dérmica linfocítica (inflamación perivascular) con epiteliotropismo focal. (B) Imagen que muestra el análisis histopatológico de la tinción tricrómica de Masson en los tejidos de la piel. Las filas superiores son 200x y la fila inferior es 400x. Barra de escala = 100 μm. (C) Espesor epidérmico y número de células inmunitarias infiltrantes (eosinófilos, linfocitos). Los valores representan la media ± SD. VC, control del vehículo; T1, grupo de tratamiento 1 (tratamiento con ovoalbúmina de baja concentración); T2, grupo de tratamiento 2 (tratamiento con ovoalbúmina de alta concentración) *p < 0,05; **p < 0,01; p < 0,005.
3.3 Los perros sensibilizados a la ovoalbúmina similares a la enfermedad de Alzheimer típicas regulan a la baja la filagrina, pero regulan al alza la expresión de la COX-2 y aumentan la producción de prostaglandinas (PGE)
En nuestro modelo de ADCh, examinamos la expresión de factores clave implicados en la barrera cutánea, a saber, la filagrina y la COX-2. Nuestro análisis de ARNm de la piel expuesta a la ovoalbúmina reveló una disminución significativa dependiente de la dosis en los niveles de expresión de filagrina en el grupo tratado con ovoalbúmina en comparación con el grupo VC (Figura 3A). Además, el tratamiento con ovoalbúmina indujo un aumento significativo en la expresión de COX-2 y un aumento asociado en la producción de PGE2. Estos hallazgos indican que la ovoalbúmina causa daño a la barrera cutánea e inflamación similar a la cAD de una manera dependiente de la concentración (Figuras 3B, C).
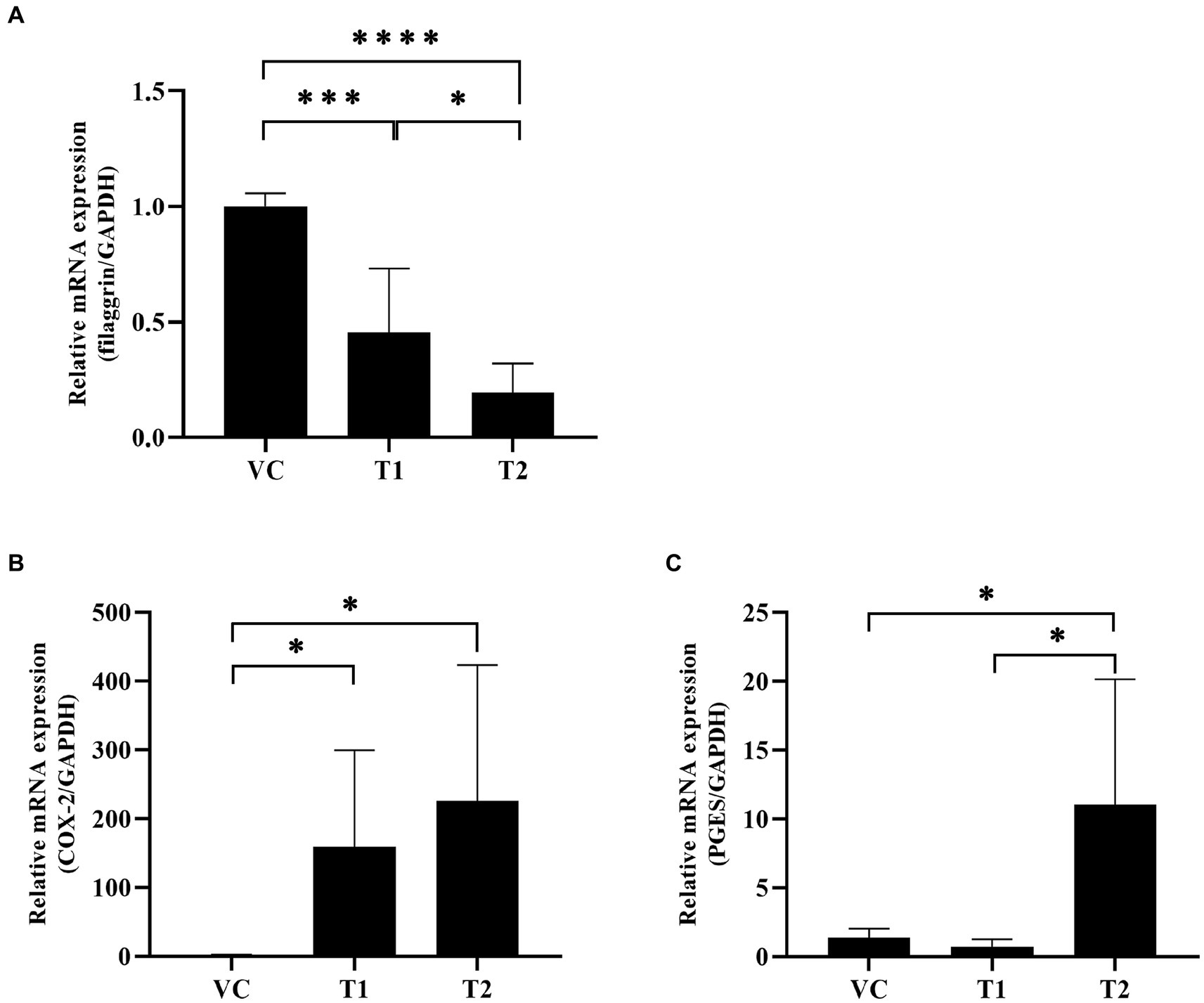 Figura 3. Cambios en los factores relacionados con la inflamación y los niveles de expresión del ARNm de la proteína de barrera cutánea después de la estimulación con ovoalbúmina. Los niveles de ARNm de citocinas relacionadas con la inflamación temprana se cuantificaron mediante PCR con transcripción inversa. (A) El nivel de expresión del ARNm de filagrina disminuyó significativamente después de la estimulación con ovoalbúmina. (B) El nivel de expresión de ARNm de COX-2 aumentó significativamente después de la estimulación con ovoalbúmina. (C) El nivel de expresión de ARNm de PGES aumentó significativamente después de la estimulación de la ovoalbúmina en el grupo T2, no en el grupo T1. Todos los valores representan la media ± SD. VC, control del vehículo; T1, grupo de tratamiento 1 (tratamiento con ovoalbúmina de baja concentración); T2, grupo de tratamiento 2 (tratamiento con ovoalbúmina de alta concentración) *p < 0,05; **p < 0,01; p < 0,005; p < 0,001. VC: control de vehículos; PGES: prostaglandinas.
Figura 3. Cambios en los factores relacionados con la inflamación y los niveles de expresión del ARNm de la proteína de barrera cutánea después de la estimulación con ovoalbúmina. Los niveles de ARNm de citocinas relacionadas con la inflamación temprana se cuantificaron mediante PCR con transcripción inversa. (A) El nivel de expresión del ARNm de filagrina disminuyó significativamente después de la estimulación con ovoalbúmina. (B) El nivel de expresión de ARNm de COX-2 aumentó significativamente después de la estimulación con ovoalbúmina. (C) El nivel de expresión de ARNm de PGES aumentó significativamente después de la estimulación de la ovoalbúmina en el grupo T2, no en el grupo T1. Todos los valores representan la media ± SD. VC, control del vehículo; T1, grupo de tratamiento 1 (tratamiento con ovoalbúmina de baja concentración); T2, grupo de tratamiento 2 (tratamiento con ovoalbúmina de alta concentración) *p < 0,05; **p < 0,01; p < 0,005; p < 0,001. VC: control de vehículos; PGES: prostaglandinas.
3.4 Los perros sensibilizados a la ovoalbúmina dan lugar a una respuesta dominada por Th2 similar a la de la ADc típica
CCL17, comúnmente conocida como quimiocina regulada por timo y activación (TARC), es una quimiocina importante que se expresa en pacientes con EA. CCL17 estimula la migración de células CCL4-Th2 al sitio de exposición al alérgeno (22). En la enfermedad de Alzheimer, la regulación positiva de la expresión de citocinas relacionadas con las células Th2 se observa no solo en la piel, sino también en las células mononucleares de sangre periférica (PBMC) y en muestras de plasma. Por el contrario, la IgE genera anticuerpos específicos contra alérgenos que se unen a los mastocitos y desencadenan la liberación de moléculas inflamatorias. En consecuencia, identificamos dos factores que desempeñan un papel en la etapa inicial de la respuesta a los DA. Nuestros hallazgos demostraron una regulación positiva significativa de la expresión de quimiocinas CCL17 a nivel de ARNm en el grupo tratado con ovoalbúmina en comparación con el grupo VC. Además, evaluamos los niveles de IgE para confirmar la producción de anticuerpos séricos de IgE total en la EA inducida por ovoalbúmina. Curiosamente, tanto la expresión de CCL17 como los niveles de IgE fueron más altos en el grupo de dosis baja que en el grupo de dosis alta (Figura 4A). Además, analizamos las citoquinas secretadas por los linfocitos T atraídos por el sitio de tratamiento con ovoalbúmina. Este análisis se realizó utilizando muestras de piel y plasma, que confirmaron la presencia de células Th2 reclutadas en la piel. También observamos la secreción predominante de citoquinas asociadas a las células Th2, incluyendo IL-4, IL-13 e IL-31, en la piel. Los niveles de ARNm de estas citocinas mostraron un aumento significativo en el grupo tratado con ovoalbúmina en comparación con el grupo VC (Figura 4B). No se detectó expresión de Th1 en el grupo tratado con ovoalbúmina. Además, observamos una elevación significativa en los niveles de IL-4 e IL-31 en las muestras de plasma del grupo tratado con OVA. Esta observación fue más pronunciada en el grupo de dosis baja que en el grupo de dosis alta (Figura 4C).+
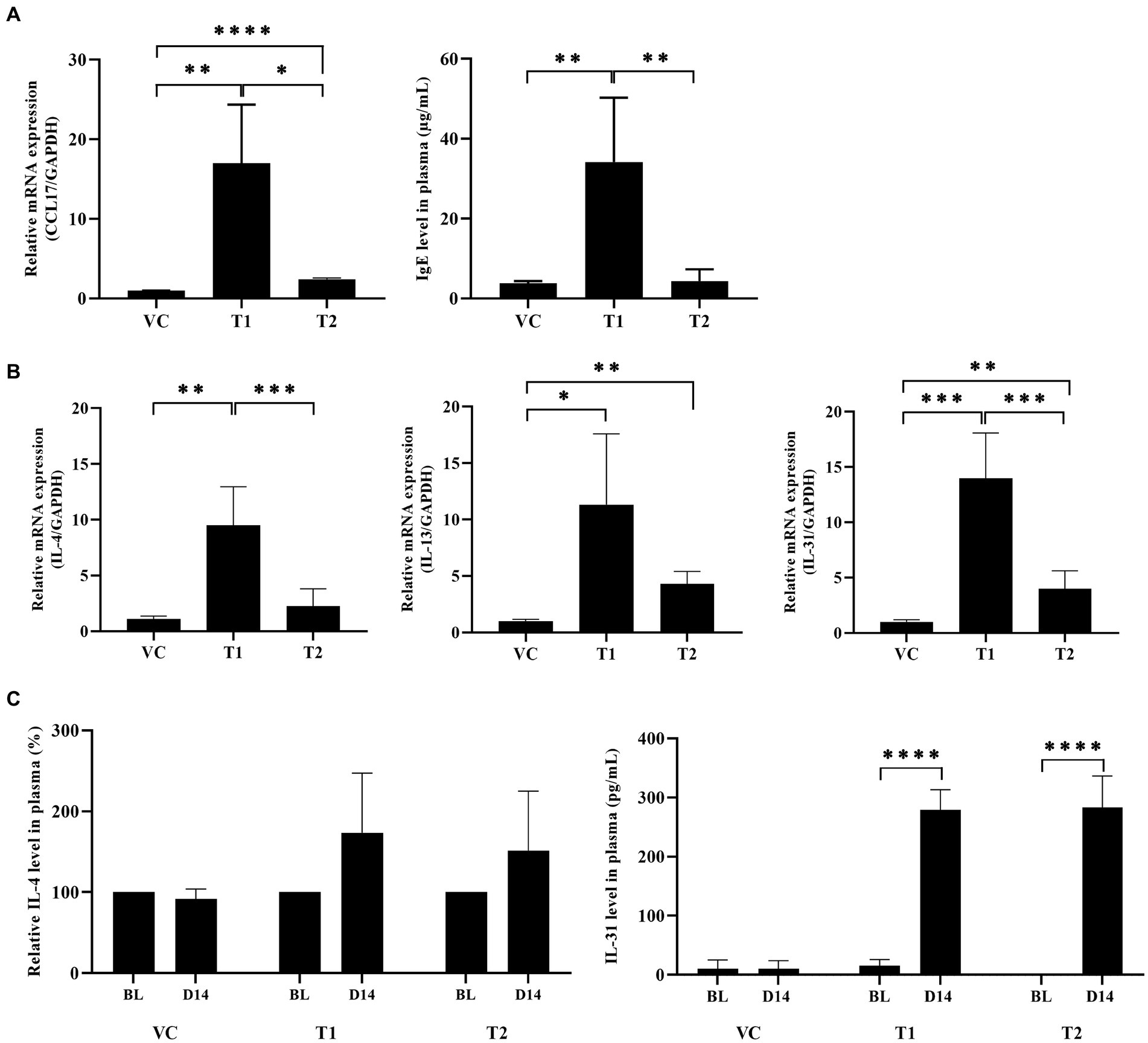 Figura 4. La ovoalbúmina induce una respuesta dominante de Th2 similar a la enfermedad de Alzheimer típica en perros sensibilizados a la ovoalbúmina. (A) Los niveles de proteína IgE total y ARNm de CCL17 se regularon al alza en el grupo tratado con ovoalbúmina en comparación con el grupo VC. (B) Los niveles de expresión de ARNm de citoquinas relacionadas con Th2 en muestras de piel de cAD inducidas por ovoalbúmina se midieron mediante qRT-PCR. (C) Los niveles de expresión proteica de citocinas relacionadas con Th2 en muestras de plasma obtenidas de individuos con EA se evaluaron mediante ELISA. Todos los valores representan la media ± SD. VC, control del vehículo; T1, grupo de tratamiento 1 (tratamiento con ovoalbúmina de baja concentración); T2, grupo de tratamiento 2 (tratamiento con ovoalbúmina de alta concentración) *p < 0,05; **p < 0,01; p < 0,005; p < 0,001. VC, control de vehículos.
Figura 4. La ovoalbúmina induce una respuesta dominante de Th2 similar a la enfermedad de Alzheimer típica en perros sensibilizados a la ovoalbúmina. (A) Los niveles de proteína IgE total y ARNm de CCL17 se regularon al alza en el grupo tratado con ovoalbúmina en comparación con el grupo VC. (B) Los niveles de expresión de ARNm de citoquinas relacionadas con Th2 en muestras de piel de cAD inducidas por ovoalbúmina se midieron mediante qRT-PCR. (C) Los niveles de expresión proteica de citocinas relacionadas con Th2 en muestras de plasma obtenidas de individuos con EA se evaluaron mediante ELISA. Todos los valores representan la media ± SD. VC, control del vehículo; T1, grupo de tratamiento 1 (tratamiento con ovoalbúmina de baja concentración); T2, grupo de tratamiento 2 (tratamiento con ovoalbúmina de alta concentración) *p < 0,05; **p < 0,01; p < 0,005; p < 0,001. VC, control de vehículos.
4 Discusión
En este estudio, nuestro objetivo fue establecer un modelo de respuesta Th2 dominante utilizando ovoalbúmina en perros beagle sanos sin antecedentes conocidos de predisposición genética para desarrollar cAD. En las etapas de sensibilización e inducción, utilizando Tegaderm, se aplicó ovoalbúmina diariamente a perros sin bañarse. Los síntomas clínicos de la atopia se analizaron dos veces por semana mediante puntuación visual. Posteriormente, se realizaron análisis histológicos e inmunológicos después del período de aplicación de la ovoalbúmina para evaluar el modelo de EA utilizando la piel expuesta a la ovoalbúmina.
La dermatitis atópica es una afección inflamatoria común de la piel que afecta tanto a humanos como a perros en todo el mundo (23, 24). El tratamiento de la dermatitis atópica humana y la dADC tiene como objetivo aliviar síntomas como el prurito y la inflamación a través de diversas intervenciones farmacológicas. Sin embargo, la eficacia no ha sido ampliamente estudiada en perros. Por lo tanto, se necesita más investigación específica. En consecuencia, se necesita un modelo de cAD fiable para fines de investigación.
En la mayoría de los perros con ADCc, se puede observar un aumento del nivel de IgE circulante hacia los alérgenos ambientales. Por lo tanto, puede ser una práctica común detectar niveles de IgE específicos para alérgenos comunes en la mayoría de los perros diagnosticados con EA. El principal método utilizado para inducir síntomas similares a los de la EA en perros con fines de investigación es la aplicación de HDM (20, 25). Algunos estudios han examinado a los perros para detectar niveles altos de IgE antes de inducir la EA (19, 25). En algunos estudios, se utilizaron perros beagle sanos sin predisposición genética a niveles elevados de IgE; sin embargo, la evaluación se basó en la IgE como único índice de evaluación. Las quimiocinas como CCL17, que están elevadas en la EA alérgica, facilitan el reclutamiento de células Th2 a los sitios de inflamación, y la citocina Th2 (IL4) estimula la síntesis de IgE (26). En consecuencia, dado que los niveles de IgE en la dermatitis atópica se correlacionan con una respuesta inmune Th2, es importante examinar las quimiocinas o citocinas que están reguladas junto con los niveles de IgE.
Por lo tanto, el establecimiento de modelos estandarizados de atopia inducida por HDM con fines de investigación es un desafío. Además, el aumento de los niveles de IgE sirve como marcador de alérgeno en la EA. Sin embargo, un nivel elevado de IgE es un indicador importante en el que no se puede confiar únicamente para el diagnóstico definitivo de la EA (1). Tanto en ratones como en minicerdos, los síntomas similares a la EA pueden ser inducidos a través de la aplicación dérmica de ovoalbúmina (27-29). En los modelos de ratón con EA inducida por ovoalbúmina, la inducción de atopia a través de la sensibilización percutánea compromete la función de barrera de la piel, lo que permite que los alérgenos penetren en la piel. Posteriormente, la sensibilización transdérmica repetida desencadena una respuesta Th2, lo que da lugar a la manifestación de síntomas cutáneos. En consecuencia, establecimos un modelo de ADc utilizando la ovoalbúmina como sensibilizador transdérmico. Además, nuestros hallazgos sugieren que los niveles elevados de IgE, acompañados de quimiocinas CCL17 y respuestas dominantes de Th2, juegan un papel importante en la exacerbación de la EA inducida por la ovoalbúmina. La dermatitis atópica en perros se acompaña de eritema macular, erupción cutánea y prurito (30, 31). Además, cualquier compromiso en la función de barrera de la piel contribuye a la progresión acelerada de la EA. Cuando la piel se encuentra con alérgenos, hay un aumento de mediadores inflamatorios como PGE y COX-2. En cuanto al desequilibrio Th1/Th2, la aplicación tópica in vitro de PGE2 suprime la producción de citoquinas IL-12, que es esencial para la liberación de IFNg, una citoquina Th1 (32). La inhibición de la IL-12 promueve una respuesta inmune Th2 (33), lo que conduce al rápido desarrollo de irritación de la piel (34). Curiosamente, investigaciones anteriores demostraron que la inhibición selectiva de la expresión de COX-2 en un modelo de ratón de atopia alérgica favoreció una respuesta Th2, exacerbando los síntomas de la EA (15). En nuestro estudio, el grupo de baja exposición a la ovoalbúmina (grupo T1) mostró una disminución de la expresión de COX-2 y PGE en comparación con el grupo de mayor exposición (grupo T2). Esto sugiere que la reducción de la exposición a la ovoalbúmina puede conducir a una disminución del mecanismo regulador de la COX-2/PGE, lo que posteriormente aumenta la expresión de citoquinas Th2 específicas. Por lo tanto, proponemos que la concentración óptima para inducir un modelo de ADCc dominante en Th2 es de 1 mg/mL. Sin embargo, esta hipótesis requiere una mayor verificación en futuros estudios que involucren a un mayor número de perros.
La EA puede estar asociada con una deficiencia de filagrina, una proteína clave involucrada en la formación de la capa más externa de la piel (estrato córneo), en algunos individuos. La respuesta inmunitaria polarizada Th2 inducida por la EA aguda conduce a una disminución secundaria de la filagrina. Por lo tanto, la disminución de filagrina puede exacerbar la enfermedad inflamatoria dérmica y debe confirmarse en asociación con la citocina Th2 en la EA (35-37). Nuestros hallazgos demostraron que el patrón de cambio en los niveles de expresión de filagrina fue similar al observado en estudios anteriores (38, 39) En el grupo tratado con ovoalbúmina, se observó una disminución dependiente de la concentración en los niveles de expresión de ARNm de filagrina. Esto indica que la aplicación de ovoalbúmina alteró la función barrera de la piel, que se asemeja a los efectos observados en pacientes con atopia.
Durante las fases iniciales de penetración de alérgenos causada por deficiencias en la barrera cutánea, la quimiocina CCL17 es liberada por las células de la piel, como los queratinocitos, las células dendríticas y las células endoteliales. Posteriormente, CCL17 es expresado por las células CCR4-Th2 en las últimas etapas de penetración del alérgeno. En un estudio realizado por Kakinuma et al., los individuos con EA tenían niveles séricos elevados de CCL17 en comparación con los pacientes con psoriasis. Este hallazgo pone de relieve el importante papel de CCL17, una quimiocina esencial, en la progresión y el desarrollo de la EA (40). En nuestro estudio, observamos un aumento sustancial en los niveles de expresión de ARNm de CCL17 en el grupo de EA inducida por ovoalbúmina en comparación con el grupo control. Curiosamente, este aumento fue particularmente prominente en el grupo de dosis baja. Esto sugiere que el nivel de CCL17 aumentado por la ovoalbúmina condujo a una respuesta inmunitaria dominante Th2 en la fase aguda y que 1 mg/ml fue la concentración adecuada para inducir una respuesta inmunitaria dominante Th2.+
Los hallazgos histopatológicos de nuestro estudio revelaron la infiltración de células inmunes (linfocitos, eosinófilos y neutrófilos) en todos los grupos analizados. En particular, se observó un aumento significativo en el número de eosinófilos y linfocitos infiltrantes en el grupo tratado con ovoalbúmina (Figura 2B). La infiltración de células inflamatorias en las lesiones cutáneas en la EA se caracteriza típicamente por la presencia de varias subpoblaciones de células T y células linfoides innatas de tipo 2 (41). Nakatani et al. informaron una mayor incidencia de infiltración de células T CCR4-CD4-en pacientes con EA crónica en comparación con pacientes con psoriasis (42). Además, Murra et al. informaron que la administración de un antagonista de CCR4 en un modelo de cAD resultó en la supresión efectiva de los síntomas clínicos asociados con cAD (43). Nuestra investigación reveló una correlación consistente entre el aumento de la inflamación dérmica eosinofílica y linfocítica (inflamación perivascular), la infiltración de células inmunitarias en la EA inducida por ovoalbúmina, los niveles elevados de expresión del ARNm de CCL17 y una mayor presencia de citocinas de respuesta dominante Th2.++
La EA se caracteriza principalmente por el predominio de la respuesta inmunitaria Th2, lo que conduce a la regulación positiva de citocinas, como IL-4, IL-5 e IL-13 (44-46). La aplicación tópica de ovoalbúmina en modelos de ratón da como resultado la regulación positiva de las quimiocinas relacionadas con Th2, como CCL17 y CCL22, promoviendo la infiltración de células Th2 e intensificando la respuesta inflamatoria alérgica (47). La evaluación del plasma y los tejidos cutáneos del grupo tratado con ovoalbúmina reveló una elevación significativa de los niveles de proteína IL-4 y ARNm, así como de los niveles de ARNm de IL-13. Curiosamente, nuestros hallazgos revelaron que los niveles de expresión eran notablemente altos en el grupo de dosis baja.
La citoquina inflamatoria IL-31 es producida por la célula Th2 y está directamente involucrada en la activación de las neuronas sensoriales y en el desencadenamiento del prurito cutáneo (48, 49). En los individuos con EA, hubo un aumento notable en los niveles de IL-31 en comparación con los individuos sanos. Además, la inyección de IL-31 en perros indujo prurito (50). Nuestros hallazgos revelaron un aumento sustancial en los niveles de expresión de la proteína IL-31 y ARNm en el grupo tratado con ovoalbúmina. Por lo tanto, determinamos la concentración óptima de ovoalbúmina requerida para inducir la atopia. También observamos que los síntomas de la EA inducidos utilizando la concentración óptima de ovoalbúmina se asemejaban mucho a los síntomas clínicos observados en los pacientes con EA, y este hallazgo valida la relevancia e importancia de nuestro modelo para la realización de estudios sobre la EA.
Este estudio tiene tres limitaciones principales. La primera limitación es que todos los grupos estaban formados por dos perros, lo que puede introducir un sesgo que podría afectar al análisis estadístico. Sin embargo, esta limitación se resolvió con cuatro biopsias de la región dorsal tratadas con Ovoalbúmina tomadas de cada perro y estimadas con al menos tres repeticiones del análisis. En segundo lugar, la escala de evaluación clínica CADESI-04 para la atopia canina no fue aplicable a nuestro estudio. Nuestro modelo de ADCc, con ovoalbúmina aplicada localmente en la espalda en lugar de EA sensibilizada sistémicamente, es un modelo para estudios en los que se observa una respuesta inmune dominante Th2 en la espalda con manifestaciones clínicas similares a la dermatitis atópica. Sin embargo, el dorso no es un sitio común de dermatitis atópica y, por lo tanto, no se incluye en las métricas de CADESI-04. Necesitábamos una métrica para evaluar los síntomas clínicos y aplicamos el DDISS, que utilizamos en nuestro estudio anterior del modelo de EA con minicerdos (29). El gráfico que presentamos puntúa las manifestaciones clínicas atópicas de eritema y edema. En nuestro estudio, la formación de escaras se puntuó consistentemente como 0 para todos los animales. En el futuro, aplicaremos indicadores que puedan reflejar las manifestaciones clínicas de la dermatitis atópica (eritema, edema, excoriación, alopecia) como una puntuación de respuesta cutánea modificada o una puntuación CADESI modificada, donde se valora el tipo de lesión y la gravedad cutánea relevantes para este modelo. Una tercera limitación es que la picazón en este modelo se basó en la observación visual casual por parte del veterinario. Aunque existen escalas para determinar el prurito clínico, las básculas están diseñadas para dueños de perros (51). El prurito es un síntoma esporádico y no pudimos controlarlo en nuestro estudio. Por lo tanto, las escalas de prurito deben desarrollarse aún más para futuros investigadores.
Cuando la piel canina fue tratada con una concentración óptima de ovoalbúmina, observamos cambios clínicos, histopatológicos y no clínicos que se asemejaban a los observados en la DA natural. Además, observamos una mayor respuesta inmunitaria relacionada con Th2. En resumen, establecimos un modelo animal de ADCc que se puede utilizar para la investigación básica de la respuesta dominante Th2 en el ámbito de la ADCc, que proporciona un medio para la evaluación precisa de la seguridad de los nuevos fármacos para el tratamiento de la ADCh.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo/material complementario, las consultas posteriores pueden dirigirse al autor correspondiente.
Declaración ética
El estudio en animales fue revisado y aprobado por todos los animales Los experimentos se llevaron a cabo de acuerdo con las directrices del Comité Institucional de Cuidado y Uso de Animales de Huvet (número de aprobación de IACUC: HV 2022-011).
Contribuciones de los autores
H-YS: Análisis formal, Metodología, Visualización, Escritura – borrador original, Escritura – revisión y edición. HJ: Metodología, Investigación. H-JT: Metodología, Validación, Redacción – revisión y edición. H-GO: Supervisión, Escritura – borrador original. JH: Conceptualización, Obtención de Fondos, Supervisión, Recursos, Redacción, Revisión y Edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este trabajo fue apoyado por la subvención del Consejo Nacional de Investigación de Ciencia y Tecnología (NST) del gobierno de Corea (MSIT) (número de subvención: CRC21022).
Conflicto de intereses
H-GO fueron empleados por la División de Investigación y Desarrollo, HUVET Co., Ltd.
El resto de los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un potencial conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Hensel, P , Santoro, D , Favrot, C , Colina, P y Griffin, C . Dermatitis atópica canina: pautas detalladas para el diagnóstico y la identificación de alérgenos. BMC Vet Res. (2015) 11:196. doi: 10.1186/s12917-015-0515-5
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Murrison, LB , Brandt, EB , Myers, JB y Hershey, GKK . Exposiciones ambientales y mecanismos en el desarrollo de alergias y asma. J Clin Invest. (2019) 129:1504–15. doi: 10.1172/JCI124612
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Ruzicka, T , Hanifin, JM , Furue, M , Pulka, G , Mlynarczyk, I , Wollenberg, A, et al. Anticuerpo anti-receptor de interleucina-31, un anticuerpo para la dermatitis atópica. N Engl J Med. (2017) 376:826–35. doi: 10.1056/NEJMoa1606490
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Beck, LA , Thaci, D , Hamilton, JD , Graham, NM , Bieber, T , Rocklin, R, et al. Dupilumab treatment in adults with moderate-to-severe atopic dermatitis. N Engl J Med. (2014) 371:130–9. doi: 10.1056/NEJMoa1314768
6. Guttman-Yassky, E , Bissonnette, R , Ungar, B , Suarez-Farinas, M , Ardeleanu, M , Esaki, H, et al. Dupilumab progressively improves systemic and cutaneous abnormalities in patients with atopic dermatitis. J Allergy Clin Immunol. (2019) 143:155–72. doi: 10.1016/j.jaci.2018.08.022
7. Pearson, J , Leon, R , Starr, H , Kim, SJ , Fogle, JE , and Banovic, F . Establishment of an intradermal canine IL-31-induced pruritus model to evaluate therapeutic candidates in atopic dermatitis. Vet Sci. (2023) 10:329. doi: 10.3390/vetsci10050329
8. Fleck, TJ , Norris, LR , Mahabir, S , Walters, RR , Martinon, O , Dunham, SA, et al. Onset and duration of action of lokivetmab in a canine model of IL-31 induced pruritus. Vet Dermatol. (2021) 32:681–e182. doi: 10.1111/vde.12943
9. Bruet, V , Mosca, M , Briand, A , Bourdeau, P , Pin, D , Cochet-Faivre, N, et al. Clinical guidelines for the use of antipruritic drugs in the control of the Most frequent pruritic skin diseases in dogs. Vet Sci. (2022) 9:149. doi: 10.3390/vetsci9040149
10. Nuttall, T , Reece, D , and Roberts, E . Life-long diseases need life-long treatment: long-term safety of ciclosporin in canine atopic dermatitis. Vet Rec. (2014) 174:3–12. doi: 10.1136/vr.102471
11. Nuttall, TJ , Knight, PA , McAleese, SM , Lamb, JR , and Hill, PB . T-helper 1, T-helper 2 and immunosuppressive cytokines in canine atopic dermatitis. Vet Immunol Immunopathol. (2002) 87:379–84. doi: 10.1016/S0165-2427(02)00076-4
12. Saeki, H , and Tamaki, K . Thymus and activation regulated chemokine (TARC)/CCL17 and skin diseases. J Dermatol Sci. (2006) 43:75–84. doi: 10.1016/j.jdermsci.2006.06.002
13. Seibert, K , Masferrer, J , Zhang, Y , Gregory, S , Olson, G , Hauser, S, et al. Mediation of inflammation by cyclooxygenase-2. Agents Actions Suppl. (1995) 46:41–50.
14. Lee, JL , Mukhtar, H , Bickers, DR , Kopelovich, L , and Athar, M . Cyclooxygenases in the skin: pharmacological and toxicological implications. Toxicol Appl Pharmacol. (2003) 192:294–306. doi: 10.1016/S0041-008X(03)00301-6
15. Laouini, D , Elkhal, A , Yalcindag, A , Kawamoto, S , Oettgen, H , and Geha, RS . COX-2 inhibition enhances the TH2 immune response to epicutaneous sensitization. J Allergy Clin Immunol. (2005) 116:390–6. doi: 10.1016/j.jaci.2005.03.042
16. Van Brussel, L , Moyaert, H , Escalada, M , Mahabir, SP y Stegemann, MR . Un ensayo clínico aleatorizado enmascarado que evalúa la eficacia y la seguridad de lokivetmab en comparación con el control con solución salina en perros con dermatitis alérgica de los clientes. Veterinario Dermatol. (2021) 32:477–E131. doi: 10.1111/vde.12984
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Kim, SW y Kim, JH . Establecimiento de un modelo experimental para la dermatitis atópica canina mediante la aplicación epicutánea de Dermatophagoides farinae. Front Vet Sci. (2022) 9:1015915. doi: 10.3389/fvets.2022.1015915
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Simpson, A , Maeda, S y Marsella, R . Cambios dinámicos temporales de la expresión fenotípica de células CD4 periféricas durante el desafío de alérgenos ambientales en un modelo experimental de dermatitis atópica canina: un estudio piloto. J Vet Med Sci. (2009) 71:1177–81. doi: 10.1292/jvms.71.1177
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Marsella, R , Níquel, C y López, J . Estudios sobre el papel de las vías de exposición a alérgenos en perros beagle con alta producción de IgE sensibilizados a los ácaros domésticos del polvo. Veterinario Dermatol. (2006) 17:306–12. doi: 10.1111/j.1365-3164.2006.00541.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Pucheu-Haston, CM , Jackson, HA , Olivry, T , Dunston, SM y Hammerberg, B . La sensibilización epicutánea con Dermatophagoides farinae induce dermatitis alérgica generalizada y niveles elevados de inmunoglobulina E específica de ácaros en un modelo canino de dermatitis atópica. Clin Exp Alergia. (2008) 38:667–79. doi: 10.1111/j.1365-2222.2008.02949.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Draize, JH . Métodos para el estudio de la irritación y toxicidad de sustancias aplicadas tópicamente sobre la piel y las mucosas. J Pharmacol Exp ther. (1944) 82:377–90.
22. Jang, M , Kim, H , Kim, Y , Choi, J , Jeon, J , Hwang, Y, et al. El papel crucial de la IL-22 y su receptor en el timo y la activación reguló la producción de quimiocinas y la migración de células T por el extracto de ácaros del polvo doméstico. Exp Dermatol. (2016) 25:598–603. doi: 10.1111/exd.12988
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. Leung, DY y Bieber, T . Dermatitis atópica. Lanceta. (2003) 361:151–60. doi: 10.1016/S0140-6736(03)12193-9
24. Gedon, NKY y Mueller, RS . Dermatitis atópica en perros y gatos: una enfermedad difícil para los animales y los propietarios. Clin Transl Alergia. (2018) 8:41. doi: 10.1186/s13601-018-0228-5
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Marsella, R , Olivry, T , Níquel, C y López, J . Investigación piloto de un modelo para dermatitis atópica canina: desafío ambiental de los ácaros del polvo doméstico de beagles con alta producción de IgE, perros hipersensibles a los ácaros con dermatitis atópica y perros normales. Veterinario Dermatol. (2006) 17:24–35. doi: 10.1111/j.1365-3164.2005.00496.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Hayashida, S , Uchi, H , Moroi, Y y Furue, M . La disminución de las células Th17 circulantes se correlaciona con un aumento de los niveles de CCL17, IgE y eosinófilos en la dermatitis atópica. J Dermatol Sci. (2011) 61:180–6. doi: 10.1016/j.jdermsci.2010.10.013
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Nakajima, S , Nomura, T , Común, J y Kabashima, K . Información sobre la dermatitis atópica obtenida a partir de modelos de ratón definidos genéticamente. J Alergia Clin Immunol. (2019) 143:13–25. doi: 10.1016/j.jaci.2018.11.014
Resumen de PubMed | Texto completo de Crossref | Google Académico
28. Alosaimi, NS , Sattar Ahmad, MAA , Alkreathy, HM , Ali, AS y Khan, LM . Bases farmacológicas del supuesto efecto terapéutico de la vitamina D3 tópica en el modelo experimental de dermatitis atópica en ratones. Eur Rev Med Pharmacol Sci. (2022) 26:6827–36. doi: 10.26355/eurrev_202209_29785
Resumen de PubMed | Texto completo de Crossref | Google Académico
29. Kim, YK , Lee, JY , Hwang, JH y Suh, HN . Un estudio piloto para establecer un modelo de Minipig de dermatitis atópica inducida por ovoalbúmina. J Vet Res. (2021) 65:307–13. doi: 10.2478/jvetres-2021-0045
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Olvido, T y Baumer, W . Prurito atópico en perros: farmacología y modelado. Handb Exp Pharmacol. (2015) 226:357–69. doi: 10.1007/978-3-662-44605-8_19
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Marsella, R y Olivry, T . Modelos animales de dermatitis atópica. Clin Dermatol. (2003) 21:122–33. doi: 10.1016/S0738-081X(02)00369-3
32. Kalinski, P , Hilkens, CM , Snijders, A , Snijdewint, FG , and Kapsenberg, ML . IL-12-deficient dendritic cells, generated in the presence of prostaglandin E2, promote type 2 cytokine production in maturing human naive T helper cells. J Immunol. (1997) 159:28–35. doi: 10.4049/jimmunol.159.1.28
33. Li, H , Edin, ML , Gruzdev, A , Cheng, J , Bradbury, JA , Graves, JP, et al. Regulation of T helper cell subsets by cyclooxygenases and their metabolites. Prostaglandins Other Lipid Mediat. (2013) 104-105:74–83. doi: 10.1016/j.prostaglandins.2012.11.002
34. Welss, T , Basketter, DA , and Schroder, KR . In vitro skin irritation: facts and future. State of the art review of mechanisms and models. Toxicol In Vitro. (2004) 18:231–43. doi: 10.1016/j.tiv.2003.09.009
35. Honzke, S , Wallmeyer, L , Ostrowski, A , Radbruch, M , Mundhenk, L , Schafer-Korting, M, et al. Influence of Th2 cytokines on the Cornified envelope, tight junction proteins, and ss-Defensins in Filaggrin-deficient skin equivalents. J Invest Dermatol. (2016) 136:631–9. doi: 10.1016/j.jid.2015.11.007
36. Howell, MD , Fairchild, HR , Kim, BE , Bin, L , Boguniewicz, M , Redzic, JS, et al. Th2 cytokines act on S100/A11 to downregulate keratinocyte differentiation. J Invest Dermatol. (2008) 128:2248–58. doi: 10.1038/jid.2008.74
Resumen de PubMed | Texto completo de Crossref | Google Académico
37. Combarros, D , Cadiergues, MC , and Simon, M . Update on canine filaggrin: a review. Vet Q. (2020) 40:162–8. doi: 10.1080/01652176.2020.1758357
Resumen de PubMed | Texto completo de Crossref | Google Académico
38. O’Regan, GM , Sandilands, A , McLean, WHI , and Irvine, AD . Filaggrin in atopic dermatitis. J Allergy Clin Immunol. (2008) 122:689–93. doi: 10.1016/j.jaci.2008.08.002
39. Santoro, D , Marsella, R , Ahrens, K , Graves, TK , and Bunick, D . Altered mRNA and protein expression of filaggrin in the skin of a canine animal model for atopic dermatitis. Vet Dermatol. (2013) 24:329–36, e73, e73. doi: 10.1111/vde.12031
Resumen de PubMed | Texto completo de Crossref | Google Académico
40. Kakinuma, T , Nakamura, K , Wakugawa, M , Mitsui, H , Tada, Y , Saeki, H, et al. Thymus and activation-regulated chemokine in atopic dermatitis: serum thymus and activation-regulated chemokine level is closely related with disease activity. J Allergy Clin Immunol. (2001) 107:535–41. doi: 10.1067/mai.2001.113237
Resumen de PubMed | Texto completo de Crossref | Google Académico
41. Kader, HA , Azeem, M , Jwayed, SA , Al-Shehhi, A , Tabassum, A , Ayoub, MA, et al. Current insights into immunology and novel therapeutics of atopic dermatitis. Cell. (2021) 10:1392. doi: 10.3390/cells10061392
Resumen de PubMed | Texto completo de Crossref | Google Académico
42. Nakatani, T , Kaburagi, Y , Shimada, Y , Inaoki, M , Takehara, K , Mukaida, N, et al. CCR4 memory CD4+ T lymphocytes are increased in peripheral blood and lesional skin from patients with atopic dermatitis. J Allergy Clin Immunol. (2001) 107:353–8. doi: 10.1067/mai.2001.112601
Resumen de PubMed | Texto completo de Crossref | Google Académico
43. Murray, C , Ahrens, K , Devalaraja, M , Dymond, M , Fagura, M , Hargreaves, A, et al. Use of a canine model of atopic dermatitis to investigate the efficacy of a CCR4 antagonist in allergen-induced skin inflammation in a randomized study. J Invest Dermatol. (2016) 136:665–71. doi: 10.1016/j.jid.2015.11.001
Resumen de PubMed | Texto completo de Crossref | Google Académico
44. Gittler, JK , Shemer, A , Suarez-Farinas, M , Fuentes-Duculan, J , Gulewicz, KJ , Wang, CQ, et al. Progressive activation of T (H)2/T (H)22 cytokines and selective epidermal proteins characterizes acute and chronic atopic dermatitis. J Allergy Clin Immunol. (2012) 130:1344–54. doi: 10.1016/j.jaci.2012.07.012
Resumen de PubMed | Texto completo de Crossref | Google Académico
45. Tsoi, LC , Rodriguez, E , Stolzl, D , Wehkamp, U , Sun, J , Gerdes, S, et al. Progression of acute-to-chronic atopic dermatitis is associated with quantitative rather than qualitative changes in cytokine responses. J Allergy Clin Immunol. (2020) 145:1406–15. doi: 10.1016/j.jaci.2019.11.047
46. Langan, SM , Irvine, AD , and Weidinger, S . Atopic dermatitis. Lancet. (2020) 396:345–60. doi: 10.1016/S0140-6736(20)31286-1
47. Matsuo, K , Hatanaka, S , Kimura, Y , Hara, Y , Nishiwaki, K , Quan, YS, et al. A CCR4 antagonist ameliorates atopic dermatitis-like skin lesions induced by dibutyl phthalate and a hydrogel patch containing ovalbumin. Biomed Pharmacother. (2019) 109:1437–44. doi: 10.1016/j.biopha.2018.10.194
48. Cevikbas, F , Wang, X , Akiyama, T , Kempkes, C , Savinko, T , Antal, A, et al. A sensory neuron-expressed IL-31 receptor mediates T helper cell-dependent itch: involvement of TRPV1 and TRPA1. J Allergy Clin Immunol. (2014) 133:448–460.e7. doi: 10.1016/j.jaci.2013.10.048
49. Oetjen, LK , Mack, MR , Feng, J , Whelan, TM , Niu, H , Guo, CJ, et al. Las neuronas sensoriales se apropian de las vías de señalización inmunitaria clásicas para mediar la picazón crónica. Célula. (2017) 171:217–228.e13. doi: 10.1016/j.cell.2017.08.006
Resumen de PubMed | Texto completo de Crossref | Google Académico
50. Gonzales, AJ , Fleck, TJ , Humphrey, WR , Galván, BA , Aleo, MM , Mahabir, SP, et al. Prurito inducido por IL-31 en perros: un nuevo modelo experimental para evaluar los efectos antipruriginosos de la terapéutica canina. Veterinario Dermatol. (2016) 27:34–E10. doi: 10.1111/vde.12280
Resumen de PubMed | Texto completo de Crossref | Google Académico
51. Joven, AJ , Torres, SMF , Koch, SN , Eisenschenk, multinacional y Rendahl, AK . Prurito canino visual Escala analógica: ¿cómo capta la percepción de los dueños sobre el nivel de picor de su mascota? Veterinario Dermatol. (2019) 30:377–E111. doi: 10.1111/vde.12761
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: ovoalbúmina, dermatitis atópica, dermatitis atópica canina, modelo animal de dermatitis atópica, respuesta inmune T helper 2
Cita: Shin H-Y, Jin HJ, Tae H-J, Oh H-G y Hwang JH (2024) Establecimiento de un modelo experimental de dermatitis atópica inducida por ovoalbúmina en caninos. Frente. Vet. Sci. 11:1296138. doi: 10.3389/fvets.2024.1296138
Recibido: 18 de septiembre de 2023; Aceptado: 04 de enero de 2024;
Publicado: 18 enero 2024.
Editado por:
Asger Lundorff Jensen, Universidad de Copenhague, Dinamarca
Revisado por:
Mette Schjærff, Universidad de Copenhague, Dinamarca
Wolfgang Bäumer, Universidad Libre de Berlín, Alemania
Derechos de autor © 2024 Shin, Jin, Tae, Oh y Hwang. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Jeong Ho Hwang, jeongho.hwang@kitox.re.kr
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía