Estimación del tiempo de infección por peste porcina africana en granjas porcinas
Estimación del tiempo de infección por peste porcina africana en granjas porcinas de Corea
 Hachung Yoon*
Hachung Yoon*  Youngmin Son
Youngmin Son  Kyung-Sook Kim
Kyung-Sook Kim  Ilseob Lee
Ilseob Lee  Yeon-Hee Kim
Yeon-Hee Kim  Eunesub Lee
Eunesub Lee- División de Epidemiología Veterinaria, Organismo de Cuarentena Animal y Vegetal, Gimcheon (República de Corea)
La peste porcina africana (PPA) es una enfermedad altamente contagiosa y letal con características de fiebre hemorrágica. Los brotes de PPA en las granjas porcinas dañan significativamente a toda la industria porcina. Comprender la dinámica de transmisión de la PPA es crucial para responder de manera efectiva. En particular, es importante saber cuándo comenzó la infección en la granja del brote. Este estudio tuvo como objetivo establecer un procedimiento para estimar el momento de la infección en granjas porcinas afectadas por el brote de PPA en Corea. Se describió el protocolo de muestreo para detectar la infección por el virus de la PPA, la estimación del intervalo de tiempo entre la infección y la detección, y la estimación de los parámetros del estadio de infección para el modelo de simulación. Después de la infección, los galpones de engorde (9,8 días en la mediana) tuvieron el tiempo de detección más largo en comparación con los galpones preñados (8,6 días) o parientes (8,0 días). Los intervalos fueron de 8,8 días para las granjas de parto a engorde, 7,0 días para las granjas de parto a destete y 9,5 días para las granjas de engorde. Los hallazgos de este estudio proporcionan información valiosa sobre los brotes de PPA en las granjas porcinas, mejorando así la capacidad de control de la enfermedad.
1 Introducción
La peste porcina africana (PPA) es una enfermedad altamente contagiosa y letal que afecta a los suidae (cerdos domésticos y jabalíes) y se caracteriza por la fiebre hemorrágica. Es causada por el virus de la PPA perteneciente a la familia Asfarviridae (1). La PPA es una enfermedad incluida en la lista de la Organización Mundial de Sanidad Animal, y sus brotes en granjas porcinas dañan significativamente a la industria porcina (2).
Desde el brote de PPA de 2018 en China, se ha extendido a varios países asiáticos. En mayo y septiembre de 2019, se notificó un brote en la República Popular Democrática de Corea (Corea del Norte) y la República de Corea (Corea del Sur, en adelante, Corea), respectivamente. El primer brote en Corea se notificó en Paju, provincia de Gyeonggi-do, situada a unos siete kilómetros al sur de la frontera con Corea del Norte (3-5). En 2019 se confirmaron catorce brotes, mientras que en 2020 solo se produjeron dos brotes. El número de brotes aumentó a cinco en 2021, seguidos de siete en 2022. Hasta julio de 2023, se habían confirmado nueve brotes de PPA, lo que eleva el número total de brotes a 37 desde el caso índice en septiembre de 2019 (6). Todas las granjas afectadas por el brote estaban ubicadas en la parte norte del país (véase el mapa de brotes de PPA en https://mafra.go.kr/FMD-AI2/map/ASF/ASF_map.jsp).
Tras la confirmación de la PPA, todos los cerdos de las granjas del brote fueron sacrificados rápidamente y se llevó a cabo una investigación del brote. Siguiendo el protocolo de control de la PPA, se debe investigar la entrada y salida de vehículos, personas y mercancías de la granja 21 días antes del brote, junto con el manejo habitual del ganado y el control de enfermedades animales en la granja (7). La investigación del brote se llevó a cabo para identificar la fuente de infección, la vía de introducción del virus en las granjas y las granjas de alto riesgo en relación epidemiológica con el brote actual. El período de alto riesgo, en el que es más probable que el virus se haya introducido en la granja del brote y se haya propagado a otras granjas, es particularmente un período crítico que requiere una investigación intensiva. Para calcular este período, es necesario determinar el momento en que se produjo la primera infección en los animales de la granja del brote. Para estimar el momento probable de un evento de infección, se debe proporcionar la evidencia y se requiere una base para explicar científicamente la evidencia (8). Además, la base debe aplicarse por igual a todos los acontecimientos. Ya se han establecido los criterios para estimar el tiempo de infección para la fiebre aftosa (9) y la gripe aviar altamente patógena (10). Todavía no se ha publicado ningún estudio de este tipo sobre la PPA. Este estudio tuvo como objetivo establecer un procedimiento para estimar el tiempo de infección por el virus en granjas porcinas afectadas por el brote de PPA en Corea.
2 Materiales y métodos
2.1 Recogida de muestras para detectar la peste porcina africana en granjas porcinas
La detección de granjas con brotes de PPA en Corea se divide en dos vías: notificación de animales sospechosos de la enfermedad y vigilancia. Los profesionales de la industria ganadera reciben educación en repetidas ocasiones para notificar de inmediato si se aplica alguna de las siguientes situaciones: (1) muerte de cerdas y un mayor número de cerdos de engorde atrofiados; (2) fiebre alta superior a 40°C; (3) aborto inexplicable o muerte fetal; (4) mortalidad diaria para todos los grupos de edad superior a la media de los últimos 10 días (11). La recogida de muestras tras la notificación de animales sospechosos debe incluir todos los animales muertos y enfermos. Las muestras fueron sangre de animales vivos y tejido de animales muertos. También se deben recolectar muestras de animales aparentemente normales cercanos (12). Por otro lado, cuando se realiza la vigilancia, se recolecta una muestra de sangre de 10 cabezas por granja al menos una vez al año en granjas porcinas de todo el país. En la vigilancia anual, primero se recogen muestras de cerdos en cobertizos y corrales de alto riesgo. Las 10 cabezas comprenden cinco cerdas y cinco cerdos de engorde. Además, cuando los cerdos se envían desde granjas ubicadas en áreas de manejo intensivo, es decir, donde se detectó el virus de la PPA en jabalíes, también se realizó una prueba con muestras de sangre. Para el envío de cerdos de engorde, se recolectaron muestras de 10 cabezas. Y todas las cerdas que iban a ser enviadas fueron sometidas a pruebas (13).
Una vez que se identificó un animal positivo a la prueba de antígeno de PPA, se recolectaron muestras adicionales de los animales a su alrededor que parecían normales. Se obtuvieron muestras de sangre de todos los establos de la granja, 10 animales por gallinero, no solo de aquellos con animales positivos (14). También se obtuvieron muestras de animales muertos adicionales encontrados durante la investigación del brote, con muestras de hisopos orales y nasales. Las muestras se analizaron mediante reacción en cadena de la polimerasa (PCR) para la detección de antígenos y ensayos de inmunoabsorción enzimática para la detección de anticuerpos. Los detalles sobre los métodos de detección se describieron en los artículos publicados (15, 16).
Se calculó la proporción de animales con antígeno positivo, definida como prevalencia, para cada nave en la que se identificó un animal con antígeno positivo. La prevalencia se calculó incluyendo los cerdos para los que se verificó la presencia de antígeno mediante PCR por el Laboratorio Nacional de Referencia (División de Enfermedades de Animales Extraños de la Agencia de Cuarentena Animal y Vegetal).
2.2 Estimación del tiempo de infección
El momento de la primera infección de un rebaño en un brote de PPA se estima teniendo en cuenta factores como la mortalidad y la detección de antígenos y anticuerpos. La mortalidad es el criterio de primera prioridad y puede aplicarse tras la confirmación del primer animal positivo para el antígeno de la PPA. Cuando se confirmó la infección por PPA en un animal fallecido, se generaron 1.000 números aleatorios siguiendo una distribución de Poisson con el parámetro lambda establecido como el tiempo desde la infección hasta la muerte utilizando el lenguaje de programación R.1 La fecha de infección de cada animal con infección confirmada se estimó restando el número de días que correspondían al cuartil de los números aleatorios generados a partir de la fecha de muerte del animal.
Para el segundo criterio de prioridad, se ejecutó un programa de simulación de transmisión dentro del rebaño para determinar la fecha que predice el número de animales con antígeno positivo, la mortalidad acumulada y el número de animales con anticuerpos positivos en el día de muestreo. Al restar el número de días pronosticados del día de muestreo, se determinó la hora de la primera infección en el galpón. Si se detectaba un animal con antígeno positivo en más de un establo, se estimaba el tiempo de infección por establo.
Después de estimar el tiempo de infección a través de la mortalidad y la simulación, los valores se combinaron utilizando un modelo de bosque aleatorio escrito en R. Sin embargo, el programa de simulación se ejecutó cuando había al menos tres animales con antígeno positivo en un establo. En el caso de las granjas con animales con anticuerpos positivos, se asumió que habían pasado más de 10 días desde el inicio de la infección, y se compararon los resultados de la simulación para su confirmación. Sin embargo, el número de animales con anticuerpos positivos no se utilizó para calcular el número de días después de la infección. Los factores epidemiológicos, incluidas las personas y los vehículos que entran y salen de la granja y los eventos, también se consideraron en la decisión final sobre el tiempo estimado de infección. Entre 34 y 37, se realizó una estimación del tiempo de infección en las granjas con brotes de PPA en 2019 de las 2023 granjas con brotes confirmados de PPA en Corea. Se excluyeron de la estimación dos granjas de traspatio y una granja con un pequeño número de cerdos coreanos nativos.
2.3 Programa de simulación
La propagación del virus de la PPA dentro de una nave de cerdos infectada se simuló utilizando un programa de modelado matemático con compartimentos SLIR: susceptible (S), infectado latentemente (L), infeccioso (I) y eliminado (R). En este modelo, «eliminado» se refiere a la persona fallecida o sobreviviente por el desarrollo de anticuerpos. El programa de simulación se construyó utilizando el lenguaje de programación R. Durante el período de simulación de nn días, se calculó el número de animales en las condiciones S, L, I y R y el número de animales recién infectados para el día i + 1. Se calcularon en función del número de animales en cada condición el día anterior (i), y el cálculo se ejecutó diariamente.
El período de latencia, el número de días entre la infección y la muerte, el número de días necesarios para la formación de anticuerpos y el porcentaje de animales muertos o formadores de anticuerpos se introdujeron como una constante en el modelo. En particular, se necesitaba un coeficiente para iniciar la simulación de la propagación de enfermedades infecciosas. La tasa a la que se producen nuevas infecciones a través del contacto entre animales infecciosos y susceptibles en una piara de cerdos se definió como «coeficiente de transmisión dentro de la piara». El coeficiente de transmisión dentro del rebaño se estableció en un valor único basado en el tipo de rebaño (0,9 para la gestación, 0,8 para el parto y 1,0 para el engorde). La simulación se iteró y los resultados se compararon con datos reales (la investigación del brote y el estudio en animales) para seleccionar los valores más adecuados. Los datos de la investigación del brote fueron registros de mortalidad diaria en los galpones infectados. En cuanto a los datos del estudio en animales, se hizo referencia al momento en que se detectó el virus en animales no vacunados alojados en el mismo corral que los animales inoculados (16). La estimación de otros valores de entrada necesarios para ejecutar el programa se discute en las Secciones 2.4 y 2.5.
La simulación se ejecutó con el número de animales a simular, asumiendo que la infección se inició con un animal infeccioso y luego se propagó en el rebaño. El programa de simulación se repitió 1.000 veces por ejecución.
2.4 Patogenicidad del virus de la peste porcina africana
Los valores de los parámetros para el estadio de infección del virus de la PPA en cerdos se estimaron sobre la base de los resultados de los experimentos de desafío de infección realizados con muestras de virus de granjas de brotes de PPA en Corea. Los virus en los experimentos de patogenicidad fueron los aislados de Paju 2019 (Corea/Cerdo/Paju1/2019), los aislados de Hwacheon 2020 (Corea/Cerdo/Hwacheon1/2020), los aislados de Yeongwol 2021 (Corea/Cerdo/Yeongwol/2021), los aislados Inje 2021 (Corea/Cerdo/Inje1/2021), los aislamientos Hongcheon 2022 (Corea/Cerdo/Hongcheon/2022) y los aislamientos Pocheon de enero 2023 (Corea/Cerdo/Pocheon1/2023). Los seis aislados (es decir, los virus aislados en las seis granjas del brote) se inyectaron por vía intramuscular en cerdos criollos de ocho semanas de edad. Como se muestra en la Tabla 1, el estudio contó con seis grupos experimentales con 22 animales (n = 3-5 por grupo). Los animales de experimentación inoculados por vía intramuscular murieron en un plazo de 10 días, y todos los animales en contacto con ellos murieron en un plazo de 18 días. En consecuencia, los virus se identificaron como virus de la PPA altamente virulentos que causan un curso clínico agudo y pertenecían al genotipo II p72 y al serogrupo 2 de CD8v (15, 16).
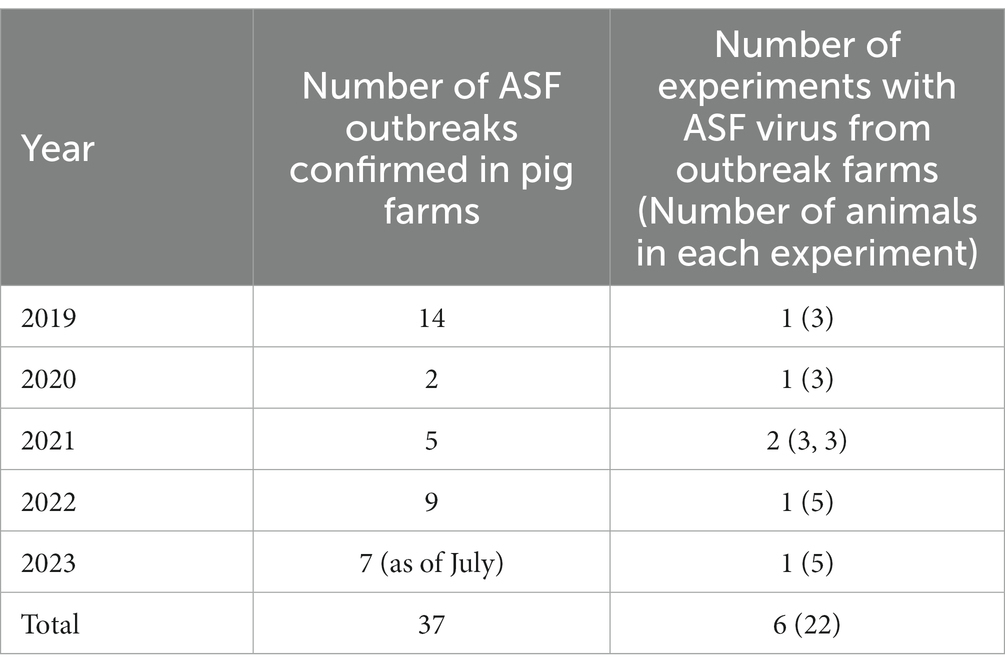 Tabla 1. Estado del brote de PPA y experimentos con el desafío de infección del virus de la PPA aislado de las granjas del brote.
Tabla 1. Estado del brote de PPA y experimentos con el desafío de infección del virus de la PPA aislado de las granjas del brote.
Los experimentos registraron el tiempo (en días) hasta la aparición de la viremia (la presencia del virus en el torrente sanguíneo), la detección del virus en la cavidad oral o nasal y la aparición de fiebre alta con una temperatura corporal de 40 °C o más. La fecha de inicio de la detección del virus en la cavidad oral o nasal fue «uno o 2 días después del inicio de la viremia». Por lo tanto, para cada animal, la fecha de inicio de la detección del virus en la cavidad oral o nasal se estimó agregando un valor asignado aleatoriamente de «uno o 2 días» a la fecha de inicio de la viremia con R.
2.5 Parámetros de la etapa de infección
Se definieron los parámetros para la etapa de infección requerida para ejecutar el modelo de simulación, y sus valores se calcularon utilizando los resultados del estudio en animales.
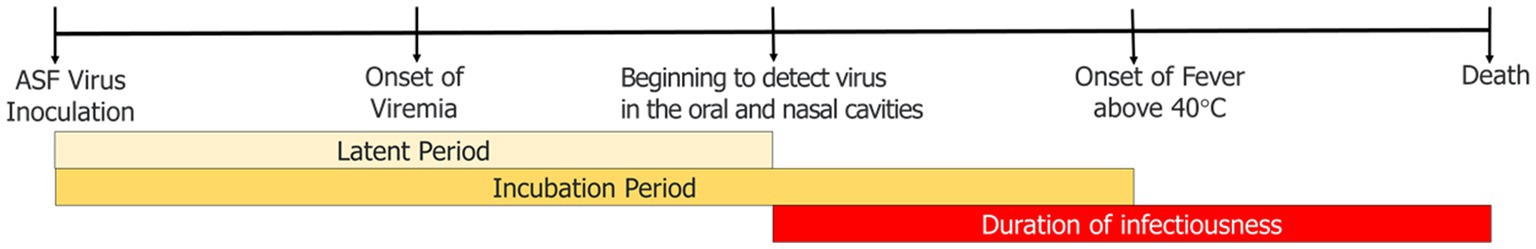
Las etapas de infección por PPA necesarias para ejecutar el modelo de simulación se definieron de la siguiente manera: (1) El período latente se definió como el intervalo desde el día de la inoculación del virus en los animales de experimentación hasta el día en que el virus se detectó por primera vez en la cavidad nasal u oral; (2) El tiempo transcurrido desde la infección hasta la muerte se definió como el intervalo entre la infección y la muerte; (3) Se estimó la duración de la infecciosidad desde el inicio de la detección del virus en la cavidad nasal u oral hasta la muerte; (4) El período de incubación se definió como el intervalo entre el día de la infección y el día en que se midió la fiebre alta con una temperatura corporal de 40 °C o más (Figura 1).
Las mediciones experimentales individuales en cada etapa de la infección se combinaron como medias agrupadas e intervalos de confianza del 95% (IC del 95%). Para este meta-análisis, se utilizó el paquete de «metáforas» con opción de efecto mixto en R. Tanto las características de los seis experimentos individuales (efecto fijo) como la variabilidad general (efecto aleatorio) se consideraron a través de un modelo de efectos mixtos. Los valores de la etapa de infección también se expresaron como función de densidad de probabilidad. Se realizó una prueba de bondad de ajuste utilizando el «paquete fitdistrplus» en R para medir la diferencia entre las mediciones experimentales y varias distribuciones de probabilidad continuas (es decir, Gamma, Logística, Normal, Lognormal y Weibull), se seleccionó la distribución con los valores más pequeños del criterio de información de Akaike y el criterio de información bayesiano.
3 Resultados
3.1 Granjas porcinas con brote de peste porcina africana
Las 37 granjas porcinas en las que se confirmaron brotes de PPA entre 2019 y 2023 comprendieron 26 (70,3%) granjas de parto a engorde, cuatro (10,8%) granjas de parto a destete y cuatro granjas de engorde (10,8%). Las tres granjas restantes (8,1%) eran una granja con cerdos negros nativos coreanos y dos granjas de traspatio. De las 34 granjas porcinas comerciales, los galpones infectados en los que los cerdos dieron positivo para los antígenos del virus de la PPA (denominados animales con antígeno positivo) se encontraron en 19 (55,9%) galpones preñados, seis (17,6%) galpones de maternidad y nueve (26,5%) galpones de engorde (engorde). Los brotes en cerdas (preñadas o parideras) representaron el 82,4% (28 granjas) del total. El número de cerdos en los galpones infectados, los animales con antígeno positivo y las muertes aumentaron en el orden de las naves de preñez, parto y engorde. Por el contrario, en función del número de cerdos por gallinero, la mayor prevalencia se observó en los establos preñados. En la Tabla 2 se muestran los datos sobre los cobertizos infectados en las granjas con brotes de PPA en Corea. Se detectaron anticuerpos en una granja con casos positivos en parideras y tres granjas con casos positivos en naves de engorde. No se reportaron casos de detección de anticuerpos en naves preñadas. Las dos granjas con casos positivos en los galpones de engorde fueron excluidas de las pruebas de anticuerpos.
 Tabla 2. Se confirmó la situación de los establos infectados por PPA en granjas porcinas entre 2019 y 2023 en Corea.
Tabla 2. Se confirmó la situación de los establos infectados por PPA en granjas porcinas entre 2019 y 2023 en Corea.
3.2 Valores para el estadio de infección de la peste porcina africana
En la Tabla 3 se muestran los valores de los estadios de infección de la PPA. Para el período latente, el rango fue de 2 a 5 días, con una media combinada (IC del 95 %) de 4,3 (3,7 a 4,8) días. Para el período de incubación, se estimó una media de 4,3 (3,4-5,2) días, y el rango fue de 3-7 días. Para el tiempo de infección hasta la muerte, el rango fue de 4 a 10 días, y la media fue de 9,0 (8,9-9,1) días. En consecuencia, la duración de la infecciosidad osciló entre 1 y 6 días, con una media de 4,4 (3,6-5,2) días.
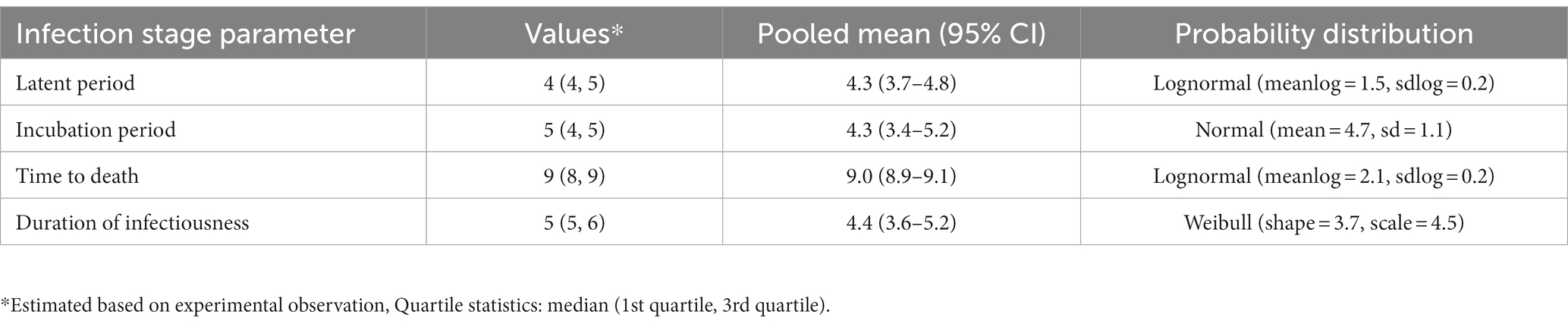 Tabla 3. Estimación de los parámetros de duración de la etapa de infección en función del experimento de la provocación de la infección por el virus de la PPA.
Tabla 3. Estimación de los parámetros de duración de la etapa de infección en función del experimento de la provocación de la infección por el virus de la PPA.
3.3 Simulación de la transmisión dentro del rebaño
El programa de simulación se ejecutó utilizando los valores del primer cuartil (Q1), mediana y tercer cuartil (Q3) del número de cerdos en los galpones infectados en la Tabla 2 y el coeficiente de transmisión basado en el tipo de galpón. El resultado de la simulación reveló que la propagación de la infección por el virus de la PPA fue relativamente más rápida en los rebaños pequeños en comparación con los grandes. Aunque el número absoluto de individuos infectados difirió según el tamaño del rebaño y el tipo de excremento, las tendencias de aumento, pico y disminución en cada etapa de la infección fueron similares. El período con el mayor número diario de animales recién infectados fue de 16 a 18 días para el Q1, de 17 a 19 días para la mediana y de 19 a 22 días para los valores del Q3 del número de cerdos. La prevalencia más alta fue inferior al 40% en las cerdas (38,3-39,0% para las naves gestantes y 35,7-36,6% para las parideras) y superior al 40% (40,7-41,4%) para las naves de engorde. La prevalencia más alta se alcanzó a los 23-24 días para el Q1, a los 24-26 días para la mediana y a los 26-28 días para los valores del Q3 del número de cerdos en el establo.
Se consideró que los cerdos fallecidos confirmados por PPA estaban infectados entre 7 y 11 días antes de la muerte, que fue el rango intercuartílico de los valores aleatorios generados (con lambda = 9), el valor medio del tiempo hasta la muerte (Tabla 3).
Tras la infección en los animales y la propagación dentro de las piaras de cerdos, se esperaba alcanzar la prevalencia de detección (que se muestra en la Tabla 2) a los 8-11 días en los establos preñados (3,9%), a los 5-11 días en los galpones de maternidad (2,3%) y a los 6-10 días en los establos de engorde (1,2%). Suponiendo que no se reconocieran los brotes de PPA y no se implementaran medidas de respuesta, se esperaba que todo el rebaño muriera dentro de los 64 días (para el número medio de cerdos) en los establos preñados, 70 días en los galpones de maternidad y 77 días en los establos de engorde desde el momento de la infección (Figura 2).
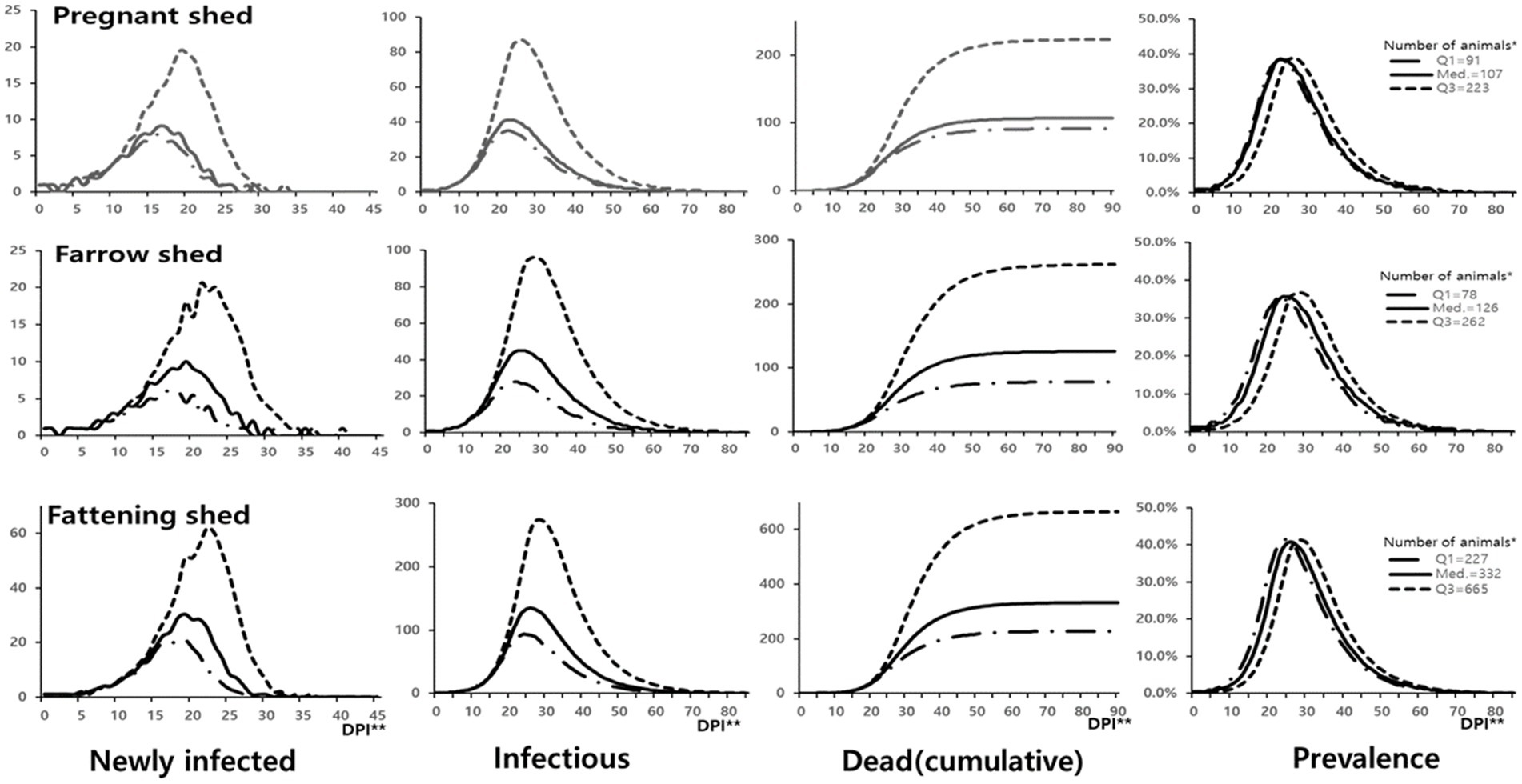 Figura 2. Transmisión dentro del rebaño de la infección por PPA según el tipo de establo infectado. *Número de animales Q1: 1er cuartil, Med.: Mediana, Q3: 3er cuartil. **DPI: Días posteriores a la introducción (inicio de la infección).
Figura 2. Transmisión dentro del rebaño de la infección por PPA según el tipo de establo infectado. *Número de animales Q1: 1er cuartil, Med.: Mediana, Q3: 3er cuartil. **DPI: Días posteriores a la introducción (inicio de la infección).
3.4 Momento de la infección en la granja con brote de peste porcina africana
Se estimó que el intervalo de tiempo desde la infección hasta la detección fue una mediana de 9,0 (Q1-Q3, 7,8-10,5) días en las granjas con brotes de PPA en Corea. La mediana de los intervalos (Q1-Q3) fue de 8,6 (7,8-10,5) días en galpones preñados, 8,0 (7,9-8,6) días en galpones de parto y 9,8 (9,0-12,8) días en galpones de engorde (engorde). En el brote real, los galpones de engorde tuvieron el mayor tiempo de detección después de la infección. Al considerar el tipo de ganado en las granjas del brote, la mediana de los intervalos (Q1-Q3) fue de 8,8 (7,8-12,8) días para las granjas de parto a engorde, 7,0 (3,9-10,1) días para las granjas de parto a destete y 9,5 (7,9-11,3) días para las granjas de engorde (Tabla 4).
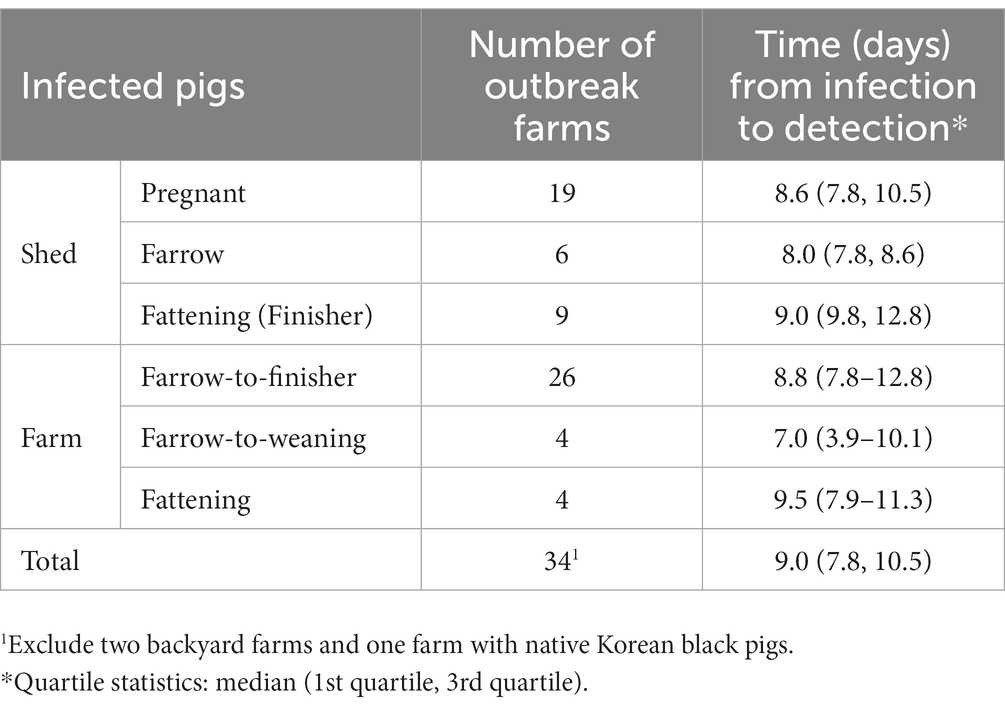 Tabla 4. Tiempo transcurrido desde la infección hasta la detección en las granjas porcinas del brote de PPA en Corea entre 2019 y 2023.
Tabla 4. Tiempo transcurrido desde la infección hasta la detección en las granjas porcinas del brote de PPA en Corea entre 2019 y 2023.
4 Discusión
La comprensión de la dinámica de transmisión dentro del rebaño es importante para una respuesta eficaz a una enfermedad infecciosa de los animales y requiere el conocimiento de cuándo comenzó la infección en la granja. Los modelos de simulación pueden ser particularmente útiles en estos casos (17, 18). Si el tamaño del rebaño es pequeño y el número de casos es bajo, el tiempo de infección puede estimarse en función del número de días transcurridos desde el inicio de los síntomas clínicos o lesiones más antiguos, y el período de incubación. Sin embargo, si muchos animales, como cerdos o aves de corral, se alojan juntos, y muchos se han enfermado o muerto simultáneamente, la simulación se puede utilizar para predecir el número de animales recién infectados, infecciosos y muertos a diario. Los valores de los parámetros de entrada afectan a la precisión de la predicción (19–21).
Sobre la base del desafío de infección con el virus de la PPA aislado de granjas en Corea entre 2019 y 2021, se encontró que todos los virus pertenecían a la cepa que causa una forma aguda de la enfermedad (15). También se determinó que el virus de la PPA de los brotes de 2022 y 2023 se encontraba en forma aguda. La viremia se detectó entre 2 y 5 días después de la inoculación, seguida de la detección en la cavidad nasal u oral en un plazo de 1 a 2 días, y la muerte se produjo entre 4 y 9 días después (15). Experimentos similares realizados en otros países mostraron que la viremia se detectó de 2 a 5 días después de la infección, seguida de la detección en hisopos orales, nasales o rectales dentro de 1 a 2 días. El período de incubación hasta que los síntomas clínicos, como fiebre alta, aparecieron a los 3-5 días y la muerte ocurrió a los 6-10 días después de la inoculación (22-25). Los resultados de nuestro estudio, que calculó un IC del 95%, fueron consistentes con los de los estudios con desafíos de infección en Corea y otros países. El tiempo estimado hasta la detección del virus en la cavidad oral o nasal varió de 3,7 a 4,8 días, el período de incubación varió de 3,4 a 5,2 días y la mortalidad varió de 8,9 a 9,1 días (Tabla 3).
La viremia se detectó entre 10 y 13 días después de la inoculación en cerdos que estuvieron en contacto con cerdos inoculados por el virus (22, 24). Los cerdos en contacto con el inóculo desarrollaron síntomas clínicos después de 9 días (25) y de 6 a 7 días después de la inoculación (26). La duración de la infecciosidad fue de 3,6 a 5,2 días en nuestro estudio, en comparación con 2,9 días de la cavidad nasal y 3,2 días de la cavidad oral con el virus de Georgia 2007 (22). El período infeccioso osciló entre 2 y 9 días en Europa (27).
Los estudios sobre la transmisión dentro de la piara entre cerdos se han centrado principalmente en el contacto directo (28, 29). Sin embargo, la transmisión indirecta a través de virus en el medio ambiente aún puede ocurrir. Por ejemplo, un experimento realizado en Polonia mostró que cerdos sanos que entraron en un corral vacío durante 1 día después de haber sido ocupados por cerdos infectados con PPA, mostraron síntomas clínicos graves en una semana (30). En las granjas porcinas de Corea, los cerdos tienen contacto entre sí dentro del mismo corral, pero hay más contacto indirecto con los cerdos de otros corrales a través del comportamiento humano, incluido el uso de herramientas. El número reproductivo (R0), que representa la transmisión entre cerdos, se ha informado que es de 2,8 (IC del 95%: 1,3-4,8) dentro de los corrales y de 1,4 (0,6-2,4) entre los corrales (31). La R0 La transmisión dentro del rebaño varía de 1,6 a 24,2 en diferentes estudios, según el tipo de reproducción y el método de medición (32). En nuestro estudio, se consideraron las vías de transmisión directas e indirectas para determinar el coeficiente de transmisión dentro del rebaño. El coeficiente más pequeño se asignó a la paridera, donde la cerda paridera permanece en un establo individual con sus lechones lactantes, con un valor de 0,8. Sobre la base de la Norma de Aplicación de la Ley de la Industria Ganadera, en Corea, los establos preñados deben tener la forma de corrales de agrupación para 2029 (33). A partir de 2023, ha comenzado la transición del establo de cerdos preñados de establo a corral de agrupación. En consecuencia, el coeficiente de transmisión para el establo preñado se fijó en 0,9. El coeficiente de transmisión dentro de la piara fue el más alto para los cerdos de engorde (1,0), donde los cerdos podían entrar en contacto cercano con sus compañeros de corral.
Con base en este estudio, se estima que la PPA se puede detectar después de 8,0 (IC 95% 7,8-8,6) días desde la infección en las parideras, 8,6 (7,8-10,5) días para las parideras y 9,0 (9,8-12,8) días para las que terminan en las parideras (Tabla 4). Varios factores, como el coeficiente utilizado, el número de animales y los patrones de trabajo en las granjas porcinas, pueden haber influido en los resultados de la simulación. En las granjas coreanas con brotes de PPA, se encontró que el tiempo estimado desde la infección hasta la detección (7,8-10,5 días) era más corto que el período sugerido por un estudio danés (13-19 días) (18) y un experimento con un virus moderadamente virulento (más de 20 días) (28). La detección relativamente rápida en Corea puede atribuirse al sistema de cría intensiva y a la cuidadosa identificación de cerdos enfermos y muertos. Detectar y notificar a los animales que muestran anomalías, como la muerte súbita, es crucial para la detección y contención temprana de la PPA. Un estudio que reconstruyó los patrones de propagación dentro de una granja porcina a gran escala en Letonia basado en una investigación sobre la PPA sugirió que el primer animal infectado murió dentro de una semana después de la infección, pero pasó desapercibido (34). En Corea, la muerte súbita es el síntoma más frecuentemente observado por los agricultores en las granjas afectadas por brotes de PPA (35). El gobierno coreano ha establecido criterios para notificar casos sospechosos de PPA, que incluyen la muerte súbita en las cerdas y una mortalidad diaria superior a la media de los últimos 10 días en todos los grupos de edad (11). La notificación rápida de un animal fallecido observado en una granja porcina mejora eficazmente la eficiencia de la respuesta a la PPA.
Además de las muertes relacionadas con la PPA, este estudio calculó la prevalencia de las poblaciones con antígenos positivos en comparación con el número total de cerdos en los establos infectados. Aunque no se realizaron pruebas de laboratorio en todos los cerdos de los establos afectados, se obtuvieron muestras de todos los cerdos enfermos y fallecidos y de sus cohabitantes, lo que garantizó que los animales más visiblemente afectados se incluyeran en las pruebas. Se necesitaron 9,0 (rango 7,8-10,5) d para que el 2,8% (IC 95%: 1,5-6,7%) de los cerdos de los establos dieran positivo para el antígeno de la PPA (Tablas 2, 4).
5 Conclusión
En este estudio, se estableció un procedimiento sistémico para estimar el momento de introducción del virus de la PPA en una granja porcina tras la confirmación de un brote de PPA en la granja. El procedimiento también se aplicó para estimar el tiempo de infección y el intervalo de tiempo desde la infección hasta la detección (es decir, el período durante el cual existe el riesgo de liberar el virus sin saberlo de la granja del brote). Los hallazgos proporcionan información valiosa sobre los brotes de PPA en las granjas porcinas, particularmente aquellas con sistemas de manejo intensivos, como las de Corea. Este estudio ayudará a facilitar la detección precoz de la PPA y la implementación de medidas preventivas, mejorando así la capacidad de control y manejo de la enfermedad.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Contribuciones de los autores
HY: Conceptualización, Curación de datos, Análisis formal, Obtención de fondos, Investigación, Metodología, Administración de proyectos, Recursos, Software, Visualización, Redacción – borrador original, Redacción – revisión y edición. YS: Análisis formal, Software, Redacción – revisión y edición. K-SK: Curación de datos, Análisis formal, Software, Redacción – revisión y edición. IL: Análisis formal, Redacción – revisión y edición. Y-HK: Recursos. EL: Adquisición de fondos, supervisión, redacción, revisión y edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este trabajo contó con el apoyo de la Agencia de Cuarentena Animal y Vegetal [Proyecto de investigación número B-1543068-2023-24-01].
Reconocimientos
Los autores expresan su sincero agradecimiento al estimado personal de la División de Enfermedades de Animales Extranjeros de la APQA por proporcionar resultados de laboratorio sobre el desafío de la infección por el virus de la PPA.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Notas
1. ^https://www.r-project/org
Referencias
1. Li, Z, Chen, W, Qiu, Z, Li, Y, Fan, J, Wu, K, et al. Virus de la peste porcina africana: una revisión. Vida. (2022) 12:1255. doi: 10.3390/life12081255
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Bergmann, H, Dups-Bergmann, J, Schulz, K, Probst, C, Zani, L, Fischer, M, et al. Identificación de factores de riesgo para la peste porcina africana: una revisión sistemática. Virus. (2022) 14:2017. doi: 10.3390/v14102107
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Cho, KH, Kim, HJ, Kim, DY, Yoo, DS, no, JJ, Kim, YJ, et al. Vigilancia de granjas porcinas infectadas por PPA de septiembre a octubre de 2019 en Corea del Sur. J Vet Sci. (2021) 22:E26. doi: 10.4142/jvs.2021.22.e26
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Kim, HJ, Choi, KH, Lee, SK, Kim, DY, no, JJ, Kim, HJ, et al. Brote de peste porcina africana en Corea del Sur, 2019. Transboud Emerg Dis. (2019) 67:473–5. doi: 10.1111/tbed.13483
5. Kim, YJ, Park, B, y Kang, HE. Medidas de control del brote de peste porcina africana: respuesta activa en Corea del Sur, preparación para el futuro y cooperación. J Vet Sci. (2021) 22:e13. doi: 10.4142/jvs.2021.22.e13
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. APQA (2023). Información del KAHIS sobre el brote de enfermedades infecciosas en animales. Disponible en: home.kahis.go.kr/home/lkntscrinfo/selectLkntsOccrrncList.do [Consultado el 21 de agosto de 2023].
7. MAFRA (2023). Directrices para el control de la peste porcina africana [Aviso MAFRA n.º 2023-4 (promulgación el 30 de enero de 2023)]. Disponible en: law.go.kr/LSW/admRulLsInfoP.do?admRulSeq=2100000218662#AJAX [Consultado el 30 de octubre de 2023].
8. Ejima, K, Kim, KS, Bento, AI, Iwanami, S, Fujita, Y, Aihara, K, et al. Estimación del momento de la infección a partir de datos longitudinales de carga viral del SARS-CoV-2: estudio de modelización matemática. BMC infecta dis. (2022) 22:656. doi: 10.1186/s12879-022-07646-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Yoon, H, Yoon, SS, Kim, H, Kim, YJ, Kim, B, y Wee, SH. Estimación de la ventana de infección para el brote de fiebre aftosa en Corea de 2010/2011. Salud Pública de Osong Res Perspect. (2013) 4:127–32. doi: 10.1016/j.phrp.2013.04.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Yoon, H, Park, CK, Nam, HM y Wee, SH. Patrón de propagación del virus dentro de las granjas de pollos infectadas utilizando el modelo de regresión: la epidemia de gripe aviar altamente patógena de 2003-2004 en la República de Corea. J Veterinary Med Ser B. (2005) 52:428–31. doi: 10.1111/j.1439-0450.2005.00891.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. MAFRA (2023). Promoción del refuerzo de la gestión del control de la peste porcina africana (PPA). Comunicado de prensa de MAFRA de fecha 29 de marzo de 2023. Disponible en: https://mafra.go.kr/home/5109/subview.do?enc=Zm5jdDF8QEB8JTJGYmJzJTJGaG9tZSUyRjc5MiUyRjU2NTg1MSUyRmFydGNsVmlldy5kbyUzRmJic0NsU2VxJTNEJTI2cmdzRW5kZGVTdHIlM0QyMDIzLjAzLjI5JTI2YmJzT3BlbldyZFNlcSUzRCUyNnBhc3N3b3JkJTNEJTI2c3JjaENvbHVtbiUzRHNqJTI2cGFnZSUzRDElMjZyZ3NCZ25kZVN0ciUzRDIwMjMuMDMuMjklMjZyb3clM0QxMCUyNmlzVmlld01pbmUlM0RmYWxzZSUyNnNyY2hXcmQlM0QlMjY%3D [Consultado el 30 de octubre de 2023].
12. MAFRA (2023). Anuncio de una norma adicional de medidas de control de enfermedades animales que deben observarse en las granjas porcinas para prevenir enfermedades animales contagiosas como la peste porcina africana. Anuncio público de MAFRA n.º 2023-142 (en vigor desde el 05 de abril de 2023). Disponible en: https://mafra.go.kr/home/5108/subview.do?enc=Zm5jdDF8QEB8JTJGYmJzJTJGaG9tZSUyRjc5MSUyRjU2NTkyOCUyRmFydGNsVmlldy5kbyUzRmJic0NsU2VxJTNEJTI2cmdzRW5kZGVTdHIlM0QyMDIzLjA0LjA1JTI2YmJzT3BlbldyZFNlcSUzRCUyNnBhc3N3b3JkJTNEJTI2c3JjaENvbHVtbiUzRHNqJTI2cGFnZSUzRDElMjZyZ3NCZ25kZVN0ciUzRDIwMjMuMDQuMDUlMjZyb3clM0QxMCUyNmlzVmlld01pbmUlM0RmYWxzZSUyNnNyY2hXcmQlM0QlMjY%3D [Consultado el 30 de octubre de 2023].
13. APQA (2023). Consejo Central de Vigilancia de las Enfermedades Contagiosas de los Animales. Disponible en: https://ebook.qia.go.kr/20230623_111353 [Consultado el 20 de octubre de 2023].
14. MAFRA (2022). Procedimiento operativo normalizado para la peste porcina africana (promulgación el 30 de diciembre de 2022). Disponible en: https://www.mafra.go.kr/FMD-AI2/2732/subview.do?enc=Zm5jdDF8QEB8JTJGYmJzJTJGRk1ELUFJMiUyRjQ2MCUyRjU2NTg1OSUyRmFydGNsVmlldy5kbyUzRmJic0NsU2VxJTNEJTI2cmdzRW5kZGVTdHIlM0QlMjZiYnNPcGVuV3JkU2VxJTNEJTI2cGFzc3dvcmQlM0QlMjZzcmNoQ29sdW1uJTNEJTI2cGFnZSUzRDElMjZyZ3NCZ25kZVN0ciUzRCUyNnJvdyUzRDEwJTI2aXNWaWV3TWluZSUzRGZhbHNlJTI2c3JjaFdyZCUzRCUyNg%3D%3D [Consultado el 30 de octubre de 2023].
15. Cho, KH, Hong, SK, Jang, MK, Ryu, JH, Kim, HJ, Lee, YR, et al. Comparación de la virulencia de aislados de peste porcina africana coreana de granjas porcinas durante 2019-2021. Virus. (2022) 14:2512. doi: 10.3390/v14112512
16. Cho, KH, Yoo, DS, Hong, SK, Kim, DY, Jang, MK, Kang, HE, et al. Perfil genético de los virus de la peste porcina africana que circulan en las granjas porcinas de Corea del Sur durante los brotes entre 2022 y abril de 2023. Virus. (2023) 15:1552. doi: 10.3390/v15071552
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Conrady, B, Mortensen, S, Nielsen, SS, Houe, H, Calvo-Artavia, FF, Ellis-Iversen, J, et al. Simulación de la propagación de la fiebre aftosa y efectos de las estrategias de mitigación para apoyar la planificación de contingencias veterinarias en Dinamarca. Patógenos. (2023) 12:435. doi: 10.3390/pathogens12030435
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Nielsen, JP, Larsen, TS, Halasa, T, y Christiansen, LE. Estimación de la dinámica de transmisión del virus de la peste porcina africana dentro de un galpón porcino. Epidemiol Infect. (2017) 145:2787–96. doi: 10.1017/S0950268817001613
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Kinsley, AC, Patterson, G, VanderWaal, KL, Craft, ME, y Pérez, AM. Valores de los parámetros de los modelos epidemiológicos de fiebre aftosa en porcinos. Front Vet Sci. (2016) 3:44. doi: 10.3389/fvets.1016.00044
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Moreno-Torres, KI, Delgado, AH, Branan, MA, Yadav, S, Stenfeldt, C, y Arzt, J. Parametrización de la duración de la fase de fiebre aftosa en cerdos. Prev Vet Med. (2022) 202:105615. doi: 10.1016/j.prevetmed.2022.105615
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Yadav, S, Stenfeldt, C, Branan, MA, Moreno-Torres, KI, Holmstrom, LK, Delgado, AH, et al. Parametrización de las duraciones de las fases de la fiebre aftosa en bovinos. Front Vet Sci. (2019) 6:263. doi: 10.3389/fvets.2019.00263
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Guinat, C, Reis, AL, Netherton, CL, Goatley, L, Pfeiffer, DU y Dixon, L. Dinámica de la excreción y excreción del virus de la peste porcina africana en cerdos domésticos infectados por inoculación intramuscular y transmisión por contacto. Res. Veterinaria. (2014) 45:93. doi: 10.1186/s13567-014-0093-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Howey, EB, O’Donnell, V, de Carvalho Ferreira, HC, Borca, MV y Arzt, J. Patogénesis del virus de la peste porcina africana altamente virulento en cerdos domésticos expuestos a través de inoculación intraorofaríngea, intranasofaríngea e intramuscular, y por contacto directo con cerdos infectados. Virus Res. (2013) 178:328–39. doi: 10.1016/j.viruses.2013.09.024
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Oh, SI, Bui, NA, Bui, VN, Dao, DT, Cho, A, Lee, HG, et al. Análisis patobiológico del virus de la peste porcina africana en cerdos expuestos al virus de la peste porcina y estimación del número básico de reproducción del virus en Vietnam. Gestión de la Salud Porcina. (2023) 9:30. doi: 10.1186/s40813-023-00330-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Zhao, D, Liu, R, Zhang, X, Li, F, Wang, J, Zhang, J, et al. Replicación y virulencia en cerdos del primer virus de la peste porcina africana aislado en China. Los microbios emergentes infectan. (2019) 8:438–47. doi: 10.1080/22221751.2019.1590128
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Yamada, M, Masujin, K, Kameyama, KI, Yamazoe, R, Kubo, T, Iwata, K, et al. Infección experimental de cerdos con diferentes dosis de la cepa Armenia 07 del virus de la peste porcina africana por inyección intramuscular y contacto directo. J Vet Med Sci. (2020) 82:1835–45. doi: 10.1292/jvms.20-0378
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Pietschmann, J, Guinat, C, Beer, M, Pronin, V, Tauscher, KT, Petrov, A, et al. Curso y características de transmisión de la infección oral a dosis bajas de cerdos domésticos y jabalíes europeos con una cepa aislada del virus de la peste porcina africana caucásica. Arch Virol. (2015) 160:1657–67. doi: 10.1007/s00705-015-2430-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Malladi, S, Ssematimba, A, Bonney, PJ, St Charles, KM, Boyer, T, Goldsmith, T, et al. Predicción del tiempo para detectar el virus de la peste porcina africana moderadamente virulento en piaras porcinas de engorde utilizando un modelo de transmisión estocástica de la enfermedad. BMC Vet Res. (2022) 18:84. doi: 10.1186/s12917-022-03188-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Seematimba, A, Malladi, S, Bonney, PJ, St Charles, KM, Boyer, TC, Goldsmith, T, et al. Estimaciones de detección y transmisión de la peste porcina africana utilizando la formulación de modelos homogéneos frente a heterogéneos en simulaciones estocásticas dentro de las instalaciones porcinas. Open Vet J. (2022) 12:787–96. doi: 10.5455/OVJ.2022.v12.i6.2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Olesen, AS, Lohse, L, Boklund, A, Halasa, T, Belsham, GJ, Rasmussen, TB, et al. Corto período de tiempo para la transmisibilidad del virus de la peste porcina africana desde un ambiente contaminado. Transbound Emerg Dis. (2018) 65:1024–32. doi: 10.1111/tbed.12837
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Guinat, C, Gubbins, S, Vergne, T, Gonzales, JL, Dixon, L, y Pfeiffer, DU. Dinámica experimental de transmisión de cerdo a cerdo para el virus de la peste porcina africana, cepa Georgia 2007/1. Epidemiol Infect. (2016) 144:25–34. doi: 10.1017/S0950268815000862
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Le, VP, Lan, NT, Canevari, JT, Villanueva-Cabezas, JP, Padungtod, P, Trinh, TBN, et al. Estimación de la tasa de transmisión dentro de la manada de peste porcina africana en Vietnam. Animales. (2023) 13:571. doi: 10.3390/ani13040571
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Norma de aplicación de la Ley de la Industria Ganadera (2022). Norma de aplicación de la Ley de la industria ganadera (decreto ministerial del MAFRA). Disponible en: https://law.go.kr/LSW//lumLsLinkPop.do?lspttninfSeq=82726&chrClsCd=010202 [Consultado el 30 de octubre de 2023].
34. Lamberga, K, Olševskis, E, Seržants, M, Berzinš, A, Viltrop, A, y Depner, K. Peste porcina africana en dos grandes granjas porcinas comerciales en LETONIA: estimación del período de alto riesgo y la propagación del virus dentro de la granja. Veterinaria Sci. (2020) 7:105. doi: 10.3390/vetsci7030105
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Yoon, H, Hong, SK, Lee, I, Uoo, DS, Jung, CS, Lee, E, et al. Síntomas clínicos de la peste porcina africana en granjas porcinas domésticas de la República de Corea, 2019. Transbound Emerg Dis. (2020) 67:2245–8. doi: 10.1111/tbed.13552
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: Peste porcina africana, granja porcina, momento de la infección, simulación, Corea
Cita: Yoon H, Son Y, Kim K-S, Lee I, Kim Y-H y Lee E (2023) Estimación del tiempo de infección por peste porcina africana en granjas porcinas en Corea. Frente. Vet. Sci. 10:1281152. doi: 10.3389/fvets.2023.1281152
Recibido: 22 de agosto de 2023; Aceptado: 02 de noviembre de 2023;
Publicado: 23 noviembre 2023.
Editado por:
Satoshi Ito, Universidad de Kagoshima, Japón
Revisado por:
Kyung-Duk Min, Universidad Nacional de Chungbuk, República de Corea
Marius Masiulis, Universidad Lituana de Ciencias de la Salud, Lituania
Derechos de autor © 2023 Yoon, Son, Kim, Lee, Kim y Lee. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Hachung Yoon, heleney@korea.kr
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía