Estrategias inmunoterapéuticas para el linfoma canino: cambiar las probabilidades contra el linfoma no Hodgkin

Estrategias inmunoterapéuticas para el linfoma canino: cambiar las probabilidades contra el linfoma no Hodgkin
 Joana N. R. Dias, Ana S. André,
Joana N. R. Dias, Ana S. André, 
 Sandra I. Aguiar,
Sandra I. Aguiar,  Solange Gil,
Solange Gil,  Luís Tavares y
Luís Tavares y  Frederico Aires-da-Silva*
Frederico Aires-da-Silva*- Centro de Investigação Interdisciplinar em Sanidade Animal, Faculdade de Medicina Veterinária, Universidade de Lisboa, Avenida da Universidade Técnica, Lisbon, Portugal
La nueva era de la inmuno-oncología ha traído complejidades y desafíos que enfatizan la necesidad de identificar nuevas estrategias y modelos para desarrollar terapias exitosas y rentables. La inclusión de un modelo canino en el desarrollo farmacológico de inmunoterapias contra el cáncer está siendo ampliamente reconocida como una solución válida para superar varios obstáculos asociados con los modelos preclínicos convencionales. Impulsado por el éxito de las inmunoterapias en el tratamiento del linfoma no Hodgkin humano (LNH) y por las notables similitudes del LNH canino con su contraparte humana, el LNH canino ha sido uno de los principales focos de la investigación comparativa. En la presente revisión, resumimos una visión general de los desafíos y perspectivas de las inmunoterapias actuales contra el cáncer y el papel que la medicina comparativa podría desempeñar en la solución de las limitaciones que plantea este campo en rápida expansión. Se aborda el estado del arte del LNH humano y canino y la lógica detrás del uso del modelo canino para cerrar la brecha traslacional entre los estudios preclínicos murinos y los ensayos clínicos en humanos. Finalmente, se describe una revisión de las inmunoterapias actualmente disponibles para el LNH canino, destacando el potencial de estas opciones terapéuticas.
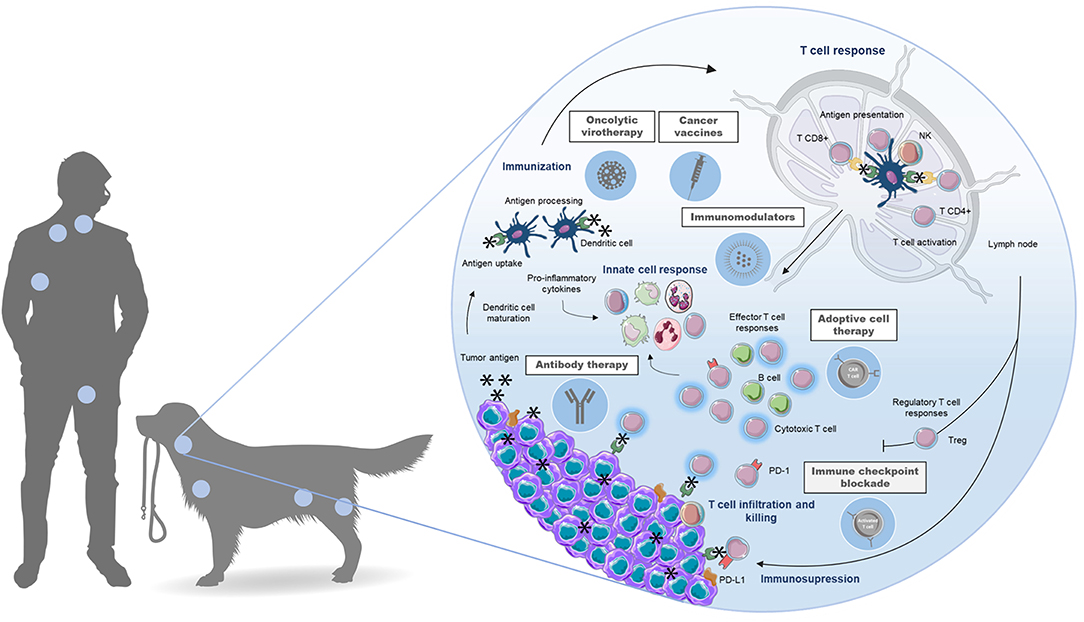 RESUMEN GRÁFICO. La aplicación del linfoma canino como modelo animal para enfoques inmunoterapéuticos en medicina comparativa proporciona una plataforma integrada de descubrimiento de fármacos que maximiza la cooperación interdisciplinaria y aprovecha los puntos en común entre humanos y perros para el desarrollo de nuevas inmunoterapias contra el linfoma no Hodgkin, beneficiando a ambas especies.
RESUMEN GRÁFICO. La aplicación del linfoma canino como modelo animal para enfoques inmunoterapéuticos en medicina comparativa proporciona una plataforma integrada de descubrimiento de fármacos que maximiza la cooperación interdisciplinaria y aprovecha los puntos en común entre humanos y perros para el desarrollo de nuevas inmunoterapias contra el linfoma no Hodgkin, beneficiando a ambas especies.
Introducción
Solo en 2018, el cáncer fue responsable de aproximadamente 9,6 millones de muertes en todo el mundo en países de todos los niveles de ingresos, ocupando el segundo lugar en las principales causas de muerte, detrás de las enfermedades cardiovasculares (1). Debido al crecimiento de la población, el envejecimiento y la adopción de comportamientos de estilo de vida asociados con el riesgo de cáncer, se espera que este número aumente en aproximadamente un 70% en los próximos 20 años (2, 3). Aún así, a pesar de que estos números impresionantes demuestran que la carga del cáncer sigue siendo un desafío importante en todo el mundo, los desarrollos recientes en medicina personalizada y nuevos enfoques de tratamiento, como la inmunoterapia, han aumentado la esperanza de mejorar significativamente la supervivencia del cáncer (2).
El concepto de aprovechar el sistema inmunológico del huésped para tratar el cáncer se remonta a décadas atrás, sin embargo, solo en los últimos años las inmunoterapias han surgido como una estrategia de tratamiento clínicamente validada y efectiva (4). Hoy en día, la inmunoterapia contra el cáncer se ha convertido en un campo de rápido crecimiento y se convirtió rápidamente en el cuarto pilar de la atención del cáncer, junto con la cirugía, la terapia citotóxica y la radioterapia (5). Más recientemente, los éxitos de los avances clínicos, como los inhibidores de puntos de control y las células T modificadas, revitalizaron el campo y destacaron las oportunidades que pueden ofrecer los enfoques inmunoterapéuticos, que culminaron con la nominación de la «inmunoterapia contra el cáncer» como el Avance del Año 2013 por la Ciencia (6, 7). En 2018, el Premio Nobel de Fisiología o Medicina fue otorgado conjuntamente a James Allison (MD Anderson Cancer Center de la Universidad de Texas) y Tasuku Honjo (Facultad de Medicina de la Universidad de Kyoto) por sus descubrimientos que conducen a nuevos enfoques en el aprovechamiento del sistema inmunológico para combatir el cáncer (8-12).
Sin embargo, al transformar el panorama terapéutico del cáncer, esta modalidad compleja trajo desafíos únicos a la comunidad de descubrimiento de fármacos. De hecho, a medida que más pacientes con cáncer han recibido inmunoterapias, algunos de los principales inconvenientes de estos tratamientos se han hecho evidentes. Uno de los principales problemas es determinar las subpoblaciones de pacientes que responderán y que experimentarán toxicidades significativas (13). De hecho, el desafío ahora es ampliar el rango de pacientes que se benefician de la inmunoterapia al tiempo que se minimizan los eventos adversos relacionados con el tratamiento. Para abordar esto, es crucial identificar los factores predictivos de la respuesta que pueden ayudar a seleccionar adecuadamente a los pacientes para el tratamiento, identificar terapias de combinación racional y definir la progresión y la resistencia (14). Esto es particularmente crítico cuando se desarrollan inmunoterapias contra el cáncer, considerando que se espera que el sistema inmunológico del paciente sea tan importante como los aspectos relacionados con el tumor al determinar la respuesta y la toxicidad (15).
La traducción clínica de la inmunoterapia contra el cáncer depende de la investigación preclínica y los modelos de roedores han sido la base de la investigación básica preliminar y los ensayos de seguridad (16). Sin embargo, estos modelos subrepresentan la heterogeneidad y la compleja interacción entre las células inmunes humanas y los cánceres. De hecho, los ratones de laboratorio rara vez desarrollan tumores espontáneos, se alojan en condiciones libres de patógenos específicos que afectan en gran medida el desarrollo inmunológico y modelan de manera incompleta las principales características del tumor / microambiente inmune, creando desafíos para la traducción clínica. Como resultado, estos modelos murinos no se han correlacionado con las tasas de éxito clínico, lo que demuestra una necesidad urgente de modelos preclínicos innovadores (17-19). Por lo tanto, el uso de modelos animales alternativos es fundamental para cerrar la brecha traslacional entre los modelos murinos y los estudios clínicos en humanos. En particular, los modelos preclínicos que muestran sistemas inmunes intactos que se parecen mucho a la respuesta inmune humana, presentan oncogénesis espontánea comparable e interacciones inmunes similares a las humanas, y pueden modelar resultados clínicos clave como eficacia, dosis-respuesta y toxicidad, serán críticos para la investigación traslacional de inmunoterapia contra el cáncer (15).
Por lo tanto, la medicina comparada ofrece una plataforma importante con modelos innovadores complejos de especies cruzadas que permiten la investigación de nuevas estrategias terapéuticas y agentes para enfermedades que son comunes a animales y humanos (20, 21). En particular, el modelo canino representa un poderoso recurso de modelos para la investigación de inmunoterapia contra el cáncer. Los perros son una atractiva combinación de animales de compañía que experimentan un desarrollo espontáneo de cáncer en el contexto de un sistema inmunológico intacto (15). Además, los tumores naturales en perros presentan muchas similitudes clínicas, patológicas, inmunológicas, moleculares, diagnósticas y terapéuticas con las observadas en humanos, que son difíciles de reproducir en otros modelos (22-25). Esto permite estudiar las complejas interacciones inmunes durante el curso del tratamiento, al tiempo que aborda la eficacia y toxicidad a largo plazo de las inmunoterapias contra el cáncer (15).
Sin embargo, la integración del modelo canino en la investigación de enfoques inmunoterapéuticos requiere diagnóstico, estadificación y evaluación de la respuesta al tratamiento, optimización y estandarización, para realizar ensayos clínicos grandes y organizados y lograr la conformidad al analizar los datos (26).
Impulsado por el gran éxito logrado con la aplicación de inmunoterapias en el tratamiento de humanos no Hodgkin (hNHL) y por las notables similitudes del linfoma no Hodgkin canino (cNHL) con su contraparte humana, el cNHL ha sido uno de los principales focos de investigación comparativa con respecto al desarrollo de enfoques inmunoterapéuticos para perros.
Justificación de un modelo canino de linfoma
Durante mucho tiempo, la investigación en linfoma se ha beneficiado de los modelos tradicionales de ratón, sin embargo, la escasez de modelos verdaderamente representativos ha obstaculizado la comprensión completa de la biología de la enfermedad y el desarrollo de fármacos. Con la introducción de la tecnología genómica, los modelos animales no tradicionales han sido más accesibles y el aprovechamiento de estas oportunidades puede representar una estrategia novedosa para acelerar la investigación de enfermedades y el descubrimiento de nuevos fármacos (27). Además, hay un número creciente de estudios que demuestran que el linfoma que surge espontáneamente en perros podría ser un recurso invaluable para estudiar la biología y el tratamiento de esta enfermedad (28). Como tal, el modelo cNHL puede ayudar a evitar muchas de las limitaciones asociadas con el uso de modelos murinos al tiempo que presenta otras ventajas adicionales (29, 30).
El cNHL comparte muchas similitudes notables con su contraparte humana (29, 31-34). La incidencia de LNHc de 15-30/100 000 es similar a la incidencia humana (35, 36), aunque estudios adicionales indican que la incidencia de LNHc puede ser mayor (37). Los esquemas de clasificación y calificación del LNHc se diseñaron para reflejar el equivalente en las personas y facilitar la comparación. De hecho, la clasificación revisada de 2008 de la Organización Mundial de la Salud basada en el sistema revisado de clasificación de linfoma europeo americano, que intenta agrupar los linfomas por tipo de célula, aspectos fenotípicos, genéticos y moleculares, es el estándar actual para el diagnóstico y clasificación del linfoma humano, también sirve como base para las recomendaciones caninas actuales (38, 39). El uso de estas pautas actuales de la Organización Mundial de la Salud como plantilla, permitió describir 20 entidades de LNH, entre casi 50 subtipos discretos de LNH. Además, el linfoma de células B es más prevalente que el linfoma de células T en ambas especies y el linfoma difuso de células B grandes es el tipo más común de linfoma no Hodgkin (LNH) tanto en humanos como en perros (38). Finalmente, las modalidades de tratamiento para el LNHc son similares a las utilizadas para el linfoma humano (radiación, corticosteroides, quimioterapia) y los agentes de quimioterapia basados en CHOP (ciclofosfamida, doxorrubicina, vincristina y prednisolona) generalmente se usan para tratarlo. La respuesta al tratamiento y la resistencia también presentan patrones clínicos similares al LNH (27).
Desde una perspectiva de desarrollo de fármacos, el modelo canino representa un modelo animal grande y de larga vida, evolutivamente más estrechamente relacionado con los humanos que con los roedores, que proporciona una evaluación más precisa de los parámetros farmacocinéticos / farmacodinámicos, al tiempo que determina la seguridad y eficacia de nuevos agentes y enfoques terapéuticos (27, 40). Además, la tasa de progresión relativamente rápida de la enfermedad permite obtener conclusiones tempranas de los ensayos clínicos. De hecho, un ensayo clínico aleatorizado en perros requiere ~ 1-3 años, mientras que un ensayo clínico en humanos tarda unos 15 años en completarse. Esta breve línea de tiempo permite integrar los hallazgos de los ensayos con mascotas en ensayos en humanos, incluida la toxicidad, la respuesta, la farmacodinámica, la dosis, el régimen, el programa, los biomarcadores y la evaluación histológica de respuesta (28).
Otra ventaja principal del modelo canino es que el LNHc es un tumor que ocurre espontáneamente en un huésped inmunocompetente, en contraste con el xenoinjerto murino o los modelos de ratón genéticamente modificados. Este entorno de cáncer natural ofrece una diversidad genética similar al linfoma humano y permite estudiar mecanismos biológicos, como la iniciación y promoción del tumor. Además, el modelo de perro mascota aprovechado por la conservación evolutiva permite identificar similitudes entre la linfomagénesis canina y humana, por ejemplo, en la identificación de mutaciones genéticas «conductoras» clave comunes a ambas especies (27).
Los beneficios del modelo cNHL se extienden más allá de las ventajas biológicas de un tumor que ocurre espontáneamente en un animal grande. Los perros comparten el mismo entorno de vida que sus cuidadores, lo que permite estudiar los factores de riesgo ambientales de desarrollar linfoma (27, 28). Por ejemplo, un estudio epidemiológico en Francia demostró una correlación entre la incidencia de LNHc y LNHH e informó una fuerte asociación entre el LNHC y la distribución de incineradores de residuos, residuos radiactivos u otros sitios contaminados (41). Además, hay una mayor prevalencia de linfoma dentro de razas específicas de perros (42) y una distribución específica de la raza de linfomas de células B y células T (43). Esto, en asociación con los pedigríes multigeneracionales bien organizados mantenidos por muchos criadores, representa una ventaja genética única que permite el mapeo de genes de predisposición al linfoma con estrategias que no son posibles en humanos (28).
La justificación final para usar perros con linfoma como modelo animal se basa en el concepto de doble beneficio de este enfoque de investigación comparativa. La mejora de la atención médica actual ha promovido el aumento de la esperanza de vida de los perros, lo que permite el diagnóstico de enfermedades tardías como el cáncer (44). El linfoma en particular es una de las neoplasias malignas más comunes en perros (28). Además, el estatus social de los perros como animales de compañía les permite beneficiarse de una atención médica de alta calidad y de la exploración ética de enfoques traslacionales. Además, estas iniciativas también están motivadas por los crecientes estándares de atención médica exigidos por los dueños de mascotas, lo que crea la necesidad de nuevas terapias contra el cáncer en entornos veterinarios (20, 21, 45). En conjunto, el uso del modelo de LNH representa una oportunidad única para fortalecer la colaboración entre la medicina humana y veterinaria en la investigación del linfoma, que en última instancia conducirá a avances en el cuidado de personas y perros afectados por LNH, una necesidad médica crítica no satisfecha de la sociedad actual (22, 27).
Una necesidad crítica insatisfecha de nuevas opciones de tratamiento para el linfoma no Hodgkin en oncología comparativa
El LNH, un grupo heterogéneo de cánceres caracterizados por una clase diversa de proliferaciones de linfocitos, representa una de las neoplasias más comunes tanto en humanos como en perros (38, 46). El LNH constituye la neoplasia maligna hematológica notificada con mayor frecuencia en todo el mundo, y comprende casi el 3% de todos los diagnósticos de cáncer. Las tasas de incidencia más altas se encuentran en Australia / Nueva Zelanda, América del Norte y Europa. En los Estados Unidos, el LNH es la séptima causa más común y la sexta más común de muerte relacionada con el cáncer, en Europa es la undécima más común y la decimocuarta más mortal neoplasia maligna y su incidencia casi se ha duplicado desde principios de los años 70 (47, 48). El LNH representa el 90% de todos los linfomas y abarca un grupo heterogéneo de cánceres caracterizados por la proliferación de linfocitos malignos, el 85-90% de los cuales surgen de linfocitos B, mientras que el resto se deriva de células T o células asesinas naturales. Este grupo diverso de neoplasias malignas generalmente se desarrolla en los ganglios linfáticos, pero puede ocurrir en casi cualquier tejido, desde el linfoma folicular más indolente hasta el más agresivo difuso de células B grandes (DLBCL) y el linfoma de Burkitt (49). Los pacientes con LNH generalmente presentan linfadenopatía persistente e indolora, pero algunos pacientes pueden presentar síntomas constitucionales o con afectación de órganos distintos de los del sistema linfoide y hematopoyético (50).
La base de la selección del tratamiento requiere un diagnóstico preciso, una estadificación cuidadosa de la enfermedad y la identificación de factores pronósticos adversos. En cualquier caso, los pacientes con LNH reciben con mayor frecuencia quimioinmunoterapia como tratamiento inicial. Se puede realizar radioterapia si los pacientes tienen enfermedad en estadio temprano (50). Las tasas de respuesta a la quimioterapia convencional son generalmente >50%; sin embargo, la mayoría de los pacientes eventualmente recaen. Además, la toxicidad de la quimioterapia convencional a menudo limita su eficacia (47).
En las últimas décadas, la comunidad científica ha estado reportando casos de éxito terapéutico utilizando anticuerpos monoclonales (mAbs) en el tratamiento del LNH en humanos. Uno de los ejemplos más exitosos ha sido la aplicación de mAbs dirigidos al antígeno de superficie de CD20 (Rituximab®) en combinación con el régimen de quimioterapia CHOP, que ha revolucionado el tratamiento del linfoma de células B al mejorar significativamente el intervalo libre de enfermedad y la supervivencia general, con una toxicidad mínima (51, 52). Aunque las estrategias terapéuticas actuales han mejorado significativamente el pronóstico de los pacientes diagnosticados con LNH, una fracción sustancial de los pacientes recaen o son refractarios a estos tratamientos. Se han identificado varias deficiencias del tratamiento como prioridades de investigación, sin embargo, la resistencia al rituximab y la enfermedad refractaria / recidivante representan los principales desafíos actuales y emergentes (53-55).
Por lo tanto, se ha producido una gran cantidad de nuevos enfoques inmunoterapéuticos para tratar el linfoma. Las clases más interesantes de inmunoterapias comprenden células T receptoras de antígenos quiméricos, anticuerpos biespecíficos, inhibidores de puntos de control inmunitario y vacunas. El advenimiento de tales terapias innovadoras trajo desafíos únicos que deben considerarse, incluida la evaluación del momento adecuado del tratamiento, la población óptima de pacientes, la duración de la terapia, la toxicidad y el costo. Por lo tanto, los estudios futuros deben centrarse en el desarrollo de nuevas estrategias, modelos y caminos para optimizar el desarrollo de nuevos fármacos de inmunoterapias para el LNHH (56).
Debido a las características moleculares, de incidencia, genéticas, histopatológicas y clínicas compartidas, el LNHC se ha propuesto como un modelo animal comparativo para la investigación de nuevos agentes terapéuticos y enfoques para el LNHH (22-24, 30). El LNHc muestra varios subtipos histológicos y los pacientes pueden manifestar una amplia gama de síntomas. Sin embargo, la mayoría sufre de linfadenopatía generalizada (forma multicéntrica) y se les diagnostica linfoma de grado intermedio a alto, más comúnmente de origen de células B. Sin tratamiento, la enfermedad tiene una alta mortalidad (28), lo que requiere quimioterapia inmediata para lograr la remisión temporal y la supervivencia prolongada. La quimioterapia sigue siendo el pilar para el tratamiento del LNHc y, a pesar de los numerosos protocolos quimioterapéuticos publicados, parece que hemos llegado a un punto muerto con respecto a lo que esta modalidad de tratamiento tiene para ofrecer en entornos estándar (57). Sin embargo, la curación rara vez se logra y la mayoría de los perros recaen con linfoma letal y resistente a los medicamentos. La mediana de la barrera de supervivencia a 12 meses y las tasas de supervivencia a 20 años del 25 al 2% demuestran una necesidad urgente e insatisfecha en medicina veterinaria de desarrollar nuevas estrategias de tratamiento para la enfermedad refractaria (58-61).
Por lo tanto, las inmunoterapias para el LNHc son un enfoque prometedor para el desarrollo de una nueva clase de terapias contra el cáncer, que en muchos casos beneficiarán a los humanos y a los mejores amigos del hombre. Para demostrar el potencial de estas estrategias, las inmunoterapias disponibles y en desarrollo para el LNHc se resumirán a continuación (Figura 1).
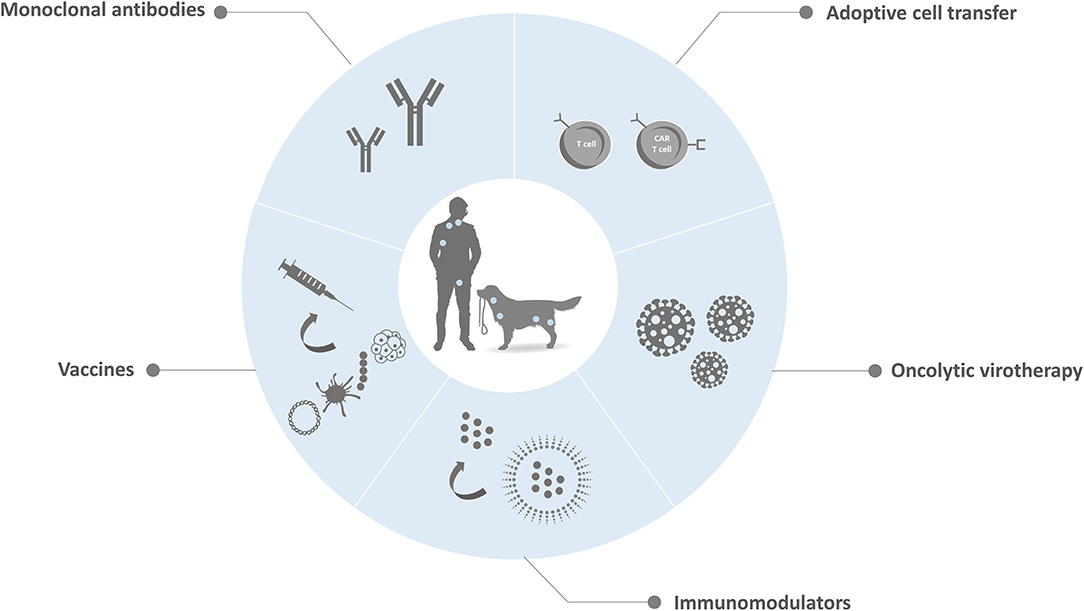 FIGURA 1. Representación esquemática de las estrategias de inmunoterapia disponibles y en desarrollo para el LNHc. Actualmente, varios grupos de investigación están investigando activamente nuevas inmunoterapias que movilicen el propio sistema inmunológico del paciente para tratar el LNH tanto en mascotas como en dueños de mascotas. Estas modalidades de tratamiento incluyen mAbs terapéuticos que promueven la muerte directa o indirecta de las células cancerosas, transferencia de células adoptivas que utilizan las propias células de un paciente para inducir actividad antitumoral, viroterapia oncolítica que involucra al virus competente en la replicación en la eliminación del cáncer, inmunomoduladores que tienen como objetivo mejorar las respuestas inmunes y el control tumoral y vacunas que estimulan el propio sistema inmunológico del paciente contra las células cancerosas.
FIGURA 1. Representación esquemática de las estrategias de inmunoterapia disponibles y en desarrollo para el LNHc. Actualmente, varios grupos de investigación están investigando activamente nuevas inmunoterapias que movilicen el propio sistema inmunológico del paciente para tratar el LNH tanto en mascotas como en dueños de mascotas. Estas modalidades de tratamiento incluyen mAbs terapéuticos que promueven la muerte directa o indirecta de las células cancerosas, transferencia de células adoptivas que utilizan las propias células de un paciente para inducir actividad antitumoral, viroterapia oncolítica que involucra al virus competente en la replicación en la eliminación del cáncer, inmunomoduladores que tienen como objetivo mejorar las respuestas inmunes y el control tumoral y vacunas que estimulan el propio sistema inmunológico del paciente contra las células cancerosas.
Inmunoterapias actuales para el linfoma no Hodgkin canino
Después de décadas de debilitar o incluso eliminar el sistema inmunológico del paciente con quimioterapia, ahora la tendencia es aprovechar la capacidad del sistema inmunológico para erradicar el cáncer (62). En las últimas décadas, la inmunoterapia ha pasado a la vanguardia de la atención del cáncer debido al éxito clínico sin precedentes en una amplia gama de neoplasias malignas, a veces incluso en etapas tardías de la enfermedad (63). El campo de la inmunoterapia veterinaria tiene una promesa similar para los animales de compañía con cáncer, y se han realizado varios esfuerzos para desarrollar inmunoterapias veterinarias específicas (Tabla 1). En un futuro próximo, se espera que la inmunoterapia tumoral se convierta en una herramienta terapéutica válida en oncología veterinaria, junto con la quimioterapia, la radioterapia y la cirugía.
Anticuerpos monoclonales
En la terapia del cáncer, el objetivo principal del tratamiento con anticuerpos es promover la muerte directa o indirecta de las células cancerosas y se han empleado con éxito varias estrategias. Los MAbs pueden unirse a las células cancerosas diana y promover directamente la muerte inducida por señalización o pueden mediar una respuesta inmune antitumoral al promover la citotoxicidad celular dependiente de anticuerpos (ADCC) e inducir citotoxicidad dependiente del complemento (CDC) (91). En el caso de las respuestas ADCC, los mAbs se unen a las células tumorales diana, mientras que la región mAb Fc se involucra con los FcγR en la superficie de las células efectoras, incluidas las células asesinas naturales y los macrófagos. Estas células inmunes causan fagocitosis, apoptosis o lisis de las células diana. En las respuestas de los CDC, los mAbs promueven directamente la muerte celular dirigida a través del desarrollo de un complejo de ataque de membrana en cascada del complemento. Además, las terapias basadas en mAb también pueden bloquear las vías promotoras del crecimiento, como la angiogénesis, o pueden regular directamente la actividad antitumoral de las células inmunes adaptativas al bloquear las señales inhibitorias responsables de limitar la activación de las células T (92). La mayoría de los mAbs comercializados consisten en una molécula de IgG de longitud completa. Al proporcionar una larga vida media y funciones efectoras, estas moléculas han estado presentando una aplicación bastante exitosa en terapéutica. Sin embargo, este formato de anticuerpo convencional presenta algunos inconvenientes que limitan su uso clínico y existe un abanico de aplicaciones terapéuticas en las que otros formatos de anticuerpos pueden ser más adecuados. Para abordar estos problemas importantes, los andamios de anticuerpos más pequeños, como el Fab o el fragmento variable de cadena única (scFv) o el anticuerpo de dominio único, están surgiendo como agentes terapéuticos alternativos (93) (Figura 2).
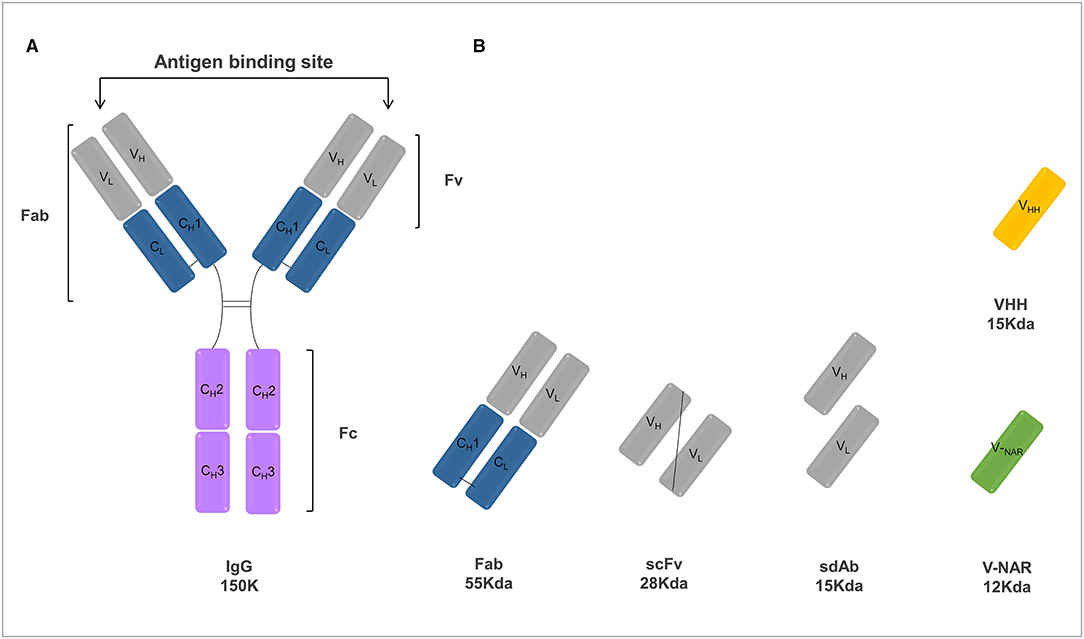 FIGURA 2. Representación esquemática de varios formatos de anticuerpos incluyendo un anticuerpo IgG convencional (A) y fragmentos de anticuerpos (B) de interés. (A) La unidad básica de un anticuerpo IgG convencional es un polipéptido que consiste en un par de cadenas pesadas y ligeras idénticas unidas por enlaces disulfuro. Las cadenas ligeras se componen de un dominio constante (CL) y un dominio variable (VL), mientras que las cadenas pesadas se componen de tres dominios constantes (CH1, CH2 y CH3) y un dominio variable (VH). El sitio de unión al antígeno está compuesto por los dominios variables de las cadenas pesada y ligera. A su vez, la región constante Fc es responsable del reclutamiento de las funciones efectoras del sistema inmune. (B) Los fragmentos de anticuerpos que pueden diseñarse a partir de una IgG convencional incluyen: fragmento de unión al antígeno (Fab), fragmento Fv de cadena simple (scFv), anticuerpos de dominio único pesados y ligeros (sdAbs) y dominio variable de camélidos naturales (VHH) y dominios variables de tiburón (V-NAR).
FIGURA 2. Representación esquemática de varios formatos de anticuerpos incluyendo un anticuerpo IgG convencional (A) y fragmentos de anticuerpos (B) de interés. (A) La unidad básica de un anticuerpo IgG convencional es un polipéptido que consiste en un par de cadenas pesadas y ligeras idénticas unidas por enlaces disulfuro. Las cadenas ligeras se componen de un dominio constante (CL) y un dominio variable (VL), mientras que las cadenas pesadas se componen de tres dominios constantes (CH1, CH2 y CH3) y un dominio variable (VH). El sitio de unión al antígeno está compuesto por los dominios variables de las cadenas pesada y ligera. A su vez, la región constante Fc es responsable del reclutamiento de las funciones efectoras del sistema inmune. (B) Los fragmentos de anticuerpos que pueden diseñarse a partir de una IgG convencional incluyen: fragmento de unión al antígeno (Fab), fragmento Fv de cadena simple (scFv), anticuerpos de dominio único pesados y ligeros (sdAbs) y dominio variable de camélidos naturales (VHH) y dominios variables de tiburón (V-NAR).
Los MAbs son el método de inmunoterapia contra el cáncer más utilizado y aprobado en la práctica clínica (94). El uso de un anticuerpo dirigido al antígeno de superficie humano CD20 (Rituximab®), expresado en linfocitos B, ha revolucionado el tratamiento del linfoma de células B (51, 52). El rituximab es un anticuerpo quimérico y fue el primer mAb aprobado por la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) para el tratamiento del cáncer humano, y se utiliza para el tratamiento de la mayoría de los LNH de células B y subtipos de leucemia linfocítica aguda (95–97). Esta inmunoterapia proporcionó mejoras significativas en la eficacia del tratamiento frente a las terapias existentes sin mAb, aumentando la tasa de remisiones duraderas del 30 al 60% (51).
A pesar de que la inmunoterapia tiene un papel crucial en el tratamiento de las neoplasias malignas de células B en humanos, su papel en el linfoma canino sigue siendo limitado. La inmunohistoquímica utilizando mAbs que reconocen los dominios intracelulares CD20 demostró la presencia de CD20 en muestras de tejido de linfoma canino (98, 99). Sin embargo, Rituximab® y otros anticuerpos antihumanos y antiratones que reconocen los dominios extracelulares CD20, no lograron unirse al CD20 canino, a pesar de que los epítopos reportados se conservan entre CD20 humano y canino (100). Por esa razón, es evidente que la tecnología para especificar anticuerpos es esencial cuando se desarrollan estrategias similares de inmunoterapia pasiva para pacientes con cáncer canino.
Curiosamente, en 1992, antes de la aprobación de la FDA de Rituximab, el Departamento de Agricultura de los Estados Unidos (USDA) aprobó la licencia de mAb 231 para su uso en cNHL. mAb 231 consiste en un mAb derivado de murina que mostró actividad in vitro (64) e in vivo y sirvió como terapia adyuvante después de la inducción de remisión con quimioterapia (65, 66, 81). Desafortunadamente, los ensayos clínicos posteriores no pudieron confirmar los resultados iniciales del estudio y el epítopo de anticuerpos nunca fue identificado, lo que culminó en su suspensión comercial (65).
Desde entonces, impulsados por el gran potencial del modelo de linfoma canino para los enfoques inmunoterapéuticos, los grupos de investigación académica y la industria comenzaron a explotar el enfoque de doble beneficio de la medicina comparada.
Uno de los primeros ejemplos fue un estudio piloto que tuvo como objetivo evaluar la idoneidad del modelo de linfoma canino para evaluar los criterios de valoración con relevancia clínica del tratamiento anti-HLA-DR mAb antes de proceder a un ensayo extenso en perros de compañía y, finalmente, a la investigación en humanos. Los estudios in vitro revelaron que L243, una IgG1 murina anti-HLA-DR, se une a los linfocitos sanos caninos y a las células del linfoma, induciendo la apoptosis en las células del LNHc. A su vez, los estudios in vivo confirmaron la seguridad del tratamiento con L243 en perros sanos y perros con linfoma y su actividad de unión a las muestras de ganglios linfáticos afectados por el linfoma. Los datos preliminares también mostraron que un subconjunto de pacientes con linfoma avanzado logró la estabilización transitoria de la enfermedad después del tratamiento con L243 (67). Además, este trabajo también informó que hL243γ4P (IMMU-114), una IgG4 humanizada anti-HLA-DR, en evaluación preclínica para ensayos en humanos, también se unió a células cNHL. Finalmente, la evaluación del tratamiento con IMMU-114 en pacientes caninos sanos indicó un perfil de seguridad y farmacocinética similar al de L243. En general, estos hallazgos apoyaron el uso de cNHL en estudios de seguridad y eficacia de mAbs anti-HLA-DR tanto para medicina veterinaria como humana (67).
Los avances en la tecnología de especiación también han llevado a varios ensayos clínicos en perros de compañía, ya que la «caninización» de anticuerpos es crucial cuando se aborda a pacientes caninos con cáncer. Con esto en mente, los grupos de investigación se centraron en la técnica para generar anticuerpos caninizados, lo que resultó en el desarrollo de un anti-EGFR canino (receptor del factor de crecimiento epidérmico) mAbs (101) y que hoy en día también se ofrece como un servicio de empresas (Creative Biolabs).
Teniendo en cuenta el éxito alcanzado con Rituximab en medicina humana, varios estudios también se centraron en el desarrollo de anticuerpos caninos anti-CD20. Se desarrolló un CD20 mAb anticanino (6C8) que reconoció el dominio extracelular del CD20 canino y mostró una unión de alta afinidad al CD20 canino en solución y su conformación nativa en las células B caninas. Este mAb promovió la fagocitosis de las células del linfoma de células B por macrófagos, pero en su marco actual no indujo citotoxicidad directa ni CDC (51). En el mismo año, Rue et al. informaron el desarrollo de un anticuerpo CD20 anticanino (1E4) y la generación de una molécula quimérica canina para uso terapéutico. Este clon se unió a un dominio extracelular similar al rituximab, y el análisis de citometría de flujo confirmó que las versiones quiméricas basadas en 1E4 fueron capaces de teñir las células B caninas y el CD16a canino, un receptor que media las respuestas ADCC. Además, el mejor candidato quimérico de mAb agotó el número de células B circulantes en beagles sanos en un estudio in vivo. Sin embargo, la eficacia clínica en perros con linfoma de células B caninas sigue siendo desconocida (68). Asimismo, se ha desarrollado un nuevo anti-CD20 mAb (NCD1.2) que une tanto CD20 humano como canino, con el fin de fortalecer el modelo comparativo humano-canino. NCD1.2 unido a células caninas clínicamente derivadas, incluidas las células B en sangre periférica y en diferentes tipos histológicos de linfoma de células B. Los genes de cadena pesada y de cadena ligera de los hibridomas NCD1.2 se clonaron y empaquetaron como scFv en una biblioteca de visualización de fagos. Se identificaron y seleccionaron scFv anti-CD20 recombinantes como una posible herramienta útil para la evaluación en inmunoterapias anti-CD20 dirigidas a bioconjugados en medicina comparativa (69). Aunque estos trabajos establecieron varios candidatos caninos anti-CD20 mAbs con alto potencial para uso terapéutico, su eficacia clínica en perros portadores de linfoma de células B sigue siendo desconocida.
Un anti-CD20 mAb canino (AT-004) ha sido totalmente aprobado por el USDA para uso clínico en perros con linfoma de células B y actualmente se está comercializando en los Estados Unidos y Canadá. El tratamiento con AT-004 (Aratana Therapeutics), un CD20 anticanino se sometió a un ensayo clínico aleatorizado prospectivo y los resultados preliminares sugirieron una mejor mediana de supervivencia libre de progresión de los perros con linfoma de células B (102). Sin embargo, estos resultados se publicaron en un resumen de la conferencia y aún faltan resultados revisados por pares. Otro trabajo evaluó la combinación del bloqueo de CD47 con 1E4-cIgGB, un anticuerpo canino específico contra CD20. Aunque 1E4-cIgGB podría provocar una respuesta terapéutica in vivo contra el linfoma canino como agente único, se observaron respuestas superiores cuando se combinaron con agentes dirigidos a CD47, un punto de control inmunitario que permite la evasión de las células tumorales a la fagocitosis promovida por anticuerpos terapéuticos, como los mAbs anti-CD20. La combinación de terapias bloqueadoras de CD47 con 1E4-cIgGB dio lugar a efectos antitumorales sinérgicos in vitro e in vivo, provocando curas en el 100% de los ratones portadores de linfoma canino (45). Sin embargo, actualmente no existe un tratamiento con anticuerpos anti-CD20 para el LNHc disponible. Más recientemente, un enfoque novedoso de desarrollo de un anticuerpo monoclonal CD20 anticanino utilizando ratas como especie huésped renovó las esperanzas de obtener finalmente una terapia basada en anticuerpos para el LNHc. Este trabajo culminó en la generación de un mAb capaz de inducir la muerte celular de líneas celulares de linfoma de células B, sin embargo, este mAb fue incapaz de provocar respuestas CDC y ADCC. Para abordar estas limitaciones, este anticuerpo se modificó en una quimérica anti-CD20 canina / rata, lo que resultó en la alteración de sus características en un potente inductor CDC y ADCC. Además, su desfucosilación resultó en una actividad ADCC 10 veces mayor. Se evaluó la actividad antitumoral in vivo de esta versión mejorada de mAb, revelando una inhibición del crecimiento tumoral en un modelo de ratón xenoinjerto cNHL y una depleción periférica de células B en beagles sanos (70). Finalmente, AT-005 (Aratana Therapeutics), un mAb caninizado dirigido a CD52 en células T, ha obtenido la aprobación condicional del USDA para el tratamiento del linfoma de células T y actualmente se está evaluando en ensayos clínicos (62).
El éxito de mAbs en medicina humana alienta fuertemente a la medicina veterinaria a desarrollar terapias similares para nuestras mascotas. Independientemente de su potencial, se han establecido mAbs poco específicos para su aplicación veterinaria y se investigaron menos en ensayos clínicos que inscribieron animales de compañía. No obstante, la aprobación del primer mAb por parte de la Agencia de la Unión Europea para el tratamiento de la dermatitis atópica en perros, Lokivetmat, un mAb anticanino caninizado IL-31 (103), destacó el impacto que las terapias biológicas pueden tener en la práctica veterinaria. En el ámbito oncológico, los mAbs tienen la capacidad de tratar una diversidad de neoplasias hematológicas y sólidas, no necesitan ser un producto personalizado y los métodos de fabricación están bien establecidos, minimizando la limitación de costos asociada. Por lo tanto, la terapia basada en mAb es una de las estrategias de inmunoterapia más prometedoras en entornos veterinarios (63).
Transferencia adoptiva de células T
La terapia celular adoptiva es un término que se utilizó por primera vez para describir la infusión de linfocitos para mediar el rechazo de los aloinjertos de órganos y para tratar tumores (104). Esta opción inmunoterapéutica representa el tratamiento más eficaz para los pacientes con melanoma metastásico que induce la regresión visible del cáncer en ~ 50% de los pacientes. La terapia celular adoptiva también se asocia con una mejoría clínica en pacientes seleccionados con enfermedades linfoproliferativas postrasplante causadas por la infección por el virus de Epstein-Barr (105). Más recientemente, las técnicas de transferencia de genes desarrolladas en la década de 1990 permitieron convertir linfocitos normales en linfocitos con actividad anticancerígena al redirigir la especificidad de las células T con el uso de receptores de células T o receptores de antígenos quiméricos (CAR). Los CAR son receptores diseñados que injertan una especificidad definida en una célula efectora inmune, típicamente una célula T, lo que resulta en el aumento de la función de las células T (104). Esta innovación representó una posibilidad de extender la inmunoterapia celular adoptiva a pacientes con una gran diversidad de tipos de cáncer (105). En los seres humanos, el tratamiento de la leucemia avanzada de células B o el linfoma utilizando células T con CAR ha demostrado respuestas clínicas prometedoras, lo que resulta en la aprobación de dos terapias autólogas de células T con CAR (Kymriah™ y Yescarta™) por la FDA (106, 107). Estas terapias son células T autólogas modificadas genéticamente que expresan un CAR específico para CD19, lisando objetivos CD19 positivos (107).
Al mostrar una respuesta inmune intacta y similitudes genéticas con los humanos, los perros pueden informar potencialmente el desarrollo de las etapas posteriores de los ensayos clínicos en humanos, mientras estudian el uso de la terapia celular adoptiva en neoplasias malignas veterinarias, incluidas las neoplasias hematológicas (71, 72). De hecho, hay evidencia de que el cáncer canino, y específicamente el LNHc, responden a la inmunoterapia basada en células. Hace medio siglo, el Centro de Cáncer Fred Hutchinson estableció el trasplante de células hematopoyéticas para el linfoma canino (108). Al principio, el valor terapéutico de esta práctica se asoció únicamente con la administración de altas dosis de quimioterapia y radiación antes del trasplante. Sin embargo, un estudio retrospectivo más amplio confirmó que, a pesar del uso de los mismos protocolos de quimioterapia y radiación, los perros que recibieron un trasplante alogénico de un compañero de camada exhibieron una tasa de recaída significativamente menor, en contraste con los perros que recibieron sus propias células madre de médula ósea (autólogas). Este efecto se conoció más tarde como el «efecto injerto vs. leucemia / tumor» y es promovido principalmente por las células T alogénicas activadas que reconocen y reaccionan a las diferencias de antígeno y, por lo tanto, también atacan las células tumorales residuales (109).
Desde entonces, pocos estudios se han centrado en la investigación científica y clínica de inmunoterapias basadas en células para pacientes caninos. O’Connor et al. realizaron un ensayo clínico para probar células T autólogas no específicas aisladas de perros con LNH y expandidas ex vivo utilizando un nuevo protocolo de células presentadoras de antígeno artificial (71, 72). Las células infundidas se detectaron en la sangre durante más de 49 días y se traficaron a órganos linfoides secundarios, lo que confirma la seguridad de la transferencia adoptiva de células T autólogas en perros. Además, esta inmunoterapia adoptiva demostró ser viable y efectiva para mejorar la primera remisión y los períodos de supervivencia general en perros con linfoma multicéntrico (71, 72).
En particular, han surgido algunas compañías de biotecnología en el área de la terapia autóloga basada en células T para medicina veterinaria. Un ejemplo es Aurelius BioTherapeutics que proporciona un servicio que expande durante 2-3 semanas los linfocitos autólogos recolectados de perros con linfoma canino, con el fin de aumentar exponencialmente el número de células T y activarlas para que respondan a los antígenos presentados por las células tumorales antes de la reinfusión. Sin embargo, los métodos utilizados para la activación y expansión de las células inmunes del perro y el beneficio clínico de esta terapia no se revelan. A su vez, Elias Animal Health incluyó un procedimiento de vacunación antes de la recolección de células, con el objetivo de mejorar la especificidad de las células cancerosas de su terapia autóloga de células T. La vacuna se obtiene del material tumoral extirpado y se administra por vía intradérmica. Además, se puede administrar un breve ciclo de quimioterapia antes de la infusión, que ha demostrado dar lugar a una mejor aceptación de la terapia con linfocitos en humanos. Los resultados preliminares revelaron que la supervivencia general puede prolongarse con esta terapia adoptiva basada en células, lo que indica que esta inmunoterapia provoca un efecto similar a la vacuna antitumoral que prolonga la vida de los pacientes caninos, incluso cuando la enfermedad no está completamente erradicada. El holding está buscando la aprobación regulatoria, lo que lo calificaría como la primera terapia celular aprobada y comercializada para perros (106).
Más recientemente, los investigadores han comenzado a explorar la terapia celular con receptores de antígenos quiméricos T (CAR-T) para perros (Figura 3). La ingeniería de CARs consiste en modificar las células T para expresar receptores artificiales formados por un scFv específico de antígeno tumoral unido a un dominio de señalización intracelular y moléculas coestimuladoras. Debido a que los CAR funcionan de manera independiente del MHC, la presentación del antígeno no depende de las células presentadoras de antígenos del paciente. Además, los CAR no tienen que ser singénicos para el sistema inmunitario del paciente (63). Se han producido células T caninas que expresan un CAR específico para HER2 (receptor 2 del factor de crecimiento epidérmico humano) y mostraron actividad antitumoral in vitro contra células de osteosarcoma canino que expresan HER2 (110). Este trabajo demostró que es posible una expansión ex vivo exitosa de linfocitos T específicos de HER2-CAR. Sin embargo, ningún paciente canino ha sido tratado. Los estudios en curso tienen como objetivo desarrollar células CAR-T caninas para el tratamiento de linfomas de células B y otras neoplasias malignas (63). Es importante destacar que se han reportado protocolos para la propagación de células CAR-T CD20 (73, 111). Los investigadores transfectaron el CD20 CAR en las células T expandidas utilizando la electroporación del ARNm de CAR. Desafortunadamente, a pesar de que esta estrategia permite evitar el uso de retro o lentivirus, la transfección de ARNm da como resultado una eficiencia variable y una actividad transcripcional transitoria que cesa después de 24 a 48 h. Se informó el tratamiento de un perro diagnosticado con linfoma con estas células T transfectadas, sin embargo, solo presentó una respuesta parcial a corto plazo (73, 106). Esta respuesta clínica limitada puede deberse a la incapacidad de estas células transfectadas para expandirse in vivo, considerando que los estudios en humanos demostraron que la expansión in vivo es un requisito para respuestas duraderas. Además, este protocolo de tratamiento no incluyó sesiones de quimioterapia antes de la infusión de células CAR-T, una práctica común utilizada en el tratamiento humano para agotar las células inmunes inhibitorias que ha demostrado potenciar la eficacia clínica. En el caso de los perros, la adición de este procedimiento también podría minimizar el riesgo de desencadenar una respuesta inmune de anticuerpos caninos anti-ratón, considerando que la mayoría de los scFvs derivan de mAbs murinos, aumentando así el riesgo de una respuesta inmune de células T anti-CAR. Para concluir, los datos reportados demostraron la viabilidad de generar células CAR-T caninas, sin embargo, se espera que la logística y los gastos necesarios sean considerables.
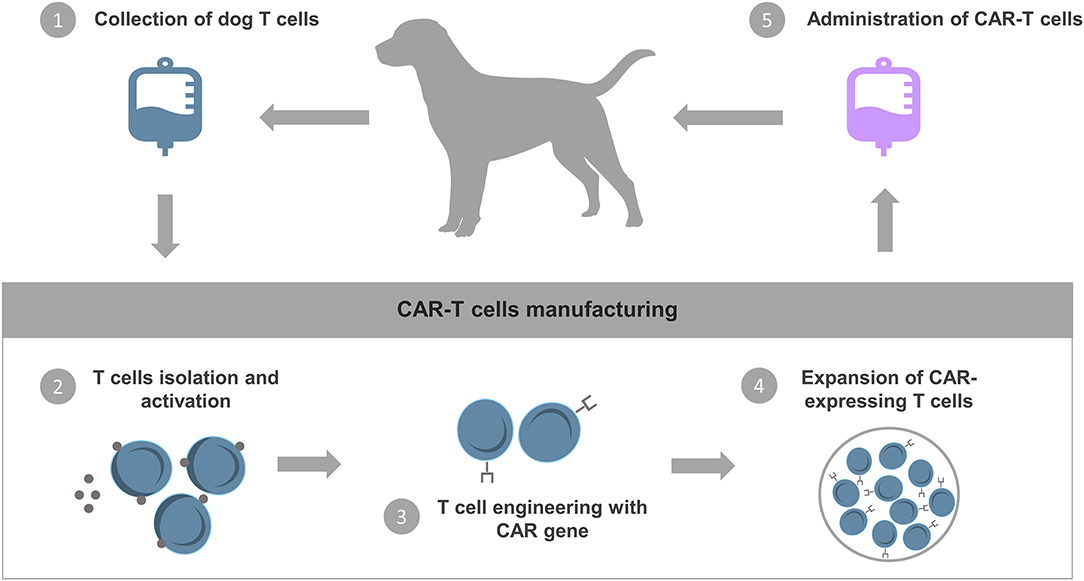 FIGURA 3. Terapia con células CAR-T. Los procedimientos básicos para la terapia de células CAR-T comienzan con la recolección y extracción de células T de la sangre periférica de la mascota. Las células T se modifican genéticamente in vitro para expresar receptores de antígenos quiméricos (CAR) que pueden reconocer antígenos específicos asociados al tumor y activar la autoproliferación y la citotoxicidad. Finalmente, las células CAR-T se expanden y se reinfunden en el paciente.
FIGURA 3. Terapia con células CAR-T. Los procedimientos básicos para la terapia de células CAR-T comienzan con la recolección y extracción de células T de la sangre periférica de la mascota. Las células T se modifican genéticamente in vitro para expresar receptores de antígenos quiméricos (CAR) que pueden reconocer antígenos específicos asociados al tumor y activar la autoproliferación y la citotoxicidad. Finalmente, las células CAR-T se expanden y se reinfunden en el paciente.
Viroterapia Oncolítica
La viroterapia oncolítica es un nuevo concepto de inmunoterapia introducido recientemente que implica el virus competente en la replicación en la eliminación del cáncer. Al infectar las células tumorales, la viroterapia oncolítica puede estimular de novo o mejorar la respuesta inmune nativa preexistente. La mayoría de los virus oncolíticos desarrollados están alterados genéticamente para promover el tropismo tumoral y reducir la virulencia contra las células huésped sanas. De este modo, la viroterapia oncolítica tiene la capacidad de promover un ambiente proinflamatorio al mejorar la liberación / reconocimiento de antígenos y promover la activación inmune, al tiempo que revierte la inmunosupresión de las células tumorales y mejora la eficacia de otras formas de inmunoterapia (112, 113). Aunque se están desarrollando varias viroterapias oncolíticas en entornos preclínicos y clínicos, actualmente la única terapia viral oncolítica aprobada por la FDA es talimogene laherparepvec (T-Vec o Imlygic) para el melanoma avanzado (114). En medicina veterinaria, varios estudios evaluaron virus oncolíticos naturales y modificados genéticamente para perros diagnosticados con cáncer, mostrando algunos resultados alentadores. Sin embargo, la mayoría de los trabajos de investigación desarrollados se centraron en los resultados in vitro, con algunos informes de estudios in vivo, de los cuales la mayoría fueron informes de casos clínicos aislados (115).
Con respecto al LNHc, un estudio informó que una cepa recombinante del virus del moquillo canino (CDV), pCDVeGFPΔN, fue capaz de infectar líneas celulares de LNH cin vitro, induciendo una muerte celular apoptótica significativa. La cepa pCDVeGFPΔN también infectó eficientemente las células primarias de linfoma canino B y T, aunque no se demostró su eficacia oncolítica (74). Otro trabajo evaluó el efecto antitumoral de la infección por CDV utilizando una cepa atenuada en siete perros con linfoma natural. Para este propósito, se inyectaron dosis únicas o múltiples del virus intratumoralmente. Este estudio informó baja toxicidad con una reacción fibrótica grave en el lugar de la inyección. El análisis inmunohistoquímico reveló una detección positiva variable del antígeno CDV en los ganglios linfáticos tratados, mientras que el cocultivo permitió el aislamiento del virus de los ganglios linfáticos tratados, pero no de los ganglios distantes o de las células mononucleares de sangre periférica (PBMC). Además, este tratamiento promovió una fuerte respuesta de anticuerpos anti-CDV (75). Sin embargo, uno de los principales inconvenientes de esta inmunoterapia es que el CDV pertenece al calendario regular de vacunación en perros y los anticuerpos preexistentes pueden limitar su eficacia (116). Otro grupo exploró las propiedades oncolíticas de una cepa vacunal del virus de la enfermedad de Newcastle, una cepa lentogénica atenuada que presenta baja virulencia, en una línea celular de linfoma de células B grandes humanas y en células de linfoma de células B caninas primarias. El grupo utilizó como controles PBMC saludables de humanos y perros. La infección por el virus de la enfermedad de Newcastle disminuyó la viabilidad celular en las células de linfoma humano y de perro en comparación con los controles no tratados, con un tropismo mínimo hacia las PBMC sanas. En el mismo trabajo, los autores informaron la biodistribución viral en un paciente canino diagnosticado con linfoma de células T, 24 h después de la inyección intravenosa del virus. La inmunohistoquímica y la PCR de criterio de valoración demostraron diseminación viral en la glándula salival, riñón, estómago y pulmón, pero no en muestras tumorales, sin hallazgos anormales en la evaluación histopatológica (76). Curiosamente, se reportó una respuesta clínica completa y a largo plazo en un perro diagnosticado con linfoma resistente a la quimioterapia (76, 77). Aunque estos datos preliminares revelaron que el virus de la enfermedad de Newcastle podría representar una viroterapia oncolítica prometedora, se requieren estudios futuros para determinar el mejor régimen terapéutico y definir el protocolo de seguridad adecuado (117).
Una de las viroterapias oncolíticas que más interés ha despertado entre la comunidad científica, debido a los prometedores resultados obtenidos en múltiples ensayos clínicos de fase I y II, es la cepa dearing de Reovirus (Reolysin®, de OncolyticsTM Biotech Inc., Calgary, AB, Canadá) (118). En perros, Reolysin® mostró resultados prometedores in vitro para el tratamiento de una variedad de neoplasias malignas, como mastocitosima, linfoma, tumores de la glándula mamaria y melanoma. De hecho, los estudios in vitro mostraron inducción de apoptosis y una reducción significativa de la viabilidad celular en el linfoma de células T y B. Además, un modelo de xenoinjerto de ratón de linfoma de células T caninas tratado mediante inyección intratumoral reveló una inhibición significativa del crecimiento tumoral, en comparación con el grupo control tratado con reovirus inactivado por ultravioleta (78). En particular, el perfil de seguridad de Reolysin® se demostró en un ensayo clínico que inscribió a perros con cáncer avanzado, incluyendo mastocitosoma, linfoma, melanoma oral y sarcoma de tejidos blandos. En este trabajo, los perros recibieron viroterapia por inyección intratumoral o inyección intravenosa diariamente durante 5 días, durante uno o varios ciclos de tratamiento. El virus vivo solo se detectó en el suero de un perro en el primer ciclo de quimioterapia, pero no en los ciclos de tratamiento posteriores. Mientras que todos los perros exhibieron un aumento en el título de anticuerpos neutralizantes anti-reovirus, se observó reducción del volumen tumoral en cinco perros y seis perros presentaron alivio de las manifestaciones clínicas. Además, un subconjunto de perros reveló un buen perfil de seguridad, así como una respuesta clínica. Teniendo en cuenta la experiencia acumulada en medicina humana, la combinación de esta inmunoterapia con terapias convencionales como quimioterapia, radioterapia u otras podría investigarse en perros (79).
En general, estos estudios proporcionan resultados preliminares que apoyan el desarrollo de la viroterapia oncolítica como terapia contra el cáncer canino para beneficiar a las mascotas y los dueños de mascotas (115).
Inmunomoduladores
La terapia con citoquinas tiene como objetivo mejorar las respuestas inmunes y el control tumoral en una variedad de enfermedades oncológicas espontáneas. En medicina humana, se ha obtenido un éxito modesto con una terapia de IL-2 de dosis baja administrada por vía subcutánea, con pocos efectos secundarios (119-124). Además, la terapia subcutánea GM-CSF (factor estimulante de colonias de granulocitos y macrófagos) aumenta las respuestas inmunes mediadas por células y mejora la eficacia de las vacunas antiidiotipo en el linfoma humano (125). En pacientes caninos, la IL-2 administrada por vía subcutánea, intralesional, por inhalación y a través de complejos liposoma-ADN que codifican el gen IL-2, como monoterapia o en combinación con otras modalidades, promovió la regresión en perros con melanoma oral, sarcoma de tejidos blandos, carcinoma de células escamosas y metástasis pulmonares de osteosarcoma (126–131). Del mismo modo, en perros con melanoma oral, la terapia combinada que incluye GM-CSF administrado intralesionalmente, ya sea a través de complejos liposoma-ADN o a través de GM-CSF secretando células xenogénicas transgénicas, resultó en regresión (126, 132). A través del Consorcio de Ensayos Oncológicos Comparativos, se realizó un estudio de Fase I de seguridad/escalada de dosis de IL12 humana administrada por vía subcutánea a perros con melanoma. Los datos recopilados de este estudio y otros datos preclínicos permitieron informar el diseño de un ensayo clínico de fase I de IL12 en pacientes con cáncer humano (133).
Un estudio de fase I que incluyó a 15 perros con linfoma de células B probó una terapia con una combinación de microperlas recubiertas de antígeno tumoral autólogo (inmunógeno multivalente grande, LMI) con terapia de citoquinas que incluye IL-2 y GM-CSF, después de la inducción de la remisión con quimioterapia convencional. Los resultados no demostraron toxicidad significativa, ni efectos adversos en el intervalo libre de enfermedad y la mitad de los animales presentaron reacciones cuantificables de hipersensibilidad de tipo retardado a la LMI intradérmica, lo que sugiere una respuesta inmune específica mediada por células (80).
Aunque estos estudios muestran que las citoquinas humanas se pueden usar de manera efectiva en perros, las dosis más altas a menudo necesarias y la inmunogenicidad que generan, limitan su uso. No obstante, el desarrollo de IL-15 canina ha llevado a un renovado interés en la terapia con citoquinas como estrategia de inmunoterapia para entornos veterinarios (134).
Vacunas
Las vacunas terapéuticas representan una estrategia de inmunoterapia contra el cáncer viable y atractiva que tiene como objetivo tratar la enfermedad en etapa tardía estimulando el propio sistema inmunitario del paciente contra las células cancerosas (135).
Se han hecho varios intentos de usar vacunas como tratamiento para el LNHc. En los estudios iniciales, el adyuvante de Freund se agregó a los lisados de extractos de células de linfoma y se usó como una estrategia de vacuna contra el cáncer. A pesar de que estos primeros estudios informaron algún beneficio del tratamiento (136), esto se atribuyó más tarde al uso del adyuvante de Freund (137).
Más tarde, Jeglum et al. describieron el uso de una vacuna tumoral autóloga administrada mediante inyección intralinfática después de la inducción de la remisión con quimioterapia. Sin embargo, los resultados que utilizan esta estrategia han sido contradictorios (81-83).
En un ensayo clínico, se administraron células B autólogas activadas por CD40 cargadas con ARN total de células de linfoma autólogo a 19 perros con LNH como adyuvante, después de la inducción de una respuesta completa con quimioterapia. La vacunación promovió una respuesta antitumoral y aumentó una tasa de segunda remisión duradera, sin embargo, la mediana del tiempo hasta la progresión de la enfermedad y la supervivencia general no mostraron diferencias entre los grupos (84).
Además, se informa de un nuevo enfoque dirigido a la transcriptasa inversa de la telomerasa canina utilizando una vacuna genética, Tel-eVax. Como la telomerasa confiere inmortalidad a las células, la telomerasa con transcriptasa inversa se sobreexpresa en líneas celulares cancerosas y en varios tumores y es indetectable en la mayoría de los tejidos normales, estableciendo un posible objetivo para la inmunoterapia traslacional contra el cáncer. Una vacuna de ADN dirigida a la transcriptasa inversa de la telomerasa canina fue capaz de provocar una respuesta inmune contra la telomerasa en perros diagnosticados con linfoma multicéntrico, y la quimioterapia convencional parece no alterar los efectos de la inmunoterapia (85). La combinación de esta vacuna con quimioterapia utilizando el protocolo de ciclofosfamida, vincristina y prednisolona dio como resultado una respuesta inmune duradera, así como una supervivencia prolongada en perros con linfoma de células B (86). En otro estudio clínico que incluyó 17 perros, Tel-eVax en asociación con la quimioterapia CHOP demostró ser seguro e inmunogénico y presentó un impacto significativo en la supervivencia de los pacientes caninos con DLBCL. La respuesta de anticuerpos inducida por Tel-eVax contra la proteína de la transcriptasa inversa de la telomerasa (TERT) también se evaluó considerando el potencial que estos anticuerpos anti-TERT pueden poseer como biomarcadores sustitutos de la respuesta inmune en perros vacunados. Curiosamente, la mayoría de los perros desarrollaron una seroconversión baja pero detectable contra el N-terminal de la proteína TERT (87).
Más recientemente, actualmente está disponible una vacuna autóloga APAVAC®, compuesta de polvo cerámico de hidroxiapatita con proteínas autólogas de choque térmico (HSP) purificadas de la biopsia de ganglios linfáticos afectados (88). Las HSP resultantes de las células tumorales, incluyendo gp96, hsp90, hsp70, calreticulina, hsp110 y hsp170, presentan una fuerte inmunogenicidad. Además, la función chaperona de las HSP permite su combinación con péptidos específicos tumorales inmunogénicos (HSPPC), exponiendo al huésped a un gran repertorio de antígenos asociados al tumor para la inmunización. Además, los vehículos de hidroxiapatita y las HSPPC funcionan como un adyuvante. Para reproducir la heterogeneidad tumoral, se produce cada vacuna para cada perro. El protocolo de vacunación consiste en cuatro administraciones dentro de las 4 semanas, seguidas de una inyección al mes durante 4 meses en combinación con quimioterapia de dosis intensa. En una fase inicial, los resultados preliminares mostraron que la administración de esta vacuna autóloga es efectiva para prolongar la supervivencia global y el tiempo de progresión en perros con DLBCL y neoplasia multicéntrica indolente de células B, sin aumentar la toxicidad del tratamiento (88, 89). A continuación, para caracterizar mejor la seguridad y eficacia de APAVAC®, y para encontrar los mejores candidatos para la inmunoterapia, se realizó un estudio retrospectivo más amplio, que incluyó a todos los perros tratados con quimioinmunoterapia hasta la fecha. En general, en comparación con los perros tratados solo con quimioterapia, los perros que recibieron el protocolo de quimioinmunoterapia sobrevivieron significativamente más tiempo, independientemente del histotipo y los factores pronósticos evaluados. El estudio también confirmó la excelente tolerabilidad de la vacuna en perros diagnosticados con linfomas de células B (90). Desafortunadamente, hasta ahora no hay información sobre la respuesta al tratamiento de quimioinmunoterapia en perros con linfoma de células T.
En conjunto, estos trabajos demuestran claramente el potencial del modelo cNHL para avanzar en la investigación de estrategias de vacunas contra el cáncer para tratar el linfoma tanto en humanos como en perros.
Bloqueo del punto de control inmunitario
Los inhibidores del punto de control inmunitario, como los dirigidos a CTLA-4 y al eje PD-1 (muerte programada 1)/PD-L1 (ligando 1 de la EP), han demostrado un efecto clínico duradero y sin precedentes en una amplia gama de neoplasias malignas y están transformando rápidamente la práctica de la oncología médica en humanos (138).
Las células tumorales pueden evadir con éxito la inmunovigilancia y progresar a través de diferentes mecanismos, incluida la activación de las vías de control inmunitario que dificultan las respuestas inmunitarias antitumorales. Al interrumpir las vías de señalización coinhibitorias, los inhibidores del punto de control inmunitario restablecen las respuestas inmunitarias antitumorales y promueven la eliminación mediada por el sistema inmunitario de las células malignas (139). Las neoplasias malignas hematológicas, como el linfoma, son objetivos probables para este tipo de tratamiento. Se han realizado varios ensayos clínicos de bloqueo del punto de control en neoplasias hematológicas, con resultados preliminares prometedores, lo que sugiere el beneficio terapéutico de este enfoque. Estos resultados fueron especialmente prometedores con respecto al bloqueo de PD-1 en el linfoma de Hodgkin (140). Hasta la fecha, actualmente hay siete inhibidores de puntos de control inmunitario aprobados para el tratamiento de varios tipos de cáncer en medicina humana.
Aún no se han realizado ensayos clínicos con inhibidores de puntos de control para el tratamiento del LNHc. Sin embargo, la expresión de PD-L1 canina se ha reportado en una variedad de tipos de tumores caninos, incluyendo mastocitosoma, melanoma y carcinoma de células renales (141). Un estudio preliminar sugiere que el anti-PD-L1 podría desempeñar un papel importante en el tratamiento de perros con tumores que expresan PD-L1, al demostrar que el tratamiento de los linfocitos infiltrantes de tumores caninos con esta molécula mejoró la producción de interferón-γ (141). Recientemente se informó que PD-L1 está elevado en los linfomas de células B caninas en comparación con las células B normales. Las células tumorales de células T cNHL y pacientes caninos sanos mostraron una expresión baja a negativa de PD-1 y PD-L1. Además, los linfocitos infiltrantes tumorales de células de linfoma de células B y células T presentaron una mayor expresión de la expresión de PD-1 y PD-L1 en comparación con las células B y T de los ganglios linfáticos de animales sanos. In vitro, las líneas celulares de linfoma de células B y células T caninas resistentes a la quimioterapia exhibieron aumentos en la expresión de PD-1 y PD-L1, en comparación con las células tumorales seleccionadas sin quimioterapia (142). En línea con esto, se generó un panel de 5 mAbs PD-1 / PD-L1 caninos que se están estudiando para determinar la actividad in vitro en ensayos de células T (143). Además, los efectos inmunomoduladores de c4G12, un mAb anti-PD-L1 quimerizado canino, se evaluaron in vitro, demostrando una producción de citoquinas significativamente mejorada y la proliferación de PBMC para perros. Luego, se realizó un estudio clínico piloto en siete perros con melanoma maligno oral y dos con sarcoma indiferenciado, revelando que este anticuerpo puede ser una opción de tratamiento segura y efectiva para los cánceres caninos (144).
Es importante destacar que también se ha descrito y clonado CTLA-4 canino (proteína 4 asociada a linfocitos T citotóxicos) (145). Un CTLA canino recombinante agonista se ha utilizado eficientemente para promover la tolerancia en un modelo de trasplante (146), lo que sugiere que el mecanismo de acción de CTLA-4 en perros es similar al de los humanos y que el bloqueo del punto de control CTLA-4 podría representar una nueva inmunoterapia para el cáncer canino. Es importante destacar que Tagawa et al. (147) demostraron una expresión de regulación positiva de CTLA-4 en células T CD4 + de sangre periférica obtenidas de perros con linfoma de alto grado de células B. La expresión de CTLA-4 en las células T también se asoció con un mal pronóstico.
Con el desarrollo de nuevos fármacos dirigidos a moléculas de punto de control para perros, surgen múltiples oportunidades en las que el modelo de perro puede proporcionar información clínica relevante, especialmente con respecto a la combinación racional de inmunoterapias, incluidos los inhibidores de puntos de control.
Discusión
El panorama actual de la investigación del cáncer se enfrenta a una profunda transformación con la introducción de la inmuno-oncología como el cuarto pilar para la terapia del cáncer. Las inmunoterapias no solo han dado lugar a respuestas clínicas sin precedentes, un rápido desarrollo de fármacos y varias aprobaciones de primera clase de la FDA en los últimos años, sino que el advenimiento de tales terapias innovadoras también está revolucionando los paradigmas y algoritmos de tratamiento en la práctica actual de oncología y hemato-oncología (148). Como resultado, la investigación clínica y traslacional debe adaptarse a un escenario que cambia rápidamente para traducir de manera efectiva los conceptos novedosos en opciones terapéuticas sostenibles y accesibles para los pacientes con cáncer (149). Las complejidades y desafíos de la nueva era de la inmunooncología enfatizan fuertemente la necesidad de identificar nuevas estrategias, modelos y caminos para desarrollar terapias rápidas, exitosas y rentables (13, 149). La inclusión de un modelo canino en la ruta de desarrollo de fármacos de inmunoterapias contra el cáncer está siendo ampliamente reconocida como una solución válida para superar varios obstáculos asociados con los modelos preclínicos convencionales (150). Los perros con tumores naturales son modelos altamente traslacionales que representan una oportunidad para investigar el potencial clínico de nuevas inmunoterapias de manera integral. Al complementar los estudios murinos y los ensayos clínicos en humanos, los perros permiten monitorear los efectos de «ampliación» de un enfoque terapéutico que depende de interacciones complejas entre las células tumorales e inmunes, al tiempo que evalúan la eficacia y la toxicidad a largo plazo (15). En conjunto, estas características pueden permitir el establecimiento de bases sólidas para traducir rápidamente los resultados obtenidos de los pacientes caninos al manejo del paciente humano, con beneficios para ambas especies (151).
Es importante destacar que los beneficios de estos estudios colaborativos pueden traducirse más fácilmente en éxito clínico en tecnologías emergentes, como los inhibidores de puntos de control inmunitario y la terapia con células T con CAR, donde el rápido ritmo de su aplicabilidad clínica está demostrando desafíos críticos. De hecho, queda mucho por entender sobre la selección de pacientes, la administración y los efectos fuera del objetivo de la inmunoterapia emergente utilizada sola o en combinación. Si bien los médicos han aprendido durante las últimas décadas a lidiar con las respuestas clínicas y las toxicidades relacionadas con el uso de anticuerpos en la terapia del cáncer, las terapias emergentes, como las mencionadas, son mucho menos familiares para los oncólogos. Por lo tanto, la investigación del cáncer necesita desarrollar mejores modelos clínicos predictivos para que estas inmunoterapias emergentes estén disponibles universalmente para aquellos pacientes con cáncer que necesitan intervención inmune además de otras terapias (152).
Sin embargo, la implementación de tales ensayos clínicos caninos está lejos de ser una búsqueda fácil. Se requieren múltiples esfuerzos organizados para validar el modelo canino, que aún carece de una caracterización exhaustiva del sistema inmune canino y sus células y moléculas efectoras, la evaluación de epítopos tumorales comunes, el desarrollo de agentes específicos caninos / reactivos cruzados y el establecimiento de modelos preclínicos para entornos oncológicos veterinarios (62, 153, 154). Además, esto también requiere que la comunidad científica veterinaria aúne fuerzas para implementar la optimización y estandarización del diagnóstico, la estadificación y la evaluación de la respuesta al tratamiento, para realizar ensayos clínicos grandes y organizados y para lograr la conformidad al analizar los datos (26).
Independientemente de los desafíos que pueda plantear la implementación de inmunoterapias para el linfoma cNHL, el tratamiento del cNHL se enfrenta a un cambio de paradigma. Con varias inmunoterapias nuevas emergentes, se espera que en un futuro cercano, la inmunoterapia se convierta en una herramienta terapéutica válida, junto con la quimioterapia, la radioterapia y la cirugía. Además, estos avances también proporcionan una plataforma integrada de descubrimiento de fármacos que maximiza la cooperación interdisciplinaria y aprovecha los puntos en común entre humanos y perros, para el desarrollo de nuevas inmunoterapias contra el LNH, beneficiando a ambas especies.
Contribuciones del autor
JD: escritura: preparación y visualización del borrador original. AA: visualización y escritura: revisión y edición. SA, SG, LT y FA-d-S: redacción, revisión y edición. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Financiación
Este trabajo fue apoyado por la Agencia Portuguesa de Financiamiento, Fundação para a Ciência e Tecnologia, FCT IP, [SAICT/2017/32085 y Ph.D. fellowship SFRH/BD/131468/2017 to AA]. CIISA ha brindado apoyo a través del Proyecto UIDB/CVT/00276/2020, financiado por FCT. Gilead Génese ha brindado apoyo a través del Proyecto PGG/050/2019.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Reconocimientos
Algunas figuras utilizaron imágenes modificadas de Servier Medical Art, licenciadas bajo una licencia Creative Common Attribution 3.0 Generic License. http://smart.servier.com/.
Abreviaturas
ADCC: citotoxicidad celular dependiente de anticuerpos; CAR: receptor de antígeno quimérico; CAR-T: linfocitos T receptores de antígenos quiméricos; CDC: citotoxicidad dependiente del complemento; CDV: virus del moquillo canino; CHOP, ciclofosfamida, doxorrubicina, vincristina y prednisolona; lNHL: linfoma canino; CTLA-4: proteína 4 asociada a linfocitos T citotóxicos; DLBCL: linfoma difuso de células B grandes; EGFR: receptor del factor de crecimiento epidérmico; FDA, Administración de Alimentos y Medicamentos de los Estados Unidos; GM-CSF: factor estimulante de colonias de granulocitos y macrófagos; HER2: receptor 2 del factor de crecimiento epidérmico humano; lNHL: linfoma no Hodgkin humano; HSP: proteínas de choque térmico; HSPPC: péptidos inmunogénicos específicos del tumor; LMI: inmunógeno multivalente grande; mAbs: anticuerpos monoclonales; LNH: linfoma no Hodgkin; PBMC: células mononucleares de sangre periférica; PD-1: muerte programada 1; PD-L1, ligando PD 1; scFv: fragmento variable de cadena única; TERT: telomerasa transcriptasa inversa; USDA, Departamento de Agricultura de los Estados Unidos.
Referencias
1. Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Estadísticas mundiales del cáncer 2018: estimaciones de incidencia y mortalidad en todo el mundo por 36 cánceres en 185 países. CA Cáncer J Clin. (2018) 68:394–424. DOI: 10.3322/CAAC.21492
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Fitzmaurice C, Allen C, Barber RM, Barregard L, Bhutta ZA, Brenner H, et al. Incidencia mundial, regional y nacional del cáncer, mortalidad, años de vida perdidos, años vividos con discapacidad y años de vida ajustados por discapacidad para 32 grupos de cáncer, 1990 a 2015: un análisis sistemático para el estudio de la carga mundial de morbilidad. JAMA Oncol. (2017) 3:524–48. doi: 10.1001/jamaoncol.2016.5688
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Torre LA, Siegel RL, Ward EM, Jemal A. Global cancer incidence and mortality rates and trends—an update. Cáncer Epidemiol Prev Biomark. (2016) 25:16–27. doi: 10.1158/1055-9965.EPI-15-0578
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Yang Y. Inmunoterapia contra el cáncer: aprovechar el sistema inmunitario para combatir el cáncer. J Clin Invest. (2015) 125:3335–7. doi: 10.1172/JCI83871
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Emens LA, Ascierto PA, Darcy PK, Demaria S, Eggermont AMM, Redmond WL, et al. Inmunoterapia contra el cáncer: oportunidades y desafíos en el panorama clínico en rápida evolución. Eur J Cáncer. (2017) 81:116–29. doi: 10.1016/j.ejca.2017.01.035
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Farkona S, Diamandis EP, Blasutig IM. Inmunoterapia contra el cáncer: ¿el principio del fin del cáncer? BMC Med. (2016) 14:73. doi: 10.1186/s12916-016-0623-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Marks L. Engineering Health: How Biotechnology Changed Medicine. Real Sociedad de Química (2017).
8. Freeman GJ, Long AJ, Iwai Y, Bourque K, Chernova T, Nishimura H, et al. El compromiso del receptor inmunoinhibidor Pd-1 por un nuevo miembro de la familia B7 conduce a una regulación negativa de la activación de linfocitos. J Exp Med. (2000) 192:1027–34. DOI: 10.1084/JEM.192.7.1027
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Ishida Y, Agata Y, Shibahara K, Honjo T. Expresión inducida de PD-1, un nuevo miembro de la superfamilia del gen de la inmunoglobulina, tras la muerte celular programada. EMBO J. (1992) 11:3887–95. doi: 10.1002/j.1460-2075.1992.tb05481.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Iwai Y, Terawaki S, Honjo T. El bloqueo de PD-1 inhibe la diseminación hematógena de células tumorales poco inmunogénicas mediante un mayor reclutamiento de células T efectoras. Int Immunol. (2005) 17:133–44. doi: 10.1093/intimm/dxh194
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Kwon ED, Hurwitz AA, Foster BA, Madias C, Feldhaus AL, Greenberg NM, et al. Manipulación de señales coestimuladoras e inhibitorias de células T para la inmunoterapia del cáncer de próstata. Proc Natl Acad Sci USA. (1997) 94:8099–103. DOI: 10.1073/PNAS.94.15.8099
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Leach DR, Krummel MF, Allison JP. Mejora de la inmunidad antitumoral mediante el bloqueo de CTLA-4. Ciencia. (1996) 271:1734–6. doi: 10.1126/science.271.5256.1734
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Ventola CL. Inmunoterapia contra el cáncer, Parte 3: desafíos y tendencias futuras. Pharm Ther. (2017) 42:514–21.
14. Klevorn LE, Teague RM. Adaptación de modelos de inmunoterapia contra el cáncer para el mundo real. Tendencias Immunol. (2016) 37:354–63. doi: 10.1016/j.it.2016.03.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Park JS, Withers SS, Modiano JF, Kent MS, Chen M, Luna JI, et al. Estudios de inmunoterapia contra el cáncer canino: vinculando ratones y humanos. J Immunother Cáncer. (2016) 4:97. DOI: 10.1186/S40425-016-0200-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Malaney P, Nicosia SV, Davé c. Un paradigma de ratón, un paciente: nuevos avatares de terapia personalizada contra el cáncer. Cáncer Lett. (2014) 344:1–12. doi: 10.1016/j.canlet.2013.10.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Biemar F, Foti M. Global progress against cancer—challenges and opportunities. Cáncer Biol Med. (2013) 10:183–6. doi: 10.7497/j.issn.2095-3941.2013.04.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Kola I, Landis J. ¿Puede la industria farmacéutica reducir las tasas de deserción? Nat Rev Drug Discov. (2004) 3:711–6. DOI: 10.1038/NRD1470
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Kohnken R, Porcu P, Mishra A. Overview of the use of murine models in leukemia and lymphoma research. Frente Oncol. (2017) 7:22. doi: 10.3389/fonc.2017.00022
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Henry C, Bryan J. No se pierde en la traducción: cómo el estudio de las enfermedades en nuestras mascotas puede beneficiarlos a ellos y a nosotros. Mo Med. (2013) 110:216–9.
21. Porrello A, Cardelli P, Spugnini EP. Oncología de animales de compañía como modelo para humanos. Una visión general de los histotipos tumorales. J Exp Clin Cancer Res CR. (2006) 25:97–105.
22. Gardner HL, Fenger JM, London CA. Dogs as a model for cancer. Annu Rev Anim Biosci. (2016) 4:199–222. doi: 10.1146/annurev-animal-022114-110911
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Pinho SS, Carvalho S, Cabral J, Reis CA, Gärtner F. Canine tumors: a spontaneous animal model of human carcinogenesis. Transl Res J Lab Clin Med. (2012) 159:165–72. doi: 10.1016/j.trsl.2011.11.005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Ranieri G, Gadaleta CD, Patruno R, Zizzo N, Daidone MG, Hansson MG, et al. Un modelo de estudio para el cáncer humano: tumores espontáneos en perros. Características biológicas y traducción para nuevas terapias contra el cáncer. Crit Rev Oncol Hematol. (2013) 88:187–97. doi: 10.1016/j.critrevonc.2013.03.005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Rowell JL, McCarthy DO, Alvarez CE. Modelos de perros de cáncer natural. Tendencias Mol Med. (2011) 17:380–8. doi: 10.1016/j.molmed.2011.02.004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Marconato L, Polton GA, Sabattini S, Dacasto M, Garden OA, Grant I, et al. Conformidad y controversias en el diagnóstico, estadificación y evaluación de seguimiento del linfoma ganglionar canino: Una revisión sistemática de los últimos 15 años de literatura publicada. Veterinario Comp Oncol. (2017) 15:1029–40. DOI: 10.1111/vco.12244
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Richards KL, Suter SE. El mejor amigo del hombre: ¿Qué pueden enseñarnos los perros sobre el linfoma no Hodgkin? (2015) 263:173–91. DOI: 10.1111/IMR.12238
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Marconato L, Gelain ME, Comazzi S. El perro como posible modelo animal para el linfoma no Hodgkin humano: Una revisión. Hematol Oncol. (2013) 31:1–9. doi: 10.1002/hon.2017
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Ito D, Frantz AM, Modiano JF. El linfoma canino como modelo comparativo para el linfoma no Hodgkin humano: progreso reciente y aplicaciones. Veterinario Immunol Immunopathol. (2014) 159:192–201. doi: 10.1016/j.vetimm.2014.02.016
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Khanna C, Lindblad-Toh K, Vail D, London C, Bergman P, Barber L, et al. El perro como modelo de cáncer. Nat Biotechnol. (2006) 24:1065–6. DOI: 10.1038/NBT0906-1065B
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Kisseberth WC, Nadella MVP, Breen M, Thomas R, Duke SE, Murahari S, et al. Una nueva línea celular de linfoma canino: un modelo traslacional y comparativo para la investigación del linfoma. Leuk Res. (2007) 31:1709–20. doi: 10.1016/j.leukres.2007.04.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Ponce, Marchal T, Magnol JP, Turinelli V, Ledieu D, Bonnefont C, et al. Un estudio morfológico de 608 casos de linfoma maligno canino en Francia con un enfoque en las similitudes comparativas entre la morfología del linfoma canino y humano. Veterinario Pathol. (2010) 47:414–33. DOI: 10.1177/0300985810363902
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Rütgen BC, Hammer SE, Gerner W, Christian M, de Arespacochaga AG, Willmann M, et al. Establecimiento y caracterización de una nueva línea de células B caninas derivada de un linfoma difuso de células grandes de aparición espontánea. Leuk Res. (2010) 34:932–8. doi: 10.1016/j.leukres.2010.01.021
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Rütgen BC, Willenbrock S, Reimann-Berg N, Walter I, Fuchs-Baumgartinger A, Wagner S, et al. La autenticación de las características primordiales de la línea celular CLBL-1 demuestra la integridad de un linfoma canino de células B en un modelo murino in vivo. PloS ONE. (2012) 7:E40078. doi: 10.1371/journal.pone.0040078
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Hahn K, Bravo L, Adams WH, Frazier DL. Tumores naturales en perros como modelos comparativos para la investigación de la terapia del cáncer. Vivo Atenas Grecia. (1994) 8:133–43.
36. Vail DM, MacEwen EG. Tumores que ocurren espontáneamente de animales de compañía como modelos para el cáncer humano. cáncer invertir. (2000) 18:781–92. DOI: 10.3109/07357900009012210
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Hansen K, Khanna C. Modelos animales espontáneos y genéticamente modificados; Uso en el desarrollo preclínico de fármacos contra el cáncer. Eur J Cancer Oxf Engl. (2004) 40:858–80. doi: 10.1016/j.ejca.2003.11.031
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Seelig DM, Avery AC, Ehrhart EJ, Linden MA. Las características diagnósticas comparativas del linfoma canino y humano. Veterinario Sci. (2016) 3:11. doi: 10.3390/vetsci3020011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Swerdlow SH. WHO classification of tumors of haematopoietic and lymphoid tissues. OMS clasifica los tumores. (2008) 22008:439.
40. Lindblad-Toh K, Wade CM, Mikkelsen TS, Karlsson EK, Jaffe DB, Kamal M, et al. Secuencia del genoma, análisis comparativo y estructura haplotípica del perro doméstico. Naturaleza. (2005) 438:803–19. doi: 10.1038/nature04338
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Pastor M, Chalvet-Monfray K, Marchal T, Keck G, Magnol JP, Fournel-Fleury C, et al. Indicadores de riesgo genéticos y ambientales en linfomas caninos no Hodgkin: asociaciones de razas y distribución geográfica de 608 casos diagnosticados en toda Francia durante 1 año. J Vet Intern Med Am Coll Vet Intern Med. (2009) 23:301–10. doi: 10.1111/j.1939-1676.2008.0255.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. Gamlem H, Nordstoga K, Glattre E. Canine neoplasia–introductory paper. APMIS Supl. (2008) 116:5–18. doi: 10.1111/j.1600-0463.2008.125m2.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Modiano JF, Breen M, Burnett RC, Parker HG, Inusah S, Thomas R, et al. La prevalencia distinta de la enfermedad linfoproliferativa de células B y células T entre las razas de perros indica un riesgo hereditario. Cáncer Res. (2005) 65:5654–61. doi: 10.1158/0008-5472.CAN-04-4613
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Paoloni M, Khanna C. Comparative oncology today. Veterinario Clin North am Small Anim Pract. (2007) 37:1023–32; v. doi: 10.1016/j.cvsm.2007.08.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Weiskopf K, Anderson KL, Ito D, Schnorr PJ, Tomiyasu H, Ring AM, et al. Erradicación del linfoma difuso canino de células B grandes en un modelo de xenoinjerto murino con bloqueo CD47 y anti-CD20. Cancer Immunol Res. (2016) 4:1072–87. doi: 10.1158/2326-6066.CIR-16-0105
Resumen de PubMed | Texto completo de CrossRef | Google Académico
46. Fisher SG, Fisher RI. La epidemiología del linfoma no Hodgkin. Oncogén. (2004) 23:6524–34. doi: 10.1038/sj.onc.1207843
Resumen de PubMed | Texto completo de CrossRef | Google Académico
47. Kong Y, Barisone GA, Sidhu RS, O’Donnell RT, Tuscano JM. Efficacy of combined histone deacetylase and checkpoint kinase inhibition in a preclinical model of human Burkitt lymphoma. Mol Med. (2015) 21:824–32. doi: 10.2119/molmed.2015.00032
48. Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. (2021) 71:209–49. doi: 10.3322/caac.21660
49. Shankland KR, Armitage JO, Hancock BW. Non-Hodgkin lymphoma. Lancet. (2012) 380:848–57. doi: 10.1016/S0140-6736(12)60605-9
50. Ansell SM. Linfoma no Hodgkin: diagnóstico y tratamiento. Mayo Clin Proc. (2015) 90:1152–63. doi: 10.1016/j.mayocp.2015.04.025
Resumen de PubMed | Texto completo de CrossRef | Google Académico
51. Ito D, Brewer S, Modiano JF, Beall MJ. Desarrollo de un nuevo anticuerpo monoclonal CD20 anticanino con potencial diagnóstico y terapéutico. Leuk Linfa. (2015) 56:219–25. doi: 10.3109/10428194.2014.914193
Resumen de PubMed | Texto completo de CrossRef | Google Académico
52. Motta G, Cea M, Moran E, Carbone F, Augusti V, Patrone F, et al. Anticuerpos monoclonales para el linfoma no Hodgkin: estado del arte y perspectivas. Clin Dev Immunol. (2011) 2010:428253. DOI: 10.1155/2010/428253
Resumen de PubMed | Texto completo de CrossRef | Google Académico
53. Molina A. Una década de rituximab: mejorando los resultados de supervivencia en el linfoma no Hodgkin. Annu Rev Med. (2008) 59:237–50. doi: 10.1146/annurev.med.59.060906.220345
Resumen de PubMed | Texto completo de CrossRef | Google Académico
54. Zappasodi R, de Braud F, Di Nicola M. Lymphoma immunotherapy: current status. Frente Immunol. (2015) 6:448. doi: 10.3389/fimmu.2015.00448
Resumen de PubMed | Texto completo de CrossRef | Google Académico
55. Chao MP. Desafíos del tratamiento en el tratamiento del linfoma no Hodgkin recidivante o refractario: terapias nuevas y emergentes. Cancer Manag Res. (2013) 5:251–69. doi: 10.2147/CMAR. S34273
Resumen de PubMed | Texto completo de CrossRef | Google Académico
56. Heyman B, Yang Y. Nuevos desarrollos en inmunoterapia para el linfoma. Cáncer Biol Med. (2018) 15:189–209. doi: 10.20892/j.issn.2095-3941.2018.0037
Resumen de PubMed | Texto completo de CrossRef | Google Académico
57. Zandvliet M. Linfoma canino: una revisión. Veterinario Q. (2016) 36:76–104. doi: 10.1080/01652176.2016.1152633
Resumen de PubMed | Texto completo de CrossRef | Google Académico
58. Flory A b, Rassnick K m, Al-Sarraf R, Bailey D b., Balkman C e., Kiselow M a., et al. Combinación de quimioterapia CCNU y DTIC para el tratamiento del linfoma resistente en perros. J Vet Pasante Med. (2008) 22:164–71. doi: 10.1111/j.1939-1676.2007.0005.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
59. Fahey CE, Milner RJ, Barabas K, Lurie D, Kow K, Parfitt S, et al. Evaluación del protocolo de quimioterapia con lomustina, vincristina, procarbazina y prednisona de la Universidad de Florida para el tratamiento del linfoma recidivante en perros: 33 casos (2003-2009). J Am Vet Med Assoc. (2011) 239:209–15. doi: 10.2460/javma.239.2.209
Resumen de PubMed | Texto completo de CrossRef | Google Académico
60. Back AR, Schleis SE, Smrkovski OA, Lee J, Smith AN, Phillips JC. Mecloretamina, vincristina, melfalán y prednisona (MOMP) para el tratamiento del linfoma recidivante en perros. Veterinario Comp Oncol. (2015) 13:398–408. DOI: 10.1111/vco.12055
Resumen de PubMed | Texto completo de CrossRef | Google Académico
61. Zandvliet M, Rutteman GR, Teske E. La inclusión de la prednisolona en un protocolo citostático multifármaco de primera línea para el tratamiento del linfoma canino no afecta los resultados del tratamiento. Veterinario J. (2013) 197:656–61. doi: 10.1016/j.tvjl.2013.04.022
Resumen de PubMed | Texto completo de CrossRef | Google Académico
62. Klingemann H. Immunotherapy for dogs: running behind humans. Frente Immunol. (2018) 9:133. doi: 10.3389/fimmu.2018.00133
Resumen de PubMed | Texto completo de CrossRef | Google Académico
63. Anderson KL, Modiano JF. Avances en inmunoterapia adaptativa para el cáncer en animales de compañía: éxito en el camino hacia una cura. Veterinario Sci. (2015) 2:363–87. doi: 10.3390/vetsci2040363
Resumen de PubMed | Texto completo de CrossRef | Google Académico
64. Rosales C, Jeglum KA, Obrocka M, Steplewski Z. Cytolytic activity of murine anti-dog lymphoma monoclonal antibodies with canine effector cells and complement. Immunol celular. (1988) 115:420–8. doi: 10.1016/0008-8749(88)90194-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
65. Jeglum KA. La historia y el futuro del anticuerpo monoclonal del linfoma canino 231. cáncer ther. (2009) 7:59–61. doi: 10.1016/s0195-5616(96)50007-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
66. Jeglum KA. Quimioinmunoterapia del linfoma canino con anticuerpo monoclonal canino adyuvante 231. Veterinario Clin North am Small Anim Pract. (1996) 26:73–85. doi: 10.1016/S0195-5616(96)50007-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
67. Stein R, Balkman C, Chen S, Rassnick K, McEntee M, Page R, et al. Evaluación de la terapia con anticuerpos monoclonales anti-antígeno leucocitario humano-DR en el linfoma canino espontáneo. Leuk Linfa. (2011) 52:273–84. doi: 10.3109/10428194.2010.535182
Resumen de PubMed | Texto completo de CrossRef | Google Académico
68. Rue SM, Eckelman BP, Efe JA, Bloink K, Deveraux QL, Lowery D, et al. Identificación de un anticuerpo terapéutico candidato para el tratamiento del linfoma canino de células B. Veterinario Immunol Immunopathol. (2015) 164:148–59. doi: 10.1016/j.vetimm.2015.02.004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
69. Jain S, Aresu L, Comazzi S, Shi J, Worrall E, Clayton J, et al. El desarrollo de un anticuerpo monoclonal scFv recombinante dirigido a CD20 canino para su uso en medicina comparada. PloS ONE. (2016) 11:E0148366. doi: 10.1371/journal.pone.0148366
Resumen de PubMed | Texto completo de CrossRef | Google Académico
70. Mizuno T, Kato Y, Kaneko MK, Sakai Y, Shiga T, Kato M, et al. Generación de un anticuerpo CD20 anticanino canino para el tratamiento del linfoma canino. (2020) 10:11476. DOI: 10.1038/S41598-020-68470-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
71. O’Connor CM, Wilson-Robles H. Desarrollo de inmunoterapia contra el cáncer de células T en el perro con linfoma. ILAR J Natl Res Counc Inst Lab Anim Resour. (2014) 55:169–81. doi: 10.1093/ilar/ilu020
Resumen de PubMed | Texto completo de CrossRef | Google Académico
72. O’Connor CM, Sheppard S, Hartline CA, Huls H, Johnson M, Palla SL, et al. La terapia adoptiva de células T mejora el tratamiento del linfoma no Hodgkin canino después de la quimioterapia. (2012) 2:249. doi: 10.1038/srep00249
Resumen de PubMed | Texto completo de CrossRef | Google Académico
73. Panjwani MK, Smith JB, Schutsky K, Gnanandarajah J, O’Connor CM, Powell DJ, et al. Viabilidad y seguridad de las células T receptoras de antígeno quimérico CD20 específicas transfectadas con ARN en perros con linfoma espontáneo de células B. Mol Ther. (2016) 24:1602–14. doi: 10.1038/mt.2016.146
Resumen de PubMed | Texto completo de CrossRef | Google Académico
74. Suter SE, Chein MB, von Messling V, Yip B, Cattaneo R, Vernau W, et al. In vitro canine distemper virus infection of canine lymphoid cells: a prelude to oncolytic therapy for lymphoma. Clin Cancer Res. (2005) 11:1579–87. doi: 10.1158/1078-0432.CCR-04-1944
Resumen de PubMed | Texto completo de CrossRef | Google Académico
75. Henson M, Suter S, Vonmessling V, Cattaneo R, Fielding A. 803. Los efectos de la inyección intratumoral de un morbillivirus replicante en un modelo canino de linfoma natural. Mol Ther. (2005) 11:312. doi: 10.1016/j.ymthe.2005.07.340
76. Sanchez D, Pelayo R, Sarmiento RE, Medina LA, Cesarman-Maus GN, Nuñez L, et al. in vitro and in vivo oncolytic activity of Lasota strain of Newcastle disease virus on a lymphoma B-cell line and a canine cutaneous T-cell lymphoma. Sangre. (2014) 124:5504. doi: 10.1182/sangre. V124.21.5504.5504
77. Sánchez D, Pelayo R, Medina LA, Vadillo E, Sánchez R, Núñez L, et al. Virus de la enfermedad de Newcastle: posible aplicación terapéutica para el linfoma humano y canino. Virus. (2015) 8:3. DOI: 10.3390/V8010003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
78. Hwang CC, Umeki S, Igase M, Coffey M, Noguchi S, Okuda M, et al. Los efectos del reovirus oncolítico en líneas celulares de linfoma canino. Veterinario Comp Oncol. (2016) 14(Suppl. 1):61–73. DOI: 10.1111/vco.12124
Resumen de PubMed | Texto completo de CrossRef | Google Académico
79. Hwang CC, Igase M, Sakurai M, Haraguchi T, Tani K, Itamoto K, et al. Terapia con reovirus oncolítico: estudio piloto en perros con tumores de aparición espontánea. Veterinario Comp Oncol. (2018) 16:229–38. DOI: 10.1111/vco.12361
Resumen de PubMed | Texto completo de CrossRef | Google Académico
80. Henson MS, Curtsinger JM, Larson VS, Klausner JS, Modiano JF, Mescher MF, et al. Inmunoterapia con microperlas recubiertas de antígeno tumoral autólogo (inmunógeno multivalente grande), IL-2 y GM-CSF en perros con linfoma espontáneo de células B. Veterinario Comp Oncol. (2011) 9:95–105. doi: 10.1111/j.1476-5829.2010.00234.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
81. Jeglum KA, Winters WD, Young KM. Monitorización inmunitaria in vitro de la respuesta de anticuerpos en perros que recibieron quimioinmunoterapia para el linfoma. Am J Vet Res. (1989) 50:488–92.
82. Jeglum KA, Young KM, Barnsley K, Whereat A. Quimioterapia versus quimioterapia con vacuna intralinfática de células tumorales en linfoma canino. Cáncer. (1988) 61:2042–50.
83. Jeglum KA, Young KM, Barnsley K, Whereat A, McGrath D, Hutson C. Intralymphatic autochthonous tumor cell vaccine in canine lymphoma. J Biol Respuesta Mod. (1986) 5:168–75.
84. Sorenmo K, Krick E, Coughlin CM, Overley B, Gregor TP, Vonderheide RH, et al. La vacuna contra el cáncer de células B activada por CD40 mejora la segunda remisión clínica y la supervivencia en perros de propiedad privada con linfoma no Hodgkin. PloS ONE. (2011) 6:E24167. doi: 10.1371/journal.pone.0024167
Resumen de PubMed | Texto completo de CrossRef | Google Académico
85. Peruzzi D, Gavazza A, Mesiti G, Lubas G, Scarselli E, Conforti A, et al. Una vacuna dirigida a la telomerasa mejora la supervivencia de los perros afectados por el linfoma de células B. Mol ther J am Soc Gene ther. (2010) 18:1559–67. doi: 10.1038/mt.2010.104
86. Gavazza A, Lubas G, Fridman A, Peruzzi D, Impellizeri JA, Luberto L, et al. Safety and efficacy of a genetic vaccine targeting telomerase plus chemotherapy for the therapy of canine B-cell lymphoma. Hum Gene Ther. (2013) 24:728–38. doi: 10.1089/hum.2013.112
87. Impellizeri JA, Gavazza A, Greissworth E, Crispo A, Montella M, Ciliberto G, et al. Tel-eVax: a genetic vaccine targeting telomerase for treatment of canine lymphoma. J Transl Med. (2018) 16:349. doi: 10.1186/s12967-018-1738-6
88. Marconato L, Frayssinet P, Rouquet N, Comazzi S, Leone VF, Laganga P, et al. Randomized, placebo-controlled, double-blinded chemoimmunotherapy clinical trial in a pet dog model of diffuse large b-cell lymphoma. Clin Cancer Res. (2014) 20:668–77. doi: 10.1158/1078-0432.CCR-13-2283
89. Marconato L, Stefanello D, Sabattini S, Comazzi S, Riondato F, Laganga P, et al. Enhanced therapeutic effect of APAVAC immunotherapy in combination with dose-intense chemotherapy in dogs with advanced indolent B-cell lymphoma. Vaccine. (2015) 33:5080–6. doi: 10.1016/j.vaccine.2015.08.017
90. Marconato L, Aresu L, Stefanello D, Comazzi S, Martini V, Ferrari R, et al. Opportunities and challenges of active immunotherapy in dogs with B-cell lymphoma: a 5-year experience in two veterinary oncology centers. J Immunother Cancer. (2019) 7:146. doi: 10.1186/s40425-019-0624-y
91. Makkouk A, Weiner G. Cancer immunotherapy and breaking immune tolerance-new approaches to an old challenge. Cancer Res. (2015) 75:5–10. doi: 10.1158/0008-5472.CAN-14-2538
92. Vacchelli E, Pol J, Bloy N, Eggermont A, Cremer I, Fridman WH, et al. Trial watch: tumor-targeting monoclonal antibodies for oncological indications. Oncoimmunology. (2015) 4:e985940. doi: 10.4161/2162402X.2014.985940
93. Aguiar S, Dias J, Manuel AM, Russo R, Gois PMP, da Silva FA, et al. Chimeric small antibody fragments as strategy to deliver therapeutic payloads. Adv Protein Chem Struct Biol. (2018) 112:143–82. doi: 10.1016/bs.apcsb.2018.03.002
94. Kimiz-Gebologlu I, Gulce-Iz S, Biray-Avci C. Monoclonal antibodies in cancer immunotherapy. Mol Biol Rep. (2018) 45:2935–40. doi: 10.1007/s11033-018-4427-x
95. Chames P, Van Regenmortel M, Weiss E, Baty D. Therapeutic antibodies: successes, limitations and hopes for the future. Br J Pharmacol. (2009) 157:220–33. doi: 10.1111/j.1476-5381.2009.00190.x
96. Maloney DG, Liles TM, Czerwinski DK, Waldichuk C, Rosenberg J, Grillo-Lopez A, et al. Phase I clinical trial using escalating single-dose infusion of chimeric anti-CD20 monoclonal antibody (IDEC-C2B8) in patients with recurrent B-cell lymphoma. Blood. (1994) 84:2457–66. doi: 10.1182/blood.V84.8.2457.2457
97. Waldmann TA. Immunotherapy: past, present and future. Nat Med. (2003) 9:269–77. doi: 10.1038/nm0303-269
98. Jubala CM, Wojcieszyn JW, Valli VEO, Getzy DM, Fosmire SP, Coffey D, et al. CD20 expression in normal canine B cells and in canine non-Hodgkin lymphoma. Vet Pathol. (2005) 42:468–76. doi: 10.1354/vp.42-4-468
99. Kano R, Inoiue C, Okano H, Yamazaki J, Takahashi T, Watari T, et al. Canine CD20 gene. Vet Immunol Immunopathol. (2005) 108:265–8. doi: 10.1016/j.vetimm.2005.05.011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
100. Impellizeri JA, Howell K, McKeever KP, Crow SE. El papel del rituximab en el tratamiento del linfoma canino: una evaluación ex vivo. Veterinario J Lond Engl. (2006) 171:556–8. doi: 10.1016/j.tvjl.2005.03.005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
101. Singer J, Fazekas J, Wang W, Weichselbaumer M, Matz M, Mader A, et al. Generación de un anticuerpo canino anti-EGFR (ErbB-1) para inmunoterapia pasiva en pacientes con cáncer de perro. Mol Cáncer Ther. (2014) 13:1777–90. doi: 10.1158/1535-7163.MCT-13-0288
Resumen de PubMed | Texto completo de CrossRef | Google Académico
102. Killick DR, Stell AJ, Catchpole B. Inmunoterapia para el cáncer canino: ¿es hora de volver al futuro? J Small Anim Pract. (2015) 56:229–41. DOI: 10.1111/JSAP.12336
Resumen de PubMed | Texto completo de CrossRef | Google Académico
103. Gonzales AJ, Fleck TJ, Humphrey WR, Galvan BA, Aleo MM, Mahabir SP, et al. Prurito inducido por IL-31 en perros: un nuevo modelo experimental para evaluar los efectos antipruriginosos de la terapéutica canina. Veterinario Dermatol. (2016) 27:34–E10. DOI: 10.1111/VDE.12280
Resumen de PubMed | Texto completo de CrossRef | Google Académico
104. June CH, Sadelain M. Quimeric Antigen Receptor Therapy. N Engl J Med. (2018) 379:64–73. doi: 10.1056/NEJMra1706169
Resumen de PubMed | Texto completo de CrossRef | Google Académico
105. Rosenberg SA, Restifo NP, Yang JC, Morgan RA, Dudley ME. Transferencia celular adoptiva: un camino clínico hacia una inmunoterapia eficaz contra el cáncer. Nat Rev Cáncer. (2008) 8:299–308. DOI: 10.1038/NRC2355
Resumen de PubMed | Texto completo de CrossRef | Google Académico
106. Addissie S, Klingemann H. Inmunoterapia celular del cáncer canino. Veterinario Sci. (2018) 5:100. DOI: 10.3390/VETSci5040100
Resumen de PubMed | Texto completo de CrossRef | Google Académico
107. Zheng P-P, Kros JM, Li J. Approved CAR T cell therapies: ice bucket challenges on flagring safety risks and long-term impacts. Drogas Discov hoy. (2018) 23:1175–82. doi: 10.1016/j.drudis.2018.02.012
Resumen de PubMed | Texto completo de CrossRef | Google Académico
108. Storb R, Epstein RB, Rudolph RH, Thomas ED. Trasplante alogénico de médula ósea canina después de la ciclofosfamida. Trasplante. (1969) 7:378. DOI: 10.1097/00007890-196905000-00007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
109. Kolb H-J. Efectos de injerto contra leucemia del trasplante y los linfocitos del donante. Sangre. (2008) 112:4371–83. doi: 10.1182/blood-2008-03-077974
Resumen de PubMed | Texto completo de CrossRef | Google Académico
110. Mata M, Vera JF, Gerken C, Rooney CM, Miller T, Pfent C, et al. Hacia la inmunoterapia con células T redirigidas en un modelo animal grande: activación ex vivo, expansión y modificación genética de células T caninas. J Immunother Hagerstown Md. (2014) 37:407–15. doi: 10.1097/CJI.0000000000000052
Resumen de PubMed | Texto completo de CrossRef | Google Académico
111. Mason N, Powell D, Panjwani MK, Smith J. Treatment of a canine cd20 positive disease or condition using a canine cd20-specific quimeric antigen receptor. WO2017011316A1 (2017).
112. Marchini A, Daeffler L, Pozdeev VI, Angelova A, Rommelaere J. Conversión inmune del microambiente tumoral por virus oncolíticos: el estudio de caso del protoparvovirus H-1PV. Frente Immunol. (2019) 10:1848. doi: 10.3389/fimmu.2019.01848
Resumen de PubMed | Texto completo de CrossRef | Google Académico
113. Raja J, Ludwig JM, Gettinger SN, Schalper KA, Kim HS. Inmunoterapia con virus oncolíticos: perspectivas futuras para la oncología. J Immunother Cáncer. (2018) 6:140. DOI: 10.1186/S40425-018-0458-Z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
114. Conry RM, Westbrook B, McKee S, Norwood TG. Talimogene laherparepvec: primera viroterapia oncolítica de su clase. Hum Vacunas Immunother. (2018) 14:839–46. doi: 10.1080/21645515.2017.1412896
Resumen de PubMed | Texto completo de CrossRef | Google Académico
115. Sánchez D, Cesarman-Maus G, Amador-Molina A, Lizano M. Virus oncolíticos para el tratamiento del cáncer canino. Cánceres. (2018) 10:401. doi: 10.3390/cánceres10110404
Resumen de PubMed | Texto completo de CrossRef | Google Académico
116. Gentschev I, Patil SS, Petrov I, Cappello J, Adelfinger M, Szalay AA. Viroterapia oncolítica del cáncer canino y felino. Virus. (2014) 6:2122–37. DOI: 10.3390/V6052122
Resumen de PubMed | Texto completo de CrossRef | Google Académico
117. Naik S, Galyon GD, Jenks NJ, Steele MB, Miller AC, Allstadt SD, et al. Evaluación oncológica comparativa del tratamiento intravenoso con virus de la estomatitis vesicular oncolítica recombinante en el cáncer canino espontáneo. Mol Cáncer Ther. (2018) 17:316–26. doi: 10.1158/1535-7163.MCT-17-0432
Resumen de PubMed | Texto completo de CrossRef | Google Académico
118. Gong J, Sachdev E, Mita AC, Mita MM. Desarrollo clínico de reovirus para el tratamiento del cáncer: un virus oncolítico con actividad antitumoral mediada por el sistema inmunitario. Mundo J Methodol. (2016) 6:25–42. doi: 10.5662/wjm.v6.i1.25
119. Atzpodien J, Kirchner H. The out-patient use of recombinant human interleukin-2 and interferon alfa-2b in advanced malignancies. Eur J Cancer Oxf Engl. (1991) 27(Suppl. 4):S88–91; discussion S92. doi: 10.1016/0277-5379(91)90586-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
120. Burns LJ, Weisdorf DJ, DeFor TE, Repka TL, Ogle KM, Hummer C, et al. Mejora de la actividad antitumoral de un injerto de células progenitoras de sangre periférica mediante la movilización con interleucina 2 más factor estimulante de colonias de granulocitos en pacientes con cáncer de mama avanzado. Exp Hematol. (2000) 28:96–103. doi: 10.1016/S0301-472X(99)00129-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
121. Burns LJ, Weisdorf DJ, DeFor TE, Vesole DH, Repka TL, Blazar BR, et al. La inmunoterapia basada en IL-2 después del trasplante autólogo para el linfoma y el cáncer de mama induce la activación inmune y la liberación de citoquinas: un ensayo de fase I / II. Trasplante de médula ósea. (2003) 32:177–86. doi: 10.1038/sj.bmt.1704086
Resumen de PubMed | Texto completo de CrossRef | Google Académico
122. Dudek AZ, Mescher MF, Okazaki I, Math VT, Luo X, Curtsinger JM, et al. Vacuna autóloga contra inmunógenos multivalentes grandes en pacientes con melanoma metastásico y carcinoma de células renales. Am J Clin Oncol. (2008) 31:173–81. doi: 10.1097/COC.0b013e3181573e6b
Resumen de PubMed | Texto completo de CrossRef | Google Académico
123. Lissoni P, Barni S, Tancini G, Ardizzoia A, Ricci G, Aldeghi R, et al. Estudio aleatorizado con dosis bajas subcutáneas de interleucina 2 sola frente a interleucina 2 más la neurohormona pineal melatonina en neoplasias sólidas avanzadas distintas del cáncer renal y el melanoma. Br J Cáncer. (1994) 69:196–9. DOI: 10.1038/BJC.1994.34
Resumen de PubMed | Texto completo de CrossRef | Google Académico
124. Miller JS, Tessmer-Tuck J, Pierson BA, Weisdorf D, McGlave P, Blazar BR, et al. La dosis baja de interleucina-2 subcutánea después del trasplante autólogo genera una actividad sostenida de células asesinas naturales in vivo. Biol Trasplante de Médula Sanguínea. (1997) 3:34–44.
125. Bendandi M, Gocke CD, Kobrin CB, Benko FA, Sternas LA, Pennington R, et al. Remisiones moleculares completas inducidas por la vacunación específica del paciente más factor estimulante de colonias de granulocitos y monocitos contra el linfoma. Nat Med. (1999) 5:1171–7. DOI: 10.1038/13928
Resumen de PubMed | Texto completo de CrossRef | Google Académico
126. Dow S, Elmslie RE, Willson AP, Roche L, Gorman C, Potter TA. La transfección tumoral in vivo con genes superantígeno más citoquinas induce la regresión tumoral y prolonga la supervivencia en perros con melanoma maligno. J Clin Invest. (1998) 101:2406–14. doi: 10.1172/JCI510
Resumen de PubMed | Texto completo de CrossRef | Google Académico
127. Dow S, Elmslie R, Kurzman I, MacEwen G, Pericle F, Liggitt D. Estudio de fase I de complejos liposoma-ADN que codifican el gen de la interleucina-2 en perros con metástasis pulmonares de osteosarcoma. Hum Gene Ther. (2005) 16:937–46. doi: 10.1089/hum.2005.16.937
Resumen de PubMed | Texto completo de CrossRef | Google Académico
128. Khanna C, Anderson PM, Hasz DE, Katsanis E, Neville M, Klausner JS. La terapia de inhalación de liposomas con interleucina-2 es segura y efectiva para perros con metástasis pulmonares espontáneas. Cáncer. (1997) 79:1409–21.
129. Moore AS, Theilen GH, Newell AD, Madewell BR, Rudolf AR. Estudio preclínico del factor de necrosis tumoral secuencial e interleucina 2 en el tratamiento de neoplasias caninas espontáneas. Cáncer Res. (1991) 51:233–8.
130. Otter WD, Cadée J, Gavhumende R, De Groot CJ, Hennink WE, Stewart R. Terapia eficaz contra el cáncer con una sola inyección de interleucina-2 en el sitio del tumor. Cáncer Immunol Immunother CII. (1999) 48:419–20. doi: 10.1007/s002620050595
Resumen de PubMed | Texto completo de CrossRef | Google Académico
131. Thamm DH, Kurzman ID, Macewen EG, Feinmehl R, Towell TL, Longhofer SL, et al. Tratamiento inmunogénico intralesional con complejos lipídicos de citocinas/superantígenos para tumores caninos espontáneos. Cáncer Immunol Immunother CII. (2003) 52:473–80. DOI: 10.1007/S00262-003-0387-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
132. Finocchiaro LME, Fiszman GL, Karara AL, Glikin GC. El gen suicida y las citocinas combinaron la terapia génica no viral para el melanoma canino espontáneo. Cáncer Gene Ther. (2008) 15:165–72. doi: 10.1038/sj.cgt.7701096
Resumen de PubMed | Texto completo de CrossRef | Google Académico
133. Paoloni M, Mazcko C, Selting K, Lana S, Barber L, Phillips J, et al. Definición del perfil farmacodinámico y el índice terapéutico de la inmunocitocina NHS-IL12 en perros con melanoma maligno. PLoS ONE. (2015) 10:E0129954. doi: 10.1371/journal.pone.0129954
Resumen de PubMed | Texto completo de CrossRef | Google Académico
134. Lee S-H, Shin D-J, Kim S-K. Generación de interleucina-15 canina recombinante y evaluación de sus efectos sobre la proliferación y función de las células NK caninas. Veterinario Immunol Immunopathol. (2015) 165:1–13. doi: 10.1016/j.vetimm.2015.04.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
135. Guo C, Manjili MH, Subjeck JR, Sarkar D, Fisher PB, Wang X-Y. Vacunas terapéuticas contra el cáncer: pasado, presente y futuro. Adv Cancer Res. (2013) 119:421–75. doi: 10.1016/B978-0-12-407190-2.00007-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
136. Crow SE, Theilen GH, Benjamini E, Torten M, Henness AM, Buhles WC. Quimioinmunoterapia para el linfosarcoma canino. Cáncer. (1977) 40:2102–8.
137. Weller RE, Theilen GH, Madewell BR, Crow SE, Benjamini E, Villalobos A. Quimioinmunoterapia para el linfosarcoma canino: una evaluación prospectiva de inmunomodulación específica y no específica. Am J Vet Res. (1980) 41:516–21.
138. Jenkins RW, Barbie DA, Flaherty KT. Mecanismos de resistencia a los inhibidores del punto de control inmunitario. Br J Cáncer. (2018) 118:9–16. DOI: 10.1038/BJC.2017.434
Resumen de PubMed | Texto completo de CrossRef | Google Académico
139. Darvin P, Toor SM, Nair VS, Elkord E. Immune checkpoint inhibitors: recent progress and potential biomarkers. Exp Mol Med. (2018) 50:1–11. DOI: 10.1038/S12276-018-0191-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
140. Armand P. Bloqueo del punto de control inmunitario en neoplasias malignas hematológicas. Sangre. (2015) 125:3393–400. doi: 10.1182/blood-2015-02-567453
Resumen de PubMed | Texto completo de CrossRef | Google Académico
141. Maekawa N, Konnai S, Ikebuchi R, Okagawa T, Adachi M, Takagi S, et al. Expresión de PD-L1 en células tumorales caninas y mejora de la producción de ifn-γ a partir de células infiltrantes tumorales mediante el bloqueo de PD-L1. PLoS ONE. (2014) 9:E98415. doi: 10.1371/journal.pone.0098415
Resumen de PubMed | Texto completo de CrossRef | Google Académico
142. Hartley G, Elmslie R, Dow S, Guth A. Expresión de moléculas de punto de control por linfomas de células B y T en perros. Veterinario Comp Oncol. (2018) 16:352–60. DOI: 10.1111/vco.12386
Resumen de PubMed | Texto completo de CrossRef | Google Académico
143. Choi JW, Withers SS, Sciammas R, Rebhun RB, McSorley SJ. Desarrollo de anticuerpos monoclonales PD-1/PD-L1 para el tratamiento del cáncer canino. J Immunol. (2018) 200:59.28.
144. Maekawa N, Konnai S, Takagi S, Kagawa Y, Okagawa T, Nishimori A, et al. A canine chimeric monoclonal antibody targeting PD-L1 and its clinical efficacy in canine oral malignant melanoma or undifferentiated sarcoma. Sci Rep. (2017) 7:8951. doi: 10.1038/s41598-017-09444-2
145. Shin I-S, Choi E-W, Chung J-Y, Hwang C-Y, Lee C-W, Youn H-Y. Cloning, expression and bioassay of canine CTLA4Ig. Vet Immunol Immunopathol. (2007) 118:12–8. doi: 10.1016/j.vetimm.2007.03.013
146. Graves SS, Stone D, Loretz C, Peterson L, McCune JS, Mielcarek M, et al. Establishment of long-term tolerance to SRBC in dogs by recombinant canine CTLA4-Ig. Transplantation. (2009) 88:317–22. doi: 10.1097/TP.0b013e3181ae3285
147. Tagawa M, Kurashima C, Takagi S, Maekawa N, Konnai S, Shimbo G, et al. Evaluation of costimulatory molecules in dogs with B cell high grade lymphoma. PLoS ONE. (2018) 13:e0201222. doi: 10.1371/journal.pone.0201222
148. Kelly PN. The cancer immunotherapy revolution. Science. (2018) 359:1344–5. doi: 10.1126/science.359.6382.1344
149. Golan T, Milella M, Ackerstein A, Berger R. The changing face of clinical trials in the personalized medicine and immuno-oncology era: report from the international congress on clinical trials in Oncology & Hemato-Oncology (ICTO 2017). J Exp Clin Cancer Res CR. (2017) 36:192. doi: 10.1186/s13046-017-0668-0
150. Decker WK, da Silva RF, Sanabria MH, Angelo LS, Guimarães F, Burt BM, et al. Cancer immunotherapy: historical perspective of a clinical revolution and emerging preclinical animal models. Front Immunol. (2017) 8:829. doi: 10.3389/fimmu.2017.00829
151. Barutello G, Rolih V, Arigoni M, Tarone L, Conti L, Quaglino E, et al. Strengths and weaknesses of pre-clinical models for human melanoma treatment: dawn of dogs’ revolution for immunotherapy. Int J Mol Sci. (2018) 19:799. doi: 10.3390/ijms19030799
152. Whiteside TL, Demaria S, Rodriguez-Ruiz ME, Zarour HM, Melero I. Emerging opportunities and challenges in cancer immunotherapy. Clin Cancer Res. (2016) 22:1845–55. doi: 10.1158/1078-0432.CCR-16-0049
153. Dias JNR, André AS, Aguiar SI, Ministro J, Oliveira J, Peleteiro C, et al. Establishment of a bioluminescent canine B- cell lymphoma xenograft model for monitoring tumor progression and treatment response in preclinical studies. PLoS ONE. (2018) 13:e0208147. doi: 10.1371/journal.pone.0208147
Cita: Dias JNR, André AS, Aguiar SI, Gil S, Tavares L y Aires-da-Silva F (2021) Estrategias inmunoterapéuticas para el linfoma canino: cambiar las probabilidades contra el linfoma no Hodgkin. Frente. Vet. Sci. 8:621758. doi: 10.3389/fvets.2021.621758
Recibido: 26 de octubre de 2020; Aprobado: 27 de julio de 2021;
Publicado: 26 agosto 2021.
Editado por:
Steven E. Suter, Universidad Estatal de Carolina del Norte, Estados Unidos
Revisado por:
Maria Gärtner, Universidad de Oporto, Portugal
Jillian M. Richmond, Facultad de Medicina de la Universidad de Massachusetts, Estados Unidos
Copyright © 2021 Dias, André, Aguiar, Gil, Tavares y Aires-da-Silva. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Frederico Aires-da-Silva, fasilva@fmv.ulisboa.pt
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía