Uso de la subfamilia A de casetes de unión a ATP Miembro 13 (ABCA13) para la detección sensible de formas patológicas focales de paratuberculosis bovina subclínica

Uso de la subfamilia A de casetes de unión a ATP Miembro 13 (ABCA13) para la detección sensible de formas patológicas focales de paratuberculosis bovina subclínica
 Cristina Blanco-Vázquez1,
Cristina Blanco-Vázquez1,  Marta Alonso-Hearn2,
Marta Alonso-Hearn2,  Natalia Iglesias1,
Natalia Iglesias1,  Patricia Vázquez2,
Patricia Vázquez2,  Ramón A. Juste2,
Ramón A. Juste2,  Joseba M. Garrido2,
Joseba M. Garrido2,  Ana Balseiro3,4,
Ana Balseiro3,4,  María Canive2,
María Canive2,  Javier Amado5,
Javier Amado5,  Manuel A. Queipo6,
Manuel A. Queipo6,  Tania Iglesias7 y
Tania Iglesias7 y  Rosa Casais1*
Rosa Casais1*- 1Centro de Biotecnología Animal, Servicio Regional de Investigación y Desarrollo Agroalimentario (SERIDA), Deva, España
- 2Departamento de Sanidad Animal, NEIKER-Instituto Vasco de Investigación y Desarrollo Agrario, Basque Research and Technology Alliance (BRTA), Derio, España
- 3Departamento de Sanidad Animal, Facultad de Veterinaria, Universidad de León, León, España
- 4Instituto de Ganadería de Montaña, Centro Superior de Investigaciones Científicas (CSIC-Universidad de León), León, España
- 5Laboratorio Regional de Sanidad Animal del Principado de Asturias, Gijón, España
- 6Servicio de Sanidad y Producción Animal del Principado de Asturias, Oviedo, España
- 7Unidad de Consultoría Estadística, Servicios científico-técnicos, Universidad de Oviedo, Gijón, España
La paratuberculosis bovina (PTB) es una enteritis crónica causada por Mycobacterium avium subespecie paratuberculosis (Map) que causa un fuerte impacto económico en todo el mundo. Los animales infectados pueden permanecer asintomáticos durante años mientras transmiten las micobacterias a otros miembros de la manada. Por lo tanto, la detección precisa de animales infectados subclínicamente es crucial para el control de la enfermedad. En un estudio previo de RNA-Seq, identificamos varios ARNm que estaban sobreexpresados en sangre total de vacas con diferentes lesiones histológicas asociadas a PTB en comparación con animales control sin lesiones detectadas. Las proteínas codificadas por dos de estos ARNm, ATP de la subfamilia de casetes de unión A miembro 13 (ABCA13) y Matrix Metalopeptidase 8 (MMP8) se sobreexpresaron significativamente en sangre total de animales con lesiones histológicas focales, la forma patológica más frecuente en los estadios subclínicos de la enfermedad. En el presente estudio, se evaluó el potencial de las herramientas sensibles de diagnóstico precoz de ELISA comerciales, basadas en la detección de estos dos biomarcadores, en muestras de suero de 704 vacas Holstein Friesian (566 animales infectados y 138 animales control de granjas libres de PTB). Para esta evaluación, los animales infectados se clasificaron en tres grupos, según el tipo de lesiones histológicas presentes en sus tejidos intestinales: focales (n = 447), multifocales (n = 59) y difusas (n = 60). El ELISA basado en la detección de ABCA13 fue validado con éxito mostrando un buen poder discriminatorio entre animales con lesiones focales y animales control (sensibilidad 82,99% y especificidad 80,43%). Por el contrario, el ELISA basado en MMP8 mostró un poder discriminatorio pobre entre los diferentes grupos histológicos y los controles no infectados. El ELISA basado en ABCA13 mostró un valor diagnóstico mayor (0,822) que el ELISA IDEXX (0,517), el aislamiento bacteriano fecal (0,523) y la PCR en tiempo real (0,531) para la detección de animales con lesiones focales. En general, nuestros resultados indican que este ELISA ABCA13 mejora en gran medida la identificación de animales infectados subclínicamente con lesiones focales que son indetectables utilizando los métodos de diagnóstico actuales.
Introducción
La paratuberculosis bovina (PTB) o enfermedad de Johne (JD) es una enteritis crónica contagiosa y debilitante de rumiantes domésticos y silvestres causada por Mycobacterium avium subespecie paratuberculosis (Map). El PTB produce importantes pérdidas económicas en los rebaños lecheros de todo el mundo debido al aumento de la mortalidad, la disminución de la producción de leche, la pérdida de peso, el sacrificio prematuro y la reducción del valor de sacrificio (1-4). El PTB también se ha relacionado con la reducción de las tasas de fertilidad (5, 6) y una mayor susceptibilidad a otras enfermedades, particularmente las infecciones mamarias (7). La importancia de esta enfermedad sería aún mayor si se considera su potencial zoonótico y el riesgo de transmisión de MAP viables a través de leche y productos lácteos pasteurizados (8-10). Se ha documentado la asociación de Map con enfermedades humanas como la enfermedad de Crohn (EC), la diabetes tipo I (DT1), la esclerosis múltiple (EM) o la artritis reumatoide (AR) (11-16).
Los principales signos clínicos de la enfermedad son pérdida progresiva de peso, diarrea y disminución de la producción de leche (17). Map generalmente ingresa a un rebaño a través de la compra de ganado infectado subclínicamente que elimina las bacterias con heces que contaminan el medio ambiente, aunque también puede ingresar a través de heces contaminadas que se adhieren a vehículos, equipos y visitantes. El acceso a pastos o fuentes de agua contaminados y el contacto con otros rumiantes también pueden estar involucrados en la propagación de la enfermedad (18–20).
Se pueden establecer diferentes formas patológicas asociadas con la infección por mapa: focal, multifocal y difusa (21). Brevemente, las lesiones focales consisten en pequeños granulomas dispersos y bien demarcados compuestos por macrófagos y pocas células gigantes de Langhans, localizadas principalmente en los ganglios linfáticos yeyunal e ileal y que no afectan a la lámina propia intestinal. Las lesiones multifocales consisten en numerosos granulomas bien demarcados en los tejidos linfoides intestinales y en la lámina propia intestinal. Las lesiones difusas se caracterizan por enteritis granulomatosa extensa grave y difusa y linfadenitis, que alteran notablemente la estructura histológica normal. De acuerdo con el tipo de célula inflamatoria presente en el infiltrado y el número de bacilos ácido-alcohol resistentes (BAAR), las lesiones difusas se subdividieron en lesiones paucibacilares linfoplasmocíticas difusas, intermedias difusas y multibacilares histocíticas difusas (22). Se han descrito tres formas epidemiopatogénicas de la infección (aparentemente libre, latente y patente) según la clasificación inmunopatológica, los aspectos epidemiológicos y los resultados diagnósticos (23). Las formas latentes no muestran signos clínicos y se caracterizan por una baja carga bacteriana, una respuesta inmune predominante mediada por células y la presencia de lesiones histológicas leves en el intestino y los ganglios linfáticos asociados. Los formularios de patente se caracterizan por un grado variable de signos asociados con lesiones multifocales y difusas avanzadas. Los animales PTB aparentemente libres son aquellos negativos por todas las pruebas diagnósticas que no muestran ninguna lesión microscópica visible.
Aunque se ha demostrado que la vacunación es una herramienta eficiente (24, 25) y se practica ampliamente en algunos entornos (26), la mayoría de los programas de control de PTB en el ganado se basan en pruebas y sacrificio de vacas positivas combinadas con buenas prácticas de manejo (27). Sin embargo, la eficiencia de los programas de control basados en la política de «prueba y sacrificio» está fuertemente condicionada por los métodos de diagnóstico utilizados para detectar la infección de Map, cuyo rendimiento varía según la etapa de la infección de Map. Las pruebas diagnósticas actuales tienen sensibilidades bajas para detectar infecciones subclínicas. En consecuencia, nuevas herramientas diagnósticas con alta sensibilidad y especificidad mejorarían la eficacia diagnóstica necesaria para controlar la enfermedad. El potencial de los enfoques ómicos emergentes para complementar y mejorar el diagnóstico de la infección por MAP en el ganado ha sido revisado previamente (28) y señala el potencial de los biomarcadores del huésped como herramientas para desarrollar nuevos métodos de diagnóstico para PTB (29-34). En un estudio anterior, la secuenciación completa del ARN (RNA-Seq) identificó genes del huésped expresados diferencialmente en muestras de sangre periférica recolectadas de animales con lesiones focales o difusas en tejidos intestinales versus (vs.) animales de control sin ninguna lesión detectada (35). Los genes que codifican para las proteínas bovinas MMP8 (Matrix metallopeptidase 8) y ABCA13 (ATP binding cassette subfamily A member 13) mostraron una expresión significativamente mayor en animales con lesiones focales (log2 fold change 1.89 y 3.74, respectivamente), mientras que los genes que codifican para FAM84A (familia con similitud de secuencia 84 miembro A), SPARC (proteína secretada ácida y rica en cisteína) y desmina (DES) se regularon al alza en animales que mostraban lesiones difusas en comparación con los animales control (log2 fold change 2.15, 2,21 y 3,75, respectivamente). Posteriormente, se estudió el rendimiento diagnóstico de ELISA comerciales basado en la detección de esos cinco biomarcadores sanguíneos candidatos para detectar animales con lesiones focales, multifocales y difusas (n = 155) y se comparó con el de los métodos de diagnóstico PTB convencionales (ELISA IDEXX y reacción en cadena de la polimerasa (PCR) en tiempo real (PCR) y cultivo bacteriológico en heces y tejidos) (36). Los resultados indicaron que los ELISA basados en biomarcadores mostraron consistentemente valores de sensibilidad más altos que los métodos de diagnóstico inmunológico y microbiológico convencionales. El ELISA basado en ABCA13 tuvo el mejor rendimiento diagnóstico para la detección global de animales con cualquier tipo de lesiones (69,41% de sensibilidad frente a 28,41%, 11,36% y 25% del ELISA IDEXX, cultivo fecal y PCR fecal, respectivamente) mejorando la detección global de animales con lesiones histológicas específicas de PTB. Lo más importante es que el ELISA basado en ABCA13 mostró el rendimiento diagnóstico más preciso para la detección de animales con lesiones focales, la forma patológica más frecuente en las etapas subclínicas de la enfermedad, con una sensibilidad del 79,25% frente a la de las sensibilidades del 14,55%, 5,45% y 9,09% del ELISA IDEXX, cultivo fecal y PCR fecal, respectivamente. El ELISA basado en MMP8 mostró la mayor precisión diagnóstica para la detección global de animales con lesiones multifocales y difusas con una sensibilidad del 96,97% frente a el 54,44%, 51,51% y 21,21% del ELISA IDEXX, cultivo fecal y PCR fecal, respectivamente.
Las proteínas de casete de unión a ATP son una superfamilia de proteínas transportadoras que desempeñan importantes funciones fisiológicas en los organismos vivos y son vitales para la función cerebral normal (37-39). A través del acoplamiento de la energía de la hidrólisis de ATP, translocan solutos como lípidos, iones, péptidos y xenobióticos a través de membranas biológicas (38, 40), pero también intervienen en una amplia variedad de otros procesos como la transducción de señales, la secreción de proteínas, la resistencia a medicamentos y antibióticos, la presentación de antígenos y la patogénesis y esporulación bacteriana (41). Dentro de esta superfamilia de proteínas, existe la subfamilia ABCA, funcionalmente caracterizada por transportar moléculas lipídicas a través de las membranas celulares (42). La interrupción de la actividad del transportador ABC resulta en la acumulación de lípidos y un nivel elevado de citoquinas inflamatorias en el tejido pulmonar (43). Uno de los genes más polimórficos de esta subfamilia es ABCA13, con 165 alteraciones descritas (44). ABCA13 se expresa en varios tejidos humanos y está involucrado en varios procesos patológicos y fisiológicos en el cuerpo humano (45). Por lo tanto, se ha asociado con trastornos neurológicos como el trastorno depresivo mayor (46), la demencia con cuerpos de Lewy (47), la esquizofrenia y el trastorno bipolar (48) y el trastorno del espectro autista (49, 50). Por el contrario, ABCA13 también se ha relacionado con el cáncer, a veces asociado con un mal pronóstico (51-55) y en otras ocasiones con una supervivencia más larga del paciente (56, 57). ABCA13 también se considera un marcador útil para predecir la metástasis de los ganglios linfáticos en pacientes con cáncer gástrico resecado en la etapa temprana (54). Entre sus vías relacionadas se encuentran la fosforilación mediada por CDK y la eliminación de Cdc6 y el sistema inmune innato. Las anotaciones de Gene Ontology (GO) relacionadas con este gen incluyen la actividad de la ATPasa y la actividad del transportador de colesterol. En bovinos, el gen ABCA13 se ha relacionado con la osteogénesis imperfecta, atribuyéndose el origen de esta enfermedad a los efectos aditivos de este gen con QRFPR e IFIM5 (58).
Las metaloproteinasas de matriz (MMP) son enzimas dependientes de metales que degradan componentes de la matriz extracelular y otros componentes como receptores, factores de crecimiento, citoquinas y quimiocinas (59-61) y que también desempeñan un papel importante como reguladores efectivos de la proliferación y diferenciación celular, la homeostasis tisular y la respuesta inmune (62) a través de la transducción de señales en la señalización de las células inmunes (63). Algunas MMP están relacionadas con la progresión del cáncer, la metástasis y la invasión (64, 65) a través de la inducción de cambios durante la transición epitelial-mesenquimal en el microambiente tumoral (66). La familia MMPs incluye colagenasas, gelatinasas, estromelisinas, MMPs de tipo membrana (MT-MMPs), matrilisinas y varias otras MMPs (67), cuya actividad está estrechamente regulada por una familia de inhibidores endógenos denominados inhibidores tisulares de metaloproteinasas (TIMPs) (68). Se han identificado veintiocho formas de MMP en vertebrados y 24 en humanos (69). Entre ellas, la metaloproteinasa 8 (MMP8) o metaloproteinasa neutrófila, enzima liberada por neutrófilos y por otras células del linaje no polimorfonuclear como fibroblastos gingivales, células óseas y plasmáticas (70) y que descompone colágeno tipo I, II, III, V, VII, VIII y X, gelatina, agrecano, elastina, fibronectina, laminina y nidogen (71) que desempeña un papel importante en la proliferación celular, la migración y la angiogénesis a través del desarrollo de estructuras de red similares a capilares (72). MMP8 está involucrado en la supervivencia y morbilidad tumoral ya que su expresión se ha asociado con efectos proinflamatorios y antiinflamatorios en diferentes tipos de microambientes tumorales (73). Así, a veces se relaciona con un peor resultado de ciertos cánceres (72, 74-76) aunque algunos autores defienden su papel protector (77). Existe evidencia que sugiere que Map puede inducir la expresión de MMPs, que son las principales proteasas en la patogénesis de la enfermedad inflamatoria intestinal (78). Los TIMSP se han sugerido como biomarcadores potenciales para la tuberculosis (TB). Los TIMPs-1,−2 y−3 facilitan la remodelación y reparación del tejido después de la destrucción por MMPs. Por ejemplo, se ha demostrado que la concentración de MMP8 disminuye rápidamente durante el tratamiento de la TB (79). Se sabe que MMP9 y TIMP1 están regulados al alza en la infección de TB y se han propuesto como biomarcadores para el diagnóstico de TB (80).
Se seleccionaron dos biomarcadores candidatos, ABCA13 y MMP8, para su posterior validación, en función de los resultados obtenidos en el análisis RNA-SEQ (35) y en el estudio previo a la validación (36). El objetivo del presente estudio fue llevar a cabo una validación robusta del potencial diagnóstico de ELISAs basada en la detección de ABCA13 y MMP8, utilizando muestras de suero de referencia de animales bien caracterizados, clasificados según las diferentes formas patológicas asociadas con la infección MAP [focal (n = 447), multifocal (n = 59) y difusa (n = 60)], y animales control de granjas libres de PTB (n = 138).
Materiales y métodos
Animales y muestras
Un total de 704 vacas Holstein-Friesian, con una edad promedio de 5,2 años que oscila entre 0,5 y 13,4, fueron incluidas en este estudio. El grupo de referencia positivo consistió en 566 vacas de 8 regiones diferentes de España (País Vasco, Cataluña, Navarra, Aragón, Cantabria, Castilla y León, La Rioja y Asturias) sacrificadas comercialmente en cinco mataderos ubicados en el País Vasco y Asturias (23, 36, 81). El grupo de referencia negativo consistió en 138 vacas vivas de 4 explotaciones libres de PTB de Asturias.
Se recogieron muestras de sangre y heces de todos los animales, mientras que las muestras de tejido (válvula ileocecal, íleon caudal y ganglios linfáticos yeyunales e ileales caudales) solo se tomaron de los animales sacrificados, in situ después de la evisceración, ya sea en los mataderos asturianos o en la sala de necropsias de NEIKER. Las muestras de tejido se dividieron para análisis molecular, microbiológico e histopatológico.
Además, para evaluar la especificidad analítica del ELISA basado en ABCA13 en relación con otras infecciones micobacterianas, se utilizaron dos conjuntos de muestras de animales infectados con Mycobacterium bovis, el agente etiológico causante de la TB. Un conjunto bovino consistió en 30 muestras de vacas infectadas experimentalmente, 10 sueros recolectados a las 8 y 12 semanas después de la infección y 20 muestras de plasma tomadas a las 16 semanas después de la infección. El otro conjunto consistió en 27 sueros de vacas infectadas naturalmente, ambas con un resultado positivo en la prueba comparativa de tuberculina intradérmica y un resultado negativo en el ELISA IDEXX para la detección de anticuerpos específicos de Map.
Evaluación del estado de infección del mapa de animales de referencia positivos y negativos
Las muestras de tejido de animales de referencia positivos se procesaron como se describe en (36) y se clasificaron según el tipo y la extensión de las lesiones histológicas presentes en sus tejidos intestinales y ganglios linfáticos asociados en tres grupos según González et al. (21) (ver Figura complementaria 1): focal (n = 447, 78.98%), multifocal (n = 59, 10.42%) y difusa (n = 60, 10,60%). El estado de infección del mapa de estos 566 animales de referencia positivos se caracterizó aún más (Tabla 1) mediante serología (prueba IDEXX Map Ab – IDEXX, Montpellier, Francia), aislamiento bacteriológico y PCR en tiempo real de tejidos y heces (en algunos casos), siguiendo los procedimientos descritos previamente (23, 36). El porcentaje de animales positivos por una o más técnicas de diagnóstico aumentó en paralelo con la gravedad de las lesiones. Así, el porcentaje de animales positivos para al menos una de las técnicas en los grupos focal, multifocal y difuso fue de 31,99%, 88,14% y 100%, respectivamente. Más concretamente, en el grupo de animales con lesiones focales, el 3,36 % fueron positivos por IDEXX ELISA sérico y 15,51, y el 16,85 % fueron positivos por cultivo fecal y PCR en tiempo real, respectivamente. En el grupo de animales con lesiones multifocales, el 30,51 % fueron positivos por IDEXX ELISA sérico y el 50,85 % y el 59,32 % fueron positivos por cultivo fecal y PCR en tiempo real, respectivamente. En el grupo difuso, el 86,67% de los animales fueron positivos por ELISA sérico y el 85 y el 90% fueron positivos por cultivo fecal y PCR en tiempo real, respectivamente. Del mismo modo, el porcentaje de animales positivos por todas las técnicas diagnósticas aumentó a medida que pasamos del grupo focal al difuso, siendo del 0,89%, 8,0% y 13,64% para el grupo focal, multifocal y difuso, respectivamente. El estado libre de PTB de los animales de referencia negativos de granjas sin antecedentes de enfermedad clínica se verificó anualmente mediante resultados séricos de ELISA IDEXX repetidamente negativos durante un período de 3 a 5 años, dependiendo de la granja específica (2016-2021). En una de las granjas, el estado libre de PTB (n = 61) también se confirmó mediante PCR fecal en tiempo real y aislamiento bacteriano.
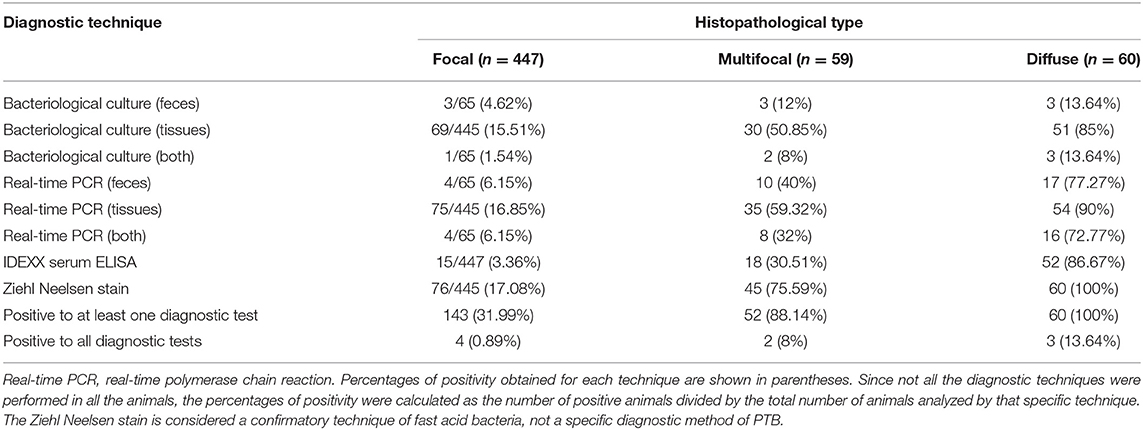 TABLA 1. Mycobacterium avium subespecie paratuberculosis (Map)-estado infeccioso de los 566 animales infectados según la clasificación histopatológica de referencia (21).
TABLA 1. Mycobacterium avium subespecie paratuberculosis (Map)-estado infeccioso de los 566 animales infectados según la clasificación histopatológica de referencia (21).
Ensayo inmunoabsorbente ligado a enzimas (ELISA) para la detección de biomarcadores
La concentración sérica de ABCA13 y MMP8 se midió utilizando ensayos inmunoabsorbentes ligados a enzimas (ELISA) disponibles comercialmente de acuerdo con las instrucciones del fabricante (MyBioSource, San Diego, CA. EUA). Se utilizaron el kit ELISA del miembro 13 de la subfamilia de casetes de unión a ATP bovino A (rango de detección 1–5,000 pg/mL) y la metaloproteinasa 8 de matriz bovina (rango de detección 3.12–100 ng/mL) para la detección específica de biomarcadores bovinos ABCA13 y MMP8, respectivamente. Según el fabricante, se utilizó una curva estándar para determinar la concentración de estos biomarcadores en las muestras de suero. Una ecuación MMF de 4 parámetros proporcionó el mejor ajuste entre la densidad óptica (OD) promedio de Define de cada dilución estándar y su concentración. Los patrones y los espacios en blanco se probaron por duplicado, pero se utilizó un solo pocillo con muestras de prueba. El valor medio del control en blanco se restó de los valores brutos de DO antes de la interpretación del resultado. La concentración de ABCA13 y MMP8 en cada muestra se interpoló a partir de la curva estándar.
Análisis estadístico
Los datos obtenidos de la cuantificación de ELISA se analizaron utilizando los paquetes pROC y Optimal Cutpoints del entorno estadístico del programa R versión 3.6.0 (http://www.Rproject.org/), con intervalos de confianza (IC) establecidos en 95% para los resultados finales. El área bajo la curva (AUC) y el valor de corte óptimo para cada grupo se determinaron individualmente mediante el análisis de la curva característica del operador receptor (ROC). Los valores de corte óptimos para la sensibilidad y la especificidad se basaron en el índice máximo de Youden (J = Se + Sp-1). El poder discriminatorio de este ABCA13 basado en ELISA para discernir entre los diferentes grupos histopatológicos y el grupo control fue considerado de la siguiente manera: se consideró que los valores de AUC ≥0,9 tenían un excelente poder discriminatorio; 0,8 ≤ AUC <0,9 buen poder discriminatorio; 0,7 ≤ AUC <0,8 poder discriminatorio justo; y AUC <0,7 pobres discriminatorios (78, 82).
El modelo desarrollado por Juste y Casal (83) se alimentó con la sensibilidad y especificidad de los diferentes métodos de prueba utilizados en este estudio con el fin de comparar su desempeño para el control de PTB en circunstancias epidemiológicas definidas.
Resultados
Rendimiento diagnóstico de los ELISA basados en biomarcadores ABCA13 y MMP8
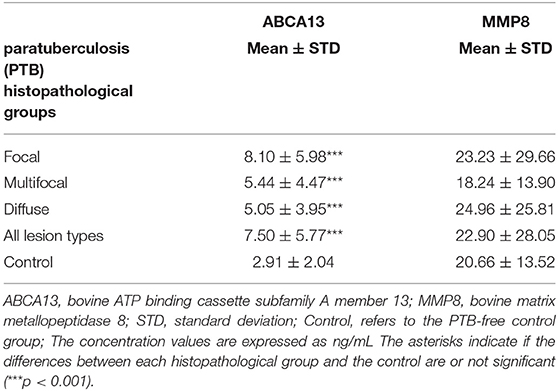
El rendimiento diagnóstico de los ELISA basados en ABCA13 se investigó mediante el análisis ROC de las concentraciones de biomarcadores utilizando un total de 704 muestras de suero y plasma, incluidas 447 de animales focales, 59 de multifocales, 60 de difusos y 138 sueros de animales control (granjas libres de PTB). El análisis ROC del ELISA basado en MMP8 se realizó utilizando 698 muestras, 442 fueron de animales con lesiones focales, 58 con multifocales, 60 con difusas y 138 con controles negativos (6 sueros solo fueron analizados por el ELISA basado en ABCA13 ya que no teníamos suficiente volumen para realizar ambos ELISA). Las concentraciones individuales de ABCA13 y MMP8 en el suero de cada vaca se muestran en la Figura 1 y los valores medios de las concentraciones de biomarcadores ABCA13 y MMP8 para cada grupo se muestran en la Tabla 2. Los valores de AUC, los puntos de corte óptimos, las especificidades y sensibilidades de cada ELISA se estimaron mediante análisis ROC para cada forma histopatológica individualmente, así como para todas las formas histopatológicas a nivel mundial (Tabla 3). Las curvas ROC correspondientes a los ELISA basados en ABCA13 y MMP8 para los diferentes grupos histopatológicos en comparación con el grupo control libre de PTB se muestran en las Figuras 2, 3, respectivamente.
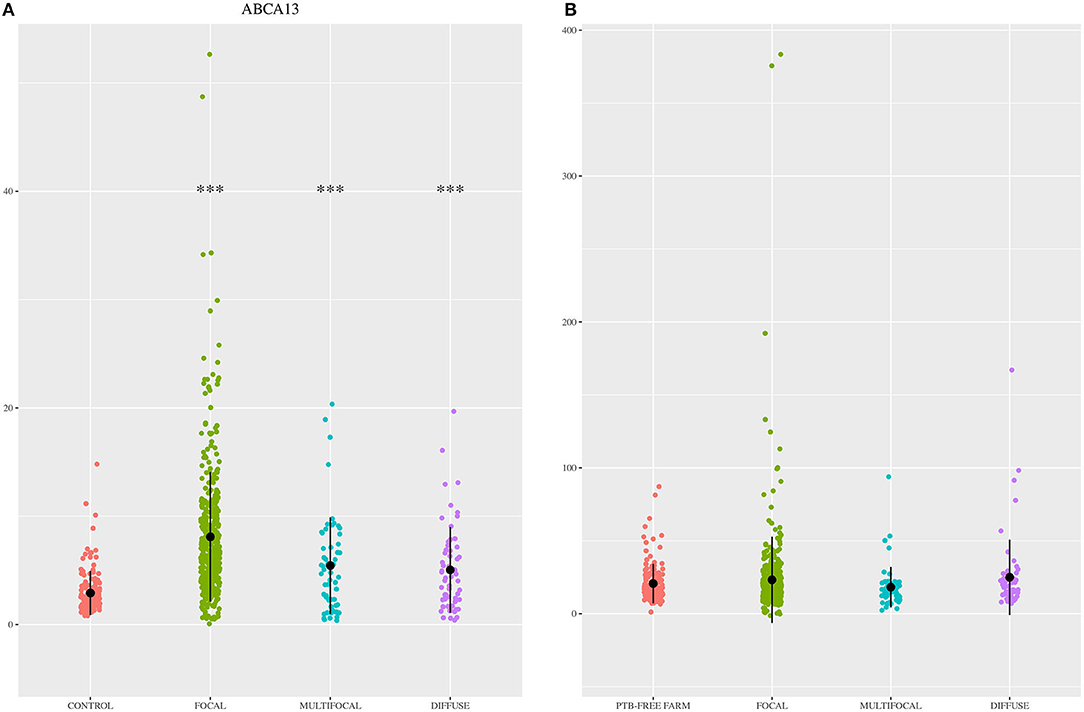 FIGURA 1. Niveles de expresión de ABCA13 y MMP8 en los 704 animales incluidos en el estudio. (A) Niveles de expresión de ABCA13 en sueros de bovinos Holstein Frisian que muestran diferentes tipos de lesiones histológicas compatibles con paratuberculosis (PTB) en sus tejidos intestinales [focal (n = 447), multifocal (n = 59) y difusa (n = 60)] y animales control de granjas libres de PTB (n = 138). (B) niveles de expresión de MMP8 en suero de bovinos Holstein Frisian que muestran diferentes tipos de lesiones histológicas compatibles con PTB en sus tejidos intestinales [focal (n = 442), multifocal (n = 58) y difusa (n = 60)] y animales control de granjas libres de PTB (n = 138). Los biomarcadores se cuantificaron mediante ELISA específicos suministrados por MyBioSource, San Diego, CA, EUA; ABCA13, miembro A de la subfamilia A del casete de unión al ATP bovino; MMP13: metalopeptidasa de matriz bovina 8. Los datos se representan como diagramas de dispersión con cada punto representando un solo animal. La media de cada grupo histopatológico está representada por un punto negro bruto y la desviación estándar por una línea vertical. Los asteriscos indican si las diferencias entre cada grupo histopatológico y el control son o no significativas (***p < 8,0).
FIGURA 1. Niveles de expresión de ABCA13 y MMP8 en los 704 animales incluidos en el estudio. (A) Niveles de expresión de ABCA13 en sueros de bovinos Holstein Frisian que muestran diferentes tipos de lesiones histológicas compatibles con paratuberculosis (PTB) en sus tejidos intestinales [focal (n = 447), multifocal (n = 59) y difusa (n = 60)] y animales control de granjas libres de PTB (n = 138). (B) niveles de expresión de MMP8 en suero de bovinos Holstein Frisian que muestran diferentes tipos de lesiones histológicas compatibles con PTB en sus tejidos intestinales [focal (n = 442), multifocal (n = 58) y difusa (n = 60)] y animales control de granjas libres de PTB (n = 138). Los biomarcadores se cuantificaron mediante ELISA específicos suministrados por MyBioSource, San Diego, CA, EUA; ABCA13, miembro A de la subfamilia A del casete de unión al ATP bovino; MMP13: metalopeptidasa de matriz bovina 8. Los datos se representan como diagramas de dispersión con cada punto representando un solo animal. La media de cada grupo histopatológico está representada por un punto negro bruto y la desviación estándar por una línea vertical. Los asteriscos indican si las diferencias entre cada grupo histopatológico y el control son o no significativas (***p < 8,0).
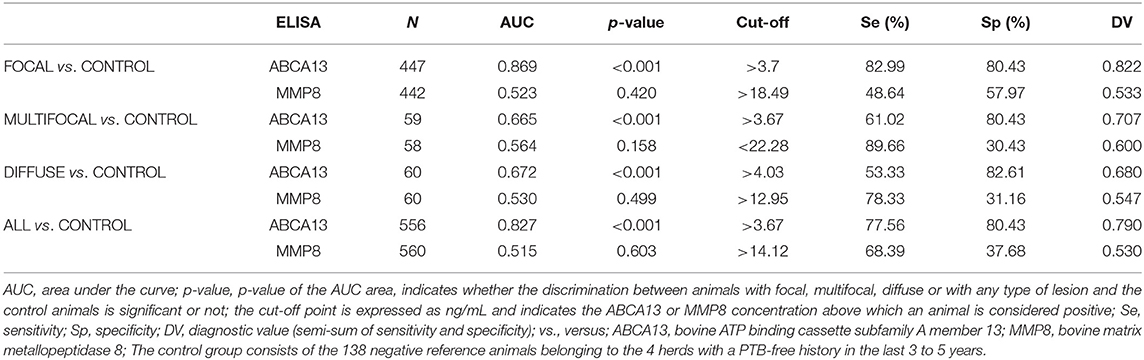 TABLA 3. Rendimiento diagnóstico de los ELISAs basados en ABCA13 y MMP8 para la detección de animales con diferentes tipos de lesiones histológicas de PTB.
TABLA 3. Rendimiento diagnóstico de los ELISAs basados en ABCA13 y MMP8 para la detección de animales con diferentes tipos de lesiones histológicas de PTB.
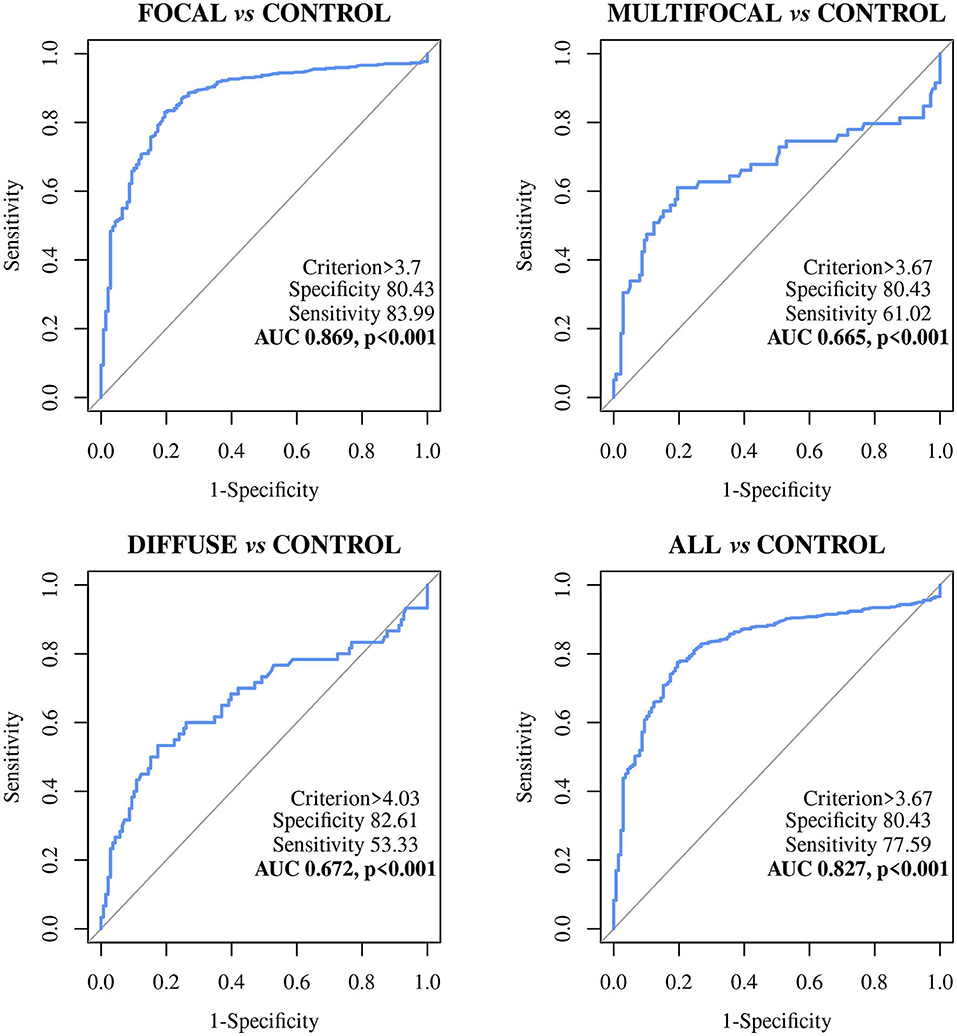 FIGURA 2. Curvas características del operador receptor (curvas ROC) del ELISA basado en biomarcadores ABCA13 en vacas Holstein Frisonian con lesiones histológicas difusas (n = 447), multifocales (n = 59) y cualquier tipo de lesiones paratuberculosas (PTB) (n = 60) vs. animales de control de granjas libres de PTB (n = 566); Todos, incluye todos los animales con lesiones focales, multifocales y difusas; ABCA138, cofre de unión de ATP bovino subfamilia A miembro 13.
FIGURA 2. Curvas características del operador receptor (curvas ROC) del ELISA basado en biomarcadores ABCA13 en vacas Holstein Frisonian con lesiones histológicas difusas (n = 447), multifocales (n = 59) y cualquier tipo de lesiones paratuberculosas (PTB) (n = 60) vs. animales de control de granjas libres de PTB (n = 566); Todos, incluye todos los animales con lesiones focales, multifocales y difusas; ABCA138, cofre de unión de ATP bovino subfamilia A miembro 13.
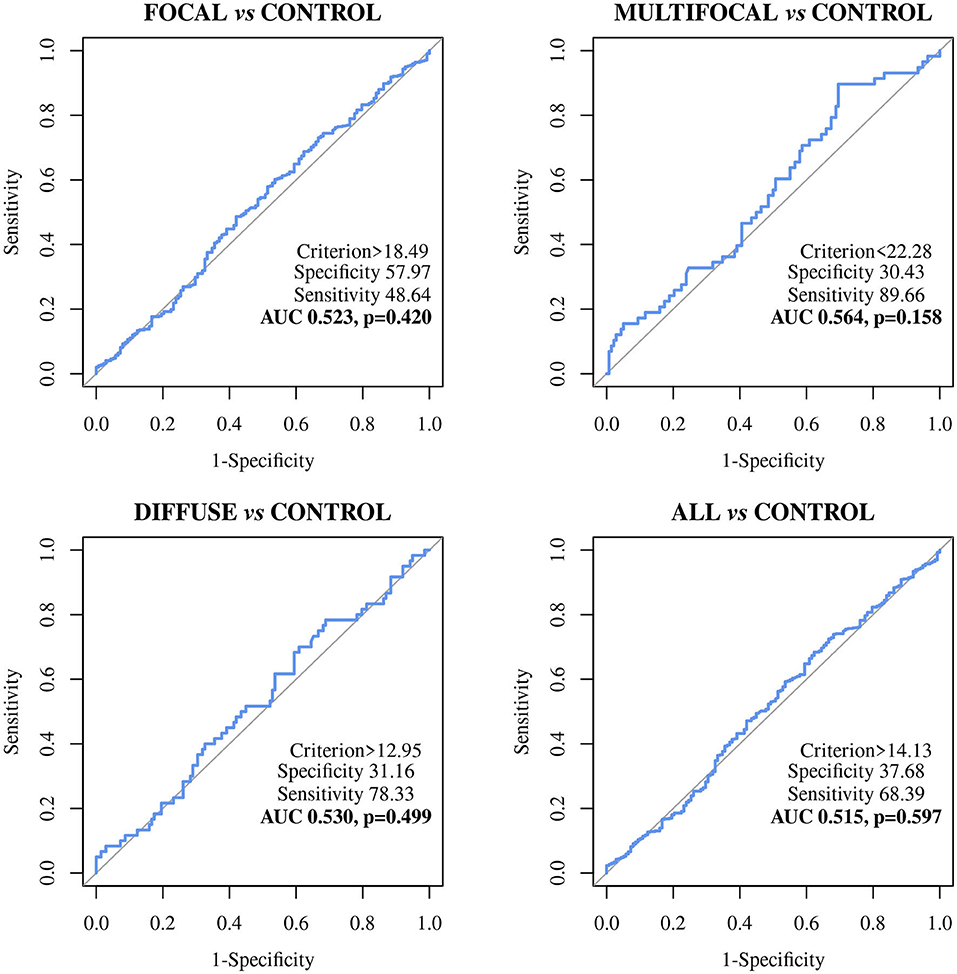 FIGURA 3. Curvas características del operador receptor (curvas ROC) del ELISA basado en biomarcadores MMP8 en vacas Holstein Frisian con lesiones focales (n = 442), multifocales (n = 58), difusas (n = 60) y cualquier tipo de lesiones (n = 560) vs. animales de control de granjas libres de PTB (n = 138); Todos, incluye todos los animales con lesiones focales, multifocales y difusas; MMP8: metalopeptidasa de matriz bovina 8.
FIGURA 3. Curvas características del operador receptor (curvas ROC) del ELISA basado en biomarcadores MMP8 en vacas Holstein Frisian con lesiones focales (n = 442), multifocales (n = 58), difusas (n = 60) y cualquier tipo de lesiones (n = 560) vs. animales de control de granjas libres de PTB (n = 138); Todos, incluye todos los animales con lesiones focales, multifocales y difusas; MMP8: metalopeptidasa de matriz bovina 8.
El ELISA basado en la detección del biomarcador ABCA13 mostró un buen poder discriminatorio (0,8 < AUC <0,9) entre animales con lesiones focales y animales control con un valor de AUC de 0,869 [(0,836-0,903, IC 95%), P < 0,001], una sensibilidad del 82,99% y una especificidad del 80,43%. Sin embargo, su poder discriminatorio entre los animales con lesiones multifocales o difusas y los animales control fue pobre (AUC <0,7). Sin embargo, a la hora de diferenciar entre animales con cualquier tipo de lesión y animales control, el ELISA basado en ABCA13 mostró un buen poder discriminatorio con un AUC de 0,827 (0,792-0,862, IC 95%), p < 0,001), una sensibilidad del 77,56% y una especificidad del 80,43%. La detección global mejora como consecuencia del buen comportamiento del ELISA para la detección de animales con lesiones focales, que son más numerosas en el análisis del grupo incluyendo todos los tipos de lesiones.
El ELISA basado en MMP8 mostró un poder discriminatorio pobre entre los diferentes grupos histopatológicos y los animales control. Los valores de AUC fueron de <0,7 en todos los casos (Tabla 3) con sensibilidades que variaron de 48,64% a 89,66%, las especificidades de 26,09% a 57,97% y los valores diagnósticos de 0,530 a 0,6.
Comparación del rendimiento diagnóstico del ELISA basado en ABCA13 con el de otros métodos convencionales
Dado el buen poder discriminatorio del ELISA basado en ABCA13, su rendimiento diagnóstico se comparó con el de otros métodos diagnósticos convencionales de PTB (ELISA IDEXX para la detección sérica de anticuerpos específicos de Map, PCR y cultivo bacteriológico de heces y tejidos) y la tinción de Ziehl-Neelsen (ver Tabla 4). El ELISA basado en MMP8 no se comparó con los métodos convencionales debido a su bajo rendimiento diagnóstico. El ELISA basado en ABCA13 mostró un valor diagnóstico (semisuma de sensibilidad y especificidad) más alto (0,822) que el ELISA IDEXX (0,517), el cultivo bacteriológico fecal (0,523) y la PCR en tiempo real (0,531) para la detección de animales con lesiones focales. Del mismo modo, este ELISA basado en biomarcadores tuvo el mejor valor diagnóstico para la detección de animales con lesiones multifocales (0,707) y para la detección global de animales con cualquier tipo de lesiones (0,790) en comparación con las técnicas mencionadas anteriormente. Sin embargo, cuando se trata de la detección de animales con lesiones difusas el método que presentó el mejor valor diagnóstico fue el ELISA IDEXX convencional (0,933). El uso combinado del ELISA basado en ABCA13 y el ELISA IDEXX aumentaría la sensibilidad del 77,66% al 83,03%, ya que el ELISA IDEXX detectó 31 animales (3 focales, 4 multifocales y 24 difusos) que no fueron detectados por el ELISA ABCA13. En cuanto a la especificidad, el rendimiento del ELISA IDEXX fue mejor. El ELISA ABCA13 detectó 27 animales control como positivos (80,43% de especificidad), mientras que el ELISA IDEXX detectó los 138 animales control negativos como negativos (100% de especificidad).
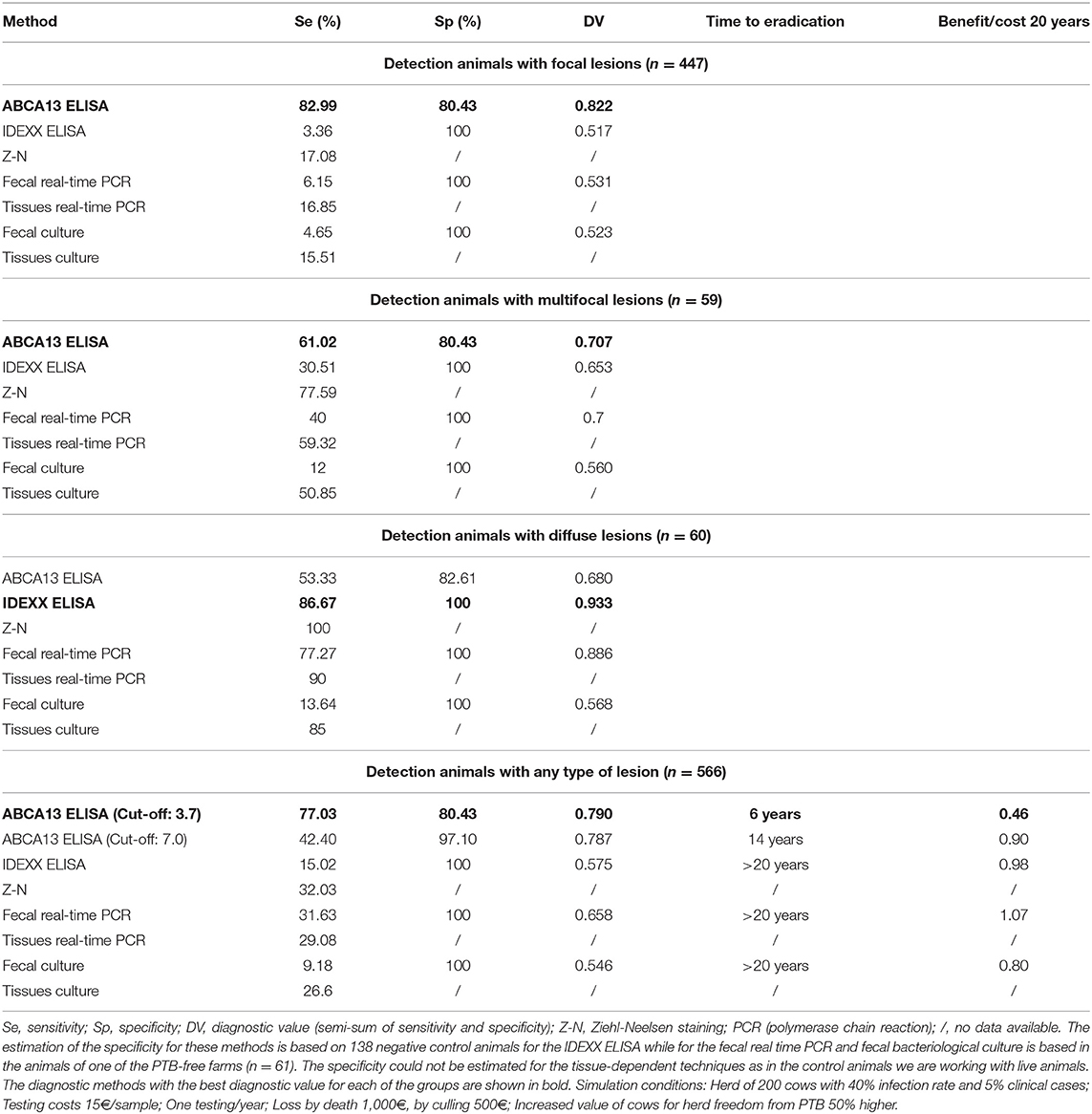 TABLA 4. Comparación del rendimiento diagnóstico del ELISA basado en ABCA13 con el de otros métodos diagnósticos convencionales de paratuberculosis (PTB).
TABLA 4. Comparación del rendimiento diagnóstico del ELISA basado en ABCA13 con el de otros métodos diagnósticos convencionales de paratuberculosis (PTB).
Además, se comparó el rendimiento de cada prueba diagnóstica en un estudio de simulación dinámica de 20 años de incidencia clínica de PTB de bajo nivel en una explotación ganadera de 200 cabezas (Tabla 4) con el modelo de Juste & Casal (83). Se puede observar que el uso del valor de corte óptimo del ELISA ABCA13 (3,67 ng/mL) con el mayor valor diagnóstico permitiría un avance en la erradicación de la infección a 6 años desde el inicio del programa (reducción del >70%) con solo una disminución del 54% en la relación beneficio/costo (0,45 vs. 0,98) en comparación con el ELISA de anticuerpos. Utilizando un valor de corte más conservador de 7 ng/mL (obtenido como valor medio del grupo control negativo + 2 desviaciones estándar (84), caracterizado por una sensibilidad del 42,40% y una mayor especificidad del 97,1%), sería posible erradicar la infección en 14 años (reducción del >30%) con una relación beneficio/coste 8% menor (0,90).
Evaluación de la reactividad cruzada del ELISA basado en ABCA13 con sueros de animales infectados por Mycobacterium bovis
La reactividad cruzada del ELISA basado en ABCA-13 se evaluó utilizando muestras de suero y plasma de vacas infectadas experimentalmente (n = 30) con M. bovis y casos naturales confirmados detectados en el programa nacional de erradicación de la tuberculosis bovina (n = 27). No se detectó reactividad cruzada con muestras de sueros y plasma de animales infectados experimentalmente (30 de 30 muestras fueron negativas), sin embargo, el ELISA basado en ABCA13 mostró algún grado de reactividad cruzada con sueros de casos naturales (7 muestras de 27 reaccionaron de forma cruzada con ABCA13, 25,92%).
Discusión
Los objetivos de los programas de control de PTB varían desde la erradicación en áreas de baja prevalencia, hasta el control en áreas con alta prevalencia y el aumento de la vigilancia en áreas sin antecedentes de enfermedad (85). La detección temprana de infecciones subclínicas MAP es crítica para el control de PTB; Sin embargo, las herramientas de diagnóstico actuales tienen bajas sensibilidades para la detección de animales infectados subclínicamente. Los biomarcadores del huésped pueden proporcionar herramientas de diagnóstico mejoradas para PTB aumentando la efectividad de los programas de control. En el presente estudio, realizamos una validación robusta de ELISA basada en la detección de dos biomarcadores candidatos utilizando una gran colección de muestras de suero (n = 704) de animales de referencia positivos y negativos. La evaluación de estos dos biomarcadores mostró el potencial de uno de ellos, el ABCA13, para la detección de la mayoría de las formas histopatológicas de PTB bovino, mientras que el otro, el MMP8, fue descartado debido a su baja sensibilidad. Los animales, estudiados al final de su vida productiva, se clasificaron inicialmente de acuerdo con las diferentes formas patológicas asociadas con la infección por Map (lesiones no infectadas, focales, multifocales y difusas), evitando así la alta tasa de resultados falsos negativos arrojados por los métodos inmunológicos y microbiológicos de referencia más utilizados. La deficiencia inesperada de la caracterización patológica fue el bajo número de animales negativos no infectados encontrados entre estos animales. Esto llevó a la búsqueda de un conjunto de sueros negativos de referencia caracterizados por otros métodos, más fáciles de implementar. Esto se hizo revisando los registros de pruebas serológicas de PTB de granjas asturianas que participaron voluntariamente en un programa de salud animal. Finalmente, se recogió un número razonable de granjas con entre 3 y 5 años de seguimiento negativo de todo el rebaño como el mayor número de muestras negativas disponibles. Estos criterios no fueron tan rigurosos como el examen histopatológico, pero a través de resultados negativos repetidos de toda la manada, y la ausencia de casos clínicos, proporcionaron la aproximación más cercana que permite una estimación de la especificidad en condiciones naturales.
El ELISA basado en MMP8 tenía un poder discriminatorio pobre (valores de AUC <0,7) entre los diferentes grupos histopatológicos y los animales control (AUC que variaban de 0,515 a 0,564), lo que lo convierte en un mal candidato para su uso como biomarcador diagnóstico de PTB. El porcentaje de positividad detectado por el ELISA basado en MMP8 y los niveles séricos de esta proteína variaron solo ligeramente entre los diferentes grupos histopatológicos (Figura 1 y Tabla 2), y no se detectaron diferencias significativas en los niveles séricos entre los diferentes grupos histológicos y el control. Estos resultados estaban en desacuerdo con los encontrados en el análisis RNA-Seq (35) y el estudio previo a la validación (36) que subyacen al hecho de que las correlaciones entre la expresión de ARN y los niveles de proteínas no siempre son fuertes (86) y la importancia del estudio actual, basado en el análisis de un gran número de muestras, para verificar el potencial de los nuevos biomarcadores putativos.
El ELISA ABCA13 tuvo un buen poder discriminatorio (0,8 ≤ AUC <0,9, p < 0,001) entre los animales con lesiones focales, los animales con cualquier tipo de lesión y los animales control de granjas libres de PTB. Además, el ELISA basado en ABCA13 tuvo sensibilidades y valores diagnósticos más altos que el ELISA IDEXX y el aislamiento bacteriológico fecal y tisular y la PCR en tiempo real para la detección de animales con lesiones focales, multifocales y aquellos con cualquier tipo de lesión. Más concretamente, el ELISA basado en la detección de ABCA13 tuvo el mejor rendimiento diagnóstico para la detección de animales con lesiones focales y para la detección global de animales con cualquier tipo de lesiones, siendo capaz de detectar el 83,99 y el 77,59% de estos animales, respectivamente. Sin embargo, el ELISA IDEXX, la PCR fecal y el cultivo fecal solo detectaron el 3,36%, 6,15% y 4,65% de los animales con lesiones focales y el 15,02, 31,63 y 9,18% de los animales con cualquier tipo de lesión, respectivamente. Los valores de especificidad de ELISA basados en ABCA13 oscilaron entre 80,43 y 82,61%, sin embargo, el ELISA IDEXX, la PCR fecal y el cultivo bacteriológico fecal tuvieron mejor especificidad (100%). Estos valores relativamente bajos de especificidad, así como la alta tasa de positivos en los casos naturales de TB, indican que la alta sensibilidad de este ELISA podría ser contrarrestada por algún grado de reactividad inespecífica debido a causas distintas del PTB. Sin embargo, no puede descartarse que este menor rendimiento de especificidad pueda deberse a la existencia de animales infectados en las explotaciones libres de PTB que no han sido reconocidos debido a la baja sensibilidad de los criterios de referencia (ELISA IDEXX) (87) utilizados para determinar el estado infeccioso de PTB de los animales control negativos. Cabe señalar que estos valores de sensibilidad y especificidad corresponden al valor de corte óptimo estimado por el análisis ROC. Sin embargo, la naturaleza cuantitativa del protocolo aquí reportado se convierte en una fortaleza, ya que podría adaptarse a cada circunstancia epidemiológica y económica específica. Por ejemplo, simplemente elevando el límite a 7,0 ng/ml (la concentración superior de 99,5% ABCA13 del grupo de control negativo), la especificidad puede llegar a ser del 97,10%, manteniendo una sensibilidad del 42,40% que es más del doble que la del anticuerpo IDEXX ELISA (Tabla 4). El estudio de simulación mostró que el aumento de la sensibilidad del ELISA ABCA13 podría mejorar en gran medida las posibilidades de alcanzar la erradicación de PTB en un período de tiempo razonable. Aunque el beneficio/coste seguiría siendo negativo y, por lo tanto, menos atractivo que la vacunación (83), este método proporcionaría una nueva alternativa a los agricultores o gestores de sanidad animal para controlar rápidamente cualquier brote de PTB.
El estudio de la reactividad cruzada del ELISA basado en ABCA13 con sueros de vacas M. bovis infectadas experimental y naturalmente mostró que los animales jóvenes infectados experimentalmente con un fondo negativo no reaccionan de forma cruzada. Sin embargo, el 25,92% de los animales infectados naturalmente lo hicieron. Esta reactividad cruzada se debe a la historia incontrolada de estos animales en los que no se puede descartar la exposición a otras micobacterias. Además, también es posible que los animales incluidos en este grupo, que son negativos por IDEXX ELISA, no se detecten como positivos para PTB debido a la baja sensibilidad del IDEXX ELISA para detectar animales con lesiones focales. Se realizarán más estudios para evaluar posibles reacciones cruzadas con otras micobacterias o patógenos.
El porcentaje de animales positivos en el ELISA basado en ABCA13 varió entre las diferentes formas patológicas. El porcentaje de animales con resultado positivo de ABCA13 fue mayor en los animales con lesiones focales, seguidos de los animales con lesiones multifocales y difusas (83,99%, 61,02% y 53,33%, respectivamente). Asimismo, los niveles medios de expresión individuales de ABCA13 en los grupos focal, multifocal y difuso fueron significativamente mayores que en el grupo control (ver Figura 1, Tabla 2). Este patrón de expresión a través de formas patológicas fue similar al observado para la intelectina 2 (ITLN2) en la válvula ileocecal (ICV) en un estudio publicado recientemente (81). Estos hallazgos validaron nuestro estudio inicial donde los resultados de RNA-seq mostraron que los genes ABCA13 e ITLN2 estaban sobreexpresados en sangre periférica (cambio log2 fold = 3.7) e ICV (log2 fold change 10.6) de animales con lesiones focales en comparación con animales control sin lesiones (35). De hecho, los genes precursores de ABCA13 e ITLN2, fueron los genes más sobreexpresados en sangre periférica e ICV de animales con lesiones focales, respectivamente.
Como hemos mencionado anteriormente, el objetivo de este estudio fue llevar a cabo una validación a gran escala del ELISA basado en ABCA13 (n = 704) para confirmar el potencial de ABCA13 como biomarcador diagnóstico. Los animales con lesiones focales muy a menudo pasan desapercibidos en las granjas infectadas debido a la baja sensibilidad de los métodos convencionales para detectar este grupo de animales (Tabla 4). Para ello, el ELISA basado en ABCA13 podría ser una herramienta diagnóstica útil para la detección de animales con lesiones focales, complementando así los métodos convencionales que tienen un mejor rendimiento diagnóstico en el grupo de lesiones difusas (Tabla 4).
El ELISA basado en el biomarcador ABCA13 ha demostrado ser útil para el diagnóstico global de animales con lesiones asociadas a PTB, aunque su rendimiento diagnóstico no es bueno en el caso de animales con lesiones difusas. Así, podría considerarse una nueva herramienta en el diagnóstico de infecciones MAP, ya sea individualmente, o en combinación con otros métodos diagnósticos convencionales que detectan animales con lesiones difusas con precisión como es el caso del ELISA IDEXX. Con respecto a esto, el ELISA IDEXX es muy sensible para detectar animales con lesiones difusas, lo que respalda aún más la idea de usar el ELISA basado en ABCA13 y el ELISA IDEXX en combinación, lo que aumentaría la sensibilidad del 77,66% al 83,03%, ya que el ELISA IDEXX detectó 31 animales (3 focales, 4 multifocales y 24 difusos) que no fueron detectados por el ELISA ABCA13. Los estudios futuros se centrarán en validar el ensayo en cohortes más jóvenes, ya que la detección de animales positivos o la selección de animales negativos será más útil en las primeras etapas de su vida.
Estudios similares utilizando biomarcadores, pero evaluados en un número menor de animales, han sido descritos por otros autores. Espinosa et al. (88) evaluaron los niveles séricos de haptoglobina y amiloide A sérico, dos proteínas inflamatorias de fase aguda detectadas durante el curso de la infección por PTB, en 190 animales infectados naturalmente por PTB clasificados según las diferentes formas patológicas asociadas con la infección (59 animales no infectados sin lesiones, 73 con lesiones focales, 19 con multifocales, 11 con paucibacilar difusas, y 28 con lesiones multibacilares difusas). Sus resultados reflejaron un aumento significativo en los niveles de estas proteínas en los animales infectados en comparación con el grupo control, más específicamente, en aquellos con tipos de lesiones caracterizadas por una baja carga bacteriana y con predominio de una respuesta inmune mediada por células. Los autores concluyeron que estas moléculas podrían mostrar potencial como biomarcadores putativos de infección por PTB, especialmente para la identificación de animales subclínicos que muestran formas patológicas relacionadas con la latencia o la resistencia al desarrollo de lesiones avanzadas. Park et al. (89) identificaron la alfa-2-macroglobulina (A2M) como un nuevo biomarcador prometedor que mejora la sensibilidad diagnóstica del PTB bovino. Mostraron que los niveles séricos de A2M fueron significativamente más altos en los grupos expuestos a Map (n = 20), derramadores subclínicos (n = 27), no diseminadores subclínicos (n = 50) y diseminadores clínicos (n = 18) que en el grupo de control sano (n = 11, de una granja libre de PTB, negativo por PCR fecal e IDEXX e ID Vet ELISA). A2M ELISA mostró un rendimiento diagnóstico superior (90,4 sensibilidad y 100% de especificidad) que otros biomarcadores y dos ELISA comerciales para la detección de anticuerpos anti-Map, aunque el número de animales de control sanos incluidos en el estudio para estimar la especificidad es bastante pequeño debido a la dificultad para encontrar una granja libre de PTB.
En resumen, podríamos concluir que el ELISA basado en la detección del biomarcador ABCA13 tiene potencial para su uso como una nueva herramienta diagnóstica para la detección de animales subclínicos, lo que permitiría establecer un protocolo de manejo adecuado en las granjas que, junto con medidas higiénico-sanitarias, podría ayudar a reducir la incidencia de PTB y, En última instancia, reducir la prevalencia de esta enfermedad costosa y generalizada. Como PTB tiene un largo período de incubación antes de que la enfermedad se haga evidente, el diagnóstico temprano de animales subclínicos es importante para controlar la propagación de la enfermedad. Por el contrario, podríamos descartar el uso del ELISA, basado en la detección de la proteína MMP8 como herramienta diagnóstica para la detección de la infección por Map.
Declaración de disponibilidad de datos
Los conjuntos de datos presentados en este estudio se pueden encontrar en repositorios en línea. Los nombres del repositorio / repositorios y el número (s) de acceso se pueden encontrar en: Base de datos NCBI Gene Expression Omnibus (GEO) bajo el número de acceso GSE137395.
Declaración ética
El estudio en animales fue revisado y aprobado por el Comité de Ética Animal del SERIDA y autorizado por la Consejería Regional de Agroganadería y Recursos Autóctonos del Principado de Asturias –España- (códigos de autorización PROAE 29/2015 y PROAE 66/2019). Todos los procedimientos se realizaron de acuerdo con la Directiva 2012/63/UE del Parlamento Europeo y el RD53/2013. Las muestras de sangre periférica y fecales fueron recogidas por personal capacitado y de acuerdo con las buenas prácticas veterinarias. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones del autor
RC y MA-H: conceptualización y adquisición de fondos. CB-V y NI: curación de datos. RAJ, TI y RC: análisis formal. CB-V, RAJ, JMG, AB, MC y RC: investigación. CB-V, NI, JA, PV, MC y TI: metodología. PV, AB y MQ: recursos. RAJ y TI: validación. CB-V y RC: redacción—borrador original. CB-V, MA-H, NI, PV, RAJ, JMG, AB, MC, JA, MAQ, TI y RC: escritura: revisión y edición. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Financiación
Este estudio formó parte del proyecto I+D+i (RTI2018-094192-R-C22) y fue financiado por el MCIN/AEI/10.13039/501100011033/ Ministerio de Ciencia, Innovación y Fondos Europeos de Desarrollo Regional (FEDER Una manera de hacer Europa) y por el Gobierno del Principado de Asturias, Fondos regionales PCTI 2021-2023 (GRUPIN: IDI2021-000102) cofinanciado por FEDER. Reconocemos al Instituto Nacional de Investigaciones Agropecuarias (INIA) por las becas de CB-V (Ayuda CPD2016-0142 financiada por MCIN/AEI/ 10.13039/501100011033 y FSE El FSE invierte en tu futuro) y MC.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Reconocimientos
Queremos agradecer a los Servicios Veterinarios de ASTEGA su colaboración en el trabajo de muestreo y el trabajo diario de los operadores de granjas de SÉRIDA en el cuidado y mantenimiento de los animales. Agradecemos a Kevin P. Dalton por corregir el manuscrito.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2022.816135/full#supplementary-material
Figura complementaria 1. Caracterización histológica de muestras de tejido bovino. Los animales se clasificaron según el tipo de lesiones histológicas asociadas a PTB presentes en sus tejidos intestinales y ganglios linfáticos asociados después de la tinción con hematoxilina-eosina (A-F) y Ziehl-Neelsen (G). A) Animal sin lesiones; (B) Lesión focal en ganglio linfático ileocecal. Se observan granulomas pequeños y focales (flechas) que consisten en macrófagos y linfocitos en el parche de Peyer; (C) Lesión multifocal en la válvula ileocecal. Pequeños granulomas (flechas) que consisten en macrófagos y linfocitos están presentes en la mucosa intestinal, así como células gigantes multinucleadas de Langhans (estrella) aisladas o asociadas con estos granulomas; (D) Lesión difusa paucibacilar en yeyuno distal. Enteritis granulomatosa difusa con infiltrado inflamatorio con predominio linfocitario. Se puede observar un granuloma en la mucosa intestinal (flecha) que consiste en un pequeño número de macrófagos y células gigantes multinucleadas. También se observa una célula gigante aislada (estrella); (E) Lesión difusa intermedia en yeyuno distal. El infiltrado consiste en linfocitos, células plasmáticas y un número moderado de macrófagos. Se observan granulomas (flechas); (F) Lesión difusa multibacilar en válvula ileocecal. El infiltrado consiste en macrófagos dentro de un gran número de bacilos ácido-alcohol resistentes a la tinción de Ziehl-Neelsen (G). (A-F) Bar = 100 micras y (G) Bar = 50 micras.
Referencias
1. McGregor H, Abbott KA, Whittington RJ. Efectos de la infección por Mycobacterium avium subsp. paratuberculosis en la bioquímica sérica, el peso corporal y el crecimiento de la lana en ovejas merinas: un estudio longitudinal. Pequeño Rumin Res. (2015) 125:146–53. doi: 10.1016/j.smallrumres.2015.02.004
2. Bush RD, Windsor PA, Toribio JALML. Pérdidas de ovejas adultas debido a la enfermedad de Johne ovina en 12 rebaños infectados durante un período de 3 años. Aust Vet J. (2006) 84:246–53. doi: 10.1111/j.1751-0813.2006.00001.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Benedictus G, Dijkhuizen AA, Stelwagen J. Economic losses due to paratuberculosis in milk cattle. Veterinario Rec. (1987) 121:142–6. DOI: 10.1136/VR.121.7.142
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Kudahl AB, Nielsen SS, Sørensen JT. Relación entre anticuerpos contra Mycobacterium avium subsp. paratuberculosis en leche y forma de curvas de lactancia. Pre Vet Med. (2004) 62:119–34. doi: 10.1016/j.prevetmed.2003.11.008
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Ozsvari L, Harnos A, Lang Z, Monostori A, Strain S, Fodor I. El impacto de la paratuberculosis en la producción de leche, la fertilidad y el sacrificio en grandes rebaños lecheros húngaros comerciales. Front Vet Sci. (2020) 7:565324. DOI: 10.3389/fvets.2020.565324
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Smith RL, Strawderman RL, Schukken YH, Wells SJ, Pradhan AK, Espejo LA, et al. Efecto del estado de la enfermedad de Johne en la reproducción y el sacrificio en ganado lechero. J Dairy Sci. (2010) 93:3513–24. DOI: 10.3168/JDS.2009-2742
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Tiwari A, VanLeeuwen JA, Dohoo IR, Stryhn H, Keefe GP, Haddad JP. Efectos de la seropositividad para el virus de la leucemia bovina, el virus de la diarrea viral bovina, contra la paratuberculosis de Mycobacterium avium subespecie y Neospora caninum en el sacrificio en ganado lechero en cuatro provincias canadienses. Veterinario Microbiol. (2005) 109:147–58. doi: 10.1016/j.vetmic.2005.05.011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Millar D, Ford J, Sanderson J, Withey S, Tizard M, Doran T, et al. IS900 PCR para detectar Mycobacterium paratuberculosis en suministros minoristas de leche entera pasteurizada de vaca en Inglaterra y Gales. Aplicación Environ Microbiol. (1996) 62:3446–52. doi: 10.1128/AEM.62.9.3446-3452
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Grant IR, Ball HJ, Neill SD, Rowe MT. Inactivación de Mycobacterium paratuberculosis en leche de vaca a temperaturas de pasteurización. Aplicación Environ Microbiol. (1996) 62:631–6. doi: 10.1128/AEM.62.2.631-636
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Monif GRG. Traducción de hipótesis a terapia en la enfermedad de Crohn. Inflamm Bowel Dis. (2016) 22:E8–9. doi: 10.1097/MIB.0000000000000692
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Feller M, Huwiler K, Stephan R, Altpeter E, Shang A, Furrer H, et al. against Mycobacterium avium subspecies paratuberculosis and Crohn’s disease: a systematic review and meta-analysis. Lancet Infect Dis. (2007) 7:607–13. doi: 10.1016/S1473-3099(07)70211-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Kuenstner JT, Naser S, Chamberlin W, Borody T, Graham DY, McNees A, et al. El consenso de la Conferencia contra Mycobacterium avium ssp. paratuberculosis (MAP) 2017. Frente Salud Pública. (2017) 5:208. DOI: 10.3389/FPUBH.2017.00208
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Niegowska M, Rapini N, Piccini S, Mameli G, Caggiu E, Manca Bitti ML, et al. Los niños con diabetes tipo 1 en riesgo reconocen altamente contra Mycobacterium avium subespecie paratuberculosis epítopos homólogos al Znt8 humano y la proinsulina. (2016) 6:22266. DOI: 10.1038/SEP22266
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Yokoyama K, Cossu D, Hoshino Y, Tomizawa Y, Momotani E, Hattori N. Anti-micobacterias anticuerpos en muestras pareadas de líquido cefalorraquídeo y suero de pacientes japoneses con esclerosis múltiple o trastorno del espectro de neuromielitis óptica. J Clin Med. (2018) 7:522. DOI: 10.3390/JCM7120522
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Mameli G, Cocco E, Frau J, Marrosu MG, Sechi LA. El virus de Epstein-Barr y contra Mycobacterium avium subsp. péptidos de paratuberculosis se reconocen en sueros y líquido cefalorraquídeo de pacientes con EM. (2016) 6:22401. DOI: 10.1038/SAPP22401
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Bo M, Erre GL, Niegowska M, Piras M, Taras L, Longu MG, et al. El factor regulador de interferón 5 es un objetivo potencial de la respuesta autoinmune desencadenada por el virus de Epstein-Barr y contra Mycobacterium avium subsp. paratuberculosis en artritis reumatoide: investigando un mecanismo de mimetismo molecular. Clin Exp Reumatol. (2018) 36:376–81.
17. Sweeney RW. Patogénesis de la paratuberculosis. Veterinario Clin North Am Food Anim Pract. (2011) 27:537–46. doi: 10.1016/j.cvfa.2011.07.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. McAloon CG, Doherty ML, Whyte P, More SJ, O’Grady L, Citer L, et al. Importancia relativa de los factores de riesgo a nivel de rebaño para la probabilidad de infección por paratuberculosis en rebaños lecheros irlandeses. J Dairy Sci. (2017) 100:9245–57. DOI: 10.3168/JDS.2017-12985
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Puerto-Parada M, Arango-Sabogal JC, Paré J, Doré E, Côté G, Wellemans V, et al. Factores de riesgo asociados a la condición de rebaño paratuberculosis contra Mycobacterium avium subsp. en rebaños lecheros quebequenses. Prev Vet Med. (2018) 152:74–80. doi: 10.1016/j.prevetmed.2018.02.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Correa-Valencia NM, Ramírez NF, Arango-Sabogal JC, Fecteau G, Fernández-Silva JA. Prevalencia de infección por Mycobacterium avium subsp. paratuberculosis en rebaños lecheros del norte de Antioquia (Colombia) y factores de riesgo asociados mediante muestreo ambiental. Prev Vet Med. (2019) 170:104739. doi: 10.1016/j.prevetmed.2019.104739
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. González J, Geijo MV, García-Pariente C, Verna A, Corpa JM, Reyes LE, et al. Clasificación histopatológica de las lesiones asociadas a la infección natural por paratuberculosis en bovinos. J Comp Pathol. (2005) 133:184–96. doi: 10.1016/j.jcpa.2005.04.007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Balseiro A, Pérez V, Juste RA. Enfermedad inflamatoria intestinal regional crónica: ¿una infección lenta transespecie? Comp Immunol Microbiol Infect Dis. (2019) 62:88–100. doi: 10.1016/j.cimid.2018.12.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Vázquez P, Ruiz-Larrañaga O, Garrido JM, Iriondo M, Manzano C, Agirre M, et al. Análisis de asociación genética de formas de paratuberculosis en ganado Holstein-friesian. Veterinario Med Int. (2014) 2014:321327. doi: 10.1155/2014/321327
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Bastida F, Juste RA. Control de la paratuberculosis: una revisión con un enfoque en la vacunación. J Vacunas basadas en el sistema inmunitario. (2011) 9:8. DOI: 10.1186/1476-8518-9-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Cho J, Tauer LW, Schukken YH, Gomez MI, Smith RL, Lu Z, et al. Análisis económico de vacunas paratuberculosis de Mycobacterium avium subespecie en rebaños lecheros. J Dairy Sci. (2012) 95:1855–72. DOI: 10.3168/JDS.2011-4787
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Juste RA, Garrido JM, Elguezabal N, Sevilla IA. Vacunas paratuberculosas y vacunación. En: Behr MA, Stevenson K, Kapur V, editores. Organismo paratuberculoso, enfermedad, control. 2ª ed. Wallingford: CABI Internacional (2020). págs. 365–79.
27. Kudahl AB, Nielsen SS, Ostergaard S. Strategies for time of culling in control of paratuberculosis in dairy herds. J Dairy Sci. (2011) 94:3824–34. DOI: 10.3168/JDS.2010-3933
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Britton LE, Cassidy JP. O’Donovan J, Gordon SV, Markey B. Aplicación potencial de técnicas de diagnóstico emergentes para el diagnóstico de la enfermedad de Johne bovina (paratuberculosis). Veterinario J. (2015) 209:32–9. doi: 10.1016/j.tvjl.2015.10.033
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Seth M, Lamont EA, Janagama HK, Widdel A, Vulchanova L, Stabel JR, et al. Descubrimiento de biomarcadores en infecciones micobacterianas subclínicas de bovinos. PLoS ONE. (2009) 4:E5478. doi: 10.1371/journal.pone.0005478
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. You Q, Verschoor CP, Pant SD, Macri J, Kirby GM, Karrow NA. Análisis proteómico del plasma de vacas Holstein que dieron positivo contra Mycobacterium avium subsp. paratuberculosis (MAP). Veterinario Immunol Immunopathol. (2012) 148:243–51. doi: 10.1016/j.vetimm.2012.05.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Cha SB, Yoo A, Park HT, Sung KY, Shin MK, Yoo HS. Análisis de perfiles transcripcionales para descubrir candidatos a biomarcadores contra macrófagos infectados con Mycobacterium avium subsp. paratuberculosis, RAW 2647. J Microbiol Biotechnol. (2013) 23:1167–75. doi: 10.4014/jmb.1302.02021
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Malvisi M, Palazzo F, Morandi N, Lazzari B, Williams JL, Pagnacco G, et al. Respuestas de la inmunidad innata bovina contra la infección por Mycobacterium avium subsp. paratuberculosis reveladas por cambios en la expresión génica y los niveles de microARN. PLoS ONE. (2016) 11:E0164461. doi: 10.1371/journal.pone.0164461
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Palacios A, Sampedro L, Sevilla IA, Molina E, Gil D, Azkargorta M, et al. Mycobacterium tuberculosis lipoproteína asociada a vesículas extracelulares LpqH como un biomarcador potencial para distinguir la infección por paratuberculosis o la vacunación de la infección tuberculosa. BMC Vet Res. (2019) 15:188. DOI: 10.1186/S12917-019-1941-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Alonso-Hearn M, Salgado M, de Silva K. Editorial: avances en el diagnóstico y control de la enfermedad de Johne. Front Vet Sci. (2021) 8:771891. DOI: 10.3389/fvets.2021.771891
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Alonso-Hearn M, Canive M, Blanco-Vázquez C, Torremocha R, Balseiro A, Amado J, et al. El análisis RNA-Seq de la válvula ileocecal y la sangre periférica del ganado Holstein infectado con Mycobacterium avium subsp, paratuberculosis reveló una desregulación de la vía de señalización CXCL8/IL8. (2019) 9:14845. DOI: 10.1038/S41598-019-51328-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Blanco Vázquez C, Alonso-Hearn M, Juste RA, Canive C, Iglesias T, Iglesias N, et al. Detection of latent forms of against Mycobacterium avium subsp. paratuberculosis infection using host Biomarker-based ELISA greatly improves paratuberculosis diagnostic sensitivity PLoS ONE. (2020) 15:e0236336. doi: 10.1371/journal.pone.0236336
37. Ueda K, ABC. proteins protect the human body and maintain optimal health. Biosci Biotechnol Biochem. (2011) 75:401–9. doi: 10.1271/bbb.100816
38. Schneider E, Hunke S. ATP-binding-cassette (ABC) transport systems: functional and structural aspects of the ATP-hydrolyzing subunits/domains. FEMS Microbiol Rev. (1998) 22:1–20. doi: 10.1111/j.1574-6976.1998.tb00358.x
39. Barbet R, Peiffer I, Hutchins JRA, Hatzfeld A, Garrido E, Hatzfeld JA. Expression of the 49 human ATP binding cassette (ABC) genes in pluripotent embryonic stem cells and in early and late-stage multipotent mesenchymal stem cells: possible role of ABC plasma membrane transporters in maintaining human stem cell pluripotency. Cell Cycle. (2012) 11:1611–20. doi: 10.4161/cc.20023
40. Davidson AL, Dassa E, Orelle C, Chen J. Structure, function, and evolution of bacterial ATP-binding cassette systems. Microbiol Mol Biol Rev. (2008) 72:317–64. doi: 10.1128/MMBR.00031-07
41. Higgins CF, ABC. transporters: from microorganisms to man. Annu Rev Cell Biol. (1992) 8:67–113. doi: 10.1146/annurev.cb.08.110192.000435
42. Albrecht C, Viturro E. The ABCA subfamily–gene and protein structures, functions and associated hereditary diseases. Pflugers Arch. (2007) 453:581–9. doi: 10.1007/s00424-006-0047-8
43. Chai AB, Ammit AJ, Gelissen IC. Examining the role of ABC lipid transporters in pulmonary lipid homeostasis and inflammation. Respir Res. (2017) 18:41. doi: 10.1186/s12931-017-0526-9
44. Hlaváč V, Václavíková R, Brynychová V, KoŽevnikovová R, Kopečková K, Vrána D, et al. Role of genetic variation in ABC transporters in breast cancer prognosis and therapy response. Int J Mol Sci. (2020) 21:9556. doi: 10.3390/ijms21249556
45. Dongsheng H, Zhuo Z, Jiamin L, Hailan M, Lijuan H, Fan C, et al. Proteomic analysis of the peri-infarct area after human umbilical cord mesenchymal stem cell transplantation in experimental stroke. Aging Dis. (2016) 7:623–34. doi: 10.14336/AD.2016.0121
46. Chen J, Waheed Khan RA, Wang M, He K, Wang Q, Li Z, et al. Association between the variability of the ABCA13 gene and the risk of major depressive disorder and schizophrenia in the Han Chinese population. World J Biol Psychiatry. (2017) 18:550–6. doi: 10.1080/15622975.2016.1245442
47. Rajkumar AP, Bidkhori G, Shoaie S, Clarke E, Morrin H, Hye A, et al. Postmortem cortical transcriptomics of Lewy body dementia reveal mitochondrial dysfunction and lack of neuroinfammation. Am J Geriatr Psychiatry. (2020) 28:75–86. doi: 10.1016/j.jagp.2019.06.007
48. Knight HM, Pickard BS, Maclean A, Malloy MP, Soares DC, McRae AF, et al. A cytogenetic abnormality and rare coding variants identify ABCA13 as a candidate gene in schizophrenia, bipolar disorder, and depression. Am J Hum Genet. (2009) 85:833–46. doi: 10.1016/j.ajhg.2009.11.003
49. Iritani S, Torii Y, Habuchi C, Sekiguchi H, Fujishiro H, Yoshida M, et al. The neuropathological investigation of the brain in a monkey model of autism spectrum disorder with ABCA13 deletion. Int J Dev Neurosci. (2018) 71:130–9. doi: 10.1016/j.ijdevneu.2018.09.002
50. Yoshida K, Go Y, Kushima I, Toyoda A, Fujiyama A, Imai H, et al. Single-neuron and genetic correlates of autistic behavior in macaque. Sci Adv. (2016) 2:e1600558. doi: 10.1126/sciadv.1600558
51. Frydrych LM, Ulintzf P, Bankhead A, Sifuentes C, Greenson J, Maguire L, et al. Rectal cancer sub-clones respond differentially to neoadjuvant therapy. Neoplasia. (2019) 21:1051–62. doi: 10.1016/j.neo.2019.08.004
52. Nymoen DA, Holth A, Hetland Falkenthal TE, Tropé CG, Davidson B. CIAPIN1 and ABCA13 are markers of poor survival in metastatic ovarian serous carcinoma. Mol Cancer. (2015) 14:44. doi: 10.1186/s12943-015-0317-1
53. Hlaváč V, Brynychová V, Václavíková R, Ehrlichová M, Vrána D, Pecha V, et al. The expression profile of ATP-binding cassette transporter genes in breast carcinoma. Pharmacogenomics. (2013) 14:515–29. doi: 10.2217/pgs.13.26
54. Araújo TM, Seabra AD, Lima EM, Assumpção PP, Montenegro RC, Demachki S, et al. Recurrent amplification of RTEL1 and ABCA13 and its synergistic effect associated with clinicopathological data of gastric adenocarcinoma. Mol Cytogenet. (2016) J9:52. doi: 10.1186/s13039-016-0260-x
55. Han J, Han N, Xu Z, Zhang C, Liu J, Ruan M. Expression profle of circular RNA and construction of circular RNA-Micro RNA network in salivary adenoid cystic carcinoma. Cancer Cell Int. (2021) 21:28. doi: 10.1186/s12935-020-01681-2
56. Dréan A, Rosenberg S, Lejeune FX, Goli L, Nadaradjane AA, Guehennec J, et al. ATP binding cassette (ABC) transporters: expression and clinical value in glioblastoma. J Neuro-Oncol. (2018) 138:479–86. doi: 10.1007/s11060-018-2819-3
57. Hlavata I, Mohelnikova-Duchonova B, Vaclavikova R, Liska V, Pitule P, Novak P, et al. The role of ABC transporters in progression and clinical outcome of colorectal cancer. Mutagenesis. (2012) 27:187–96. doi: 10.1093/mutage/ger075
58. Zhang X, Hirschfeld M, Beck J, Kupke A, Köhler K, Schütz E, et al. Osteogenesis imperfecta in a male holstein calf associated with a possible oligogenic origin. Vet Q. (2020) 40:58–67. doi: 10.1080/01652176.2020.1721611
59. Lauhio A, Färkkilä E, Pietiläinen KH, Åström P, Winkelmann A, Tervahartiala T, et al. Association of MMP-8 with obesity, smoking and insulin resistance. Eur J Clin Invest. (2016) 46:757–65. doi: 10.1111/eci.12649
60. Kunt AT, Isbir S, Görmus U. Polymorphisms of MMP9 and TIMP2 in patients with varicose veins. In Vivo. (2015) 29:461–5.
61. Shiomi T, Lemaître V, D’Armiento J, Okada Y. Matrix metalloproteinases, a disintegrin and metalloproteinases, and a disintegrin and metalloproteinases with thrombospondin motifs in non-neoplastic diseases. Pathol Int. (2010) 60:477–96. doi: 10.1111/j.1440-1827.2010.02547.x
62. Löffek S, Schilling O, Franzke C. Biological role of matrix metalloproteinases: a critical balance. Eur Respir J. (2011) 38:191–208. doi: 10.1183/09031936.00146510
63. Long Z. Computational analysis of the metal selectivity of matrix metalloproteinase 8. PLoS One. (2020) 15:e0243321. doi: 10.1371/journal.pone.0243321
64. Chambers AF, Matrisian LM. Changing views of the role of matrix metalloproteinases in metastasis. J Natl Cancer Inst. (1997) 89:1260–70. doi: 10.1093/jnci/89.17.1260
65. Sternlicht MD, Werb Z. How matrix metalloproteinases regulate cell behavior. Annu Rev Cell Dev Biol. (2001):463–516. doi: 10.1146/annurev.cellbio.17.1.463
66. Smith BN, Bhowmick NA. Role of EMT in metastasis and therapy resistance. J Clin Med. (2016) 5:17. doi: 10.3390/jcm5020017
Resumen de PubMed | Texto completo de CrossRef | Google Académico
67. Bajbouj K, Ramakrishnan RK, Hamid Q. Papel de las metaloproteinasas de matriz en la angiogénesis y sus implicaciones en el asma. J Immunol Res. (2021) 2021:6645072. doi: 10.1155/2021/6645072
Resumen de PubMed | Texto completo de CrossRef | Google Académico
68. Johnson JL. Metaloproteinasas en aterosclerosis. Eur J Pharmacol. (2017) 816:9 −106. doi: 10.1016/j.ejphar.2017.09.007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
69. Kathamuthu GR, Kumar NP, Moideen K, Nair D, Banurekha VV, Sridhar R, et al. Las metaloproteinasas de matriz y los inhibidores tisulares de las metaloproteinasas son biomarcadores potenciales de tuberculosis pulmonar y extrapulmonar. Frente Immunol. (2020) 11:419. doi: 10.3389/fimmu.2020.00419
Resumen de PubMed | Texto completo de CrossRef | Google Académico
70. Hanemaaijer R, Sorsa T, Konttinen YT, Ding Y, Sutinen M, Visser H, et al. La metaloproteinasa-8 de matriz se expresa en fibroblastos sinoviales reumatoides y células endoteliales. Regulación por factor de necrosis tumoral alfa y doxiciclina. J Biol Chem. (1997) 272:31504–9. DOI: 10.1074/JBC.272.50.31504
Resumen de PubMed | Texto completo de CrossRef | Google Académico
71. Maccoll E, Khalil RA. Metaloproteinasas de matriz como reguladores de la estructura y función de las venas: implicaciones en la enfermedad venosa crónica. J Pharmacol Exp ther. (2015) 355:410–28. doi: 10.1124/jpet.115.227330
Resumen de PubMed | Texto completo de CrossRef | Google Académico
72. Qin G, Luo M, Chen J, Dang Y, Chen G, Li L, et al. La activación recíproca entre MMP-8 y TGF-β1 estimula la EMT y la progresión maligna del carcinoma hepatocelular. Cáncer Lett. (2016):85–95. doi: 10.1016/j.canlet.2016.02.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
73. Juurikka K, Butler GS, Salo T, Nyberg P, Astrom P. El papel de MMP8 en el cáncer: una revisión sistemática. Int J Mol Sci. (2019) 2018:4506. DOI: 10.3390/IJMS20184506
Resumen de PubMed | Texto completo de CrossRef | Google Académico
74. Sirniö P, Tuomisto A, Tervahartiala T, Sorsa T, Klintrup K, Karhu T, et al. Los niveles séricos altos de MMP-8 se asocian con una disminución de la supervivencia e inflamación sistémica en el cáncer colorrectal. Br J Cáncer. (2018):213–19. doi: 10.1038/s41416-018-0136-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
75. Kushlinskii NE, Gershtein ES, Alferov AA, Bezhanova SD, Mushtenko VV, Pushkar DY, et al. Papel pronóstico de las metaloproteinasas de matriz 2, 7, 8, 9 y su inhibidor tisular tipo 1 en el suero sanguíneo de pacientes con cáncer de riñón. Bull Exp Med. (2020) 168:673–6. DOI: 10.1007/S10517-020-04778-W
Resumen de PubMed | Texto completo de CrossRef | Google Académico
76. Kelppe J, Thorén H, Haglund C, Sorsa T, Hagström J. MMP-7,−8,−9, E-cadherin, and beta-catenin expression in 34 amelobastoma cases. Clin Exp dent Res. (2021) 7:63–9. doi: 10.1002/cre2.331
Resumen de PubMed | Texto completo de CrossRef | Google Académico
77. Korpi JT, Kervinen V, Mäklin H, Väänänen A, Lahtinen M, Läärä E, et al. La colagenasa-2 (metaloproteinasa-8 de matriz) desempeña un papel protector en el cáncer de lengua. Br J Cáncer. (2008) 98:766–75. doi: 10.1038/sj.bjc.6604239
78. Muller MP, Tomlinson G, Marrie TJ, Tang P, McGeer A, Low DE, et al. Can routine laboratory tests discriminate between severe acute respiratory syndrome and other causes of community-acquired pneumonia?. Clin Infect Dis. (2005) 40:1079–10. doi: 10.1086/428577
79. DeLong ER, DeLong DM, Clarke-Pearson DL. Comparing the areas under two or more correlated receiver operating characteristic curves: a non-parametric approach. Biometrics. (1988) 44:837–45.
80. Garry FB. Control of paratuberculosis in dairy herds. Vet Clin North Am Food Anim Pract. (2011) 27:599–607. doi: 10.1016/j.cvfa.2011.07.006
81. Blanco Vázquez C, Balseiro A, Alonso-Hearn M, Juste RA, Iglesias N, Canive M, et al. Expresión de la intelectina 2 bovina como biomarcador de la progresión de la enfermedad paratuberculosa. Animales. (2021) 11:1370. doi: 10.3390/ani11051370
Resumen de PubMed | Texto completo de CrossRef | Google Académico
82. Park HE, Park HT, Jung YH, Yoo HS. Establecimiento de una PCR con transcripción inversa en tiempo real basada en biomarcadores del huésped para la detección de los casos subclínicos de Mycobacterium avium subsp. Paratuberculosis PLoS ONE. (2017) 12:E0178336. doi: 10.1371/journal.pone.0178336
Resumen de PubMed | Texto completo de CrossRef | Google Académico
83. Juste RA, Casal J. Simulación económica y epidemiológica de diferentes estrategias de control de la paratuberculosis ovina. Prev Vet Med. (1993) 15:101–15. doi: 10.1016/0167-5877(93)90106-4
84. Li L, Wagner B, Freer H, Schilling M, Bannantine JP, Campo JJ, et al. Detección precoz de la infección por Mycobacterium avium subsp. paratuberculosis en bovinos con inmunoensayos basados en perlas múltiples. PLoS ONE. (2017) 12:E0189783. doi: 10.1371/journal.pone.0189783
Resumen de PubMed | Texto completo de CrossRef | Google Académico
85. Barkema HW, Orsel K, Nielsen SS, Koets AP, Rutten VPMG, Bannantine JP, et al. Lagunas de conocimiento que dificultan la prevención y el control de la infección por paratuberculosis por Mycobacterium avium subespecie. Transbound Emerg Dis. (2018) 1:125–48. doi: 10.1111/tbed.12723
Resumen de PubMed | Texto completo de CrossRef | Google Académico
86. Vogel C, Marcotte EM. Información sobre la regulación de la abundancia de proteínas a partir de análisis proteómicos y transcriptómicos. Nat Rev Genet. (2012) 13:227–32. DOI: 10.1038/NRG3185
Resumen de PubMed | Texto completo de CrossRef | Google Académico
87. Whitlock RH, Wells SJ, Sweeney RW, Van Tiem J, ELISA. y cultivo fecal para paratuberculosis (enfermedad de Johne): sensibilidad y especificidad de cada método. Veterinario Microbiol. (2000) 77:387–98. doi: 10.1016/s0378-1135(00)00324-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
88. Espinosa J, de la Morena R, Benavides J, García-Pariente C, Fernández M, Tesouro M, et al. Evaluación de la respuesta proteica en fase aguda asociada a las diferentes formas patológicas de paratuberculosis bovina. Animales. (2020) 10:1925. DOI: 10.3390/ANI10101925
Resumen de PubMed | Texto completo de CrossRef | Google Académico
89. Park HE, Park JS, Park HT, Choi JG, Shin JI, Jung M, et al. Alfa-2-macroglobulina como nuevo biomarcador prometedor que mejora la sensibilidad diagnóstica de la paratuberculosis bovina. Frente. Vet. (2021). 8:637716. DOI: 10.3389/fvets.2021.637716
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: paratuberculosis, infección subclínica, lesiones focales, diagnóstico, biomarcadores, miembro A de la subfamilia A del casete de unión a ATP 13
Cita: Blanco-Vázquez C, Alonso-Hearn M, Iglesias N, Vázquez P, Juste RA, Garrido JM, Balseiro A, Canive M, Amado J, Queipo MA, Iglesias T y Casais R (2022) Uso de la subfamilia A de casetes de unión a ATP Miembro 13 (ABCA13) para la detección sensible de formas patológicas focales de paratuberculosis bovina subclínica. Frente. Vet. Sci. 9:816135. doi: 10.3389/fvets.2022.816135
Recibido: 16 de noviembre de 2021; Aprobado: 24 de enero de 2022;
Publicado: 10 marzo 2022.
Editado por:
Michael Kogut, Servicio de Investigación Agrícola (USDA), Estados Unidos
Revisado por:
Douwe Bakker, Investigador independiente, Lelystad, Países Bajos
Valeria Grieco, Universidad de Milán, Italia
Copyright © 2022 Blanco-Vázquez, Alonso-Hearn, Iglesias, Vázquez, Juste, Garrido, Balseiro, Canive, Amado, Queipo, Iglesias y Casais. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Rosa Casais, rosacg@serida.org
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.