Estudio de farmacocinética y biodisponibilidad relativa de dos infusiones intramamarias de sulfato de cefquinoma en leche de vaca
Estudio de farmacocinética y biodisponibilidad relativa de dos infusiones intramamarias de sulfato de cefquinoma en leche de vaca
 Shuang Li1,2,3†
Shuang Li1,2,3†  Na Yu1,3,4†
Na Yu1,3,4†  Yaoxin Tang1,3,4
Yaoxin Tang1,3,4  Chunsuang Liu1,3,4
Chunsuang Liu1,3,4  Ying Zhang1,3,4
Ying Zhang1,3,4  Xiaojie Chen1,3,4
Xiaojie Chen1,3,4  Hao Wu5
Hao Wu5  Xiubo Li1,3,4*
Xiubo Li1,3,4*  Yiming Liu1,3,4*
Yiming Liu1,3,4*- 1Laboratorios Nacionales de Referencia de Medicamentos para Piensos, Instituto de Investigación de Piensos, Academia China de Ciencias Agrícolas, Pekín, China
- 2Laboratorio Clave de Cría de Animales Agrícolas y Cría Saludable de Tianjin, Facultad de Ciencia Animal y Medicina Veterinaria, Universidad Agrícola de Tianjin, Tianjin, China
- 3Laboratorio Clave de Vigilancia de la Resistencia a los Antimicrobianos en Animales, Ministerio de Agricultura y Asuntos Rurales, Instituto de Investigación de Piensos, Academia China de Ciencias Agrícolas, Pekín (China)
- 4Laboratorio de Evaluación de Riesgos de Calidad e Inocuidad de Productos en Factores de Riesgo de Origen Alimenticio, Ministerio de Agricultura y Asuntos Rurales, Instituto de Investigación de Piensos, Academia China de Ciencias Agrícolas, Beijing, China
- 5Facultad de Medicina Veterinaria, Universidad Agrícola de China, Pekín, China
En este estudio, se investigó la farmacocinética y la biodisponibilidad de dos infusiones intramamarias de sulfato de cefquinoma. A doce vacas lactantes de cada grupo se les administró una dosis efectiva de 75 mg/glándula para el cefquinoma, con muestras de leche recogidas en varios intervalos de tiempo. Las concentraciones de cefquinoma en la leche en diferentes momentos se determinaron mediante el método UPLC-MS/MS. Se realizaron análisis de farmacocinética no compartimental sobre la concentración de cefquinoma en la leche. Los parámetros farmacocinéticos medios de los grupos A y B tras la administración intramamaria fueron los siguientes: AUCúltimo 300558.57 ± 25052.78 ng/mL y 266551.3 ± 50654.85 ng/mL, CMáximo 51786.35 ± 11948.4 ng/mL y 59763.7 ± 8403.2 ng/mL, T1/2 5,69 ± 0,62 h y 5,25 ± 1,62 h, TMT 7,43 ± 0,79 h y 4,8 ± 0,78 h, respectivamente. Los experimentos farmacocinéticos mostraron que la biodisponibilidad relativa del grupo B era del 88,69% de la del grupo A. A partir de nuestros hallazgos, el grupo B (3 g: 75 mg) muestra un proceso de eliminación del fármaco más rápido que el grupo A (8 g: 75 mg), lo que sugiere que el período de retirada de la nueva formulación puede ser más corto.
1 Introducción
La mastitis, una afección prevalente que afecta a las vacas, ejerce una influencia adversa tanto en el bienestar de los animales como en la viabilidad financiera de las explotaciones (1). Investigaciones anteriores han demostrado que las pérdidas económicas sufridas por las granjas varían de $1.20 por vaca por día en el primer mes a $2.06 por vaca por día en el décimo mes (2). Staphylococcus aureus y Escherichia coli representan el 40 ~ 50% de los productos lácteos, lo que representa un riesgo para la salud humana (3-5). La terapia antibiótica representa una gran proporción del tratamiento de la mastitis, incluyendo marbofloxacino, penicilina, rifaximina, cefquinoma, etc., que puede administrarse mediante inyección intramuscular/intravenosa o intramamaria (6-8). Con el fin de lograr una alta biodisponibilidad, que es difícil de lograr a través de otras vías de administración, los antibióticos generalmente se administran mediante inyección intravenosa (9). Además, el tratamiento sistémico extensivo y el control de la mastitis bovina no producen consistentemente la eficacia deseable (10). Los antibióticos locales administrados a través de la infusión intramamaria tratan eficazmente las infecciones por patógenos al aumentar la concentración del fármaco en el lugar de administración (11, 12). Recientemente, ha habido una tendencia notable hacia el desarrollo de la infusión intramamaria en el campo del tratamiento de la mastitis. Investigaciones anteriores indican que las infusiones intramamarias representaron el 81% del total de productos utilizados en las granjas de Irlanda (13). Además, aproximadamente el 85,4% de las infusiones intramamarias se emplearon en Argentina dirigidas al tratamiento de la enfermedad (14).
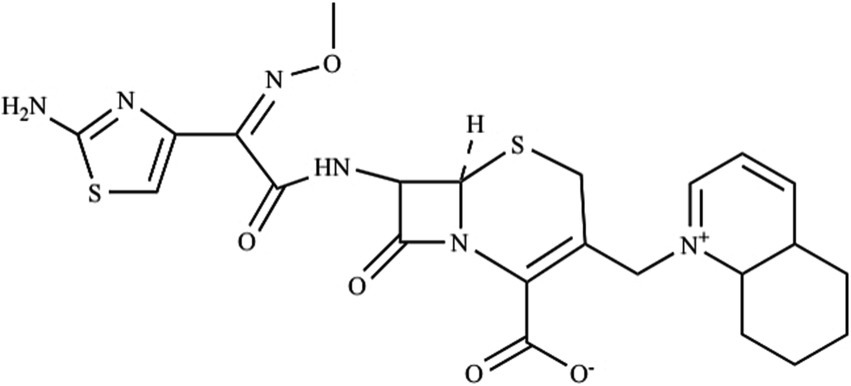
Cefquinoma, la cefalosporina de cuarta generación, que tiene un amplio espectro de actividad antimicrobiana (15). La fórmula estructural química del cefquinoma se muestra en la Figura 1. A diferencia de las cefalosporinas de segunda y tercera generación, la modificación química de la estructura básica de las cefalosporinas proporciona la naturaleza anfótera del cefquinoma, que puede promover la rápida penetración de la membrana biológicay mejorar la biodisponibilidad (16, 17). Cefquinoma es un medicamento veterinario específico que se utiliza en clínicas veterinarias para el tratamiento de enfermedades respiratorias en caballos (18) y neumonía en perros (19). En la ganadería lechera, se utiliza ampliamente para el tratamiento de las infecciones respiratorias y subrespiratorias de las vacas, así como para el tratamiento de la endometritis de las vacas (20, 21). Un estudio multicéntrico europeo mostró una alta actividad in vitro del cefquinoma frente a un amplio espectro de patógenos de la vaca (22).
Estudios previos mostraron que la infusión intramamaria comercial de sulfato de cefquinoma tenía buenas características farmacocinéticas en vacas lecheras. Xiao et al. (23) también estudiaron las características farmacocinéticas de la infusión intramamaria de cefquinoma de 75 mg en la leche de vacas lecheras sanas. Los resultados mostraron que el cefquinoma se eliminó lentamente y la concentración efectiva en la leche se mantuvo durante mucho tiempo. Li et al. (24) investigaron la farmacocinética del cefquinoma en muestras de plasma y leche de vacas lactantes después de una dosis de 75 mg, y los resultados mostraron que el cefquinoma no penetró en la sangre y se eliminó rápidamente de la leche después de la administración intramuscular en vacas lactantes.
El uso irracional de antibióticos en las clínicas veterinarias ha provocado efectos adversos como resistencia bacteriana y reacciones alérgicas (25). Investigaciones anteriores han indicado que las cepas bacterianas aisladas de muestras de leche recogidas en once provincias de China presentan una resistencia multifacética a los antibióticos (26). Se supone que la resistencia a los antimicrobianos supone un riesgo para la salud de los seres humanos debido a la introducción de patógenos resistentes en la cadena alimentaria y a la propagación horizontal de los determinantes de la resistencia a otras bacterias (27). Los casos presentados ilustran que la dosificación irracional conduce al fracaso de los fármacos para lograr efectos terapéuticos. En respuesta a este problema, un régimen de dosificación de antibióticos mejorado podría garantizar la eficacia de todo el proceso de tratamiento (28). El hecho de que la utilización de la farmacocinética con el fin de diseñar regímenes de dosificación no es un fenómeno nuevo, es crucial que los desarrolladores farmacéuticos identifiquen el régimen de dosificación más eficaz a través de la farmacocinética (29, 30).
El tratamiento eficaz, estable y seguro de las enfermedades depende en gran medida del desarrollo de formulaciones farmacéuticas, lo que requiere principalmente ensayos clínicos costosos y que requieren mucho tiempo (18, 19). En un entorno con recursos limitados, se pueden utilizar trayectorias de desarrollo específicas y una composición controlable para optimizar cada nueva fórmula (31). El principal desafío con el parto intramamario es administrar dosis relativamente altas dentro de un volumen limitado para minimizar las molestias o los efectos secundarios adversos (32). Por lo tanto, se desarrolló una nueva infusión intramamaria de sulfato de cefquinoma (3 g: 75 mg), que tiene una mayor concentración efectiva del fármaco por unidad de volumen de infusión intramamaria en comparación con el tamaño anterior (8 g: 75 mg). La nueva infusión intramamaria de sulfato de cefquinoma contiene una disminución del peso del 62,5% con respecto a la anterior.
En este estudio se investigó la farmacocinética de dos infusiones intramamarias de cefquinoma y se obtuvieron los parámetros farmacocinéticos. Así como la biodisponibilidad relativa se obtuvo por el método de área bajo curva (AUC). Proporcionará una base científica para que los productores de leche utilicen las infusiones en la práctica clínica, reduciendo así los resultados adversos resultantes del uso irracional.
2 Materiales y métodos
2.1 Reactivos
La sustancia referencial del sulfato de cefquinoma (con una pureza de ensayo del 82,6%, número de lote: K0321406) se adquirió del Instituto de Control de Medicamentos Veterinarios de China, situado en Beijing, China. El grupo A: Infusión intramamaria de sulfato de cefquinoma (vaca lactante) (8 g: 75 mg, número de lote: 120215), proporcionado por Huaqinyuan Animal Pharmaceutical Co., Ltd. El grupo B: Infusión intramamaria de sulfato de cefquinoma (vaca lactante) (3 g: 75 mg, número de lote: 210910001), proporcionado por Zhongmu Nanjing Animal Pharmaceutical Co., Ltd., (no disponible comercialmente). El agua ultrapura se preparó utilizando el equipo Cascada I PALL de Nueva York, Estados Unidos. El metanol y el acetonitrilo de cromatografía líquida/grado de espectrómetro de masas utilizados en este estudio se obtuvieron de Fisher Scientific en Fair Lawn, NJ, Estados Unidos. Otros reactivos utilizados en este estudio fueron de grado analítico y se obtuvieron de proveedores en Beijing, China.
2.2 Instrumentos
Cromatógrafo de líquidos de ultra rendimiento ACQUITY UPLC de Waters, de Waters Corporation, Estados Unidos. Espectrómetro de masas de triple cuadrupolo, Xevo TQ-S, de Waters Corporation, Estados Unidos. Balanza analítica, CPA225D, por Sartorius, Alemania. Dispositivo de extracción en fase sólida de Waters Corporation.
2.3 Animales
Doce vacas lactantes de cada grupo, con una edad aproximada de 36 meses y un rango de peso de 600 ± 50 kg, procedían de una granja lechera comercial en el distrito de Changping, Beijing. A lo largo del período de investigación, las vacas estaban sanas y tenían acceso sin restricciones al agua y a una dieta estándar libre de antibióticos. Los procedimientos que involucraron animales en el experimento se llevaron a cabo de acuerdo con las directrices, que fueron aprobadas por el Comité de Uso y Cuidado de los Animales del Instituto de Investigación de Piensos de la Academia China de Ciencias Agrícolas (IFR-CAAS20230309). Las vacas estaban sanas después de todo el experimento y no se utilizó anestesia ni eutanasia.
2.4 Recogida de muestras
Para el grupo A (8 g: 75 mg) y el grupo B (3 g: 75 mg), se administró un tubo de inyectante con 75 mg de cefquinoma por vía intramamaria a la glándula frontal derecha de la vaca. Masajear unos 30 s para repartir la infusión de forma homogénea. Se recogieron muestras en blanco como controles de cada glándula antes de la administración. Después de la administración de una sola dosis, se recogieron muestras de leche de 20 ml a las 0,25 h, 0,75 h, 1 h, 2 h, 4 h, 6 h, 8 h, 12 h, 24 h, 30 h, 36 h, 48 h, 54 h, 60 h y 72 h. Para la glándula no tratada (parte posterior izquierda), se recogieron muestras de leche de 20 mL a las 2 h, 6 h, 12 h y 24 h después de la administración. Las muestras de leche se conservaron en estado de congelación a 40 °C bajo cero a la espera de un análisis más detallado (24).
2.5 Preparación de la muestra
Un gramo de muestra de leche se transfirió delicadamente al tubo de centrífuga (10 mL), seguido de la adición de 4 mL de acetonitrilo. La mezcla se agitó en vórtice durante 3 min y se agitó durante 10 min más, luego se centrifugó a aproximadamente 7.656 ×g durante 10 min a 4 °C. A continuación, la solución de muestra se secó con gas nitrógeno a 40 °C. El precipitado resultante se reformó en una solución de 3 mL que comprendía ácido fórmico acuoso y acetonitrilo en una proporción volumétrica de 95:5. La solución de la muestra se pasó a través de un cartucho de extracción en fase sólida (SPE) (HLB, 60 mg/3 mL) preactivado con 3 mL de metanol y agua, respectivamente. La solución de muestra fluye a través del cartucho de extracción SPE bajo la acción de la gravedad, seguido de la elución del cartucho con metanol de 3 mL de mililitros. A continuación, se repitió el proceso de secado con nitrógeno. Disuelva el precipitado con 1 ml de ácido fórmico acuoso y acetonitrilo. Finalmente, la solución de muestra se recolectó en un vial de muestra de pequeño volumen después de la filtración a través de un filtro de jeringa de 0,22 μm, y la muestra se analizó posteriormente mediante UPLC-MS/MS.
2.6 Condiciones UPLC-MS/MS
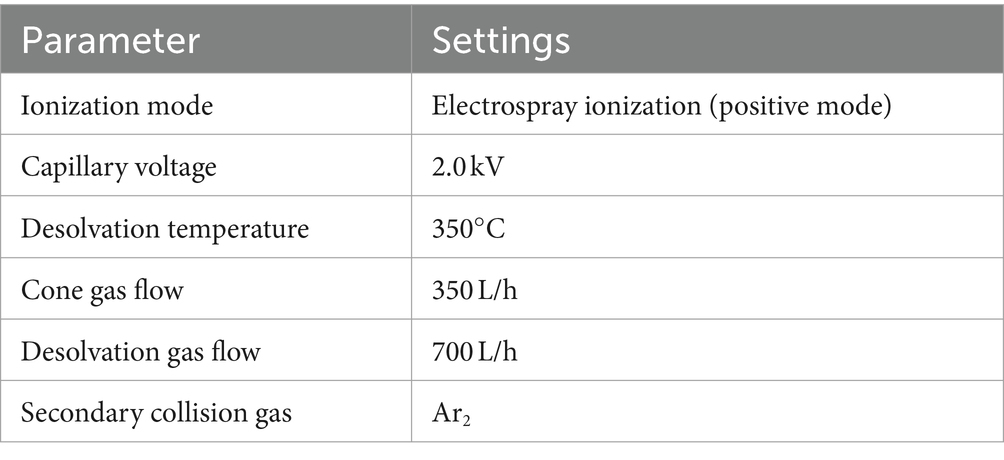
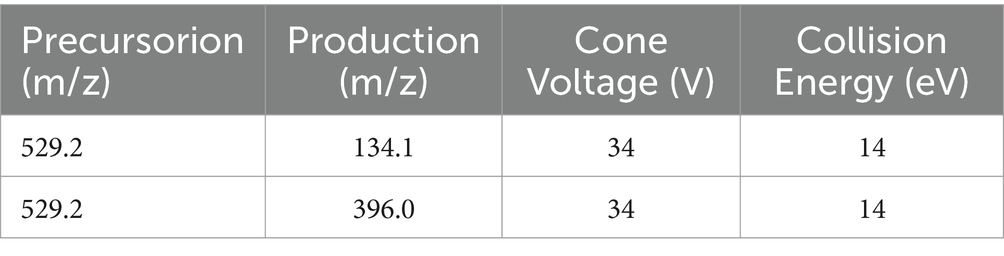
Los parámetros para el análisis UPLC se configuraron de la siguiente manera. En el sistema UPLC, el proceso de separación se llevó a cabo utilizando un BEH C de Waters18 columna (50 mm por 2,1 mm por 1,7 μm). Las separaciones cromatográficas se realizaron con un sistema de elución compuesto por metanol como disolvente orgánico (fase A) y ácido fórmico al 0,1% v/v en agua como disolvente acuoso (fase B). El proceso de elución se llevó a cabo con una velocidad de fluido invariable, fijada con precisión en 0,35 mililitros por minuto, empleando un protocolo de gradación lineal: de una duración inicial a 0,9 min se utilizó el 95% de la fase B, que se alteró al 50% en el siguiente corte de 0,9 a 3 min; posteriormente, para el lapso de 3 a 5 minutos, se cambió al 10% de la fase B; y finalmente, en el último intervalo de 5 a 6 min se restauró el 95% de la fase B. Todo el procedimiento se llevó a cabo manteniendo una temperatura de columna de 40 ± 0,5 °C. Para una descripción más precisa de las condiciones de funcionamiento en el modo de ionización positiva (ESI) (Tabla 1). Los parámetros para el monitoreo de reacciones múltiples (MRM) del cefquinoma (Tabla 2).+
2.7 Validación del método
La validación de los métodos tiene una importancia significativa en el desarrollo de los métodos, ya que implica el establecimiento de prerrequisitos analíticos y la verificación de las capacidades de rendimiento del método para garantizar la alineación con dichos prerrequisitos (33). El proceso de validación del método se refiere a los requisitos del Reglamento de Ejecución (UE) 2021/808 de la Comisión. Los criterios evaluados incluyeron la selectividad, el efecto matriz (ME), el límite de detección (LOD), el límite de cuantificaciones (LOQ), la linealidad, la exactitud, la precisión y la estabilidad.
2.7.1 Selectividad y efecto matriz
La yuxtaposición de cromatogramas derivados de leche en blanco y muestras de leche infundidas con cefquinoma sirve como método para evaluar la selectividad (34). La evaluación del efecto de la matriz se determinó contrastando el área de pico de la solución patrón de matriz en blanco (X) con la de la solución patrón de disolvente (Y) (35). Un atributo numérico positivo representa el aumento de la señal, mientras que un atributo negativo denota la disminución de la señal. Cuando el efecto de matriz se sitúa en el 0%, esto implica una interferencia mínima de la matriz. Cuando la magnitud absoluta del efecto matriz es <20%, es razonable considerar que el impacto de la matriz es insignificante. El efecto matriz se vuelve moderado cuando su magnitud absoluta reside entre el 20 y el 50%. Sin embargo, cuando la magnitud absoluta del efecto matriz supera el 50%, equivale a una interferencia intensa de la matriz (36).
2.7.2 LOD y LOQ
El LOD y el LOQ se verificaron inyectando una solución de trabajo estándar de concentración adecuada en la matriz de leche en blanco para preparar muestras con diversas concentraciones añadidas. El LOD se caracteriza por ser la concentración medible más pequeña de un analito en una muestra, lo que provoca una relación señal-ruido (S/N) superior a tres. LOQ se denota como la concentración mínima del analito que puede dar lugar a una relación señal-ruido (S/N) superior a 10.
2.7.3 Linealidad
El análisis de regresión lineal se determinó mediante la preparación de soluciones patrón de cefquinoma a concentraciones de 0,2, 1, 5, 10, 25 y 50 ng/g para construir curvas de calibración de matrices. Al graficar el área del pico correspondiente al ion cuantificador del analito en el eje Y frente a la concentración de la solución estándar en el eje X, se calcularon la ecuación de regresión y el coeficiente de correlación. Se utilizó el método de la curva estándar para determinar las muestras desconocidas diluyendo las muestras de leche con una matriz de leche en blanco para llevar la concentración dentro del rango de la curva estándar.
2.7.4 Exactitud y precisión
Basándose en la tasa de recuperación y el coeficiente de variabilidad obtenidos por el aumento de la leche, se evaluó la exactitud y la precisión. Se aumentaron cuatro concentraciones (0,2, 10, 20 y 40 ng/g) de leche en blanco para determinar las tasas de recuperación. El análisis de seis réplicas de las concentraciones de control de calidad en el mismo día y la evaluación de cinco mediciones de las concentraciones de control de calidad durante cinco días consecutivos evaluaron la exactitud y precisión del método UPLC-MS/MS.
2.7.5 Estabilidad
Se evaluó la estabilidad del cefquinoma en diversas condiciones de almacenamiento. La solución estándar de Cefquinome se almacenó primero a -40 °C para evaluar su estabilidad durante un período de 30 días. Se utilizó la exposición a tres ciclos de congelación-descongelación, pasando de temperatura ambiente a -40 °C, para determinar la estabilidad de congelación-descongelación. Las pruebas de estabilidad a largo plazo implicaron el almacenamiento de estas muestras a -40 °C durante un período prolongado de 90 días. Por último, se analizó la estabilidad de las muestras durante la residencia en la bandeja del automuestreador a 4°C durante 8 h.
2.8 Análisis de parámetros farmacocinéticos
Utilizando el software Phoenix (versión 8.1, Pharsight, Estados Unidos), analice la relación entre la concentración de leche y el tiempo en cada vaca. El análisis de parámetros se realizó mediante modelos no compartimentales y se compararon los principales parámetros farmacocinéticos de dos grupos. Los parámetros farmacocinéticos se presentaron como la media más o menos la desviación estándar (DE). Con base en investigaciones previas, la fórmula de cálculo de la biodisponibilidad relativa (RBA) es la siguiente:
3 Resultados
3.1 Selectividad y efecto matriz
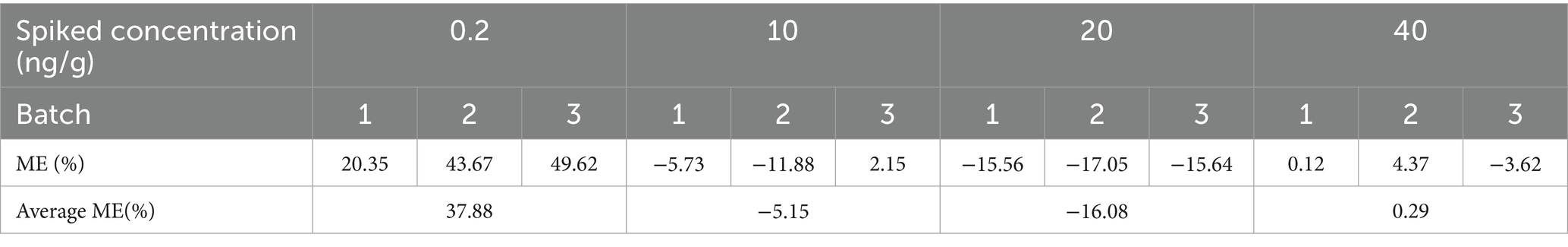
Las sustancias endógenas presentes en la leche de vaca en blanco no interfieren con la medición del compuesto objetivo que se está probando, lo que validó la especificidad del enfoque de prueba. En la Figura 2 se muestra el cromatograma que representa la leche en blanco, la leche en blanco con picos de cefquinoma y la fase móvil en blanco con picos de cefquinoma. Los resultados del efecto matriz mostraron que hubo un aumento de la señal en las concentraciones de adición de la matriz láctea de 0,2 ng/g y 40 ng/g, y una disminución de la señal a 10 ng/g y 20 ng/g (Tabla 3). El efecto de la matriz en la concentración de picos de la matriz láctea de 0,2 ng/g fue del 37,88%, lo que se considera un efecto de matriz media, mientras que los valores absolutos de las otras concentraciones de picos son todos del <20%, categorizados como efectos de matriz débil. La cuantificación del cefquinoma se realizó utilizando la curva de calibración de la matriz para compensar los efectos de la matriz.
 Figura 2. Cromatogramas UPLC-MS/MS. (A) El cromatograma de la muestra de leche en blanco. (B) El cromatograma de la muestra de leche en blanco añadida cefquinoma (10 ng/g). (C) El cromatograma del cefquinoma añadido en fase móvil en blanco (10 ng/mL).
Figura 2. Cromatogramas UPLC-MS/MS. (A) El cromatograma de la muestra de leche en blanco. (B) El cromatograma de la muestra de leche en blanco añadida cefquinoma (10 ng/g). (C) El cromatograma del cefquinoma añadido en fase móvil en blanco (10 ng/mL).
3.2 LOD y LOQ
Con una relación señal/ruido (S/N) de ≥3, el valor del límite de detección (LOD) se estableció en 0,1 ng/g. Con una relación S/N de ≥10, el valor límite de cuantificación (LOQ) se estableció en 0,2 ng/g. Los cromatogramas correspondientes se pueden ver en la Figura 3.
 Figura 3. Cromatogramas UPLC-MS/MS. (A) El cromatograma de LOD para el cefquinoma. (B) El cromatograma de LOQ para el cefquinoma.
Figura 3. Cromatogramas UPLC-MS/MS. (A) El cromatograma de LOD para el cefquinoma. (B) El cromatograma de LOQ para el cefquinoma.
3.3 Linealidad
Sobre la base de la ponderación (1/x2) resultados del análisis de regresión lineal por mínimos cuadrados, la curva de calibración de la matriz para el cefquinoma puso de manifiesto la correlación proporcional entre la concentración de cefquinoma y la respuesta analítica. La relación lineal se confirmó en todo el espectro de concentración de 0,2 ~ 50 ng/g y el coeficiente de correlación (r), superando 0,999 (Tabla 4), reveló una correlación robusta entre la concentración de cefquinoma y su correspondiente intensidad máxima. Las ecuaciones que describen esta calibración, donde X denota concentración e Y denota área de pico, se proporcionan en la Figura 4.
3.4 Exactitud y precisión
La desviación estándar relativa y la recuperación se calcularon tanto para las variaciones intradía como entre días mediante la realización de seis pruebas paralelas en cada concentración, repetidas 5 días. Los resultados se muestran en la Tabla 5. Se ha medido que las tasas de recuperación del cefquinoma en la leche están entre el 97,42 y el 99,94 %, que los coeficientes de variación intralote son del <9,97 % y que el coeficiente de variación entre lotes es del <5,95 %. Con base en los resultados del estudio, el uso del método analítico empleado dio como resultado una cuantificación exacta y precisa del cefquinoma en muestras de leche, satisfaciendo los requisitos para un método confiable.
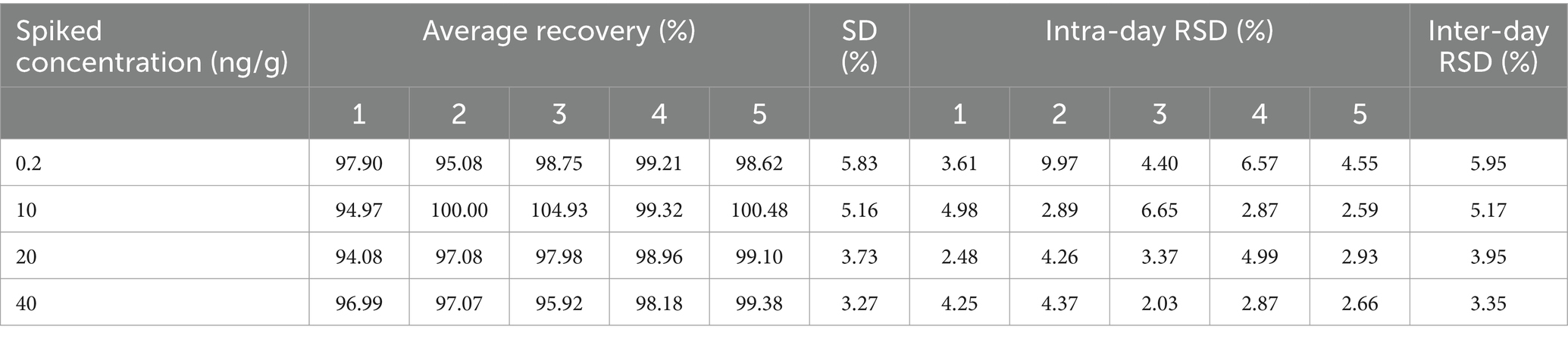 Tabla 5. Los resultados de exactitud y precisión para el cefquinoma en la leche a cuatro concentraciones distintas. (día = 5, n = 30).
Tabla 5. Los resultados de exactitud y precisión para el cefquinoma en la leche a cuatro concentraciones distintas. (día = 5, n = 30).
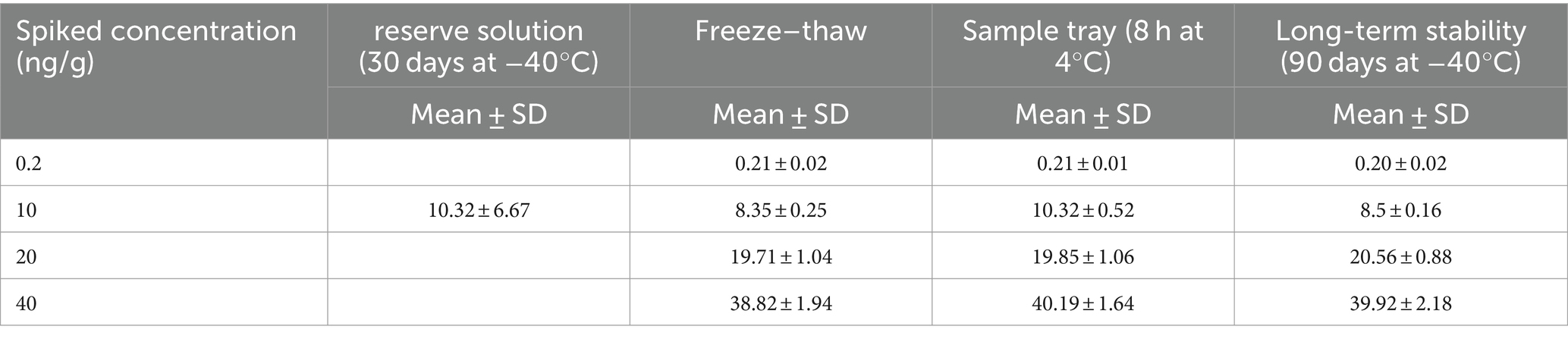
3.5 Estabilidad
La evaluación de la estabilidad del cefquinoma incorporó una variedad de pruebas: solución estándar madre, tres ensayos de congelación-descongelación, bandeja de muestras y estabilidad a largo plazo (Tabla 6). Después de ser sometido a tres ciclos de congelación-descongelación que van desde -40 °C hasta temperatura ambiente, el cefquinoma mantuvo su estabilidad en la leche. También mostró características estables después de 8 h de almacenamiento en una bandeja de muestras a 4 °C y un almacenamiento prolongado de 90 días a -40 °C. Además, las soluciones madre de cefquinoma se mantuvieron estables durante un lapso de 30 días a -40 °C. Los resultados indican que las condiciones anteriores no parecieron afectar la cuantificación del cefquinoma.
3.6 Análisis de parámetros farmacocinéticos
En la Figura 5 se ilustran los AUC de dos infusiones. A medida que avanzaba el tiempo, las concentraciones de cefquinoma en la leche mostraron una disminución exponencial después de la administración intramamaria. A lo largo de todo el proceso de investigación, no se encontraron ni se informaron eventos adversos. Los AUC para los grupos A y B fueron 300558,57 ± 25052,78 h·ng/mL y 266551,32 ± 50654,84 h·ng/mL, el T1/2 para los grupos A y B fueron de 5,69 ± 0,62 h y 5,25 ± 1,62 h, la TRM para los grupos A y B fue de 7,43 ± 0,79 h y 4,81 ± 0,78 h, la Cl/F para los grupos A y B fue de 251,14 ± 21,82 mL/h y 290,57 ± 53,98 mL/h, la CMáximo para los grupos A y B fueron 51786,35 ± 11948,4 ng/mL y 59763,7 ± 8403,2 ng/mL, y la TMáximo para los grupos A y B fueron iguales a las 0,25 h. Otros parámetros farmacocinéticos se presentaron en la Tabla 7.
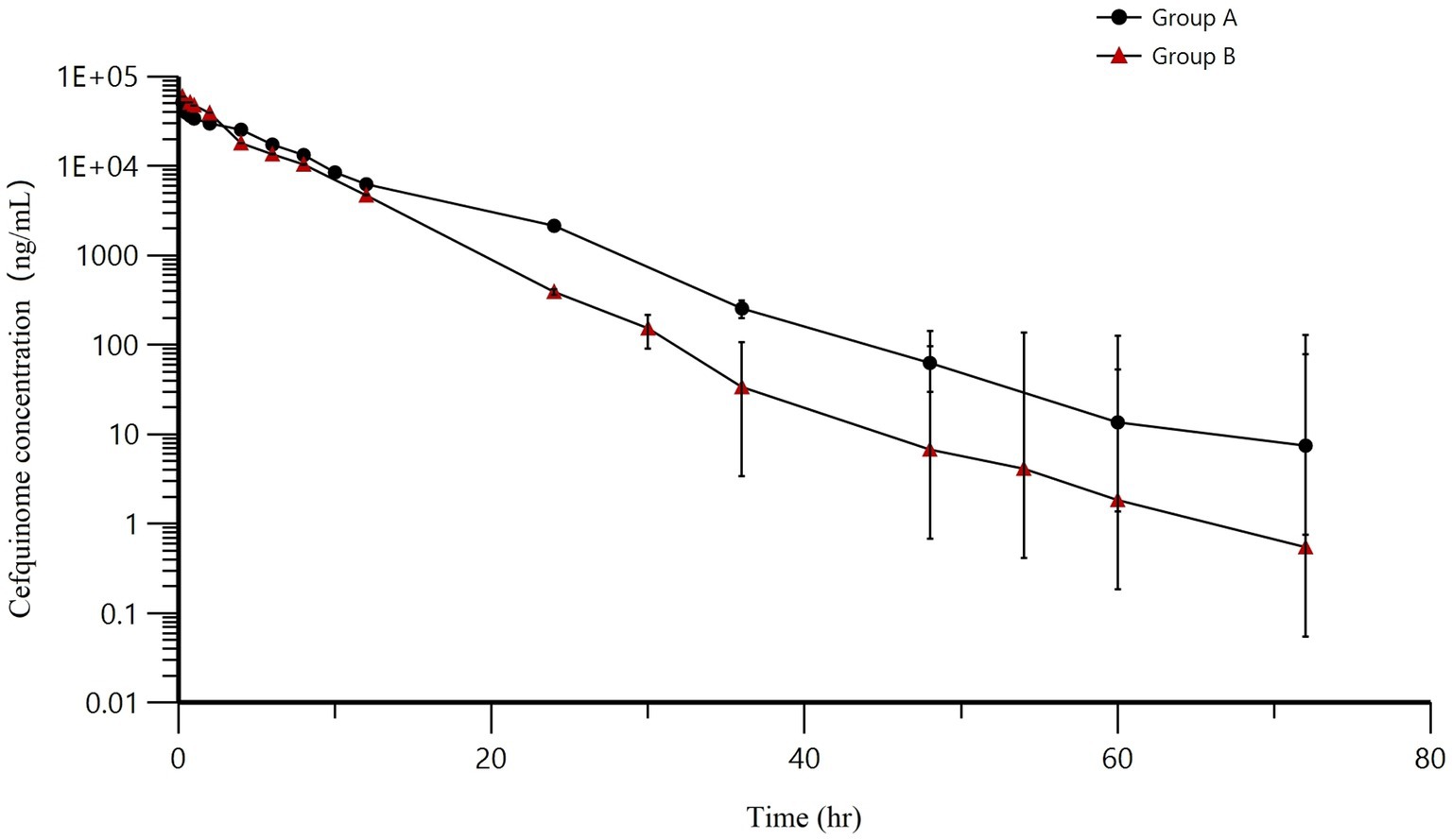 Figura 5. Concentraciones medias de leche (±DE) en los cuartos tratados después de la administración intramamaria de cefquinoma. Grupo A = 8 g: 75 mg, Grupo B = 3 g: 75 mg.
Figura 5. Concentraciones medias de leche (±DE) en los cuartos tratados después de la administración intramamaria de cefquinoma. Grupo A = 8 g: 75 mg, Grupo B = 3 g: 75 mg.
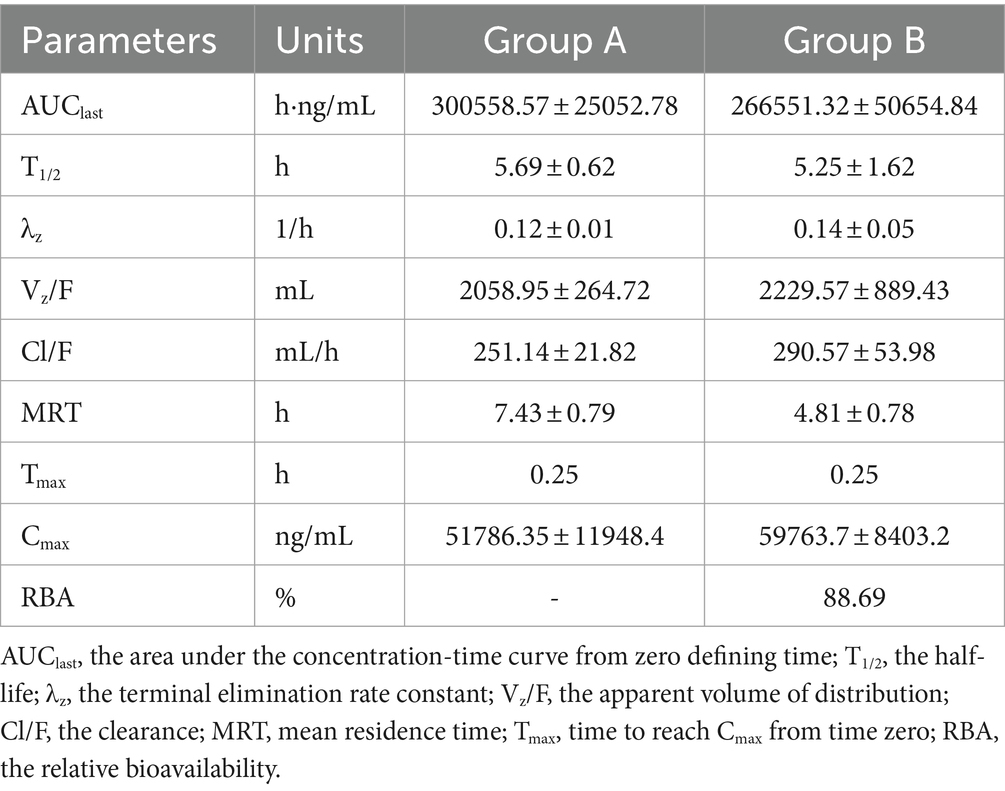 Tabla 7. Comparación de los parámetros farmacocinéticos del cefquinoma y la biodisponibilidad relativa entre el grupo A (8 g:75 mg) y B (3 g:75 mg).
Tabla 7. Comparación de los parámetros farmacocinéticos del cefquinoma y la biodisponibilidad relativa entre el grupo A (8 g:75 mg) y B (3 g:75 mg).
4 Discusión
En casos de prevalencia elevada de mastitis inducida por Staphylococcus aureus, la administración intramuscular convencional a corto plazo de cefquinoma puede mostrar una capacidad insuficiente de erradicación de patógenos (37). La tasa de curación de la mastitis en las vacas podría elevarse mediante un régimen prolongado de administración de cefquinoma (38). Sin embargo, la implementación de dicho protocolo se vio limitada por su alto costo y su impracticabilidad (13). Tras la administración de infusiones intramamarias, la concentración del fármaco en la ubre aumentará rápidamente, lo que podría mejorar la eficacia terapéutica del tratamiento de la mastitis (39).
Una deficiencia del modelo de PK de dosis múltiples es que el primer punto de tiempo de muestreo incluido en el modelo puede ocurrir después de CMáximo y TMáximo (40). Dará lugar a valores notificados más bajos para el AUC y, por lo tanto, sobreestimará los valores notificados para Cl/F y Vz/F. Además, la administración repetida de cefalosporinas puede conducir a un nivel de saturación de los sitios de unión a proteínas, lo que lleva a la producción de más metabolitos activos no unidos con el paso del tiempo sin crecimiento de T1/2 (41). Para evitar esta situación, se optó por un modelo de farmacocinética de dosis única para estudiar la farmacocinética del cefquinoma en leche. Los principales parámetros farmacocinéticos de ambas formulaciones se obtuvieron mediante un modelo no auricular.
La determinación de la vida media tiene una importancia significativa en el ámbito de la investigación y el desarrollo (42). Tras la inyección intramamaria de cefquinoma, la vida media (T1/2) de cefquinoma fueron de 5,69 ± 0,62 h y de 5,25 ± 1,62 h en el grupo A (8 g: 75 mg) y en el grupo B (3 g:75 mg), respectivamente. Este valor difiere de la inyección subcutánea única de cefquinoma en el muslo del ratón (T1/2 0,35 h) (43), inyección intravenosa de cefquinoma en caballos (T1/2 2.32 h) (44), vaca (T1/2 2.12 h) (45) y ovejas (T1/2 0,78 h) (46). Estas diferencias en los datos indican que las variaciones en la vida media del cefquinoma se deben a diferentes vías de administración y especies animales. En la práctica clínica, la frecuencia y la dosis de administración deben considerarse en función de la duración de la vida media para garantizar una concentración constante y segura del fármaco en el organismo (42). La T1/2 El número de cefquinoma en la leche obtenida de este estudio puede proporcionar una base para estimar el tiempo necesario para que el fármaco alcance un estado estacionario en la leche de vaca.
La Agencia de Evaluación de Medicamentos Veterinarios de la Unión Europea recomendó 75 mg de cefquinoma por glándula de la enfermedad como dosis de cefquinoma para el tratamiento de la mastitis (47). De manera crucial, la infusión intramamaria de sulfato de cefquinoma del grupo B (3 g:75 mg) disminuyó significativamente el volumen total sin cambiar la masa del fármaco. La reducción del volumen de infusión puede proteger la glándula mamaria de estímulos mecánicos. Después de la administración intramamaria, el cefquinoma se absorbió rápidamente, las concentraciones máximas (CMáximo) observados a las 0,25 h fueron 51786,35 ± 11948,4 ng/mL y 59763,7 ± 8403,2 ng/mL en el grupo A (8 g:75 mg) y en el grupo B (3 g:75 mg), respectivamente. La fórmula de las infusiones, que mejoró la tasa de difusión a través de la disminución del volumen, había sido la fuente de la discrepancia (48). Las AUCúltimo fueron 300558,57 ± 25052,78 h·ng/mL y 266551,32 ± 50654,84 h·ng/mL en el grupo A (8 g:75 mg) y en el grupo B (3 g:75 mg), respectivamente. El AUC depende de la dosis del fármaco y de la velocidad a la que se elimina. En nuestro estudio, la dosis efectiva de cefquinoma fue de 75 mg/glándula en todos los casos, pero la Cl/F en el grupo A fue más lenta que en el grupo B, lo que resultó en un mayor AUC.
La FDA estableció el concepto de biodisponibilidad en 1977 (49). La biodisponibilidad es la velocidad y el grado en que el ingrediente activo se absorbe de un medicamento y está disponible en el sitio de acción farmacológica. El método AUC es una forma más rápida, barata y eficaz de proporcionar valores relativos de biodisponibilidad (50). De acuerdo con la fórmula de cálculo de la biodisponibilidad relativa, el RBA es del 88,69%, lo que indica una alta similitud en la exposición clínica entre dos infusiones (51). Estudios previos han documentado que la biodisponibilidad del cefquinoma después de la administración intramuscular fue del 80,38% (52). La biodisponibilidad de la inyección subcutánea de cefquinoma >100% (53). La biodisponibilidad oral de cefixima fue de aproximadamente el 80% (54). Estos casos demuestran que la posibilidad de biodisponibilidad está estrechamente relacionada con las formas farmacéuticas de los fármacos (55).
La Cl/F es un parámetro clave en farmacocinética para evaluar la capacidad del organismo para eliminar el fármaco (56). En el presente estudio, los valores determinados de Cl/F fueron de 251,14 ± 21,82 mL/h y de 290,57 ± 53,98 mL/h para el grupo A (8 g: 75 mg) y el grupo B (3 g: 75 mg), respectivamente. Los resultados indican que la infusión intramamaria de cefquinoma del grupo B (3 g: 75 mg) presentó un proceso de eliminación del fármaco más rápido en comparación con el grupo A (8 g: 75 mg). Además, el tiempo medio de residencia (TMT) se refiere al tiempo durante el cual un fármaco permanece en interacción directa con su diana biológica (57). Estudios previos han demostrado que el tiempo de residencia se ha identificado como un predictor potencial de la eficacia del fármaco in vivo (58). En el presente estudio, la TRM fue de 7,43 ± 0,79 h y de 4,81 ± 0,78 en el grupo A (8 g:75 mg) y en el grupo B (3 g:75 mg), respectivamente. Los resultados sugieren que el grupo B (3 g: 75 mg) presentó un tiempo medio de residencia más corto. Por lo tanto, la influencia de la farmacocinética debe analizarse en función de circunstancias específicas. Los hallazgos de Cl/F sugieren que el uso de la infusión del grupo B tiene el potencial de acortar el período de retirada de la leche. La leche tiene importantes beneficios económicos para la industria láctea y la dieta en general, y un tiempo de extracción más corto es favorable. El acortamiento del período de retirada de la leche reduce la pérdida de leche al tiempo que garantiza la inocuidad alimentaria de la leche para salvaguardar la salud humana (59).
En este estudio, se detectaron concentraciones extremadamente mínimas de cefquinoma (0,43-2,70 ng/mL) en la glándula no tratada, lo que es similar a los resultados de investigaciones anteriores (24). El resultado indica que el cefquinoma exhibe una penetración limitada a través de la barrera hematopomamaria. Esto confirma el hallazgo de Rasmussen, quien observó poca difusión del cefquinoma en el tejido, e indicó que el fármaco permanece principalmente dentro de las regiones de la ubre (39). Posteriormente, Kietzmann et al. informaron que las concentraciones detectadas de cloxacilina dentro de las muestras de perfusión estaban por debajo del límite de cuantificación, lo que potencialmente sugiere que la absorción del fármaco de las regiones de la ubre a la circulación sistémica fue menor (60). Como es bien sabido, el rumen es un órgano que contiene una gran comunidad microbiana. El tratamiento sistémico puede provocar desequilibrios en el microbioma intestinal y la destrucción del ecosistema (61). Por el contrario, el enfoque de administración intramamaria prolonga la duración de la acción del fármaco en la glándula y mitiga los efectos secundarios comunes asociados con la infusión sistémica de fármacos (62).
La eficacia terapéutica de los antimicrobianos β-lactámicos se decidió por la duración de la exposición de los agentes infecciosos a concentraciones superiores a la concentración mínima inhibitoria (63). El cefquinoma exhibió una muerte dependiente del tiempo que exhibe efectos bactericidas cuando la concentración en el órgano controlado por el objetivo excedió la concentración inhibitoria mínima (MIC) del patógeno (64, 65). Los estudios han demostrado que la CMI de Staphylococcus aureus, especies de Streptococcus y Escherichia coli aisladas de vacas fue de 0,5 a 1 μg/ml, 0,25 a 0,5 μg/ml y 0,06 a 0,13 μg/ml, respectivamente (46). En el presente estudio, el cefquinoma mostró concentraciones sostenidas en glándula por encima de 1 μg/mL durante 12 h. Por lo tanto, el régimen de dosificación de 75 mg/glándula con intervalos de 12 h debe ser apropiado cuando se utiliza la perfusión intramamaria de sulfato de cefquinoma en vacas para el tratamiento de la mastitis.
En conclusión, nuestro estudio estableció un método UPLC-MS/MS para estudiar la farmacocinética de dos infusiones intramamarias de sulfato de cefquinoma. Dos infusiones exhiben un comportamiento farmacocinético similar y el RBA es del 88,69% y comparten un régimen de dosificación idéntico. Este estudio proporciona información valiosa para la medicación clínica veterinaria y la toma de decisiones.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio están incluidas en el artículo/Material complementario, las consultas adicionales pueden dirigirse a los autores correspondientes.
Declaración ética
Los estudios en animales fueron aprobados por el Comité de Uso y Cuidado de los Animales del Instituto de Investigación de Piensos de la Academia China de Ciencias Agrícolas (IFR-CAAS20230309). Los estudios se llevaron a cabo de acuerdo con la legislación local y los requisitos institucionales. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
SL: Redacción – borrador original, Redacción – revisión y edición, Metodología, Software, Validación. NY: Metodología, Software, Validación, Redacción – borrador original, Redacción – revisión y edición. YT: Curación de datos, Análisis formal, Metodología, Software, Redacción, revisión y edición. CL: Conceptualización, Escritura – borrador original. YZ: Conceptualización, Escritura – borrador original. XC: Análisis formal, Investigación, Escritura – borrador original. HW: Curación de datos, Recursos, Visualización, Escritura – borrador original. XL: Adquisición de fondos, Administración de proyectos, Redacción – borrador original, Redacción – revisión y edición. YL: Adquisición de fondos, Administración de proyectos, Supervisión, Redacción, revisión y edición.
Financiación
El/los autor/es declaran/n que se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este trabajo fue financiado por el Programa Nacional de Investigación y Desarrollo Clave de China (subvención n.º 2023YFD1800100) y el Proyecto Nacional de Investigación y Desarrollo Clave (2021YFD1800700).
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2024.1384076/full#supplementary-material
Referencias
1. Ruegg, PL. Una revisión de 100 años: detección, manejo y prevención de la mastitis. J Lácteos Sci. (2017) 100:10381–97. doi: 10.3168/jds.2017-13023
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Hadrich, JC, Wolf, CA, Lombard, J y Dolak, TM. Estimación de la producción de leche y las pérdidas de valor por el aumento del recuento de células somáticas en granjas lecheras de EE. UU. J Lácteos Sci. (2018) 101:3588–96. doi: 10.3168/jds.2017-13840
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Rainard, P, Gilbert, FB, Germon, P, y Foucras, G. Revisión invitada: una evaluación crítica de las vacunas contra la mastitis para vacas lecheras. J Lácteos Sci. (2021) 104:10427–48. doi: 10.3168/jds.2021-20434
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Kadariya, J, Smith, TC, y Thapaliya, D. Staphylococcus aureus y las enfermedades estafilocócicas transmitidas por los alimentos: un desafío continuo en la salud pública. Biomed Res Int. (2014) 2014:827965. doi: 10.1155/2014/827965
5. Mwasinga, W, Shawa, M, Katemangwe, P, Chambaro, H, Mpundu, P, M’Kandawire, E, et al. Escherichia coli multirresistente de leche cruda de vaca en el distrito de Namwala, Zambia: implicaciones para la salud pública. Antibióticos Basilea. (2023) 12:1421. doi: 10.3390/antibióticos12091421
6. Lin, WC, Hsu, KC, You, MF, Lee, KH, Chi, CH y Chen, JY. El ácido octanoico promueve la eliminación de las células tolerantes a los antibióticos y erradica las biopelículas de Staphylococcus aureus aisladas de la mastitis bovina recurrente. Biofilms. (2023) 6:100149. doi: 10.1016/j.bioflm.2023.100149
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Cheng, WN y Han, SG. Mastitis bovina: factores de riesgo, estrategias terapéuticas y tratamientos alternativos: una revisión. Australas Asiáticas J Anim Sci. (2020) 33:1699–713. doi: 10.5713/ajas.20.0156
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Caneschi, A, Bardhi, A, Barbarroja, A, y Zaghini, A. Aceites esenciales vegetales como herramienta en el control de la mastitis bovina: una actualización. Moléculas. (2023) 28:3425. doi: 10.3390/moléculas28083425
9. Dahmana, N, Destruel, PL, Facchetti, S, Braun, V, Lebouc, V, Marin, Z, et al. Complejos proteicos reversibles como una vía prometedora para el desarrollo de formulaciones de alta concentración de productos biológicos. Int J Pharm. (2023) 648:123616. doi: 10.1016/j.ijpharm.2023.123616
10. Pasca, C, Marghitas, LA, Dezmirean, DS, Matei, IA, Bonta, V, Pasca, I, et al. Eficacia de formulaciones naturales en patología de mastitis bovina: solución alternativa al tratamiento antibiótico. J Vet Res. (2020) 64:523–9. doi: 10.2478/jvetres-2020-0067
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Alper, F, Karadeniz, E, Guven, F, Cankaya, BY, Yalcin, A, Ozden, K, et al. Comparación de la eficacia del tratamiento con esteroides sistémico versus local en la mastitis granulomatosa idiopática: un estudio de cohortes. J Surg Res. (2022) 278:86–92. doi: 10.1016/j.jss.2022.04.015
12. Sharma, Y, Mahar, R, Chakraborty, A y Nainwal, N. Optimización de las variables de formulación para la encapsulación de linezolid en microesferas inhalables de policaprolactona mediante evaporación de disolvente de doble emulsión. Tuberculosis (Edinb). (2023) 143:102417. doi: 10.1016/j.tube.2023.102417
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Burke, N, y Adley, CC. Prevalencia del uso de antibióticos intramamarios en la ganadería lechera. J Dairy Res. (2021) 88:176–8. doi: 10.1017/S0022029921000431
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. González, PV, Pol, M, Pastorino, F, y Herrero, A. Cuantificación del uso de antimicrobianos en vacas lecheras y terneros predestetados en Argentina. Prev Vet Med. (2015) 122:273–9. doi: 10.1016/j.prevetmed.2015.10.019
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Kasravi, R, Bolourchi, M, Farzaneh, N, Seifi, HA, Barin, A, Hovareshti, P, et al. Eficacia del tratamiento intramamario convencional y extendido de la mastitis subclínica persistente con cefquinoma en vacas lecheras lactantes. Trop Anim Salud Prod. (2011) 43:1203–10. doi: 10.1007/s11250-011-9826-0
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Uney, K, Altan, F, y Elmas, M. Desarrollo y validación de un método de cromatografía líquida de alta resolución para la determinación de las concentraciones de cefquinoma en plasma de ovejas y su aplicación a estudios farmacocinéticos. Agentes antimicrobianos quimiotera. (2011) 55:854–9. doi: 10.1128/AAC.01126-10
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. El-Tahawy, AO, Said, AA, Shams, GA, Hassan, HM, Hassan, AM, Amer, SA, et al. Evaluación de la eficacia del cefquinoma en el control de la colibacilosis aviar y detección de sus residuos mediante cromatografía líquida de alta resolución (HPLC). Saudi J Biol Sci. (2022) 29:3502–10. doi: 10.1016/j.sjbs.2022.02.029
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Bao, Z, Bufton, J, Hickman, RJ, Aspuru-Guzik, A, Bannigan, P y Allen, C. Revolucionando el desarrollo de formulaciones de fármacos: el creciente impacto del aprendizaje automático. Adv Droga Deliv Rev. (2023) 202:115108. doi: 10.1016/j.addr.2023.115108
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. DiMasi, JA, Grabowski, HG, y Hansen, RW. Innovación en la industria farmacéutica: nuevas estimaciones de costes de investigación y desarrollo. J Salud Econ. (2016) 47:20–33. doi: 10.1016/j.jhealeco.2016.01.012
20. Mao, Y, Chen, Y, Liu, C, He, X, Zheng, Y, Chen, X, et al. Nanosuspensión oleosa de sulfato de cefquinoma diseñada para mejorar su biodisponibilidad en el tratamiento de infecciones veterinarias. Int J Nanomedicina. (2022) 17:2535–53. doi: 10.2147/IJN. S348822
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Amiridis, GS, Fthenakis, GC, Dafopoulos, J, Papanikolaou, T, y Mavrogianni, VS. Uso del cefquinoma para la prevención y el tratamiento de la endometritis bovina. J Vet Pharmacol Ther. (2003) 26:387–90. doi: 10.1046/j.1365-2885.2003.00490.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Shpigel, Nueva York. Contribución al tratamiento de la mastitis bovina aguda con cefquinoma. Tierarztliche Praxis. (1997) 3:200–6.
23. Xiao, X, Chen, X, Yan, K, Jiang, L, Li, R, Liu, Y, et al. Integración PK/PD y corte farmacodinámico del cefquinoma contra la mastitis de vaca debido a Escherichia coli. J Vet Pharmacol Ther. (2022) 45:83–91. doi: 10.1111/jvp.13012
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Li, Y, Wang, L, Gu, X, Zeng, Z, He, L, Yang, F, et al. Farmacocinética y residuos de Cefquinoma en Leche de vacas lecheras chinas lactantes después de la administración intramamaria. J Integr Agr. (2014) 13:2750–7. doi: 10.1016/S2095-3119(14)60757-7
25. Kappeli, N, Morach, M, Zurfluh, K, Corti, S, Nuesch-Inderbinen, M y Stephan, R. Tipos de secuencia y perfiles de resistencia a los antimicrobianos de Streptococcus uberis aislado de mastitis bovina. Front Vet Sci. (2019) 6:234. doi: 10.3389/fvets.2019.00234
26. Tian, XY, Zheng, N, Han, RW, Ho, H, Wang, J, Wang, YT, et al. Genes de resistencia antimicrobiana y virulencia de Streptococcus aislados de vacas lecheras con mastitis en China. Patogénesis microb. (2019) 131:33–9. doi: 10.1016/j.micpath.2019.03.035
27. Schmiedel, J, Falgenhauer, L, Domann, E, Bauerfeind, R, Prenger-Berninghoff, E, Imirzalioglu, C, et al. Enterobacterias multirresistentes productoras de betalactamasas de espectro extendido de humanos, animales de compañía y caballos en Hesse Central, Alemania. BMC Microbiol. (2014) 14:187. doi: 10.1186/1471-2180-14-187
Resumen de PubMed | Texto completo de Crossref | Google Académico
28. Yang, Q, Zhang, C, Liu, X, Zhang, L, Yong, K, Lv, Q, et al. Farmacocinética y farmacodinamia del cefquinoma frente a Streptococcus agalactiae en un modelo de mastitis murina. PLoS Uno. (2023) 18:e0278306. doi: 10.1371/journal.pone.0278306
29. Monogue, ML, Kuti, JL y Nicolau, DP. Optimización de las estrategias de dosificación de antibióticos para el tratamiento de infecciones por gramnegativos en la era de la resistencia. Experta Rev Clin Pharmacol. (2016) 9:459–76. doi: 10.1586/17512433.2016.1133286
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Sy, SK, Zhuang, L y Derendorf, H. Farmacocinética y farmacodinamia en la optimización de dosis de antibióticos. Experto Opin Droga Metab Toxicol. (2016) 12:93–114. doi: 10.1517/17425255.2016.1123250
31. Hebbink, GA, Jaspers, M, Peters, H, y Dickhoff, B. Desarrollos recientes en formulaciones de mezclas de lactosa para la inhalación de polvo seco a base de portadores. Adv Droga Deliv Rev. (2022) 189:114527. doi: 10.1016/j.addr.2022.114527
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. Stockler, RM, Morin, DE, Lantz, RK y Constable, PD. Efecto de la frecuencia de ordeño y el intervalo de dosificación en la farmacocinética de la cefapirina después de la infusión intramamaria en vacas lecheras lactantes. J Lácteos Sci. (2009) 92:4262–75. doi: 10.3168/jds.2008-1916
Resumen de PubMed | Texto completo de Crossref | Google Académico
33. Ogbonna, J, Cunha, E, Attama, AA, Ofokansi, KC, Ferreira, H, Pinto, S, et al. Superación de retos en la formulación pediátrica con un enfoque de diseño centrado en el paciente: un estudio de prueba de concepto sobre el diseño de una solución oral de un fármaco amargo. Productos farmacéuticos (Basilea). (2022) 15:1331. doi: 10.3390/ph15111331
34. Li, B, Gong, SY, Zhou, XZ, Yang, YJ, Li, JY, Wei, XJ, et al. Determinación del agente antibacteriano tilmicosina en plasma porcino por LC/MS/MS y su aplicación a la farmacocinética. Cromatografía Biomédica. (2017) 31:3825. doi: 10.1002/bmc.3825
Resumen de PubMed | Texto completo de Crossref | Google Académico
35. Yang, F, Chen, Y, Liu, J, Ji, Y, Wang, K, Jiang, X, et al. Evaluación del efecto matriz en la determinación de estereoisómeros de mevinfos en tabaco mediante cromatografía de fluidos supercríticos espectrometría de masas en tándem. Microchem J. (2022) 175:107174. doi: 10.1016/j.microc.2022.107174
36. Ferrer, C, Lozano, A, Agüera, A, Girón, AJ, y Fernández-Alba, AR. Superación de los efectos de la matriz mediante el enfoque de dilución en métodos multirresiduos para frutas y hortalizas. J Cromatogr A. (2011) 1218:7634–9. doi: 10.1016/j.chroma.2011.07.033
Resumen de PubMed | Texto completo de Crossref | Google Académico
37. Shpigel, NY, Kass, PH, y Saran, A. Un ensayo de campo aleatorizado comparativo sobre el tratamiento antibiótico intramamario e intramuscular de la mastitis subclínica por Staphylococcus aureus en vacas lecheras. J Vet Med A Physiol Pathol Clin Med. (2006) 53:418–22. doi: 10.1111/j.1439-0442.2006.00848.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
38. Swinkels, JM, Lam, TJ, Green, MJ y Bradley, AJ. Efecto del tratamiento prolongado con cefquinoma sobre la persistencia clínica o recurrencia de la mastitis clínica ambiental. Veterinario J. (2013) 197:682–7. doi: 10.1016/j.tvjl.2013.03.010
39. Ehinger, AM, Schmidt, H y Kietzmann, M. Distribución tisular del cefquinoma después de la administración intramamaria y «sistémica» en la ubre bovina perfundida aislada. Veterinario J. (2006) 172:147–53. doi: 10.1016/j.tvjl.2005.02.029
Resumen de PubMed | Texto completo de Crossref | Google Académico
40. Gorden, PJ, Kleinhenz, MD, Wulf, LW, KuKanich, B, Lee, CJ, Wang, C, et al. Alteración de la farmacocinética plasmática del clorhidrato de ceftiofur en vacas afectadas por mastitis clínica grave. J Lácteos Sci. (2016) 99:505–14. doi: 10.3168/jds.2015-10239
Resumen de PubMed | Texto completo de Crossref | Google Académico
41. Halstead, SL, Walker, RD, Baker, JC, Holland, RE, Stein, GE, y Hauptman, JG. Evaluación farmacocinética de ceftiofur en suero, líquido de la cámara tisular y secreciones bronquiales de terneros sanos criados en carne. Can J Vet Res. (1992) 56:269–74.
42. Smith, DA, Beaumont, K, Maurer, TS y Di, L. Relevancia de la vida media en el diseño de fármacos. J Med Chem. (2018) 61:4273–82. doi: 10.1021/acs.jmedchem.7b00969
43. Wang, J, Shan, Q, Ding, H, Liang, C y Zeng, Z. Farmacodinámica del cefquinoma en un modelo neutropénico de muslo de ratón de infección por Staphylococcus aureus. Agentes antimicrobianos quimiotera. (2014) 58:3008–12. doi: 10.1128/AAC.01666-13
Resumen de PubMed | Texto completo de Crossref | Google Académico
44. Uney, K, Altan, F, Altan, S, Erol, H, Arican, M y Elmas, M. Farmacocinética del plasma y del líquido sinovial del cefquinoma tras la administración de múltiples dosis en caballos. J Vet Pharmacol Ther. (2017) 40:239–47. doi: 10.1111/jvp.12362
Resumen de PubMed | Texto completo de Crossref | Google Académico
45. Ahmad, I, Hao, H, Huang, L, Sanders, P, Wang, X, Chen, D, et al. Integración de PK/PD para la optimización de la dosis de cefquinoma frente a Staphylococcus aureus causante de septicemia en bovinos. Microbiol frontal. (2015) 6:588. doi: 10.3389/fmicb.2015.00588
46. Zonca, A, Gallo, M, Locatelli, C, Carli, S, Moroni, P, Villa, R, et al. Comportamiento del sulfato de cefquinoma después de la administración intramamaria en vacas sanas e infectadas. J Lácteos Sci. (2011) 94:3455–61. doi: 10.3168/jds.2010-4109
Resumen de PubMed | Texto completo de Crossref | Google Académico
47. Yu, Y, Zhou, YF, Li, X, Chen, MR, Qiao, GL, Sun, J, et al. Evaluación de la dosis de Cefquinoma mediante modelización farmacocinética/farmacodinámica en un modelo murino de mastitis por Staphylococcus aureus. Microbiol frontal. (2016) 7:1595. doi: 10.3389/fmicb.2016.01595
48. El-Hewaity, M, Abd, ELA, Soliman, A, y Aboubakr, M. Farmacocinética comparativa de Cefquinome (Cobactan 2,5%) después de repetidas administraciones intramusculares en ovejas y cabras. J Vet Med. (2014) 2014:949642. doi: 10.1155/2014/949642
49. Tsekouras, AA y Macheras, P. Reexaminando la biodisponibilidad de la digoxina después de medio siglo: tiempo de cambios en los conceptos de biodisponibilidad. Pharm Res. (2021) 38:1635–8. DOI: 10.1007/S11095-021-03121-W
Resumen de PubMed | Texto completo de Crossref | Google Académico
50. Kihal, A, Rodríguez-Prado, M, y Calsamiglia, S. Biodisponibilidad relativa de 3 fuentes de metionina no degradables en el rumen en vacas lecheras utilizando la técnica del área bajo la curva. JDS Commun. (2021) 2:182–5. doi: 10.3168/jdsc.2020-0045
Resumen de PubMed | Texto completo de Crossref | Google Académico
51. Giri, N, Lam, LH, LaBadie, RR, Krzyzaniak, JF, Jiang, H, Hee, B, et al. Evaluación del efecto de una nueva formulación, alimento o un inhibidor de la bomba de protones sobre la biodisponibilidad relativa del inhibidor suavizado glasdegib (PF-04449913) en voluntarios sanos. Quimioterapia contra el cáncer Pharmacol. (2017) 80:1249–60. doi: 10.1007/s00280-017-3472-9
52. Liu, B, Zhang, C, Zhang, X, Yang, S, Yu, J, Sun, J, et al. Farmacocinética y biodisponibilidad del cefquinoma en jabalíes cruzados. J Vet Pharmacol Ther. (2012) 35:611–4. doi: 10.1111/j.1365-2885.2011.01360.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
53. Corum, O, Corum, DD, Er, A y Uney, K. Farmacocinética del cefquinoma después de administraciones subcutáneas únicas y repetidas en ovejas. J Vet Pharmacol Ther. (2019) 42:647–53. doi: 10.1111/jvp.12750
Resumen de PubMed | Texto completo de Crossref | Google Académico
54. Razdan, K, Sahajpal, NS, Singh, K, Singh, H, Singh, H y Jain, SK. Formulación de microesferas de cefixima de liberación sostenida con mayor biodisponibilidad oral y potencial antibacteriano. Ther Deliv. (2019) 10:769–82. doi: 10.4155/tde-2019-0057
Resumen de PubMed | Texto completo de Crossref | Google Académico
55. Vranikova, B, y Gajdziok, J. Biodisponibilidad y factores que influyen en su tasa. Granja Ceska Slov. (2015) 64:7–13. Disponible en: https://www.prolekare.cz/casopisy/ceska-slovenska-farmacie/2015-1-2-1/biologicka-dostupnost-leciva-a-moznosti-jejiho-ovlivnovani-52403#
56. Whiteley, WJD, y Hardman, JG. Análisis farmacocinético. Anaesth Medicina de Cuidados Intensivos. (2023) 24:479–81. doi: 10.1016/j.mpaic.2023.05.003
57. Bernetti, M, Masetti, M, Rocchia, W, y Cavalli, A. Cinética de la unión a la droga y el tiempo de residencia. Annu Rev Phys Chem. (2019) 70:143–71. doi: 10.1146/annurev-physchem-042018-052340
58. Pan, AC, Borhani, DW, Dror, RO y Shaw, DE. Determinantes moleculares de la cinética de unión fármaco-receptor. Droga Discov hoy. (2013) 18:667–73. doi: 10.1016/j.drudis.2013.02.007
59. Huang, W, Qiu, Q, Chen, M, Shi, J, Huang, X, Kong, Q, et al. Determinación de 18 antibióticos en orina mediante LC-QqQ-MS/MS. J Cromatógrafo B. (2019) 1105:176–83. doi: 10.1016/j.jchromb.2018.12.019
Resumen de PubMed | Texto completo de Crossref | Google Académico
60. Kietzmann, M, Niedorf, F y Gossellin, J. Distribución tisular de cloxacilina después de la administración intramamaria en la ubre bovina perfundida aislada. BMC Vet Res. (2010) 6:46. doi: 10.1186/1746-6148-6-46
Resumen de PubMed | Texto completo de Crossref | Google Académico
61. Hu, X, Li, S, Fu, Y y Zhang, N. Dirigirse a la microbiota intestinal como posible terapia para la mastitis. Eur J Clin Microbiol. (2019) 38:1409–23. doi: 10.1007/s10096-019-03549-4
Resumen de PubMed | Texto completo de Crossref | Google Académico
62. Cruz, M, Fernandes, M, Monteiro, A, Teles, JA, Anadon, A, y Reyes, F. Agotamiento de residuos tisulares de moxidectina en corderos (Ovis aries) después de la administración subcutánea. Food Addit Contam Part A Chem Anal Control Expo Risk Assess. (2018) 35:1278–85. doi: 10.1080/19440049.2018.1465207
Resumen de PubMed | Texto completo de Crossref | Google Académico
63. McKellar, QA, Sánchez, BS, y Jones, DG. Relaciones farmacocinéticas/farmacodinámicas de los fármacos antimicrobianos utilizados en medicina veterinaria. J Vet Pharmacol Ther. (2004) 27:503–14. doi: 10.1111/j.1365-2885.2004.00603.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
64. Zhang, L, Xie, H, Wang, H, Ding, H, Zhang, G y Hu, J. Tasa de mortalidad y evaluación de la integración PK/PD ex vivo de Cefquinome contra Actinobacillus pleuropneumoniae. Front Vet Sci. (2021) 8:751957. doi: 10.3389/fvets.2021.751957
Resumen de PubMed | Texto completo de Crossref | Google Académico
65. Jiang, LJ, Xiao, X, Yan, KX, Deng, T y Wang, ZQ. Modelización farmacocinética y farmacodinámica ex vivo y evaluación de regímenes óptimos de Cefquinome frente a mastitis bovina causada por Staphylococcus aureus. Front Vet Sci. (2022) 9:837882. doi: 10.3389/fvets.2022.837882
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: farmacocinética, biodisponibilidad relativa, UPLC-MS/MS, infusión intramamaria de sulfato de cefquinoma, leche de vaca
Cita: Li S, Yu N, Tang Y, Liu C, Zhang Y, Chen X, Wu H, Li X y Liu Y (2024) Estudio de farmacocinética y biodisponibilidad relativa de dos infusiones intramamarias de sulfato de cefquinoma en leche de vaca. Frente. Vet. Sci. 11:1384076. doi: 10.3389/fvets.2024.1384076
Recibido: 08 de febrero de 2024; Aceptado: 26 de febrero de 2024;
Publicado: 11 marzo 2024.
Editado por:
Fan Yang, Universidad de Ciencia y Tecnología de Henan, China
Revisado por:
Qi Shan, Academia China de Ciencias Pesqueras, China
Jianzhong Wang, Universidad Agrícola de Shanxi, China
Dongping Zeng, Universidad Agrícola del Sur de China, China
Derechos de autor © 2024 Li, Yu, Tang, Liu, Zhang, Chen, Wu, Li y Liu. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Xiubo Li, lixiubo@caas.cn; Yiming Liu, liuyiming@caas.cn
†Estos autores han contribuido igualmente a este trabajo y comparten la primera autoría
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía