Evaluación de Bcl-2 como marcador para la predicción de enfermedad renal crónica en gatos
Evaluación de Bcl-2 como marcador para la predicción de enfermedad renal crónica en gatos
 Pattiya Pila1
Pattiya Pila1  Phongsakorn Chummitri2,3
Phongsakorn Chummitri2,3  Prapas Patchanee4
Prapas Patchanee4  Kidsadagn Pringproa3
Kidsadagn Pringproa3  Kakanang Piyarungsri1,2*
Kakanang Piyarungsri1,2*- 1Departamento de Clínica de Animales de Compañía y Vida Silvestre, Facultad de Medicina Veterinaria, Universidad de Chiang Mai, Chiang Mai, Tailandia
- 2Centro de Investigación de Producción y Desarrollo de Productos e Innovaciones para la Salud y la Producción Animal, Universidad de Chiang Mai, Chiang Mai, Tailandia
- 3Departamento de Biociencias Veterinarias y Salud Pública Veterinaria, Facultad de Medicina Veterinaria, Universidad de Chiang Mai, Chiang Mai, Tailandia
- 4Departamento de Clínica de Animales de Consumo, Facultad de Medicina Veterinaria, Universidad de Chiang Mai, Chiang Mai, Tailandia
La enfermedad renal crónica (ERC) es una afección frecuente en gatos de edad avanzada. El Bcl-2 está relacionado con la enfermedad renal a través de los procesos de apoptosis y fibrosis. El propósito de este estudio es examinar los niveles de Bcl-2 en ERC y gatos clínicamente sanos de la misma edad con el fin de evaluar la relación entre los niveles de Bcl-2, la señalización y los parámetros sanguíneos en gatos con ERC. Los niveles circulantes de Bcl-2 se determinaron mediante un inmunoensayo en veinticuatro gatos con ERC y once gatos clínicamente sanos de la misma edad mediante la utilización del modelo lineal general (GLM), la correlación de Pearson, el análisis de componentes principales (PCA), las curvas ROC, el modelo de riesgo de Cox y el análisis de supervivencia de Kaplan-Meier. Todos ellos se realizaron con el fin de explorar los niveles de Bcl-2 y su conexión con otras variables. La intensidad inmunohistoquímica de Bcl-2 se clasificó en cada glomérulo y tubulointersticio. Se realizó la prueba de McNemar con el fin de comparar la expresión de Bcl-2 en los dos sitios de tejido renal. El Bcl-2 circulante de los gatos con ERC fue significativamente menor que el de los gatos clínicamente sanos de la misma edad (P = 0,034). La presencia de Bcl-2 circulante (P < 0,01) y la gravedad de la ERC (P = 0,02) se relacionaron con el tiempo de supervivencia de los gatos con ERC. El área bajo la curva (AUC) de Bcl-2 para la detección de ERC fue de 0,723. En gatos, la disminución de Bcl-2 circulante se asoció con un aumento del BUN sanguíneo, los niveles de creatinina y la gravedad de la ERC. La expresión de la proteína Bcl-2 se redujo en los tejidos renales de los gatos con ERC a medida que avanzaba la enfermedad, lo que resultó en una disminución en su tiempo de supervivencia. Este estudio demostró que Bcl-2 puede ser eficaz en el diagnóstico de la ERC felina.
Introducción
La enfermedad renal crónica (ERC) es una enfermedad común en gatos mayores. La ERC puede afectar a gatos de diversas edades y razas (1). La prevalencia de ERC felina fue del 1,9% en Estados Unidos (2), del 20% en Australia (3), así como del 0,63 y 2,37% en Bangkok y Chiang Mai, Tailandia, respectivamente (4, 5). La ERC felina opera en cuatro estadios basados en la creatinina sérica y la dimetilarginina simétrica (SDMA) (6). Además, es posible que se produzca una subestadificación debido a la proteinuria y la hipertensión.
La tasa de filtración glomerular (TFG) se utiliza para evaluar la función renal. El aclaramiento de inulina es el estándar de oro para medir la TFG. Sin embargo, este método es poco práctico y requiere mucho tiempo. Aunque la creatinina sérica sigue siendo un criterio para determinar el FG, es normal hasta que el GRF se reduce en casi un 75%. Además, puede estar influenciado por factores no renales, como la masa muscular.
La familia de proteínas Bcl-2 desempeña un papel fundamental en la regulación del proceso de apoptosis. Las proteínas de la familia Bcl-2 están reguladas por la vía intrínseca de la apoptosis, que puede ser activada por el daño del ADN, el estrés oxidativo, la radiación, la activación del oncogén y la privación de nutrientes. Hay tres clases de proteínas de la familia Bcl-2 (antiapoptosis, proapoptosis y proteínas solo BH3) que se unen y regulan los antiapoptóticos para promover la apoptosis (7). Bcl-2 es un gen antiapoptótico que tiene una correlación inversa con Bax, como se demostró en el estudio previo de sujetos con obstrucción ureteral unilateral (UUO), por lo que se demostró que los niveles de Bcl-2 disminuirán durante la UUO (8, 9). Los niveles de Bcl-2 de los pacientes con enfermedad renal terminal, que se mantuvieron en hemodiálisis, experimentaron una disminución de la expresión en comparación con el grupo de ERC (10). La falta de Bcl-2 aumentará la expresión de Bax, que promueve la liberación de citocromo C y la fragmentación de la membrana externa mitocondrial. Además, la expresión de Bax también conducirá a la activación de la caspasa-3 y a la muerte celular (7, 8). En otro estudio en humanos, se encontró que una deposición de miofibroblastos en el área intersticial después de la muerte celular puede inducir daño renal irreversible. Además, se sabe que la fibrosis renal también provoca enfermedad renal crónica (11).
Sin embargo, se han realizado algunos estudios que han investigado los niveles de Bcl-2 en gatos con ERC. Por lo tanto, este estudio tuvo como objetivo comparar los niveles de Bcl-2 entre la ERC y gatos clínicamente sanos de la misma edad. Esto se realizó con el fin de determinar la correlación entre los niveles de Bcl-2, la señalización y los parámetros sanguíneos de gatos con ERC, así como para determinar el nivel de Bcl-2 en los tejidos renales de gatos con ERC, tanto en aspectos cuantitativos como cualitativos mediante técnicas de inmunohistoquímica.
Materiales y métodos
Animales y recogida de muestras
Se incluyeron 11 gatos con ERC y 5 clínicamente normales de la misma edad. Los gatos con ERC se presentaron en el Hospital de Pequeños Animales de la Facultad de Medicina Veterinaria de la Universidad de Chiang Mai. No hubo restricciones de género o raza para estos gatos con ERC. Sin embargo, la edad debe ser de ≥1 años con niveles de creatinina sérica >6,1 mg/dl; una gravedad específica de la orina de < 035,35; y niveles de nitrógeno ureico en sangre >3 mg/dl, o con una estructura renal anormal que se revela por ultrasonido, como en el riñón pequeño, el riñón poliquístico y la hidronefrosis. Además, los gatos con ERC deben tener azotemia o estructura renal anormal durante más de 11 meses antes de ser incluidos en el estudio. También se excluyeron si tenían hipertiroidismo, otros problemas relacionados con la tiroides o si se les alimentaba con una dieta restringida en fósforo. Además, se examinaron 14 gatos clínicamente normales de la misma edad y no se encontró ningún signo de ERC. Además, las personas deben pasar un examen físico de rutina y pruebas químicas sanguíneas adicionales para ser elegibles. Todos los gatos clínicamente normales de la misma edad tenían niveles séricos de SDMA < 25 μg/dL, que estaba dentro del intervalo de referencia. Además, los gatos clínicamente normales de la misma edad se seleccionaron al azar sin tener en cuenta el sexo o la raza. Los criterios de exclusión de la ERC y de los gatos sanos se establecieron como aquellos gatos que poseían otras enfermedades sistémicas y/o infecciones por retrovirus. El siguiente comité de ética aprobó todos los gatos para la experimentación con animales: la Facultad de Medicina Veterinaria de la Universidad de Chiang Mai Nº S2563/<>.
Se recogieron muestras de sangre y orina de ambos grupos. Se recogieron muestras de sangre de la vena cefálica o safena. Se almacenaron en tubos de EDTA (0,5 ml) y tubos de heparina (1 ml) con el fin de analizar el hemograma completo y la química sanguínea. Se recogió un ml de cada muestra de sangre en tubos de suero VACUETTE (Greiner Bio-One, Kremsmünster, Austria) con el fin de obtener suero con el fin de determinar el Bcl-2 circulante. Las muestras de suero se almacenaron a -20 °C para su posterior análisis. Se utilizó el procedimiento de cistocentesis para la obtención de muestras de orina para análisis de orina. Se obtuvieron diecisiete tejidos renales de gatos que murieron durante el estudio de ERC en el Hospital de Pequeños Animales de la Facultad de Medicina Veterinaria de la Universidad de Chiang Mai. Estos tejidos renales se analizaron con el fin de evaluar la intensidad de inmunotinción de Bcl-2. El marco conceptual de nuestra investigación se muestra esquemáticamente en la Figura 1.®
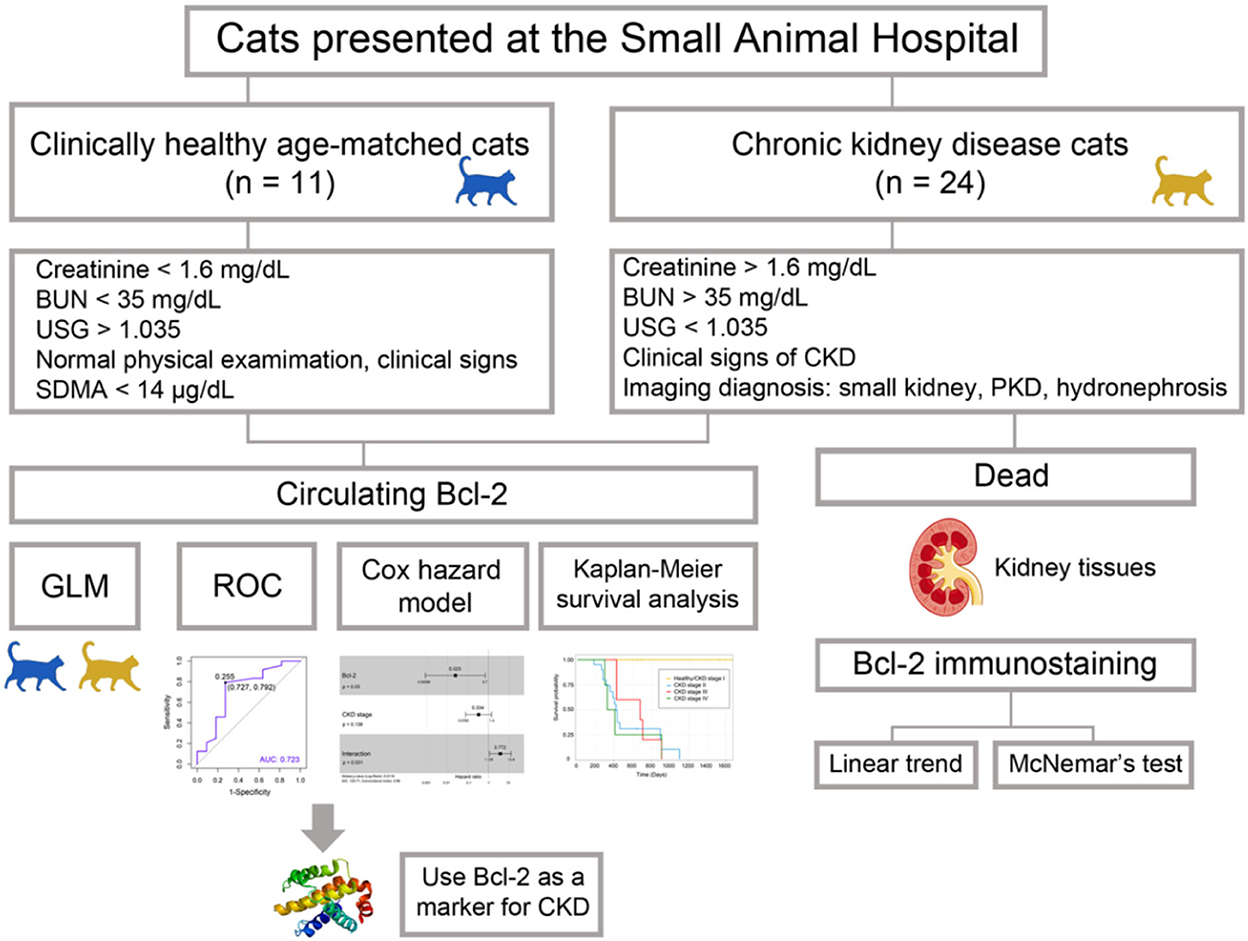 Figura 1. El flujo de trabajo del experimento. El objetivo de los estudios de Bcl-2 es determinar la eficacia de Bcl-2 como biomarcador en la enfermedad renal crónica felina.
Figura 1. El flujo de trabajo del experimento. El objetivo de los estudios de Bcl-2 es determinar la eficacia de Bcl-2 como biomarcador en la enfermedad renal crónica felina.
Análisis de manchas de puntos
Los sueros de gato se diluyeron con PBS (1:1) y se incubaron a 95 °C durante 5 min. La membrana de PVDF se empapó con metanol y se colocó sobre papel de filtro Whatman empapado. Se dejaron caer tres μl de suero diluido en el PVDF (Bio-Rad, Hercules, CA, EE. UU.) y se secaron. Luego, se bloqueó con un tampón de bloqueo durante 30 minutos a temperatura ambiente. A continuación, el PVDF se incubó con un anticuerpo monoclonal primario anti-Bcl-2 de ratón (BioLegend, San Diego, CA, EE.UU.) (dilución 1:1.000) dentro de un tampón de bloqueo a temperatura ambiente durante 2 h. A continuación, se incubó con IgG secundaria de ratón HRP (BioLegend) (dilución 1:2.000) en un tampón de bloqueo durante 45 min a temperatura ambiente. Finalmente, la membrana se tiñó con un sustrato DAB y se secó a temperatura ambiente. Se preparó otra membrana de PVDF con el fin de determinar la proteína total en cada suero. Este PVDF se ha teñido con tinción Ponceau S (Sigma-Aldrich, St. Louis, MO, EE. UU.) durante 10 min a temperatura ambiente. El estudio de imágenes LiteTM (LI-COR, Lincoln, NE, USA) para cuantificar la densitometría de las proteínas, las cuales se encontraban en la relación Bcl-2/Ponceau S (12, 13). Cada mancha de puntos típica se convirtió a escala de grises antes de cuantificar la densitometría de proteínas.
Inmunohistoquímica
Los tejidos renales se obtuvieron de la unidad de autopsias de la Facultad de Medicina Veterinaria de la Universidad de Chiang Mai. Cada portaobjetos fue desparafinado con xileno durante 10 min. Luego, se rehidrató con etanol absoluto, etanol al 90%, etanol al 70% y etanol al 50% durante 5 min/cada paso. A continuación, cada portaobjetos se calentó con un tampón de citrato con el fin de recuperar el antígeno. Las rodajas se colocaron en un recipiente con tampón cítrico a un pH de 6,0 y se incubaron en el microondas, 700 w durante 20 min. Después de eso, los portaobjetos se bloquearon con peroxidasa endógena en peróxido de hidrógeno al 3% durante 5 min y se lavaron con PBST tres veces durante 5 min cada uno. Se añadieron 200 μl de albúmina sérica bovina al 2,5% en cada portaobjetos y se incubaron durante 5 min. El anticuerpo primario se aplicó mediante la caída de 200 μl de un anticuerpo primario que se diluyó con PBS al 1% en las secciones de los portaobjetos y luego se incubó a 37 °C durante 2 h. El portaobjetos se incubó con un anticuerpo primario monoclonal de ratón anti-Bcl-2 (BioLegend) (dilución 1:200) en un tampón de bloqueo a 37 °C durante 2 h y luego todos los portaobjetos se lavaron con PBS, tres veces durante 5 min. Los 200 μl de suero de cabra normal (1:5) se añadieron a temperatura ambiente durante 30 min y se lavaron con PBS, tres veces durante 5 min. A continuación, se añadieron 200 μl de IgG secundaria anti-ratón de cabra HRP (BioLegend) (dilución 1:200) en un tampón de bloqueo durante 45 min a temperatura ambiente y luego se lavó con PBS, tres veces durante 5 min. Se utilizó sustrato DAB con el fin de teñir durante 5 min, así como terminar la reacción enjuagando con agua corriente del grifo. Los portaobjetos se tiñeron con hematoxilina durante 10 s, litio durante 10 s y luego se lavaron con agua destilada. Finalmente, se realizó el proceso de montaje y recubrimiento de las diapositivas. El control negativo se llevó a cabo mediante la sustitución del anticuerpo primario por el suero normal de ratón (1:200). La inmunotinción se visualizó y escaneó con un escáner de diapositivas MIDI Pannoramic (3D HISTECH, Budapest, Hungría). La base de puntuación fue semicuantitativa y se puntuó de 0 a 2 (14), de la siguiente manera: grado 0 es sin tinción; el grado 0,5 es tinción de trazas; El grado 1 es tinción débil; y el grado 2 es una tinción fuerte. Para determinar la puntuación se utilizó la siguiente ecuación:
Puntuación de intensidad=[(0.5×N0.5)+(1×N1)+(2×N2)]/NPuntuación de intensidad=[(0.5×N0.5)+(1×N1)+(2×N2)]/N
Análisis estadístico
Se compararon los niveles circulantes de Bcl-2 entre la ERC y los gatos clínicamente normales de la misma edad utilizando el modelo lineal general (GLM). La correlación entre el Bcl-2 circulante, la señalización y los parámetros sanguíneos se determinó mediante el método de correlación de Pearson. La asociación entre el tiempo de supervivencia de los gatos con ERC y las variables potenciales se investigó mediante el modelo de riesgo de Cox y el análisis de supervivencia de Kaplan-Meier. El área bajo la curva de Bcl-2 a los efectos de la detección de la ERC se logró utilizando la característica de funcionamiento del receptor. En cuanto a las pruebas estadísticas y las presentaciones gráficas, se utilizaron los siguientes paquetes de R: cluster, corrplot, factoextra, ggfortify, ggplot2, pROC, RColorBrewer, survival, survminer y viridis. Con el fin de identificar los factores relacionados con la progresión de la ERC, se empleó un modelo de riesgo proporcional de Cox. Además, se realizó un análisis de regresión de Cox paso a paso hacia atrás en todas las variables con una p < 0,20. La tendencia lineal estima los interceptos y las pendientes de las tendencias medias para el estadio de ERC y la tinción de IHQ Bcl-2. Además, se utilizó la prueba de McNemar para comparar la expresión de Bcl-2 de las dos localizaciones de los tejidos renales; el resultado con P < 0,05 se consideró significativo. Se utilizaron los paquetes GraphPad Prism 7 (GraphPad Software, San Diego, CA, EE. UU.) o R (The R Foundation) para visualizar los datos adquiridos a partir del análisis estadístico.
Resultados
La inmunotinción de Bcl-2 se detectó en las células del epitelio glomerular y tubular del gato con ERC de los tejidos renales (n = 17) (Figuras 2A-D). Cuando se examinó en los sitios glomerulares, se encontró la proteína Bcl-2 en la cápsula de Bowman, el túbulo contorneado proximal (PCT) y el túbulo contorneado distal (DCT), como se muestra en las Figuras 2A y B. También se identificó la inmunotinción de Bcl-2 en el túbulo contorneado distal y en el conducto colector de los túbulos renales (Figuras 2C, D). No hubo diferencias en la intensidad media de la tinción de Bcl-2 en el glomerular (0,2 ± 0,27) y en el tubulointersticio (0,19 ± 0,32).
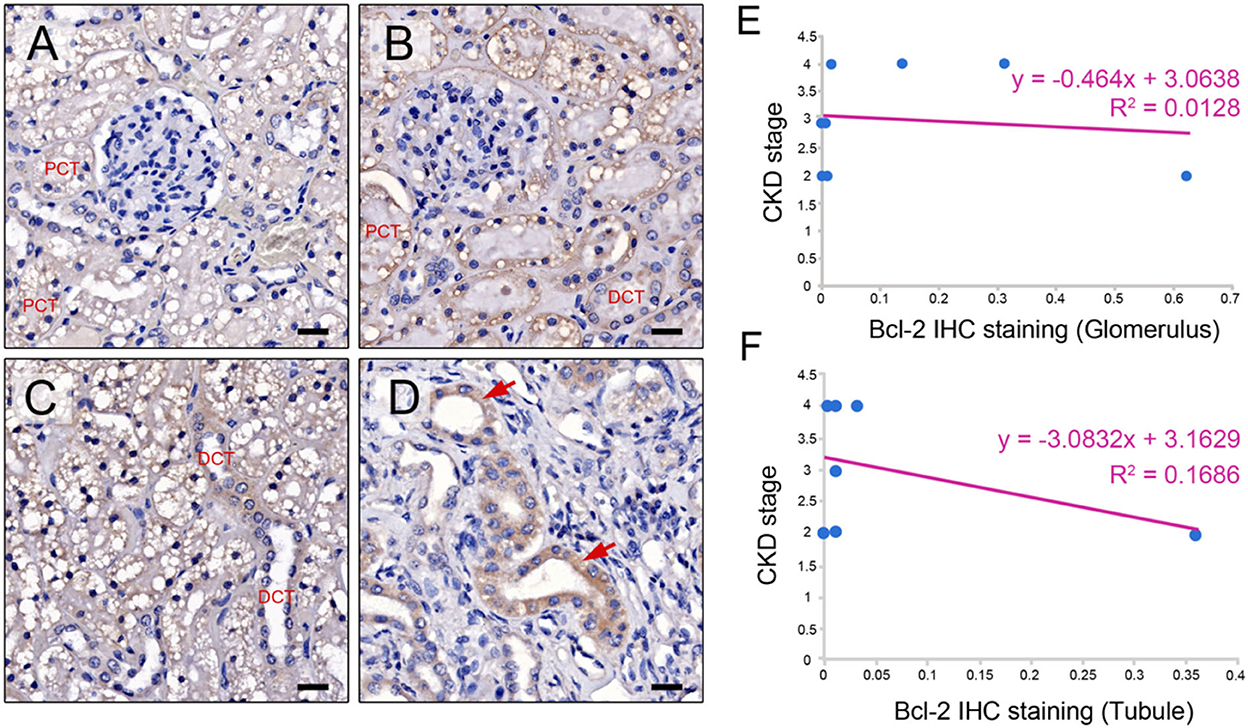 Figura 2. Expresión de la proteína Bcl-2. Imágenes representativas de IHQ que ilustran el rango de intensidad de tinción para Bcl-2 en la cápsula de Bowman, el túbulo contorneado proximal (PCT), el túbulo contorneado distal (DCT) (A, B), el túbulo contorneado distal (DCT) (C) y el conducto colector en los gatos con ERC (flechas rojas) (D). Aumento original 400 × . Barra de escala = 20 μm. El estadio de ERC y la tinción de Bcl-2 se correlacionan en el glomérulo y (E) y el túbulo (F).
Figura 2. Expresión de la proteína Bcl-2. Imágenes representativas de IHQ que ilustran el rango de intensidad de tinción para Bcl-2 en la cápsula de Bowman, el túbulo contorneado proximal (PCT), el túbulo contorneado distal (DCT) (A, B), el túbulo contorneado distal (DCT) (C) y el conducto colector en los gatos con ERC (flechas rojas) (D). Aumento original 400 × . Barra de escala = 20 μm. El estadio de ERC y la tinción de Bcl-2 se correlacionan en el glomérulo y (E) y el túbulo (F).
El estadio de ERC y la tinción de Bcl-2 tuvieron una relación negativa. Además, en el estadio avanzado de la ERC, la expresión de Bcl-2 tanto glomerular como tubular estaba reducida (Figuras 2E, F). La prueba de McNemar reveló que los tejidos renales de los gatos con ERC contenían tinción de proteína Bcl-2 en la misma proporción en los sitios glomerular y tubular. Como resultado, el marcaje de Bcl-2 en ambos sitios no afectó la progresión de la enfermedad. Además, se demostró un control negativo al sustituir el anticuerpo primario por suero normal de ratón (Figura suplementaria 1).
De acuerdo con los resultados de la comparación de los parámetros sanguíneos medios entre los gatos clínicamente sanos de la misma edad y los gatos con ERC, el estadio de la ERC (P = 0,0001) fue estadísticamente diferente entre los gatos clínicamente normales de la misma edad y los gatos con ERC, seguido de la creatinina (P = 0,02), el BUN (P = 0,02) y el Bcl-2 (P = 0,05) (Figura 3). El hematocrito de los gatos con ERC fue considerablemente menor que el de los gatos clínicamente normales de la misma edad (p < 0,01). Además, los niveles de Bcl-2 en gatos con ERC fueron significativamente más bajos que en gatos clínicamente normales de la misma edad (P = 0,034); consulte la Tabla 1 y la Figura 4A para obtener más detalles. Además, la Figura 4B muestra la intensidad de la proteína Bcl-2 en gatos clínicamente normales de la misma edad y ERC.
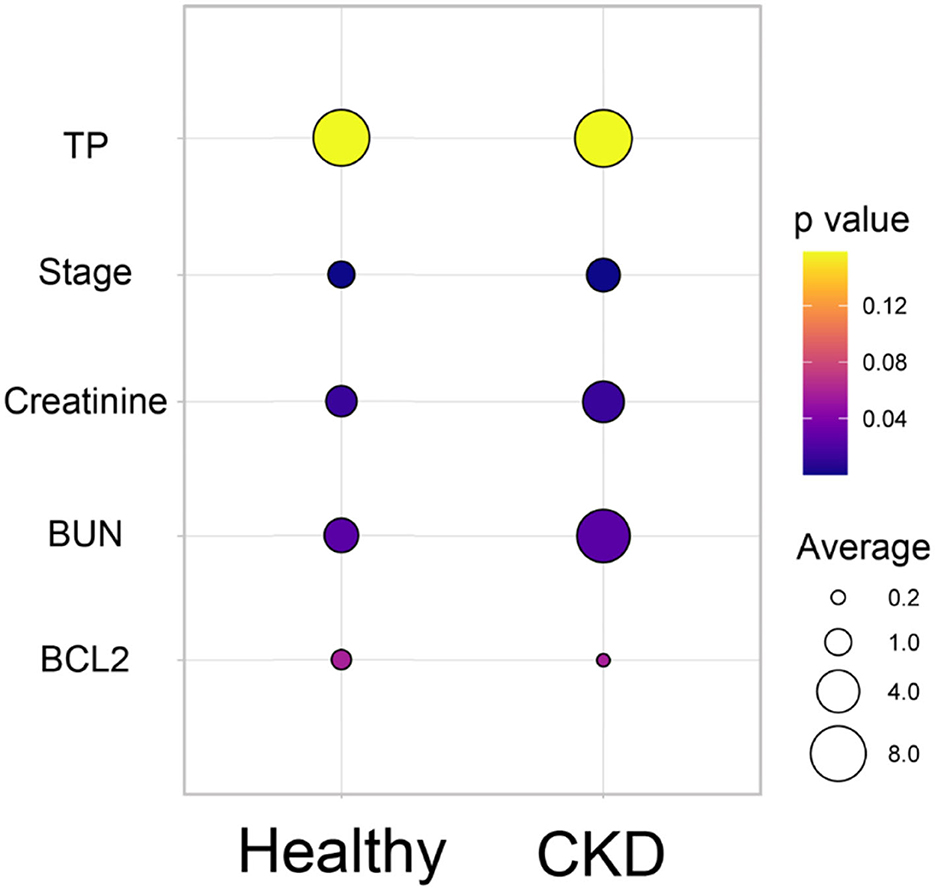 Figura 3. Diagrama de burbujas de la comparación de los parámetros sanguíneos medios entre los gatos clínicamente sanos de la misma edad y los gatos con ERC. El promedio de cada parámetro sanguíneo se muestra en diferentes tamaños de círculo. El valor p de las diferentes medias de cada grupo se muestra en los diferentes colores.
Figura 3. Diagrama de burbujas de la comparación de los parámetros sanguíneos medios entre los gatos clínicamente sanos de la misma edad y los gatos con ERC. El promedio de cada parámetro sanguíneo se muestra en diferentes tamaños de círculo. El valor p de las diferentes medias de cada grupo se muestra en los diferentes colores.
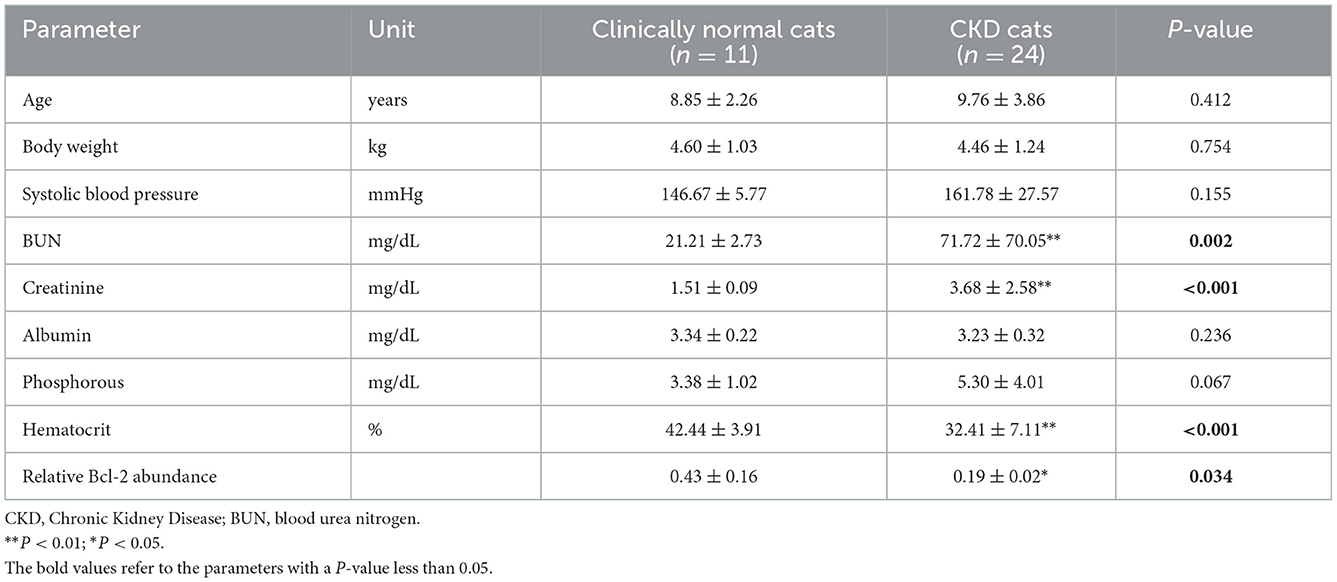 Tabla 1. Media ± desviaciones estándar (DE) de otros parámetros y abundancia relativa de Bcl-2 entre gatos clínicamente normales de la misma edad y con enfermedad renal crónica.
Tabla 1. Media ± desviaciones estándar (DE) de otros parámetros y abundancia relativa de Bcl-2 entre gatos clínicamente normales de la misma edad y con enfermedad renal crónica.
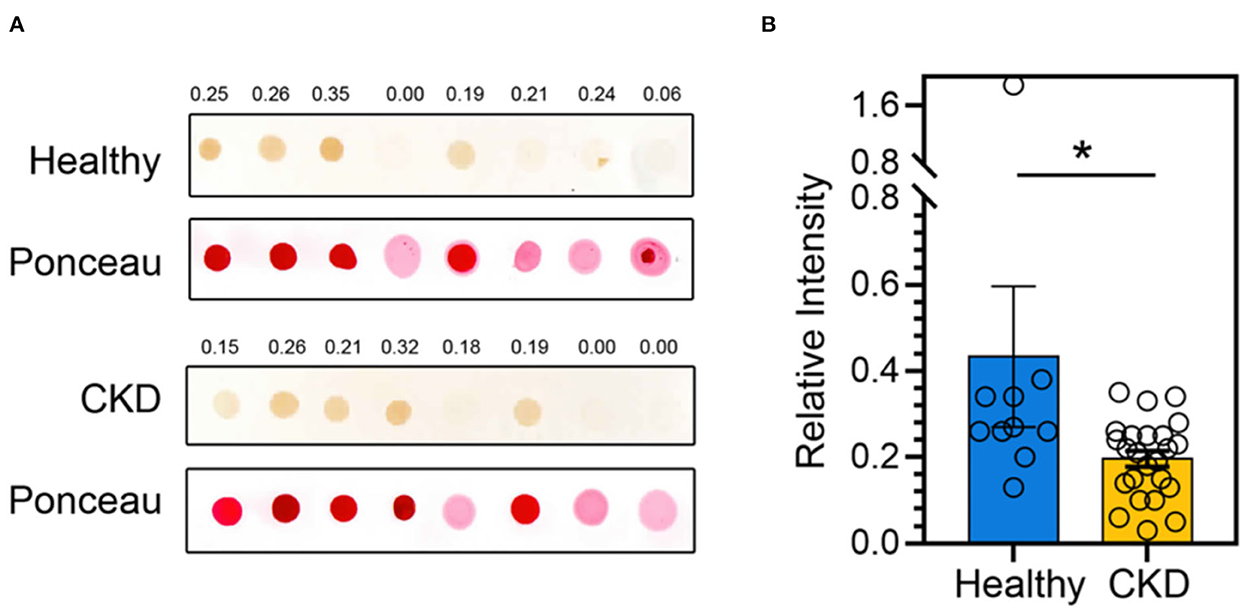 Figura 4. (A) Una mancha de puntos representativa de la abundancia de Bcl-2 de gatos clínicamente normales de la misma edad (panel superior) y ERC (panel inferior). La tinción de Ponceau S se utiliza para controlar la cantidad de proteína cargada en las membranas. Las intensidades relativas de Bcl-2 se indican en la parte superior de cada panel. (B) El gráfico de barras representa la media y el error estándar de la media (SEM) de la intensidad relativa de puntos Bcl-2 de gatos clínicamente normales de la misma edad (n = 11) y ERC (n = 24). *P < 0,05. La significación estadística se determinó mediante un modelo lineal generalizado (GLM).
Figura 4. (A) Una mancha de puntos representativa de la abundancia de Bcl-2 de gatos clínicamente normales de la misma edad (panel superior) y ERC (panel inferior). La tinción de Ponceau S se utiliza para controlar la cantidad de proteína cargada en las membranas. Las intensidades relativas de Bcl-2 se indican en la parte superior de cada panel. (B) El gráfico de barras representa la media y el error estándar de la media (SEM) de la intensidad relativa de puntos Bcl-2 de gatos clínicamente normales de la misma edad (n = 11) y ERC (n = 24). *P < 0,05. La significación estadística se determinó mediante un modelo lineal generalizado (GLM).
El estadio de la ERC fue una correlación positiva con el BUN (r = 0,83), la creatinina (r = 0,87) y el leucocto (r = 0,43), pero una correlación negativa con los glóbulos rojos (r = –0,53), el hematocrito (r = –0,57) y la hemoglobina (r = –0,53) (Figura 5). Para analizar el análisis de componentes principales (ACP), se examinaron los factores que interactuaron con la progresión de la ERC (como el Bcl-2 circulante, el nitrógeno ureico en sangre (BUN), la creatinina y el estadio de la enfermedad renal).
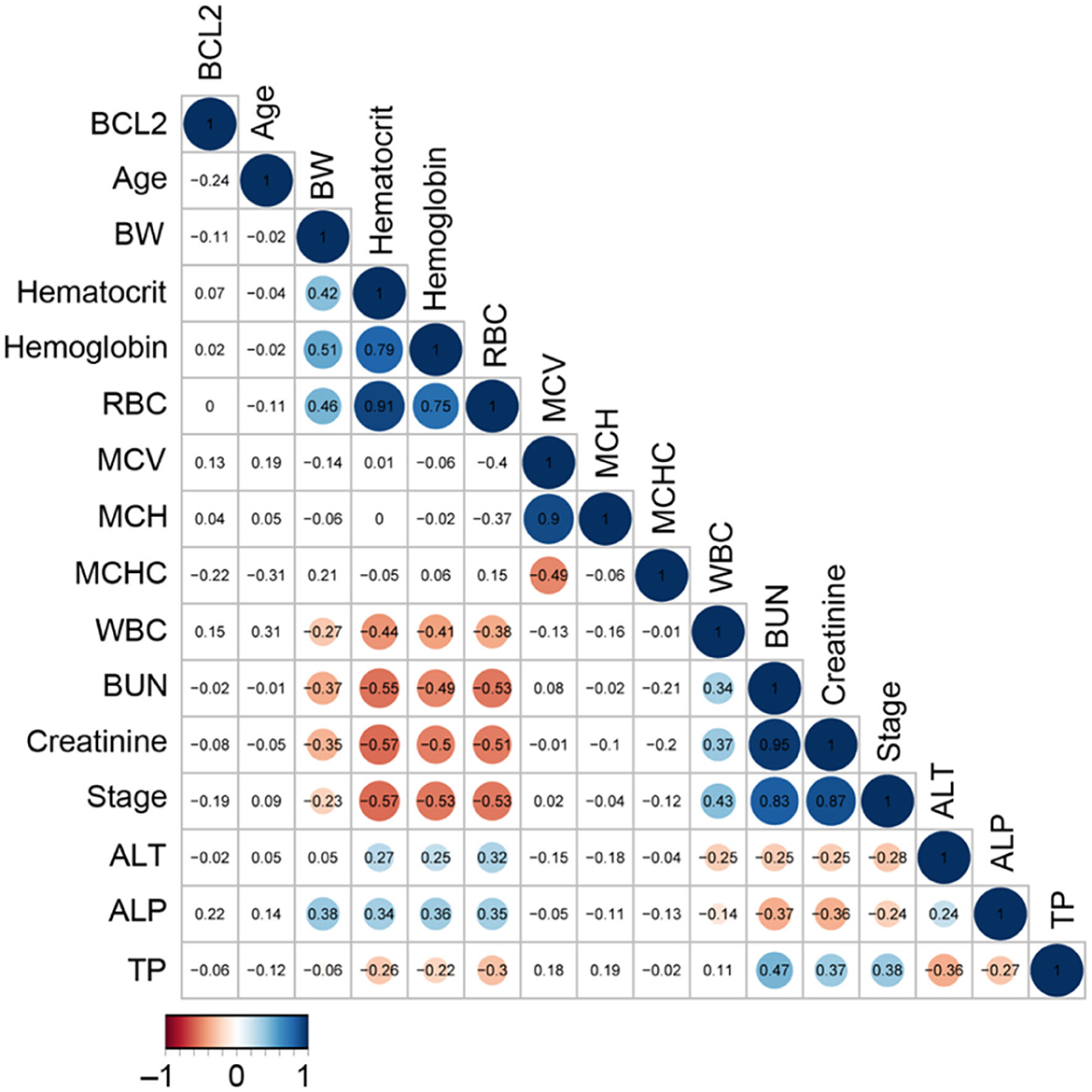 Figura 5. El análisis de correlación del Bcl-2 circulante con otros parámetros sanguíneos. Los círculos coloreados de la matriz de correlación representan los coeficientes de correlación para cada par de Bcl-2 en la matriz celular correspondiente.
Figura 5. El análisis de correlación del Bcl-2 circulante con otros parámetros sanguíneos. Los círculos coloreados de la matriz de correlación representan los coeficientes de correlación para cada par de Bcl-2 en la matriz celular correspondiente.
Se empleó una parcela de pedregal para determinar el número de dimensiones a realizar en la ACP. De acuerdo con el diagrama de pedregales, solo se utilizaron dos componentes (PC1 y PC2) para correlacionar la variación en cada componente (Figura 6A). Además, la ACP se puede llevar a cabo con estos dos componentes. El Bcl-2 circulante puede distinguir entre la ERC y los gatos clínicamente normales de la misma edad que utilizan ACP (Figura 6B). Aunque no hubo correlaciones entre el Bcl-2 circulante y otros factores en el análisis de correlación, el Bcl-2 circulante puede distinguir entre la ERC y los gatos clínicamente normales de la misma edad a través de la PCA.
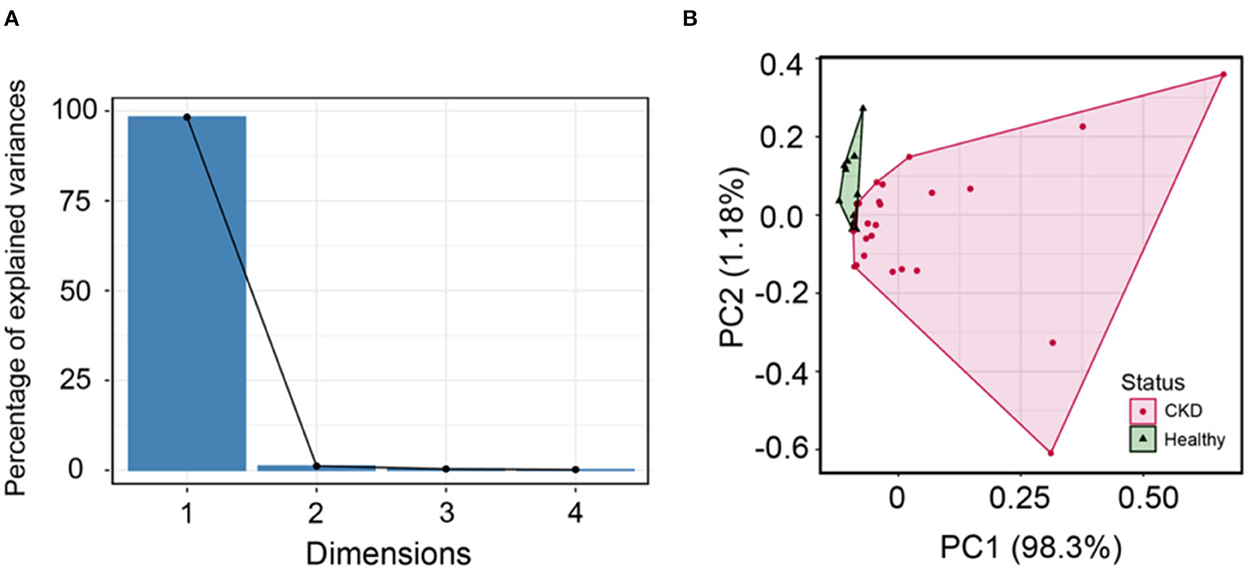 Figura 6. (A) El diagrama de pedregal muestra las dimensiones y el porcentaje de varianza, según lo explicado por cada dimensión (PC). (B) El análisis de componentes principales puede distinguir entre gatos normales de la misma edad (verde) y ERC (rosa) detectados cuando se utiliza el análisis de conglomerados.
Figura 6. (A) El diagrama de pedregal muestra las dimensiones y el porcentaje de varianza, según lo explicado por cada dimensión (PC). (B) El análisis de componentes principales puede distinguir entre gatos normales de la misma edad (verde) y ERC (rosa) detectados cuando se utiliza el análisis de conglomerados.
El área bajo la curva (AUC) de Bcl-2 circulante para la detección de ERC fue de 0,723, lo que indica un predictor aceptable (Figura 7). El índice de Youden determinó el umbral de corte para el Bcl-2 circulante en gatos con ERC y gatos clínicamente sanos de la misma edad con el fin de identificar a aquellos con alto riesgo. Cuando el valor óptimo del índice de Youden fue de 0,255, se entendió que esta característica poseía un rendimiento óptimo (sensibilidad: 0,727; especificidad: 0,792, Figura 7).
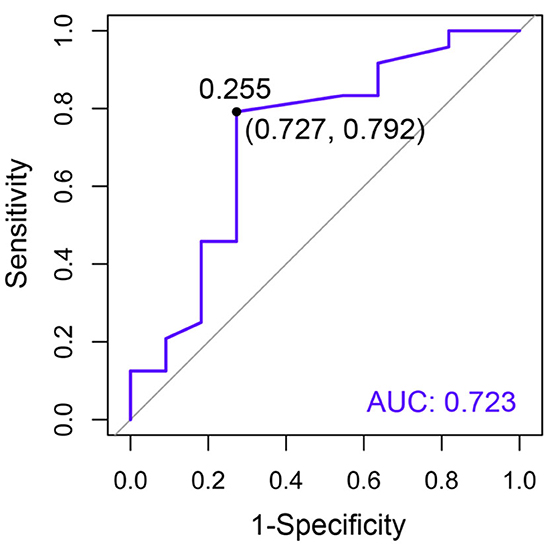 Figura 7. Curva de características operativas del receptor (ROC) del Bcl-2 circulante a efectos del diagnóstico de la ERC. Se muestra la especificidad (eje x) frente a la sensibilidad (eje y). Además, el AUC es un área bajo la curva ROC.
Figura 7. Curva de características operativas del receptor (ROC) del Bcl-2 circulante a efectos del diagnóstico de la ERC. Se muestra la especificidad (eje x) frente a la sensibilidad (eje y). Además, el AUC es un área bajo la curva ROC.
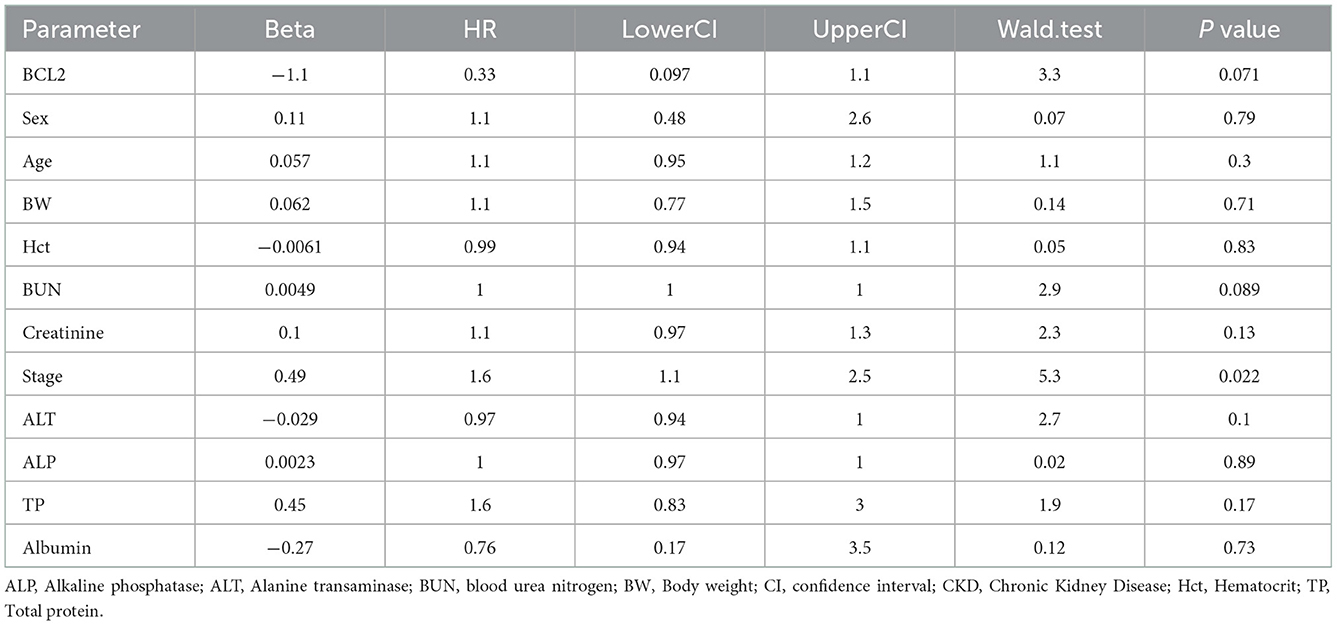
Un cociente de riesgos instantáneos superior a uno, sexo, edad avanzada, mayor peso corporal, mayor creatinina, mayor estadio de ERC y mayor proteína total resultó en un mayor riesgo de desarrollar ERC (Tabla 2). Se incluyeron todas las variables con el fin de analizar los modelos finales de la interacción entre cada factor y la progresión de la ERC. Las figuras 8-12 muestran los modelos finales de la asociación entre Bcl-2 y otras variables para la progresión de la ERC. Todos los modelos indicaron que el Bcl-2 circulante sin interacción con otros factores era un riesgo de progresión de la ERC (Figuras 8-12). Además, la creatinina sérica sin interacción con otros factores del modelo tenía un alto riesgo de progresión de la ERC (Figura 10). Los modelos finales de la asociación entre Bcl-2 y estadio de ERC, así como entre Bcl-2 y creatinina sérica tuvieron factores de riesgo para la progresión de la ERC debido a que estos modelos tuvieron un hazard ratio superior a 1 (Figuras 8, 10). Sin embargo, los otros modelos finales incluyen la interacción de Bcl-2 con BUN sérico (Figura 9); interacción de Bcl-2 con BUN sérico y proteína total (Figura 11); y la interacción de Bcl-2 con la creatinina y la proteína total (Figura 12). Todos ellos poseían un cociente de riesgo igual a 1. Por lo tanto, estos modelos no tenían riesgo de progresión de la ERC (Figuras 9, 11, 12).
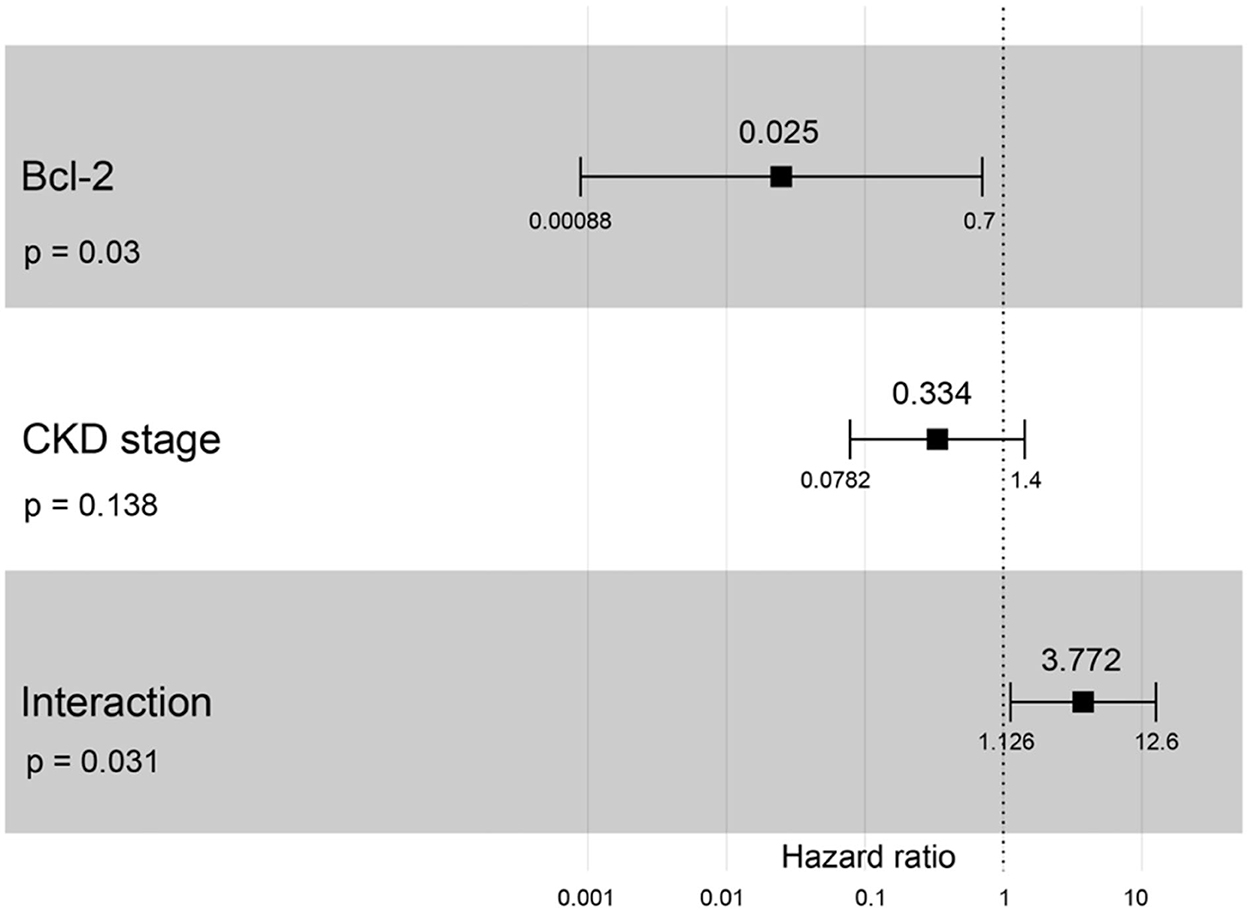 Figura 8. El resultado del diagrama de bosque para la interacción de Bcl-2 con el estadio de ERC es covariable con la progresión de la ERC en función de los cocientes de riesgo (HR) determinados mediante el análisis de regresión de Cox. Los cuadrados representan los cocientes de riesgo. Las barras representan intervalos de confianza del 95%.
Figura 8. El resultado del diagrama de bosque para la interacción de Bcl-2 con el estadio de ERC es covariable con la progresión de la ERC en función de los cocientes de riesgo (HR) determinados mediante el análisis de regresión de Cox. Los cuadrados representan los cocientes de riesgo. Las barras representan intervalos de confianza del 95%.
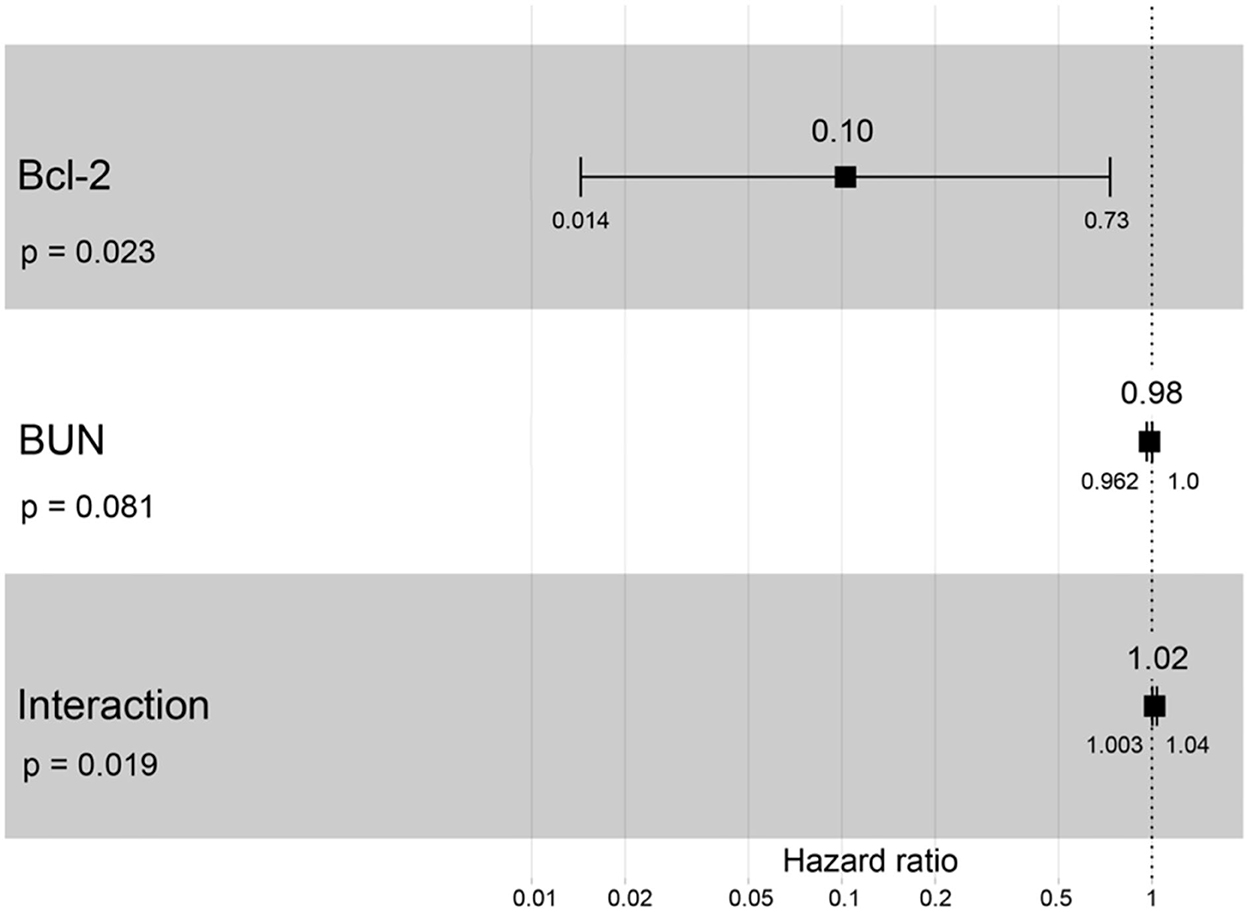 Figura 9. Resultado del gráfico forestal para la interacción de Bcl-2 con BUN que es covariable con la progresión de la ERC basada en los cocientes de riesgo (HR) a través del análisis de regresión de Cox. Los cuadrados representan los cocientes de riesgo. Las barras representan intervalos de confianza del 95%.
Figura 9. Resultado del gráfico forestal para la interacción de Bcl-2 con BUN que es covariable con la progresión de la ERC basada en los cocientes de riesgo (HR) a través del análisis de regresión de Cox. Los cuadrados representan los cocientes de riesgo. Las barras representan intervalos de confianza del 95%.
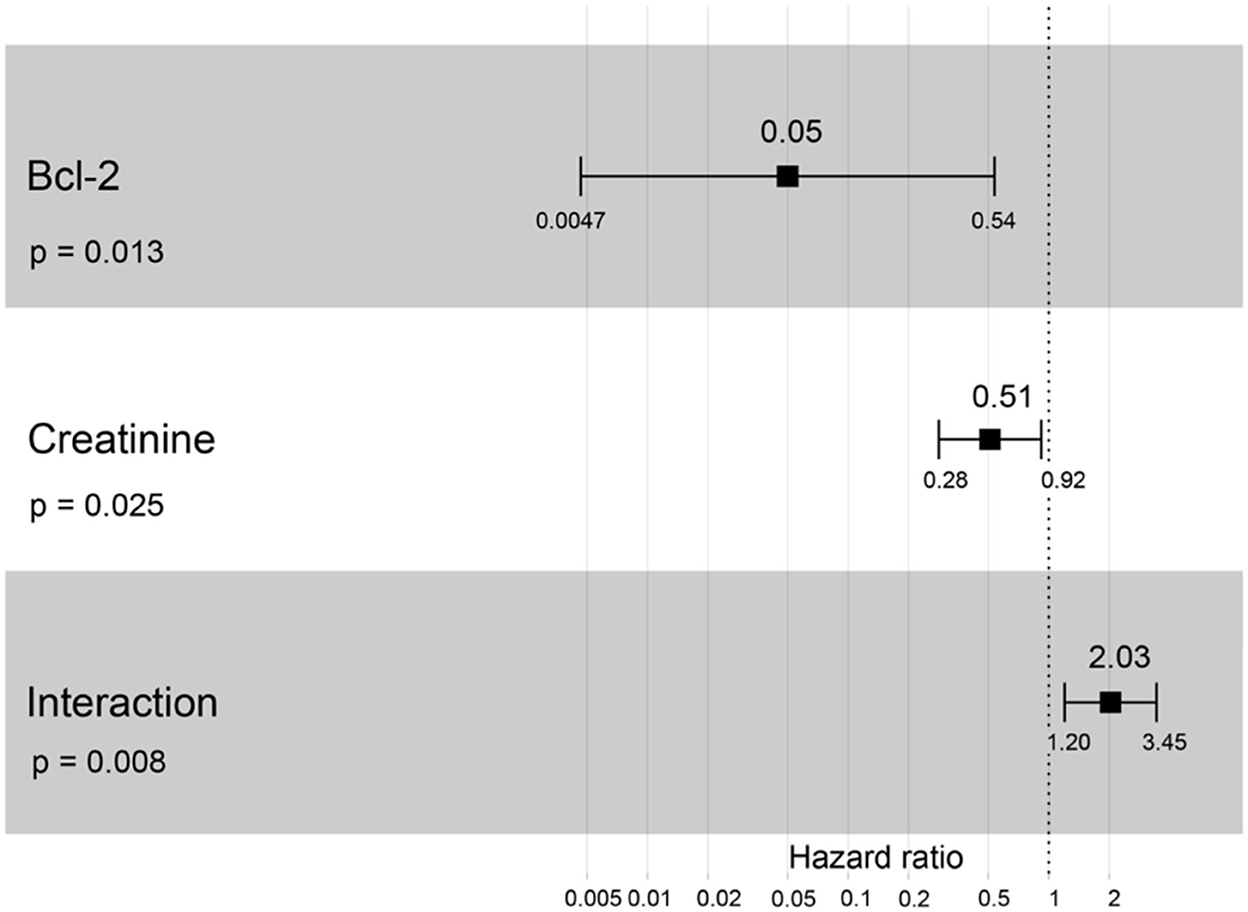 Figura 10. Resultado del gráfico forestal para la interacción de Bcl-2 con creatinina que es covariable con la progresión de la ERC basada en los cocientes de riesgo (HR) a través del análisis de regresión de Cox. Los cuadrados representan los cocientes de riesgo. Las barras representan intervalos de confianza del 95%.
Figura 10. Resultado del gráfico forestal para la interacción de Bcl-2 con creatinina que es covariable con la progresión de la ERC basada en los cocientes de riesgo (HR) a través del análisis de regresión de Cox. Los cuadrados representan los cocientes de riesgo. Las barras representan intervalos de confianza del 95%.
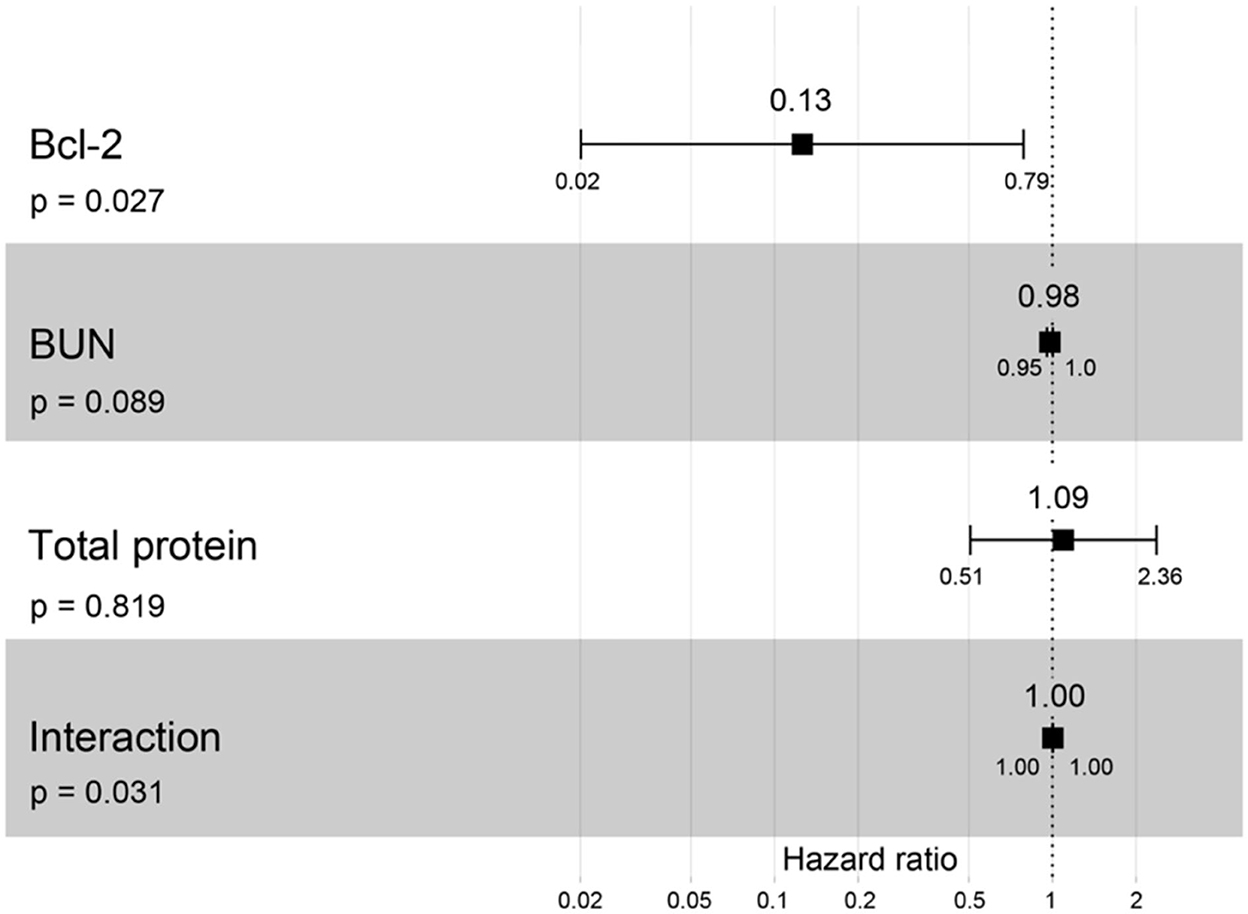 Figura 11. Resultado del gráfico forestal para la interacción de Bcl-2 con dos covariables diferentes (BUN y proteína total) con la progresión de la ERC basada en los cocientes de riesgo instantáneo (HR) mediante análisis de regresión de Cox. Los cuadrados representan los cocientes de riesgo. Las barras representan intervalos de confianza del 95%.
Figura 11. Resultado del gráfico forestal para la interacción de Bcl-2 con dos covariables diferentes (BUN y proteína total) con la progresión de la ERC basada en los cocientes de riesgo instantáneo (HR) mediante análisis de regresión de Cox. Los cuadrados representan los cocientes de riesgo. Las barras representan intervalos de confianza del 95%.
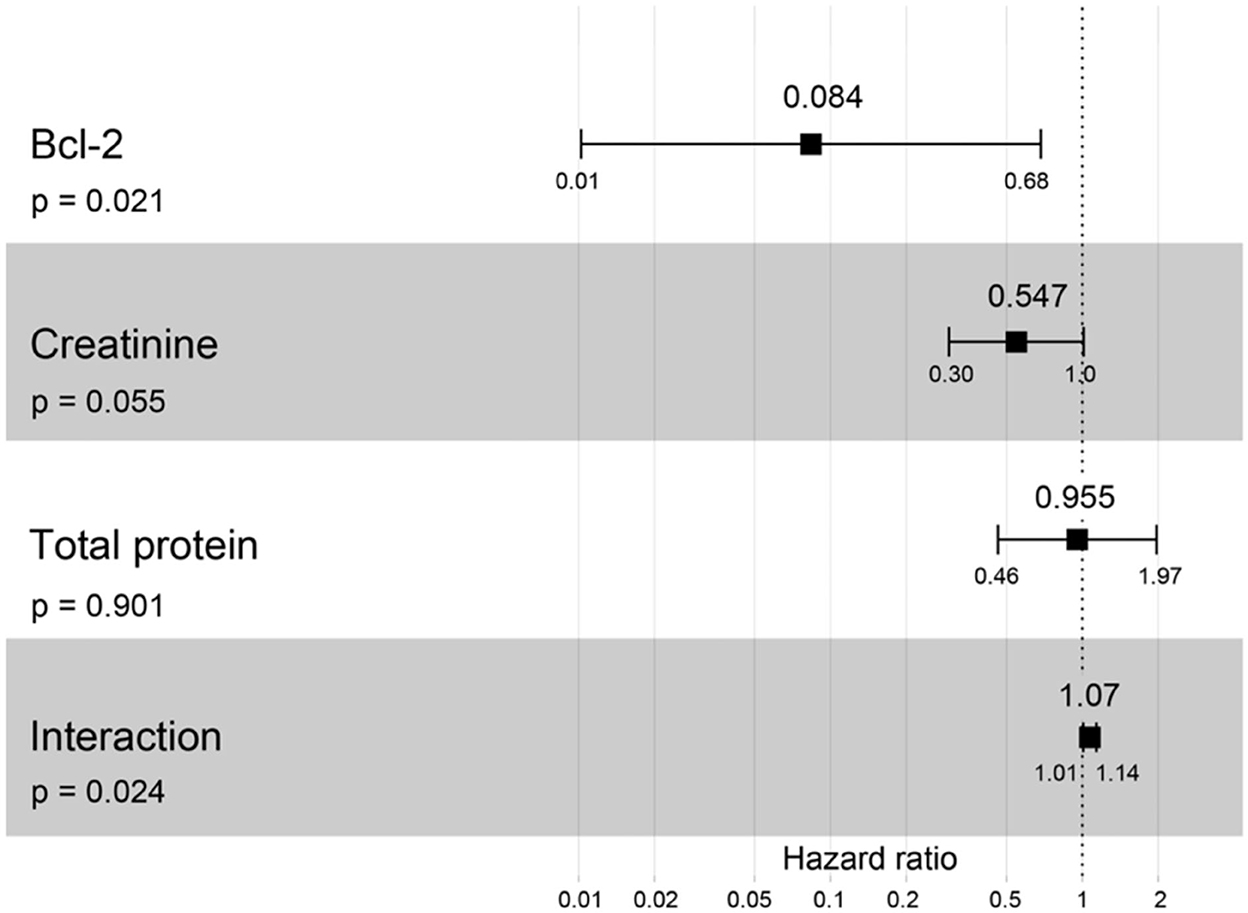 Figura 12. Resultado del gráfico forestal para la interacción de Bcl-2 con dos covariables diferentes (creatinina y proteína total) con la progresión de la ERC basada en los cocientes de riesgo instantáneo (HR) mediante análisis de regresión de Cox. Los cuadrados representan los cocientes de riesgo. Las barras representan intervalos de confianza del 95%.
Figura 12. Resultado del gráfico forestal para la interacción de Bcl-2 con dos covariables diferentes (creatinina y proteína total) con la progresión de la ERC basada en los cocientes de riesgo instantáneo (HR) mediante análisis de regresión de Cox. Los cuadrados representan los cocientes de riesgo. Las barras representan intervalos de confianza del 95%.
Los gatos clínicamente sanos de la misma edad tendrán la vida útil más prolongada (< 1.600 días) desde la fecha del diagnóstico hasta la fecha del análisis. Del mismo modo, los gatos con ERC en estadio II vivirán alrededor de 1.100 días, pero los gatos con ERC en estadios III y IV vivirán solo unos 900 días, P = 0,02 (Figura 13). Los gatos con ERC en estadio II tuvieron un mayor tiempo de supervivencia que los gatos con ERC en estadios III y IV. Además, los gatos clínicamente sanos de la misma edad tuvieron un tiempo de supervivencia significativamente mayor que los gatos con ERC estadios II-IV.
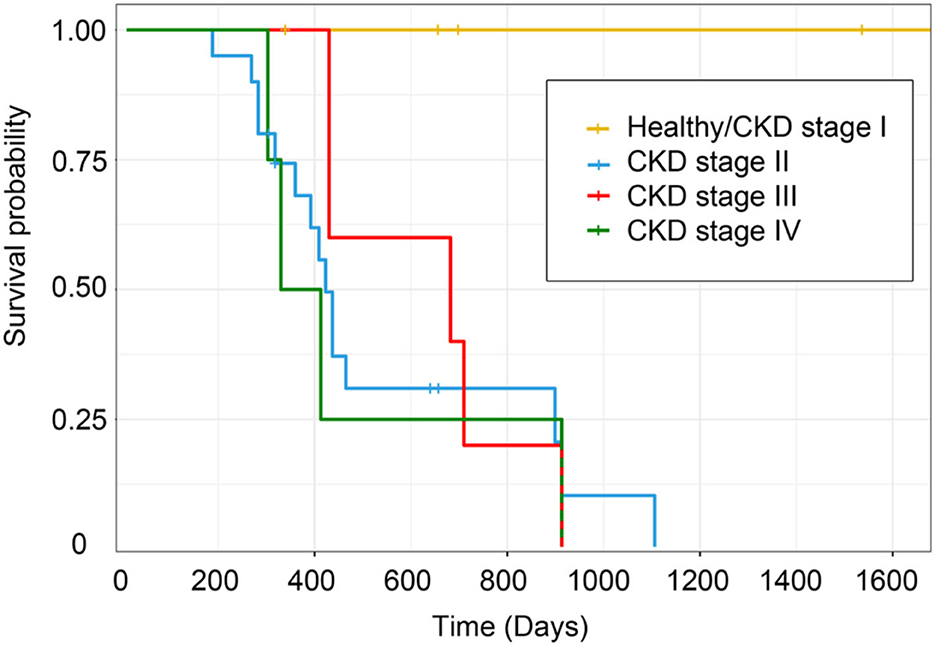 Figura 13. Estimaciones de supervivencia de Kaplan-Meier por estadio de ERC. La curva de supervivencia de cada estadio de la ERC muestra el tiempo de supervivencia en función de la estadificación de la ERC.
Figura 13. Estimaciones de supervivencia de Kaplan-Meier por estadio de ERC. La curva de supervivencia de cada estadio de la ERC muestra el tiempo de supervivencia en función de la estadificación de la ERC.
Discusión
El presente estudio demostró que el BUN sérico y la concentración de creatinina de los gatos con ERC eran significativamente más altos que los encontrados en gatos clínicamente normales de la misma edad. Otros estudios también han encontrado que los gatos con ERC aumentaron el BUN y la creatinina (5, 15, 16). El hematocrito de los gatos con ERC fue considerablemente más bajo que el de los gatos clínicamente sanos de la misma edad, incluidos los gatos con ERC que tenían un hematocrito sanguíneo reducido debido a la deficiencia de eritropoyetina (17, 18). En este estudio, el estadio de la ERC se correlacionó con la leucocitosis. Además, el aumento de los niveles de leucocitos en la población china con función renal normal puede predecir futuras disminuciones de la función renal (19). Además, el estadio de ERC poseía una correlación negativa con el peso corporal. Piyarungsri et al. (5) también demostraron que la mayoría de los gatos con ERC se ven afectados por la pérdida de peso y la anorexia.
Además, el estadio de la ERC se correlacionó negativamente con la anemia. La deficiencia de eritropoyetina en la insuficiencia renal puede explicar este resultado (17, 20). En este estudio, el tiempo de supervivencia de los gatos con el estadio más alto de ERC fue menor que en el estadio inicial. De acuerdo con la investigación previa, los gatos con ERC en estadio IIb poseían un mayor tiempo de supervivencia que los gatos con ERC en estadio III y IV (21). El aumento de la creatinina sérica y el BUN, la proteinuria y la disminución de la PCV se asociaron con la influencia en el tiempo de supervivencia en gatos con ERC (22). Por lo tanto, estos resultados confirmaron el conocimiento consolidado relacionado con la ERC.
El presente estudio indicó que Bcl-2 se expresó débilmente en la cápsula de Bowman, el túbulo contorneado proximal y distal y las células del epitelio del conducto colector. Los estudios previos también reportaron resultados similares en otras especies (8, 9, 23–26). Los estudios de UUO demostraron que Bcl-2 se expresa en las células tubulares de ratas (8) y ratones (9). El Bcl-2 se tiñó en túbulos proximales, túbulos distales y células intersticiales en pacientes con glomerulonefritis (23). La expresión de Bcl-2 fue fuerte en los túbulos ligeramente dilatados y débil en los túbulos severamente dilatados de ratas con obstrucción ureteral (24). El Bcl-2 aumentó en cuanto a la tinción dentro de los túbulos distales, pero disminuyó en los túbulos proximales de ratas con insuficiencia renal isquémica aguda (25). Además, la expresión de Bcl-2 había disminuido significativamente en el tejido renal de los pacientes con nefropatía diabética (26).
El presente estudio investigó si la Bcl-2 circulante en los gatos con ERC era significativamente menor que la encontrada en gatos clínicamente normales de la misma edad. De acuerdo con estudios previos, también se detectó una disminución de Bcl-2 en otras especies con problemas renales (8-10, 27). Según Zhang et al. (8), la inmunotinción de Bcl-2 en los tejidos renales de ratas con UUO fue menos detectable que en el grupo control. Los niveles de expresión génica de Bcl-2 disminuyeron significativamente en el tejido renal de ratas inducidas por glutamato monosódico (GMS) en comparación con el grupo de control (27). De acuerdo con un estudio reciente con ratones, el ARNm de Bcl-2 se expresó sustancialmente en el grupo UUO3, pero disminuyó en los grupos UUO7 y UUO14 (9). Además, una investigación previa en pacientes humanos encontró que los niveles de Bcl-2 eran más bajos en pacientes con enfermedad renal en etapa terminal que en individuos con enfermedad renal crónica (10).
La proteína Bcl-2 fue uno de los mecanismos de autoprotección inducidos por las células dañadas (8). Otro estudio informó que Bcl-2 preserva la membrana mitocondrial y se une a Bax para inhibir la apoptosis en las leucemias (28). Además, las células heridas expresan proteínas anti y proapoptóticas, pero las células lesionadas sobrevivirán si se logra un aumento de Bcl-2 (9). Los resultados del presente estudio corroboraron la implicación antiapoptótica de Bcl2 en la enfermedad renal crónica en gatos. La afectación pudo ser aclarada por estudios previos (27, 29, 30). La regulación negativa de Bcl-2 desempeña un papel en la muerte de las células renales (27). La disminución de Bcl-2 puede aumentar el estrés oxidativo inducido por la isquemia/reperfusión, así como la apoptosis tubular (29). La apoptosis tubular renal, por la disminución de Bcl-2, se asoció con atrofia tubular y fibrosis renal crónica (30). Por lo tanto, Bcl-2 puede estar relacionado con la enfermedad renal a través de la apoptosis.
Aunque el estudio actual indicó que el Bcl-2 circulante no se relacionó con el BUN y la creatinina, un Bcl-2 circulante más bajo con un BUN, creatinina y gravedad de la ERC más alta se asoció con la progresión de la ERC. El presente estudio es un tamaño de cohorte limitado que puede afectar la correlación entre el Bcl-2 circulante y otros parámetros. Sin embargo, en los estudios previos se observó la misma tendencia que en el presente estudio, con tamaños de muestra más extensos. Cuarenta pacientes con enfermedades renales poseían una expresión génica Bcl-2 más baja en sus muestras de sangre que en 20 individuos sanos (10). Como se informó anteriormente, no hubo correlación entre las células positivas para Bcl-2 y los niveles de BUN o creatinina en pacientes con glomerulonefritis (31). Sin embargo, el Bcl-2 se relacionó con hipertensión arterial e hipertrofia glomerular, que podría desarrollar ERC (32). Se necesitan más estudios para incluir más gatos clínicamente sanos y gatos con ERC.
Varios estudios también reportaron el AUC de Bcl-2 en otras enfermedades crónicas (33-35). El Bcl-2 fue un predictor significativo en pacientes con cáncer epitelial de ovario (0,838) (33) y pacientes con cáncer de mama (AUC = 0,841) (34). Además, la relación Bcl-2/Bax puede ser un diferenciador para la osteoartritis humana (AUC = 0,673) (35). Este estudio indicó que el AUC de Bcl-2 para la predicción de gatos con ERC fue de 0,723, lo cual es una capacidad de discriminación razonable (36). Por lo tanto, se podría evaluar que Bcl-2 tiene una capacidad de predicción para la ERC en gatos.
Conclusiones
En conclusión, los niveles de Bcl-2 en gatos con ERC fueron considerablemente más bajos que los de los gatos clínicamente normales de la misma edad. El análisis AUC de Bcl-2 demostró que predijo adecuadamente la ERC en gatos. Además, en gatos, la disminución de la expresión de Bcl-2 se asoció con un aumento de la gravedad del BUN, la creatinina y la ERC. Desafortunadamente, la intensidad inmunotimental de Bcl-2 fue débil en los tejidos renales de gatos con ERC. Este estudio reveló que Bcl-2 podría ayudar a distinguir entre gatos con enfermedad renal crónica y gatos sanos. Sin embargo, el presente estudio es de un tamaño muestral pequeño, no está completamente validado y no tiene un estudio de seguimiento longitudinal. Se requieren más estudios para incluir un tamaño de muestra más sustancial, para investigar la validación de estos resultados, para hacer un seguimiento de los resultados longitudinales, para realizar inmunotinciones de Bcl-2 en tejidos renales de gatos que murieron de otras enfermedades, y para determinar mejor la relación entre los niveles de Bcl-2 en el tejido renal y los niveles de Bcl-2 en la sangre de gatos vivos.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio están incluidas en el artículo/Material complementario, las consultas posteriores pueden dirigirse al autor correspondiente.
Declaración ética
El estudio en animales fue revisado y aprobado por el Comité Institucional de Cuidado y Uso de Animales, Facultad de Medicina Veterinaria, Universidad de Chiang Mai, Chiang Mai, Tailandia (referencia n.º S25/2563, fecha de aprobación: 17 de julio de 2020). Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
KPi y PC diseñaron el estudio, participaron en la supervisión y editaron el manuscrito. KPi y PPi reclutaron casos y organizaron la recolección de muestras. PC y PPa realizaron el análisis estadístico. KPr proporcionó sugerencias útiles y realizó la inmunohistoquímica. PPi, KPi y PC realizaron los ensayos. PPi escribió el primer borrador del manuscrito. KPi participó en la adquisición de fondos. Todos los autores contribuyeron al artículo y aprobaron el manuscrito.
Financiación
Este estudio fue totalmente financiado por el Fondo de Investigación de Tailandia y la Oficina de la Comisión de Educación Superior con el número de subvención: MRG6280209.
Reconocimientos
Nos gustaría agradecer a todos los dueños de gatos por su amable cooperación en la recolección de las muestras para este estudio. También queremos agradecer a la clínica felina y a todos los veterinarios del Hospital de Pequeños Animales de la Facultad de Medicina Veterinaria de la Universidad de Chiang Mai por su apoyo y ayuda en la recogida de las muestras.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2022.1043848/full#supplementary-material
Referencias
1. Marino CL, Lascelles BD, Vaden SL, Gruen ME, Marks SL. Prevalencia y clasificación de la enfermedad renal crónica en gatos seleccionados aleatoriamente de cuatro grupos de edad y en gatos reclutados para estudios de enfermedades articulares degenerativas. J Feline Med Surg. (2014) 16:465–72. doi: 10.1177/1098612X13511446
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Lund EM, Armstrong PJ, Kirk CA, Kolar LM, Klausner JS. Estado de salud y características poblacionales de perros y gatos examinados en consultorios veterinarios privados en los Estados Unidos. J Am Vet Med Assoc. (1999) 214:1336–41.
3. Watson A. Indicadores de insuficiencia renal en perros y gatos presentados en un hospital universitario veterinario. Aust Vet Pract. (2001) 31:54–8.
4. Pusoonthornthum R, Pusoonthornthum P, Krishnamra N. Homeostasis de calcio-fósforo y cambios en la secreción de hormona paratiroidea en gatos con varias etapas de insuficiencia renal crónica espontánea. Comp Clin Path. (2010) 19:287–93. doi: 10.1007/s00580-009-0844-5
5. Piyarungsri K, Tangtrongsup S, Thongtharb A, Sodarat C, Bussayapalakorn K. Los factores de riesgo de tener el virus de la leucemia felina infectado o el virus de la inmunodeficiencia felina para la enfermedad renal crónica felina de origen natural. Vet Integr Sci. (2020) 18:119–31.
7. Youle RJ, Strasser A. La familia de proteínas Bcl-2: actividades opuestas que median la muerte celular. Nat Rev Mol Cell Biol. (2008) 9:47–59. doi: 10.1038/nrm2308
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Zhang G, Oldroyd SD, Huang LH, Yang B, Li Y, Ye R, et al. Papel de la apoptosis y Bcl-2/Bax en el desarrollo de fibrosis tubulointersticial durante la nefropatía obstructiva experimental. Exp Nephrol. (2001) 9:71–80. doi: 10.1159/000052597
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Sulistiyowati I, Yunus J, Sari DCR, Arfian N. Regulación positiva de la expresión de ARNm de P16, Bax y Bcl-2 asociada con la apoptosis epitelial y la proliferación de miofibroblastos en el modelo de fibrosis renal en ratones. Malayos J Med Sci. (2020) 27:37–44. doi: 10.21315/mjms2020.27.2.4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Nour H, Zahran N, Abd El-Hamid S, Zahran M, Raafat M, Saeed A. El papel de los genes Bcl-2 y Bak en pacientes con enfermedad renal crónica y hemodiálisis. J Gly Met. (2016) 1:8–24. doi: 10.14302/issn.2572-5424.jgm-15-815
11. Eddy AA. Fibrosis raspante: fibrosis renal umodulante. Nat Med. (2011) 17:553–5. doi: 10.1038/nm0511-553
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Putra SE, Tsuprykov O, Von Websky K, Ritter T, Reichetzeder C, Hocher B. Manejo de grandes tamaños de muestra: comparación de un nuevo método de transferencia de puntos de un punto con Western Blot. Laboratorio Clin. (2014) 60:1871–7. doi: 10.7754/Clin.Lab.2014.140317
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Helbing DL, Bohm L, Oraha N, Stabenow LK, Cui Y. Un ensayo de dot blot basado en la tinción de ponceau s para la cuantificación rápida de proteínas de muestras biológicas. Geles. (2022) 8:43. doi: 10.3390/gels8010043
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Wada T, Hamakawa S, Hori Y, Kaname S, Shimizu S, Kurokawa K, et al. Localización inmunohistoquímica de la proteína de unión al factor de crecimiento transformante latente beta en la nefropatía por Iga. Riñón Int Suppl. (1997) 63:S182-4.
15. Ghys LF, Paepe D, Lefebvre HP, Reynolds BS, Croubels S, Meyer E, et al. Evaluación de cistatina C para la detección de enfermedad renal crónica en gatos. J Veterinario Pasante Med. (2016) 30:1074–82. doi: 10.1111/jvim.14256
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Bradley R, Tagkopoulos I, Kim M, Kokkinos Y, Panagiotakos T, Kennedy J, et al. Predicción temprana del riesgo de enfermedad renal crónica en gatos mediante pruebas de laboratorio clínico de rutina y aprendizaje automático. J Veterinario Pasante Med. (2019) 33:2644–56. doi: 10.1111/jvim.15623
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. King JN, Tasker S, Gunn-Moore DA, Strehlau G, Grupo BS. Factores pronósticos en gatos con enfermedad renal crónica. J Veterinario Pasante Med. (2007) 21:906–16. doi: 10.1111/j.1939-1676.2007.tb03042.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Jepson RE, Brodbelt D, Vallance C, Syme HM, Elliott J. Evaluación de predictores del desarrollo de azotemia en gatos. J Veterinario Pasante Med. (2009) 23:806–13. doi: 10.1111/j.1939-1676.2009.0339.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Fan F, Jia J, Li J, Huo Y, Zhang Y. El recuento de glóbulos blancos predice las probabilidades de disminución de la función renal en una población basada en la comunidad china. BMC Nefrol. (2017) 18:190. doi: 10.1186/s12882-017-0608-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Chakrabarti S, Syme HM, Elliott J. Variables clinicopatológicas que predicen la progresión de la azotemia en gatos con enfermedad renal crónica. J Veterinario Pasante Med. (2012) 26:275–81. doi: 10.1111/j.1939-1676.2011.00874.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Boyd LM, Langston C, Thompson K, Zivin K, Imanishi M. Supervivencia en gatos con enfermedad renal crónica natural (2000-2002). J Veterinario Pasante Med. (2008) 22:1111–7. doi: 10.1111/j.1939-1676.2008.0163.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Kuwahara Y, Ohba Y, Kitoh K, Kuwahara N, Kitagawa H. Asociación de datos de laboratorio y muerte en el plazo de un mes en gatos con insuficiencia renal crónica. J Pequeña Anim Pract. (2006) 47:446–50. doi: 10.1111/j.1748-5827.2006.00200.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Goumenos DS, Tsamandas AC, Kalliakmani P, Tsakas S, Sotsiou F, Bonikos DS, et al. Expresión de las proteínas relacionadas con la apoptosis bcl-2 y bax junto con el factor de crecimiento transformante (Tgf-Beta1) en el riñón de pacientes con glomerulonefrítidos. Ren Fail. (2004) 26:361–7. doi: 10.1081/JDI-120039818
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Chevalier RL, Smith CD, Wolstenholme J, Krajewski S, Reed JC. La obstrucción ureteral crónica en la rata suprime el Bcl-2 tubular renal y estimula la apoptosis. Exp Nephrol. (2000) 8:115–22. doi: 10.1159/000020657
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Gobe G, Zhang XJ, Willgoss DA, Schoch E, Hogg NA, Endre ZH. Relación entre la expresión de genes Bcl-2 y factores de crecimiento en insuficiencia renal aguda isquémica en rata. J Am Soc Nephrol. (2000) 11:454–67. doi: 10.1681/ASN. V113454
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Liu XQ, Jiang L, Li YY, Huang YB, Hu XR, Zhu W, et al. La wogonina protege los podocitos glomerulares al dirigirse a la autofagia mediada por Bcl-2 y la apoptosis en la enfermedad renal diabética. Acta Pharmacol Sin. (2022) 43:96–110. doi: 10.1038/s41401-021-00721-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Koohpeyma F, Siri M, Allahyari S, Mahmoodi M, Saki F, Dastghaib S. Los efectos de la L-carnitina sobre la función renal y la expresión génica de caspasa-9 y Bcl-2 en ratas inducidas por glutamato monosódico. BMC Nefrol. (2021) 22:162. doi: 10.1186/s12882-021-02364-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Tzifi F, Economopoulou C, Gourgiotis D, Ardavanis A, Papageorgiou S, Scorilas A. El papel de la familia Bcl2 de proteínas reguladoras de la apoptosis en leucemias agudas y crónicas. Adv Hematol. (2012) 2012:524308. doi: 10.1155/2012/524308
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Chien CT, Chang TC, Tsai CY, Shyue SK, Lai MK. La transferencia del gen bcl-2 mediada por adenovirus inhibe el estrés oxidativo tubular inducido por isquemia/reperfusión renal y la apoptosis. Am J Trasplante. (2005) 5:1194–203. doi: 10.1111/j.1600-6143.2005.00826.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Yang B, Johnson TS, Thomas GL, Watson PF, Wagner B, Skill NJ, et al. Expresión de genes y proteínas relacionados con la apoptosis en la cicatrización renal crónica experimental. J Am Soc Nephrol. (2001) 12:275–88. doi: 10.1681/ASN. V122275
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Uguz A, Gonlusen G, Ergin M, Tuncer I. Expresión de las moléculas Fas, Bcl-2 y P53 en la glomerulonefritis y sus correlaciones con los hallazgos clínicos y de laboratorio. Nefrología (Carlton). (2005) 10:311–6. doi: 10.1111/j.1440-1797.2005.00397.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Rodríguez-López AM, Flores O, Arévalo MA, López-Novoa JM. Proliferación de células glomerulares y apoptosis en ratas espontáneamente hipertensas no inefrectomías. Riñón Int Suppl. (1998) 68:S36-40. doi: 10.1046/j.1523-1755.1998.06810.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Kassim SK, Ali HS, Sallam MM, Fayed ST, Seada LS, abd-Elkawy E, et al. El aumento de la expresión de Bcl-2 se asocia con la resistencia primaria a la quimioterapia en el cáncer de ovario epitelial humano. Clin Biochem. (1999) 32:333–8. doi: 10.1016/S0009-9120(99)00026-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. El-Moneim Ebied SA, El-Moneim NAA, Hewala Tl, Anwar MM, Rabi SM. El valor diagnóstico, pronóstico y seguimiento de las proteínas séricas Bcl-2, Bax y P53 en pacientes con cáncer de mama: una comparación con el suero Ca 15-3 de Oriente Medio. J Cáncer. (2013) 4:51–62.
35. Karaliotas GI, Mavridis K, Scorilas A, Babis GC. Análisis cuantitativo de los niveles de expresión de ARNm de los genes Bcl2 y Bax en artrosis humana y cartílago articular normal: una investigación sobre su expresión diferencial. Mol Med Rep. (2015) 12:4514–21. doi: 10.3892/mmr.2015.3939
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Swets JA. Medición de la precisión de los sistemas de diagnóstico. Ciencia (1988). 240:1285–93. doi: 10.1126/science.3287615
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: Bcl-2, biomarcador, gato, enfermedad renal crónica, predicción
Cita: Pila P, Chuammitri P, Patchanee P, Pringproa K y Piyarungsri K (2023) Evaluación de Bcl-2 como marcador para la predicción de enfermedad renal crónica en gatos. Frente. Vet. Sci. 9:1043848. doi: 10.3389/fvets.2022.1043848
Recibido: 14 de septiembre de 2022; Aceptado: 15 de diciembre de 2022;
Publicado: 09 Enero 2023.
Editado por:
Khalid Mehmood, Universidad Islamia de Bahawalpur, Pakistán
Revisado por:
Adrian Florin Gal, Universidad de Ciencias Agrícolas y Medicina Veterinaria de Cluj-Napoca, Rumanía
Paolo Emidio Crisi, Universidad de Teramo, Italia
Derechos de autor © 2023 Pila, Chuammitri, Patchanee, Pringproa y Piyarungsri. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Kakanang Piyarungsri,  kakanangjp@gmail.com
kakanangjp@gmail.com
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía