Panel citométrico de flujo para evaluar biomarcadores pronósticos en aspirados con aguja fina de tumores de mastocitos
Desarrollo de un panel citométrico de flujo para evaluar biomarcadores pronósticos en aspirados con aguja fina de tumores de mastocitos cutáneos o subcutáneos caninos
 BinXi Wu1*
BinXi Wu1*  Amandine Lejeune2
Amandine Lejeune2  Verena K. Affolter1
Verena K. Affolter1  Giulia Iamone3
Giulia Iamone3  Fulvio Riondato3
Fulvio Riondato3  Amir Kol1
Amir Kol1- 1Departamento de Patología, Microbiología e Inmunología, Facultad de Medicina Veterinaria Davis de la Universidad de California, Davis, CA, Estados Unidos
- 2Departamento de Ciencias Quirúrgicas y Radiológicas, Facultad de Medicina Veterinaria Davis de la Universidad de California, Davis, CA, Estados Unidos
- 3Departamento de Ciencias Veterinarias, Facultad de Agricultura y Medicina Veterinaria, Universidad de Turín, Turín, Italia
El tumor de mastocitos (MCT) es un cáncer de piel común en perros que tiene una amplia gama de comportamientos clínicos. El propósito de este estudio fue desarrollar un nuevo panel de citometría de flujo (FC) multicolor que permita la cuantificación de marcadores pronósticos candidatos (Ki-67 y pKIT) en muestras de aspirado con aguja fina (PAAF) antes de la extirpación quirúrgica de los tumores. Se utilizaron PAAF de MCT caninos y la línea celular NI-1 para desarrollar un panel de FC que incluye un colorante de viabilidad (FVS620, BD Biosciences; 7-AAD, Invitrogen) y los siguientes anticuerpos conjugados primarios: CD117-PE (ACK45, BD Biosciences), pKIT-A647 (policlonal bs-3242R, BIOSS) y Ki-67-FITC (20Raj1, eBioscience; MIB-1, DAKO). Se recogieron un total de nueve muestras de PAAF de MCT caninos, siete de las cuales produjeron suficientes células para el análisis de FC. El clon de anticuerpos Ki-67 20Raj1 produjo una señal positiva cuando se aplicó a los leucocitos sanguíneos, pero no proporcionó un marcaje robusto de los mastocitos neoplásicos. El clon de anticuerpos Ki-67 MIB-1 proporcionó una calidad de tinción superior tanto en las células NI-1 como en las células MCT primarias. La señal CD117-PE fue adecuada después de la fijación y permeabilización y en la combinación de 7-AAD. pKIT producía tinciones inespecíficas y no era adecuado para este panel FC multicolor. En conclusión, las muestras de PAAF de MCT caninos a menudo pueden producir un número adecuado de células para el análisis de FC, y se desarrolló un panel de FC multicolor que puede detectar Ki-67 en mastocitos caninos. Esto permitiría realizar más estudios sobre el uso potencial de este panel para fines pronósticos de MCT cutáneo y subcutáneo canino.
Introducción
El tumor de mastocitos caninos (TCM) es un tumor común que puede ocurrir dentro de la dermis (es decir, MCT cutáneo) o dentro del tejido graso subcutáneo (es decir, MCT subcutáneo) (1, 2), y representa del 7 al 21 % de todas las neoplasias cutáneas (2-4). Estos tumores tienen un comportamiento biológico muy variable que va desde benigno hasta altamente metastásico y agresivo (3, 5, 6). Se indica una evaluación diagnóstica exhaustiva de la estadificación para los TCM cutáneos si hay factores pronósticos negativos, como un grado tumoral alto, pero puede ser innecesaria en los tumores de riesgo bajo (7, 8). Además, aún no se dispone de un enfoque estandarizado para determinar la extensión adecuada de los márgenes quirúrgicos laterales necesarios para lograr márgenes histológicos claros, y es posible que un tumor de grado más bajo no requiera un margen tan extenso para lograr la escisión completa (1, 9). Si bien se considera que los MCT subcutáneos tienen un comportamiento biológico mayoritariamente benigno (10), un estudio reciente informa una tasa de recurrencia local del 18%, una tasa del 27% de metástasis en los ganglios linfáticos y una mortalidad relacionada con MCT del 13% en una cohorte de 45 perros (11). En este contexto, se necesitan urgentemente ensayos de pronóstico que se puedan realizar antes de la extirpación del tumor.
Se han investigado herramientas auxiliares para ayudar a los médicos a decidir cuándo ser más agresivos en la estadificación y el tratamiento del TCM cutáneo canino. Por ejemplo, los marcadores de grado tumoral (3, 12) e inmunohistoquímicos (IHQ) adyuvantes, como el Ki-67 y el c-kit fosforilado (pKIT), son valiosos para predecir el comportamiento de los MCT cutáneos caninos. Específicamente, el nivel de expresión de IHQ del marcador de proliferación nuclear Ki-67 se asocia con el grado tumoral (13) y la mortalidad relacionada con el tumor (14). La cuantificación de pKIT a través de IHQ se ha asociado con la localización de la proteína CD117, la tasa mitótica, el tiempo de supervivencia, el grado tumoral y la mutación de KIT en los exones 8 y 11 (15). Del mismo modo, el Ki-67 también puede servir como un indicador pronóstico útil en los TCM subcutáneos (16). En otras palabras, la clasificación histológica del tumor y la expresión de biomarcadores ayudan a predecir el comportamiento biológico de los TCM cutáneos y subcutáneos caninos, proporcionando información valiosa sobre la estadificación y la planificación del tratamiento, incluidas las opciones quirúrgicas y la inclusión de quimioterapia y/o radioterapia. Desafortunadamente, la histopatología y la IHQ se realizan con mayor frecuencia después de la cirugía definitiva en lugar de como una biopsia de tejido incisional preoperatoria, lo que limita su utilidad para guiar la estadificación y las recomendaciones quirúrgicas. Además, con la reciente comercialización del agente anticancerígeno intratumoral tigilanol tigilanol (17), es posible que algunos pacientes nunca obtengan una biopsia o un análisis histopatológico de su tumor, lo que pone de relieve aún más la necesidad de una predicción precisa, previa a la biopsia, del comportamiento biológico de los MCT caninos.
La citología por aspirado con aguja fina (PAAF) es el principal método de diagnóstico para el MCT canino. A diferencia de la biopsia incisional, la citología con PAAF es una modalidad diagnóstica mínimamente invasiva, asequible y rápida con alta precisión en el diagnóstico de TCM (18). También es una modalidad común para obtener muestras para el inmunofenotipado de linfocitos mediante citometría de flujo (CF), y también se ha utilizado para detectar la presencia de mastocitos en los ganglios linfáticos de perros con MCT cutáneas (19). Además, la CF se ha utilizado para cuantificar la expresión de Ki-67 en el linfoma canino (20). En comparación con la IHQ, los beneficios adicionales del uso de FC para analizar estos marcadores incluyen la posibilidad de obtener resultados más objetivos, precisos y sólidos. Por ejemplo, se ha informado de una amplia gama de índices de IHQ Ki-67 (de 0,01 a 0,135) como puntos de corte para un mayor riesgo de mortalidad y grado histológico en perros con TCM cutáneo (13, 21-23), y la CF puede estar mejor equipada para estandarizar el punto de corte debido a un mayor número de células analizadas. Las limitaciones potenciales de la CF incluyen la falta de contexto espacial dentro del tumor y la distribución desigual de la expresión de biomarcadores dentro del tumor (24). Por último, aún no se han descrito paneles de FC que utilicen muestras de PAAF de MCT caninos para cuantificar Ki-67 y pKIT en MCT canino. Los objetivos de este estudio fueron determinar si las muestras de PAAF de MCT cutáneo o subcutáneo canino pueden producir suficientes células para el análisis citométrico de flujo en el entorno clínico y desarrollar un panel de FC que incluya CD117 (c-kit, un marcador de identidad de mastocitos) (19), Ki-67, pKIT y un colorante de viabilidad.
Materiales y métodos
Cultivo celular
Para optimizar el protocolo de citometría de flujo para la cuantificación de Ki-67 y pKIT en mastocitos neoplásicos caninos, se utilizó la línea de mastocitos caninos (abm) NI-1 (25). Esta línea celular se estableció a partir de un perro mestizo de 3,5 años de edad con leucemia mastocitoscópica. Estas células expresan tanto CD117 como pKIT (25). Las células se cultivaron en una incubadora con medios de cultivo PriGlow II (abm) o RMPI 1640 (Gibco) con 10% de FBS (R&D Systems) y 1% de penicilina/estreptomicina (Gibco) a 37 °C y 5% de CO2 y se pasa cada 3-4 días.
Muestras clínicas
El protocolo del estudio fue aprobado por el Comité Institucional de Cuidado y Uso de Animales de la Universidad de California, Davis (protocolo IACUC #21854). Para ser incluidos, los pacientes debían ser diagnosticados de TCM cutáneo o subcutáneo en base a la citología de la PAAF. Las muestras de PAAF de los perros se obtuvieron después de que los dueños de los perros firmaran un formulario de consentimiento informado. Las muestras se obtuvieron utilizando una aguja de calibre 22 unida a una jeringa de 3 mL y recubierta con EDTA de potasio. Se aplicó succión negativa después de penetrar el tumor, seguida de una redirección de la jeringa al menos 3 veces. Por lo general, se obtuvieron de dos a cuatro jeringas de cada tumor. Las muestras se vaciaron inmediatamente en un tubo estéril que contenía 1 mL de RMPI 1640 con 10% de FBS y 1% de penicilina/estreptomicina con un lavado suave. Se utilizó sangre entera canina desechada del laboratorio de diagnóstico hematológico del Hospital Docente de Medicina Veterinaria de UC Davis para la optimización de la tinción de marcadores individuales. Los recuentos celulares y la viabilidad de todas las muestras clínicas de PAAF se realizaron con un analizador de células Muse (Millipore) o un hemocitómetro.
Citometría de flujo
Se evaluaron individualmente cuatro anticuerpos y dos colorantes de viabilidad (ver Tabla 1). La optimización inicial de estos anticuerpos se realizó utilizando los mastocitos NI-1, con o sin la adición de leucocitos de sangre periférica canina como control negativo interno. Se completaron estudios de titulación para determinar la concentración óptima de anticuerpos para cada anticuerpo. Las muestras clínicas se procesaron dentro de las 2 h posteriores a la recolección de la muestra de PAAF. Se incluyeron controles de un solo color (kit de compensación de anticuerpos totales AbC, Invitrogen), control de viabilidad (mezcla 1:1 de células NI-1 recién cultivadas y células NI-1 muertas por calor) y controles fluorescentes menos uno (FMO) para cada panel multicolor. Los datos de citometría de flujo se adquirieron entre 24 y 48 h después de la tinción y fijación de 8/9 de las muestras, utilizando un FACScalibur (BD Biosciences). Los datos de una muestra se recogieron 1 semana después de la tinción debido al mal funcionamiento del analizador. Se adquirieron un mínimo de 10.000 eventos (20) en la puerta de la celda intacta. Los datos de citometría de flujo se analizaron utilizando un software disponible comercialmente (Flowjo).
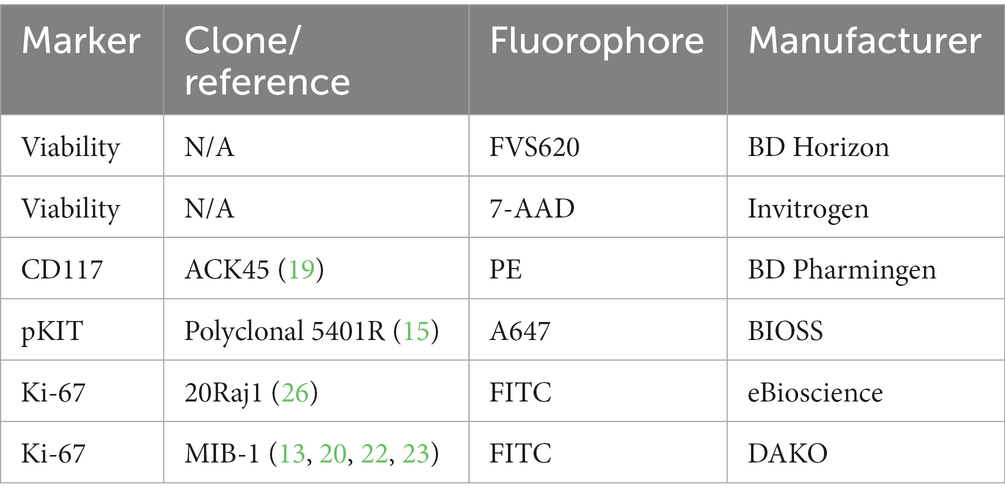 Tabla 1. Lista de los anticuerpos y colorantes de viabilidad utilizados para el análisis por citometría de flujo de mastocitos en este estudio.
Tabla 1. Lista de los anticuerpos y colorantes de viabilidad utilizados para el análisis por citometría de flujo de mastocitos en este estudio.
Protocolo de tinción
Las muestras se incubaron, en medios de cultivo de 100 uL, con anticuerpo anti-CD117 (ACK45-PE) y 7-AAD, a 4°C durante 15 min. Después de la incubación, se utilizaron 2 mL de un tampón de lisis de glóbulos rojos a base de cloruro de amonio para lisar los glóbulos rojos y como lavado. A continuación, se realizó la fijación y permeabilización de las células (FoxP3 transcription factor fix/perm set, eBioscience) con 30 min de tiempo de fijación a 4 °C y un solo lavado con el agente de permeabilización. A continuación, las muestras se incubaron a 4 °C con el anticuerpo anti-Ki-67 (20Raj1-FITC o MIB-1-FITC) y el anticuerpo anti-pKIT (Polyclonal 5401R-A647) en 100 uL de tampón de permeabilización (con albúmina sérica bovina añadida al 2%) durante 30 min y luego seguido de un solo lavado en el tampón de permeabilización. Se utilizaron 200-300 uL de paraformaldehído (PFA) al 1% en solución salina tamponada con fosfato (DPBS) de Dulbecco para resuspender las muestras antes de la adquisición de datos de CF. Para cada ejecución de nuestro panel FC final, se ejecutaron 7 tubos de la siguiente manera: celdas sin teñir, panel completo, FMO-Ki67, FMO-CD117, solo viabilidad (celdas NI-1), control de un solo color de PE (perlas) y control de un solo color FITC (perlas).
Se realizaron modificaciones en el protocolo de tinción en un intento de detectar Ki-67 utilizando el clon 20Raj1. Dos kits de reactivos fijos/permanentes diferentes (FoxP3 transcription factor fix/perm set, eBioscience; True-Nuclear transcription factor fix/perm set, BioLegend). Se probaron modificaciones del reactivo de permeabilización con 0,1% de Tween, 0,1% de Tritón y 0,1% de saponina adicionales. También se evaluaron diferentes tiempos de fijación (30 min vs. 60 min), temperaturas de fijación (4 °C vs. temperatura ambiente), tiempos de incubación de anticuerpos (30 min vs. 60 min) y temperaturas de incubación de anticuerpos (4 °C vs. temperatura ambiente).
Estadística
Para el análisis estadístico se utilizó un software estadístico disponible en el mercado (GraphPad, Prism y Excel). En su caso, se calcularon estadísticas descriptivas.
Resultados
Las muestras de PAAF pueden producir un número y una calidad celulares adecuados para el análisis de FC en el entorno clínico
Se analizaron nueve muestras de PAAF de perros con MCT confirmados citológicamente para determinar el rendimiento celular. Los datos demográficos de los pacientes, el tamaño, la ubicación, el grado y el estadio del tumor, así como el método de recolección de muestras y el rendimiento celular, se detallan en la Tabla Suplementaria S1. Se obtuvieron seis muestras durante las visitas prequirúrgicas y tres muestras se obtuvieron inmediatamente después de la extirpación quirúrgica utilizando la misma técnica de PAAF. El tamaño del tumor (eje más largo) varió de 0,5 cm a 5 cm. Se recolectaron de 2 a 4 jeringas en todos los casos, excepto en uno en el que solo se recolectó 1 jeringa. La celularidad de la muestra varió de solo 200 a más de 16.000.000 de células viables totales (200-4.000.000 por jeringa) con una mediana de rendimiento total de células viables de 800.000 células (Figura suplementaria S1). Utilizando 150.000 celdas (se estima que se necesitan celdas mínimas para el panel multicolor) como punto de corte, 7/9 (78%) de las muestras fueron adecuadas para el análisis de FC. Dos de las nueve muestras (22%) no produjeron suficientes células. Ambas muestras procedían de tumores que se presentaban en las extremidades. Uno de estos tumores medía 1,2 cm con una sola jeringa recogida y el otro medía 0,5 cm. Se observaron efectos adversos locales leves (tumor con aspecto levemente eritematoso o supuración) en dos casos y se trataron en consecuencia. Seis de las nueve muestras se utilizaron para el análisis del rendimiento celular y el desarrollo del panel, y en 3/9 casos se realizó el panel completo.
El anticuerpo anti-CD117-PE (clon ACK45) conserva su capacidad de marcar mastocitos neoplásicos caninos con posterior fijación y permeabilización celular
El anticuerpo anti-CD117 que se utilizó en este estudio (ACK45) ha sido ampliamente estudiado en el pasado y se ha reportado su capacidad para marcar mastocitos caninos (19). No obstante, los protocolos de tinción del receptor de superficie celular (que se han descrito previamente) (19) no requieren fijación y permeabilización celular, lo que puede afectar las propiedades de tinción celular. Dado que el objetivo es marcar CD117 y Ki-67 (factor de transcripción intranuclear) al mismo tiempo, los pasos de fijación y permeabilización tuvieron que incorporarse al protocolo. El anticuerpo anti-CD117 produjo una fuerte señal cuando se aplicó a las células NI-1 sin fijación, como se esperaba (Figura 1A). Cuando las células NI-1 se enriquecieron con sangre entera canina seguida de una posterior fijación y permeabilización, la alta expresión de CD117 de las células NI-1 formó una población discreta que podía separarse fácilmente de los leucocitos de sangre periférica (Figura 1B). Una muestra de sangre periférica fija y permeabilizada de un perro con mastocitemia (10% de mastocitos en un recuento diferencial de 100 células) mostró una separación adecuada de los mastocitos de otros leucocitos (Figura 1C). Este anticuerpo anti-CD117 fue más eficaz para diferenciar los mastocitos de los no mastocitos en una muestra de PAAF que se fijó y permeabilizó de un perro con MCT (Figura 1D).
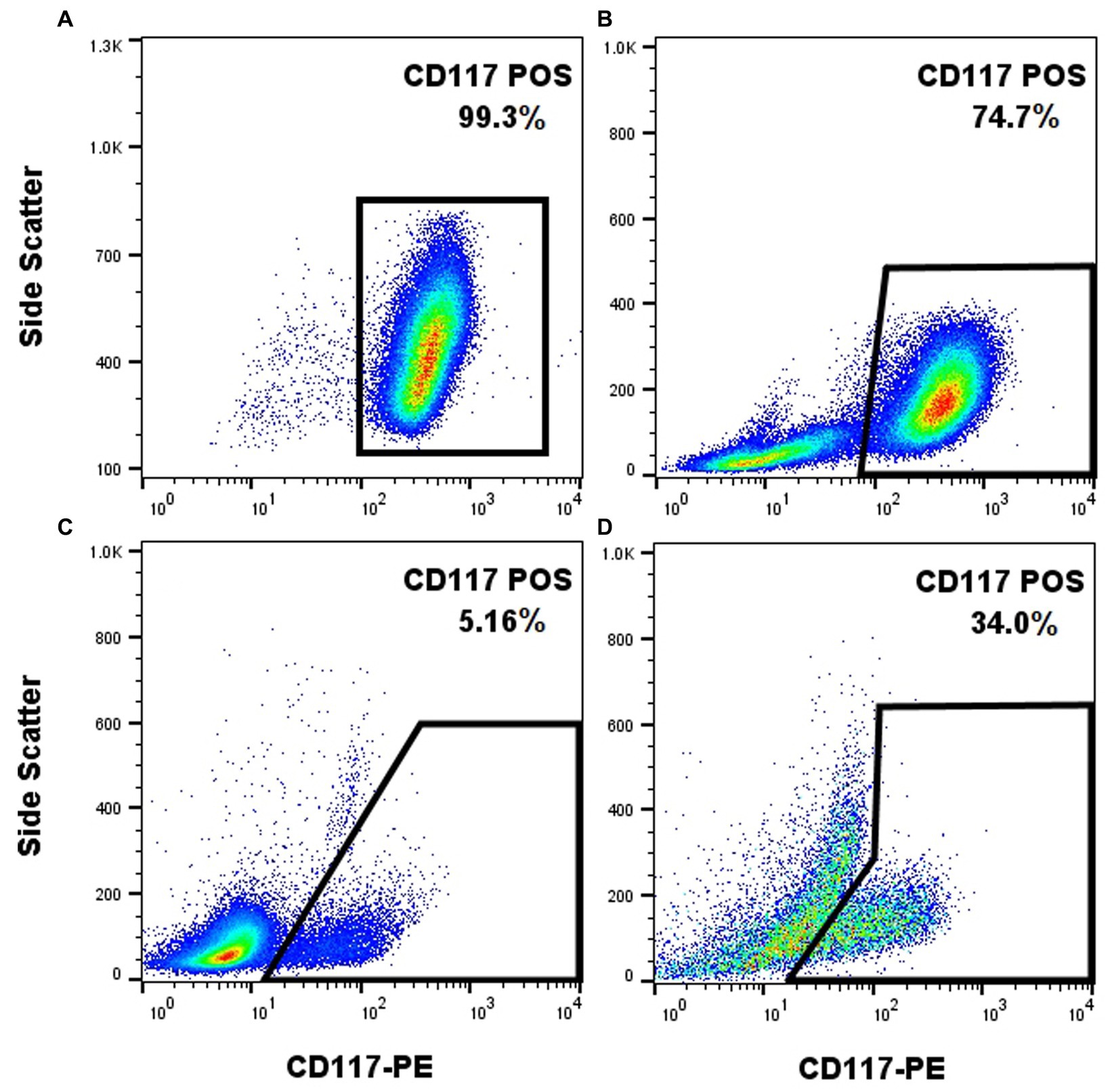 Figura 1. El anticuerpo anti-CD117-PE (clon ACK45, BD Pharmingen) permite el marcaje eficaz de mastocitos caninos con fijación y permeabilización posteriores al marcado. Fluorescencia CD117-PE (eje x) trazada contra la dispersión lateral (eje y) de diferentes muestras que contienen mastocitos. Los mastocitos NI-1 no fijados mostraron una positividad uniforme (A). Los mastocitos NI-1 fijos y permeabilizados enriquecidos con leucocitos de sangre periférica mostraron una población discreta de mastocitos (B). La sangre entera fijada y permeabilizada de un perro con mastocitemia mostró una separación efectiva de los mastocitos de los no mastocitos (C). La muestra fija y permeabilizada de PAAF de un TCM mostró una separación efectiva de los mastocitos de los no mastocitos (D).
Figura 1. El anticuerpo anti-CD117-PE (clon ACK45, BD Pharmingen) permite el marcaje eficaz de mastocitos caninos con fijación y permeabilización posteriores al marcado. Fluorescencia CD117-PE (eje x) trazada contra la dispersión lateral (eje y) de diferentes muestras que contienen mastocitos. Los mastocitos NI-1 no fijados mostraron una positividad uniforme (A). Los mastocitos NI-1 fijos y permeabilizados enriquecidos con leucocitos de sangre periférica mostraron una población discreta de mastocitos (B). La sangre entera fijada y permeabilizada de un perro con mastocitemia mostró una separación efectiva de los mastocitos de los no mastocitos (C). La muestra fija y permeabilizada de PAAF de un TCM mostró una separación efectiva de los mastocitos de los no mastocitos (D).
La tinción de pKIT produce un patrón de tinción inespecífico
El anticuerpo policlonal 5401R anti-pKIT mostró una tinción inespecífica significativa de las células NI-1 y los leucocitos de sangre periférica (datos no mostrados). En consecuencia, pKIT fue excluido del panel final de FC.
El anticuerpo MIB-1 anti-Ki-67 proporciona una calidad de tinción superior de los mastocitos neoplásicos caninos
El clon MIB-1 del anticuerpo anti-Ki-67 produjo una señal claramente identificable y distinta en las células NI-1 utilizando el conjunto de tampones fijos/permanentes del factor de transcripción FoxP3 (Figura 2). Por otro lado, el clon 20Raj-1 del anticuerpo anti-Ki-67 no produjo una tinción creíble en las células NI-1, a pesar de las muchas modificaciones del protocolo en los reactivos fijos/permanentes, la concentración, el tiempo de incubación y la temperatura de incubación (Figura 2). Tampoco produjo una tinción creíble de las muestras clínicas de PAAF de MCT (datos no mostrados). Sin embargo, produjo tinción positiva en linfocitos de sangre periférica y un caso de sospecha de leucemia aguda (Figura suplementaria S2).
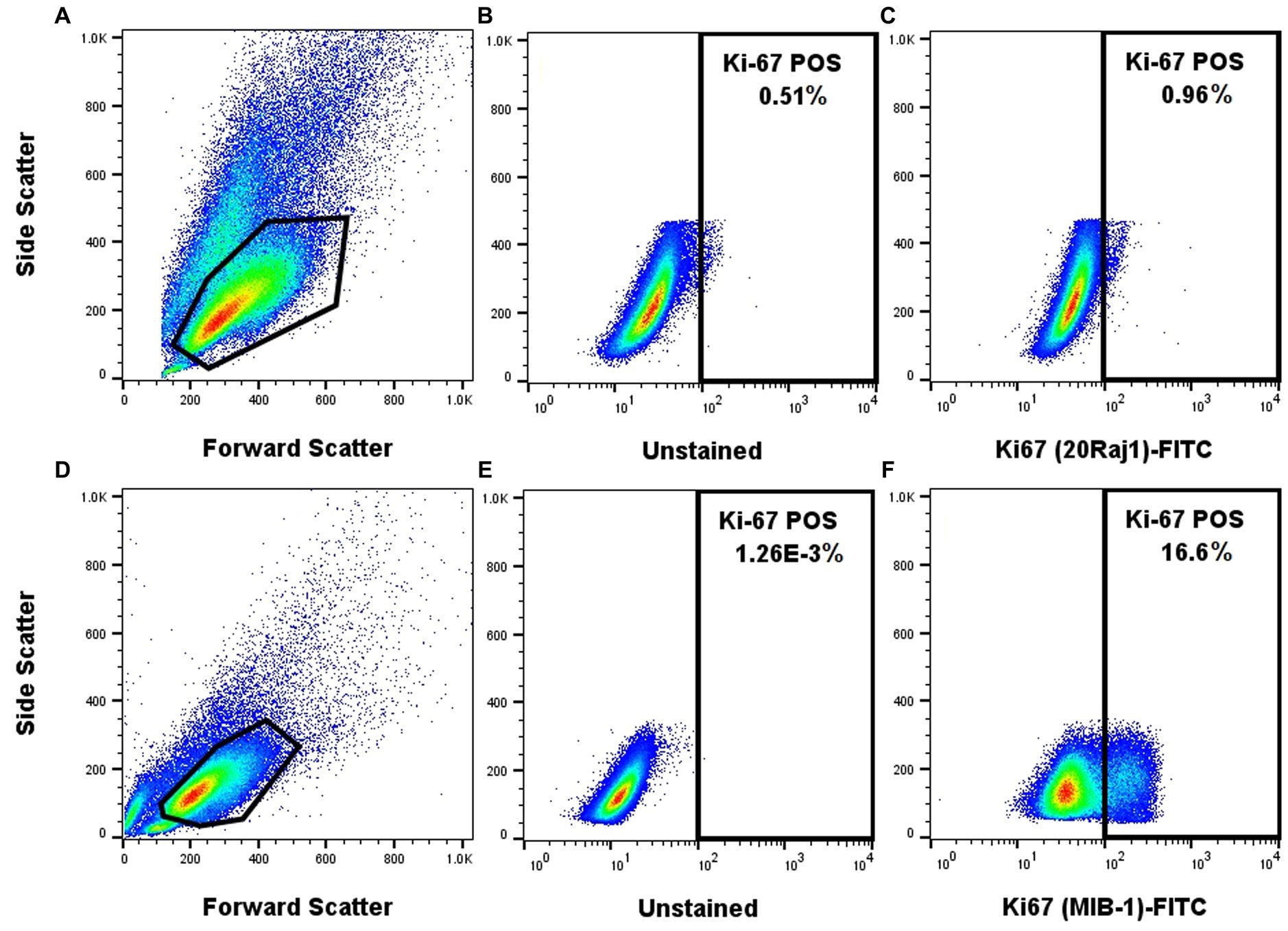 Figura 2. El anticuerpo MIB-1 anti-Ki67 proporciona una calidad de tinción superior de los mastocitos neoplásicos caninos NI-1. Las células NI-1 se tiñeron con el clon 20Raj1 (A-C) o el clon MIB-1 (D-F).
Figura 2. El anticuerpo MIB-1 anti-Ki67 proporciona una calidad de tinción superior de los mastocitos neoplásicos caninos NI-1. Las células NI-1 se tiñeron con el clon 20Raj1 (A-C) o el clon MIB-1 (D-F).
Aplicación de prueba de concepto de nuestro panel FC
Una vez que se optimizó el protocolo de tinción para cada marcador individual, se combinaron para determinar si se podían identificar patrones de tinción apropiados en muestras de PAAF de MCT clínicos. La aplicación del panel FC a un tumor histológico de grado 1/bajo grado y a un tumor biológicamente maligno (metástasis confirmada en el ganglio linfático en la citología) produjo una señal distintiva de Ki-67 que fue baja (5,2 %) en la muestra tumoral de bajo grado y marcadamente más alta (28,8 %) en el tumor biológicamente agresivo (Figura 3). El tumor biológicamente agresivo tenía un número bajo de mastocitos en la citología, lo que concuerda con los resultados de la CF. Se realizó un diferencial de 500 células en un portaobjetos teñido con Wright Giemsa que consistía principalmente en neutrófilos con menos macrófagos, linfocitos y eosinófilos y 1,6% de mastocitos bien granulados.
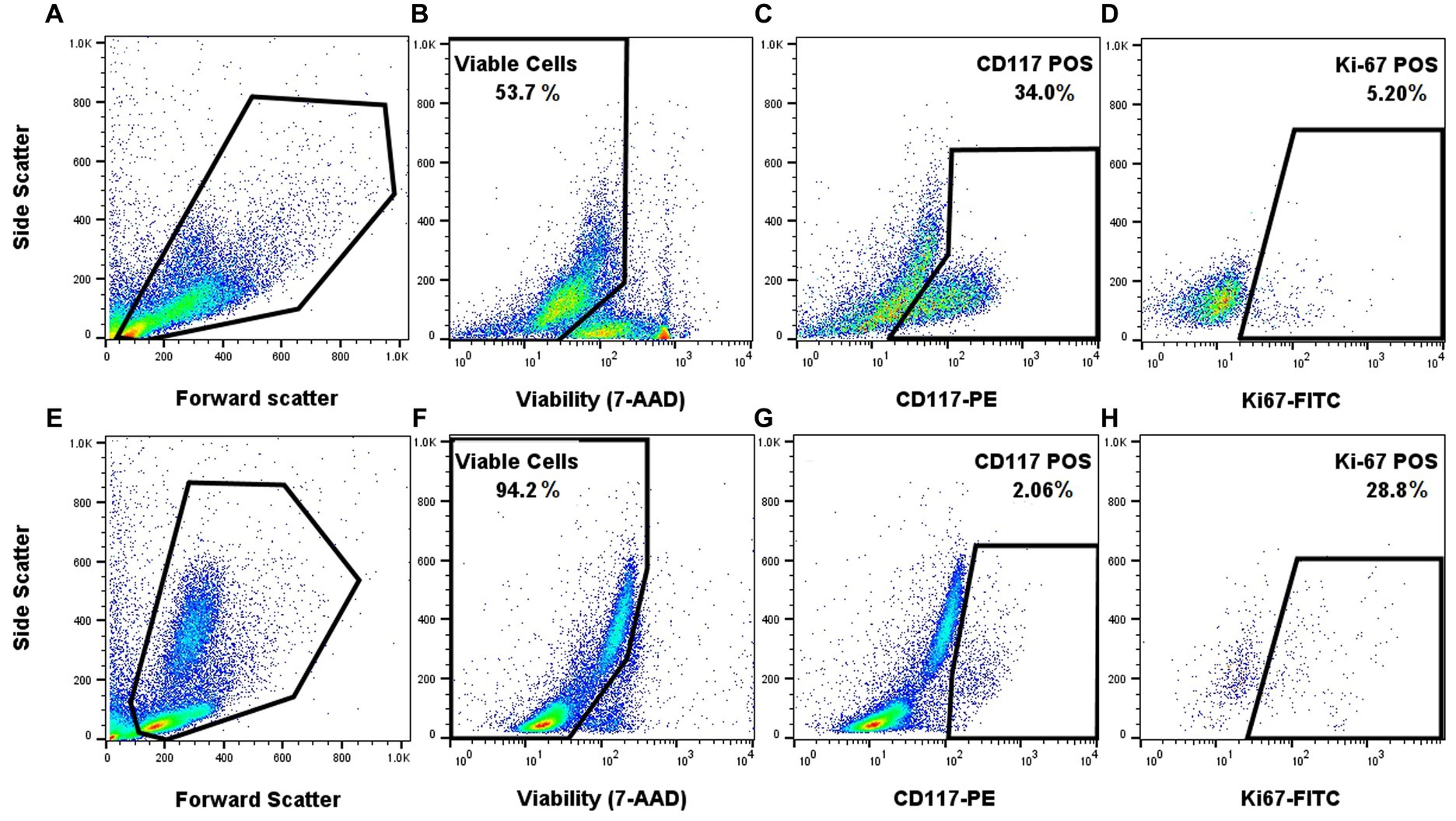 Figura 3. Aplicación de prueba de concepto del panel FC utilizando muestras de un TCM cutáneo canino de bajo grado (A-D) y un TCM biológicamente agresivo (E-H). Dispersión frontal y lateral para las dos muestras diferentes (A,E). Activación de las células viables mediante 7-AAD (B,F). Activación de células CD117 positivas dentro de las células viables (C,G). Activación de células viables y CD117 positivas que expresan Ki-67 (D,H). Se utilizaron controles apropiados de un solo color y FMO.
Figura 3. Aplicación de prueba de concepto del panel FC utilizando muestras de un TCM cutáneo canino de bajo grado (A-D) y un TCM biológicamente agresivo (E-H). Dispersión frontal y lateral para las dos muestras diferentes (A,E). Activación de las células viables mediante 7-AAD (B,F). Activación de células CD117 positivas dentro de las células viables (C,G). Activación de células viables y CD117 positivas que expresan Ki-67 (D,H). Se utilizaron controles apropiados de un solo color y FMO.
Discusión
Los MCT cutáneos caninos tienen un comportamiento biológico muy variable y los tumores subcutáneos también podrían ser agresivos. Se dispone de opciones prequirúrgicas limitadas para evaluar su pronóstico y guiar la estadificación y el tratamiento posteriores. El presente estudio desarrolló un panel de FC que permite la cuantificación de la expresión de Ki-67, un marcador pronóstico de IHQ validado, en mastocitos neoplásicos viables utilizando muestras de PAAF que pueden aplicarse prequirúrgicamente. Se requerirán estudios futuros para determinar su eficacia clínica para el pronóstico de MCT canino.
Los experimentos de rendimiento celular mostraron que se pueden obtener fácilmente suficientes células de los tumores de mastocitos a través de la PAAF, y que el 78 % de los casos tienen un rendimiento celular total muy por encima de las 150 000 células estimadas necesarias para este panel (Figura suplementaria S1). Esto refleja los resultados de un informe anterior, en el que 34/38 (89%) muestras de MCT por PAAF arrojaron suficientes células (19). A diferencia de este informe anterior, la mayoría (6/9) de nuestras muestras se obtuvieron durante la visita prequirúrgica en lugar de la escisión posquirúrgica. Además, todas nuestras muestras se obtuvieron mediante la técnica de PAAF y ninguna se complementó con raspado tumoral. Dos de nuestros nueve casos (22%) no produjeron suficientes células. Ambas muestras procedían de tumores pequeños (eje más largo de 1,2 cm y 0,5 cm) y se localizaron en las extremidades. Una PAAF se obtuvo antes de la cirugía y la otra se obtuvo inmediatamente después de la cirugía. Desafortunadamente, el bajo número de muestras con un número insuficiente de células (n = 2) no nos permitió determinar si existían asociaciones estadísticas. Por último, los diferentes operadores que recogen las muestras de PAAF pueden haber contribuido aún más a la variación en el rendimiento celular. Se necesitan más estudios para confirmar estas observaciones y ofrecer más orientación sobre el muestreo de PAAF para CF.
Para garantizar que solo se evaluara la expresión de biomarcadores en células vivas, se aplicó el colorante de unión al ADN 7-amino-actinomicina D (7-AAD). En el protocolo actual, el 7-AAD mostró una señal brillante y eficaz que diferenciaba las células viables de las no viables. Aunque normalmente se utiliza para protocolos de tinción solo de superficie celular, el 7-AAD se ha informado previamente para la tinción intracelular con posterior fijación y permeabilización celular (27). El colorante reactivo a la amina intracelular alternativo (FVS620) produjo un índice de tinción CD117 deficiente en muestras clínicas de tumores de mastocitos y no se incluyó en el panel final (no se muestran los datos).
Se probaron dos clones diferentes de anticuerpos anti-Ki-67 (20Raj1 y MIB-1), incluyendo diferentes protocolos de fijación/permeabilización. El clon MIB-1 mostró una tinción superior de los mastocitos utilizando el conjunto de factor de transcripción fijo/permanente FoxP3 (Figura 2). Las células NI-1 (Figura 2) y las muestras clínicas de mastocitos tumorales (datos no mostrados) no fueron reactivas al anticuerpo 20Raj1, a pesar de los diferentes reactivos de fijación/permeabilización, el tiempo de incubación y las temperaturas de incubación aplicados. Esto contrasta con un estudio que informa sobre el uso exitoso del anticuerpo 20Raj1 en el análisis citométrico de flujo de linfocitos caninos (26). Además, se detectó la inmunorreactividad de este anticuerpo en una muestra de sangre de un perro con leucemia aguda (Figura suplementaria S2), demostrando que el anticuerpo puede detectar el antígeno Ki-67 en células caninas. Los diferentes resultados con estos dos anticuerpos pueden deberse a la especificidad de diferentes epítopos o a que el anticuerpo 20Raj1 puede requerir un tipo diferente de permeabilización celular. La causa de esta discrepancia no se investigó más a fondo, ya que está fuera del alcance de este proyecto.
Un anticuerpo policlonal pKIT (5401R, BIOSS) mostró una unión amplia e inespecífica y uniforme a los leucocitos de sangre periférica (datos no mostrados), que no deberían expresar CD117 ni su forma fosforilada. Las posibles causas de esta importante tinción inespecífica incluyen que se trata de un anticuerpo policlonal y que también se dirige a una diana fosforilada, que puede requerir un tipo diferente de permeabilización (como la basada en metanol) que puede no ser compatible con el resto de nuestros marcadores de panel. Como tal, este marcador no se incluyó en el panel multicolor final.
Por último, y lo más importante, la aplicación del panel multicolor combinado mostró que un tumor de mastocitos biológicamente agresivo, con evidencia citológica de metástasis en el ganglio linfático drenante, tenía una expresión de Ki-67 mucho mayor en comparación con un tumor de bajo grado (Figura 3). Además, este caso también demostró la robustez del panel y de los biomarcadores, donde el CF fue capaz de delinear el bajo porcentaje de mastocitos de los leucocitos predominantes. De hecho, el tumor primario estaba marcadamente inflamado y solo se identificaron unos pocos mastocitos en la evaluación citológica (1,6 % de mastocitos en un recuento diferencial de 500 células), lo que es consistente con el bajo porcentaje de mastocitos en FC (2,06 % de células CD117+). Se necesitarán más muestras para determinar si hay una diferencia significativa en el nivel de expresión de Ki-67 entre los tumores de grado bajo y alto y si se puede usar para el pronóstico de la enfermedad.
El desarrollo de este panel tiene varias limitaciones. En primer lugar, el bajo número de muestras de PAAF impide una evaluación significativa si el tamaño y la ubicación del tumor afectan la producción de células de PAAF. En segundo lugar, la obtención de las muestras de FNA por parte de múltiples operadores puede dar lugar a una variación en el rendimiento celular. En tercer lugar, la línea celular NI-1 proviene de un perro con leucemia de mastocitos, no de un tumor cutáneo de mastocitos, y es posible que no tenga el mismo patrón de expresión de biomarcadores. Por último, los leucocitos de sangre periférica con picos se utilizaron como población control negativa con las células NI-1, pero no representan la población leucocitaria típica (principalmente eosinófilos) en los tumores de mastocitos.
Sin embargo, proporcionamos datos de prueba de concepto utilizando muestras clínicas de PAAF que demuestran la solidez de nuestro panel FC, su capacidad para separar mastocitos neoplásicos de los no mastocitos y etiquetar eficazmente Ki-67 dentro de esta población de células neoplásicas. El desarrollo de un panel de FC multicolor en MCT cutáneo canino que incluye Ki-67 nos da una poderosa herramienta para evaluar el comportamiento tumoral antes de la cirugía. El siguiente paso inmediato sería examinar si existe una correlación entre la expresión de Ki-67 en mastocitos neoplásicos a través de FC y el grado histológico, el estadio tumoral y la supervivencia.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
Los estudios en animales fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales de la Universidad de California, Davis. Los estudios se llevaron a cabo de acuerdo con la legislación local y los requisitos institucionales. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
BW: Conceptualización, Curación de datos, Análisis formal, Investigación, Metodología, Validación, Visualización, Redacción – borrador original, Redacción – revisión y edición, Obtención de fondos. AL: Conceptualización, Obtención de Fondos, Metodología, Redacción – Revisión y Edición. VA: Conceptualización, Obtención de fondos, Redacción – revisión y edición. GI: Metodología, Redacción – revisión y edición. FR: Análisis Formal, Metodología, Visualización, Escritura – Revisión y Edición. AK: Conceptualización, Análisis Formal, Obtención de Financiamiento, Investigación, Metodología, Administración de Proyectos, Recursos, Software, Supervisión, Validación, Visualización, Redacción – Revisión y Edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este proyecto está financiado por el Centro para la Salud de los Animales de Compañía de la Universidad de California Davis, subvención número 2021-49-R.
Reconocimientos
Los autores desean agradecer al Centro para la Salud de los Animales de Compañía por financiar este proyecto, y agradecer al Dr. Emir Hadzijusufovic por su ayuda con las células NI-1 y la optimización de los anticuerpos anti-Ki-67.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
El/los autor/es declararon, en el momento de la presentación, ser miembro del consejo editorial de Frontiers. Esto no tuvo ningún impacto en el proceso de revisión por pares ni en la decisión final.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1279881/full#supplementary-material
FIGURA COMPLEMENTARIA S1
Rendimiento celular de PAAF de nueve casos de MCT canino. Los puntos negros representan los seis casos en los que se obtuvieron muestras de PAAF antes de la cirugía. Los puntos azules representan los tres casos en los que se obtuvieron muestras de PAAF inmediatamente después de la cirugía. La línea negra continua representa la mediana del rendimiento total de células viables. La línea negra punteada representa el rendimiento mínimo de celda estimado requerido para realizar este panel FC.
FIGURA COMPLEMENTARIA S2
Marcaje de anticuerpos anti-Ki20 1Raj67 de células sanguíneas periféricas de un perro con leucemia aguda. Dispersión frontal y lateral (A). Control sin manchas (B). Muestra teñida con 20Raj1 (C). Se utilizaron controles apropiados de un solo color y FMO.
CUADRO COMPLEMENTARIO 1
Se recopilaron datos de los nueve casos de tumores de mastocitos caninos.
Referencias
1. Selmic, LE, y Ruple, A. Una revisión sistemática de los márgenes quirúrgicos utilizados para la extirpación de tumores cutáneos de mastocitos en perros. BMC Vet Res. (2020) 16:5. doi: 10.1186/s12917-019-2227-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Villamil, JA, Henry, CJ, Bryan, JN, Ellersieck, M, Schultz, L, Tyler, JW, et al. Identificación de las neoplasias cutáneas más comunes en perros y evaluación de la distribución de razas y edades para las neoplasias seleccionadas. J Am Vet Med Assoc. (2011) 239:960–5. doi: 10.2460/javma.239.7.960
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Kiupel, M, Webster, JD, Bailey, KL, Best, S, DeLay, J, Detrisac, CJ, et al. Propuesta de un sistema de clasificación histológica de 2 niveles para los tumores cutáneos de mastocitos caninos para predecir con mayor precisión el comportamiento biológico. Veterinario Pathol. (2011) 48:147–55. doi: 10.1177/0300985810386469
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Kiupel, M. Tumores de mastocitos en: Tumores en animales domésticos. Hoboken, Nueva Jersey: John Wiley & Sons, Ltd (2016). 176–202.
5. Donnelly, L, Mullin, C, Balko, J, Goldschmidt, M, Krick, E, Hume, C, et al. Evaluación del grado histológico y de los márgenes histológicamente libres de tumores como predictores de recidiva local en tumores de mastocitos caninos completamente extirpados. Veterinario Comp Oncol. (2015) 13:70–6. doi: 10.1111/vco.12021
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Marconato, L, Polton, G, Stefanello, D, Morello, E, Ferrari, R, Henriques, J, et al. Impacto terapéutico de la linfadenectomía regional en tumores cutáneos de mastocitos caninos estadio II. Veterinario Comp Oncol. (2018) 16:580–9. doi: 10.1111/vco.12425
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Fejös, C, Troedson, K, Ignatenko, N, Zablotski, Y, y Hirschberger, J. La estadificación extensiva no tiene valor pronóstico en perros con tumores de mastocitos de bajo riesgo. Veterinario Comp Oncol. (2021) 20:265–75. doi: 10.1111/vco.12773
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Pecceu, E, Serra Varela, JC, Handel, I, Piccinelli, C, Milne, E, y Lawrence, J. La ecografía es un mal predictor de metástasis hepáticas o de bazo tempranas o manifiestas en perros con tumores de mastocitos de alto riesgo. Veterinario Comp Oncol. (2020) 18:389–401. doi: 10.1111/vco.12563
9. Simpson, AM, Ludwig, LL, Newman, SJ, Bergman, PJ, Hottinger, HA, y Patnaik, AK. Evaluación de los márgenes quirúrgicos necesarios para la extirpación completa de los tumores cutáneos de mastocitos en perros. J Am Vet Med Assoc. (2004) 224:236–40. doi: 10.2460/javma.2004.224.236
10. Thompson, JJ, Pearl, DL, Yager, JA, Best, SJ, Coomber, BL y Foster, RA. Tumor subcutáneo canino de mastocitos: caracterización e índices pronósticos. Veterinario Pathol. (2011) 48:156–68. doi: 10.1177/0300985810387446
11. Cherzan, NL, Fryer, K, Burke, B, y Farrelly, J. Factores que afectan el pronóstico en los tumores subcutáneos de mastocitos caninos: 45 casos. Cirugía veterinaria. (2023) 52:531–7. doi: 10.1111/vsu.13944
12. Patnaik, AK, Ehler, WJ y MacEwen, EG. Tumor cutáneo canino de mastocitos: gradación morfológica y tiempo de supervivencia en 83 perros. Veterinario Pathol. (1984) 21:469–74. doi: 10.1177/030098588402100503
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Vascellari, M, Giantin, M, Capello, K, Carminato, A, Morello, EM, Vercelli, A, et al. Expresión de Ki67, BCL-2 y COX-2 en tumores cutáneos de mastocitos caninos: asociación con el grado y el pronóstico. Veterinario Pathol. (2013) 50:110–21. doi: 10.1177/0300985812447829
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Webster, JD, Yuzbasiyan-Gurkan, V, Miller, RA, Kaneene, JB y Kiupel, M. Proliferación celular en tumores cutáneos de mastocitos caninos: asociaciones con c-KIT y su papel en el pronóstico. Veterinario Pathol. (2007) 44:298–308. doi: 10.1354/vp.44-3-298
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Halsey, CHC, Thamm, DH, Weishaar, KM, Burton, JH, Charles, JB, Gustafson, DL, et al. Expresión de KIT fosforilado en mastocitos caninos. Veterinario Pathol. (2017) 54:387–94. doi: 10.1177/0300985816688943
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Thompson, JJ, Yager, JA, Best, SJ, Pearl, DL, Coomber, BL, Torres, RN, et al. Tumores subcutáneos caninos: proliferación celular y expresión de KIT como índices pronósticos. Veterinario Pathol. (2011) 48:169–81. doi: 10.1177/0300985810390716
17. De Ridder, TR, Campbell, JE, Burke-Schwarz, C, Clegg, D, Elliot, EL, Geller, S, et al. Estudio clínico controlado aleatorizado que evalúa la eficacia y seguridad del tratamiento intratumoral de los tumores de mastocitos caninos con tigilanol tiglate (EBC-46). J Veterinario Pasante Med. (2021) 35:415–29. doi: 10.1111/jvim.15806
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Ghisleni, G, Roccabianca, P, Ceruti, R, Stefanello, D, Bertazzolo, W, Bonfanti, U, et al. Correlación entre la citología aspirativa con aguja fina y la histopatología en la evaluación de masas cutáneas y subcutáneas de perros y gatos. Veterinario Clin Pathol. (2006) 35:24–30. doi: 10.1111/j.1939-165X.2006.tb00084.x
19. Sulce, M, Marconato, L, Martano, M, Iussich, S, Dentini, A, Melega, M, et al. Utilidad de la citometría de flujo en el tumor cutáneo primario canino y en el tumor ganglionar emparejado. Veterinario J. (2018) 242:15–23. doi: 10.1016/j.tvjl.2018.10.004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Poggi, A, Miniscalco, B, Morello, E, Comazzi, S, Gelain, ME, Aresu, L, et al. Evaluación citométrica de flujo de ki67 para la determinación del grado de malignidad en el linfoma canino. Veterinario Comp Oncol. (2015) 13:475–80. doi: 10.1111/vco.12078
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Berlato, D, Murphy, S, Monti, P, Stewart, J, Newton, JR, Flindall, A, et al. Comparación del índice mitótico y el índice Ki67 en el pronóstico de los mastocitos cutáneos caninos. Veterinario Comp Oncol. (2015) 13:143–50. doi: 10.1111/vco.12029
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Horta, RS, Lavalle, GE, Monteiro, LN, Souza, MCC, Cassali, GD, y Araújo, RB. Evaluación del riesgo de mortalidad tumoral de mastocitos caninos en función de las características clínicas, histológicas, inmunohistoquímicas y moleculares. Veterinario Pathol. (2018) 55:212–23. doi: 10.1177/0300985817747325
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Scase, TJ, Edwards, D, Miller, J, Henley, W, Smith, K, Blunden, A, et al. Tumores de mastocitos caninos: correlación de marcadores de apoptosis y proliferación con el pronóstico. J Veterinario Pasante Med. (2006) 20:151–8. doi: 10.1892/0891-6640(2006)20[151:CMCTCO]2.0.co; 2
24. Aubreville, M, Bertram, CA, Marzahl, C, Gurtner, C, Dettwiler, M, Schmidt, A, et al. Los algoritmos de aprendizaje profundo superan a los patólogos veterinarios en la detección de la región tumoral mitóticamente más activa. Sci Rep. (2020) 10:16447. doi: 10.1038/s41598-020-73246-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Hadzijusufovic, E, Peter, B, Herrmann, H, Rülicke, T, Cerny-Reiterer, S, Schuch, K, et al. NI-1: un nuevo modelo de mastocitoma canino para estudiar la resistencia a los medicamentos y la activación de mastocitos dependientes de IgER. Alergia. (2012) 67:858–68. doi: 10.1111/j.1398-9995.2012.02833.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Sparger, EE, Chang, H, Chin, N, Rebhun, RB, Withers, SS, Kieu, H, et al. Perfiles inmunitarios de células T de sangre y tumor en perros diagnosticados con melanoma maligno. Front Vet Sci. (2021) 8:772932. doi: 10.3389/fvets.2021.772932
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Schmid, I, Ferbas, J, Uittenbogaart, CH, y Giorgi, JV. Análisis citométrico de flujo de proliferación y fenotipo de células vivas en poblaciones con baja viabilidad. Citometría. (1999) 35:64–74. doi: 10.1002/(SICI)1097-0320(19990101)35:1<64::AID-CYTO9>3.0.CO; 2-Y
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: citometría de flujo, aspirado con aguja fina, tumor cutáneo canino, biomarcadores, Ki-67, CD117
Cita: Wu B, Lejeune A, Affolter VK, Iamone G, Riondato F y Kol A (2023) Desarrollo de un panel citométrico de flujo para evaluar biomarcadores pronósticos en aspirados con aguja fina de tumores de mastocitos caninos cutáneos o subcutáneos. Frente. Vet. Sci. 10:1279881. doi: 10.3389/fvets.2023.1279881
Recibido: 18 de agosto de 2023; Aceptado: 06 de noviembre de 2023;
Publicado: 21 Noviembre 2023.
Editado por:
Marta Vascellari, Instituto Zooprofiláctico Experimental de Venecia (IZSVe), Italia
Revisado por:
Valeria Martini, Universidad de Milán, Italia
Joy Archer, Universidad de Cambridge, Reino Unido
Derechos de autor © 2023 Wu, Lejeune, Affolter, Iamone, Riondato y Kol. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: BinXi Wu, bwu@midwestern.edu
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía