Evaluación del efecto combinado de zoledronato y agentes quimioterapéuticos en células de osteosarcoma canino
Evaluación del efecto combinado de zoledronato y agentes quimioterapéuticos en células de osteosarcoma canino
 Yoshimi Iwaki1,2*
Yoshimi Iwaki1,2*  Stephanie E. S. Lindley1
Stephanie E. S. Lindley1  Noelle Bergman1
Noelle Bergman1  Bruce F. Smith3
Bruce F. Smith3  Satyanarayana R. Pondugula4
Satyanarayana R. Pondugula4- 1Departamento de Ciencias Clínicas, Facultad de Medicina Veterinaria, Universidad de Auburn, Auburn, AL, Estados Unidos
- 2Departamento de Medicina y Cirugía Veterinaria, Facultad de Medicina Veterinaria, Universidad de Missouri, Columbia, MO, Estados Unidos
- 3Centro de Investigación Scott Ritchey, Facultad de Medicina Veterinaria, Universidad de Auburn, Auburn, AL, Estados Unidos
- 4Departamento de Anatomía, Fisiología y Farmacología, Facultad de Medicina Veterinaria, Auburn, AL, Estados Unidos
Introducción: El osteosarcoma (AOS) es una forma agresiva de cáncer de hueso tanto en perros como en humanos. Las opciones de tratamiento de la AOS metastásica (estadio III) son actualmente limitadas y el pronóstico es precario. El zoledronato, un aminobifosfonato de segunda generación, se usa comúnmente para paliar el dolor óseo inducido por el cáncer. El zoledronato también ha demostrado propiedades anticancerígenas y posiblemente aumenta la citotoxicidad de la doxorrubicina en una línea celular de histiocitosis canina y una línea celular de cáncer de próstata humano. El objetivo de este estudio fue evaluar el efecto combinado del zoledronato y diversos fármacos quimioterapéuticos en células caninas de AOS.
Métodos: Para evaluar el potencial terapéutico de estos fármacos se utilizaron la línea celular de AOS canina (D17), células de dos AOS primarias caninas y MDCK, una línea celular de riñón canino. Se utilizaron carboplatino, doxorrubicina, vinorelbina, toceranib y mostaza isoforamida (metabolito activo de la ifosfamida) como agentes quimioterapéuticos. En primer lugar, las células se trataron con zoledronato o con un fármaco quimioterapéutico solo durante 72 horas. La viabilidad celular se evaluó mediante CellTiter Glo e IC5IC10IC20y el IC50 se calcularon. En segundo lugar, las células fueron tratadas con una combinación de zoledronato y cada agente quimioterapéutico en su CI5IC10IC20y el IC50 Concentraciones. Después de 72 horas, la viabilidad celular fue evaluada por CellTiter Glo.
Resultados y discusión: El zoledronato, el carboplatino, la doxorrubicina, la vinorelbina y la mostaza isoforamida mostraron una disminución dependiente de la concentración en la viabilidad celular. El toceranib mostró una disminución de la viabilidad celular solo a concentraciones más altas. Cuando se utilizó zoledronato en combinación con fármacos quimioterápicos, aunque mostró posibles efectos sinérgicos con toceranib, se observaron posibles efectos antagónicos con vinorelbina e isoforamida mostaza. Sin embargo, los resultados difieren según la línea celular y, por lo tanto, se justifica una evaluación adicional para comprender el mecanismo de acción exacto.
1 Introducción
El osteosarcoma (AOS) es el tumor óseo más frecuente en perros (1). Este tumor presenta un comportamiento localmente agresivo y altamente metastásico (2). El estándar actual de atención para la AOS apendicular canina consiste en terapia local (es decir, amputación, cirugía con preservación de la extremidad o radioterapia estereotáctica) combinada con quimioterapia citotóxica (es decir, carboplatino, cisplatino y/o doxorrubicina), lo que da como resultado una mediana de supervivencia de 10 a 12 meses (2). A pesar del adecuado control tumoral local, se espera que más del 90% de los perros desarrollen y mueran a partir de enfermedad metastásica a distancia (2). Las opciones para tratar la enfermedad metastásica siguen siendo limitadas. La quimioterapia citotóxica parece ser mínimamente eficaz para la enfermedad macroscópica con doxorrubicina, cisplatino, mitoxantrona, ifosfamida o fosfato de toceranib (Palladia) con una tasa de respuesta de 0–12 % (3–6). La alta frecuencia de metástasis y la resistencia a la quimioterapia han llevado a la búsqueda de nuevas estrategias de tratamiento.
El zoledronato es un bifosfonato de tercera generación utilizado en medicina humana y veterinaria para el tratamiento del dolor óseo asociado al cáncer, la hipercalcemia, la enfermedad de Paget y la osteoporosis (7). Cuando se administran sistémicamente, los bifosfonatos se concentran dentro de las porciones metabólicamente activas del hueso y sirven para inhibir los osteoclastos y la resorción ósea. Los bifosfonatos parecen ser bien tolerados en perros, y los eventos adversos son limitados (7, 8). Más recientemente, los bifosfonatos se han investigado por sus propiedades antineoplásicas. El zoledronato se concentra dentro de los osteoclastos e inhibe la farnesil pirofosfato sintasa, una enzima necesaria para la prenilación de las proteínas de unión a GTP. Esto da lugar a la detención del ciclo celular y a la apoptosis (9). El zoledronato también parece modular el microambiente tumoral mediante la activación de las células T γδ (10), la inhibición de la actividad de la metaloproteinasa de la matriz (11), la promoción de la diferenciación de los macrófagos hacia un fenotipo M1 antitumoral (11) y la disminución de la secreción del factor de crecimiento endotelial vascular por parte de las células AOS (12). Los estudios murinos in vitro e in vivo han demostrado que el zoledronato reduce la lisis ósea inducida por AOS, reduce el crecimiento del tumor primario y disminuye la metástasis pulmonar a través de sus efectos sobre la migración, adhesión e invasividad de las células de AOS (12-14). En una publicación anterior se describieron cuatro pacientes humanos con AOS metastásico que fueron tratados con zoledronato después de fracasar la quimioterapia. Los cuatro pacientes experimentaron una marcada mejoría en la supervivencia libre de progresión en comparación con los controles históricos (>19 meses vs. 2 meses, respectivamente) (15). En el modelo de ratones de AOS canina, el zoledronato mitigó el alcance de la lisis ósea en los huesos afectados. Sin embargo, el volumen de tumores metastásicos en los pulmones aumentó en el grupo de ratones que recibieron zoledronato (16). Otro estudio investigó el impacto del zoledronato en pacientes caninos con AOS en estadio III y encontró que no extendió la supervivencia de estos perros con AOS (17).
Se han observado efectos anticancerígenos sinérgicos in vitro de los bifosfonatos y los fármacos quimioterapéuticos, específicamente zoledronato y doxorrubicina, en células de histiocitosis maligna canina (18), células de cáncer de próstata humano (19) y células de cáncer de mama humano (20). En estos estudios, la combinación de zoledronato y doxorrubicina aumentó la apoptosis celular, mientras que la combinación de zoledronato con lomustina (CCNU) y vincristina no aumentó la apoptosis celular. Se indicó que el zoledronato aumentó la acumulación intracelular de doxorrubicina en células caninas malignas de histiocitosis; sin embargo, aún no se han determinado otros mecanismos de este fenómeno (18). Anteriormente, se llevó a cabo un estudio de fase I de zoledronato en humanos con AOS metastásico recién diagnosticado (21). Este estudio demostró que el zoledronato podía administrarse de forma segura junto con la quimioterapia citotóxica convencional. Aun así, los efectos anticancerígenos sinérgicos de los bifosfonatos y los fármacos quimioterapéuticos de los estudios in vivo son controvertidos. Cuando se usó zoledronato con ifosfamida en un modelo de rata, mostró una resolución completa de osteosarcoma frente a enfermedad progresiva en el grupo control (22). Sin embargo, un ensayo clínico de fase III en pacientes humanos con AOS no demostró ningún beneficio cuando se inició el zoledronato después del diagnóstico junto con la cirugía y la quimioterapia (23, 24).
Aunque el zoledronato se usa comúnmente en perros con AOS, faltan estudios que evalúen los efectos del zoledronato y la quimioterapia citotóxica en combinación para el tratamiento de la AOS canina. El objetivo de este estudio fue evaluar el efecto del zoledronato cuando se combina con quimioterapia citotóxica tradicional en líneas celulares caninas de AOS. Planteamos la hipótesis de que el uso simultáneo de zoledronato y quimioterapia citotóxica aumentará la muerte de las células con AOS.
2 Materiales y métodos
2.1 Líneas celulares, células primarias y cultivos celulares
Para este estudio se utilizaron la línea celular renal canina (MDCK), la línea celular de AOS canina (D17) y las células primarias de AOS (Ronald y Walter). MDCK fue un regalo del Dr. Kyriakis (Universidad de Auburn). El origen celular de esta línea celular se confirmó mediante pruebas de PCR (IDEXX BioAnalytics, Columbia, MO, Estados Unidos). D17 fue un regalo de BFS, y previamente se realizó una PCR específica de la especie para confirmar que se trataba de células caninas. Dos células primarias de AOS se obtuvieron de perros de los clientes en el momento de la amputación por BFS. Ninguno de los perros recibió quimioterapia antes de la amputación. Estas células se cultivaron en DMEM (Dulbecco’s Modified Eagle’s Medium, Corning) con penicilina (100 UI/mL, Corning), estreptomicina (100 ug/mL, Corning), anfotericina B (0,5 ug/mL, Corning) y 10% FBS (suero fetal bovino, Sigma). Las líneas celulares y las células primarias de AOS se mantuvieron a 37 °C (95% aire, 5% CO2).
2.2 Zoledronato y agentes quimioterápicos
Los agentes quimioterapéuticos carboplatino (Sigma-Aldrich, St. Louis, MO, Estados Unidos), doxorrubicina (Sigma-Aldrich), vinorelbina (Sigma-Aldrich), toceranib (Sigma-Aldrich), mostaza isoforamida (MedChemExpress, Monmouth Junction, NJ, Estados Unidos) y el metabolito activo de la ifosfamida se utilizaron en base a publicaciones previas (2–6). El zoledronato (Sigma-Aldrich), el carboplatino y la vinorelbina se disolvieron en H2O destilado estéril a una concentración final de 10 mM. La doxorrubicina y el toceranib se disolvieron en DMSO a una concentración final de 10 mM. Las soluciones madre se alícuota y se mantuvieron a -20 °C para su almacenamiento a largo plazo. La mostaza isoforamida se disolvió en DMSO a una concentración final de 100 mM. La solución madre de isoforamida se alícuota y se mantuvo a -80 °C. Las soluciones madre de carboplatino, doxorrubicina, vinorelbina y toceranib se utilizaron dentro de 1 año después de la disolución. Se utilizaron zoledronato y mostaza isoforamida dentro de los 6 meses posteriores a la disolución. La información sobre la estabilidad de las soluciones congeladas solo fue accesible para la mostaza isoforamida, y permanece estable dentro de los 6 meses.
2.3 Evaluaciones de dosis óptimas de fármacos
MDCK, D17 y células OSA primarias (Ronald y Walter) se suspendieron en medio de cultivo celular y se pipetearon en una placa de fondo plano de 96 pocillos utilizando un volumen final de 100 μL/pocillo para obtener un número final de 5.000 células/pocillo. Las células se incubaron durante 24 h. Luego, las células se trataron con quimioterapia sola o zoledronato solo. Los agentes quimioterapéuticos y el zoledronato se diluyeron en un medio de cultivo celular antes de añadir la concentración prevista de cada compuesto a las células. Las células se incubaron con fármacos quimioterápicos o zoledronato durante 72 h. Las células control se incubaron con un medio de cultivo celular y se utilizó un vehículo para disolver los fármacos durante 72 h. Se utilizó puromicina (100 ng/mL) como control positivo de citotoxicidad. Después de los tratamientos, la viabilidad se determinó mediante el uso de un kit de ensayo de viabilidad celular CellTiter-Glo (Promega, Madison, WI, Estados Unidos). Se añadió el reactivo CellTiter-Glo (70 μL) a cada pocillo y la placa se colocó a temperatura ambiente durante 15 min para estabilizar la señal de luminiscencia. La señal de luminiscencia se midió con un luminómetro (BMG LABTECH Inc., Cary, NC, Estados Unidos). IC5IC10IC20y el IC50 se calcularon utilizando GraphPad Prism (GraphPad Software, La Jolla, CA, Estados Unidos). La viabilidad celular se evaluó con triplicados y se repitió 3 veces para cada concentración de cada agente quimioterápico y zoledronato.
2.4 Evaluaciones de los efectos combinatorios
Las células se suspendieron y pipetearon en una placa de 96 pocillos, como se describió anteriormente, y se incubaron durante 24 h. A continuación, se añadieron fármacos quimioterapéuticos y zoledronato a los pocillos con las combinaciones de (a) ningún fármaco, (b) zoledronato solo con las concentraciones de IC5IC10IC20y el IC50, (c) fármaco quimioterápico solo con la concentración de CI5IC10IC20y el IC50y (d) fármaco quimioterápico más zoledronato con las concentraciones de IC de cada fármaco5IC10IC20y el IC50. Las células se incubaron a 37 °C en una atmósfera humidificada que contenía 5% de CO2 durante 72 h. La viabilidad celular se determinó mediante el uso del kit de ensayo de viabilidad celular CellTiter-Glo como se mencionó anteriormente. La señal de luminiscencia se midió con el luminómetro. La viabilidad celular se evaluó por triplicado y se repitió 3 veces para cada fármaco o combinación de fármacos. Los efectos combinacionales se evaluaron en función de la apariencia de las figuras y los valores de p.
2.5 Análisis estadístico y de datos
Para comparar las viabilidades celulares en más de 2 grupos, se realizó ANOVA seguido de la prueba de Tukey con GraphPad Prism 8. Los datos se normalizaron antes del análisis. Las diferencias se consideraron estadísticamente significativas para los valores de p menores de 0,05.
3 Resultados
3.1 Determinación de la dosis óptima
El zoledronato, el carboplatino, la doxorrubicina, la vinorelbina y la mostaza isoforamida causaron una disminución de la viabilidad celular de forma dependiente de la dosis en la línea celular D17. Toceranib mostró una reducción significativa de la viabilidad celular por encima de la concentración de 10 uM, y la CI5-50 no se pudo calcular (Figura suplementaria 1; Cuadro complementario 1). En las células primarias de AOS (Ronald), el zoledronato, el carboplatino, la doxorrubicina y la vinorelbina causaron una disminución de la viabilidad celular de una manera dependiente de la dosis. El toceranib y la mostaza isoforamida mostraron un aumento de la viabilidad celular a dosis más bajas y una disminución de la viabilidad celular a dosis más altas (Figura suplementaria 2; Cuadro complementario 2). IC50 de toceranib no se pudo calcular. En las células primarias de AOS de un perro diferente (Walter), el zoledronato, el carboplatino, la doxorrubicina, la vinorelbina y la mostaza isoforamida causaron una disminución de la viabilidad celular de forma dependiente de la dosis. El toceranib mostró un aumento de la viabilidad celular a dosis más bajas y una reducción significativa de la viabilidad celular por encima de la concentración de 10 uM. IC50 de toceranib no pudo calcularse (Figura suplementaria 3; Cuadro complementario 3). En la línea celular MDCK, el zoledronato, el carboplatino, la doxorrubicina, la vinorelbina, el toceranib y la mostaza isofosforamida causaron una disminución de la viabilidad celular de forma dependiente de la dosis (Figura suplementaria 4; Cuadro complementario 4).
3.2 Evaluación de los efectos combinatorios
Los efectos combinatorios se evaluaron mediante CI5IC10IC20y el IC50, que se calcularon (Tablas suplementarias 1-4). En las células D17, estos valores con toceranib no se pudieron calcular. Como resultado, se utilizó la concentración de 300 nM, ya que esa concentración se reportó como Cmax en estudios de farmacocinética (25-31) (Tabla suplementaria 5). Además, 10 uM de toceranib causaron aproximadamente un 10% de muerte celular según la curva de viabilidad celular (Figura suplementaria 1) y esta concentración también se utilizó para la evaluación del efecto combinatorio. Los resultados de viabilidad celular con una combinación de zoledronato y agentes quimioterapéuticos se muestran en las figuras 1 a 4. En las células D17, no hubo cambios significativos en la viabilidad celular con la combinación de carboplatino, doxorrubicina y toceranib. Sin embargo, hubo una tendencia a los efectos antagónicos con la vinorelbina y la isoforamida (Figura 1). En la célula primaria de AOS 1 (Ronald), no hubo efecto con carboplatino, doxorrubicina e isofosforamida. Hubo un efecto sinérgico con toceranib. Se observó una tendencia a los efectos antagónicos en la vinorelbina cuando se combinó con concentraciones más bajas de zoledronato (Figura 2). En la célula 2 primaria de AOS (Walter), no hubo efecto con carboplatino, vinorelbina, doxorrubicina e isofoforamida. Hubo una tendencia a un efecto sinérgico con toceranib cuando se usó zoledronato en concentraciones más altas (Figura 3). En las células MDCK, no se observaron efectos con todos los fármacos quimioterapéuticos (Figura 4).
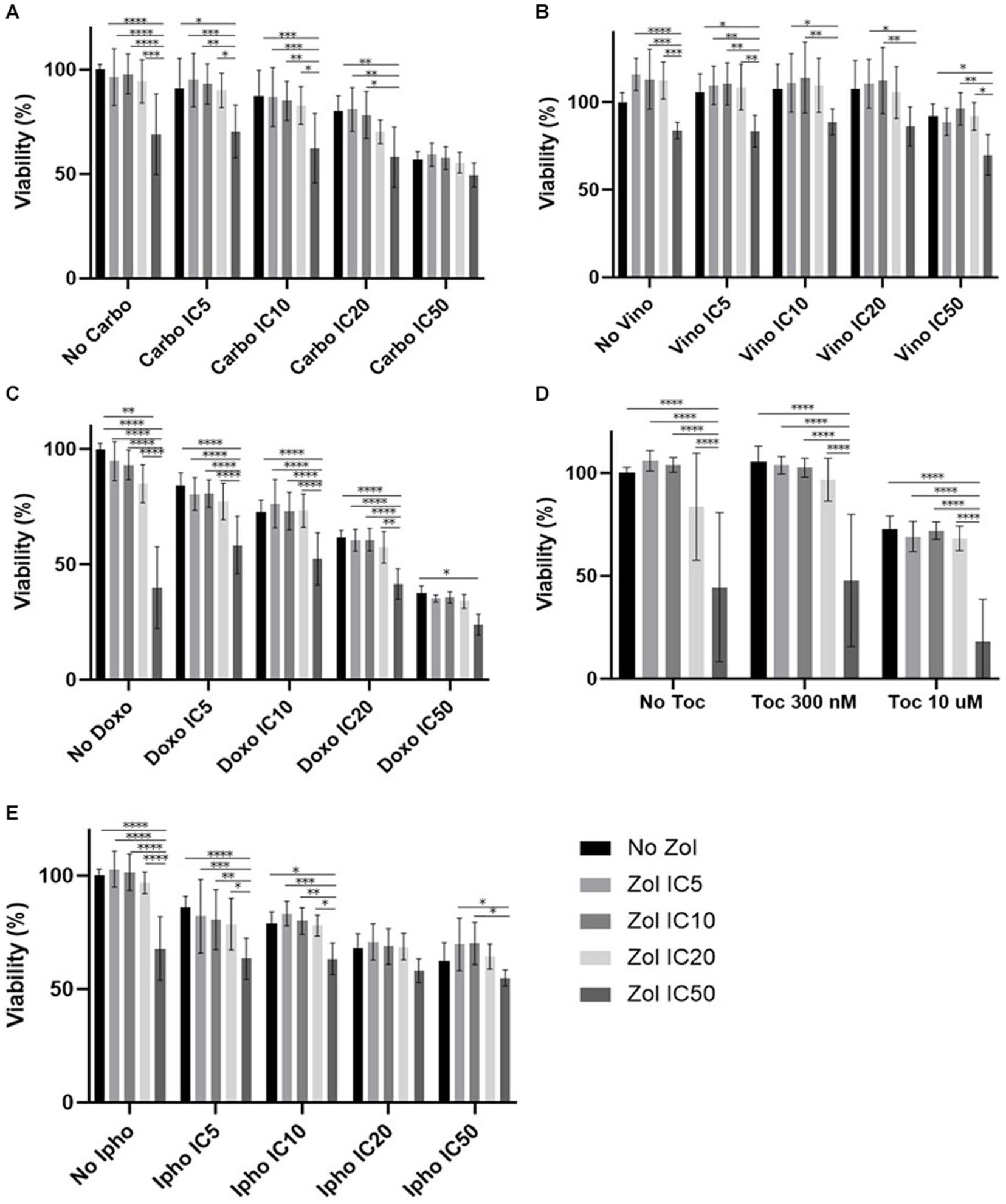 Figura 1. Viabilidad celular de células D17 tratadas con una combinación de zoledronato y fármacos quimioterápicos. (A) Carboplatino, (B) Vinorelbina, (C) Doxorrubicina, (D) Toceranib, (E) Mostaza de isoforamida. Los datos se expresaron como media +/− DE y significación definida como p < 0,05 , p < 0,01, p < 0,001, p < 0,0001. **********
Figura 1. Viabilidad celular de células D17 tratadas con una combinación de zoledronato y fármacos quimioterápicos. (A) Carboplatino, (B) Vinorelbina, (C) Doxorrubicina, (D) Toceranib, (E) Mostaza de isoforamida. Los datos se expresaron como media +/− DE y significación definida como p < 0,05 , p < 0,01, p < 0,001, p < 0,0001. **********
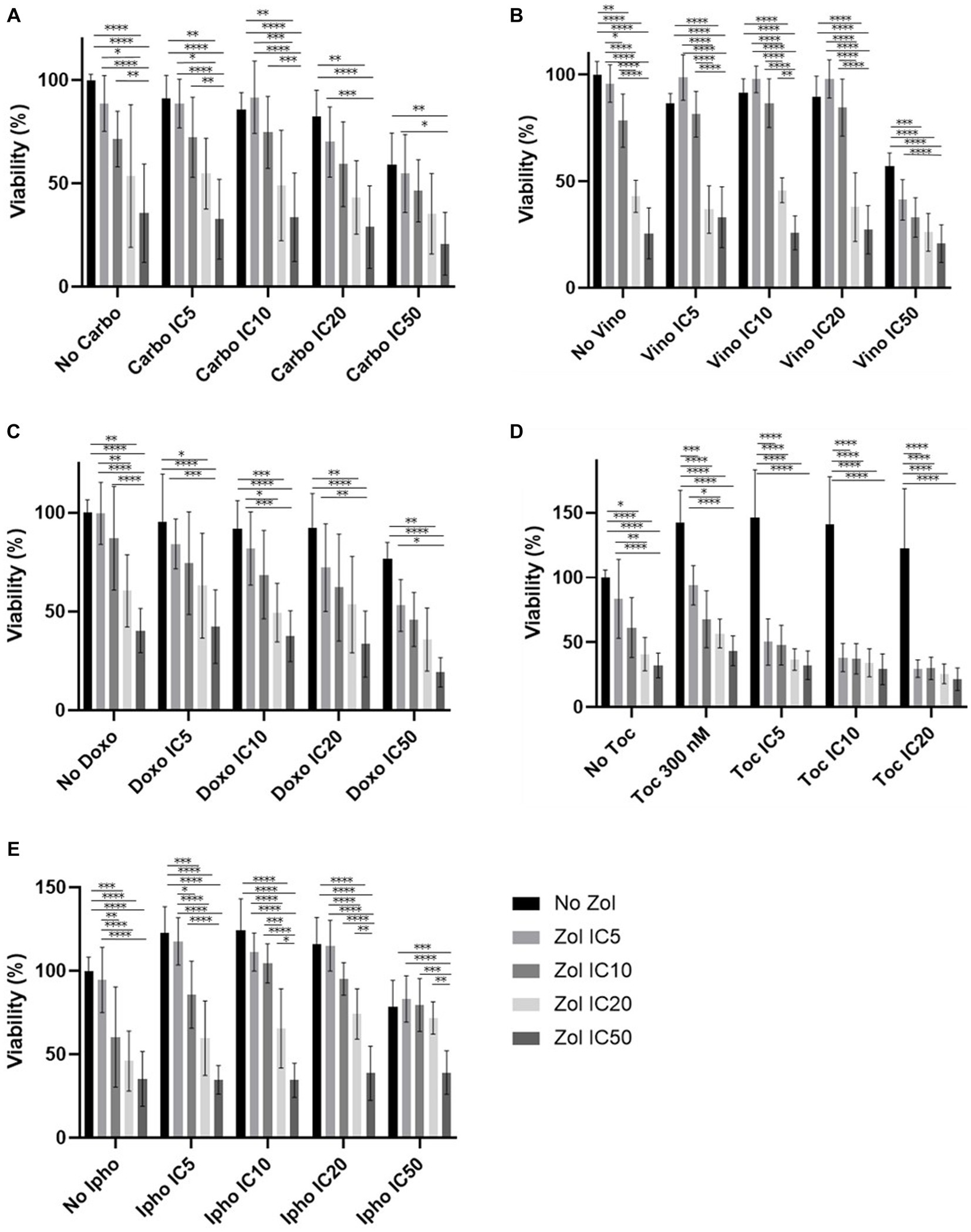 Figura 2. Viabilidad celular del osteosarcoma primario 1 (Ronald), tratado con una combinación de zoledronato y fármacos quimioterapéuticos. (A) Carboplatino, (B) Vinorelbina, (C) Doxorrubicina, (D) Toceranib, (E) Mostaza de isoforamida. Los datos se expresaron como media +/− DE y significación definida como p < 0,05 , p < 0,01, p < 0,001, p < 0,0001. **********
Figura 2. Viabilidad celular del osteosarcoma primario 1 (Ronald), tratado con una combinación de zoledronato y fármacos quimioterapéuticos. (A) Carboplatino, (B) Vinorelbina, (C) Doxorrubicina, (D) Toceranib, (E) Mostaza de isoforamida. Los datos se expresaron como media +/− DE y significación definida como p < 0,05 , p < 0,01, p < 0,001, p < 0,0001. **********
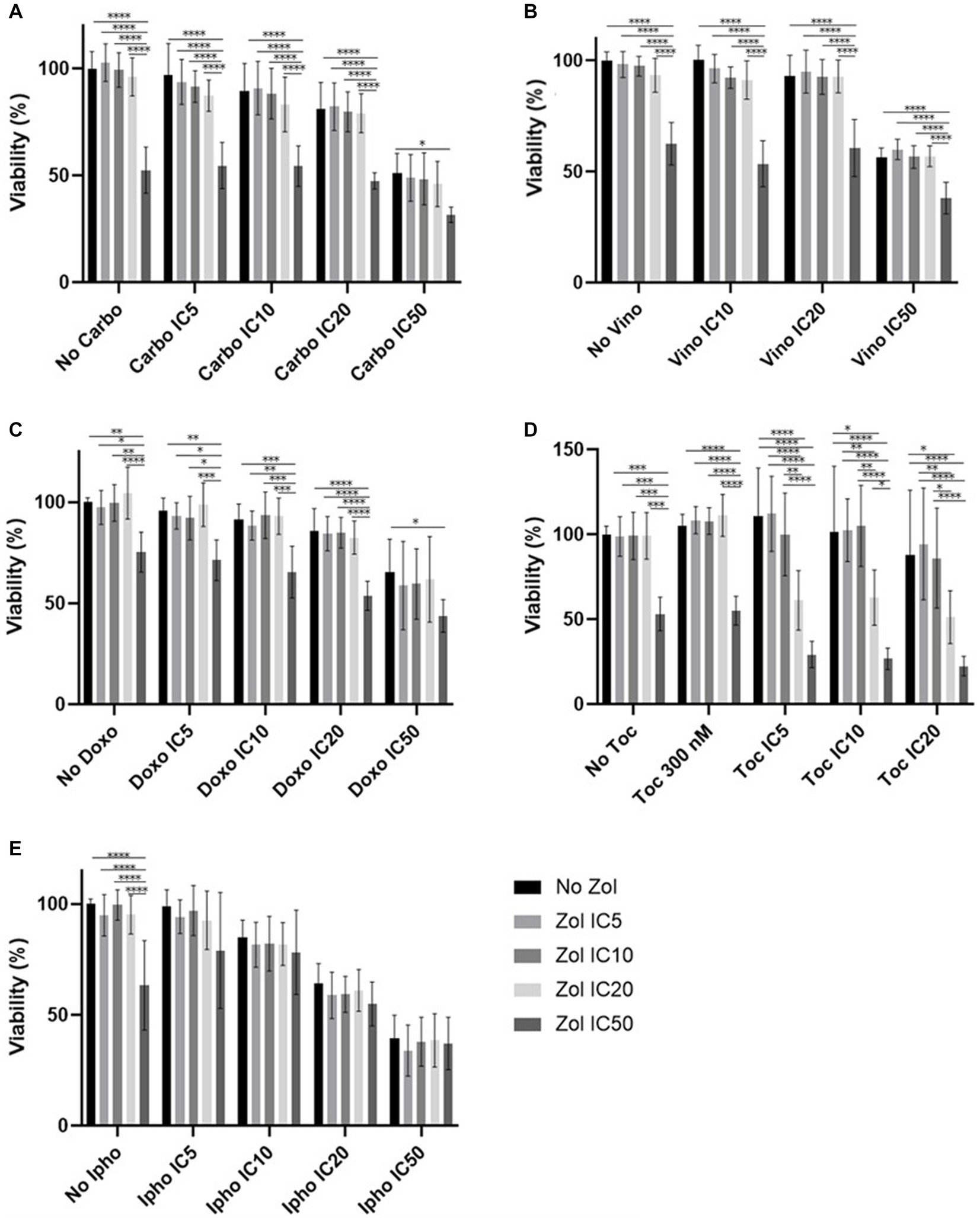 Figura 3. Viabilidad celular del osteosarcoma primario 2 (Walter), tratado con una combinación de zoledronato y fármacos quimioterapéuticos. (A) Carboplatino, (B) Vinorelbina, (C) Doxorrubicina, (D) Toceranib, (E) Mostaza de isoforamida. Los datos se expresaron como media +/− DE y significación definida como p < 0,05 , p < 0,01, p < 0,001, p < 0,0001. **********
Figura 3. Viabilidad celular del osteosarcoma primario 2 (Walter), tratado con una combinación de zoledronato y fármacos quimioterapéuticos. (A) Carboplatino, (B) Vinorelbina, (C) Doxorrubicina, (D) Toceranib, (E) Mostaza de isoforamida. Los datos se expresaron como media +/− DE y significación definida como p < 0,05 , p < 0,01, p < 0,001, p < 0,0001. **********
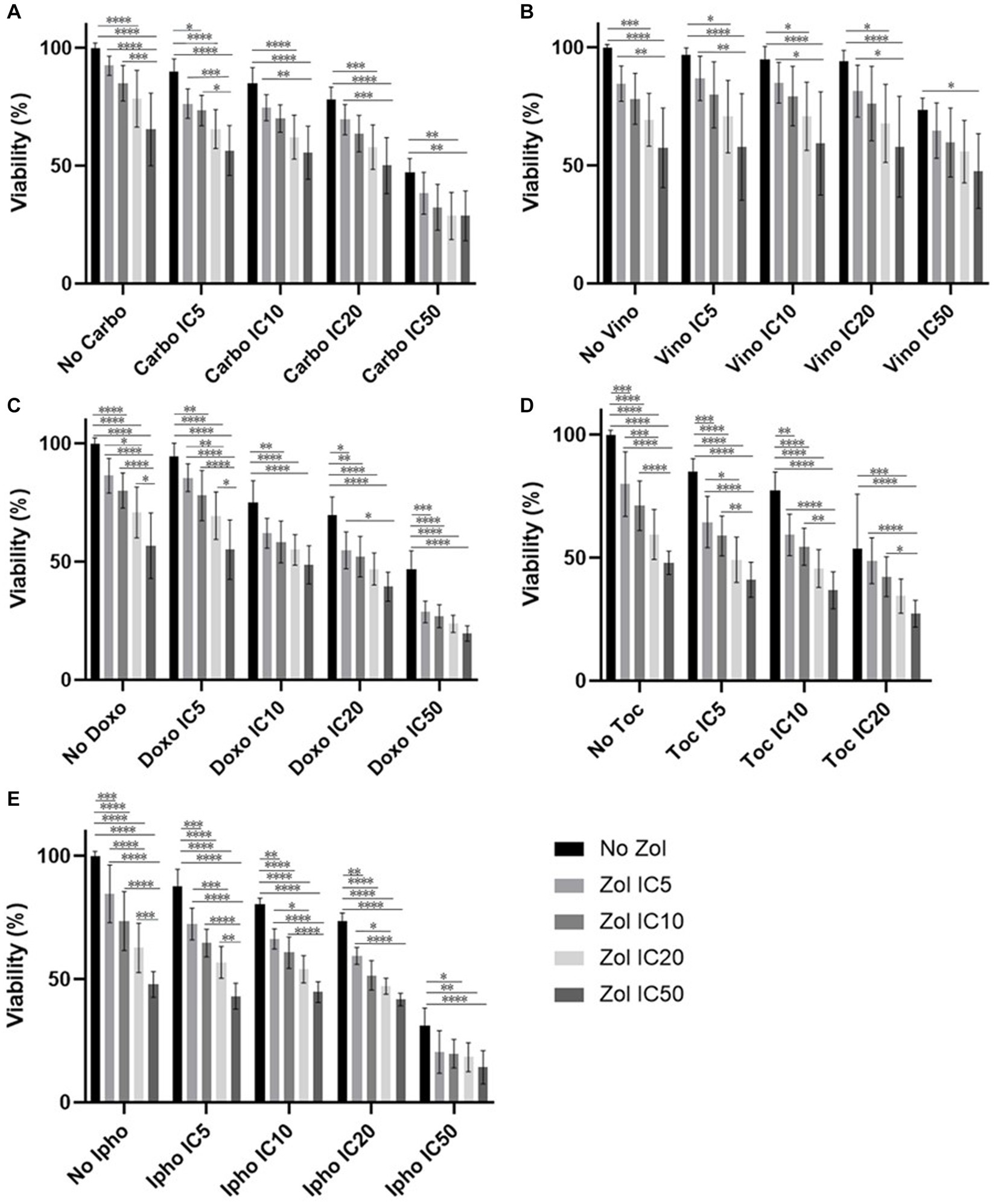 Figura 4. Viabilidad celular de la célula MDCK, tratada con una combinación de zoledronato y fármacos quimioterápicos. (A) Carboplatino, (B) Vinorelbina, (C) Doxorrubicina, (D) Toceranib, (E) Mostaza de isoforamida. Los datos se expresaron como media +/− DE y significación definida como p < 0,05 , p < 0,01, p < 0,001, p < 0,0001. **********
Figura 4. Viabilidad celular de la célula MDCK, tratada con una combinación de zoledronato y fármacos quimioterápicos. (A) Carboplatino, (B) Vinorelbina, (C) Doxorrubicina, (D) Toceranib, (E) Mostaza de isoforamida. Los datos se expresaron como media +/− DE y significación definida como p < 0,05 , p < 0,01, p < 0,001, p < 0,0001. **********
4 Discusión
El objetivo de este estudio fue evaluar el potencial del zoledronato para mejorar la eficacia terapéutica de los agentes quimioterapéuticos citotóxicos en células caninas de AOS. Con una búsqueda óptima de la dosis, el tratamiento con zoledronato, carboplatino, vinorelbina, doxorrubicina e isoforamida por sí solos produjo una disminución de la viabilidad celular dependiente de la dosis. Por el contrario, toceranib causó un aumento de la viabilidad celular a concentraciones más bajas y luego mostró una disminución significativa en la viabilidad celular a concentraciones más altas. Este efecto no monotónico del toceranib podría deberse a su mecanismo de acción único. Mientras que el carboplatino, la vinorelbina, la doxorrubicina y la ifosfamida interactúan directamente con el ADN o el ciclo celular y causan la muerte celular, el toceranib es un inhibidor de la tirosina quinasa y bloquea el receptor tirosina quinasa expresado en la superficie celular actuando como un inhibidor competitivo de la unión al trifosfato de adenosina (32). Los objetivos principales de toceranib son KIT, receptor 2 del factor de crecimiento endotelial vascular (VEGFR2), receptor β del factor de crecimiento derivado de plaquetas (PDGFRβ) y tirosina quinasas-3 similares a FMS-3 (Flt-3) (32-34). El toceranib puede atacar las células tumorales mediante la inhibición de los receptores tirosina quinasas expresados en su superficie que promueven la división celular y la supervivencia. En el caso de los perros, la concentración plasmática de VEGF se asoció con la Cmax de toceranib y se ha informado que su dosis mínima efectiva es de 2,4 mg/kg (35). Esta información respalda que toceranib podría tener un valor umbral de su eficacia. Debido a su naturaleza de inhibición competitiva, el toceranib podría requerir una concentración más alta para causar la muerte celular. En opinión de los autores, si no se alcanza la mayor concentración y el toceranib solo se une a una parte de las dianas, podría potenciar los efectos contrarios, como la mejora de la vía de señalización celular o la regulación positiva de los receptores de la superficie celular, lo que favorecería una mayor viabilidad.
En estudios anteriores, se demostró que el zoledronato aumenta la citotoxicidad de la doxorrubicina en células de histiocitosis maligna canina (18), células de cáncer de próstata humano (19) y células de cáncer de mama humano (20). Nuestro estudio es el primero que evaluó los efectos del zoledronato en células caninas de AOS cuando se combina con varios fármacos quimioterápicos. En este estudio, se indicó que el zoledronato puede tener un efecto sinérgico cuando se usa con toceranib. Además, el zoledronato puede tener efectos antagónicos cuando se usa con vinorelbina e ifosfamida. Se han sugerido múltiples mecanismos para el efecto antineoplásico del zoledronato, incluido el aumento de la acumulación intracelular de quimioterápicos. Específicamente, el zoledronato causó un aumento de la acumulación intracelular de doxorrubicina en las células malignas caninas de histiocitosis (18). Se desconoce el mecanismo del aumento de la acumulación de fármacos. El mecanismo propuesto incluye la alteración del metabolismo intracelular del fármaco a través de la inhibición de la GTPasa inducida por zoledronato y la disminución del flujo de fármacos a través de la regulación negativa de la glicoproteína p. Si bien la doxorrubicina y la vinorelbina son fármacos que salen de las células a través de transportadores de glicoproteínas p, encontramos que la doxorrubicina y la vinorelbina tuvieron efectos diferentes cuando se combinaron con zoledronato, lo que sugiere que el aumento de la glicoproteína p no es responsable del aumento de la actividad del fármaco. En base a esto, es probable que otros mecanismos contribuyan al efecto antagónico del zoledronato con la vinorelbina. Como siguiente paso, la proteómica podría ayudar a determinar qué proteínas están relacionadas con este fenómeno.
En medicina humana, se realizaron estudios aleatorizados de fase III en pacientes con AOS (23, 24). En estos estudios, los pacientes con AOS recibieron quimioterapia o quimioterapia más zoledronato antes y después de la cirugía. La adición de zoledronato no demostró un beneficio en la supervivencia y el grupo de zoledronato desarrolló eventos adversos adicionales, incluyendo hipocalcemia e hipofosfatemia, en comparación con los grupos de control. Los investigadores concluyeron que el zoledronato no debe añadirse al tratamiento estándar con AOS. En estos estudios, utilizaron dos protocolos de quimioterapia combinada: (1) metotrexato, etopósido e ifosfamida o (2) doxorrubicina, ifosfamida y cisplatino. Según nuestro estudio, la mostaza isoforamida mostró posibles efectos antagónicos, y este resultado respalda los resultados clínicos informados en este estudio de fase III de AOS en humanos.
Aunque los efectos secundarios del zoledronato no son comunes, se ha informado osteonecrosis de la mandíbula y elevación de BUN en perros (8, 36). Para evaluar cualquier posibilidad de toxicidad significativa con las combinaciones de zoledronato de fármacos quimioterápicos, se utilizaron células MDCK y se analizó su viabilidad. En las células MDCK, no hubo efectos sinérgicos o antagónicos obvios de la combinación de zoledronato y fármacos quimioterapéuticos; sin embargo, la viabilidad celular pareció disminuir en comparación con las células D17 y las células primarias de AOS. Esto puede indicar que los perros pueden tener un mayor riesgo de toxicidad renal cuando se usan zoledronato y medicamentos quimioterapéuticos al mismo tiempo.
Este fue un estudio in vitro, y algunas condiciones son diferentes a las in vivo. In vivo, el cáncer puede crear un microambiente tumoral que contribuye a una mayor proliferación de células cancerosas. Existe una barrera inmunosupresora que ayuda a las células cancerosas a evitar la destrucción inmunitaria e incluye las células T reguladoras, las células supresoras derivadas de mieloides, las células madre mesenquimales, el factor de crecimiento transformante β e inmunoglobulinas (37-39). Además, los macrófagos tumorales y los fibroblastos asociados al cáncer pueden promover la proliferación celular, la invasión y la neoangiogénesis (40, 41). Los estudios in vitro carecen de estos componentes, y es difícil imitar completamente la verdadera reacción tumoral a estos fármacos que puede estar influenciada por el microambiente.
En este estudio, se utilizó CI5-50 para evaluar los efectos combinados de los fármacos, y no se utilizaron concentraciones más bajas que no causaron muerte celular ni concentraciones más altas que causaron un aumento de la muerte celular. Esto nos permitió evaluar el rango de viabilidad celular cuando combinamos 2 fármacos. Las concentraciones de fármacos que calculamos en este estudio fueron ligeramente diferentes de lo que se ha informado en los estudios de farmacocinética in vivo (Tabla suplementaria 5); sin embargo, hubo cierta superposición entre las concentraciones de fármacos reportadas en el cuerpo canino (25-31).
La otra limitación de este estudio es que no evaluamos la dependencia del horario. La viabilidad celular de las células caninas de AOS se ha evaluado con la combinación de radioterapia y bifosfonatos (42). Evaluaron la diferencia en la viabilidad celular cuando se agregan bifosfonatos 24 h antes, dentro de las 2 h o 24 h después de la administración de radioterapia. En su estudio, encontraron que la viabilidad celular disminuyó significativamente cuando se agregaron bifosfonatos 24 horas después de la radiación. Todavía se desconoce el mecanismo; Sin embargo, puede ser importante cambiar el momento de la administración de bifosfonatos en relación con la administración de quimioterapia para una evaluación adicional.
En este estudio, cada concentración de fármaco dio como resultado resultados diferentes; Por lo tanto, las concentraciones que pueden causar efectos sinérgicos pueden o no ser alcanzables in vivo.
En conclusión, encontramos que el zoledronato tuvo efectos sinérgicos con toceranib y efectos antagónicos con vinorelbina e isofosforamida. Sin embargo, estos efectos fueron diferentes dependiendo de la línea celular y la concentración utilizada, y se necesita una evaluación adicional para aplicar estos tratamientos a los casos clínicos.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio están incluidas en el artículo/Material complementario, las consultas posteriores pueden dirigirse al autor correspondiente.
Declaración ética
No se requirió aprobación ética para los estudios en animales de acuerdo con la legislación local y los requisitos institucionales, ya que solo se utilizaron líneas celulares establecidas disponibles comercialmente.
Contribuciones de los autores
YI: Conceptualización, Análisis formal, Obtención de fondos, Investigación, Metodología, Visualización, Redacción – borrador original. SL: Conceptualización, Obtención de Fondos, Redacción – Revisión y Edición. NB: Conceptualización, Obtención de fondos, Redacción – revisión y edición. BS: Obtención de fondos, Metodología, Recursos, Supervisión, Redacción, revisión y edición. SP: Obtención de fondos, Recursos, Supervisión, Validación, Redacción, revisión y edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este estudio fue financiado por la Beca de Investigación para Residentes del Colegio Americano de Medicina Interna Veterinaria y patrocinado por el Instituto Purina. Este manuscrito no ha sido revisado por la ACVIM ni por el Instituto Purina y no refleja necesariamente los puntos de vista de la ACVIM, sus funcionarios, directores o el Patrocinador.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2024.1327377/full#supplementary-material
Referencias
1. Fenger, JM, Londres, CA, y Kisseberth, WC. Osteosarcoma canino: una enfermedad natural que se presenta en oncología pediátrica. ILAR J. (2014) 55:69–85. doi: 10.1093/ilar/ilu009
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Vail, DM. Oncología clínica de pequeños animales de Withrow y Macewen, vol. xiii. 6ª ed. Edimburgo, Nueva York: Elsevier (2020). 842 págs.
3. Ogilvie, GK, Straw, RC, Jameson, VJ, Walters, LM, Lafferty, MH, Powers, BE, et al. Evaluación de la quimioterapia en monoterapia para el tratamiento de metástasis de osteosarcoma clínicamente evidentes en perros: 45 casos (1987-1991). J Am Vet Med Assoc. (1993) 202:304–6. doi: 10.2460/javma.1993.202.02.304
4. Batschinski, K, Dervisis, NG, y Kitchell, BE. Evaluación de la terapia de rescate con ifosfamida para el osteosarcoma canino metastásico. Veterinario Comp Oncol. (2014) 12:249–57. doi: 10.1111/j.1476-5829.2012.00355.x
5. Laver, T, London, CA, Vail, DM, Biller, BJ, Coy, J y Thamm, DH. Evaluación prospectiva del fosfato de toceranib en el osteosarcoma canino metastásico. Veterinario Comp Oncol. (2018) 16:E23–9. doi: 10.1111/vco.12328
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Kim, C, Matsuyama, A, Mutsaers, AJ y Woods, JP. Evaluación retrospectiva del tratamiento con toceranib (Palladia) para el osteosarcoma apendicular metastásico canino. ¿Puede Vet J. (2017) 58:1059–64.
7. Ventilador, TM. El papel de los bifosfonatos en el tratamiento de los pacientes con cáncer. Vet Clin North Am Small Anim Pract. (2007) 37:1091–110. doi: 10.1016/j.cvsm.2007.08.002
8. Lundberg, AP, Roady, PJ, Somrak, AJ, Howes, ME y Fan, TM. Osteonecrosis de la mandíbula asociada a zoledronato en un perro con osteosarcoma apendicular. J Veterinario Pasante Med. (2016) 30:1235–40. doi: 10.1111/jvim.13980
9. Iguchi, T, Miyakawa, Y, Saito, K, Nakabayashi, C, Nakanishi, M, Saya, H, et al. Detención de la fase S inducida por zoledronato y apoptosis acompañada de daño en el ADN y activación de la vía Atm/Chk1/Cdc25 en células de osteosarcoma humano. Int J Oncol. (2007) 31:285–91. doi: 10.3892/ijo.31.2.285
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Das, H, Wang, L, Kamath, A, y Bukowski, JF. Vgamma2vdelta2 Reconocimiento de aminobifosfonatos mediado por receptores de células T. Sangre. (2001) 98:1616–8. doi: 10.1182/blood.v98.5.1616
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Roelofs, AJ, Thompson, K, Ebetino, FH, Rogers, MJ y Coxon, FP. Bifosfonatos: mecanismos moleculares de acción y efectos sobre las células óseas, monocitos y macrófagos. Curr Pharm Des. (2010) 16:2950–60. doi: 10.2174/138161210793563635
12. Ohba, T, Cates, JM, Cole, HA, Slosky, DA, Haro, H, Ichikawa, J, et al. Efectos pleiotrópicos de los bifosfonatos en el osteosarcoma. Hueso. (2014) 63:110–20. doi: 10.1016/j.bone.2014.03.005
13. Koto, K, Horie, N, Kimura, S, Murata, H, Sakabe, T, Matsui, T, et al. Una dosis clínicamente relevante de ácido zoledrónico inhibe la metástasis pulmonar espontánea en un modelo de osteosarcoma murino. Cáncer Lett. (2009) 274:271–8. doi: 10.1016/j.canlet.2008.09.026
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Ory, B, Heymann, MF, Kamijo, A, Gouin, F, Heymann, D y Redini, F. El ácido zoledrónico suprime las metástasis pulmonares y prolonga la supervivencia general de los ratones portadores de osteosarcoma. Cáncer. (2005) 104:2522–9. doi: 10.1002/cncr.21530
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Conry, RM, Rodríguez, MG, y Pressey, JG. Ácido zoledrónico en el osteosarcoma metastásico: fomento de la supervivencia libre de progresión en cuatro pacientes consecutivos. Sarcoma Clin Res. (2016) 6:2. doi: 10.1186/s13569-016-0046-2
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Wolfe, TD, Pillai, SPS, Hildreth, BE, Lanigan, LG, Martin, CK, Werbeck, JL, et al. Efecto del ácido zoledrónico y la amputación sobre la invasión ósea y la metástasis pulmonar del osteosarcoma canino en ratones desnudos. Clin Exp Metástasis. (2011) 28:377–89. doi: 10.1007/s10585-011-9377-9
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Smith, AA, Lindley, SES, Almond, GT, Bergman, NS, Matz, BM y Smith, AN. Evaluación del zoledronato para el tratamiento del osteosarcoma canino en estadio iii: un estudio de fase ii. Vet Med Sci. (2023) 9:59–67. doi: 10.1002/vms3.1000
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Hafeman, SD, Varland, D, y Dow, SW. Los bifosfonatos aumentan significativamente la actividad de la doxorrubicina o vincristina contra las células malignas caninas de histiocitosis. Veterinario Comp Oncol. (2012) 10:44–56. doi: 10.1111/j.1476-5829.2011.00274.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Clyburn, RD, Reid, P, Evans, CA, Lefley, DV y Holen, I. Aumento de los efectos antitumorales de la doxorrubicina y el ácido zoledrónico en las células cancerosas de próstata in vitro: apoyo a los beneficios de la terapia combinada. Quimioterapia contra el cáncer Pharmacol. (2010) 65:969–78. doi: 10.1007/s00280-009-1106-6
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Neville-Webbe, HL, Rostami-Hodjegan, A, Evans, CA, Coleman, RE y Holen, I. Mejora dependiente de la secuencia y el horario de la apoptosis inducida por el ácido zoledrónico por doxorrubicina en células de cáncer de mama y próstata. Int J Cáncer. (2005) 113:364–71. doi: 10.1002/ijc.20602
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Goldsby, RE, Fan, TM, Villaluna, D, Wagner, LM, Isakoff, MS, Meyer, J, et al. Análisis de viabilidad y descubrimiento de dosis de ácido zoledrónico con quimioterapia simultánea en el tratamiento del osteosarcoma metastásico recién diagnosticado: un informe del grupo de oncología pediátrica. Eur J Cáncer. (2013) 49:2384–91. doi: 10.1016/j.ejca.2013.03.018
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Heymann, D, Ory, B, Blanchard, F, Heymann, MF, Coipeau, P, Charrier, C, et al. Mejora de la regresión tumoral y la reparación tisular cuando el ácido zoledrónico se combina con ifosfamida en el osteosarcoma de rata. Hueso. (2005) 37:74–86. doi: 10.1016/j.bone.2005.02.020
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. Piperno-Neumann, S, Le Deley, MC, Rédini, F, Pacquement, H, Marec-Bérard, P, Petit, P, et al. Zoledronato en combinación con quimioterapia y cirugía para tratar el osteosarcoma (Os2006): un ensayo aleatorizado, multicéntrico, abierto, de fase 3. Lancet Oncol. (2016) 17:1070–80. doi: 10.1016/s1470-2045(16)30096-1
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Li, S, Chen, P, Pei, Y, Zheng, K, Wang, W, Qiu, E, et al. Adición de zoledronato a la quimioterapia en pacientes con osteosarcoma tratados con cirugía conservadora de extremidades: un ensayo clínico de fase III. Med Sci Monit. (2019) 25:1429–38. doi: 10.12659/msm.913236
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Martín-Jiménez, T, De Lorimier, LP, Fan, TM y Freise, KJ. Farmacocinética y farmacodinamia de una dosis única de zoledronato en perros sanos. J Vet Pharmacol Ther. (2007) 30:492–5. doi: 10.1111/j.1365-2885.2007.00883.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Chen, C, Wang, W, Zhou, H, Huang, J, Liu, P, Song, T, et al. Comparación farmacocinética entre quimioterapia sistémica y local por carboplatino en perros. Reprod Sci. (2009) 16:1097–102. doi: 10.1177/1933719109341999
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Kirsch, M, Weisse, C, Berent, A, Clifford, C, Leibman, N, Wittenburg, L, et al. Estudio piloto que compara los niveles de quimioterapia sérica después de la administración intraarterial e intravenosa en perros con tumores del tracto urinario de origen natural. Can J Vet Res. (2019) 83:187–96.
28. Kobayashi, S, Sakai, T, Dalrymple, PD, Wood, SG, y Chasseaud, LF. Disposición del nuevo agente anticancerígeno Ditartrato de vinorelbina después de la administración intravenosa en ratones, ratas y perros. Arzneimittelforschung. (1993) 43:1367–77.
29. Selting, KA, Ogilvie, GK, Gustafson, DL, Long, ME, Lana, SE, Walton, JA, et al. Evaluación de los efectos de la suplementación dietética con ácidos grasos N-3 sobre la farmacocinética de doxorrubicina en perros con linfoma. Am J Vet Res. (2006) 67:145–51. doi: 10.2460/ajvr.67.1.145
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Yancey, MF, Merritt, DA, Lesman, SP, Boucher, JF y Michels, GM. Propiedades farmacocinéticas del fosfato de toceranib (Palladia, Su11654), un nuevo inhibidor de la tirosina quinasa, en perros de laboratorio y perros con tumores de mastocitos. J Vet Pharmacol Ther. (2010) 33:162–71. doi: 10.1111/j.1365-2885.2009.01133.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Germann, N, Urien, S, Rodgers, AH, Ratterree, M, Struck, RF, Waud, WR, et al. Toxicología preclínica comparada y farmacología de la mostaza isoforamida, el metabolito activo de la ifosfamida. Quimioterapia contra el cáncer Pharmacol. (2005) 55:143–51. doi: 10.1007/s00280-004-0894-y
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. London, CA, Hannah, AL, Zadovoskaya, R, Chien, MB, Kollias-Baker, C, Rosenberg, M, et al. Estudio de fase I de escalada de dosis de Su11654, un inhibidor de la tirosina quinasa del receptor de molécula pequeña, en perros con neoplasias malignas espontáneas. Clin Cáncer Res. (2003) 9:2755–68.
33. London, C, Mathie, T, Stingle, N, Clifford, C, Haney, S, Klein, MK, et al. Evidencia preliminar de la actividad biológica del fosfato de toceranib (Palladia(®)) en tumores sólidos. Veterinario Comp Oncol. (2012) 10:194–205. doi: 10.1111/j.1476-5829.2011.00275.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
34. Pryer, NK, Lee, LB, Zadovaskaya, R, Yu, X, Sukbuntherng, J, Cherrington, JM, et al. Prueba de la diana de Su11654: inhibición de la fosforilación del kit en tumores de mastocitos caninos. Clin Cáncer Res. (2003) 9:5729–34.
35. Bernabe, LF, Portela, R, Nguyen, S, Kisseberth, WC, Pennell, M, Yancey, MF, et al. Evaluación del perfil de eventos adversos y farmacodinámica de Toceranib fosfato administrado a perros con tumores sólidos a dosis inferiores a la dosis máxima tolerada. BMC Vet Res. (2013) 9:190. doi: 10.1186/1746-6148-9-190
Resumen de PubMed | Texto completo de Crossref | Google Académico
36. Fan, TM, de Lorimier, LP, Garrett, LD, y Lacoste, HI. Los efectos biológicos óseos del zoledronato en perros sanos y perros con osteólisis maligna. J Veterinario Pasante Med. (2008) 22:380–7. doi: 10.1111/j.1939-1676.2008.0046.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
37. Modiano, JF, Lindborg, BA, McElmurry, RT, Lewellen, M, Forster, CL, Zamora, EA, et al. Las células estromales mesenquimales inhiben las respuestas inmunitarias antitumorales singénicas murinas atenuando la inflamación y reorganizando el microambiente tumoral. Inmunol Inmunoterapia contra el Cáncer. (2015) 64:1449–60. doi: 10.1007/s00262-015-1749-6
Resumen de PubMed | Texto completo de Crossref | Google Académico
38. Anderson, KL, y Modiano, JF. Avances en inmunoterapia adaptativa para el cáncer en animales de compañía: éxito en el camino hacia la cura. Veterinaria Sci. (2015) 2:363–87. doi: 10.3390/vetsci2040363
Resumen de PubMed | Texto completo de Crossref | Google Académico
39. Erez, N, Truitt, M, Olson, P, Arron, ST y Hanahan, D. Los fibroblastos asociados al cáncer se activan en la neoplasia incipiente para orquestar la inflamación promotora del tumor de una manera dependiente de Nf-Kappab. Célula cancerosa. (2010) 17:135–47. doi: 10.1016/j.ccr.2009.12.041
40. Raposo, TP, Beirao, BC, Pang, LY, Queiroga, FL, y Argyle, DJ. Inflamación y cáncer: hasta que la muerte los destroza. Veterinario J. (2015) 205:161–74. doi: 10.1016/j.tvjl.2015.04.015
Resumen de PubMed | Texto completo de Crossref | Google Académico
41. Terragni, R, Casadei Gardini, A, Sabattini, S, Bettini, G, Amadori, D, Talamonti, C, et al. Egfr, Her-2 y Kras en tumores epiteliales gástricos caninos: ¿un modelo humano potencial? PLoS Uno. (2014) 9:e85388. doi: 10.1371/journal.pone.0085388
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: perros, osteosarcoma, quimioterapia, zoledronato, efecto combinado
Cita: Iwaki Y, Lindley SES, Bergman N, Smith BF y Pondugula SR (2024) Una evaluación del efecto combinado de zoledronato y agentes quimioterapéuticos en células de osteosarcoma canino. Frente. Vet. Sci. 11:1327377. doi: 10.3389/fvets.2024.1327377
Recibido: 24 de octubre de 2023; Aceptado: 17 de enero de 2024;
Publicado: 13 febrero 2024.
Editado por:
Helen Roberts, Universidad de Middlesex, Reino Unido
Revisado por:
Sita Withers, Universidad Estatal de Luisiana, Estados
Unidos Alessio Pierini, Universidad de Pisa, Italia
Derechos de autor © 2024 Iwaki, Lindley, Bergman, Smith y Pondugula. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Yoshimi Iwaki, yiktb@missouri.edu
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía


