Evaluación del ELISA P22 para la detección de anticuerpos específicos de Mycobacterium bovis

Evaluación del ELISA P22 para la detección de anticuerpos específicos de Mycobacterium bovis en el fluido oral de cabras
 Javier Ortega1,2†,
Javier Ortega1,2†,  José A. Infantes-Lorenzo3†,
José A. Infantes-Lorenzo3†,  Javier Bezos1,2*,
Javier Bezos1,2*,  Álvaro Roy1,
Álvaro Roy1,  Lucía de Juan1,2,
Lucía de Juan1,2,  Beatriz Romero1,
Beatriz Romero1,  Inmaculada Moreno3,
Inmaculada Moreno3,  Alberto Gómez-Buendía1,
Alberto Gómez-Buendía1,  Irene Agulló-Ros4,
Irene Agulló-Ros4,  Lucas Domínguez1,2 y
Lucas Domínguez1,2 y  Mercedes Domínguez3
Mercedes Domínguez3- 1Centro de Vigilancia Sanitaria VISAVET, Universidad Complutense de Madrid, Madrid, España
- 2Departamento de Sanidad Animal, Facultad de Veterinaria, Universidad Complutense de Madrid, Madrid, España
- 3Unidad de Inmunología Microbiana, Centro Nacional de Microbiología, Instituto de Investigación Carlos III, Madrid, España
- 4Grupo de Investigación en Sanidad Animal y Zoonosis, Departamento de Anatomía y Anatomía Patológica Comparadas, Facultad de Veterinaria, Universidad de Córdoba, Córdoba, España
El diagnóstico ante mortem de tuberculosis (TB) en rumiantes se basa principalmente en la prueba de tuberculina intradérmica y el ensayo IFN-γ. Las pruebas basadas en anticuerpos (Ab) han surgido como herramientas potenciales para la detección de animales infectados con TB utilizando suero, plasma o incluso muestras de leche. También se han evaluado fluidos orales como muestras alternativas con las que detectar Abs específicos contra Mycobacterium bovis en cerdos o jabalíes, pero no en rumiantes. El objetivo de este estudio fue, por lo tanto, evaluar el rendimiento de un ELISA interno para el diagnóstico de TB (ELISA P22) en cabras como modelo experimental para el diagnóstico de TB utilizando muestras de fluido oral. Las muestras de fluido oral de 64 cabras de un rebaño infectado con TB (n = 197) y todos los animales de un rebaño libre de TB (n = 113) se analizaron utilizando el ELISA P22. La sensibilidad (EE) y la especificidad (Sp) estimadas fueron 34,4 % (IC 95 %: 22,4–45,6) y 100 % (IC 95 %: 97,4–100), respectivamente. El punto de corte óptimo se estableció en 100% de acuerdo con el análisis ROC. Aquellos animales con un mayor nivel de Abs en su fluido oral alcanzaron una mayor puntuación de lesión (p = 0,018). De hecho, al tener en cuenta solo el entorno de los animales con lesiones graves (n = 16), el ELISA mostró un Se del 75% (IC 95%: 53,7-96,2). Los resultados del presente estudio sugieren que el ELISA P22 es altamente específico, pero tiene un valor limitado para detectar animales infectados en muestras de fluidos orales. Sin embargo, su rendimiento es significativamente mayor en presencia de lesiones graves.
Introducción
La tuberculosis animal (TB) es una infección zoonótica causada principalmente por Mycobacterium bovis y, más raramente, por otros miembros del complejo Mycobacterium tuberculosis (MTBC) (1). Los programas de control llevados a cabo para rumiantes como el ganado vacuno y caprino se basan principalmente en una estrategia de prueba y sacrificio utilizando las pruebas de tuberculina intradérmica única y comparativa (TIE y CIT), ambas basadas en la respuesta inmune mediada por células (2). El ensayo de liberación de interferón gamma (IGRA), que es una prueba diagnóstica auxiliar oficial para la tuberculosis bovina, se utiliza para maximizar la detección de animales infectados y también se basa en la respuesta inmune celular (3).
En los últimos años, las pruebas serológicas se han convertido en una posible prueba auxiliar para el ganado, e incluso pueden ser una primera opción para la vida silvestre debido a sus ventajas en comparación con las pruebas basadas en células (4, 5). Además, las pruebas serológicas podrían ser una valiosa herramienta de diagnóstico en forma de pruebas de detección para detectar la TB a nivel de rebaño y se ha demostrado que maximizan la detección de rumiantes infectados con TB cuando se utilizan en combinación con pruebas basadas en celulares (6-8). Un ELISA basado en el complejo proteico P22 recientemente desarrollado (P22 ELISA) ha mostrado un alto rendimiento en términos de sensibilidad (Se) y especificidad (Sp) en rumiantes (4, 6, 8, 9).
También se han evaluado muestras no invasivas y fáciles de recolectar distintas del suero y el plasma para la detección de abdominales específicos contra varias enfermedades, incluida la tuberculosis, una de las cuales son los fluidos orales (10-13). Estudios previos han evaluado el rendimiento del ELISA comparando muestras de leche con las de suero para el diagnóstico de TB, y han obtenido un Se y Sp similares (14, 15). Sin embargo, el uso de muestras de leche está restringido a los animales lecheros. El fluido oral, que es un fluido biológico, puede, por su parte, permitir el monitoreo rutinario del estado de salud de los animales debido al método mínimamente invasivo y no estresante empleado para recolectarlo, que puede ser realizado por personal con una capacitación mínima. Además, a diferencia de las muestras de leche, no es necesario que el animal esté amamantando y permite muestrear a los machos y a los animales que no producen leche (cababritos, hembras no lactantes o rebaños de carne) (11) Además, se han propuesto muestras de fluidos orales como un espécimen biológico alternativo para detectar Abs específicos contra M. bovis en jabalíes. alcanzando un Se y un Sp de 67,3 y 100%, respectivamente (13). De hecho, las muestras de fluidos orales se han utilizado en la lucha contra otras enfermedades porcinas, como la peste porcina clásica, la gripe o el síndrome reproductivo y respiratorio porcino (PRRS) (16-20), lo que sugiere que los fluidos orales son muestras valiosas para la vigilancia y el control de la TB y otras enfermedades en los suidos mediante el uso de plataformas de diagnóstico basadas en Ab (21).
A pesar de su uso en poblaciones porcinas, pocos estudios han evaluado las pruebas serológicas empleando muestras de fluidos orales en rumiantes para detectar anticuerpos contra el virus de la fiebre aftosa (FMDV) o el virus de Schmallenberg (SBV) en bovinos (22, 23). Con respecto a la tuberculosis, no se han publicado previamente estudios que utilicen muestras de fluidos orales para el diagnóstico de TB basado en anticuerpos en rumiantes domésticos.
Dada la utilidad de las muestras de fluidos orales en otras especies, hemos adaptado un ELISA P22 para analizar muestras de fluidos orales en cabras. El objetivo principal del presente estudio fue evaluar, por primera vez, la utilidad de las muestras de fluidos orales para detectar anticuerpos específicos contra M. bovis en rumiantes.
Materiales y métodos
Diseño del estudio y rebaños de estudio
El estudio se realizó con dos rebaños de cabras de raza Guadarrama localizados en el centro de España, uno de los cuales estaba infectado por M. bovis (rango: 1-7 años de edad) y uno de los cuales estaba libre de TB (rango: 1-6 años de edad), que se utilizaron para las estimaciones de Se y Sp, respectivamente. El Se fue evaluado en un rebaño (n = 197) en el que se aisló M. bovis SB0121. Este rebaño fue sometido a una prueba SIT, una prueba CIT y una IGRA, que mostraron una prevalencia aparente de 87,5, 67,7 y 53,8%, respectivamente. Debido a la alta proporción de reactores, todos los animales fueron sacrificados y sometidos a análisis post mortem. La presencia de lesiones compatibles con TB se evaluó durante el sacrificio, y se recogieron muestras de tejido para el cultivo bacteriológico y el aislamiento de bacterias en el laboratorio. Se incluyeron en el estudio animales con cultivo positivo (M. bovis SB0121) y aquellos con lesiones compatibles con TB (n = 64) para evaluar el Se del ELISA P22 en muestras de fluido oral. El Sp se evaluó en un rebaño libre de TB (n = 113), con base en su historia de estado libre de TB y los resultados negativos obtenidos de las pruebas SIT, CIT y serológicas de los animales (P22 ELISA) en los últimos tres eventos de prueba en los últimos 2 años. La vacuna Gudair (CZ Vaccines, Porriño, España) contra M. avium subsp. paratuberculosis (MAP) se había administrado a los animales de ambos rebaños a la edad de 6 meses como parte de sus programas de vacunación.
Los animales incluidos en el estudio fueron sometidos a pruebas SIT y CIT e IGRA. Se recogieron muestras de suero y fluido oral antes de la prueba intradérmica y se analizaron mediante un ELISA P22. Los resultados obtenidos se compararon con el análisis post mortem.
Los animales en el presente estudio no fueron considerados como animales de experimentación. Todos los procedimientos de manipulación y muestreo se realizaron de conformidad con la legislación española (Real Decreto 720.7/2011).
Recolección de muestras de suero y líquido oral
Se recogieron muestras de sangre de la vena yugular por medio de venopunción, utilizando tubos de suero plástico (BD Vacutainer Becton, Dickinson and Company, Franklin Lakes, USA). Las muestras se almacenaron a temperatura ambiente durante 24 h y luego se centrifugaron durante 15 min a 650 g, después de lo cual los sueros se almacenaron a -20 ° C hasta el ensayo. Se obtuvieron muestras de fluido oral de las mismas cabras frotando en seco la boca de los animales, que se limpiaron de antemano. En el laboratorio, los hisopos secos se introdujeron en tubos de 2 ml con un medio compuesto por 4 μl de azidiol (Panreac, España) y 1 ml de solución salina tamponada con fosfato (PBS). Estos hisopos secos se conservaron a 4 °C durante 8 h, después de lo cual las muestras se centrifugaron a 13.000 g durante 5 min, y se obtuvo una alícuota de 500 μl del sobrenadante y se almacenó a -20 °C hasta la prueba de ensayo.
P22 ELISA
Las muestras de suero se analizaron empleando un ELISA P22, como lo describió previamente Infantes-Lorenzo et al. (4). El protocolo se adaptó a las muestras de fluidos orales de la siguiente manera: la dilución óptima del fluido oral se determinó evaluando la reactividad de las muestras diluidas de 1:2 a 1:128, y finalmente se eligió una dilución de 1:2. Se añadieron cien microlitros de anticuerpos de detección a 1:2.000, y las placas se incubaron a temperatura ambiente durante 30 min. Como antes, el anticuerpo secundario [Rabbit anti sheep IgG(H/L)-HRP] (Southern Biotech, USA) se tituló de 1:500 a 1:8.000 para elegir la dilución óptima.
Los resultados se expresaron como un porcentaje de ELISA P22 (E%), que se calculó utilizando la siguiente fórmula:
E%=[media de la muestra de OD/(2×media de la OD de control negativo)]×100E%=[Muestra media de DO/(2×media de control negativo OD)] ×100
En el caso de las muestras de suero, los valores de E% de 100 o más se consideraron positivos, como se describe en otra parte (4), mientras que en el de las muestras de fluidos orales, se calculó un punto de corte mediante un análisis de características operativas del receptor (ROC), y los valores de E% de 100 o más se consideraron positivos.
Pruebas intradérmicas de tuberculina
Las pruebas SIT y CIT se realizaron mediante la inoculación intradérmica de 0,1 ml de PPD bovinos y aviares (CZ Vaccines, Porriño, España) en el sitio derecho e izquierdo de la región cervical, respectivamente, utilizando una jeringa Dermojet (Akra Dermojet, Pau, Francia). Todos los ensayos se realizaron de acuerdo con la Directiva 64/432/CEE del Consejo y el Real Decreto RD2611/1996, y las reacciones se interpretaron como se describió anteriormente (24).
Ensayo de liberación de interferón gamma
Se recogieron muestras de sangre de la vena yugular utilizando tubos evacuados (BD Vacutainer Becton, Dickinson and Company, Franklin Lakes, USA) con heparina para detectar la producción de IFN-γ. Las muestras de sangre se procesaron como se describió anteriormente (25). La sangre se incubó a 37°C en atmósfera humidificada en presencia de antígenos (PPD-B y PPD-A) durante 18-20 h. Las muestras se centrifugaron a 2.500 rpm durante 15 minutos, y se recogió el sobrenadante. La liberación de interferón gamma se midió utilizando un IGRA comercial diseñado para cabras (Bovigam TB kit, Thermo Fisher Scientific, Waltham, EUA), de acuerdo con las instrucciones del fabricante, y los resultados se interpretaron como se describe en otra parte (26).
Análisis post mortem
Las lesiones macroscópicas compatibles con TB (TBL) incluyen lesiones nodulares blanquecinas que contienen material caseoso, que puede mineralizarse en el centro y encapsularse por tejido fibroso (27, 28). La inspección y la puntuación semicuantitativa del TBL presente en los lóbulos pulmonares y los ganglios linfáticos (LN) de los animales sacrificados se llevaron a cabo sobre la base de un modelo previo de valoración de lesiones propuesto por Vordermeier et al. (29), con algunas modificaciones. Este sistema de puntuación se basa en el tamaño y el número de lesiones, además del porcentaje del órgano afectado, de la siguiente manera: 0, sin lesiones visibles; 1, una pequeña lesión aparente al cortar; 2, <5 lesiones de <10 mm de diámetro; 3, más de cinco lesiones de <10 mm de diámetro o una lesión de >10-30 mm de diámetro y/o <50% del órgano afectado; 4, más de una lesión de >30 mm de diámetro y/o >50% del órgano afectado; y 5, lesiones coalescentes y >70% del órgano afectado. En los pulmones, se otorgó un punto extra a los animales que tenían adherencias pleurales. Todos los lóbulos pulmonares (apical izquierdo, diafragmático izquierdo, apical derecho, cardíaco derecho, accesorio derecho y diafragmático derecho) se examinaron individualmente y se sumaron las puntuaciones de estos lóbulos para calcular el puntaje pulmonar total. El LN de la cabeza (retrofaríngeo) y los LN pulmonares (traqueobronquiales y mediastinos) también se examinaron individualmente, y se sumaron las puntuaciones de los diferentes LN para calcular el puntaje total.
Se utilizaron muestras de tejido de los pulmones y de los LN retrofaríngeos, traqueobronquiales y mediastínicos de 64 animales con lesiones de TB para el cultivo bacteriológico en Löwenstein-Jensen con medio piruvato de sodio (Difco, España), como se describió anteriormente (15). Los animales con lesiones compatibles con TB en los pulmones o en los diferentes LN analizados en el presente estudio fueron considerados como TB positivos. A continuación, se realizó una comparación entre los resultados del ELISA P22 y la puntuación de la lesión obtenida para los pulmones y/o la cabeza y los LN pulmonares.
Análisis estadístico
Se calcularon los intervalos de confianza del 95% de Wilson (IC del 95%) para el porcentaje de reactores positivos a las diferentes pruebas. Se realizó un análisis ROC para definir el valor de corte óptimo (Material Suplementario). Los valores cuantitativos, como E% en muestras de fluido oral con respecto a la puntuación TBL, se alcanzaron para los dos rebaños diferentes y se compararon mediante la prueba U de Mann-Whitney. Además, la variación de los valores cuantitativos de las técnicas diagnósticas con respecto a la puntuación TBL se calculó utilizando un R-cuadrado (R2) e interpretado de la siguiente manera: 0,00–0,25 pobre, 0,26–0,50 regular, 0,51–0,75 moderado y 0,76–1,00 sustancial. Todas las pruebas estadísticas fueron realizadas con SPSS Statistics 25 (IBM, Nueva York, NY, USA), e interpretadas considerando un valor de p de 0,05 para determinar la significación estadística.
Resultados
Con respecto al ELISA P22 realizado con muestras de fluido oral, se calculó una curva ROC utilizando muestras de animales infectados con TB (n = 64) y libres de TB (n = 113). El punto de corte óptimo se estableció en 100%, en el que se observaron los niveles más altos de Se y Sp. Un punto de corte más alto o más bajo causó una pérdida de Se con un Sp constante, o viceversa, y fue por esta razón que se eligió un E% de 100 como punto de corte.
En el presente estudio, 22 de los 64 animales infectados con TB obtuvieron resultados positivos al ELISA P22 cuando usaron fluidos orales, lo que arrojó un Se estimado de 34,4% (IC 95%: 22,4–45,6). Todos los animales del rebaño libre de TB dieron negativo al ELISA P22 cuando utilizaron muestras de fluido oral, alcanzando un Sp del 100% (IC 95%: 96,7–100; Tabla 1). El uso del punto de corte seleccionado permitió obtener el valor predictivo positivo [100% (IC 95%: 97,4-100)], el valor predictivo negativo [77,2% (IC 95%: 71,1-83,2)] y el área bajo la curva (0,827). Diecinueve de las 22 cabras positivas para ELISA P22 tenían lesiones compatibles con la tuberculosis en los pulmones, y 20 de 22 las tenían en diferentes LN (17 de 22 en ambos lugares). Teniendo en cuenta solo el entorno de 16 animales con lesiones graves (puntuación de lesión superior a 10), el ELISA mostró un SE del 75% (IC 95%: 53,7–96,2). Además, aquellos animales que fueron positivos al ELISA P22 en cuanto a las muestras de fluido oral tuvieron una puntuación TBL pulmonar significativamente mayor (p = 0,018) (Figura 1).
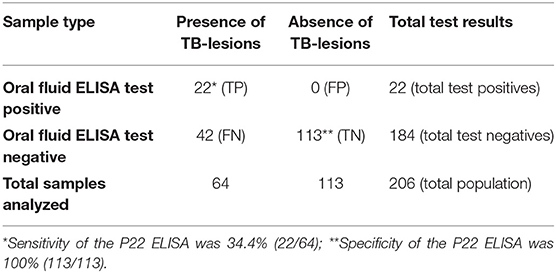 TABLA 1. Resultados utilizados para determinar la sensibilidad y especificidad del fluido oral P22 ELISA para el diagnóstico de tuberculosis en cabras.
TABLA 1. Resultados utilizados para determinar la sensibilidad y especificidad del fluido oral P22 ELISA para el diagnóstico de tuberculosis en cabras.
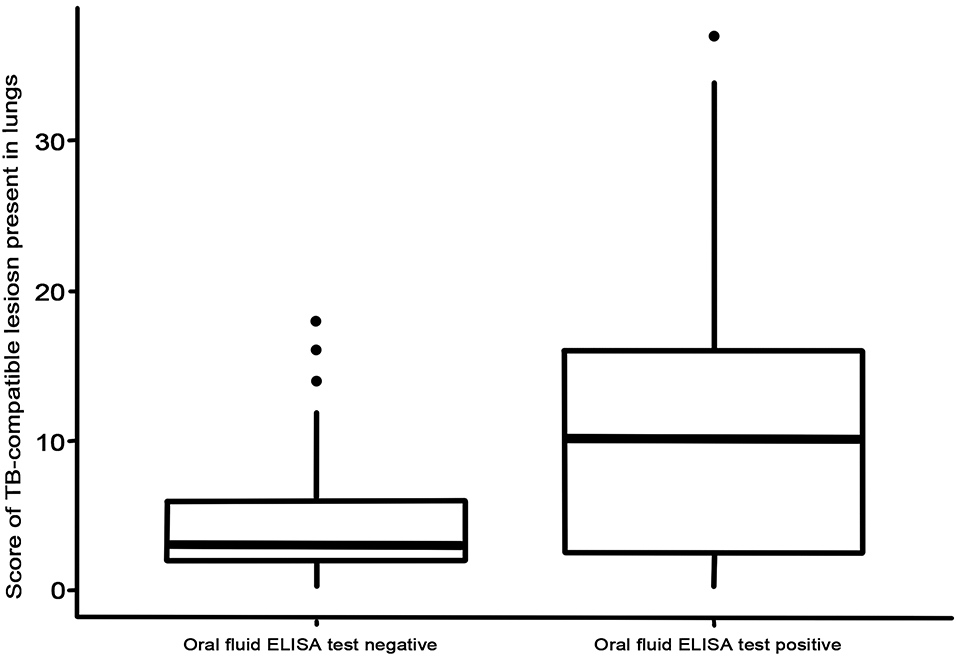 FIGURA 1. Puntuación de lesión pulmonar para animales negativos y positivos analizados con P22 ELISA con muestras de fluido oral.
FIGURA 1. Puntuación de lesión pulmonar para animales negativos y positivos analizados con P22 ELISA con muestras de fluido oral.
Al utilizar las muestras de suero, 56 de las 64 cabras infectadas con M. bovis fueron positivas para el ELISA P22 (E% > 100), con un Se de 87,5% (77,2–93,5, IC 95%) (Tabla 2). Los animales infectados por M. bovis presentaron un E% mayor cuando emplearon el suero (mediana = 653,9 E%; p < 0,0001) que cuando se emplean las muestras de fluidos orales (mediana = 66,6 E%) (Figura 2). Se obtuvieron muestras similares de E% para el fluido oral (mediana = 46,2 E%) y el suero (mediana = 55,2 E%) de animales del rebaño libre de TB, y no se observaron diferencias significativas (p = 0,852). Finalmente, hubo una correlación muy pequeña entre los resultados de P22 obtenidos para las muestras de fluido oral y suero (R2 = 0,032) y entre el E% de resultados obtenidos para el fluido oral y las lesiones compatibles con TB observadas en los pulmones de las cabras sacrificadas (R2 = 0,142) y la cabeza y los LN pulmonares: retrofaríngeos (R2 = 0,206), traqueobronquial (R2 = 0,081), y mediastínico (R2 = 0,116) (material complementario). La correlación entre el E% del fluido oral y la puntuación total de la lesión fue ligeramente mayor (R2 = 0,225).
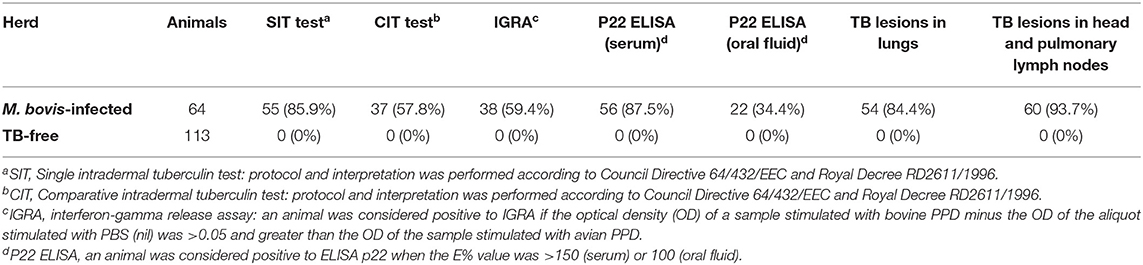 TABLA 2. Resumen de las pruebas diagnósticas de tuberculosis (TB) ante mortem y análisis post mortem en las cabras en estudio.
TABLA 2. Resumen de las pruebas diagnósticas de tuberculosis (TB) ante mortem y análisis post mortem en las cabras en estudio.
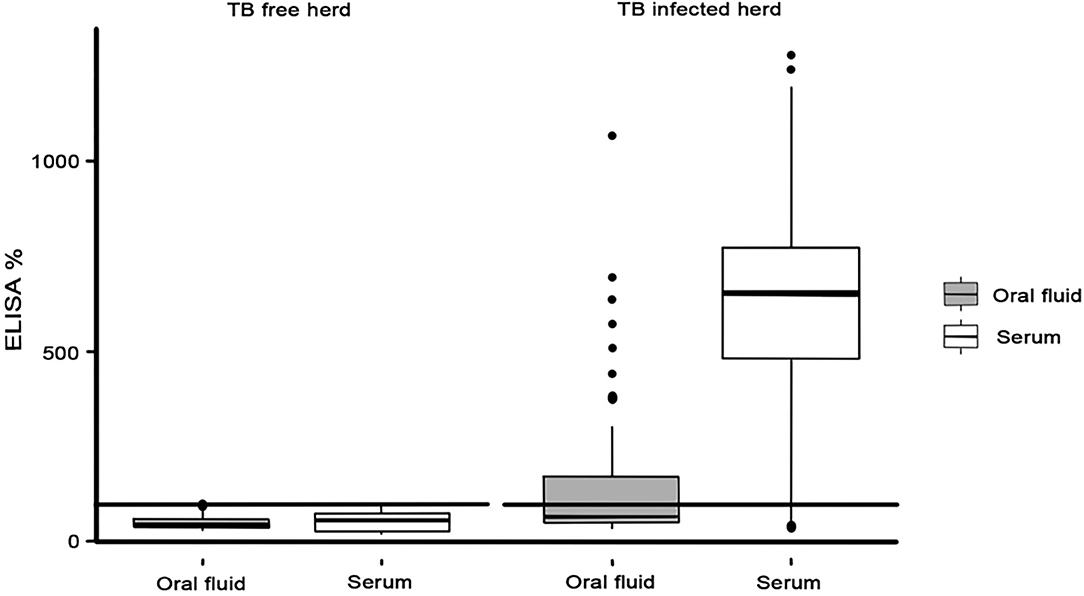 FIGURA 2. ELISA% en muestras de fluido oral (gris) y suero (blanco) observadas en rebaños libres de TB e infectados con TB.
FIGURA 2. ELISA% en muestras de fluido oral (gris) y suero (blanco) observadas en rebaños libres de TB e infectados con TB.
Finalmente, con respecto a las técnicas basadas en la respuesta inmune celular, de las 64 cabras del rebaño infectado con TB, 55 y 37 fueron consideradas reactores positivos a la prueba SIT [(85,9% (IC 95%: 75,3-92,4)] y a la prueba CIT [(57,8% (IC 95%: 45,6-69,1)], respectivamente. En este rebaño, 38/64 animales fueron positivos a IGRA, con una prevalencia aparente de 59,4% (IC 95%: 47,1–70,5) (Tabla 2). En este sentido, no hubo correlación entre la IGRA y los resultados de la puntuación total de la lesión (R2 = 0,004), que fue menor que la correlación observada con E% cuando se utilizaron muestras de fluidos orales. Se observó una correlación deficiente entre las pruebas SIT y CIT y los resultados de la puntuación total de la lesión (R2 = 0,042 y 0,069, respectivamente) (Material suplementario).
Discusión
En el presente estudio, se desarrolló y evaluó por primera vez en cabras un ELISA interno con el que detectar anticuerpos específicos contra M. bovis en muestras de fluidos orales. Los resultados mostraron un Sp alto pero un Se limitado del ELISA P22 para el diagnóstico de TB utilizando muestras de fluido oral de cabras.
El ELISA P22 había sido previamente evaluado para el diagnóstico de TB en cabras utilizando muestras de sueros y leche, mostrando resultados prometedores en lo que respecta a Se y Sp (4, 8, 15). Con respecto a las muestras de fluido oral para el diagnóstico de TB, se realizó un estudio previo utilizando un ELISA basado en PPD-B en jabalíes (13). Sin embargo, hasta donde saben los autores, no se dispone de estudios previos que utilicen un ELISA para la detección de anticuerpos específicos contra la TB en muestras de fluidos orales de rumiantes. Con respecto a la Sp, el ELISA P22 alcanzó una excelente Sp del 100%, que fue superior a la obtenida por las pruebas serológicas descritas hasta la fecha para el diagnóstico de TB en cabras utilizando muestras de suero o leche (4, 7). La interferencia de la vacunación contra MAP en el diagnóstico de TB en cabras se ha descrito previamente en rebaños libres de TB en otros países (30). Además, diferentes estudios han reportado un Sp más bajo [58.3 (IC 95%: 42.2–72.9)−96 (IC 95%: 90.1–98.4)] del ELISA P22 en cabras vacunadas con MAP que en cabras no vacunadas (4, 31). El mayor Sp obtenido en nuestro estudio [100% (IC 95%: 96,7-100)] utilizando fluidos orales se relacionó con el bajo Se alcanzado. Por lo tanto, aunque los dos rebaños estudiados en este documento fueron vacunados contra M. avium subsp. paratuberculosis (MAP), no se demostró una reacción cruzada en la prueba de líquido oral de TB debido a la vacunación MAP en nuestro estudio utilizando el punto de corte recomendado. Sin embargo, a pesar del óptimo desempeño del ELISA P22 cuando se utilizaron muestras de suero y leche, el presente estudio mostró que la utilidad de las muestras de fluido oral para detectar la infección por M. bovis en cabras fue limitada, a diferencia de lo que ocurrió en un estudio previo con jabalíes que reportó un Se de 67,3% (13). La realización de una prueba diagnóstica suele evaluarse teniendo en cuenta los resultados de un cultivo bacteriológico que se considera el estándar de oro. Ninguna de las pruebas ante mortem utilizadas para definir la infección por TB en cabras es perfecta en términos de Se y Sp, y no son, por lo tanto, indicadores precisos del estado real de TB de los animales. En este sentido, los resultados de la serología se utilizaron como referencia para definir el estado de infección en el estudio del jabalí, y esto podría haber afectado la precisión de la prueba (13). De hecho, cuando el Se del ELISA P22 llevado a cabo utilizando muestras de fluido oral se estimó utilizando los resultados séricos como estándar de oro, el Se fue ligeramente más alto en nuestro estudio [39.3% (IC 95%: 27.6-52.4) datos no mostrados], pero aún más bajo que el reportado para jabalíes.
Es necesario señalar que en el presente estudio, el ELISA P22 alcanzó un mayor Se cuando se utilizaron muestras de suero que cuando se utilizaron muestras de fluidos orales. Además, las técnicas de diagnóstico de TB basadas en la detección de anticuerpos específicos pueden mejorarse utilizando muestras recogidas después de la inoculación de PPD. Este fenómeno, que se denomina efecto booster, ha sido reportado en diferentes especies (8, 32, 33). Se ha sugerido que el efecto de refuerzo sobre la respuesta de anticuerpos es una metodología valiosa para aumentar el Se de los ensayos serológicos en rumiantes (6, 8). Sin embargo, se requieren estudios adicionales para evaluar este efecto de refuerzo en muestras de fluidos orales.
El Se de las herramientas de detección de anticuerpos es generalmente menor que el reportado cuando se usan herramientas de diagnóstico basadas en la respuesta inmune celular (34). Sin embargo, en este trabajo, se obtuvo un mayor Se cuando se utilizaron muestras de suero (87,5%) que cuando se utilizaron las pruebas IGRA (59,4%), SIT (85,9%) y CIT (57,8%), incluso en ausencia del efecto booster. Estos resultados respaldan el valor de las pruebas serológicas como herramienta para el diagnóstico de TB en rumiantes, como se observa en estudios recientes (4, 6, 8, 9), y la importancia de desarrollar nuevas herramientas de diagnóstico de TB para maximizar la detección de animales infectados.
Es ampliamente conocido que la producción y concentración en las muestras de las diferentes inmunoglobulinas (Ig) puede diferir entre especies. En este contexto, la concentración de IgG en el fluido oral de cabras es significativamente menor que en cerdos (35), lo que puede explicar las diferencias en el Se anteriormente declaradas. Los niveles de anticuerpos IgA en rumiantes son, por el contrario, más altos que en otras especies, lo que podría explicar las diferencias observadas en el diagnóstico al emplear ELISA basados en IgA o IgG para otras infecciones como la enfermedad de Schmallenberg (23). Además, estudios recientes apoyan la teoría de que la detección de IgA en muestras de fluidos orales parece ser más robusta y estable en el tiempo en cerdos (20). La producción de Ab en el fluido oral está relacionada con la inmunidad de la mucosa y, por lo tanto, la estimulación local del antígeno es, por lo tanto, de suma importancia si se quieren alcanzar altos niveles de IgA en esa muestra. Esto también podría explicar las diferencias observadas entre las muestras de suero y fluido oral. En este sentido, en el presente estudio, se observó una mejor correlación entre el E% en muestras de fluido oral y la gravedad de las lesiones en los LN retrofaríngeos. Estos LN están más cerca de las glándulas salivales en comparación con los LN pulmonares (mediastínicos y traqueobronquiales), pero se requieren estudios adicionales para confirmar la posible correlación entre una respuesta inmune local más grave y una mayor producción de anticuerpos en rumiantes.
Finalmente, es necesario señalar que, en este estudio, se utilizó un modelo de cabra para evaluar el rendimiento del ELISA P22 cuando se utilizaron muestras de fluidos orales. Estudios previos han mostrado resultados prometedores de plataformas basadas en anticuerpos para el diagnóstico de otras enfermedades (por ejemplo, FMDV o SVB) cuando se utilizan muestras de fluido oral en el ganado (22, 23). Los resultados del presente estudio sugieren un rendimiento similar o limitado del ELISA P22 en muestras de fluidos orales de bovinos debido a la alta presión diagnóstica como consecuencia de los programas oficiales de erradicación, ya que es difícil encontrar animales en una etapa avanzada de la infección. La realización de estudios similares con los que confirmar esta hipótesis sería, sin embargo, interesante.
En conclusión, el uso de biomarcadores de muestras de fluidos orales para el diagnóstico de TB en rumiantes aún está lejos de aplicarse de forma rutinaria y requiere una mayor validación e investigación. Los resultados globales obtenidos del presente estudio sugieren que el empleo del ELISA P22 para la detección de anticuerpos específicos en muestras de fluidos orales es muy específico, pero tiene un valor limitado en lo que respecta a la detección de animales infectados. Sin embargo, su rendimiento es significativamente mayor en presencia de lesiones graves, detectándose una alta proporción de aquellos animales del rebaño que presentan estas lesiones.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo / Material complementario, las consultas adicionales pueden dirigirse al autor correspondiente.
Declaración ética
No se requirió revisión ética y aprobación para el estudio en animales porque los animales en el presente estudio no fueron considerados como animales de experimentación. Todos los procedimientos de manipulación y muestreo se realizaron de conformidad con la legislación española (Real Decreto 720.7/2011). No se obtuvo el consentimiento informado por escrito para la participación de los propietarios porque el animal tiene un dueño, pero él colabora con nuestro centro de investigación y está al tanto de todos los estudios y publicaciones (prefiere ser anónimo).
Contribuciones del autor
JO, JI-L y JB escribieron el manuscrito y diseñaron las figuras. JO y JI-L realizaron la búsqueda bibliográfica. JO, JI-L, AG-B e IA-R realizaron los experimentos. JO, JI-L, JB, LJ, IM, IA-R, ÁR, LJ, BR y MD interpretaron los datos. Todos los autores revisaron y aprobaron el manuscrito.
Financiación
Este estudio ha sido financiado por el proyecto Herramientas para alcanzar la erradicación de la tuberculosis caprina (GoaTBfree) (PID2019-105155RB-C31) y el Ministerio de Agricultura, Pesca y Alimentación del Gobierno de España. JO fue apoyado por un contrato-beca FPU (Formación de Profesorado Universitario) proporcionado por el Ministerio de Ciencia, Innovación y Universidades (FPU18/05197).
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Reconocimientos
Los autores agradecen a Ana Belén Martín y Cristina Viñolo su asistencia técnica.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2021.674636/full#supplementary-material
Referencias
1. Brosch R, Gordon SV, Marmiesse M, Brodin P, Buchrieser C, Eiglmeier K, et al. Un nuevo escenario evolutivo para el complejo Mycobacterium tuberculosis. Proc Natl Acad Sci. (2002) 99:3684–9. DOI: 10.1073/PNAS.052548299
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Bezos J, Álvarez J, Romero B, Aranaz A, Juan L. Tuberculosis en cabras: evaluación de ensayos diagnósticos actuales mediados por células in vivo y basados en anticuerpos. Veterinario J. (2012) 191:161–5. doi: 10.1016/j.tvjl.2011.02.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Wood PR, Corner LA, Plackett P. Desarrollo de un ensayo celular in vitro simple y rápido para la tuberculosis bovina basado en la producción de interferón gamma. Res Vet Sci. (1990) 49:46–9. doi: 10.1016/S0034-5288(18)31044-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Infantes-Lorenzo JA, Moreno I, Roy A, Risalde MA, Balseiro A, de Juan L, et al. Especificidad de la prueba serológica para la detección de tuberculosis en bovinos, caprinos, ovinos y porcinos en diferentes situaciones epidemiológicas. BMC Vet Res. (2019) 15:70. DOI: 10.1186/S12917-019-1814-Z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Thomas J, Infantes-Lorenzo JA, Moreno I, Romero B, Garrido JM, Juste R, et al. Una nueva prueba para detectar anticuerpos contra el complejo Mycobacterium tuberculosis en suero de ciervo rojo. Veterinario J. (2019) 244:98–103. doi: 10.1016/j.tvjl.2018.12.021
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Casal C, Infantes JA, Risalde MA, Díez-Guerrier A, Domínguez M, Moreno I, et al. Las pruebas de detección de anticuerpos mejoran la sensibilidad del diagnóstico de tuberculosis en el ganado. Res Vet Sci. (2017) 112:214–21. doi: 10.1016/j.rvsc.2017.05.012
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. O’Brien A, Whelan C, Clarke JB, Hayton A, Watt NJ, Harkiss GD. Análisis serológico de la tuberculosis en cabras mediante el uso de la prueba múltiple de TB caprina enferplex. Clin Vaccine Immunol. (2017) 24:E00518–E6. doi: 10.1128/CVI.00518-16
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Bezos J, Roy A, Infantes-Lorenzo JA, González I, Venteo A, Romero B, et al. El uso de pruebas serológicas en combinación con la prueba intradérmica de tuberculina maximiza la detección de cabras infectadas con tuberculosis. Veterinario Immunol Immunopathol. (2018) 199:43–52. doi: 10.1016/j.vetimm.2018.03.006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Infantes-Lorenzo JA, Gortázar C, Domínguez L, Muñoz-Mendoza M, Domínguez M, Balseiro A. Técnica serológica para detectar la prevalencia de tuberculosis en ovinos en España atlántica. Res in Vet Sci. (2020) 129:96–8. doi: 10.1016/j.rvsc.2020.01.013
10. Madar R, Straka S, Baska T. Detection of antibodies in saliva–an effective auxiliary method in surveillance of infectious diseases. Bratisl Lek Listy. (2002) 103:38–41.
11. Prickett JR, Zimmerman JJ. The development of oral fluid-based diagnostics and applications in veterinary medicine. Anim Health Res Rev. (2010) 11:207–16. doi: 10.1017/S1466252310000010
12. Olsen C, Karriker L, Wang C, Binjawadagi B, Renukaradhya G, Kittawornrat A, et al. Effect of collection material and sample processing on pig oral fluid testing results. Vet J. (2013) 198:158. doi: 10.1016/j.tvjl.2013.06.014
13. Barasona JA, Barroso-Arévalo S, Rivera B, Gortázar C, Sánchez-Vizcaíno JM. Detection of antibodies against Mycobacterium bovis in oral fluid from Eurasian wild boar. Pathogens. (2020) 9:242. doi: 10.3390/pathogens9040242
14. Buddle BM, Wilson T, Luo D, Voges H, Linscott R, Martel E, et al. Evaluation of a commercial enzyme-linked immunosorbent assay for the diagnosis of bovine tuberculosis from milk samples from dairy cows. CVI. (2013) 20:1812–6. doi: 10.1128/CVI.00538-13
15. Roy A, Infantes-Lorenzo JA, Domínguez M, Moreno I, Pérez M, García N, et al. Evaluation of a new enzyme-linked immunosorbent assay for the diagnosis of tuberculosis in goat milk. Res Vet Sci. (2020) 128:217–23. doi: 10.1016/j.rvsc.2019.12.009
16. Kittawornrat A, Engle M, Panyasing Y, Olsen C, Schwartz K, Rice A, et al. Kinetics of the porcine reproductive and respiratory syndrome virus (PRRSV) humoral immune response in swine serum and oral fluids collected from individual boars. BMC Vet Res. (2013) 9:61. doi: 10.1186/1746-6148-9-61
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Mur L, Gallardo C, Soler A, Zimmermman J, Pelayo V, Nieto R, et al. Uso potencial de muestras de fluido oral para el diagnóstico serológico de la peste porcina africana. Veterinario Microbiol. (2013) 165:135–9. doi: 10.1016/j.vetmic.2012.12.034
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Schaefer R, Rech RR, Silva MC, Gava D, Ciacci-Zanella JR. Orientações para o diagnóstico de influenza em suínos. Sujetadores Pesq Vet. (2013) 33:61. doi: 10.1590/S0100-736X2013000100012
19. Henao-Díaz A, Giménez-Lirola L, Magtoto R, Ji J, Zimmerman J. Evaluation of three commercial porcine reproductive and respiratory syndrome virus (PRRSV) oral fluid antibody ELISAs using samples of known status. Res Vet Sci. (2019) 125:113–8. doi: 10.1016/j.rvsc.2019.05.019
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Campero LM, Schott F, Gottstein B, Deplazes P, Sidler X, Basso W. Detección de anticuerpos contra Toxoplasma gondii en fluidos orales de cerdos. Int J Parasitol. (2020) 50:349–55. doi: 10.1016/j.ijpara.2019.11.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Ramirez A, Wang C, Prickett JR, Pogranichniy R, Yoon K, Main R, et al. Vigilancia eficiente de las poblaciones porcinas utilizando fluidos orales. Prev Vet Med. (2012) 104:292. doi: 10.1016/j.prevetmed.2011.11.008
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Archetti IL, Amadori M, Donn A, Salt J, Lodetti E. Detection of foot-and-mouth-disease-virus infected cattle by assessment of antibody-response in oropharyngeal fluids. J Clin Microbiol. (1995) 33:79–84. DOI: 10.1128/JCM.33.1.79-84.1995
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Lazutka J, Spakova A, Sereika V, Lelesius R, Sasnauskas K, Petraityte-Burneikiene R. Saliva as an alternative specimen for detection of Schmallenberg virus-specific antibodies in bovines. BMC Vet Res. (2015) 11:237. DOI: 10.1186/S12917-015-0552-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Bezos J, Casal C, Díez-Delgado I, Romero B, Liandris E, Álvarez J, et al. Las cabras desafiadas con diferentes miembros del complejo Mycobacterium tuberculosis muestran diferentes cuadros clínicos. Veterinario Immunol Immunopathol. (2015) 167:185–9. doi: 10.1016/j.vetimm.2015.07.009
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Bezos J, Álvarez J, de Juan L, Romero B, Rodríguez S, Castellanos E, et al. Factores que influyen en la realización de un ensayo de interferón gamma para el diagnóstico de tuberculosis en cabras. Veterinario J. (2011) 190:131–5. doi: 10.1016/j.tvjl.2010.09.026
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Bezos J, Casal C, Puentes E, Díez-Guerrier A, Romero B, Aguilo N, et al. Evaluación de la inmunogenicidad e interferencia diagnóstica causada por M. tuberculosis SO2 Vacunación contra la tuberculosis en cabras. Res Vet Sci. (2015) 103:73–9. doi: 10.1016/j.rvsc.2015.09.017
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Corner LAL, Murphy D, Gormley E. Mycobacterium bovis infection in the Eurasian badger (Meles meles): the disease, pathogenesis, epidemiology and control. J Comp Pathol. (2011) 144:1–24. doi: 10.1016/j.jcpa.2010.10.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Thomas J, Balseiro A, Gortázar C, Risalde MA. Diagnóstico de tuberculosis en fauna silvestre: una revisión sistemática. Vet Res. (2021) 52:31. DOI: 10.1186/S13567-020-00881-Y
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Vordermeier HM, Chambers MA, Cockle PJ, Whelan AO, Simmons J, Hewinson RG. Correlación de la producción de interferón gamma específico de ESAT-6 con patología en bovinos después de la vacunación con Mycobacterium bovis BCG contra tuberculosis bovina experimental. Infectar inmune. (2002) 70:3026–32. doi: 10.1128/IAI.70.6.3026-3032.2002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Chartier C, Mercier P, Pellet MP, Vialard J. Effect of an inactivated paratuberculosis vaccine on the intradermal testing of winats for tuberculosis. Veterinario J. (2012) 191:360–3. doi: 10.1016/j.tvjl.2011.03.009
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Roy A, Infantes-Lorenzo JA, Blázquez JC, Venteo A, Mayoral FJ, Domínguez M, et al. Análisis temporal de la interferencia causada por la vacunación paratuberculosa en las pruebas diagnósticas de tuberculosis en caprinos. Prev Vet Med. (2018) 156:68–75. doi: 10.1016/j.prevetmed.2018.05.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Bezos J, Casal C, Álvarez J, Díez-Guerrier A, Rodríguez-Bertos A, Romero B, et al. Evaluación de la realización de pruebas diagnósticas celulares y serológicas para el diagnóstico de tuberculosis en un rebaño de al-paca (Vicugna pacos) infectado naturalmente con Mycobacterium bovis. Prev Vet Med. (2013) 111:304–13. doi: 10.1016/j.prevetmed.2013.05.013
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Casal C, Díez-Guerrier A, Álvarez J, Rodríguez-Campos S, Mateos A, Linscott R, et al. Uso estratégico de la serología para el diagnóstico de la tuberculosis bovina después de la prueba cutánea intradérmica. Veterinario Microbiol. (2014) 170:342–51. doi: 10.1016/j.vetmic.2014.02.036
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Bezos J, Casal C, Romero B, Schroeder B, Hardegger R, Raeber AJ, et al. Técnicas actuales ante mortem para el diagnóstico de la tuberculosis bovina. Res Vet Sci. (2014) 97(Suppl.):S44–S52. doi: 10.1016/j.rvsc.2014.04.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Duncan JR, Wilkie BN, Hiestand F, Winter AJ. Las inmunoglobulinas séricas y secretoras del ganado vacuno: caracterización y cuantificación. J Immunol. (1972) 108:965–76.
Cita: Ortega J, Infantes-Lorenzo JA, Bezos J, Roy Á, de Juan L, Romero B, Moreno I, Gómez-Buendía A, Agulló-Ros I, Domínguez L y Domínguez M (2021) Evaluación de P22 ELISA para la detección de anticuerpos específicos de Mycobacterium bovis en el fluido oral de cabras. Frente. Vet. Sci. 8:674636. doi: 10.3389/fvets.2021.674636
Recibido: 01 Marzo 2021; Aprobado: 20 de julio de 2021;
Publicado: 11 agosto 2021.
Editado por:
Federico Blanco, Instituto Nacional de Tecnología Agropecuaria (INTA), Argentina
Reviewed by:
Semmannan Kalaiyarasu, ICAR-National Institute of High Security Animal Diseases (ICAR-NIHSAD), India
Michele Ann Miller, Stellenbosch University, South Africa
Gobena Ameni, Addis Ababa University, Ethiopia
Copyright © 2021 Ortega, Infantes-Lorenzo, Bezos, Roy, de Juan, Romero, Moreno, Gómez-Buendía, Agulló-Ros, Domínguez y Domínguez. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Javier Bezos, jbezosga@visavet.ucm.es
†Estos autores han contribuido igualmente a este trabajo
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

