Modelos animales de metástasis del cáncer al hueso
Modelos animales de metástasis del cáncer al hueso
 Yihan Yu1†,
Yihan Yu1†,  Kanglu Li1†,
Kanglu Li1†,  Yizhong Peng1†,
Yizhong Peng1†,  Wei Wu1,
Wei Wu1,  Fengxia Chen2*,
Fengxia Chen2*,  Zengwu Shao1* y
Zengwu Shao1* y  Zhicai Zhag1*
Zhicai Zhag1*- 1Departamento de Ortopedia, Union Hospital, Tongji Medical College, Universidad de Ciencia y Tecnología de Huazhong, Wuhan, Hubei, China
- 2Departamento de Radiación y Oncología Médica, Hospital Zhongnan, Universidad de Wuhan, Wuhan, Hubei, China
La metástasis del cáncer es una causa importante de mortalidad por varios tumores, incluidos los de mama, próstata y glándula tiroides. Dado que el tejido óseo es uno de los sitios más comunes de metástasis, el tratamiento de las metástasis óseas es crucial para la curación del cáncer. Por lo tanto, se deben desarrollar modelos de enfermedad para comprender el proceso de metástasis ósea con el fin de diseñar terapias para ello. Se han desarrollado varios modelos traslacionales de diferentes tumores metastásicos óseos, incluidos modelos animales, modelos de inyección de líneas celulares, modelos de implantes óseos y modelos de xenoinjertos derivados de pacientes. Sin embargo, actualmente no se dispone de un compendio sobre diferentes cánceres metastásicos óseos. Aquí, hemos recopilado varios modelos animales derivados de experimentos actuales sobre metástasis óseas, principalmente con cáncer de mama y próstata, para mejorar el desarrollo de modelos preclínicos y promover el tratamiento de la metástasis ósea.
1 Introducción
La metástasis es una manifestación maligna frecuente del cáncer en las etapas medias y tardías de la progresión tumoral. La metástasis al hueso, uno de los sitios más comunes, ocurre cuando las células cancerosas migran desde el sitio original e invaden el tejido óseo. Indica pronóstico adverso y puede causar dolor intenso, fracturas, movilidad deteriorada y la muerte. La invasión de células cancerosas en sitios diana implica varias etapas. Inicialmente, invaden los alrededores del sitio original, rompiendo la vasculatura y entrando en la circulación. Luego, dependiendo de las señales moleculares en las membranas celulares o en su microambiente, invaden un órgano diana particular a lo largo de su camino de circulación (1, 2). Aunque el proceso preciso aún no se ha dilucidado, la invasión parece durar muchos meses, si no años, (3). Una vez que una gran cantidad de células cancerosas invasivas se aglomeran en una masa, comienza la metástasis. Las células cancerosas modifican los tejidos circundantes y la vasculatura para favorecer su crecimiento. El tratamiento del cáncer a menudo implica una combinación de radiación, quimioterapia y medicamentos para reducir el dolor y la inflamación.
El cáncer de mama, uno de los tumores malignos más prevalentes, exhibe una probabilidad del 40% de desarrollar metástasis óseas (4, 5). El tejido óseo es el sitio diana más común del cáncer de mama. La metástasis ósea refleja posibles eventos relacionados con el esqueleto y resultados clínicos deficientes. Para mejorar las terapias actuales para el cáncer de mama con metástasis óseas, se han utilizado modelos animales que imitan el microambiente tumoral humano en experimentos preclínicos (6). El cáncer de próstata es el segundo cáncer más frecuente en los hombres. Preferentemente hace metástasis al hueso, y presenta un peor pronóstico en la etapa metastásica. Raramente letal cuando se restringe a su sitio primario, la tasa de supervivencia a 5 años del cáncer de próstata disminuye en un 29,8% cuando hace metástasis al hueso, lo que explica su rango como la quinta causa principal de mortalidad relacionada con tumores en hombres (7). Es necesario desarrollar urgentemente agentes antimetastásicos y mejorar el pronóstico después de la metástasis ósea.
Se han utilizado múltiples modelos animales en la investigación clínica para explorar los mecanismos y el pronóstico de la metástasis tumoral. Se han utilizado modelos traslacionales para estudiar las etapas avanzadas de las metástasis tumorales, revelar posibles objetivos proteicos y desarrollar tratamientos relacionados con la metástasis. Sin embargo, la reproducción completa de metástasis óseas humanas en modelos animales es difícil. Sin embargo, al seleccionar diferentes líneas celulares, cepas animales y métodos de trasplante de tumores, se pueden construir modelos animales para responder a varias preguntas.
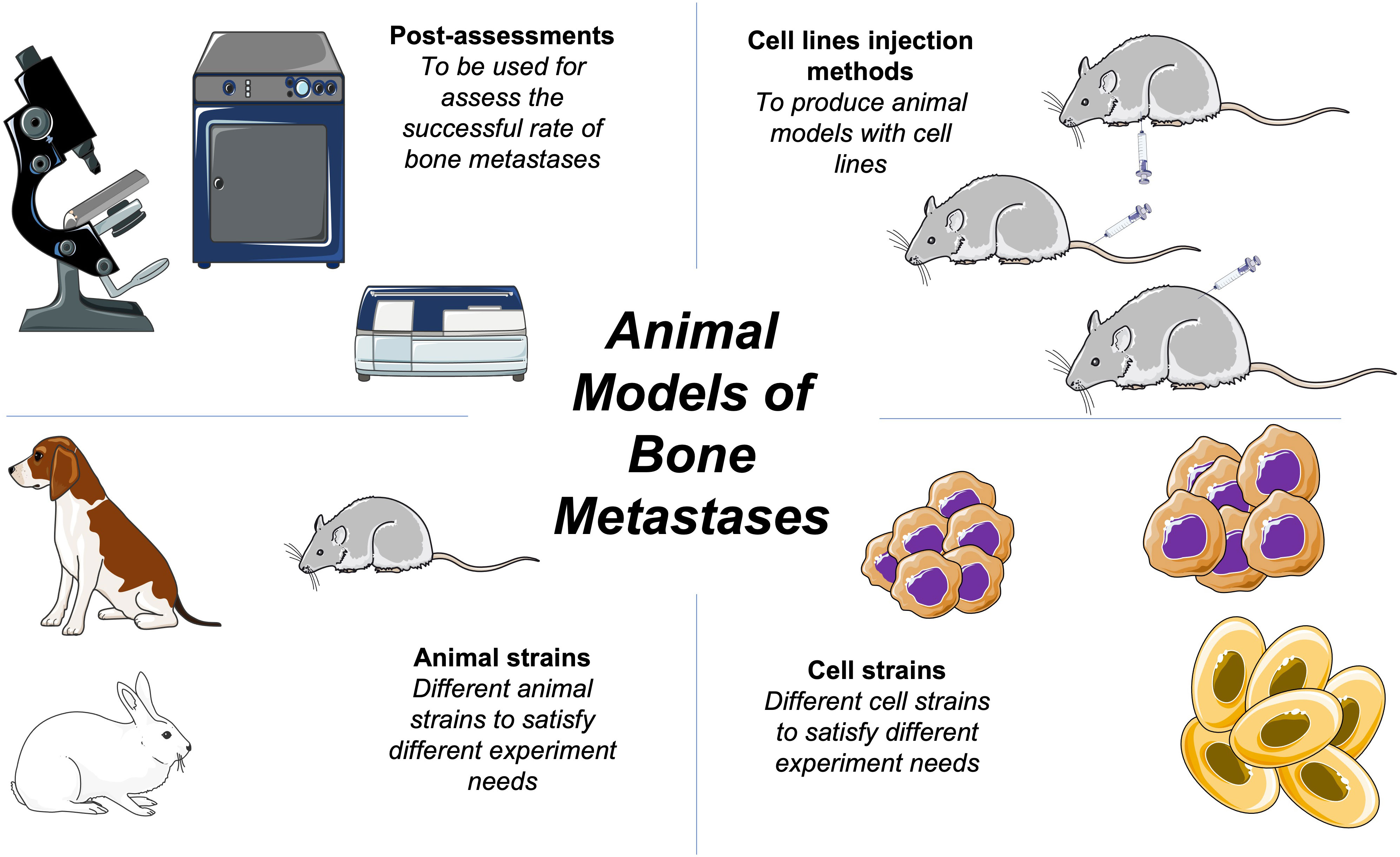
En esta revisión, hemos discutido los modelos animales de metástasis ósea más comúnmente utilizados en experimentos preclínicos y sus mecanismos subyacentes. Ningún modelo puede representar todos los mecanismos genéticos de la metástasis ósea, que requiere organismos de todo el cuerpo. Aquí, hemos compilado una selección de modelos animales para ayudar en futuros estudios (Figura 1).
2 Animales de uso común en la construcción de modelos animales
Basar modelos animales de metástasis óseas en modelos generales de enfermedades no es confiable. Debido a que la etiología de la metástasis ósea de los cánceres humanos y animales es diferente, diferentes cánceres tienen diferentes objetivos metastásicos. Por ejemplo, el cáncer de mama de ratón puede hacer metástasis preferentemente al pulmón, mientras que el cáncer de mama humano hace metástasis principalmente al hueso (2). Los tumores pulmonares pueden hacer metástasis específicamente a la columna vertebral (8, 9). Por lo tanto, los investigadores deben modificar los modelos animales en función de sus experimentos. El ratón es el animal de elección más común para construir modelos de metástasis ósea.
2.1 Cáncer de mama
Los modelos animales basados en células de cáncer de mama humano se construyen comúnmente utilizando roedores, como ratones o ratas, y se utilizan en experimentos preclínicos (10). Se utilizan animales inmunodeficientes e inmunocompetentes. Los ratones desnudos del fondo Balb/c se usan con frecuencia porque son susceptibles a las líneas celulares de cáncer de mama humano y roedor (2). Debido a la falta de timo, las respuestas inmunes apenas se generan en la mayoría de estos ratones después de la inyección de células cancerosas, lo que mejora significativamente la tasa de éxito de la construcción del modelo. Los ratones diabéticos / inmunodeficiencia combinada severa / no obesos (NOD / SCID) son ratones inmunodeficientes comúnmente utilizados en experimentos de xenoinjertos. Las discapacidades en el sistema inmune de los ratones NOD / SCID afectan el crecimiento de las células linfáticas, así como la señalización inmune. El equipo de Yin utilizó ratones NOD / SCID emparejados con la línea celular MDA-MB-231 para investigar cómo el factor de transcripción 2 relacionado con runt, un factor relacionado con la osteogénesis, promueve el cáncer de mama y la metástasis ósea (11).
La demanda de ratones cruzados o genéticamente modificados también ha aumentado para satisfacer mejor las necesidades experimentales (12-16). Los ratones que han sido cruzados y cruzados repetidamente pueden ofrecer un entorno in vivo más adecuado para investigar el mecanismo de metástasis ósea del cáncer de mama (13). En el experimento de Laura, los ratones Col1a-Krm2 fueron retrocruzados con NOD / SCID / IL2rγnulo (NSG) ratones durante 10 generaciones para introducir un fondo inmunocomprometido (13). Encontraron que la metástasis del cáncer a otros órganos como la columna vertebral se puede prevenir en animales bastante jóvenes. Al modificar el modelo animal en ratones adultos y cruzar más de 10 generaciones, podrían centrarse en las primeras etapas de la metástasis del cáncer de mama humano. El equipo de Devignes también cruzó ratones Floxed criados en experimentos previos con ratones de tipo salvaje FVB / n durante 10 generaciones para lograr una reconstitución genética consistente con sus requisitos experimentales. Según si se expresó el gen HIF, los ratones se dividieron en dos grupos para verificar si la vía de señalización HIF en los osteoblastos podría promover la invasión de células de cáncer de mama y la metástasis ósea (14).
A diferencia de estos experimentos, el equipo de Mercatali utilizó el pez cebra como modelo especial para estudiar la metástasis ósea (17). La visualización de embriones de pez cebra y la fácil manipulación genética proporcionan a los investigadores un nuevo método para estudiar la progresión del cáncer.
2.2 Cáncer de próstata
El primer modelo de cáncer de próstata, la rata Dunning, exhibe un desarrollo espontáneo de la enfermedad (7). Sin embargo, este modelo no mostró una tendencia a la metástasis ósea, y las células R-3327 derivadas de la rata Dunning solo pueden hacer metástasis a los ganglios linfáticos. Los perros también figuran como modelos animales candidatos, pero rara vez desarrollan cáncer de próstata debido a la falta de receptores de andrógenos en sus membranas celulares (7). La organización interna del fémur de los ratones incluye una estructura ósea de alto tejido que es menos fibrolamelar por naturaleza, proporcionando condiciones susceptibles de metástasis óseas (10, 18).
Los modelos de ratón transgénico tienen la ventaja de carecer de respuestas inmunes a las células inyectadas o xenoinjertos (19). El adenocarcinoma transgénico de próstata de ratón (TRAMP) es uno de los modelos transgénicos más famosos, que exhibe metástasis en el pulmón y los ganglios linfáticos en lugar del hueso (19, 20). Los promotores expresados en células neuroendocrinas, como el promotor de la procuenca en TRAMP, impulsan la expresión del oncogén transgénico. El ratón NOD/SCID es uno de los modelos animales inmunodeficientes más utilizados en experimentos de metástasis ósea de cáncer de próstata (21–25). Landgraf creó un nuevo modelo para estudiar la metástasis ósea del cáncer de próstata mediante la modificación de ratones NSG con una construcción ósea humanizada de ingeniería tisular (hTEBC), que facilita el crecimiento de células cancerosas (23). El equipo de Ganguly inyectó células PC3 en la tibia de ratones NSG de 6 semanas de edad para explorar si NOTCH3 induce elevación y secreción específica del tumor a través de MMP-3 (21).
Sin embargo, los modelos existentes todavía se limitan a algunos de los factores detectables relacionados con el cáncer y no pueden proporcionar una imagen completa o lineal de la metástasis ósea.
3 Líneas celulares de cáncer
Tanto los tejidos cancerosos derivados del paciente como las líneas celulares de cáncer inmortalizadas se utilizan para el trasplante. Los tejidos cancerosos derivados de pacientes muestran concordancia genética entre la clínica y los modelos animales, y ayudan a establecer modelos animales consistentes específicos para líneas celulares de cáncer particulares. Sin embargo, estos modelos pueden enfrentar obstáculos en forma de ética y disponibilidad de tejidos. Las líneas celulares, después de varios pasajes, pueden generar sitios estables de cáncer primario o secundario. Además, los investigadores pueden editar genéticamente las líneas celulares mediante el uso de genes de luciferasa o eliminando ciertos genes (26-28).
3.1 Cáncer de mama
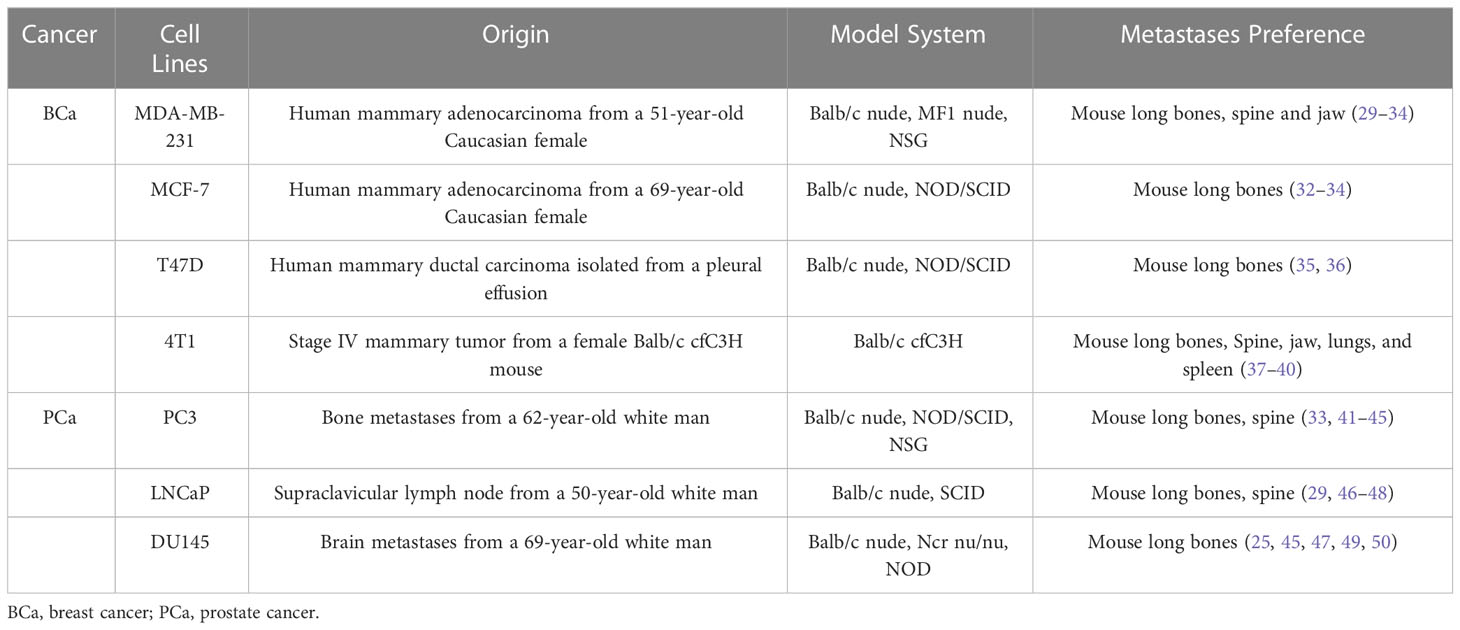
Las líneas celulares de cáncer de mama humano inmortalizado, como MDA-MB-231, 4T1 y MCF-7, están más fácilmente disponibles que los tejidos derivados de pacientes. Poseen características obvias del objetivo del cáncer de mama, y también pueden exhibir una tendencia a la metástasis ósea después de múltiples pasajes (Tabla 1) (2, 5, 11, 51). Pueden ayudar a restaurar la metástasis ósea humana en modelos animales. Las capacidades de localización ósea de las sublíneas MDA-MB-231 se pueden mejorar mediante inyecciones de generación, y hasta el 90% de las células óseas MDA-MB-231 pueden formar neoplasias (52-54). El uso de ratones de 5 a 8 semanas de edad es vital para lograr la metástasis ósea a través de inyecciones intracardíacas, intraarteriales o intravenosas. Farhoodi inyectó células 4T1 en la almohadilla de grasa mamaria de ratones Balb / c, y luego examinó sus piernas en busca de metástasis óseas. Una vez que se confirmó su incidencia, los ratones fueron sacrificados para recolectar las células tumorales metastásicas de los huesos de las piernas. Estas células se cultivaron para purificar células tumorales con tendencias metastásicas óseas (51). Purificaron sus células experimentales para mejorar la tasa de éxito.
También se pueden combinar diferentes pares de líneas celulares para probar ciertos conceptos. El equipo de Yin comparó MCF-7 y HCC1954 para validar si KRT13, una proteína de la familia de la queratina, promueve el tallo, la metástasis y la invasividad celular (55). El grupo de Han estimó la tasa metastásica de diferentes líneas celulares (56). Encontraron que la proliferación de células MDA-MB-453, UACC-893 y HCC-202 aumentó en la octava semana, mientras que las células MDA-MB-361, UACC-812, BT-474 y ZR-75-1 exhibieron una proliferación moderada pero una migración obvia. Usando células HCC-2218 y HCC1419, no se formaron tumores, lo que sugiere que ambos carecen de la capacidad de hacer metástasis al hueso. Los tumores formados por las células HCC-202 y MDA-MB-361 disminuyeron de tamaño después de la sexta semana, lo que indica que estas dos líneas celulares pueden no sobrevivir a la metástasis a largo plazo (56). Eckhardt et al. también probaron varias líneas celulares, y se utilizaron ratones NSG en estudios de xenoinjertos con células MDA-MB-231 y SUM159 (37).
3.2 Cáncer de próstata
Al igual que otras líneas celulares de cáncer, las del cáncer de próstata también se originan tanto en humanos como en animales (Tabla 1). R-3327, derivado de la rata Dunning, se ha utilizado para investigar el cáncer de próstata humano debido a su desarrollo espontáneo de neoplasias (57). Otras líneas celulares derivadas de animales, como PA-III o AT6-1, forman naturalmente lesiones osteolíticas y osteoblásticas similares a las metástasis óseas humanas en modelos animales (57-59). RM1, derivado de la próstata del ratón, es una línea celular altamente metastásica, pero no hace metástasis al hueso (60). Aunque puede inducir lesiones óseas consistentes en modelos de ratón, es una línea celular transformada, no natural.
PC3, DU145 y LNCaP son líneas celulares derivadas de pacientes que se usan comúnmente en modelos animales de cáncer de próstata. Están fácilmente disponibles y poseen los objetivos básicos de las células de cáncer de próstata. La PC3, derivada de las metástasis óseas de un hombre blanco de 62 años, se seleccionó aislando células altamente invasivas de lesiones óseas metastásicas. Landgraf implantó una estructura hTEBC basada en las propiedades de localización ósea de las células PC3, seguida de una inyección intracardíaca de células cancerosas transfectadas con Luc, facilitando la construcción de modelos para transferir la línea de osteoblastos humanos PC3 a hTEBC y el fémur murino (23). Los estudios en células LNCaP, PC3 y DU145, todas las cuales difieren en su sensibilidad a los andrógenos, mostraron que el factor de diferenciación de crecimiento secretado por cáncer de próstata 15 modula el potencial de remodelación ósea en lesiones óseas metastásicas (49, 61). El equipo de Lang agrupó cinco líneas celulares comunes de cáncer de próstata para verificar si PCAT7, un ARN largo no codificante relacionado con la metástasis ósea, activa el factor de crecimiento transformante β / supresor de las madres contra la vía de señalización decapentapléjica al regular al alza el receptor 1 del factor de crecimiento transformante β. También se investigó su correlación negativa con miR-324-5p (62). El equipo de Sohn intentó inyectar intracardiacamente líneas celulares LNCaP agrupadas con CD133. La sobreexpresión de CD133 en células LNCaP mejoró sus características similares a las células madre cancerosas en términos de formación de colonias, migración, etc. El grupo CD133 exhibió una tasa de metástasis ósea del 80%, en comparación con el 20% en el grupo Vec. Además, el grupo CD133 mostró una violación significativa de las características osteolíticas difusas de la médula espinal y los cuerpos vertebrales (29).++++
4 Preparación de líneas celulares para trasplante
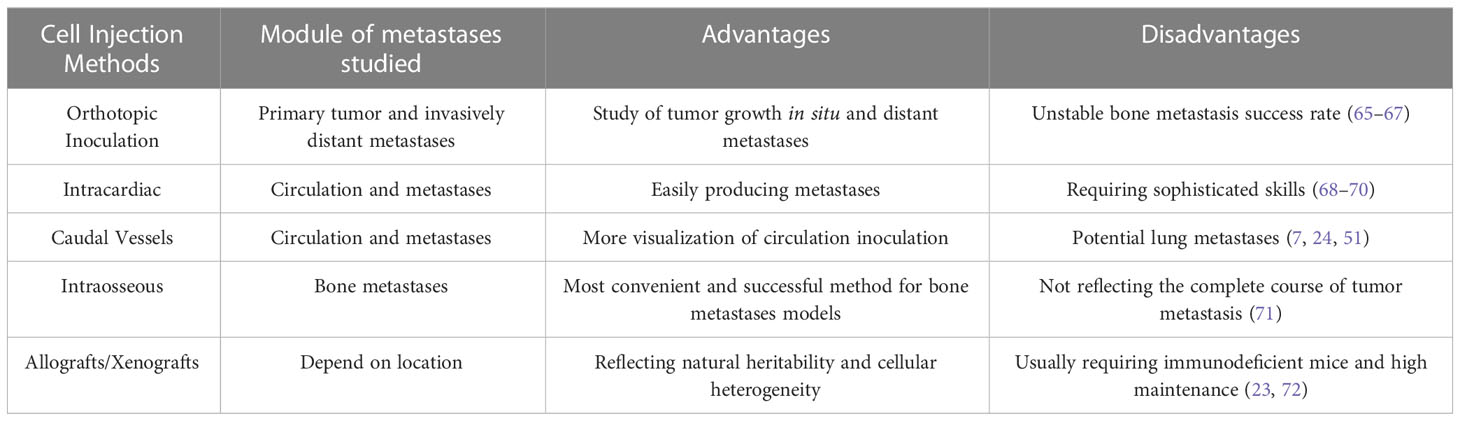
4.1 Inoculación ortotópica de células
La inyección in situ de células cancerosas reproduce mejor el proceso de metástasis del cáncer en el cuerpo humano. Inyectadas en almohadillas de grasa mamaria de ratón, las células tumorales se pueden sembrar a través de la vasculatura hacia los órganos diana, un método que logra el 40-60% de las metástasis óseas en modelos animales de cáncer de mama (63). Para estudiar la función de TIE2, un receptor de tirosina quinasa, en la metástasis ósea osteolítica, el equipo de Drescher administró inyecciones bilaterales de almohadillas de grasa mamaria e inyecciones ventriculares izquierdas a los ratones agrupados. Se evaluó la correlación entre el carcinoma in situ y la metástasis ósea para determinar si la inhibición de TIE2 estimula las células latentes del cáncer de mama y promueve la metástasis ósea (34). Del mismo modo, el equipo de Spadazzi inyectó células MCF-7 en el ventrículo izquierdo y las almohadillas de grasa mamaria de ratones NSG para investigar si el factor trébol-1 podría ejercer efectos inducidos por el estrógeno (64).
Sin embargo, este método sufre de una variación considerable en el crecimiento tumoral metastásico, además de la comorbilidad causada por el desarrollo del tumor (Tabla 2) (73). Además, plantea el problema de metástasis óseas pequeñas mientras el tumor primario ha crecido más allá de un tamaño éticamente razonable (5), lo que compromete seriamente la detección de metástasis óseas estimuladas.
Algunos científicos también han sugerido aloinjertos subcutáneos para modelar la metástasis ósea. El equipo de Peiffer proporcionó un protocolo detallado para resecar aloinjertos subcutáneos de cáncer de próstata de ratones inmunocompetentes (65). Las metástasis óseas, las metástasis de la cavidad abdominal y la invasión local ocurrieron en ocho ratones. Este estudio demostró que la resección de aloinjertos subcutáneos de ratones puede conducir al desarrollo de metástasis; Sin embargo, la duración del experimento se extendió por la extirpación de la glándula prostática y operaciones precisas.
4.2 Inyección intravascular
La inyección intravascular es una forma de inocular células en la circulación sanguínea. A diferencia de la inoculación ortotópica o ectópica, las células tumorales inyectadas a través de este método pueden localizarse en el sitio objetivo a través de la circulación intravascular (Tabla 2) (66). Las inyecciones intraarteriales generalmente se administran al ventrículo izquierdo, lo que limita la eliminación de las células que se produce cuando pasan a través de los capilares pulmonares (10, 53, 67). La inyección de venas de la cola, que es la inyección intravenosa más común en la actualidad, aumenta efectivamente la tasa de metástasis óseas al tiempo que aumenta la tasa de mortalidad en ratones (51).
Los modelos animales actualmente dependen de inyecciones intracardíacas para realizar el proceso de metástasis ósea. Las células tumorales se inyectan en la circulación a través del ventrículo izquierdo de los ratones, después de lo cual pasan por los procesos de adhesión, degradación y migración para finalmente causar metástasis en diferentes órganos, simulando así el proceso de metástasis sanguínea de los tumores. El uso de inyecciones intracardíacas para investigar el papel de los factores asociados con el cáncer en la regulación de la metástasis ósea tumoral se ha convertido en el enfoque de modelado preferido (44–46). Zheng et al. utilizaron este método para demostrar que Jagged1 osteoblástico derivado de Niche sensibiliza las metástasis óseas (15). El equipo de Wang demostró que el eje de integrina sialoproteína-αvβ3 ósea funcionaba significativamente más eficientemente en la metástasis ósea de células cancerosas cuando la integrina se sobreexpresaba. Para la comparación, se recolectaron muestras teñidas del cerebro, pulmón, tibia y fémur después de la inyección ventricular izquierda en ratones desnudos (52). Aunque la mortalidad postoperatoria es relativamente alta, la tasa de supervivencia aún puede superar el 90% con la práctica.
La inyección del vaso caudal puede producir una mayor tasa de metástasis en el hueso de la pierna que en otros órganos vitales. Este método ofrece una mejor precisión que la inyección intracardíaca porque la visibilidad de los vasos de la cola permite a los investigadores observar el flujo de fluidos de células cancerosas dentro (74). Las inyecciones vasculares caudales pueden ser intravenosas o arteriales. La inyección a través de la arteria de la cola reducirá la eliminación de células tumorales en los capilares pulmonares y mejorará la tasa de éxito de la colonización al hueso, mientras que la inyección de la vena de la cola promoverá la metástasis tumoral al pulmón (2, 51, 74). En los experimentos de Farhoodi, los ratones de inyección de la arteria de la cola modelo de células 4T1 mostraron un número significativo de células tumorales localizadas en la almohadilla de grasa subinguinal y el hueso de la pierna (51). Se encontraron células tumorales en los huesos de las piernas de los 32 ratones inyectados a través de la arteria de la cola, y la tasa de metástasis óseas después de la inyección completa del velo de la cola también fue superior al 90%. También se detectaron metástasis en el 70% de otras ubicaciones objetivo 2 semanas después de la inyección. Hamaidi et al. determinaron el efecto de Lim1 en la adhesión, la transición epitelial-mesenquimal, la invasión y la progresión metastásica de los objetivos de la superficie de las células cancerosas después de la inyección de la línea celular de carcinoma renal Caki2/786 a través de la vena caudal lateral de ratones desnudos (75). Sin embargo, la inyección de la vena caudal también dio lugar a focos metastásicos en los pulmones de ratones.
Múltiples factores afectan el éxito de los experimentos que involucran inyección vascular. Las brechas de habilidad del operador, los procedimientos estándar de operación celular y la presión dentro de los vasos caudales pueden influir en la tasa de crecimiento y el éxito de la metástasis ósea tumoral (51). La dilatación de los vasos caudales antes de la inyección o el uso de fluoresceína para revelar el flujo de los vasos puede mejorar la eficacia de la inyección. La inyección intracardíaca no dirigida todavía se asocia con un riesgo de trombosis debido a la actividad procoagulante de las células tumorales después de una finalización precisa. La mortalidad de los modelos animales posteriores a la inoculación puede reducirse inyectando heparina de bajo peso molecular en la vena de la cola 10 minutos antes de la inoculación (76).
4.3 Inyección intraósea
Los tumores metastásicos pueden eludir el proceso premetastásico si se implantan directamente ectópicamente en el hueso. El crecimiento de las células tumorales dentro del hueso depende de su interacción con las células óseas y el microambiente óseo (Tabla 2) (77, 78). Por lo tanto, si bien la inyección intraósea puede ayudar a examinar el comportamiento local del tumor dentro del microambiente óseo, no se puede usar para estudiar las primeras etapas de la metástasis ósea (79). Los investigadores suelen inyectar entre 50.000 y 100.000 células cancerosas directamente en la tibia o el fémur de los ratones, evitando la posible comorbilidad del tumor primario de los animales (80, 81). Chen et al. observaron que Brachyury, un gen que afecta la longitud de la cola en ratones, se expresó a un nivel bajo en la línea celular MDA-MB-231 altamente metastásica, mientras que se expresó altamente en la línea celular T47D poco metastásica cuando se inyectaron células de cáncer de mama en la región condilar anterior superior de la tibia derecha de ratones. Los ratones desnudos mostraron una hinchazón significativa en el lugar de la inyección 4 semanas después de la inyección, y los rayos X revelaron lesiones osteolíticas inducidas por tumores (35). Después de inyectar células de cáncer de próstata en la tibia izquierda de ratones desnudos Balb / c, el equipo de Thulin realizó ensayos del estado de desarrollo del tumor óseo utilizando tomografía computarizada cuantitativa periférica (TC) y microTC para investigar el efecto del transductor de señal y activador de los inhibidores de la transcripción 3 (STAT3) en la metástasis ósea del cáncer de próstata regulada por STAT3. El tratamiento con inhibidores de STAT3 dio como resultado un microambiente de hueso tibial intacto sin formación de tumores ni respuesta esclerótica en ratones, mientras que el grupo VCaP mostró una respuesta tumoral ósea esclerótica de hasta el 85% (48).
4.4 Modelos de aloinjertos y xenoinjertos
El trasplante de tejidos alogénicos o xenogénicos en modelos animales es una forma común de modelar la metástasis ósea (Tabla 2). Dado que los animales con diferentes antecedentes genéticos responden a los tejidos alogénicos de manera diferente, es especialmente importante seleccionar la fuente de tejido adecuada. En el caso de los xenoinjertos, los tejidos tumorales derivados del paciente pueden reflejar mejor las características biológicas de la metástasis ósea tumoral en humanos (82). Los xenoinjertos derivados de pacientes tienen como objetivo trasplantar directamente tejido tumoral humano en ratones inmunodeficientes, lo que representa la heredabilidad natural y la heterogeneidad celular en el cáncer humano mejor que los modelos simples de trasplante de células (83). Entre los modelos animales, los xenoinjertos solo se pueden realizar en animales inmunocomprometidos o inmunodeficientes. Aoki et al. primero cultivaron tejido tumoral a partir de metástasis óseas inyectándolo intraperitonealmente en ratones machos sin timo nu / nu nude (42). Los tumores se procesaron quirúrgicamente a 1 mm3 fragmentos para ser implantados en la tibia izquierda proximal de los ratones desnudos cuando alcanzaron los 10 mm de diámetro. Observaron crecimiento tumoral en los ocho ratones. El modelo hTEBC de Landgraf también se basa en la baja respuesta inmune de los ratones NSG a los xenoinjertos, al tiempo que agrega componentes humanizados para imitar la metástasis ósea del tumor humano de la manera más satisfactoria posible en ratones (23).
5 Evaluación de modelos animales de metástasis óseas
Después de inyectar células cancerosas en ratones, las lesiones óseas se desarrollan rápidamente, lo que requiere que los investigadores detecten condiciones fisiológicas, cambios óseos y lesiones tumorales de manera oportuna.
El establecimiento de modelos de metástasis ósea utilizando luciferasa o líneas celulares marcadas con proteínas fluorescentes permite a los investigadores monitorear el desarrollo de tumores en los huesos de animales vivos (15, 39-41). Oliemuller et al. estudiaron los efectos de SOX11 sobre la invasión celular y la metástasis ósea utilizando células DCIS-Luc, generadas por transducción de las células con partículas lentivirales de luciferasa 2 (84). El equipo de Arriaga crió NPKEYFP ratones cruzando ratones NPK con el alelo reportero Rosa-CAG-LSL-EYFP-WPRE, lo que facilita la visualización de fluorescencia in vivo y la cuantificación de tumores de próstata y metástasis positivos para YFP (85).
A su vez, la instrumentación como el sistema IVIS puede proporcionar indicadores cuantitativos más precisos a través de lecturas fluorescentes o bioluminiscentes obtenidas de tumores (76-78). Por lo general, el crecimiento del tumor en el hueso se mide una o dos veces por semana. El área de lesiones osteolíticas y remodelación ósea anormal se puede evaluar visualmente mediante rayos X o microTC in vivo (45-47, 85). El equipo de Hinz luego usó el sistema IVIS. Después de inyectar células MDA-MB-231 en el ventrículo izquierdo de ratones NSG, realizaron ensayos de bioluminiscencia IVIS semanalmente para evaluar las lesiones osteolíticas causadas por metástasis óseas de cáncer de mama triple negativo. La inoculación de células AKT3-knockout 231-BO en ratones NSG resultó en metástasis óseas mejoradas (86). Otro equipo validó el efecto de inyectar intracardiacamente células osteotrópicas derivadas de MDA-MB-231 en ratones desnudos mediante el examen de lesiones osteolíticas en su tibia posterior y fémures mediante microCT. Las imágenes de microCT mostraron que las líneas celulares silenciadas con NKX2-8 tenían más probabilidades de producir metástasis óseas más tempranas, mientras que su sobreexpresión retrasó la aparición de metástasis, inhibió la actividad de los osteoclastos y redujo las lesiones metástasicas óseas (87).
Al final de la prueba en animales, los ratones deben ser examinados simultáneamente para detectar metástasis extraóseas. Todos los órganos y metástasis relevantes se fijan en formalina al 10% para su análisis. Para estudios histológicos, las muestras se fijan en paraformaldehído durante 24-48 horas y luego se descalcifican en solución de paraformaldehído/ácido etilendiaminotetraacético durante 2 semanas. El hueso descalcificado incrustado en parafina debe seccionarse para la tinción de hematoxilina y eosina y evaluarse utilizando un software de análisis de imágenes. También se pueden analizar los factores de crecimiento relacionados con la conversión ósea en el suero (88, 89). Las metástasis del pulmón, el hígado y el tejido cerebral también se pueden analizar y se pueden realizar estudios que investiguen la correlación entre el área y el número de metástasis óseas (90).
6 Conclusión
La metástasis ósea es una manifestación común del deterioro del cáncer en las etapas media y tardía de la enfermedad. Se han realizado muchas investigaciones sobre la invasión de células cancerosas, desde la migración al tejido óseo y más allá; Sin embargo, aún queda mucho por entender. Los modelos animales son herramientas vitales en experimentos metastásicos preclínicos que pueden ayudar a identificar los pasos clave en la metástasis ósea. Aquí, hemos resumido los animales experimentales, líneas celulares, técnicas de implantación celular y métodos de evaluación utilizados durante el estudio de metástasis óseas comunes de cáncer de mama y próstata. Para las pruebas preclínicas en animales, se utilizan animales inmunodeficientes para lograr el crecimiento del xenoinjerto sin provocar una respuesta inmune del huésped. En estudios preclínicos, muchos investigadores han mejorado con éxito el éxito de la colonización de células tumorales al hueso mediante el retrocruzamiento de líneas celulares y ratones transgénicos. Más importante aún, la mayoría de las pruebas en animales relacionadas con la metástasis ósea del cáncer se han realizado utilizando modelos de inyección de líneas celulares de cáncer. Aunque las primeras etapas de la metástasis ósea no se pueden estudiar, estos modelos son efectivos para estudiar la interacción entre las células cancerosas y el microambiente óseo.
Sin embargo, el uso de ratones para estudiar la inmunidad tumoral humana tiene sus limitaciones. Las diferencias en las vías de metástasis óseas entre humanos y modelos animales pueden explicar por qué el éxito de los tratamientos preclínicos no se reproduce perfectamente en humanos. La incapacidad de presentar una imagen completa y exhaustiva de todo el proceso de metástasis ósea es también un problema que debe abordarse al diseñar modelos animales en la actualidad.
Contribuciones del autor
Todos los autores contribuyeron por igual a este trabajo. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Financiación
Fundación Nacional de Ciencias Naturales de China.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Zhang L, Gaskins K, Yu Z, Xiong Y, Merino MJ, Kebebew E. Un modelo de ratón in vivo de cáncer de tiroides humano metastásico. Tiroides Off J Am Thyroid Assoc (2014) 24(4):695–704. doi: 10.1089/thy.2013.0149
2. Tulotta C, Groenewoud A, Snaar-Jagalska BE, Ottewell P. Modelos animales de metástasis ósea de cáncer de mama. Métodos Mol Biol Clifton NJ (2019) 1914: 309-30. DOI: 10.1007/978-1-4939-8997-3_17
3. Gawrzak S, Rinaldi L, Gregorio S, Arenas EJ, Salvador F, Urosevic J, et al. MSK1 regula la diferenciación de células luminales y la latencia metastásica en el cáncer de mama ER +. Nat Cell Biol (2018) 20(2):211–21. DOI: 10.1038/S41556-017-0021-Z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Zhang L, Qu J, Qi Y, Duan Y, Huang YW, Zhou Z, et al. EZH2 involucra la señalización de TGFβ para promover la metástasis ósea del cáncer de mama a través de la activación de la integrina β1-FAK. Nat Commun (2022) 13(1):2543. DOI: 10.1038/S41467-022-30105-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Horas K, Zheng Y, Zhou H, Seibel MJ. Modelos animales para la metástasis del cáncer de mama al hueso: oportunidades y limitaciones. cáncer invertir. (2015) 33(9):459–68. doi: 10.3109/07357907.2015.1065500
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Deasy SK, Erez N. Una falla en la matriz: matrisomas específicos de órganos en nichos metastásicos. Trends Cell Biol (2022) 32(2):110–23. doi: 10.1016/j.tcb.2021.08.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Berish RB, Ali AN, Telmer PG, Ronald JA, Leong HS. Modelos traslacionales de metástasis óseas de cáncer de próstata. Nat Rev Urol. (2018) 15(7):403–21. DOI: 10.1038/S41585-018-0020-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Liang H, Zhou L, Hu Z, Ge Y, Zhang T, Chen Q, et al. Bloqueo del punto de control Siglec15 para la inmunoquimioterapia simultánea y la inhibición de la osteólisis en metástasis espinales de adenocarcinoma de pulmón a través de una nanoplataforma hueca. Pequeño Weinh Bergstr Ger (2022) 18(29):e2107787. doi: 10.1002/smll.202107787
9. Wang K, Jiang L, Hu A, Sun C, Zhou L, Huang Y, et al. La activación vertebral específica de la red de señalización CX3CL1/ICAM-1 media la metástasis espinal del cáncer de pulmón de células no pequeñas mediante la participación en las interacciones entre las células tumorales y las células endoteliales de la médula ósea vertebral. Teranósticos (2021) 11(10):4770–89. doi: 10.7150/thno.54235
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Haq M, Goltzman D, Tremblay G, Brodt P. Las células de adenocarcinoma de próstata de rata se diseminan al hueso y se adhieren preferentemente a las células endoteliales derivadas de la médula ósea. Cancer Res (1992) 52(17):4613–9. DOI: 10.1038/S41467-022-30105-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Yin X, Teng X, Ma T, Yang T, Zhang J, Huo M, et al. RUNX2 recluta el complejo NuRD (MTA1) / CRL4B para promover la progresión del cáncer de mama y la metástasis ósea. Cell Death Differ (2022) 29(11):2203–17. DOI: 10.1038/S41418-022-01010-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Zuo H, Yang D, Wan Y. Fam20C regulates bone resorption and breast cancer bone metastasis through osteopontin and BMP4. Cancer Res (2021) 81(20):5242–54. doi: 10.1158/0008-5472.CAN-20-3328
13. Brylka L, Jähn-Rickert K, Baranowsky A, Neven M, Horn M, Yorgan T, et al. Spine metastases in immunocompromised mice after intracardiac injection of MDA-MB-231-SCP2 breast cancer cells. Cancers (2022) 14(3):556. doi: 10.3390/cancers14030556
14. Devignes CS, Aslan Y, Brenot A, Devillers A, Schepers K, Fabre S, et al. HIF signaling in osteoblast-lineage cells promotes systemic breast cancer growth and metastasis in mice. Proc Natl Acad Sci USA (2018) 115(5):E992–1001. doi: 10.1073/pnas.1718009115
15. Zheng H, Bae Y, Kasimir-Bauer S, Tang R, Chen J, Ren G, et al. Therapeutic antibody targeting tumor- and osteoblastic niche-derived Jagged1 sensitizes bone metastasis to chemotherapy. Cancer Cell (2017) 32(6):731–747.e6. doi: 10.1016/j.ccell.2017.11.002
16. Ouarné M, Bouvard C, Boneva G, Mallet C, Ribeiro J, Desroches-Castan A, et al. BMP9, but not BMP10, acts as a quiescence factor on tumor growth, vessel normalization and metastasis in a mouse model of breast cancer. J Exp Clin Cancer Res CR. (2018) 37:209. doi: 10.1186/s13046-018-0885-1
17. Mercatali L, La Manna F, Groenewoud A, Casadei R, Recine F, Miserocchi G, et al. Development of a patient-derived xenograft (PDX) of breast cancer bone metastasis in a zebrafish model. Int J Mol Sci (2016) 17(8):1375. doi: 10.3390/ijms17081375
18. Kerschnitzki M, Wagermaier W, Roschger P, Seto J, Shahar R, Duda GN, et al. The organization of the osteocyte network mirrors the extracellular matrix orientation in bone. J Struct Biol (2011) 173(2):303–11. doi: 10.1016/j.jsb.2010.11.014
19. Kang J, La Manna F, Bonollo F, Sampson N, Alberts IL, Mingels C, et al. Tumor microenvironment mechanisms and bone metastatic disease progression of prostate cancer. Cancer Lett (2022) 530:156–69. doi: 10.1016/j.canlet.2022.01.015
20. Gingrich JR, Barrios RJ, Morton RA, Boyce BF, DeMayo FJ, Finegold MJ, et al. Metastatic prostate cancer in a transgenic mouse. Cancer Res (1996) 56(18):4096–102.
21. Ganguly SS, Hostetter G, Tang L, Frank SB, Saboda K, Mehra R, et al. Notch3 promotes prostate cancer-induced bone lesion development via MMP-3. Oncogene (2020) 39(1):204–18. doi: 10.1038/s41388-019-0977-1
22. Polavaram NS, Dutta S, Islam R, Bag AK, Roy S, Poitz D, et al. Tumor- and osteoclast-derived NRP2 in prostate cancer bone metastases. Bone Res (2021) 9(1):24. doi: 10.1038/s41413-021-00136-2
23. Landgraf M, Lahr CA, Sanchez-Herrero A, Meinert C, Shokoohmand A, Pollock PM, et al. Humanized bone facilitates prostate cancer metastasis and recapitulates therapeutic effects of zoledronic acid in vivo. Bone Res (2019) 7:31. doi: 10.1038/s41413-019-0072-9
24. Hu CY, Chen J, Qin XH, You P, Ma J, Zhang J, et al. Long non-coding RNA NORAD promotes the prostate cancer cell extracellular vesicle release via microRNA-541-3p-regulated PKM2 to induce bone metastasis of prostate cancer. J Exp Clin Cancer Res CR. (2021) 40(1):98. doi: 10.1186/s13046-021-01891-0
25. Li L, Ameri AH, Wang S, Jansson KH, Casey OM, Yang Q, et al. EGR1 regulates angiogenic and osteoclastogenic factors in prostate cancer and promotes metastasis. Oncogene (2019) 38(35):6241–55. doi: 10.1038/s41388-019-0873-8
26. Luo A, Xu Y, Li S, Bao J, Lü J, Ding N, et al. Cancer stem cell property and gene signature in bone-metastatic breast cancer cells. Int J Biol Sci (2020) 16(14):2580–94. doi: 10.7150/ijbs.45693
27. Jenkins DE, Hornig YS, Oei Y, Dusich J, Purchio T. Bioluminescent human breast cancer cell lines that permit rapid and sensitive in vivo detection of mammary tumors and multiple metastases in immune deficient mice. Breast Cancer Res BCR (2005) 7(4):R444–454. doi: 10.1186/bcr1026
28. Sawada Y, Kikugawa T, Iio H, Sakakibara I, Yoshida S, Ikedo A, et al. GPRC5A facilitates cell proliferation through cell cycle regulation and correlates with bone metastasis in prostate cancer. Int J Cancer (2020) 146(5):1369–82. doi: 10.1002/ijc.32554
29. Sohn HM, Kim B, Park M, Ko YJ, Moon YH, Sun JM, et al. Effect of CD133 overexpression on bone metastasis in prostate cancer cell line LNCaP. Oncol Lett (2019) 18(2):1189–98. doi: 10.3892/ol.2019.10443
30. Sung NJ, Kim NH, Surh YJ, Park SA. Gremlin-1 promotes metastasis of breast cancer cells by activating STAT3-MMP13 signaling pathway. Int J Mol Sci (2020) 21(23):9227. doi: 10.3390/ijms21239227
31. Marino S, de Ridder D, Bishop RT, Renema N, Ponzetti M, Sophocleous A, et al. Paradoxical effects of JZL184, an inhibitor of monoacylglycerol lipase, on bone remodelling in healthy and cancer-bearing mice. EBioMedicine (2019) 44:452–66. doi: 10.1016/j.ebiom.2019.05.048
32. Zhang Z, Xu Q, Song C, Mi B, Zhang H, Kang H, et al. Serum- and glucocorticoid-inducible kinase 1 is essential for osteoclastogenesis and promotes breast cancer bone metastasis. Mol Cancer Ther (2020) 19(2):650–60. doi: 10.1158/1535-7163.MCT-18-0783
33. Kim B, Kim H, Jung S, Moon A, Noh DY, Lee ZH, et al. A CTGF-RUNX2-RANKL axis in breast and prostate cancer cells promotes tumor progression in bone. J Bone Miner Res (2020) 35(1):155–66. doi: 10.1002/jbmr.3869
34. Drescher F, Juárez P, Arellano DL, Serafín-Higuera N, Olvera-Rodriguez F, Jiménez S, et al. TIE2 induces breast cancer cell dormancy and inhibits the development of osteolytic bone metastases. Cancers (2020) 12(4):868. doi: 10.3390/cancers12040868
35. Chen M, Zou S, He C, Zhou J, Li S, Shen M, et al. Transactivation of SOX5 by brachyury promotes breast cancer bone metastasis. Carcinogenesis (2020) 41(5):551–60. doi: 10.1093/carcin/bgz142
36. Zhao C, Cai X, Wang Y, Wang D, Wang T, Gong H, et al. NAT1 promotes osteolytic metastasis in luminal breast cancer by regulating the bone metastatic niche via NF-κB/IL-1B signaling pathway. Am J Cancer Res (2020) 10(8):2464–79.
37. Eckhardt BL, Cao Y, Redfern AD, Chi LH, Burrows AD, Roslan S, et al. La activación de la señalización canónica BMP4-SMAD7 suprime la metástasis del cáncer de mama. Cancer Res (2020) 80(6):1304–15. doi: 10.1158/0008-5472.CAN-19-0743
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Zhang D, Iwabuchi S, Baba T, Hashimoto S, Mukaida N, Sasaki S. Involvement of a transcription factor, Nfe2, in breast cancer metastasis to bone. Cánceres (2020) 12(10):3003. DOI: 10.3390/cánceres12103003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Sasaki S, Zhang D, Iwabuchi S, Tanabe Y, Hashimoto S, Yamauchi A, et al. Contribución crucial de GPR56/ADGRG1, expresada por las células de cáncer de mama, a la formación de metástasis óseas. Cancer Sci (2021) 112(12):4883–93. doi: 10.1111/cas.15150
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Sun J, Huang J, Lan J, Zhou K, Gao Y, Song Z, et al. La sobreexpresión de CENPF se correlaciona con un mal pronóstico y metástasis ósea tumoral en el cáncer de mama. Cancer Cell Int (2019) 19:264. DOI: 10.1186/S12935-019-0986-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Connelly ZM, Jin R, Zhang J, Yang S, Cheng S, Shi M, et al. FOXA2 promueve el crecimiento del cáncer de próstata en el hueso. Am J Transl Res (2020) 12(9):5619–29. doi: 10.1038/s41413-021-00178-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. Aoki Y, Masaki N, Tome Y, Kubota Y, Aoki Y, Bouvet M, et al. Modelo experimental de ratón con metástasis ósea de implantación de fragmento de tibia con imágenes no invasivas de cáncer de próstata que expresa GFP. Vivo Atenas Grecia (2022) 36(4):1647–50. doi: 10.21873/invivo.12876
43. Shin SH, Kim I, Lee JE, Lee M, Park JW. La pérdida de EGR3 es un factor de riesgo independiente para la progresión metastásica en el cáncer de próstata. Oncogén (2020) 39(36):5839–54. DOI: 10.1038/S41388-020-01418-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Huang S, Wa Q, Pan J, Peng X, Ren D, Li Q, et al. La regulación transcripcional a la baja de miR-133b por REST promueve la metástasis del cáncer de próstata al hueso a través de la activación de la señalización de TGF-β. Cell Death Dis (2018) 9(7):779. DOI: 10.1038/S41419-018-0807-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Meng X, Vander Ark A, Daft P, Woodford E, Wang J, Madaj Z, et al. La pérdida de la señalización de TGF-β en los osteoblastos aumenta el FGF básico y promueve la metástasis ósea del cáncer de próstata. Cancer Lett (2018) 418:109–18. doi: 10.1016/j.canlet.2018.01.018
Resumen de PubMed | Texto completo de CrossRef | Google Académico
46. Li Q, Wang M, Hu Y, Zhao E, Li J, Ren L, et al. MYBL2 interrumpe la vía hipopótamo-YAP y confiere resistencia a la castración y potencial metastásico en el cáncer de próstata. Teranósticos (2021) 11(12):5794–812. doi: 10.7150/thno.56604
Resumen de PubMed | Texto completo de CrossRef | Google Académico
47. Zhao Z, Li E, Luo L, Zhao S, Liu L, Wang J, et al. Un eje PSCA/PGRN-NF-κB-Integrina-α4 promueve la adhesión de las células del cáncer de próstata al endotelio de la médula ósea y mejora el potencial metastásico. Mol Cancer Res MCR (2020) 18(3):501–13. doi: 10.1158/1541-7786.MCR-19-0278
48. Thulin MH, Määttä J, Linder A, Sterbova S, Ohlsson C, Damber JE, et al. La inhibición de STAT3 previene la progresión metástasica ósea del cáncer de próstata in vivo. Próstata (2021) 81(8):452–62. doi: 10.1002/pros.24125
Resumen de PubMed | Texto completo de CrossRef | Google Académico
49. Siddiqui JA, Seshacharyulu P, Muniyan S, Pothuraju R, Khan P, Vengoji R, et al. GDF15 promueve la metástasis ósea del cáncer de próstata y la colonización a través de la activación osteoblástica de CCL2 y RANKL. Bone Res (2022) 10(1):6. doi: 10.1038/s41413-021-00178-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
50. Zhang B, Li Y, Wu Q, Xie L, Barwick B, Fu C, et al. La acetilación de KLF5 mantiene la EMT y la tumorigenicidad para causar metástasis óseas quimiorresistentes en el cáncer de próstata. Nat Commun (2021) 12(1):1714. DOI: 10.1038/S41467-021-21976-W
Resumen de PubMed | Texto completo de CrossRef | Google Académico
51. Farhoodi HP, Segaliny AI, Wagoner ZW, Cheng JL, Liu L, Zhao W. Optimización de un modelo murino singénico de metástasis ósea. J Bone Oncol (2020) 23:100298. doi: 10.1016/j.jbo.2020.100298
Resumen de PubMed | Texto completo de CrossRef | Google Académico
52. Wang L, Song L, Li J, Wang Y, Yang C, Kou X, et al. El eje de integrina sialoproteína-αvβ3 ósea promueve la metástasis del cáncer de mama en el hueso. Cancer Sci (2019) 110(10):3157–72. DOI: 10.1111/CAS.14172
Resumen de PubMed | Texto completo de CrossRef | Google Académico
53. Wetterwald A, van der Pluijm G, Que I, Sijmons B, Buijs J, Karperien M, et al. Imágenes ópticas de metástasis de cáncer a médula ósea: un modelo de ratón de enfermedad residual mínima. Am J Pathol (2002) 160(3):1143–53. doi: 10.1016/S0002-9440(10)64934-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
54. Nutter F, Holen I, Brown HK, Cross SS, Evans CA, Walker M, et al. Diferentes perfiles moleculares se asocian con la localización de células de cáncer de mama en comparación con la colonización del hueso: evidencia utilizando una nueva línea celular de búsqueda de hueso. Endocr Relat Cancer (2014) 21(2):327–41. doi: 10.1530/ERC-13-0158
Resumen de PubMed | Texto completo de CrossRef | Google Académico
55. Yin L, Li Q, Mrdenovic S, Chu GCY, Wu BJ, Bu H, et al. KRT13 promueve el tallo e impulsa la metástasis en el cáncer de mama a través de una vía de señalización plakoglobina / c-myc. Cáncer de mama Res BCR (2022) 24(1):7. DOI: 10.1186/S13058-022-01502-6
56. Han Y, Azuma K, Watanabe S, Semba K, Nakayama J. Metastatic profiling of HER2-positive breast cancer cell lines in xenograft models. Clin Exp Metastasis (2022) 39(3):467–77. DOI: 10.1007/S10585-022-10150-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
57. Liepe K, Geidel H, Haase M, Hakenberg OW, Runge R, Kotzerke J. Nuevo modelo para la inducción de metástasis óseas osteoblásticas. Anticancer Res (2005) 25(2A):1067–73.
58. Blouin S, Baslé MF, Chappard D. Rat models of bone metastases. Clin Exp Metastasis (2005) 22(8):605–14. DOI: 10.1007/S10585-006-9002-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
59. Lamoureux F, Ory B, Battaglia S, Pilet P, Heymann MF, Gouin F, et al. Relevancia de un nuevo modelo de rata de metástasis osteoblásticas de carcinoma de próstata para estudios preclínicos con ácido zoledrónico. Int J Cancer (2008) 122(4):751–60. doi: 10.1002/ijc.23187
Resumen de PubMed | Texto completo de CrossRef | Google Académico
60. Power CA, Pwint H, Chan J, Cho J, Yu Y, Walsh W, et al. Un nuevo modelo de cáncer de próstata metastásico óseo en ratones inmunocompetentes. Próstata (2009) 69(15):1613–23. doi: 10.1002/pros.21010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
61. Wang W, Yang X, Dai J, Lu Y, Zhang J, Keller ET. El cáncer de próstata promueve un círculo vicioso de progresión de la metástasis ósea a través de la inducción de osteocitos para secretar GDF15 que estimula el crecimiento y la invasión del cáncer de próstata. Oncogén (2019) 38(23):4540–59. DOI: 10.1038/S41388-019-0736-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
62. Lang C, Dai Y, Wu Z, Yang Q, He S, Zhang X, et al. SMAD3/SP1 complex-mediated constitutive active loop between lncRNA PCAT7 and TGF-β signaling promote prostate cancer bone metastasis. Mol Oncol (2020) 14(4):808–28. doi: 10.1002/1878-0261.12634
Resumen de PubMed | Texto completo de CrossRef | Google Académico
63. Lee JH, Kim B, Jin WJ, Kim JW, Kim HH, Ha H, et al. Trolox inhibe la metástasis ósea osteolítica del cáncer de mama a través de mecanismos independientes y dependientes de PGE2. Biochem Pharmacol (2014) 91(1):51–60. doi: 10.1016/j.bcp.2014.06.005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
64. Spadazzi C, Mercatali L, Esposito M, Wei Y, Liverani C, De Vita A, et al. La regulación positiva del factor de trébol-1 en el cáncer de mama con receptores de estrógeno positivos se correlaciona con un mayor riesgo de metástasis ósea. Hueso (2021) 144:115775. doi: 10.1016/j.bone.2020.115775
Resumen de PubMed | Texto completo de CrossRef | Google Académico
65. Peiffer LB, Hicks J, Sosa RY, De Marzo AM, Sfanos KS, Maynard JP. Modelado de metástasis de cáncer de próstata humano en ratones mediante resección de aloinjertos subcutáneos. Frente Oncol (2022) 12:877536. doi: 10.3389/fonc.2022.877536
Resumen de PubMed | Texto completo de CrossRef | Google Académico
66. Yip RKH, Rimes JS, Capaldo BD, Vaillant F, Mouchemore KA, Pal B, et al. Las células tumorales mamarias remodelan el microambiente vascular de la médula ósea para apoyar la metástasis. Nat Commun (2021) 12(1):6920. DOI: 10.1038/S41467-021-26556-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
67. Chang J, Sun X, Ma X, Zhao P, Shi B, Wang Y, et al. Inyección intracardíaca de células de cáncer de próstata humano para crear un modelo de ratón xenoinjerto de metástasis ósea. J Vis Exp JoVE (2022) 189). DOI: 10.3791/64589
68. Chen M, Wu C, Fu Z, Liu S. ICAM1 promueve la metástasis ósea a través de la señalización TGF-β/EMT mediada por integrina en el cáncer de mama triple negativo. Cancer Sci (2022) 113(11):3751–65. doi: 10.1111/cas.15532
Resumen de PubMed | Texto completo de CrossRef | Google Académico
69. Labanca E, Yang J, Shepherd PDA, Wan X, Starbuck MW, Guerra LD, et al. El receptor 1 del factor de crecimiento de fibroblastos impulsa la progresión metastásica del cáncer de próstata. Eur Urol Oncol (2022) 5(2):164–75. doi: 10.1016/j.euo.2021.10.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
70. Capietto AH, Lee S, Clever D, Eul E, Ellis H, Ma CX, et al. El tratamiento eficaz de las metástasis óseas establecidas se puede lograr mediante el bloqueo combinado de osteoclastos y el agotamiento de los subconjuntos granulocíticos. Cancer Immunol Res (2021) 9(12):1400–12. doi: 10.1158/2326-6066.CIR-21-0232
Resumen de PubMed | Texto completo de CrossRef | Google Académico
71. Engelmann J, Zarrer J, Gensch V, Riecken K, Berenbrok N, Luu TV, et al. Regulación de la homeostasis ósea por MERTK y TYRO3. Nat Commun (2022) 13(1):7689. DOI: 10.1038/S41467-022-33938-X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
72. Boudreau MW, Duraki D, Wang L, Mao C, Kim JE, Henn MA, et al. Un activador de moléculas pequeñas de la respuesta de proteína desplegada erradica los tumores de mama humanos en ratones. Sci Transl Med (2021) 13(603):eabf1383. doi: 10.1126/scitranslmed.abf1383
Resumen de PubMed | Texto completo de CrossRef | Google Académico
73. Bibby MC. Modelos ortotópicos de cáncer para la evaluación preclínica de medicamentos: ventajas y desventajas. Eur J Cancer Oxf Engl 1990 (2004) 40(6):852–7. DOI: 10.1186/S13046-018-0813-4
74. Kuchimaru T, Kataoka N, Nakagawa K, Isozaki T, Miyabara H, Minegishi M, et al. Un modelo murino confiable de metástasis ósea mediante la inyección de células cancerosas a través de las arterias caudales. Nat Commun (2018) 9:2981. DOI: 10.1038/S41467-018-05366-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
75. Hamaidi I, Coquard C, Danilin S, Dormoy V, Béraud C, Rothhut S, et al. El oncogén Lim1 como nueva diana terapéutica para el carcinoma metastásico de células renales humanas. Oncogén (2019) 38(1):60–72. DOI: 10.1038/S41388-018-0413-Y
Resumen de PubMed | Texto completo de CrossRef | Google Académico
76. Stocking KL, Jones JC, Everds NE, Buetow BS, Roudier MP, Miller RE. Uso de heparina de bajo peso molecular para disminuir la mortalidad en ratones después de la inyección intracardíaca de células tumorales. Comp Med (2009) 59(1):37–45.
77. Robinson BD, Sica GL, Liu YF, Rohan TE, Gertler FB, Condeelis JS, et al. Microambiente tumoral de metástasis en carcinoma de mama humano: un marcador pronóstico potencial relacionado con la diseminación hematógena. Clin Cancer Res Off J Am Assoc Cancer Res (2009) 15(7):2433–41. doi: 10.1158/1078-0432.CCR-08-2179
78. Coleman RE, Gregory W, Marshall H, Wilson C, Holen I. El microambiente metastásico del cáncer de mama: implicaciones clínicas. Breast Edinb Scotl (2013) 22 Suppl 2:S50–56. doi: 10.1016/j.breast.2013.07.010
79. Halpern J, Lynch CC, Fleming J, Hamming D, Martin MD, Schwartz HS, et al. La aplicación de un biorreactor óseo murino como modelo de tumor: interacción ósea. Clin Exp Metastasis (2006) 23(7–8):345–56. DOI: 10.1007/S10585-006-9044-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
80. Zhu W, Sheng D, Shao Y, Zhang Q, Peng Y. El péptido relacionado con el gen de la calcitonina neuronal promueve el crecimiento del tumor de próstata en el microambiente óseo. Péptidos (2021) 135:170423. doi: 10.1016/j.peptides.2020.170423
Resumen de PubMed | Texto completo de CrossRef | Google Académico
81. Zheng Y, Seibel MJ, Zhou H. Métodos en biología ósea: cáncer y hueso. En: Duque G, Watanabe K, editores. Osteoporosis Res: Modelos animales. Londres: Springer London (2011). págs. 83–91. DOI: 10.1007/978-0-85729-293-3_7
82. Holzapfel BM, Thibaudeau L, Hesami P, Taubenberger A, Holzapfel NP, Mayer-Wagner S, et al. Modelos humanizados de xenoinjerto de metástasis ósea revisados: nuevos conocimientos sobre los mecanismos específicos de la especie del osteotropismo de células cancerosas. Cancer Metastasis Rev (2013) 32(1–2):129–45. DOI: 10.1007/S10555-013-9437-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
83. Lin D, Xue H, Wang Y, Wu R, Watahiki A, Dong X, et al. Modelos de xenoinjerto de cáncer de próstata derivados de pacientes de próxima generación. Asiático J Androl. (2014) 16(3):407–12. doi: 10.4103/1008-682X.125394
Resumen de PubMed | Texto completo de CrossRef | Google Académico
84. Oliemuller E, Newman R, Tsang SM, Foo S, Muirhead G, Noor F, et al. SOX11 promueve el estado híbrido epitelial/mesenquimal y altera el tropismo de las células invasivas de cáncer de mama. eLife (2020) 9. doi: 10.7554/eLife.58374
Resumen de PubMed | Texto completo de CrossRef | Google Académico
85. Arriaga JM, Panja S, Alshalalfa M, Zhao J, Zou M, Giacobbe A, et al. Una firma de coactivación de MYC y RAS en el cáncer de próstata localizado impulsa la metástasis ósea y la resistencia a la castración. Nat Cancer (2020) 11):1082–96. DOI: 10.1038/S43018-020-00125-0
86. Hinz N, Baranowsky A, Horn M, Kriegs M, Sibbertsen F, Smit DJ, et al. La eliminación de AKT3 activa las quinasas HER2 y DDR en células de cáncer de mama que buscan hueso, promueve la metástasis in vivo y atenúa el eje TGFβ / CTGF. Celdas (2021) 10(2):430. doi: 10.3390/cells10020430
Resumen de PubMed | Texto completo de CrossRef | Google Académico
87. Abudourousuli A, Chen S, Hu Y, Qian W, Liao X, Xu Y, et al. NKX2-8/PTHrP axis-mediated osteoclastogenesis and bone metastasis in breast cancer. Frente Oncol (2022) 12:907000. doi: 10.3389/fonc.2022.907000
Resumen de PubMed | Texto completo de CrossRef | Google Académico
88. Maimon A, Levi-Yahid V, Ben-Meir K, Halpern A, Talmi Z, Priya S, et al. PROS1 derivado de células mieloides inhibe la metástasis tumoral mediante la regulación de las respuestas inflamatorias e inmunes a través de IL-10. J Clin Invest (2021) 131(10):e126089. doi: 10.1172/JCI126089
Resumen de PubMed | Texto completo de CrossRef | Google Académico
89. Cai WL, Huang WD, Li B, Chen TR, Li ZX, Zhao CL, et al. microRNA-124 inhibe la metástasis ósea del cáncer de mama mediante la represión de la interleucina-11. Mol Cancer (2018) 17(1):9. DOI: 10.1186/S12943-017-0746-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
90. He Y, Luo W, Liu Y, Wang Y, Ma C, Wu Q, et al. IL-20RB media la respuesta tumoral a nichos osteoclásticos y promueve la metástasis ósea del cáncer de pulmón. J Clin Invest (2022) 132(20):e157917. doi: 10.1172/JCI157917
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Cita: Yu Y, Li K, Peng Y, Wu W, Chen F, Shao Z y Zhang Z (2023) Modelos animales de metástasis de cáncer al hueso. Frente. Oncol. 13:1165380. doi: 10.3389/fonc.2023.1165380
Recibido: 14 de febrero de 2023; Aprobado: 10 de marzo de 2023;
Publicado: 05 abril 2023.
Editado por:
Wenwen Zhang, Universidad Médica de Nanjing, China
Revisado por:
Qiuyu Liu, Hospital Popular Provincial de Henan, China Yanping Yang, Universidad de Medicina Tradicional China de Shanghai, China
Derechos de autor © 2023 Yu, Li, Peng, Wu, Chen, Shao y Zhang. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Fengxia Chen, fengxiachen@whu.edu.cn; Zengwu Shao, 1985XH0536@hust.edu.cn; Zhicai Zhang, zhicaizhang@126.com
†Estos autores han contribuido igualmente a este trabajo
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía