Exploración de los mecanismos protectores de la icariina contra el daño celular renal inducido por cisplatino en caninos
Exploración de los mecanismos protectores de la icariina contra el daño celular renal inducido por cisplatino en caninos
 Jiayi Liu1*
Jiayi Liu1*  Liuwei Xie1
Liuwei Xie1  He Zhai1
He Zhai1  Dongwei Wang1
Dongwei Wang1  Xiao Li2
Xiao Li2  Yao Wang1
Yao Wang1  Canción de Mingqiang1
Canción de Mingqiang1  Chao Xu2
Chao Xu2- 1Colegio de Tecnología de Perros Policía de Investigación Criminal Universidad de China, Shenyang, China
- 2Instituto de Animales y Plantas Económicas Silvestres Especiales, Academia China de Ciencias Agrícolas, Changchun, China
Este estudio profundiza en los mecanismos protectores de la icariina (ICA) contra el daño inducido por cisplatino en las células del riñón canino de Madin-Darby (MDCK). Con dos fases distintas, la investigación empleó inicialmente un diseño aleatorizado de un solo factor para determinar la concentración mínima de cisplatino que provoca daño celular MDCK, abarcando concentraciones de 0 a 16 mmol/L. Al mismo tiempo, se combinaron varias concentraciones de ICA (que oscilaban entre 5 y 50 mmol/L) con cisplatino de 1 mmol/L para determinar la concentración de tratamiento más eficaz. Las investigaciones posteriores utilizaron cuatro grupos de tratamiento: control, 1 mmol/L de cisplatino, 1 mmol/L de cisplatino + 20 mmol/L de ACI y 1 mmol/L de cisplatino + 25 mmol/L de ACI, con el objetivo de dilucidar los mecanismos de protección de la ACI. Los hallazgos de la fase inicial subrayaron una reducción significativa en la viabilidad de las células MDCK con cisplatino de 1 mmol/L en comparación con el control (P < 0,01). En particular, la inclusión de 20 y 25 mmol/L de ICA mejoró sustancialmente la viabilidad de las células MDCK bajo 1 mmol/L de cisplatino (P < 0,01). Además, la administración de cisplatino indujo una elevación de los factores inflamatorios, el malondialdehído (MDA), las especies reactivas de oxígeno (ROS) y los niveles de proteína Bax, al tiempo que suprimió simultáneamente la expresión de superóxido dismutasa (SOD), catalasa (CAT) y Bcl-2 (P < 0,01). Por el contrario, la suplementación de 20 y 25 mmol/L ICA demostró un marcado aumento en el potencial de membrana mitocondrial y en los niveles de SOD, CAT y Bcl-2 (P < 0,01). Estas intervenciones atenuaron eficazmente las respuestas inflamatorias y suprimieron la expresión de la proteína Bax (P < 0,05), mitigando así la apoptosis inducida por cisplatino en las células MDCK (P < 0,01). En resumen, estos hallazgos aclaran el papel de la ICA en la prevención de la apoptosis en las células MDCK inducidas por cisplatino mediante la regulación de las respuestas inflamatorias, el estrés oxidativo y la expresión de proteínas autofágicas.
1 Introducción
El cisplatino es un agente quimioterapéutico ampliamente utilizado para el tratamiento de diversos tipos de cáncer y sarcomas. Su principal modo de acción implica la formación de enlaces cruzados entre las bases de purina dentro del ADN, lo que interrumpe los mecanismos de reparación del ADN en las células malignas, lo que en última instancia resulta en daño del ADN y una mayor apoptosis celular (1). Sin embargo, la quimioterapia con cisplatino y sus derivados puede provocar efectos secundarios potentes, en particular la inflamación, el estrés oxidativo y la fibrosis en las células tubulares renales, lo que en última instancia conduce a una lesión renal aguda e incluso a una insuficiencia renal (2-4). Por lo tanto, es de suma importancia buscar un componente medicinal natural para mitigar el daño celular renal inducido por cisplatino. La icariina (ICA), el principal compuesto bioactivo derivado de la hierba medicinal Epimedium, se ha utilizado ampliamente en el tratamiento terapéutico de trastornos sistémicos, como la nefritis lúpica, la enfermedad inflamatoria intestinal, la artritis reumatoide y el cáncer (5, 6). La investigación de Xie et al. (7) ha demostrado que la ACI presenta un potencial para mitigar la mortalidad y la lesión renal aguda en ratones con sepsis inducida por ligadura cecal y punción. Este efecto se consigue a través de la inhibición del daño oxidativo renal, las respuestas inflamatorias, la apoptosis celular, así como la mejora de la permeabilidad vascular. Además, las investigaciones han revelado las propiedades antifibróticas de la ICA, que se atribuyen a su capacidad para suprimir la activación de los fibroblastos renales a través de la inhibición de las vías de señalización asociadas con las citoquinas inflamatorias IL-1β/TGF-β (8). Además, altas dosis de ICA han mostrado una mejora significativa en la fibrosis, la dinámica mitocondrial y la función mitocondrial en un modelo de rata de insuficiencia renal crónica (IRC) (9). Sin embargo, existe una bibliografía limitada sobre el potencial de la ICA para aliviar el daño de las células renales inducido por la quimioterapia con cisplatino. Por lo tanto, este estudio utiliza el daño inducido por cisplatino en las células del riñón canino de Madin-Darby (MDCK) como modelo para investigar cómo la ICA puede aliviar el estrés oxidativo y mejorar la actividad mitocondrial para mitigar el daño celular inducido por el cisplatino. Esta exploración busca identificar los complementos naturales del tratamiento con cisplatino, ofreciendo nuevos conocimientos sobre la reducción clínica de la toxicidad renal inducida por cisplatino.
2 Materiales y métodos
2.1 Productos químicos y reactivos
Las células renales caninas de Madin-Darby (MDCK, Procell CL-0154) se obtuvieron de Wuhan Procell Life Science and Technology Co., Ltd. Icariin (pureza ≥ 99%) se compró a Chengdu Mansite Biotechnology Co., Ltd. (A0049). El medio de cultivo DMEM (LV-DMEM001) y el suero fetal bovino (WS500T) se adquirieron de Liver Biotechnology (Shenzhen) Co., Ltd. El cisplatino (479306-1G) se compró a Sigma-Aldrich en los Estados Unidos. El kit de apoptosis de células PI/Anexina V (P-CA-201) se obtuvo de BD Biosciences en los Estados Unidos. Se compraron kits de ensayo de malondialdehído (MDA, ml095226), catalasa (CAT, ml095270) y superóxido dismutasa (SOD, ml103496) de Shanghai Enzyme-linked Biotechnology Co., Ltd. El factor de necrosis tumoral α (TNF-α, E-EL-H0109c), la interleucina-6 (IL-6, E-EL-H6165) y la interleucina-1β (IL-1β, E-EL-H0149c) se adquirieron de Jiangsu Zhengneng Biological Technology Co., Ltd.
2.2 Diseño experimental
2.2.1 Cribado de la citotoxicidad del cisplatino y de la concentración del tratamiento con icariina para las células MDCK
Este experimento se dividió en dos partes. En la primera parte, se utilizó un diseño completamente aleatorizado de un solo factor, con la adición de la concentración de cisplatino en medio de cultivo celular MDCK como variable única. Se establecieron siete concentraciones (0 mmol/L, 0,5 mmol/L, 1 mmol/L, 2 mmol/L, 4 mmol/L, 8 mmol/L, 16 mmol/L), cada una con 6 repeticiones, para determinar la concentración inhibitoria semimáxima (IC50) de cisplatino en la viabilidad de las células MDCK. Esta información se utilizó para seleccionar la concentración de modelado para este experimento. En la segunda parte, se utilizó nuevamente un diseño completamente aleatorizado de un solo factor, con la concentración de Icariina en medio de cultivo celular MDCK como variable única. Se establecieron siete concentraciones (0 mmol/L, 5 mmol/L, 10 mmol/L, 15 mmol/L, 20 mmol/L, 25 mmol/L, 50 mmol/L), cada una con 6 repeticiones, para detectar la concentración efectiva de Icariin en las células MDCK después del tratamiento con cisplatino.
2.2.2 Mecanismo del tratamiento con icariina para las células MDCK después de la inducción de cisplatino
Este experimento utilizó un diseño completamente aleatorizado de un solo factor. Se establecieron cuatro grupos de tratamiento: cultivo normal de células MDCK (grupo control), medio de cultivo que contenía 1 mmol/L de cisplatino y 0, 20, 25 mmol/L de Icariina. Cada grupo de tratamiento tuvo 6 repeticiones, con el objetivo de investigar el mecanismo del tratamiento con icariina en las células MDCK después de la inducción de cisplatino.
2.3 Cultivo celular
Las células MDCK se sembraron en medio de cultivo DMEM y se colocaron en una incubadora a 37 °C con 5% de CO2 durante 24 h. El medio se cambiaba cada 12 h. Cuando la densidad celular alcanzó ~90%, las células en la fase de crecimiento logarítmico fueron digeridas y contadas usando una placa de conteo. Acerca de 9 × 103 Las células se sembraron en cada pocillo de una placa de cultivo celular de 96 pocillos. Después de 24 h de incubación, cuando las células se adhirieron a los pocillos, se co-cultivaron con cisplatino a concentraciones de 0, 0.5, 1, 2, 4, 8 y 16 mmol/L durante 12 h. Esto se hizo para determinar la concentración de cisplatino que logra un efecto inhibidor medio máximo sobre la viabilidad de las células MDCK. Utilizando la concentración inhibitoria media máxima de cisplatino, se repitió el proceso de cultivo celular para obtener células MDCK con viabilidad deteriorada. A continuación, estas células se sometieron a cambios medios que contenían ICA a concentraciones de 5 mmol/L, 10 mmol/L, 15 mmol/L, 20 mmol/L, 25 mmol/L y 50 mmol/L. Se calcularon las tasas de supervivencia de las células MDCK en cada grupo.
2.4 Medidas
2.4.1 Ensayo de viabilidad celular
En el caso de las células en fase de crecimiento logarítmico tratadas con cisplatino o icariina, tal como se describe en la sección 2.2.1, se prepararon y contaron suspensiones celulares. Las suspensiones celulares (100 μL por pocillo) se sembraron en una placa de 96 pocillos. Después de la preincubación en una incubadora de cultivo celular (37 °C, 5 % de CO2) durante 24 h, se añadieron 10 μL de reactivo CCK-8 a cada pocillo. A continuación, la placa se devolvió a la incubadora durante 2 h más. La absorbancia (valor OD) a una longitud de onda de 450 nm se midió utilizando un lector de microplacas. El experimento se repitió tres veces, y el promedio de los resultados se tomó como resultado experimental final.
2.4.2 Tinción de Hoechst 33258
Las suspensiones celulares de cada tratamiento descrito en la sección 1.2.2 se fijaron con ácido acético-etanol. Se lavaron con 0,01 mol/L de PBS durante 5 min. Posteriormente, se utilizó la solución de trabajo Hoechst 33258 para la tinción, y las células se dejaron a temperatura ambiente durante 15 min. Después de la tinción, las células se lavaron con 0,01 mol/L de PBS tres veces, con una duración de 5 minutos en cada lavado. Finalmente, las células se sellaron con una mezcla de glicerol y PBS en una proporción de 1:9 o un medio de montaje soluble en agua, y se observaron bajo un microscopio de fluorescencia.
2.4.3 Detección del potencial de membrana mitocondrial
El medio de cultivo superior se aspiró de cada tratamiento descrito en la sección 1.2.2. A continuación, se añadió 1 ml de solución de trabajo de tinción JC-1 preparada a cada pocillo, se mezcló suavemente y se incubó en la oscuridad a 37 °C durante 20 min. Después de la incubación, las células se lavaron dos veces con tampón de tinción y luego se retiraron, se sellaron con un extintor antifluorescente y se observaron y fotografiaron bajo un microscopio de fluorescencia.
2.4.4 Análisis de citometría de flujo
Las células de cada grupo de tratamiento descrito en la sección 1.2.2 se recogieron con un raspador. Las células de cada pocillo se resuspendieron en 100 μL de tampón de unión, y se añadieron 5 μL de FITC-Anexina V y 5 μL de solución de trabajo PI a cada grupo. A continuación, las células se incubaron en la oscuridad durante 15 minutos a temperatura ambiente. Después de la incubación, las células se lavaron con tampón de unión, se centrifugaron para eliminar el sobrenadante y se resuspendieron en 400 μL de tampón de unión para el análisis de citometría de flujo.
2.4.5 Análisis de Western blot
Las células de cada grupo de tratamiento descrito en la sección 1.2.2 se lisaron en tampón de lisis RIPA sobre hielo. Después de la lisis, las muestras se centrifugaron a 3000 rpm durante 5 min. Se añadió la proteína apropiada al tampón y se hirvió, seguida de electroforesis en gel, transferencia de membrana y bloqueo con leche desnatada en polvo al 5% a 4 °C durante la noche. Luego, la membrana se incubó durante la noche con anticuerpos contra Keap1-Nrf2 (HY-151362), HO-1 (HY-P70276), BAX (HY-P0081) y BCL-2 (HY-P72101) de Med Chem Express LLC. Al día siguiente, se añadieron anticuerpos secundarios, incubados a temperatura ambiente durante 1,5 h, seguidos de lavado. Después del lavado, se añadieron anticuerpos secundarios, se incubaron a temperatura ambiente durante 1 h y se realizó la exposición a la LPE.
2.5 Análisis estadístico
La fórmula para calcular la viabilidad celular es la siguiente:
Ce l l V i a b i lity = (A s − Ab)/ (A c − Ab) × 100%Cell VYounbYolYoty = (Uns – Unb)/ (Unc – Unb) × 100%
en el que As es el valor de absorbancia del pocillo experimental (que contiene células, medio de cultivo y reactivo CCK-8); Ab es el valor de absorbancia del pocillo en blanco (que contiene medio de cultivo y reactivo CCK-8); Ac es el valor de absorbancia del pocillo de control (que contiene células, medio de cultivo y reactivo CCK-8).
Los datos se sometieron a análisis estadístico básico utilizando el módulo MEANS en SAS 9.4. En el Experimento 1, el módulo GLM realizó un análisis de varianza para la viabilidad de las células MDCK caninas bajo diferentes concentraciones de cisplatino y la viabilidad de las células dañadas bajo diferentes concentraciones de ICA. La prueba de comparación múltiple de Duncan identificó la concentración mínima de cisplatino que induce daño celular y la concentración óptima de tratamiento con ICA. En el Experimento 2, el módulo GLM analizó indicadores fisiológicos de células MDCK caninas bajo diversos tratamientos. La prueba de comparación múltiple de Duncan dilucidó el mecanismo del tratamiento con ICA sobre el daño celular. Se consideró un nivel de significancia de P < 0.05 y el software GraphPad Prism 8.0 generó gráficos estadísticos.
3 Análisis de resultados
3.1 Daño celular inducido por cisplatino y selección de la concentración óptima de tratamiento con icariina
Después de 48 h de cocultivo con un medio de cultivo que contenía 0, 0,5, 1, 2, 4, 8 o 16 mmol/L de cisplatino, se observó que la viabilidad de las células MDCK disminuyó significativamente con el aumento de la concentración de cisplatino (Figura 1A). Específicamente, cuando la concentración de cisplatino en el medio de cultivo alcanzó 1 mmol/L, la viabilidad de las células MDCK fue significativamente menor que la del grupo control en blanco (P < 0,01), y la viabilidad celular disminuyó al 55%, acercándose a la concentración semiinhibitoria. Sobre la base de estos resultados, las células MDCK se cocultivaron con un medio de cultivo que contenía 1 mmol/L de cisplatino además de 0, 5, 10, 15, 20, 25 o 50 mmol/L de Icariina durante 48 h. Se encontró que la viabilidad de las células MDCK en los grupos con 20, 25 y 50 mmol/L de Icariina añadida al medio de cultivo fue significativamente mayor que la del grupo control y los grupos con 5, 10 o 15 mmol/L de Icariina (P < 0,05) (Figura 1B). Entre estas concentraciones, 20 y 25 mmol/L de Icariina mostraron el efecto más significativo del tratamiento sobre la viabilidad de las células MDCK caninas. Por lo tanto, en este estudio, se seleccionó 1 mmol/L de concentración de cisplatino como concentración tóxica para las células MDCK, y 20 y 25 mmol/L de icariina como concentraciones de tratamiento para las células MDCK después de la exposición al cisplatino.
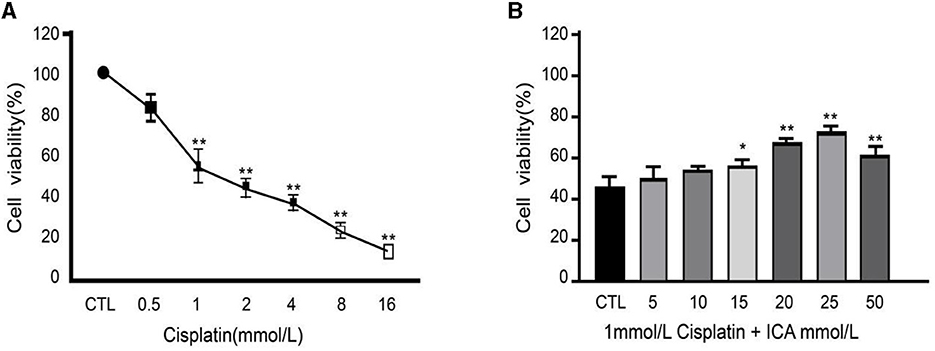 Figura 1. (A, B) Efecto de Epimedium sobre la eficacia terapéutica del daño inducido por cisplatino en las células MDCK caninas. Indica una diferencia significativa con P < 0,05; Indica una diferencia altamente significativa con P < 0,01.***
Figura 1. (A, B) Efecto de Epimedium sobre la eficacia terapéutica del daño inducido por cisplatino en las células MDCK caninas. Indica una diferencia significativa con P < 0,05; Indica una diferencia altamente significativa con P < 0,01.***
3.2 Efectos de la Icariina sobre las funciones antioxidantes y antiinflamatorias de las células MDCK inducidas por el cisplatino
Como se muestra en la Figura 2A, la actividad de SOD y CAT en células MDCK caninas tratadas con cisplatino (grupo MOD) fue significativamente menor que en el grupo control CTL (P < 0,01), mientras que el contenido de MDA fue significativamente mayor que en el grupo control (P < 0,01). En comparación con el grupo MOD, la adición de 20 y 25 mmol/L de icariina al medio de cultivo aumentó significativamente la actividad de SOD y CAT en células MDCK inducidas por cisplatino (P < 0,01) y disminuyó significativamente el contenido de MDA (P < 0,01). Esto indica que la icariina mejora eficazmente la función antioxidante de las células MDCK después de la inducción de cisplatino.
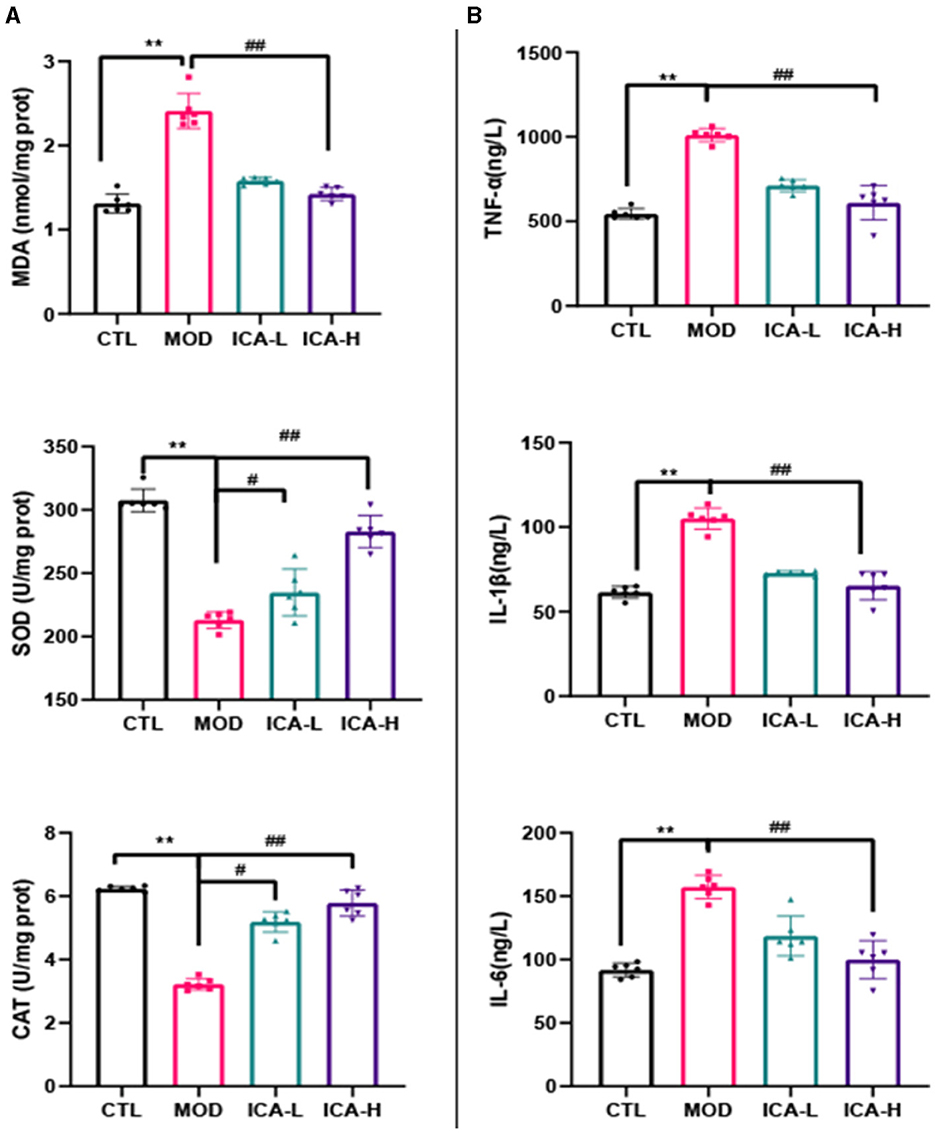 Figura 2. (A, B) Efecto de la icariina sobre las funciones antioxidantes y antiinflamatorias de las células MDCK después de la inducción de cisplatino. , Ambos indican diferencias significativas; , Ambos indican diferencias muy significativas.*#**##
Figura 2. (A, B) Efecto de la icariina sobre las funciones antioxidantes y antiinflamatorias de las células MDCK después de la inducción de cisplatino. , Ambos indican diferencias significativas; , Ambos indican diferencias muy significativas.*#**##
Como se muestra en la Figura 2B, el contenido de TNF-α, IL-1β e IL-6 en células MDCK caninas tratadas con cisplatino en el medio de cultivo (grupo MOD) fue significativamente mayor que en el grupo control CTL (P < 0,01). Sin embargo, en comparación con el grupo MOD, la adición de 20 y 25 mmol/L de icariina al medio de cultivo inhibió eficazmente la producción de TNF-α, IL-1β e IL-6 en células MDCK inducidas por cisplatino (P < 0,01). Esto indica que la icariina mejora eficazmente la capacidad antiinflamatoria de las células MDCK después de la inducción con cisplatino, y la eficacia de su acción depende de la dosis de icariina.
3.3 Efectos de la icariina sobre la expresión de proteínas de autofagia en células MDCK inducidas por cisplatino
Los resultados de inmunotransferencia de proteínas (Figura 3) muestran que la expresión de las proteínas Keap-1 y Bax en células MDCK caninas tratadas con cisplatino en el medio de cultivo (grupo MOD) fue mayor que en el grupo control CTL (P < 0,01). Por el contrario, la expresión de las proteínas Nrf-2, HO-1 y Bcl-2 mostró la tendencia opuesta (P < 0,01). En comparación con el grupo MOD, la adición de 20 y 25 mmol/L de icariina al medio de cultivo inhibió eficazmente la expresión de las proteínas Keap-1 y Bax en las células MDCK inducida por cisplatino (P < 0,01) y promovió la expresión de las proteínas Nrf-2, HO-1 y Bcl-2 (P < 0,01). Esto indica que la ICA puede mejorar significativamente la función de autofagia de las células MDCK caninas después de la inducción de cisplatino.
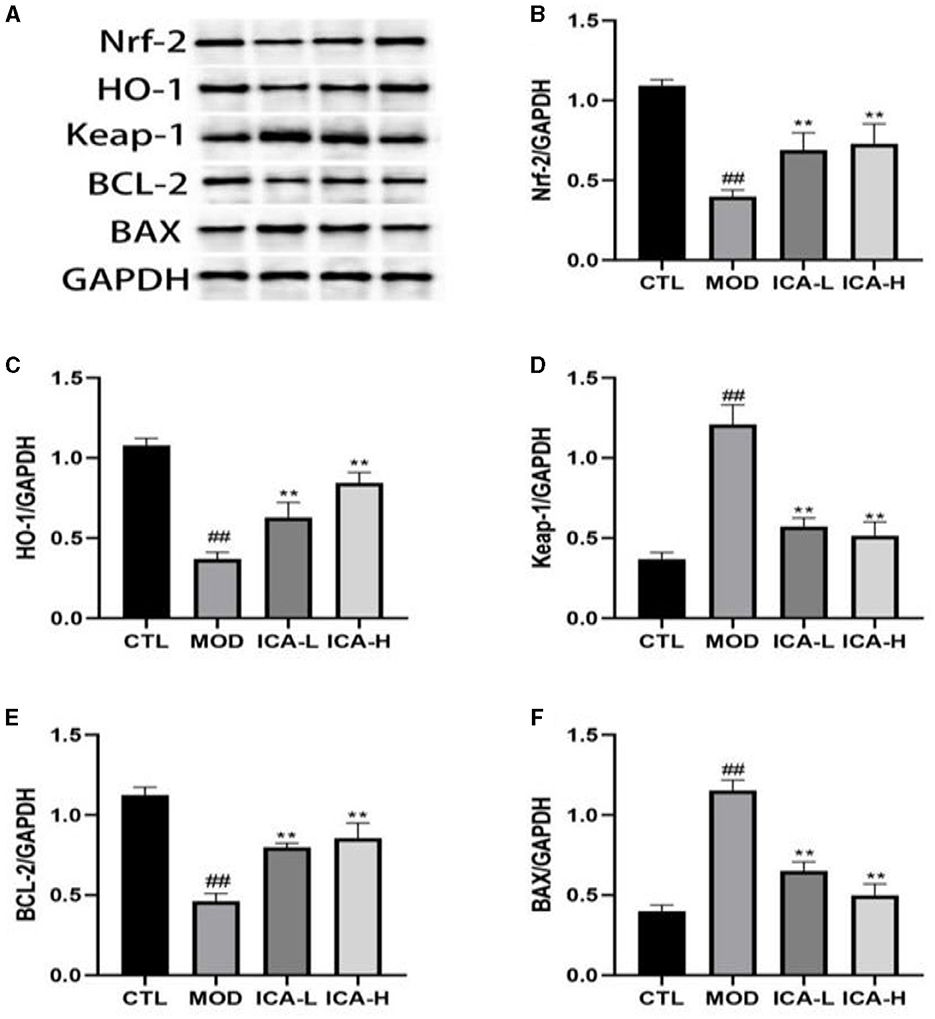 Figura 3. (De la A a la F) Efecto de la icariina sobre la expresión de proteínas de autofagia en células MDCK después de la inducción de cisplatino. , Ambos indican diferencias significativas; , Ambos indican diferencias muy significativas.*#**##
Figura 3. (De la A a la F) Efecto de la icariina sobre la expresión de proteínas de autofagia en células MDCK después de la inducción de cisplatino. , Ambos indican diferencias significativas; , Ambos indican diferencias muy significativas.*#**##
3.4 Efectos de la icariina sobre el potencial de membrana mitocondrial y la apoptosis nuclear en células MDCK inducidas por cisplatino
Después de la tinción con JC-1 de las células MDCK, la relación entre la fluorescencia roja y verde puede indicar cambios en el potencial de membrana mitocondrial. Como se muestra en la Figura 4A, en comparación con el grupo de control de CTL, las células del cisplatino (grupo MOD) mostraron un aumento significativo de la fluorescencia verde y una reducción de la fluorescencia roja, lo que indica que el cultivo de cisplatino redujo el potencial de membrana mitocondrial en las células MDCK. En comparación con el grupo MOD, la administración de 20 y 25 mmol/L de icariina redujo la fluorescencia verde y aumentó significativamente la fluorescencia roja en las células MDCK. Esto sugiere que la icariina mejora el potencial de membrana mitocondrial en las células MDCK inducidas por el cisplatino. Además, en comparación con el grupo de control de CTL (Figura 4B), las células MDCK del grupo MOD mostraron una tinción nuclear mejorada, con una fluorescencia más brillante y un aspecto redondo o encogido y agrupado. Por el contrario, en comparación con el grupo MOD, la administración de 20 y 25 mmol/L de icariina redujo el número de puntos brillantes en la tinción nuclear, y este efecto pareció ser dependiente de la dosis. Esto indica que la icariina inhibe eficazmente la apoptosis en las células MDCK inducida por el cisplatino.
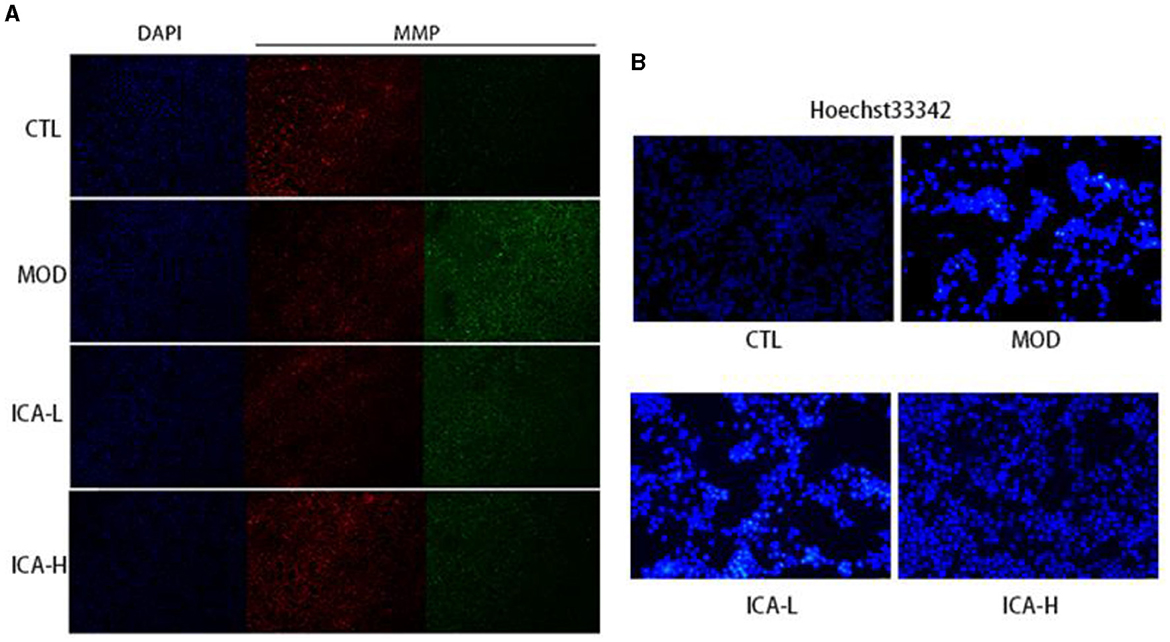 Figura 4. (A, B) Efecto de la icariina sobre el potencial de membrana mitocondrial y la apoptosis nuclear en células MDCK inducidas por cisplatino.
Figura 4. (A, B) Efecto de la icariina sobre el potencial de membrana mitocondrial y la apoptosis nuclear en células MDCK inducidas por cisplatino.
3.5 Efectos de la Icariina sobre la apoptosis en células MDCK inducida por cisplatino
Los resultados de la apoptosis detectada por citometría de flujo en células MDCK se muestran en la Figura 5. La tasa de apoptosis de las células MDCK en el medio de cultivo adicionado con cisplatino (grupo MOD) fue significativamente mayor que en el grupo control CTL (P < 0,01). Sin embargo, en comparación con el grupo MOD, la adición de 20 y 25 mmol/L de icariina aumentó significativamente la tasa de supervivencia celular de las células MDCK inducidas por cisplatino (P < 0,01), y este efecto del tratamiento mostró una relación dosis-dependiente. Esto indica que la icariina mejora eficazmente la viabilidad de las células MDCK inducidas por el cisplatino.
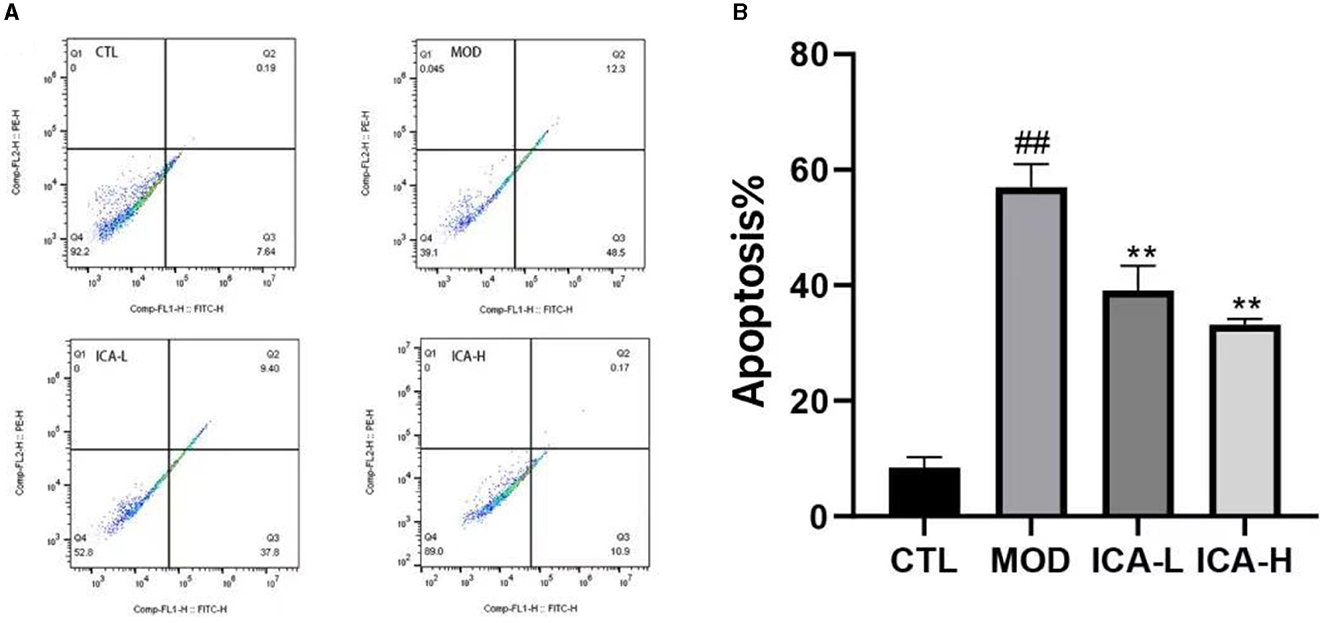 Figura 5. (A, B) Efecto de la icariina sobre la apoptosis de las células MDCK después de la inducción de cisplatino.
Figura 5. (A, B) Efecto de la icariina sobre la apoptosis de las células MDCK después de la inducción de cisplatino.
4 Discusión
El uso de cisplatino en el tratamiento de diversas formas de cáncer y sarcomas sigue siendo uno de los enfoques más efectivos, principalmente al impedir los mecanismos de reparación del ADN en las células aberrantes, inhibiendo así fundamentalmente la proliferación celular (1, 10). Sin embargo, la quimioterapia con cisplatino provoca potentes efectos adversos en el organismo, en particular causando inflamación de las células tubulares renales, estrés oxidativo y fibrosis, lo que conduce a una lesión renal aguda e incluso a la insuficiencia renal (2-4). Por lo tanto, la búsqueda de un componente terapéutico natural para contrarrestar el daño de las células renales inducido por cisplatino es de suma importancia. Los estudios han demostrado que la ICA posee la capacidad de mitigar el daño oxidativo renal, las respuestas inflamatorias y la apoptosis celular y se emplea ampliamente en el tratamiento de enfermedades sistémicas como la nefritis lúpica, la enfermedad inflamatoria intestinal, la artritis reumatoide y el cáncer (5, 7). Este estudio utilizó un modelo de daño celular MDCK canino inducido por cisplatino para explorar los mecanismos de ICA en el alivio del daño celular. Además, la investigación actual se centra en mejorar el alcance y la intensidad del tratamiento con cisplatino mediante la combinación de cisplatino con componentes terapéuticos naturales (11, 12). Por lo tanto, la búsqueda de adyuvantes naturales para ser utilizados junto con cisplatino para aliviar sus efectos secundarios inducidos por la quimioterapia en la práctica clínica ofrece una nueva perspectiva. En este estudio, las células MDCK caninas se cocultivaron con cisplatino en diferentes concentraciones, revelando una fuerte disminución en la viabilidad celular a medida que aumentaba la concentración de cisplatino. Cuando la concentración de cisplatino en el medio de cultivo celular alcanzó 1 mmol/L, la tasa de apoptosis de las células MDCK alcanzó el 53,4%. Esto subraya el considerable daño celular causado por el tratamiento con cisplatino. Posteriormente, el cocultivo de células MDCK caninas con diferentes concentraciones de ICA en combinación con cisplatino de 1 mmol/L demostró una mejora significativa en el daño celular inducido por cisplatino, particularmente a concentraciones de 20 y 25 mmol/L. Por lo tanto, en este estudio, la concentración de cisplatino seleccionada de 1 mmol/L sirvió como concentración citotóxica para las células MDCK, mientras que se eligieron 20 y 25 mmol/L ICA como concentraciones terapéuticas para las células MDCK dañadas.
Las células, como entidades autónomas, cuentan con un elaborado sistema antioxidante (13). En particular, el estrés oxidativo y la inflamación intracelular constituyen factores clave que contribuyen a la apoptosis. En casos de daño celular, los indicadores del metabolismo oxidativo proporcionan una representación lúcida de la vitalidad celular. La investigación de Gu et al. (14) estableció que la lesión renal aguda inducida por la administración de cisplatino en modelos murinos exhibe rasgos patológicos distintos, entre los que destacan el estrés oxidativo, la apoptosis de las células tubulares renales y las respuestas inflamatorias. Este hallazgo se alinea con la investigación realizada por Li et al. (15), donde se demostró que el cisplatino induce una desregulación en los parámetros oxidativos, incluidos MDA, CAT y SOD, junto con la alteración de indicadores inflamatorios como TNF-α e IL-1β dentro de las células renales murinas. Estas perturbaciones aceleran el proceso de apoptosis celular, lo que en última instancia conduce al desarrollo de una lesión renal aguda en ratones. Se observaron patrones similares en este estudio, donde el cisplatino exhibió efectos análogos. Redujo las actividades de SOD y CAT en las células MDCK caninas al tiempo que elevó los niveles de MDA, TNF-α, IL-1β e IL-6. Es evidente que el mecanismo del cisplatino para inducir la apoptosis celular es consistente y universalmente aplicable, con el alivio de los efectos secundarios de la quimioterapia con cisplatino que se puede lograr mediante el control del estrés oxidativo celular y las reacciones inflamatorias. Esta inferencia ha obtenido el reconocimiento de numerosos investigadores. Los estudios han demostrado que los antioxidantes como el galato de epigalocatequina (16), la hesperidina (17) y la quercetina (2) pueden mejorar el estrés oxidativo y la inflamación inducidos por el cisplatino, mitigando así la apoptosis celular durante la quimioterapia con cisplatino. El sujeto de este estudio, Icariin (ICA), exhibe propiedades similares. La adición de 20 mmol/L−25 mmol/L ICA a los medios de cultivo celular mejora eficazmente las capacidades antiinflamatorias y antioxidantes celulares, lo que resulta en un aumento de más del 45% en las tasas de supervivencia celular. Esto sugiere que la ACI es prometedora como terapia complementaria con cisplatino, proporcionando una base farmacológica para aliviar los efectos secundarios de la quimioterapia con cisplatino en la práctica clínica.
El estrés oxidativo dentro de las células se manifiesta principalmente en el proceso de metabolismo energético mitocondrial. Cuando el sistema antioxidante intracelular no logra contrarrestar las ROS generadas por la biooxidación mitocondrial, conduce a daño mitocondrial (18, 19). El suministro insuficiente de energía resultante no puede mantener el metabolismo celular, lo que en última instancia desencadena la apoptosis celular. En este estudio, se encontró que el cisplatino induce una reducción en el potencial de membrana mitocondrial en las células MDCK caninas, lo que conduce al daño mitocondrial, que puede ser una de las razones importantes para inducir la apoptosis celular. Además, el contenido de antioxidantes intracelulares determina el grado de respuesta al estrés oxidativo en las células. Las proteínas reguladoras oxidativas como Nrf-2, Keap1, BCL-2 y BAX se promueven e inhiben mutuamente, manteniendo colectivamente el funcionamiento normal de las reacciones oxidativas intracelulares (20, 21). La investigación de Wang et al. (22) demostró que Keap1, en su estado normal, puede unirse al antioxidante Nrf-2 y promover su degradación, mientras que la sobreexpresión de BAX puede contrarrestar el efecto protector de BCL-2, empujando a las células hacia la apoptosis. En este estudio, el tratamiento con cisplatino promovió la expresión de las proteínas Keap1 y BAX en las células, lo que condujo a una disminución en el contenido de antioxidantes intracelulares Nrf-2 y BCL-2, lo que provocó estrés oxidativo celular. La icariina (ICA) reequilibra eficazmente la expresión de los factores antioxidantes celulares dañados y el potencial de la membrana mitocondrial, ofreciendo así un enfoque proactivo para mitigar la apoptosis celular inducida por el cisplatino. Esto se alinea con los hallazgos de Shao et al. (23), donde ICA activó la vía Nrf-2/HO-1, facilitando la autofagia mitocondrial, aliviando los desequilibrios oxidativos-reductores y la disfunción mitocondrial, mejorando en última instancia las tasas de supervivencia celular. Sobre la base de los resultados de la investigación actual, la ICA parece mejorar eficazmente el estrés oxidativo y la apoptosis celular inducida por el tratamiento con cisplatino en células MDCK caninas a nivel celular. Sin embargo, los experimentos de validación a nivel de organismos caninos requieren más investigación.
5 Conclusión
Nuestros hallazgos sugieren que 20 y 25 mmol/L de ICA alivian eficazmente el daño inducido por cisplatino en las células MDCK caninas a nivel celular. Esta mejora se atribuye principalmente a la regulación positiva de la actividad enzimática antioxidante intracelular, la regulación a la baja de las respuestas inflamatorias, la reducción de la acumulación de especies reactivas de oxígeno, la inhibición de los procesos de fosforilación oxidativa mitocondrial y, en última instancia, la supresión de la vía de apoptosis celular. Estos resultados mitigan colectivamente el daño inducido por cisplatino en las células MDCK.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo/material complementario, las consultas posteriores pueden dirigirse al autor correspondiente.
Declaración ética
No se requirió aprobación ética para los estudios en animales de acuerdo con la legislación local y los requisitos institucionales, ya que solo se utilizaron líneas celulares establecidas disponibles comercialmente.
Contribuciones de los autores
JL: Conceptualización, Administración del proyecto, Redacción, borrador original. LX: Metodología, Redacción, revisión y edición. HZ: Escritura, borrador original. DW: Metodología, redacción, borrador original. XL: Metodología, Redacción, borrador original. YW: Administración del proyecto, redacción, borrador original. MS: Análisis formal, redacción, revisión y edición. CX: Conceptualización, Redacción, revisión y edición.
Financiación
El/los autor/es declaran/n que se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este estudio fue respaldado por la Investigación sobre la Aplicación de la Tecnología de Búsqueda Autónoma de Perros Policía en Cultivos de Postes Altos, Cuevas y Entornos de Pozos, un Proyecto Clave del Ministerio de Seguridad Pública (2022JSZ10) y la Especificación de Uso de Búsqueda de Campo de Perros de Búsqueda Estándar de la Industria (2022BZ126).
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Romani AMP. Cisplatino en el tratamiento del cáncer. Bioquímica. Pharmacol. (2022) 21:115323. doi: 10.1016/j.bcp.2022.115323
2. Wang H, Xia W, Long G, Pei ZY Li YY, Wu MY, et al. La isoquercitrina mejora la nefrotoxicidad inducida por cisplatino a través de la inhibición de la apoptosis, la inflamación y el estrés oxidativo. Frente Pharmacol. (2020) 11:599416. doi: 10.3389/fphar.2020.599416
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Tsai YS, Chen YP, Lin SW, Chen YL, Chen CC, Huang CJ. Lactobacillus rhamnosus GKLC1 mejora la nefrotoxicidad crónica inducida por cisplatino al inhibir la inflamación celular y la apoptosis. Farmacia Biomédica. (2022) 147:112701. doi: 10.1016/j.biopha.2022.112701
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Latcha S, Jaimes EA, Patil S, Glezerman IG, Mehta S, Flombaum CD. Resultados renales a largo plazo después del tratamiento con cisplatino. Clin J Am Soc Nephrol: CJASN. (2016) 11:1173. doi: 10.2215/CJN.08070715
5. Bi ZY, Zhang W, Yan X. Efectos antiinflamatorios e inmunorreguladores de la icariina y la icaritina. Farmacia Biomédica. (2022) 151:113180. doi: 10.1016/j.biopha.2022.113180
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Zhao YD, Yang WY, Zhang X, Lv CG, Lu JC. La icariina, el principal prenilflavonoide de epimedii folium, mejoró la enfermedad renal crónica mediante la modulación del metabolismo energético a través de la ACTIVACIÓN DE AMPK. J Etnofarmaco. (2023) 312:116543. doi: 10.1016/j.jep.2023.116543
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Xie CY, Liu L, Wang ZG, Xie HC, Feng YH, Suo JJ, et al. La icariina mejora la mortalidad inducida por sepsis y la lesión renal aguda. Pharmacol. (2018) 102:196–205. doi: 10.1159/000487955
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Wang M, Wang LC, Zhou Y, Feng XX, Ye CY, Wang C. La icariina atenúa la fibrosis renal en la enfermedad renal crónica mediante la inhibición de la activación mediada por la interleucina-1β/factor de crecimiento transformante β de los fibroblastos renales. Phytother Res. (2021) 35:6204–15. doi: 10.1002/ptr.7256
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Wang M, Wang LC, Feng XX, Zhou Y, Ye CY, Wang C. La icariina mejora la fibrosis intersticial renal en un modelo de rata de insuficiencia renal crónica mediante la regulación de la dinámica mitocondrial. China J Chin Mater Biomed. (2022) 47:2170–7. doi: 10.19540/j.cnki.cjcmm.20211104.401
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Holíčková A, Roška J, Órásová E, Bruderová V, Palacka P, Jurkovičová D, et al. Respuesta de las líneas celulares de carcinoma urotelial al cisplatino. Int J Mol Sci. (2022) 23:12488. doi: 10.3390/ijms232012488
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Tatli Seven P, Seven I, Karakus S, Iflazoglu Mutlu S, Arkali G, Muge Sahin Y, et al. El propóleo turco y su forma nano pueden mejorar los efectos secundarios del cisplatino, que es un fármaco ampliamente utilizado en el tratamiento del cáncer. Plantas. (2020) 9:1075. doi: 10.3390/plants9091075
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Zhao CC, Yan HF, Pang WT, Wu T, Kong XB Li XJ, et al. Lentinan combinado con cisplatino para el tratamiento del cáncer de pulmón de células no pequeñas. Medicina. (2021) 100:e25220. doi: 10.1097/MD.000000000000025220
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Ou CC, Lu TM, Tsai JJ, Yen JH, Chen HW, Lin MY. Efecto antioxidante de las bacterias lácticas: células intactas vs. extractos intracelulares. J Droga Alimenticia Anal. (2009) 17:6. doi: 10.38212/2224-6614.2609
14. Gu HM, Gwon MG, Kim JH, Leem JC, Lee SJ. La oridonina atenúa la lesión renal aguda inducida por cisplatino mediante la inhibición del estrés oxidativo, la apoptosis y la inflamación en ratones. BioMed Res. Int. (2022) 2022:2962. doi: 10.1155/2022/3002962
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Li CZ, Jin HH, Sun HX, Zhang ZZ, Zheng JX, et al. El eriodictiol atenúa la lesión renal inducida por cisplatino al inhibir el estrés oxidativo y la inflamación. Eur J Pharmacol. (2016) 772:124–30. doi: 10.1016/j.ejphar.2015.12.042
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Wang SW, Xu Y, Weng YY, Fan XY, Bai YF, Zheng XY, et al. La astilbina mejora la nefrotoxicidad inducida por cisplatino al reducir el estrés oxidativo y la inflamación. Toxicol químico alimentario. (2018) 114:227–36. doi: 10.1016/j.fct.2018.02.041
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Chen XL, Wei W, Li YZ, Huang JB Ci XX. La hesperetina alivia la lesión renal aguda inducida por cisplatino al mitigar el estrés oxidativo, la inflamación y la apoptosis. Interacción Chem-Biol. (2019) 308:269–78. doi: 10.1016/j.cbi.2019.05.040
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Napolitano G, Fasciolo G, Venditti P. Manejo mitocondrial de especies reactivas de oxígeno. Antioxidantes. (2021) 10:1824. doi: 10.3390/antiox10111824
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Yamamoto H, Morino K, Mengistu L, Ishibashi T, Kiriyama K, Ikami T, et al. Amla mejora la capacidad respiratoria mitocondrial al aumentar la biogénesis mitocondrial y los sistemas antioxidantes en una línea celular del músculo esquelético murino. Longevidad celular de Oxid Med. (2016) 2016:5841. doi: 10.1155/2016/1735841
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Huang CY, Deng JS, Huang WC, Jiang WP, Huang GJ. Atenuación de la lesión pulmonar aguda inducida por lipopolisacáridos por hispolón en ratones, mediante la regulación de las vías TLR4/PI3K/Akt/mTOR y Keap1/Nrf2/HO-1, y la supresión de la apoptosis y la autofagia inducidas por estrés oxidativo mediadas por estrés oxidativo. Nutrientes. (2020) 12:1742. doi: 10.3390/nu12061742
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Sogwagwa N, Davison G, Khan S, Solomon W. P9 Correlación de la apoptosis inducida por radiación con la expresión de las proteínas Bax y Bcl-2. Physica Med Eur J Med Phys. (2016) 32:163. doi: 10.1016/j.ejmp.2016.07.076
22. Wang JC, Wang K, Ding LL, Zhao PL, Zhang C, Wang HW, et al. Efecto paliativo de la quercetina sobre el daño oxidativo inducido por cadmio y la apoptosis mediante la activación de la vía Nrf2-keap1 en células BRL-3A. Frente Pharmacol. (2022) 13:969892. doi: 10.3389/fphar.2022.969892
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. Shao YD, Sun L, Yang GH, Wang WC, Liu XY, Du T, et al. La icariina protege los condrocitos de la placa terminal vertebral contra la apoptosis y la degeneración mediante la activación de la vía Nrf-2/HO-1. Frente Pharmacol. (2022) 13:937502. doi: 10.3389/fphar.2022.937502
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: Icariina, cisplatino, células MDCK, apoptosis de células, efecto protector
Cita: Liu J, Xie L, Zhai H, Wang D, Li X, Wang Y, Song M y Xu C (2024) Exploración de los mecanismos protectores de la icariina contra el daño de las células renales inducido por cisplatino en caninos. Frente. Vet. Sci. 11:1331409. doi: 10.3389/fvets.2024.1331409
Recibido: 01 de noviembre de 2023; Aceptado: 05 de febrero de 2024;
Publicado: 21 de febrero de 2024.
Editado por:
Mohsan Ullah Goraya, Universidad de Huaqiao, China
Revisado por:
Amjad Islam Aqib, Universidad de Ciencias Veterinarias y Animales de Cholistán, Pakistán
Muhammad Asmat Ullah Saleem, Universidad Agrícola del Noreste, China
Derechos de autor © 2024 Liu, Xie, Zhai, Wang, Li, Wang, Song y Xu. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Jiayi Liu, 2018990026@cipuc.edu.cn
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía