Extirpación intraventricular del tumor mediante abordaje transcallosal
 Caso clínico: Extirpación intraventricular del tumor mediante abordaje transcallosal y seguimiento en tres perros
Caso clínico: Extirpación intraventricular del tumor mediante abordaje transcallosal y seguimiento en tres perros
 László Lehner41*
László Lehner41*  Kálmán Czeibert2
Kálmán Czeibert2  Péter Csébi3
Péter Csébi3  Kristóf Diószegi4
Kristóf Diószegi4  Gábor Nagy5
Gábor Nagy5- 1Clínica y Hospital Veterinario Fuziovet, Budapest, Hungría
- 2LimesVet Ltd, Budapest, Hungría
- 3Radiovet Bt, Budapest, Hungría
- 4Medivet Birstall, Birstall, Reino Unido
- 5Instituto Nacional de Salud Mental, Neurología y Neurocirugía, Budapest, Hungría
Esta serie de casos describe la extirpación quirúrgica de tumores ventriculares laterales mediante un enfoque transcallosal, seguimiento a largo plazo y resultados de imágenes por resonancia magnética (IRM) de 3 perros. Dos tumores fueron tumores benignos del plexo coroideo (CPT). Uno fue un astrocitoma de grado 2. La extirpación completa del tumor se logró mediante el enfoque transcalloso. Todos los perros tenían ventriculomegalia que permaneció estática o progresó durante el período de seguimiento. Todos los perros tuvieron ataques epilépticos antes del procedimiento quirúrgico que persistieron a pesar de la extirpación del tumor. Un perro con CPT estaba vivo después de 3 años y 5 meses y tenía convulsiones focales menores cada 3-4 meses. No se observaron otros signos clínicos. El segundo perro con CPT estuvo neurológicamente libre durante 17 meses después del procedimiento quirúrgico, pero murió debido a ataques epilépticos generalizados resistentes a la terapia de inicio agudo. El tercer perro con astrocitoma intraventricular experimentó ataques epilépticos 2 y 4 meses después del procedimiento quirúrgico. El segundo evento fue resistente a la terapia, lo que llevó a la muerte.
1. Introducción
Los tumores del plexo coroideo (CPT) son el tipo más común de tumor intraventricular en medicina veterinaria (1). Los CPT representan el 7-10% de todos los tumores cerebrales primarios en perros (2, 3) y pueden clasificarse histológicamente como papilomas, papilomas atípicos y carcinomas (2). Casi la mitad (49%), 29 y 22% de los CPT ocurren en el cuarto, lateral y tercer ventrículo, respectivamente (4). Otros tumores ventriculares raros incluyen astrocitomas. El origen de los astrocitomas sigue siendo controvertido, aunque se sabe que ocurren en la zona subventricular del ventrículo lateral (5). Los astrocitomas son el tipo de glioma más prevalente, representando aproximadamente el 17% de todos los tumores primarios del sistema nervioso central (6). Los tumores intraventriculares pueden causar hidrocefalia secundaria debido a la obstrucción de la circulación del líquido cefalorraquídeo (LCR) en el foramen de Monro o cuarto ventrículo (7) o debido a la sobreproducción de LCR (7).
Todavía no se han establecido protocolos de tratamiento estándar ampliamente aceptados para los tumores intraventriculares en medicina veterinaria (8). En humanos, la escisión quirúrgica con o sin radioterapia adyuvante se considera el tratamiento más efectivo para las CPT (9). La escisión quirúrgica puede eliminar el tumor y la compresión de los tejidos cerebrales locales inducidos por el tumor y detener la obstrucción de la circulación del LCR, lo que aumenta la presión intracraneal. Además, puede proporcionar un diagnóstico histopatológico (1). La radioterapia es un tratamiento paliativo invasivo que se recomienda para casos inoperables si es posible o después de la extirpación del tumor (10). Además, la derivación ventriculoperitoneal paliativa (VPS) es una opción en casos de deterioro rápido donde la radioterapia no alivia los signos clínicos de presión intracraneal elevada causada por hidrocefalia rápidamente o la ubicación de la masa impide la escisión quirúrgica o después de la eliminación del tumor si se produjo un crecimiento progresivo del ventrículo (11, 12).
La extirpación quirúrgica de los tumores intraventriculares presenta un desafío significativo debido a su localización. Los abordajes transcorticales, transcallosos y paraespleniales se pueden aplicar a los ventrículos laterales (13). Un abordaje transcallosal proporciona un acceso relativamente simple a los ventrículos y minimiza la morbilidad asociada con la resección de estas lesiones (13). El cuerpo calloso es una de las 3 principales comisuras que conectan los 2 hemisferios del cerebro (14). Estas comisuras son responsables de la comunicación entre las áreas corticales (15). En los seres humanos, la transección parcial del cuerpo calloso (callosotomía) no causa déficits neurológicos significativos. Sin embargo, si la cirugía induce una lesión cerebral adicional, la callosotomía puede aumentar la gravedad de los déficits neurológicos (13). La preservación del esplenio del cuerpo calloso mitiga los efectos neuropsicológicos postoperatorios de este enfoque (16, 17), llamado colectivamente síndrome de desconexión. En los seres humanos, los síntomas clínicos incluyen control motor afectado, orientación espacial, visión, audición y lenguaje (16). Aunque existen datos mínimos, los animales presentan defectos mínimos o nulos después de 2 semanas de callosotomía parcial o completa (18, 19). El enfoque transcallosal para la eliminación intraventricular de CPT en un perro con 9 meses de seguimiento fue reportado por primera vez por nuestro grupo (20).
2. Materiales y métodos
Seis perros fueron remitidos a la Clínica de Referencia Veterinaria FuzioVet, Budapest, Hungría entre 2019 y 2022 con tumores intraventriculares rostrotentoriales basados en imágenes de resonancia magnética (MRI). En 3 casos, los propietarios eligieron para la cirugía. Los 3 casos restantes fueron tratados conservadoramente con prednisolona y / o medicamentos anticonvulsivos (ASM) de acuerdo con la voluntad de los propietarios. Todos los perros tratados conservadoramente murieron dentro de los 3 meses debido al deterioro de los signos clínicos (obnubilación y convulsiones incontroladas). Resumimos los signos clínicos, los tratamientos, los hallazgos de la RM pre y postoperatoria y los tiempos de supervivencia de los casos tratados de manera conservadora y quirúrgica en la Tabla 1.
En todos los perros tratados quirúrgicamente, hemograma completo preoperatorio, bioquímica sérica, análisis de orina, ecografía abdominal, ecocardiografía y radiografía torácica, pero no se observaron anomalías significativas. Los protocolos anestésicos y quirúrgicos utilizados en cada caso han sido descritos en detalle previamente (21). Brevemente, la craneotomía parieto-parasagital se realizó utilizando una sierra oscilante. Después de la durotomía, el LCR intraventricular se drenó utilizando un catéter intravenoso para relajar el cerebro para su posterior manipulación. El cuerpo calloso entre los dos hemisferios fue cuidadosamente expuesto y parcialmente transeccionado en la línea media. Hicimos la incisión más pequeña posible para acceder al tumor, minimizando así la invasividad de este procedimiento. Se utilizó un microscopio de operación y cánulas de succión de Fergusson de 8 y 12 canales para visualizar y eliminar los fragmentos tumorales de los ventrículos. Se utilizaron esponjas de gelatina y electrocauterio bipolar para controlar el sangrado. Después de la extirpación del tumor, el ventrículo se limpió con una infusión fisiológica estéril de NaCl y se verificó la permeabilidad del foramen interventricular de Monro. Los ventrículos se rellenaron con infusión fisiológica de NaCl y se colocó una esponja de gelatina en la superficie del cerebro. Se suturó la duramadre y se reemplazaron los fragmentos óseos de la craneotomía. Los pacientes fueron hospitalizados y tratados con metilprednisolona (1 mg/kg, IV), cefazolina (30 mg/kg, IV), clorhidrato de morfina (2-4 mg/kg, IV) y manitol para prevenir y tratar el edema postoperatorio (0,5-1 g/kg TID, IV el primer día, BID el segundo día y suspender el tercer día si no se observaron signos clínicos). Los medicamentos específicos de cada caso continuaron después del alta hospitalaria. Las muestras de tejido fueron sometidas a análisis histopatológico.
3. Descripciones de los casos
El primer caso ha sido descrito detalladamente en una publicación anterior (20). Hemos incluido este caso aquí porque describimos un período de seguimiento significativamente más largo (3 años y 5 meses después de la cirugía) que el del artículo anterior (9 meses), y creemos que esto agrega una visión novedosa al caso.
3.1. Caso 1
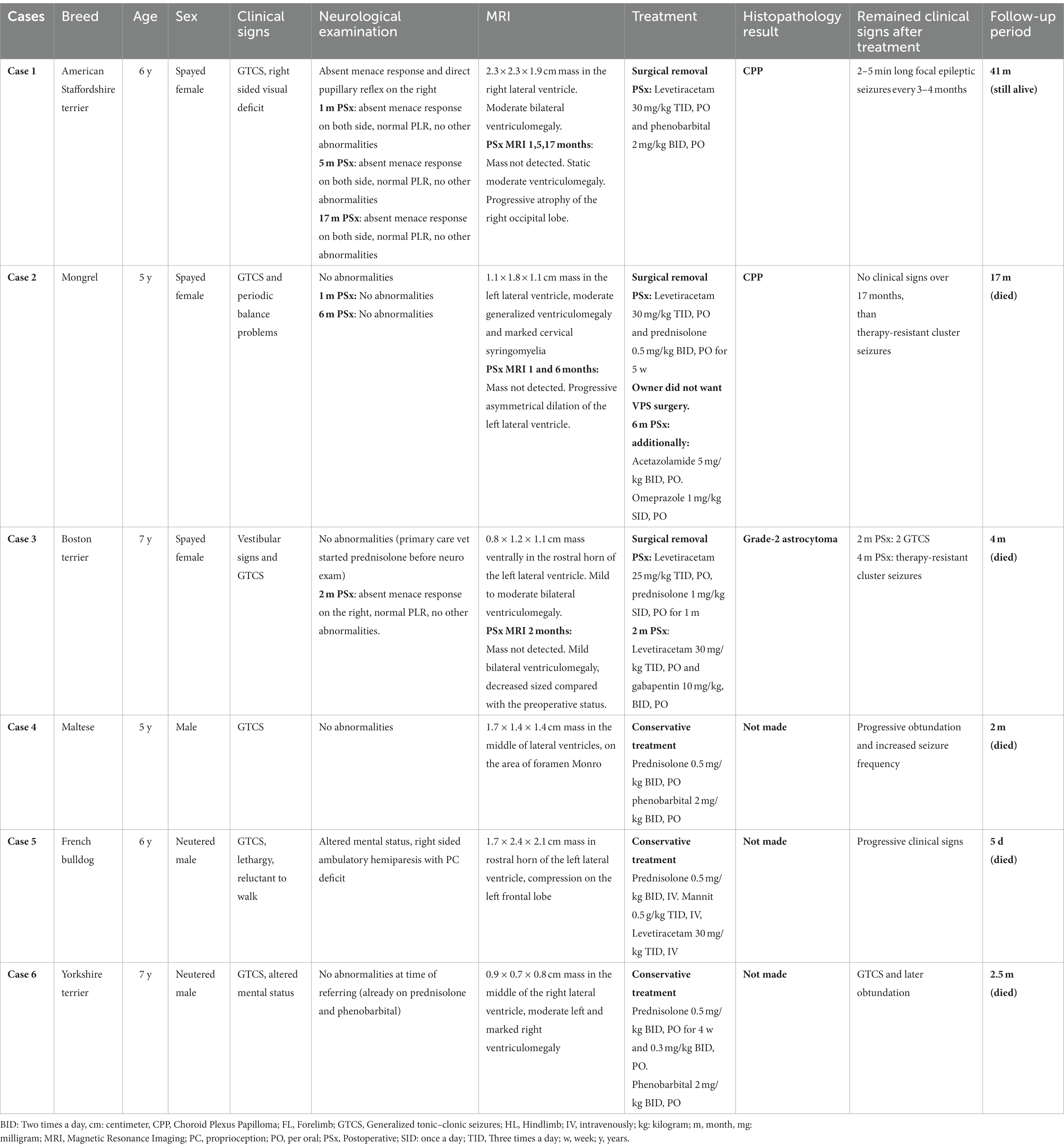
Una hembra esterilizada de American Staffordshire terrier de 6 años presentó ataques epilépticos generalizados periódicos y déficits visuales. Las investigaciones realizadas antes de la cirugía revelaron hidrocefalia grave y crónica y la presencia de un tumor intraventricular de 2,3 × 2,3 × 1,9 cm de tamaño. El tumor era isointenso ponderado en T2 (T2W) y ponderado en T1 (T1W), ligeramente hiperintenso en las secuencias de recuperación de inversión atenuada por líquidos (FLAIR) y fuertemente potenciador del contraste (Figura 1A). La histopatología fue consistente con el papiloma benigno del plexo coroideo (PPC).
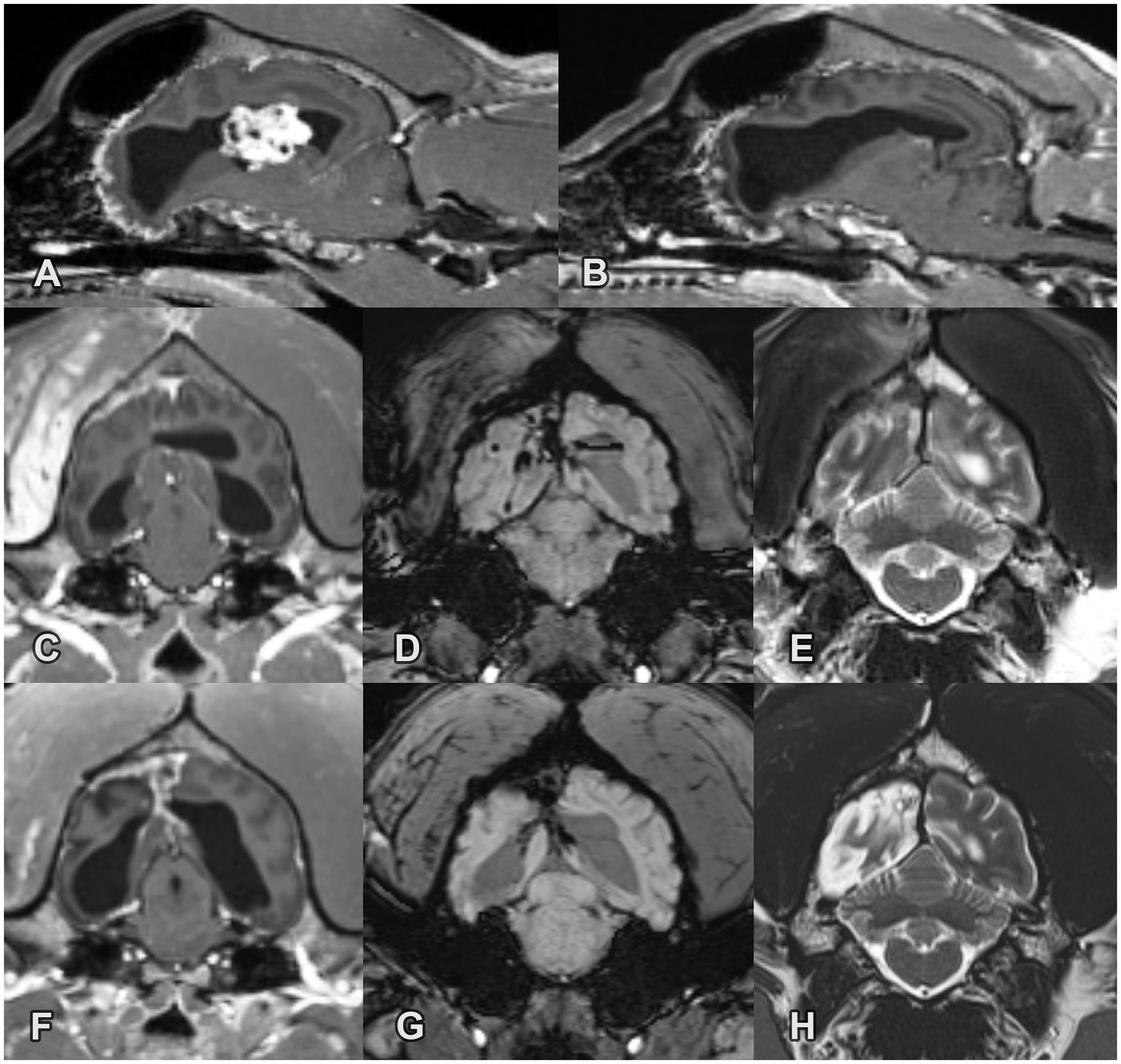 Figura 1. Imágenes de resonancia magnética pre y postoperatorias de un papiloma del plexo coroideo en el ventrículo lateral derecho en el caso 1. (A) Imagen post-contraste de T1W sagital preoperatoria. Tenga en cuenta la gran masa similar a la coliflor con marcado realce de contraste y la ventriculomegalia crónica moderada secundaria. (B) Imagen postoperatoria de T1W sagital de 1 mes después del contraste. La masa ya no está presente. Los ventrículos laterales permanecieron moderadamente agrandados sin cambios significativos en comparación con el estado preoperatorio. (C) Imagen de T1W transversal postoperatoria de 1 mes después del contraste. Tenga en cuenta la marcada mejora del contraste a lo largo del sitio del abordaje quirúrgico en el músculo temporal derecho, el calvario y el falx cerebri. (D) Imagen SWI transversal postoperatoria de 1 mes. La señal vacía está presente a lo largo del sitio del abordaje quirúrgico consistente con hemorragia subaguda moderada. (E) Imagen T1W transversal postoperatoria de 2 mes. Los surcos están ligeramente ensanchados en el lóbulo occipital derecho. (F) Imagen postoperatoria postoperatoria posterior al contraste de T17W transversal de 1 meses. Los ventrículos laterales permanecieron moderadamente agrandados sin cambios significativos en comparación con el estado preoperatorio. La mejora del contraste disminuyó en el músculo temporal, pero permaneció estática en el cerebro. (G) Imagen SWI transversal postoperatoria de 17 meses. El área del vacío de la señal disminuye levemente. (H) Imagen T17W transversal postoperatoria de 2 meses. Tenga en cuenta la atrofia progresiva del lóbulo occipital derecho.
Figura 1. Imágenes de resonancia magnética pre y postoperatorias de un papiloma del plexo coroideo en el ventrículo lateral derecho en el caso 1. (A) Imagen post-contraste de T1W sagital preoperatoria. Tenga en cuenta la gran masa similar a la coliflor con marcado realce de contraste y la ventriculomegalia crónica moderada secundaria. (B) Imagen postoperatoria de T1W sagital de 1 mes después del contraste. La masa ya no está presente. Los ventrículos laterales permanecieron moderadamente agrandados sin cambios significativos en comparación con el estado preoperatorio. (C) Imagen de T1W transversal postoperatoria de 1 mes después del contraste. Tenga en cuenta la marcada mejora del contraste a lo largo del sitio del abordaje quirúrgico en el músculo temporal derecho, el calvario y el falx cerebri. (D) Imagen SWI transversal postoperatoria de 1 mes. La señal vacía está presente a lo largo del sitio del abordaje quirúrgico consistente con hemorragia subaguda moderada. (E) Imagen T1W transversal postoperatoria de 2 mes. Los surcos están ligeramente ensanchados en el lóbulo occipital derecho. (F) Imagen postoperatoria postoperatoria posterior al contraste de T17W transversal de 1 meses. Los ventrículos laterales permanecieron moderadamente agrandados sin cambios significativos en comparación con el estado preoperatorio. La mejora del contraste disminuyó en el músculo temporal, pero permaneció estática en el cerebro. (G) Imagen SWI transversal postoperatoria de 17 meses. El área del vacío de la señal disminuye levemente. (H) Imagen T17W transversal postoperatoria de 2 meses. Tenga en cuenta la atrofia progresiva del lóbulo occipital derecho.
Se produjeron dos convulsiones tónico-clónicas generalizadas (GTCS) de 5 minutos de duración dentro de 1 mes de la resección del tumor. En los siguientes 3 meses, no se observaron ataques epilépticos, y el perro estaba en buenas condiciones sin déficit neurológico. Dos GTCS ocurrieron 4 meses después de la intervención. Después de aumentar la dosis de ASM, no se observaron más convulsiones durante 6 meses. Diez meses después de la cirugía, el perro comenzó a mostrar 2-3 convulsiones focales cada 2-3 meses. Dos GTCS ocurrieron 12 meses después. La dosis de levetiracetam se incrementó de 20 mg/kg a 30 mg/kg TID, PO, y fenobarbital se administró como ASM complementaria (2 mg/kg BID, PO). Tres años y 5 meses después de la cirugía, el perro tuvo aproximadamente 2-5 minutos de ataques epilépticos focales de largo cada 3-4 meses y todavía tiene déficit visual. Hasta la fecha, el perro se ha sometido a 3 resonancias magnéticas de seguimiento (1, 5 y 17 meses después de la cirugía). No se ha realizado ninguna resonancia magnética adicional porque el propietario ha disminuido hasta que el perro muestra signos clínicos de deterioro. No se detectaron restos de la masa o recurrencia. Los ventrículos laterales permanecieron moderadamente agrandados sin cambios significativos en comparación con su estado preoperatorio. Se observó hemorragia subaguda moderada y realce del contraste en el sitio quirúrgico en la primera resonancia magnética. El área del vacío de señal disminuyó ligeramente en la resonancia magnética de seguimiento. La mejora del contraste permaneció estática en el cerebro. Se observó atrofia progresiva del lóbulo occipital derecho en la segunda y tercera resonancia magnética (Figuras 1B-H).
3.2. Caso 2
Una mujer mestiza esterilizada de 5,5 años presentó GTCS periódicos y problemas de equilibrio. El examen neurológico no mostró ninguna anomalía. La resonancia magnética cerebral se realizó utilizando un imán de 1,5 Tesla (Siemens Magnetom Avanto, Siemens, Erlangen, Alemania) que reveló una masa grande de 1,1 × 1,8 × 1,1 cm en el ventrículo lateral izquierdo. La masa fue T2W y T1W isointensa con la materia gris cerebral e hiperintensa en FLAIR y mostró una marcada mejora heterogénea del contraste. Todos los ventrículos estaban marcadamente agrandados. Se observó hiperintensidad periventricular de FLAIR, consistente con edema, alrededor del ventrículo lateral izquierdo. Se observó un leve desplazamiento de la línea media derecha y una marcada siringomielia en la columna cervical (Figura 2A). La histopatología fue consistente con PPC benigna.
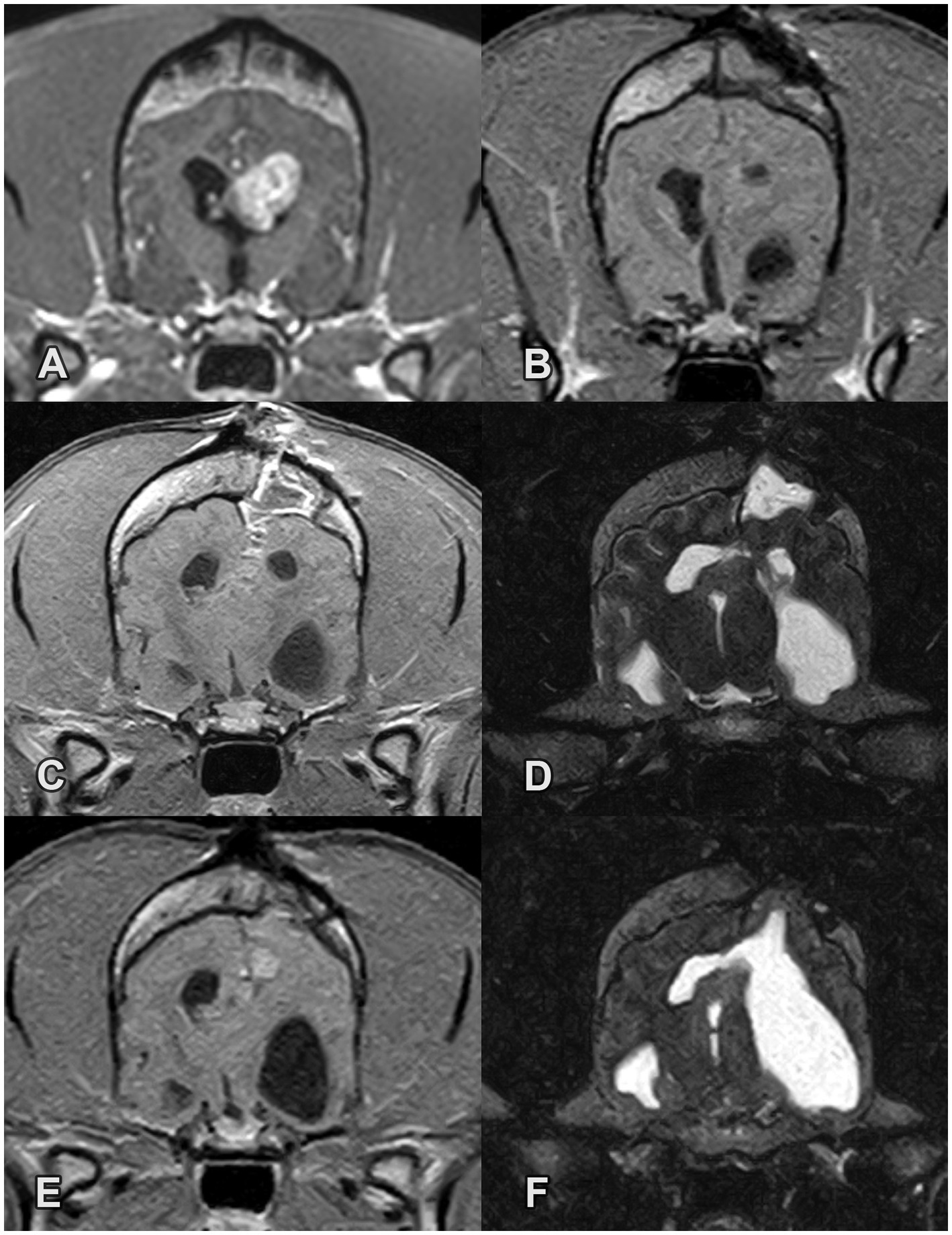 Figura 2. Imágenes de resonancia magnética pre y postoperatorias de un papiloma del plexo coroideo en el ventrículo lateral izquierdo en el caso 2. (A) Imagen transversal preoperatoria T1W post-contraste. Tenga en cuenta la gran masa con marcado realce de contraste y la ventriculomegalia crónica secundaria. (B) Imagen post-contraste de T1W transversal postoperatoria de 1 mes a nivel de la masa ventricular previa. La masa ya no está presente. (C-F) Imágenes postoperatorias a nivel del sitio quirúrgico (C) imagen transversal de 1 mes de T1W post-contraste, (D) imagen transversal de 1 mes de T2W, (E) imagen post-contraste de T6W de 1 meses, (F) imagen transversal de 6 meses de T2W. Tenga en cuenta la dilatación asimétrica progresiva del ventrículo lateral izquierdo con un desplazamiento de la línea media derecha y la leve mejora del contraste focal en la región del abordaje quirúrgico.
Figura 2. Imágenes de resonancia magnética pre y postoperatorias de un papiloma del plexo coroideo en el ventrículo lateral izquierdo en el caso 2. (A) Imagen transversal preoperatoria T1W post-contraste. Tenga en cuenta la gran masa con marcado realce de contraste y la ventriculomegalia crónica secundaria. (B) Imagen post-contraste de T1W transversal postoperatoria de 1 mes a nivel de la masa ventricular previa. La masa ya no está presente. (C-F) Imágenes postoperatorias a nivel del sitio quirúrgico (C) imagen transversal de 1 mes de T1W post-contraste, (D) imagen transversal de 1 mes de T2W, (E) imagen post-contraste de T6W de 1 meses, (F) imagen transversal de 6 meses de T2W. Tenga en cuenta la dilatación asimétrica progresiva del ventrículo lateral izquierdo con un desplazamiento de la línea media derecha y la leve mejora del contraste focal en la región del abordaje quirúrgico.
El perro se recuperó sin incidentes después de la cirugía y fue dado de alta con tratamiento con levetiracetam (30 mg / kg TID, PO) y prednisolona (0,5 mg / kg, BID, PO). Cinco semanas después de la operación, la prednisolona se redujo gradualmente y se suspendió, y levetiracetam se continuó con la dosis anterior. Durante los siguientes 16 meses, el perro estuvo en buen estado general con un examen neurológico normal y sin convulsiones. La resonancia magnética se repitió 1 y 6 meses después de la cirugía. No se detectaron restos de la masa y recurrencia. Se observó dilatación asimétrica progresiva del ventrículo lateral izquierdo con un desplazamiento de la línea media hacia la derecha. Se observó hiperintensidad T2 focal leve y realce del contraste en la región del abordaje quirúrgico en ambas visitas de seguimiento (Figuras 2B-F) Debido a la progresión de la dilatación ventricular (que se observó en la RM postoperatoria de 6 meses), se recomendó la cirugía VPS. Sin embargo, el propietario rechazó la cirugía VPS, por lo tanto, iniciamos tratamiento conservador con acetazolamida (5 mg/kg, BID, PO) y omeprazol (1 mg/kg, SID, PO). Las convulsiones en racimo resistentes a la terapia ocurrieron 17 meses después de la cirugía que llevaron a la muerte.
3.3. Caso 3
Una hembra de Boston Terrier esterilizada de 7 años fue remitida para consulta neurológica debido a signos vestibulares centrales y GTCS. Se administró levetiracetam (25 mg/kg, TID, PO) y prednisolona (1 mg/kg, SID, PO). La resonancia magnética cerebral se realizó con un imán de 0,4 Tesla (Hitachi Airis Vento, Fujifilm Europe GmbH, Ratingen, Alemania) que reveló una masa grande de 0,8 × 1,2 × 1,1 cm ventralmente en el cuerno rostral del ventrículo lateral izquierdo. La masa fue T2W ligeramente hiperintensa y T1W iso-a-hipointensa sin mejora del contraste. Los ventrículos laterales izquierdo y derecho estaban moderada y ligeramente agrandados, respectivamente. Se observó un leve desplazamiento de la línea media hacia la derecha (Figuras 3A-C). La histopatología del tejido tumoral extirpado fue consistente con un astrocitoma de grado 2.
 Figura 3. Imágenes de resonancia magnética pre y postoperatorias de un astrocitoma intraventricular en el asta rostral del ventrículo lateral izquierdo en el caso 3. (A-C) Las imágenes transversales preoperatorias (A) FLAIR, (B) T1W post-contraste y (C) T2W revelan una masa hiperintensa FLAIR/T2W y T1W hipointensa sin mejora del contraste. (D-F) Imágenes transversales postoperatorias en el sitio de la masa anterior. La masa ya no está presente. (G-I) imágenes transversales postoperatorias de 2 meses (G) FLAIR, (H) T1W post-contraste e (I) T2W imagen. Se observan hiperintensidades T2 multifocales en la sustancia blanca subcortical y realce del contraste en la región del abordaje quirúrgico. Los ventrículos laterales todavía están ligeramente agrandados, pero su tamaño disminuyó en comparación con el estado preoperatorio.
Figura 3. Imágenes de resonancia magnética pre y postoperatorias de un astrocitoma intraventricular en el asta rostral del ventrículo lateral izquierdo en el caso 3. (A-C) Las imágenes transversales preoperatorias (A) FLAIR, (B) T1W post-contraste y (C) T2W revelan una masa hiperintensa FLAIR/T2W y T1W hipointensa sin mejora del contraste. (D-F) Imágenes transversales postoperatorias en el sitio de la masa anterior. La masa ya no está presente. (G-I) imágenes transversales postoperatorias de 2 meses (G) FLAIR, (H) T1W post-contraste e (I) T2W imagen. Se observan hiperintensidades T2 multifocales en la sustancia blanca subcortical y realce del contraste en la región del abordaje quirúrgico. Los ventrículos laterales todavía están ligeramente agrandados, pero su tamaño disminuyó en comparación con el estado preoperatorio.
La tomografía computarizada (TC) se realizó inmediatamente después de la cirugía utilizando un escáner CT multicorte (General Electronic Optima 520, Estados Unidos). La masa intraventricular estaba ausente, y el fragmento óseo de craneotomía reemplazado cubrió adecuadamente el hiato quirúrgico. Después de la cirugía, el perro mostró una leve inclinación de la cabeza izquierda y hemiparesia ambulatoria en el lado derecho. La respuesta a la amenaza estaba ausente en el lado derecho, y el reflejo pupilar de la luz era normal. La propiocepción consciente de las extremidades derechas se retrasó. Durante la hospitalización, los déficits propioceptivos mejoraron, pero la respuesta a la amenaza aún estaba ausente.
Los tratamientos con levetiracetam y prednisolona se continuaron con las dosis preoperatorias. La prednisolona se redujo gradualmente y se suspendió 1 mes después de la cirugía. Dos meses después de la cirugía, se produjeron 2 GTCS que fueron tratados con una solución rectal de diazepam (1 mg / kg) en casa. La dosis de levetiracetam se aumentó a 30 mg/kg TID, PO y gabapentina (10 mg/kg BID, PO) se utilizó como ASM complementaria. La resonancia magnética se repitió 2 meses después de la cirugía. Los ventrículos laterales todavía estaban ligeramente agrandados, pero su tamaño disminuyó en comparación con el estado preoperatorio. No se observó masa intraventricular. Se observaron hiperintensidades T2 multifocales en la sustancia blanca y realce del contraste en la región del abordaje quirúrgico (Figuras 3D-I).
Cuatro meses después de la cirugía, se produjeron convulsiones en racimo. Las convulsiones no respondieron al tratamiento con midazolam (0,3 mg/kg, IV) y se inició infusión de velocidad continua (IR) de medetomidina-ketamina (medetomidina 3 mcg/kg/h, clorhidrato de ketamina 1 mg/kg/h, IV) para tratar las convulsiones. Después de las 12 h, CRI se detuvo y la actividad de GTCS se repitió. Se administró propofol (5,5 mg/kg/h, IV) CRI durante 12 h, seguido de fenobarbital intravenoso (2 mg/kg, IV) y levetiracetam (30 mg/kg, IV). Durante la disminución gradual de la dosis de propofol CRI, se observó GTCS nuevamente, que no respondió a ningún medicamento, y el perro murió.
4. Discusión
Hay múltiples opciones de tratamiento disponibles para los tumores intraventriculares. El tratamiento paliativo conservador incluye anticonvulsivos, corticosteroides y analgésicos. Otros tratamientos paliativos o curativos incluyen quimioterapia, radioterapia, extirpación quirúrgica parcial o completa del tumor, VPS o una combinación de estos.
En medicina humana, si es técnicamente factible, la extirpación intraventricular del tumor es la primera etapa porque esta es la única terapia curativa definitiva con típicamente menos morbilidad como en el caso de la radioterapia principalmente paliativa. La resección quirúrgica tiene el beneficio de reducir o eliminar la compresión local del tejido cerebral causada por el tumor, al disminuir la presión intracraneal (alteración del flujo del LCR causada por la obstrucción tumoral) y proporcionar un diagnóstico histopatológico del tipo y grado del tumor (2). El tratamiento quirúrgico es seguido por radioterapia en caso de resección completa del tumor sin éxito (10). La dependencia del VPS después de la extirpación exitosa del tumor es rara, pero si el tejido cicatricial o el tumor restante (resección parcial del tumor) causa interrupción del flujo del LCR y ventriculomegalia secundaria, VPS puede prevenir un mayor deterioro (11). En medicina humana, la tasa de supervivencia a 5 años reportada de CPT depende en gran medida de la histología. El papiloma del plexo coroideo (87%) tuvo resultados mucho mejores que el carcinoma del plexo coroideo (34%) (21).
En medicina veterinaria, los estudios han demostrado una amplia gama de resultados y posibles impactos de la tecnología en caso de tumores intracraneales (22). El tratamiento óptimo en perros con tumores intraventriculares no está bien descrito en medicina veterinaria. En un estudio de tumores intraventriculares solitarios en 7 perros y 5 gatos tratados con radioterapia sola o radioterapia combinada con VPS, los tiempos medios de supervivencia fueron de 162 días y 1.103 días, respectivamente. Por lo tanto, el VPS puede ser beneficioso para aumentar el tiempo de supervivencia en el caso de tumores ventriculares (12). VPS puede disminuir rápidamente la presión intracraneal y aliviar los signos clínicos asociados, pero no proporciona tratamiento curativo, no puede aliviar la compresión local del tejido cerebral causada por el tumor, no proporciona un diagnóstico histopatológico y a menudo se asocia con complicaciones (12, 23). Por lo tanto, VPS solo no se recomienda en medicina humana. La radioterapia también es un tratamiento invasivo, con varios posibles efectos secundarios graves y anestesia repetida requerida para el procedimiento. En el estudio mencionado anteriormente, dos de cada seis perros murieron y cuatro de cada seis se deterioraron durante la radioterapia (22).
Debido a la muy limitada experiencia veterinaria y los antecedentes de la literatura disponible en el tratamiento de tumores intraventriculares, hemos utilizado el protocolo de tratamiento humano actual en nuestros casos basado en un enfoque neuroquirúrgico potencialmente curativo.
Los enfoques transcorticales y transcallosos se utilizan en medicina humana para extirpar tumores laterales y del tercer ventrículo. El abordaje transcallosal interhemisférico interrumpe las fibras comisurales del cuerpo calloso, mientras que el abordaje transcortical daña la materia gris y blanca del cerebro (24). En los seres humanos, los enfoques transcallosal y transcortical causan el mismo grado de daño del cuerpo calloso, mientras que el enfoque transcortical también interrumpe los tractos frontales de la sustancia blanca (25). El abordaje transcallosal se asoció con una mayor incidencia (10,8%) de hidrocefalia (dependencia de derivación) que el abordaje transcortical (7,0%); sin embargo, la diferencia no fue significativa.
Basándonos en la experiencia neuroquirúrgica humana, utilizamos el abordaje transcallosal en nuestros casos y todos los tumores fueron completamente removibles. Experimentamos durante los procedimientos, que hay una mayor probabilidad de daño cerebral iatrogénico durante la disección debido al pequeño tamaño del cerebro de un perro en comparación con un humano. Por lo tanto, se recomienda el uso de un microscopio de operación adecuado y microinstrumenst durante el procedimiento. Debido a la rareza de tales casos, también se recomienda concentrar el tratamiento quirúrgico de tales casos para alcanzar la máxima experiencia quirúrgica.
En los seres humanos, los cambios típicos del tejido cerebral postoperatorio están presentes alrededor del sitio quirúrgico en la resonancia magnética repetida, incluyendo hiperintensidades multifocales de T2W en la sustancia blanca, mejora del contraste a lo largo del enfoque quirúrgico y, ocasionalmente, un capuchón periventricular causado por un aumento del contenido de agua intersticial debido al transporte transependimario disfuncional (26). Con el tiempo, estos se reducen, pero pueden permanecer visibles durante meses después de la cirugía y el desarrollo de tejido cicatricial puede estar presente en las resonancias magnéticas postoperatorias (26). La RM postoperatoria reveló alteraciones morfológicas similares en caninos. En el primer caso, se observó una marcada hemorragia intraparenquimatosa en el sitio quirúrgico. Además, se observó atrofia progresiva del lóbulo occipital derecho en las imágenes de resonancia magnética para un caso. Esto puede ser el resultado de una lesión iatrogénica a la radiación óptica inducida por la retracción cerebral, que dañó la vía aferente, dando lugar a alteraciones del lóbulo occipital como la encefalomalacia secundaria. Otra hipótesis podría ser que la discapacidad visual fue causada por daño vascular. Sin embargo, dada la ubicación del enfoque quirúrgico actual, es menos probable. Esto se debe a que la arteria cerebral caudal, que es responsable de suministrar sangre a la circunvolución occipital, corre adyacente al splenium corporis callosi (más caudalmente desde el sitio quirúrgico) a medida que emerge de la arteria comunicante caudal (27).
En los casos 1 y 2, el diagnóstico histopatológico final fue un papiloma benigno del plexo coroideo. En ambos casos, la masa causó ventriculomegalia lateral debido al bloqueo de la circulación del LCR.
En el caso 1, a pesar de la escisión completa de la masa intraventricular, la ventriculomegalia se mantuvo sin cambios. Debido al flujo alterado del LCR causado por tumores intraventriculares, la dilatación crónica de los ventrículos (particularmente los ventrículos laterales) se ha observado con frecuencia en humanos (28, 29). Según la teoría de Monroe-Kellie, el tejido cerebral se atrofia cuando los ventrículos se dilatan lentamente. Después de la cirugía, la circulación crónica alterada del LCR se reanudó, pero la pérdida del parénquima cerebral y la dilatación de los ventrículos permanecen sin cambios (28, 29). La hidrocefalia crónica no requiere cirugía VPS (28).
En el caso 2, el ventrículo lateral izquierdo presentó un agrandamiento progresivo. Sospechamos que la conformación del tejido cicatricial dentro de los ventrículos laterales resultó en un flujo alterado del LCR. Este flujo alterado del LCR puede causar dilatación ventricular simétrica o asimétrica. Después de la fase de compensación, la elevación de la presión intracraneal puede desarrollarse y causar signos clínicos, incluyendo alteración del estado de conciencia, convulsiones, anomalías de la marcha y signos vestibulares. VPS se recomienda para prevenir el deterioro del estado neurológico si se desarrolla algún signo neurológico o si las resonancias magnéticas repetidas revelan cualquier progresión de la dilatación ventricular durante el seguimiento (30). Recomendamos la cirugía VPS en este caso, pero fue rechazada por el propietario.
En el caso 3, se confirmó un astrocitoma. Dada la localización rostral de la masa y la falta de realce del contraste, nuestro diagnóstico diferencial preoperatorio basado en las imágenes de RM incluyó principalmente un glioma, linfoma, ependimoma y se consideró poco probable que la TCP fuera poco probable. Sin embargo, durante la cirugía, no observamos ninguna diferencia macroscópica en comparación con los casos anteriores, excepto por la ubicación del tumor. El oligodendroglioma es el tipo más común de glioma que se observa con frecuencia en razas braquicefálicas más antiguas y rara vez está relacionado con el sistema ventricular (31). Además, el astrocitoma que afecta a los ventrículos es extremadamente infrecuente (32). Los gliomas que crecen en los ventrículos se consideran tumores pseudointraventriculares, ya que se originan en la periferia y no en el ventrículo. Sin embargo, el protocolo de tratamiento quirúrgico es el mismo enfoque transcalloso, ya que no se pueden eliminar a través del parénquima cerebral. El tumor fue completamente removible y la ventriculomegalia asociada mostró regresión en los estudios repetidos de RM.
La actividad convulsiva epiléptica fue el principal síntoma clínico preoperatorio en todos los casos. Después de la escisión tumoral, 2 perros desarrollaron epilepsia refractaria. La neoplasia cerebral canina a menudo causa epilepsia estructural asociada a tumores. Los tumores intraventriculares pueden causar dificultades visuales, obnubilación, alteración del comportamiento y alteración de la conciencia (2). Las convulsiones relacionadas con la hidrocefalia se sospechan en medicina veterinaria, pero no se han probado. Sin embargo, algunos artículos han mencionado signos clínicos similares a la epilepsia en perros con hidrocefalia (33-35). En humanos, las lesiones corticales iatrogénicas debidas a procedimientos quirúrgicos pueden causar epilepsia después de craneotomías en el 4-5% de los casos (36). En un estudio veterinario, la incidencia de convulsiones postoperatorias tempranas (EPS) entre perros con tumores intracraneales rostrotentoriales varió de 12,8 a 18,2 % y no se relacionó con la epilepsia estructural previa y el protocolo de mantenimiento prequirúrgico de ASM. Sin embargo, los caninos con EPS tuvieron hospitalizaciones más largas, un mayor riesgo de complicaciones neurológicas y una menor probabilidad de sobrevivir al alta (37). En nuestra serie de casos, como las convulsiones ocurrieron antes de la cirugía, no pudimos determinar cómo las afectó el daño cortical. Sin embargo, en nuestra opinión, se recomienda la medicación anticonvulsiva de por vida después de la craneotomía debido a la posibilidad de daño cortical iatrogénico intraoperatorio.
La callosotomía es una intervención bien conocida para el tratamiento del GTCS grave en humanos. En esto, se realiza una callosotomía del cuerpo anterior de 2/3 versus una callosotomía del cuerpo completa/total para prevenir las convulsiones generalizadas (16, 17). Durante el abordaje transcallosal sólo se realizó callosotomía parcial. En nuestros casos, no se realizó callosotomía total, lo que puede haber contribuido para el desarrollo de convulsiones generalizadas; sin embargo, se recomienda una exposición quirúrgica mínima durante la extirpación del tumor para prevenir una mayor invasividad. En el caso 1, es muy probable que las ASM, en lugar de la callosotomía parcial, previnieran las convulsiones generalizadas y condujeran solo a convulsiones focales.
Nuestro estudio estuvo limitado por el pequeño tamaño de la muestra de perros que se sometieron a cirugía transcallosa y tratamiento conservador. Se necesita un gran tamaño de muestra para obtener una experiencia sólida con respecto a los resultados a largo plazo de los tumores intraventriculares tratados quirúrgicamente en perros.
5. Conclusión
Siguiendo y aplicando los enfoques neuroquirúrgicos humanos actuales, nuestros resultados muestran que la escisión transcallosa de los tumores ventriculares laterales es factible. En nuestra opinión, si el tumor se puede extirpar mediante escisión, debe extirparse como tratamiento curativo primario, seguido de radioterapia o cirugía VPS si es necesario. En los 3 casos, fue posible la extirpación completa del tumor, lo que prolongó los tiempos de supervivencia de los perros en comparación con los que se sometieron a un tratamiento conservador. En los casos con CPT, la ventriculomegalia permaneció estática o incluso mostró dilatación progresiva a pesar de la extirpación del tumor, muy probablemente debido a la formación de tejido cicatricial en los ventrículos. La cirugía VPS se recomienda cuando el diagnóstico por imágenes revela dilatación ventricular progresiva y se exhiben los síntomas neurológicos correspondientes. En todos los casos, las convulsiones epilépticas ocurrieron antes de la cirugía y persistieron después de que se extirpó la masa. Por lo tanto, se recomendó el tratamiento ASM de por vida.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo / material complementario, las consultas adicionales pueden dirigirse al autor correspondiente.
Declaración ética
No se requirió aprobación ética para los estudios con animales de acuerdo con la legislación local y los requisitos institucionales porque tenemos el consentimiento por escrito de los propietarios. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones del autor
LL, KC y GN realizaron las cirugías. CP evaluó los datos radiológicos. LL y KC escribieron el primer borrador del manuscrito. PC, KD y GN escribieron secciones del manuscrito. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Reconocimientos
Los autores desean agradecer a VetScan Ltd., Judit Benczik y Borbála Lőrincz por realizar el diagnóstico por imágenes. Además, gracias a Csaba Jakab por realizar estudios histopatológicos y a FuzioVet Referral Clinic por el manejo perioperatorio de los animales.
Conflicto de intereses
KC es empleado de LimesVet Ltd. PC es empleado de RadioVet Bt. KD es empleado de Medivet Birstall.
Los autores restantes declaran que la investigación se realizó en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Vail, DM, Thamm, DH y Liptak, JM. Oncología clínica de pequeños animales de Withrow y MacEwen. MO: W.B. Saunders (2020).
2. Miller, AD, Miller, CR y Rossmeisl, JH. Cáncer intracraneal primario canino: una revisión clínica-patológica y comparativa de glioma, meningioma y tumores del plexo coroideo. Frente Oncol. (2019) 9:1151. doi: 10.3389/fonc.2019.01151
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. de Witt, AA, Lewis, M, y Schoeman, JP. Carcinoma del plexo coroideo en un perro: informe de caso. Informes de casos de registros veterinarios. (2022) 10:E403. DOI: 10.1002/VRC2.403
4. Westworth, DR, Dickinson, PJ, Vernau, W, Johnson, EG, Bollen, AW, Kass, PH, et al. Tumores del plexo coroideo en 56 perros (1985-2007). J Vet Pasante Med. (2008) 22:1157–65. doi: 10.1111/j.1939-1676.2008.0170.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Stoica, G, Levine, J, Wolff, J, y Murphy, K. Tumores astrocíticos caninos: una revisión comparativa. Veterinario Pathol. (2011) 48:266–75. doi: 10.1177/0300985810389543
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Snyder, JM, Shofer, FS, Van Winkle, TJ, and Massicotte, C. Canine intracranial primary neoplasia: 173 cases (1986-2003). J Vet Pasante Med. (2006) 20:669–75. doi: 10.1892/0891-6640(2006)20[669:cipnc]2.0.co; 2
7. Roth, J, and Constantini, S. Hydrocephalus and brain tumors In: DD Limbrick Jr and JR Leonard, editors. Trastornos del líquido cefalorraquídeo: implicaciones de por vida. Cham: Springer International Publishing (2019). 199–217.
8. Antonakakis, MG, Carletti, BE, Anselmi, C, McGrath, S, and Minguez, JJ. Use of a telovelar approach for complete resection of a choroid plexus tumor in a dog. Veterinario Surg. (2022) 51:1273–9. DOI: 10.1111/VSU.13859
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Hosmann, A, Hinker, F, Dorfer, C, Slavc, I, Haberler, C, Dieckmann, K, et al. Manejo de los tumores del plexo coroideo: una experiencia institucional. Acta Neurochir. (2019) 161:745–54. DOI: 10.1007/S00701-019-03832-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. MDHRW. Cirugía neurológica de Youmans y Winn: 4 – conjunto de volúmenes. 8ª ed. Ámsterdam: Elsevier (2022).
11. Teske, N, Chiquillo-Domínguez, M, Skrap, B, Harter, PN, Rejeski, K, Blobner, J, et al. La dependencia de la derivación en los tumores intraventriculares supratentoriales depende de la extensión de la resección tumoral. Acta Neurochir. (2023) 165:1053–64. DOI: 10.1007/S00701-023-05532-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Beckmann, K, Kowalska, M, y Meier, V. Solitary intraventricular tumors in dogs and cats treated with radiotherapy alone or combined with ventriculoperitoneal shunts: a retrospective descriptive case series. J Vet Pasante Med. (2023) 37:204–15. DOI: 10.1111/JVIM.16583
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Kasowski, H, y Piepmeier, JM. Abordaje transcallosal para tumores del ventrículo lateral y tercero. Neurosurg Focus. (2001) 10:1–5. doi: 10.3171/foc.2001.10.6.4
14. Raybaud, C. El cuerpo calloso, las otras grandes comisuras del prosencéfalo y el tabique pelúcido: anatomía, desarrollo y malformación. Neurorradiología. (2010) 52:447–77. DOI: 10.1007/S00234-010-0696-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. van der Knaap, LJ, y van der Ham, IJM. ¿Cómo media el cuerpo calloso la transferencia interhemisférica? Behav Brain Res. (2011) 223:211–21. doi: 10.1016/j.bbr.2011.04.018
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Jea, A, Vachhrajani, S, Widjaja, E, Nilsson, D, Raybaud, C, Shroff, M, et al. La callosotomía del cuerpo en niños y los síndromes de desconexión: una revisión. Childs Nerv Syst. (2008) 24:685–92. DOI: 10.1007/S00381-008-0626-4
17. Markosian, C, Patel, S, Kosach, S, Goodman, RR, and Tomycz, LD. Corpus Callosotomy in the modern era: origins, efficacy, technical variations, complications, and indications. Neurosurg Mundial. (2022) 159:146–55. doi: 10.1016/j.wneu.2022.01.037
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Bagley, RS, Baszler, TV, Harrington, ML, Pluhar, GE, Moore, MP, Keegan, RD, et al. Efectos clínicos de la división longitudinal del cuerpo calloso en perros normales. Veterinario Surg. (1995) 24:122–7. doi: 10.1111/j.1532-950X.1995.tb01306.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Asada, R, Mizuno, S, Yu, Y, Hamamoto, Y, Anazawa, T, Ito, D, et al. Corpus Callosotomy in 3 cavalier king Charles spaniel dogs with drug-resistant epilepsy. Cerebro Sci. (2021) 11:1462. doi: 10.3390/brainsci11111462
20. Lehner, L, Czeibert, K, Jakab, C, Benczik, J, and Nagy, G. Transcallosal removal of a choroid plexus tumor from the lateral ventrle in a dog. Caso clínico. Frente Veterinaria Sci. (2020) 7. DOI: 10.3389/FVETS.2020.00536
21. Wrede, B, Liu, P, y Wolff, JEA. La quimioterapia mejora la supervivencia de los pacientes con carcinoma del plexo coroideo: un metanálisis de casos individuales con tumores del plexo coroideo. J Neuro-Oncol. (2007) 85:345–51. DOI: 10.1007/S11060-007-9428-X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Dickinson, PJ. Avances en las modalidades de diagnóstico y tratamiento de tumores intracraneales. J Vet Pasante Med. (2014) 28:1165–85. DOI: 10.1111/JVIM.12370
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Orlandi, R, Vasilache, CG, and Mateo, I. Palliative ventriculoperitoneal shunting in dogs with obstructive hydrocephalus caused by tumors affecting the third ventritrle. J Vet Pasante Med. (2020) 34:1556–62. DOI: 10.1111/JVIM.15818
24. Palamar, OI, Huk, AP, Teslenko, DS, Aksyonov, RV, Okonskyi, DI y Lazko, NV. Complicaciones postoperatorias en la cirugía transcortical frontal endoscópica de tumores laterales y del tercer ventrículo: trastornos del habla. Neurocirugía rumana. (2021) 35:444–51. DOI: 10.33962/roneuro-2021-075
25. El-Bendary, Y, Apra, C, Aldea, S, Chauvet, D, Dorfmüller, G, Ferrand-Sorbets, S, et al. Preservación de los tractos frontales de sustancia blanca en cirugía ventricular: favoreciendo un abordaje transcallosal interhemisférico anterior vs abordaje transventricular transfrontal transcortical. Neurosurg Rev. (2022) 45:3349–59. DOI: 10.1007/S10143-022-01841-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Ginat, D, y Westesson, P-LA. Atlas de neurorradiología posquirúrgica: imágenes del cerebro, la columna vertebral, la cabeza y el cuello. 2ª ed. Estados Unidos: Springer International Publishing (2017).
27. Hermanson, JW, De, LA, y Evans, HE. Anatomía del perro de Miller y Evans. 5ª ed. St. Louis, Missouri: Elsevier (2020).
28. Alselisly, AMA, Ashry, AH, y Mahmoud, AT. Hidrocefalia con lesiones ventriculares laterales: serie de casos y revisión de la literatura. J Neurol egipcio, psiquiatría y neurocirugía. (2021) 57:31. DOI: 10.1186/S41983-021-00283-7
29. Suzuki, T. Tratamiento para la hidrocefalia causada por tumores intraventriculares. No Shinkei Geka. (2022) 50:429–40. DOI: 10.11477/MF.1436204570
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Zhang, C, Ge, L, Li, Z, Zhang, T, and Chen, J. Single-center retrospective analysis of risk factors for hydrocephalus after lateral ventricular tumor resection. Cirugía frontal. (2022) 9:886472. doi: 10.3389/fsurg.2022.886472
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Pupin, RC, Rissi, DR, Gomes, DC, Gimelli, A, y Palumbo, MIP. Astrocitoma de alto grado con invasión ventricular en un perro. Informes de casos de registros veterinarios. (2019) 7:E000958. DOI: 10.1136/vetreccr-2019-000958
32. Rissi, DR, Levine, JM, Eden, KB, Watson, VE, Griffin, JF, Edwards, JF, et al. Oligodendroglioma cerebral que imita la neoplasia intraventricular en tres perros. J Vet Diagn Investig. (2015) 27:396–400. doi: 10.1177/1040638715584619
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Watson, F, Coppi, AA, Volk, HA, Packer, RMA, Tauro, A, and Rusbridge, C. Comparison of volume of the forebrain, subarachnoid space and lateral ventriles between dogs with idiopathic epilepsy and controls using a stereological approach: Cavalieri’s principle. Canine Med Genetics. (2021) 8:3. DOI: 10.1186/S40575-021-00101-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Tirrito, F, Cozzi, F, Bonaldi, M, Corazzo, S, Contiero, B, and Lombardo, R. Ventriculomegaly in cavalier king Charles spaniels with Chiari-like malformation: relationship with clinical and imaging findings. J Vet Med Sci. (2022) 84:1185–93. DOI: 10.1292/JVMS.22-0134
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Farke, D, Kolecka, M, Czerwik, A, Wrzosek, M, Schaub, S, Kramer, M, et al. Prevalencia de convulsiones en perros y gatos con hidrocefalia interna idiopática y prevalencia de convulsiones después de la implantación de una derivación ventriculo-peritoneal. J Vet Pasante Med. (2020) 34:1986–92. DOI: 10.1111/JVIM.15890
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Horiuchi, S, Kanaya, K, y Horiuchi, T. La ocurrencia y relación de la convulsión postoperatoria y la epilepsia de novo después de la cirugía de craneotomía: un estudio de cohorte retrospectivo de un solo centro. Surga frontal. (2022) 9:881874. doi: 10.3389/fsurg.2022.881874
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Parker, RL, Du, J, Shinn, RL, Drury, AG, Hsu, F-C, Roberston, JL, et al. Incidencia, factores de riesgo y resultados de las convulsiones postoperatorias tempranas en perros con tumores cerebrales rostrotentoriales después de la cirugía intracraneal. J Vet Pasante Med. (2022) 36:694–701. DOI: 10.1111/JVIM.16391
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: transcallosal, perro, ventrículo lateral, tumor del plexo coroideo, cirugía, craneotomía, astrocitoma, ventriculomegalia
Cita: Lehner L, Czeibert K, Csébi P, Diószegi K y Nagy G (2023) Informe de caso: extirpación intraventricular del tumor mediante enfoque transcallosal y seguimiento en tres perros. Frente. Vet. Sci. 10:1240934. doi: 10.3389/fvets.2023.1240934
Recibido: 15 de junio de 2023; Aprobado: 06 Septiembre 2023;
Publicado: 25 septiembre 2023.
Editado por:
Daisuke Hasegawa, Universidad Nippon de Veterinaria y Ciencias de la Vida, Japón
Revisado por:
John Henry Rossmeisl, Virginia Tech, Estados Unidos
Shinichi Kanazono, Especialistas Veterinarios y Centro de Emergencias, Japón
Copyright © 2023 Lehner, Czeibert, Csébi, Diószegi y Nagy. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY). S
*Correspondencia: László Lehner, dr.lehner.laszlo@gmail.com
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía