Factores de riesgo para Enterobacterales resistentes a los antimicrobianos en perros
 Esa Karalliu1
Esa Karalliu1 Kai Yeung Chung1
Kai Yeung Chung1 Brett MacKinnon2
Brett MacKinnon2 Belete Haile1
Belete Haile1 Pawel M. Beczkowski2
Pawel M. Beczkowski2 Vanessa R. Barrs2
Vanessa R. Barrs2 Ibrahim Elsohaby1*
Ibrahim Elsohaby1* Omid Nekouei1*
Omid Nekouei1*- 1Departamento de Enfermedades Infecciosas y Salud Pública, Facultad de Medicina Veterinaria y Ciencias de la Vida del Jockey Club, Universidad de la Ciudad de Hong Kong, Hong Kong, RAE de Hong Kong, China
- número arábigoDepartamento de Ciencias Clínicas Veterinarias, Centro de Salud y Bienestar Animal, Facultad de Medicina Veterinaria y Ciencias de la Vida del Jockey Club, Universidad de la Ciudad de Hong Kong, Hong Kong, RAE de Hong Kong, China
La identificación de los factores de riesgo asociados con el transporte de bacterias resistentes a los antimicrobianos (RAM) en los perros es crucial para comprender su epidemiología y para desarrollar y perfeccionar medidas de control específicas. Sin embargo, los datos pertinentes están dispersos y se han reportado hallazgos contradictorios. Esta revisión sistemática tuvo como objetivo compilar los factores de riesgo asociados con la transmisión de AMR-Enterobacterales en perros en todo el mundo e identificar brechas de conocimiento relevantes para dirigir investigaciones futuras. Se realizó una revisión sistemática de acuerdo con las directrices PRISMA, buscando en las bases de datos PubMed, CABi y Scopus estudios que informaran sobre los factores de riesgo para la adquisición de AMR-Enterobacterales en perros. Después de seleccionar los estudios en inglés revisados por pares por título/resumen, los estudios elegibles se sometieron a una evaluación de texto completo, extracción de datos, evaluación de riesgo de sesgo y síntesis cualitativa. En la búsqueda inicial se identificaron 774 artículos, incluyendo 274 duplicados. Después de la selección por título/resumen, 77 artículos se sometieron a una revisión de texto completo, de los cuales finalmente se seleccionaron 40 para la extracción de datos, incluidos 29 estudios transversales, seis estudios de cohorte y cinco estudios de casos y controles. Los factores de riesgo más frecuentemente investigados para la transmisión de AMR-Enterobacterales en perros fueron el uso de antimicrobianos (28 de 40), la edad (24), el sexo (22), la hospitalización (19) y la alimentación con dieta cruda (14). De estos, el uso de antimicrobianos fue el factor de riesgo más común asociado significativamente con la RAM-Enterobacterales (19/28), seguido de la dieta cruda (9/14) y la hospitalización (8/19). Nuestra síntesis enfatizó la importancia de aumentar la conciencia sobre el uso prudente de antimicrobianos (CIA) de importancia crítica, como las fluoroquinolonas, en las prácticas de animales de compañía, fortalecer los procedimientos de prevención y control de infecciones en clínicas y hospitales veterinarios y educar a los cuidadores sobre los riesgos potenciales de alimentar a los niños con dietas crudas para reducir la carga de bacterias AMR en los perros.
1 Introducción
La resistencia a los antimicrobianos (RAM) ha sido incluida en la lista de las 10 principales amenazas para la salud pública mundial por la Organización Mundial de la Salud (OMS) (1). Según una revisión publicada en 2019, la resistencia a los antimicrobianos causó directamente más de 1,2 millones de muertes y se asoció indirectamente con casi cinco millones de muertes en humanos (2). En ausencia de medidas de control eficaces, las muertes debidas a la resistencia a los antimicrobianos podrían alcanzar a 10 millones de personas al año para 2050 (3).
La resistencia a los antimicrobianos es un problema crítico de «Una sola salud» debido al uso extensivo de antimicrobianos y la posible transmisión de bacterias resistentes y sus genes entre humanos, animales y su nicho ecológico (4, 5). Los animales de compañía, en particular perros y gatos, han sido identificados como potenciales reservorios y portadores de bacterias AMR, principalmente debido a la administración frecuente de fármacos antimicrobianos en las prácticas de pequeños animales y su estrecho contacto con los humanos (6). Se han aislado bacterias de la resistencia a los antimicrobianos con genotipos idénticos o similares de animales de compañía y sus cuidadores, lo que indica su probable transmisión entre humanos y animales de compañía (7-9). Esta fuente de bacterias AMR es cada vez más preocupante porque la población de mascotas está aumentando a nivel mundial, se forman fuertes lazos entre los animales y sus cuidadores y, a menudo, se les trata como miembros de la familia con un contacto físico cercano frecuente (10, 11).
Los mecanismos de selección y propagación de la resistencia a los antimicrobianos varían entre las diferentes especies bacterianas y pueden ser complejos y multifactoriales (12). El orden Enterobacterales incluye Escherichia coli y Klebsiella pneumoniae, clasificadas en el grupo de prioridad crítica por la OMS debido a su importante amenaza de resistencia a los antimicrobianos para la salud pública y su alta prevalencia (1). Estos organismos plantean un reto considerable en la lucha mundial contra la resistencia a los antimicrobianos, lo que justifica un seguimiento y una investigación específicos para mitigar su impacto negativo en los animales y la salud pública.
Los principales factores de riesgo identificados para la portación o infección por AMR-Enterobacterales en perros incluyen el uso de antimicrobianos, la alimentación, las dietas de carne cruda y la hospitalización (13-15). Algunos estudios también han identificado la edad, el sexo y la raza como posibles factores de riesgo; Sin embargo, hay hallazgos contradictorios entre algunos estudios y los factores investigados varían. Es necesario identificar los factores de riesgo importantes que contribuyen a la portación de AMR-Enterobacterales para comprender mejor su epidemiología y desarrollar estrategias de prevención y control personalizadas. Los objetivos de esta revisión sistemática fueron compilar la evidencia publicada sobre los factores de riesgo para la portación de AMR-Enterobacterales en perros reportados en todo el mundo e identificar brechas de conocimiento relevantes para dirigir futuras investigaciones.
2 Métodos
Esta revisión sistemática se llevó a cabo de acuerdo con las directrices de Preferred Reporting Items for Systematic Reviews and Meta-Analysis (PRISMA) (16).
2.1 Criterios de elegibilidad
Se incluyeron en nuestra revisión sistemática los estudios que informaron sobre los factores de riesgo para portar o detectar AMR-Enterobacterales en perros de todo el mundo. La búsqueda se limitó a estudios revisados por pares publicados en inglés. No hubo limitaciones de fecha ni geográficas para la inclusión. Se incluyeron estudios con perros solos o perros con otras especies animales (especies mixtas); sin embargo, los datos relevantes solo se extrajeron para los perros. Se excluyeron los estudios sobre bacterias no Enterobacterales, publicados en idiomas distintos al inglés, puramente experimentales, revisiones y literatura gris.
2.2 Estrategia de búsqueda
La última búsqueda de artículos elegibles se realizó en diciembre de 2023 utilizando tres bases de datos electrónicas (PubMed, CABi y Scopus) y tres dominios principales con términos de búsqueda relevantes ((perro OR perros OR canino*) Y (resistencia a los antimicrobianos* O RAMA O resistencia a los antibióticos*) Y (Factor de riesgo* O factor protector*)). La cadena de búsqueda inicial se mantuvo amplia para capturar todos los artículos posiblemente relevantes, y se consultó a un bibliotecario experto de la Universidad de la Ciudad de Hong Kong para confirmar y ajustar la cadena para que fuera compatible con cada base de datos.
2.3 Cribado y selección de estudios
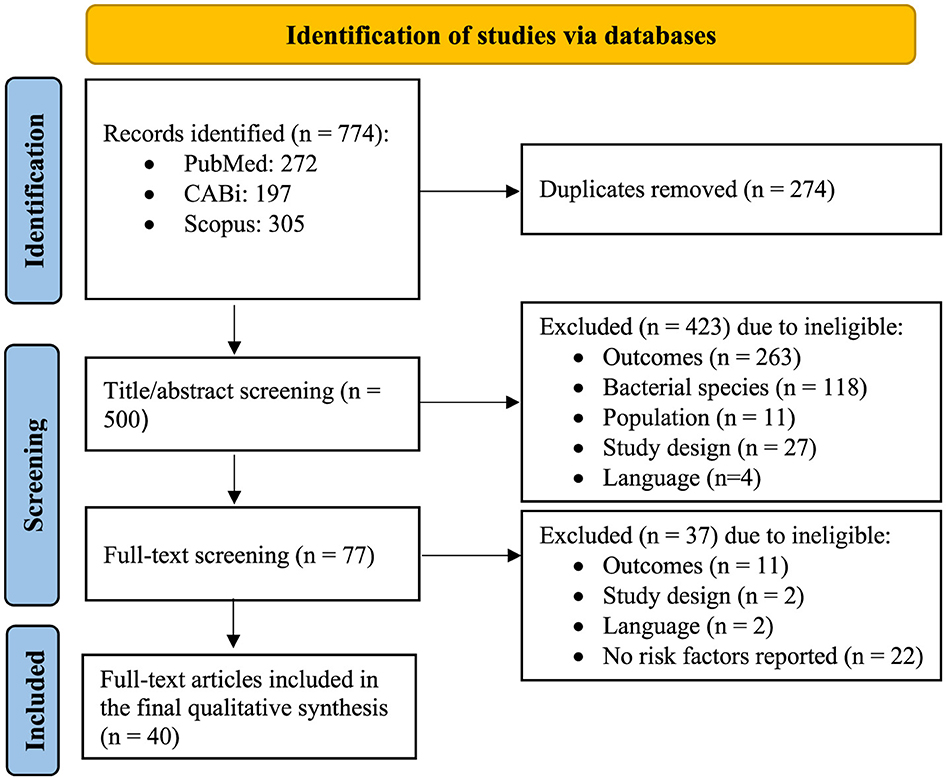
En la búsqueda inicial, los estudios identificados de las tres bases de datos se exportaron a EndNote V 20.6 (Clavariate Analytics, 2020) y se eliminaron los duplicados. Los estudios restantes se cargaron en el software Rayyan QCRI (http://rayyan.qcri.org) (17), y cada estudio se seleccionó por título/resumen, seguido de una revisión de texto completo de cada estudio elegible identificado para garantizar la relevancia. Dos revisores llevaron a cabo de forma independiente el proceso de selección y selección. Cualquier desacuerdo fue resuelto por un tercer revisor independiente. En la Figura 1 se resumen todas las etapas del proceso de selección y selección del estudio.
2.4 Extracción de datos
Las siguientes variables e información se extrajeron del cuerpo y del material complementario de los estudios elegibles y se ingresaron en una tabla de extracción de datos en Microsoft Excel™ diseñada para este estudio: (1) Características generales del estudio (título, autores, nombre de la revista, año de publicación, país del estudio realizado, objetivos), (2) Metodología (tipo de estudio, duración del estudio, métodos de muestreo), (3) Características de la población animal (especies, número, sexo, edad, raza, estado de castración), (4) Especies bacterianas aisladas, (5) Patrones de RAM (p. ej., BLEE), (6) Prueba de susceptibilidad a los antimicrobianos (AST) realizada, (7) Genes de AMR detectados, (8) Análisis estadístico realizado y (9) Factores investigados (factores de riesgo y de protección investigados).
2.5 Clasificación de los factores de riesgo
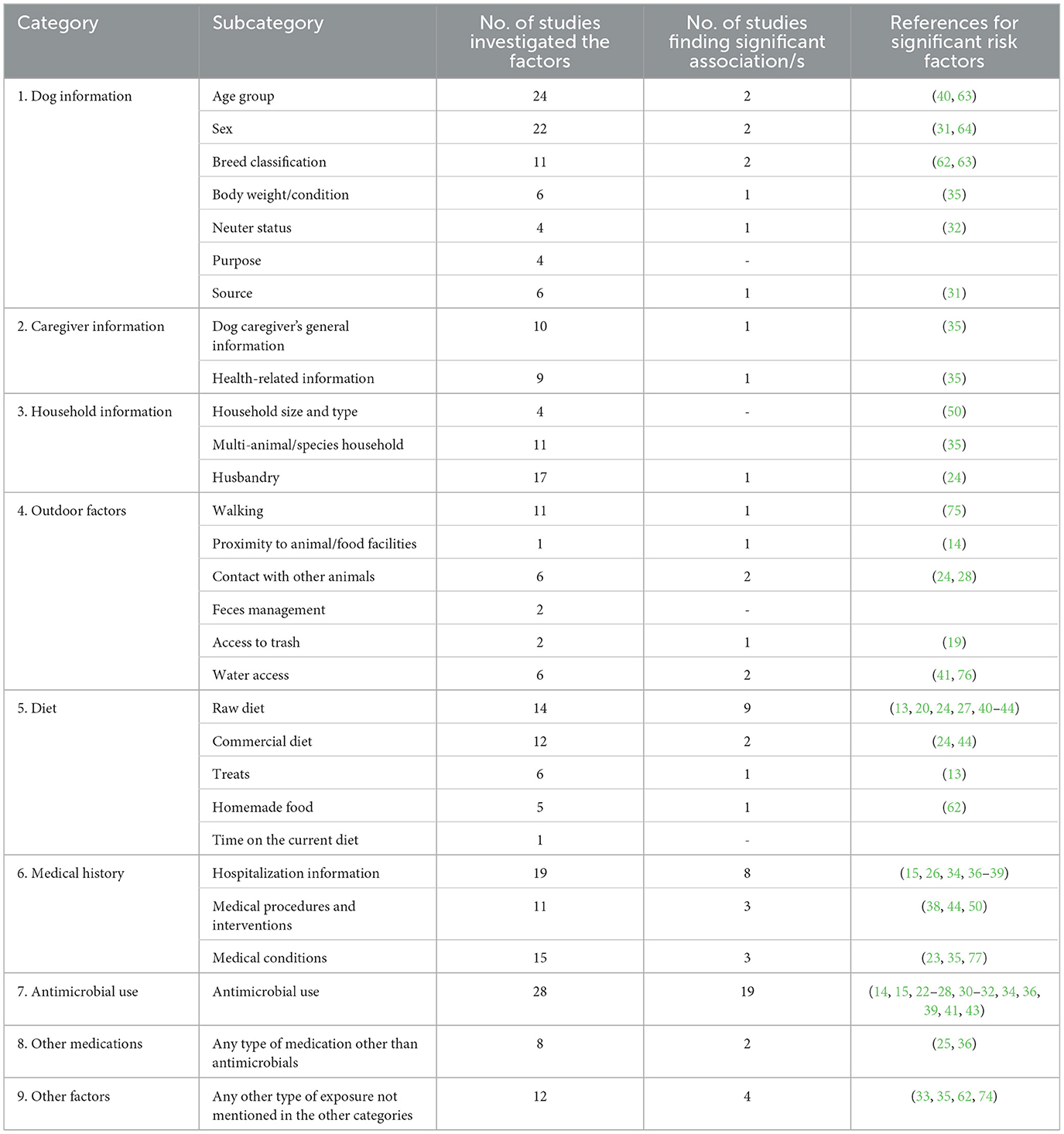
Todas las variables predictoras investigadas para la resistencia a los antimicrobianos-enterobacterias, incluidos los factores de riesgo/protección (en adelante, «factores de riesgo»), extraídas de los estudios finales seleccionados, se clasificaron en nueve categorías principales en función de sus similitudes con el fin de proporcionar evaluaciones resumidas claras (Tabla 1). La mayoría de los estudios investigaron un gran número de variables predictoras y se incluyeron en múltiples categorías de factores de riesgo. Las principales categorías, subcategorías y significación estadística de las asociaciones entre los factores de riesgo reportados y la aparición de AMR-Enterobacterales se resumen en la Tabla 1, y con más detalles (por ejemplo, todas las variables predictoras estudiadas por subcategoría) en la Tabla Suplementaria 1.
2.6 Evaluación de la calidad de los estudios incluidos
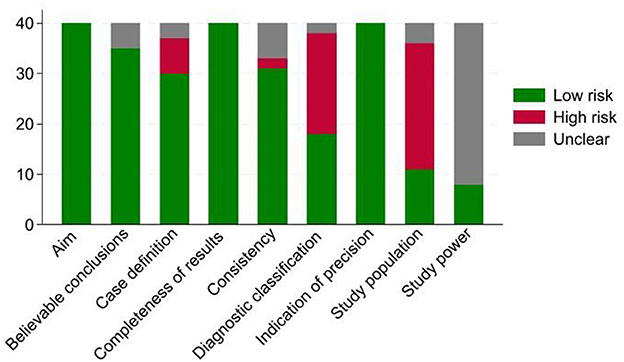
La calidad de los estudios incluidos se evaluó utilizando las notas guía del Manual Cochrane for Systematic Reviews of Interventions (Cochrane Handbook for Systematic Reviews of Interventions) (18), que se adaptaron a nuestros tipos de estudio. Se trata de una evaluación basada en dominios que incluye 10 dominios principales de evaluación de la calidad (objetivo, población de estudio, potencia del estudio, enmascaramiento, definición de caso, clasificación diagnóstica, indicación de precisión, integridad de los resultados, conclusiones creíbles y consistencia). Las evaluaciones críticas se realizaron por separado para cada dominio. El riesgo de sesgo para cada dominio se definió como alto, bajo o incierto, sobre la base de una revisión detallada de cada estudio seleccionado.
3 Resultados
3.1 Selección de estudios
En total, se identificaron 774 artículos en la búsqueda inicial de las tres bases de datos, incluidos 272 en PubMed, 197 en CABi y 305 en Scopus. El flujo de trabajo y los números correspondientes de los artículos en cada etapa se resumen en la Figura 1. Después de eliminar los duplicados, quedaron 500 artículos únicos para la selección de títulos/resúmenes. Posteriormente, se seleccionaron 77 artículos para la revisión a texto completo, de los cuales, 37 fueron excluidos debido a: (1) no informar ningún factor de riesgo (22/37), (2) resultados irrelevantes (11/37), (3) diseño del estudio (2/37) y (4) lenguaje (2/37) (Figura 1). Finalmente, 40 estudios fueron elegibles para la extracción completa de los datos.
3.2 Características de los estudios incluidos
Los 40 estudios incluidos en la síntesis cualitativa final fueron observacionales, incluidos 29 estudios transversales, seis estudios de cohorte y cinco estudios de casos y controles. Todos los estudios se publicaron entre 2006 y 2023 y se realizaron con mayor frecuencia en Europa (16/40), seguida de América del Norte (8/40), Asia (8/40), América del Sur (4/40), Australia (3/40) y África (1/40).
La mayoría de los estudios (26/40) siguieron una estrategia de muestreo no aleatorio, y 10 informaron un muestreo aleatorio para la selección de los participantes. Cuatro estudios no proporcionaron detalles explícitos sobre los métodos de muestreo (19-21). La edad de los perros estudiados osciló entre 1 mes y 17 años.
E. coli fue la bacteria más frecuentemente investigada y aislada en estos estudios (30/40), seguida de Klebsiella (5/40), Salmonella (3/40), Citrobacter (3/40). Nueve estudios (de 40) informaron el aislamiento simultáneo de múltiples especies bacterianas de la siguiente manera: 3 informaron simultáneamente E. coli y Salmonella; otros 3 aislaron E. coli y Klebsiella; un estudio detectó E. coli y Citrobacter; un estudio reportó E. coli, Klebsiella, Citrobacter y Morganella; y el restante reportó E. coli, Klebsiella, Citrobacter, Proteus y Enterobacter. Ningún estudio informó la detección de Shigella, Yersinia o Serratia.
El tipo de RAM notificado con mayor frecuencia fue la E. coli productora de betalactamasas de espectro extendido (BLEE) (19/40). Ocho estudios informaron sobre E. coli multirresistente (MDR). Todos los estudios realizaron AST, incluyendo difusión en disco (22/40) y concentración inhibitoria mínima (CMI) (18/40). Más de la mitad (24/40) utilizaron los puntos de corte recomendados por las directrices del Clinical and Laboratory Standards Institute (CLSI), mientras que 4/40 utilizaron las directrices del Comité Europeo de Pruebas de Susceptibilidad a los Antimicrobianos (EUCAST), 7/40 informaron tanto de EUCAST como de CLSI, 3/40 aplicaron las directrices de la Sociedad Británica de Quimioterapia Antimicrobiana (BSAC) y 2/40 no informaron sobre el uso de ninguna guía específica.
3.3 Factores de riesgo reportados
Las variables predictoras más comúnmente investigadas para la portación de AMR-Enterobacterales en perros fueron el uso de antimicrobianos (28/40), la edad (24/40), el sexo (22/40), la hospitalización (19/40) y la dieta cruda (14/40) (Tabla 1). El factor de riesgo estadísticamente significativo identificado más frecuente fue el uso previo de antimicrobianos (19/28). Cinco estudios informaron que el uso previo de antibióticos (sin especificar las clases de antibióticos) estaba significativamente relacionado con E. coli resistente a BLEE y carbapenémicos (22-26). Con respecto al período de tiempo de uso de antibióticos, seis estudios revelaron una asociación positiva entre el momento de la administración de antimicrobianos (de 10 días a un año) con la BLEE, la resistencia a la ampicilina (AmpCC) y la portadora de 3GCR-E. coli (14, 27-31).
Para clases específicas de antimicrobianos, siete estudios investigaron clases específicas de antimicrobianos, de los cuales, cuatro informaron que el uso previo de fluoroquinolonas se asoció significativamente con BLEE, resistencia a las quinolonas y MDR-E. coli (15, 32-34). Un estudio asoció fluoroquinolonas, cefalosporinas, penicilina betalactamasa con E. coli 3-GCR, productora de AmpC y resistente a las fluoroquinolonas (35). Un estudio informó que las fluoroquinolonas y las cefalosporinas estaban asociadas con ESBL-E. coli (32), mientras que otro estudio asoció el uso de cefalosporinas y nitroimidazol con MDR-E. coli (36).
Por último, un estudio mostró que el uso de antimicrobianos en cualquier especie de animal doméstico en los últimos 6 meses y la compra de antimicrobianos en una tienda de alimentos para mascotas se asociaron significativamente con 3-GCR y ESBL-E. coli (14).
Otros factores de riesgo comunes que se asociaron significativamente con la transmisión de AMR-Enterobacterales en perros fueron la dieta cruda (9/14) y la hospitalización (8/19). La hospitalización prolongada (≥3 días) aumentó el riesgo de contraer ESBL-E. coli, ESBL-K. pneumoniae y MDR-E. coli (4/8) (15, 36–38). Además, se encontró que estar hospitalizado y asistir a una consulta de referencia son factores de riesgo para E. coli productora de BLEE y AmpC, respectivamente (3/8) (34, 35, 39). La alimentación de los perros con carne cruda se asoció con 3-GCR- y ESBL-E. coli en nueve estudios (13, 20, 27, 40-44), de los cuales, dos informaron una asociación significativa entre el consumo de pollo crudo y la resistencia a los antimicrobianos Salmonella y E. coli (43, 44). Sin embargo, no se identificó una asociación significativa entre la frecuencia de consumo de alimentos crudos y la aparición de la presencia de bacterias AMR en estos estudios.
Los odds ratios y los correspondientes intervalos de confianza para cada factor (estadísticamente significativos o no), cuando se informaron en los 40 estudios, se incluyen en la Tabla Suplementaria 2.
3.4 Evaluación de la calidad (riesgo de sesgo)
El dominio «enmascaramiento» se eliminó de nuestro análisis porque no es relevante para los estudios observacionales. En la Figura 2 se resume el número de artículos con riesgo de sesgo bajo, poco claro o alto (de 40) para cada dominio. Los principales factores que condujeron a un alto riesgo de sesgo fueron el muestreo no aleatorio, pequeño y conveniente (62,5% de los estudios) y la falta de información sobre las posibles variables que podrían conducir al sesgo (50%). Además, en el 80% de los estudios, los autores no informaron cómo se calculó el tamaño de la muestra; Por lo tanto, el riesgo de sesgo con respecto a la potencia del estudio no estaba claro.
4 Discusión
Hasta donde sabemos, esta es la primera revisión exhaustiva que sintetiza los factores de riesgo asociados con la portación de AMR-Enterobacterales en perros a escala mundial. Al compilar una amplia gama de factores de riesgo, nuestro objetivo era proporcionar una visión general de los factores de riesgo que podrían contribuir a la adquisición y propagación de la resistencia a los antimicrobianos en perros en todo el mundo. El factor de riesgo más comúnmente reportado fue el uso de antimicrobianos. Las fluoroquinolonas, las cefalosporinas, las penicilinas betalactamasas y los nitroimidazoles se encontraban entre las clases antimicrobianas significativamente asociadas con la E. coli de tercera generación resistente a las cefalosporinas, productora de AmpC y resistente a las quinolonas (35). Es probable que este hallazgo se deba al uso extensivo de estos medicamentos en las prácticas de animales de compañía y en la medicina veterinaria en general (45). De hecho, la OMS, la Organización Mundial de Sanidad Animal y la Agencia Europea de Medicamentos consideran que las fluoroquinolonas son «antimicrobianos de máxima prioridad e importancia crítica» (CIA) con una alta probabilidad y consecuencias (riesgo) de desarrollo de RAM (46, 47).
Además del uso de antimicrobianos, nuestro estudio reveló varios otros factores de riesgo médicamente importantes que pueden afectar la transmisión de AMR-Enterobacterales en perros. La hospitalización fue el tercer factor de riesgo más común reportado. La estancia hospitalaria prolongada se asocia con una mayor probabilidad de exposición a superficies y objetos contaminados, contacto con otros animales hospitalizados e interacción con el personal del hospital (48). Se sabe que estos factores también contribuyen a la transmisión de las bacterias AMR en estudios en humanos (49). Dos estudios han realizado un análisis en profundidad de los factores de riesgo en los hospitales veterinarios, examinando unidades hospitalarias específicas, como oncología, neurología, ortopedia, cardiología y otras (37, 50). Entre estos factores, se encontró que la exposición a la anestesia, la cirugía, el diagnóstico por imágenes y la intubación tienen una asociación significativa con la adquisición de E. coli resistente a los carbapenémicos y blaNDM-5 (50). Estos hallazgos son consistentes con otros estudios publicados en humanos, que han destacado la importancia de los servicios y dispositivos médicos en la atención al paciente como un factor que contribuye a la transmisión de infecciones y bacterias AMR (51, 52). Sin embargo, a diferencia de lo que ocurre en el ámbito de la salud humana, en la medicina veterinaria, se afirma que la reutilización de algunos dispositivos, como los tubos endotraqueales, es relativamente común, lo que puede suponer un grave riesgo en cuanto a la adquisición y propagación de patógenos de la resistencia a los antimicrobianos (50). Estos hallazgos exigen que se refuercen los procedimientos de prevención y control de infecciones y que se implemente una vigilancia activa en las clínicas y hospitales veterinarios, particularmente en los países en desarrollo.
Se informó de una asociación significativa entre las enfermedades crónicas o recurrentes y las enfermedades MDR-E. coli y ESBL-E. coli en dos estudios (de 14), en los que se encontró que los perros con infecciones crónicas del tracto urinario (ITU) previamente tratados con antimicrobianos tenían ocho veces más probabilidades de portar MDR-E. coli en comparación con los perros con ITU agudas y sin antecedentes de tratamiento antimicrobiano previo (23, 35). Estos hallazgos sugirieron que el uso prolongado de antimicrobianos para el tratamiento de enfermedades crónicas puede contribuir sustancialmente a un mayor riesgo de contraer infecciones por AMR-E. coli. Curiosamente, la vacunación anual y el tratamiento preventivo contra el gusano del corazón en los últimos 6 meses demostraron un efecto protector significativo contra la AMR-Salmonella spp. y la AMR-E. coli (53). Otros estudios no han reportado esta asociación, lo que sugiere que estas variables pueden haber servido como indicadores de la exposición constante a la atención veterinaria (44).
Algunos estudios han demostrado que el estilo de vida y las elecciones dietéticas pueden influir significativamente en los patrones de resistencia. Por ejemplo, nueve (de 14) estudios que investigaron la dieta cruda encontraron una asociación significativa entre el consumo de carne cruda y AMR-Salmonella spp., clavulanato-amoxicilina y E. coli resistente a las cefalosporinas de tercera generación. El consumo de carne cruda de ave se reportó en dos de estos estudios (43, 44). La alta prevalencia de ESBL-E. coli en la carne de pollo ha sido bien documentada (54, 55). La administración de antimicrobianos en animales destinados a la producción de alimentos, para promover el crecimiento y/o el tratamiento de enfermedades, se ha identificado como un factor de riesgo significativo en la propagación de bacterias RAM dentro de la cadena alimentaria (56, 57). Además, la presencia de Salmonella ambientalmente persistente en el entorno de las fábricas de alimentos para mascotas ha sido bien documentada, y la formación de biopelículas puede servir como un mecanismo potencial que contribuye a su supervivencia a largo plazo (58). Las creencias de algunos dueños de mascotas de que los alimentos crudos son más «naturales» y «más saludables» en comparación con los alimentos comerciales procesados pueden representar un riesgo para los animales a través de la adquisición y propagación de varios patógenos y bacterias AMR (59, 60). Esto plantea preocupaciones de salud pública debido al contacto cercano frecuente entre los dueños, las mascotas y su entorno compartido. En algunos países desarrollados, las asociaciones veterinarias han realizado esfuerzos colectivos para educar a los cuidadores sobre los riesgos potenciales de la alimentación cruda; sin embargo, no es adecuado a escala mundial (61). Los cuidadores deben ser educados sobre los riesgos potenciales de dar carne cruda o productos cárnicos a sus mascotas. Por el contrario, los suplementos alimenticios (por ejemplo, vitaminas y minerales), los productos a base de hierbas, las golosinas patentadas para perros y las dietas caseras cocinadas mostraron un efecto protector contra la resistencia a la ciprofloxacina y la MDR-E. coli (13, 24, 44, 62). Los autores destacaron la escasez de investigaciones que investiguen los efectos protectores de los complementos alimenticios, particularmente en la medicina de pequeños animales. Sin embargo, se supone que los cuidadores, que proporcionan suplementos a sus perros, se preocupan más por su salud (es decir, un efecto de factor de confusión). Las asociaciones protectoras observadas entre las golosinas para perros y las dietas caseras cocinadas pueden atribuirse a la eliminación de E. coli en el proceso de producción, particularmente cuando se utiliza un tratamiento térmico (24).
Después del uso de antimicrobianos, la edad fue el factor más comúnmente investigado (24/40). Se encontró una mayor prevalencia de RAM en E. coli aislada de perros mayores de 10 años en comparación con las aisladas de perros más jóvenes (1-3 años) (27, 63). Esto se atribuyó a la supresión de la inmunidad en perros geriátricos y a la presión de selección del uso previo de antimicrobianos en perros más jóvenes (63). El sexo también fue un factor comúnmente investigado (22/40), con solo dos estudios que informaron asociaciones significativas con las bacterias AMR (53, 64). Un estudio demostró que las perras tenían un mayor riesgo de portar E. coli productora de pAmpC (31), potencialmente debido a una mayor incidencia de infecciones bacterianas en el tracto urinario inferior. En contraste, el otro estudio reportó una prevalencia significativamente mayor de Enterobacterales resistentes a las cefalosporinas en hombres (64), sin explicación para esta observación. El hecho de que la mayoría de los estudios (20/22) no encontraran ninguna asociación significativa indica que no es probable que la edad y el sexo sean determinantes primarios para la adquisición y propagación de bacterias AMR en perros. Sin embargo, en humanos, un estudio reciente realizado en 29 países europeos encontró que la aparición de Staphylococcus aureus resistente a la meticilina aumentaba con la edad, mientras que la aparición de resistencia a la aminopenicilina en E. coli disminuía con la edad (65). Los autores también concluyeron que, en general, los hombres presentaban un mayor riesgo de resistencia a los antimicrobianos en comparación con las mujeres. Estos hallazgos pueden sugerir que las futuras intervenciones destinadas a reducir la carga de la resistencia a los antimicrobianos en animales y seres humanos deben tener en cuenta las variaciones significativas en los patrones y la prevalencia de la resistencia a los antimicrobianos observadas en diferentes grupos de edad y entre sexos.
Dos estudios (de 11) informaron que la raza era un factor de riesgo, lo que indica una mayor prevalencia de AMR-E. coli entre terriers, perros de pastoreo y perros mestizos grandes en comparación con otras razas (62, 63). La alta prevalencia reportada se atribuyó a ciertos aspectos del estilo de vida entre los perros mestizos grandes, aunque no se mencionaron explícitamente aspectos específicos. Además, el 20% de estos perros se obtuvieron de una sociedad protectora de animales, donde los animales están en contacto cercano, lo que lleva a una mayor probabilidad de adquirir bacterias de AMR (63). En otro estudio, los perros más pequeños también tenían menos probabilidades de tener aislados resistentes de E. coli productora de AmpC en comparación con los más pesados (13). Los perros de refugios o criadores también tenían un mayor riesgo de portar E. coli productora de AmpC, posiblemente debido al uso frecuente de antimicrobianos en los criaderos y al uso común de ácido amoxicilina-clavulanato en medicina veterinaria (31). El estado de castración (es decir, estar intacto) se asoció significativamente con el porte del gen móvil de resistencia a la colistina, mcr-1 (32). Explicaron que se esperaba que los cambios hormonales y de comportamiento resultantes de la ovariectomía/castración afectaran a la composición y diversidad de la microbiota intestinal, lo que podría afectar a la colonización de los genes de la resistencia a los antimicrobianos; lo contrario de lo observado en este estudio. Sin embargo, se espera que los perros intactos sean más activos y más propensos a entrar en contacto con otros perros que los perros castrados en celo, lo que podría haberlos alentado a adquirir bacterias mcr-1 positivas de otros perros y del medio ambiente (32).
Se encontró que los factores ambientales, como caminar por el campo, el contacto con cachorros, el acceso a compost, los olores comerciales de aves de corral detectados, vivir a menos de 5 km de las instalaciones comerciales de animales de alimentación más cercanas, el contacto directo con el ganado que juega en el río y tener acceso a zanjas/charcos tienen una asociación positiva con el transporte de AMR-Enterobacterales de los perros del estudio en siete de los estudios revisados. La contaminación ambiental a través de prácticas ganaderas, como el uso de heces de aves de corral como fertilizantes o la contaminación de fuentes de agua compartidas, puede contribuir a la propagación de bacterias RAM entre los animales domésticos (66). Jugar en ríos y tener acceso a charcos/zanjas se asoció positivamente con la tercera generación de E. coli y ESBL-E. coli resistentes a las cefalosporinas (3GC). Investigaciones anteriores han demostrado que las fuentes de agua contaminada sirven como entornos distintos para la propagación de los genes de AMR entre los patógenos (67). El acceso al compost se relacionó con E. coli resistente a múltiples clases en un estudio (62). Sin embargo, no se especificó si los perros consumieron el compost o solo tuvieron contacto con él y también se desconocía el nivel de exposición. El compost puede contener subproductos animales y heces de animales salvajes, que podrían albergar bacterias de la resistencia a los antimicrobianos (62).
Se demostró una correlación positiva para el porte del gen de resistencia a la colistina, mcr-1, entre los perros y sus cuidadores en un estudio (32), en el que los perros que consumían comida humana (compartida con sus dueños) tenían una mayor prevalencia de mcr-1 (24,5%) en comparación con los que comían comida comercial para perros (14,3%). Este hallazgo puso de relieve el papel potencial de los hábitos dietéticos compartidos y las áreas de vida en la transmisión del gen mcr-1 (32). Además, investigaciones anteriores también han demostrado la presencia de Staphylococcus pseudintermedius genéticamente similares resistentes a la meticilina en pacientes, animales de contacto y muestras ambientales dentro del mismo hogar (68). Sin embargo, los estudios posteriores deben centrarse en las fuentes y las similitudes genéticas de las bacterias de la RAM entre las mascotas, los propietarios y su entorno para comprender mejor la dirección de la transmisión.
Se encontró que la administración de corticosteroides 1 mes antes de la hospitalización se asoció significativamente con la portación de ESBL-E. coli en perros (25). En humanos, se reportó una asociación significativa entre el uso de corticosteroides y la portación de ESBL-K. pneumoniae en pacientes con enfermedades autoinmunes reumáticas (69); Sin embargo, los autores no explicaron las posibles razones detrás de esta asociación. Se necesitan estudios adicionales para proporcionar más información sobre la asociación entre el uso de corticosteroides y la RAM. Además, el intervalo de tiempo entre el ingreso en el hospital y el tratamiento con AINE demostró un efecto protector contra el desarrollo de MDR-E. coli en un estudio (de dos) (36). Si bien los autores no proporcionaron ninguna razón para este efecto, investigaciones previas en humanos sugieren que ciertos AINE (ácido acetilsalicílico, diclofenaco, ibuprofeno) tienen actividades anti-biopelícula en concentraciones encontradas en estudios farmacocinéticos humanos (70-72). Sin embargo, la mayoría de estos estudios se realizaron in vitro y probaron aislados bacterianos no clínicos, que pueden no representar las poblaciones bacterianas que causan infecciones clínicamente relevantes. A pesar del prometedor potencial de los AINE para controlar las infecciones relacionadas con las biopelículas, hay una falta de investigación, en particular de ensayos clínicos controlados que apoyen su uso como agentes anti-biopelículas (73).
En un estudio, la asistencia a la guardería canina se asoció con la portación de E. coli productora de AmpC (62). Los autores explicaron que, si bien investigaciones anteriores habían demostrado que los perros dentro de la misma perrera de cría arrojaban bacterias con una mayor similitud en los patrones de resistencia, ningún estudio había investigado específicamente la propagación de la resistencia a los antimicrobianos en las guarderías para perros.
Los hábitos coprófagos también se asociaron positivamente con la colonización intestinal de ESBL-E. coli y MDR-E. coli en dos estudios (33, 74). Este comportamiento común en los perros permite la ingestión de microflora intestinal, incluidas las bacterias AMR. Las heces de los animales sometidos a tratamientos antimicrobianos pueden contener residuos de fármacos que pueden contribuir aún más a la selección y propagación de las bacterias de la resistencia a los antimicrobianos. Esto destaca el importante papel de los veterinarios en hospitales y clínicas para educar a los cuidadores de mascotas para prevenir y controlar este comportamiento.
Si bien este estudio se diseñó para evaluar de manera transparente y objetiva los estudios seleccionados utilizando los dominios de riesgo de sesgo, hubo algunas limitaciones potenciales, incluidos tamaños de muestra pequeños, que con frecuencia se informaron como una limitación a nivel de estudio. Muchos estudios no realizaron o informaron un cálculo del tamaño de la muestra. Este fue un factor común que limitó el poder estadístico de los estudios en la determinación de factores de riesgo significativos. Otra limitación común fue la falta de información clara sobre las estrategias de muestreo. Con base en la información disponible, asumimos que en estos estudios se aplicó un método de muestreo conveniente, lo que puede limitar sustancialmente la validez interna y externa (generalización) de algunos hallazgos. Algunos estudios también carecían de historias clínicas detalladas, incluyendo factores importantes como el uso previo de antimicrobianos, lo que podría haber confundido sus resultados. Nuestra selección final incluyó estudios realizados en todos los continentes. Sin embargo, inevitablemente, los estudios de los países de habla inglesa están relativamente sobrerrepresentados debido a nuestras limitaciones logísticas para incluir literatura no inglesa. Esto puede disminuir en cierta medida la generalización de nuestros hallazgos compilados a ubicaciones geográficas con condiciones de manejo particulares. Los factores de riesgo investigados y su significación estadística podrían haberse visto afectados en los estudios individuales al incluir perros de una amplia gama de estados de salud. En las poblaciones de perros enfermos, en comparación con las sanas, se presume que la probabilidad de adquirir y diseminar bacterias de la RAM puede ser mayor debido a diversos factores, como el mayor uso de antimicrobianos y la exposición a entornos hospitalarios. Por último, debemos enfatizar que nuestro enfoque de basarnos en el número de informes (es decir, la concordancia en los hallazgos de diferentes estudios) y la importancia de los factores informados puede simplificar hasta cierto punto la importancia de estos factores de riesgo. Aunque se intentó tener en cuenta la magnitud de los odds ratios informados, junto con sus correspondientes intervalos de confianza (ver Tabla complementaria 2), la clara inconsistencia en el informe y la heterogeneidad sustancial en los diseños de los estudios y los métodos estadísticos impidieron realizar un metanálisis sólido de los odds ratios extraídos para los factores de riesgo comúnmente investigados. Los lectores deben tener en cuenta esta limitación a la hora de interpretar nuestros hallazgos.
5 Conclusiones
Sobre la base de nuestra revisión sistemática, ya se ha publicado una buena cantidad de evidencia sobre los posibles factores de riesgo asociados con la portación de AMR-Enterobacterales en perros. Nuestro resumen tiene implicaciones para los veterinarios de pequeños animales, las autoridades de salud pública y los investigadores que participan activamente en el tratamiento del desafío de la resistencia a los antimicrobianos. El uso de antimicrobianos, la alimentación con dietas crudas y la hospitalización fueron los factores más significativos reportados consistentemente en la literatura revisada. Esto pone de manifiesto la necesidad de implementar y mantener altos estándares de administración de antimicrobianos para reducir nuestra dependencia de las clases prioritarias de antimicrobianos y educar a los cuidadores de mascotas sobre la dieta adecuada para sus perros. Si bien se han identificado otros factores de riesgo, como la edad, el sexo, la raza, los factores relacionados con el dueño del perro o el uso de medicamentos distintos de los antimicrobianos, sus posibles asociaciones con la transmisión de AMR-Enterobacterales son algo contradictorias o poco conocidas. Esto se debió al bajo número de estudios diseñados específicamente para abordar estos factores o a deficiencias en el tamaño de la muestra y/o en el diseño del estudio que impidieron análisis estadísticos sólidos. Se justifican nuevos estudios dirigidos a estos posibles factores de riesgo, ya que una comprensión integral de los factores de riesgo subyacentes es crucial para el desarrollo de estrategias e intervenciones preventivas específicas y eficaces. Por último, nuestra evaluación de la calidad de la literatura revisada exige mantener altos estándares en el diseño de los estudios y en los procesos de revisión por pares de las revistas científicas.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio están incluidas en el artículo/Material complementario, las consultas posteriores pueden dirigirse a los autores correspondientes.
Contribuciones de los autores
EK: Metodología, Administración de proyectos, Software, Redacción – borrador original, Redacción – revisión y edición, Curación de datos, Análisis formal, Investigación. KC: Curación de datos, Análisis formal, Investigación, Redacción – borrador original, Redacción – revisión y edición. BM: Curación de datos, Investigación, Redacción – borrador original, Redacción – revisión y edición. BH: Curación de datos, Redacción – borrador original, Redacción – revisión y edición. PB: Redacción – borrador original, Redacción – revisión y edición, Validación. VB: Validación, Redacción – borrador original, Redacción – revisión y edición. IE: Validación, Redacción – borrador original, Redacción – revisión y edición, Conceptualización, Investigación, Recursos, Supervisión. ON: Conceptualización, Recursos, Supervisión, Validación, Redacción – borrador original, Redacción – revisión y edición, Obtención de fondos, Metodología, Administración de proyectos, Software.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este proyecto contó con el apoyo del fondo interno proporcionado por la Universidad de la Ciudad de Hong Kong (Número de Proyecto: 9610511).
Reconocimientos
Los autores agradecen al Prof. Dirk U. Pfeiffer por su contribución en el diseño del estudio y a la Sra. Celia Chow, bibliotecaria de la Universidad de la Ciudad de Hong Kong, por supervisar el proceso de búsqueda.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda hacer su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2024.1447707/full#supplementary-material
Referencias
1. Resistencia a los antimicrobianos. (2023). Disponible en: https://www.who.int/news-room/fact-sheets/detail/antimicrobial-resistance (consultado el 5 de mayo de 2024).
2. Murray CJL, Ikuta KS, Sharara F, Swetschinski L, Aguilar GR, Gray A, et al. Carga mundial de resistencia bacteriana a los antimicrobianos en 2019: un análisis sistemático. Lanceta. (2022) 399:629–55.
3. O’Neill J. Abordar las infecciones resistentes a los medicamentos a nivel mundial: informe final y recomendaciones. 2016: Gobierno del Reino Unido.
4. Velázquez-Meza ME, Galarde-López M, Carrillo-Quiróz B, Alpuche-Aranda CM. Resistencia a los antimicrobianos: enfoque de Una Salud. Mundo Veterinario. (2022) 15:743–9. doi: 10.14202/vetworld.2022.743-749
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Marco-Fuertes A, Marín C, Lorenzo-Rebenaque L, Vega S, Montoro-Dasi L. Resistencia a los antimicrobianos en animales de compañía: un nuevo reto para el enfoque One Health en la Unión Europea. Veterinario Sci. (2022) 9:208. doi: 10.3390/vetsci9050208
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Guardabassi L, Schwarz S, Lloyd DH. Animales de compañía como reservorios de bacterias resistentes a los antimicrobianos: revisión. J Quimiomadre antimicrobiana. (2004) 54:321–32. doi: 10.1093/jac/dkh332
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Wegener HC, Aarestrup FM, Gerner-Smidt P, Bager F. Transferencia de bacterias resistentes a los antibióticos de los animales al hombre. Acta Vet Scand Suppl. (1999) 92: 51–7.
8. Ljungquist O, Ljungquist D, Myrenås M, Rydén C, Finn M, Bengtsson B. Evidencia de transferencia domiciliaria de enterobacterias productoras de ESBL-/pAmpC entre humanos y perros: un estudio piloto. Infectar Ecol Epidemiol. (2016) 6:31514. doi: 10.3402/iee.v6.31514
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Stenske KA, Bemis DA, Gillespie BE, D’Souza DH, Oliver SP, Draughon FA, et al. Comparación de la relación clonal y la susceptibilidad antimicrobiana de Escherichia coli fecal de perros sanos y sus dueños. Am J Vet Res. (2009) 70:1108–16. doi: 10.2460/ajvr.70.9.1108
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Prato-Previde E, Basso Ricci E, Colombo ES. La complejidad del vínculo humano-animal: empatía, apego y antropomorfismo en las relaciones humano-animal y el acaparamiento animal. Animales. (2022) 12:2835. doi: 10.3390/ani12202835
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Walsh F. Vínculos humano-animal II: el papel de las mascotas en los sistemas familiares y la terapia familiar. Proc. Familiar. (2009) 48:481–99. doi: 10.1111/j.1545-5300.2009.01297.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. WC de Reygaert. Una visión general de los mecanismos de resistencia a los antimicrobianos de las bacterias. AIMS Microbiol. (2018) 4:482–501. doi: 10.3934/microbiol.2018.3.482
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Schmidt VM, Pinchbeck GL, Nuttall T, McEwan N, Dawson S, Williams NJ. Factores de riesgo de resistencia a los antimicrobianos y caracterización de E. coli fecal aislada de labradores retriever sanos en el Reino Unido. Ant: Vet Med. (2015) 119:31–40. doi: 10.1016/j.prevetmed.2015.01.013
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Mitman SL, Amato HK, Saraiva-García C, Loayza F, Salinas L, Kurowski K, et al. Factores de riesgo para la tercera generación de cefalosporinas resistentes y de espectro extendido productoras de β-lactamasas en animales domésticos de parroquias semirrurales al este de Quito, Ecuador. PLOS Salud Pública Global. (2022) 2:E0000206. doi: 10.1371/journal.pgph.0000206
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Ogeer-Gyles J, Mathews KA, Sears W, Prescott JF, Weese JS, Boerlin P. Desarrollo de resistencia a los medicamentos antimicrobianos en aislados rectales de Escherichia coli de perros hospitalizados en una unidad de cuidados intensivos. J am vet med assoc. (2006) 229:694–9. doi: 10.2460/javma.229.5.694
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Page MJ, McKenzie JE, Bossuyt PM, Boutron I, Hoffmann TC, Mulrow CD, et al. La declaración PRISMA 2020: una guía actualizada para informar sobre revisiones sistemáticas. Int J Surg. (2021) 88:105906.
17. Ouzzani M, Hammady H, Fedorowicz Z, Elmagarmid A. Rayyan: una aplicación web y móvil para revisiones sistemáticas. (2016) 5:1–10. doi: 10.1186/s13643-016-0384-4
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Higgins J, Green S. Manual Cochrane de Revisiones Sistemáticas de Intervenciones. Wiley (2008). Disponible en: https://onlinelibrary.wiley.com/doi/book/10.1002/9780470712184
19. Aasmäe B, Volkova J, Häkkinen L, Orro T. Resistencia antimicrobiana in vitro de Escherichia coli intestinal y enterococos en perros clínicamente sanos en Estonia. Veterinarija ir Zootechnika (2015) 72:3–8.
20. Lefebvre SL, Reid-Smith R, Boerlin P, Weese JS. Evaluación de los riesgos de excreción de Salmonelae y otros patógenos potenciales por perros de terapia alimentados con dietas crudas en Ontario y Alberta. Zoonosis Salud Pública. (2008) 55:470–80. doi: 10.1111/j.1863-2378.2008.01145.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Guri A, Flaks-Manov N, Ghilai A, Hoshen M, Rimon OF, Ciobotaro P, et al. Factores de riesgo para Enterobacteriaceae resistentes a las cefalosporinas de tercera generación en cultivos de orina gestacional: un estudio de cohorte retrospectivo basado en registros de salud electrónicos centralizados. PLoS Uno. (2020) 15:e0226515. doi: 10.1371/journal.pone.0226515
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Menard J, Goggs R, Mitchell P, Yang Y, Robbins S, Franklin-Guild RJ, et al. Efecto de la administración de antimicrobianos sobre la microbiota fecal de perros críticamente enfermos: dinámica de la resistencia a los antimicrobianos a lo largo del tiempo. Microbioma animal. (2022) 4:9. doi: 10.1186/s42523-022-00178-9
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. Saputra S, Jordan D, Mitchell T, Wong HS, Abraham RJ, Kidsley A, et al. Resistencia a los antimicrobianos en Escherichia coli clínica aislada de animales de compañía en Australia. Microbiol veterinario. (2017) 211:43–50. doi: 10.1016/j.vetmic.2017.09.014
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Beining MW, Hartmann M, Luebke-Becker A, Guenther S, Schaufler K, Hille K, et al. Portación de Escherichia coli productora de beta lactamasas de espectro extendido: prevalencia y factores asociados a la colonización fecal de perros de una clínica de mascotas en Baja Sajonia, Alemania. Animales. (2023) 13:584. doi: 10.3390/ani13040584
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Ortiz-Díez G, Mengíbar RL, Turrientes MC, Artigao MB, Gallifa RL, Tello AM, et al. Prevalencia, incidencia y factores de riesgo para la adquisición y colonización de Enterobacteriaceae productoras de betalactamasas y carbapenemasas de espectro extendido en perros atendidos en un hospital veterinario en España. Comp Immunol Microbiol Infect Dis. (2023) 92:101922. doi: 10.1016/j.cimid.2022.101922
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Dazio V, Nigg A, Schmidt JS, Brilhante M, Mauri N, Kuster SP, et al. Adquisición y transporte de organismos multirresistentes en perros y gatos, presentado a clínicas y consultorios de pequeños animales en Suiza. J Veterinario Pasante Med. (2021) 35:970–9. doi: 10.1111/jvim.16038
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Groat EF, Williams NJ, Pinchbeck G, Warner B, Simpson A, Schmidt VM. UK dogs eating raw meat diets have higher risk of Salmonella and antimicrobial-resistant Escherichia coli faecal carriage. J Small Anim Pract. (2022) 63:435–41. doi: 10.1111/jsap.13488
28. Salgado-Caxito M, Benavides JA, Munita JM, Rivas L, García P, Listoni FJP, et al. Risk factors associated with faecal carriage of extended-spectrum cephalosporin-resistant Escherichia coli among dogs in Southeast Brazil. Prev Vet Med. (2021) 190:105316. doi: 10.1016/j.prevetmed.2021.105316
29. Gandolfi-Decristophoris P, Petrini O, Ruggeri-Bernardi N, Schelling E. Extended-spectrum β-lactamase-producing Enterobacteriaceae in healthy companion animals living in nursing homes and in the community. Am J Infect Control. (2013) 41:831–5. doi: 10.1016/j.ajic.2012.11.013
30. Chen J, Huang HH, Chang SM, Scaria J, Chiu YL, Chen CM, et al. Antibiotic-resistant Escherichia coli and sequence type 131 in fecal colonization in dogs in Taiwan. Microorganisms. (2020) 8:1439. doi: 10.3390/microorganisms8091439
31. Belas A, Salazar AS, da Gama LT, Couto N, Pomba C. Risk factors for faecal colonisation with Escherichia coli producing extended-spectrum and plasmid-mediated AmpC β-lactamases in dogs. Vet Record. (2014) 175:101978. doi: 10.1136/vr.101978
32. Lei L, Wang Y, He J, Cai C, Liu Q, Yang D, et al. Prevalence and risk analysis of mobile colistin resistance and extended-spectrum β-lactamase genes carriage in pet dogs and their owners: a population based cross-sectional study. Emerg Microb Infect. (2021) 10:242–51. doi: 10.1080/22221751.2021.1882884
33. Leite-Martins LR, Mahú MIM, Costa AL, Mendes A, Lopes E, Mendonça DMV, et al. Prevalence of antimicrobial resistance in enteric Escherichia coli from domestic pets and assessment of associated risk markers using a generalized linear mixed model. Prevent Vet Med. (2014) 117:28–39. doi: 10.1016/j.prevetmed.2014.09.008
34. Cocca G, Piva S, Magno SD, Scarpellini R, Giacometti F, Serraino A, et al. Prevalence and patterns of antimicrobial resistance among Escherichia coli and Staphylococcus spin a veterinary university hospital. Vet Sci. (2021) 8:308. doi: 10.3390/vetsci8120308
35. Schmidt VM, Pinchbeck G, McIntyre KM, Nuttall T, McEwan N, Dawson S, et al. Routine antibiotic therapy in dogs increases the detection of antimicrobial-resistant faecal Escherichia coli. J Antimicrob Chemother. (2018) 73:3305–16. doi: 10.1093/jac/dky352
36. Gibson JS, Morton JM, Cobbold RN, Filippich LJ, Trott DJ. Risk factors for dogs becoming rectal carriers of multidrug-resistant Escherichia coli during hospitalization. Epidemiol Infect. (2011) 139:1511–21. doi: 10.1017/S0950268810002785
37. Hamilton E, Kruger JM, Schall W, Beal M, Manning SD, Kaneene JB. Acquisition and persistence of antimicrobial-resistant bacteria isolated from dogs and cats admitted to a veterinary teaching hospital. J Am Vet Med Assoc. (2013) 243:990–1000. doi: 10.2460/javma.243.7.990
38. Hamilton E, Kruger JM, Schall W, Beal M, Manning SD, Kaneene JB. Factores de riesgo para la colonización rectal multirresistente por Escherichia coli en perros al ingreso en un hospital veterinario. Epidemiol infecto. (2011) 139:197–205. doi: 10.1017/S0950268810000798
Resumen de PubMed | Texto completo de Crossref | Google Académico
39. Shnaiderman-Torban A, Navon-Venezia S, Kelmer E, Cohen A, Paitan Y, Arielly H, et al. Diseminación de enterobacterias productoras de β-lactamasas de espectro extendido en perros y gatos hospitalizados en un departamento de emergencias y cuidados intensivos de un hospital de enseñanza veterinaria. Antibióticos. (2020) 9:545. doi: 10.3390/antibióticos9090545
Resumen de PubMed | Texto completo de Crossref | Google Académico
40. Ramos CP, Kamei CYI, Viegas FM, Barbieri JD, Cunha JLR, Hounmanou YMG, et al. Diseminación fecal de aislados de Escherichia coli multirresistente en perros alimentados con dietas a base de carne cruda en Brasil. Antibióticos. (2022) 11:534. doi: 10.3390/antibióticos11040534
Resumen de PubMed | Texto completo de Crossref | Google Académico
41. Sealey JE, Hammond A, Mounsey O, Gould VC, Reyher KK, Avison MB. Ecología molecular y factores de riesgo para la tercera generación de Escherichia coli resistente a las cefalosporinas por perros que viven en entornos urbanos y rurales cercanos. J Quimiomadre antimicrobiana. (2022) 77:2399–405. doi: 10.1093/jac/dkac208
Resumen de PubMed | Texto completo de Crossref | Google Académico
42. Mounsey O, Wareham K, Hammond A, Findlay J, Gould VC, Morley K, et al. Evidencia de que la portación fecal de Escherichia coli resistente por perros de 16 semanas de edad en el Reino Unido está asociada con la alimentación cruda. Una sola salud. (2022) 14:100370. doi: 10.1016/j.onehlt.2022.100370
Resumen de PubMed | Texto completo de Crossref | Google Académico
43. Wedley AL, Dawson S, Maddox TW, Coyne KP, Pinchbeck GL, Clegg P, et al. Portación de Escherichia coli resistente a antimicrobianos en perros: prevalencia, factores de riesgo asociados y características moleculares. Microbiol veterinario. (2017) 199:23–30. doi: 10.1016/j.vetmic.2016.11.017
Resumen de PubMed | Texto completo de Crossref | Google Académico
44. Leonard EK, Pearl DL, Janecko N, Finley RL, Reid-Smith RJ, Weese JS, et al. Factores de riesgo para el porte de Salmonella spp y Escherichia coli resistentes a los antimicrobianos en perros domésticos de hogares voluntarios en Ontario, Canadá, en 2005 y (2006). Am J Vet Res. (2015) 76:959–68. doi: 10.2460/ajvr.76.11.959
Resumen de PubMed | Texto completo de Crossref | Google Académico
45. Caneschi A, Bardhi A, Barbarroja A, Zaghini A. El uso de antibióticos y la resistencia a los antimicrobianos en medicina veterinaria, un fenómeno complejo: una revisión narrativa. Antibióticos. (2023) 12:487. doi: 10.3390/antibióticos12030487
Resumen de PubMed | Texto completo de Crossref | Google Académico
46. Collignon PC, Conly JM, Andremont A, McEwen SA, Aidara-Kane A, Grupo Asesor de la Organización Mundial de la Salud, et al. Clasificación de la Organización Mundial de la Salud de los antimicrobianos según su importancia en la medicina humana: un paso crítico para desarrollar estrategias de gestión de riesgos para controlar la resistencia a los antimicrobianos de la producción animal para alimentos Clin Infect Dis. (2016) 63:1087–93. doi: 10.1093/cid/CIW475
Resumen de PubMed | Texto completo de Crossref | Google Académico
47. Gehring R, Mochel JP, Schmerold I. Comprensión de los antecedentes y la importancia clínica de las clasificaciones de la OMS, la OMSA y la EMA de los antimicrobianos para mitigar la resistencia a los antimicrobianos. Frente Vet Sci. (2023) 10:1153048. doi: 10.3389/fvets.2023.1153048
Resumen de PubMed | Texto completo de Crossref | Google Académico
48. Haque M, McKimm J, Sartelli M, Dhingra S, Labricciosa FM, Islam S, et al. Estrategias para prevenir las infecciones asociadas a la asistencia sanitaria: una visión general. Política de Gestión de Riesgos de Salud. (2020) 13:1765–80. doi: 10.2147/RMHP. S269315
Resumen de PubMed | Texto completo de Crossref | Google Académico
49. D’Accolti M, Soffritti I, Mazzacane S, Caselli E. Lucha contra la resistencia a los antimicrobianos en el entorno sanitario: enfoques de saneamiento basados en el microbioma y herramientas de seguimiento. Int J Mol Sci. (2019) 20:1535. doi: 10.3390/ijms20071535
Resumen de PubMed | Texto completo de Crossref | Google Académico
50. Lavigne SH, Cole SD, Daidone C, Rankin SC. Factores de riesgo para la adquisición de una Escherichia coli resistente a los carbapenémicos bla NDM-5 en un hospital veterinario. J Am Animal Hosp Assoc. (2021) 57:101–5. doi: 10.5326/JAAHA-MS-7105
Resumen de PubMed | Texto completo de Crossref | Google Académico
51. Palacios-Baena ZR, Giannella M, Manissero D, Rodríguez-Baño J, Viale P, Lopes S, et al. Factores de riesgo para infecciones bacterianas gramnegativas resistentes a los carbapenémicos: una revisión sistemática. Clin Microbiol Infectar. (2021) 27:228–35. doi: 10.1016/j.cmi.2020.10.016
Resumen de PubMed | Texto completo de Crossref | Google Académico
52. Buhl M, Peter S, Willmann M. Prevalencia y factores de riesgo asociados con la colonización e infección de Pseudomonas aeruginosa ampliamente resistente a los medicamentos: una revisión sistemática. Expert Rev Anti Infect ther. (2015) 13:1159–70. doi: 10.1586/14787210.2015.1064310
Resumen de PubMed | Texto completo de Crossref | Google Académico
53. Tuerena I, Williams NJ, Nuttall T, Pinchbeck G. Escherichia coli resistente a los antimicrobianos en animales de compañía hospitalizados y su entorno hospitalario. J Pequeña Anim Pract. (2016) 57:339–47. doi: 10.1111/jsap.12525
Resumen de PubMed | Texto completo de Crossref | Google Académico
54. Sukkua K, Manothong S. Sukhumungoon Seroprevalencia y epidemiología molecular de Escherichia coli portadora del gen EAST1 de pacientes diarreicos y carnes crudas. J infectar países de desarrollo. (2017) 11:220–7. doi: 10.3855/jidc.6865
Resumen de PubMed | Texto completo de Crossref | Google Académico
55. Hasib FMY, Magouras I, St-Hilaire S, Paudel S, Kamali M, Lugsomya K, et al. Prevalencia y caracterización de Escherichia coli resistente a los antimicrobianos en carne de pollo procedente de mercados húmedos de Hong Kong. Frente Vet Sci. (2024) 11:1340548. doi: 10.3389/fvets.2024.1340548
Resumen de PubMed | Texto completo de Crossref | Google Académico
56. Gouvêa R, Dos Santos F, De Aquino M. Fluoroquinolonas en la producción avícola industrial, resistencia bacteriana y residuos de alimentos: una revisión. Brasil J Poultry Sci. (2015) 17:1–10. doi: 10.1590/1516-635×17011-10
Resumen de PubMed | Texto completo de Crossref | Google Académico
57. Nekouei O, Checkley S, Waldner C, Smith BA, Invik J, Carson C, et al. Exposición a Escherichia coli resistente a los antimicrobianos a través del consumo de carne molida de res en el oeste de Canadá. Int J Microbiol Alimentario. (2018) 272:41–8. doi: 10.1016/j.ijfoodmicro.2018.02.022
58. Bashir A, Azeem A, Stedman Y, Hilton AC. Los aislados de serotipos de Salmonella en fábricas de alimentos para mascotas no demuestran una mayor formación de biopelículas en comparación con los aislados clínicos y veterinarios emparejados con serotipos. BioMed Res Int. (2019) 2019:8569459. doi: 10.1155/2019/8569459
Resumen de PubMed | Texto completo de Crossref | Google Académico
59. Vecchiato CG, Schwaiger K, Biagi G, Dobenecker B. De la adecuación nutricional a la calidad de la higiene: una evaluación detallada de los alimentos crudos comerciales para perros y gatos. Animales. (2022) 12:2395. doi: 10.3390/ani12182395
Resumen de PubMed | Texto completo de Crossref | Google Académico
60. Lumbis R, Chan DL. El trato crudo: aclarar los problemas nutricionales y de salud pública relacionados con las dietas basadas en carne cruda. Enfermera veterinaria. (2015) 6:336–41. doi: 10.12968/vetn.2015.6.6.336
61. Raditic DM. Perspectivas sobre los alimentos comerciales para mascotas. Veterinario Clini. (2021) 51:551–62. doi: 10.1016/j.cvsm.2021.01.013
Resumen de PubMed | Texto completo de Crossref | Google Académico
62. Procter TD, Pearl DL, Finley RL, Leonard EK, Janecko N, Reid-Smith RJ, et al. Un estudio transversal que examina la prevalencia y los factores de riesgo de la Escherichia coli genérica resistente a los antimicrobianos en perros domésticos que frecuentan parques para perros en tres ciudades del suroeste de Ontario, Canadá. Zoonosis Salud Pública. (2014) 61:250–9. doi: 10.1111/zph.12064
Resumen de PubMed | Texto completo de Crossref | Google Académico
63. Ekakoro JE, Hendrix GK, Guptill LF, Ruple A. Susceptibilidad antimicrobiana y factores de riesgo de resistencia entre Escherichia coli aislada de especímenes caninos presentados a un laboratorio de diagnóstico en Indiana, 2010-2019. PLoS UNO. (2022) 17:E0263949. doi: 10.1371/journal.pone.0263949
Resumen de PubMed | Texto completo de Crossref | Google Académico
64. Umeda K, Hase A, Matsuo M, Horimoto T, Ogasawara J. Prevalencia y caracterización genética de enterobacterias resistentes a las cefalosporinas entre perros y gatos en un refugio de animales. J Med Microbiol. (2019) 68:339–45. doi: 10.1099/jmm.0.000933
Resumen de PubMed | Texto completo de Crossref | Google Académico
65. Waterlow NR, Cooper BS, Robotham JV, Knight GM. Prevalencia de resistencia a los antimicrobianos en la infección del torrente sanguíneo en 29 países europeos por edad y sexo: un estudio observacional. PLoS Med. (2024) 21:E1004301. doi: 10.1371/journal.pmed.1004301
Resumen de PubMed | Texto completo de Crossref | Google Académico
66. Salinas L, Loayza F, Cárdenas P, Saraiva C, Johnson TJ, Amato H, et al. Propagación ambiental de betalactamasas de espectro extendido (BLEE) productoras de Escherichia coli y genes BLEE entre niños y animales domésticos en Ecuador. Perspectiva de la salud ambiental. (2021) 129:027007. doi: 10.1289/EHP7729
Resumen de PubMed | Texto completo de Crossref | Google Académico
67. Hayward C, Ross KE, Brown MH, Whiley H. El agua como fuente de resistencia a los antimicrobianos e infecciones asociadas a la atención sanitaria. Patógenos. (2020) 9:667. doi: 10.3390/patógenos9080667
Resumen de PubMed | Texto completo de Crossref | Google Académico
68. Laarhoven LM, de Heus P, van Luijn J, Duim B, Wagenaar JA, van Duijkeren E. Estudio longitudinal sobre Staphylococcus pseudintermedius resistente a la meticilina en los hogares. PLoS UNO. (2011) 6:E27788. doi: 10.1371/journal.pone.0027788
69. Liu Y, Liu Y, Dai J, Liu A, Li Y, Xu J, et al. Klebsiella pneumoniae in patients with rheumatic autoimmune diseases: clinical characteristics, antimicrobial resistance and factors associated with extended-spectrum β-lactamase production. BMC Infect Dis. (2021) 21:1–10. doi: 10.1186/s12879-021-06055-1
70. Rosato A, Catalano A, Carocci A, Carrieri A, Carone A, Caggiano G, et al. In vitro interactions between anidulafungin and nonsteroidal anti-inflammatory drugs on biofilms of Candida. Bioorganic Med Chem. (2016) 24:1002–5. doi: 10.1016/j.bmc.2016.01.026
71. Leão C, Borges A, Simões M. NSAIDs as a drug repurposing strategy for biofilm control. Antibiotics. (2020) 9:591. doi: 10.3390/antibiotics9090591
72. Abbas HA, Atallah H, El-Sayed MA, El-Ganiny AM. Diclofenac mitigates virulence of multidrug-resistant Staphylococcus aureus. Arch Microbiol. (2020) 202:2751–60. doi: 10.1007/s00203-020-01992-y
73. Paes Leme RC, da Silva RB. Antimicrobial activity of non-steroidal anti-inflammatory drugs on biofilm: Current evidence and potential for drug repurposing. Front Microbiol. (2021) 12:707629. doi: 10.3389/fmicb.2021.707629
74. Shnaiderman-Torban A, Navon-Venezia S, Baron H, Abu-Ahmad W, Arielly H, Valenci GZ, et al. Prevalencia y caracterización molecular de Enterobacterales productores de β-lactamasas de espectro extendido en perros comunitarios sanos en Israel. Antibióticos. (2022) 11:1069. doi: 10.3390/antibióticos11081069
Resumen de PubMed | Texto completo de Crossref | Google Académico
75. Formenti N, et al. Escherichia coli productora de β-lactamasas y AmpC de espectro extendido en perros domésticos: propagación, caracterización y factores de riesgo asociados. Antibióticos. (2021) 10:1251. doi: 10.3390/antibióticos10101251
Resumen de PubMed | Texto completo de Crossref | Google Académico
76. Habib I, Mohteshamuddin K, Mohamed M-YI, Lakshmi GB, Abdalla A, Alkaabi ABA. Mascotas domésticas en los Emiratos Árabes Unidos como reservorios de bacterias resistentes a los antibióticos: un análisis exhaustivo de la prevalencia y los factores de riesgo de Escherichia coli que producen betalactamasas de espectro extendido. Animales. (2023) 13:1587. doi: 10.3390/ani13101587
Resumen de PubMed | Texto completo de Crossref | Google Académico
77. Gruel G, Couvin D, Guyomard-Rabenirina S, Arlet G, Bambou J-C, Pot M, et al. Alta prevalencia de plásmidos blaCTXM−1/IncI1-Iγ/ST3 en aislados de Escherichia coli productores de β-lactamasas de espectro extendido recolectados de animales domésticos en Guadalupe (Antillas Francesas). Microbiol frontal. (2022) 13:882422. doi: 10.3389/fmicb.2022.882422
Resumen de PubMed | Texto completo de Crossref | Google Académico
78. Kinnison T, McGilvray TA, Couëtil LL, Smith KC, Wylie CE, Bacigalupo SA, et al. Asma equina leve-moderada: una revisión exploratoria de la evidencia que respalda la definición de consenso. Veterinario J. (2022) 286:105865. doi: 10.1016/j.tvjl.2022.105865
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: resistencia a antimicrobianos, factor de riesgo, infección bacteriana, perro, Enterobacterales
Cita: Karalliu E, Chung KY, MacKinnon B, Haile B, Beczkowski PM, Barrs VR, Elsohaby I y Nekouei O (2024) Factores de riesgo para Enterobacterales resistentes a los antimicrobianos en perros: una revisión sistemática. Frente. Vet. Sci. 11:1447707. doi: 10.3389/fvets.2024.1447707
Recibido: 12 de junio de 2024; Aceptado: 23 de septiembre de 2024;
Publicado: 07 de octubre de 2024.
Editado por:
Alda Natale, Instituto Zooprofiláctico Experimental de Venecia (IZSVe), Italia
Revisado por:
Raúl Alejandro Alegría, Universidad de Chile, Chile
James Wabwire Oguttu, Universidad de Sudáfrica, Sudáfrica
Derechos de autor © 2024 Karalliu, Chung, MacKinnon, Haile, Beczkowski, Barrs, Elsohaby y Nekouei. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Atribución (CC BY).
*Correspondencia: Omid Nekouei, omid.nekouei@cityu.edu.hk; Ibrahim Elsohaby, ielsohab@cityu.edu.hk
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente a las de sus organizaciones afiliadas, o las del editor, de los editores y de los revisores. Cualquier producto que puede ser evaluada en este artículo o afirmación que puede ser hecha por su El fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

