Farmacocinética comparativa de la doxorrubicina libre y una formulación liposomal en gatos
Farmacocinética comparativa de la doxorrubicina libre y una formulación liposomal en gatos tras la administración intravenosa
 Yu Liu1
Yu Liu1  Sumeng Chen1
Sumeng Chen1  Zeyu Wen1
Zeyu Wen1  Jinyan Meng1
Jinyan Meng1  Yuxin Yang1
Yuxin Yang1  Yang Zhang1
Yang Zhang1  Jianzhong Wang2*
Jianzhong Wang2*  Xingyuan Cao1,3*
Xingyuan Cao1,3*- 1Departamento de Farmacología y Toxicología Veterinaria, Facultad de Medicina Veterinaria, Universidad Agrícola de China, Pekín (China)
- 2Laboratorio clave de Shanxi para la modernización de la MVTC, Facultad de Medicina Veterinaria, Universidad Agrícola de Shanxi, Jinzhong, China
- 3Laboratorio Clave de Detección de Residuos de Medicamentos Veterinarios y Aditivos Ilegales, Ministerio de Agricultura y Asuntos Rurales, Beijing, China
La doxorrubicina, un potente agente quimioterapéutico utilizado ampliamente en el tratamiento del cáncer, muestra un comportamiento farmacocinético complejo, especialmente en varias formulaciones. Con una creciente incidencia de casos de cáncer en gatos, la comprensión de la farmacocinética del fármaco en sujetos felinos sigue siendo un área crítica aún inexplorada. Por lo tanto, este estudio investigó el perfil farmacocinético de la doxorrubicina después de la administración intravenosa lenta de clorhidrato de doxorrubicina (DOX· HCl) o clorhidrato de doxorrubicina pegilado liposoma (DOX· HCl-PLI) en doce gatos a una dosis única de 20 mg/m2. Las muestras de sangre recogidas en el tiempo de pretratamiento (0 h) y durante 192 h se analizaron mediante cromatografía líquida de ultra alta resolución-espectrometría de masas (UPLC-MS/MS). Los parámetros farmacocinéticos obtenidos de la doxorrubicina revelaron diferencias significativas entre las dos formulaciones y fueron los siguientes: vida media de eliminación (T1/2λz) de 5.00 ± 3.20 h (DOX· HCl) y 17,62 ± 8,13 h (DOX· HCl-PLI), área bajo la curva de concentración/tiempo desde 0 hasta el último punto (AUCúltimo) de 0,67 ± 0,12 μg h/ml (DOX· HCl) y 783,09 ± 267,29 μg hr./mL (DOX· HCl-PLI) y el aclaramiento total del cuerpo (CL_Obs) de 27098,58 ± 5205,19 mL/h/m2 (DOX· HCl) y 28,65 ± 11,09 mL/h/m2 (DOX· HCl-PLI). Además, también se detectaron diferencias en el volumen aparente de distribución (Vz_Obs) con 178,56 ± 71,89 L/m2 (DOX· HCl) y 0,64 ± 0,20 L/m2 (DOX· HCl-PLI) y la concentración plasmática máxima (Cmáximo) con 2,25 ± 0,30 μg/mL (DOX· HCl) y 24,02 ± 5,45 μg/mL (DOX· HCl-PLI). En particular, se detectó una baja concentración de doxorrubicinol, el metabolito de la doxorrubicina, en plasma después de la administración de DOX· HCl, con aún menos presencia cuando DOX· Se administró HCl-PLI. Esta investigación proporciona información valiosa sobre los distintos comportamientos farmacocinéticos de DOX· HCl y DOX· HCl-PLI en gatos, aportando una base esencial para futuros estudios y posibles aplicaciones clínicas en oncología felina.
Introducción
La doxorrubicina, ampliamente utilizada en el tratamiento del cáncer de mama y de ovario, es un antibiótico antitumoral de amplio espectro de antraciclinas que inhibe la síntesis de ADN, ARN y proteínas en las células en varios ciclos de crecimiento (1, 2). Actualmente, existen dos formulaciones de doxorrubicina autorizadas para su uso clínico en tratamientos humanos: clorhidrato de doxorrubicina y clorhidrato de doxorrubicina liposomada (3). Aunque la doxorrubicina tiene una eficacia antitumoral significativa, los estudios clínicos han informado de sus muchos efectos adversos (4-6). Por ejemplo, la investigación ha demostrado que la doxorrubicina y su metabolito, el doxorrubicinol, cuando se combinan, provocan fuertes efectos secundarios tóxicos en humanos y otras especies (7, 8). Las investigaciones sobre una forma liposomal de doxorrubicina han revelado su capacidad para alterar el perfil farmacocinético del fármaco in vivo, mejorando así la eficacia antitumoral del fármaco (9-13).
El carcinoma mamario felino sigue siendo uno de los tumores más comunes en gatos, con una alta tasa de malignidad y metástasis, características clinicopatológicas, epidemiológicas e histológicas, y una clasificación molecular similar a la encontrada en el cáncer humano (14-16). En los últimos años, varios estudios han descrito gradualmente la eficacia de la doxorrubicina en el tratamiento de tumores clínicos en gatos en una variedad de tumores felinos (17-20). Específicamente, un informe detalló el uso de la cirugía citorreductora y la quimioterapia adyuvante con doxorrubicina en el tratamiento del hemangiosarcoma mesentérico, lo que resultó en una supervivencia prolongada en el gato (18). Sin embargo, otros informes han expresado preocupaciones con respecto a la toxicidad significativa del medicamento en gatos, lo que conduce a lesiones renales, mielosupresión, anorexia y pérdida de peso (21). Se necesita un conocimiento profundo para desvelar opciones terapéuticas destinadas a mejorar el resultado clínico del gato. Estos estudios se ven limitados por la falta de líneas celulares felinas disponibles para ensayos de citotoxicidad (22). Además, al comparar las dos formulaciones de doxorrubicina, las propiedades físicas del liposoma juegan un papel importante en la alteración de la farmacocinética del fármaco, un factor estrechamente relacionado tanto con la eficacia como con las reacciones adversas (23). A pesar de ello, solo unos pocos estudios han caracterizado el perfil farmacocinético de la doxorrubicina en gatos. La evaluación del perfil farmacocinético de la doxorrubicina y el doxorrubicinol en las especies diana es un paso crucial para comprender la eficacia y gestionar los posibles efectos adversos en futuros tratamientos clínicos. Por lo tanto, el objetivo principal del presente estudio fue caracterizar la farmacocinética de la doxorrubicina y su metabolito, doxorrubicinol, a partir de dos formulaciones distintas de doxorrubicina en gatos.
Materiales y métodos
Materiales
El producto estándar de clorhidrato de doxorrubicina (pureza = 98,0%), el producto estándar de doxorrubicinol (pureza = 96,4%) y el producto estándar de clorhidrato de daunorrubicina (estándar interno, pureza = 98,8%) fueron proporcionados por TLC Pharmaceutical Standers. Clorhidrato de doxorrubicina inyectable (DOX· HCl, 10 mg) se obtuvo de ShanXi Pude Pharmaceutical Co., Ltd., y la inyección de liposomas pegilados de clorhidrato de doxorrubicina (DOX· HCl-PLI, 20 mg: 10 mL) fue suministrado por CSPC Pharmaceutical Group Ouyi Pharmaceutical Co., Ltd. Todos los demás productos químicos y reactivos utilizados eran de grado cromatográfico y se obtenían de proveedores comerciales (Fisher Scientific).
Diseño de experimentos
En este estudio se utilizaron doce gatos pastores chinos domesticados (seis hembras y seis machos; 3-3,6 kg; rango de edad de 2-3 años) obtenidos del Centro de Animales Experimentales de la Universidad Agrícola de China. Antes del estudio, se verificó que los gatos estaban sanos basándose en un examen físico. Todos los procedimientos fueron revisados y aprobados por el Comité Institucional de Cuidado y Uso de Animales de la Universidad Agrícola de China (NO.13303-21-E-001).
El experimento preestablecido se llevó a cabo en un diseño de dosis única y dosis paralela. Doce gatos fueron asignados aleatoriamente a dos grupos de tratamiento de igual tamaño. El grupo I recibió DOX· HCl a dosis de 20 mg/m2 superficie corporal, mientras que el grupo II recibió DOX· HCl-PLI a la misma dosis. De manera similar a la práctica clínica, ambas formulaciones se administraron mediante infusión intravenosa lenta (i.v.) (administrada durante 10 minutos) después de la dilución con NaCl al 0,9%, manteniendo una tasa de inyección de aproximadamente 10 μL/s. Los gatos ayunaron durante 16 h antes y 8 h después de la administración del fármaco. Cada gato fue pesado inmediatamente antes de la administración del fármaco el primer día de tratamiento.
Se recogieron muestras de sangre de 0,5 mL en tubos heparinizados a través de las venas de las extremidades anteriores a las 0 (pretratamiento) y a las 0,033, 0,083, 0,167, 0,25, 0,5, 0,75, 1, 1,5, 3, 6, 12, 24, 48, 72, 96, 120, 144, 168 y 192 h después del inicio de la administración. Posteriormente, las muestras de sangre se centrifugaron durante 10 min a 4000 rpm, y las muestras de plasma se almacenaron a -20 °C hasta su análisis.
Análisis de muestras
Las concentraciones plasmáticas de doxorrubicina y doxorrubicinol se analizaron utilizando un método validado de cromatografía líquida de ultra resolución-espectrometría de masas (UPLC-MS/MS) como se informó anteriormente (7, 24). El límite inferior de cuantificación (LLOQ) para doxorrubicina y doxorrubicinol en plasma fue de 10 ng/mL y 2 ng/mL, respectivamente. Los coeficientes de variación entre ensayos e intraensayos se mantuvieron por debajo del 15%. Las recuperaciones medias de doxorrubicina oscilaron entre -14,51 y 10,00%, mientras que las de doxorrubicinol oscilaron entre -14,00 y 10,63%. Las curvas de calibración de doxorrubicina y doxorrubicinol mostraron una linealidad satisfactoria dentro del rango de concentración de 10 a 2000 ng/mL (r2 > 0,99) y de 2 a 400 ng/ml (r2 > 0,99), respectivamente.
Análisis de datos
Los parámetros farmacocinéticos se determinaron a partir del Modelo de Análisis No Compartimental 200-202 (Método de Interpolación Lineal Trapezoidal Lineal, Ponderación Uniforme) en el software WinNonlin (WinNonlin™ 8.3, Certara Estados Unidos). Para evaluar las diferencias significativas, se empleó una prueba T mediante SPSS Statistics 20.0 (International Business Machines, Armonk, NY, Estados Unidos) entre los grupos de estudio después de la transformación logarítmica en la vida media de eliminación (T1/2λz), área bajo la curva de concentración/tiempo desde 0 hasta el último punto (AUCúltimo), holgura total del cuerpo (CL_Obs), volumen aparente de distribución (Vz_Obs), y la concentración plasmática máxima (Cmáximo). Se consideraron diferencias estadísticamente significativas para valores de p (p) inferiores a 0,01 y todos los datos se expresan como media ± desviación estándar (DE).
Resultados
Las curvas plasmáticas de concentración/tiempo de doxorrubicina para DOX· HCl y DOX· Los grupos HCl-PLI se muestran en la Figura 1. Además, se presenta la curva de doxorrubicinol para el DOX· HCl, mientras que la curva para el grupo DOX· El grupo HCl-PLI no se muestra debido a los limitados puntos de tiempo medidos después de la administración. Los resultados demostraron que el perfil farmacocinético de la doxorrubicina después de la administración de las dos formulaciones fue significativamente diferente.
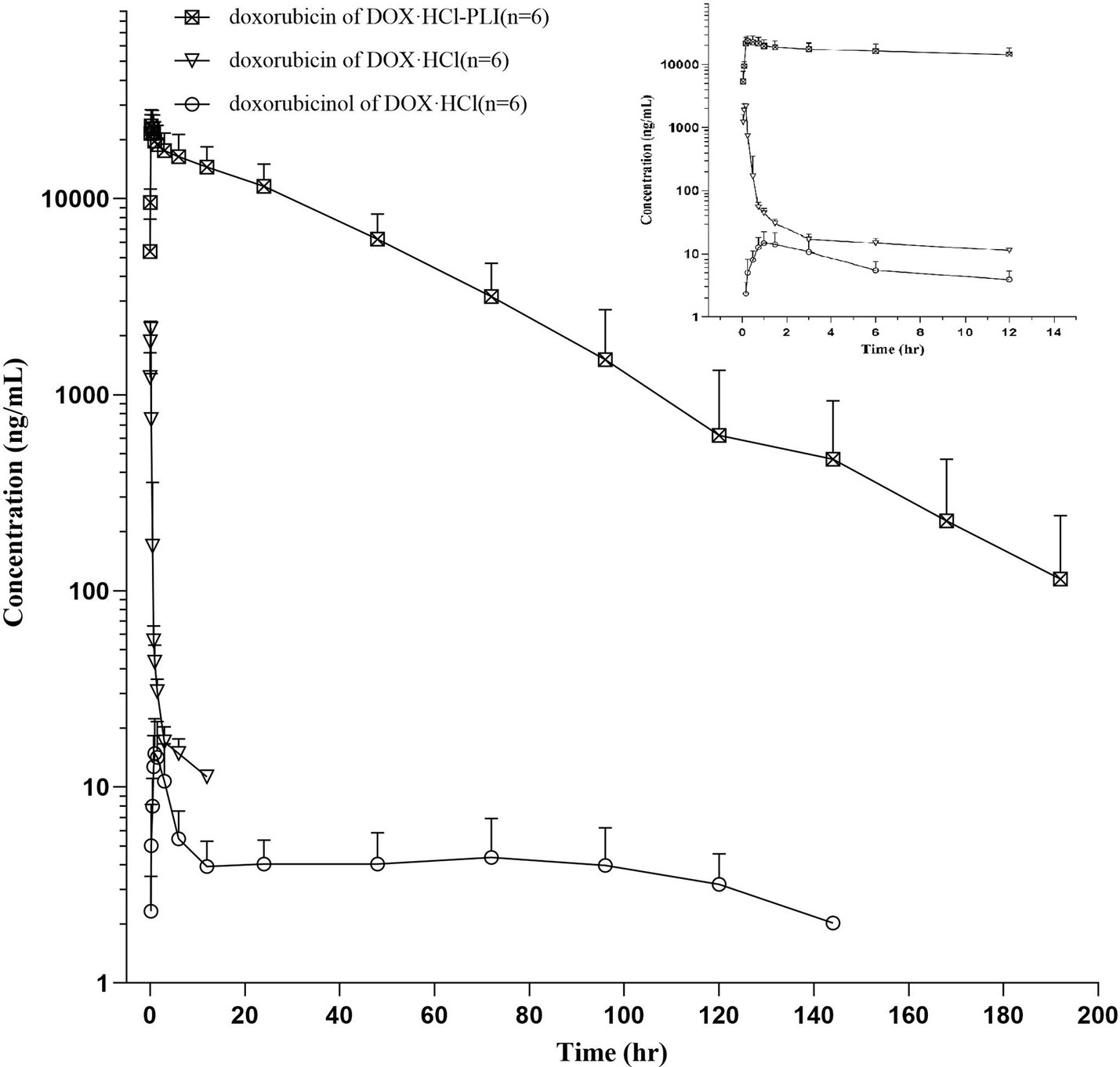 Figura 1. Curvas plasmáticas de concentración plasmática/tiempo de doxorrubicina y doxorrubicinol en gatos (n = 6) tras una inyección intravenosa lenta de una dosis única (20 mg/m2) de DOX· HCl o DOX· HCl-PLI, respectivamente. Se muestra un primer plano de las primeras 12 h después de la administración del fármaco.
Figura 1. Curvas plasmáticas de concentración plasmática/tiempo de doxorrubicina y doxorrubicinol en gatos (n = 6) tras una inyección intravenosa lenta de una dosis única (20 mg/m2) de DOX· HCl o DOX· HCl-PLI, respectivamente. Se muestra un primer plano de las primeras 12 h después de la administración del fármaco.
Los parámetros farmacocinéticos de las dos formulaciones de doxorrubicina se presentan en la Tabla 1. Los resultados mostraron diferencias significativas entre los dos grupos, DOX· HCl y DOX· HCl-PLI, en la T1/2λzAUCúltimoCL_Obs, Vz_Obsy Cmáximo (p < 0,01). Dada la baja concentración del metabolito doxorrubicinol y el número limitado de puntos temporales medidos, no se pudieron obtener con precisión los parámetros farmacocinéticos del doxorrubicinol sobre la base de la dosis actual de doxorrubicina. No se observaron efectos adversos en ningún gato.
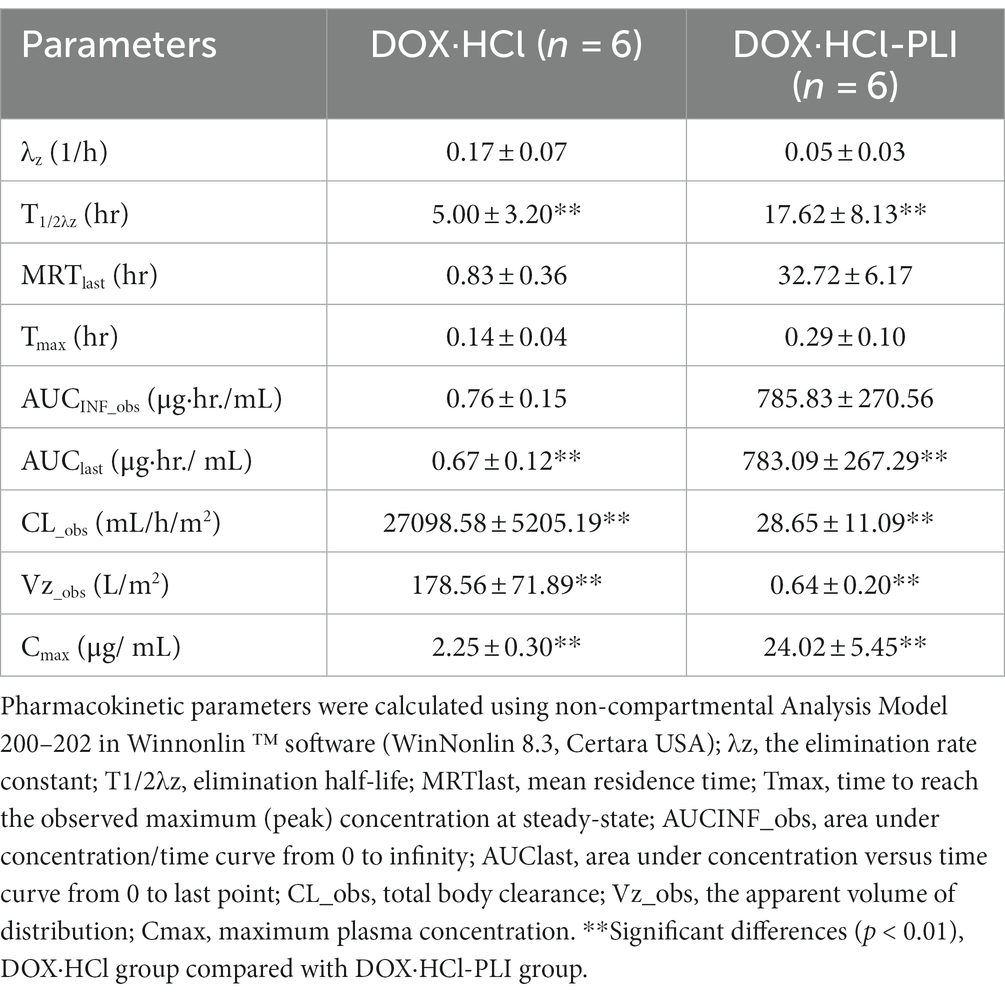 Tabla 1. Parámetros farmacocinéticos plasmáticos (media aritmética ± DE) después de la administración por infusión intravenosa de una dosis única (20 mg/m2) de las dos formulaciones de doxorrubicina para gatos (n = 6), DOX· HCl y DOX· HCl-PLI.
Tabla 1. Parámetros farmacocinéticos plasmáticos (media aritmética ± DE) después de la administración por infusión intravenosa de una dosis única (20 mg/m2) de las dos formulaciones de doxorrubicina para gatos (n = 6), DOX· HCl y DOX· HCl-PLI.
Discusión
La doxorrubicina ha demostrado una eficacia terapéutica significativa en muchos tipos de cáncer, siendo considerada uno de los fármacos quimioterapéuticos aprobados más potentes. Los estudios farmacocinéticos anteriores se centraron principalmente en humanos y otras especies (25); Sin embargo, en los últimos años se ha observado una tendencia al alza en los casos clínicos de tumores clínicos notificados entre los gatos (18, 21). Así, nuestro estudio investigó la farmacocinética de dos formulaciones de doxorrubicina midiendo las concentraciones plasmáticas de doxorrubicina y su metabolito, doxorrubicinol, en gatos. De acuerdo con los hallazgos comunes, nuestros resultados detectaron doxorrubicina y doxorrubicinol en muestras de plasma, con el fármaco original predominantemente presente en el plasma después de la administración (26).
Nuestros hallazgos mostraron diferencias significativas en los perfiles farmacocinéticos de doxorrubicina y doxorrubixinol entre DOX· HCl y DOX· Formulaciones de HCl-PLI. Estos resultados se alinean con los de A. Gabixon et al., en los que el estudio de la formulación del liposoma de doxorrubicina informó de un mayor tiempo de circulación en plasma y un menor volumen aparente de distribución tras la administración intravenosa en comparación con la doxorrubicina convencional (27). Además, nuestro estudio indicó una vida media de eliminación más larga después de la administración de DOX· HCl-PLI en comparación con DOX· Grupo HCl. Cabe destacar que el mismo rasgo también se observó en otras especies, como lo demuestra la vida media de eliminación de 27 ± 5 h después de la administración de doxorrubicina liposomal en perros (28). La presencia de moléculas de polietilenglicol (PEG) en la superficie de la doxorrubicina liposomal contribuye a que sus tiempos de circulación se extiendan in vivo, superando las 18 h en ratones y las 50 h en humanos (29). La aparente diferencia en el tiempo de circulación entre las dos formulaciones probablemente se atribuye a la cubierta de PEG que reduce su interacción con el sistema de fagocitos mononucleares (MPS), lo que ayuda a evitar la eliminación en el hígado (30). Además, el volumen de distribución de DOX· El grupo HCl-PLI fue significativamente menor en comparación con el grupo DOX· HCl, lo que indica que la formulación liposomal está mayoritariamente confinada dentro del compartimento intravascular (2). Además, las AUCúltimo (0,67 ± 0,12 μg·hr./mL) de DOX· El HCl fue menor que el de la DOX· HCl-PLI (783,09 ± 267,29 μg·hr./mL) en gatos.
Estos resultados sugieren que DOX· El HCl-PLI aumenta potencialmente la biodisponibilidad y mejora su potencial de efectos antitumorales. En un estudio realizado por A. Rahmab et al., se exploró la farmacocinética comparativa de la doxorrubicina libre y la doxorrubicina atrapada en liposomas de cardiolipina en ratas administradas a una dosis intravenosa de 6 mg/kg. La concentración plasmática máxima de doxorrubicina libre a los 5 min fue de 1,7 μg/mL, mientras que la formulación de liposomas de cardiolipina produjo una concentración plasmática máxima de doxorrubicina a los 5 min de 20,9 μg/mL. El AUC para la doxorrubicina libre y la doxorrubicina liposomal fue de 1,95 μg·h/mL y 81,4 μg·h/mL, respectivamente (31). Del mismo modo, en ratones, el AUCúltimo (72,98 ± 15,79 μg·hr./mL) de DOX· El HCl fue menor que el de la DOX· HCl-PLI (499,61 ± 72,35·μg hr./mL) (32).
Los presentes hallazgos sugieren que DOX· El HCl presenta un mayor volumen de distribución, un aclaramiento más rápido y una vida media más corta en comparación con el DOX· HCl-PLI.
Sin embargo, nuestro estudio pudo detectar que la concentración de doxorrubicinol era baja inmediatamente después de la administración de DOX· HCl, con aún menos presencia cuando DOX· Se administró HCl-PLI. Estas observaciones concuerdan con hallazgos previos (29, 33) e indican una conversión notablemente reducida de doxorrubicina en doxorrubicinol cuando se administra doxorrubicina en su forma liposomal. Los datos del presente estudio podrían servir como evidencia científica que contribuya a explicar la reducción sustancial de la cardiotoxicidad asociada con la doxorrubicina liposomal.
En conclusión, esta investigación representa una investigación inicial para comprender la farmacocinética de dos formulaciones distintas de doxorrubicina en gatos. Aunque preliminares, los hallazgos ofrecen información fundamental que podría resultar crucial para la administración práctica y clínica de doxorrubicina, particularmente en el tratamiento del cáncer en sujetos felinos.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio están incluidas en el artículo/material complementario, las consultas adicionales pueden dirigirse a los autores correspondientes.
Declaración ética
El estudio en animales fue aprobado por el Comité Institucional de Cuidado y Uso de Animales de la Universidad Agrícola de China (NO. 13303-21-E-001). El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
YL: Redacción – borrador original, Análisis formal, Validación, Redacción – revisión y edición. SC: Redacción – revisión y edición, análisis formal, validación. ZW: Escritura – revisión y edición, Validación. JM: Redacción – revisión y edición, curación de datos, validación. YY: Escritura – revisión y edición, Validación. YZ: Escritura – revisión y edición, Validación. JW: Escribir, revisar y editar. XC: Escritura – revisión y edición.
Financiación
El/los autor/es declaran/n que no se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo.
Reconocimientos
Nos gustaría agradecer a Xiaohui Gong, Pan Sun y Jing Li por su ayuda con la determinación analítica de medicamentos y consumibles experimentales de pedido.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Rivankar, S. Una descripción general de las formulaciones de doxorrubicina en la terapia del cáncer. J Cancer Res ther. (2014) 10:853–8. doi: 10.4103/0973-1482.139267
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Tahover, E, Patil, YP y Gabizon, AA. Sistemas de administración emergentes para reducir la cardiotoxicidad de la doxorrubicina y mejorar el índice terapéutico: enfoque en liposomas. Medicamentos contra el cáncer. (2015) 26:241–58. doi: 10.1097/CAD.000000000000000182
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Li, XR, Cheng, XH, Zhang, GN, Wang, XX y Huang, JM. Análisis de la seguridad cardíaca del fármaco quimioterápico pegilado de primera línea doxorrubicina liposomal en el cáncer de ovario. J Res. Ovárica. (2022) 15:96. doi: 10.1186/s13048-022-01029-6
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Wu, BB, Leung, KT y Poon, EN. Terapia dirigida mitocondrial para la cardiotoxicidad inducida por doxorrubicina. Int J Mol Sci. (2022) 23:1912. doi: 10.3390/ijms23031912
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Kong, CY, Guo, Z, Song, P, Zhang, X, Yuan, YP, Teng, T, et al. Subyacente a los mecanismos de la cardiotoxicidad aguda inducida por doxorrubicina: estrés oxidativo y muerte celular. Int J Biol Sci. (2022) 18:760–70. doi: 10.7150/ijbs.65258
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Sheibani, M, Azizi, Y, Shayan, M, Nezamoleslami, S, Eslami, F, Farjoo, MH, et al. Cardiotoxicidad inducida por doxorrubicina: una visión general de los enfoques terapéuticos preclínicos. Cardiovasc Toxicol. (2022) 22:292–310. doi: 10.1007/s12012-022-09721-1
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Harahap, Y, Ardiningsih, P, Corintias Winarti, A, y Purwanto, DJ. Análisis de la doxorrubicina y doxorrubicinol en el plasma de pacientes con cáncer de mama para monitorizar la toxicidad de la doxorrubicina. Drug des Devel ther. (2020) 14:3469–75. doi: 10.2147/DDDT. S251144
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Zeng, X, Cai, H, Yang, J, Qiu, H, Cheng, Y y Liu, M. Farmacocinética y cardiotoxicidad de la doxorrubicina y su metabolito secundario de alcohol en ratas. Farmacia Biomédica. (2019) 116:108964. doi: 10.1016/j.biopha.2019.108964
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Gabizón, AA. Doxorrubicina liposomal pegilada: metamorfosis de un fármaco antiguo en una nueva forma de quimioterapia. Cancer Investig. (2001) 19:424–36. doi: 10.1081/CNV-100103136
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Laginha, KM, Verwoert, S, Charrois, GJ y Allen, TM. Determinación de los niveles de doxorrubicina en tumor completo y núcleos tumorales en tumores de cáncer de mama murino. Clin Cáncer Res. (2005) 11:6944–9. doi: 10.1158/1078-0432.CCR-05-0343
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Goebel, FD, Goldstein, D, Goos, M, Jablonowski, H, y Stewart, JS. Eficacia y seguridad de la doxorrubicina liposomal sigilosa en el sarcoma de Kaposi relacionado con el sida. El grupo de estudio internacional Sl-dox. Hno. J Cáncer. (1996) 73:989–94. doi: 10.1038/bjc.1996.193
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Taléns-Visconti, R, Díez-Sales, O, de Julián-Ortiz, JV, y Nácher, A. Nanoliposomas en la terapia del cáncer: productos comercializados y ensayos clínicos actuales. Int J Mol Sci. (2022) 23:4249. doi: 10.3390/ijms23084249
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Nascimento, C, Gameiro, A, Correia, J, Ferreira, J, y Ferreira, F. El panorama de las células inmunitarias infiltrantes de tumores en el carcinoma mamario felino: implicaciones patológicas y clínicas. Célula. (2022) 11:2578. doi: 10.3390/cells11162578
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Nascimento, C, y Ferreira, F. Microambiente tumoral del cáncer de mama humano y carcinoma mamario felino como posible modelo de estudio. Biochim Biophys Acta Rev Cáncer. (2021) 1876:188587. doi: 10.1016/j.bbcan.2021.188587
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Granados-Soler, JL, Taher, L, Beck, J, Bornemann-Kolatzki, K, Brenig, B, Nerschbach, V, et al. El perfil de transcripción de carcinomas mamarios felinos y líneas celulares derivadas revela biomarcadores y dianas farmacológicas asociadas con las vías metabólicas y del ciclo celular. Sci Rep. (2022) 12:17025. doi: 10.1038/s41598-022-20874-5
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Williams, AG, Hohenhaus, AE, y Lamb, KE. Incidencia y tratamiento del linfoma renal felino: 27 casos. J Feline Med Surg. (2021) 23:936–44. doi: 10.1177/1098612X20984363
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Simon, KL, Cook, MR, Husbands, BD, Long, ME, Hokamp, JA, Helms, TH, et al. Uso de quimioterapia con doxorrubicina después de la cirugía citorreductora en el tratamiento de un gato con hemangiosarcoma mesentérico. JFMS Open Rep. (2022) 8:20551169221121900. doi: 10.1177/20551169221121900
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Zabielska-Koczywąs, K, y Lechowski, R. El uso de liposomas y nanopartículas como sistemas de administración de fármacos para mejorar el tratamiento del cáncer en perros y gatos. Moléculas. (2017) 22:2167. doi: 10.3390/moléculas22122167
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Barber, LG, Sorenmo, KU, Cronin, KL y Shofer, FS. Quimioterapia combinada con doxorrubicina y ciclofosfamida para el fibrosarcoma felino irresecable. J Am Anim Hosp Assoc. (2000) 36:416–21. doi: 10.5326/15473317-36-5-416
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Reiman, RA, Mauldin, GE y Neal, MG. Comparación de la toxicidad de dos esquemas de dosificación de doxorrubicina en el gato. J Feline Med Surg. (2008) 10:324–31. doi: 10.1016/j.jfms.2007.12.009
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Gameiro, A, Urbano, AC, y Ferreira, F. Biomarcadores emergentes y terapias dirigidas en el carcinoma mamario felino. Veterinaria Sci. (2021) 8:164. doi: 10.3390/vetsci8080164
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. Tardi, PG, Boman, NL y Cullis, PR. Doxorrubicina liposomal. J Objetivo farmacológico. (1996) 4:129–40. doi: 10.3109/10611869609015970
24. Anders, CK, Adamo, B, Karginova, O, Deal, AM, Rawal, S, Darr, D, et al. Farmacocinética y eficacia de la doxorrubicina liposomal pegilada en un modelo intracraneal de cáncer de mama. PLoS Uno. (2013) 8:E61359. doi: 10.1371/journal.pone.0061359
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Gabizon, A, Shmeeda, H y Barenholz, Y. Farmacocinética de la doxorrubicina liposomal pegilada: revisión de estudios en animales y humanos. Clin Pharmacokinet. (2003) 42:419–36. doi: 10.2165/00003088-200342050-00002
26. Maniez-Devos, DM, Baurain, R, Trouet, A, y Lesne, M. Farmacocinética de la doxorrubicina en el conejo. J Pharmacol. (1985) 16:159–69.
27. Gabizon, A, Catane, R, Uziely, B, Kaufman, B, Safra, T, Cohen, R, et al. Prolongación del tiempo de circulación y aumento de la acumulación en exudados malignos de doxorrubicina encapsulada en liposomas recubiertos de polietilenglicol. Cáncer Res. (1994) 54:987–92.
28. Gabizon, AA, Barenholz, Y, y Bialer, M. Prolongación del tiempo de circulación de la doxorrubicina encapsulada en liposomas que contienen un fosfolípido derivado de polietilenglicol: estudios farmacocinéticos en roedores y perros. Pharm Res. (1993) 10:703–8. doi: 10.1023/A:1018907715905
29. Allen, TM, K Cheng, WW, Hare, JI y Laginha, KM. Farmacocinética y farmacodinámica de las nanopartículas lipídicas en el cáncer. Agentes anticancerígenos Med Chem. (2006) 6:513–23. doi: 10.2174/187152006778699121
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Makwana, V, Karanjia, J, Haselhorst, T, Anoopkumar-Dukie, S, y Rudrawar, S. Doxorrubicina liposomal como plataforma de administración dirigida: tendencias actuales en la funcionalización de superficies. Int J Pharm. (2021) 593:120117. doi: 10.1016/j.ijpharm.2020.120117
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Rahman, A, Carmichael, D, Harris, M, y Roh, JK. Farmacocinética comparativa de la doxorrubicina libre y la doxorrubicina atrapada en liposomas de cardiolipina. Cáncer Res. (1986) 46:2295–9.
32. Lu, WL, Qi, XR, Zhang, Q, Li, RY, Wang, GL, Zhang, RJ, et al. Una plataforma liposomal pegilada: farmacocinética, farmacodinamia y toxicidad en ratones que utilizan doxorrubicina como fármaco modelo. J Pharmacol Sci. (2004) 95:381–9. doi: 10.1254/jphs. FPJ04001X
Resumen de PubMed | Texto completo de Crossref | Google Académico
33. Liu, Y, Yang, Y, Liu, X y Jiang, T. Cuantificación de doxorrubicina liposomal pegilada y doxorrubicinol en plasma de rata mediante cromatografía líquida/espectroscopia de masas en tándem con electrospray: aplicación a estudios farmacocinéticos preclínicos. Talanta. (2008) 74:887–95. doi: 10.1016/j.talanta.2007.07.022
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: doxorrubicina, doxorrubicinol, farmacocinética comparada, felino, cáncer
Cita: Liu Y, Chen S, Wen Z, Meng J, Yang Y, Zhang Y, Wang J y Cao X (2024) Farmacocinética comparativa de la doxorrubicina libre y una formulación liposomal en gatos después de la administración intravenosa. Frente. Vet. Sci. 11:1353775. doi: 10.3389/fvets.2024.1353775
Recibido: 11 de diciembre de 2023; Aceptado: 08 de enero de 2024;
Publicado: 17 enero 2024.
Editado por:
Irma Ares, Universidad Complutense de Madrid, España
Revisado por:
Dawei Guo, Universidad Agrícola de Nanjing, China
Fernando Costa Ferreira, Universidad de Lisboa, Portugal
Derechos de autor © 2024 Liu, Chen, Wen, Meng, Yang, Zhang, Wang y Cao. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Jianzhong Wang, de wjz2020@foxmail.com; jianzhongwang@cau.edu.cn; Xingyuan Cao, cxy@cau.edu.cn
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía