La moxidectina es candidata para su uso como patrón interno in vivo en estudios farmacocinéticos
La moxidectina es candidata para su uso como patrón interno in vivo en estudios farmacocinéticos, como se ha demostrado con su uso en la recolección simultánea de fluidos en jaula de tejidos y ultrafiltración
 Richard Munn1,2*
Richard Munn1,2*  Ted Whittem1,3
Ted Whittem1,3- 1Facultad de Veterinaria de Melbourne, Facultad de Ciencias, Universidad de Melbourne, Werribee, VIC, Australia
- 2Cognosco, Servicios Veterinarios Anexa, Morrinsville, Nueva Zelanda
- 3Facultad de Salud Pública, Ciencias Médicas y Veterinarias, Universidad James Cook, Townsville, QLD, Australia
La ultrafiltración in vivo se ha utilizado en farmacocinética veterinaria desde principios de la década de 2000 como una mejora del modelo de jaula de tejido que permite la toma de muestras de fluidos de compartimentos extracirculatorios. La variabilidad en la recuperación de analitos de las muestras de ultrafiltración, debido al ensuciamiento de la membrana o a la inflamación de los tejidos, ha sido una preocupación para esta técnica. Se pueden utilizar patrones internos para escalar o verificar el resultado desconocido, como es común en las extracciones analíticas y la microdiálisis in vivo. A ocho ovejas merinas se les implantaron jaulas de tejido subcutáneo y 2 semanas antes del inicio del estudio se inyectaron 0,2 mg/kg de moxidectina por vía subcutánea. El día del estudio se introdujeron sondas de ultrafiltración por vía subcutánea. En el momento cero se inyectaron 4 mg/kg de carprofeno por vía intravenosa. Las muestras de plasma, jaula tisular y ultrafiltración se tomaron 30 minutos antes y 0,5, 1, 2, 3, 4, 5, 7, 24, 36, 48, 72 h después de la dosificación. Las concentraciones de carprofeno y moxidectina se midieron mediante LC-MS/MS. Los parámetros farmacocinéticos se estimaron utilizando Monolix tanto para las concentraciones de carprofeno como para las concentraciones de carprofeno corregidas por moxidectina. Las sondas de ultrafiltración no lograron producir de manera consistente suficiente volumen de muestra para analizar. Las concentraciones de moxidectina en el plasma y en el líquido de la jaula tisular se mantuvieron estables durante la ventana de muestreo de 72 h. La moxidectina demostró ser adecuada como patrón interno in vivo para la investigación farmacocinética utilizando jaulas de tejido, muestras de plasma y sondas de ultrafiltración, pero la aplicación de técnicas de ultrafiltración requiere refinamiento.
1 Introducción
La ultrafiltración in vivo se ha utilizado en la investigación farmacológica veterinaria desde al menos principios de la década de 2000 (1), aunque la adopción del método ha sido lenta desde su descripción temprana para estudios de distribución de fármacos en 1992 (2). La ultrafiltración in vivo se considera un modelo mejorado para el muestreo de fluidos tisulares en comparación con los modelos de jaula tisular (3). Una sonda de ultrafiltración, que consiste en múltiples bucles de una membrana que es porosa a moléculas de menos de 30.000 Da, se inserta por vía subcutánea y se conecta a un vial de recolección bajo presión negativa (vacutainer). El vial de recolección se reemplaza en los puntos de tiempo designados para dar múltiples muestras. La concentración del analito se determina y se considera la concentración media del período de muestreo, normalmente trazada como el punto medio del período de muestreo. Esta metodología fue desarrollada para el monitoreo de glucosa por Janle et al. y reportada en 1987 (4).
La temperatura, el diferencial de presión, el material de membrana elegido y el área superficial de la membrana afectan el flujo de analito a través de la membrana (2). Además de estos factores, se ha reconocido que el ensuciamiento cambia el flujo a través de la membrana (5). Imsilp et al. (6) informaron de respuestas inflamatorias a la implantación intramuscular de sondas de ultrafiltración de poliacrilonitrilo en ovejas, con la preocupación de que la inflamación pueda cambiar la recuperación de los analitos diana. Bungay et al. (7), desarrollaron un modelo para explicar la inflamación inducida por la implantación de sondas de microdiálisis, que están construidas con el mismo material que las sondas de ultrafiltración, en el tejido neural. El modelo predijo que la inflamación llevaría a una subestimación de las concentraciones de analitos. Los usos anteriores de las sondas de ultrafiltración para el muestreo farmacocinético no han descrito métodos para incorporar un control interno para compensar estos cambios en la recuperación del analito.
A diferencia de la ultrafiltración, las técnicas de microdiálisis utilizan una perfusión bombeada que contiene una concentración conocida de un compuesto como patrón interno. Este compuesto junto con el analito objetivo se mide y el cambio en el patrón interno se utiliza para calcular la recuperación relativa del analito objetivo. Linhares y Kissinger (8) compararon la ultrafiltración y la microdiálisis simultáneamente para las mediciones farmacocinéticas de teofilina en un pequeño número (n = 3) de ratas, las concentraciones obtenidas entre las dos técnicas difirieron pero la pendiente y la forma del gráfico de tiempo de concentración fueron similares.
Los patrones internos ideales para la microdiálisis, al igual que para otras técnicas analíticas como la cromatografía líquida, tienen propiedades fisicoquímicas similares a las del compuesto que se está estudiando. Para la microdiálisis, el patrón interno debe difundirse a través de la membrana de manera similar al compuesto de interés y ser metabolizado por vías similares en el tejido (9). Algunos autores han empleado radioisótopos para lograrlo (10). Dado que el patrón interno se bombea a la membrana y al tejido a una velocidad constante, en la microdiálisis el patrón interno debe tener una vida media de eliminación corta para que se pueda alcanzar rápidamente un estado estacionario.
Un fármaco administrado sistémicamente que alcanza una concentración en estado estacionario podría proporcionar un control interno para el muestreo por ultrafiltración. A concentraciones en estado estacionario, se esperaría que el patrón interno estuviera a una concentración constante en cualquier tejido dado, por lo que los cambios en la concentración, particularmente las disminuciones, indicarían un cambio potencial en la recuperación del analito de interés en el ultrafiltrado. El cambio relativo en el estándar interno podría utilizarse para corregir el cambio en la recuperación.
La moxidectina es una lactona macrocíclica antiparasitaria, comúnmente utilizada en medicina veterinaria para el tratamiento de nematodos intestinales y parásitos externos como los piojos. Además, tiene actividad contra el gusano del corazón microfiliria (Dirofilaria immitis) en perros. Se ha descrito la farmacocinética de la moxidectina en ovejas (11). Debido a su larga vida media de ~18 y 19 días en ovejas y perros, respectivamente, puede dosificarse mensualmente para la prevención del gusano del corazón (12) o proporcionar actividad residual contra parásitos intestinales como Haemonchus contortus. Las concentraciones plasmáticas en estado pseudoestacionario, en relación con los fármacos de acción corta, pueden alcanzarse después de una dosis única o poco frecuente. Estas características lo convierten en un candidato potencial para su uso como estándar interno in vivo.
El carprofeno es un medicamento antiinflamatorio no esteroideo (AINE) ampliamente utilizado en medicina veterinaria para el tratamiento del dolor y la inflamación. Se ha utilizado ampliamente en estudios farmacológicos en múltiples especies con modelos de jaula de tejido y ultrafiltración, incluida la descripción de su farmacocinética en ovejas (3, 13-17).
En nuestro trabajo previo en ovejas (16) se recogieron muestras simultáneas, de cinco tamaños de jaulas de tejido y de sangre, tras la dosificación de carprofeno. La relación entre el área de superficie y el volumen difirió entre los tamaños de las jaulas de tejido y se construyó un modelo para ajustar simultáneamente la farmacocinética para el plasma y todas las jaulas de tejido. Se utilizó una relación lineal para describir el cambio en las microconstantes de flujo entre el compartimento central y las jaulas de tejido. Se demostró que la relación entre el área de superficie y el volumen afecta los resultados farmacocinéticos en las jaulas de tejido. Las sondas de ultrafiltración tienen un volumen mínimo y una superficie difusible extremadamente grande y, por lo tanto, deberían representar el estándar de oro para medir fármacos en fluidos tisulares, ya que el SA:V es prácticamente infinito.
Los objetivos de este estudio son dobles. En primer lugar, pretendemos adquirir datos simultáneos de un modelo de jaula tisular y sondas de ultrafiltración, que permitan contrastar o comparar y posiblemente validar los diferentes modelos experimentales. En segundo lugar, este estudio tiene como objetivo investigar la viabilidad del uso de la moxidectina como patrón interno in vivo para el muestreo de fluidos tisulares (ultrafiltración y/o jaula tisular). Nuestras hipótesis son que los datos de ultrafiltración se parecerán más a la farmacocinética del plasma que a los datos de la jaula tisular y que la moxidectina proporcionará una concentración en estado pseudoestacionario durante la duración del experimento y los cambios en la concentración de moxidectina reflejarán cambios en la recuperación del carprofeno.
2 Materiales y métodos
El trabajo con animales fue aprobado por el Comité de Ética Animal de la Facultad de Ciencias Veterinarias y Agrícolas de la Universidad de Melbourne (UoM 2,015,111).
Se inscribieron ocho hembras merinas, de aproximadamente 18 meses de edad y con un peso de entre 42 y 51,5 kg. Se determinó que cada uno de los pacientes estaba sano mediante un examen clínico veterinario y pruebas hematológicas y bioquímicas rutinarias antes de la inclusión. Todas las ovejas se alojaban en un cobertizo de hierro corrugado sobre pisos de listones con agua suministrada ad libitum. Diariamente se proporcionaron pellets (Sheep & Cattle Rumevite, Townsville, QLD, Australia) y paja de alfalfa. La ventilación se proporcionó mediante el movimiento pasivo del aire a través de puertas y ventanas, y se realizaron experimentos entre octubre y noviembre de 2020 en Werribee, Victoria, Australia (18).
Los animales fueron anestesiados y se introdujeron dos jaulas de tejido (6 cm y 10 cm de longitud) debajo de la piel en un lado del cuello tres semanas antes del experimento, como se describió anteriormente (16, 18), con la adición de un bloqueo de campo anestésico local que se colocó alrededor del sitio quirúrgico con ropivacaína al 0,75%. El lado del cuello en el que se implantaron las jaulas de tejido se alternó de modo que 4 ovejas tuvieran implantado el lado izquierdo y 4 el lado derecho.
Catorce días antes del experimento, se inyectaron 0,2 mg/kg de moxidectina (Cydectin, Virbac, Milperra, NSW, Australia) por vía subcutánea en una extremidad posterior.
En la mañana del experimento, se cateterizó una vena cefálica con un catéter intravenoso de 18 g (Jelco Optiva, Smiths Medical Macquarie Park NSW) y se conectó un puerto de inyección. El puerto y el catéter se aseguraron con cinta adhesiva y se enjuagaron con solución salina heparinizada después de cada muestra. El lado del cuello sin jaulas de tejido se recortó y se preparó asépticamente con exfoliante de yodo. Se inyectaron dos ampollas de lignocaína al 2% debajo de la piel y se hizo una incisión punzante a través de la ampolla. Se tunelizó un trócar introductor metálico estéril por vía subcutánea desde la incisión ventralmente, se insertó la sonda de ultrafiltración dentro del trócar, luego se retiró el trócar mientras se mantenía la sonda en su lugar. La sonda se fijó a la oveja colocando alas con cinta de mariposa alrededor del tubo expuesto y grapando las alas a la piel con grapas de piel. El tubo estaba conectado a una aguja de doble extremo montada en una campana de muestreo vacutainer. Se colocó un frasco de muestra con presión negativa en el extremo de la aguja.
En el momento cero, se inyectaron 4 mg/kg de carprofeno por vía intravenosa en la vena cefálica contralateral al catéter intravenoso. Se obtuvieron muestras de sangre y líquido de la jaula tisular en los puntos temporales -0,5, 0,5, 1, 2, 3, 4, 5, 7, 24, 36, 48, 72 h. El vial de muestra conectado a cada una de las sondas de ultrafiltración se cambió en estos mismos momentos. Se obtuvieron muestras de sangre a través del catéter cefálico, se extrajeron 1,5 mL de sangre y se desecharon antes de obtener una muestra de 4 mL, el catéter se enjuagó con solución salina heparinizada. El líquido tisular de la jaula se obtuvo mediante punción percutánea de la jaula con una aguja hipodérmica de 20 ga, la analgesia fue proporcionada por el dispositivo Coolsense (18). Todas las muestras se recogieron o transfirieron a viales de muestra que contenían heparina de litio.
Las muestras se almacenaron a 4 °C antes de la centrifugación, el plasma (sangre) o el fluido libre de sedimentos (jaula de tejido) se decantó en tubos de microcentrífuga de 1,5 ml y se almacenó a -80 °C hasta el análisis (≤21 días). Se ha demostrado que el carprofeno y la moxidectina son estables en plasma canino y humano, respectivamente, a -80 °C (19, 20).
Al final de la fase de vida, las ovejas fueron sacrificadas con pentobarbitona IV a través del catéter cefálico. Tejido de alrededor de la sonda de ultrafiltración recogido y enviado para su examen histopatológico.
2.1 Método analítico
Las muestras se sometieron a análisis LCMS de carprofeno y moxidectina por separado. El análisis del carprofeno fue como se describió anteriormente (16) con los siguientes refinamientos; La preparación de la muestra se simplificó a 100 μL de muestra, además de 400 μL de solución de trabajo estándar interna de ácido meclofenámico que se agregó a las placas de paso Ostro (Waters Australia Rydalmere, NSW). El acetonitrilo (ACN) se sustituyó por metanol 50:50: ACN como fase móvil B. La fase móvil A fue agua MilliQ sin adición de tampón y el volumen de inyección se redujo a 5 μL. La curva estándar se amplió a 100 μg/mL. El ensayo fue parcialmente validado para concentraciones entre 0,25 y 100 μg/mL. El plasma enriquecido se analizó en cada punto de la curva estándar con 6 muestras para calcular el CV entre muestras. Además, el CV intraensayo se calculó a 50, 10, 1 y 0,25 μg/mL. Toda la validación se realizó en un solo día, no se evaluó la variabilidad interdiaria. La variabilidad entre ensayos fue del 1,9 % al 4,7 % y la variabilidad entre ensayos fue del 0,4 % al 2,3 %.
Se desarrolló un método de moxidectina que fue parcialmente validado. La preparación de la muestra para el análisis de moxidectina fue; Se mezclaron 400 μL de muestra con 1.000 μL de solución de trabajo estándar interna de abamectina (500 ng/ml de disolvente ACN) en un tubo de microcentrífuga. Este fue centrifugado y decantado. El sobrenadante se evaporó hasta que se secó en un Speedvac (Environmental Speedvac Savant, Estados Unidos) a temperatura media. Las muestras se reconstituyeron con 200 μL de ACN antes de transferirlas a placas de 96 pocillos para su análisis. El muestreador automático realizó una inyección de 20 μL en un sistema LCMS/MS de Shimadzu equipado con una columna C18 como se describió anteriormente (16), el horno de columna se mantuvo a 50 °C. El programa de cromatografía líquida comenzó en una fase móvil orgánica al 30% (alcohol isopropílico: ACN, 75:25) aumentando al 90% orgánico a los 5 min, la fase móvil se cambió rápidamente a una fase acuosa al 95% (agua MilliQ) antes de volver a las condiciones iniciales durante 2 min. El gas de nebulización, el gas de calefacción y el gas de secado se ajustaron a 2, 10 y 10 L/m, respectivamente. La temperatura de la interfaz, la temperatura DL y el bloque calefactor se ajustaron a 375, 250 y 400 °C. La espectrometría de masas se llevó a cabo en modo MRM con ionización por electropulverización negativa. Abamectin m/z 871.6 → 229.2 y 565.5 con energías de colisión de 27 y 28 eV, respectivamente. La moxidectina m/z se monitorizó 638,3 → 602,4, 236,2 y 247,1 con CE 20, 27, 26 eV, respectivamente. El ensayo se validó parcialmente para concentraciones entre 10 ng/mL y 0,25 ng/mL. Se calculó CV intraensayo para 10, 5, 2,5, 1, 0,5, 0,25 ng/mL. La variabilidad entre ensayos fue del 5,3 % al 18,5 % y la variabilidad entre ensayos fue del 2,1 % al 5,9 %.
Se incluyeron picos plasmáticos de moxidectina o carprofeno en cada ciclo analítico como control de calidad. Los resultados de las muestras se ajustaron en función de la relación entre la concentración medida y la concentración conocida del plasma enriquecido.
Dado que los volúmenes de muestra obtenidos de las sondas de ultrafiltración eran generalmente bajos, el método LCMS se modificó para volúmenes pequeños; Se combinaron 60 μL de muestra con 150 μL de ISWS de abamectina para el análisis de moxidectina, 100 o 20 μL de muestra se combinaron con 400 u 80 μL de ISWS MFA dependiendo del volumen de muestra disponible. El resto de la preparación de la muestra siguió como se indicó anteriormente, con volúmenes ajustados para mantener las proporciones. En la mayoría de los casos se utilizó la muestra completa, lo que evitó la repetición del análisis de las muestras.
2.2 Métodos estadísticos
El análisis farmacocinético se realizó en Monolix (2023R1, SimulationsPlus) utilizando un modelo personalizado como se describió anteriormente (16), las concentraciones de la jaula tisular fueron impulsadas por el compartimento central con la longitud de la jaula en centímetros utilizada como valor del regresor. El modelo se ejecutó tanto en las concentraciones de carprofeno crudo como en la concentración de carprofeno corregida. Los intervalos de confianza para los parámetros estimados por Monolix se generaron utilizando el paquete Rsmlx en R (21).
3 Resultados
Se obtuvieron resultados válidos de carprofeno plasmático para todos los puntos temporales en todas las ovejas, excepto en la oveja 6 a las 36 h. La moxidectina plasmática no fue detectable en las ovejas 1 a −0,5 y en las ovejas 6 a las 72 h. En las jaulas de tejido no se pudo medir carprofeno en las ovejas 2 a las 5 h en la jaula de 6 cm y en las ovejas 4 a la 1 h en la jaula de 10 cm. No se pudo medir la moxidectina en 6 muestras de las jaulas de tejidos de las ovejas 6 y 8.
La ultrafiltración arrojó 74 muestras a partir de las cuales se pudo cuantificar carprofeno (n = 71), moxidectina (n = 19) o ambos (n = 16). Las concentraciones de carprofeno fueron generalmente bajas, con 66 muestras con concentraciones inferiores a 1 ng/mL.
Las concentraciones plasmáticas de moxidectina tuvieron poca variación dentro de las ovejas individuales durante el período de muestreo, con una media (CV) de moxidectina plasmática de 8,55-8,57 (0,05-0,15) ng/ml. La concentración media de moxidectina en las jaulas de tejido en las jaulas de tejido individual dentro de las jaulas de tejido fue de 8,25 a 8,58 ng/ml, con un CV que osciló entre el 0,03 % y el 14 %.
Las concentraciones de carprofeno se corrigieron cuando se disponía de un resultado válido de moxidectina concurrente multiplicando el resultado de carprofeno por la concentración media de moxidectina en el tejido respectivo y en las ovejas dividida por el resultado de la moxidectina.
3.1 Farmacocinética
La estimación farmacocinética se realizó simultáneamente en los datos plasmáticos y de la jaula tisular, pero no se dispuso de resultados válidos suficientes de las sondas de ultrafiltración para realizar el análisis de estos datos. Se incluyó una covariable continua en el modelo para describir el cambio en el flujo entre la jaula de tejido y el compartimento central debido al tamaño de la jaula de tejido.
En la Figura 1 se muestran los parámetros farmacocinéticos estimados para las concentraciones de carprofeno crudo y corregido, y el intervalo de confianza del 95%. La corrección de las concentraciones de carprofeno mediante concentraciones de moxidectina no alteró los valores estimados de los parámetros farmacocinéticos. El grado de incertidumbre de estos valores no se vio afectado, como lo muestran los intervalos de confianza del 95%. Las estimaciones exactas están disponibles en el cuadro suplementario S1, pero no se informa, como se indica a continuación.
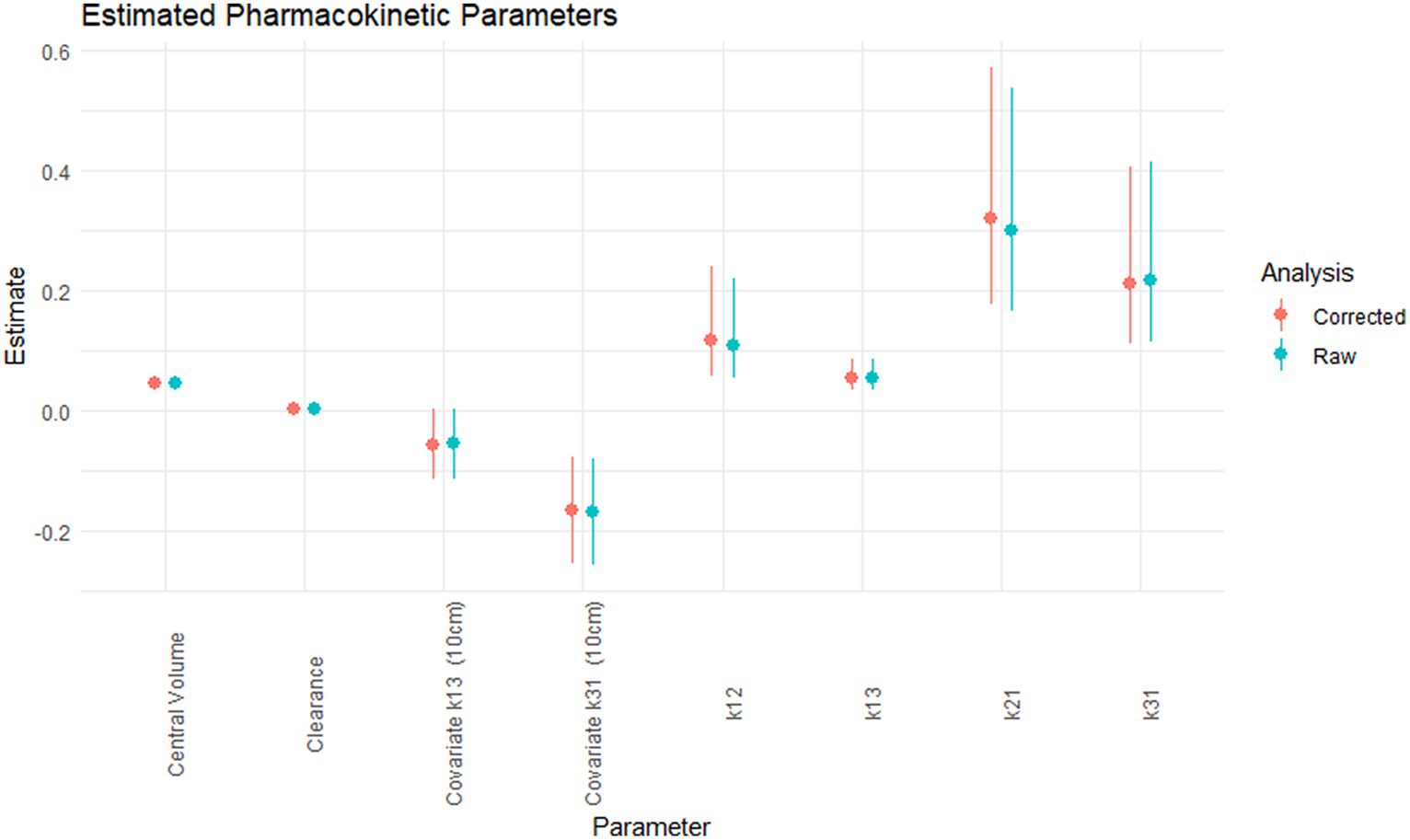 Figura 1. Los parámetros farmacocinéticos estimados; volumen central (L/kg), espacio libre (L/kg.h), covariable para k13 para jaula de 10 cm (h−1), covariable para K31 para jaula de 10 cm (h−1), K12 (h−1), k13 (h−1), K21 (h−1), K31 (h−1) para el carprofeno crudo (verde) y corregido.
Figura 1. Los parámetros farmacocinéticos estimados; volumen central (L/kg), espacio libre (L/kg.h), covariable para k13 para jaula de 10 cm (h−1), covariable para K31 para jaula de 10 cm (h−1), K12 (h−1), k13 (h−1), K21 (h−1), K31 (h−1) para el carprofeno crudo (verde) y corregido.
3.2 Histopatología
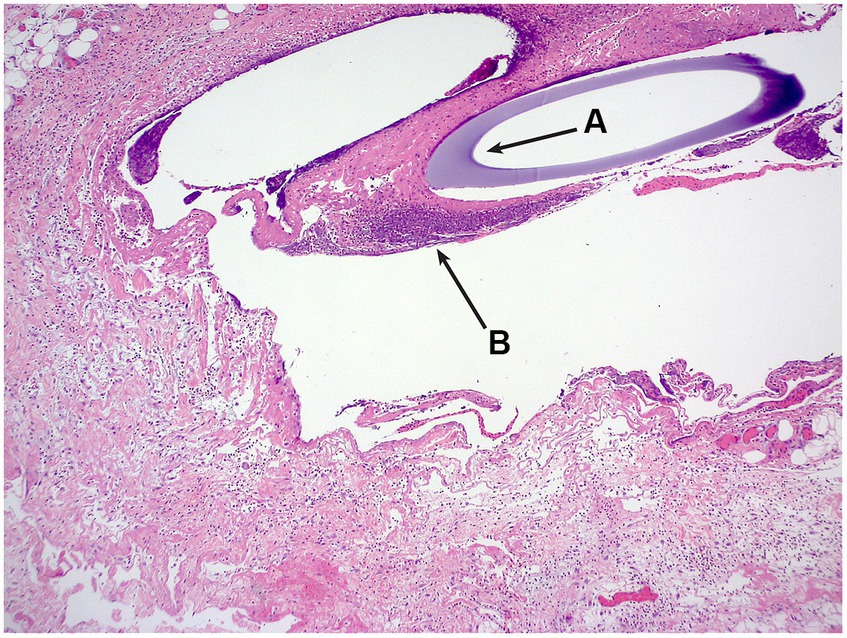
Una sola sonda de ultrafiltración se recuperó post mortem in situ y se sometió a histología. Se examinaron seis secciones de piel hasta el nivel del tejido adiposo subcutáneo y los músculos esqueléticos. Todas las secciones revelan cambios comparables, pero los cambios fueron más prominentes en secciones de la parte distal del implante de cuerda. Localizado dentro del subcutis profundo y formando un manto alrededor de los espacios cavitados que en ocasiones contienen la sección transversal de un tubo basófilo había un infiltrado inflamatorio moderado y mixto. Este infiltrado estaba dominado por macrófagos, incluidas células gigantes multinucleadas, neutrófilos y eosinófilos, junto con menos linfocitos y células plasmáticas raras. También se observaron dentro de estas áreas inflamadas eritrocitos libres, así como acumulaciones de material eosinofílico amorfo a fibrilar con aparición de fibrina y necrosis. Hubo acúmulos marginales de fibroblastos, vasos y fibras de colágeno de pequeño calibre (tejido de granulación). No se identificaron bacterias en la tinción de Gram. El diagnóstico morfológico fue de paniculitis piogranulomatosa moderada, crónica, multifocal con cuerpo extraño intralesional (Figura 2).
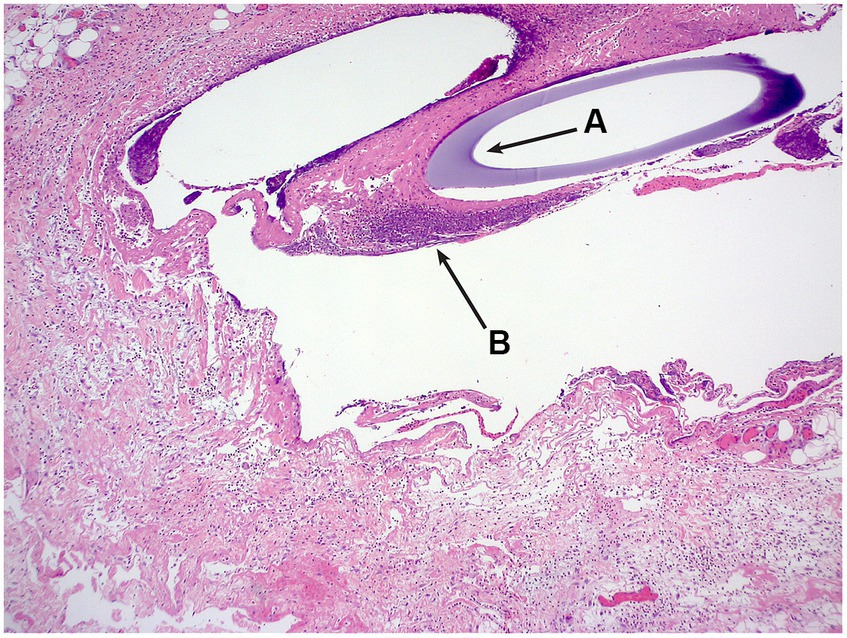 Figura 2. Fotomicrografía H&E, se puede ver la sección transversal de la sonda de ultrafiltración (A), rodeada de infiltrado inflamatorio (B).
Figura 2. Fotomicrografía H&E, se puede ver la sección transversal de la sonda de ultrafiltración (A), rodeada de infiltrado inflamatorio (B).
4 Discusión
Las concentraciones de moxidectina medidas en el plasma y en el fluido de la jaula tisular mostraron poca variabilidad a lo largo del período de muestreo. Esto demuestra que la moxidectina es adecuada como patrón interno in vivo para períodos de muestreo de hasta 72 h en ovejas cuando se administra 14 días antes de la primera muestra planificada. La estabilidad de la moxidectina en el líquido de la jaula tisular sugiere que la eliminación del líquido de la muestra no influyó directamente en los valores farmacocinéticos obtenidos. Es poco probable que la moxidectina sea adecuada para estudios de más de 72 h, ya que se espera que las concentraciones disminuyan en un >10% con una vida media de 18 días. Hasta donde saben los autores, este es el primer uso de un patrón interno para la validación de jaulas de ultrafiltración y/o tejidos y proporciona información para el uso futuro de patrones internos en estas metodologías de muestreo.
Los valores farmacocinéticos no difirieron en cantidades clínica o estadísticamente relevantes (22) entre el carprofeno crudo y el carprofeno ajustado por las concentraciones de moxidectina. El volumen del compartimento central calculado en este conjunto de datos fue aproximadamente un 50% más pequeño que nuestros cálculos anteriores, el espacio libre se redujo (16). Esto dio como resultado una vida media estimada de 19,5 h en comparación con 27,2 h en el conjunto de datos anterior. Las constantes de velocidad k21 para la distribución en el compartimento periférico fueron mayores, mientras que k13 y k31, que representan el flujo de carprofeno dentro y fuera de las jaulas de tejido, fueron menores. Estas diferencias pueden ser artefactuales de la fase analítica, ya que se requirieron grandes correcciones basadas en las curvas estándar incluidas en las corridas. Además, el presente conjunto de datos solo contiene 2 tamaños de jaulas de tejido, en lugar de los 5 de nuestro trabajo anterior. Las estimaciones de los parámetros farmacocinéticos en el presente estudio permiten realizar comparaciones dentro de este estudio, pero es poco probable que sean tan válidas externamente como en nuestro informe anterior (16) y, por lo tanto, no se confía en ellas; La estimación de los índices farmacocinéticos no fue un objetivo de este estudio.
Existen implicaciones potenciales del uso de la moxidectina como patrón interno in vivo al evaluar la farmacocinética de otros fármacos, como el carprofeno. Las interacciones farmacológicas entre el carprofeno y la moxidectina son posibles en las ovejas, con la posibilidad de que se altere la farmacocinética de uno o ambos fármacos. Sin embargo, no se han podido encontrar informes de interacciones en la literatura para ninguna especie. Es probable que estos dos medicamentos se administren por coincidencia en perros, ya que la moxidectina se usa para la prevención del gusano del corazón y el carprofeno es un antiinflamatorio común en la práctica general. No se encontraron informes de eventos adversos o interacciones. Para validar completamente el uso de la moxidectina como patrón interno in vivo, se podrían realizar estudios cruzados con el fármaco de interés para comprobar las interacciones en el plasma. Del mismo modo, sería valioso evaluar las interacciones ex vivo y analíticas que podrían influir en los resultados derivados de la concentración de la muestra y el fármaco.
El volumen de la muestra de recuperación de ultrafiltrado de las sondas fue muy pobre, con una sola sonda produciendo consistentemente volúmenes de muestra de 100 μL o más. Esto obligó a adaptar la metodología LCMS a pequeños volúmenes y evitó la repetición del análisis de las muestras, ya que no se disponía de muestras adicionales. En el presente estudio, las sondas se introdujeron por vía subcutánea utilizando la metodología previamente descrita el mismo día en que se inició el período de muestreo. Por el contrario, algunas publicaciones anteriores han insertado las sondas 24 h o más antes del muestreo. Nuestra decisión de insertar las sondas el primer día se determinó a partir de necesidades pragmáticas, ya que tanto en las ovejas alojadas en grupo como en las ovejas en corrales individuales, los animales vecinos intentaron masticar el tubo de la sonda. La inserción en el mismo día también tenía como objetivo minimizar el efecto de la obstrucción inflamatoria de las membranas de la sonda descrita anteriormente (6). Los volúmenes de muestra de las sondas no aumentaron sustancialmente durante el período de muestreo de 72 h, lo que sugiere que el momento de la inserción no influyó en la recuperación del volumen de muestra.
A diferencia de lo que hacen otros autores (4), las incisiones punzantes a través de las cuales se introdujeron las sondas no se cerraron en este estudio. Esto puede haber dado lugar a un espacio de aire entre la sonda y los tejidos subcutáneos, que podría mantenerse mediante la entrada continua de aire de la herida. El trabajo futuro puede beneficiarse del sellado de la herida de inserción. Las diferencias entre especies pueden contribuir a la cantidad de ultrafiltrado que se puede obtener. Los primeros trabajos de Janle afirmaban que las sondas subcutáneas producían entre 0,5 y 1 ml de ultrafiltrado al día. Sin embargo, Plummer et al. (23) también reportan bajos volúmenes de muestra (máximo de 1 mL por 4-12 h) de sondas de ultrafiltración en ovejas merinas. Además, Plummer et al. reportan una alta tasa de fracaso y complicaciones de las sondas UF en ovejas, similar a nuestra experiencia en el estudio actual. Experiencias similares han sido reportadas en terneros. Hauschild et al. (24) informaron que las concentraciones del fármaco pradofloxacino en la muestra de ultrafiltrado estaban por debajo del LOD cuando el volumen de la muestra era bajo, los autores infieren que no había suficiente vacío para conducir las moléculas del fármaco a través de la membrana, este fenómeno también se observó en nuestro estudio. Los avances en la tecnología analítica que permiten utilizar muestras más pequeñas pueden superar algunas de estas barreras, pero no superarán la escasa recuperación observada con tasas de flujo bajas, como se describe en Hauschild y en este artículo.
En este trabajo se utilizaron tubos de vacío de 4 mL para aplicar la presión de vacío y recoger la muestra. Esto es similar a lo que hacen otros autores (4, 25), aunque los caudales en esos artículos son bajos. Se esperaría que el uso de tubos de vacío más grandes, es decir, de 10 mL, aplicara una mayor presión de vacío y aumentara el caudal del ultrafiltrado.
Cooke et al. (26) superaron algunas de estas dificultades mediante la utilización de un método híbrido, mediante la implantación de un haz de fibras de microdialaysis (n = 176) por vía subcutánea, con ambos extremos accesibles. Las muestras se obtuvieron lavando el haz de forma intermitente, por lo que pudieron prescindir del sistema de bomba de perfusión de la microdiálisis tradicional y asegurarse de que el volumen de la muestra fuera suficiente para el análisis por HPLC. Se informó que el equilibrio del haz de fibras con el medio ambiente circundante era de 5 min, lo que permitió que se produjera un muestreo farmacocinético denso. A pesar del aparente éxito de esta técnica, no se encontraron otros informes de su uso. Esta técnica puede justificar un uso adicional dadas las dificultades reportadas de la ultrafiltración y las limitaciones de los equipos de microdiálisis.
El uso limitado reportado de sondas de ultrafiltración para estudios farmacológicos fuera de ratas de laboratorio da lugar a la posibilidad de sesgo de publicación, el trabajo de Plummer et al. (23), Bidgood y Papich (1), Messenger et al. (3) y este artículo formaron parte de programas de investigación de posgrado, lo que aumenta la probabilidad de presentación de resultados desfavorables, ya que la publicación es a menudo un requisito previo para la especialidad (27, 28). Es posible que los trabajos financiados comercialmente que utilizan sondas de ultrafiltración y que no produjeron volúmenes suficientes para el análisis no se hayan presentado o aceptado para su publicación (29).
Los hallazgos histopatológicos en la sonda recuperada fueron consistentes con los reportados por Imsilp et al. (6) con inflamación granulomatosa sin evidencia de infección bacteriana. Esto sugiere que las sondas sufrieron de bioincrustación y encapsulación como lo describen Wisniewski et al. (30). Parece haber marcadas diferencias entre especies en la reacción a las sondas de ultrafiltración, con Underwood informando de una inflamación leve en línea con la reacción del material de sutura cuando las sondas de ultrafiltración se insertaron en el tejido lamelar equino (25).
Dadas las concentraciones constantes de moxidectina en el plasma y en el fluido de la jaula tisular, se esperaría que la moxidectina se recuperara en concentraciones de un orden y variabilidad similares a partir de las sondas de ultrafiltración si funcionaran correctamente. El uso de moxidectina como patrón interno in vivo para estudios farmacocinéticos permitiría a los investigadores detectar cambios en la recuperación y corregirlos post-hoc. Esto debería conducir a resultados más fiables y sólidos.
5 Conclusión
Las jaulas de tejido implantadas por vía subcutánea son un modelo más fiable para obtener muestras de compartimentos no centrales que las sondas de ultrafiltración disponibles en el mercado. Desafortunadamente, es menos probable que las muestras derivadas de jaulas de tejido representen verdaderos espacios fisiológicos que las muestras obtenidas por ultrafiltración (16).
Las técnicas de sonda de ultrafiltración reportadas actualmente parecen no ser adecuadas para el muestreo farmacocinético. De acuerdo con trabajos previos, encontramos que el método requerirá modificaciones o refinamientos si se quiere dar muestras consistentes. No se han identificado modificaciones ni mejoras efectivas.
No pudimos aceptar o rechazar nuestra primera hipótesis, ya que pudimos generar suficientes datos simultáneos de las dos metodologías para la comparación.
Este trabajo demostró que la moxidectina es útil como estándar interno in vivo para estudios farmacocinéticos. En ovejas, una dosis única demostró ser útil durante aproximadamente 3 días cuando se inyectó por vía subcutánea 2 semanas antes del inicio del estudio. Las muestras de las jaulas de tejido y los estudios de sondas de ultrafiltración ilustraron esta utilidad. Por lo tanto, podemos aceptar parcialmente la segunda hipótesis, no observamos cambios en la concentración de moxidectina de magnitud suficiente para evaluar la segunda parte de la hipótesis.
Los trabajos adicionales para caracterizar la moxidectina como un patrón interno in vivo en muestras de ultrafiltrado deben esperar al descubrimiento de modificaciones y refinamientos efectivos en las técnicas de muestras de ultrafiltración que permitan la adquisición confiable de muestras.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
El estudio en animales fue aprobado por el Comité de Ética Animal de la Facultad de Ciencias Veterinarias y Agrícolas de la Universidad de Melbourne. El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
RM: Curación de datos, Análisis formal, Investigación, Metodología, Administración de proyectos, Redacción – borrador original, Redacción – revisión y edición. TW: Conceptualización, Investigación, Metodología, Administración de Proyectos, Recursos, Supervisión, Redacción – Revisión y Edición.
Financiación
El/los autor/es declaran/n que no se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo.
Reconocimientos
Los autores desean agradecer a Yuchi Chen y Richard Ploeg por los informes histopatológicos. La asistencia técnica de Jess Leung, Sebastien Bauquier, Andrew Woodward, Thierry Beths, Jamie Wearn, Dianne Rees y Babak Jillian.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
El/los autor/es declararon, en el momento de la presentación, ser miembro del consejo editorial de Frontiers. Esto no tuvo ningún impacto en el proceso de revisión por pares ni en la decisión final.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2024.1332974/full#supplementary-material
Referencias
1. Bidgood, T, y Papich, MG. Farmacocinética plasmática y concentraciones de meropenem en los fluidos tisulares después de la administración intravenosa y subcutánea en perros. Am J Vet Res. (2002) 63:1622–8. doi: 10.2460/ajvr.2002.63.1622
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Linhares, MC, y Kissinger, PT. Ultrafiltración capilar: sondas de muestreo in vivo para moléculas pequeñas. Química anal. (1992) 64:2831–5. doi: 10.1021/ac00046a029
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Messenger, K, Wofford, J y Papich, M. Farmacocinética del carprofeno en plasma y en fluido tisular canino de control e inflamado mediante ultrafiltración in vivo. J Vet Pharmacol Ther. (2016) 39:32–9. doi: 10.1111/jvp.12233
4. Janle-Swain, E, Van Vleet, JF y Ash, SR. Uso de un colector de filtrado capilar para monitorear la glucosa en diabéticos. ASAIO J. (1987) 33:336–40.
5. Garrison, KE, Pasas, SA, Cooper, JD y Davies, MI. Una revisión del muestreo de membranas de tejidos biológicos con aplicaciones en farmacocinética, metabolismo y farmacodinamia. Eur J Pharm Sci. (2002) 17:1–12. doi: 10.1016/S0928-0987(02)00149-5
6. Imsilp, K, Whittem, T, Koritz, GD, Zachary, JF y Schaeffer, DJ. Respuesta inflamatoria a la implantación intramuscular de sondas de ultrafiltración de poliacrilonitrilo en ovejas. Res. Veterinaria. (2000) 31:623–34. doi: 10.1051/vetres:2000145
7. Bungay, PM, Newton-Vinson, P, Isele, W, Garris, PA, y Justice, JB Jr. Microdiálisis de dopamina interpretada con modelo cuantitativo que incorpora trauma de implantación de sonda. J Neuroquímica. (2003) 86:932–46. doi: 10.1046/j.1471-4159.2003.01904.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Linhares, MC, y Kissinger, PT. Monitorización farmacocinética en tejido subcutáneo mediante sondas de ultrafiltración capilar in vivo. Pharm Res. (1993) 10:598–602. doi: 10.1023/A:1018914522749
9. de Lange, EC. Técnicas de recuperación y calibración: hacia la microdiálisis cuantitativa En: Müller M Microdiálisis en el desarrollo de fármacos. Nueva York: Springer (2012). 13–33.
10. MacLean, DA, Ettinger, SM, Sinoway, LI y Lanoue, KF. Determinación del flujo de glucosa específico del músculo mediante estereoisómeros radiactivos y microdiálisis. Am J Physiol Endocrinol Metab. (2001) 280:E187-92. doi: 10.1152/ajpendo.2001.280.1.E187
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Pérez, R, Núñez, MJ, Palma, C, Riquelme, J, y Arboix, M. Cinética de disposición plasmática de moxidectina después de la administración subcutánea a ovejas preñadas. J Vet Pharmacol Ther. (2014) 37:550–5. doi: 10.1111/jvp.12127
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Mealey, KL. ABCB1 canino y lactonas macrocíclicas: prevención y farmacogenética del gusano del corazón. Parasitol veterinario. (2008) 158:215–22. doi: 10.1016/j.vetpar.2008.09.009
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Brentnall, C, Cheng, Z, Mckellar, QA y Lees, P. Influencia de la oxitetraciclina en la farmacodinámica y farmacocinética del carprofeno en terneros. J Vet Pharmacol Ther. (2013) 36:320–8. doi: 10.1111/jvp.12000
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Cheng, Z, Nolan, A y McKellar, Q. Efectos antiinflamatorios del carprofeno, los enantiómeros de carprofeno y el éster metílico de NG-nitro-L-arginina en ovejas. Am J Vet Res. (2002) 63:782–8. doi: 10.2460/ajvr.2002.63.782
15. Lees, P, Delatour, P, Benoit, E y Foster, AP. Farmacocinética de los enantiómeros de carprofeno en el caballo. Acta Vet Scand Suppl. (1991) 87:249–51.
16. Munn, R, Whittem, T, y Woodward, AP. La relación superficie/volumen cambia los parámetros farmacocinéticos y farmacodinámicos en el modelo de jaula de tejido subcutáneo: como lo ilustra el carprofeno en ovejas. Front Vet Sci. (2022) 9:801. doi: 10.3389/fvets.2022.905797
17. Welsh, EM, Baxter, P, y Nolan, AM. Farmacocinética del carprofeno administrado por vía intravenosa a ovejas. Res Vet Sci. (1992) 53:264–6. doi: 10.1016/0034-5288(92)90123-J
18. Munn, R, Woodward, A, Beths, T, y Whittem, T. Observaciones sobre el uso de un dispositivo anestésico para el muestreo percutáneo repetitivo en ovejas. Aust Vet J. (2021) 99:445–8. doi: 10.1111/avj.13104
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Shuttleworth, JR, Behrens, KN, Biggo, MR, Horne, RL, Cox, S, Lakritz, J, et al. Efecto de la duración del almacenamiento en las mediciones de concentración de carprofeno en plasma canino. Vet Med Sci. (2023) 9:2022–5. doi: 10.1002/vms3.1215
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Chhonker, YS, Sleightholm, RL y Murry, DJ. Desarrollo de métodos bioanalíticos y validación de moxidectina en plasma mediante LC–MS/MS: aplicación al metabolismo in vitro. Cromatografía Biomédica. (2019) 33:e4389. doi: 10.1002/bmc.4389
21. Lavielle, M., Rsmlx: R habla ‘Monolix’. Repositorio CRAN. Eds. Mihaljevic F, Lavielle M, Chauvin J., Pinaud C. (2022). Disponible en: https://monolix.lixoft.com/rsmlx/
22. Cumming, G, y Finch, S. Inferencia a ojo: intervalos de confianza y cómo leer imágenes de datos. Am Psychol. (2005) 60:170–80. doi: 10.1037/0003-066X.60.2.170
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. Plummer, C, White, PJ, Kimble, B, Govendir, M y van der Saag, D. Investigación preliminar sobre una nueva formulación de liberación sostenida de meloxicam en ovejas (Ovis aries): perfil farmacocinético. Animales. (2021) 11:2484. doi: 10.3390/ani11092484
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Hauschild, G, Rohn, K, Engelhardt, E, Sager, M, Hardes, J y Gosheger, G. Estudio farmacocinético sobre pradofloxacina en el perro: comparación del análisis de suero, la ultrafiltración y la toma de muestras de tejido después de la administración oral. BMC Vet Res. (2013) 9:32. doi: 10.1186/1746-6148-9-32
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Underwood, C, Collins, SN, van Eps, AW, Allavena, RE, Medina-Torres, CE, y Pollitt, CC. Ultrafiltración de tejido laminar digital equino. Veterinario J. (2014) 202:314–22. doi: 10.1016/j.tvjl.2014.05.007
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Cooke, I, Bevill, R y Koritz, G. Farmacocinética de la penicilina G en plasma y líquido intersticial recolectado con haces de fibras de diálisis en ovejas. Res. Veterinaria. (1996) 27:147–59.
27. Wood, W, McCollum, J, Kukreja, P, Vetter, IL, Morgan, CJ, Hossein Zadeh Maleki, A, et al. Iniciativas de actividades académicas de educación médica de posgrado: una revisión sistemática y metaanálisis. BMC Med Educ. (2018) 18:318. doi: 10.1186/s12909-018-1407-8
Resumen de PubMed | Texto completo de Crossref | Google Académico
28. Manual de candidatos a becas del Colegio de Científicos Veterinarios de Australia y Nueva Zelanda. (2023). Disponible en: https://ripehosting.blob.core.windows.net/anzcvs-dev-media/42753/20230724-fellowship-candidate-handbook-2023-finalised1.pdf
29. Thornton, A, y Lee, P. Sesgo de publicación en el metaanálisis: sus causas y consecuencias. J Clin Epidemiol. (2000) 53:207–16. doi: 10.1016/S0895-4356(99)00161-4
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Wisniewski, N, Klitzman, B, Miller, B y Reichert, WM. Disminución del transporte de analitos a través de membranas implantadas: diferenciación de la bioincrustación de los efectos tisulares. J Biomed Mater Res. (2001) 57:513–21. doi: 10.1002/1097-4636(20011215)57:4<513::AID-JBM1197>3.0.CO; 2-E
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: ultrafiltración, patrón interno, farmacocinética, moxidectina, carprofeno, ovino
Cita: Munn R y Whittem T (2024) La moxidectina es candidata para su uso como estándar interno in vivo en estudios farmacocinéticos, como se ha demostrado con su uso en la recolección simultánea de fluidos en jaulas de tejidos y ultrafiltración. Frente. Vet. Sci. 11:1332974. doi: 10.3389/fvets.2024.1332974
Recibido: 04 de noviembre de 2023; Aceptado: 04 de enero de 2024;
Publicado: 16 enero 2024.
Editado por:
Arturo Anadón, Universidad Complutense de Madrid, España
Revisado por:
Raquel Díez Laiz, Universidad de León, España
Muammer Elmas, Universidad Selcuk, Türkiye
Derechos de autor © 2024 Munn y Whittem. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY). S
*Correspondencia: Richard Munn, rmunn@anexa.co.nz
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía