Farmacocinética de levobupivacaína al 0,5% después de bloqueo infraorbitario o alveolar inferior en perros anestesiados
 Farmacocinética de levobupivacaína al 0,5% después de bloqueo infraorbitario o alveolar inferior en perros anestesiados
Farmacocinética de levobupivacaína al 0,5% después de bloqueo infraorbitario o alveolar inferior en perros anestesiados
 Matic Pavlica1
Matic Pavlica1  Mojca Kržan2
Mojca Kržan2  Ana emec1
Ana emec1  Tina Kosjek3,4
Tina Kosjek3,4  Anže Baš5
Anže Baš5  Alenka Seliškar1*
Alenka Seliškar1*- 1Clínica de Pequeños Animales, Facultad de Veterinaria, Universidad de Liubliana, Liubliana, Eslovenia
- 2Departamento de Farmacología y Toxicología Experimental, Facultad de Medicina, Universidad de Liubliana, Liubliana, Eslovenia
- 3Departamento de Ciencias Ambientales, Instituto Jožef Stefan, Liubliana, Eslovenia
- 4Escuela Internacional de Postgrado Jožef Stefan, Liubliana, Eslovenia
- 5Facultad de Educación, Universidad de Liubliana, Liubliana, Eslovenia
Introducción: Faltan datos sobre el perfil farmacocinético y la seguridad de la levobupivacaína (LB) utilizada para la anestesia regional del maxilar y las mandíbulas en perros.
Métodos: Se administró bloqueo infraorbitario (n = 10), bloqueo alveolar inferior (n = 10) o bloqueos infraorbitario y alveolar inferior (n = 10) a los perros sometidos a cirugía dental bajo anestesia con isoflurano. La dosis de LB se calculó como 0,11 ml/kg2/3 para el bloque infraorbitario y 0,18 ml/kg2/3 para el bloqueo alveolar inferior. Se recogieron muestras de sangre antes e inmediatamente después de la administración de los bloqueos orales, y 3, 4, 7, 12, 17, 32, 47, 62, 92 y 122 min después. La cuantificación de LB en plasma se realizó mediante LC-MS/MS.
Resultados y discusión: Los resultados se presentan como mediana y rango intercuartílico. En perros en los que los cuatro cuadrantes de la cavidad oral estaban desensibilizados con LB, la C.max fue de 1.335 (1.030-1.929) ng/ml, la T.max fue de 7 (4–9,5) min, y el AUC(0 → 120) fue de 57.976 (44.954-96.224) ng min/ml. Las concentraciones plasmáticas de LB fueron varias veces más bajas que las concentraciones tóxicas informadas, y no se observaron signos de depresión cardiovascular o neurotoxicidad en ninguno de los perros, lo que sugiere que la ocurrencia de efectos adversos graves después de la administración de LB en las dosis utilizadas en este estudio es poco probable.
Introducción
La bupivacaína es un anestésico local de acción prolongada (LA); El inicio de la acción es de 5 a 10 minutos después de la administración, y la duración del bloqueo sensorial es de 2 a 10 h (1). La levobupivacaína (LB) es el isómero L activo de la bupivacaína y tiene efectos similares a los de la bupivacaína racémica, pero es menos cardiotóxica (2). En los seres humanos, más del 97% de la LB se une a las proteínas plasmáticas (albúmina y α1-glicoproteína), y entre el 95% y el 99% se metaboliza por biotransformación hepática. La mayor parte del LB se excreta como metabolitos inactivos en la orina (71%) y las heces (24%) (3).
En el único estudio que describe la farmacocinética de LB para la desensibilización de la cavidad oral en humanos, se administró un 0,5% de LB cerca de los terceros molares maxilares y mandibulares en una dosis total de 6,6 ml, equivalente a ~0,5 mg/kg. La concentración plasmática máxima (C.max) fue de 578 ± 101 ng/ml, el tiempo para alcanzar la concentración plasmática máxima (T.max) fue de 21 ± 3 min, el aclaramiento (Cl) fue de 465 ± 178 ml/min y el área bajo la curva (AUC) fue de 1.371 ± 442 ng h/ml (4).
La toxicidad sistémica de los AL se produce con una sobredosis o con la administración accidental por vía intravenosa (IV). Los signos de intoxicación por el sistema nervioso central (SNC) suelen preceder a la aparición de toxicidad por el sistema cardiovascular (CVS) en animales despiertos y son difíciles de detectar durante la anestesia (5). En ratas anestesiadas con isoflurano en oxígeno, las concentraciones plasmáticas de LB al inicio de la actividad convulsiva, al principio de la arritmia y a la asistolia fueron de 10,0 ± 1,1, 21,2 ± 1,8 y 36,2 ± 6,5 μg/ml, respectivamente (6). En ovejas conscientes a las que se les administró LB IV durante 3 min, la concentración arterial de LB en sangre al inicio del comportamiento convulsivo fue de 16,3 ± 4,0 μg/ml (7). En perros anestesiados, la dosis acumulada que indujo el colapso de CVS fue de 27,3 ± 2,0 mg/kg, y la concentración plasmática fue de 22,7 μg/ml. El régimen de dosificación de LB se basó en la tasa de aclaramiento asumida por el fabricante (0,9 L/h/kg). Se asumió que después de la infusión inicial de 12 minutos se alcanzaría el 88% de la concentración plasmática deseada, y que después de la infusión de mantenimiento de 12 minutos se alcanzaría el 92% de la concentración objetivo deseada (8).
La levobupivacaína se usa en perros fuera de etiqueta, y aún no se han publicado datos sobre la farmacocinética de LB utilizada para desensibilizar la cavidad oral en perros. Aunque no se han publicado estudios similares en perros, se ha examinado la farmacocinética de la bupivacaína siguiendo otros bloqueos locales en perros y gatos (9-13). Debido a que las dosis tóxicas notificadas son todas después de la administración intravenosa de LB (6-8), no se esperaría que las concentraciones plasmáticas de LB fueran tan altas después de la administración perineural. Este estudio tuvo como objetivo obtener una visión detallada de la farmacocinética de LB utilizada para la anestesia regional del maxilar y las mandíbulas en perros. Investigamos el perfil farmacocinético y la posible aparición de efectos adversos de LB, cuando se administra para desensibilizar uno o los cuatro cuadrantes de la cavidad oral a dosis descritas por Pascoe (1), y si la tasa de absorción de LB difiere con respecto al sitio de aplicación (canal infraorbitario o depósito submucoso cerca del nervio alveolar inferior).
Materiales y métodos
Animales
El protocolo del estudio fue revisado y aprobado por el Comité Institucional de Ética para el Bienestar Animal de la Facultad de Veterinaria de la Universidad de Liubliana (n.º 8-10-2020/7, fecha de aprobación 7.1.2021), y se obtuvo el consentimiento formal por escrito de los propietarios de los perros antes de su inclusión en el estudio. Treinta perros programados para diferentes procedimientos dentales fueron incluidos en el estudio. Solo se incluyeron en el estudio perros sin antecedentes de enfermedad endocrinológica, renal o hepática y sin tratamiento continuo con inhibidores de la enzima convertidora de angiotensina, corticosteroides o antiinflamatorios no esteroideos. Los criterios de exclusión también incluyeron razas de perros braquicéfalos y perros con un peso corporal de <10 kg. Todos los perros recibieron un examen oral completo con gráficos de boca completa y radiografías dentales, seguido de una terapia periodontal básica realizada con un raspador sónico y otros procedimientos dentales según lo indicado clínicamente (extracciones dentales individuales o múltiples, procedimiento de endodoncia, gingivectomía, colocación de plano inclinado y pulpectomía coronal parcial).
Solo los perros que estaban en estado físico I o II según la evaluación de la Sociedad Americana de Anestesiólogos se consideraron elegibles. Se realizó examen físico preanestésico y análisis hematológicos y bioquímicos séricos en todos los perros y todos los parámetros sanguíneos estaban dentro de los límites normales.
Los perros fueron asignados en grupos de acuerdo a si requerían un procedimiento dental en un cuadrante (bloqueo infraorbitario izquierdo o derecho, n = 10, o bloqueo alveolar inferior izquierdo o derecho, n = 10) o en los cuatro cuadrantes (ambos bloqueos infraorbitarios y ambos bloqueos alveolares inferiores , n = 10) de la cavidad oral. Se administró levobupivacaína al 0,5% como parte del protocolo anestésico estándar en uno o ambos canales infraorbitarios y/o en la submucosa cerca del agujero mandibular en una o ambas mandíbulas. La dosis de LB se calculó como 0,11 ml/kg2/3 para el bloque infraorbitario y 0,18 ml/kg2/3 para el bloqueo alveolar inferior (1).
Protocolo de estudio
La comida se retuvo durante no más de 12 horas antes de la anestesia, y se permitió el agua ad libitum hasta el procedimiento. En primer lugar, se colocó un catéter de calibre 20 en la vena cefálica para administrar los fármacos y los líquidos. Los perros fueron premedicados con metadona 0,2 mg/kg IV y 5 min después se indujo anestesia con propofol titulado hasta lograr la intubación endotraqueal. La anestesia se mantuvo con isoflurano en oxígeno y se permitió que los perros respiraran espontáneamente. Se colocaron en decúbito dorsal sobre una mesa dental cubierta con almohadillas blandas. Si la temperatura rectal disminuía por debajo de 37 °C, se aplicaba calentamiento por aire forzado (Bair Hugger, 3M, EE. UU.). La presión arterial sistólica se midió de forma no invasiva con un monitor de flujo Doppler ultrasónico (Modelo 811, Parks Medical Electronics, EE. UU.). Frecuencia cardíaca, frecuencia respiratoria, concentración de isoflurano al final de la espiración, CO al final de la espiración2 La tensión y el ECG (derivación II) se monitorizaron de forma continua con un monitor multiparamétrico (B105 Patient Monitor, GE Medical Systems Information Technologies Inc, EE. UU.). La temperatura corporal se midió cada 15 min con un termómetro rectal.
Se colocó un catéter de calibre 22 en la arteria pedal dorsal para recolectar muestras de sangre para análisis farmacocinéticos de LB. Se realizaron bloqueos orales después de la colocación del catéter arterial. El bloqueo infraorbitario se realizó por vía intraoral con una aguja fina de calibre 27 de 42 mm (Sulzer Mixpac GmbH, Alemania). La longitud del canal infraorbitario se estimó midiendo la distancia desde la raíz distal del tercer premolar ipsilateral, donde se palpaba el foramen infraorbitario hasta la unión del hueso cigomático con el maxilar. La aguja se insertó en el canal infraorbitario hasta la longitud que correspondía a la longitud estimada del canal infraorbitario, como se describió anteriormente (1), para evitar el riesgo de lesión ocular (14). El bloqueo alveolar inferior se realizó con técnica extraoral, también con aguja fina de calibre 27 de 42 mm. En primer lugar, se palpó el agujero mandibular con una mano dentro de la cavidad bucal en la cara medial de la mandíbula, caudal y ventral al último molar ipsilateral. Con la otra mano, la aguja se avanzaba verticalmente sobre la superficie más ventral de la mandíbula y se guiaba medialmente lo más cerca posible del hueso hacia el foramen. Con ambas técnicas, el bisel de la aguja siempre se orientaba en la misma dirección que las fibras nerviosas, y siempre se aplicaba aspiración antes de la inyección de LB. Todos los bloqueos se realizaron con un abordaje aséptico y por el mismo dentista (AN).
Para la analgesia de rescate durante la anestesia (si la frecuencia cardíaca, la frecuencia respiratoria o la presión arterial sistólica aumentaban en más del 30% de los valores basales), se utilizó fentanilo 2 μg/kg IV. Se administró propofol 0,5-1 mg/kg IV y la concentración inspirada de isoflurano se ajustó en un 0,1% cuando se observó un reflejo palpebral positivo. Se administró carprofeno 4 mg/kg por vía intravenosa cuando se midió por primera vez la presión arterial sistólica por encima de 80 mmHg. Durante el procedimiento, la solución de lactato de Ringer se infundió con una bomba de infusión (Infusion Pump SK-600I Vet, Shenzhen Mindray Scientific Co. LTD, China) a razón de 5 ml/kg/h. Después del procedimiento, los líquidos se administraron a una velocidad de 2-6 ml/kg/h hasta el alta. Se administró buprenorfina 0,02 mg/kg IV en dosis única 4 h después de la premedicación con metadona o se repitió metadona 0,2 mg/kg IV cada 4 h hasta el alta. A los perros se les prescribió carprofeno peroral 2 mg/kg/12 h durante 2-7 días, y si se requería más analgesia, se les aplicó un parche transdérmico de fentanilo 4 μg/kg/h al final del procedimiento.
Toma de muestras de sangre
Se recolectó sangre (4 ml) del catéter arterial en tubos que contenían heparinato de litio antes de la administración de bloqueos orales (valores basales), inmediatamente después de la administración de bloqueos orales y 3, 4, 7, 12, 17, 32, 47, 62, 92 y 122 min después. Para cada recolección, se descartó 1 ml de sangre del catéter, se recolectó la muestra y luego se enjuagó el catéter con 4 ml de NaCl al 0,9%. Las muestras de sangre se centrifugaron inmediatamente después de la recolección a 1.500 g durante 15 min a temperatura ambiente. Las muestras de plasma se separaron en alícuotas y se almacenaron a -80 °C hasta su análisis.
Análisis de laboratorio
Las muestras de plasma se prepararon para su análisis mediante una placa Ostro de 96 pocillos (Waters Corp., Milford, MA, EE. UU.) para la precipitación de proteínas y la eliminación de fosfolípidos. Se añadieron cuatro microlitros del patrón interno bupivacaína-d9 (Bupivacaína-d9 HCl, LGC/Toronto Research Chemicals, Canadá) a una concentración de 2,5 μg/ml a la muestra de plasma de 50 μl y se diluyó con ácido fórmico al 0,1% hasta el volumen de 150 μL. Esta mezcla se transfirió a un pocillo de 2 ml de la placa de pocillos Ostro™ antes de la adición de 450 μl de ácido fórmico al 0,1% en acetonitrilo. A continuación, las muestras se aspiraron tres veces con una pipeta multicanal y se colocaron en un procesador de presión positiva (Waters Corp.) ajustando el flujo a 60 psi durante 5 min. El eluido se secó bajo una suave corriente de nitrógeno y luego se reconstituyó en 1 ml de mezcla de acetonitrilo/ácido fórmico al 0,1% (3/7). Finalmente, la muestra se filtró a través de un filtro de jeringa de 0,2 μm con una membrana de celulosa regenerada (Phenomenex, Torrance, CA, USA) y se analizó mediante cromatografía líquida acoplada a espectrometría de masas en tándem (LC-MS/MS).
El análisis LC-MS/MS se realizó utilizando un LC de ultra alto rendimiento Nexera (Shimadzu Corp., Japón) acoplado a un sistema QTRAP 4500 MS/MS (AB Sciex, Alemania). La separación se logró a temperatura ambiente utilizando una columna Ascentis Express C18 (Supelco, Bellefonte, PA, EE. UU.) de 5 cm con un tamaño de partícula de 2 μm y un diámetro interno de 2,1 mm. Las fases móviles fueron acetonitrilo (A) y ácido fórmico (B) al 0,1%. El caudal fue de 0,3 ml/min y el volumen de inyección fue de 1 μl. El gradiente comenzó en 70% B y se redujo a 0% B en 3 min, y luego se mantuvo durante los siguientes 0,5 min. Finalmente, el gradiente se incrementó de nuevo al 70% B y se mantuvo durante 1,5 minutos para permitir que la columna se equilibrara. El espectrómetro de masas funcionó bajo ionización positiva por electrospray a una temperatura de fuente de 600 °C y en modo de adquisición de monitoreo de reacciones múltiples. El software de la estación de datos fue Analyst v1.6.3. Para LB, se monitorearon las transiciones 289 > 140, 289 > 98 y 289 > 112, y se utilizó la primera como transición cuantificadora. Para la norma interna LB-d9, se utilizaron las transiciones 298 > 149 y 198 > 101 para controlar el tiempo de retención y la calidad del proceso.
El límite de cuantificación (LOQ) del método fue de 16 ng/ml y el límite de detección (LOD) fue de 6,0 ng/ml. El rango de calibración fue de LOQ a 4,0 μg/ml, con un cociente de regresión lineal >0,999. La calidad de la preparación y el análisis de las muestras se monitoreó a través de blancos de solventes, blancos de proceso y muestras de control de calidad preparadas mediante la adición de analito al plasma en blanco con analito y patrón interno a nivel de LOQ. La precisión determinada para las muestras de control de calidad fue del ±15% y la precisión del 7,3%. La validación del método y todos los procedimientos de control de calidad se realizaron de acuerdo con las directrices de la FDA para la validación de métodos bioanalíticos (https://www.fda.gov/files/drugs/published/Bioanalytical-Method-Validation-Guidance-for-Industry.pdf).
Análisis farmacocinético
Los parámetros farmacocinéticos se calcularon utilizando el software Graph Pad Prism versión 9.4.1. El C.max y T.max se determinaron directamente a partir de los datos brutos de las mediciones individuales de las concentraciones de LB de las muestras de sangre de 30 animales. El área bajo la curva se calculó como AUC(0 → 120) desde el tiempo 0 hasta el último punto de datos cuantificable a los 120 min utilizando un método trapezoidal lineal. Los datos se presentan como mediana y rango intercuartílico.
Análisis estadístico
La normalidad de distribución de los datos farmacocinéticos se analizó mediante la prueba de Shapiro-Wilk. Dada la mezcla de datos distribuidos normalmente y no normalmente, los valores se expresan como mediana y rango intercuartílico. Para eliminar variables extrañas como la proporción de sexos, el peso y la edad como posibles variables de confusión, se realizó la prueba de Kruskall-Wallis y la prueba exacta de Fisher. Las diferencias en los parámetros farmacocinéticos entre los grupos se analizaron mediante la prueba de Kruskal-Wallis con el análisis de comparación múltiple post-hoc de Dunn. El análisis estadístico se realizó con Jamovi 2.0.0.0 (The Jamovi Project 2021, Australia) y el software Graph Pad Prism versión 9.4.1. La significación estadística se fijó en p < 0,05.
Resultados
La edad media de los perros de este estudio fue de 72 (DE = 43) meses y pesaron 25,2 (DE = 7,8) kg de media. No hubo diferencias significativas entre los grupos en cuanto al peso H(2) = 0,194, p = 0,91 y edad H(2) = 1,312, p = 0,52. Las diferencias en la proporción de sexos entre los grupos tampoco fueron significativas (p = 0,26, prueba exacta de Fisher).
Ninguno de los perros de este estudio requirió analgesia de rescate con fentanilo durante la anestesia. Seis perros en el grupo LB IO, siete perros en el grupo LB IA y seis perros en el grupo LB ALL recibieron un bolo de propofol y/o se aumentó la concentración de isoflurano para profundizar la anestesia en respuesta al regreso de un reflejo palpebral que ocurría cuando había poca o ninguna estimulación. También se administró propofol y la concentración de isoflurano aumentó cuando se observó un reflejo palpebral positivo debido a un estímulo nocivo que provocó un aumento de la frecuencia cardíaca, respiratoria o presión arterial sistólica del <30% de los valores basales.
El volumen de sangre recolectada para el análisis farmacocinético (4 ml × 12 = 48 ml) más el volumen de sangre descartada (1 ml × 12 = 12 ml) totalizó 60 ml. En el perro más pequeño, que pesaba 11,2 kg, 60 ml de sangre representaron ~6,0% del volumen total de sangre. La pérdida de sangre debida al procedimiento dental se estimó por el número de hisopos empapados de sangre, donde un hisopo completamente empapado equivalía a 10 ml de sangre. La pérdida de sangre debido al procedimiento dental no superó el 3% del volumen total de sangre en ninguno de los perros. El volumen de células empaquetadas se comprobó en todos los perros antes y después del procedimiento, y los valores estuvieron siempre dentro del rango de referencia.
No se observaron efectos adversos clínicamente evidentes de los bloqueos en ningún perro después del procedimiento.
Análisis farmacocinético
El C calculado.max, T.max y AUC(0 → 120) se presentan en la Tabla 1. Las concentraciones plasmáticas máximas se determinaron en muestras tomadas entre 3 y 12 min (rango 9 min LB IO) o 3 y 17 min (rango 14 min LB IA y LB ALL). La T.max fue el más corto en el grupo LB IA, seguido por los grupos LB IO y LB ALL. No hay diferencias significativas en T.max se observó entre los grupos. El C.max fue el más alto en el grupo LB LLA, seguido por los grupos LB IA y LB IO. La diferencia entre LB ALL y los otros dos grupos fue significativa. Lo mismo se observó con las AUC. El perfil de concentración vs. tiempo de LB se presenta en la Figura 1.
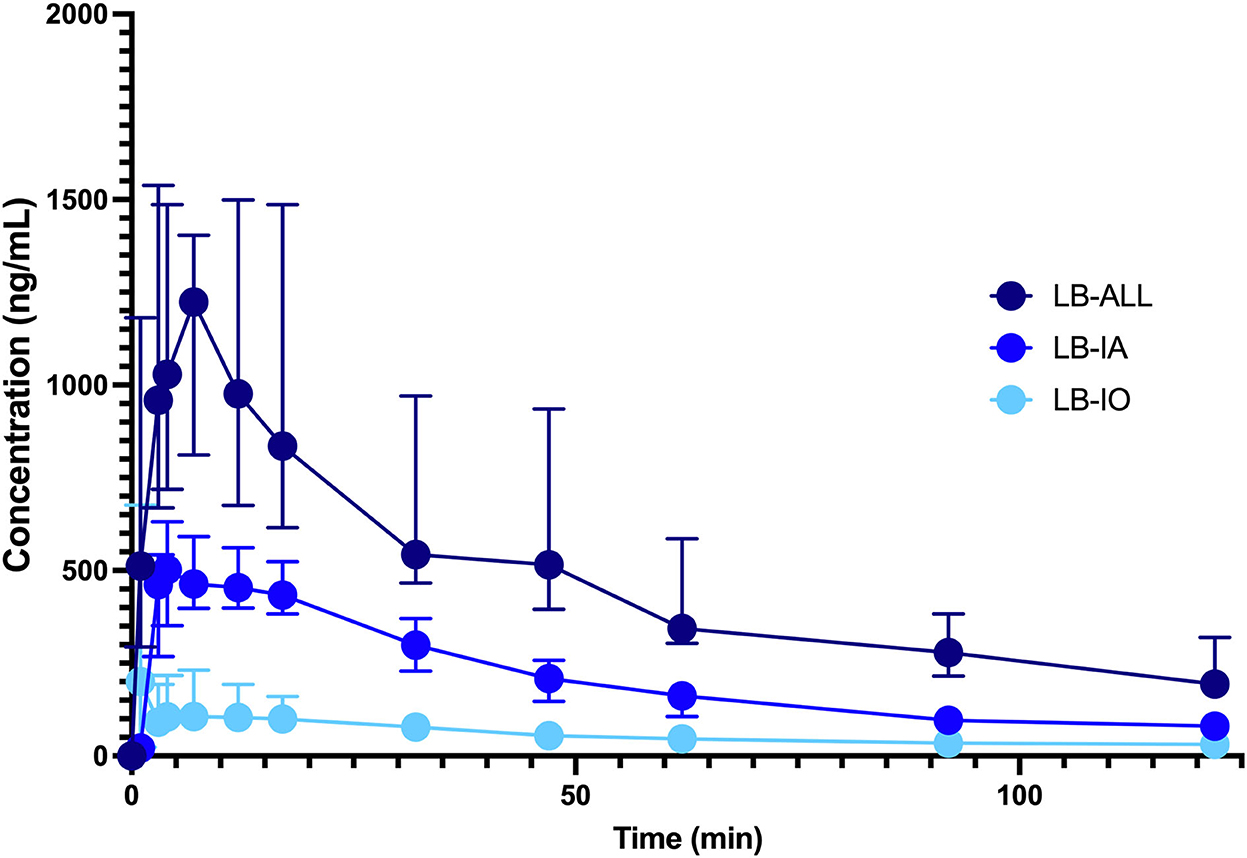 Figura 1. Perfil de concentración vs. tiempo de LB 0,5% inyectado perineuralmente como un solo bloque infraorbitario (, n = 10, LB IO) o un solo bloque alveolar inferior (, n = 10, grupo LB IA) o ambos bloqueos infraorbitarios y alveolares inferiores (
Figura 1. Perfil de concentración vs. tiempo de LB 0,5% inyectado perineuralmente como un solo bloque infraorbitario (, n = 10, LB IO) o un solo bloque alveolar inferior (, n = 10, grupo LB IA) o ambos bloqueos infraorbitarios y alveolares inferiores (

 , n = 10, LB grupo LLA). Los perros fueron premedicados con metadona por vía intravenosa, y la anestesia fue inducida con propofol y mantenida con isoflurano en oxígeno. La dosis de LB se calculó como 0,11 ml/kg2/3 para el bloque infraorbitario y 0,18 ml/kg2/3 para el bloque IA. Los datos se presentan como mediana con rango intercuartílico.
, n = 10, LB grupo LLA). Los perros fueron premedicados con metadona por vía intravenosa, y la anestesia fue inducida con propofol y mantenida con isoflurano en oxígeno. La dosis de LB se calculó como 0,11 ml/kg2/3 para el bloque infraorbitario y 0,18 ml/kg2/3 para el bloque IA. Los datos se presentan como mediana con rango intercuartílico.
Discusión
Este estudio confirmó que las concentraciones plasmáticas de LB a las dosis descritas por Pascoe (1) son varias veces inferiores a las concentraciones tóxicas notificadas y que los efectos adversos graves de LB en términos de toxicidad en el SNC y CVS son altamente improbables cuando se utilizan para la anestesia regional de la cavidad oral en perros anestesiados con isoflurano. La tasa de absorción de LB no difirió con respecto al sitio de aplicación (canal infraorbitario o depósito submucoso cerca del nervio alveolar inferior).
Se estudiaron la dosis acumulada y las concentraciones plasmáticas de LB al inicio de la toxicidad en el SNC o CVS en ratas, ovejas y perros (6-8). La mediana de las concentraciones plasmáticas totales y libres requeridas para producir el colapso cardíaco y la mediana de la dosis acumulada para el colapso en los perros anestesiados a los que se les administró LB IV fueron de 22.700 ng/ml, 9.400 ng/ml y 27,3 ± 2,0 mg/kg, respectivamente (8). El C.max en el grupo LB ALL de nuestro estudio fue de 1.213 ± 69,8 ng/ml, que es aproximadamente 19 veces inferior a la concentración plasmática al inicio de la toxicidad por CVS en perros anestesiados a los que se les administró LB por vía intravenosa (8), lo que indica que la aparición de efectos adversos graves es poco probable cuando se utiliza para la anestesia regional de la cavidad oral en perros anestesiados a una dosis acumulada de hasta 2 mg/kg.
En nuestro estudio, las diferencias esperadas en C.max y AUC(0 → 120) se observaron entre los perros a los que se les administró LB para desensibilizar todos los cuadrantes (LB ALL) y los perros a los que se les administró LB para desensibilizar solo un cuadrante (LB IO y LB IA). El C.max y el AUC fueron consistentes con la dosis administrada, pero no directamente proporcionales a la dosis. Esta observación puede deberse a la diferente vía de administración de LB asociada a posibles diferencias en la vascularización tisular del canal infraorbitario y de la submucosa cercana al nervio alveolar inferior. Las diferentes propiedades vasoactivas de LB, que conducen a la vasodilatación a concentraciones más altas y a la vasoconstricción a concentraciones más bajas, también pueden contribuir a las diferencias observadas (15).
La administración de LB en el canal infraorbitario no dio lugar a una T más corta.max en comparación con la administración en la submucosa cerca del agujero mandibular. Los datos del grupo LB IO no se distribuyeron normalmente, mientras que los datos del grupo LB IA sí se distribuyeron normalmente, lo que dificultó la comparación entre los grupos. Sospechamos que las diferencias interindividuales en la anchura del canal infraorbitario y la presión en el mismo después de la administración de LB pueden haber contribuido a la distribución no normal de los datos en el grupo LB IO.
Los perros de nuestro estudio fueron anestesiados con isoflurano; por lo tanto, la farmacocinética de LB puede diferir de la de los animales conscientes. Por ejemplo, a las ovejas anestesiadas con halotano se les administró 125 mg LB IV durante 3 min, y la concentración sanguínea de LB fue el doble que la de las ovejas conscientes. La T.max también fue más largo en las ovejas anestesiadas (16). Del mismo modo, las concentraciones plasmáticas de lidocaína administrada 2 mg/kg IV difirieron significativamente entre los gatos conscientes y los anestesiados con isoflurano, como lo demuestran los valores más de dos veces más altos de la concentración plasmática extrapolada del fármaco en el tiempo 0 (Cp0) en gatos anestesiados (17).
Aunque los signos clínicos de toxicidad del SNC podrían ser enmascarados por la anestesia, la depresión cardiovascular causada por los anestésicos inhalatorios podría exacerbarse debido a la alta concentración plasmática de LA. Por otro lado, la anestesia podría proteger contra los efectos tóxicos de los AL y posiblemente la muerte, ya que en el estudio de toxicidad de LB todas las ovejas anestesiadas con halotano sobrevivieron en comparación con las ovejas conscientes (18). En nuestro estudio, solo se realizó una monitorización no invasiva de CVS, y no se observaron signos de depresión cardiovascular clínicamente significativa o neurotoxicidad en ningún grupo de perros.
La principal limitación de este estudio clínico es el procedimiento dental no estandarizado. En algunos perros, el procedimiento se completó antes de que se tomara la última muestra de sangre, y sería éticamente inaceptable prolongar la anestesia únicamente debido a los requisitos de este estudio. En este caso, las muestras de sangre restantes se recogieron de perros no anestesiados, lo que podría haber afectado a la farmacocinética de LB (19). Debido a que el volumen total de sangre extraído de cada perro fue de 60 ml, no se incluyeron en este estudio perros que pesaran <10 kg.
En conclusión, nuestro estudio confirmó que (1) las concentraciones plasmáticas de LB son varias veces más bajas que las concentraciones tóxicas reportadas cuando se utiliza LB para la anestesia regional de la cavidad oral en perros anestesiados con isoflurano a las dosis descritas por Pascoe (1), y (2) la tasa de absorción de LB no difirió con respecto al sitio de aplicación.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
Este estudio fue aprobado por el Comité de Bienestar Animal de la Facultad de Veterinaria de la Universidad de Liubliana, Eslovenia (número de aprobación 8-10-2020/7, fecha de aprobación 7 de enero de 2021). Todos los procedimientos cumplieron con la normativa eslovena (Ley de Protección Animal UL RS, 43/2007) y europea. Se obtuvo el consentimiento informado formal por escrito de los dueños de los perros antes de participar en el estudio. Su participación era voluntaria y podían retirarse del estudio en cualquier momento. Se les informó que todos los datos y el material fotográfico se publicarían sin revelar la identidad del perro o de su dueño.
Contribuciones de los autores
Este estudio fue concebido y diseñado por MP, MK, AN y AS. Los datos fueron analizados por MK y AB. Todos los autores contribuyeron a la realización del estudio, la preparación del manuscrito y aprobaron la versión presentada.
Financiación
Este trabajo contó con el apoyo de la Agencia Eslovena de Investigación (P4-0053, P3-0067, P1-0143, J1-6744 y J3-3082).
Reconocimientos
Los autores agradecen al personal de la Clínica de Pequeños Animales de la Facultad de Veterinaria de la Universidad de Liubliana, Eslovenia, por su apoyo técnico.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Pascoe PJ. Anestesia y manejo del dolor. En:Verstraete, FJM, Lommer MJ, Arzi B, , editores. Cirugía oral y maxilofacial en perros y gatos, 2ª ed. Nueva York, NY: Elsevier (2020), p. 22–43. ISBN: 9780702076756. doi: 10.1016/B978-0-7020-7675-6.00013-9
2. McLeod GA, Burke D. Levobupivacaína. Anestesia. (2001) 56:331–41. doi: 10.1046/j.1365-2044.2001.01964.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Foster RH, Markham A. Levobupivacaína: una revisión de su farmacología y uso como anestésico local. Drogas. (2000) 59:551–79. doi: 10.2165/00003495-200059030-00013
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Fawcett JP, Kennedy JM, Kumar A, Ledger R, Kumara GM, Patel MJ, et al. Eficacia comparativa y farmacocinética de la bupivacaína racémica y la S-bupivacaína en cirugía de terceros molares. J Pharm Pharm Sci. (2002) 5:199–204.
5. Leone S, Di Cianni S, Casati A, Fanelli F. Farmacología, toxicología y uso clínico de nuevos anestésicos de acción prolongada, ropivacaína y levobupivacaína. Acta Biomed. (2008) 79:92–105.
6. Ohmura S, Kawada M, Ohta T, Yamamoto K, Kobayashi T. Toxicidad sistémica y reanimación en ratas con infusión de bupivacaína, levobupivacaína o ropivacaína. Anesth Analg. (2001) 93:743–8. doi: 10.1097/00000539-200109000-00039
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Chang DH, Ladd LA, Wilson KA, Gelgor L, Mather LE. Tolerabilidad de la levobupivacaína intravenosa a grandes dosis en ovejas. Anesth Analg. (2000) 91:671–9. doi: 10.1213/00000539-200009000-00033
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Groban L, Deal DD, Vernon JC, L James RL, Butterworth J. Reanimación cardíaca después de una sobredosis incremental con lidocaína, bupivacaína, levobupivacaína y ropivacaína en perros anestesiados. Anesth Analg. (2001) 92:37–43. doi: 10.1097/00000539-200101000-00008
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Franquelo C, Toledo A, Manubens J, Valladares JE, Cristòfol C, Arboix M. Farmacocinética y efectos farmacológicos del isómero S(-) de la bupivacaína tras la administración intravenosa y epidural en perros. Am J Vet Res. (1999) 60:832–5.
10. Bubenik L, Hosgood G, Barker BM, Serra V, Stout R. Concentración plasmática estimada de bupivacaína después de una dosis única y una infusión intraarticular continua de ocho horas de bupivacaína en perros normales. Cirugía veterinaria. (2007) 36:783–91. doi: 10.1111/j.1532-950X.2007.00337.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Benito J, Monteiro B, Beaudry F, Steagall P. Eficacia y farmacocinética de la bupivacaína con epinefrina o dexmedetomidina tras la administración intraperitoneal en gatas sometidas a ovariohisterectomía. Can J Vet Res. (2018) 82:124–30.
12. Shilo-Benjamini Y, Pypendop BH, Newbold G, Pascoe PJ. Concentraciones plasmáticas de bupivacaína después de inyecciones orbitarias en gatos. Veterinario Anaesth Analg. (2017) 44:178–82. doi: 10.1111/vaa.12388
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Garbin M, Benito J, Ruel HLM, Watanabe R, Monteiro BP, Cagnardi P, et al. Farmacocinética de la bupivacaína tras la administración mediante un bloqueo del plano transverso del abdomen guiado por ecografía en gatas sometidas a ovariohisterectomía. Farmacia. (2022) 14:1548. doi: 10.3390/pharmaceutics14081548
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Pumphrey SA, Reader RC, Rosenstein DS, Mouser PJ, Wetmore LA. Trauma ocular iatrogénico asociado al bloqueo infraorbitario realizado para rinoscopia en un gato: reporte de un caso y hallazgos preliminares de imagen. JFMS Open Rep. (2021) 7:20551169211011456. doi: 10.1177/20551169211011456
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Newton DJ, McLeod GA, Khan F, Belch JJ. Características vasoactivas de la bupivacaína y la levobupivacaína con y sin epinefrina adyuvante en la piel humana periférica. Hno. J Anaesth. (2005) 94:662–7. doi: 10.1093/bja/aei095
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Copeland SE, Ladd LA, Gu XQ, Mather LE. Los efectos de la anestesia general sobre la farmacocinética de todo el cuerpo y regional de los anestésicos locales a dosis tóxicas. Anesth Analg. (2008) 106:1440–9. doi: 10.1213/ane.0b013e31816ba541
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Thomasy SM, Pypendop BH, Ilkiw JE, Stanley SD. Farmacocinética de la lidocaína y su metabolito activo, monoetilglicinexiliida, después de la administración intravenosa de lidocaína a gatos despiertos y anestesiados con isoflurano. Am J Vet Res. (2005) 66:1162–6. doi: 10.2460/ajvr.2005.66.1162
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Copeland SE, Ladd LA, Gu XQ, Mather LE. Los efectos de la anestesia general sobre la toxicidad de los anestésicos locales en el sistema nervioso central y cardiovascular. Anesth Analg. (2008) 106:1429–39. doi: 10.1213/ane.0b013e31816d12af
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Groban L, Deal DD, Vernon JC, James RL, Butterworth J. Arritmias ventriculares con o sin estimulación eléctrica programada después de una sobredosis incremental con lidocaína, bupivacaína, levobupivacaína y ropivacaína. Anesth Analg. (2000) 91:1103–11. doi: 10.1213/00000539-200011000-00011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: anestesia regional, levobupivacaína, dexmedetomidina, farmacología, experimentación animal, perros
Cita: Pavlica M, Kržan M, Nemec A, Kosjek T, Baš A y Seliškar A (2022) La farmacocinética de la levobupivacaína al 0,5% después del bloqueo infraorbitario o alveolar inferior en perros anestesiados. Frente. Vet. Sci. 9:1055231. doi: 10.3389/fvets.2022.1055231
Recibido: 27 de septiembre de 2022; Aceptado: 28 de noviembre de 2022;
Publicado: 14 diciembre 2022.
Editado por:
Fan Yang, Universidad de Ciencia y Tecnología de Henan, China
Revisado por:
Bruno Pypendop, Universidad de California, Davis, Estados Unidos Peter Pascoe, Universidad de California, Davis, Estados
Unidos
Derechos de autor © 2022 Pavlica, Kržan, Nemec, Kosjek, Baš y Seliškar. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Alenka Seliškar, alenka.seliskar@vf.uni-lj.si
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.


