Fasciolosis: patogenia, interacciones huésped-parásito e implicación en el desarrollo de vacunas
Fasciolosis: patogenia, interacciones huésped-parásito e implicación en el desarrollo de vacunas
 Luis Miguel Flores-Velázquez1†
Luis Miguel Flores-Velázquez1†  María Teresa Ruiz-Campillo2†
María Teresa Ruiz-Campillo2†  Guillem Herrera-Torres2
Guillem Herrera-Torres2  Álvaro Martínez-Moreno3
Álvaro Martínez-Moreno3  Francisco Javier Martínez-Moreno3
Francisco Javier Martínez-Moreno3  Rafael Zafra3
Rafael Zafra3  Leandro Buffoni3
Leandro Buffoni3  Pablo José Rufino-Moya3
Pablo José Rufino-Moya3  Verónica Molina-Hernández2*
Verónica Molina-Hernández2*  José Pérez2
José Pérez2- 1Unidad de Anatomía, Histología y Patología Veterinaria, Escuela de Medicina Veterinaria, Facultad de Ciencias Naturales, Universidad San Sebastián, Campus Puerto Montt, Puerto Montt, Chile
- 2Departamento de Anatomía y Anatomía Patológica Comparadas y Toxicología, UIC Zoonosis y Enfermedades Emergentes ENZOEM, Universidad de Córdoba, Córdoba, España
- 3Departamento de Sanidad Animal (Área de Parasitología), UIC Zoonosis y Enfermedades Emergentes ENZOEM, Universidad de Córdoba, Córdoba, España
Fasciola hepatica se distribuye por todo el mundo, causando importantes pérdidas económicas en la industria ganadera. La fasciolosis humana es una zoonosis emergente en América Andina, Asia y África. El control de la enfermedad, tanto en humanos como en animales, se basa en el uso de fármacos antihelmínticos, lo que ha dado lugar a un aumento de la resistencia a los antihelmínticos más eficaces, como el triclabendazol, en muchos países. Esto, junto con la preocupación por los residuos de medicamentos en los alimentos y el medio ambiente, ha aumentado el interés por las medidas preventivas, como una vacuna, para ayudar a controlar la enfermedad en las zonas endémicas. A pesar de los importantes esfuerzos realizados en las últimas dos décadas y del trabajo realizado con numerosas vacunas candidatas, ninguna de ellas ha demostrado una protección consistente y reproducible en las especies objetivo. Esto se debe, al menos en parte, a la alta capacidad de inmunomodulación del parásito, lo que hace ineficaz la respuesta del huésped en especies susceptibles como los rumiantes. Es ampliamente aceptado que se necesita un conocimiento más profundo de las interacciones huésped-parásito para un diseño más racional de las vacunas candidatas. En los últimos años, el uso de tecnologías emergentes ha aumentado notablemente la cantidad de datos sobre estas interacciones. En el presente estudio, se revisa el conocimiento actual de las interacciones huésped-parásito y su implicación en el desarrollo de la vacuna contra Fasciola hepática.
1 Introducción
La fasciolosis es una enfermedad parasitaria de distribución mundial, excluyendo la Antártida. En el caso de la ganadería, tiene importantes implicaciones económicas, con pérdidas económicas estimadas en todo el mundo que ascienden a 3.200 millones de dólares, incluidos los tratamientos antihelmínticos, el control de huéspedes intermediarios (molusquicidas), la investigación y la implicación de pérdidas económicas en la producción de ganado lechero y cárnico (1, 2).
La fasciolosis humana ha persistido desde tiempos prehistóricos (3) y, en la actualidad, tiene un impacto significativo en la salud global en lugares geográficos específicos. La Organización Mundial de la Salud (OMS) ha clasificado la fasciolosis como una enfermedad tropical desatendida (4), y es la zoonosis parasitaria más distribuida geográficamente (5, 6). Las infecciones humanas por F. hepatica oscilan entre 2,4 y 17 millones de personas (7), con 91 a 180 millones de personas en riesgo de infección anualmente (8, 9).
En la actualidad, el control de la fasciolosis en rumiantes sigue basándose en medidas de manejo como la rotación de pastos y el uso de antihelmínticos (10). El uso continuado de antihelmínticos ha dado lugar a un aumento de las cepas resistentes a los parásitos de los fluquicidas más eficaces y ampliamente utilizados, como el triclabendazol y el albendazol (11, 12). En las últimas tres décadas, ha habido un creciente interés en la obtención de vacunas que ayuden a prevenir y controlar la fasciolosis en rumiantes (13). Sin embargo, el desarrollo de vacunas contra la fasciolosis ha sido lento, en parte debido a la gran capacidad inmunomoduladora del parásito. Por lo tanto, es necesaria una mejor comprensión de las interacciones parásito-huésped para un diseño más racional de nuevas vacunas candidatas (14, 15).
2 Etiología y ciclo biológico del parásito
La fasciolosis es causada por trematodos del género Fasciola, conocidos como trematodos hepáticos. Las dos especies más implicadas como agentes etiológicos de la fasciolosis son F. hepatica, que se distribuye principalmente en regiones de clima templado, y F. gigantica, que se encuentra en regiones tropicales. Además, se han descrito formas híbridas en regiones donde coexisten las dos especies (16, 17). Se ha utilizado la PCR en tiempo real (qPCR) dirigida al ADNr ITS1, el ADNr ITS2 y el ADNr 28S para diferenciar las dos firmas genéticas distintas que representan a cada especie (18-20). El potencial epidemiológico de hibridación e introgresión entre F. hepatica y F. gigantica sigue siendo desconocido; Por lo tanto, es importante utilizar la terminología correcta de forma coherente y no utilizar los dos términos indistintamente (21).
El ciclo de vida de Fasciola spp. es bastante complejo, ya que implica varias variaciones. En general, involucra a uno o más huéspedes intermediarios, que son los moluscos. Al menos 20 especies de la familia Lymnaeidae han sido reportadas como hospederos intermediarios (22, 23). Las larvas asexuales sufren varias multiplicaciones (24-26) antes de infectar finalmente a un huésped definitivo en el que se produce la reproducción sexual.
3 Patogenia
La penetración, migración y localización de los parásitos en las vías biliares ejercen una acción traumática que provoca una serie de lesiones en el parénquima hepático y en las vías biliares (27). Los juveniles recién excysted (NEJs) de Fasciola spp. penetran en la mucosa intestinal y se pueden encontrar en la cavidad abdominal 72 h después de la ingestión de metacercaria. Los NEJ migran a través del peritoneo a la superficie hepática y no presentan sinología clínica en animales (28). El destino de la mayoría de los NEJ es el lóbulo hepático izquierdo, probablemente debido a su proximidad anatómica al duodeno y al hecho de que llegan menos a los otros lóbulos hepáticos. En ocasiones, debido a infestaciones masivas, estos juveniles pueden tener una migración aberrante a otros órganos, como el diafragma y el pulmón, causando neumonía y pleuresía fibrinosa (29).
La patogénesis de la fasciolosis ocurre en dos fases: la fase parenquimatosa y la fase biliar. La fase parenquimatosa comienza cuando los NEJs atraviesan la cápsula hepática (cápsula de Glisson), continuando con la migración de los estadios juveniles a través del parénquima hepático. Esta migración provoca daños mecánicos a través de la abrasión por el tegumento que presenta espinas que ayudan a mantener la posición del parásito dentro de los tejidos hepáticos y probablemente subproductos secretados por las larvas migratorias. Varios procesos patológicos ocurren simultáneamente dentro del parénquima hepático, incluyendo la migración de estadios juveniles que causan lesiones necróticas y hemorrágicas, que, a su vez, causan reacciones inflamatorias activando el sistema inmune (30). Esta respuesta se puede encontrar a lo largo de la tortuosa trayectoria migratoria de los parásitos, lo que sugiere que la excreción y secreción de estos productos permanecen en el tejido, atrayendo más infiltración de células inflamatorias de naturaleza inmune (31). La fase biliar comienza cuando los parásitos entran en las vías biliares, donde ejercen una acción mecánica y química combinada. A través de la ventosa oral, los parásitos adultos causan daño mecánico mientras se alimentan de sangre y del parénquima hepático adyacente al conducto. Se han observado hepatocitos macerados en el interior de la ventosa y la faringe (27), lo que provoca erosión del epitelio, traumatismos, rotura focal del conducto y punción de pequeños vasos sanguíneos. El agrandamiento del conducto biliar puede ser inducido químicamente (32), y se ha sugerido que el aminoácido prolina, que es esencial para la síntesis de colágeno por los fibroblastos, también es liberado en grandes cantidades por el parásito (33, 34). Estas dos acciones ejercidas por el parásito adulto provocan una respuesta inflamatoria eosinofílica y granulomatosa severa, particularmente cuando los huevos alcanzan el parénquima hepático (35), y una marcada hiperplasia de los conductos biliares en los que se alojan los parásitos (36).
El efecto de estas dos fases provoca una serie de lesiones en el parénquima hepático, que se correlaciona ampliamente con la dosis infecciosa; Una dosis alta provoca lesiones más graves que son más agudas e incluso mortales. Sin embargo, diferentes estudios realizados en ovinos (35) y caprinos (37) también han demostrado que pequeñas dosis repetitivas (infecciones por goteo) causaron daño hepático más severo que una dosis única utilizando el mismo número total de metacercarias. Estos hallazgos sugieren que las actividades mecánicas y enzimáticas del parásito pueden ser la causa inicial del daño hepático. Por lo tanto, la respuesta inmune o cicatrización, así como la infección simultánea en diferentes etapas y la respuesta inmune a la primera infección, juegan un papel importante en la patogénesis de la fasciolosis (31).
4 Respuesta inmunitaria del huésped
4.1 Respuesta inmune innata
El reconocimiento inicial de los NEJ tiene lugar dentro de la mucosa epitelial del tracto intestinal con una amplia activación. La respuesta a los NEJ puede ocurrir a través del reconocimiento de residuos de proteínas glicosiladas y carbohidratos que se comportan como antígenos tegumentales e inducen la proliferación de células T a través de la activación de células dendríticas (38, 39). Los productos secretores excretores que contienen antígenos liberados por F. hepatica (FhESP) también pueden inducir una respuesta de los macrófagos bovinos, que es parcialmente dependiente de TLR4 (40, 41).
La función de los mastocitos no está realmente definida, ni hay evidencia de que sea protectora (42). Estas células son residentes de tejidos que responden a la activación tanto del sistema inmune innato como del adquirido mediante la producción y liberación de diferentes mediadores inflamatorios presentes en sus gránulos citoplasmáticos, prostaglandinas, leucotrienos y ciertas citoquinas como el factor de necrosis tumoral alfa (TNF-α) o la interleucina-4 (IL-4) (43). Además, pueden liberar ciertas sustancias activas contra los parásitos uniendo los complejos antígeno-IgE del parásito con sus receptores IgE de alta afinidad (44, 45). Se estima que su papel es más determinante en los estadios iniciales (peritoneo) de la infección (42, 46, 47). Sin embargo, se ha descrito en bovinos que después de ser infectado por F. hepatica, hay poca evidencia de un aumento en el porcentaje de basófilos y mastocitos (48, 49) y en el líquido peritoneal en ovejas (50). Por el contrario, la infección por F. gigantica en búfalos induce aumentos en el número de mastocitos en el infiltrado inflamatorio hepático (51). En numerosos procesos parasitarios, podemos encontrar una población de mastocitos intraepiteliales residentes responsables de fenómenos de rechazo rápido del parásito a nivel epitelial (52-54). Sin embargo, estas células no se han descrito en el intestino tras la migración de F. hepatica (30, 36) ni en células biliares como macrófagos y neutrófilos, cuya función es fagocítica y pueden liberar sustancias como reactivos derivados del óxido nítrico o especies activas de oxígeno que actúan directamente contra el parásito (55, 56). Por otro lado, la infección por F. hepatica provoca una respuesta inmune de tipo Th2 con producción de IgE (57) e infiltración de eosinófilos y mastocitos en el hígado (48).
Los neutrófilos humanos de pacientes con fasciolosis aguda mostraron una mayor función fagocítica en comparación con los que se encontraban en la etapa crónica de la infección (58). Del mismo modo, los neutrófilos de cabras infectadas crónicamente mostraron una respuesta fagocítica pobre en comparación con los de cabras no infectadas. Esta pobre respuesta de los fagocitos se correlacionó con la carga de trematodos (59). El papel de los neutrófilos en las respuestas protectoras aún no se ha descrito en las infecciones por trematodos.
En bovinos, ovinos y caprinos, F. hepatica induce eosinofilia hepática y sanguínea, y la infección por F. gigantica en ovejas da el mismo perfil (60-62). Sin embargo, la vacunación de terneros y cabras que mostraron protección redujo los recuentos de eosinófilos (30, 63), lo que puede deberse a la menor carga de trematodos y lesiones hepáticas en animales parcialmente protegidos. En los estadios agudos de la infección por F. hepatica se ha descrito un aumento dramático de eosinófilos en la cavidad peritoneal (50, 64) así como en las lesiones hepáticas, tanto durante la etapa migratoria (30, 36, 65, 66) como durante la etapa crónica (35). Se ha demostrado que los eosinófilos median la citotoxicidad celular dependiente de anticuerpos (ADCC) contra F. hepatica en ratas (42). En ovejas de cola fina (ITT) de Indonesia que muestran resistencia a F. gigantica pero no a F. hepatica, se ha observado que la ADCC por eosinófilos desempeña un papel (ex vivo) en la muerte de F. gigantica pero no de F. hepatica de juveniles recién excysted (NEJ) (56). Sin embargo, la eosinofilia periférica no se relacionó con la resistencia a F. gigantica, lo que sugiere que este tipo de célula es efectiva solo dentro del intestino o la cavidad peritoneal, pero no en el hígado, al menos en ovejas ITT (67).
También se ha demostrado que los macrófagos peritoneales de ovejas ITT matan a F. gigantica pero no a F. hepatica por ADCC (56, 68). Este mecanismo se produce mediante la unión de células efectoras con NEJ en presencia de suero de ovejas infectadas. Los macrófagos que participan en el mecanismo efectivo de ADCC contra F. gigantica mostraron niveles más altos de radicales superóxido que aquellos que participan en ADCC ineficaz contra F. hepatica, lo que sugiere que los radicales de oxígeno juegan un papel en la muerte de los NEJ de F. gigantica (56). Se ha reportado que en terneros protegidos por vacunación experimental, la ADCC mediada por macrófagos está mediada por óxido nítrico e induce una respuesta de citoquinas Th1 que depende de IgG2a (69). Los estudios in vitro han revelado que los macrófagos bovinos eran capaces de matar a los NEJ en presencia de suero de animales infectados. Sin embargo, los NEJ fueron capaces de producir moléculas como una familia de moléculas similares a TGF (FhTLM) que reduce significativamente el ADCC. Estos macrófagos mostraron características de activación alternativa con la expresión de altos niveles de IL-10 (70). En animales no protegidos, se ha observado que los NEJ inducen la activación alternativa (M2) de los macrófagos y secretan las citoquinas reguladoras IL-10 y el factor de crecimiento transformante beta (TGF-β) durante la migración peritoneal (71-73). Los macrófagos activados por M2 tienen un papel importante en la reparación de tejidos, pero tienen una capacidad reducida para matar NEJs (41, 70).
4.2 Respuesta inmunitaria adaptativa
Los linfocitos B han demostrado importancia tanto en animales infectados por Fasciola spp. como en aquellos que han sido previamente vacunados (74), destacando el aumento de linfocitos B CD19+ a nivel de los ganglios linfáticos hepáticos, aumentando el reclutamiento de estas células (66). En bovinos, ovinos y caprinos, IgG1 es el anticuerpo dominante, que aumenta a las 4-5 semanas después de la infección (wpi) y alcanza picos a 12-15 wpi (37, 75, 76). Se ha demostrado que un aumento de la IgG2 específica corresponde a la protección inducida por la vacuna, y un aumento de la IgG1 se ha asociado con una respuesta Th2 no protectora (76-78). No se ha detectado IgA específica para antígenos trematodos en suero (75), pero se ha encontrado en la bilis y el hígado de bovinos infectados (51), donde esta inmunoglobulina puede participar en la activación de eosinófilos para matar NEJ por ADCC (49). A pesar de esta interesante sugerencia, pocos estudios han investigado la presencia de IgA en la bilis y el hígado tanto en infecciones experimentales como naturales.
La respuesta inmunitaria ejercida durante las primeras etapas de la fasciolosis se considera generalmente como una respuesta mixta Th1/Th2 que muestra un aumento de ciertas citocinas como IFN-γ, IL-4, IL-10 y TGF-β. A medida que la infección progresa, una respuesta Th2 se amplifica junto con la supresión de la inflamación Th1, lo que permite una infección prolongada que puede depender de IL-4 (79). En las primeras etapas de la infección por F. hepatica en ovinos y bovinos, tanto el IFN-γ como la IL-10 están aumentados, lo que confirma la respuesta inmune mixta inicial (75, 80, 81). Cuando la infección progresa, la respuesta Th2 se amplifica junto con la supresión de la respuesta Th1 con una reducción del IFN-γ y un aumento de los niveles de IL-4 (79). En las primeras etapas de la infección bovina por F. hepatica, tanto el IFN-γ como la IL-10 están aumentados, lo que corrobora la idea de que la respuesta inmune inicial es mixta (75). Los búfalos con infección primaria y secundaria de F. gigantica también mostraron una respuesta mixta Th1/Th2 en suero con niveles elevados de IFN-γ, IL-4, IL-5 y TGF-β durante las primeras etapas de la infección. Por el contrario, cuando la infección progresó, la respuesta Th2 fue dominante (82). La respuesta Th1/Th2 no fue la misma en los diferentes compartimentos: en el hígado de oveja, el IFN-γ aumentó durante las primeras etapas de la infección (80, 81) y se mantuvo alta durante los estados crónicos de infecciones (81). Al mismo tiempo, en los ganglios linfáticos hepáticos, el IFN-γ se redujo tanto en animales infectados como reinfectados en etapas agudas y crónicas de infecciones (81). Los altos niveles de IFN-γ reportados en el hígado durante las etapas agudas y crónicas de las infecciones por F. hepatica contrastan con la regulación negativa de esta citocina en PBMC (83) y ganglios linfáticos hepáticos (80, 81) y podría deberse a una respuesta a la necrosis hepática causada por trematodos migratorios o adultos y formación de granulomas.
5 Estrategias de inmunomodulación
La reacción inflamatoria en la fasciolosis es uno de los puntos a tratar principalmente para entender la respuesta inmune y su evasión. Dado que las metacercarias se excystan en la luz intestinal, los NEJ se exponen a la respuesta inmunitaria del huésped para matar al parásito. Sin embargo, Fasciola spp. ha desarrollado una variedad de estrategias para evadir la respuesta del huésped en los diferentes compartimentos donde permanecen durante las etapas tempranas y tardías de la infección, lo que permite que el parásito viva durante años dentro del huésped. Algunas de estas estrategias pueden considerarse pasivas, como la protección conferida por el tegumento, que consiste en una capa sincitial que cubre todo el cuerpo del parásito, formada por una membrana plasmática que sirve de soporte para el glicocálix externo y una membrana basal que está conectada a través de canales. Estas estructuras permiten el paso de los componentes necesarios para la sustitución del tegumento. La rápida sustitución del glicocálix que recubre el tegumento, que tiene lugar cada 2 o 3 h, también puede ser un obstáculo para que los productos liberados por las células inflamatorias lleguen al tegumento del parásito (84), que está compuesto por al menos 369 proteínas. Además, la presencia de abundantes proteínas N-glicosiladas y glicolípidos ha dificultado la caracterización de sus funciones fisiológicas e inmunorreguladoras (85).
La mayoría de las estrategias utilizadas por el parásito para evadir la respuesta del huésped pueden considerarse activas, ya que implican la liberación de una gran cantidad de moléculas del parásito en la vecindad del parásito. Estas moléculas pueden ser liberadas libres o dentro de vesículas extracelulares (VEs) que están cubiertas por una membrana, y pueden ser internalizadas por las células huésped, provocando su modulación (84, 85). Las VE son producidas por todas las etapas de desarrollo de F. hepatica, y se consideran transportadores eficientes de moléculas del parásito a diferentes compartimentos del huésped, evitando la acción de los anticuerpos debido a la membrana que rodea las moléculas del parásito contenidas en las VE (86). En los VE de F. hepática se han identificado hasta 618 proteínas, lo que nos da una idea de la importancia de los VE para que el parásito interactúe con el huésped (87).
Fasciola spp. no solo utilizan proteínas para modular la respuesta inmunitaria del huésped, sino que los VE también contienen microARN (miARN), moléculas con capacidad de expresión génica moduladora. Los miARN son abundantes tanto en las metacercarias como en los gusanos F. hepatica juveniles y adultos y pueden desempeñar un papel principal en la regulación de los procesos metabólicos y de desarrollo del parásito, así como en las interacciones huésped-parásito (88-90). El contenido de miARN en los VE es diferente cuando son producidos por parásitos adultos o juveniles, lo que lleva a diferentes influencias en las células huésped. Estos datos apoyan la hipótesis de que los miRNAs son los mediadores de la función inmunomoduladora previamente demostrada de los EVs. Sin embargo, los datos actuales no permiten una comprensión fundamental de sus mecanismos reguladores en diferentes procesos de interacción huésped-parásito (88-91).
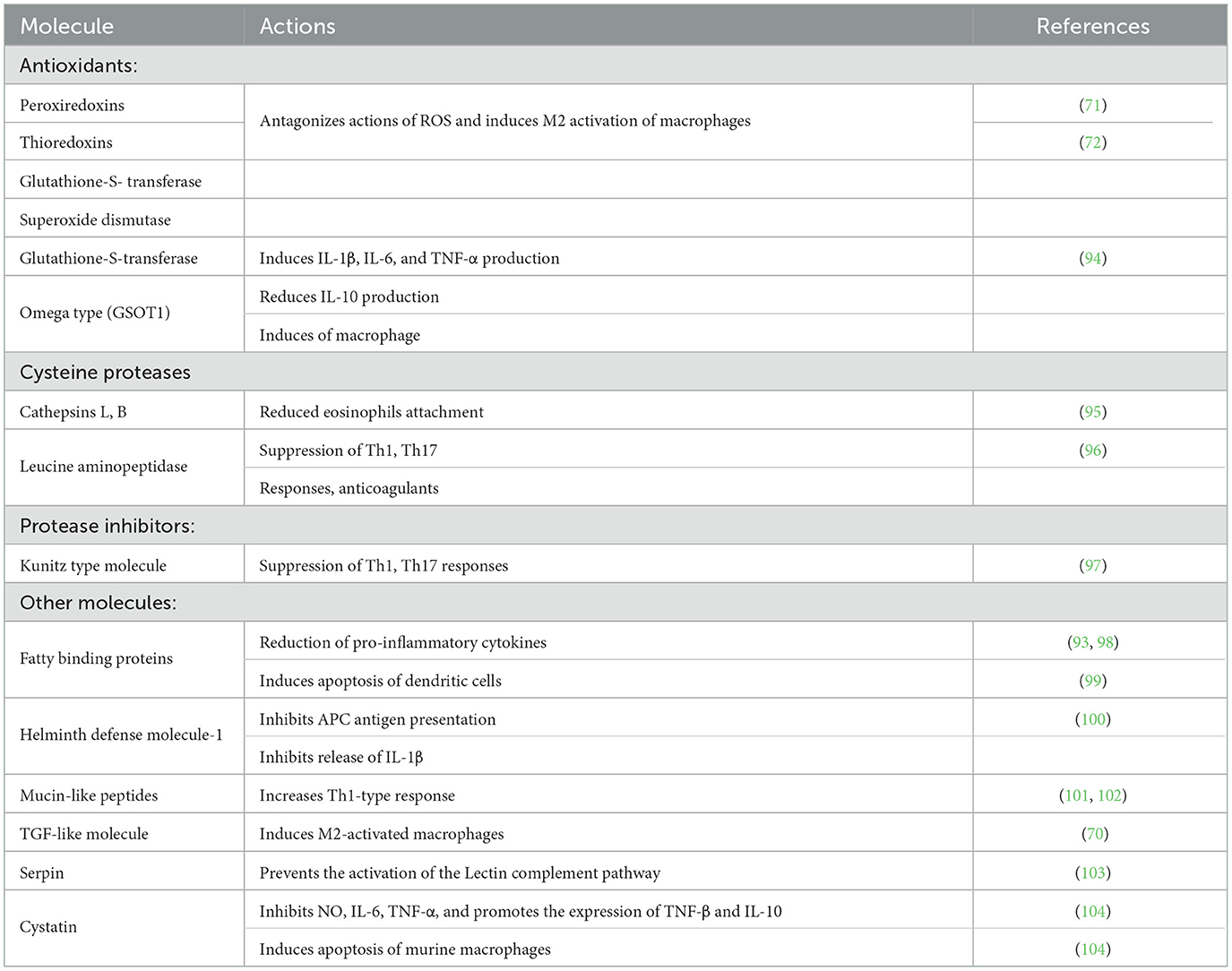
Otro mecanismo utilizado por la duela hepática para sobrevivir, migrar, obtener nutrientes y evadir la respuesta inmune del huésped, es la liberación de productos secretores excretores (PES) (92). La FhESP de F. hepatica adulta contiene hasta 160 proteínas diferentes, incluyendo proteasas como las catepsinas B y L (FhCB y FhCL), la leucina aminopeptidasa y la carboxipeptidasa, la proteína de unión a ácidos grasos (FABP) y la proteína similar a la saposina de F. hepatica (FhSAP), todas ellas necesarias para su metabolismo (93) (Tabla 1 ). FhESP también contiene numerosas enzimas antioxidantes para proteger al parásito de las especies reactivas de oxígeno liberadas por los eosinófilos y los macrófagos, como la superóxido dismutasa (SOD), la glutatión-S-transferasa (GST), la tiorredoxina peroxidasa (TPx) y la peroxirredoxina (Px) (Tabla 1). Estas enzimas no solo participan en la inactivación de especies reactivas de oxígeno, sino también en varios procesos metabólicos importantes para la supervivencia de los parásitos, como el exquiste de las metacercarias, la migración de tejidos, la alimentación y la evasión inmune (92, 105, 106). Algunas estrategias que Fasciola spp. para evadir la respuesta del host se analizan a continuación.
5.1 Movimiento de parásitos
Durante la migración hepática, se ha reportado que algunas larvas muestran un fuerte infiltrado inflamatorio, compuesto principalmente por eosinófilos adheridos a la cutícula del parásito y en las proximidades del parásito. Sin embargo, en otras larvas, no se encontró ninguna reacción inflamatoria en su vecindad, pero se observó tracto necrótico e inflamación 2-3 mm detrás de ellas (30, 36). Se ha sugerido que cuando los parásitos son perturbados por la reacción inflamatoria, avanzan, dejando atrás las células inflamatorias (66).
5.2 Apoptosis de células efectoras e inmunitarias
Existe una íntima conexión entre la respuesta inflamatoria y la respuesta inmunitaria cuando se padece fasciolosis. La respuesta inmune innata determina las poblaciones celulares involucradas en la respuesta inflamatoria atrayendo y activando las células inflamatorias (107). Los eosinófilos desempeñan un papel clave en la respuesta del huésped a la infección por Fasciola spp, como sugiere el rápido aumento de este tipo de células en la sangre, el peritoneo y el hígado durante la migración temprana de juveniles en ovejas (35, 60), bovinos (48) y roedores (108). Los estudios in vitro han reportado que los antígenos FhESP de F. hepatica inducen la apoptosis de eosinófilos y macrófagos de rata (109, 110). Estudios in vivo han descrito apoptosis en eosinófilos en el infiltrado inflamatorio hepático durante las fases aguda y crónica de la infección en ovejas (65) y la etapa migratoria en un porcentaje relevante de macrófagos peritoneales, eosinófilos y linfocitos (50). También se ha descrito un aumento de la expresión del gen proapoptótico en células mononucleares de sangre periférica de ovejas y bovinos infectados (111, 112). Más recientemente, se ha investigado el papel de una variedad de moléculas de F. hepatica en la inducción de la apoptosis; algunos de ellos han sido identificados como glutatión S-transferasa tipo Omega (GSTO1), que reguló a la baja la relación Bcl-2/Bax e indujo un aumento de la expresión de caspasa-3 y la apoptosis de macrófagos in vitro (94). Se ha demostrado que la cistatina recombinante de F. hepatica (rFhCystatin) induce la apoptosis de los macrófagos murinos (104), y la proteína de unión a ácidos grasos (Fh12) induce la apoptosis de las células dendríticas murinas en estudios in vitro (99).
5.3 Modulación de las respuestas Th1/Th2 y Th17
La respuesta inmunitaria montada durante las primeras etapas de la fasciolosis es generalmente una respuesta mixta Th1/Th2 con niveles elevados de citocinas como IFN-γ, IL-4, IL-10 y TGF-β. A medida que avanza la infección, se amplifica una respuesta Th2 junto con la supresión de la producción de citocinas Th1, en particular IFN-γ, lo que facilita la supervivencia del parásito en ratones, vacas y ovejas infectadas con F. hepatica (41, 79-81, 113). Se ha reportado una dinámica similar de Th1/Th2 en búfalos infectados con F. gigantica (82). Se ha reportado que una variedad de moléculas parásitas son capaces de producir modulación de la respuesta del huésped Th1/Th2; por lo tanto, la rFhCistatina indujo una reducción de la producción de IL-6 y TNF-α y un aumento de la producción de IL-10 y TGF-β en macrófagos murinos (104). F. hepatica La molécula de tipo Kunitz indujo la supresión de las respuestas Th1 y Th17 en células dendríticas murinas y humanas (CD) en estudios in vitro (97).
5.4 Modulación de las funciones de los macrófagos y de las células presentadoras de antígenos
En las primeras etapas de la infección por F. hepatica, se ha reportado el reclutamiento de macrófagos y la activación alternativa (M2) en la cavidad peritoneal en ratas a las 24 h post-infección (hpi) (71) y a las 48 hpi en ratones (114). Además, FhESP indujo la activación de M2 de macrófagos peritoneales en ratones (114). En ovejas, se ha descrito una marcada activación de M2 por la expresión génica en PBMC a 7 dpi (83), aunque los macrófagos peritoneales de oveja mostraron activación de M2 a 24 hpi (73). En el ganado bovino, F. hepatica también indujo la activación de M2 de los macrófagos (115, 116). Los macrófagos activados por M2 participan en la reparación de tejidos, pero muestran una capacidad limitada para controlar las infecciones por helmintos (117). F. hepatica posee FhTLM, que se expresa altamente en NEJs y huevos no embrionados. Se ha reportado que FhTLM induce la diferenciación de los macrófagos derivados de monocitos a la activación de M2 con aumento de la producción de IL-10, arginasa-1, receptor de manosa y PD-L1 (70).
Se ha reportado que diferentes preparaciones antigénicas de este parásito, como el extracto total, el antígeno tegumental de F. hepatica (FhTeg) y la ESP de Fasciola hepática, disminuyen el estado de activación de las células dendríticas (CD) en ratones (118-121), y la ESP de F. gigantica induce la modulación de las CD de búfalo (122). Más específicamente, se ha reportado que FhTeg induce la modulación de DC, provocando la ausencia de respuesta de citoquinas Th1 de células T y actividad proliferativa (38). También se ha informado que los productos glicanos producidos por F. hepatica inducen la modulación de la maduración de la DC, lo que resulta en un aumento de la producción de IL-10 e IL-4 durante la infección, induciendo una respuesta inmune Th2/polarizada regulatoria (40, 79, 113, 123, 124). Además, la catepsina L1 (FhCL1) de F. hepatica, la glutatión S-transferasa (FhGST) y la molécula de tipo Kunitz participan en la modulación de las CD, lo que conduce a la supresión de las respuestas inmunitarias adaptativas, Th1 y/o Th17 (40, 97). Las ovejas infectadas con F. hepatica mostraron un aumento en el número de CD en los ganglios linfáticos hepáticos, pero una reducción de la expresión de MHC clase II y CD83, lo que sugiere la supresión del proceso de presentación de antígenos en los linfocitos tanto en las etapas tempranas como tardías de la infección (125).
5.5 Expansión de las células T reguladoras
Las ovejas y cabras infectadas con F. hepatica mostraron expansión de las células T reguladoras (Treg) Foxp3+ durante las etapas tempranas y tardías de la infección en el hígado y los ganglios linfáticos hepáticos (50, 81, 126). Además, el aumento de células Foxp3+ fue más severo en las proximidades de los conductos biliares hiperplásicos durante los estados crónicos de infecciones (50). Esta expansión de Foxp3+ Treg se ha relacionado con la IL-10 y la supervivencia del parásito (127, 128).
6 Desarrollo de vacunas
En las últimas dos décadas, se han producido avances considerables en la identificación de posibles moléculas vacunales para el control de la fasciolosis en el ganado. Sin embargo, a pesar de algunos resultados prometedores con algunas vacunas candidatas en rumiantes, aún no se ha alcanzado la eficacia consistente requerida para la comercialización (13). Un obstáculo importante para el desarrollo de vacunas contra la fasciolosis es la inmunosupresión/modulación inducida por Fasciola spp. que impide la inducción de una respuesta inmune protectora (Figura 1), evidenciada por la falta de inmunidad observada en ovejas infectadas natural y experimentalmente (31, 70, 129). En el ganado bovino, se ha demostrado que las infecciones naturales o experimentales inducen cierta protección contra la reinfección, que se mantiene a largo plazo (hasta 26 semanas después de la infección). Se ha atribuido a la fibrosis severa inducida por la infección primaria que dificulta la migración hepática durante la infección secundaria (130) o por un aumento de eosinófilos intestinales y mastocitos mucosos (47). Algunos estudios también han reportado evidencia de que la protección contra F. hepatica es inducible en ratas, ovejas o ganado mediante la transferencia pasiva de sueros y células inmunes (131). Sin embargo, otros estudios no han reportado resistencia a la reinfección medida por la carga de trematodos (75). Además, no se informaron diferencias en la carga de trematodos, el recuento de huevos fecales, la respuesta humoral (IgG1 e IgG2 específicas) y la respuesta inmune mediada por células (producción de IFN-γ) en los terneros desafiados con F. hepatica después de una infección única o por goteo (48, 57, 75), lo que sugiere que las reinfecciones no inducen protección. Los estudios experimentales no informaron protección contra la reinfección en ovejas (35, 81, 132) y cabras (37), aunque la respuesta del huésped fue diferente; así, las ovejas primoinfectadas mostraron una respuesta mixta Th1/Th2/Th17, mientras que las reinfectadas presentaron una respuesta más polarizada Th2 (81) y una menor respuesta humoral (132).
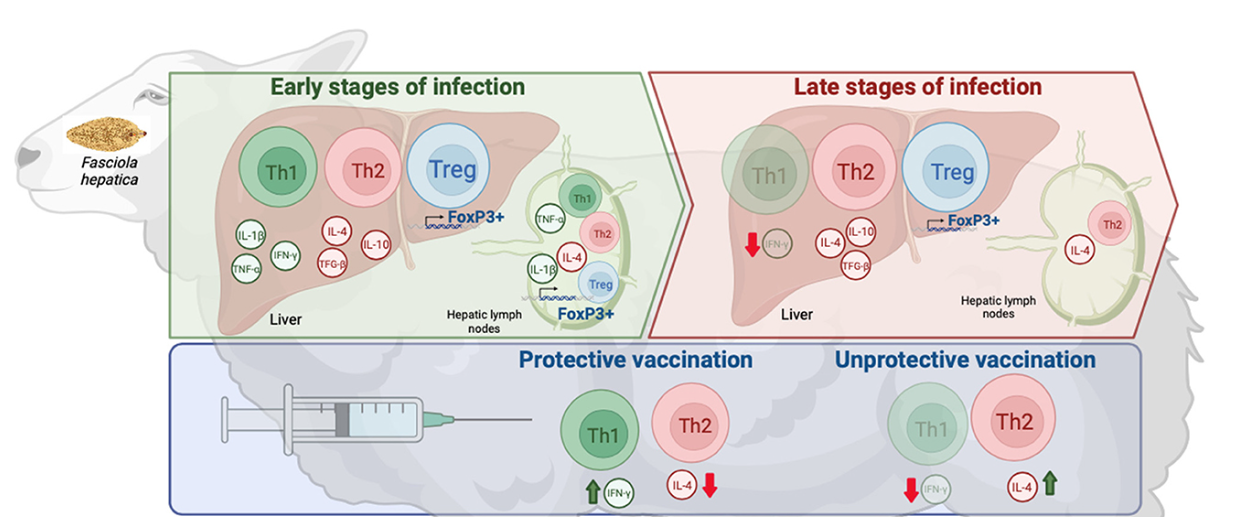
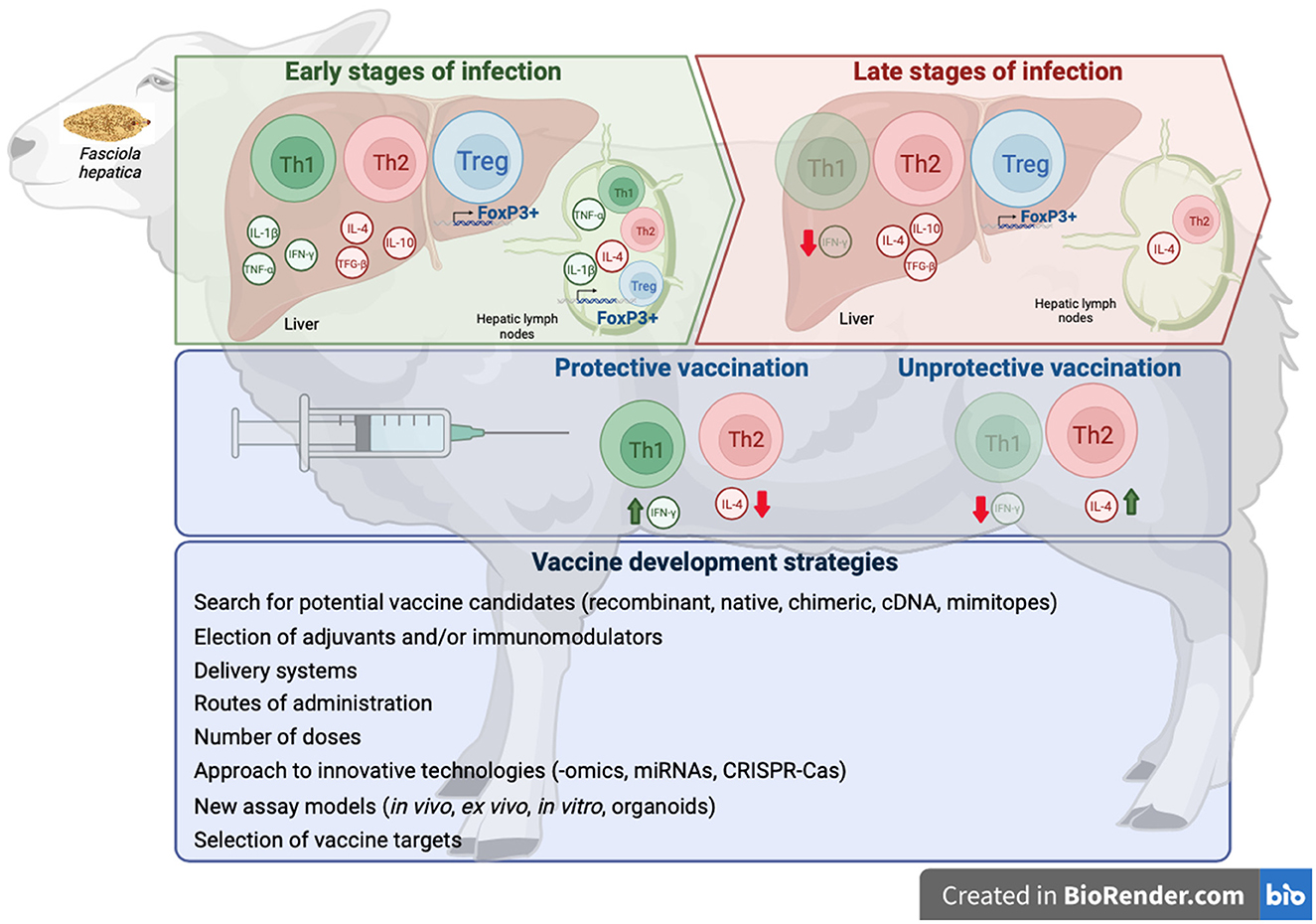 Figura 1. Esquema de las respuestas inmunitarias ejercidas en estadios tempranos y tardíos de las infecciones por F. hepatica, respuestas inmunitarias inducidas por vacunas protectoras e improductivas contra F. hepatica, y estrategias para desarrollar vacunas efectivas. Creado con BioRender.com.
Figura 1. Esquema de las respuestas inmunitarias ejercidas en estadios tempranos y tardíos de las infecciones por F. hepatica, respuestas inmunitarias inducidas por vacunas protectoras e improductivas contra F. hepatica, y estrategias para desarrollar vacunas efectivas. Creado con BioRender.com.
Se ha reportado que en las vacunas protectoras en ovejas (133) y cabras (134), se encontró una respuesta mixta Th1/Th2 con niveles más altos de IFN-γ y niveles más bajos de IL-4 en los grupos vacunados que en el grupo de control infectado (133). En las ovejas inmunizadas con una vacuna no protectora, la respuesta inmunitaria del huésped mostró un perfil predominantemente Th2 durante las etapas crónicas de la infección, similar al encontrado en animales no vacunados e infectados (80). El reto consiste en identificar los antígenos específicos que son los objetivos de esta inmunidad protectora e incorporarlos en formulaciones de vacunas que induzcan una respuesta mixta Th1/Th2 para mejorar la eficacia de la vacuna (135). Se ha estimado que una vacuna con una eficacia del 50-60% en la reducción de trematodos probablemente sería beneficiosa en numerosos países para reducir significativamente las pérdidas económicas, y también tendría un impacto positivo en la epidemiología al reducir los huevos en los pastos (13).
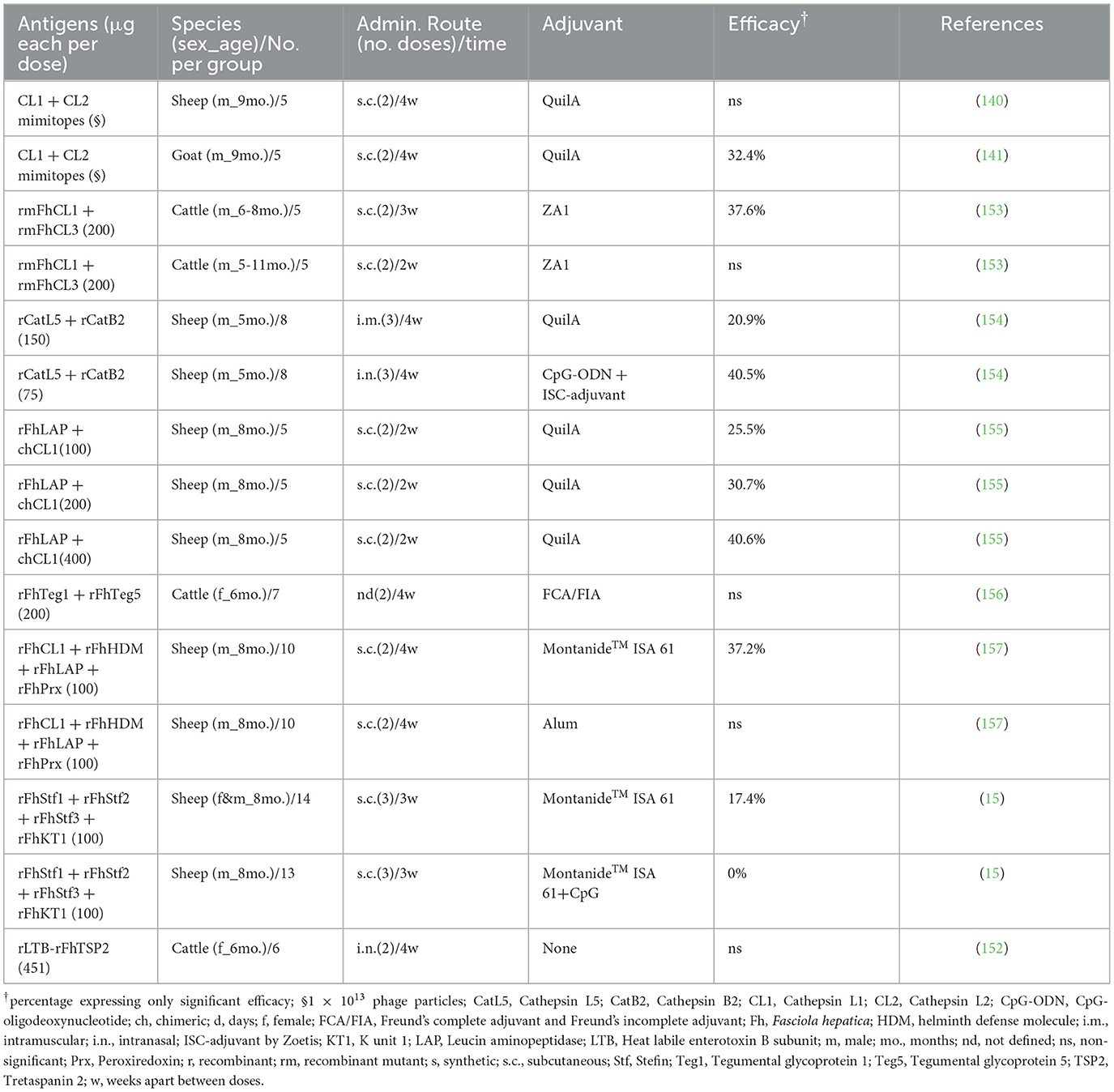
Se han utilizado varias estrategias para diseñar vacunas candidatas contra la fasciolosis en el ganado. Los primeros ensayos de vacunas utilizaron proteínas nativas aisladas mediante métodos bioquímicos convencionales a partir de las proteínas excretadas/secretadas (ES) de parásitos adultos (136, 137). A pesar de que en estos ensayos se ha encontrado una buena protección en ovinos y bovinos con FhCL1 y FhGST nativos, no es factible el uso de proteínas nativas en una vacuna comercial para la fasciolosis en el ganado, por lo que la mayoría de los ensayos vacunales posteriores se han llevado a cabo utilizando proteínas recombinantes de diferentes estadios del parásito (13). Algunos ensayos de vacunas que utilizaron proteínas recombinantes informaron una alta protección de hasta el 89% en la reducción de trematodos (Tablas 2 y 3); Sin embargo, esta alta protección no ha sido reproducible en diferentes laboratorios y condiciones. Recientemente también se ha utilizado una combinación de vacunas recombinantes (vacunas cóctel) con eficacia variable (Tabla 3). La mayoría de los ensayos de vacunas han utilizado la vía de administración subcutánea o intramuscular. Sin embargo, algunos ensayos han utilizado la administración de vacunas mucosas con resultados prometedores. Por ejemplo, Norbury et al. (154) administraron una vacuna cóctel que contenía FhCL5 y FhCB2 por vía intranasal en ovejas, obteniendo una reducción del 40,5% de los trematodos y una reducción del 92% de la viabilidad de los huevos, mientras que la misma vacuna administrada por vía intramuscular no indujo protección. La vía oral también se ha utilizado para administrar lechuga transgénica liofilizada que expresa la cisteína proteinasa de F. hepatica (CPFhW) en ovinos y bovinos, induciendo una protección significativa en bovinos (56,2%) y una reducción del 35,5% de trematodos (no significativa) en ovinos (142).
La mayoría de los ensayos de vacunas en rumiantes han utilizado proteasas, enzimas antioxidantes o proteínas de unión a ácidos grasos como antígenos (Tablas 2, 3). Sin embargo, estas proteínas son bastante abundantes en Fasciola spp, y el bloqueo de una o varias de ellas mediante una vacuna probablemente no cause problemas graves al gusano ya que tiene otras proteínas con funciones similares. Esto podría ser una de las razones de la escasa eficacia obtenida en los numerosos ensayos vacunales realizados con estos antígenos en rumiantes.
7 Conclusión y observaciones
El lento progreso hasta la fecha en el desarrollo de una vacuna protectora para ser utilizada en el control de la fasciolosis en el ganado sugiere que se deben investigar nuevos enfoques, como el uso de nuevos antígenos, la evaluación de la inmunidad inducida por proteínas recombinantes, el uso de diferentes adyuvantes, formulaciones y sistemas de administración. A pesar de los importantes avances en el conocimiento de las interacciones huésped-parásito en la fasciolosis, un diseño más racional de la vacuna candidata requiere un conocimiento más profundo de los mecanismos y moléculas implicados en la comunicación cruzada huésped-parásito en las especies diana (ovejas, vacas, cabras, búfalos). El progreso de las tecnologías -ómicas y de los enfoques inmunoinformáticos/inmunoproteómicos debería proporcionar datos útiles en los próximos años. Un ejemplo son las nuevas tecnologías proteómicas aplicadas a los NEJs después de atravesar el intestino (158) o durante las primeras etapas de la migración hepática, que pueden ser útiles para seleccionar nuevos candidatos vacunales dirigidos contra los NEJs, una etapa del parásito que está más expuesta al sistema inmune del huésped que los adultos ubicados dentro de los conductos biliares.
Contribuciones de los autores
LF-V: Escritura: borrador original. MR-C: Redacción: borrador original. GH-T: Redacción, revisión y edición. ÁM-M: Redacción, revisión y edición. FM-M: Redacción, revisión y edición. RZ: Escribir, revisar y editar. LB: Escribir, revisar y editar. PR-M: Redacción, revisión y edición. VM-H: Conceptualización, Redacción (borrador original), Redacción (revisión y edición). JP: Conceptualización, Redacción (borrador original), Redacción (revisión y edición).
Financiación
El/los autor/es declaran/n que se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo. El trabajo ha sido apoyado por la Subvención Nacional PID2019-108782RB-C21. VM-H contó con el apoyo financiero de la Junta de Andalucía (Consejería de Conocimiento, Investigación y Universidad)-FEDER (proyecto P18-RTJ-1956).
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Mehmood K, Zhang H, Sabir AJ, Abbas RZ, Ijaz M, Durrani AZ, et al. Una revisión sobre epidemiología, prevalencia global y pérdidas económicas de fasciolosis en rumiantes. Microb Pathog. (2017) 109:253–62. doi: 10.1016/j.micpath.2017.06.006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Hayward AD, Skuce PJ, McNeilly TN. La influencia de la infección por trematodos hepáticos en la producción en ovejas y bovinos: un metaanálisis. Int J Parasitol. (2021) 51:913–24. doi: 10.1016/j.ijpara.2021.02.006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Dittmar K, Teegen WR. La presencia de Fasciola hepatica (duela hepática) en humanos y ganado de un yacimiento arqueológico de 4.500 años de antigüedad en el valle de Saale-Unstrut, Alemania. Mem Inst Oswaldo Cruz. (2003) 98(Supl. 1):141–3. doi: 10.1590/S0074-02762003000900021
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. QUIÉN. Enfermedades tropicales desatendidas. Ginebra: Organización Mundial de la Salud (2017). Disponible en línea en: http://www.who.int/neglected_diseases/diseases/en/ (consultado el 30 de mayo de 2020).
5. Cabada MM, Blanco AC Jr. Nuevos avances en epidemiología, diagnóstico y tratamiento de la fascioliasis. Curr Opin Infect Dis. (2012) 25:518–22. doi: 10.1097/QCO.0b013e3283567b7e
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Nyindo M, Lukambagire AH. Fascioliasis: una infección zoonótica por trematodos en curso. Biomed Res Int. (2015) 2015:786195. doi: 10.1155/2015/786195
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Mas-Coma S, Valero MA, Bargues MD. Fascioliasis. Adv Exp Med Biol. (2019) 1154:71–103. doi: 10.1007/978-3-030-18616-6_4
8. Mas-Coma S. Epidemiología de la fascioliasis en áreas endémicas humanas. J Helminthol. (2005) 79:207–16. doi: 10.1079/JOH2005296
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Keiser J, Utzinger J. Trematodiasis transmitidas por los alimentos. Clin Microbiol Rev. (2009) 22:466–83. doi: 10.1128/CMR.00012-09
10. Carson A, Jones B, Grove-White D. Manejo de la duela hepática en granjas de montaña. Rec. Veterinario (2022) 191:115–7. DOI: 10.1002/VTR.2105
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Fairweather I. Reducir la amenaza futura de la duela (hepática): ¿perspectiva realista o fantasía quijotesca? Parasitol veterinario. (2011) 180:133–43. doi: 10.1016/j.vetpar.2011.05.034
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Carmona C, Agravio JF. Fasciolosis en América del Sur: desafíos epidemiológicos y de control. J Helminthol. (2017) 91:99–109. doi: 10.1017/S0022149X16000560
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Spithill TW, Toet H, Rathinasamy V, Zerna G, Swan J, Cameron T, et al. Vacunas para la fasciola: nuevas ideas para un viejo problema. En:Dalton, JP, , editor. Fasciolosis 2ª edn. Cambridge: CABI Publishing (2022). págs. 379-422. doi: 10.1079/9781789246162.0012
14. Beesley NJ, Caminade C, Charlier J, Flynn RJ, Hodgkinson JE, Martinez-Moreno A, et al. Fasciola y fasciolosis en rumiantes en Europa: identificación de necesidades de investigación. Transbound Emerg Dis. (2018) 65(Supl. 1):199–216. doi: 10.1111/tbed.12682
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Cwiklinski K, Drysdale O, López Corrales J, Corripio-Miyar Y, De Marco Verissimo C, Jewhurst H, et al. Dirigirse al equilibrio proteasa/antiproteasa secretado como estrategia vacunal contra el helminto Fasciola hepatica. Vacunas. (2022) 10:155. doi: 10.3390/vaccines10020155
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Agatsuma T, Arakawa Y, Iwagami M, Honzako Y, Cahyaningsih U, Kang SY, et al. Evidencia molecular de hibridación natural entre Fasciola hepatica y F. gigantica. Parasitol Int. (2000) 49:231–8. doi: 10.1016/S1383-5769(00)00051-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Lotfy WM, Brant SV, DeJong RJ, Le TH, Demiaszkiewicz A, Rajapakse RP, et al. Orígenes evolutivos, diversificación y biogeografía de trematodos hepáticos (Digenea, Fasciolidae). Am J Trop Med Hyg. (2008) 79:248–55. doi: 10.4269/ajtmh.2008.79.248
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Marcilla A, Dra. Bargues, Mas-Coma S. Ensayo PCR-RFLP para la distinción entre Fasciola hepatica y Fasciola gigantica. Sondas de células molares. (2002) 16:327–33. doi: 10.1006/mcpr.2002.0429
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Alasaad S, Soriguer RC, Abu-Madi M, El Behairy A, Jowers MJ, Baños PD, et al. Un ensayo basado en PCR en tiempo real de TaqMan para la identificación de Fasciola spp. Vet Parasitol. (2011) 179:266–71. doi: 10.1016/j.vetpar.2011.01.059
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Calvani NED, Ichikawa-Seki M, Bush RD, Khounsy S, Šlapeta J. Qué especie se encuentra en las heces en un momento de movimientos ganaderos globales: ensayos de genotipado de polimorfismo de nucleótido único para la diferenciación de Fasciola spp. Int J Parasitol. (2020) 50:91–101. doi: 10.1016/j.ijpara.2019.12.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Calvani NED, Šlapeta J. Fasciola gigantica e híbridos de Fasciola en el sudeste asiático. En:Dalton, JP, , editor. Fasciolosis 2ª edn. Cambridge: CABI Publishing (2022). págs. 423-60. doi: 10.1079/9781789246162.0013
22. Torgerson P, Claxton J. Epidemiología y control. En:Dalton JP, , editor. Fasciolosis. Wallingford: CAB International (1999). págs. 113-49.
23. Correa AC, Escobar JS, Durand P, Renaud F, David P, Jarne P, et al. Cerrando brechas en la filogenia molecular de los Lymnaeidae (Gastropoda: Pulmonata), vectores de Fascioliasis. BMC Evol Biol. (2010) 10:381. doi: 10.1186/1471-2148-10-381
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Wilson RA, Pullin R, Denison J. Una investigación del mecanismo de infección por trematodos digenéticos: la penetración del miracidium de Fasciola hepatica en su caracol huésped Lymnaea truncatula. Parasitología. (1971) 63:491–506. doi: 10.1017/S003118200008001X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Tomás AP. La historia natural de la duela hepática y la prevención de la podredumbre. J R Agric Soc. (1883) 19:276–305.
26. Tomás AP. La historia de vida de la duela hepática (Fasciola hepatica). Q J Microsc Sci. (1883) 23:99–133. doi: 10.1242/jcs.s2-23.89.99
27. Dawes B, Hughes DL. Fascioliasis: las etapas invasivas de Fasciola hepatica en huéspedes mamíferos. Adv Parasitol. (1964) 2:97–168. doi: 10.1016/S0065-308X(08)60587-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Dow C, Ross JG, Todd JR. Histopatología de las infecciones por Fasciola hepatica en ovejas. Parasitología. (1968) 58:129–35. doi: 10.1017/S0031182000073480
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Boray JC. Fascioliasis experimental en Australia. Adv Parasitol. (1969) 7:95–210. doi: 10.1016/S0065-308X(08)60435-2
30. Zafra R, Pérez-Écija RA, Buffoni L, Moreno P, Bautista MJ, Martínez-Moreno A, et al. Cambios peritoneales y hepáticos tempranos y tardíos en cabras inmunizadas con catepsina L1 recombinante e infectadas con Fasciola hepatica. J Comp Pathol. (2013) 148:373–84. doi: 10.1016/j.jcpa.2012.08.007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Molina-Hernández V, Mulcahy G, Pérez J, Martínez-Moreno Á, Donnelly S, O’Neill SM, et al. Vacuna contra la fasciola hepática: puede que aún no hayamos llegado a ese punto, pero estamos en el camino correcto. Parasitol veterinario. (2015) 208:101–11. doi: 10.1016/j.vetpar.2015.01.004
32. López P, Tuñón MJ, González P, Diez N, Bravo AM, González-Gallego J. Proliferación ductular y función secretora hepática en fascioliasis experimental. Exp parasitol. (1993) 77:36–42. doi: 10.1006/expr.1993.1058
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Isseroff H, Sawma JT, Reino D. Fascioliasis: papel de la prolina en la hiperplasia de las vías biliares. Ciencia. (1977) 198:1157–9. doi: 10.1126/science.929191
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Modavi S, Isseroff H. Fasciola hepatica: depósito de colágeno y otras histopatologías en el conducto biliar del huésped de rata causado por el parásito y por infusión de prolina. Exp parasitol. (1984) 58:239–44. doi: 10.1016/0014-4894(84)90040-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Pérez J, Ortega J, Moreno T, Morrondo P, López-Sández C, Martínez-Moreno A. Estudio patológico e inmunohistoquímico del hígado y ganglios linfáticos hepáticos de ovejas reinfectadas crónicamente con Fasciola hepatica, con o sin tratamiento con triclabendazol. J Comp Pathol. (2002) 127:30–6. doi: 10.1053/jcpa.2002.0561
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Zafra R, Pérez-Écija RA, Buffoni L, Pacheco IL, Martínez-Moreno A, LaCourse EJ, et al. Cambios hepáticos y peritoneales tempranos y respuesta inmune en cabras vacunadas con una clase sigma de glutatión transferasa recombinante y desafiadas con Fasciola hepatica. Res Vet Sci. (2013) 94:602–9. doi: 10.1016/j.rvsc.2012.10.026
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Martínez-Moreno A, Jiménez-Luque V, Moreno T, Redondo ES, de las Mulas JM, Pérez J. Patología hepática y respuesta inmune en infecciones experimentales por Fasciola hepatica en cabras. Parasitol veterinario. (1999) 82:19–33. doi: 10.1016/S0304-4017(98)00262-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Aldridge A, O’Neill SM. Los antígenos tegumentales de Fasciola hepatica inducen células T similares a las anérgicas a través de las células dendríticas de una manera dependiente del receptor de manosa. Eur J Immunol. (2016) 46:1180–92. doi: 10.1002/eji.201545905
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. García-Campos A, Ravidà A, Nguyen DL, Cwiklinski K, Dalton JP, Hokke CH, et al. Las glicoproteínas del tegumento y las catepsinas de los juveniles recién excysted de Fasciola hepatica son portadores de N-glicanos manosisídicos y paucimannosídicos. PLoS negl trop dis. (2016) 10:e0004688. doi: 10.1371/journal.pntd.0004688
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Dowling DJ, Hamilton CM, Donnelly S, La Course J, Brophy PM, Dalton J, et al. Los principales antígenos secretores del helminto Fasciola hepatica activan un fenotipo de células dendríticas supresoras que atenúa las células Th17 pero no activa las respuestas inmunitarias Th2. Infectar a Immun. (2010) 78:793–801. doi: 10.1128/IAI.00573-09
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Flynn RJ, Mulcahy G. Posible papel de los receptores tipo Toll en la interacción de los productos excretores/secretores de Fasciola hepatica con los macrófagos bovinos. Infectar a Immun. (2008) 76:678–84. doi: 10.1128/IAI.00732-07
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. van Milligen FJ, Cornelissen JB, Gaasenbeek CP, Bokhout BA. Un nuevo modelo de infección ex vivo en ratas para estudiar la inmunidad protectora contra Fasciola hepatica a nivel intestinal. J Métodos Immunol. (1998) 213:183–90. doi: 10.1016/S0022-1759(98)00026-X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Prussin C, Metcalfe DD. 4. IgE, mastocitos, basófilos y eosinófilos. J Alergia Clin Immunol. (2003) 111:S486-94. doi: 10.1067/mai.2003.120
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Gurish MF, Bryce PJ, Tao H, Kisselgof AB, Thornton EM, Miller HR, et al. La IgE mejora la eliminación de parásitos y regula las respuestas de los mastocitos en ratones infectados con Trichinella spiralis. J Immunol. (2004) 172:1139–45. doi: 10.4049/jimmunol.172.2.1139
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Yoshimoto T, Nakanishi K. Funciones de la IL-18 en basófilos y mastocitos. Allergol Int. (2006) 55:105–13. doi: 10.2332/allergolint.55.105
Resumen de PubMed | Texto completo de CrossRef | Google Académico
46. Doy TG, Hughes DL, Harness E. Hipersensibilidad en ratas infectadas con Fasciola hepatica: posible papel en la protección contra una infección de desafío. Res Vet Sci. (1981) 30:360–3. doi: 10.1016/S0034-5288(18)32558-X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
47. Wicki P, Schwalbach B, Charbon JL, Steiner A, Lang M, Loup F, et al. Reacción celular intestinal del ganado bovino después de la infección por Fasciola hepatica. Schweiz Arch Tierheilkd. (1991) 133:429–37.
48. Bossaert K, Jacquinet E, Saunders J, Farnir F, Losson B. Respuesta inmunitaria mediada por células en terneros a infecciones de dosis única, goteo y desafío con Fasciola hepatica. Parasitol veterinario. (2000) 88:17–34. doi: 10.1016/S0304-4017(99)00200-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
49. McCole DF, Doherty ML, Baird AW, Davis WC, McGill K, Torgerson PR. Proliferación estimulada por concanavalina a de poblaciones de linfocitos empobrecidos en subconjuntos de células T aisladas de ganado infectado con Fasciola hepatica. Veterinario Inmunol Inmunopatíaco. (1998) 66:289–300. doi: 10.1016/S0165-2427(98)00207-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
50. Escamilla A, Pérez-Caballero R, Zafra R, Bautista MJ, Pacheco IL, Ruiz MT, et al. Apoptosis de leucocitos peritoneales durante las primeras etapas de las infecciones por Fasciola hepatica en ovejas. Parasitol veterinario. (2017) 238:49–53. doi: 10.1016/j.vetpar.2017.03.015
Resumen de PubMed | Texto completo de CrossRef | Google Académico
51. Molina EC, Skerratt LF. Respuestas celulares y humorales en hígado de bovinos y búfalos infectados con una dosis única de Fasciola gigantica. Parasitol veterinario. (2005) 131:157–63. doi: 10.1016/j.vetpar.2005.04.028
Resumen de PubMed | Texto completo de CrossRef | Google Académico
52. Huntley JF, Newlands G, Miller HR. Aislamiento y caracterización de leucocitos glóbulos: su derivación a partir de mastocitos mucosos en ovejas parasitadas. Parásitos Inmunológicos. (1984) 6:371–90. doi: 10.1111/j.1365-3024.1984.tb00809.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
53. Stankiewicz M, Jonas WE, Douch PC, Rabel B, Bisset S, Cabaj W. Leucocitos glóbulos en la luz del intestino delgado y el estado de resistencia de ovejas infectadas con nematodos parásitos. J Parasitol. (1993) 79:940–5. doi: 10.2307/3283734
Resumen de PubMed | Texto completo de CrossRef | Google Académico
54. Balic A, Bowles VM, Meeusen EN. Inmunobiología de las infecciones por nematodos gastrointestinales en rumiantes. Adv Parasitol. (2000) 45:181–241. doi: 10.1016/S0065-308X(00)45005-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
55. Delves PJ, Martin SJ, Burton DR, Roitt IM. Inmunología Esencial de Roitt, 13ª ed. Wiley-Blackwell (2014).
56. Piedrafita D, Estuningsih E, Pleasance J, Prowse R, Raadsma HW, Meeusen EN, et al. Las células de lavado peritoneal de las ovejas de cola fina de Indonesia median la citotoxicidad del radical superóxido dependiente de anticuerpos in vitro contra los juveniles recién extraídos de Fasciola gigantica, pero no contra los juveniles de Fasciola hepatica. Infectar a Immun. (2007) 75:1954–63. doi: 10.1128/IAI.01034-06
Resumen de PubMed | Texto completo de CrossRef | Google Académico
57. Bossaert K, Farnir F, Leclipteux T, Protz M, Lonneux JF, Losson B. Respuesta inmune humoral en terneros a infecciones de dosis única, goteo y desafío con Fasciola hepatica. Parasitol veterinario. (2000) 87:103–23. doi: 10.1016/S0304-4017(99)00177-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
58. Osman MM, Rashwan E, Farag HF. Actividad fagocítica de los neutrófilos en la fasciolosis humana antes y después del tratamiento. J Egipto Soc Parasitol. (1995) 25:321–7.
59. Martínez-Moreno A, Jiménez-Luque V, Cámara S, Martínez-Moreno FJ, Acosta I, Hernández S. Respuestas oxidativas durante la fagocitosis bacteriana de leucocitos polimorfonucleares en cabras infectadas primaria y secundariamente por Fasciola hepática. Int J Parasitol. (2000) 30:1013–7. doi: 10.1016/S0020-7519(00)00082-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
60. Chauvin A, Moreau E, Boulard C. Respuestas de ovejas infectadas por Fasciola hepatica a varios niveles de infección. Res. Veterinaria. (2001) 32:87–92. doi: 10.1051/vetres:2001113
Resumen de PubMed | Texto completo de CrossRef | Google Académico
61. Zhang WY, Moreau E, Hope JC, Howard CJ, Huang WY, Chauvin A. Fasciola hepatica y Fasciola gigantica: comparación de la respuesta celular a la infección experimental en ovejas. Exp parasitol. (2005) 111:154–9. doi: 10.1016/j.exppara.2005.06.005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
62. Zafra R, Buffoni L, Martínez-Moreno A, Pérez-Ecija A, Martinez-Moreno FJ, Pérez J, et al. estudio del hígado de cabras inmunizadas con un péptido sintético del antígeno Sm14 y desafiadas con Fasciola hepatica. J Comp Pathol. (2008) 139:169–76. doi: 10.1016/j.jcpa.2008.06.004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
63. Wedrychowicz H, Kesik M, Kaliniak M, Kozak-Cieszczyk M, Jedlina-Panasiuk L, Jaros S, et al. Potencial vacunal de cuerpos de inclusión que contienen cisteína proteinasa de Fasciola hepatica en terneros y corderos desafiados experimentalmente con metacercarias del trematodo. Parasitol veterinario. (2007) 147:77–88. doi: 10.1016/j.vetpar.2007.03.023
Resumen de PubMed | Texto completo de CrossRef | Google Académico
64. Ruiz-Campillo MT, Molina Hernandez V, Escamilla A, Stevenson M, Perez J, Martinez-Moreno A, et al. Firmas inmunitarias de patogénesis en el compartimento peritoneal durante la infección temprana de ovejas con Fasciola hepatica. Sci Rep. (2017) 7:2782. doi: 10.1038/s41598-017-03094-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
65. Escamilla A, Bautista MJ, Zafra R, Pacheco IL, Ruiz MT, Martínez-Cruz S, et al. Fasciola hepatica induce la apoptosis eosinófila en las etapas migratoria y biliar de la infección en ovejas. Parasitol veterinario. (2016) 216:84–8. doi: 10.1016/j.vetpar.2015.12.013
Resumen de PubMed | Texto completo de CrossRef | Google Académico
66. Meeusen E, Lee CS, Rickard MD, Brandon MR. Respuestas celulares durante la infección por trematodos hepáticos en ovejas y su evasión por el parásito. Parásitos Inmunológicos. (1995) 17:37–45. doi: 10.1111/j.1365-3024.1995.tb00964.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
67. Pleasance J, Raadsma HW, Estuningsih SE, Widjajanti S, Meeusen E, Piedrafita D. Resistencia innata y adaptativa de las ovejas de cola delgada de Indonesia a la duela hepática: un análisis comparativo de la infección por Fasciola gigantica y Fasciola hepática. Parasitol veterinario. (2011) 178:264–72. doi: 10.1016/j.vetpar.2011.01.037
Resumen de PubMed | Texto completo de CrossRef | Google Académico
68. Piedrafita D, Parsons JC, Sandeman RM, Wood PR, Estuningsih SE, Partoutomo S, et al. La citotoxicidad mediada por células dependiente de anticuerpos para juveniles recién excysted de Fasciola hepatica in vitro está mediada por intermediarios de nitrógeno reactivos. Parásitos Inmunológicos. (2001) 23:473–82. doi: 10.1046/j.1365-3024.2001.00404.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
69. Golden O, Flynn RJ, Read C, Sekiya M, Donnelly SM, Stack C, et al. Protección del ganado bovino frente a una infección natural de Fasciola hepatica mediante vacunación con catepsina L1 recombinante (rFhCL1). Vacuna. (2010) 28:5551–7. doi: 10.1016/j.vaccine.2010.06.039
Resumen de PubMed | Texto completo de CrossRef | Google Académico
70. Sulaiman AA, Zolnierczyk K, Japa O, Owen JP, Maddison BC, Emes RD, et al. Un factor de crecimiento derivado de un parásito trematodo se une e influye en las funciones inmunitarias del huésped a través de complejos receptores de citocinas del huésped. PLoS Pathog. (2016) 12:e1005991. doi: 10.1371/journal.ppat.1005991
Resumen de PubMed | Texto completo de CrossRef | Google Académico
71. Donnelly S, O’Neill SM, Sekiya M, Mulcahy G, Dalton JP. La tiorredoxina peroxidasa secretada por Fasciola hepatica induce la activación alternativa de los macrófagos. Infectar a Immun. (2005) 73:166–73. doi: 10.1128/IAI.73.1.166-173.2005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
72. Donnelly S, Stack CM, O’Neill SM, Sayed AA, Williams DL, Dalton JP. La peroxirredoxina Helminth 2-Cys impulsa las respuestas Th2 a través de un mecanismo que involucra macrófagos activados alternativamente. FASEB J. (2008) 22:4022–32. doi: 10.1096/fj.08-106278
Resumen de PubMed | Texto completo de CrossRef | Google Académico
73. Ruiz-Campillo MT, Molina-Hernández V, Pérez J, Pacheco IL, Pérez R, Escamilla A, et al. Estudio del inmunofenotipo de macrófagos peritoneales en ovejas infectadas experimentalmente con Fasciola hepatica. Parasitol veterinario. (2018) 257:34–9. doi: 10.1016/j.vetpar.2018.05.019
Resumen de PubMed | Texto completo de CrossRef | Google Académico
74. Chung JY, Bae YA, Yun DH, Yang HJ, Kong Y. La fascioliasis murina experimental deriva de una inmunosupresión temprana con niveles elevados de TGF-β e IL-4. Parasitol coreano J. (2012) 50:301–8. doi: 10.3347/kjp.2012.50.4.301
Resumen de PubMed | Texto completo de CrossRef | Google Académico
75. Clery D, Torgerson P, Mulcahy G. Respuestas inmunitarias del ganado adulto infectado crónicamente a Fasciola hepatica. Parasitol veterinario. (1996) 62:71–82. doi: 10.1016/0304-4017(95)00858-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
76. Phiri IK, Phiri AM, Harrison LJ. Respuestas del isotipo de anticuerpos séricos de ovejas y bovinos infectados por Fasciola a productos excretores y secretores de especies de Fasciola. Parasitol veterinario. (2006) 141:234–42. doi: 10.1016/j.vetpar.2006.05.019
Resumen de PubMed | Texto completo de CrossRef | Google Académico
77. Mulcahy G, O’Connor F, McGonigle S, Dowd A, Clery DG, Andrews SJ, et al. Correlación del título de anticuerpos específicos y la avidez con la protección en bovinos inmunizados contra Fasciola hepatica. Vacuna. (1998) 16:932–9. doi: 10.1016/S0264-410X(97)00289-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
78. Mulcahy G, Dalton JP. Catepsina L proteinasas como vacunas contra la infección por Fasciola hepatica (trematodos hepáticos) en rumiantes. Res Vet Sci. (2001) 70:83–6. doi: 10.1053/rvsc.2000.0425
Resumen de PubMed | Texto completo de CrossRef | Google Académico
79. O’Neill SM, Brady MT, Callanan JJ, Mulcahy G, Joyce P, Mills KH, et al. La infección por Fasciola hepatica regula a la baja las respuestas Th1 en ratones. Parásitos Inmunológicos. (2000) 22:147–55. doi: 10.1046/j.1365-3024.2000.00290.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
80. Pacheco IL, Abril N, Morales-Prieto N, Bautista MJ, Zafra R, Escamilla A, et al. Equilibrio Th1/Th2 en el hígado y los ganglios linfáticos hepáticos de ovejas vacunadas y no vacunadas durante las etapas agudas de la infección por Fasciola hepatica. Parasitol veterinario. (2017) 238:61–5. doi: 10.1016/j.vetpar.2017.03.022
Resumen de PubMed | Texto completo de CrossRef | Google Académico
81. Ruiz-Campillo MT, Barrero-Torres DM, Abril N, Pérez J, Zafra R, Buffoni L, et al. Las primoinfecciones y reinfecciones por Fasciola hepatica en ovejas impulsan distintas respuestas inmunitarias Th1/Th2/Treg en el hígado y los ganglios linfáticos hepáticos en etapas tempranas y tardías. Res. Veterinaria. (2023) 54:2. doi: 10.1186/s13567-022-01129-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
82. Meng Z, Zhai L, Guo Y, Zheng M, Li L, Wen C, et al. La infección secundaria de Fasciola gigantica en búfalos muestra un patrón similar de secreción sérica de citocinas que en la infección primaria. Front Vet Sci. (2023) 10:1109947. doi: 10.3389/fvets.2023.1109947
Resumen de PubMed | Texto completo de CrossRef | Google Académico
83. Fu Y, Chryssafidis AL, Browne JA, O’Sullivan J, McGettigan PA, Mulcahy G. Estudio transcriptómico sobre las respuestas inmunitarias ovinas a la infección por Fasciola hepática. PLoS negl trop dis. (2016) 10:E0005015. doi: 10.1371/journal.pntd.0005015
Resumen de PubMed | Texto completo de CrossRef | Google Académico
84. Haçariz O, Sayers G, Baykal AT. Un enfoque proteómico para investigar la distribución y abundancia de proteínas de superficie e internas de Fasciola hepatica durante la etapa crónica de la infección natural por trematodos hepáticos en bovinos. J Proteome Res. (2012) 11:3592–604. DOI: 10.1021/PR300015P
Resumen de PubMed | Texto completo de CrossRef | Google Académico
85. Ravidà A, Aldridge AM, Driessen NN, Heus FA, Hokke CH, O’Neill SM. Las glicoproteínas de la cubierta superficial de Fasciola hepatica contienen N-glicanos manosilados y fosforilados y exhiben propiedades inmunomoduladoras independientes del receptor de manosa. PLoS negl trop dis. (2016) 10:e0004601. doi: 10.1371/journal.pntd.0004601
Resumen de PubMed | Texto completo de CrossRef | Google Académico
86. Sánchez-López CM, Trelis M, Jara L, Cantalapiedra F, Marcilla A, Bernal D. Diversidad de vesículas extracelulares de diferentes etapas de desarrollo de Fasciola hepatica. Int J Parasitol. (2020) 50:663–9. doi: 10.1016/j.ijpara.2020.03.011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
87. Murphy A, Cwiklinski K, Lalor R, O’Connell B, Robinson MW, Gerlach J, et al. Las vesículas extracelulares de Fasciola hepatica aisladas de productos excretores-secretores mediante un método de flujo por gravedad modulan el fenotipo y la actividad de las células dendríticas. PLoS negl trop dis. (2020) 14:e0008626. doi: 10.1371/journal.pntd.0008626
Resumen de PubMed | Texto completo de CrossRef | Google Académico
88. Fontenla S, Langleib M, de la Torre-Escudero E, Domínguez MF, Robinson MW, Tort J. Papel de los ARN pequeños de Fasciola hepatica en la interacción con el huésped mamífero. Las células frontales infectan el microbiol. (2022) 11:812141. doi: 10.3389/fcimb.2021.812141
Resumen de PubMed | Texto completo de CrossRef | Google Académico
89. Herron CM, O’Connor A, Robb E, McCammick E, Hill C, Marks NJ, et al. Regulación del desarrollo y predicción funcional de microRNAs en un miRNoma expandido de Fasciola hepática. Las células frontales infectan el microbiol. (2022) 12:811123. doi: 10.3389/fcimb.2022.811123
Resumen de PubMed | Texto completo de CrossRef | Google Académico
90. Ricafrente A, Cwiklinski K, Nguyen H, Dalton JP, Tran N, Donnelly S. Los miARN específicos de la etapa regulan la expresión génica asociada con el crecimiento, el desarrollo y la interacción parásito-huésped durante la migración intramamífera del parásito helmintos zoonóticos Fasciola hepatica. BMC Genómica. (2022) 23:419. doi: 10.1186/s12864-022-08644-z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
91. Fromm B, Ovchinnikov V, Høye E, Bernal D, Hackenberg M, Marcilla A. Sobre la presencia y funciones inmunorreguladoras de microRNAs extracelulares en el trematodo Fasciola hepatica. Parásitos Inmunológicos. (2017) 39. doi: 10.1111/pim.12399
Resumen de PubMed | Texto completo de CrossRef | Google Académico
92. Cancela M, Acosta D, Rinaldi G, Silva E, Durán R, Roche L, et al. Un repertorio distintivo de catepsinas se expresa en los juveniles invasivos de Fasciola hepatica. Biochimie. (2008) 90:1461–75. doi: 10.1016/j.biochi.2008.04.020
Resumen de PubMed | Texto completo de CrossRef | Google Académico
93. Robinson MW, Dalton JP, Donnelly S. Proteasas de catepsina del patógeno helminto: es un asunto de familia. Tendencias Biochem Sci. (2008) 33:601–8. doi: 10.1016/j.tibs.2008.09.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
94. Xifeng W, Jiahua Z, Ningxing L, Guowu Z, Yunxia S, Xuepeng C, et al. El papel regulador de la proteína GSTO1 de Fasciola hepatica en la expresión de citoquinas inflamatorias y la apoptosis en macrófagos murinos. Acta Trop. (2023) 245:106977. doi: 10.1016/j.actatropica.2023.106977
Resumen de PubMed | Texto completo de CrossRef | Google Académico
95. Carmona C, Dowd AJ, Smith AM, Dalton JP. La catepsina L proteinasa secretada por Fasciola hepatica in vitro impide la unión de eosinófilos mediada por anticuerpos a los juveniles recién excididos. Mol Biochem Parasitol. (1993) 62:9–17. doi: 10.1016/0166-6851(93)90172-T
Resumen de PubMed | Texto completo de CrossRef | Google Académico
96. Mebius MM, Op Heij JMJ, Tielens AGM, de Groot PG, Urbanus RT, van Hellemond JJ. El fibrinógeno y la fibrina son sustratos novedosos para las peptidasas de catepsina L de Fasciola hepatica. Mol Biochem Parasitol. (2018) 221:10–3. doi: 10.1016/j.molbiopara.2018.02.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
97. Falcón CR, Masih D, Gatti G, Sanchez MC, Motrán CC, Cervi L. Fasciola hepatica La molécula tipo Kunitz disminuye la activación de las células dendríticas y su capacidad para inducir respuestas inflamatorias. PLoS UNO. (2014) 9:e114505. doi: 10.1371/journal.pone.0114505
Resumen de PubMed | Texto completo de CrossRef | Google Académico
98. Ramos-Benítez MJ, Ruiz-Jiménez C, Aguayo V, Espino AM. La proteína recombinante de unión a ácidos grasos Fasciola hepatica suprime la estimulación del receptor tipo Toll en respuesta a múltiples ligandos bacterianos. Sci Rep. (2017) 7:5455. DOI: 10.1038/s41598-017-05735-w
Resumen de PubMed | Texto completo de CrossRef | Google Académico
99. Ruiz-Jiménez C, Celias D, Valdés B, Ramos-Pérez WD, Cervi L, Espino AM. La proteína de unión a ácidos grasos Fasciola hepatica (Fh12) induce apoptosis y propiedades tolerogénicas en células dendríticas derivadas de la médula ósea murina. Exp parasitol. (2021) 231:108174. doi: 10.1016/j.exppara.2021.108174
Resumen de PubMed | Texto completo de CrossRef | Google Académico
100. Alvarado R, O’Brien B, Tanaka A, Dalton JP, Donnelly S. Un péptido derivado de helmintos parásitos que se dirige al lisosoma de macrófagos es una nueva opción terapéutica para las enfermedades autoinmunes. Inmunobiología. (2015) 220:262–9. doi: 10.1016/j.imbio.2014.11.008
Resumen de PubMed | Texto completo de CrossRef | Google Académico
101. Cancela M, Santos GB, Carmona C, Ferreira HB, Tort JF, Zaha A. Gen codificante de mucina de Fasciola hepatica: expresión, variabilidad y su relevancia potencial en la relación huésped-parásito. Parasitología. (2015) 142:1673–81. doi: 10.1017/S0031182015001134
Resumen de PubMed | Texto completo de CrossRef | Google Académico
102. Noya V, Brossard N, Rodríguez E, Dergan-Dylon LS, Carmona C, Rabinovich GA, et al. El péptido similar a la mucina de Fasciola hepatica instruye a las células dendríticas con actividad polarizadora Th1 específica del parásito. Sci Rep. (2017) 7:40615. doi: 10.1038/srep40615
Resumen de PubMed | Texto completo de CrossRef | Google Académico
103. De Marco Verissimo C, Jewhurst HL, Dobó J, Gál P, Dalton JP, Cwiklinski K. Fasciola hepatica es refractaria a la muerte complementaria al prevenir la unión de la lectina de unión a manosa (MBL) e inhibir las serina proteasas asociadas a MBL (MASP) con serpinas. PLoS Pathog. (2022) 18:e1010226. doi: 10.1371/journal.ppat.1010226
Resumen de PubMed | Texto completo de CrossRef | Google Académico
104. Zhang K, Liu Y, Zhang G, Wang X, Li Z, Shang Y, et al. Características moleculares y potente actividad inmunomoduladora de la cistatina de Fasciola hepatica. Parasitol coreano J. (2022) 60:117–26. doi: 10.3347/kjp.2022.60.2.117
Resumen de PubMed | Texto completo de CrossRef | Google Académico
105. Zawistowska-Deniziak A, Wasyl K, Norbury LJ, Wesołowska A, Bień J, Grodzik M, et al. Caracterización y expresión diferencial de alelos de catepsina L3 de Fasciola hepatica. Mol Biochem Parasitol. (2013) 190:27–37. doi: 10.1016/j.molbiopara.2013.06.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
106. McNulty SN, Tort JF, Rinaldi G, Fischer K, Rosa BA, Smircich P, et al. Genomas de Fasciola hepatica de las Américas revelan colonización con endobacterias neorickettsia relacionadas con los agentes de las fiebres del potomac, caballo y sennetsu humano. PLoS Genet. (2017) 13:e1006537. doi: 10.1371/journal.pgen.1006537
Resumen de PubMed | Texto completo de CrossRef | Google Académico
107. Flynn RJ, Mulcahy G, Elsheikha HM. Coordinación de la inmunidad innata y adaptativa en la infección por Fasciola hepática: implicaciones para el control. Parasitol veterinario. (2010) 169:235–40. doi: 10.1016/j.vetpar.2010.02.015
Resumen de PubMed | Texto completo de CrossRef | Google Académico
108. Tliba O, Sibille P, Boulard C, Chauvin A. Respuesta inmune hepática local en ratas durante la infección primaria con Fasciola hepatica. Parásito. (2000) 7:9–18. doi: 10.1051/parásito/2000071009
Resumen de PubMed | Texto completo de CrossRef | Google Académico
109. Serradell MC, Guasconi L, Cervi L, Chiapello LS, Masih DT. Los productos excretores-secretores de Fasciola hepatica inducen la apoptosis eosinófila por un mecanismo dependiente de caspasas. Veterinario Inmunol Inmunopatíaco. (2007) 117:197–208. doi: 10.1016/j.vetimm.2007.03.007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
110. Guasconi L, Serradell MC, Masih DT. Los productos de Fasciola hepatica inducen la apoptosis de los macrófagos peritoneales. Veterinario Inmunol Inmunopatíaco. (2012) 148:359–63. doi: 10.1016/j.vetimm.2012.06.022
Resumen de PubMed | Texto completo de CrossRef | Google Académico
111. Fu Y, Browne JA, Killick K, Mulcahy G. El análisis de redes de la respuesta sistémica a la infección por Fasciola hepatica en ovejas revela cambios en la fibrosis, la apoptosis, los receptores tipo Toll 3/4 y la función de las células B. Frente Immunol. (2017) 8:485. doi: 10.3389/fimmu.2017.00485
Resumen de PubMed | Texto completo de CrossRef | Google Académico
112. García-Campos A, Correia CN, Naranjo-Lucena A, Garza-Cuartero L, Farries G, Browne JA, et al. Infección por Fasciola hepatica en bovinos: análisis de las respuestas de las células mononucleares de sangre periférica (PBMC) mediante un enfoque transcriptómico. Frente Immunol. (2019) 10:2081. doi: 10.3389/fimmu.2019.02081
Resumen de PubMed | Texto completo de CrossRef | Google Académico
113. Flynn RJ, Mulcahy G. El papel de la IL-10 y el TGF-beta en el control de la producción de IL-4 e IFN-gamma durante la infección experimental por Fasciola hepática. Int J Parasitol. (2008) 38:1673–80. doi: 10.1016/j.ijpara.2008.05.008
Resumen de PubMed | Texto completo de CrossRef | Google Académico
114. Guasconi L, Serradell MC, Garro AP, Iacobelli L, Masih DT. Las lectinas de tipo C en los macrófagos participan en la respuesta inmunomoduladora a los productos de Fasciola hepática. Inmunología. (2011) 133:386–96. doi: 10.1111/j.1365-2567.2011.03449.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
115. Flynn RJ, Irwin JA, Olivier M, Sekiya M, Dalton JP, Mulcahy G. Activación alternativa de macrófagos rumiantes por Fasciola hepatica. Veterinario Inmunol Inmunopatíaco. (2007) 120:31–40. doi: 10.1016/j.vetimm.2007.07.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
116. Garza-Cuartero L, O’Sullivan J, Blanco A, McNair J, Welsh M, Flynn RJ, et al. La infección por Fasciola hepatica reduce la carga de Mycobacterium bovis y la absorción de micobacterias y suprime la respuesta proinflamatoria. Parásitos Inmunológicos. (2016) 38:387–402. doi: 10.1111/pim.12326
Resumen de PubMed | Texto completo de CrossRef | Google Académico
117. Kreider T, Anthony RM, Urban JF Jr, Gause WC. Alternativamente, los macrófagos activados en las infecciones por helmintos. Curr Opin Immunol. (2007) 19:448–53. doi: 10.1016/j.coi.2007.07.002
118. Hamilton CM, Dowling DJ, Loscher CE, Morphew RM, Brophy PM, O’Neill SM. El antígeno tegumental de Fasciola hepatica suprime la maduración y la función de las células dendríticas. Infectar a Immun. (2009) 77:2488–98. doi: 10.1128/IAI.00919-08
Resumen de PubMed | Texto completo de CrossRef | Google Académico
119. Falcón C, Carranza F, Martínez FF, Knubel CP, Masih DT, Motrán CC, et al. Los productos excretores-secretores (ESP) de Fasciola hepatica inducen propiedades tolerogénicas en las células dendríticas mieloides. Veterinario Inmunol Inmunopatíaco. (2010) 137:36–46. doi: 10.1016/j.vetimm.2010.04.007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
120. Falcón CR, Carranza FA, Aoki P, Motrán CC, Cervi L. La transferencia adoptiva de células dendríticas pulsadas con antígenos de Fasciola hepatica y lipopolisacáridos confiere protección contra fasciolosis en ratones. J Infectar Dis. (2012) 205:506–14. doi: 10.1093/infdis/jir606
Resumen de PubMed | Texto completo de CrossRef | Google Académico
121. Vukman KV, Adams PN, O’Neill SM. El antígeno de la cubierta tegumental de Fasciola hepatica suprime la señalización de MAPK en las células dendríticas y regula al alza la expresión de SOCS3. Parásitos Inmunológicos. (2013) 35:234–8. doi: 10.1111/pim.12033
Resumen de PubMed | Texto completo de CrossRef | Google Académico
122. Mei XF, Shi W, Zhang YY, Zhu B, Wang YR, Hou LJ, et al. Los perfiles de metilación e hidroximetilación del ADN revelan el posible papel de la señalización de TLR altamente metilada en la modulación de los productos excretores/secretores (FgESP) de Fasciola gigantica de las células dendríticas de búfalo. Vectores parásitos. (2019) 12:358. doi: 10.1186/s13071-019-3615-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
123. Walsh KP, Brady MT, Finlay CM, Boon L, Mills KH. La infección por un parásito helminto atenúa la autoinmunidad a través de la supresión mediada por TGF-beta de las respuestas Th17 y Th1. J Immunol. (2009) 183:1577–86. doi: 10.4049/jimmunol.0803803
Resumen de PubMed | Texto completo de CrossRef | Google Académico
124. Rodríguez E, Kalay H, Noya V, Brossard N, Giacomini C, van Kooyk Y, et al. Fasciola hepatica glycoconjugates immunregulan las células dendríticas a través de la molécula de adhesión intercelular específica de células dendríticas-3-agarrando la anergia de células T que no induce la integrina. Sci Rep. (2017) 7:46748. doi: 10.1038/srep46748
Resumen de PubMed | Texto completo de CrossRef | Google Académico
125. Ruiz-Campillo MT, Molina-Hernández V, Bautista MJ, Pacheco IL, Zafra R, Buffoni L, et al. Caracterización de células dendríticas y células dendríticas foliculares en ganglios linfáticos hepáticos e hígado de ovejas infectadas experimentalmente con Fasciola hepatica. Res. Veterinaria. (2020) 51:33. doi: 10.1186/s13567-020-00757-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
126. Pacheco IL, Abril N, Zafra R, Molina-Hernández V, Morales-Prieto N, Bautista MJ, et al. Fasciola hepatica induce la sobreexpresión de citoquinas proinflamatorias y reguladoras de células T Foxp3 en el hígado de ovejas infectadas durante las primeras etapas de la infección. Res. Veterinaria. (2018) 49:56. doi: 10.1186/s13567-018-0550-x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
127. Taylor MD, Van Der Werf N, Maizels RM. Células T en la infección por helmintos: los reguladores y los regulados. Tendencias Immunol. (2012) 33:181–9. doi: 10.1016/j.it.2012.01.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
128. McNeilly TN, Rocchi M, Bartley Y, Brown JK, Frew D, Longhi C, et al. Supresión de la activación de linfocitos ovinos por productos excretores-secretores de larvas de teladorsagia circumcincta. Res. Veterinaria. (2013) 44:70. doi: 10.1186/1297-9716-44-70
Resumen de PubMed | Texto completo de CrossRef | Google Académico
129. Dalton JP, Robinson MW, Mulcahy G, O’Neill SM, Donnelly S. Moléculas inmunomoduladoras de Fasciola hepatica: candidatos para el desarrollo de vacunas e inmunoterapias. Parasitol veterinario. (2013) 195:272–85. doi: 10.1016/j.vetpar.2013.04.008
Resumen de PubMed | Texto completo de CrossRef | Google Académico
130. Doy TG, Hughes DL. Fasciola hepatica: sitio de resistencia a la reinfección en bovinos. Exp parasitol. (1984) 57:274–8. doi: 10.1016/0014-4894(84)90101-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
131. Piedrafita D, Raadsma HW, Prowse R, Spithill TW. Inmunología de la relación huésped-parásito en fasciolosis (Fasciola hepatica y Fasciola gigantica). Can J Zool. (2004) 82:233–50. doi: 10.1139/z03-216
132. Chauvin A, Bouvet G, Boulard C. Respuestas inmunitarias humorales y celulares a la infección primaria y secundaria experimental por Fasciola hepatica en ovejas. Int J Parasitol. (1995) 10:1227–41. doi: 10.1016/0020-7519(95)00039-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
133. Villa-Mancera A, Olivares-Pérez J, Olmedo-Juárez A, Reynoso-Palomar A. La vacuna basada en la visualización de fagos con catepsina L y productos secretores-excretores mimotopes de Fasciola hepatica induce respuestas inmunitarias celulares y humorales protectoras en ovejas. Parasitol veterinario. (2021) 289:109340. doi: 10.1016/j.vetpar.2020.109340
Resumen de PubMed | Texto completo de CrossRef | Google Académico
134. Villa-Mancera A, Reynoso-Palomar A, Utrera-Quintana F, Carreón-Luna L. Las mimotopes de catepsina L1 con adyuvante Quil A inducen una respuesta inmune Th1/Th2 y confieren una protección significativa contra la infección por Fasciola hepatica en cabras. Parasitol Res. (2014) 113:243–50. doi: 10.1007/s00436-013-3650-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
135. Toet H, Piedrafita DM, Spithill TW. Vacunas contra trematodos hepáticos en rumiantes: estrategias, avances y oportunidades futuras. Int J Parasitol. (2014) 44:915–27. doi: 10.1016/j.ijpara.2014.07.011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
136. Dalton JP, McGonigle S, Rolph TP, Andrews SJ. Inducción de inmunidad protectora en bovinos frente a la infección por Fasciola hepatica mediante vacunación con catepsina L proteinasas y con hemoglobina. Infectar a Immun. (1996) 64:5066–74. doi: 10.1128/iai.64.12.5066-5074.1996
Resumen de PubMed | Texto completo de CrossRef | Google Académico
137. Morrison CA, Colin T, Sexton JL, Bowen F, Wicker J, Friedel T, et al. Protección del ganado bovino frente a la infección por Fasciola hepatica mediante la vacunación con glutatión S-transferasa. Vacuna. (1996) 14:1603–12. doi: 10.1016/S0264-410X(96)00147-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
138. Orbegozo-Medina RA, Martínez-Sernández V, González-Warleta M, Castro-Hermida JA, Mezo M, Ubeira FM. La vacunación de ovejas con el adyuvante Quil-A amplía el repertorio de anticuerpos contra el antígeno Fasciola MF6p/FhHDM-1 y administrados conjuntamente perjudican el crecimiento y la liberación de antígenos de trematodos. Vacuna. (2018) 36:1949–57. doi: 10.1016/j.vaccine.2018.02.115®
Resumen de PubMed | Texto completo de CrossRef | Google Académico
139. Villa-Mancera A, Méndez-Mendoza M. Protección y respuestas de isotipo de anticuerpos contra Fasciola hepatica con anticuerpos específicos contra mimotopes peptídicos pIII de catepsina L1 en ovejas. Veterinario J. (2012) 194:108–12. doi: 10.1016/j.tvjl.2012.03.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
140. Villa-Mancera A, Alcalá-Canto Y, Reynoso-Palomar A, Olmedo-Juárez A, Olivares-Pérez J. Vacunación con mimotopes expuestos a catepsina L phage, solos o combinados, reduce el tamaño, la carga de trematodos, la producción de huevos y la viabilidad en ovejas infectadas experimentalmente con Fasciola hepatica. Parasitol Int. (2021) 83:102355. doi: 10.1016/j.parint.2021.102355
Resumen de PubMed | Texto completo de CrossRef | Google Académico
141. Villa-Mancera A, Alcalá-Canto Y, Olivares-Pérez J, Molina-Mendoza P, Hernández-Guzmán K, Utrera-Quintana F, et al. La vacunación con catepsina L mimotopes de Fasciola hepatica en cabras reduce la carga de gusanos, las medidas morfométricas y las estructuras reproductivas. Microb Pathog. (2021) 155:104859. doi: 10.1016/j.micpath.2021.104859
Resumen de PubMed | Texto completo de CrossRef | Google Académico
142. Wesołowska A, Kozak Ljunggren M, Jedlina L, Basałaj K, Legocki A, Wedrychowicz H, et al. Estudio preliminar de una vacuna comestible a base de lechuga que expresa la cisteína proteinasa de Fasciola hepatica para el control de la fasciolosis en el ganado. Frente Immunol. (2018) 9:2592. doi: 10.3389/fimmu.2018.02592
Resumen de PubMed | Texto completo de CrossRef | Google Académico
143. Maggioli G, Acosta D, Silveira F, Rossi S, Giacaman S, Basika T, et al. La leucina aminopeptidasa M17 asociada al intestino recombinante en combinación con diferentes adyuvantes confiere un alto nivel de protección contra la infección por Fasciola hepatica en ovejas. Vacuna. (2011) 29:9057–63. doi: 10.1016/j.vaccine.2011.09.020
Resumen de PubMed | Texto completo de CrossRef | Google Académico
144. Raina OK, Nagar G, Varghese A, Prajitha G, Alex A, Maharana BR, et al. Falta de eficacia protectora en búfalos vacunados con Fasciola gigantica, leucina, aminopeptidasa y proteínas recombinantes de peroxiredoxina. Acta Trop. (2011) 118:217–22. doi: 10.1016/j.actatropica.2011.02.008
Resumen de PubMed | Texto completo de CrossRef | Google Académico
145. López-Abán J, Casanueva P, Nogal J, Arias M, Morrondo P, Diez-Baños P, et al. Avances en el desarrollo de la vacuna contra Fasciola hepatica utilizando proteína de unión a ácidos grasos recombinantes con el sistema de adaptación adyuvante ADAD. Parasitol veterinario. (2007) 145:287–96. doi: 10.1016/j.vetpar.2006.12.017
Resumen de PubMed | Texto completo de CrossRef | Google Académico
146. Nambi PA, Yadav SC, Raina OK, Sriveny D, Saini M. Vacunación de búfalos con proteína de unión a ácidos grasos recombinantes Fasciola gigantica. Parasitol Res. (2005) 97:129–35. doi: 10.1007/s00436-005-1397-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
147. Kumar N, Anju V, Gaurav N, Chandra D, Samanta S, Gupta SC, et al. Vacunación de búfalos con Fasciola gigantica glutatión recombinante S-transferasa y proteína de unión a ácidos grasos. Parasitol Res. (2012) 110:419–26. doi: 10.1007/s00436-011-2507-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
148. Buffoni L, Martínez-Moreno FJ, Zafra R, Mendes RE, Pérez-Écija A, Sekiya M, et al. Respuesta inmune humoral en cabras inmunizadas con catepsina L1, peroxiredoxina y antígeno Sm14 y desafiadas experimentalmente con Fasciola hepatica. Parasitol veterinario. (2012) 185:315–21. doi: 10.1016/j.vetpar.2011.09.027
Resumen de PubMed | Texto completo de CrossRef | Google Académico
149. Maggioli G, Bottini G, Basika T, Alonzo P, Salinas G, Carmona C. La inmunización con Fasciola hepatica tiorredoxina glutatión reductasa no logró conferir protección contra la fasciolosis en bovinos. Parasitol veterinario. (2016) 224:13–9. doi: 10.1016/j.vetpar.2016.05.007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
150. Wesołowska A, Basałaj K, Zawistowska-Deniziak A, Januszkiewicz K, Kozak Ljunggren M, Jedlina L, et al. El fracaso de un régimen de refuerzo de proteínas y potenciación de proteínas de ADN y la focalización mediada por CTLA-4 para mejorar la potencia de una vacuna de ADN que codifica la fosfoglicerato quinasa de Fasciola hepatica en ovejas. Veterinario Inmunol Inmunopatíaco. (2019) 217:109941. doi: 10.1016/j.vetimm.2019.109941
Resumen de PubMed | Texto completo de CrossRef | Google Académico
151. Pérez-Caballero R, Siles-Lucas M, González-Miguel J, Martínez-Moreno FJ, Escamilla A, Pérez J, et al. Estudio anatomopatológico, inmunológico y parasitológico de ovejas vacunadas con la proteína recombinante 14-3-3z e infectadas experimentalmente con Fasciola hepatica. Veterinario Inmunol Inmunopatíaco. (2018) 202:115–21. doi: 10.1016/j.vetimm.2018.07.006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
152. Zerna G, Rathinasamy VA, Toet H, Anderson G, Dempster R, Spithill TW, et al. Evaluación de la inmunogenicidad y eficacia del adyuvante LTB de la subunidad LTB de la enterotoxina B termolábil de Fasciola hepatica (TSP2) fusionado con E. coli después de la vacunación intranasal del bovino. Vacunas. (2) 2021:9. doi: 1213.10/vacunas3390
Resumen de PubMed | Texto completo de CrossRef | Google Académico
153. Garza-Cuartero L, Geurden T, Mahan SM, Hardham JM, Dalton JP, Mulcahy G. Reconocimiento de anticuerpos de péptidos derivados de catepsina L1 en bovinos infectados y/o vacunados por Fasciola hepática e identificación de epítopos lineales protectores de células B. Vacuna. (2018) 36:958–68. doi: 10.1016/j.vaccine.2018.01.020
Resumen de PubMed | Texto completo de CrossRef | Google Académico
154. Norbury LJ, Basałaj K, Zawistowska-Deniziak A, Sielicka A, Wilkowski P, Wesołowska A, et al. La administración intranasal de una formulación que contiene proteínas recombinantes específicas de la etapa de Fasciola hepatica catepsina L5 y catepsina B2 desencadena un efecto antifecundidad y una reducción mediada por adyuvantes en la carga de trematodos en ovejas. Parasitol veterinario. (2018) 258:14–23. doi: 10.1016/j.vetpar.2018.05.008
Resumen de PubMed | Texto completo de CrossRef | Google Académico
155. Ortega-Vargas S, Espitia C, Sahagún-Ruiz A, Parada C, Balderas-Loaeza A, Villa-Mancera A, et al. Una proteína quimérica compuesta de leucina aminopeptidasa y catepsina L1 induce una protección moderada contra el desafío de Fasciola hepatica en ovejas. Vacuna. (2019) 37:3234–40. doi: 10.1016/j.vaccine.2019.04.067
Resumen de PubMed | Texto completo de CrossRef | Google Académico
156. McCusker P, Toet H, Rathinasamy V, Young N, Beddoe T, Anderson G, et al. Caracterización molecular y eficacia vacunal de dos nuevas proteínas del tegumento de superficie reguladas por el desarrollo de Fasciola hepatica. Parasitol veterinario. (2020) 286:109244. doi: 10.1016/j.vetpar.2020.109244
Resumen de PubMed | Texto completo de CrossRef | Google Académico
157. Zafra R, Buffoni L, Pérez-Caballero R, Molina-Hernández V, Ruiz-Campillo MT, Pérez J, et al. Eficacia de una vacuna multivalente contra la infección por Fasciola hepatica en ovinos. Res. Veterinaria. (2021) 52:13. doi: 10.1186/s13567-021-00895-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
158. Becerro-Recio D, Serrat J, López-García M, Molina-Hernández V, Pérez-Arévalo J, Martínez-Moreno Á, et al. Estudio de la migración de juveniles de Fasciola hepatica a través de la barrera intestinal del huésped mediante proteómica cuantitativa en un modelo ex vivo. PLoS negl trop dis. (2022) 16:E0010766. doi: 10.1371/journal.pntd.0010766
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: Fasciola hepatica, patogenia, interacción huésped-patógeno, inmunomodulación, vacuna, ganadería, onehealth, zoonosis
Cita: Flores-Velázquez LM, Ruiz-Campillo MT, Herrera-Torres G, Martínez-Moreno Á, Martínez-Moreno FJ, Zafra R, Buffoni L, Rufino-Moya PJ, Molina-Hernández V y Pérez J (2023) Fasciolosis: patogénesis, interacciones huésped-parásito e implicación en el desarrollo de vacunas. Frente. Vet. Sci. 10:1270064. doi: 10.3389/fvets.2023.1270064
Recibido: 31 de julio de 2023; Aceptado: 30 de octubre de 2023;
Publicado: 11 diciembre 2023.
Editado por:
Francisco Javier Salguero, Agencia de Seguridad Sanitaria del Reino Unido (UKHSA), Reino Unido
Revisado por:
Mihaela Niculae, Universidad de Ciencias Agrícolas y Medicina Veterinaria de Cluj-Napoca, Rumanía
Peter Geldhof, Universidad de Gante, Bélgica
Copyright © 2023 Flores-Velázquez, Ruiz-Campillo, Herrera-Torres, Martínez-Moreno, Martínez-Moreno, Zafra, Buffoni, Rufino-Moya, Molina-Hernández y Pérez. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Verónica Molina-Hernández, vmolina@uco.es
†Estos autores han contribuido igualmente a este trabajo
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía