Fractura de pico asociada a leiomiosarcoma en periquito (Melopsittacus undulatus)
Fractura de pico asociada a leiomiosarcoma en periquito (Melopsittacus undulatus): reporte de un caso y revisión de la literatura
Brittany L. Rasche1,2† Daniel Felipe Barrantes Murillo3† Tatiane Terumi Negrão Watanabe1,4*
- 1Departamento de Salud de la Población y Patobiología, Facultad de Medicina Veterinaria, Universidad Estatal de Carolina del Norte, Raleigh, Carolina del Norte, Estados Unidos
- 2Departamento de Medicina Diagnóstica/Patobiología, Facultad de Medicina Veterinaria, Universidad Estatal de Kansas, Manhattan, KS, Estados Unidos
- 3Departamento de Patobiología, Facultad de Medicina Veterinaria, Universidad de Auburn, Auburn, AL, Estados Unidos
- 4Antech Diagnostics, Los Ángeles, CA, Estados Unidos
Un periquito macho de 2 años de edad (Melopsittacus undulatus) murió después de una historia de 1 día de fractura de la rinoteca rostral con membranas mucosas pálidas, disnea, mentación opaca y ataxia. La histopatología reveló una neoplasia infiltrativa compuesta por corrientes entrelazadas de células fusiformes que borraban la dermis y el hueso del pico superior rostral, así como un ganglio y dos nervios craneales. No se observaron metástasis viscerales. Las células neoplásicas exhibieron un fuerte inmunomarcaje citoplasmático para la actina del músculo liso alfa (α-SMA) y carecían de inmunomarcaje para S100, Melan-A, PNL2 y citoqueratina AE1/AE3. Estos hallazgos fueron consistentes con un leiomiosarcoma localmente invasivo Los leiomiosarcomas surgen del músculo liso y son localmente invasivos con metástasis raras. En las aves, se informa que los leiomiosarcomas surgen principalmente del bazo, el tracto gastrointestinal y el tracto reproductivo. En el presente reporte de caso, describimos las características histológicas e inmunohistoquímicas de un leiomiosarcoma primario de pico en un periquito asociado a una fractura localizada en la rinoteca rostral. El leiomiosarcoma que surge del pico no se ha descrito en la literatura.
1 Introducción
En las aves, las fracturas del pico están más relacionadas con un traumatismo. Sin embargo, las enfermedades subyacentes, como la infección local, la desnutrición, los trastornos metabólicos, la enfermedad hepática crónica o la neoplasia, pueden debilitar el pico, haciéndolo más susceptible a la fractura con traumatismos menores (fractura patológica) (1).
Las neoplasias del pico son una posible causa de fractura patológica del pico y también pueden predisponer a infecciones bacterianas y fúngicas secundarias, que contribuyen aún más al debilitamiento del pico. En las aves, especialmente en los periquitos y las cacatúas, el fibrosarcoma se considera el tumor primario del pico más común (1). Los fibrosarcomas pueden causar deformación del pico por invasión de las fosas nasales, los cornetes nasales y los huesos asociados (1). Otros tumores primarios comunes del pico incluyen el carcinoma de células escamosas y el melanoma maligno (1). Los tumores metastásicos también tienen el potencial de invadir y borrar el pico, pero se consideran menos comunes. En el Cuadro 1 (2–14) se presenta un resumen de los hallazgos clínicos, la localización tumoral y el perfil inmunohistoquímico (cuando se realiza) de varios informes de casos seleccionados de neoplasias primarias del pico en una variedad de especies de aves. Además, se ha informado de la formación de neuromas tras la amputación parcial del pico en pollos (15). En el presente reporte, describimos las características histológicas e inmunohistoquímicas de un leiomiosarcoma primario del pico que causa una fractura rinotecal rostral en un periquito. El leiomiosarcoma que surge del pico de las aves no se ha descrito previamente en la literatura.
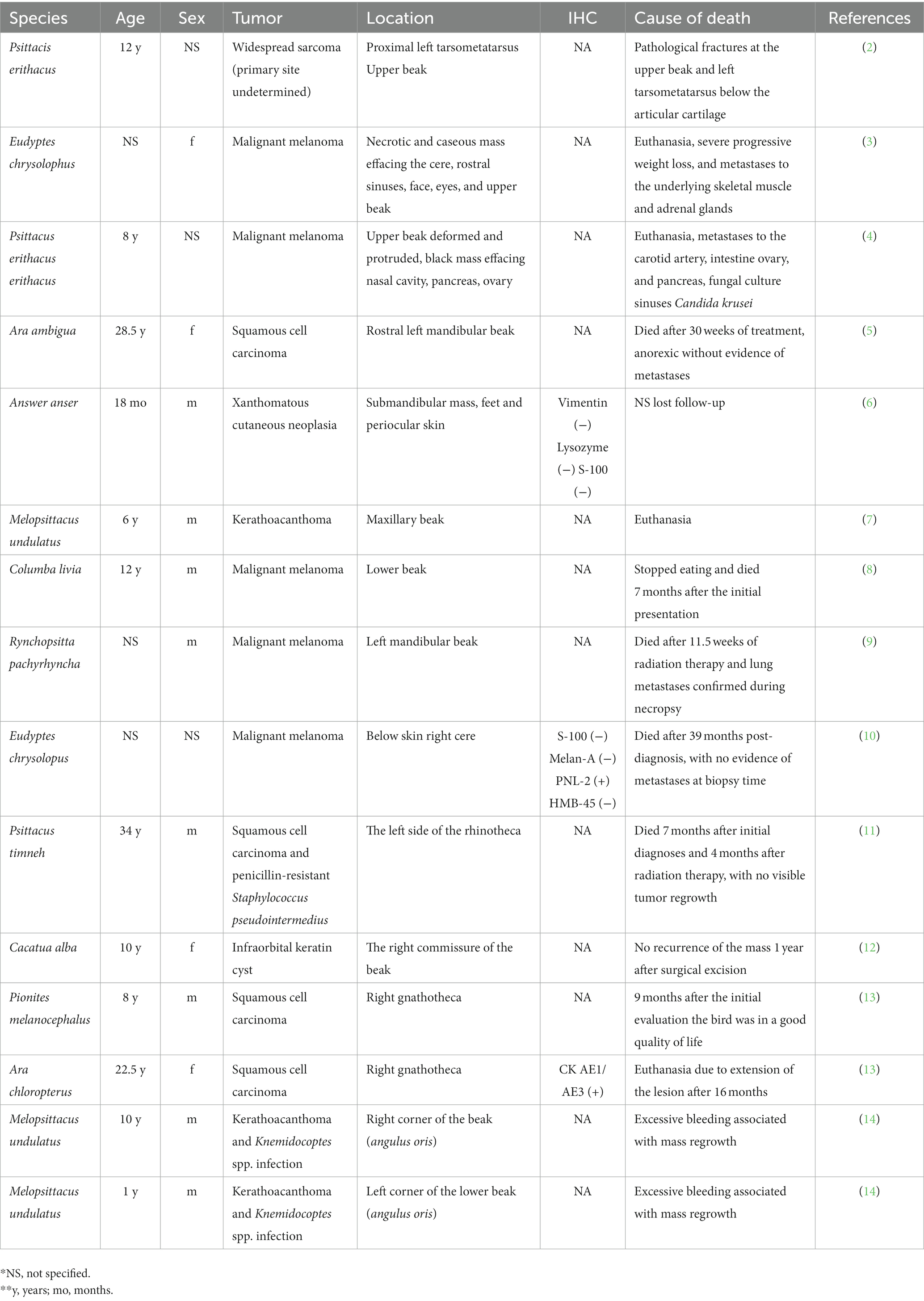
Tabla 1. Casos seleccionados de neoplasia derivada de las localizaciones anatómicas del pico.
2 Descripción del caso
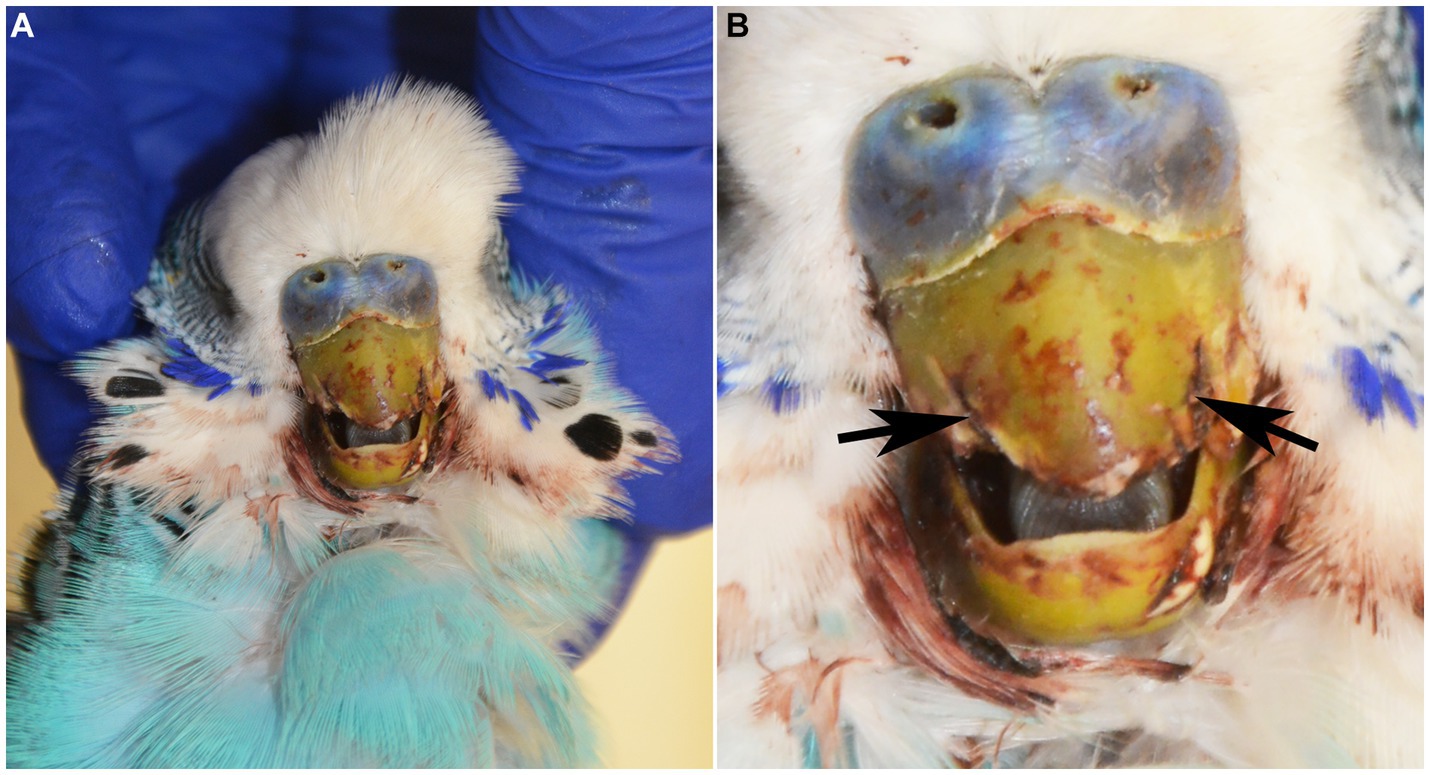
Un periquito macho intacto (Melopsittacus undulatus) de 2,5 años de edad se presentó en los Servicios de Animales Exóticos del Hospital Docente Veterinario de la Universidad Estatal de Carolina del Norte por fractura de la rinoteca rostral (porción cornificada de la parte superior del pico) dentro de las 24 horas anteriores. En el examen físico, el ave tenía las membranas mucosas pálidas, un leve aumento del esfuerzo respiratorio, mentación opaca, ataxia y sospecha de convulsiones que involucraban aleteo y opistótonos. El ave murió en el hospital un par de horas después de un examen físico y fue sometida a la autopsia. En el examen postmortem, la porción rostral de la rinoteca estaba ausente con bordes laterales dentados y oclusión incompleta (Figura 1). Las plumas que rodeaban el pico y a lo largo de las alas craneodorsales estaban cubiertas de sangre seca. El examen de los órganos internos no tuvo nada de especial.
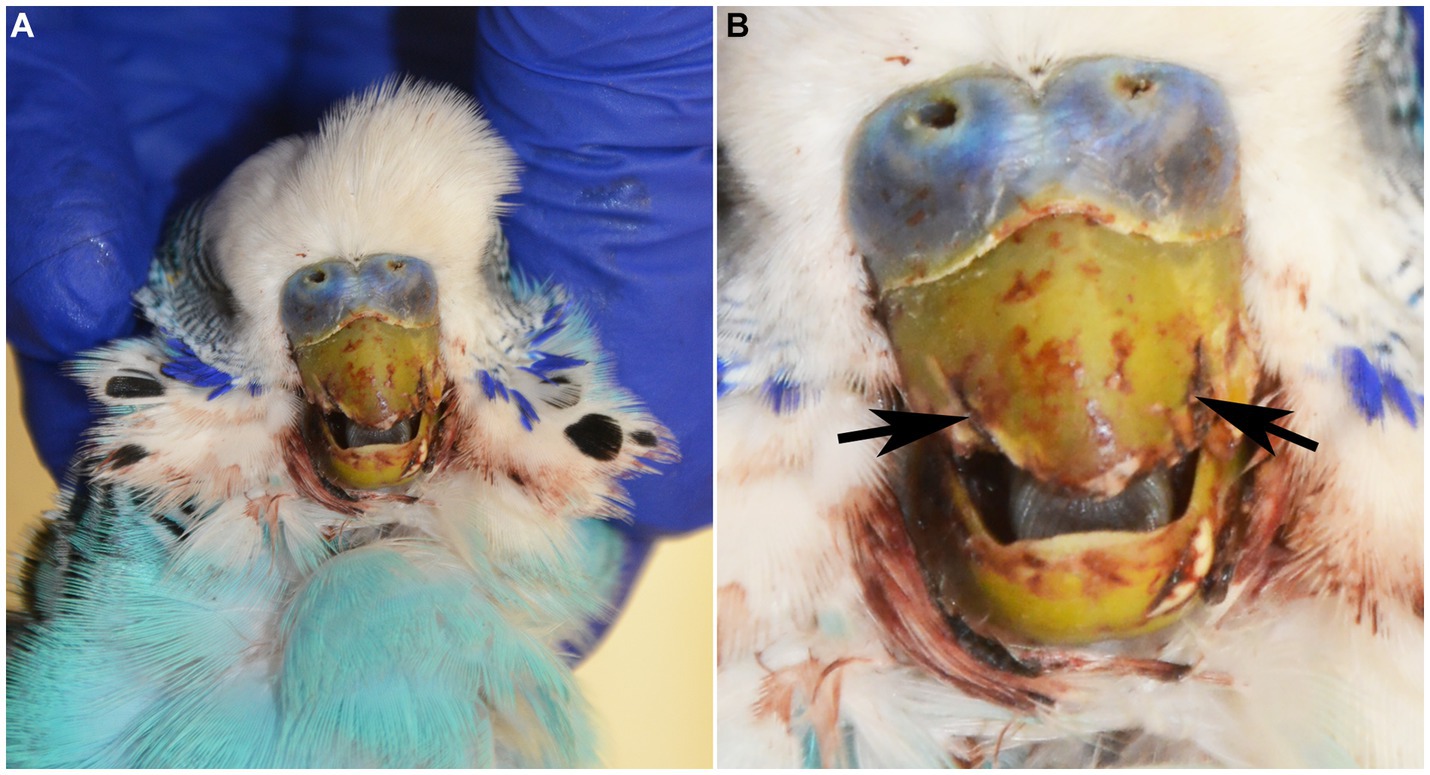
Figura 1. (A) Periquito azul macho de 2 años de edad (Melopsittacus undulatus) sometido a examen post mortem. (B) La porción rostral de la rinoteca estaba ausente con bordes laterales dentados (flechas negras), oclusión incompleta y tinción hemorrágica leve de las plumas circundantes.
Se recogieron muestras de cabeza y de rutina del bazo, corazón, hígado, pulmón, tráquea, riñón, tracto gastrointestinal, testículos, cerebro, médula espinal y ojos, se fijaron en formol tamponado neutro al 10%, se procesaron de forma rutinaria y se tiñeron con hematoxilina y eosina. También se realizó tinción inmunohistoquímica en secciones del pico utilizando los anticuerpos especificados en la Tabla 2. Los controles negativos (sin la adición de anticuerpos primarios) fueron adecuados. Los controles positivos internos para la actina del músculo liso alfa (α-SMA) (túnica media de las arterias), S100 (nervio) y citoqueratina AE1/AE3 (CK AE1/AE3) (epitelio nasal, epidermis) fueron adecuados. Se utilizaron secciones de melanomas cutáneos caninos como controles positivos para Melan-A y PNL2. Los controles positivos internos para vimentina (músculo esquelético, fibrocitos en dermis y submucosa nasal) fueron inadecuados para tres anticuerpos diferentes, por lo que este marcador inmunohistoquímico no pudo ser interpretado en este caso. Se recolectó un hisopo de coanas post mortem y se envió para PCR de Chlamydia spp. en el Laboratorio de Enfermedades Infecciosas de la Facultad de Medicina Veterinaria de la Universidad de Georgia. En este caso no se detectó Chlamydia spp.
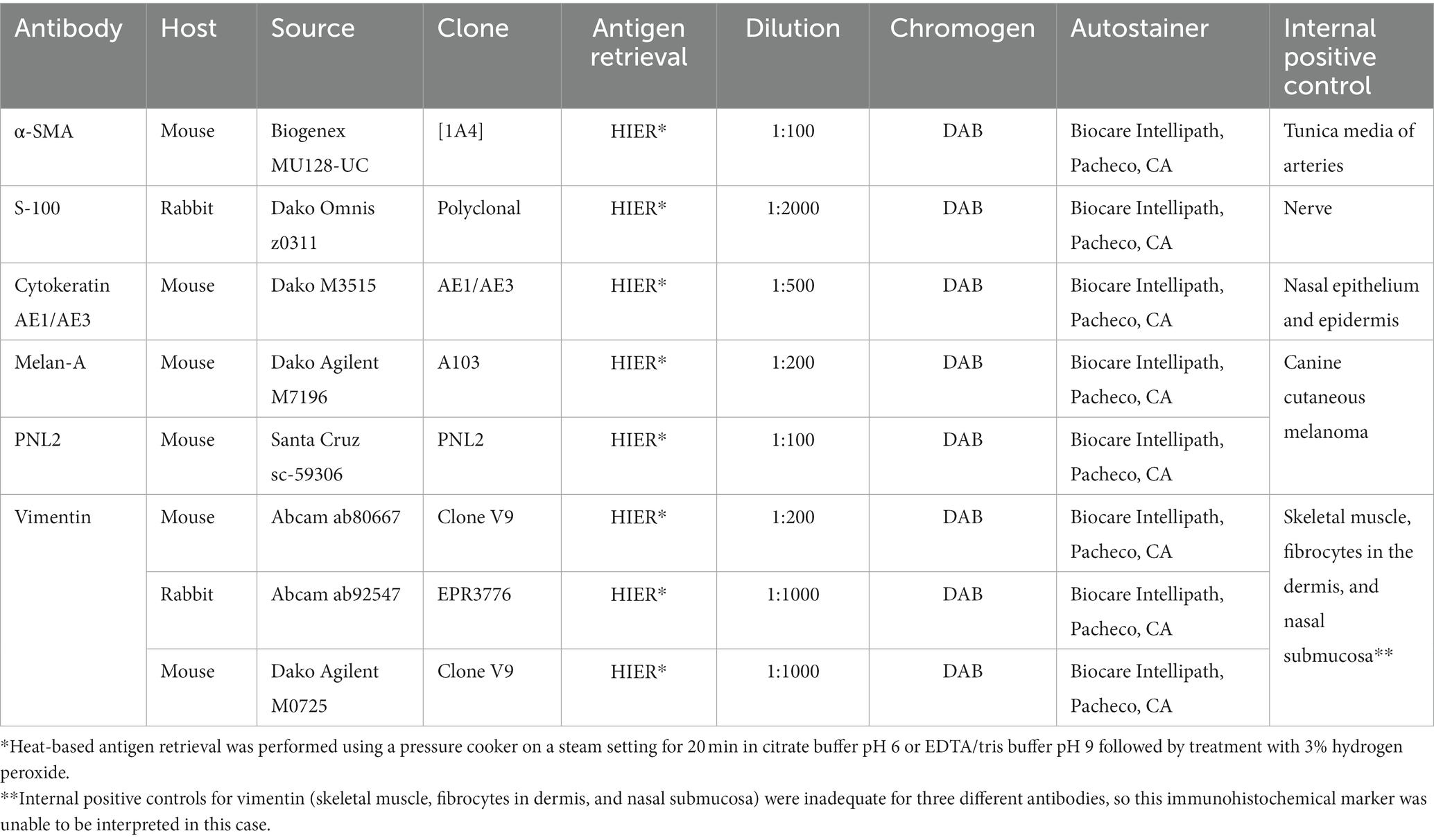
Tabla 2. Anticuerpos con fuente, clon, fabricante, concentración utilizada, información de recuperación, método de detección y control positivo utilizado.
El examen histológico de la porción rostral de la parte superior del pico reveló una neoplasia no encapsulada mal delimitada que infiltraba la dermis y los huesos del premaxilar y el maxilar, mientras comprimía ligeramente la cavidad nasal rostral (Figura 2A). Esta neoplasia estaba compuesta por corrientes densamente entrelazadas de células fusiformes sostenidas por un estroma fibrovascular mínimo (Figura 2B). Las células neoplásicas tenían una pequeña cantidad de citoplasma eosinófilo con bordes celulares indistintos y núcleos alargados con cromatina densamente punteada. La anisocitosis y la anisobariosis fueron leves a moderadas con 233 figuras mitóticas en campos 10400X (2,37 mm2). Ocasionalmente se presentaron grandes áreas multifocales de necrosis coagulativa a lítica en toda la neoplasia. La infiltración neoplásica de la cavidad medular del premaxilar y maxilar superior se asoció con adelgazamiento y pérdida de las trabéculas óseas. Ocasionalmente pequeños fragmentos de hueso necrótico estaban incrustados dentro de la población neoplásica y rodeados de macrófagos y varias células multinucleadas (osteoclastos y células gigantes multinucleadas) (Figura 2C). Las trabéculas restantes adyacentes a la neoplasia a menudo tenían bordes festoneados con un mayor número de osteoclastos en las lagunas de Howship (reabsorción ósea y osteólisis). La epidermis y el material cornificado (rinoteca) a lo largo de la cara ventral de la punta del pico estaban ausentes con la exposición de la neoplasia subyacente. A lo largo de la superficie ulcerada expuesta de la neoplasia había una hemorragia abundante, fibrina, restos necróticos eosinófilos, restos nucleares y un número moderado de colonias bacterianas mixtas superficiales. Una población similar de células fusiformes neoplásicas infiltró el nervio trigémino y el ganglio justo caudal a los cornetes nasales (Figura 2D), así como el nervio óptico de un ojo. No se observaron metástasis neoplásicas en órganos intracelómicos. Aproximadamente el 80 % de las células neoplásicas exhibieron un fuerte inmunomarcaje citoplasmático para α-AME (Figura 3A), pero carecían de inmunomarcaje para S100, CK AE1/AE3, PNL2 y Melan-A (Figuras 3B-E).
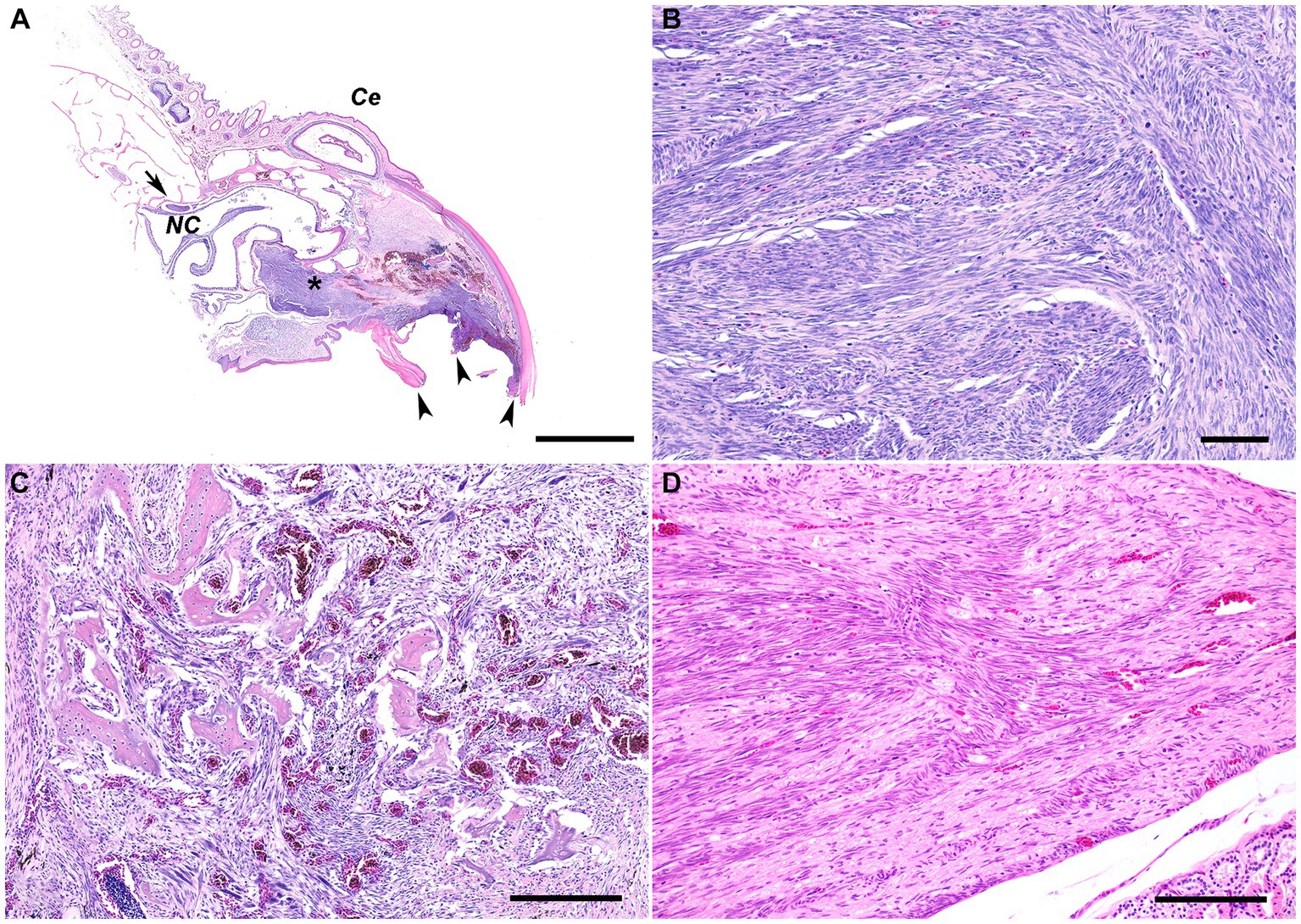
Figura 2. (A) Fotomicrografía subgruesa de la rinoteca rostral. La porción rostral fracturada del pico se observó de forma macroscópica (puntas de flecha). Extendiéndose desde la rinoteca rostral y borrando la dermis subyacente y el hueso del premaxilar y el maxilar hay una población neoplásica infiltrativa no encapsulada, mal delimitada, con hemorragia entremezclada y áreas de necrosis (asterisco). La neoplasia se extiende caudalmente con una ligera compresión ventral de la cavidad nasal rostral. Caudal a la cavidad nasal, un nervio y un ganglio son infiltrados por la neoplasia (flecha). NC: cavidad nasal; Ce, cere. Tinción H&E. Barra = 2 mm. (B) La neoplasia infiltrativa no encapsulada y mal delimitada consiste en corrientes densamente entrelazadas de células fusiformes bien diferenciadas sostenidas por un estroma fibrovascular mínimo. Tinción H&E. Barra = 60 μm. (C) Las células del huso neoplásico se infiltran en la cavidad medular del hueso con adelgazamiento y pérdida de las trabéculas óseas. Ocasionalmente, pequeños fragmentos de hueso necrótico están incrustados dentro de la población neoplásica y rodeados de macrófagos y varias células multinucleadas. Las trabéculas restantes adyacentes a la neoplasia a menudo tienen bordes festoneados con un mayor número de osteoclastos en las lagunas de Howship, lo que es consistente con la resorción ósea/osteólisis. Tinción H&E. Tamaño de la barra = 200 μm. (D) El nervio y el ganglio justo caudal a los cornetes nasales están infiltrados por una población similar de células fusiformes neoplásicas. Tinción H&E. Tamaño de la barra = 200 μm.
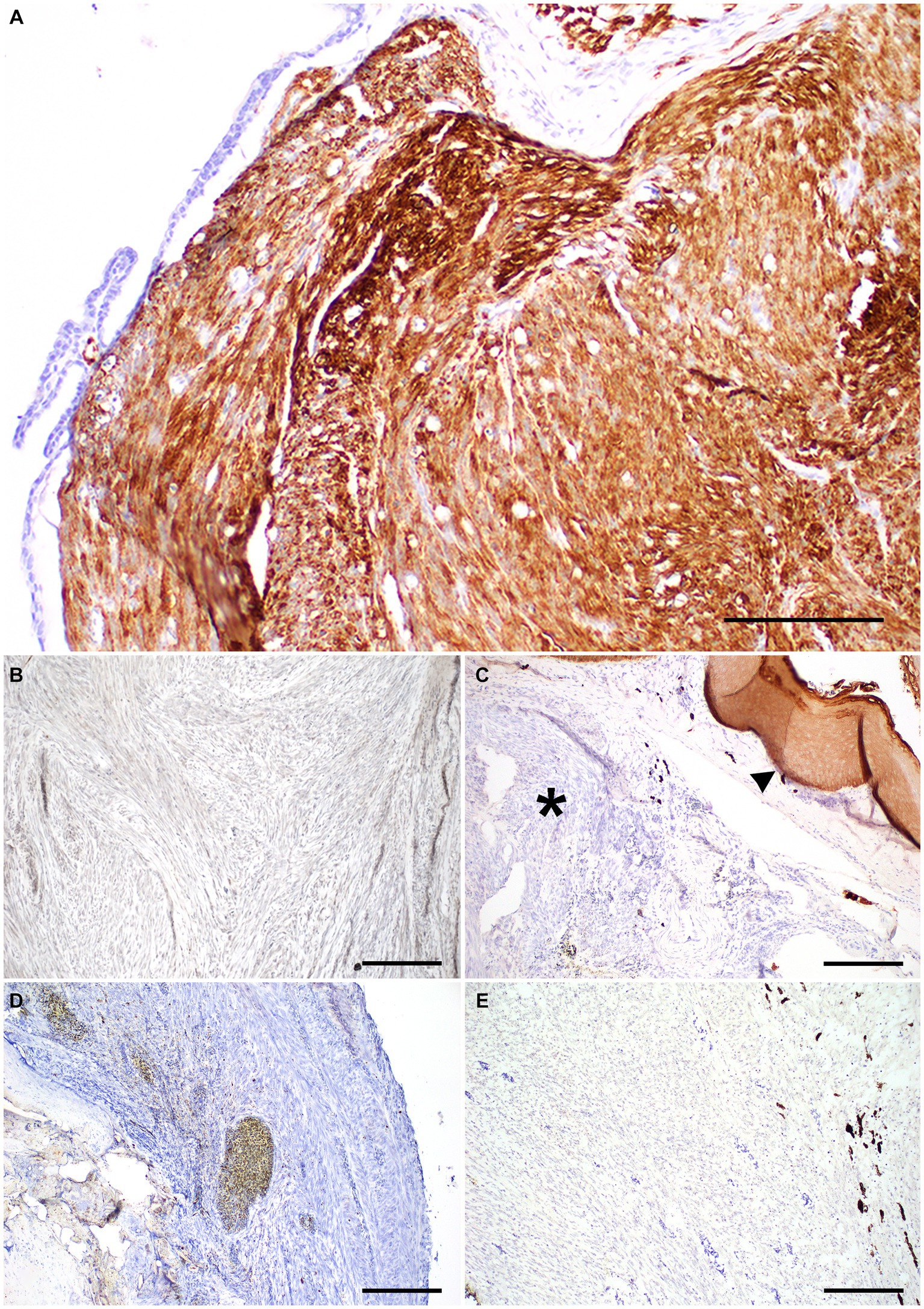
Figura 3. Panel inmunohistoquímico de un leiomiosarcoma de pico en la rinoteca rostral de un periquito macho de 2 años de edad. (A) Las células neoplásicas tenían un fuerte inmunomarcaje citoplasmático para la IHQ de actina del músculo liso α. Tamaño de la barra = 200 μm. (B) Las células neoplásicas carecían de inmunomarcaje para la IHQ S-100. Tamaño de la barra = 200 μm. (C) Las células neoplásicas carecen de inmunomarcaje citoplasmático CK AE1/AE3 (asterisco), el epitelio normal está presente como control positivo interno (punta de flecha). Tamaño de la barra = 200 μm. (D,E) El inmunomarcaje de PNL-2 y Melan-A estuvo ausente en las células neoplásicas. Tamaño de la barra = 200 μm.
3 Discusión
Para comprender mejor el proceso de la enfermedad que afecta al pico, se proporciona un resumen de la anatomía normal. El pico o pico en las aves se conoce comúnmente como rostro y está formado por los huesos maxilares o rostro maxilar y los huesos mandibulares o rostro mandibular cubiertos por sus respectivas vainas córneas (16-18). El pico superior e inferior están cubiertos por una estructura de queratina derivada de la epidermis, formando el pico córneo o ramfoteca mandibular (rhinotheca) y la ramfoteca mandibular (gnathotheca) (17, 18). El suministro vascular primario al pico es la arteria carótida común y sus ramas, mientras que la inervación primaria del pico es el nervio trigémino (18, 19).
Al igual que otras estructuras óseas, las fracturas del pico pueden clasificarse como traumáticas o patológicas. El daño traumático en el pico es más comúnmente el resultado de heridas por mordedura de otra ave, pero también puede ser causado por lesiones por impacto, como volar contra un objeto (1, 18). La enfermedad localizada del pico y algunas enfermedades sistémicas pueden disminuir la integridad estructural del pico, lo que aumenta la posibilidad de lesiones significativas incluso con traumatismos menores. La enfermedad localizada en el pico puede incluir infección bacteriana o fúngica, infestación de ácaros (es decir, Knemidokoptes spp.) o neoplasia. Las enfermedades sistémicas que pueden debilitar la estructura del pico incluyen la desnutrición (es decir, deficiencia de vitamina A, enfermedad ósea metabólica) y enfermedad hepática crónica (18). En este caso, la infiltración neoplásica de la parte superior del pico probablemente contribuyó a la fractura observada de la rinoteca rostral con infección bacteriana superficial secundaria. Estos hallazgos representan una fractura patológica del pico en este periquito. En este caso, no se apreció evidencia de otros factores que contribuyen a la disminución de la integridad del pico, como la infestación de ácaros, la desnutrición o la enfermedad hepática crónica mediante un examen macroscópico o histológico.
Las enfermedades neoplásicas que afectan comúnmente el pico de las aves incluyen el fibrosarcoma, el carcinoma de células escamosas y el melanoma maligno. Los fibrosarcomas se consideran el tumor primario del pico más común en las aves, siendo más prevalente en periquitos y cacatúas (1). Los fibrosarcomas suelen ser localmente agresivos con metástasis poco frecuentes. Al igual que la fractura patológica del pico en este caso, existe una descripción de una fractura del pico asociada a una neoplasia descrita en un loro gris africano (2). Un fibrosarcoma diseminado causó una fractura patológica en los dos tercios de la parte superior del pico y en el tarsometatarso izquierdo proximal, justo debajo de la epífisis del ave (2). Los autores no pudieron determinar el origen primario del tumor (2). El osteosarcoma y el melanoma se consideraron diagnósticos diferenciales, sin embargo, se descartaron en función de la interpretación patológica de cada lesión. La evidencia de formación ósea dentro de la fractura localizada en el metatarso se atribuyó a la formación de callos, y la abundante pigmentación de melanina presente dentro de las células en la lesión del pico se interpretó como restos del tejido local invadido por el tumor (2). Otra limitación de este reporte de caso fue la falta de uso de inmunohistoquímica. Algunos autores consideran que los fibrosarcomas están sobrediagnosticados porque cualquier tumor carente de histogénesis específica, con morfología de células fusiformes, atipia y estroma colágeno puede ser diagnosticado como fibrosarcoma (20).
Los carcinomas de células escamosas son localmente invasivos con un bajo potencial metastásico (1). Las infecciones bacterianas y micóticas secundarias están comúnmente documentadas (1). El tratamiento requiere resección quirúrgica agresiva, quimioterapia (cisplatino), radioterapia (cobalto-60) y terapia angiogénica tópica y oral con una tasa de éxito variable (5, 21, 22). En este caso, la forma fusiforme de las células neoplásicas junto con la falta de inmunomarcaje para la citoqueratina AE1/AE3 descartaron el carcinoma de células escamosas. Los melanomas malignos se han descrito en varias especies de aves, y las metástasis en los pulmones, el riñón, el hígado, el bazo y la médula ósea se notifican con frecuencia (1, 8–10). Los tratamientos reportados incluyen la escisión quirúrgica, la radiación y la terapia angiogénica (8–10). La falta de inmunomarcaje para Melan-A y PNL2 en el caso aquí reportado sugirió que un diagnóstico de melanoma maligno era poco probable.
El uso de la inmunohistoquímica como herramienta diagnóstica rutinaria permite diferenciar el fibrosarcoma de otros tumores de células fusiformes como los tumores de la vaina de los nervios periféricos, el rabdomiosarcoma, el melanoma maligno amelanótico, el carcinoma de células fusiformes, el leiomiosarcoma y otros (20). PNL2, Melan-A y citoqueratina AE1/AE3 pueden descartar melanoma y carcinoma. Con base en el aspecto histológico de la población neoplásica que borró la dermis y el hueso de la parte superior del pico, los diferenciales adicionales en este caso incluyeron tumor de la vaina del nervio periférico y leiomiosarcoma. Se consideró un tumor de la vaina del nervio periférico dada la presencia de infiltración neoplásica en los nervios craneales y un ganglio asociado. Sin embargo, los tumores de la vaina de los nervios periféricos no están bien documentados en las aves. Dada la falta de inmunomarcaje frente a S-100 (marcador de tumores de origen neural) en esta población neoplásica, se consideró menos probable el tumor de la vaina del nervio periférico (20).
Los leiomiosarcomas en aves se reportan con mayor frecuencia en el bazo, el tracto gastrointestinal y el tracto reproductivo, con informes ocasionales de leiomiosarcomas cutáneos y subcutáneos (23, 24). Los leiomiosarcomas suelen ser localmente invasivos con metástasis poco frecuentes en el hígado, el bazo, la médula ósea y el tórax (23–27). En este caso, el inmunomarcaje positivo de las células neoplásicas para la α-AME (un marcador del músculo liso), apoyó el diagnóstico de leiomiosarcoma con una localización primaria en el pico.
La inmunohistoquímica fue esencial para caracterizar mejor la neoplasia del pico en este periquito con inmunorreactividad positiva a la α-AME, que es más consistente con el leiomiosarcoma (28). El inmunomarcaje de la α-AME indica un origen del músculo liso en lugar de un origen cardíaco o del músculo esquelético (29) y ayuda a diferenciar los tumores de músculo liso de los fibrosarcomas (30). Los leiomiosarcomas y los leiomiomas se originan en el músculo liso y consisten en haces entrelazados de células fusiformes con núcleos vesiculares y citoplasma fibrilar (1). La diferenciación entre tumores benignos y malignos se basa en la actividad mitótica y la atipia celular (1). Si bien la mayoría de los leiomiosarcomas en aves surgen de órganos viscerales, pocos informes de casos describen leiomiosarcomas cutáneos y subcutáneos en aves (23). A diferencia de los leiomiosarcomas viscerales, estos informes observaron una rápida progresión clínica de la enfermedad neoplásica con metástasis a los órganos viscerales (23). Se reportó un leiomiosarcoma cutáneo en una paloma ornamental hembra de 4 años de edad (cola de abanico) con múltiples metástasis en el hígado, el páncreas y los pulmones (29). El diagnóstico final se realizó en base a los hallazgos histológicos y al fuerte inmunomarcaje citoplasmático para α-AME y vimentina, con falta de inmunomarcaje para MyoD1, citoqueratina AE1/AE3 y desmina (29). Se describió un leiomiosarcoma cutáneo en la región cervical de un macho de 14 años de edad de paloma blanca (Columba livia) en el que el diagnóstico se confirmó mediante inmunomarcaje positivo para desmina y α-AME y falta de inmunomarcaje para citoqueratina AE1/AE3, S100 y factor von Willebrand (23). También hay dos informes de leiomiosarcomas cutáneos en periquitos que incluyen uno en el celoma caudal de una hembra de 6 años y otro en el ala derecha de una hembra de 5 años (31). En ambos casos, el diagnóstico se confirmó mediante inmunomarcaje para α-AME y desmina, y no se identificaron metástasis en ninguno de los casos (31, 32). En esta última, se identificó metaplasia ósea dentro de la neoplasia (32). Esta característica histológica no se observó en el presente caso. Los restos de trabéculas óseas presentes en esta neoplasia se interpretaron como restos del hueso maxilar en lugar de metaplasia ósea. No se observó metástasis visceral en este periquito, pero sí invasión local en un nervio óptico y en el nervio trigémino y el ganglio. Hasta donde sabemos, no se han reportado leiomiosarcomas previamente en el pico de las aves.
4 Conclusión
Las limitaciones de este caso están relacionadas con el estadio avanzado de la enfermedad neoplásica en el momento del diagnóstico. No se pudo realizar una descripción más detallada de los hallazgos clinicopatológicos asociados a esta neoplasia, ya que el ave falleció poco después de la hospitalización. No está claro si los signos neurológicos como la mentación sorda, la ataxia y la sospecha de convulsiones que involucran aleteo de alas y opistótonos fueron consecuencia de la hipoglucemia, un síndrome paraneoplásico comúnmente reportado en el leiomiosarcoma en perros (28). Además, este informe de caso tiene varios desafíos diagnósticos. Incluso si la fractura del pico se observa comúnmente en las aves, rara vez se informa que es secundaria a una neoplasia. Las fracturas del pico en las aves se atribuyen principalmente a traumatismos. Sin embargo, una variedad de estados de enfermedad subyacentes pueden actuar como factores predisponentes. En el examen macroscópico, no hubo evidencia de un efecto de masa, pero el examen histológico reveló una neoplasia infiltrativa de células fusiformes que borraba el hueso y la dermis de la parte superior del pico, lo que probablemente contribuyó a la fractura observada clínicamente. Con base en el marcaje inmunohistoquímico de las células neoplásicas con α-AME y la falta de inmunomarcaje para la citoqueratina AE1/AE3, S-100, Melan-A y PNL-2, esta neoplasia se diagnosticó como un leiomiosarcoma primario del pico. La metástasis manifiesta de esta neoplasia no se apreció macroscópica ni histológicamente, pero hubo invasión histológica del nervio trigémino y del ganglio y de un nervio óptico. Este reporte de caso destaca la neoplasia como un diferencial importante para las fracturas del pico en aves y sirve como el primer reporte de leiomiosarcoma primario del pico en un ave.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo, las consultas posteriores pueden dirigirse al autor correspondiente.
Declaración ética
No se requirió aprobación ética para los estudios con animales de acuerdo con la legislación local y los requisitos institucionales porque los propietarios permitieron la evaluación post-mortem. El periquito fue enviado para un examen post-mortem de diagnóstico de rutina a la Facultad de Medicina Veterinaria de la Universidad Estatal de Carolina del Norte y, como resultado, no estaba sujeto a las pautas de ética animal. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio. Se obtuvo el consentimiento informado por escrito del participante/paciente para la publicación de este informe de caso.
Contribuciones de los autores
BR: Conceptualización, Curación de datos, Análisis formal, Investigación, Metodología, Redacción – borrador original, Redacción – revisión y edición. DB: Curación de datos, Análisis formal, Investigación, Redacción – borrador original, Redacción – revisión y edición, Conceptualización, Metodología. TN: Conceptualización, Curación de datos, Análisis formal, Investigación, Metodología, Supervisión, Validación, Redacción – borrador original, Redacción – revisión y edición.
Financiación
El/los autor/es declaran/n que no se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo.
Reconocimientos
Deseamos agradecer al personal de los laboratorios de autopsia e histología de la Facultad de Medicina Veterinaria de la Universidad Estatal de Carolina del Norte.
Conflicto de intereses
TN fue empleado de Antech Diagnostics.
El resto de los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un potencial conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
- Schmidt, RE, Reavill, DR y Phalen, DN. Sistema gastrointestinal y páncreas En: Patología de aves de compañía y aviario. RE Schmidt, DR Reavill y D Phalen editores, 2ª ed. Ames, IA: Wiley Blackwell (2015). 55–94.
- Riddell, C, y Cribb, PH. Fibrosarcoma en un loro gris africano (Psittacus erithacus). Avian Dis. (1983) 27:549–55. doi: 10.2307/1590185
Resumen de PubMed | Texto completo de CrossRef | Google Académico
- Kufuor-Mensah, E, y Watson, GL. Melanomas malignos en un pingüino (Eudyptes chrysolophus) y un halcón de cola roja (Buteo jamaicensis). Veterinario Pathol. (1992) 29:354–6. doi: 10.1177/030098589202900411
Resumen de PubMed | Texto completo de CrossRef | Google Académico
- André, JT, Delverdier, M, Cabanié, P, y Bartel, G. Melanoma maligno en un loro gris africano (Psittacus erithacus erithacus). J Assoc Avi Vet. (1993) 7:83–5. doi: 10.2307/30135010
Texto completo de CrossRef | Google Académico
- Manucy, TK, Bennett, RA, Greenacre, CB, Roberts, RE, Schumacher, J y Deem, SL. Carcinoma de células escamosas del pico mandibular en un guacamayo de Buffon (Ara ambigua). J Avian Med Surg. (1998) 12:158–66.
- Jaensch, SM, Butler, R, O’Hara, A, Raidal, SR y Wyatt, K. Neoplasia cutánea atípica múltiple, papiliforme, xantomatosa en un ganso (Anser anser). Aust Vet J. (2002) 80:277–80. doi: 10.1111/j.1751-0813.2002.tb10838.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
- Owen, HC, Doneley, RJ, Schmidt, RE, y Patterson-Kane, JC. Queratoacantoma que causa deformidad del pico en un periquito (Melopsittacus undulatus). Pathol aviar. (2007) 36:499–502. doi: 10.1080/03079450701697275
Resumen de PubMed | Texto completo de CrossRef | Google Académico
- Kajigaya, H, Konagaya, K, Ejima, H, Usuda, Z, Kodama, S y Thone, J. Melanoma metastásico que parece originarse en el pico de una paloma mensajera (Columba livia). Avian Dis. (2010) 54:958–60. doi: 10.1637/9083-092309-Case.1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
- Guthrie, AL, González-Angulo, C, Wigle, WL, y DeMaar, TW. Radioterapia de un melanoma maligno en un loro de pico grueso (Rhynchopsitta pachyrhyncha). J Avian Med Surg. (2010) 24:299–307. doi: 10.1647/2009-007.1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
- Duncan, AE, Smedley, R, Anthony, S, y Garner, MM. Melanoma maligno en el pingüino: caracterización de las características clínicas, histológicas e inmunohistoquímicas del melanoma maligno en 10 individuos de tres especies de pingüinos. J Zoo Wildl Med. (2014) 45:534–49. doi: 10.1638/2013-0207R1.1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
- Swisher, SD, Phillips, KL, Tobias, JR, Cullen, JM, Gieger, TL y Grunkemeyer, VL. Radioterapia de haz externo del carcinoma de células escamosas en el pico de un loro gris africano (Psittacus timneh). J Avian Med Surg. (2016) 30:250–6. doi: 10.1647/2015-106
Resumen de PubMed | Texto completo de CrossRef | Google Académico
- Turner, RC, Graham, JE, Hahn, S, Mariano, A y McCarthy, R. Quiste de queratina infraorbitaria en una cacatúa paraguas (Cacatua alba). J Avian Med Surg. (2019) 33:150–4. doi: 10.1647/2018-342
Resumen de PubMed | Texto completo de CrossRef | Google Académico
- Halley, MA, Stilwell, JM, Comolli, JR, Wilkinson, SL, Reavill, DR, Divers, S, et al. Carcinoma de células escamosas mandibular en 2 psitácidas. J Vet Diagn Investig. (2020) 32:344–7. doi: 10.1177/1040638720906451
Resumen de PubMed | Texto completo de CrossRef | Google Académico
- Doukaki, C, Papaioannou, N, and Huynh, M. Beak keratoacanthomas in two budgerigars (Melopsittacus undulatus) with Knemidocoptesspp. Infection J Exot. (2021) 36:80–3. doi: 10.1053/j.jepm.2019.06.008
Texto completo de CrossRef | Google Académico
- Gentle, MJ. Neuroma formation following partial beak amputation (beak trimming) in the chicken. Res Vet Sci. (1986) 41:383–5. doi: 10.1016/S0034-5288(18)30635-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
- King, AS, and McLelland, J. (eds) Skeletomuscular system In: Birds–their structure and function. 2nd ed. London: Bailliere Tindall (1984). 43–51.
- King, AS, and McLelland, J. (eds) External anatomy In: Birds–their structure and function. 2nd ed. London: Bailliere Tindall (1984). 9–10.
- Speer, B, and Powers, LV. Anatomy and disorders of the beak and oral cavity of birds. Vet Clin North Am Exot Anim Pract. (2016) 19:707–36. doi: 10.1016/j.cvex.2016.04.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
- King, AS, and McLelland, J. (eds) Nervous system In: Birds–their structure and function. 2nd ed. London: Bailliere Tindall (1984). 258–60.
- Mauldin, EA, and Peters-Kennedy, J. Integumentary system in Jubb, Kennedy and Palmer’s pathology of domestic animals. MG Maxie editor. Vol 1. 6th ed. St Louis, MO; Elsevier, 511–736 (2016).
- Suedmeyer, WK, McCaw, D, and Turnquist, S. Attempted photodynamic therapy of squamous cell carcinoma in the casque of a great hornbill (Buceros bicornis). J Avian Med Surg. (2001) 15:44–9. doi: 10.1647/1082-6742(2001)015[0044:APTOSC]2.0.CO;2
Texto completo de CrossRef | Google Académico
- Baitchman, E, Li, VW, Li, WW, Bonar, C, Mayer, J, Caron, S, et al. Treatment of squamous cell carcinoma in a great Indian hornbill (Buceros bicornis). P Pion editor. Los Angeles, CA, USA: Proc Amer Assoc Zoo Vet. (2008) 134–5.
- Fabian, NJ, Esmail, MY, Richey, L, Muthupalani, S, Haupt, JL, Joy, J, et al. Cutaneous leiomyosarcoma with visceral metastases in a white Carneau pigeon and literature review. J Vet Diagn Investig. (2021) 33:1040638721992061. doi: 10.1177/1040638721992061
Resumen de PubMed | Texto completo de CrossRef | Google Académico
- Robat, CS, Ammersbach, M, and Mans, C. Avian oncology: diseases, diagnostics, and therapeutics. Vet Clin North Am Exot Anim Pract. (2017) 20:57–86. doi: 10.1016/j.cvex.2016.07.009
Resumen de PubMed | Texto completo de CrossRef | Google Académico
- Blackmore, DK. The clinical approach to tumours in cage birds. I. The pathology and incidence of neoplasia in cage birds. J Small Anim Pract. (1966) 7:217–23. doi: 10.1111/j.1748-5827.1966.tb04435.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
- Sasipreeyajan, J, Newman, JA, and Brown, PA. Leiomyosarcoma in a budgerigar (Melopsittacus undulatus). Avian Dis. (1988) 32:163–5. doi: 10.2307/1590968
Resumen de PubMed | Texto completo de CrossRef | Google Académico
- Latimer, KS. Oncology In: B Ritchie, G Harrison, L Harrison, and D Zantop, editors. Avian medicine: principles and application. 2nd ed. Lake Worth, FL: Wingers Publishing, Inc (1997). 640–68.
- Cooper, BJ y Valentine, BA En: DJ Meuten, editor. Tumores musculares en tumores en animales domésticos. 5ª ed. Saint Louis, MO: John Wiley & Sons, Inc. (2016). 425–66.
- Stenzel, T, Gesek, M, Paździor-Czapula, K, Otrocka-Domagała, I, y Koncicki, A. Leiomiosarcoma cutáneo con múltiples metástasis viscerales en una paloma doméstica. Avian Dis. (2017) 61:274–8. doi: 10.1637/11552-120516-Case.1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
- Ramos-Vara, JA, y Borst, LB En: DJ Meuten, editor. Inmunohistoquímica: fundamentos y aplicaciones en oncología en tumores en animales domésticos. 5ª ed. Saint Louis, MO: John Wiley & Sons, Inc. (2016). 44–87.
- Zamani-Ahmadmahmudi, M, Nassiri, SM, Khaksar, E, y Solati, AA. Un caso raro de leiomiosarcoma cutáneo en un periquito (Melopsittacus undulatus). Arch Razi Inst. (2015) 70:57–60. doi: 10.7508/ari.2015.01.009
Texto completo de CrossRef | Google Académico
- Timurkaan, N, Eroksuz, H, Cevik, A, y Karabulut, B. Leiomiosarcoma cutáneo con metaplasia osteoide en un periquito (Melopsittacus undulatus): reporte de un caso. Veterinario Med. (2016) 61:533–7. doi: 10.17221/43/2016-VETMED
Texto completo de CrossRef | Google Académico
Palabras clave: periquito, Melopsittacus undulatus, leiomiosarcoma, pico, neoplasia
Cita: Rasche BL, Barrantes Murillo DF y Negrão Watanabe TT (2023) Fractura de pico asociada a leiomiosarcoma en un periquito (Melopsittacus undulatus): reporte de un caso y revisión de la literatura. Frente. Vet. Sci. 10:1309185. doi: 10.3389/fvets.2023.1309185
Recibido: 07 de octubre de 2023; Aceptado: 24 de noviembre de 2023;
Publicado: 08 Diciembre 2023.
Editado por:
Orlando Paciello, Universidad de Nápoles Federico II, Italia
Revisado por:
Michael James Dark, Universidad de Florida, Estados
Unidos Adrian Florin Gal, Universidad de Ciencias Agrícolas y Medicina Veterinaria de Cluj-Napoca, Rumania
Derechos de autor © 2023 Rasche, Barrantes Murillo y Negrão Watanabe. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Tatiane Terumi Negrão Watanabe, tatiane.watanabe@antechmail.com
†Estos autores han contribuido igualmente a este trabajo y comparten la primera autoría
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respalda
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía