Frecuencia cardíaca en caballos después de la administración oral de una pasta que contiene cannabidiol(1/2)
Observaciones conductuales, frecuencia cardíaca y variabilidad de la frecuencia cardíaca en caballos después de la administración oral de una pasta que contiene cannabidiol en tres dosis crecientes (parte 1/2)
 Fabienne Eichler1*
Fabienne Eichler1*  Anna Ehrle1
Anna Ehrle1  Katharina Charlotte Jensen2
Katharina Charlotte Jensen2  Natalie Baudisch1
Natalie Baudisch1  Hannah Petersen1
Hannah Petersen1  Wolfgang Bäumer3
Wolfgang Bäumer3  Christoph Lischer1
Christoph Lischer1  Mechthild Wiegard4
Mechthild Wiegard4- 1Clínica Equina, Hospital Veterinario Freie Universität Berlin, Facultad de Medicina Veterinaria, Freie Universität Berlin, Berlín, Alemania
- 2Instituto de Epidemiología y Bioestadística Veterinaria, Facultad de Medicina Veterinaria, Freie Universität Berlin, Berlín, Alemania
- 3Instituto de Farmacología y Toxicología, Facultad de Medicina Veterinaria, Freie Universität Berlin, Berlín, Alemania
- 4Instituto de Bienestar Animal, Comportamiento Animal y Ciencia de Animales de Laboratorio, Facultad de Medicina Veterinaria, Freie Universität Berlin, Berlín, Alemania
Se ha propuesto que los productos de cannabidiol (CBD) ejercen efectos de alivio del estrés y la ansiedad en animales. A pesar de la creciente popularidad del CBD para uso veterinario, la investigación disponible que detalla los efectos del CBD en caballos es limitada. El objetivo de este estudio (parte 1 de 2) fue analizar los parámetros de estrés a través de observaciones conductuales y monitorización de la frecuencia cardíaca en caballos sanos tras la administración oral única de una pasta que contiene CBD en diferentes dosis. Los productos del estudio fueron dos pastas para administración oral, una que contenía CBD y otra que no contenía ningún ingrediente activo. Las pastas se aplicaron como administración única en ensayos consecutivos con dosis crecientes (dosis: 0,2, 1,0, 3,0 mg de CBD/kg) a un tratamiento (ensayo 1: n = 3, ensayo 2: n = 3, ensayo 3: n = 5 caballos) y un grupo de control (ensayo 1: n = 3, ensayo 2: n = 3, ensayo 3: n = 6 caballos) con períodos mínimos de lavado de siete días entre ellos. Los parámetros conductuales se evaluaron mediante grabaciones de vídeo para puntuar los niveles de sedación, incluidas las reacciones de los caballos a los estímulos acústicos y visuales. La expresión facial se evaluó mediante fotografías. La evaluación se basó en la escala de sedación facial para caballos (FaceSed) y la Escala de Muecas de Caballo. Para los valores basales, se registraron observaciones idénticas el día anterior a cada administración de pasta. Tanto la administración de pasta como la evaluación conductual se realizaron doble ciego. Los intervalos de latido a latido cardíaco (R-R) se registraron continuamente durante todo el ensayo y se evaluaron mediante parámetros de frecuencia cardíaca y variabilidad de la frecuencia cardíaca. El análisis estadístico incluyó la comparación entre el grupo de tratamiento y el grupo de control sobre dosis y puntos de tiempo crecientes utilizando modelos lineales mixtos. La pasta de CBD fue bien tolerada y no se observaron efectos secundarios. El análisis de las puntuaciones de sedación y las expresiones faciales no indicaron diferencias significativas entre el grupo de tratamiento y el grupo de control sobre las dosis crecientes. La frecuencia cardíaca no se redujo, ni se observaron cambios significativos en la variabilidad de la frecuencia cardíaca en comparación con el grupo control. La principal limitación de este estudio es el pequeño tamaño de la muestra. Se requiere más investigación para determinar las dosis e indicaciones adecuadas para el uso de productos de CBD en caballos.
1 Introducción
El cannabidiol (CBD) pertenece a uno de los compuestos más conocidos de las plantas de cannabis y está ganando cada vez más atención en el campo de la medicina veterinaria. A diferencia de Δ9-tetrahidrocannabinol (THC), el CBD no presenta propiedades psicoactivas (1, 2), pero se han probado sus efectos analgésicos, antiinflamatorios y anticonvulsivos en animales de compañía (3-8). Además, actualmente se está investigando el impacto del CBD en el alivio de la ansiedad y el estrés. En los seres humanos, el estrés y la ansiedad son las indicaciones más comunes para el consumo de CBD (9).
Los mecanismos de acción incluyen varias vías: El CBD puede actuar como ligando de la serotonina1A (5-HT1A) (10-14) e inhibe la desactivación de cannabinoides endógenos como la anandamida (AEA) (15-17). El AEA es un ligando del sistema endocannabinoide (eCB) que regula las respuestas emocionales y puede reducir la ansiedad (12, 18, 19). El CBD también puede influir en el cannabinoide tipo 1 (CB1) receptores del sistema eCB como agonista indirecto al aumentar la fluidez de la membrana y, por lo tanto, modular la actividad constitucional del CB1 (12, 20 y 21).
En humanos y roedores, se ha informado que el CBD disminuye la frecuencia cardíaca y muestra efectos ansiolíticos (9, 22-25). Sin embargo, los resultados siguen siendo inconsistentes, ya que otros estudios no pudieron confirmar estos hallazgos en la misma medida (26-29). Otros efectos del CBD incluyen la sedación, que se ha reportado en humanos (30, 31). En perros, las encuestas realizadas entre veterinarios y dueños de mascotas de EE. UU. han informado que la sedación es un efecto secundario percibido después de la suplementación con CBD o cáñamo (32-34). Además, se sugirió que la suplementación con CBD puede disminuir el comportamiento agresivo relacionado con el estrés (1). Otro estudio no pudo identificar una alteración significativa en la actividad diaria o la calidad del sueño en perros (35). Hay pocos informes que detallen el efecto del CBD en el comportamiento equino: un estudio encontró una reducción de la reactividad sin ningún efecto significativo en la frecuencia cardíaca (36). Otros informes no mostraron ningún efecto del CBD sobre la ataxia, las puntuaciones de sedación o el comportamiento equino en general (37, 38). Dos informes de casos describieron el CBD como un tratamiento eficaz para el comportamiento estereotipado, como morderse la cuna y la alodinia mecánica (39, 40). El efecto del CBD en los caballos es de particular interés, ya que todos los cannabinoides están en la lista de sustancias prohibidas emitida por el organismo rector internacional de los deportes ecuestres (FEI, Fédération Equestre Internationale) debido a sus supuestas propiedades psicotrópicas (41).
El objetivo de este estudio fue analizar los niveles de estrés a través de observaciones conductuales y monitoreo de la frecuencia cardíaca en caballos sanos después de la administración oral de una pasta que contiene CBD para validar aún más el comportamiento equino bajo la influencia de la medicación con CBD. Los autores plantearon la hipótesis de que el aumento de las dosis de CBD tendría un efecto calmante moderado en los caballos.
2 Materiales y métodos
2.1 Animales
Doce caballos cruzados Haflinger × Warmblood, incluyendo siete yeguas y cinco sementales, fueron asignados aleatoriamente a un grupo de tratamiento o de control (n = 6 + 6). La edad de los caballos varió entre 3 y 16 años (mediana: 11 años) en el grupo de tratamiento y de 10 a 26 años (mediana: 10,5 años) en el grupo control. Las yeguas y los sementales se alojaban por separado y las yeguas tenían libre acceso al potrero. Todos los caballos fueron alimentados con heno y piensos minerales, y pasaron 8 h al día en pasto. El estudio fue aprobado por la autoridad competente para los procedimientos de autorización y notificación de experimentos con animales (LAVG) en Brandeburgo, Alemania (AZ: 2347-12-2021).
2.2 Productos del estudio
Los productos del estudio fueron dos pastas (tratamiento y control). La pasta de tratamiento contenía un 55% de extracto de planta de CBD de espectro completo, aceite de coco con triglicéridos de cadena media (MCT), fitocannabinoides naturales, terpenos, flavonoides y cera de abejas (TAMACAN XL 55%, Herosan healthcare GmbH, Austria). El contenido de THC estaba por debajo del 0,2%. La pasta de control contenía aceite MCT y cera de abejas solamente. Los ingredientes de ambas pastas fueron analizados y las concentraciones de los contenidos fueron confirmadas por un laboratorio antidopaje independiente y acreditado internacionalmente (Instituto de Bioquímica, Universidad Alemana del Deporte de Colonia, Alemania). Las pastas fueron etiquetadas como «A» o «B» por el fabricante antes del envío para ocultar sus formulaciones. Las personas que manejaban los caballos, es decir, los cuidadores y los tomadores de muestras, desconocían la asignación grupal de los caballos.®
2.3 Estudio de escalada de dosis
El estudio se dividió en tres ensayos con administración de pasta de CBD en dosis crecientes (ensayo 1: 0,2 mg de CBD/kg; ensayo 2: 1 mg de CBD/kg; ensayo 3: 3 mg de CBD/kg). Las dosis se seleccionaron en función de la recomendación del fabricante y de la literatura actual (36, 38). Los dos primeros ensayos se realizaron con tres caballos en cada grupo (n = 3 tratamiento + 3 control) y se prestó especial atención a la aparición de posibles efectos secundarios. El tercer ensayo (3 mg de CBD/kg) se realizó posteriormente con los doce caballos (n = 6 tratamiento + 6 control). El día antes de cada prueba, los caballos fueron examinados físicamente y se colocó un catéter de vena yugular de forma aséptica. El día del juicio, la pasta (A o B) se administró por vía oral a las 6:30 am. Para una mejor aceptación, la pasta se insertó en una golosina. Para determinar los parámetros farmacocinéticos de la administración de CBD en caballos, se tomaron múltiples muestras de sangre y orina a lo largo de los ensayos de todos los caballos (42).
El comportamiento equino se registró para la posterior evaluación de una puntuación de sedación por parte de un observador independiente en los puntos de tiempo 0, 1, 2, 4 y 12 horas (h) después de la administración de la pasta (Figura 1). La ocurrencia y la profundidad de la sedación se determinaron en función de la posición observada de la cabeza del caballo y la reacción a los estímulos acústicos y visuales (Tabla 1). Los estímulos acústicos incluyeron un clicker, ya que se utiliza para el entrenamiento de refuerzo positivo, así como el crujido de una bolsa de plástico. Como estímulo visual, se ató una tela rosa a un palo y se agitó frente a la cara del caballo. Las reacciones a los estímulos fueron grabadas en video. Además, se tomaron fotografías para la posterior valoración de las expresiones faciales. Las expresiones se clasificaron en función de las aberturas orbitales del caballo, la posición de las orejas, la visibilidad de los músculos de la masticación, la posición de los labios y la dilatación de las fosas nasales (Tabla 2).
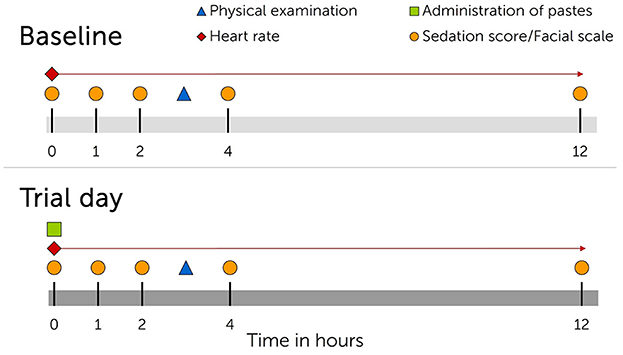 Figura 1. Cronología que muestra las intervenciones para cada ensayo de medicación oral con cannabidiol (CBD). Panel superior, día antes del inicio del juicio. Panel inferior, día del juicio. Los ensayos se repitieron tres veces con la administración única de dosis crecientes de CBD (0,2 mg de CBD/kg de peso corporal; 1 mg de CBD/kg de peso corporal; 3 mg de CBD/kg de peso corporal) y períodos de lavado de un mínimo de siete días entre ensayos.
Figura 1. Cronología que muestra las intervenciones para cada ensayo de medicación oral con cannabidiol (CBD). Panel superior, día antes del inicio del juicio. Panel inferior, día del juicio. Los ensayos se repitieron tres veces con la administración única de dosis crecientes de CBD (0,2 mg de CBD/kg de peso corporal; 1 mg de CBD/kg de peso corporal; 3 mg de CBD/kg de peso corporal) y períodos de lavado de un mínimo de siete días entre ensayos.
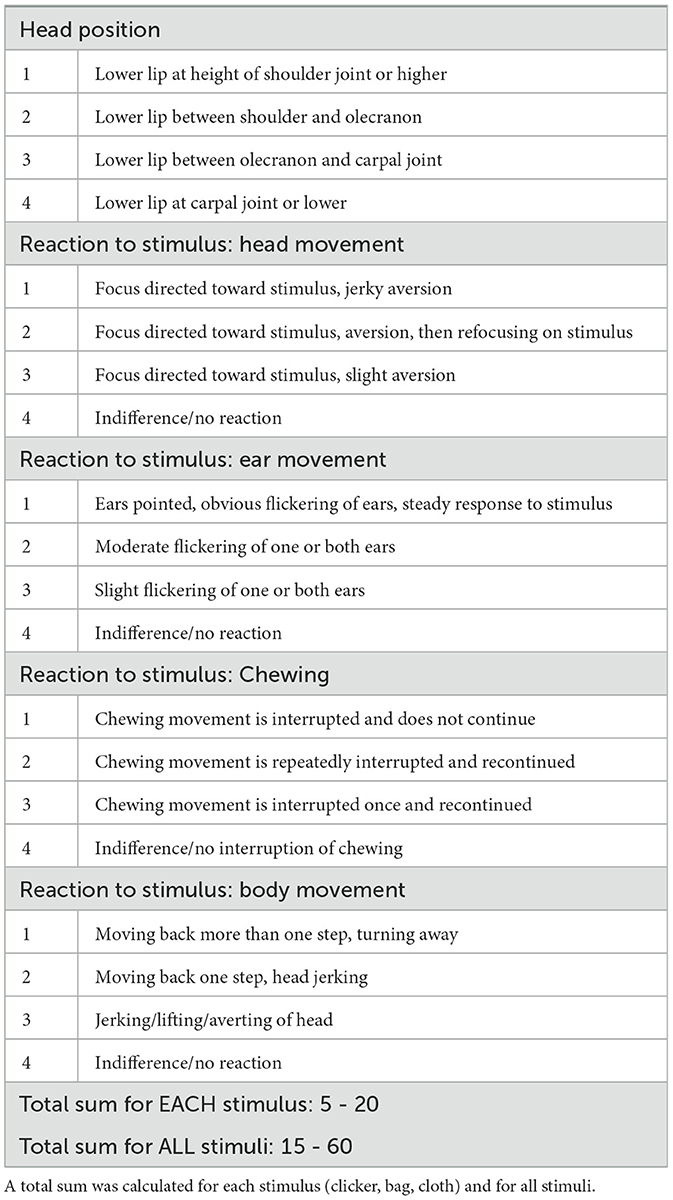 Tabla 1. Puntuación de sedación desarrollada para observaciones conductuales después de la administración oral única de cannabidiol (CBD) en tres dosis crecientes (0,2 mg de CBD/kg; 1 mg de CBD/kg; 3 mg de CBD/kg), basada en la puntuación de sedación de Poller et al. (43).
Tabla 1. Puntuación de sedación desarrollada para observaciones conductuales después de la administración oral única de cannabidiol (CBD) en tres dosis crecientes (0,2 mg de CBD/kg; 1 mg de CBD/kg; 3 mg de CBD/kg), basada en la puntuación de sedación de Poller et al. (43).
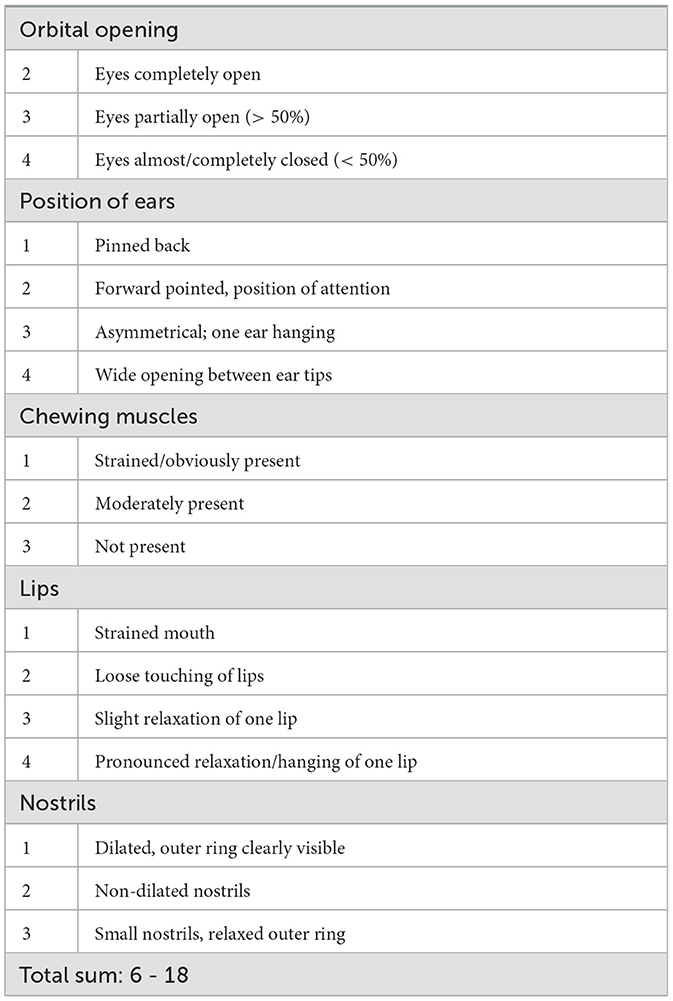 Tabla 2. Escala de expresión facial desarrollada para observaciones conductuales después de la administración oral única de pasta de cannabidiol (CBD) en tres dosis crecientes (0,2 mg de CBD/kg; 1 mg de CBD/kg; 3 mg de CBD/kg), basada en la FaceSed (44) y la Escala de Muecas de Caballo (45).
Tabla 2. Escala de expresión facial desarrollada para observaciones conductuales después de la administración oral única de pasta de cannabidiol (CBD) en tres dosis crecientes (0,2 mg de CBD/kg; 1 mg de CBD/kg; 3 mg de CBD/kg), basada en la FaceSed (44) y la Escala de Muecas de Caballo (45).
La frecuencia cardíaca (FC) de cada caballo se registró de forma continua a lo largo de las pruebas utilizando un sensor de frecuencia cardíaca Polar H10 (Polar Electro Oy, Kempele, Finlandia). El sensor estaba conectado a un cinturón de electrodos que se extendía alrededor del pecho del caballo. Para mejorar el contacto con la piel y la transmisión de señales, el pelaje se recortó e hidrató con agua sobre la base del corazón entre los 4®®ésimo y 5ésimo espacio intercostal donde se colocaron los electrodos. Cada sensor se conectó a un dispositivo móvil a través de Bluetooth para documentar los intervalos cardíacos latido a latido (R-R) con la aplicación Polar Equine (versión 1.2.1, Polar Electro, Kempele, Finlandia).®®
Se realizó un examen físico repetido de 2 a 4 h después de la administración de la pasta y se obtuvieron muestras de sangre para el recuento de glóbulos blancos (GB).
Los valores basales, incluidos los registros del comportamiento equino y la frecuencia cardíaca, se obtuvieron en el mismo patrón que se describió el día anterior a cada ensayo para el análisis comparativo (Figura 1). Los ensayos se dividieron por períodos de lavado de al menos siete días.
2.4 Evaluación de las observaciones conductuales
La evaluación de las grabaciones de vídeo se basó en una puntuación de sedación previamente descrita (43). Para la evaluación de las fotografías se elaboró una escala de expresión facial basada en la escala de sedación facial para caballos (FaceSed) (44) y la Escala de Muecas de Caballo (45). Los parámetros descritos fueron modificados de acuerdo con las reacciones y expresiones observadas en los animales de estudio (Tablas 1, 2). Los videos y fotografías de cada caballo se organizaron al azar y la evaluación ciega fue realizada por una persona que tenía experiencia en estudios de comportamiento equino pero que no participó activamente en ninguno de los ensayos. Para cada caballo, estímulo y punto de tiempo, se sumaron los cinco parámetros de la puntuación de sedación, resultando en puntuaciones que oscilaron entre 5 y 20 (Tabla 1). Las puntuaciones de los tres estímulos se sumaron a un total para cada caballo y punto de tiempo, lo que dio como resultado una puntuación total de sedación que osciló entre 15 y 60. Para la escala de expresión facial, los parámetros se sumaron de manera similar hasta una posible suma total de 6 a 18 para cada punto de tiempo y cada caballo individual. Se dio una puntuación de 10 cuando los ojos estaban abiertos, las orejas apuntando hacia adelante, los músculos masticadores moderadamente presentes, los labios tocándose flojamente y las fosas nasales no dilatadas (Tabla 2). Las puntuaciones altas representan una relajación o sedación más profunda.
2.5 Evaluación de la frecuencia cardíaca y la variabilidad de la frecuencia cardíaca
La frecuencia cardíaca (FC) y la variabilidad de la frecuencia cardíaca (VFC) se analizaron utilizando el software Kubios HRV Standard (ver. 3.5, Kubios Oy, Kuopio, Finlandia). Los parámetros incluyeron la FC media en latidos por minuto (lpm), la raíz cuadrada media de las diferencias sucesivas de latido a latido (RMSSD en milisegundos, ms) y la desviación estándar de los intervalos de latido a latido normales a normales (SDNN, ms). Se aplicó la corrección automática del ritmo para eliminar los artefactos (umbral: muy bajo, 0,3 s). Cada período de grabación se dividió en secciones de 15 minutos como se describió anteriormente (46).®®
2.6 Análisis estadístico
Los datos se registraron en Microsoft Excel (versión 2304) y el análisis estadístico se realizó con SPSS Statistics 27 (IBM, NY, USA). En primer lugar, los datos se analizaron de forma descriptiva: el valor de cada puntuación total de sedación y las puntuaciones de sedación de los tres estímulos se mostraron en gráficos de barras (media + desviación estándar). Para el análisis inductivo, se calculó la diferencia entre la puntuación total de sedación al inicio y durante el ensayo para cada caballo y punto de tiempo (que osciló entre -45 y +45). Del mismo modo, se calcularon las diferencias entre la puntuación basal y el día del juicio para la escala de expresión facial (que osciló entre -12 y +12). Los efectos de los niveles de dosis sobre las diferencias entre el inicio y el día del ensayo de la puntuación total de sedación se analizaron utilizando modelos lineales mixtos. Se asignaron caballos individuales como sujetos, los niveles de dosis como efectos fijos (referencia = grupo control; ensayo 1 = 0,2 mg de CBD/kg; ensayo 2 = 1 mg de CBD/kg; ensayo 3 = 3 mg de CBD/kg) y los puntos temporales como efectos aleatorios (0 h; 1 h; 2 h; 4 h; 12 h). Los residuos se inspeccionaron visualmente para determinar su distribución normal. El nivel de significancia fue de p < 0,05. Para la escala de expresión facial, se calcularon las diferencias entre el inicio y el día del ensayo y se probó el efecto de los niveles de dosis utilizando un modelo lineal mixto como se describió anteriormente.®®®
Para los parámetros de FC, RMSSD y SDNN, se seleccionaron las primeras ocho secciones de 15 minutos (un total de dos horas) posteriores a la administración de la pasta para su análisis, ya que las concentraciones de CBD en sangre alcanzaron un máximo aquí (42). Para probar el efecto de los niveles de dosis en los parámetros, se calcularon modelos lineales mixtos como se describió anteriormente.
Para identificar las diferencias sistemáticas entre los valores basales y los valores del día del ensayo de CRI, RMSSD y SDNN dentro del grupo de tratamiento a lo largo del tiempo, se calcularon modelos mixtos lineales para cada resultado con ensayos (referencia = valor basal; ensayo 1 = 0,2 mg de CBD/kg; ensayo 2 = 1 mg de CBD/kg; ensayo 3 = 3 mg de CBD/kg) como efectos fijos. El siguiente análisis se realizó como se describió anteriormente con caballos individuales como sujetos, niveles de dosis como efectos fijos y puntos de tiempo como efectos aleatorios.
3 Resultados
3.1 Animales
El peso corporal de los caballos fue en promedio de 488 ± 55 kg en el grupo de tratamiento y de 443 ± 56 kg en el grupo de control. Durante los dos primeros ensayos, no se observaron efectos secundarios como intolerancias gastrointestinales después de la aplicación de la pasta y se consideró seguro continuar con el tercer ensayo. Durante el tercer ensayo, una yegua desarrolló signos de una tromboflebitis en la vena yugular y fue excluida, lo que resultó en que cinco caballos restantes en el grupo de tratamiento completaran el tercer ensayo (n = 5 + 6). En todos los ensayos, el recuento de leucocitos se mantuvo cerca del rango de referencia con solo una elevación leve de leucocitos (leucocitos máximos en el grupo de tratamiento = 11,63 109/L) (Cuadro 3).
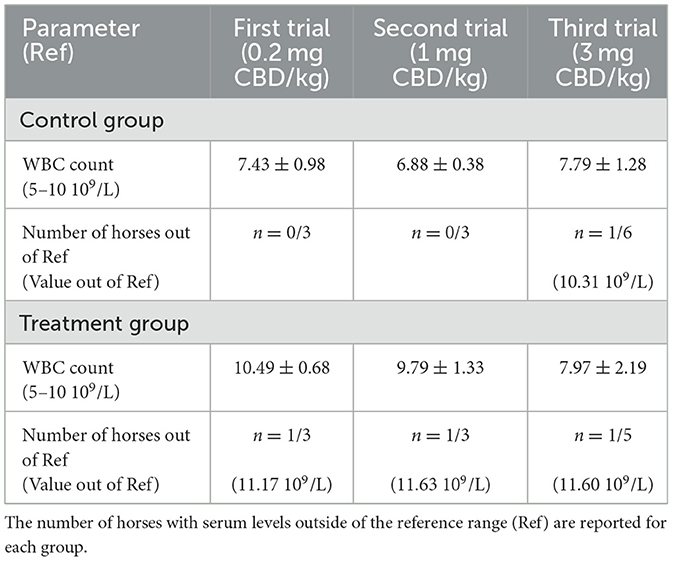 Tabla 3. Media ± desviación estándar del recuento de glóbulos blancos (GB) después de la administración oral única de una pasta que contiene cannabidiol (CBD) en tres ensayos.
Tabla 3. Media ± desviación estándar del recuento de glóbulos blancos (GB) después de la administración oral única de una pasta que contiene cannabidiol (CBD) en tres ensayos.
3.2 Observaciones conductuales
3.2.1 Puntuación de sedación
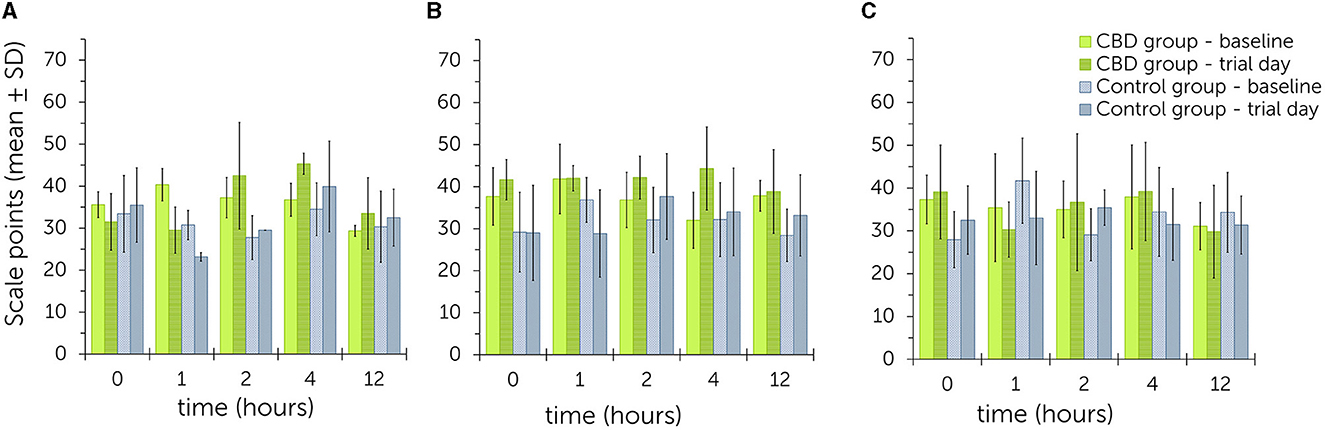
Para los tres ensayos, la ilustración gráfica de los datos estadísticos mediante gráficos de barras no identificó una tendencia clara para puntuaciones de sedación más altas o más bajas entre los grupos o los niveles de dosis (Figura 2, Figuras suplementarias S1-S3). Durante el ensayo 1, las puntuaciones generales de los valores basales oscilaron entre 29,3 ± 1,3 y 40,3 ± 3,9 en todos los momentos del grupo de tratamiento. Las puntuaciones generales para los valores del día de prueba oscilaron entre 29,5 ± 5,5 y 45,3 ± 2,5 en todos los puntos temporales. En el grupo control, los valores oscilaron entre 27,8 ± 5,3 a 34,5 ± 6,3 al inicio y entre 23,2 ± 1,0 a 39,9 ± 10,8 el día del ensayo. No se observó ninguna tendencia a que los valores fueran generalmente más altos o más bajos en ciertos momentos en ninguno de los grupos.
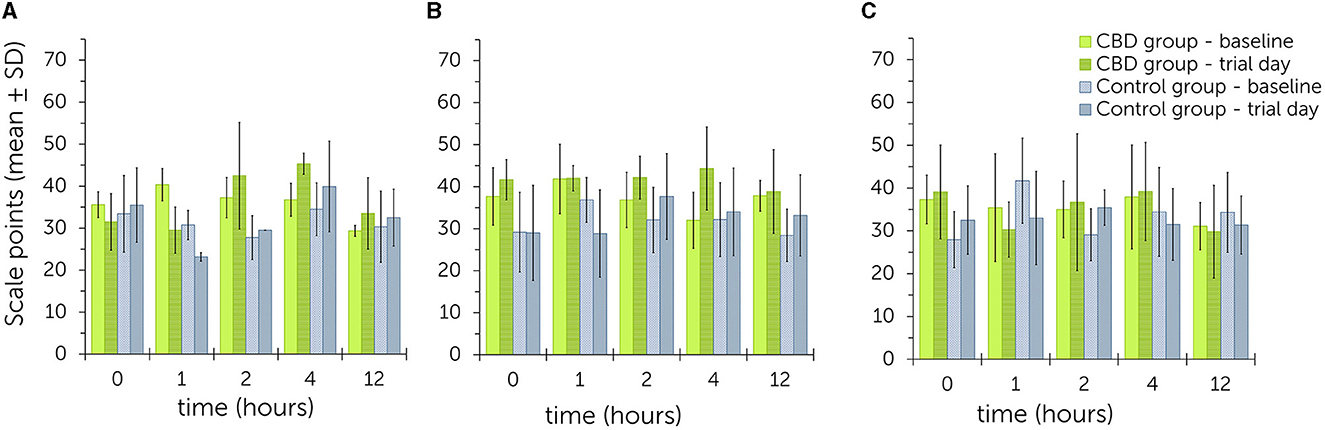 Figura 2. Puntuaciones resumidas de sedación después de estimulaciones acústicas y visuales (clicker, bolsa de plástico, tela rosa) después de la administración oral única de pasta de cannabidiol (CBD) en dosis crecientes (A: 0,2 mg de CBD/kg; B: 1 mg de CBD/kg; C: 3 mg de CBD/kg) – comparación entre los valores obtenidos al inicio y el día del ensayo para el grupo de tratamiento y control. Los puntos de escala más altos se relacionan con un mayor nivel de sedación (Tabla 1). No se encontraron diferencias significativas entre el grupo de tratamiento y el grupo control en los tres ensayos.
Figura 2. Puntuaciones resumidas de sedación después de estimulaciones acústicas y visuales (clicker, bolsa de plástico, tela rosa) después de la administración oral única de pasta de cannabidiol (CBD) en dosis crecientes (A: 0,2 mg de CBD/kg; B: 1 mg de CBD/kg; C: 3 mg de CBD/kg) – comparación entre los valores obtenidos al inicio y el día del ensayo para el grupo de tratamiento y control. Los puntos de escala más altos se relacionan con un mayor nivel de sedación (Tabla 1). No se encontraron diferencias significativas entre el grupo de tratamiento y el grupo control en los tres ensayos.
Durante el ensayo 2, los valores basales oscilaron entre 32,0 ± 6,7 a 41,8 ± 8,3 y los valores del día del ensayo entre 38,8 ± 10,0 a 44,3 ± 9,9 en el grupo de tratamiento. Todos los valores fueron más altos el día del ensayo que al inicio del estudio, como se ejemplifica en la ilustración gráfica. En el grupo control, los valores basales estuvieron entre 28,4 ± 6,2 a 36,8 ± 7,3 y los valores del día del ensayo entre 28,8 ± 10,4 a 37,7 ± 10,2. Los valores fueron más altos el día del juicio que los valores basales correspondientes en los puntos de tiempo 2, 4 y 12.
Durante el ensayo 3, los valores basales en el grupo de tratamiento estuvieron entre 31,1 ± 5,5 a 37,9 ± 12,2 y los valores del día del ensayo entre 29,8 ± 10,8 a 39,2 ± 11,4. En el grupo control, los valores basales oscilaron entre 28,0 ± 6,6 y 41,7 ± 9,9 y los valores del día del ensayo entre 31,3 ± 6,7 y 35,4 ± 4,1. No se observó ninguna tendencia a que los valores fueran generalmente más altos o más bajos en ciertos momentos en ninguno de los grupos.
Los modelos mixtos lineales con dosis crecientes como efectos fijos no identificaron diferencias significativas entre la suma total de las puntuaciones de sedación en el grupo de tratamiento y control [P(F) = 0,527]. Incluso durante el ensayo 2, la diferencia no fue significativa [P(F) = 0,180]. Del mismo modo, las puntuaciones individuales no se vieron influenciadas significativamente por el aumento de las dosis de estimulación con un clicker [P(F) = 0,196], el crujido de una bolsa de plástico [P(F) = 0,442] o el saludo con la tela rosa [P(F) = 0,915]. Las estimaciones de los efectos aleatorios para la suma total fueron: β = 25,9 [intervalos de confianza [IC] del 95% = 6,7, 100,6; error estándar (EE) = 17,9], para clicker: β = 7,7 (IC del 95% = 2,9, 20,4; EE = 3,8) y para bolsa de plástico: β = 1,3 (IC 95% = 0,0, 126,8; SE = 3,0). No se estimaron efectos aleatorios para la estimulación visual con un paño. Para la suma total, el 21,7% de la variabilidad se debió a diferencias entre puntos temporales. Para la estimulación con clicker y bolsa de plástico, los puntos de tiempo como efectos aleatorios se atribuyeron a 32,6 y 4,7% de variabilidad, respectivamente.
3.2.2 Escala de expresión facial
En la Tabla Suplementaria S1 se muestran ejemplos de puntuación de las expresiones faciales. En la Figura 3 se muestra una ilustración gráfica de las puntuaciones de sedación.
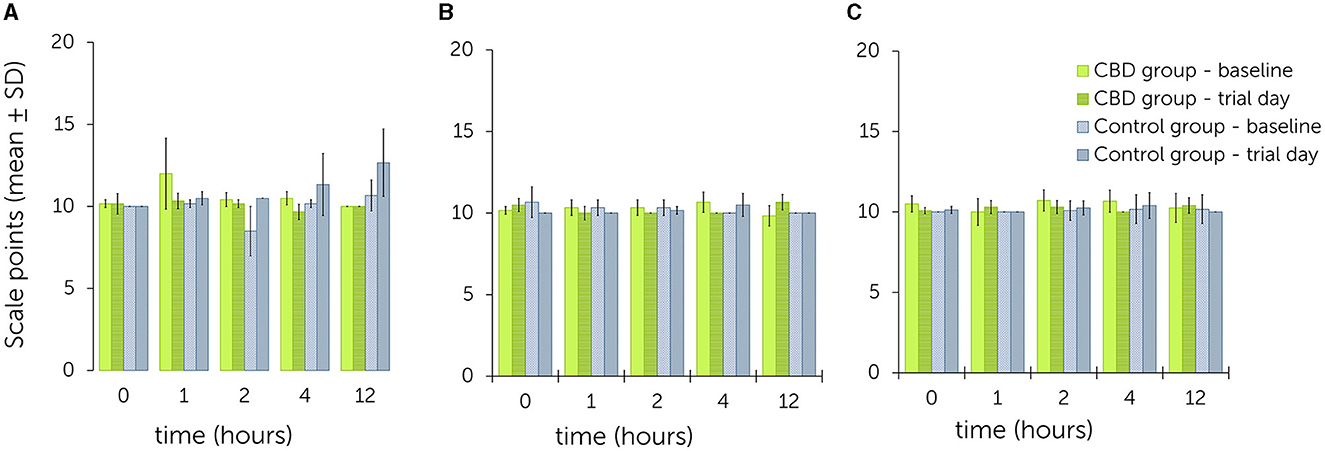 Figura 3. Escala de expresión facial tras la administración oral única de pasta de cannabidiol (CBD) en dosis crecientes (A: 0,2 mg de CBD/kg; B: 1 mg de CBD/kg; C: 3 mg de CBD/kg) – comparación entre los valores obtenidos al inicio y el día del ensayo para el grupo de tratamiento y control. Los puntos de escala más altos se relacionan con un mayor nivel de sedación (Tabla 2).
Figura 3. Escala de expresión facial tras la administración oral única de pasta de cannabidiol (CBD) en dosis crecientes (A: 0,2 mg de CBD/kg; B: 1 mg de CBD/kg; C: 3 mg de CBD/kg) – comparación entre los valores obtenidos al inicio y el día del ensayo para el grupo de tratamiento y control. Los puntos de escala más altos se relacionan con un mayor nivel de sedación (Tabla 2).
Durante el ensayo 1, las puntuaciones generales de los valores basales oscilaron entre 10,0 ± 0,0 y 12,0 ± 2,2 en todos los momentos del grupo de tratamiento. Las puntuaciones generales para los valores del día de prueba oscilaron entre 9,7 ± 0,5 y 10,3 ± 0,5 en todos los puntos temporales. Todos los valores fueron iguales o inferiores el día del ensayo que al inicio del estudio. En el grupo control, los valores basales oscilaron entre 8,5 ± 1,5 y 10,7 ± 0,9 y entre 10,0 ± 0,0 y 12,7 ± 2,1 el día del ensayo. Todos los valores fueron iguales o superiores el día del ensayo que al inicio del estudio. En este ensayo, las diferencias más notables entre el inicio y el día del ensayo se encontraron en el punto de tiempo 1 (grupo de tratamiento: 12,0 ± 2,2 a 10,3 ± 0,5) y en el punto de tiempo 12 (grupo de control: 10,7 ± 0,9 a 12,7 ± 2,1).
Durante el ensayo 2, los valores basales en el grupo de tratamiento estuvieron entre 9,8 ± 0,6 a 10,7 ± 0,6 y los valores del día del ensayo entre 10,0 ± 0,0 a 10,7 ± 0,5. En el grupo control, los valores basales oscilaron entre 10,0 ± 0,0 a 10,7 ± 0,9 y los valores del día del ensayo entre 10,0 ± 0,0 a 10,5 ± 0,7. No se observó ninguna tendencia a que los valores fueran generalmente más altos o más bajos en ciertos momentos en ninguno de los grupos.
Durante el ensayo 3, los valores basales en el grupo de tratamiento oscilaron entre 10,0 ± 0,8 y 10,7 ± 0,7 y los valores del día del ensayo entre 10,0 ± 0,0 y 10,4 ± 0,5. En el grupo control, los valores basales oscilaron entre 10,0 ± 0,0 a 10,2 ± 0,9 y los valores del día del ensayo entre 10,0 ± 0,0 a 10,4 ± 0,8. No se observó ninguna tendencia a que los valores fueran generalmente más altos o más bajos en ciertos momentos en ninguno de los grupos.
El modelo mixto lineal no identificó un efecto significativo del aumento de las dosis de CBD en la escala de expresión facial en comparación con el grupo de control [P(F) = 0,080]. Considerando las estimaciones de efectos fijos, se evidenció un efecto significativo entre el ensayo 1 y el grupo control (p = 0,021) (Tabla 4). El cálculo de los efectos aleatorios fue β = 0,1 (IC del 95% = 0,0, 27,4; SE = 0,2) con un 3,3% de variabilidad atribuida a las diferencias entre puntos temporales.
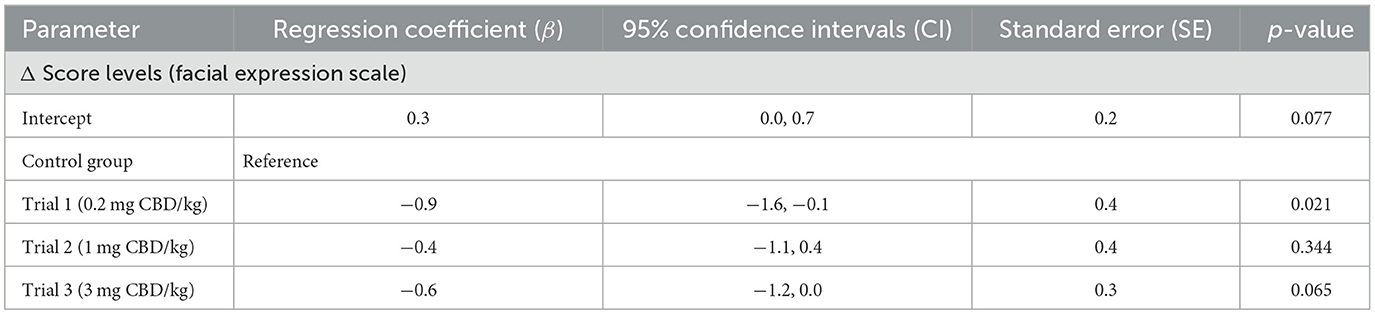 Tabla 4. Estimaciones de efectos fijos para la comparación de las diferencias (Δ) entre los niveles de puntuación alcanzados en una escala de expresión facial en los días iniciales y de ensayo [administración oral única de pasta de cannabidiol (CBD) en tres dosis crecientes (0,2 mg de CBD/kg; 1 mg de CBD/kg; 3 mg de CBD/kg)].
Tabla 4. Estimaciones de efectos fijos para la comparación de las diferencias (Δ) entre los niveles de puntuación alcanzados en una escala de expresión facial en los días iniciales y de ensayo [administración oral única de pasta de cannabidiol (CBD) en tres dosis crecientes (0,2 mg de CBD/kg; 1 mg de CBD/kg; 3 mg de CBD/kg)].
3.3 Frecuencia cardíaca y variabilidad de la frecuencia cardíaca
3.3.1 Comparación entre el grupo de tratamiento y el grupo control
Los valores medios de FC y VFC se muestran en la Tabla 5. En los días de ensayo, la FC media en las primeras 2 h después de la administración de la pasta fue de entre 42,1 ± 8,6 lpm a 45,4 ± 7,5 lpm en el grupo de tratamiento, y entre 41,3 ± 8,2 lpm a 44,4 ± 9,8 lpm en el grupo control.
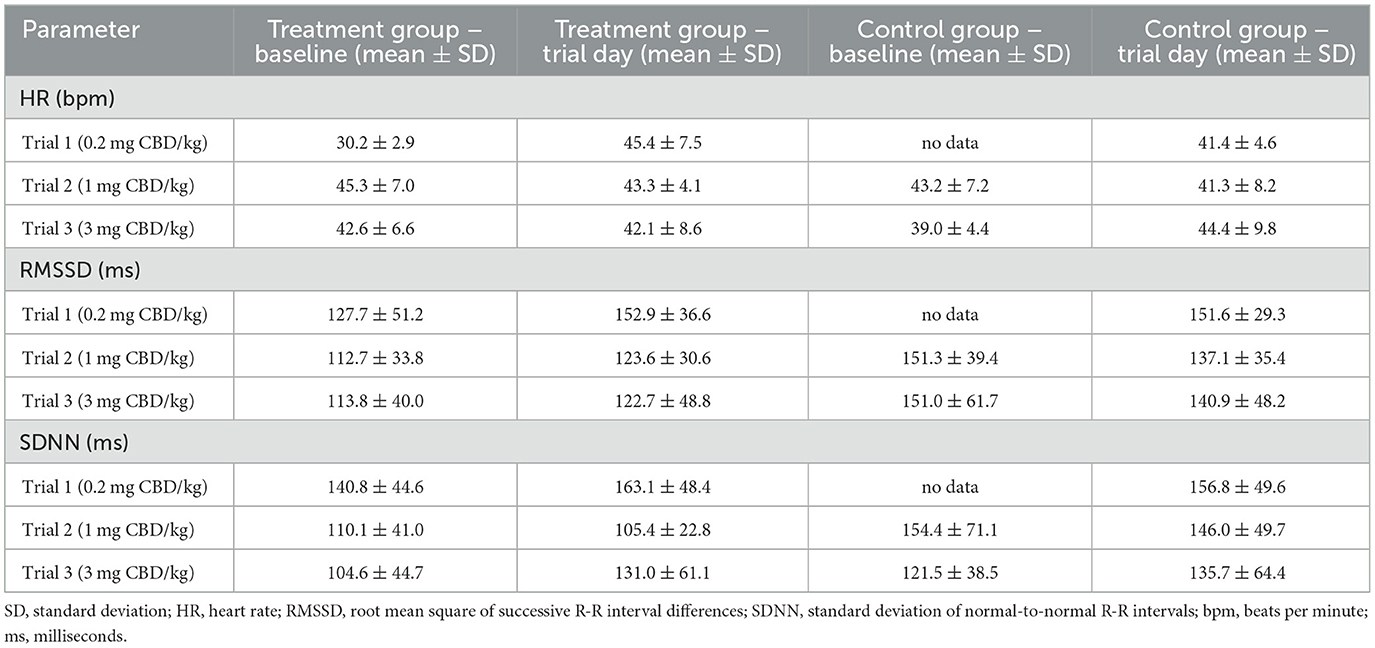 Tabla 5. Valores medios ± de DE para los valores de FC, RMSSD y SDNN desde las primeras 2 h después de la administración de pasta de cannabidiol (CBD) oral única con los valores basales correspondientes. Debido a problemas técnicos, los datos del intervalo R-R del ensayo 1 están parcialmente incompletos.
Tabla 5. Valores medios ± de DE para los valores de FC, RMSSD y SDNN desde las primeras 2 h después de la administración de pasta de cannabidiol (CBD) oral única con los valores basales correspondientes. Debido a problemas técnicos, los datos del intervalo R-R del ensayo 1 están parcialmente incompletos.
Los valores de RMSSD oscilaron entre 122,7 ± 48,8 ms y 152,9 ± 36,6 ms en el grupo de tratamiento, y entre 137,1 ± 35,4 ms y 151,6 ± 29,3 ms en el grupo control. Para SDNN, los valores medios estuvieron entre 105,4 ± 22,8 ms y 163,1 ± 48,4 ms en el grupo de tratamiento, y entre 135,7 ± 64,4 ms y 156,8 ± 49,6 ms en el grupo control. Las representaciones gráficas de la FC media, RMSSD y SDNN se muestran en las Figuras 4 a 6 (días de prueba) y en las Figuras Suplementarias S4 a S6 (línea de base).
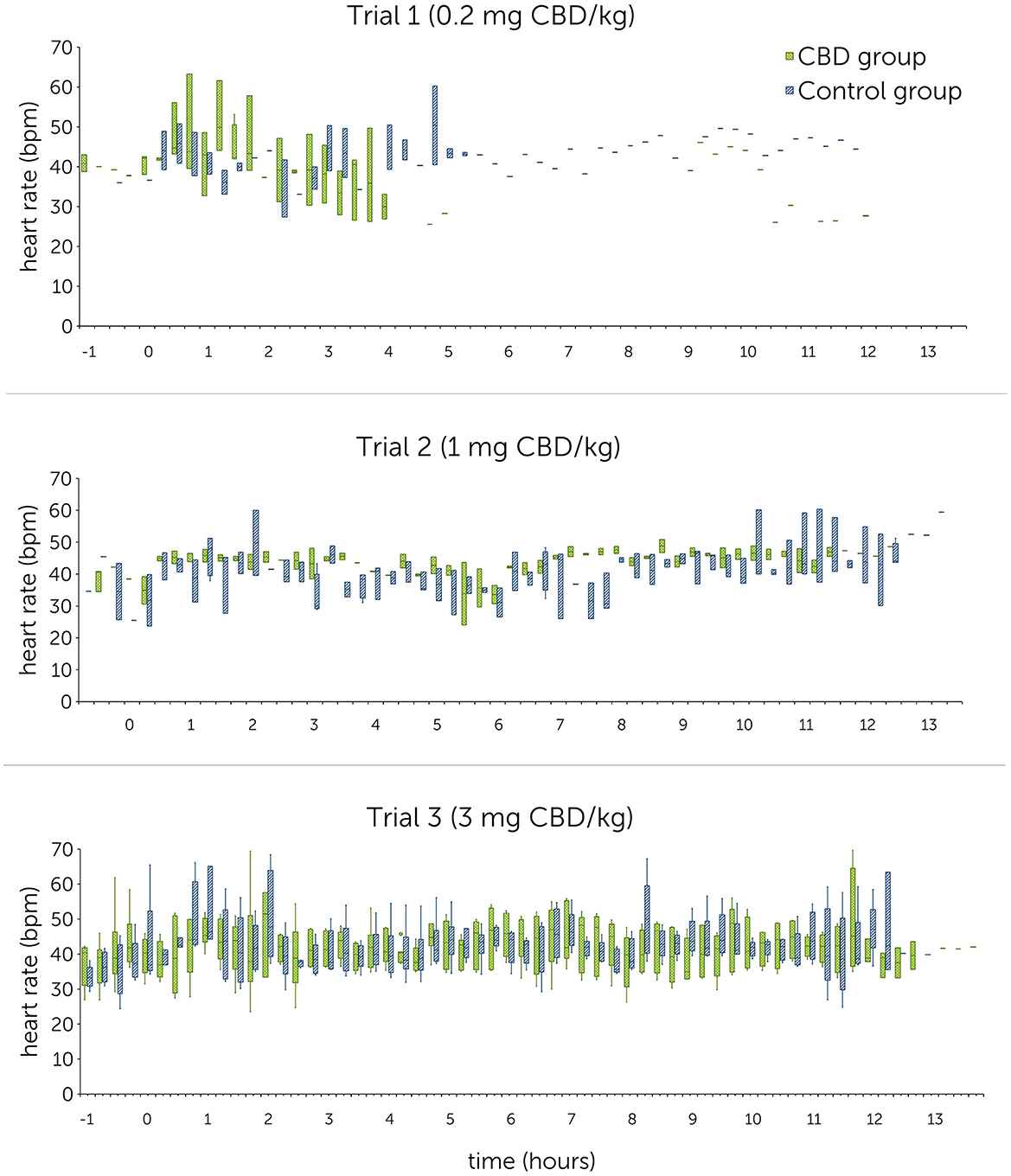 Figura 4. Frecuencia cardíaca [latidos por minuto (lpm)] después de la administración oral única de cannabidiol (CBD) en tres dosis crecientes (0,2 mg de CBD/kg de peso corporal; 1 mg de CBD/kg de peso corporal; 3 mg de CBD/kg de peso corporal) en el punto de tiempo 0, mostradas en secciones de 15 minutos durante 12 h. Debido a problemas técnicos, los datos del intervalo R-R del ensayo 1 están parcialmente incompletos.
Figura 4. Frecuencia cardíaca [latidos por minuto (lpm)] después de la administración oral única de cannabidiol (CBD) en tres dosis crecientes (0,2 mg de CBD/kg de peso corporal; 1 mg de CBD/kg de peso corporal; 3 mg de CBD/kg de peso corporal) en el punto de tiempo 0, mostradas en secciones de 15 minutos durante 12 h. Debido a problemas técnicos, los datos del intervalo R-R del ensayo 1 están parcialmente incompletos.
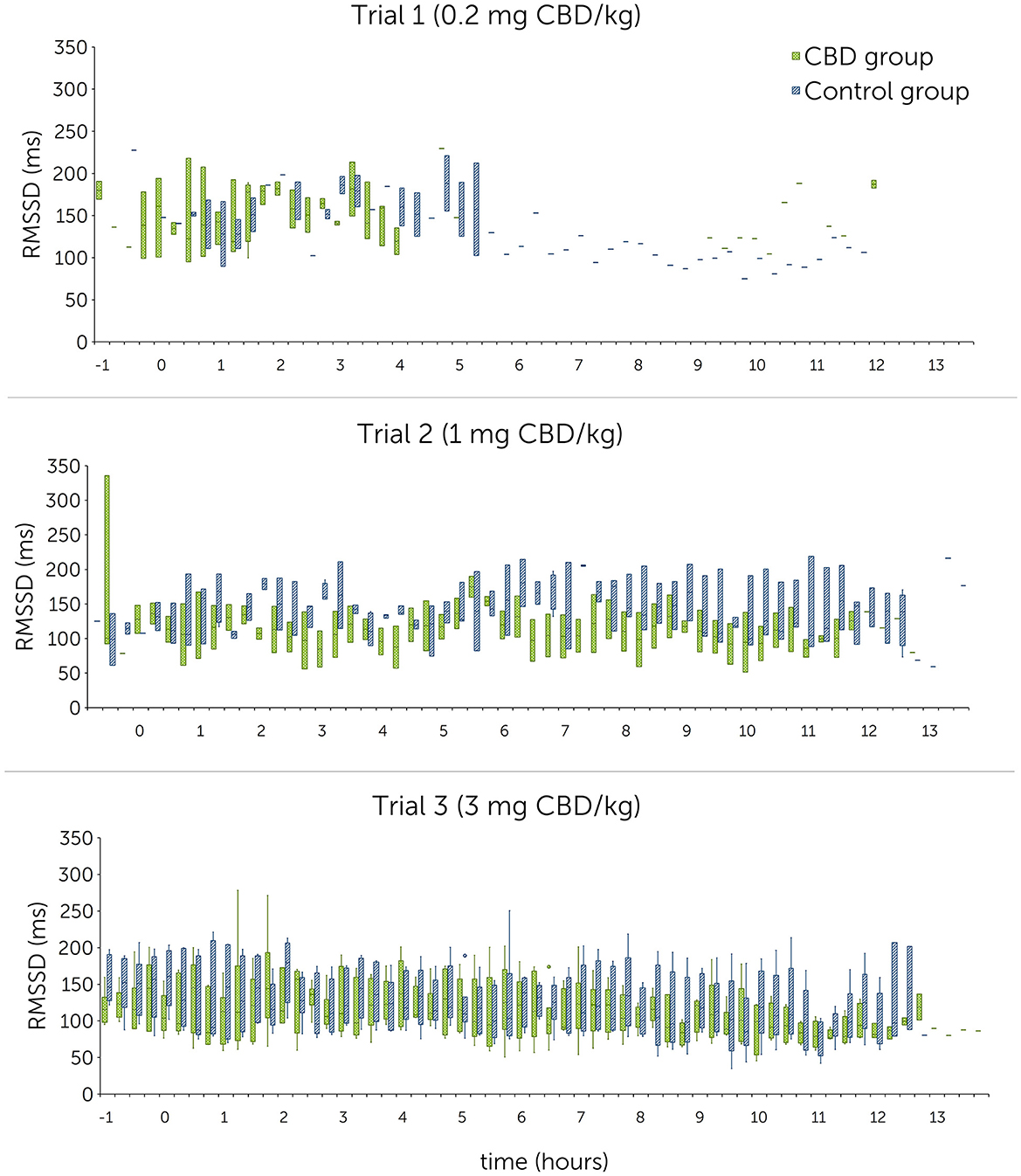 Figura 5. Raíz cuadrática media de las diferencias sucesivas del intervalo R-R (RMSSD) en milisegundos (ms) después de la administración oral única de cannabidiol (CBD) en tres dosis crecientes (0,2 mg de CBD/kg de peso corporal; 1 mg de CBD/kg de peso corporal; 3 mg de CBD/kg de peso corporal) en el punto de tiempo 0, mostrada en secciones de 15 minutos durante 12 h. Debido a problemas técnicos, los datos del intervalo R-R del ensayo 1 están parcialmente incompletos.
Figura 5. Raíz cuadrática media de las diferencias sucesivas del intervalo R-R (RMSSD) en milisegundos (ms) después de la administración oral única de cannabidiol (CBD) en tres dosis crecientes (0,2 mg de CBD/kg de peso corporal; 1 mg de CBD/kg de peso corporal; 3 mg de CBD/kg de peso corporal) en el punto de tiempo 0, mostrada en secciones de 15 minutos durante 12 h. Debido a problemas técnicos, los datos del intervalo R-R del ensayo 1 están parcialmente incompletos.
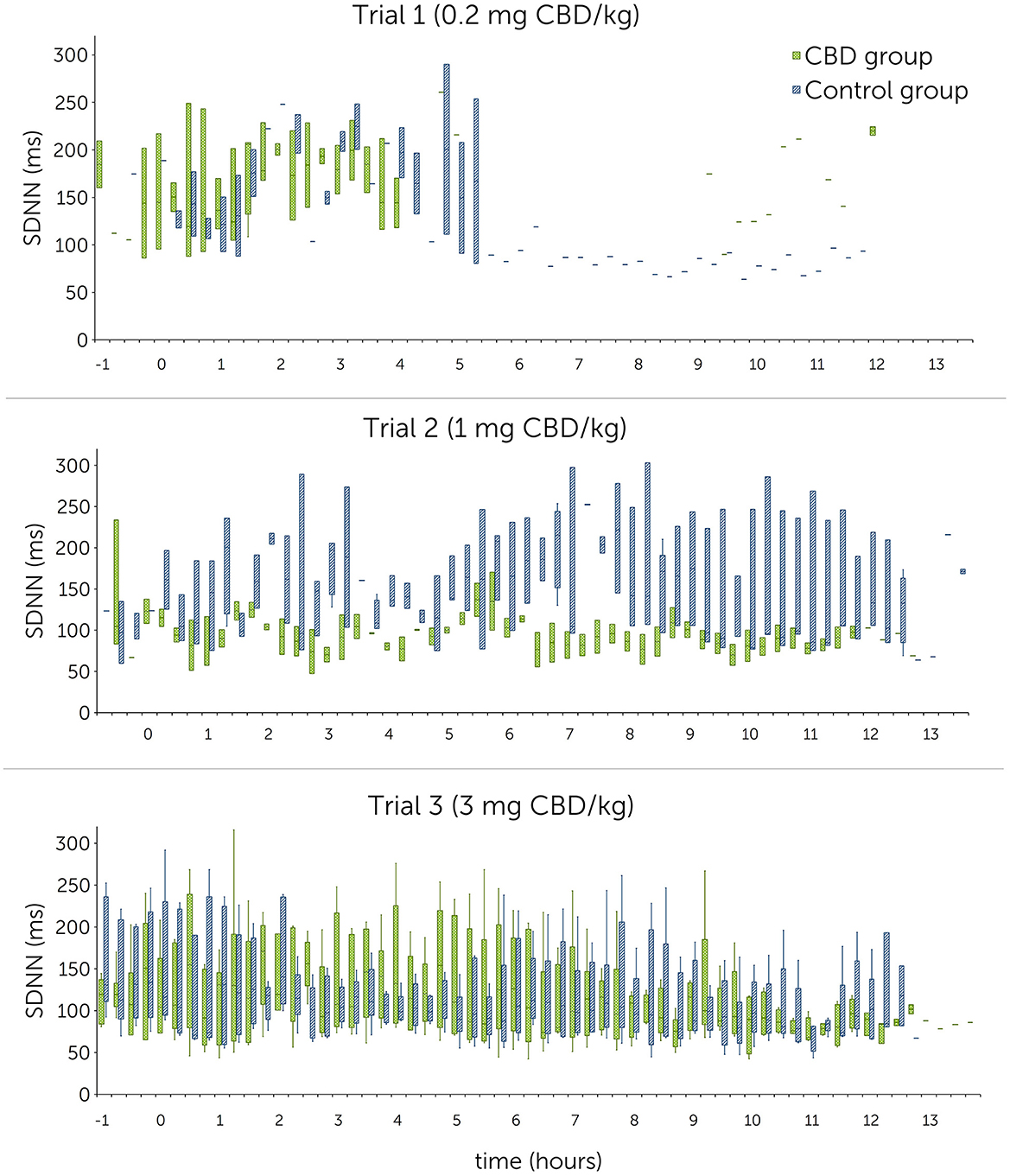 Figura 6. Intervalos R-R normales (SDNN) en milisegundos (ms) después de la administración oral única de cannabidiol (CBD) en tres dosis crecientes (0,2 mg de CBD/kg de peso corporal; 1 mg de CBD/kg de peso corporal; 3 mg de CBD/kg de peso corporal) en el punto de tiempo 0, mostrados en secciones de 15 minutos durante 12 h. Debido a problemas técnicos, los datos del intervalo R-R del ensayo 1 están parcialmente incompletos.
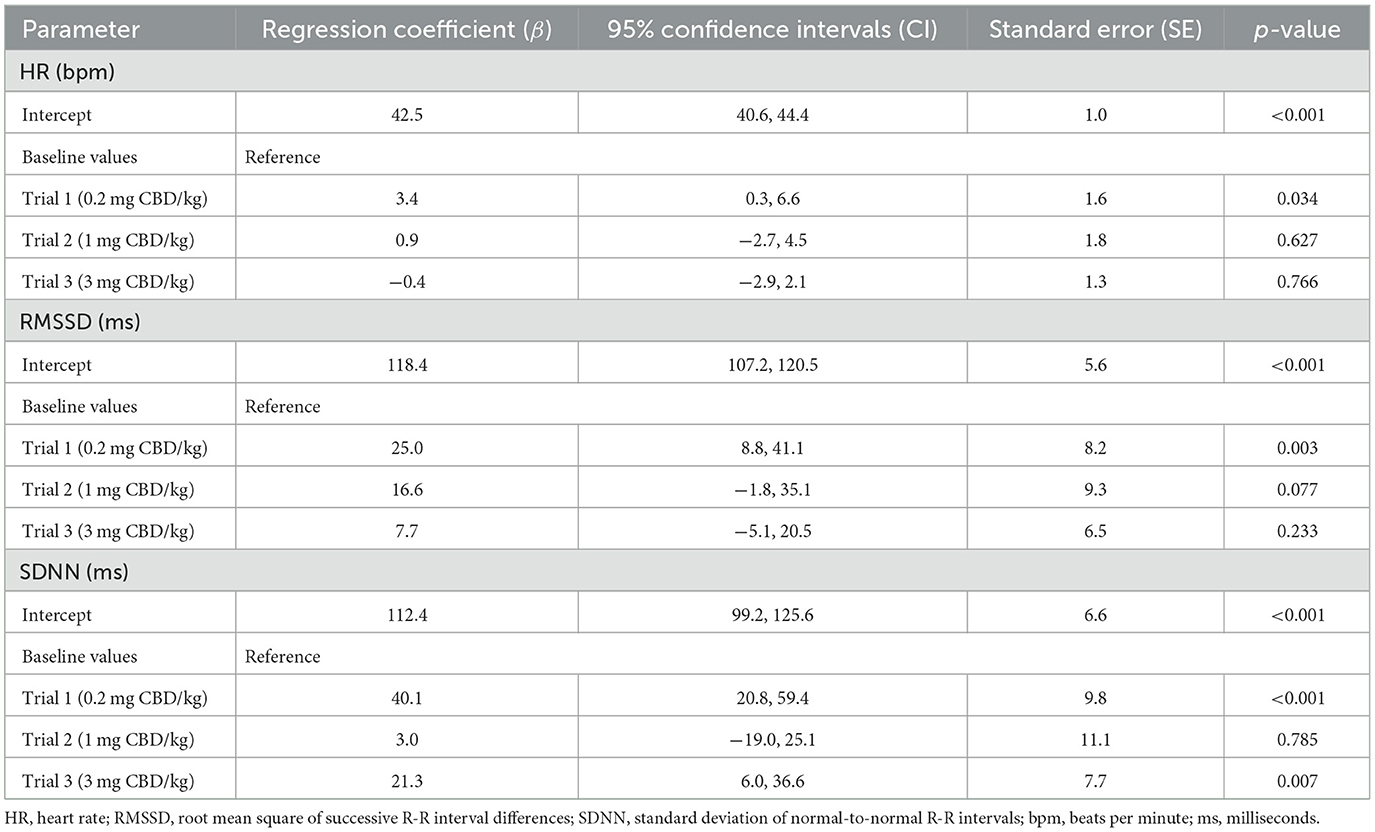
Figura 6. Intervalos R-R normales (SDNN) en milisegundos (ms) después de la administración oral única de cannabidiol (CBD) en tres dosis crecientes (0,2 mg de CBD/kg de peso corporal; 1 mg de CBD/kg de peso corporal; 3 mg de CBD/kg de peso corporal) en el punto de tiempo 0, mostrados en secciones de 15 minutos durante 12 h. Debido a problemas técnicos, los datos del intervalo R-R del ensayo 1 están parcialmente incompletos.El análisis estadístico utilizando modelos lineales mixtos encontró que las dosis como efectos fijos no tuvieron un impacto significativo en la FC [P(F) = 0,139], RMSSD [P(F) = 0,104] y SDNN [P(F) = 0,202]. No se pudo identificar una diferencia significativa ni siquiera entre la dosis más alta de CBD (3 mg de CBD/kg) y el grupo control (HR: p = 0,377; RMSSD: p = 0,189; SDNN: p = 0,734) (Tabla 6).
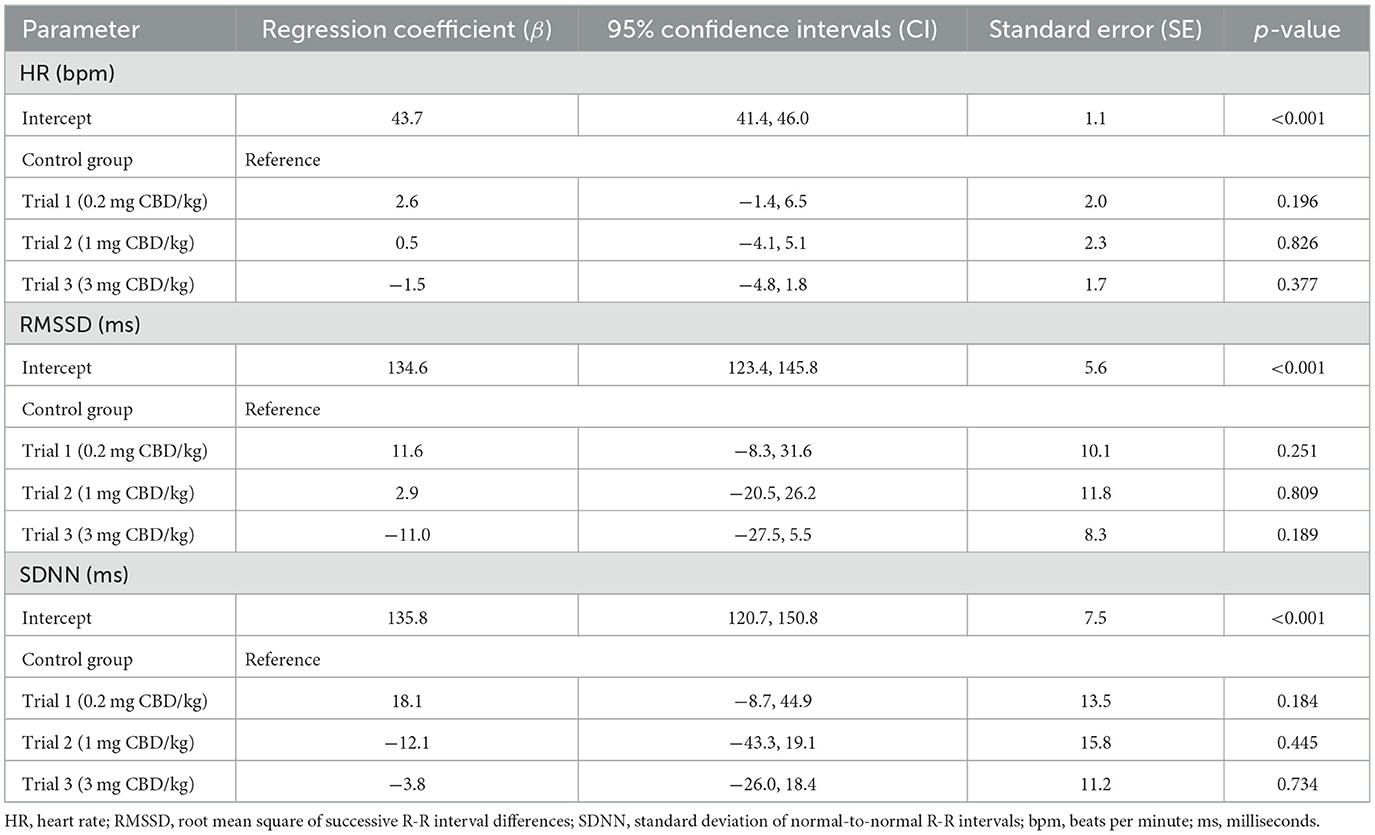 Tabla 6. Estimaciones de efectos fijos para la comparación entre el grupo de tratamiento y control de los valores de HR, RMSSD y SDNN desde las primeras 2 h después de la administración oral única de pasta de cannabidiol (CBD) en tres dosis crecientes (0,2 mg de CBD/kg; 1 mg de CBD/kg; 3 mg de CBD/kg).
Tabla 6. Estimaciones de efectos fijos para la comparación entre el grupo de tratamiento y control de los valores de HR, RMSSD y SDNN desde las primeras 2 h después de la administración oral única de pasta de cannabidiol (CBD) en tres dosis crecientes (0,2 mg de CBD/kg; 1 mg de CBD/kg; 3 mg de CBD/kg).
Para el CRI, el cálculo de los efectos aleatorios fue β = 31,5 (IC del 95% = 15,1, 65,7; SE = 11,8). Las diferencias entre tramos de tiempo explican el 44,1% de la variabilidad. La estimación de la RMSSD fue β = 607,0 (IC del 95% = 262,0, 1406,3; SE = 260,2) y el 33,2% de la variabilidad se atribuyó a las secciones temporales. Para SDNN, β fue 1107,0 (IC 95% = 456,3, 2685,8; SE = 500,6). Las secciones de tiempo se asociaron con un 33,7% de variabilidad.
3.3.2 Comparación entre el inicio y el día del ensayo dentro del grupo de tratamiento
Los valores medios de FC no mostraron ninguna tendencia que indicara un aumento o disminución constante desde el inicio hasta el día del ensayo en el grupo de tratamiento (Tabla 5). Los valores medios de RMSSD y SDNN mostraron un aumento constante desde el inicio hasta el día del ensayo durante todos los ensayos, excepto por una disminución en los valores de SDNN durante el ensayo 2 (110,1 ± 41,0 ms a 105,4 ± 22,8 ms).
El examen de las diferencias entre los valores iniciales y los valores del día del ensayo no identificó ningún efecto significativo para el CRI [P(F) = 0,136] en los tres ensayos, pero encontró efectos significativos para la DMRSD [P(F) = 0,016] y la SDNN [P(F) < 0,001]. Ambos hallazgos significativos pueden atribuirse a los ensayos 1 y 3 (Tabla 7). Los cálculos de los efectos aleatorios para el CRI fueron: β = 13,1 (IC del 95% = 5,0, 34,1; EE = 6,4), para RMSSD: β = 768,5 (IC 95% = 399,6, 1478,2; EE = 256,5) y para SDNN: β = 1052,6 (IC 95% = 537,88, 2060,1; SE = 360,6). Para los valores de FC, RMSSD y SDNN, las diferencias entre secciones de tiempo explican el 22,5%, el 40,6% y el 39,6% de la variabilidad, respectivamente.
La
Tabla 7. Estimaciones de efectos fijos para la comparación dentro del grupo de tratamiento de los valores de HR, RMSSD y SDNN desde las primeras 2 h entre el inicio y la administración oral única de pasta de cannabidiol (CBD) en tres dosis crecientes (0,2 mg de CBD/kg; 1 mg de CBD/kg; 3 mg de CBD/kg).
4 Discusión
investigación de los parámetros de estrés en caballos sanos, incluidas las observaciones del comportamiento y la monitorización de la frecuencia cardíaca, tras la administración oral de una pasta que contenía CBD en dosis crecientes no identificó diferencias significativas consistentes en comparación con un grupo de control.
Los productos de CBD se comercializan para una variedad de afecciones en animales, incluida la mejora del bienestar general y el efecto calmante y aliviador del estrés (3-8). La sedación es un efecto secundario asociado con la aplicación de CBD en humanos y perros (30-34, 47). Para evaluar la sedación en caballos se han propuesto múltiples sistemas de puntuación, pero están dirigidos principalmente a probar sedantes como la detomidina o la acepromazina (43, 48, 49). Dado que los niveles de sedación en este estudio no fueron pronunciados y la puntuación basada en escalas establecidas no produjo resultados satisfactorios, se ajustó una escala de sedación previamente descrita (43) al comportamiento exhibido por los caballos en el presente estudio (37). Los niveles de dosis probados en este estudio (0,2 mg de CBD/kg, 1 mg de CBD/kg, 3 mg de CBD/kg) no dieron lugar a ninguna diferencia significativa en las puntuaciones de sedación después de la estimulación acústica o visual en comparación con el grupo de control. Esto concuerda con un informe anterior en el que se puntuaron los niveles de sedación en caballos tras la administración de CBD (37). En este informe, se administraron gránulos que contenían 150 mg de CBD (~ 0,29 mg de CBD/kg) durante 56 días sin que se detectaran diferencias significativas en los niveles de sedación en comparación con un grupo de control. En humanos, la sedación se describió como un efecto secundario después de la ingesta oral diaria de un total de 600 mg de CBD durante 6 semanas (47). Estudios futuros pueden investigar si la administración de dosis más altas conduce a signos más significativos de sedación en caballos.
Se tomaron fotografías para evaluar la posible influencia del CBD en la expresión facial de los equinos. Los sistemas de puntuación existentes, incluidos FaceSed y Horse Grimace Scale (HGS), se modificaron para adaptarse al propósito del presente informe, ya que la administración de CBD no produjo niveles de sedación en comparación con los representados en la escala FaceSed (44, 45). Los caballos también mostraron expresiones faciales descritas en el HGS, como la boca tensa y los músculos de la masticación. Como los caballos incluidos en el presente estudio no se sometieron a ningún procedimiento doloroso, expresiones similares fueron interpretadas como signos de estrés. También se exhibieron expresiones relacionadas con la molestia, como las orejas hacia atrás. Solo las puntuaciones modificadas del ensayo 1 (0,2 mg de CBD/kg) fueron significativamente diferentes cuando se compararon entre el grupo de tratamiento y el grupo de control (p = 0,021). Los niveles de puntuación fueron más altos al inicio que el día del ensayo en el grupo de tratamiento en los puntos de tiempo 1, 2 y 4, mientras que los niveles de puntuación en el grupo de control fueron consistentemente más bajos al inicio que el día del ensayo (Figura 3). Dado que este resultado es el único evento significativo en esta parte del estudio y las comparaciones con las administraciones de dosis más altas no produjeron resultados significativos, su relevancia debe interpretarse con precaución.
El CBD reduce la ansiedad y el estrés al actuar como agonista directo o indirecto del 5-HT1A– y CB1-receptores (10-14, 20). Los niveles de estrés pueden evaluarse en función de los cambios en la frecuencia cardíaca y la variabilidad de la frecuencia cardíaca en caballos (50-53). Una FC comparativamente más baja y un aumento de los valores de VFC (RMSSD y SDNN) indican un cambio autonómico hacia una dominancia parasimpática y, por lo tanto, una reducción del estrés (50, 52, 54). En roedores, se ha demostrado que el CBD inyectado intraperitonealmente una sola vez (10 mg/kg) reduce el aumento de la FC y la presión arterial en un entorno que induce al estrés y al condicionamiento del miedo, lo que sugiere un efecto ansiolítico similar al diazepam (24, 55). Otro estudio identificó un efecto modesto del CBD oral (dosis total: 30 mg) sobre la FC en reposo y la VFC en humanos (29). Sin embargo, la relevancia de las funciones fisiológicas con el efecto mostrado es cuestionable y debe evaluarse con precaución, ya que el diseño del estudio no incluyó un grupo de control (29). Otros estudios en caballos y perros no mostraron ninguna influencia del CBD en la FC o la VFC hasta el momento: Un estudio en caballos no encontró diferencias significativas en la FC durante una prueba de objetos novedosos entre un grupo de tratamiento alimentado con 100 mg de CBD granulado (~ 0,2 mg de CBD/kg) y un grupo de control (36). En perros, un grupo de tratamiento y otro de placebo mostraron valores similares de FC y VFC durante una prueba de esfuerzo. La dosis probada aquí fue de 4 mg de CBD/kg, administrada por vía oral todos los días durante un período de 6 meses (56). Del mismo modo, los perros tratados por vía oral con 1,4 mg de CBD/kg no mostraron cambios significativos en RMSSD y SDNN después de una prueba de respuesta al miedo (57). Hasta donde saben los autores, hasta el momento no hay estudios que investiguen el efecto del CBD sobre la FC y la VFC en reposo en caballos sanos. Debido al corto intervalo de estimulación, se decidió no analizar específicamente la FC y la VFC durante la puntuación de la sedación, incluidos los estímulos acústicos y visuales en el presente estudio. La HR y la VFC comparadas durante las primeras 2 h después de la administración de la pasta identificaron diferencias no significativas entre el grupo de tratamiento y el grupo control en todos los ensayos. La comparación dentro del grupo de tratamiento mostró un aumento constante de la RMSSD en comparación con los tres valores basales y del día del ensayo, con un efecto significativo identificado para el ensayo 1 (0,2 mg de CBD/kg) (Tabla 7). En el caso de SDNN, se detectaron aumentos significativos en los ensayos 1 y 3 (3 mg de CBD/kg) (Tabla 7). Estos resultados apuntan hacia una disminución del tono simpático y un aumento del tono parasimpático después de la administración de CBD y respaldan el hipotético efecto relajante del CBD. Sin embargo, dado que los intervalos de confianza del 95% son amplios, los resultados deben interpretarse con precaución.
El cannabis y los cannabinoides son sustancias prohibidas declaradas por la FEI, y el CBD y el ácido cannabidiólico (CBDA) figuran como medicamentos controlados, debido a sus posibles propiedades psicotrópicas y analgésicas (41). En este estudio, no se pudo confirmar la influencia del CBD en el aumento de los niveles de dosis en los parámetros de comportamiento equino, pero no se puede excluir que dosis más altas o la administración durante períodos de tiempo más largos influyan en el comportamiento de un caballo. Como los caballos del estudio actual estaban sanos y mostraban un comportamiento tranquilo en todo momento, el efecto del CBD en caballos estresados o ansiosos sería un punto de interés adicional.
Las limitaciones de este estudio incluyen el pequeño tamaño de la muestra y la evaluación de administraciones únicas de un solo producto que contiene CBD. Como los caballos fueron monitoreados de cerca y los niveles de sedación se puntuaron varias veces al día, no se puede excluir un efecto de habituación. Los signos de estrés o molestia que se evidencian en las fotografías pueden ser parcialmente el resultado de pruebas repetidas. Sin embargo, como los grupos de tratamiento y control se sometieron exactamente al mismo protocolo, el efecto de las pruebas repetidas se consideró insignificante, ya que se concluyó que habría ocurrido de manera similar en ambos grupos.
5 Conclusiones
El análisis de los parámetros de estrés no identificó efectos consistentemente significativos del CBD administrado por vía oral sobre los niveles de sedación, la frecuencia cardíaca en reposo o la variabilidad de la frecuencia cardíaca en caballos. El aumento de las dosis (de 0,2 mg de CBD/kg a 3 mg de CBD/kg) no dio lugar a una reducción significativa de la frecuencia cardíaca ni a un aumento de la sedación o la relajación. La administración oral de pasta que contiene CBD demostró ser bien tolerada y no causó ningún efecto secundario. Se requiere más investigación para determinar indicaciones específicas para el uso de productos de CBD en caballos.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
El estudio en animales fue aprobado por la Autoridad de Procedimientos de Autorización y Notificación para Experimentos con Animales (LAVG) en Brandeburgo, Alemania (AZ: 2347-12-2021). El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
FE: Conceptualización, Curación de datos, Análisis formal, Investigación, Metodología, Administración de proyectos, Software, Validación, Visualización, Redacción, borrador original. AE: Conceptualización, Curación de datos, Análisis formal, Obtención de fondos, Investigación, Metodología, Administración de proyectos, Recursos, Supervisión, Validación, Redacción, revisión y edición. KCJ: Análisis formal, Metodología, Software, Validación, Redacción, revisión y edición. NB: Conceptualización, Curación de datos, Metodología, Administración de proyectos, Redacción, revisión y edición. HP: Curación de datos, Análisis formal, Investigación, Metodología, Redacción, revisión y edición. WB: Conceptualización, Metodología, Administración de Proyectos, Supervisión, Redacción, Revisión y Edición. CL: Conceptualización, Obtención de Financiamiento, Metodología, Administración de Proyectos, Recursos, Supervisión, Redacción, Revisión y Edición. MW: Conceptualización, Investigación, Metodología, Administración de Proyectos, Recursos, Supervisión, Redacción, Revisión y Edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. El estudio fue financiado por la Freie Universität Berlin, la Federación Ecuestre Alemana (FN) y la Herosan healthcare GmbH. Herosan healthcare GmbH no participó en el diseño del estudio, la recopilación, el análisis, la interpretación de los datos, la redacción de este artículo ni la decisión de enviarlo para su publicación. Agradecemos el apoyo del Fondo de Publicaciones de Acceso Abierto de la Freie Universität Berlin.
Reconocimientos
Los autores desean agradecer sinceramente al Dr. Marc Machnik y al Dr. Ina Schenk por sus extensas contribuciones a este estudio y a Franziska Berger, Julia Bolk, Lena Haas, Katharina Jessat, Anja Kühnel, Dr. Jenny Ries, Clara Schubert y Elisa Zimmermann por su apoyo con el manejo de caballos y el trabajo de laboratorio. También agradecemos a todo el equipo del Centro Equino de Bad Saarow, especialmente al Prof. Dr. Johannes Handler, por brindar sus instalaciones y apoyo durante la parte práctica del estudio. Los autores agradecen además el apoyo de Conny Pint y Daniela Wimmer y agradecen sinceramente a Philine Bank por iniciar el proyecto.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses. Este estudio recibió financiación de Herosan healthcare GmbH.
El financiador no participó en el diseño del estudio, la recopilación, el análisis, la interpretación de los datos, la redacción de este artículo ni la decisión de enviarlo para su publicación. Todos los autores declaran tener control total sobre los datos y no tener otros intereses contrapuestos.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1305868/full#supplementary-material
Referencias
1. Corsetti S, Borruso S, Malandrucco L, Spallucci V, Maragliano L, Perino R, et al. Cannabis sativa L. may reduce aggressive behaviour towards humans in shelter dogs. Sci Rep. (2021) 11:2773. doi: 10.1038/s41598-021-82439-2
2. Casajuana Köguel C, López-Pelayo H, Balcells-Olivero MM, Colom J, Gual A. Constituyentes psicoactivos del cannabis y sus implicaciones clínicas: una revisión sistemática. Adicciones. (2018) 30:140–51. doi: 10.20882/adicciones.858
3. Potschka H, Bhatti SF, Tipold A, McGrath S. Cannabidiol in canine epilepsy. Vet J. (2022) 12:105913. doi: 10.1016/j.tvjl.2022.105913
4. Corsato Alvarenga I, Panickar KS, Hess H, McGrath S. Validación científica del cannabidiol para el tratamiento de enfermedades de perros y gatos. Annu Rev Anim Biosci. (2023) 11:227–46. doi: 10.1146/annurev-animal-081122-070236
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Miranda-Cortés A, Mota-Rojas D, Crosignani-Outeda N, Casas-Alvarado A, Martínez-Burnes J, Olmos-Hernández A, et al. El papel de los cannabinoides en la modulación del dolor en animales de compañía. Front Vet Sci. (2022) 9:1050884. doi: 10.3389/fvets.2022.1050884
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Mogi C, Yoshida M, Kawano K, Fukuyama T, Arai T. Efectos del cannabidiol sin delta-9-tetrahidrocannabinol en la dermatitis atópica canina: una evaluación retrospectiva de 8 casos. ¿Puede Vet J. (2022) 63:423–6.
7. McGrath S, Bartner LR, Rao S, Packer RA, Gustafson DL. Ensayo clínico aleatorizado, ciego, controlado para evaluar el efecto de la administración oral de cannabidiol además del tratamiento antiepiléptico convencional sobre la frecuencia de las convulsiones en perros con epilepsia idiopática intratable. J Am Vet Med Assoc. (2019) 254:1301–8. doi: 10.2460/javma.254.11.1301
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Gugliandolo E, Licata P, Peritore AF, Siracusa R, D’Amico R, Cordaro M, et al. Efecto del cannabidiol (CBD) sobre la respuesta inflamatoria canina: un estudio ex vivo sobre la sangre total estimulada por lps. Veterinaria Sci. (2021) 8:185. doi: 10.3390/vetsci8090185
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Moltke J, Hindocha C. Razones para el uso de cannabidiol: un estudio transversal de usuarios de CBD, centrado en el estrés autopercibido, la ansiedad y los problemas de sueño. J Cannabis Res. (2021) 3:5. doi: 10.1186/s42238-021-00061-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Izzo AA, Borrelli F, Capasso R, Di Marzo V, Mechoulam R. Cannabinoides vegetales no psicotrópicos: nuevas oportunidades terapéuticas a partir de una hierba milenaria. Tendencias Pharmacol Sci. (2009) 30:515–27. doi: 10.1016/j.tips.2009.07.006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Campos AC, Moreira FA, Gomes FV, Del Bel EA, Guimarães FS. Múltiples mecanismos implicados en el potencial terapéutico de amplio espectro del cannabidiol en trastornos psiquiátricos. Philos Trans R Soc Lond B Biol Sci. (2012) 367:3364–78. doi: 10.1098/rstb.2011.0389
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Blessing EM, Steenkamp MM, Manzanares J, Marmar CR. Cannabidiol como tratamiento potencial para los trastornos de ansiedad. Neuroterapéutica. (2015) 12:825–36. doi: 10.1007/s13311-015-0387-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Fogaça MV, Campos AC, Coelho LD, Duman RS, Guimarães FS. Los efectos ansiolíticos del cannabidiol en ratones con estrés crónico están mediados por el sistema endocannabinoide: Papel de la neurogénesis y la remodelación dendrítica. Neurofarmacología. (2018) 135:22–33. doi: 10.1016/j.neuropharm.2018.03.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Fogaça MV, Campos AC, Guimarães FS. «Cannabidiol y receptores 5-HT1A», en Neuropatología de las adicciones a las drogas y el uso indebido de sustancias, ed V. R. Preedy (Amsterdam: Elsevier) (2016), 749–59.
15. Leweke FM, Piomelli D, Pahlisch F, Muhl D, Gerth CW, Hoyer C, et al. El cannabidiol mejora la señalización de la anandamida y alivia los síntomas psicóticos de la esquizofrenia. Psiquiatría Transl. (2012) 2:e94. doi: 10.1038/tp.2012.15
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Watanabe K, Kayano Y, Matsunaga T, Yamamoto I, Yoshimura H. Inhibición de la actividad de la anandamida amidasa en microsomas cerebrales de ratón por cannabinoides. Biol Pharm Bull. (1996) 19:1109–11. doi: 10.1248/bpb.19.1109
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Di Marzo V, Bisogno T, Petrocellis L, de Anandamide: a algunos les gusta el calor. Tendencias Pharmacol Sci. (2001) 22:346–9. doi: 10.1016/S0165-6147(00)01712-0
18. Riebe CJ, Pamplona FA, Kamprath K, Wotjak CT. Alivio del miedo: hacia un nuevo marco conceptual y lo que los endocannabinoides tienen que ver con él. Neurociencia. (2012) 204:159–85. doi: 10.1016/j.neuroscience.2011.11.057
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. McLaughlin RJ, Hill MN, Gorzalka BB, A. Papel crítico de la señalización endocannabinoide prefrontocortical en la regulación del estrés y el comportamiento emocional. Neurosci Biobehav Rev. (2014) 42:116–31. doi: 10.1016/j.neubiorev.2014.02.006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. McPartland JM, Duncan M, Di Marzo V, Pertwee RG. ¿Son el cannabidiol y la Δ(9)-tetrahidrocannabivarina moduladores negativos del sistema endocannabinoide? Una revisión sistemática. Hno. J Pharmacol. (2015) 172:737–53. doi: 10.1111/bph.12944
21. Howlett AC, Scott DK, Wilken GH. Regulación de la adenilato ciclasa por fármacos cannabinoides. Conocimientos basados en estudios termodinámicos. Biochem Pharmacol. (1989) 38:3297–304. doi: 10.1016/0006-2952(89)90628-X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Granjeiro EM, Gomes FV, Guimarães FS, Corrêa FM, Resstel LB. Efectos de la administración intracisternal de cannabidiol sobre las respuestas cardiovasculares y conductuales al estrés agudo de restricción. Pharmacol Biochem Behave. (2011) 99:743–8. doi: 10.1016/j.pbb.2011.06.027
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Gomes FV, Resstel LB, Guimarães FS. Los efectos ansiolíticos del cannabidiol inyectado en el núcleo del lecho de la estría terminal están mediados por los receptores 5-HT1A. Psicofarmacología. (2011) 213:465–73. doi: 10.1007/s00213-010-2036-z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Resstel LB, Tavares RF, Lisboa SF, Joca SR, Corrêa FM, Guimarães FS. Los receptores 5-HT1A están implicados en la atenuación inducida por el cannabidiol de las respuestas conductuales y cardiovasculares al estrés agudo de restricción en ratas. Hno. J Pharmacol. (2009) 156:181–8. doi: 10.1111/j.1476-5381.2008.00046.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Crippa JA, Derenusson GN, Ferrari TB, Wichert-Ana L, Duran FL, Martin-Santos R, et al. Bases neurales de los efectos ansiolíticos del cannabidiol (CBD) en el trastorno de ansiedad social generalizada: un informe preliminar. J Psicofarmaco. (2011) 25:121–30. doi: 10.1177/0269881110379283
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Shallcross J, Hámor P, Bechard AR, Romano M, Knackstedt L, Schwendt M. Los efectos divergentes de CDPPB y cannabidiol en la extinción del miedo y la ansiedad en un modelo de estrés olfativo de depredadores de TEPT en ratas. Comportamiento frontal Neurosci. (2019) 13:91. doi: 10.3389/fnbeh.2019.00091
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Zieba J, Sinclair D, Sebree T, Bonn-Miller M, Gutterman D, Siegel S, et al. El cannabidiol (CBD) reduce el comportamiento relacionado con la ansiedad en ratones a través de un mecanismo independiente de FMRP. Pharmacol Biochem Behave. (2019) 181:93–100. doi: 10.1016/j.pbb.2019.05.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Fusar-Poli P, Crippa JA, Bhattacharyya S, Borgwardt SJ, Allen P, Martin-Santos R, et al. Efectos distintivos del Δ9-tetrahidrocannabinol y el cannabidiol sobre la activación neuronal durante el procesamiento emocional. Arch Gen Psiquiatría. (2009) 66:95–105. doi: 10.1001/archgenpsychiatry.2008.519
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Williams NN, Ewell TR, Abbotts KS, Harms KJ, Woelfel KA, Dooley GP, et al. Comparación de cinco preparaciones orales de cannabidiol en humanos adultos: farmacocinética, composición corporal y variabilidad de la frecuencia cardíaca. Productos farmacéuticos. (2021) 14:35. doi: 10.3390/ph14010035
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Dos Santos RG, Guimarães FS, Crippa JA, Hallak JE, Rossi GN, Rocha JM, et al. Efectos adversos graves del cannabidiol (CBD): una revisión de ensayos controlados aleatorizados. Experto Opin Droga Metab Toxicol. (2020) 16:517–26. doi: 10.1080/17425255.2020.1754793
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Dos Santos RG, Hallak JE, Crippa JA. Efectos neurofarmacológicos de los principales fitocannabinoides: una revisión narrativa. Adv Exp Med Biol. (2021) 1264:29–45. doi: 10.1007/978-3-030-57369-0_3
32. Kogan LR, Hellyer PW, Robinson NG. Percepciones de los consumidores sobre los productos de cáñamo para animales. J Am Holistic Vet Med Assoc. (2016) 42:40–8.
33. Kogan L, Schoenfeld-Tacher R, Hellyer P, Rishniw M. Conocimiento, experiencia y percepción de los veterinarios estadounidenses sobre el uso del cannabidiol para afecciones médicas caninas. Front Vet Sci. (2018) 5:338. doi: 10.3389/fvets.2018.00338
34. Kogan LR, Hellyer PW, Silcox S, Schoenfeld-Tacher R. Canadian dog owners’ use and perceptions of cannabis products. Can Vet J. (2019) 60:749–55.
35. Morris EM, Kitts-Morgan SE, Spangler DM, Gebert J, Vanzant ES, McLeod KR, et al. Feeding cannabidiol (CBD)-containing treats did not affect canine daily voluntary activity. Front Vet Sci. (2021) 8:645667. doi: 10.3389/fvets.2021.645667
36. Draeger A, Thomas E, Jones K, Godwin P, Davis A, Porr S. 81 Cannabidiol in the horse: Effects on movement and reactivity. J Equine Vet Sci. (2021) 100:103544. doi: 10.1016/j.jevs.2021.103544
37. St Blanc MP, Chapman AM, Keowen ML, Garza F, Liu C-C, Gray L, et al. Effects of a supplement containing cannabidiol (CBD) on sedation and ataxia scores and health. J Equine Vet Sci. (2022) 117:104085. doi: 10.1016/j.jevs.2022.104085
38. Ryan D, McKemie DS, Kass PH, Puschner B, Knych HK. Farmacocinética y efectos sobre el metabolismo del ácido araquidónico de dosis bajas de cannabidiol tras la administración oral a caballos. Prueba de drogas anal. (2021) 13:1305–17. doi: 10.1002/dta.3028
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Cunha RZ, Felisardo LL, Salamanca G, Marchioni GG, Neto OI, Chiocchetti R. El uso del cannabidiol como tratamiento novedoso para el comportamiento estereotipado oral (morder la cuna) en un caballo. Vet Anim Sci. (2023) 19:100289. doi: 10.1016/j.vas.2023.100289
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Ellis KL, Contino EK. Tratamiento con cannabidiol en un caballo con alodinia mecánica. Veterinario Equino Educ. (2021) 33:168. doi: 10.1111/eve.13168
41. Fédération Equestre Internationale. FEI Clean Sport – Base de Datos de Sustancias Prohibidas. (2022). Disponible en línea en: https://inside.fei.org/content/anti-doping-rules (consultado el 23 de junio de 2022).
42. Eichler F, Pozniak B, Machnik M, Schenk I, Wingender A, Baudisch N, et al. Modelización farmacocinética del cannabidiol administrado por vía oral e implicaciones para el control de la medicación en caballos. Front Vet Sci. (2023) 10:1234551. doi: 10.3389/fvets.2023.1234551
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Poller C, Hopster K, Rohn K, Kästner SB. Pruebas de umbral térmico nociceptivo en caballos: efecto de la sedación neuroléptica y la neuroleptanalgesia en diferentes sitios de estimulación. BMC Vet Res. (2013) 9:135. doi: 10.1186/1746-6148-9-135
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Oliveira AR de, Gozalo-Marcilla M, Ringer SK, Schauvliege S, Fonseca MW, Esteves Trindade PH, et al. Desarrollo y validación de la escala facial (FaceSed) para evaluar la sedación en caballos. PLoS UNO. (2021) 16:E0251909. doi: 10.1371/journal.pone.0251909
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Dalla Costa E, Minero M, Lebelt D, Stucke D, Canali E, Leach MC. Desarrollo de la Escala de Muecas del Caballo (HGS) como herramienta de evaluación del dolor en caballos sometidos a castración rutinaria. PLoS UNO. (2014) 9:e92281. doi: 10.1371/journal.pone.0092281
Resumen de PubMed | Texto completo de CrossRef | Google Académico
46. Younes M, Robert C, Barrey E, Cottin F. Efectos de la edad, la duración del ejercicio y las condiciones de prueba sobre la variabilidad de la frecuencia cardíaca en caballos jóvenes de resistencia. Fisiola delantera. (2016) 7:155. doi: 10.3389/fphys.2016.00155
Resumen de PubMed | Texto completo de CrossRef | Google Académico
47. Boggs DL, Surti T, Gupta A, Gupta S, Niciu M, Pittman B, et al. Los efectos del cannabidiol (CBD) sobre la cognición y los síntomas en pacientes ambulatorios con esquizofrenia crónica: un ensayo aleatorizado controlado con placebo. Psicofarmacología. (2018) 235:1923–32. doi: 10.1007/s00213-018-4885-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
48. Oliveira AR de, Gozalo-Marcilla M, Ringer SK, Schauvliege S, Fonseca MW, Trindade PH, et al. desarrollo, validación y confiabilidad de una escala de sedación en caballos (EquiSed). Front Vet Sci. (2021) 8:611729. doi: 10.3389/fvets.2021.611729
Resumen de PubMed | Texto completo de CrossRef | Google Académico
49. Schauvliege S, Cuypers C, Michielsen A, Gasthuys F, Gozalo-Marcilla M. Cómo puntuar la sedación y ajustar la tasa de administración de sedantes en caballos: una revisión de la literatura e introducción del algoritmo de sedación de Gante. Veterinario Anaesth Analg. (2019) 46:4–13. doi: 10.1016/j.vaa.2018.08.005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
50. Lewinski M, von Biau S, Erber R, Ille N, Aurich J, Faure J-M, et al. Liberación de cortisol, frecuencia cardíaca y variabilidad de la frecuencia cardíaca en el caballo y su jinete: diferentes respuestas al entrenamiento y al rendimiento. Veterinario J. (2013) 197:229–32. doi: 10.1016/j.tvjl.2012.12.025
Resumen de PubMed | Texto completo de CrossRef | Google Académico
51. König von Borstel U, Euent S, Graf P, König S, Gauly M. Comportamiento equino y frecuencia cardíaca en pruebas de temperamento con o sin jinete o guía. Physiol Behave. (2011) 104:454–63. doi: 10.1016/j.physbeh.2011.05.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
52. Visser EK, van Reenena CG, van der Werf JTN, Schilder MBH, Knaap JH, Barneveld A, et al. Frecuencia cardíaca y variabilidad de la frecuencia cardíaca durante una prueba de objetos novedosos y una prueba de manejo en caballos jóvenes. Physiol Behave. (2002) 76:289–96. doi: 10.1016/S0031-9384(02)00698-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
53. Visser EK, van Reenen CG, Rundgren M, Zetterqvist M, Morgan K, Blokhuis HJ. Las respuestas de los caballos en las pruebas de comportamiento se correlacionan con el temperamento evaluado por los jinetes. Veterinario Equino J. (2003) 35:176–83. doi: 10.2746/042516403776114108
Resumen de PubMed | Texto completo de CrossRef | Google Académico
54. Lenoir A, Trachsel DS, Younes M, Barrey E, Robert C. La concordancia entre el electrocardiograma y el medidor de frecuencia cardíaca es baja para la medición de la variabilidad de la frecuencia cardíaca durante el ejercicio en caballos jóvenes de resistencia. Front Vet Sci. (2017) 4:170. doi: 10.3389/fvets.2017.00170
Resumen de PubMed | Texto completo de CrossRef | Google Académico
55. Resstel LB, Joca SR, Moreira FA, Corrêa FM, Guimarães FS. Efectos del cannabidiol y el diazepam en las respuestas conductuales y cardiovasculares inducidas por el miedo condicionado contextual en ratas. Behav Brain Res. (2006) 172:294–8. doi: 10.1016/j.bbr.2006.05.016
Resumen de PubMed | Texto completo de CrossRef | Google Académico
56. Hunt AB, Flint HE, Logan DW, King T, A. La dosis única de cannabidiol (CBD) influye positivamente en las medidas de estrés en los perros durante la separación y los viajes en automóvil. Front Vet Sci. (2023) 10:1112604. doi: 10.3389/fvets.2023.1112604
Resumen de PubMed | Texto completo de CrossRef | Google Académico
57. Morris EM, Kitts-Morgan SE, Spangler DM, McLeod KR, Costa JH, Harmon DL. El impacto de la alimentación con golosinas que contienen cannabidiol (CBD) en la respuesta canina a una prueba de respuesta al miedo inducida por el ruido. Front Vet Sci. (2020) 7:569565. doi: 10.3389/fvets.2020.569565
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: comportamiento, CBD, equino, FaceSed, Escala de Muecas de Caballo, puntuación de sedación
Cita: Eichler F, Ehrle A, Jensen KC, Baudisch N, Petersen H, Bäumer W, Lischer C y Wiegard M (2023) Observaciones conductuales, frecuencia cardíaca y variabilidad de la frecuencia cardíaca en caballos después de la administración oral de una pasta que contiene cannabidiol en tres dosis crecientes (parte 1/2). Frente. Vet. Sci. 10:1305868. doi: 10.3389/fvets.2023.1305868
Recibido: 02 de octubre de 2023; Aceptado: 06 de noviembre de 2023;
Publicado: 11 diciembre 2023.
Editado por:
Robin Temmerman, Colegio Europeo de Farmacología y Toxicología Veterinaria (ECVPT), Bélgica
Revisado por:
Claudia Interlandi, Universidad de Messina, Italia
Isabella Corsato Alvarenga, Universidad Estatal de Colorado, Estados Unidos
Derechos de autor © 2023 Eichler, Ehrle, Jensen, Baudisch, Petersen, Bäumer, Lischer y Wiegard. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Fabienne Eichler, f.eichler@fu-berlin.de
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía