Frecuencia cardíaca y cortisol en caballos después de múltiples administraciones orales de una pasta que contiene cannabidiol (parte 2/2)
Observaciones conductuales, monitorización de la frecuencia cardíaca y cortisol en caballos después de múltiples administraciones orales de una pasta que contiene cannabidiol (parte 2/2)
 Fabienne Eichler1*
Fabienne Eichler1*  Anna Ehrle1
Anna Ehrle1  Marc Machnik2
Marc Machnik2  Katharina Charlotte Jensen3
Katharina Charlotte Jensen3  Sabrina Wagner2
Sabrina Wagner2  Natalie Baudisch1
Natalie Baudisch1  Julia Bolk1
Julia Bolk1  Magdalena Pötzsch1
Magdalena Pötzsch1  Mario Thevis2
Mario Thevis2  Wolfgang Bäumer4
Wolfgang Bäumer4  Christoph Lischer1
Christoph Lischer1  Mechthild Wiegard5
Mechthild Wiegard5- 1Clínica Equina, Hospital Veterinario Freie Universität Berlin, Facultad de Medicina Veterinaria, Freie Universität Berlin, Berlín, Alemania
- 2Centro de Investigación Preventiva sobre el Dopaje, Instituto de Bioquímica, Universidad Alemana del Deporte de Colonia, Colonia, Alemania
- 3Instituto de Epidemiología y Bioestadística Veterinaria, Facultad de Medicina Veterinaria, Freie Universität Berlin, Berlín, Alemania
- 4Instituto de Farmacología y Toxicología, Facultad de Medicina Veterinaria, Freie Universität Berlin, Berlín, Alemania
- 5Instituto de Bienestar Animal, Comportamiento Animal y Ciencia de Animales de Laboratorio, Facultad de Medicina Veterinaria, Freie Universität Berlin, Berlín, Alemania
Como remedio contra el estrés y la ansiedad, los productos de cannabidiol (CBD) son de creciente interés en la medicina veterinaria. Se dispone de datos limitados que describen la eficacia real del CBD en caballos. El objetivo de este estudio (parte 2 de 2) fue analizar los parámetros de estrés a través de la observación del comportamiento, la monitorización de la frecuencia cardíaca y la evaluación de los niveles de cortisol en sangre y saliva en caballos sanos tratados repetidamente con una pasta que contiene CBD. Doce caballos fueron asignados aleatoriamente a un grupo de tratamiento o de control. Se administraron dos pastas por vía oral en un diseño de estudio doble ciego, una pasta que contenía CBD y una pasta sin ingrediente activo. Ambas pastas se administraron dos veces al día durante 15 días (dosis: 3 mg de CBD/kg). Las observaciones conductuales se realizaron diariamente utilizando una puntuación de sedación y una calificación de las expresiones faciales, basadas en la escala de sedación facial para caballos descrita anteriormente (FaceSed) y la Escala de Muecas de Caballo. Se obtuvieron muestras de sangre y saliva regularmente para determinar los niveles de cortisol a lo largo del estudio. Los niveles de cortisol se analizaron mediante cromatografía líquida/espectrometría de masas en tándem (LC/MS/MS). Se compararon las observaciones conductuales y los niveles de cortisol entre los grupos. Antes de la administración de la pasta, se realizó una prueba de objetos novedosos y se registró la reacción de los caballos a la carga en un remolque. Ambas pruebas se repitieron después de 13 días de aplicación de la pasta. Se evaluaron los patrones de movimiento, como las diferentes marchas durante la prueba del objeto novedoso, y se diseñó un etograma para evaluar los rasgos de comportamiento exhibidos. Los intervalos de latido a latido cardíaco (R-R) se registraron en todo momento y se evaluaron mediante parámetros de frecuencia cardíaca (FC) y variabilidad de la frecuencia cardíaca (VFC). Se tomaron muestras de sangre y saliva para el análisis de cortisol antes y después de las pruebas. Las observaciones conductuales diarias y los niveles de cortisol no difirieron entre el grupo de tratamiento y el grupo de control. Del mismo modo, el análisis de los patrones de movimiento, la FC, la VFC y los niveles de cortisol durante la prueba del objeto nuevo y la prueba del remolque no identificó diferencias significativas entre los grupos. El CBD oral administrado regularmente (3 mg/kg dos veces al día durante 15 días) no tuvo un efecto estadísticamente significativo sobre las observaciones conductuales, los niveles de cortisol, la FC y la VFC en caballos. Se requiere más investigación para establecer dosis e indicaciones adecuadas para el uso de CBD en caballos.
1 Introducción
Los suplementos que contienen compuestos de cannabis se han promovido como remedios para el tratamiento de numerosas afecciones como la ansiedad o la osteoartritis en pacientes humanos y animales (1-5). Su popularidad ha aumentado en los últimos años, pero pocos estudios científicos han investigado la eficacia real en animales y específicamente en caballos (6-8). Los compuestos predominantes del cannabis incluyen los fitocannabinoides cannabidiol (CBD) y Δ9-tetrahidrocannabinol (THC), conocido por sus propiedades psicoactivas (9-11). El CBD está siendo investigado actualmente por sus posibles efectos relajantes y ansiolíticos en humanos, roedores y perros (3, 12-23). El CBD interactúa directamente con la serotonina1A (5-HT1A) (1, 24-27) e indirectamente con el cannabinoide tipo 1 (CB1) del sistema endocannabinoide (eCB) mediante la inhibición de la desactivación de los cannabinoides endógenos (28-30). 5-HT1A Los receptores y el sistema eCB regulan las respuestas al estrés y pueden exhibir un efecto ansiolítico cuando se activan (27, 31-33). El CB1 y su importancia como diana terapéutica están actualmente bajo investigación (34, 35).
La actividad farmacológica de las formas ácidas de CBD y THC, ácido cannabidiólico (CBDA) y Δ9-ácido tetrahidrocannabinólico (THCA), ha sido escasamente reportado hasta ahora (9). Se ha demostrado que el CBDA y el THCA interactúan con el sistema eCB y su funcionalidad aún está en estudio (36-38). Además de los fitocannabinoides, las plantas de cannabis contienen contenido de terpenoides y flavonoides que se describe que presentan múltiples efectos, incluidos los antiinflamatorios o la sedación (39).
En la Unión Europea (UE), las empresas declaran sus productos de cannabis para caballos como «suplementos nutricionales» en lugar de productos medicinales y, por lo tanto, no están bajo la regulación de la Agencia Europea de Medicamentos (EMA). Hasta la fecha, no existe ningún medicamento veterinario de cannabis autorizado en la UE o en América del Norte (40). La Fédération Equestre Internationale (FEI) ha prohibido todos los productos de cannabis debido a la exhibición de efectos potencialmente psicotrópicos (41). Desde 2022, el CBD está clasificado como un medicamento controlado (41).
En los caballos, las opciones para la evaluación de las respuestas al estrés incluyen observaciones conductuales como puntuaciones de sedación o escalas de expresión facial (42-46), así como el análisis de parámetros fisiológicos como los niveles de cortisol (47-51), la frecuencia cardíaca y la variabilidad de la frecuencia cardíaca (48, 52-54). Una prueba común y frecuentemente documentada para evaluar el estrés o el miedo en animales es la prueba del objeto novedoso (6, 54-57). Un informe ha evaluado el efecto del CBD en caballos utilizando una nueva prueba de objetos con evaluación de la reactividad y la frecuencia cardíaca después de la alimentación diaria con gránulos de CBD (dosis: ~0,2 mg de CBD/kg SID) durante 6 semanas (6). En comparación con un grupo de control, las puntuaciones de reactividad fueron más bajas, pero no se identificaron diferencias significativas en la frecuencia cardíaca (6).
El transporte y la carga en remolques causan respuestas de estrés en los caballos que se reflejan en un aumento de la frecuencia cardíaca y los niveles de cortisol (58-60). Se pueden aplicar diferentes métodos de entrenamiento o incluso sedantes para reducir eficazmente estas respuestas al estrés (58-61). Hasta el momento, ningún informe ha documentado un efecto potencial del CBD en los niveles de estrés equino durante la carga en un remolque.
El objetivo de este estudio fue validar el comportamiento equino y las reacciones al estrés, incluida la respuesta a una prueba de objetos novedosos y una prueba de remolque a través de la monitorización de la frecuencia cardíaca y el nivel de cortisol en caballos sanos después de la administración oral repetida de pasta que contiene CBD (3 mg de CBD / kg dos veces al día) durante 15 días. Los autores plantearon la hipótesis de que las administraciones regulares de CBD tendrían un efecto calmante en los caballos.
2 Materiales y métodos
2.1 Animales y productos de estudio
Doce caballos (siete yeguas y cinco sementales, cruce Haflinger x Warmblood) fueron inscritos en el estudio. Los caballos fueron asignados aleatoriamente a un grupo de tratamiento o de control (n = 6 + 6). La edad de los caballos fue de 3 a 16 años (mediana: 11 años) con un peso corporal promedio de 488 ± 55 kg en el grupo de tratamiento. En el grupo control, la edad fue de 10 a 26 años (mediana: 10,5 años) y el peso corporal de 443 ± 56 kg. Este estudio fue diseñado como un ensayo clínico prospectivo y aleatorizado. Los productos del estudio fueron dos pastas para administración oral, una que contenía un 55% de extracto de planta de CBD de espectro completo, aceite de coco con triglicéridos de cadena media (MCT), fitocannabinoides naturales, terpenos, flavonoides y cera de abejas con un contenido de THC del <0,2% (TAMACAN XL 55%, Herosan healthcare GmbH, Austria). La segunda pasta carecía de un ingrediente activo y contenía aceite de coco MCT y cera de abejas [véase la parte 1/2 para más detalles (62)]. Las pastas se etiquetaron como «A» o «B» para ocultar la formulación. El estudio fue aprobado por la autoridad competente para los procedimientos de autorización y notificación de experimentos con animales (LAVG) en Brandeburgo, Alemania (AZ: 2347-12-2021). Los animales incluidos tuvieron que pasar un examen físico general por parte de un veterinario autorizado y se sometieron a un análisis de muestra de sangre que incluía la evaluación de un hemograma completo (CBC), biomarcadores renales y hepáticos antes del inicio del estudio. Los criterios de exclusión incluyeron irregularidades durante el examen de los sistemas circulatorio, respiratorio y gastrointestinal, y signos de dolor o inflamación, como fiebre y recuentos altos de glóbulos blancos.®
2.2 Estudio de dosis múltiples
El estudio de dosis múltiples comenzó después de un período de lavado de 25 días después del estudio de escalada de dosis (62) para garantizar una eliminación completa de todos los cannabinoides después de aplicaciones previas de CBD. El día antes del inicio del estudio, se examinó físicamente a los caballos y se colocó un catéter para la vena yugular de forma aséptica. La tromboflebitis de la vena yugular de una yegua de la parte del estudio anterior se había resuelto en ese momento (62). Las muestras de suero y orina se analizaron para detectar el contenido residual de cannabinoides de la parte del estudio anterior. A lo largo del estudio, el examen físico se repitió diariamente en todos los caballos. Se administraron pastas (dosis: 3 mg de CBD/kg) antes de la alimentación cada 12 h (6:30 a.m. y 6:30 p.m.) durante 15 días. Las observaciones del comportamiento equino se grabaron diariamente entre las 7:30 y las 8:30 horas utilizando dos estímulos acústicos (clicker y crujido de una bolsa de plástico) y un estímulo visual (agitar una tela rosa). La duración del vídeo osciló entre los 30 y los 60 segundos. Además, se tomaron fotografías de los rostros de los caballos una vez al día entre las 8:30 y las 9:30 a.m. para evaluar las expresiones faciales. El análisis de las expresiones faciales se realizó en una foto por caballo y día. Los videos y fotografías fueron tomados con un Apple iPhone SE (Apple Inc., CA, Estados Unidos). El análisis de las expresiones faciales se basó en la escala de sedación facial para caballos (FaceSed) (43) y la Escala de Muecas de Caballo (45). Los parámetros faciales analizados incluyeron la apertura orbitaria, la posición de las orejas, la tensión de los músculos masticadores representados por su presencia visible, la relajación de los labios y la dilatación de las fosas nasales (62). La Figura 1 muestra una cronología del estudio.®
 Figura 1. Cronología del estudio de dosis múltiples. Las pastas (3 mg de CBD/kg y control) se administraron dos veces al día (n = 6 + 6 caballos) desde los días 1 hasta el 15.
Figura 1. Cronología del estudio de dosis múltiples. Las pastas (3 mg de CBD/kg y control) se administraron dos veces al día (n = 6 + 6 caballos) desde los días 1 hasta el 15.
Las muestras de sangre y saliva obtenidas para la evaluación de los niveles de cannabinoides (63) se analizaron adicionalmente para determinar los niveles de cortisol. Las muestras se tomaron el día anterior al inicio de la administración de pasta (día 0), días 1-4, 8, 15-19, 23 y 30 (Figura 1). Para evitar cualquier influencia del ritmo circadiano, solo se eligieron muestras tomadas entre las 8:00 a.m. y las 9:00 a.m. para el análisis de cortisol. Por cada caballo, se recogieron 10 ml de sangre en tubos separadores de suero, se almacenaron a temperatura ambiente durante 30-60 min y se centrifugaron a 3.000 × g durante 10 min. De cada tubo, se transfirieron 5 mL de suero a un tubo nuevo para ser congelado y almacenado a -20 °C. Se analizaron muestras por cada caballo individual. Para analizar más a fondo los niveles de cortisol, se tomaron muestras de saliva con hisopos sintéticos (Salivette, SARSTED AG & Co. KG, Nümbrecht, Alemania). Los hisopos se extrajeron del tubo con pinzas de vendaje Gross-Maier y se insertaron en la boca del caballo durante aproximadamente 30 s. Se utilizaron de dos a tres hisopos para cada muestra. Las salivettes se centrifugaron a 1.000 × g durante 10 min. Posteriormente, la saliva se transfirió a nuevos tubos, se congeló y se almacenó a -20 °C.®®
2.3 Ensayo de objetos novedosos y ensayo de remolque
Para obtener los valores de comportamiento de referencia, se grabó en video una prueba de objetos novedosos y las reacciones de los caballos a la carga en un remolque 3 días antes del inicio de la administración de pasta. Se tomaron muestras de sangre y saliva para medir los niveles de cortisol inmediatamente antes de la prueba del nuevo objeto. Un sensor de frecuencia cardíaca Polar H10 (Polar Electro Oy, Kempele, Finlandia) estaba conectado a un cinturón de electrodos que se extendía alrededor del pecho del caballo. El pelaje de cada caballo fue recortado e hidratado con agua sobre la base del corazón entre los 4®®ésimo y 5ésimo espacio intercostal para mejorar la transmisión de la señal. El sensor de frecuencia cardíaca se conectó a un dispositivo móvil a través de Bluetooth para registrar los intervalos cardíacos latido a latido (R-R) utilizando la aplicación Polar Equine (versión 1.2.1, Polar Electro, Kempele, Finlandia). Para la prueba del objeto novedoso, una balsa de piscina inflable (aproximadamente 170 × 80 × 10 cm, piña amarilla) sirvió como objeto desconocido. La balsa de la piscina fue elegida por su exterior luminoso y amplio, y para minimizar el posible riesgo de lesiones para los animales. La prueba comenzó con la conducción de los caballos a un corral redondo (Ø 15 m). La persona que guiaba el caballo abandonó el corral redondo y el objeto fue bajado del techo en el centro del corral redondo (Figura 2). Después de 10 minutos, el caballo fue sacado del corral redondo y el objeto fue levantado hasta el techo nuevamente.®®
 Figura 2. Prueba de objetos novedosos. Una balsa de piscina (piña amarilla) fue elegida como el objeto desconocido. El caballo lleva un cinturón de electrodos con un sensor de frecuencia cardíaca alrededor del pecho.
Figura 2. Prueba de objetos novedosos. Una balsa de piscina (piña amarilla) fue elegida como el objeto desconocido. El caballo lleva un cinturón de electrodos con un sensor de frecuencia cardíaca alrededor del pecho.
Posteriormente, cada caballo fue conducido a un picadero, donde se estacionó un remolque. Los caballos fueron guiados directamente hacia el remolque y subieron por la rampa. Si un caballo no estaba dispuesto a subir por la rampa, se le llevaba de vuelta en círculo para otro intento (máximo cinco intentos). Luego se le pidió a una segunda persona que se parara detrás del caballo y apoyara su guía hacia el remolque. La carga no se impuso mediante ninguna medida adicional. Después de las pruebas, se obtuvieron muestras de sangre y saliva para su posterior evaluación de los niveles de cortisol.
Ambas pruebas se repitieron después de 13 días de administración de pasta (Figura 1), ya que se esperaba que las concentraciones de CBD en suero hubieran alcanzado un estado estable en ese momento (63). Se eligió una nueva balsa de piscina con dimensiones similares pero diferente apariencia exterior (tortuga verde) para la segunda prueba de objetos novedosos. El resto del protocolo, incluida la configuración para la carga en un remolque, siguió siendo el mismo. Todas las pruebas se grabaron con una cámara de vídeo (GoPro HERO10, San Mateo, Estados Unidos).®
2.3.1 Evaluación de la prueba del objeto novedoso
Todas las grabaciones de video fueron aleatorias y cegadas. La evaluación fue realizada por un observador que tenía experiencia en estudios de comportamiento equino y que no estaba al tanto de las asignaciones grupales de los caballos. Para cada registro, se evaluaron los períodos de tiempo pasados en diferentes patrones de movimiento. Los patrones de movimiento incluían olfatear el suelo, quedarse quieto, moverse en cada marcha (caminar, trotar, galope) y rodar. Durante la locomoción en cada marcha, se documentó adicionalmente el número de cambios de dirección. Las reacciones de los caballos al nuevo objeto en sí se registraron tomando nota del tiempo que le tomó a un caballo fijar visualmente el objeto por primera vez, acercarse primero al objeto y tocarlo por primera vez.
2.3.2 Evaluación del ensayo del remolque
Las grabaciones de video aleatorias y ciegas fueron evaluadas por un observador experimentado en estudios de comportamiento equino, que no participó en las partes del estudio anterior. El cumplimiento de cada caballo con la entrada al remolque se puntuó en una escala de 0 a 7 para cada intento (Tabla 1). Para el análisis estadístico se seleccionó el intento con mayor puntuación.
2.3.3 Etograma
Se desarrolló un etograma ajustado para evaluar los rasgos de comportamiento mostrados a lo largo de las pruebas de objetos novedosos y de remolque (Tabla 2). El análisis de video aleatorio y ciego fue realizado por tres observadores que no participaron en las partes del estudio anterior, pero que estaban específicamente capacitados para la evaluación del comportamiento equino. Se evaluó el número de rasgos conductuales mostrados por caballo. Los resultados de las tres evaluaciones se agruparon en valores medianos para su posterior análisis.
 Tabla 2. Etograma desarrollado para la evaluación de la †Prueba de objetos novedosos y prueba de remolque. §
Tabla 2. Etograma desarrollado para la evaluación de la †Prueba de objetos novedosos y prueba de remolque. §
2.3.4 Evaluación de la frecuencia cardíaca y la variabilidad de la frecuencia cardíaca
Cada registro cardíaco latido a latido (R-R) se dividió en secciones de 5 min como se describió anteriormente (54). Se aplicó la corrección automática del ritmo para eliminar los artefactos (umbral: muy bajo, 0,3 s). La frecuencia cardíaca (FC) y la variabilidad de la frecuencia cardíaca (VFC), incluidos los siguientes parámetros: FC media en latidos por minuto (lpm), raíz cuadrada media de las diferencias sucesivas de latido a latido (RMSSD en milisegundos, ms) y desviación estándar de los intervalos R-R normales a normales (SDNN, ms) se evaluaron utilizando el software Kubios HRV Standard (ver. 3.5, Kubios Oy, Kuopio, Finlandia).®®
2.4 Evaluación de los niveles de cortisol
Los niveles de cortisol en muestras de suero y saliva se determinaron mediante cromatografía líquida de alta resolución/espectrometría de masas en tándem (LC/MS/MS). La información sobre la preparación/extracción de la muestra, las condiciones instrumentales, la validación, el análisis y la validación del método se resumen en el material complementario.
2.5 Análisis estadístico
Los datos se registraron en Microsoft Excel (versión 2304) y el análisis estadístico se realizó con SPSS Statistics 27 (IBM, NY, Estados Unidos). Los datos se inspeccionaron visualmente y se probaron con una prueba de Shapiro-Wilk para determinar su distribución normal. Las observaciones conductuales (puntuación de sedación, escala de expresión facial) y las concentraciones de cortisol se analizaron mediante un análisis de varianza (ANOVA) con una corrección de Greenhouse-Geisser y un modelo lineal general de medidas repetidas para comprobar las diferencias entre el grupo de tratamiento y el grupo control a lo largo del tiempo. Los niveles de cortisol en suero y saliva se analizaron para determinar la correlación utilizando el coeficiente de correlación de rangos de Spearman.®®®
Para la prueba del objeto nuevo y la prueba del remolque, se calcularon las diferencias entre los patrones de movimiento, las reacciones a los objetos desconocidos, las puntuaciones de la carga en un remolque, los rasgos de comportamiento del etograma y los niveles de cortisol durante la primera prueba (línea de base) y después de 13 días de administración de pasta para cada caballo. Las diferencias entre el grupo de tratamiento y el grupo control se compararon mediante una prueba t (para datos distribuidos normalmente) o una prueba U de Mann-Whitney (para datos no distribuidos normalmente). Para el etograma, los coeficientes de correlación intraclase determinaron el nivel de concordancia entre los observadores para cada rasgo conductual observado. Los parámetros de FC, RMSSD y SDNN obtenidos durante la segunda prueba se analizaron mediante un ANOVA para comprobar las diferencias entre el grupo de tratamiento y el grupo control. Los residuos se inspeccionaron visualmente para determinar su distribución normal. El nivel de significancia fue de p < 0,05.
3 Resultados
3.1 Animales
Los exámenes físicos diarios de todos los caballos no identificaron ningún efecto secundario, como intolerancias gastrointestinales asociadas con la aplicación de pasta. El día anterior al inicio del estudio, no se detectaron contenidos residuales de cannabinoides en suero u orina. Los análisis de sangre regulares no identificaron irregularidades significativas en los biomarcadores de hemograma, riñón y hígado (63). Las concentraciones de CBD en suero alcanzaron un estado estable después de 2 días de administración de pasta de CBD con una concentración sérica máxima media (Cmáximo) de 38,4 ± 8,9 ng/ml (63).
3.2 Observaciones conductuales
Los valores medios de las puntuaciones de sedación oscilaron entre 34,0 ± 5,0 (día 3) a 51,7 ± 1,5 (día 19) en el grupo de tratamiento, y de 39,0 ± 1,5 (día 15) a 56,0 ± 2,0 (día 19) en el grupo control. Para la escala de expresión facial, los valores oscilaron entre 9,7 ± 2,0 (día 3) a 12,6 ± 2,3 (día 9) en el grupo de tratamiento, y de 10,3 ± 0,8 (día 0) a 13,8 ± 1,1 (día 1) en el grupo control (Figura 3). En 12 de los 18 días, los valores de las puntuaciones de sedación fueron más altos en el grupo de control que en el grupo de tratamiento. La comparación mediante ANOVA con una corrección de Greenhouse-Geisser no mostró diferencias significativas entre los grupos para la puntuación de sedación [F(3.0, 11.9) = 2.3, p = 0.127] y la escala de expresión facial [F(1.0, 1.0) = 1.5, p = 0.435]. Debido a dificultades técnicas, los videos y fotografías de los días 13 y 14 no fueron evaluables para la puntuación.
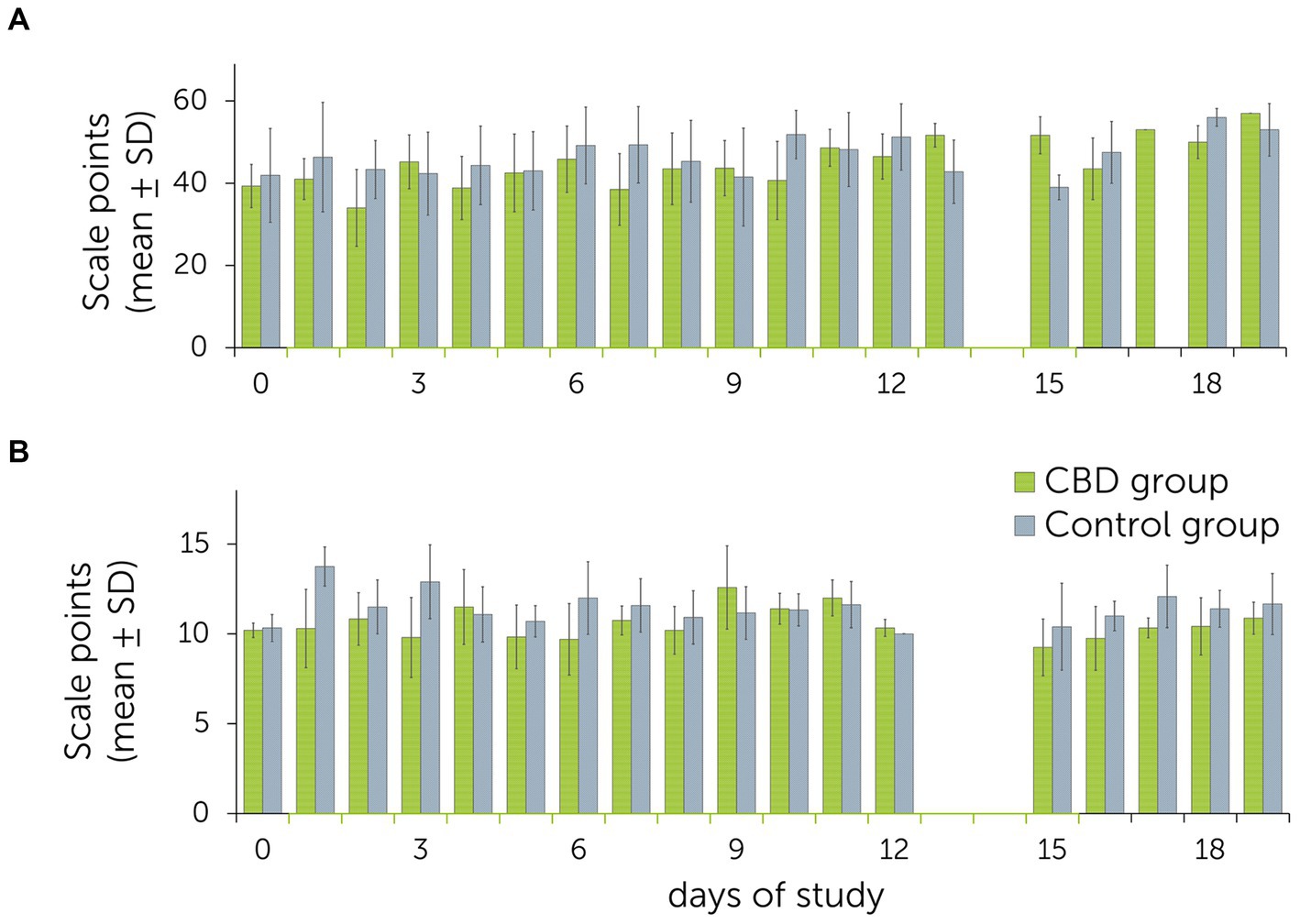 Figura 3. Media ± desviaciones estándar (DE) de las observaciones conductuales obtenidas durante el estudio de dosis múltiple con la administración diaria de cannabidiol (CBD) y pastas placebo a un grupo de tratamiento y control (n = 6 + 6 caballos). El grupo de tratamiento recibió pasta que contenía CBD de los días 1 a 15 (3 mg de CBD/kg dos veces al día p.o.). (A) Puntuaciones resumidas de sedación después de las estimulaciones acústicas y visuales (clicker, bolsa de plástico, tela rosa). (B) Puntuaciones diarias de expresiones faciales. Los puntos de escala más altos se relacionan con un mayor nivel de relajación/sedación.
Figura 3. Media ± desviaciones estándar (DE) de las observaciones conductuales obtenidas durante el estudio de dosis múltiple con la administración diaria de cannabidiol (CBD) y pastas placebo a un grupo de tratamiento y control (n = 6 + 6 caballos). El grupo de tratamiento recibió pasta que contenía CBD de los días 1 a 15 (3 mg de CBD/kg dos veces al día p.o.). (A) Puntuaciones resumidas de sedación después de las estimulaciones acústicas y visuales (clicker, bolsa de plástico, tela rosa). (B) Puntuaciones diarias de expresiones faciales. Los puntos de escala más altos se relacionan con un mayor nivel de relajación/sedación.
3.3 Niveles de cortisol matutino
A lo largo del estudio de dosis múltiples, los niveles de cortisol en suero fueron en promedio de 54,7 ± 18,6 ng/ml en el grupo de tratamiento y de 62,2 ± 19,2 ng/ml en el grupo de control. En el caso de la saliva, los niveles medios de cortisol fueron en promedio de 0,40 ± 0,30 ng/ml en el grupo de tratamiento y de 0,63 ± 0,45 ng/ml en el grupo control (Figura 4). Las diferencias entre los grupos se probaron mediante un ANOVA con corrección de Greenhouse-Geisser y no fueron significativas para los niveles de cortisol en suero [F(4,1, 37,0) = 1,7, p = 0,171] y en saliva [F(1,6, 3,2) = 1,0, p = 0,442] durante todos los días. La correlación entre los niveles de cortisol sérico y salival fue rs = 0,53 (p < 0,001).
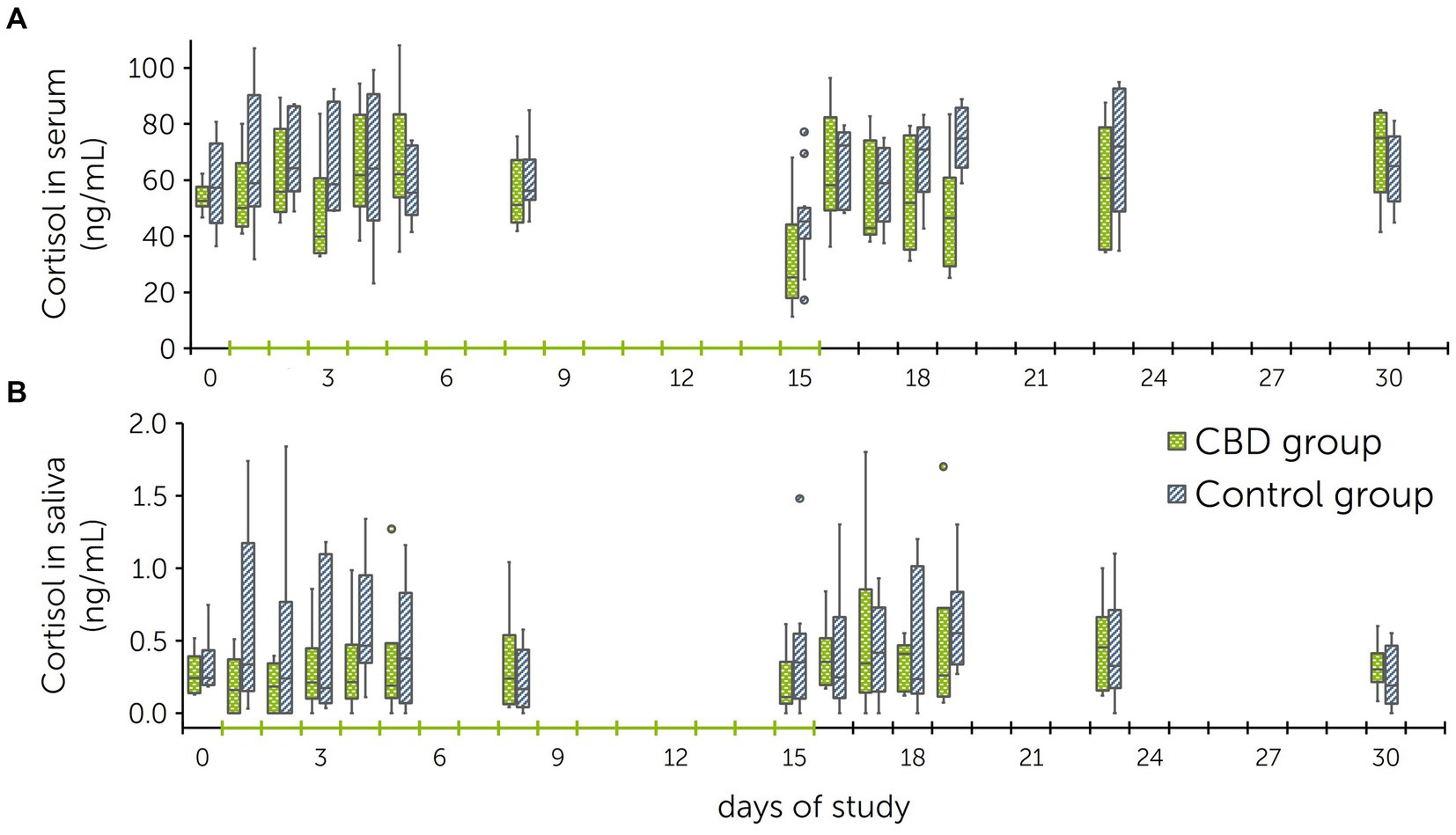 Figura 4. Diagramas de caja de los niveles de cortisol en suero (A) y saliva (B) obtenidos durante el estudio de dosis múltiples con administración diaria de cannabidiol (CBD) y pastas placebo a un grupo de tratamiento y control (n = 6 + 6 caballos). El grupo de tratamiento recibió pasta que contenía CBD de los días 1 a 15 (3 mg de CBD/kg dos veces al día p.o.).
Figura 4. Diagramas de caja de los niveles de cortisol en suero (A) y saliva (B) obtenidos durante el estudio de dosis múltiples con administración diaria de cannabidiol (CBD) y pastas placebo a un grupo de tratamiento y control (n = 6 + 6 caballos). El grupo de tratamiento recibió pasta que contenía CBD de los días 1 a 15 (3 mg de CBD/kg dos veces al día p.o.).
3.4 Ensayo de objetos novedosos y ensayo de remolque
3.4.1 Ensayo del objeto novedoso
Las reacciones iniciales al descenso de la balsa de la piscina fueron trotar o galopar junto al parámetro exterior del corral redondo en todos los caballos. Los movimientos se reducen entonces a caminar, ponerse de pie u olfatear el suelo con una continuación posterior del trote o el galope en varios casos. Los patrones de movimiento de cada caballo individual se representan en la Figura 5. Se calculó la diferencia entre cada patrón de movimiento mostrado durante la prueba del objeto novedoso antes del inicio del ensayo (línea de base) y después de 13 días de administración de pasta para cada caballo. La comparación de las diferencias entre el grupo de tratamiento y el grupo control resultó no ser significativa para todos los patrones de movimiento (olfateo: p = 0,699; caminar: p = 0,818; trote: p = 0,818; galopar: p = 0,394; rodar: p = 0,699).
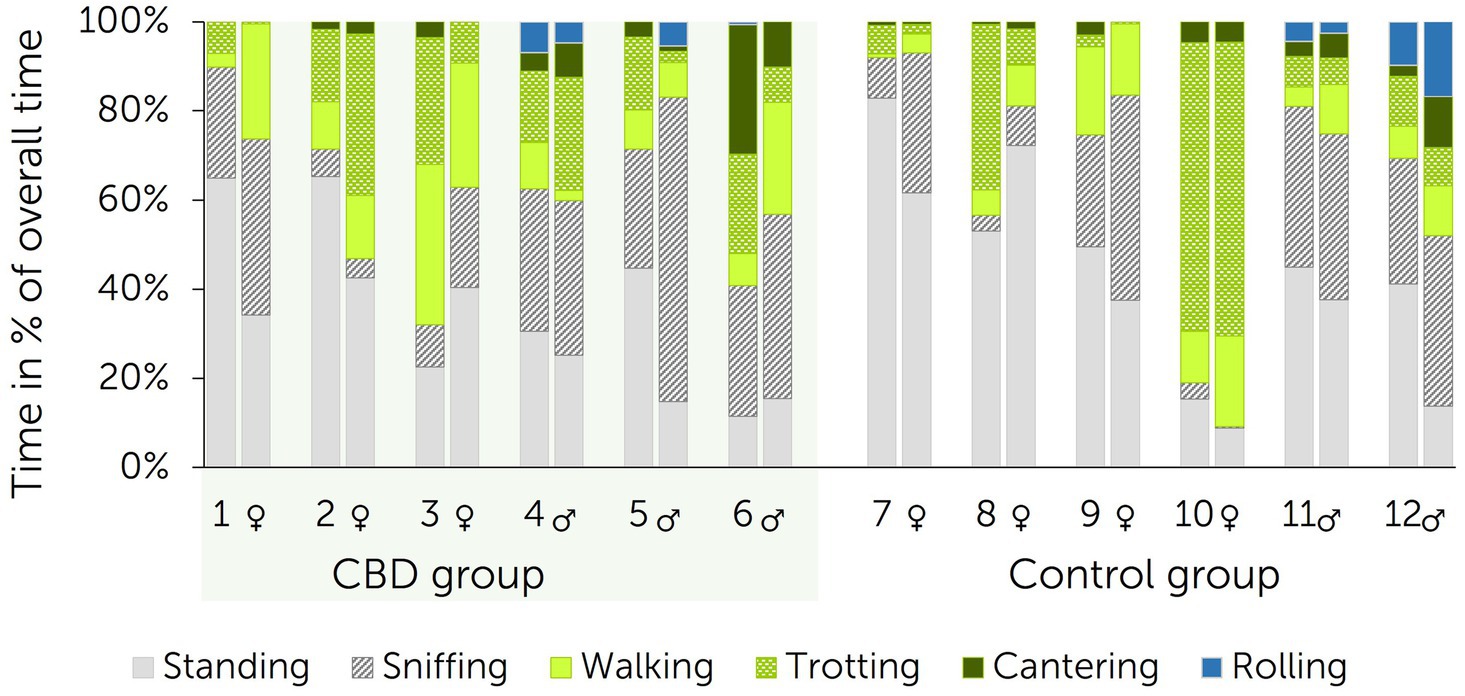 Figura 5. Patrones de movimiento durante la prueba del objeto nuevo en comparación directa por caballo individual (1-12) entre la línea de base (barras izquierdas) y después de 13 días de administración de pasta (barras derechas) a un grupo de tratamiento y control (n = 6 + 6 caballos). El grupo de tratamiento recibió una pasta que contenía cannabidiol (CBD) dos veces al día desde los días 1 hasta el 15 (3 mg de CBD/kg).
Figura 5. Patrones de movimiento durante la prueba del objeto nuevo en comparación directa por caballo individual (1-12) entre la línea de base (barras izquierdas) y después de 13 días de administración de pasta (barras derechas) a un grupo de tratamiento y control (n = 6 + 6 caballos). El grupo de tratamiento recibió una pasta que contenía cannabidiol (CBD) dos veces al día desde los días 1 hasta el 15 (3 mg de CBD/kg).
Durante ambas pruebas, los caballos cambiaron de dirección varias veces. Las diferencias en el número de cambios de dirección entre antes y después del tratamiento variaron de 0 a 4 para cada caballo en el grupo de tratamiento y de 1 a 8 para cada caballo en el grupo de control. No se encontraron diferencias significativas en la comparación entre grupos (p = 0,485).
En ambas pruebas de objetos novedosos, todos los caballos fijaron visualmente la balsa de la piscina 1,1-1,4 minutos después del inicio con una diferencia no significativa entre los grupos (p = 0,485). Durante la primera prueba del objeto nuevo (línea de base), todos los caballos se acercaron al objeto nuevo después de aproximadamente 3 minutos (grupo de tratamiento: 3,0 ± 1,3 minutos, grupo de control: 3,0 ± 1,5 minutos). Durante la segunda prueba de objetos nuevos, los caballos del grupo de tratamiento se acercaron por primera vez al objeto nuevo después de 4,4 ± 3,4 minutos y los caballos del grupo de control después de 1,5 ± 0,5 minutos. Las diferencias no fueron significativas (p = 0,065). Durante la prueba de referencia del objeto novedoso, cuatro caballos de cada grupo tocaron el objeto. Dos caballos en el grupo de tratamiento y cuatro caballos en el grupo de control tocaron la balsa de la piscina durante la segunda prueba de objetos novedosos. Los modos de tocar incluían alcanzar cuidadosamente la cabeza y el cuello, tocar tentativamente o mordisquear. No se identificó diferencia estadísticamente significativa entre los grupos (p = 0,485).
3.4.1.1 Prueba del objeto nuevo: etograma
Diez de los quince rasgos conductuales fueron calificados con valores de ICC de > 0,90. El valor ICC para «permanecer cerca de la salida» fue de 0,80. «Ladear la pata trasera» y «pisotear» se calificaron con valores de ICC entre 0,50 y 0,75, y «lamer/masticar» y «resoplar» se calificaron con valores de ICC < 0,50.
En ambos grupos, el rasgo exhibido con mayor frecuencia fue «olfatear» (grupo de tratamiento: mediana al inicio = 12 veces, mediana después de la administración de pasta = 16,5 veces; grupo control: mediana al inicio = 9,5 veces, mediana después de la administración de pasta = 10,5 veces). Otros rasgos conductuales (Tabla 2) se exhibieron una mediana de 0 a 4 veces. Los sementales individuales mostraron rasgos de comportamiento como «mover la cola» y «mover la cabeza» hasta 18 y 29 veces, respectivamente.
Para cada caballo, se calcularon las diferencias entre las puntuaciones determinadas durante el inicio y después de la administración de la pasta, sin efecto significativo cuando se compararon entre los grupos (p = 0,589).
3.4.2.1 Ensayo del remolque: etograma
La concordancia de los observadores utilizando el ICC fue calificada > 0,90 para seis de los doce rasgos conductuales. Los valores de ICC para «mover la cola», «mirar a su alrededor o detrás» y «pisar en el lugar» estuvieron entre 0,75 y 0,90. El «movimiento de la oreja», la «congelación» y el «resoplido» se calificaron con valores ICC de < 0,50.
En ambos grupos, el rasgo conductual observado con mayor frecuencia fue el «movimiento de la oreja» durante la prueba basal (grupo de tratamiento: mediana de 5 veces; grupo control: mediana de 3 veces) y después de la administración de pasta (ambos grupos: mediana de 3 veces). El «movimiento de las orejas», el «movimiento de la cabeza» y «mirar alrededor o detrás» se observaron principalmente en los sementales (entre 10 y 13 veces cada uno). Ningún caballo exhibió «cavar/arañar». Se calcularon las diferencias entre la prueba basal y después de la administración de pasta para cada caballo individual. Las diferencias se compararon entre los grupos mediante la prueba U de Mann-Whitney, con valores de p resultantes que oscilaron entre 0,180 («mirar a su alrededor o detrás») a > 0,999 («cavar/rascarse», «relinchar», «caminar de lado»).
3.4.2.1 Trailer test: ethogram
La concordancia de los observadores utilizando el ICC fue calificada > 0,90 para seis de los doce rasgos conductuales. Los valores de ICC para «mover la cola», «mirar a su alrededor o detrás» y «pisar en el lugar» estuvieron entre 0,75 y 0,90. El «movimiento de la oreja», la «congelación» y el «resoplido» se calificaron con valores ICC de < 0,50.
En ambos grupos, el rasgo conductual observado con mayor frecuencia fue el «movimiento de la oreja» durante la prueba basal (grupo de tratamiento: mediana de 5 veces; grupo control: mediana de 3 veces) y después de la administración de pasta (ambos grupos: mediana de 3 veces). El «movimiento de las orejas», el «movimiento de la cabeza» y «mirar alrededor o detrás» se observaron principalmente en los sementales (entre 10 y 13 veces cada uno). Ningún caballo exhibió «cavar/arañar». Se calcularon las diferencias entre la prueba basal y después de la administración de pasta para cada caballo individual. Las diferencias se compararon entre los grupos mediante la prueba U de Mann-Whitney, con valores de p resultantes que oscilaron entre 0,180 («mirar a su alrededor o detrás») a > 0,999 («cavar/rascarse», «relinchar», «caminar de lado»).
3.4.3 Frecuencia cardíaca y variabilidad de la frecuencia cardíaca
Debido a dificultades técnicas, no se dispuso de registros de los intervalos R-R durante la prueba del objeto nuevo y la prueba del remolque antes del inicio del estudio (línea de base) para su análisis. Se decidió comparar los datos de FC y VFC obtenidos durante las segundas pruebas entre el grupo de tratamiento y el grupo control. Los valores medios evaluados durante la prueba del objeto nuevo para la FC fueron: 48,6 ± 1,5 lpm, para RMSSD: 93,4 ± 22,1 ms y para SDNN: 87,9 ± 26,3 ms en el grupo de tratamiento. En el grupo control, los valores medios para la FC fueron: 44,9 ± 5,3 lpm, para RMSSD: 113,8 ± 36,5 ms y para SDNN: 113,5 ± 58,9 ms.
Durante la prueba de remolque, la HR media fue de 47,2 ± 3,7 lpm, la RMSSD media fue de 121,1 ± 21,3 ms y la SDNN media fue de 118,6 ± 37,6 ms en el grupo de tratamiento. En el grupo control, los valores medios fueron: FC: 46,3 ± 10,7 lpm, RMSSD: 124,2 ± 45,0 ms y SDNN: 132,4 ± 61,0 ms. El análisis que utilizó un ANOVA de un factor con una corrección de Greenhouse-Geisser no encontró diferencias estadísticamente significativas entre el grupo de tratamiento y el grupo de control en ambos ensayos para HR: F (1,5, 12,2) = 1,2, p = 0,312, RMSSD: F (5, 40) = 1,6, p = 0,183 y SDNN: F (6, 36) = 1,6, p = 0,178.
3.4.4 Niveles de cortisol
Se obtuvieron muestras de suero y saliva para el análisis de cortisol antes de cada prueba de objeto novedoso y después de cada prueba de remolque. Antes de la primera prueba de objetos novedosos (línea de base), los niveles de cortisol de los caballos en el grupo de tratamiento eran de 44,68 ± 11,08 ng/ml en suero y de 0,17 ± 0,09 ng/ml en saliva. Después de las pruebas basales, los niveles de cortisol aumentaron a 68,87 ± 24,95 ng/mL en suero y 0,46 ± 0,38 ng/mL en saliva. Antes de la segunda prueba de objetos nuevos, los niveles de cortisol sérico eran de 45,22 ± 12,61 ng/mL y los niveles de cortisol en saliva de 0,15 ± 0,05 ng/mL. Después de la segunda prueba de remolque, los niveles de cortisol aumentaron a 47,23 ± 18,27 ng/mL (suero) y 0,35 ± 0,15 ng/mL (saliva) (Figura 6).
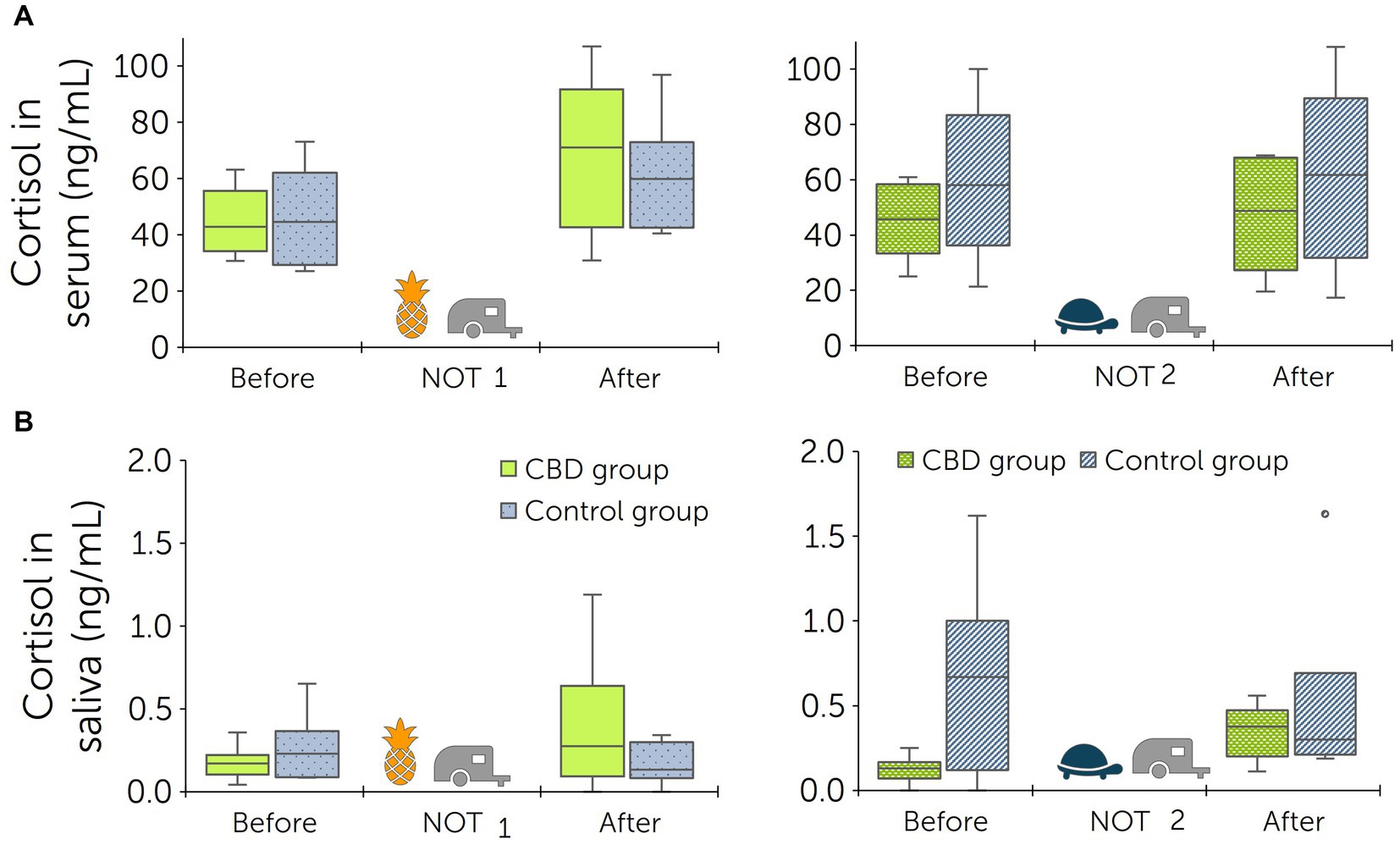 Figura 6. Niveles de cortisol en suero (A) y saliva (B) antes de la prueba del objeto nuevo (NOT) y la prueba del remolque, e inmediatamente después de ambas pruebas. Las pruebas se realizaron dos veces: antes del inicio de la administración de pasta (basal) y después de 13 días de administración de pasta a un grupo de tratamiento y control (n = 6 + 6 caballos). Las balsas de piscina se utilizaron como objetos novedosos [piña para la prueba de referencia (NO 1), tortuga para la segunda prueba (NO 2)]. El grupo de tratamiento recibió una pasta que contenía cannabidiol (CBD) dos veces al día desde los días 1 hasta el 15 (3 mg de CBD/kg).
Figura 6. Niveles de cortisol en suero (A) y saliva (B) antes de la prueba del objeto nuevo (NOT) y la prueba del remolque, e inmediatamente después de ambas pruebas. Las pruebas se realizaron dos veces: antes del inicio de la administración de pasta (basal) y después de 13 días de administración de pasta a un grupo de tratamiento y control (n = 6 + 6 caballos). Las balsas de piscina se utilizaron como objetos novedosos [piña para la prueba de referencia (NO 1), tortuga para la segunda prueba (NO 2)]. El grupo de tratamiento recibió una pasta que contenía cannabidiol (CBD) dos veces al día desde los días 1 hasta el 15 (3 mg de CBD/kg).
Antes de la prueba basal del nuevo objeto, los niveles de cortisol en el grupo de control eran de 46,28 ± 16,10 ng/ml en suero y de 0,26 ± 0,19 ng/ml en saliva. Después de cargar en un remolque, los niveles de cortisol alcanzaron 60,87 ± 18,67 ng/mL en suero y 0,20 ± 0,09 ng/mL en saliva. Antes de la segunda prueba de objetos novedosos, los niveles de cortisol sérico eran de 59,40 ± 25,12 ng/ml y los niveles de cortisol en saliva eran de 0,78 ± 0,48 ng/ml. Después de la segunda prueba de remolque, los niveles de cortisol fueron de 61,42 ± 30,30 ng/mL (suero) y de 0,50 ± 0,51 ng/mL (saliva) (Figura 6).
Se calcularon las diferencias entre los niveles de cortisol medidos en suero y saliva antes y después de las pruebas para cada caballo. La comparación de los resultados de las segundas pruebas encontró una diferencia significativa entre los grupos para los niveles de cortisol en saliva (p = 0,016), pero no en suero (p > 0,999). Dentro del grupo de tratamiento, la comparación entre las pruebas de referencia y las pruebas posteriores a la administración de pasta de CBD no mostró diferencias significativas (suero: p = 0,505; saliva: p > 0,999).
4 Discusión
La administración oral regular de una pasta que contiene CBD a una dosis de 3 mg/kg fue bien tolerada por todos los caballos de este estudio. Las múltiples administraciones orales de CBD no tuvieron un efecto significativo en las observaciones conductuales y en la monitorización del cortisol. Los parámetros investigados en una prueba de objetos novedosos y durante la carga en un remolque no difirieron significativamente del grupo de control.
Los informes de casos han descrito el CBD como un agente eficaz para el tratamiento de la alodinia mecánica, la mordedura crónica de la cuna y la succión del viento a una dosis oral de 0,5 mg de CBD/kg dos veces al día en caballos (64, 65). Estos informes no probaron los niveles de CBD en suero, pero estudios anteriores informaron concentraciones máximas de CBD de menos de 20 ng/ml en suero después de la administración de hasta 3 mg de CBD/kg p.o. (8, 66-71). Dos estudios encontraron Cmáximo niveles de 51 ng/ml de CBD en suero después de la administración oral de 2 mg de CBD/kg SID durante 7 días (67, 70), y Cmáximo niveles de 55,7 ng/ml de CBD en suero después de una dosis oral única de 10 mg de CBD/kg (72). El Cmáximo Por lo tanto, los niveles de 38,4 ± 8,9 ng/ml en suero notificados durante el presente estudio (63) están en línea con los informes anteriores y son comparativamente altos (70). En perros, niveles similares de dosis de CBD conducen a máximos de concentración mucho más altos en suero: un estudio ha demostrado que la media de Cmáximo de CBD fue de 102,3 ng/mL después de la administración oral única de 2 mg de CBD/kg (4). La absorción y retención de CBD en los caballos parece ser más parecida a la de los humanos que a la de los perros (70). La ingesta oral única de 400 mg de CBD resultó en una reducción subjetiva de la ansiedad en humanos con trastorno de ansiedad social generalizada (15). Sin embargo, dado que hasta ahora no se dispone de concentraciones séricas terapéuticas para la ansiedad en humanos, se necesitan más estudios para traducir los niveles de dosis de CBD administrados a concentraciones séricas terapéuticas.
La escala de expresión facial utilizada en este estudio se basó en la escala de sedación facial para caballos (FaceSed) y la escala de muecas de caballo (HGS) (43, 45). Dos estudios han reportado una evaluación efectiva de las expresiones faciales utilizando el HGS para indicar los niveles de dolor (73, 74). En el estudio actual, las observaciones conductuales diarias de los niveles de sedación utilizando una puntuación de sedación y una escala de expresión facial no difirieron significativamente entre el grupo de tratamiento y el grupo de control. Esta evaluación está en línea con estudios anteriores que no encontraron ningún efecto significativo en los niveles de sedación después de la alimentación regular con gránulos de CBD (~0,29 mg de CBD/kg durante 56 días) en caballos (7) y la administración oral de golosinas de CBD (4,5 mg de CBD/kg dos veces al día durante 21 días) en perros (18). Los informes sobre las percepciones de los veterinarios estadounidenses y los dueños de mascotas sobre el uso de CBD y cáñamo en perros afirman que la sedación/cansancio fueron los efectos secundarios más comúnmente observados (75-77). En humanos, se informó que la sedación era un efecto secundario después de la ingesta oral diaria de 600 mg de CBD durante 6 semanas (78). Dado que las dosis fueron más altas en estos informes, la pregunta sigue siendo si el aumento de los niveles de dosis y, por lo tanto, el aumento de las concentraciones séricas conducirían a un efecto similar en los caballos.
El cortisol es una hormona esteroide que está sujeta a un ritmo circadiano. Se informó que los niveles de cortisol evaluados en publicaciones anteriores eran más altos entre las 8 a.m. y las 12 p.m. (suero: 25-70 ng/mL; saliva: 0.55-0.70 ng/mL) (50, 79) y son comparables a los niveles alcanzados en el estudio actual. Dependiendo de la hora del día y de la exposición al estrés, los niveles de saliva pueden alcanzar hasta 3 ng/mL en los caballos, pero generalmente se mantienen por debajo de 1 ng/mL (49, 50, 80). La toma de muestras de saliva es una técnica adicional no invasiva e indolora para obtener más información sobre los niveles de cortisol (49, 81). Se ha reportado que los niveles de cortisol salival y sérico tienen diferentes grados de correlación (rs = 0,32–0,80) (50, 81). En este estudio, se observó una correlación moderada entre los niveles de cortisol sérico y salival (rs = 0,53) (82). Las interrupciones menores que conducen a respuestas de estrés pueden resultar en desviaciones del ritmo circadiano normal de cortisol y pueden elevar los niveles de cortisol en la sangre (50, 79). En este estudio, no se identificó ningún efecto significativo del CBD sobre los niveles de cortisol matutino.
Las pruebas de objetos nuevos se han utilizado en una variedad de especies y se pueden realizar con diferentes objetos desconocidos (54-57) o incluso caballos desconocidos (prueba de caballos nuevos) (83). Las pruebas de objetos novedosos están diseñadas como pruebas de miedo y se utilizan para documentar la intensidad del miedo de un animal cuando se enfrenta al objeto desconocido. Dado que no existe un protocolo estándar, ni en lo que respecta al tipo de objeto ni a la duración de la exposición, la puntuación de las reacciones y la evaluación de parámetros adicionales (como la frecuencia cardíaca) tienden a variar. En este estudio, se realizaron dos pruebas de objetos novedosos con objetos de tamaño similar pero de diferentes colores y formas (balsas de piscina: piña amarilla y tortuga verde) para que los resultados de la prueba fueran comparables y excluyeran un efecto de habituación. Un informe probó la habituación a un estímulo aterrador (bolsa de nailon blanco) en potros de 2 años de edad. Se concluyó que los caballos se habituaron al estímulo después de cuatro sesiones de entrenamiento, todas ellas realizadas en 1 día (84). Dado que las pruebas de objetos novedosos realizadas en este estudio solo se realizaron dos veces y con 16 días de diferencia, se consideró que la habituación era un factor limitante poco probable. El efecto del CBD en caballos se ha probado en otro estudio utilizando una nueva prueba de objetos después de la administración oral diaria de gránulos de CBD (~0,2 mg de CBD/kg) (6). Se documentó un grado de reactividad significativamente menor en comparación con un grupo control (6). Una prueba de respuesta al miedo realizada en perros después del tratamiento oral con CBD (1,4 mg de CBD/kg) no mostró ningún efecto significativo (85). De acuerdo con este informe, el presente estudio no encontró diferencias significativas entre el grupo de tratamiento y el grupo control en cuanto a los patrones de movimiento. Los tiempos de reacción al nuevo objeto difirieron entre los grupos: durante la primera prueba del nuevo objeto, los caballos de ambos grupos tardaron unos 3 minutos en acercarse por primera vez al nuevo objeto. Durante la segunda prueba, los caballos del grupo de tratamiento tardaron más tiempo en acercarse por primera vez al objeto (4,4 ± 3,4 min) que los caballos del grupo de control (1,5 ± 0,5 min). Estas diferencias podrían sugerir que el CBD no muestra un efecto reductor del miedo en el nivel de dosis estudiado, o que el CBD tiene un efecto relajante y reduce el interés del caballo en el nuevo objeto. El análisis estadístico mostró que las diferencias entre los grupos rozan la significación (p = 0,065), lo que podría estar sesgado por el pequeño tamaño de la muestra. Las pruebas futuras deberían incluir tamaños de muestra más grandes y caballos potencialmente nerviosos a la hora de determinar el efecto del CBD como agente ansiolítico o reductor del miedo.
Cargar en un remolque se considera un evento estresante para los caballos (58-60). Se describen diferentes métodos de entrenamiento para reducir el malestar y la ansiedad de los caballos (58-60). Además del entrenamiento, se pueden usar sedantes como la acepromazina para reducir las respuestas al estrés (61). Se ha informado que el CBD oral (un total de 400 mg, administración única) disminuye subjetivamente la ansiedad en humanos con trastorno de ansiedad social generalizada (15). Todavía no se ha informado del efecto del CBD en las reacciones de los caballos a la carga en un remolque, pero los resultados de este estudio sugieren que no aumenta la disposición de los caballos a entrar en un remolque al nivel de dosis probado.
Los rasgos de comportamiento mostrados por los caballos durante la prueba del objeto novedoso y del remolque se evaluaron mediante un etograma personalizado. Las observaciones conductuales pueden realizarse utilizando un software (53) o listas escritas a mano preparadas por uno a cuatro observadores independientes (73, 74, 86). Para reducir la subjetividad, tres observadores calificaron los rasgos de comportamiento en este estudio. La mayoría de los rasgos conductuales mostraron una concordancia de buena (0,75-0,90) a excelente (> 0,90) (87). Los rasgos conductuales con poca concordancia (< 0,50) incluyeron «movimiento de la oreja», «congelación», «lamer/masticar» y «resoplar». Las puntuaciones bajas pueden estar relacionadas con una descripción insuficiente de los rasgos respectivos, o con la detección más difícil de movimientos más pequeños, como el «movimiento de la oreja» o el «lamer/masticar», especialmente en combinación con otros movimientos al ver una grabación de vídeo. Se evaluó una amplia variedad de rasgos conductuales, incluidos los ruidos («relincho») y los movimientos de todo el cuerpo («caminar hacia atrás»), así como comportamientos indicativos de estrés, como «corcovear» o «mover la cabeza» (88). No se identificaron diferencias significativas en los rasgos conductuales mostrados entre el grupo de tratamiento y el grupo control.
Los estudios que investigan la frecuencia cardíaca (FC) y la variabilidad de la frecuencia cardíaca (HRV: RMSSD y SDNN) han demostrado que una disminución de la FC y un aumento de la RMSSD y SDNN sugieren un cambio autonómico hacia una dominancia parasimpática y, por lo tanto, son indicativos de los niveles de estrés del caballo (48, 54, 89-92). La medición de la FC y la VFC es una herramienta establecida para evaluar las respuestas al estrés debido a eventos que inducen dolor o ansiedad (90, 93-96). Además, se han realizado evaluaciones de la FC y la VFC durante las pruebas de objetos novedosos (54-56, 97) y la carga en un remolque y el posterior transporte (98, 99) en caballos. El efecto del CBD sobre la FC y la VFC se ha documentado en caballos, perros, humanos y roedores con resultados variables. En caballos, la FC evaluada durante una prueba de objetos novedosos no encontró ningún efecto significativo entre un grupo de tratamiento alimentado con 100 mg de CBD granulado (~0,2 mg de CBD/kg) y un grupo de control (6). Una prueba de esfuerzo realizada en perros tampoco encontró diferencias significativas en los valores de FC y VFC entre un grupo de tratamiento (administración oral única de 4 mg de CBD/kg) y un grupo placebo (100). Un segundo informe en perros tampoco identificó cambios significativos en RMSSD y SDNN después de una prueba de respuesta al miedo cuando se trataron por vía oral con 1,4 mg de CBD/kg (85). Por el contrario, la administración intraperitoneal única de CBD en roedores (10 mg de CBD/kg) redujo significativamente el aumento de la FC y la presión arterial en un entorno que inducía estrés y condicionamiento del miedo, lo que sugiere un efecto ansiolítico (14, 16). En este estudio, los valores de FC fueron más altos y la RMSSD y SDNN fueron más bajas en el grupo de tratamiento que en el grupo de control, lo que indica un estado parasimpático menos pronunciado en el grupo de tratamiento. Sin embargo, dado que estas diferencias no fueron estadísticamente significativas, su relevancia es discutible.
La medición de las concentraciones de cortisol es un parámetro establecido para la evaluación del estrés en caballos (49, 51, 81, 92, 99). Al comparar los niveles de cortisol antes y después de las nuevas pruebas de objetos y remolques, los niveles de cortisol en el suero aumentaron en diversos grados (Figura 6). Dentro del grupo de tratamiento, el aumento fue menos pronunciado después de la segunda ronda de pruebas. El análisis estadístico mostró que esta reducción no fue significativa. En el grupo de control, los niveles de cortisol salival habían disminuido después de ambas rondas de prueba. Por lo tanto, la diferencia entre el grupo de tratamiento y el grupo control fue significativa (p = 0,016). El efecto del CBD sobre los niveles de cortisol se ha investigado en humanos, perros y caballos con resultados variables (17, 66, 100-102). Después de una prueba de esfuerzo, los perros que recibieron CBD oral (4 mg de CBD/kg) mostraron concentraciones séricas de cortisol significativamente más bajas que un grupo de control (100). En caballos, un estudio comparó los niveles de cortisol entre los caballos a los que se les administró aceite de CBD y los caballos que recibieron aceite de oliva después del transporte sin hallazgos significativos (66). Los estudios realizados en humanos son difíciles de comparar debido a sus diferentes diseños e intenciones, pero tampoco han encontrado un efecto significativo del CBD en los niveles de cortisol (101, 102).
Dado que todos los cannabinoides están catalogados como sustancias prohibidas por la FEI, y el CBD se define como un medicamento controlado (41), se requieren estudios futuros para determinar qué efectos ejerce exactamente la dosis oral de CBD en los caballos, y qué niveles de dosis e intervalos se necesitan para lograr estos efectos. En este estudio no se observaron efectos consistentemente significativos sobre el comportamiento equino.
El tamaño pequeño de la muestra es la principal limitación de este estudio. Otras limitaciones incluyen la falta de registros de los intervalos R-R durante la prueba del objeto novedoso y la prueba del remolque antes del inicio del estudio (línea de base). En consecuencia, se realizó la comparación de la FC y la VFC entre los grupos después de la administración de la pasta. Los sujetos eran caballos sanos que no mostraban problemas de conducta. Se necesitan más ensayos con tamaños de muestra más grandes para validar la eficacia potencial del CBD en caballos ansiosos o nerviosos. Los estudios futuros también pueden incluir evaluaciones más detalladas de los parámetros de la VFC, incluido el índice de actividad tonal parasimpática (PTA). También se debe considerar la dosificación oral utilizando diferentes formulaciones, como la formulación micelar (72). Los estudios clínicos que se han realizado con perros (4) son de interés para evaluar más a fondo el uso potencial del CBD en la medicina equina.
5 Conclusión
Este estudio no detectó efectos consistentemente significativos del CBD oral administrado regularmente (3 mg/kg dos veces al día durante 15 días) en las observaciones conductuales o los niveles de cortisol matutino en caballos sanos. Se probaron las reacciones de los caballos a un objeto nuevo y a la carga en un remolque y no se identificaron diferencias significativas entre el grupo de tratamiento y el grupo de control. Los parámetros evaluados incluyeron patrones de movimiento, reacción al nuevo objeto, frecuencia cardíaca y variabilidad de la frecuencia cardíaca, y niveles de cortisol en suero y saliva. No se observaron reacciones adversas después de múltiples administraciones de una pasta que contenía CBD. Se requiere más investigación para determinar las indicaciones adecuadas para el uso de productos de CBD en caballos.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Ethics statement
El estudio en animales fue aprobado por la autoridad competente para los procedimientos de autorización y notificación de experimentos con animales (LAVG) en Brandeburgo, Alemania (AZ: 2347-12-2021). El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
FE: Conceptualización, Curación de datos, Análisis formal, Investigación, Metodología, Administración de proyectos, Software, Validación, Visualización, Redacción – borrador original. AE: Conceptualización, Curación de datos, Análisis formal, Obtención de fondos, Investigación, Metodología, Administración de proyectos, Recursos, Supervisión, Validación, Redacción, revisión y edición. MM: Análisis formal, Investigación, Metodología, Administración de proyectos, Software, Validación, Redacción, revisión y edición. KCJ: Análisis formal, Metodología, Software, Validación, Redacción – revisión y edición. SW: Análisis formal, Metodología, Software, Validación, Redacción – revisión y edición. NB: Conceptualización, Curación de datos, Metodología, Administración de proyectos, Redacción, revisión y edición. JB: Curación de datos, Análisis formal, Investigación, Metodología, Administración de proyectos, Redacción, revisión y edición. MP: Curación de datos, Análisis formal, Investigación, Metodología, Redacción, revisión y edición. MT: Metodología, Supervisión, Redacción, Revisión y Edición. WB: Conceptualización, Metodología, Administración de Proyectos, Supervisión, Redacción, Revisión y Edición. CL: Conceptualización, Obtención de Financiamiento, Metodología, Administración de Proyectos, Recursos, Supervisión, Redacción, Revisión y Edición. MW: Conceptualización, Investigación, Metodología, Administración de Proyectos, Recursos, Supervisión, Redacción – revisión y edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. El estudio fue financiado por la Freie Universität Berlin, la Federación Ecuestre Alemana (FN) y Herosan healthcare GmbH. Herosan healthcare GmbH no participó en el diseño del estudio, la recopilación, el análisis, la interpretación de los datos, la redacción de este artículo ni la decisión de enviarlo para su publicación. Agradecemos el apoyo del Fondo de Publicaciones de Acceso Abierto de la Freie Universität Berlin.
Reconocimientos
Los autores desean agradecer sinceramente a Hannah Petersen y al Dr. Ina Schenk por sus extensas contribuciones a este estudio, y a Franziska Berger, Lena Haas, Katharina Jessat, Anja Kühnel, Jenny Ries, Clara Schubert y Elisa Zimmermann por su apoyo con el manejo de caballos. También agradecemos a todo el equipo del Centro Equino de Bad Saarow, especialmente al Prof. Dr. Johannes Handler, por proporcionar los caballos y su apoyo durante la parte práctica del estudio. Los autores agradecen además el apoyo de Conny Pint y Daniela Wimmer, y agradecen sinceramente a Philine Bank por iniciar el proyecto.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1305873/full#supplementary-material
Referencias
1. Fogaça, MV, Campos, AC, Coelho, LD, Duman, RS, y Guimarães, FS. Los efectos ansiolíticos del cannabidiol en ratones con estrés crónico están mediados por el sistema endocannabinoide: papel de la neurogénesis y la remodelación dendrítica. Neurofarmacología. (2018) 135:22–33. doi: 10.1016/j.neuropharm.2018.03.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Henson, JD, Vitetta, L, Quezada, M, and Hall, S. Enhancing endocannabinoid control of stress with Cannabidiol. J Clin Med. (2021) 10:10. doi: 10.3390/jcm10245852
3. Moltke, J, and Hindocha, C. Reasons for cannabidiol use: a cross-sectional study of CBD users, focusing on self-perceived stress, anxiety, and sleep problems. J Cannabis Res. (2021) 3:5. doi: 10.1186/s42238-021-00061-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Gamble, L-J, Boesch, JM, Frye, CW, Schwark, WS, Mann, S, Wolfe, L, et al. Farmacocinética, seguridad y eficacia clínica del tratamiento con Cannabidiol en perros con artrosis. Front Vet Sci. (2018) 5:165. doi: 10.3389/fvets.2018.00165
5. Della Rocca, G, y Di Salvo, A. El cáñamo en la medicina veterinaria: de la alimentación a la droga. Front Vet Sci. (2020) 7:387. doi: 10.3389/fvets.2020.00387
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Draeger, AL, Thomas, EP, Jones, KA, Davis, AJ y Porr, CS. Los efectos de la suplementación con cannabidiol granulado sobre la frecuencia cardíaca y las puntuaciones de reacción en caballos. J Vet se comporta. (2021) 46:97–100. doi: 10.1016/j.jveb.2021.09.003
7. St Blanc, MP, Chapman, AM, Keowen, ML, Garza, F, Liu, C-C, Gray, L, et al. Efectos de un suplemento que contiene Cannabidiol (CBD) sobre la sedación y las puntuaciones de Ataxia y la salud. J Veterinario Equino. (2022) 117:104085. doi: 10.1016/j.jevs.2022.104085
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Ryan, D, McKemie, DS, Kass, PH, Puschner, B, y Knych, HK. Farmacocinética y efectos sobre el metabolismo del ácido araquidónico de dosis bajas de cannabidiol tras la administración oral a caballos. Prueba de drogas anal. (2021) 13:1305–17. doi: 10.1002/dta.3028
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Mechoulam, R, Hanuš, LO, Pertwee, R, y Howlett, AC. Desde la química temprana de los fitocannabinoides hasta los endocannabinoides y más allá. Nat Rev Neurosci. (2014) 15:757–64. doi: 10.1038/nrn3811
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Golombek, P, Müller, M, Barthlott, I, Sproll, C, y Lachenmeier, DW. Conversión del cannabidiol (CBD) en cannabinoides psicotrópicos, incluido el tetrahidrocannabinol (THC): una controversia en la literatura científica. Tóxicos. (2020) 8:8. doi: 10.3390/toxics8020041
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Casajuana Köguel, C, López-Pelayo, H, Balcells-Olivero, MM, Colom, J, y Gual, A. Constituyentes psicoactivos del cannabis y sus implicaciones clínicas: una revisión sistemática. Adicciones. (2018) 30:140–51. doi: 10.20882/adicciones.858
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Granjeiro, EM, Gomes, FV, Guimarães, FS, Corrêa, FM y Resstel, LB. Efectos de la administración intracisternal de cannabidiol sobre las respuestas cardiovasculares y conductuales al estrés agudo de restricción. Pharmacol Biochem Behave. (2011) 99:743–8. doi: 10.1016/j.pbb.2011.06.027
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Gomes, FV, Resstel, LB, y Guimarães, FS. Los efectos ansiolíticos del cannabidiol inyectado en el núcleo del lecho de la estría terminal están mediados por los receptores 5-HT1A. Psicofarmacología. (2011) 213:465–73. doi: 10.1007/s00213-010-2036-z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Resstel, LB, Tavares, RF, Lisboa, SF, Joca, SR, Corrêa, FM y Guimarães, FS. Los receptores 5-HT1A están implicados en la atenuación inducida por el cannabidiol de las respuestas conductuales y cardiovasculares al estrés agudo de restricción en ratas. Hno. J Pharmacol. (2009) 156:181–8. doi: 10.1111/j.1476-5381.2008.00046.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Crippa, JA, Derenusson, GN, Ferrari, TB, Wichert-Ana, L, Duran, FL, Martin-Santos, R, et al. Bases neurales de los efectos ansiolíticos del cannabidiol (CBD) en el trastorno de ansiedad social generalizada: un informe preliminar. J Psychopharmacol (Oxford, Inglaterra). (2011) 25:121–30. doi: 10.1177/0269881110379283
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Resstel, LB, Joca, SR, Moreira, FA, Corrêa, FM, y Guimarães, FS. Efectos del cannabidiol y el diazepam en las respuestas conductuales y cardiovasculares inducidas por el miedo condicionado contextual en ratas. Behav Brain Res. (2006) 172:294–8. doi: 10.1016/j.bbr.2006.05.016
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Corsetti, S, Borruso, S, Malandrucco, L, Spallucci, V, Maragliano, L, Perino, R, et al. Cannabis sativa L. puede reducir el comportamiento agresivo hacia los humanos en perros de refugio. Sci Rep. (2021) 11:2773. doi: 10.1038/s41598-021-82439-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Morris, EM, Kitts-Morgan, SE, Spangler, DM, Gebert, J, Vanzant, ES, McLeod, KR, et al. La alimentación con golosinas que contienen cannabidiol (CBD) no afectó la actividad voluntaria diaria canina. Front Vet Sci. (2021) 8:645667. doi: 10.3389/fvets.2021.645667
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Shallcross, J, Hámor, P, Bechard, AR, Romano, M, Knackstedt, L, y Schwendt, M. Los efectos divergentes de CDPPB y Cannabidiol en la extinción del miedo y la ansiedad en un modelo de estrés olfativo de depredador de TEPT en ratas. Comportamiento frontal Neurosci. (2019) 13:91. doi: 10.3389/fnbeh.2019.00091
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Fusar-Poli, P, Crippa, JA, Bhattacharyya, S, Borgwardt, SJ, Allen, P, Martin-Santos, R, et al. Efectos distintivos del Δ9-tetrahidrocannabinol y el cannabidiol sobre la activación neuronal durante el procesamiento emocional. Arch Gen Psiquiatría. (2009) 66:95–105. doi: 10.1001/archgenpsychiatry.2008.519
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Williams, NN, Ewell, TR, Abbotts, KS, Harms, KJ, Woelfel, KA, Dooley, GP, et al. Comparación de cinco preparaciones orales de cannabidiol en humanos adultos: farmacocinética, composición corporal y variabilidad de la frecuencia cardíaca. Productos farmacéuticos (Basilea). (2021) 14. doi: 10.3390/ph14010035
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Zieba, J, Sinclair, D, Sebree, T, Bonn-Miller, M, Gutterman, D, Siegel, S, et al. El cannabidiol (CBD) reduce el comportamiento relacionado con la ansiedad en ratones a través de un mecanismo independiente de FMRP. Pharmacol Biochem Behave. (2019) 181:93–100. doi: 10.1016/j.pbb.2019.05.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. De Gregorio, D, McLaughlin, RJ, Posa, L, Ochoa-Sanchez, R, Enns, J, Lopez-Canul, M, et al. El cannabidiol modula la transmisión serotoninérgica y revierte tanto la alodinia como el comportamiento similar a la ansiedad en un modelo de dolor neuropático. Dolor. (2019) 160:136–50. doi: 10.1097/j.pain.0000000000000001386
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Fogaça, MV, Campos, AC, y Guimarães, FS. Cannabidiol y receptores 5-HT1A En: Neuropatología de las adicciones a las drogas y el abuso de sustancias: Elsevier (2016). 749–59.
25. Izzo, AA, Borrelli, F, Capasso, R, Di Marzo, V, y Mechoulam, R. Cannabinoides vegetales no psicotrópicos: nuevas oportunidades terapéuticas a partir de una hierba antigua. Tendencias Pharmacol Sci. (2009) 30:515–27. doi: 10.1016/j.tips.2009.07.006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Campos, AC, Moreira, FA, Gomes, FV, Del Bel, EA, y Guimarães, FS. Múltiples mecanismos implicados en el potencial terapéutico de amplio espectro del cannabidiol en trastornos psiquiátricos. Philos Trans R Soc Lond Ser B Biol Sci. (2012) 367:3364–78. doi: 10.1098/rstb.2011.0389
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Blessing, EM, Steenkamp, MM, Manzanares, J y Marmar, CR. Cannabidiol como tratamiento potencial para los trastornos de ansiedad. Neuroterapéutica. (2015) 12:825–36. doi: 10.1007/s13311-015-0387-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Leweke, FM, Piomelli, D, Pahlisch, F, Muhl, D, Gerth, CW, Hoyer, C, et al. El cannabidiol mejora la señalización de la anandamida y alivia los síntomas psicóticos de la esquizofrenia. Psiquiatría Transl. (2012) 2:e94. doi: 10.1038/tp.2012.15
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Watanabe, K, Kayano, Y, Matsunaga, T, Yamamoto, I y Yoshimura, H. Inhibición de la actividad de la anandamida amidasa en microsomas cerebrales de ratón por cannabinoides. Biol Pharm Bull. (1996) 19:1109–11. doi: 10.1248/bpb.19.1109
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Di Marzo, V, Bisogno, T, y De, PL. Anandamida: a algunos les gusta el calor. Tendencias Pharmacol Sci. (2001) 22:346–9. doi: 10.1016/S0165-6147(00)01712-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Riebe, CJ, Pamplona, FA, Kamprath, K, y Wotjak, CT. Alivio del miedo: hacia un nuevo marco conceptual y lo que los endocannabinoides tienen que ver con él. Neurociencia. (2012) 204:159–85. doi: 10.1016/j.neuroscience.2011.11.057
32. McLaughlin, RJ, Hill, MN, y Gorzalka, BB. Un papel fundamental para la señalización endocannabinoide prefrontocortical en la regulación del estrés y el comportamiento emocional. Neurosci Biobehav Rev. (2014) 42:116–31. doi: 10.1016/j.neubiorev.2014.02.006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Russo, EB, Burnett, A, Hall, B, y Parker, KK. Propiedades agonísticas del cannabidiol en los receptores 5-HT1a. Neurochem Res. (2005) 30:1037–43. doi: 10.1007/s11064-005-6978-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Kupczyk, P, Rykala, M, Serek, P, Pawlak, A, Slowikowski, B, Holysz, M, et al. El sistema de receptores cannabinoides en caballos: distribución tisular e identificación celular en la piel. J Veterinario Pasante Med. (2022) 36:1508–24. doi: 10.1111/jvim.16467
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Galiazzo, G, Tagliavia, C, Giancola, F, Rinnovati, R, Sadeghinezhad, J, Bombardi, C, et al. Localización de cannabinoides y receptores relacionados con cannabinoides en el íleon equino. J Veterinario Equino. (2021) 104:103688. doi: 10.1016/j.jevs.2021.103688
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. McPartland, JM, Mac Donald, C, Young, M, Grant, PS, Furkert, DP y Glass, M. Estudios de afinidad y eficacia del ácido tetrahidrocannabinólico a en los tipos de receptores cannabinoides uno y dos. Cannabinoide de Cannabis Res. (2017) 2:87–95. doi: 10.1089/can.2016.0032
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Bolognini, D, Rock, EM, Cluny, NL, Cascio, MG, Limebeer, CL, Duncan, M, et al. El ácido cannabidiólico previene los vómitos en Suncus murinus y el comportamiento inducido por náuseas en ratas al mejorar la activación del receptor 5-HT1A. Hno. J Pharmacol. (2013) 168:1456–70. doi: 10.1111/bph.12043
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. de Petrocellis, L, Ligresti, A, Moriello, AS, Allarà, M, Bisogno, T, Petrosino, S, et al. Efectos de los cannabinoides y extractos de Cannabis enriquecidos con cannabinoides sobre los canales TRP y las enzimas metabólicas endocannabinoides. Hno. J Pharmacol. (2011) 163:1479–94. doi: 10.1111/j.1476-5381.2010.01166.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. McPartland, JM, y Russo, EB. Cannabis y extractos de Cannabis. J Cannabis Therapeutics. (2001) 1:103–32. doi: 10.1300/J175v01n03_08
40. Briyne, N, De, HD, Sandler, I, Stiles, E, Szymanski, D, Moody, S, et al. Cannabis, aceites de cannabidiol y tetrahidrocannabinol: ¿qué necesitan saber los veterinarios? Animales (Basilea). (2021) 11. doi: 10.3390/ani11030892
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Fédération Equestre Internationale. Base de datos de sustancias prohibidas de la FEI Clean Sport (2022). Disponible en: https://inside.fei.org/content/anti-doping-rules.
42. Poller, C, Hopster, K, Rohn, K y Kästner, SB. Pruebas de umbral térmico nociceptivo en caballos: efecto de la sedación neuroléptica y la neuroleptanalgesia en diferentes sitios de estimulación. BMC Vet Res. (2013) 9:135. doi: 10.1186/1746-6148-9-135
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. De, OAR, Gozalo-Marcilla, M, Ringer, SK, Schauvliege, S, Fonseca, MW, Esteves Trindade, PH, et al. Desarrollo y validación de la escala facial (cara Sed) para evaluar la sedación en caballos. PLoS Uno. (2021) 16:E0251909. doi: 10.1371/journal.pone.0251909
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Schauvliege, S, Cuypers, C, Michielsen, A, Gasthuys, F, y Gozalo-Marcilla, M. Cómo puntuar la sedación y ajustar la tasa de administración de sedantes en caballos: una revisión de la literatura e introducción del algoritmo de sedación de Gante. Veterinario Anaesth Analg. (2019) 46:4–13. doi: 10.1016/j.vaa.2018.08.005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Dalla Costa, E, Minero, M, Lebelt, D, Stucke, D, Canali, E, y Leach, MC. Desarrollo de la escala de muecas de caballo (HGS) como herramienta de evaluación del dolor en caballos sometidos a castración rutinaria. PLoS Uno. (2014) 9:e92281. doi: 10.1371/journal.pone.0092281
46. De, OAR, Gozalo-Marcilla, M, Ringer, SK, Schauvliege, S, Fonseca, MW, Trindade, PH, et al. Desarrollo, validación y fiabilidad de una escala de sedación en caballos (Equi Sed). Front Vet Sci. (2021) 8:611729. doi: 10.3389/fvets.2021.611729
Resumen de PubMed | Texto completo de CrossRef | Google Académico
47. König, V, Borstel, U, Visser, EK y Hall, C. Indicadores de estrés en la equitación. Appl Anim Behav Sci. (2017) 190:43–56. doi: 10.1016/j.applanim.2017.02.018
48. von Lewinski, M, Biau, S, Erber, R, Ille, N, Aurich, J, Faure, J-M, et al. Liberación de cortisol, frecuencia cardíaca y variabilidad de la frecuencia cardíaca en el caballo y su jinete: diferentes respuestas al entrenamiento y al rendimiento. Veterinario J. (2013) 197:229–32. doi: 10.1016/j.tvjl.2012.12.025
Resumen de PubMed | Texto completo de CrossRef | Google Académico
49. Peeters, M, Closson, C, Beckers, J-F y Vandenheede, M. Niveles de cortisol salival del jinete y del caballo durante la competición y su impacto en el rendimiento. J Veterinario Equino. (2013) 33:155–60. doi: 10.1016/j.jevs.2012.05.073
50. Bohák, Z, Szabó, F, Beckers, J-F, Melo de Sousa, N, Kutasi, O, Nagy, K, et al. Monitorización del ritmo circadiano de las concentraciones séricas y salivales de cortisol en el caballo. Domest Anim Endocrinol. (2013) 45:38–42. doi: 10.1016/j.domaniend.2013.04.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
51. Becker-Birck, M, Schmidt, A, Lasarzik, J, Aurich, J, Möstl, E y Aurich, C. Liberación de cortisol y variabilidad de la frecuencia cardíaca en caballos de deporte que participan en competiciones ecuestres. J Vet se comporta. (2013) 8:87–94. doi: 10.1016/j.jveb.2012.05.002
52. König von Borstel, U, Euent, S, Graf, P, König, S, y Gauly, M. Comportamiento equino y frecuencia cardíaca en pruebas de temperamento con o sin jinete o guía. Physiol Behave. (2011) 104:454–63. doi: 10.1016/j.physbeh.2011.05.010
53. Visser, EK, van Reenen, CG, Rundgren, M, Zetterqvist, M, Morgan, K, y Blokhuis, HJ. Las respuestas de los caballos en las pruebas de comportamiento se correlacionan con el temperamento evaluado por los jinetes. Veterinario Equino J. (2003) 35:176–83. doi: 10.2746/042516403776114108
Resumen de PubMed | Texto completo de CrossRef | Google Académico
54. Visser, EK, van Reenena, CG, van der Werf, JTN, Schilder, MBH, Knaap, JH, Barneveld, A, et al. Frecuencia cardíaca y variabilidad de la frecuencia cardíaca durante una prueba de objetos novedosos y una prueba de manejo en caballos jóvenes. Physiol Behave. (2002) 76:289–96. doi: 10.1016/S0031-9384(02)00698-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
55. Christensen, JW, Keeling, LJ y Nielsen, BL. Respuestas de los caballos a nuevos estímulos visuales, olfativos y auditivos. Appl Anim Behav Sci. (2005) 93:53–65. doi: 10.1016/j.applanim.2005.06.017
56. Munsters, CC, Visser, KE, van den Broek, J, y van Sloet Oldruitenborgh-Oosterbaan, MM. La influencia de los objetos desafiantes y la coincidencia entre el caballo y el jinete en la frecuencia cardíaca, la variabilidad de la frecuencia cardíaca y la puntuación del comportamiento en la equitación. Veterinario J. (2012) 192:75–80. doi: 10.1016/j.tvjl.2011.04.011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
57. Forkman, B, Boissy, A, Meunier-Salaün, M-C, Canali, E, y Jones, RB. Una revisión crítica de las pruebas de miedo utilizadas en bovinos, porcinos, ovinos, aves de corral y caballos. Physiol Behave. (2007) 92:340–74. doi: 10.1016/j.physbeh.2007.03.016
Resumen de PubMed | Texto completo de CrossRef | Google Académico
58. Tateo, A, Padalino, B, Boccaccio, M, Maggiolino, A, y Centoducati, P. Estrés de transporte en caballos: efectos de dos distancias diferentes. J Vet se comporta. (2012) 7:33–42. doi: 10.1016/j.jveb.2011.04.007
59. Dai, F, Dalla Costa, A, Bonfanti, L, Caucci, C, Di Martino, G, Lucarelli, R, et al. El entrenamiento basado en el refuerzo positivo para la autocarga de caballos de carne reduce el tiempo de carga y el comportamiento relacionado con el estrés. Front Vet Sci. (2019) 6:350. doi: 10.3389/fvets.2019.00350
Resumen de PubMed | Texto completo de CrossRef | Google Académico
60. Shanahan, S. Estrés de carga de remolque en caballos: efectos conductuales y fisiológicos del entrenamiento no aversivo (TTEAM). J Appl Anim Welf Sci. (2003) 6:263–74. doi: 10.1207/s15327604jaws0604_1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
61. Santos Godoi, TL, Villas-Boas, JD, Almeida, NA, Trigo, PI, De, AFQ y De, MMA. Farmacopuntura versus Acepromazina en las respuestas al estrés de los caballos durante el transporte por carretera. J Veterinario Equino. (2014) 34:294–301. doi: 10.1016/j.jevs.2013.06.008
62. Eichler, F, Ehrle, A, Jensen, KC, Baudisch, N, Petersen, H, Bäumer, W, et al. Observaciones conductuales, frecuencia cardíaca y variabilidad de la frecuencia cardíaca en caballos después de la administración oral de una pasta que contiene cannabidiol en tres dosis crecientes (parte 1/2). Front Vet Sci. (2023) 10:1305868. doi: 10.3389/fvets.2023.1305868
63. Eichler, F, Poźniak, B, Machnik, M, Schenk, I, Wingender, A, Baudisch, N, et al. Modelización farmacocinética del cannabidiol administrado por vía oral e implicaciones para el control de la medicación en caballos. Front Vet Sci. (2023) 10:1234551. doi: 10.3389/fvets.2023.1234551
Resumen de PubMed | Texto completo de CrossRef | Google Académico
64. Ellis, KL, y Contino, EK. Tratamiento con cannabidiol en un caballo con alodinia mecánica. Veterinario Equino Educ. (2021) 33:33. doi: 10.1111/eve.13168
65. Cunha, RZ, Felisardo, LL, Salamanca, G, Marchioni, GG, Neto, OI y Chiocchetti, R. El uso del cannabidiol como tratamiento novedoso para el comportamiento estereotipado oral (morder la cuna) en un caballo. Vet Anim Sci. (2023) 19:100289. doi: 10.1016/j.vas.2023.100289
Resumen de PubMed | Texto completo de CrossRef | Google Académico
66. Turner, PL, Guay, KA, Jones, T, Cohen, L, Elwonger, F, van Geem, R, et al. 113 Suplementación con cannabidiol y respuesta fisiológica en caballos transportados. J Anim Sci. (2022) 100:33. doi: 10.1093/jas/skac028.063
67. Williams, MR, Holbrook, TC, Maxwell, L, Croft, CH, Ientile, MM y Cliburn, K. Evaluación farmacocinética de un suplemento de cannabidiol en caballos. J Veterinario Equino. (2022) 110:103842. doi: 10.1016/j.jevs.2021.103842
Resumen de PubMed | Texto completo de CrossRef | Google Académico
68. Yocom, AF, O’Fallon, ES, Gustafson, DL, y Contino, EK. Farmacocinética, seguridad y concentraciones en el líquido sinovial de dosis única y múltiple Administración oral de 1 y 3 mg/kg de cannabidiol en caballos. J Veterinario Equino. (2022) 113:103933. doi: 10.1016/j.jevs.2022.103933
Resumen de PubMed | Texto completo de CrossRef | Google Académico
69. Draeger, AL, Hoffman, LK, Godwin, PR, Davis, AJ y Porr, SA. Farmacocinética de una sola alimentación de cannabidiol peletizado en caballos. Carrera de obstáculos: Universidad Estatal de Murray (2020).
70. Schwark, WS, y Wakshlag, JJ. Una perspectiva de una sola salud sobre la farmacocinética y la biotransformación comparativa del cannabidiol y el ácido cannabidiólico en humanos y animales domésticos. Am J Vet Res. (2023) 84:1–9. doi: 10.2460/ajvr.23.02.0031
Resumen de PubMed | Texto completo de CrossRef | Google Académico
71. Turner, SE, Knych, HK, y Adams, AA. Farmacocinética del cannabidiol en un ensayo cruzado aleatorizado en caballos senior. Am J Vet Res. (2022) 83:83. doi: 10.2460/ajvr.22.02.0028
Resumen de PubMed | Texto completo de CrossRef | Google Académico
72. Sánchez de Medina, A, Serrano-Rodríguez, JM, Díez de Castro, E, García-Valverde, MT, Saitua, A, Becero, M, et al. Farmacocinética y biodisponibilidad oral del cannabidiol en caballos tras administración intravenosa y oral con oleo y formulaciones micelares. Veterinario Equino J. (2023) 55:1094–103. doi: 10.1111/evj.13923
Resumen de PubMed | Texto completo de CrossRef | Google Académico
73. Dalla Costa, E, Bracci, D, Dai, F, Lebelt, D, y Minero, M. ¿Afectan los diferentes estados emocionales a la puntuación de la escala de muecas de caballo? Un estudio piloto. J Veterinario Equino. (2017) 54:114–7. doi: 10.1016/j.jevs.2017.03.221
74. Dalla Costa, E, Stucke, D, Dai, F, Minero, M, Leach, MC y Lebelt, D. Uso de la escala de muecas del caballo (HGS) para evaluar el dolor asociado con la laminitis aguda en caballos (Equus caballus). Animales (Basilea). (2016) 6:6. doi: 10.3390/ani6080047
Resumen de PubMed | Texto completo de CrossRef | Google Académico
75. Kogan, LR, Hellyer, PW, Silcox, S y Schoenfeld-Tacher, R. Uso y percepciones de los dueños de perros canadienses sobre los productos de cannabis. ¿Puede Vet J. (2019) 60:749–55.
76. Kogan, L, Schoenfeld-Tacher, R, Hellyer, P y Rishniw, M. Conocimiento, experiencia y percepción de los veterinarios de EE. UU. con respecto al uso de cannabidiol para afecciones médicas caninas. Front Vet Sci. (2018) 5:338. doi: 10.3389/fvets.2018.00338
Resumen de PubMed | Texto completo de CrossRef | Google Académico
77. Kogan, LR, Hellyer, PW y Robinson, NG. Percepciones de los consumidores sobre los productos de cáñamo para animales. J am Holistic Vet Med Assoc JAHVMA. (2016):42.
78. Boggs, DL, Surti, T, Gupta, A, Gupta, S, Niciu, M, Pittman, B, et al. Los efectos del cannabidiol (CBD) sobre la cognición y los síntomas en pacientes ambulatorios con esquizofrenia crónica: un ensayo aleatorizado controlado con placebo. Psicofarmacología. (2018) 235:1923–32. doi: 10.1007/s00213-018-4885-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
79. Irvine, CH y Alexander, SL. Factores que afectan el ritmo circadiano en las concentraciones plasmáticas de cortisol en el caballo. Domest Anim Endocrinol. (1994) 11:227–38. doi: 10.1016/0739-7240(94)90030-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
80. Aurich, J, Wulf, M, Ille, N, Erber, R, Von, LM, Palme, R, et al. Efectos de la estación, la edad, el sexo y la vivienda sobre las concentraciones salivales de cortisol en caballos. Domest Anim Endocrinol. (2015) 52:11–6. doi: 10.1016/j.domaniend.2015.01.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
81. Peeters, M, Sulon, J, Beckers, J-F, Ledoux, D y Vandenheede, M. Comparación entre las concentraciones de cortisol en sangre sérica y salival en caballos mediante un desafío hormonal adrenocorticotrópico. Veterinario Equino J. (2011) 43:487–93. doi: 10.1111/j.2042-3306.2010.00294.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
82. Schober, P, Boer, C, y Schwarte, LA. Coeficientes de correlación: uso e interpretación adecuados. Anesth Analg. (2018) 126:1763–8. doi: 10.1213/ANE.000000000000002864
83. Roelfsema, E. Adaptaciones endocrinológicas y conductuales al estrés físico inducido experimentalmente en caballos. Universidad de Utrecht: Tesis. (2008):234.
84. Christensen, JW, Rundgren, M, y Olsson, K. Métodos de entrenamiento para caballos: habituación a un estímulo aterrador. Veterinario Equino J. (2006) 38:439–43. doi: 10.2746/042516406778400574
Resumen de PubMed | Texto completo de CrossRef | Google Académico
85. Morris, EM, Kitts-Morgan, SE, Spangler, DM, McLeod, KR, Costa, JH y Harmon, DL. El impacto de la alimentación con golosinas que contienen cannabidiol (CBD) en la respuesta canina a una prueba de respuesta al miedo inducida por ruido. Front Vet Sci. (2020) 7:569565. doi: 10.3389/fvets.2020.569565
Resumen de PubMed | Texto completo de CrossRef | Google Académico
86. Terry, RL, McDonnell, SM, van Eps, AW, Soma, LR, Liu, Y, Uboh, CE, et al. Perfil farmacocinético y efectos conductuales de la gabapentina en el caballo. J Vet Pharmacol Ther. (2010) 33:485–94. doi: 10.1111/j.1365-2885.2010.01161.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
87. Perinetti, G. Sta tips parte IV: selección, interpretación y reporte del coeficiente de correlación intraclase. Sejodr. (2018) 5:3–5. doi: 10.5937/sejodr5-17434
88. Kaiser, L, Heleski, CR, Siegford, J, y Smith, KA. Conductas relacionadas con el estrés entre caballos utilizados en un programa terapéutico de equitación. J Am Vet Med Assoc. (2006) 228:39–45. doi: 10.2460/javma.228.1.39
Resumen de PubMed | Texto completo de CrossRef | Google Académico
89. Lenoir, A, Trachsel, DS, Younes, M, Barrey, E, y Robert, C. La concordancia entre el electrocardiograma y el medidor de frecuencia cardíaca es baja para la medición de la variabilidad de la frecuencia cardíaca durante el ejercicio en caballos jóvenes de resistencia. Front Vet Sci. (2017) 4:170. doi: 10.3389/fvets.2017.00170
Resumen de PubMed | Texto completo de CrossRef | Google Académico
90. Reid, K, Rogers, CW, Gronqvist, G, Gee, EK y Bolwell, CF. Ansiedad y dolor en caballos medidos por la variabilidad de la frecuencia cardíaca y el comportamiento. J Vet se comporta. (2017) 22:1–6. doi: 10.1016/j.jveb.2017.09.002
91. Borell, E von, Langbein, J, Després, G, Hansen, S, Leterrier, C, Marchant, J, et al. La variabilidad de la frecuencia cardíaca como medida de la regulación autonómica de la actividad cardíaca para evaluar el estrés y el bienestar en animales de granja: una revisión. Physiol Behave. (2007) 92:293–316. doi: 10.1016/j.physbeh.2007.01.007
92. Hernández-Avalos, I, Mota-Rojas, D, Mendoza-Flores, JE, Casas-Alvarado, A, Flores-Padilla, K, Miranda-Cortés, AE, et al. Dolor nociceptivo y ansiedad en equinos: alteraciones fisiológicas y conductuales. Mundo Veterinario. (2021) 14:2984–95. doi: 10.14202/vetworld.2021.2984-2995
Resumen de PubMed | Texto completo de CrossRef | Google Académico
93. Gehlen, H, Faust, M-D, Grzeskowiak, RM, y Trachsel, DS. Asociación entre la gravedad de la enfermedad, la variabilidad de la frecuencia cardíaca (VFC) y las concentraciones séricas de cortisol en caballos con dolor abdominal agudo. Animales (Basilea). (2020) 10. doi: 10.3390/ani10091563
Resumen de PubMed | Texto completo de CrossRef | Google Académico
94. Gehlen, H, Loschelder, J, Merle, R, y Walther, M. Evaluación de la respuesta al estrés bajo un protocolo de eutanasia estándar en caballos mediante el análisis de la variabilidad de la frecuencia cardíaca. Animales (Basilea). (2020) 10:10. doi: 10.3390/ani10030485
Resumen de PubMed | Texto completo de CrossRef | Google Académico
95. Rietmann, TR, Stuart, A, Bernasconi, P, Stauffacher, M, Auer, JA, y Weishaupt, MA. Evaluación del estrés mental en caballos de sangre caliente: variabilidad de la frecuencia cardíaca en comparación con la frecuencia cardíaca y parámetros conductuales seleccionados. Appl Anim Behav Sci. (2004) 88:121–36. doi: 10.1016/j.applanim.2004.02.016
96. Rietmann, TR, Stauffacher, M, Bernasconi, P, Auer, JA, y Weishaupt, MA. La asociación entre la frecuencia cardíaca, la variabilidad de la frecuencia cardíaca, el dolor endocrino y conductual mide el dolor en caballos que sufren de laminitis. J Vet Med A Physiol Pathol Clin Med. (2004) 51:218–25. doi: 10.1111/j.1439-0442.2004.00627.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
97. Lee, KE, Kim, JG, Lee, H y Kim, BS. Respuestas conductuales y cardíacas en caballos maduros expuestos a un objeto novedoso. J Anim Sci Technol. (2021) 63:651–61. doi: 10.5187/jast.2021.e51
98. Waran, NK, Robertson, V, Cuddeford, D, Kokoszko, A, y Marlin, DJ. Efectos del transporte de caballos mirando hacia adelante o hacia atrás sobre su comportamiento y frecuencia cardíaca. Rec. Veterinario (1996) 139:7–11. doi: 10.1136/vr.139.1.7
99. Schmidt, A, Biau, S, Möstl, E, Becker-Birck, M, Morillon, B, Aurich, J, et al. Cambios en la liberación de cortisol y la variabilidad de la frecuencia cardíaca en caballos de deporte durante el transporte por carretera de larga distancia. Domest Anim Endocrinol. (2010) 38:179–89. doi: 10.1016/j.domaniend.2009.10.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
100. Hunt, AB, Flint, HE, Logan, DW, y King, T. Una sola dosis de cannabidiol (CBD) influye positivamente en las medidas de estrés en los perros durante la separación y los viajes en coche. Frente. Vet. Sci. (2023) 10:1112604. doi: 10.3389/fvets.2023.1112604
Resumen de PubMed | Texto completo de CrossRef | Google Académico
101. Appiah-Kusi, E, Petros, N, Wilson, R, Colizzi, M, Bossong, MG, Valmaggia, L, et al. Efectos del tratamiento con cannabidiol a corto plazo sobre la respuesta al estrés social en sujetos con alto riesgo clínico de desarrollar psicosis. Psicofarmacología. (2020) 237:1121–30. doi: 10.1007/s00213-019-05442-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
102. Mongeau-Pérusse, V, Rizkallah, E, Morissette, F, Brissette, S, Bruneau, J, Dubreucq, S, et al. Efecto del cannabidiol sobre los síntomas de ansiedad y la respuesta al estrés en individuos con trastorno por consumo de cocaína: resultados exploratorios de un ensayo controlado aleatorizado. J Addict Med. (2022) 16:521–6. doi: 10.1097/ADM.000000000000000959
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: comportamiento, CBD, equino, FaceSed, variabilidad de la frecuencia cardíaca, Escala de muecas de caballo, prueba de objetos novedosos, puntuación de sedación
Cita: Eichler F, Ehrle A, Machnik M, Jensen KC, Wagner S, Baudisch N, Bolk J, Pötzsch M, Thevis M, Bäumer W, Lischer C y Wiegard M (2024) Observaciones conductuales, monitorización de la frecuencia cardíaca y el cortisol en caballos tras múltiples administraciones orales de una pasta que contiene cannabidiol (parte 2/2). Frente. Vet. Sci. 10:1305873. doi: 10.3389/fvets.2023.1305873
Recibido: 02 de octubre de 2023; Aceptado: 10 de noviembre de 2023;
Publicado: 03 Enero 2024.
Editado por:
Robin Temmerman, Colegio Europeo de Farmacología y Toxicología Veterinaria (ECVPT), Bélgica
Revisado por:
Ismael Hernández Avalos, Universidad Nacional Autónoma de México, México
Marilena Bazzano, Universidad de Camerino, Italia
Derechos de autor © 2024 Eichler, Ehrle, Machnik, Jensen, Wagner, Baudisch, Bolk, Pötzsch, Thevis, Bäumer, Lischer y Wiegard. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY). S
*Correspondencia: Fabienne Eichler, f.eichler@fu-berlin.de
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía



