Helmintiasis zoonóticas desatendidas en cánidos salvajes
 Helmintiasis zoonóticas desatendidas en cánidos salvajes: nuevos conocimientos de América del Sur
Helmintiasis zoonóticas desatendidas en cánidos salvajes: nuevos conocimientos de América del Sur
 Manuel Uribe1,2
Manuel Uribe1,2  Jan Brabec3
Jan Brabec3  Jenny J. Chaparro-Gutiérrez2
Jenny J. Chaparro-Gutiérrez2  Carlos Hermosilla1
Carlos Hermosilla1- 1Centro de Investigación Biomédica Seltersberg (BFS), Instituto de Parasitología, Universidad Justus Liebig Giessen, Gießen, Alemania
- 2Grupo de Investigación CIBAV, Facultad de Medicina Veterinaria, Universidad de Antioquia, Medellín, Colombia
- 3Instituto de Parasitología, Centro de Biología de la Academia Checa de Ciencias, České Budějovice, Chequia
La amenaza mundial de las enfermedades tropicales desatendidas (ETD) constituye un problema de salud pública en los países subdesarrollados. Las helmintiasis zoonóticas son los agentes humanos más comunes de las ETD en los países en desarrollo del África subsahariana, Asia y las Américas, causando una carga mundial de morbilidad que excede la de enfermedades infecciosas más reconocidas como la malaria y la tuberculosis. Los cánidos silvestres son mamíferos bien conocidos que actúan como reservorios naturales de helmintiasis zoonótica relevante en todo el mundo, desempeñando así un papel fundamental en su epidemiología y transmisión a los humanos. Aquí evaluamos la ocurrencia de helmintos gastrointestinales zoonóticos en dos especies de cánidos silvestres neotropicales de las regiones amazónica y andina de Colombia, es decir, el perro de monte (Speothos venaticus) y el zorro cangrejero (Cerdocyon thous). Recuperamos proglótides de tenia de muestras fecales de perros de monte y las identificamos molecularmente como el linaje canino específico de Dipylidium caninum mediante el uso de secuencias del gen de la subunidad I de la citocromo c oxidasa (cox1). Además, el examen de un zorro cangrejero durante la necropsia reveló la presencia de huevos no embrionados del nematodo descuidado Lagochilascaris cf. minor, además de huevos y proglótides grávidas del cestodo Spirometra mansoni. Estos hallazgos representan el primer informe de cestodos zoonóticos relevantes, es decir, D. caninum («genotipo canino»), S. mansoni y el nematodo L. cf. minor, en perros de monte y zorros cangrejeros como huéspedes finales. La aparición de estas helmintiasis zoonóticas en especies de cánidos silvestres requiere programas de monitoreo regulares para comprender mejor la epidemiología y las rutas de transmisión de la dipilidiasis, lagoquilascariosis y esparganosis desatendidas en América del Sur.
1. Introducción
Las zoonosis representan aproximadamente el 60% de las enfermedades infecciosas humanas emergentes, y entre estas, hasta el 70% son patógenos derivados de la vida silvestre (1, 2). Además, la amenaza mundial de las enfermedades tropicales desatendidas (ETD) constituye un problema de salud pública en los países subdesarrollados del África subsahariana, Asia y las Américas. Entre las ETD, las helmintiasis zoonóticas son los patógenos humanos más comunes, causando una carga mundial de enfermedad superior a la de enfermedades infecciosas más conocidas como la malaria y la tuberculosis. A escala mundial, las infecciones por helmintos representan más del 75% de los años de vida perdidos ajustados por discapacidad. Sin embargo, muchas de ellas han caído en el olvido como enfermedades desatendidas (3, 4). Los cánidos silvestres son reservorios naturales bien conocidos de parásitos zoonóticos (5-10), que incluyen numerosas especies de helmintos y, por lo tanto, desempeñan un papel fundamental en el ciclo de vida, la epidemiología y las rutas de transmisión de infecciones humanas (11-14). Las regiones tropicales boscosas con alta riqueza de especies de mamíferos se enfrentan a la aparición de puntos críticos de enfermedades zoonóticas bajo los cambios continuos en el uso de la tierra, lo que da lugar a un mayor riesgo de transmisión de enfermedades en la interfaz humano-animal (15, 16). Los países en desarrollo de latitudes más bajas (por ejemplo, los territorios neotropicales) tienen una concentración de patógenos zoonóticos emergentes, mientras que los estudios científicos y los esfuerzos de vigilancia que se centran en este tema siguen siendo escasos (17). El conocimiento de los cestodos zoonóticos se limita a los géneros Dibothriocephalus (diphyllobothriosis), Hymenolepis y Taenia, dejando infecciones descuidadas por cestodos poco comunes como bertielliosis, dipylidiasis, equinococosis, inermicapsiferosis, raillietinosis, mesocestoidiosis y esparganosis, que rara vez se informan clínicamente y se subestiman incluso por especialistas (4, 18, 19). Los cánidos silvestres comprenden un gran grupo de carnívoros que se distribuyen por todo el mundo, a menudo viviendo muy cerca de las poblaciones humanas (20-22). Los neotrópicos albergan un total de 10 especies de cánidos silvestres con variados comportamientos, hábitats y formas (Tabla 1). El presente estudio presenta los hallazgos sobre el parásito helminto gastrointestinal en dos especies de cánidos salvajes neotropicales (NWC) altamente divergentes: el esquivo perro semiacuático diurno / crepuscular y el zorro cangrejero nocturno que habita en el suelo. Además, examinamos el papel potencial que NWC puede desempeñar como huéspedes definitivos (DH) en la transmisión y mantenimiento de helmintiasis zoonóticas desatendidas, proporcionando nuevos conocimientos sobre este problema no resuelto.
2. Materiales y métodos
2.1. Áreas de estudio y recogida de muestras
Con base en el sistema de clasificación Köppen-Geiger, las áreas de muestreo amazónicas y andinas se encontraron en selvas tropicales y veranos templados y cálidos sin climas secos, respectivamente (23). El muestreo de animales se centró en las regiones del norte de América del Sur (Figura 1) y dentro del rango de distribución de perros de monte y zorros cangrejeros en el área neotropical. El estudio actual incluyó muestras recolectadas entre 2019 y 2021 como parte de un programa nacional de conservación y monitoreo de vida silvestre llevado a cabo por veterinarios / mamólogos en Colombia. Además, los animales encontrados muertos y recolectados por los pueblos indígenas y las comunidades locales se incluyeron en el estudio. Debido al comportamiento evasivo de los perros de monte, se recolectaron especímenes de parásitos de sitios de muestreo directo en senderos que fueron monitoreados sistemáticamente por cámaras trampa. Se siguieron las características generales y morfométricas de los depósitos de carnívoros silvestres para la identificación fecal (24). Además, las pistas asociadas y el conocimiento ecológico tradicional local también se utilizaron para muestrear estos individuos esquivos, como se describió anteriormente (25, 26). Por lo tanto, las muestras fecales se recogieron lo más frescas posible. No se examinaron cadáveres de perros de monte durante el período de estudio. Sin embargo, se encontraron proglótides dispersos y segmentos de estróbilos de cestodos parcialmente deshidratados durante el examen macroscópico de heces de dos perros de monte monitoreados (n = 2) en el municipio amazónico de Puerto Santander, Colombia. La recolección de parásitos de zorros cangrejeros se llevó a cabo durante la necropsia de un animal muerto (n = 1) en el municipio andino de Ciudad Bolívar, Colombia, y en un ambiente donde se cría ganado alimentado con pastura. Las cavidades de la cabeza, torácica y abdominal se examinaron exhaustivamente para detectar la presencia de ectoparásitos y endoparásitos. Se extirpó todo el tracto gastrointestinal, el corazón, el bazo, los riñones y el tracto respiratorio y se inspeccionaron minuciosamente in situ para detectar la presencia de parásitos macroscópicos utilizando una lupa de vidrio de 40X-25 mm. Una muestra de cestodo adulto se recuperó cuidadosamente de heces frescas recolectadas de la luz intestinal después de una incisión intestinal longitudinal. Las muestras fecales se recogieron directamente del tracto gastrointestinal y se conservaron en seco hasta su examen.
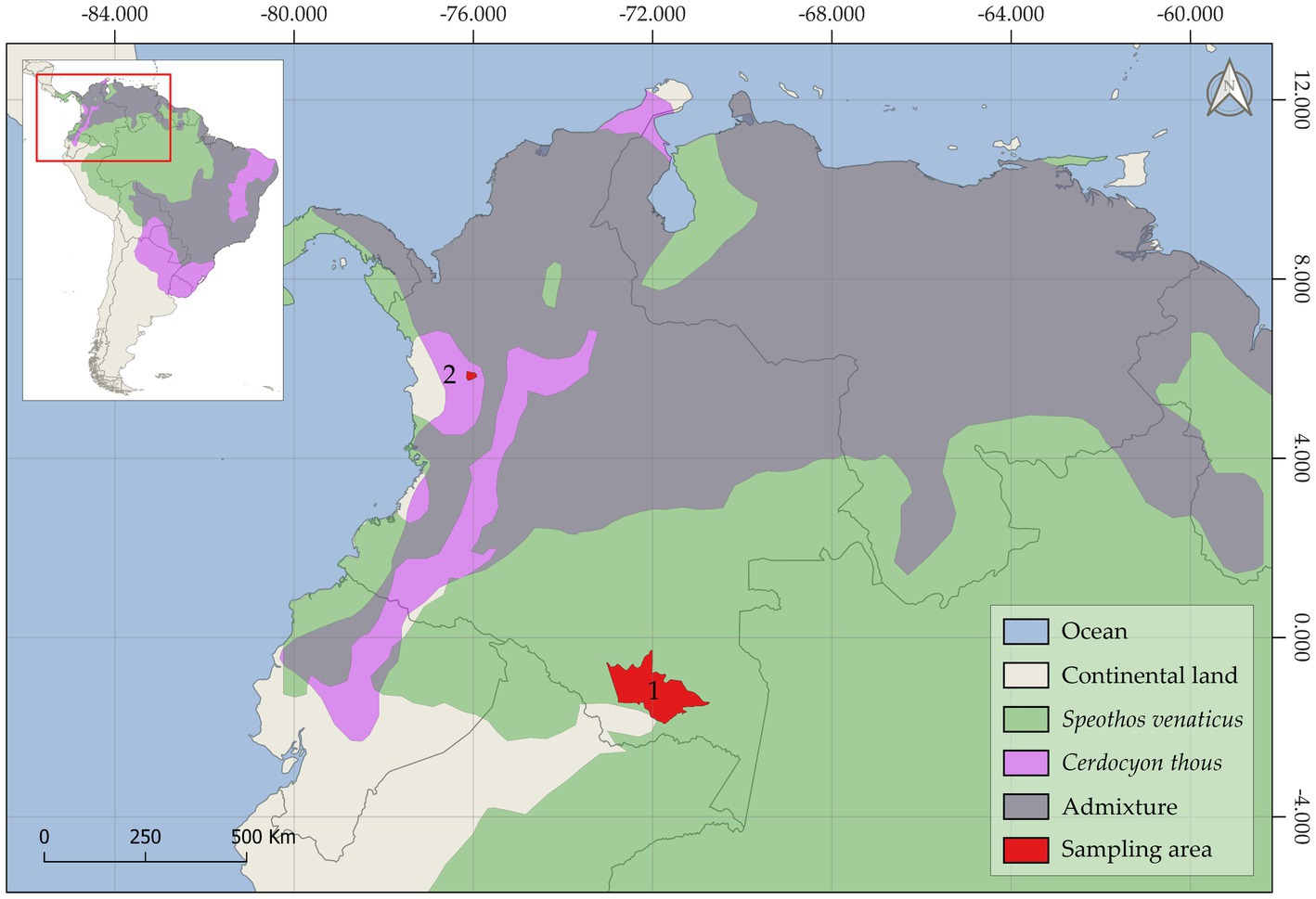 Figura 1. El mapa geográfico muestra el rango de distribución histórico del perro de monte (Speothos venaticus), el zorro cangrejero (Cerdocyon thous) y la zona de mezcla donde se encuentran ambas especies. Las áreas de muestreo amazónicas (1) y andinas (2) de este estudio se muestran en rojo.
Figura 1. El mapa geográfico muestra el rango de distribución histórico del perro de monte (Speothos venaticus), el zorro cangrejero (Cerdocyon thous) y la zona de mezcla donde se encuentran ambas especies. Las áreas de muestreo amazónicas (1) y andinas (2) de este estudio se muestran en rojo.
Después de la observación macroscópica de estrobilos de cestodos y proglótides libres en las heces, todas las muestras de parásitos recolectadas se manipularon con pinzas entomológicas finas, se enjuagaron suavemente, se lavaron tres veces con solución salina tamponada con fosfato (PBS) precalentada al 0,9% y posteriormente se conservaron en ~ 96% de EtOH hasta la evaluación microscópica y molecular. Se utilizaron técnicas parasitológicas estandarizadas combinadas de sedimentación-flotación y acetato de sodio-ácido acético-formalina modificadas para analizar muestras fecales de cánidos silvestres (27). Además, las proglótides grávidas obtenidas de la estrobila de la tenia zorro cangrejero fueron diseccionadas y montadas en húmedo en portaobjetos. Este método no invasivo para la recolección fecal permitió la recuperación de especímenes de cestodos adultos sin manipulación innecesaria, trampa o perturbación de estos cánidos en libertad (25, 28).
2.2. Evaluación fenotípica de especímenes de cestodos adultos
Se observaron rasgos morfológicos y taxonómicos morfométricos generales, y la identificación de la etapa del parásito se realizó bajo análisis microscópico utilizando un microscopio óptico semimotorizado Olympus BX53™ (Olympus Corporation, Tokio, Japón) con un aumento de 400 y 1.000X. La cámara digital Olympus DP74™ se utilizó para capturar fotomicrografías de huevos, estróbilos adultos y proglótides. Los parásitos se midieron utilizando el software de imagen estándar cellSens™. Además, los proglótidos de cestodos se deshidrataron en series de etanol (75, 80, 85, 90, 96 y 100%), se transfirieron a una solución fijadora (es decir, formalina, EtOH al 95%, ácido acético glacial, glicerina y agua destilada ultrapura Milli-Q; 10:25:5:10:50 partes, respectivamente), se clarificaron con lactofenol y se tiñeron con acetocarmina de Semichon. Finalmente, las proglótides se montaron en húmedo y el fluido de Berlese en portaobjetos como se describió anteriormente (29).
2.3. Filogenética molecular
La secuencia codificante completa del gen de la subunidad I de la citocromo c oxidasa (cox1) se amplificó en dos fragmentos superpuestos con los cebadores cox1 F y JB4.5, y JB3 y cox1R, respectivamente (30, 31) utilizando Phusion High-Fidelity DNA Polymerase (New England Biolabs, Inc., Ipswich, EUA) y las siguientes condiciones de ciclo: 35 ciclos de 10 s a 98°C, 15 s a 50°C (cox1 F + JB4.5) o 60°C (JB3 + cox1R), y 50 s a 72°C. Los productos de PCR se comprobaron en gel, se purificaron con exonucleasa I y fosfatasa alcalina FastAP (Thermo Fisher Scientific, Waltham, EE. UU.) y directamente con secuenciación de Sanger en SeqMe (Dobříš, República Checa). Las secuencias de genes contiguos se ensamblaron, verificaron visualmente y se recortaron a la región codificante de cox1 en Geneious Prime 2020.0.51 y depositado en GenBank con los números de acceso OR251823 y OR251823. Las secuencias resultantes se alinearon con datos de cox1 previamente publicados de especímenes de Dipylidium, además de otras especies estrechamente relacionadas utilizando el complemento de alineación traslacional L-INS-i de MAFFT (32) de Geneious. El uso de Nippotaenia chaenogobii (JQ2685509) y Nippotaenia mogurndae (ON640728) como taxones de grupos externos y la selección de representantes relevantes dentro del grupo se basaron en estimaciones filogenéticas previas, especialmente por Waeschenbach et al. (33) y Guo et al. (34). El árbol filogenético se estimó bajo el criterio de máxima verosimilitud en IQ-TREE (35). El modelo de mejor ajuste de la evolución de nucleótidos se seleccionó de acuerdo con el criterio de información de Akaike corregido en IQ-TREE (36), y los soportes nodales se estimaron ejecutando 1.000 réplicas estándar de bootstrap no paramétrico y 10.000 repeticiones de la prueba de razón de probabilidad aproximada similar a SH.
3. Resultados
3.1. Identificación morfológica y morfométrica del parásito
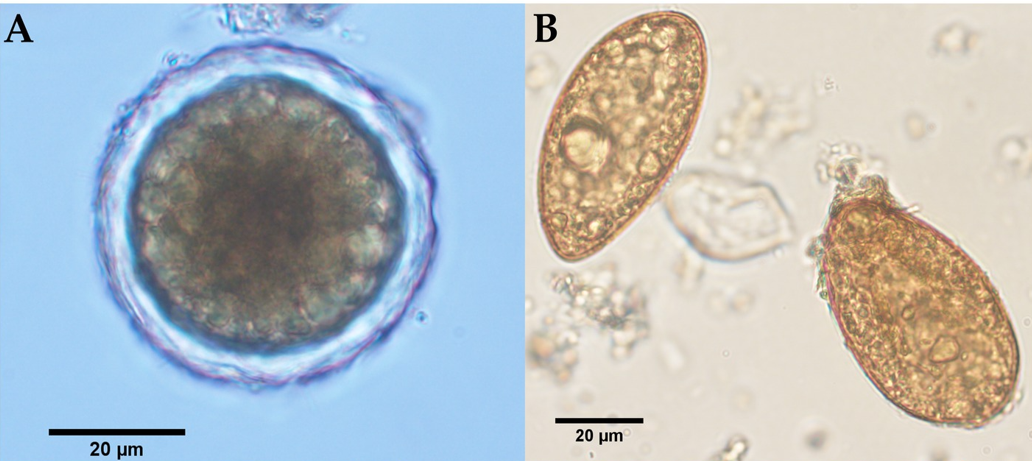
La identificación morfológica de los segmentos blanquecinos, planos, en forma de barril recuperados de las heces de perro de monte (Figura 2) se basó en la observación de la forma típica más larga que ancha, con cada proglótido con dos poros genitales bilaterales, uno en el centro de cada margen lateral. Las medidas medias de grávidos proglotínidos (n = 10) fueron de 12,082 mm (DE ± 0,542 mm) de longitud y 3,996 mm (DE ± 0,344 mm) de ancho. La evaluación fenotípica se corresponde bien con Dipylidium caninum s.l. (Dipylidiidae). También se observaron cápsulas de cáscara delgada (cápsulas ovígeras) que contenían huevos dentro de las proglótides grávidas (Figura 2D). En cuanto a la evaluación parasitológica del zorro cangrejero, se observaron huevos tipo ascarido no embrionados (51,21 × 51,57 μm) con cáscara gruesa de huevo y superficie gruesa con múltiples excavaciones (Figura 3A). Los rasgos morfológicos del huevo corresponden bien a Lagochilascaris minor, previamente descrito en hospedadores definitivos carnívoros salvajes sudamericanos (37, 38). Además, se detectaron estadios del parásito (es decir, adultos y huevos) de la especie difilobotriidea Spirometra mansoni. También se registró un cestodo débilmente musculoso, de tamaño mediano, de color rosado (89,73 cm de longitud) con un cuello largo y prominente. Se observó segmentación externa de la estróbila en todo el espécimen. El cestodo mostraba un escólex en forma de cuchara bien desarrollado sin bordes botriales enrollados. Los proglótidos maduros y grávidos estaban dentados, y los huevos presentaban un opérculo único claramente visible y una forma ovalada con un extremo puntiagudo (Figuras 3B-E y Video Suplementario S1). Las medidas proglótidas promedio (n = 483) fueron 454,14 μm (DE ± 207,16 μm) de longitud y 1,78 mm (DE ± 0,73 mm) de ancho. Los segmentos de estrobila de este espécimen de parásito se utilizaron previamente para la identificación molecular de S. mansoni reportada por Brabec et al. (39).
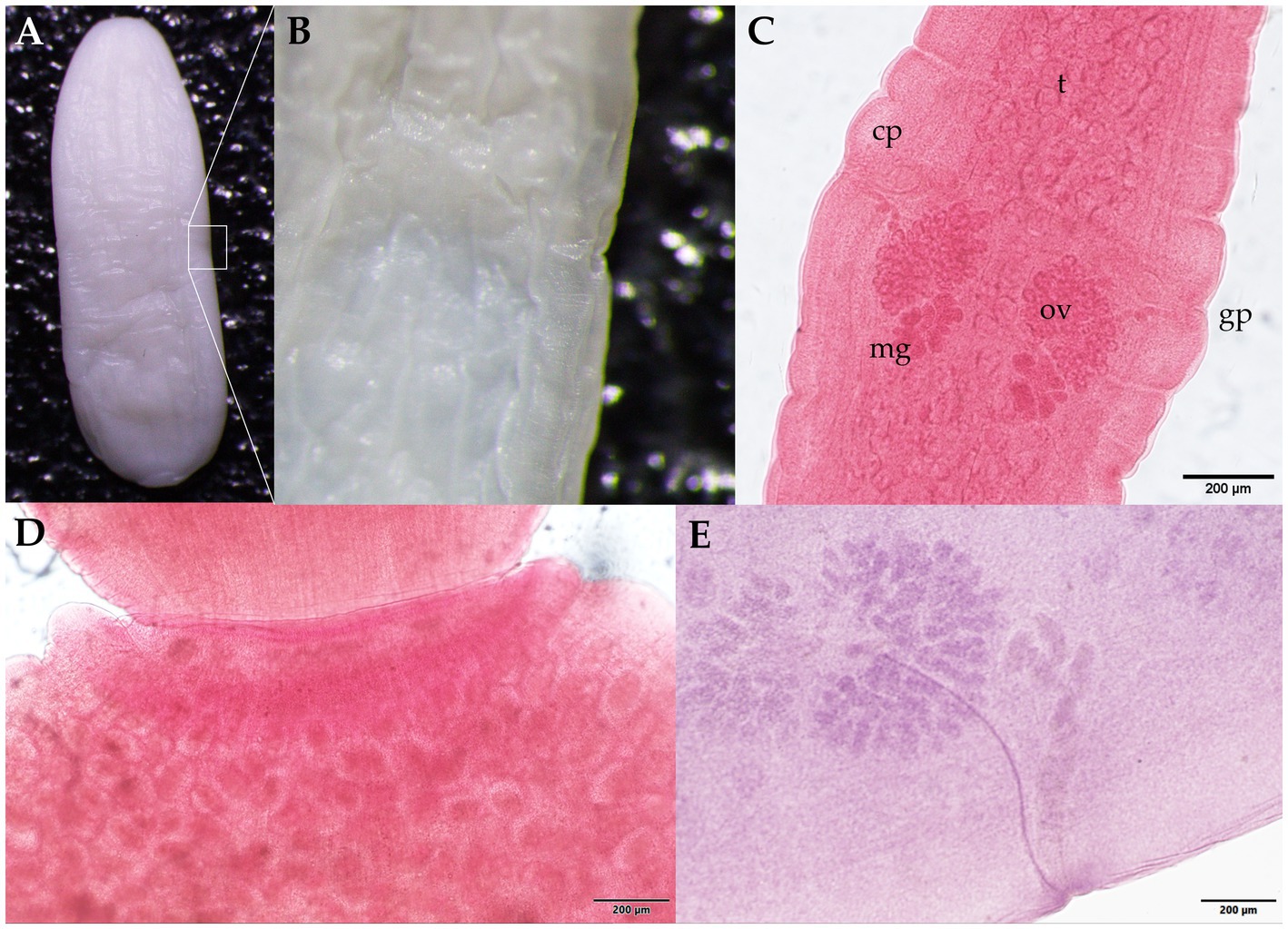 Figura 2. Proglótides de Dipylidium caninum s.l. (familia Dipylidiidae) recogidas de las heces del perro de monte amazónico (Speothos venaticus). (A) Proglótida grávida sin teñir de montaje húmedo. El cuadrado blanco indica (B) una vista ampliada lateral del poro genital. (C) Proglótides maduras teñidas con acetocarmina de Semichon; dos conjuntos de órganos genitales distribuidos simétricamente son visibles, con el parénquima testicular (T), la bolsa cirro (CP), el poro genital (GP), los ovarios (OV) y las glándulas de Mehlis (MG). (D) Primer plano del extremo proglótido ovígero en forma de semilla con cápsulas de huevo redondas a ovaladas (paquetes) con una longitud promedio de 31–50 μm y un ancho de 27–48 μm (n = 88). (E) Microfotografía del parásito que muestra detalles de uno de los dos conjuntos de órganos reproductores masculinos y femeninos. Barras de escala: (C-E) 200 μm.
Figura 2. Proglótides de Dipylidium caninum s.l. (familia Dipylidiidae) recogidas de las heces del perro de monte amazónico (Speothos venaticus). (A) Proglótida grávida sin teñir de montaje húmedo. El cuadrado blanco indica (B) una vista ampliada lateral del poro genital. (C) Proglótides maduras teñidas con acetocarmina de Semichon; dos conjuntos de órganos genitales distribuidos simétricamente son visibles, con el parénquima testicular (T), la bolsa cirro (CP), el poro genital (GP), los ovarios (OV) y las glándulas de Mehlis (MG). (D) Primer plano del extremo proglótido ovígero en forma de semilla con cápsulas de huevo redondas a ovaladas (paquetes) con una longitud promedio de 31–50 μm y un ancho de 27–48 μm (n = 88). (E) Microfotografía del parásito que muestra detalles de uno de los dos conjuntos de órganos reproductores masculinos y femeninos. Barras de escala: (C-E) 200 μm.
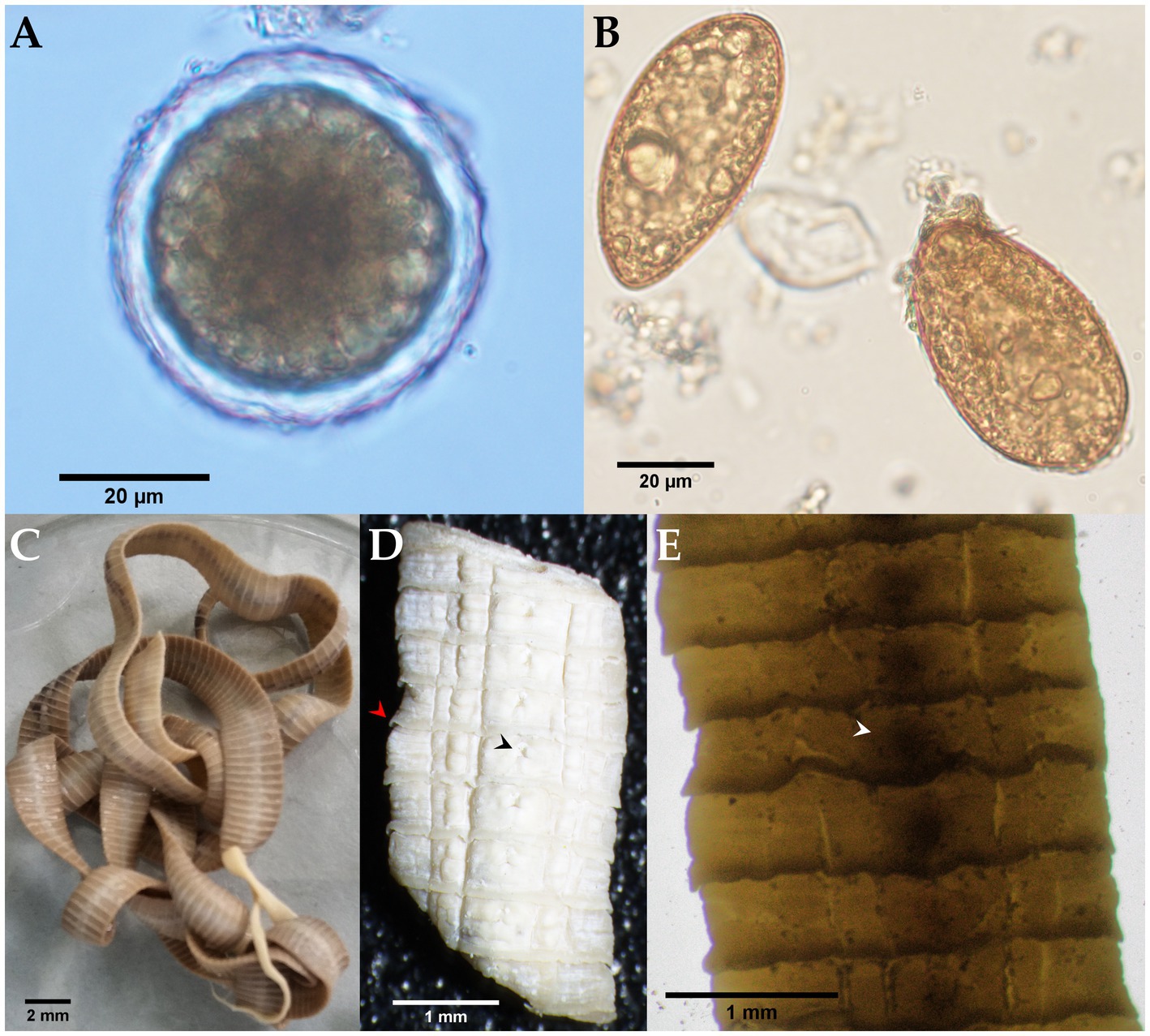 Figura 3. Examen morfológico microscópico y estereomicroscópico de las etapas del parásito encontradas en las heces de un zorro cangrejero (Cerdocyon thous). (A) Huevo no embrionado de Lagochilascaris cf. minor (51,21 × 51,57 μm) con una cáscara de huevo evidente de 5,79 μm de espesor. (B) Huevos operculados de color marrón amarillento, en forma de cono, de Spirometra mansoni (61,67 × 34,97 μm). (C) S. mansoni adulto (de los Andes) con un escólex en forma de cuchara y color rosado característico debido a la presencia de vitamina B12 del huésped. (D) Fotografía en primer plano de proglótides grávidas serradas (punta de flecha roja); Un poro genital está indicado por la punta de flecha negra. (E) Segmento estróbilo montado entero que muestra el útero en espiral ubicado centralmente (punta de flecha blanca).
Figura 3. Examen morfológico microscópico y estereomicroscópico de las etapas del parásito encontradas en las heces de un zorro cangrejero (Cerdocyon thous). (A) Huevo no embrionado de Lagochilascaris cf. minor (51,21 × 51,57 μm) con una cáscara de huevo evidente de 5,79 μm de espesor. (B) Huevos operculados de color marrón amarillento, en forma de cono, de Spirometra mansoni (61,67 × 34,97 μm). (C) S. mansoni adulto (de los Andes) con un escólex en forma de cuchara y color rosado característico debido a la presencia de vitamina B12 del huésped. (D) Fotografía en primer plano de proglótides grávidas serradas (punta de flecha roja); Un poro genital está indicado por la punta de flecha negra. (E) Segmento estróbilo montado entero que muestra el útero en espiral ubicado centralmente (punta de flecha blanca).
3.2. Caracterización molecular de Dipylidium caninum
Los segmentos de Strobila aislados de dos muestras fecales de perros andinos recolectadas por separado se caracterizaron molecularmente mediante la secuenciación de cox1. El análisis filogenético de máxima verosimilitud confirmó la identificación de la especie como D. caninum, colocando ambos especímenes en la base de un grupo bien definido compuesto exclusivamente por D. representantes del caninum (Figura 4). El linaje de los D. El grupo caninum consiste en dos subgrupos genéticamente diferenciados que corresponden a los genotipos específicos caninos y felinos de D descritos anteriormente. caninum (40). Dentro de estos, cinco representantes de genotipo específicos caninos formaron un conjunto de especímenes relativamente basal, no monofilético, estadísticamente no soportado, mientras que el genotipo específico felino representado por dos especímenes (MG587892 y OK523385) formó un linaje interno relativamente derivado y bien respaldado. Los aislados de perro de monte andino se agrupan basalmente dentro de los representantes del genotipo canino específico (Figura 4).
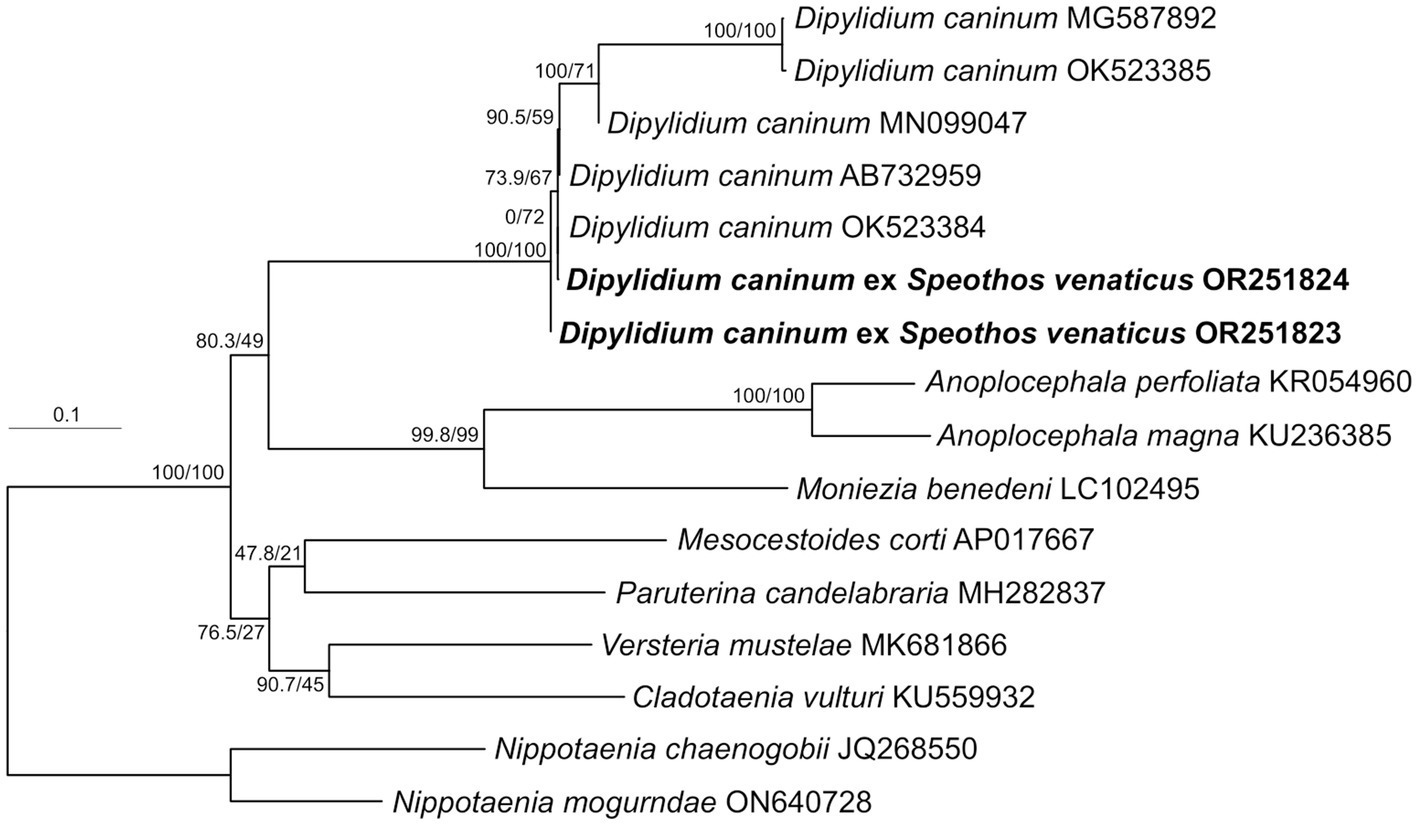 Figura 4. Posición filogenética de aislados de Dipylidium caninum obtenidos de dos huéspedes de perros de monte amazónicos. Árbol de máxima verosimilitud de IQ-TREE basado en secuencias casi completas (1.563 pb) del gen cox1 analizadas como una sola partición utilizando el modelo TIM + F + R5. Los valores nodales muestran valores de prueba de razón de verosimilitud aproximada similares a SH (10.000 repeticiones) y soportes de bootstrap no paramétricos estándar (1.000 repeticiones). Los especímenes recién caracterizados se muestran en negrita. Las accesiones de GenBank se muestran después de los nombres de taxones. La barra de escala de longitud de rama indica el número de sustituciones por sitio.
Figura 4. Posición filogenética de aislados de Dipylidium caninum obtenidos de dos huéspedes de perros de monte amazónicos. Árbol de máxima verosimilitud de IQ-TREE basado en secuencias casi completas (1.563 pb) del gen cox1 analizadas como una sola partición utilizando el modelo TIM + F + R5. Los valores nodales muestran valores de prueba de razón de verosimilitud aproximada similares a SH (10.000 repeticiones) y soportes de bootstrap no paramétricos estándar (1.000 repeticiones). Los especímenes recién caracterizados se muestran en negrita. Las accesiones de GenBank se muestran después de los nombres de taxones. La barra de escala de longitud de rama indica el número de sustituciones por sitio.
4. Discusión
En un mundo cada vez más globalizado, los factores antropogénicos han intensificado la interfaz humano-vida silvestre, aumentando así el riesgo de propagación de enfermedades, reducción de la biodiversidad y colapso de la red alimentaria (41–43). Entre los carnívoros, solo el 54,3% del área de distribución mundial de las especies comprende hábitats de alta calidad debido a la fragmentación del paisaje y la pérdida de conectividad (44). Hoy en día, la vigilancia de las enfermedades infecciosas derivadas de la vida silvestre es imprescindible para comprender mejor el impacto de las enfermedades en las poblaciones, la ecoepidemiología y la conservación de la biodiversidad (45-47). Como ya se ha dicho, los cánidos salvajes sinantrópicos también han sido reportados como reservorios naturales de nuevos parásitos helmintos (48-50).
Los estudios parasitológicos de los perros de monte todavía son limitados debido a su naturaleza esquiva y comportamiento crepuscular, y por lo tanto siguen siendo una de las especies de cánidos salvajes menos conocidas. No obstante, el agente causal de la equinococosis humana poliquística crónica (es decir, Echinococcus vogeli) se describió por primera vez en 1972 en un perro salvaje capturado en América del Sur (51, 52). Además, se han reportado otros parásitos zoonóticos relevantes como Toxocara canis, Lagochilascaris sp. y Spirometra sp. en perros silvestres junto con las ocurrencias de Spirocerca lupi, Ancylostoma caninum, Taenia sp. y el apicomplejo Cystoisospora caninum (53, 54). Además, parásitos como Dioctophyme renale, Dirofilaria immitis, Neospora caninum, Rangelia vitalii, los coccidios formadores de quistes Hammondia heydorni y los parásitos zoonóticos Angiostrongylus cantonensis, Dipylidium caninum, Leishmania infantum (sin. chagasi), Toxoplasma gondii y varias garrapatas importantes para el zorro cangrejero (55-63). Por lo tanto, ambas especies de NWC pueden contribuir al mantenimiento ambiental y la transmisión de parasitosis humanas y animales domésticos. Dada la falta de información sobre la aparición y distribución de helmintiasis de preocupación para la salud pública, como la dipilidiasis, la lagoquillascariosis y la esparganosis, los resultados presentados aquí colectivamente proporcionan nuevos conocimientos sobre el potencial de NWC en la aparición y transmisión de enfermedades infecciosas zoonóticas. Aquí, realizamos con éxito la identificación de helmintos zoonóticos descuidados albergados por perros de monte y zorros cangrejeros.
La ocurrencia mundial de D. Caninum S.L. en perros y gatos domésticos está bien documentada, al igual que la dipilidiasis humana, especialmente en niños pequeños (64-68). Los seres humanos se infectan por la ingestión accidental de D. huéspedes intermedios portadores de caninum-cisticercoides (IH), más comúnmente pulgas o piojos masticadores (69, 70). Basado en técnicas moleculares que permiten la diferenciación de especies crípticas y linajes genéticos ocultos, dos linajes genéticamente distintos, es decir, los llamados D. caninum canine y D. Los genotipos felinos de Caninum, han sido propuestos dentro del género (40, 71). En contraste con la dipilidiasis humana, D. Las infecciones por caninum rara vez producen manifestaciones clínicas en cánidos o félidos. No obstante, los animales que frecuentemente portan D. Los HI infectados con caninum contribuyen a la transmisión del parásito humano (72, 73). Los carnívoros salvajes como los dingos (Canis dingo), los chacales dorados (Canis aureus), los jaguares (Panthera onca), los zorros rojos (Vulpes vulpes) y las hienas manchadas (Crocuta crocuta) son huéspedes naturales silvestres y, por lo tanto, esenciales para el mantenimiento del ciclo de vida del parásito (72, 74-77). Las infecciones por Dipylidium caninum en poblaciones de zorros cangrejeros se han sugerido como una posible consecuencia de la expansión antropogénica en los hábitats naturales de los huéspedes silvestres (60). Un estudio realizado en la región rural de alta montaña de Colombia reportó la ocurrencia de D. caninum con una prevalencia estimada del 20% (DE ± 8,7%) en poblaciones de perros itinerantes y peridomésticos (78). En Colombia, el parásito solo se ha reportado previamente en humanos y huéspedes domésticos (79). Por lo tanto, hasta donde sabemos, los resultados presentados aquí amplían el rango de distribución geográfica de la dipilidiasis de la vida silvestre a las regiones panamazónicas y del norte de los Andes, proporcionando el primer registro de huésped para perros de monte. Adicionalmente, establecemos aquí que las proglótides de cestodos analizadas de perros de monte corresponden a la D. El genotipo canino del canino, que ocurre con mayor frecuencia en los cánidos, tiene una prepermeabilidad más corta y tiene una vida útil más larga que la D. Genotipo felino Caninum (40).
La detección del género de nematodos ascáridos Lagochilascaris plantea problemas de salud pública ya que la lagoquilascariosis humana, principalmente debido a L. minor, sigue siendo una enfermedad zoonótica extremadamente desatendida del Neotrópico. Los huéspedes definitivos son carnívoros (es decir, cánidos y félidos) portadores de adultos intestinales que arrojan huevos similares a los ascáridos altamente resistentes con una cáscara de huevo gruesa y áspera (37, 80). Los seres humanos adquieren lagoquilascariosis a través de la ingestión de roedores infectados IH (por ejemplo, agutíes, ratones, ratas) que contienen larvas de tercera etapa (L3), pero también hay evidencia de que los seres humanos podrían infectarse después de la ingestión de huevos embrionados de Lagochilascaris (81). Hasta el momento, se han registrado más de 100 casos humanos de lagoquilascariosis en las Américas (80). Se han documentado tres casos de lagoquilascariosis humana en las regiones del Caribe / Pacífico y la Amazonía de Colombia (82, 83). En cualquier caso, el presente estudio constituye el primer informe no humano de este parásito en Colombia. Debido a que la cantidad de ADN obtenida de los huevos aislados de Lagochilascaris cf. minor era extremadamente baja y mostraba una degradación parcial, el análisis filogenético posterior no fue factible. No obstante, debe recomendarse la vigilancia de la lagoquilascariosis humana por parte de las autoridades locales de salud pública.
La esparganosis distribuida a nivel mundial es una enfermedad zoonótica desatendida transmitida por los alimentos y el agua causada por la infección con cestodos del género Spirometra (Diphyllobothriidea), que se informa con frecuencia en numerosas especies de vida silvestre (14, 18, 39, 84). La esparganosis se manifiesta como larvas musculares y subcutáneas (spargana), pero también se ha reportado invasión cerebral (85). El ciclo de vida del parásito heteroxenoso obligado involucra a los carnívoros, donde los adultos intestinales arrojan huevos que posteriormente se liberan al medio ambiente con heces. En el ambiente acuoso, los huevos eclosionan en coracidia, que son ingeridos por los copépodos como el primer IH en el que se desarrolla una larva procercoide. Estas larvas son infecciosas para el segundo tetrápodo IH (por ejemplo, ranas, serpientes y aves), donde tiene lugar la maduración en larvas plerocercoides (86). Los seres humanos se infectan al comer carne cruda de IH, usarla en cataplasmas tradicionales o beber agua que contiene copépodos infectados (87). En América del Sur, se han reportado un total de 16 casos humanos de esparganosis, uno de ellos en Colombia (87, 88). El espécimen de cestodo del zorro cangrejero morfológicamente descrito aquí fue identificado molecularmente como Spirometra mansoni, el primer reporte de la especie en América del Sur (39). Como la esparganosis sigue siendo una de las enfermedades menos estudiadas, los datos morfológicos presentados aquí respaldan los hallazgos de Brabec et al. en 2022 (39), que ampliaron efectivamente el rango de distribución de S. mansoni para el Neotrópico, y requieren una mayor investigación de la esparganosis humana.
Aquí, hemos proporcionado evidencia de importantes infecciones zoonóticas por helmintos en especies de NWC altamente divergentes. En consecuencia, la investigación del papel potencial del esquivo perro de monte semiacuático, el zorro cangrejero sinantrópico / peridoméstico y otros NWC poco estudiados en el ciclo de transmisión de estos parásitos a los humanos parece esencial. Además, se necesita urgentemente una futura investigación de ectoparásitos en diferentes taxones de piojos y pulgas (por ejemplo, Felicola subrostratus, Trichodectes canis, Archaeopsyllinae y Pulicinae) que infestan las poblaciones de carnívoros silvestres para identificar el IH que alberga cisticercoides de D. caninum y, por lo tanto, permitir la transmisión zoonótica de la dipilidiasis. Las consecuencias de las coinfecciones en la epidemiología y la aptitud del huésped requieren un mejor conocimiento de los agentes infecciosos asociados a NWC para comprender su papel en la aparición de dipilidiasis, lagoquilascariosis y esparganosis (89). Sobre la base de estos hallazgos, alentamos a que se realicen más investigaciones parasitológicas entre los NWC, específicamente con respecto a sus endo y ectoparásitos. En conclusión, un estudio parasitológico continuo de la vida silvestre es fundamental para implementar estrategias de salud pública para evitar el desbordamiento zoonótico en una red de vigilancia relacionada con patógenos.
Declaración de disponibilidad de datos
Los conjuntos de datos presentados en este estudio se pueden encontrar en repositorios en línea. Los nombres del repositorio o repositorios y los números de acceso se pueden encontrar en: https://www.ncbi.nlm.nih.gov/nuccore/OR251824, OR251824; y https://www.ncbi.nlm.nih.gov/nuccore/OR251823, OR251823.
Declaración ética
El estudio en animales fue aprobado por el Comité de Ética para la Experimentación Animal (CEEA) de la Universidad de Antioquia, Colombia (AS No. 132) bajo el permiso de recolección No. 0524 de 2014 (IDB0321), los procedimientos se realizaron de acuerdo con las Directrices de la Sociedad Americana de Mamólogos para el uso de mamíferos silvestres en investigación y educación, y la Directiva de la UE 2010/63 / UE. El estudio se realizó de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones del autor
MU: conceptualización, investigación, redacción y preparación de borradores originales. MU y JB: metodología, software y visualización. JB, JC-G y CH: validación. JB y MU: análisis formal. CH y JC-G: adquisición de recursos y financiación. JB, CH y JC-G: curación y redacción de datos: revisión y edición. JC-G y CH: supervisión. Todos los autores han leído y aceptado la versión publicada del manuscrito.
Financiación
El proyecto en el que se recolectaron las muestras fue financiado por el Grupo de Investigación CIBAV-Centro de Investigaciones Básicas y Aplicadas en Veterinaria (COL0153246), Universidad de Antioquia, Estrategia de Consolidación 2018-2019. La caracterización molecular de los especímenes fue financiada por la Fundación Checa de Ciencias, Proyecto No. 19-28399X. El APC fue financiado por la Universidad Justus Liebig en Giessen. Nos gustaría extender nuestro agradecimiento al Programa de becas de excelencia doctoral del bicentenario de Colombia por el apoyo financiero al estudiante de doctorado MU.
Reconocimientos
Nos gustaría agradecer a las comunidades locales nativas amazónicas de Araracuara, Amazonas, Colombia, las comunidades rurales y los ganaderos de Ciudad Bolívar.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1235182/full#supplementary-material
Notas
1. ^http://www.geneious.com
Referencias
1. Rahman, MT, Sobur, MA, Islam, MS, Ievy, S, Hossain, MJ, El Zowalaty, ME, et al. Enfermedades zoonóticas: etiología, impacto y control. Microorganismos. (2020) 8:1405. doi: 10.3390/microorganismos8091405
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Salyer, SJ, Silver, R, Simone, K y Barton, BC. Priorización de zoonosis para el desarrollo de capacidades de salud global: temas de los talleres de enfermedades zoonóticas de una salud en 7 países, 2014-2016. Emerg infectar dis. (2017) 23:C55–64. DOI: 10.3201/EID2313.170418
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Xiao, N, Yao, J-W, Ding, W, Giraudoux, P, Craig, PS, and Ito, A. Priorities for research and control of cestode zoonoses in Asia. infectar la pobreza. (2013) 2:16. DOI: 10.1186/2049-9957-2-16
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Sapp, SGH y Bradbury, RS. Las tenias exóticas olvidadas: una revisión de la poco común Cyclophyllidea zoonótica. Parasitología. (2020) 147:533–58. doi: 10.1017/S003118202000013X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Irie, T, Uraguchi, K, Ito, T, Yamazaki, A, Takai, S, y Yagi, K. Primer informe de Sarcocystis pilosa sporocysts en heces de zorro rojo, Vulpes vulpes schrencki, en Hokkaido, Japón. Int J Parasitol Parásitos Wildl. (2020) 11:29–31. doi: 10.1016/j.ijppaw.2019.12.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Elmore, SA, Lalonde, LF, Samelius, G, Alisauskas, RT, Gajadhar, AA, y Jenkins, EJ. Endoparásitos en las heces de zorros árticos en un ecosistema terrestre en Canadá. Int J Parasitol Parásitos Wildl. (2013) 2:90–6. doi: 10.1016/j.ijppaw.2013.02.005
7. Otranto, D, y Deplazes, P. Nematodos zoonóticos de carnívoros salvajes. Int J Parasitol Parásitos Wildl. (2019) 9:370–83. doi: 10.1016/j.ijppaw.2018.12.011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Myšková, E, Brož, M, Fuglei, E, Kvičerová, J, Mácová, A, Sak, B, et al. Parásitos gastrointestinales de zorros árticos (Vulpes lagopus) y ratones hermanos (Microtus levis) en Spitsbergen. Svalbard Parasitol Res. (2019) 118:3409–18. DOI: 10.1007/S00436-019-06502-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Duscher, GG, Leschnik, M, Führer, H-P, and Joachim, A. Wildlife reservoirs for vector-borne canine, feline and zoonotic infections in Austria. Int J Parasitol Parásitos Wildl. (2015) 4:88–96. doi: 10.1016/j.ijppaw.2014.12.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Karamon, J, Samorek-Pieróg, M, Sroka, J, Bilska-Zając, E, Dąbrowska, J, Kochanowski, M, et al. El primer registro de tenias de Echinococcus ortleppi (G5) en lobo gris (Canis lupus). Patógenos. (2021) 10:853. doi: 10.3390/patógenos10070853
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Macchioni, F, Coppola, F, Furzi, F, Gabrielli, S, Baldanti, S, Boni, CB, et al. Cestodos teniidos en una manada de lobos que viven en un agroecosistema montañoso altamente antrópico. Parásito. (2021) 28:10. doi: 10.1051/parásito/2021008
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Oudni-M’rad, M, Chaâbane-Banaoues, R, M’rad, S, Trifa, F, Mezhoud, H, and Babba, H. Gastrointestinal parasites of canids, a latent risk to human health in Tunisia. Vectores parásitos. (2017) 10:280. DOI: 10.1186/S13071-017-2208-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Guerra, D, Armua-Fernandez, MT, Silva, M, Bravo, I, Santos, N, Deplazes, P, et al. Especie Taeniid del lobo ibérico (Canis lupus signatus) en Portugal con especial atención a Echinococcus spp. Int J Parasitol Parasites Wildl. (2013) 2:50–3. doi: 10.1016/j.ijppaw.2012.11.007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Bagrade, G, Králová-Hromadová, I, Bazsalovicsová, E, Radačovská, A, y Kołodziej-Sobocińska, M. Los primeros registros de Spirometra erinaceieuropaei (Cestoda: Diphyllobothriidae), un agente causal de la esparganosis humana, en la fauna letona. Parasitol Res. (2021) 120:365–71. DOI: 10.1007/S00436-020-06957-0
15. Allen, T, Murray, KA, Zambrana-Torrelio, C, Morse, SS, Rondinini, C, Di Marco, M, et al. Puntos calientes globales y correlatos de enfermedades zoonóticas emergentes. Nat Commun. (2017) 8:1124. DOI: 10.1038/S41467-017-00923-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Namusisi, S, Mahero, M, Travis, D, Pelican, K, Robertson, C, y Mugisha, L. Un estudio descriptivo del riesgo de enfermedad zoonótica en la interfaz humano-vida silvestre en un punto caliente de biodiversidad en el suroeste de Uganda. PLoS Negl Trop Dis. (2021) 15:E0008633. doi: 10.1371/journal.pntd.0008633
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Jones, KE, Patel, NG, Levy, MA, Storeygard, A, Balk, D, Gittleman, JL, et al. Tendencias mundiales de las enfermedades infecciosas emergentes. Naturaleza. (2008) 451:990–3. doi: 10.1038/nature06536
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Kuchta, R, Kołodziej-Sobocińska, M, Brabec, J, Młocicki, D, Sałamatin, R, and Scholz, T. Sparganosis (Spirometra) in Europe in the molecular era. Clin infectar dis. (2021) 72:882–90. DOI: 10.1093/cid/ciaa1036
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Dhaliwal, BBS, y Juyal, PD. Cestode zoonosis en:. Zoonosis parasitarias. Nueva Delhi: Springer India (2013). 65–82. DOI: 10.1007/978-81-322-1551-6
20. Schipper, J, Chanson, JS, Chiozza, F, Cox, NA, Hoffmann, M, Katariya, V, et al. El estado de los mamíferos terrestres y marinos del mundo: diversidad, amenaza y conocimiento. Ciencia. (2008) 322:225–30. doi: 10.1126/science.1165115
21. Brandão, EMV, Xavier, SCC, Rocha, FL, Lima, CFM, Candeias, ÍZ, Lemos, FG, et al. Cánidos silvestres y domésticos y sus interacciones en los ciclos de transmisión de Trypanosoma Cruzi y Leishmania spp. en un área del Cerrado brasileño. Patógenos. (2020) 9:818. doi: 10.3390/patógenos9100818
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Macpherson, CNL. El comportamiento humano y la epidemiología de las zoonosis parasitarias. Int J Parasitol. (2005) 35:1319–31. doi: 10.1016/j.ijpara.2005.06.004
23. Beck, HE, Zimmermann, NE, McVicar, TR, Vergopolan, N, Berg, A, y Wood, EF. Mapas actuales y futuros de clasificación climática de Köppen-Geiger con una resolución de 1 km. Datos Sci. (2018) 5:180214. doi: 10.1038/sdata.2018.214
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Chame, M. Heces de mamíferos terrestres: un resumen morfométrico y descripción. Mem Inst Oswaldo Cruz. (2003) 98:71–94. doi: 10.1590/S0074-02762003000900014
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Uribe, M, Payán, E, Brabec, J, Vélez, J, Taubert, A, Chaparro-Gutiérrez, JJ, et al. Parásitos intestinales de jaguares salvajes neotropicales, pumas, ocelotes y jaguarundis en Colombia: viejos amigos traídos del olvido y nuevas ideas. Patógenos. (2021) 10:822. DOI: 10.3390/patógenos10070822
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Zuercher, GL, Gipson, PS, y Stewart, GC. Identificación de heces carnívoras por pueblos locales y análisis moleculares. Wildl Soc Bull. (2003) 31:961–70.
27. Yang, J, y Scholten, T. Un fijador para parásitos intestinales que permite el uso de procedimientos de concentración y tinción permanente. Soy J Clin Pathol. (1977) 67:300–4. DOI: 10.1093/AJCP/67.3.300
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Uribe, M, Hermosilla, C, Rodríguez-Durán, A, Vélez, J, López-Osorio, S, Chaparro-Gutiérrez, JJ, et al. Parásitos que circulan en capibaras sinantrópicos silvestres (Hydrochoerus hydrochaeris): un enfoque de una sola salud. Patógenos. (2021) 10:1152. doi: 10.3390/patógenos10091152
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Swan, DC. El fluido de Berlese: observaciones sobre su preparación y uso como medio de montaje. Bull Entomol Res. (1936) 27:389–91. doi: 10.1017/S0007485300058259
30. Bowles, J, Blair, D, y McManus, DP. Variantes genéticas dentro del género Echinococcus identificadas por secuenciación de ADN mitocondrial. Mol Biochem Parasitol. (1992) 54:165–73. doi: 10.1016/0166-6851(92)90109-W
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Wicht, B, Yanagida, T, Scholz, T, Ito, A, Jiménez, JA, and Brabec, J. Multiplex PCR for differential identification of broad tapeworms (Cestoda: Diphyllobothrium) infecting humans. J Clin Microbiol. (2010) 48:3111–6. doi: 10.1128/JCM.00445-10
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Katoh, K, y Standley, DM. MAFFT multiple sequence alignment software version 7: improvements in performance and usability. Mol Biol Evol. (2013) 30:772–80. DOI: 10.1093/molbev/mst010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Waeschenbach, A, Webster, BL y Littlewood, DTJ. Adición de resolución a las relaciones de nivel ordinal de tenias (Platyhelminthes: Cestoda) con grandes fragmentos de ADNmt. Mol Phylogenet Evol. (2012) 63:834–47. doi: 10.1016/j.ympev.2012.02.020
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Guo, X, Liu, J, Hao, G, Zhang, L, Mao, K, Wang, X, et al. Filogenia de Plastome y diversificación temprana de Brassicaceae. BMC Genómica. (2017) 18:176. DOI: 10.1186/S12864-017-3555-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Nguyen, L-T, Schmidt, HA, von Haeseler, A, y Minh, BQ. IQ-TREE: un algoritmo estocástico rápido y eficaz para estimar filogenias de máxima verosimilitud. Mol Biol Evol. (2015) 32:268–74. DOI: 10.1093/molbev/msu300
36. Kalyaanamoorthy, S, Minh, BQ, Wong, TKF, von Haeseler, A, y Jermiin, LS. ModelFinder: selección rápida de modelos para estimaciones filogenéticas precisas. Métodos Nat. (2017) 14:587–9. DOI: 10.1038/NMETH.4285
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Rodriguez-Vivas, RI, Salazar-Grosskelwing, E, Ojeda-Chi, MM, Flota-Burgos, GJ, Solano-Barquero, A, Trinidad-Martínez, I, et al. Primer reporte morfológico y molecular de Lagochilascaris minor (Nematoda, Ascarididae) en un gato doméstico de Veracruz, México. Veterinario Parasitol (Amst). (2023) 37:100823. doi: 10.1016/j.vprsr.2022.100823
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Trindade, MAC, MRP, DM, Drehmer, CJ, y Muller, G. Primer registro de Lagochilascaris minor (Nematoda: Ascarididae) en Leopardus geoffroyi (Carnivora: Felidae) en Brasil. Rev Bras Parasitol Veterinária. (2019) 28:812–5. doi: 10.1590/s1984-29612019087
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Brabec, J, Uribe, M, Chaparro-Gutiérrez, JJ, y Hermosilla, C. Presencia de Spirometra mansoni, agente causal de la esparganosis, en América del Sur. Emerg infectar dis. (2022) 28:2347–50. DOI: 10.3201/EID2811.220529
40. Beugnet, F, Labuschagne, M, Vos C,, Crafford, D, and Fourie, J. Analysis of Dipylidium caninum tapeworms from dogs and cats, or their respective fleas. Parasite. (2018) 25:31. doi: 10.1051/parasite/2018029
41. Fricke, EC, Hsieh, C, Middleton, O, Gorczynski, D, Cappello, CD, Sanisidro, O, et al. Collapse of terrestrial mammal food webs since the late Pleistocene. Science. (2022) 377:1008–11. doi: 10.1126/science.abn4012
42. Magouras, I, Brookes, VJ, Jori, F, Martin, A, Pfeiffer, DU, and Dürr, S. Emerging zoonotic diseases: should we rethink the animal–human interface? Front Vet Sci. (2020) 7:582743. doi: 10.3389/fvets.2020.582743
43. El Bizri, HR, Morcatty, TQ, Valsecchi, J, Mayor, P, Ribeiro, JES, Vasconcelos Neto, CFA, et al. Urban wild meat consumption and trade in Central Amazonia. Conserv Biol. (2020) 34:438–48. doi: 10.1111/cobi.13420
44. Crooks, KR, Burdett, CL, Theobald, DM, Rondinini, C, and Boitani, L. Global patterns of fragmentation and connectivity of mammalian carnivore habitat. Philos Trans R Soc B Biol Sci. (2011) 366:2642–51. doi: 10.1098/rstb.2011.0120
45. Grogan, LF, Berger, L, Rose, K, Grillo, V, Cashins, SD, and Skerratt, LF. Surveillance for emerging biodiversity diseases of wildlife. PLoS Pathog. (2014) 10:e1004015. doi: 10.1371/journal.ppat.1004015
46. Martínez, ME. El calendario de epidemias: ciclos estacionales de enfermedades infecciosas. PLoS Pathog. (2018) 14:E1007327. doi: 10.1371/journal.ppat.1007327
Resumen de PubMed | Texto completo de CrossRef | Google Académico
47. Uribe, M, Rodríguez-Posada, ME, y Ramirez-Nieto, GC. Evidencia molecular de la presencia de orthomyxovirus en murciélagos neotropicales colombianos. Microbiol frontal. (2022) 13:845546. DOI: 10.3389/fmicb.2022.845546
Resumen de PubMed | Texto completo de CrossRef | Google Académico
48. Nascimento Gomes, AP, dos Santos, MM, Olifiers, N, do Val Vilela, R, Guimarães Beltrão, M, Maldonado Júnior, A, et al. Estudio filogenético molecular en Spirocercidae (Nematoda) con descripción de una nueva especie Spirobakerus sagittalis sp. nov. en cánido salvaje Cerdocyon thous de Brasil. Parasitol Res. (2021) 120:1713–25. DOI: 10.1007/S00436-021-07106-X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
49. Rojas, A, Sanchis-Monsonís, G, Alić, A, Hodžić, A, Otranto, D, Yasur-Landau, D, et al. Spirocerca vulpis sp. (Spiruridae: Spirocercidae): descripción de una nueva especie de nematodo del zorro rojo, Vulpes vulpes (Carnivora: Canidae). Parasitología. (2018) 145:1917–28. doi: 10.1017/S0031182018000707
Resumen de PubMed | Texto completo de CrossRef | Google Académico
50. Gomes, APN, Olifiers, N, Souza, JGR, Barbosa, HS, D’Andrea, PS y Maldonado, A. Una nueva especie de acantocéfalo (Archiacanthocephala: Oligacanthorhynchidae) del zorro cangrejero (Cerdocyon thous) en los humedales del Pantanal brasileño. J Parasitol. (2015) 101:74–9. doi: 10.1645/13-321.1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
51. Rausch, RL, y Bernstein, JJ. Echinococcus vogeli sp. n. (Cestoda: Taeniidae) del perro de monte, Speothos venaticus (Lund). Z Tropenmed Parasitol. (1972) 23:25–34.
52. Tappe, D, Stich, A, and Frosch, M. Emergence of polycystic neotropical echinococcosis. Emerg infectar dis. (2008) 14:292–7. DOI: 10.3201/EID1402.070742
53. Rinas, MA, Nesnek, R, Kinsella, JM y DeMatteo, KE. Aneurisma aórtico fatal y rotura en un perro de monte neotropical (Speothos venaticus) causado por Spirocerca lupi. Veterinario Parasitol. (2009) 164:347–9. doi: 10.1016/j.vetpar.2009.05.006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
54. Vizcaychipi, KA, Rinas, M, Irazu, L, Miyagi, A, Argüelles, CF, y Dematteo, KE. Parásitos zoonóticos neotropicales en perros de monte (Speothos venaticus) de bosques atlánticos del Alto Paraná en Misiones, Argentina. Vector-Borne Zoonotic Dis. (2016) 16:664–72. DOI: 10.1089/VBZ.2015.1929
Resumen de PubMed | Texto completo de CrossRef | Google Académico
55. Ribeiro, CT, Verocal, GG, y Tavares, LER. Infección por Dioctophyme renale (Nematoda, Dioctophymatidae) en el zorro cangrejero (Cerdocyon thous) de Brasil. J Wildl Dis. (2009) 45:248–50. doi: 10.7589/0090-3558-45.1.248
Resumen de PubMed | Texto completo de CrossRef | Google Académico
56. Almeida,, Kim, PCP, Melo,, Nogueira, JF, Martins, FDC, Garcia, JL, et al. Neospora caninum DNA in feces of crab-eating fox (Cerdocyon thous – Linnaeus, 1776) from northeastern Brazil. Acta Trop (2019) 197:105068. doi: 10.1016/j.actatropica.2019.105068
Resumen de PubMed | Texto completo de CrossRef | Google Académico
57. Copat, B, Bastiani, PV, Castellarin Jaconi, F, Wallyson Damarem, W, Streck, AF, de Oliveira, EC, et al. Presentación de rangeliosis hemolítica y hemorrágica en Cerdocyon thous. garrapatas garrapatas transmitidas dis. (2019) 10:690–3. doi: 10.1016/j.ttbdis.2019.02.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
58. Soares, RM, Cortez, LRPB, Gennari, SM, Sercundes, MK, Keid, LB y Pena, HFJ. Zorro cangrejero (Cerdocyon thous), un cánido sudamericano, como huésped definitivo de Hammondia heydorni. Veterinario Parasitol. (2009) 162:46–50. doi: 10.1016/j.vetpar.2009.02.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
59. Caprioli, RA, De Andrade, CP, Argenta, FF, Ehlers, LP, Soares, JF, Pavarini, SP, et al. Angiostrongilosis en Cerdocyon thous (zorro cangrejero) y Lycalopex gymnocercus (zorro de las pampas) en el sur de Brasil. Parasitología. (2019) 146:617–24. doi: 10.1017/S0031182018001865
Resumen de PubMed | Texto completo de CrossRef | Google Académico
60. Vieira, FM, Luque, JL, de Souza, LS, de Moraes Neto, AHA, y Muniz-Pereira, LC. Dipylidium caninum (Cyclophyllidea, Dipylidiidae) en un carnívoro salvaje de Brasil. J Wildl Dis. (2012) 48:233–4. doi: 10.7589/0090-3558-48.1.233
Resumen de PubMed | Texto completo de CrossRef | Google Académico
61. Almeida, JC, Melo, RPB, Kim, PCP, Guerra, NR, Alves, LC, Costa, DF, et al. Investigación molecular y serológica de enfermedades infecciosas en zorro cautivo y cangrejero (Cerdocyon thous – Linnaeus, 1776) del noreste de Brasil. Acta Parasitol. (2018) 63:184–9. DOI: 10.1515/AP-2018-0021
Resumen de PubMed | Texto completo de CrossRef | Google Académico
62. Ramos, VN, Lemos, FG, Azevedo, FC, Arrais, RC, Lima, CFM, Candeias, IZ, et al. Carnívoros salvajes, perros domésticos y garrapatas: parasitismo compartido en el Cerrado brasileño. Parasitología. (2020) 147:689–98. doi: 10.1017/S0031182020000335
Resumen de PubMed | Texto completo de CrossRef | Google Académico
63. Fiorello, CV, Robbins, RG, Maffei, L, and Wade, SE. Parasites of free-ranging small canids and felids in the Bolivian Chaco. J Zoo Wildl Med. (2006) 37:130–4. doi: 10.1638/05-075.1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
64. Ilić, T, Nišavić, U, Gajić, B, Nenadović, K, Ristić, M, Stanojević, D, et al. Prevalencia de parásitos intestinales en perros de refugios públicos en Serbia. Comp Immunol Microbiol Infect Dis. (2021) 76:101653. doi: 10.1016/j.cimid.2021.101653
Resumen de PubMed | Texto completo de CrossRef | Google Académico
65. Felsmann, M, Michalski, M, Felsmann, M, Sokół, R, Szarek, J, y Strzyżewska-Worotyńska, E. Invasive forms of canine endoparasites as a potential threat to public health – a review and own studies. Ann Agric Environ Med. (2017) 24:245–9. doi: 10.5604/12321966.1235019
Resumen de PubMed | Texto completo de CrossRef | Google Académico
66. Dantas-Torres, F, y Otranto, D. Perros, gatos, parásitos y humanos en Brasil: abriendo la caja negra. Vectores parásitos. (2014) 7:22. doi: 10.1186/1756-3305-7-22
Resumen de PubMed | Texto completo de CrossRef | Google Académico
67. Mulinge, E, Zeyhle, E, Mpario, J, Mugo, M, Nungari, L, Ngugi, B, et al. Un estudio de helmintos intestinales en perros domésticos en una interfaz humano-animal-ambiental: la conservación de Oloisukut, condado de Narok, Kenia. J Helminthol. (2021) 95:e59. doi: 10.1017/S0022149X21000547
Resumen de PubMed | Texto completo de CrossRef | Google Académico
68. Yu, Z, Ruan, Y, Zhou, M, Chen, S, Zhang, Y, Wang, L, et al. Prevalencia de parásitos intestinales en perros de compañía con diarrea en Beijing, China, y características genéticas de las especies Giardia y Cryptosporidium. Parasitol Res. (2018) 117:35–43. DOI: 10.1007/S00436-017-5631-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
69. Pilarczyk, BM, Tomza-Marciniak, AK, Pilarczyk, R, Rząd, I, Bąkowska, MJ, Udała, JM, et al. Infección de perros mapache (Nyctereutes procyonoides) del norte de Polonia con parásitos gastrointestinales como una amenaza potencial para la salud humana. J Clin Med. (2022) 11:1277. DOI: 10.3390/JCM11051277
Resumen de PubMed | Texto completo de CrossRef | Google Académico
70. Darabi, E, Beigom Kia, E, Mohebali, M, Mobedi, I, Zahabiun, F, Zarei, Z, et al. Parásitos helmínticos gastrointestinales de gatos callejeros (Felis catus) en el noroeste de Irán. Irán J Parasitol. (2021) 16:418–25. doi: 10.18502/ijpa.v16i3.7095
Resumen de PubMed | Texto completo de CrossRef | Google Académico
71. Labuschagne, M, Beugnet, F, Rehbein, S, Guillot, J, Fourie, J, and Crafford, D. Analysis of Dipylidium caninum tenias from dogs and cats, or their respective fleas. Parásito. (2018) 25:30. doi: 10.1051/parásito/2018028
Resumen de PubMed | Texto completo de CrossRef | Google Académico
72. García-Agudo, L, García-Martos, P, and Rodríguez-Iglesias, M. Dipylidium caninum infection in an infant: a rare case report and literature review. Asian Pac J Trop Biomed. (2014) 4:C565–7. doi: 10.12980/APJTB.4.2014APJTB-2014-0034
73. Hogan, CA, y Schwenk, H. Dipylidium caninum infection. N Engl J Med. (2019) 380:e39. doi: 10.1056/NEJMicm1813985
74. Smout, F, Skerratt, L, Johnson, C, Butler, J, y Congdon, B. Zoonotic helminth diseases in dogs and dingoes using shared resources in an Australian aboriginal community. Trop Med Infect Dis. (2018) 3:110. doi: 10.3390/tropicalmed3040110
Resumen de PubMed | Texto completo de CrossRef | Google Académico
75. Ćirović, D, Pavlović, I, Penezić, A, Kulišić, Z, y Selaković, S. Levels of infection of intestinal helminth species in the golden chaal Canis aureus from Serbia. J Helminthol. (2015) 89:28–33. doi: 10.1017/S0022149X13000552
Resumen de PubMed | Texto completo de CrossRef | Google Académico
76. East, ML, Kurze, C, Wilhelm, K, Benhaiem, S, and Hofer, H. Factors influencing Dipylidium sp. infection in a free-ranging social carnivore, the spotted hyaena (Crocuta crocuta). Int J Parasitol Parásitos Wildl. (2013) 2:257–65. doi: 10.1016/j.ijppaw.2013.09.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
77. Erol, U, Sarimehmetoglu, O, y Utuk, AE. Helmintos del sistema intestinal de zorros rojos y caracterización molecular de cestodos teniidos. Parasitol Res. (2021) 120:2847–54. DOI: 10.1007/S00436-021-07227-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
78. Peña-Quistial, MG, Benavides-Montaño, JA, Duque, NJR, and Benavides-Montaño, GA. Prevalencia y factores de riesgo asociados de parásitos intestinales en comunidades rurales de alta montaña del Valle del Cauca—Colombia. PLoS Negl Trop Dis. (2020) 14:E0008734. doi: 10.1371/journal.pntd.0008734
Resumen de PubMed | Texto completo de CrossRef | Google Académico
79. Rousseau, J, Castro, A, Novo, T, and Maia, C. Dipylidium caninum in the twenty-first century: epidemiological studies and reported cases in companion animals and humans. Vectores parásitos. (2022) 15:131. DOI: 10.1186/S13071-022-05243-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
80. Campos, DMB, Barbosa, AP, de Oliveira, JA, Tavares, GG, Cravo, PVL, and Ostermayer, AL. Human lagochilascariasis—a rare helmintic disease. PLoS Negl Trop Dis. (2017) 11:E0005510. doi: 10.1371/journal.pntd.0005510
81. Scioscia, NP, Olmos, L, Gorosábel, A, Bernad, L, Pedrana, J, y Denegri, GM. Natural infection in pampas fox (Lycalopex gymnocercus) by Lagochilascaris major Leiper, 1910 (Nematoda: Ascarididae) in Buenos Aires, Argentina. Zeitschrift für Parasitenkunde (Berlín, Alemania). (2018) 117:3023–7. DOI: 10.1007/S00436-018-5978-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
82. Moncada, LI, Alvarez, CA, Castellanos, C, Caceres, E, Nicholls, S, and Corredor, A. Lagochilascaris minor in a patient from the Colombian amazon: a case report. Rev Inst Med Trop Sao Paulo. (1998) 40:387–9. DOI: 10.1590/S0036-46651998000600009
Resumen de PubMed | Texto completo de CrossRef | Google Académico
83. Little, MD, y Botero, D. Dos casos de infección humana por Lagochilascaris en Colombia. Am J Trop Med Hyg. (1984) 33:381–6. DOI: 10.4269/AJTMH.1984.33.381
Resumen de PubMed | Texto completo de CrossRef | Google Académico
84. Scholz, T, Kuchta, R, y Brabec, J. Broad tapeworms (Diphyllobothriidae), parasites of wildlife and humans: recent progress and future challenges. Int J Parasitol Parásitos Wildl. (2019) 9:359–69. doi: 10.1016/j.ijppaw.2019.02.001
85. Hwang, Y-H, Son, W, Kim, Y-W, Kang, D-H, Chang, H-H, Goo, Y-K, et al. Un esparganum recuperado de Spirometra erinaceieuropaei de un hombre coreano durante la trombectomía mecánica. Coreano J Parasitol. (2020) 58:309–13. doi: 10.3347/kjp.2020.58.3.309
Resumen de PubMed | Texto completo de CrossRef | Google Académico
86. Mueller, JF. La biología de Spirometra. J Parasitol. (1974) 60:2–14. doi: 10.2307/3278670
87. Kuchta, R, Scholz, T, Brabec, J, y Narduzzi-Wicht, B. Chapter 17: Diphyllobothrium, Diplogonoporus and Spirometra En: L Xiao, U Ryan, and Y Feng, editors. Biología de parásitos transmitidos por los alimentos. Sección III: Helmintos importantes transmitidos por los alimentos. Boca Ratón: CRC Press (2015). 299–326.
88. Gómez, JJ, y Botero, D. El primer caso de esparganosis en Colombia. Am J Trop Med Hyg. (1958) 7:597–9. doi: 10.4269/ajtmh.1958.7.597
89. Hoarau, AOG, Mavingui, P, y Lebarbenchon, C. Coinfecciones en la vida silvestre: enfoque en un aspecto descuidado de la epidemiología de las enfermedades infecciosas. PLoS Pathog. (2020) 16:E1008790. doi: 10.1371/journal.ppat.1008790
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: desatendido, zoonosis, cánidos silvestres, neotrópicos, dipilidiasis, lagoquilascariosis, esparganosis
Cita: Uribe M, Brabec J, Chaparro-Gutiérrez JJ y Hermosilla C (2023) Helmintiasis zoonóticas desatendidas en cánidos salvajes: nuevos conocimientos de América del Sur. Frente. Vet. Sci. 10:1235182. doi: 10.3389/fvets.2023.1235182
Recibido: 05 Junio 2023; Aprobado: 24 de julio de 2023;
Publicado: 11 agosto 2023.
Editado por:
Georgiana Deak, Universidad de Ciencias Agrícolas y Medicina Veterinaria de Cluj-Napoca, Rumania
Revisado por:
Calin Mircea Gherman, Universidad de Ciencias Agrícolas y Medicina Veterinaria de Cluj-Napoca, Rumania
Harold Salant, Universidad Hebrea de Jerusalén, Israel
Copyright © 2023 Uribe, Brabec, Chaparro-Gutiérrez y Hermosilla. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Carlos Hermosilla, carlos.r.hermosilla@vetmed.uni-giessen.de
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía