Hipertrigliceridemia asintomática grave asociada a la administración a largo plazo de dosis bajas de rapamicina
Caso clínico: Hipertrigliceridemia asintomática grave asociada a la administración a largo plazo de dosis bajas de rapamicina en un labrador retriever sano de mediana edad
 Jeremy B. Evans1†
Jeremy B. Evans1†  Lucy Chou1†
Lucy Chou1†  Matt Kaeberlein2,3
Matt Kaeberlein2,3  Daniel E.L. Promislow2,4
Daniel E.L. Promislow2,4  Kate E. Creevy1*
Kate E. Creevy1*- 1Departamento de Ciencias Clínicas de Pequeños Animales, Facultad de Medicina Veterinaria y Ciencias Biomédicas de Texas A&M, College Station, TX, Estados Unidos
- 2Departamento de Medicina de Laboratorio y Patología, Facultad de Medicina de la Universidad de Washington, Seattle, WA, Estados Unidos
- 3Optispan, Inc., Seattle, WA, Estados Unidos
- 4Departamento de Biología, Universidad de Washington, Seattle, WA, Estados Unidos
La rapamicina es un inhibidor de mTOR que se ha demostrado que prolonga la vida útil de los organismos modelo de laboratorio. En los seres humanos, la rapamicina se usa en dosis más altas como medicamento inmunosupresor para prevenir el rechazo de órganos. Se observan numerosos efectos adversos con el tratamiento con rapamicina en humanos, siendo uno de los más comunes la desregulación del metabolismo de los lípidos. En los seres humanos, esto a menudo se manifiesta como elevaciones leves a moderadas de los lípidos séricos, con un pequeño subconjunto que desarrolla elevaciones extremas de triglicéridos. Este informe de caso describe a un labrador retriever de ocho años de edad, castrado, clínicamente sano, que desarrolló hipertrigliceridemia grave asociada con la administración de dosis bajas de rapamicina durante un período de seis meses. Durante este tiempo, el perro estuvo asintomático y no mostró otras anomalías clínicas, aparte de una lipemia progresiva. A los 15 días de suspender el tratamiento con rapamicina, y sin intervención lipémica dirigida, la lipemia y la hipertrigliceridemia del perro se resolvieron por completo.
Introducción
La rapamicina (también conocida como sirolimus), un macrólido antifúngico, es un inhibidor de la diana de la rapamicina en mamíferos (mTOR), una proteína quinasa serina/treonina responsable de regular el crecimiento, la proliferación y la vida útil de las células mediante la integración de la disponibilidad de nutrientes, la señalización celular y los factores estresantes (1-3). La rapamicina ha mostrado una actividad antitumoral prometedora contra varios tipos de neoplasia (1, 3-8) y, debido a sus efectos inmunosupresores, se utiliza a menudo para prevenir el rechazo agudo en receptores de trasplantes renales humanos (9-14). Además, uno de los descubrimientos más notables con respecto a la rapamicina es su capacidad para extender significativamente la vida útil en múltiples modelos animales de laboratorio (15-26). Aunque el efecto de la rapamicina en la longevidad canina aún no se ha evaluado en perros, estudios anteriores han demostrado protocolos de administración seguros que resultaron en una mejor función cardíaca y prometedores en el tratamiento de la enfermedad por almacenamiento de glucógeno canino (27-29).
En humanos y roedores, la rapamicina se asocia con varios efectos secundarios sistémicos y cambios clinicopatológicos (30-35). Entre estos, la hipercolesterolemia y la hipertrigliceridemia son algunos de los cambios clinicopatológicos más comúnmente observados (30, 31, 36-38). El mecanismo exacto de las dislipidemias no se conoce con precisión, pero puede estar relacionado con la inhibición del metabolismo de los lípidos mediado por la insulina, la disminución de la actividad de la lipoproteína lipasa y/o un aumento de las lipoproteínas circulantes (38-41). Si bien la gran mayoría de las elevaciones de lípidos en sangre son de leves a moderadas, hay informes raros en la literatura humana que describen elevaciones severas de triglicéridos que se desarrollan como consecuencia de la terapia con rapamicina (42-44). En los estudios limitados con perros, la administración de rapamicina en dosis bajas no se ha asociado con ningún efecto secundario significativo aparte de la microcitosis eritrocitaria y la trombocitopenia (27, 28).
Descripción del caso
Un labrador retriever castrado macho sano de ocho años de edad fue reclutado para un estudio de los efectos de la administración intermitente de rapamicina a largo plazo y en dosis bajas en perros de compañía. Este ensayo y sus resultados han sido reportados (45) y se resumirán brevemente aquí. Entre mayo de 2018 y febrero de 2019, se utilizaron medios de comunicación convencionales, sitios web y alcance comunitario local en el área de Bryan/College Station, Texas, para solicitar la inscripción. El proceso de inscripción consistió en la evaluación en tres etapas: respuestas a la encuesta del propietario, revisión de los registros médicos veterinarios del perro y exámenes físicos/hallazgos de diagnóstico en una cita hospitalaria en el Hospital de Enseñanza Médica Veterinaria de la Universidad de Texas A&M (TAMU VMTH). Se inscribieron participantes cuyas respuestas y hallazgos cumplieron con los criterios de inclusión. Se programaron exámenes de seguimiento intrahospitalarios en los momentos de estudio de tres, seis y 12 meses en TAMU VMTH. Entre las visitas al hospital, se pidió a los propietarios que completaran encuestas sobre la condición de sus perros cada dos semanas en línea. En el examen de detección inicial, los perros fueron evaluados por un internista y un cardiólogo certificados por la junta para detectar anomalías en el historial médico y el examen físico o signos que sugirieran una enfermedad sistémica subyacente. El diagnóstico fue realizado por el Laboratorio de Patología Clínica, el Laboratorio de Inmunología Clínica y el Laboratorio Gastrointestinal de TAMU VMTH e incluyeron una prueba de antígeno del gusano del corazón, hemograma completo, panel bioquímico, concentración total de tiroxina (TT4) (si TT4 era baja, se realizaron pruebas de tiroxina libre refleja [T4 libre] y hormona estimulante de la tiroides [TSH]), enfermedad de Chagas (Trypanosoma cruzi) serología y análisis de orina. La presión arterial (presión arterial sistólica indirecta medida mediante Doppler), el electrocardiograma y el ecocardiograma fueron realizados por profesores de medicina interna y cardiología de pequeños animales y técnicos veterinarios. El suero se almacenó de cada perro en cada visita mediante congelación instantánea en nitrógeno líquido y almacenamiento a -80 ° C. Durante los exámenes de seguimiento, se realizaron la mayoría de los mismos diagnósticos, excepto la enfermedad del gusano del corazón, la enfermedad de Chagas y las pruebas de tiroides. Todos los procedimientos para este estudio fueron revisados y aprobados por el Comité Institucional de Cuidado y Uso de Animales de TAMU (IACUC 2017-0125).
Diecisiete perros se inscribieron en el ensayo clínico de un año de duración. El ensayo aleatorizado, controlado con placebo y con doble enmascaramiento incluyó seis meses de tratamiento (rapamicina o placebo) y seis meses adicionales de seguimiento. Se instruyó a los propietarios para que administraran medicamentos del estudio a sus perros tres veces por semana los lunes, miércoles y viernes por la mañana. A los perros del grupo de rapamicina se les administró una dosis de 0,025 mg/kg por vía oral los días de administración. Después de la aleatorización, nueve perros fueron colocados en el grupo de rapamicina y ocho en el grupo de placebo; El participante descrito en este informe fue colocado en el grupo de tratamiento con rapamicina. El trabajo de laboratorio en todos los demás participantes fue en gran medida poco notable a lo largo del ensayo (45). Otro perro tratado con rapamicina tuvo un índice de lipemia positivo reportado por el laboratorio de patología clínica en los controles de tres y seis meses que no se llevó a cabo.
El participante de este informe tenía un historial médico de problemas dermatológicos que consistían principalmente en infecciones de oído y dermatitis. Los signos clínicos asociados (principalmente, prurito) fueron históricamente bien controlados con oclacitinib (Apoquel, Zoetis US, Parsippany, NJ). Según el propietario, no hubo eventos significativos en el historial médico del participante desde que se obtuvo cuando era cachorro, y la única cirugía previa fue una castración electiva.
Durante el examen físico de detección inicial, la única anomalía apreciada en este participante fue el sobreacondicionamiento (puntuación de condición corporal = 6/9). Se realizaron los diagnósticos de detección descritos anteriormente y no se identificaron anomalías significativas ni evidencia de enfermedad sistémica. A los efectos de este informe, la presentación de los resultados diagnósticos seriados se centrará en la concentración de colesterol, la concentración de triglicéridos y la lipemia macroscópica, ya que todos los demás parámetros de seguimiento diagnóstico se mantuvieron normales durante toda la duración del estudio. Los resultados basales incluyeron una concentración normal de colesterol (247 mg/dl, intervalo de referencia 120-247 mg/dl) y ausencia de lipemia macroscópica (índice de lipemia puntuado cualitativamente = 0) en las muestras de sangre. La concentración de triglicéridos no se incluyó en el panel bioquímico de rutina del hospital ni del estudio. La concentración total de tiroxina fue de 2,37 mcg/dl (intervalo de referencia, 1,7–3,6).
En la evaluación a los tres meses, el paciente no mostró anormalidades clínicas, y los parámetros de seguimiento diagnóstico permanecieron sin importancia con colesterol normal (243 mg/dL) y lipemia manifiesta con un índice de lipemia de 3+ en una muestra de sangre que se creía que había sido ayunada. El hallazgo de lipemia se discutió con el propietario y se recomendó obtener una segunda muestra para medir directamente los triglicéridos. Sin embargo, luego se descubrió que el perro probablemente había comido una golosina grasosa en la mañana de la cita, lo que parecía una explicación plausible para la lipemia detectada visualmente. No se realizaron pruebas adicionales en este momento.
En este estudio, el período de tratamiento fue de seis meses, con seis meses adicionales de seguimiento. Este participante recibió su dosis final de la medicación del estudio ocho días antes de su examen de seis meses. En el momento del examen, el participante no presentaba anomalías clínicas, y los parámetros de seguimiento diagnóstico permanecieron generalmente sin importancia, incluido el colesterol normal (232 mg/dL). Sin embargo, se volvió a observar lipemia macroscópica (índice de lipemia 4+) y se confirmó que el participante había estado en ayunas antes de la cita. Esta lipemia macroscópica en ayunas provocó la medición de la concentración de triglicéridos. La concentración de triglicéridos estaba severamente elevada a 2167 mg/dL (intervalo de referencia, 11-140 mg/dL). Este valor se confirmó mediante análisis repetidos y dilución en serie como parte del procedimiento operativo estándar del laboratorio. Debido a la hipertrigliceridemia, la asignación del tratamiento se desenmascaró a un internista certificado por la junta no asociado con el estudio para que se pudiera monitorear la condición clínica del perro; Se reveló que la asignación del tratamiento había sido rapamicina. Se recomendó que la bioquímica de seguimiento se realizara en una semana y fue enviada a un laboratorio veterinario de referencia por el veterinario de atención primaria local del propietario. En ese momento (es decir, 15 días después de la dosis final de rapamicina) la concentración de triglicéridos era normal (87 mg/dl, intervalo de referencia, 29–291 mg/dl). El TT4 (que se había presentado para descartar el desarrollo de hipotiroidismo como causa de la elevación de los triglicéridos) también fue normal (1,1 mcg/dL, intervalo de referencia, 0,8-3,5 mcg/dL), y todos los demás resultados del hemograma completo, el perfil bioquímico y el análisis de orina también fueron normales. La Figura 1 muestra la línea de tiempo del estudio, el período de tratamiento y los intervalos de muestreo.
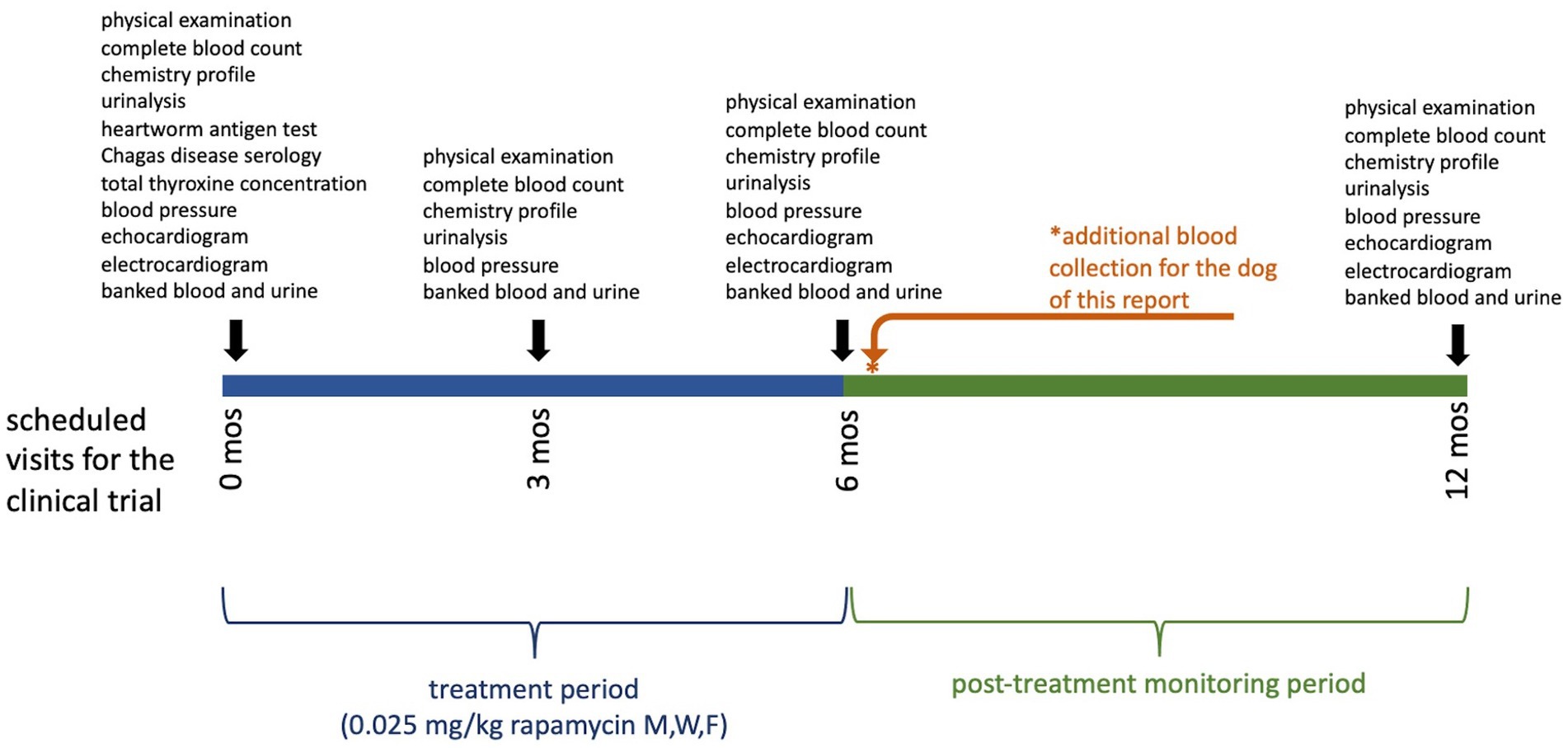 Figura 1. Cronograma del ensayo clínico que muestra el período de tratamiento y los intervalos de muestreo para los perros en este estudio. Los exámenes realizados y las muestras recogidas en cada punto de tiempo se muestran encima de la barra. El perro de este informe tuvo un punto de tiempo de muestreo adicional después del reconocimiento de la hipertrigliceridemia severa, indicada por el asterisco (*).
Figura 1. Cronograma del ensayo clínico que muestra el período de tratamiento y los intervalos de muestreo para los perros en este estudio. Los exámenes realizados y las muestras recogidas en cada punto de tiempo se muestran encima de la barra. El perro de este informe tuvo un punto de tiempo de muestreo adicional después del reconocimiento de la hipertrigliceridemia severa, indicada por el asterisco (*).
Se utilizaron muestras de suero almacenadas de las evaluaciones iniciales y de tres meses de este participante para medir retrospectivamente las concentraciones de triglicéridos y revelaron resultados de 82 mg/dL y 422 mg/dL, respectivamente. La concentración de triglicéridos se evaluó una vez más en el momento del examen final relacionado con el estudio del participante a TAMU VMTH a los 12 meses (6 meses después de la finalización de la administración de la medicación del estudio) y fue de 149 mg/dl (intervalo de referencia 11-140 mg/dl) (Tabla 1; Figura 2).
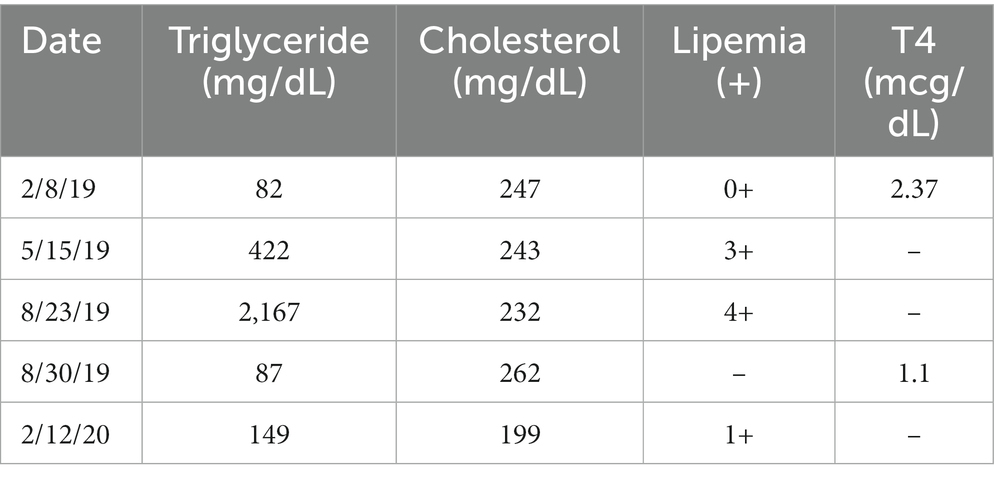 Tabla 1. Se informaron los valores de la concentración de triglicéridos, la concentración de colesterol, el índice de lipemia y la concentración total de tiroxina (TT4) de este participante en el examen inicial (2/8/19) y posteriormente.
Tabla 1. Se informaron los valores de la concentración de triglicéridos, la concentración de colesterol, el índice de lipemia y la concentración total de tiroxina (TT4) de este participante en el examen inicial (2/8/19) y posteriormente.
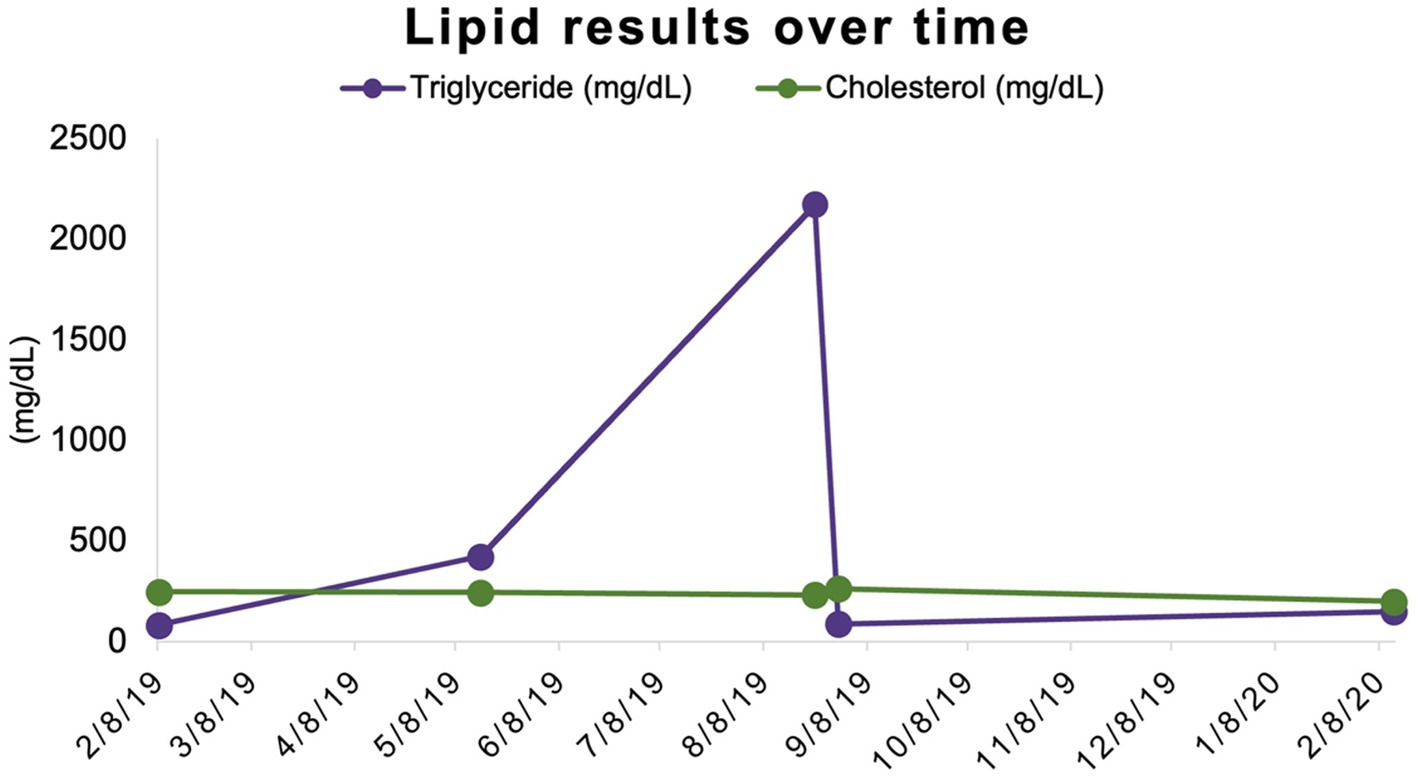 Figura 2. Concentraciones de triglicéridos y colesterol a lo largo del tiempo. Las concentraciones de triglicéridos y colesterol comparten una escala (mg/dL) en el eje Y.
Figura 2. Concentraciones de triglicéridos y colesterol a lo largo del tiempo. Las concentraciones de triglicéridos y colesterol comparten una escala (mg/dL) en el eje Y.
Discusión
Este informe de caso representa la primera descripción de un perro sano, de mediana edad, de propiedad privada, que desarrolla una hipertrigliceridemia grave mientras recibe dosis bajas de rapamicina. Aunque es difícil establecer una causalidad directa, el riguroso proceso de selección para descartar la presencia de enfermedad sistémica, la naturaleza grave y asintomática de la hipertrigliceridemia y la resolución completa de la hipertrigliceridemia dentro de los 15 días posteriores a la interrupción de la administración de rapamicina es altamente sugestivo de que la rapamicina fue la causa de la hipertrigliceridemia. La hipertrigliceridemia puede ser secundaria a múltiples causas en el perro y se consideraron una variedad de explicaciones alternativas para la hipertrigliceridemia de este perro. Las causas más comunes de hipertrigliceridemia en perros son el hipotiroidismo o la ingesta reciente de alimentos, aunque incluso en estas circunstancias, es muy inusual que el aumento sea tan extremo como el valor observado en este caso (46). En este perro, se confirmó un estado eutiroideo tanto al comienzo del estudio como poco después del examen de seis meses en el que se había documentado la hipertrigliceridemia, por lo que el hipotiroidismo no puede explicar su hipertrigliceridemia. En el momento del hallazgo de hipertrigliceridemia en el examen de seis meses y la revisión bioquímica siete días después, el propietario confirmó que no se le había proporcionado ninguna comida reciente. Es posible que el dueño se equivocara al respecto y que el perro hubiera sido alimentado inadvertidamente por otro miembro de la familia antes de la extracción de sangre; Aun así, la magnitud de la hipertrigliceridemia sería inusualmente severa para un aumento postprandial. Además, el perro fue alimentado con un alimento comercial, seco y de fórmula para adultos, sin cambios en la dieta a lo largo del ensayo, por lo que una diferencia en los componentes dietéticos principales no explica el cambio. La hipertrigliceridemia primaria también ocurre en perros, especialmente en Schnauzers miniatura, pero dada la resolución completa de la lipemia sin una intervención dirigida que no sea la interrupción de la rapamicina, la hipertrigliceridemia primaria no estuvo presente en este caso. Otras endocrinopatías, pancreatitis, nefropatía perdedora de proteínas y colestasis son causas adicionales de hipertrigliceridemia en perros que no estaban presentes en este caso (47). Este perro tenía un examen físico normal y un hemograma, un perfil químico y un análisis de orina (aparte de la hipertrigliceridemia) normales en cada examen. La diabetes mellitus se descarta por un nivel normal de glucosa en sangre y falta de glucosuria. Si bien no se realizó una prueba de dexametasona a dosis bajas, la ausencia de poliuria, polidipsia, alopecia endocrina, aumento de la actividad de la fosfatasa alcalina, leucograma de esfuerzo, trombocitosis o concentración de orina diluida hace que el hiperadrenocorticismo sea inverosímil. El perro no presentó signos clínicos de pancreatitis como vómitos, diarrea, inapetencia o dolor abdominal en ningún momento. Proteína en orina: no se realizó creatinina, sin embargo, en el contexto de orina bien concentrada (1,039-1,056) en cada visita, el perro solo tuvo trazas de proteinuria con tira reactiva en cualquier momento y tuvo una albúmina sérica consistentemente normal, por lo que la nefropatía perdedora de proteínas no explica la hipertrigliceridemia. Finalmente, el perro no tuvo un aumento en el colesterol sérico, la bilirrubina total o las enzimas hepáticas (alanina aminotransferasa, fosfatasa alcalina, gamma glutamiltransferasa) en ningún momento para apoyar un diagnóstico de colestasis. Dados estos hallazgos y la rápida resolución completa de la hipertrigliceridemia sin otra intervención que la interrupción de la rapamicina, no se encontró una explicación alternativa para la hipertrigliceridemia severa de este perro.
En pacientes humanos tratados con rapamicina y su derivado inhibidor de mTOR, everolimus, la hipertrigliceridemia moderada y la hipercolesterolemia leve a moderada son relativamente comunes, mientras que la hipertrigliceridemia grave es rara (42, 48-51). En este momento, no existe un consenso claro sobre si el desarrollo de dislipidemia asociada con la administración de rapamicina en las personas está más influenciado por la dosis, la concentración sérica o la duración de la terapia (42, 52). Los mecanismos precisos de estas dislipidemias son inciertos, pero es probable que sean el resultado de alteraciones en la señalización de la insulina causadas por la inhibición de mTOR que posteriormente inhiben la actividad de las lipasas en las lipoproteínas circulantes, y/o alteraciones en la degradación de la apolipoproteína B100 (51, 53, 54). Es posible que, mientras que la hiperlipidemia leve a moderada depende de la dosis, la hiperlipidemia grave es independiente de la dosis y está relacionada con otros factores del paciente. Existe cierta evidencia de que los valores de lípidos previos al tratamiento pueden predecir la presencia, pero no necesariamente la gravedad, de la hiperlipidemia asociada con la terapia con inhibidores de mTOR, lo que sugiere que los factores individuales (genéticos, comórbidos o de otro tipo) pueden contribuir al riesgo de aumentos graves (55). En relación con la posibilidad de un riesgo genético, el sujeto de este informe de caso fue un labrador retriever. Hubo otros cuatro labradores retriever inscritos en el ensayo clínico (dos en el grupo de rapamicina), ninguno de los cuales desarrolló hiperlipidemia; No se realizó un análisis genético detallado. Los resultados de nuestro estudio respaldan la naturaleza independiente de la dosis de la hiperlipidemia grave, ya que nuestro participante recibía una dosis muy baja de rapamicina solo tres días a la semana. Si bien se han utilizado dosis más bajas en perros (27), se trataba de inyecciones intramusculares diarias, y en este momento nuestro estudio representa el programa de dosificación de rapamicina oral más bajo reportado para perros.
Al considerar el protocolo utilizado en este caso y que no se ha informado previamente que ningún perro desarrolle dislipidemia grave a pesar de recibir dosis iguales o superiores, esto respalda la naturaleza impredecible e independiente de la dosis de este efecto secundario. En los seres humanos, la rapamicina se usa comúnmente en una dosis relativa más alta y se administra diariamente (30, 31). Esto es claramente diferente de nuestro caso, en el que el esquema de dosificación de lunes, miércoles y viernes fue más similar a la «dosificación intermitente», ya que los datos farmacocinéticos obtenidos de otros participantes del estudio no revelaron rapamicina detectable en la sangre 48 h después de la administración (datos no publicados). Además, los datos no publicados relacionados con este estudio muestran que las concentraciones máximas de rapamicina sérica fueron de aproximadamente 1 a 2 ng/mL, que es significativamente más baja que la concentración terapéutica dirigida en humanos (12).
En los seres humanos que desarrollan hipertrigliceridemia grave secundaria a la rapamicina, se puede observar tan pronto como de uno a tres meses después de comenzar a tomar el medicamento, pero puede tardar hasta dos años en desarrollarse (42, 44). En nuestro caso, la lipemia macroscópica observada en el recontrol a los seis meses del participante motivó la medición de triglicéridos. Sin embargo, cuando se analizaron retrospectivamente muestras almacenadas previamente, los triglicéridos del paciente ya estaban moderadamente elevados a los tres meses. No se puede determinar la relación con la posibilidad de que la muestra de tres meses no haya estado en ayunas. Dado que el protocolo de monitoreo y almacenamiento no incluyó la toma de muestras de sangre entre el inicio y los tres meses, no pudimos determinar cuándo comenzó el aumento de triglicéridos. Aun así, a los siete días de tener triglicéridos séricos superiores a <2000 mg/dL, y quince días de la interrupción de la administración de rapamicina, la lipemia y la hipertrigliceridemia del participante se habían resuelto por completo. Se ha observado una reducción dramática similar después de la interrupción de la rapamicina en humanos, con mejoras significativas observadas dentro de cinco a diez días, y una resolución completa observada tan pronto como un mes (42, 44). En los seres humanos, estas reducciones de triglicéridos a menudo se deben a una combinación de interrupción de la rapamicina y una intervención lipémica dirigida.
En perros, el hallazgo clínico más frecuente asociado a la hipertrigliceridemia, como causa o consecuencia, es la pancreatitis (47, 56). A diferencia de los humanos, que presentan concentraciones de triglicéridos similares, este perro fue considerado asintomático por su dislipidemia. Es posible que algunos de los signos presentes en los seres humanos (migrañas o opresión en el pecho, por ejemplo), que generalmente se reconocen debido a la autonotificación, hayan pasado desapercibidos en nuestro caso (43, 44).
En este momento, se desconoce si la exposición repetida a la rapamicina provocaría nuevamente un aumento significativo en la concentración de triglicéridos en este perro, como se ha visto en humanos (38). Dado que el participante del estudio es un perro de propiedad privada que no requiere terapia con rapamicina por ningún motivo, y la hipertrigliceridemia no está exenta de riesgos, no sería ético exponer al perro a este riesgo para responder a esta pregunta. Dado que este efecto secundario se ha observado en múltiples especies, se justifican estudios futuros para comprender mejor la frecuencia con la que se observa la hiperlipidemia durante la administración de rapamicina en perros y otras especies, e identificar qué factores pueden predisponer a ciertos individuos a este efecto secundario.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
Los estudios en animales fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC, por sus siglas en inglés) de la Facultad de Medicina Veterinaria y Ciencias Biomédicas de la Universidad de Texas A&M y el Comité de Revisión de Investigación Clínica número de protocolo 2017-0125. Debido a que el estudio involucró animales propiedad del cliente, se consultó al TAMU IRB y se determinó que el estudio no era una investigación con seres humanos. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio. Los estudios se llevaron a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
JE: Investigación, Redacción – borrador original, Redacción – revisión y edición. LC: Investigación, Redacción – borrador original, Redacción – revisión y edición. MK: Conceptualización, Obtención de fondos, Redacción – revisión y edición. DP: Conceptualización, Obtención de Fondos, Redacción – Revisión y Edición. KC: Conceptualización, Obtención de Fondos, Investigación, Supervisión, Redacción – Revisión y Edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este estudio fue financiado por la Fundación William H. Donner. El Proyecto de Envejecimiento de Perros (NIA U19 AG057377) proporcionó apoyo adicional a los autores.
Conflicto de intereses
MK era empleado de Optispan, Inc.
El resto de los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un potencial conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Andrassy, J, Graeb, C, Rentsch, M, Jauch, KW y Guba, M. Inhibición de Mtor y su efecto sobre el cáncer en el trasplante. Trasplante. (2005) 80:S171-4. doi: 10.1097/01.tp.0000186912.23630.85
2. Kapahi, P, Chen, D, Rogers, AN, Katewa, SD, Li, PW, Thomas, EL, et al. Con Tor, menos es más: un papel clave para la vía Tor de detección de nutrientes conservada en el envejecimiento. Célula Metab. (2010) 11:453–65. doi: 10.1016/j.cmet.2010.05.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Mabuchi, S, Sasano, T y Kawano, M. Dirigirse a los complejos mTOR en el cáncer de ovario. J Cáncer Sci Ther. (2014) 6:211–16. doi: 10.4172/1948-5956.1000274
4. Di Paolo, S, Teutonico, A, Leogrande, D, Capobianco, C, y Schena, PF. La inhibición crónica de la diana de los mamíferos de la señalización de la rapamicina regula a la baja los sustratos 1 y 2 de los receptores de insulina y la activación de Akt: ¿una encrucijada entre el cáncer y la diabetes? J Am Soc Nephrol. (2006) 17:2236–44. doi: 10.1681/ASN.2006030196
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Granville, CA, Warfel, N, Tsurutani, J, Hollander, MC, Robertson, M, Fox, SD, et al. Identificación de un esquema de rapamicina altamente eficaz que reduce marcadamente el tamaño, la multiplicidad y la progresión fenotípica de los tumores de pulmón murinos inducidos por carcinógenos del tabaco. Clin Cáncer Res. (2007) 13:2281–9. doi: 10.1158/1078-0432.CCR-06-2570
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Guertin, DA, y Sabatini, DM. Definición del papel de Mtor en el cáncer. Célula cancerosa. (2007) 12:9–22. doi: 10.1016/j.ccr.2007.05.008
7. Namba, R, Young, LJ, Abbey, CK, Kim, L, Damonte, P, Borowsky, AD, et al. La rapamicina inhibe el crecimiento de lesiones mamarias premalignas y malignas en un modelo murino de carcinoma ductal in situ. Clin Cáncer Res. (2006) 12:2613–21. doi: 10.1158/1078-0432.CCR-05-2170
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Robinson, J, Lai, C, Martin, A, Nye, E, Tomlinson, I, y Silver, A. La rapamicina oral reduce la carga tumoral y la vascularización en ratones Lkb1(+/−). J Pathol. (2009) 219:35–40. doi: 10.1002/path.2562
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Chen, C, Liu, Y, Liu, Y y Zheng, P. El objetivo de los mamíferos de la activación de la rapamicina subyace a los defectos de Hsc en la enfermedad autoinmune y la inflamación en ratones. J Clin Invest. (2010) 120:4091–101. doi: 10.1172/JCI43873
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Fine, NM, y Kushwaha, SS. Avances recientes en el uso de inhibidores de la rapamicina en mamíferos en trasplantes de corazón y pulmón. Trasplante. (2016) 100:2558–68. doi: 10.1097/TP.0000000000001432
11. Geissler, EK, Schnitzbauer, AA, Zulke, C, Lamby, PE, Proneth, A, Duvoux, C, et al. Uso de sirolimus en receptores de trasplante hepático con carcinoma hepatocelular: un ensayo de fase 3 aleatorizado, multicéntrico y abierto. Trasplante. (2016) 100:116–25. doi: 10.1097/tp.0000000000000965
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Morath, C, Arns, W, Schwenger, V, Mehrabi, A, Fonouni, H, Schmidt, J, et al. Sirolimus en trasplante renal. Nephrol Dial Trans. (2007) 22:VIII61-5. DOI: 10.1093/NDT/GFM652
13. Sánchez Antolin, G, García Pajares, F, Lorenzo Pelayo, S, Herranz Bachiller, MT, Almohalla, C, Velicia, R, et al. Indicaciones y eficacia de la diana de rapamicina en mamíferos en el trasplante hepático. Trasplante Proc. (2011) 43:714–7. doi: 10.1016/j.transproceed.2011.01.105
14. Saunders, RN, Metcalfe, MS y Nicholson, ML. Rapamicina en el trasplante: una revisión de la evidencia. Riñón Int. (2001) 59:3–16. doi: 10.1046/j.1523-1755.2001.00460.x
15. Anisimov, VN, Zabezhinski, MA, Popovich, IG, Piskunova, TS, Semenchenko, AV, Tyndyk, ML, et al. La rapamicina prolonga la vida útil máxima en ratones propensos al cáncer. Am J Pathol. (2010) 176:2092–7. doi: 10.2353/ajpath.2010.091050
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Bitto, A, Ito, TK, Pineda, VV, LeTexier, NJ, Huang, HZ, Sutlief, E, et al. El tratamiento transitorio con rapamicina puede aumentar la esperanza de vida y la salud en ratones de mediana edad. elife. (2016) 5:5. doi: 10.7554/eLife.16351
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Bjedov, I, Toivonen, JM, Kerr, F, Slack, C, Jacobson, J, Foley, A, et al. Mecanismos de extensión de la vida útil por rapamicina en la mosca de la fruta Drosophila Melanogaster. Célula Metab. (2010) 11:35–46. doi: 10.1016/j.cmet.2009.11.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Fok, WC, Chen, Y, Bokov, A, Zhang, Y, Salmon, AB, Díaz, V, et al. Los ratones alimentados con rapamicina tienen un aumento en la esperanza de vida asociado con cambios importantes en el transcriptoma hepático. PLoS Uno. (2014) 9:e83988. doi: 10.1371/journal.pone.0083988
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Halloran, J, Hussong, SA, Burbank, R, Podlutskaya, N, Fischer, KE, Sloane, LB, et al. La inhibición crónica de la diana de rapamicina en mamíferos por rapamicina modula los componentes cognitivos y no cognitivos del comportamiento a lo largo de la vida en ratones. Neurociencia. (2012) 223:102–13. doi: 10.1016/j.neuroscience.2012.06.054
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Harrison, DE, Strong, R, Sharp, ZD, Nelson, JF, Astle, CM, Flurkey, K, et al. La rapamicina alimentada tarde en la vida prolonga la vida útil en ratones genéticamente heterogéneos. Naturaleza. (2009) 460:392–5. doi: 10.1038/nature08221
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Lind, MI, Chen, HY, Cortázar-Chinarro, M, y Maklakov, AA. La rapamicina prolonga aditivamente la vida útil en líneas cortas y longevas del nematodo Caenorhabditis remanei. Exp Gerontol. (2017) 90:79–82. doi: 10.1016/j.exger.2017.01.017
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Miller, RA, Harrison, DE, Astle, CM, Fernández, E, Flurkey, K, Han, M, et al. El aumento de la esperanza de vida mediado por rapamicina en ratones depende de la dosis y del sexo y es metabólicamente distinto de la restricción dietética. Célula envejecida. (2014) 13:468–77. doi: 10.1111/acel.12194
23. Miller, RA, Harrison, DE, Astle, CM, Baur, JA, Boyd, AR, de Cabo, R, et al. La rapamicina, pero no el resveratrol ni la simvastatina, prolonga la vida de ratones genéticamente heterogéneos. J Gerontol A Biol Sci Med Sci. (2011) 66:191–201. doi: 10.1093/gerona/glq178
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Ramos, FJ, Chen, SC, Garelick, MG, Dai, DF, Liao, CY, Schreiber, KH, et al. La rapamicina revierte la señalización elevada de Mtorc1 en ratones con deficiencia de lamina a/C, rescata la función cardíaca y del músculo esquelético y prolonga la supervivencia. Sci Transl Med. (2012) 4:144ra103. doi: 10.1126/scitranslmed.3003802
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Wilkinson, JE, Burmeister, L, Brooks, SV, Chan, CC, Friedline, S, Harrison, DE, et al. La rapamicina retrasa el envejecimiento en ratones. Célula envejecida. (2012) 11:675–82. doi: 10.1111/j.1474-9726.2012.00832.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Zhang, C, Liu, A, Su, G y Chen, Y. Efecto de la rapamicina en el nivel de autofagia en ratas con insuficiencia cardíaca temprana. J Cell Biochem. (2019) 120:4065–70. doi: 10.1002/jcb.27691
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Paoloni, MC, Mazcko, C, Fox, E, Fan, T, Lana, S, Kisseberth, W, et al. Relaciones farmacocinéticas y farmacodinámicas de la rapamicina en el osteosarcoma: un estudio oncológico comparativo en perros. PLoS Uno. (2010) 5:E11013. doi: 10.1371/journal.pone.0011013
28. Urfer, SR, Kaeberlein, TL, Mailheau, S, Bergman, PJ, Creevy, KE, Promislow, DEL, et al. Un ensayo controlado aleatorizado para establecer los efectos del tratamiento con rapamicina a corto plazo en 24 perros de compañía de mediana edad. Gerociencia. (2017) 39:117–27. doi: 10.1007/s11357-017-9972-z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Yi, H, Brooks, ED, Thurberg, BL, Fyfe, JC, Kishnani, PS y Sun, B. Corrección de la enfermedad de almacenamiento de glucógeno tipo iii con rapamicina en un modelo canino. J Mol Med (Berl). (2014) 92:641–50. doi: 10.1007/s00109-014-1127-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Kahan, BD . Eficacia de sirolimus comparada con azatioprina para la reducción del rechazo agudo del aloinjerto renal: un estudio multicéntrico aleatorizado. Lanceta. (2000) 356:194–202. doi: 10.1016/s0140-6736(00)02480-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. MacDonald AS, Grupo RGS . Estudio mundial, fase iii, aleatorizado, controlado, de seguridad y eficacia de un régimen de sirolimus/ciclosporina para la prevención del rechazo agudo en receptores de aloinjertos renales primarios incompatibles. Trasplante. (2001) 71:271–80. doi: 10.1097/00007890-200101270-00019
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Sankhala, K, Mita, A, Kelly, K, Mahalingam, D, Giles, F, y Mita, M. El perfil de seguridad emergente de los inhibidores de mTOR, una nueva clase de agentes anticancerígenos. Objetivo Oncol. (2009) 4:135–42. doi: 10.1007/s11523-009-0107-z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Fraenkel, M, Ketzinel-Gilad, M, Ariav, Y, Pappo, O, Karaca, M, Castel, J, et al. La inhibición de Mtor por rapamicina previene la adaptación de las células beta a la hiperglucemia y exacerba el estado metabólico en la diabetes tipo 2. Diabetes. (2008) 57:945–57. doi: 10.2337/db07-0922
34. Johnston, O, Rose, CL, Webster, AC y Gill, JS. El sirolimus se asocia con la diabetes de nueva aparición en receptores de trasplantes de riñón. J Am Soc Nephrol. (2008) 19:1411–8. doi: 10.1681/ASN.2007111202
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Hong, J y Kahan, B. Trombocitopenia y leucopenia inducidas por sirolimus en receptores de trasplante renal: factores de riesgo, incidencia, progresión y tratamiento. Trasplante. (2000) 69:2085–90. doi: 10.1097/00007890-200005270-00019
36. Houde, VP, Brule, S, Festuccia, WT, Blanchard, PG, Bellmann, K, Deshaies, Y, et al. El tratamiento crónico con rapamicina causa intolerancia a la glucosa e hiperlipidemia al aumentar la gluconeogénesis hepática y alterar la deposición de lípidos en el tejido adiposo. Diabetes. (2010) 59:1338–48. doi: 10.2337/db09-1324
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Morelon, E, y Kreis, H. Terapia con sirolimus sin inhibidores de la calcineurina: experiencia de 8 años en el hospital Necker. Trasplante Proc. (2003) 35:S52-7. doi: 10.1016/s0041-1345(03)00244-6
38. Morrisett, JD, Abdel-Fattah, G, y Kahan, BD. El sirolimus cambia las concentraciones de lípidos y el metabolismo de las lipoproteínas en receptores de trasplantes renales. Trasplante Proc. (2003) 35:S143-50. doi: 10.1016/s0041-1345(03)00233-1
39. Kraemer, FB, Takeda, D, Natu, V y Sztalryd, C. La insulina regula la actividad de la lipoproteína lipasa en las células adiposas de rata a través de vías sensibles a la wortmannina y la rapamicina. Metabolismo. (1998) 47:555–9. doi: 10.1016/s0026-0495(98)90239-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Blanchard, PG, Festuccia, WT, Houde, VP, St-Pierre, P, Brule, S, Turcotte, V, et al. Importante implicación de mTOR en la estimulación inducida por PPARgamma de la captación de lípidos en el tejido adiposo y la acumulación de grasa. J Lipid Res. (2012) 53:1117–25. DOI: 10.1194/JLR. M021485
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Kwon, S, Jeon, JS, Kim, SB, Hong, YK, Ahn, C, Sung, JS, et al. La rapamicina regula al alza los triglicéridos en los hepatocitos mediante la regulación a la baja de Prox1. Lípidos Salud Dis. (2016) 15:41. doi: 10.1186/s12944-016-0211-x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. Firpi, RJ, Tran, TT, Flores, P, Nissen, N, Colquhoun, S, Shackleton, C, et al. La hiperlipidemia inducida por sirolimus en receptores de trasplante hepático no depende de la dosis. Aliment Pharmacol Ther. (2004) 19:1033–9. doi: 10.1111/j.1365-2036.2004.01923.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Fernandez-Bussy, S, Akindipe, O, Baz, M, Gosain, P, Rosenberg, A, y Zumberg, M. Hipertrigliceridemia grave inducida por sirolimus en un receptor de trasplante pulmonar. Trasplante. (2010) 89:481–2. doi: 10.1097/TP.0b013e3181caa5e4
44. Kido, K, Evans, RA, Gopinath, A, y Flynn, JD. Hipertrigliceridemia severa inducida por sirolimus tratada con manejo médico sin plasmaféresis: reporte de un caso. J Pharm Pract. (2018) 31:104–6. doi: 10.1177/0897190017692920
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Barnett, BG, Wesselowski, SR, Gordon, SG, Saunders, AB, Promislow, DEL, Schwartz, SM, et al. Un ensayo clínico aleatorizado, controlado con placebo y enmascarado que evalúa la seguridad y el efecto sobre la función cardíaca de la rapamicina en dosis bajas en 17 perros sanos propiedad de clientes. Front Vet Sci. (2023) 10:1168711. doi: 10.3389/fvets.2023.1168711
Resumen de PubMed | Texto completo de CrossRef | Google Académico
46. Dixon, RM, Reid, SW y Mooney, CT. Características epidemiológicas, clínicas, hematológicas y bioquímicas del hipotiroidismo canino. Rec. Veterinario (1999) 145:481–7. doi: 10.1136/vr.145.17.481
Resumen de PubMed | Texto completo de CrossRef | Google Académico
47. Xenoulis, PG, y Steiner, JM. Metabolismo lipídico e hiperlipidemia en perros. Veterinario J. (2010) 183:12–21. doi: 10.1016/j.tvjl.2008.10.011
48. Lai, KC, Hermanos, JA, y Stoller, JZ. Hipertrigliceridemia grave asociada con la colocación de un stent liberador de fármacos everolimus en un lactante. Cardiol Young. (2019) 29:541–3. doi: 10.1017/s1047951119000167
Resumen de PubMed | Texto completo de CrossRef | Google Académico
49. Morviducci, L, Rota, F, Rizza, L, Di Giacinto, P, Ramponi, S, Nardone, MR, et al. Everolimus es una nueva molécula anticancerígena: efectos secundarios metabólicos como trastornos lipídicos e hiperglucemia. Diabetes Res Clin Pract. (2018) 143:428–31. doi: 10.1016/j.diabres.2018.04.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
50. Clark, H, Schulte, R, y Haggstrom, AN. Hipertrigliceridemia severa después del uso de sirolimus en un bebé. Pediatr Dermatol. (2021) 38:1581–2. doi: 10.1111/pde.14853
Resumen de PubMed | Texto completo de CrossRef | Google Académico
51. Pallet, N, y Legendre, C. Eventos adversos asociados con los inhibidores de Mtor. Experto Opin Drug Saf. (2013) 12:177–86. doi: 10.1517/14740338.2013.752814
52. Spinelli, G, Felipe, C, Machado, P, García, R, Casarini, D, Moreira, S, et al. Relación de las concentraciones séricas de ciclosporina y sirolimus en relación con la incidencia y gravedad de la hiperlipidemia tras el trasplante renal. Braz J Med Biol Re. (2006) 39:19–30. doi: 10.1590/S0100-879X2006000100003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
53. Ponticelli, C . Los pros y los contras de los inhibidores de Mtor en el trasplante renal. Experta Rev Clin Immunol. (2014) 10:295–305. doi: 10.1586/1744666X.2014.872562
Resumen de PubMed | Texto completo de CrossRef | Google Académico
54. Subramaniam, S, Zell, JA y Kunz, PL. Everolimus que causa hipertrigliceridemia severa y pancreatitis aguda. J Natl Compr Cancer Netw. (2013) 11:5–9. doi: 10.6004/jnccn.2013.0003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
55. Wang, W, Wang, Z, Zhao, Y, Wang, X, Li, H y Zhang, Y. Análisis de los parámetros lipídicos séricos que predicen trastornos metabólicos lipídicos en pacientes con LMA-TSC con tratamiento con inhibidores de mTOR. J Clin Pharm Ther. (2022) 47:979–85. doi: 10.1111/jcpt.13631
Resumen de PubMed | Texto completo de CrossRef | Google Académico
56. Xenoulis, P, Suchodolski, J, Ruaux, C y Steiner, J. Asociación entre las concentraciones séricas de triglicéridos y la inmunorreactividad de la lipasa pancreática canina en schnauzers miniatura. J Am Anim Hosp Assoc. (2010) 46:229–34. doi: 10.5326/0460229
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: perro, lipemia, dislipidemia, efecto secundario, efecto adverso
Cita: Evans JB, Chou L, Kaeberlein M, Promislow DEL y Creevy KE (2023) Informe de caso: Hipertrigliceridemia asintomática grave asociada con la administración a largo plazo de dosis bajas de rapamicina en un labrador retriever sano de mediana edad. Frente. Vet. Sci. 10:1285498. doi: 10.3389/fvets.2023.1285498
Recibido: 30 de agosto de 2023; Aceptado: 02 de noviembre de 2023;
Publicado: 29 Noviembre 2023.
Editado por:
Benito Soto-Blanco, Universidad Federal de Minas Gerais, Brasil
Revisado por:
Catarina Jota Baptista, Universidade de Trás os Montes e Alto Douro, Portugal
Cengiz Gokbulut, Universidad de Balıkesir, Türkiye
Derechos de autor © 2023 Evans, Chou, Kaeberlein, Promislow y Creevy. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Kate E. Creevy, kcreevy@tamu.edu
†Estos autores comparten la primera autoría
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía


