Historia natural del desarrollo de microquistes de Echinococcus granulosus en cultivo in vitro
Historia natural del desarrollo de microquistes de Echinococcus granulosus en cultivo in vitro a largo plazo y cambios moleculares y morfológicos inducidos por insulina y BMP-4
 Ali Derakhshani1
Ali Derakhshani1  Seyed Mohammad Mousavi1
Seyed Mohammad Mousavi1  Masoud Rezaei1
Masoud Rezaei1  Ali Afgar1,2
Ali Afgar1,2  Ali Reza Keyhani3
Ali Reza Keyhani3  Mohammad Ali Mohammadi1
Mohammad Ali Mohammadi1  Shahriar Dabiri4
Shahriar Dabiri4  Majid Fasihi Harandi1*
Majid Fasihi Harandi1*- 1Centro de Investigación de la Enfermedad Hidatídica en Irán, Universidad de Ciencias Médicas de Kerman, Kerman, Irán
- 2Comité de Investigación Estudiantil, Universidad de Ciencias Médicas de Kerman, Kerman, Irán
- 3Centro de Investigación de la Leishmaniasis, Universidad de Ciencias Médicas de Kerman, Kerman, Irán
- 4Departamento de Patología, Facultad de Medicina de Afzalipour, Centro de Investigación de Patología y Células Madre, Universidad de Ciencias Médicas de Kerman, Kerman, Irán
Introducción: La equinococosis quística (EC) causada por el cestodo Echinococcus granulosus es una enfermedad de importancia económica y de salud pública mundial. Los determinantes y los mecanismos celulares subyacentes del desarrollo y destino de la CE en los huéspedes intermediarios son en gran medida desconocidos. Las hormonas y citoquinas como la insulina y la BMP-4 son los actores clave en el desarrollo, la diferenciación y la apoptosis. En este estudio, evaluamos la historia natural a largo plazo de los microquistes de E. granulosus en un entorno in vitro y los cambios moleculares y morfológicos inducidos por los factores de crecimiento, la insulina y BMP4 durante el desarrollo de la etapa de metacestodos de E. granulosus.
Métodos: Se cultivaron protoscoleces de E. granulosus y se siguió el desarrollo del parásito en el cultivo monofásico a largo plazo durante 105 días y se evaluaron los cambios morfométricos, moleculares e inmunohistoquímicos, incluyendo el número y tamaño de los microquistes, las tasas de desarrollo y deformación de los microquistes, así como los marcadores de calcificación (tinción con rojo de alizarina) y apoptosis (BAX, BCL2, Caspasa-3, Expresión de caspasa-8 y TNF-α) en los microquistes. También se evaluaron las consecuencias biológicas, histológicas y moleculares del tratamiento con insulina y BMP-4 en el desarrollo del parásito.
Resultados: El tratamiento con insulina y BMP-4 de los microquistes dio lugar a un aumento significativo de la formación de microquistes, un aumento del tamaño, una reducción de la apoptosis y la deformación de los microquistes. La tinción con rojo de alizarina de los microquistes tratados con insulina y BMP-4 confirmó que la deposición de calcio es significativamente menor que la de los microquistes no tratados. Además, la tinción con rojo de alizarina y la inmunohistoquímica de los microquistes indican que la acumulación de calcio en los microquistes deformados es mayor que la normal en el día 105. Los microquistes comenzaron a arrugarse y la capa germinal se desprendió parcialmente de la capa laminada en el día 84.
Conclusión: Los resultados del presente estudio sugieren que los cambios degenerativos en los quistes hidatídicos pueden ser ralentizados por la insulina y el BMP-4, lo que indica que los factores celulares y las hormonas del huésped podrían contribuir a la longevidad de los quistes hidatídicos. Se aportan evidencias significativas que sugieren que los microquistes cultivados in vitro pueden sufrir procesos de calcificación y apoptótica similares a los observados en la infección hidatídica natural en los hospederos intermediarios.
1. Introducción
La equinococosis quística (EC) es una enfermedad zoonótica causada por las larvas de la tenia canina Echinococcus granulosus, que es una enfermedad de gran importancia económica y de salud pública. El ciclo de vida de E. granulosus es complejo e involucra a dos huéspedes mamíferos, un huésped carnívoro definitivo y un huésped herbívoro intermediario. El ser humano es un huésped accidental sin salida que alberga la etapa de metacestodo del parásito conocido como quiste hidatídico en el hígado y los pulmones. Este parásito tiene una distribución mundial y se estima que infecta a 2-3 millones de personas en todo el mundo (1, 2).
La infección de los huéspedes humanos e intermediarios se produjo a través de la ingestión de huevos infecciosos, que se liberan en las heces de los huéspedes definitivos. Las oncosferas liberadas en el tracto gastrointestinal, penetran en la pared intestinal y migran a través del sistema portal a varios órganos y tejidos internos, principalmente hígado y pulmones, donde se convierten en quiste hidatídico. El quiste hidatídico es un quiste unilocular lleno de líquido compuesto por una capa germinal nucleada interna (GL) responsable de la producción de la etapa infecciosa, una estructura llamada protoscolex (PSC), una capa laminada acelular externa (LL) que es exclusiva del género Echinococcus y una capa adventicial externa producida por el huésped como resultado de la respuesta inmune al parásito. Al alimentarse de órganos infectados, la madurez sexual de E. granulosus adulto se produce en el intestino delgado del huésped carnívoro definitivo en un plazo de 4 a 5 semanas. Los huevos y/o las proglótides grávidas se diseminan en el medio ambiente a través de la defecación de los perros (3).
De acuerdo con el conocimiento actual, el desarrollo de quistes en humanos se puede dividir en cuatro etapas: (1) la fase de maduración (desarrollo de quistes y protoscoleces) (2) fase estable (crecimiento de quistes y aumento exponencial del volumen del quiste); (3) fase inestable (desprendimiento de la capa germinal y daño a los tejidos del parásito); (4) fase degenerativa (calcificación y muerte del quiste). Comprender los determinantes moleculares y biológicos del desarrollo del quiste hidatídico es crucial en el diagnóstico y tratamiento de la EC. Desafortunadamente, nuestro conocimiento sobre los eventos durante el proceso de desarrollo de los quistes hidatídicos es pobre (4).
La naturaleza bidireccional del cultivo in vitro de E. granulosus, en el que el parásito se desarrolla en el gusano estrobilado en medios de cultivo bifásicos o en microquistes en medios monofásicos, es una característica fascinante y una herramienta valiosa para comprender la biología de Echinococcus. La comprensión de las bases moleculares y los determinantes del desarrollo del parásito mejora nuestro conocimiento sobre la historia natural de la EC humana (5-7).
Se sabe muy poco sobre la historia natural del desarrollo del quiste en el cultivo in vitro a largo plazo, así como sobre los mecanismos moleculares que implican el desarrollo y la supervivencia del parásito. De especial interés son los extensos estudios de J.D.Smyth en 1960-70 y su importante contribución en nuestro conocimiento de E. granulosus, que condujo a la identificación de factores bioquímicos y fisiológicos del huésped. Sin embargo, se han realizado estudios limitados para identificar estos factores a nivel molecular. Se cree que varios factores derivados del huésped, incluidos diferentes factores de crecimiento, hormonas, citoquinas, así como las interacciones entre el huésped y la célula del parásito, influyen en la historia natural del quiste (8).
La mayoría de los sistemas de señalización se conservan evolutivamente en la mayoría de las comunicaciones entre células animales. Estos sistemas incluyen hormonas y citocinas como la insulina, el factor de crecimiento epidérmico (EGF), el factor de crecimiento de fibroblastos (FGF), el receptor tirosina quinasa unido a la membrana (RTK) y las citocinas convertidoras del factor de crecimiento (TGF-b) / proteína morfogenética ósea (BMP) (9-11).
La señalización de la insulina se ha estudiado comúnmente en mamíferos. Invertebrados como Caenorhabditis elegans y Drosophila melanogaster se han utilizado como organismos modelo para estudiar la señalización de la insulina debido a su papel crucial en la regulación de los procesos metabólicos, el control del crecimiento, la reproducción y el envejecimiento (12-14). La insulina actúa uniéndose a los receptores situados en la superficie de las células diana. Las tirosina quinasas ya se han identificado en una amplia variedad de helmintos parásitos, incluyendo E. multilocularis (15, 16), Schistosoma mansoni (17, 18) y S. japonicum (19). Hemer et al. estudiaron los efectos in vitro de la insulina humana sobre los metacestodos de E. multilocularis, y sugirieron que la insulina del huésped estimula el crecimiento y desarrollo de los metacestodos (16). Se ha demostrado que las insulinas similares a péptidos o las insulinas del huésped pueden estimular los receptores de insulina en los helmintos a través de las principales vías de señalización de la quinasa regulada por señales extracelulares (Erk)/proteínas quinasas activadas por mitógenos (MAPK), así como las subvías de serina/treonina quinasa Akt (también conocida como proteína quinasa B)/fosfoinositida-3-quinasa (PI3K). Además, debido a la alta concentración de insulina en el hígado, la insulina probablemente puede desempeñar un papel importante en el establecimiento de oncosferas y en el crecimiento y desarrollo de E. granulosus, como se demostró en otras especies de platilihelmintos estrechamente relacionadas, como E. multilocularis y S. japonicum (8, 16, 20).
Las proteínas morfogenéticas óseas (BMPs) son un factor de crecimiento multifuncional que pertenece a la superfamilia del factor de crecimiento transformante b (TGFb). Estudios recientes han examinado exhaustivamente el papel de las BMP en el desarrollo embrionario y la función celular. Smad1, 5 y 8 son las moléculas aguas abajo de los receptores BMP y juegan un papel clave en la transducción de señales BMP (21). Las BMP en metazoos tienen un papel importante en el desarrollo, diferenciación y apoptosis en helmintos y muchos estudios se han centrado en el papel de la subfamilia BMP en el desarrollo de S. mansoni (22) y E. multilocularis (23, 24). Los resultados de un estudio sobre metacestodos de E. multilocularis Smad E, indicaron que se expresa en todos los estadios larvarios del parásito y está implicado en la señalización de TGF-b y BMP (23). Los estudios han demostrado que uno o más receptores de TGF-b/BMP del parásito pueden interactuar funcionalmente con el TGF del huésped. Por lo tanto, se debe prestar más atención a los estudios bioquímicos sobre la interacción entre los receptores TGF-b/BMP de Echinococcus y el TGF-b del huésped (8). Sin embargo, nuestro conocimiento sobre el efecto de BMP en el crecimiento y desarrollo de E. granulosus es limitado y se sabe muy poco sobre el papel de este factor de crecimiento en el parásito.
El objetivo de este estudio fue evaluar la historia natural de E. granulosus en cultivo in vitro a largo plazo y el efecto de los factores de crecimiento insulina y BMP4 en el desarrollo y crecimiento de este parásito.
2. Materiales y métodos
La presentación esquemática del estudio con las siguientes etapas se muestra en la Figura 1.
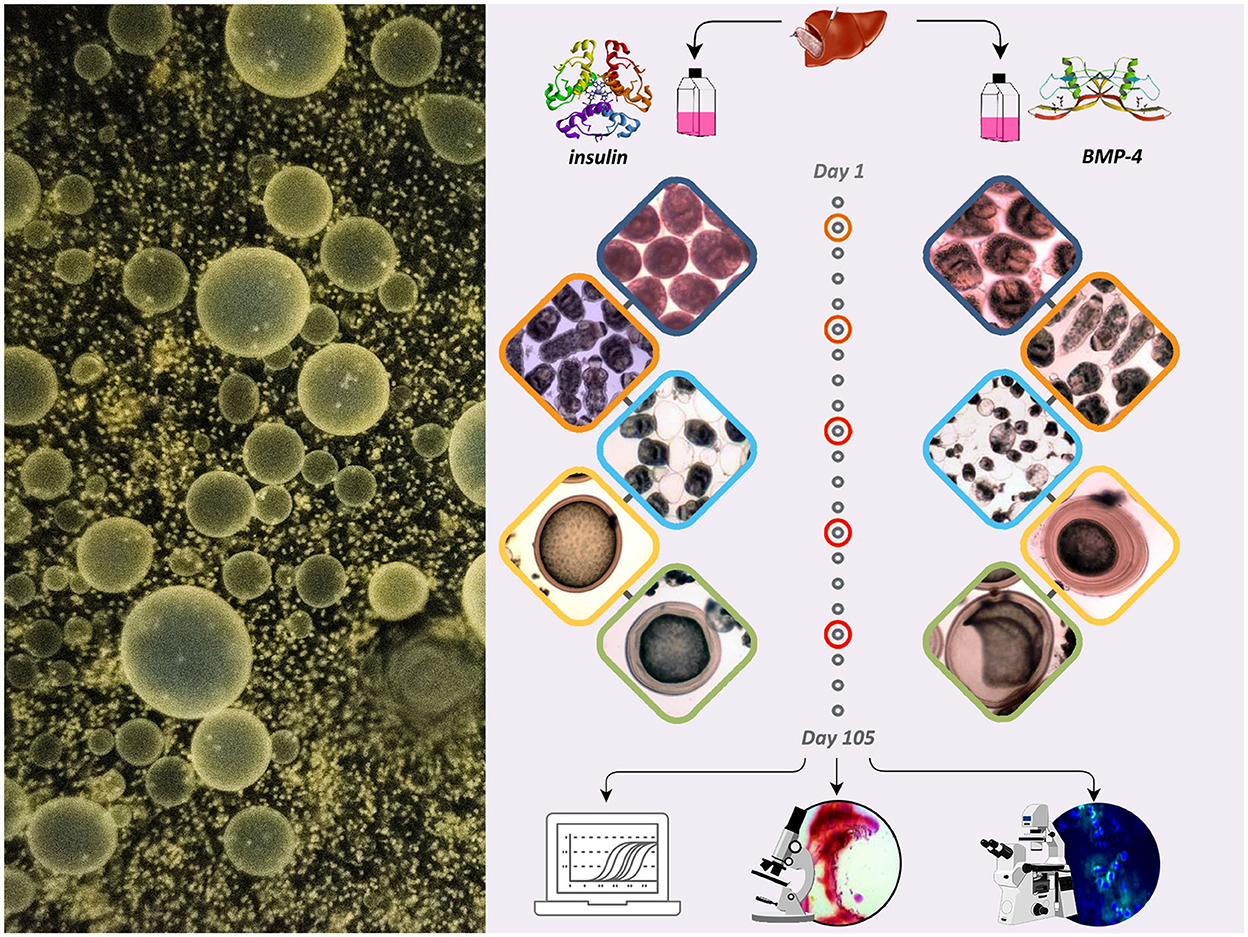 Figura 1. Presentación esquemática del estudio que muestra el efecto de la insulina y BMP-4 sobre el crecimiento y desarrollo de E. granulosus cultivada in vitro durante 105 días.
Figura 1. Presentación esquemática del estudio que muestra el efecto de la insulina y BMP-4 sobre el crecimiento y desarrollo de E. granulosus cultivada in vitro durante 105 días.
2.1. Cultivo y preparaciones de parásitos
Los quistes de Echinococcus granulosus se obtuvieron mediante la disección de hígados de ovejas infectadas de forma natural sacrificadas bajo la supervisión de los veterinarios del matadero municipal de Kerman. Los órganos infectados se transfirieron inmediatamente al laboratorio de parasitología y, en condiciones estériles, se aspiró el líquido hidatídico que contenía protoscoleces con una jeringa de 50 ml y se retiró la capa laminada/germinal. Los protoscoleces se lavaron cuidadosamente cinco veces con solución salina tamponada con fosfato que contenía 100 U/ml de penicilina y 100 μg/ml de estreptomicina (PBS-PS). Antes del cultivo, la viabilidad de los protoscoleces se comprobó mediante una prueba de eosina al 0,1% bajo un microscopio óptico (25). El genotipado de los protoscoleces se realizó mediante secuenciación por PCR de cox1 mitocondrial y la secuencia se envió al GenBank.
Se utilizaron alícuotas de 2000 protoscoleces con una viabilidad mínima del 95% para el cultivo in vitro en medios monofásicos para alcanzar las formas de microquistes, de acuerdo con el método descrito en otro lugar (26). Brevemente, los protoscoleces se separaron de las cápsulas de cría mediante el tratamiento con pepsina al 0,1% (p/v) producida en cloruro de sodio al 0,85% (p/v), pH 4,0 durante 30 min a 37°C. Posteriormente, los protoscoleces se añadieron al DMEM monofásico y se cambiaron los medios cada 4 días y se monitorizó la viabilidad y el desarrollo morfológico del parásito bajo un microscopio invertido (TCM 400, Labomed Inc., CA).
Las soluciones madre de BMP-4 (Sigma-Aldrich, EE.UU.) se prepararon en PBS con concentraciones de 100 ng/ml y se pasaron por un filtro estéril y se almacenaron hasta su uso. Las soluciones madre de insulina (Eli Lilly and Co., EE.UU.) se prepararon de manera similar en concentraciones de 1 U/ml y se almacenaron a -20 °C hasta su uso. Se añadieron insulina y BMP-4 a cada pocillo de placas de 12 pocillos en un volumen final de 1.500 μl.
2.2. Morfología y estudio morfométrico
Después de los tratamientos con insulina y BMP4, los parásitos se examinaron microscópicamente diariamente durante 105 días, y se registró el número, tamaño y porcentaje de microquistes, así como los primeros días de formación y deformación de microquistes. Además, se evaluaron los cambios morfológicos de los microquistes durante este período de tiempo. El tamaño del microquiste se midió con un microscopio calibrado. Además, se registró el número de microquistes en los matraces bajo un microscopio óptico. El porcentaje de microquistes deformados se evaluó midiendo el número total de microquistes. También se utilizó la tinción con hematoxilina y eosina (H&E) en secciones fijadas en formol e incluidas en parafina para la comparación morfológica entre microquistes normales y deformados.
2.3. Inmunohistoquímica
Las muestras se fijaron e incrustaron en parafina antes de preparar secciones transversales de 5 μm. Las secciones desparafinadas fueron deshidratadas por diferentes concentraciones de etanol. La recuperación del antígeno se realizó con tampón citrato (PH = 9,1). La solución de PBS se utilizó para enjuagar las secciones transversales durante 3 minutos, seguido de sumergirse en peróxido de hidrógeno (H2O2) durante 10 minutos y tritón al 0,3% durante 30 minutos para penetrar en la membrana celular. Después del lavado con PBS, las secciones se bloquearon con suero de cabra al 10% y se incubaron con anticuerpos primarios que incluían BAX (1:100, SC-7480, Santa Cruz Biotechnology, EE. UU.), Bcl-2 (1:100, sc-7382 – Santa Cruz Biotechnology, EE. UU.). Se utilizó como anticuerpos secundarios IgG-CFL 488 contra ratones o conejos de cabra (orb688924, Abcam, Cambridge, Reino Unido) durante 90 min. Posteriormente, los portaobjetos se lavaron y se sometieron a 4′,6-diamidino-2-fenilindol (DAPI) a temperatura ambiente, y se volvieron a lavar con PBS. Se utilizó un microscopio de fluorescencia equipado con una cámara digital para tomar imágenes. Todas las imágenes se capturaron con la misma configuración con un aumento de 200× bajo un microscopio fluorescente. La cuantificación del ensayo de inmunofluorescencia se basó en marcadores de fluorescencia. El número de células positivas fue contado cuidadosamente en 3 secciones en 5 campos por un investigador ciego. El porcentaje de células teñidas positivamente (marcadores) frente a núcleos totales (DAPI) en las regiones se evaluó en cada grupo utilizando el software Image J v1.8 (NIH, Wayne Rasband, USA) (27).
2.4. Tinción de rojo de alizarina
Para evaluar los restos de calcificación en los microquistes, se desparafinaron los portaobjetos y se realizaron los pasos de riego. Los portaobjetos se tiñeron con una solución de alizarina (Merck −1,06278) durante 1-5 minutos y se observaron al microscopio óptico. El color rojo anaranjado del calcio suele aparecer en 2 min. Para eliminar el exceso de pintura, los portaobjetos se colocaron primero en acetona al 100% y luego en una solución de acetona-xileno en una proporción de uno a uno. Después de los pasos de clarificación, la fotografía se realizó con un microscopio óptico (TCM 400, Labomed Inc., CA) (28).
2.5. Análisis de la expresión génica
Las expresiones de BAX, Bcl-2, Caspasa-3, Caspasa-8 y TNF-α se cuantificaron mediante PCR en tiempo real (qPCR). Los cebadores específicos se muestran en la Tabla 1. El ARN total se extrajo con TRIzol como se describe en otra parte (29). La pureza y las concentraciones de ARN se cuantificaron mediante mediciones de absorbancia a 260/280 nm utilizando NanoDrop 2000 (Nano Drop ND-1000, Nano Drop Technologies, Wilmington, DE). Se utilizó el kit de transcriptasa inversa miscriptII (Qiagen, Alemania) para construir el ADNc y se realizó una qPCR en un sistema Rotor-Gene Q (QIAGEN, Hilden, Alemania). Las condiciones de los ciclos térmicos fueron las siguientes: predesnaturalización a 95 °C durante 15 min, seguida de 40 ciclos a 95 °C durante 10 s y 60 °C durante 34 s. y una extensión final de 72 °C durante 40 s. Los niveles relativos de expresión de ARNm se cuantificaron mediante los 2®−ΔΔCT método.
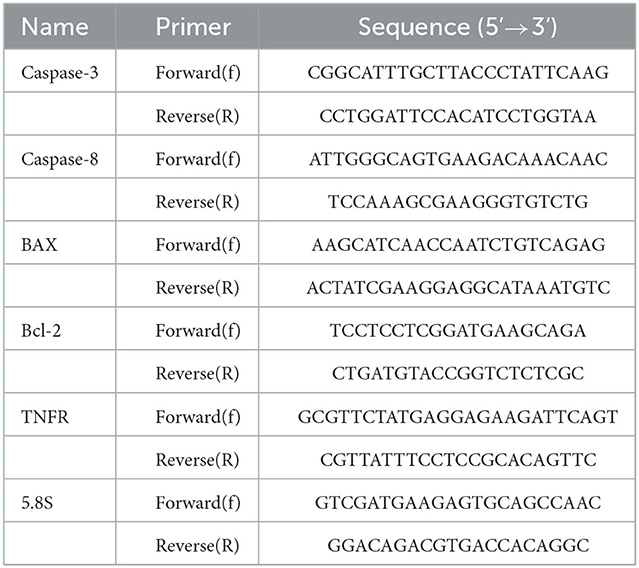 Tabla 1. Imprimadores utilizados en RT-qPCR para el análisis de la expresión de cinco genes relacionados con la apoptosis en diferentes etapas de desarrollo de Echinococcus granulosus. Se utilizó el gen 5.8S como gen de referencia.
Tabla 1. Imprimadores utilizados en RT-qPCR para el análisis de la expresión de cinco genes relacionados con la apoptosis en diferentes etapas de desarrollo de Echinococcus granulosus. Se utilizó el gen 5.8S como gen de referencia.
2.6. Dinámica molecular
La secuencia del receptor de insulina de E. granulosus (INSR) y del receptor de activina tipo 2 (ACTR) se obtuvieron del GenBank, CDS16915 y KAH9286272.1 para INSR y ACTR, respectivamente. El gen que codifica para el receptor de proteína morfogenética ósea en E. granulosus no se ha caracterizado adecuadamente. Por lo tanto, para encontrar los receptores de proteínas morfogenéticas óseas en E. granulosus para realizar simulaciones de acoplamiento molecular y DM, se utilizó el receptor de proteínas morfogenéticas óseas humanas con el número de acceso NP_001195.2 en la base de datos NCBI Gene. A continuación, con el fin de identificar una estructura similar en E. granulosus, se realizó un blasto proteína-proteína utilizando la página de blastos contra la base de datos de «secuencia de proteínas no redundante» y el organismo seleccionado E. granulosus. Finalmente, se evaluaron los resultados obtenidos en función de la identidad, la cobertura de consultas y el valor e.
La estructura cristalográfica de la insulina humana en complejo con cucurbitáceas (código de acceso RCSB: 3Q6E) se utilizó para simulaciones de acoplamiento y dinámica molecular. Las moléculas de agua y el ligando se eliminaron del archivo PDB y solo quedaron las dos cadenas de la proteína insulina. Se utilizó el servidor de modelado de proteínas Robetta para construir la estructura tridimensional ab-initio del INSR. Se utilizó un servidor de modelos suizo para predecir ACTR. Se utilizó el servidor FG-MD para el paso de refinamiento de la estructura. La calidad y validación de la estructura se evaluó mediante PROSA, Molprobity, servidores Verify3D y diagrama Ramachandran.
Para predecir el dominio extracelular de los receptores de proteínas, utilizamos el servidor TOPCONS, un servidor basado en el consenso que determina la ubicación subcelular de diferentes partes de una proteína definida por el usuario. Se utilizó el servidor CASTp para determinar la geometría del bolsillo de unión potencial de las estructuras predichas y los aminoácidos. El servidor HDOCK se utilizó en el acoplamiento insulina-INSR. HDOCK es un método híbrido que consiste en modelado basado en plantillas y acoplamiento libre. Para los análisis posteriores se utilizó la estructura con menor energía (30).
Se simularon diferentes estructuras biomoleculares mediante GROMACS 5.0.4 (2021) (31). En todas las simulaciones se aplicaron campos de fuerza OPLS-AA. Se creó una caja de dodecaedro, que se llenó con moléculas de agua TIP3P y se neutralizó. La energía de las estructuras se minimizó utilizando un algoritmo de descenso más pronunciado con 50.000 pasos y un tamaño de paso de 0,01 kJ/mol/nm. La minimización finalizó cuando la fuerza máxima <1.000,0 kJ/mol/nm. Todas las simulaciones se llevaron a cabo con un paso de tiempo de 2fs. El termostato Nose-Hoover y el acoplamiento de presión Parrinello-Rahman se utilizaron en el sistema para mantener una temperatura constante de 300 K y una presión constante de 101,3 kPa. Se aplicaron condiciones de contorno periódicas al sistema. La estructura de energía minimizada se sometió a un conjunto NVT de 50 ps y luego a un NPT de 50 ps. La estructura equilibrada se utilizó para la producción de MD. Se llevó a cabo una simulación de MD INSR 20-ns para evaluar la estabilidad de la estructura. A continuación, se utilizó la mejor estructura acoplada de la simulación de la MD insulina-INSR 20-ns para evaluar la energía de unión del complejo. Los cálculos de energía libre en estado final se realizaron mediante el método de área superficial de mecánica molecular/Poisson-Boltzmann (generalizado-nacido) utilizando la herramienta gmx_MMPBSA en GROMACS. Utilizando el paquete MDAnalysis, se realizó la desviación cuadrática media (RMSD), la fluctuación cuadrática media (RMSF), el radio de giro, el análisis de componentes principales y el análisis de enlaces de hidrógeno.
2.7. Análisis estadístico
Los datos se presentan como la media ± la desviación estándar (DE) y se trazaron con el software GraphPad Prism 8.0. Se evaluaron comparaciones múltiples y dentro de los grupos para determinar la significación estadística mediante ANOVA de un factor. Los valores de P < 0,05 se consideraron estadísticamente significativos.
3. Resultados
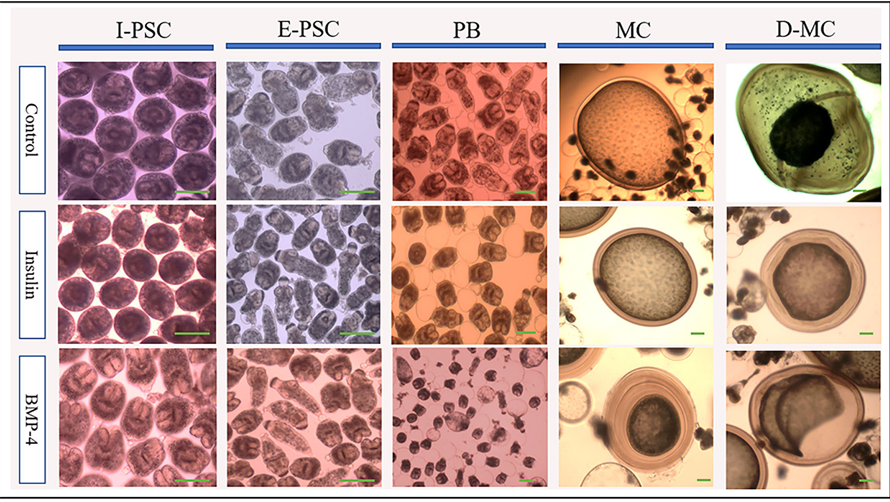
En la Figura 2 se muestran las etapas de desarrollo del genotipo G1 de E. granulosus sensu stricto (accesión No. OP882698) en el medio monofásico comparando las PSC invaginadas (I-PSC), las PSC evaginadas (E-PSC), los protoscoleces con vejiga posterior (PB), los microquistes maduros (MC) y los microquistes deformados (D-MC) en los grupos tratados con insulina/BMP4 así como en el grupo control.
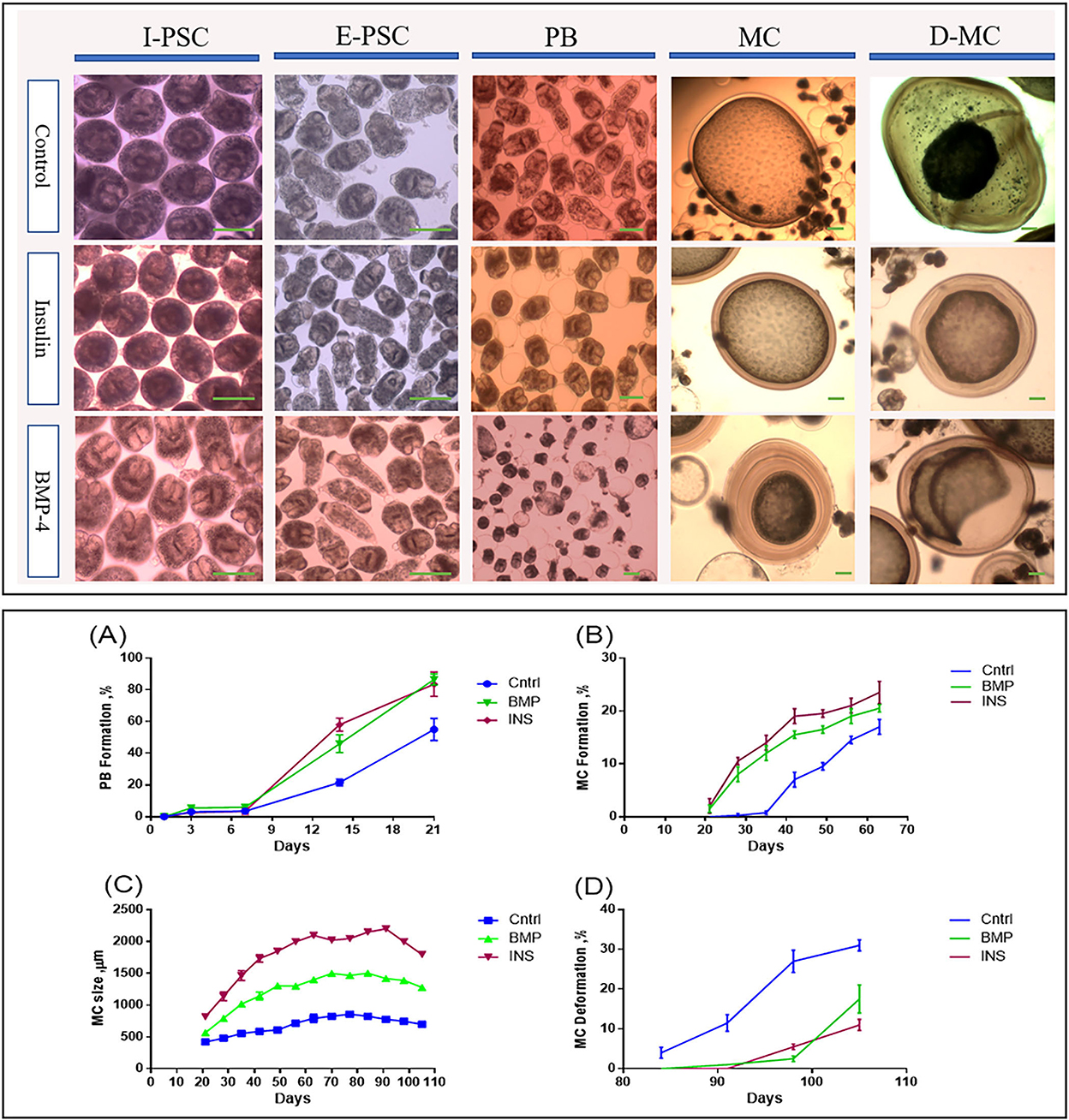 Figura 2. Cambios morfológicos y de desarrollo en diferentes estadios de Echinococcus granulosus a partir de 2000 protoscoleces cultivados en medio DMEM. Panel superior: Cambios morfológicos en diferentes estadios de desarrollo in vitro de Echinococcus granulosus tratados con insulina y BMP-4 en comparación con el control. I-PSC: protoscoleces invaginados; E-PSC: protoscoleces evaginadas; PB: Formación de la vejiga posterior; MC: Microquistes; D-MC: Microquistes deformados. Panel inferior: Cambios en el desarrollo inducidos por el tratamiento con insulina y BMP-4 en diferentes estadios in vitro de Echinococcus granulosus. (A) Tasa de formación de la vejiga posterior (PB). (B) Tasa de formación de microquistes. (C) Cambios en el tamaño medio de los microquistes. (D) Tasa de deformación de microquistes. Barra de escala: 200 μm.
Figura 2. Cambios morfológicos y de desarrollo en diferentes estadios de Echinococcus granulosus a partir de 2000 protoscoleces cultivados en medio DMEM. Panel superior: Cambios morfológicos en diferentes estadios de desarrollo in vitro de Echinococcus granulosus tratados con insulina y BMP-4 en comparación con el control. I-PSC: protoscoleces invaginados; E-PSC: protoscoleces evaginadas; PB: Formación de la vejiga posterior; MC: Microquistes; D-MC: Microquistes deformados. Panel inferior: Cambios en el desarrollo inducidos por el tratamiento con insulina y BMP-4 en diferentes estadios in vitro de Echinococcus granulosus. (A) Tasa de formación de la vejiga posterior (PB). (B) Tasa de formación de microquistes. (C) Cambios en el tamaño medio de los microquistes. (D) Tasa de deformación de microquistes. Barra de escala: 200 μm.
A partir del día 7, aparecieron vesículas similares a la vejiga conocidas como vejigas posteriores en el extremo posterior de los protoescoles en todos los grupos. Los porcentajes de formación de PB en las PSC tratadas con insulina y BMP-4 se incrementaron significativamente en comparación con las PSC control, de modo que al final del día 21, la formación de PB en las PSC fue del 55, 83,5 y 86,5% en las PSC control, insulina y BMP-4 respectivamente (Figura 2A). Mientras que en el grupo control, el primer microquiste se encontró el día 28, en los grupos de insulina y BMP los primeros microquistes se formaron el día 21. En el día 63, mientras que el 17% de los microquistes estaban presentes en el grupo control, casi el 23% de los microquistes se formaron en el grupo de insulina y el 20% en el grupo de BMP (Figura 2B).
De acuerdo con la Figura 2C, el tamaño promedio de los microquistes en los grupos de insulina y BMP fue significativamente mayor que en el grupo control, y el tamaño comenzó a disminuir a partir del día 84. Hay muy pocas variaciones en el tamaño de los quistes dentro de cada grupo, sin embargo, los grupos tratados con insulina y BMP-4 produjeron microquistes significativamente más grandes en comparación con el grupo de control. También dentro de los grupos de insulina y BMP-4, no observamos variaciones significativas en diferentes momentos. Como se muestra en la Figura 2D, en el grupo control, a partir del día 84, los microquistes comenzaron a arrugarse de modo que la capa germinal se desprendió parcialmente de la capa laminada. En el grupo control, un mayor porcentaje de microquistes se deformaron al final del día 105 y esta deformación ocurrió antes que los grupos tratados con insulina y BMP-4. Por otro lado, la tinción de H&E mostró (Figura 3A) que en todos los grupos el espesor de la capa laminada en los microquistes arrugados fue mayor que en los microquistes normales con la misma edad (p < 0,05). La tinción con rojo alizarina de los microquistes indica que la acumulación de calcio en los microquistes deformados es mayor que la normal. Cabe destacar que la intensidad de la deposición de calcio en los grupos de insulina y BMP fue menor que en el grupo control (Figura 3B).
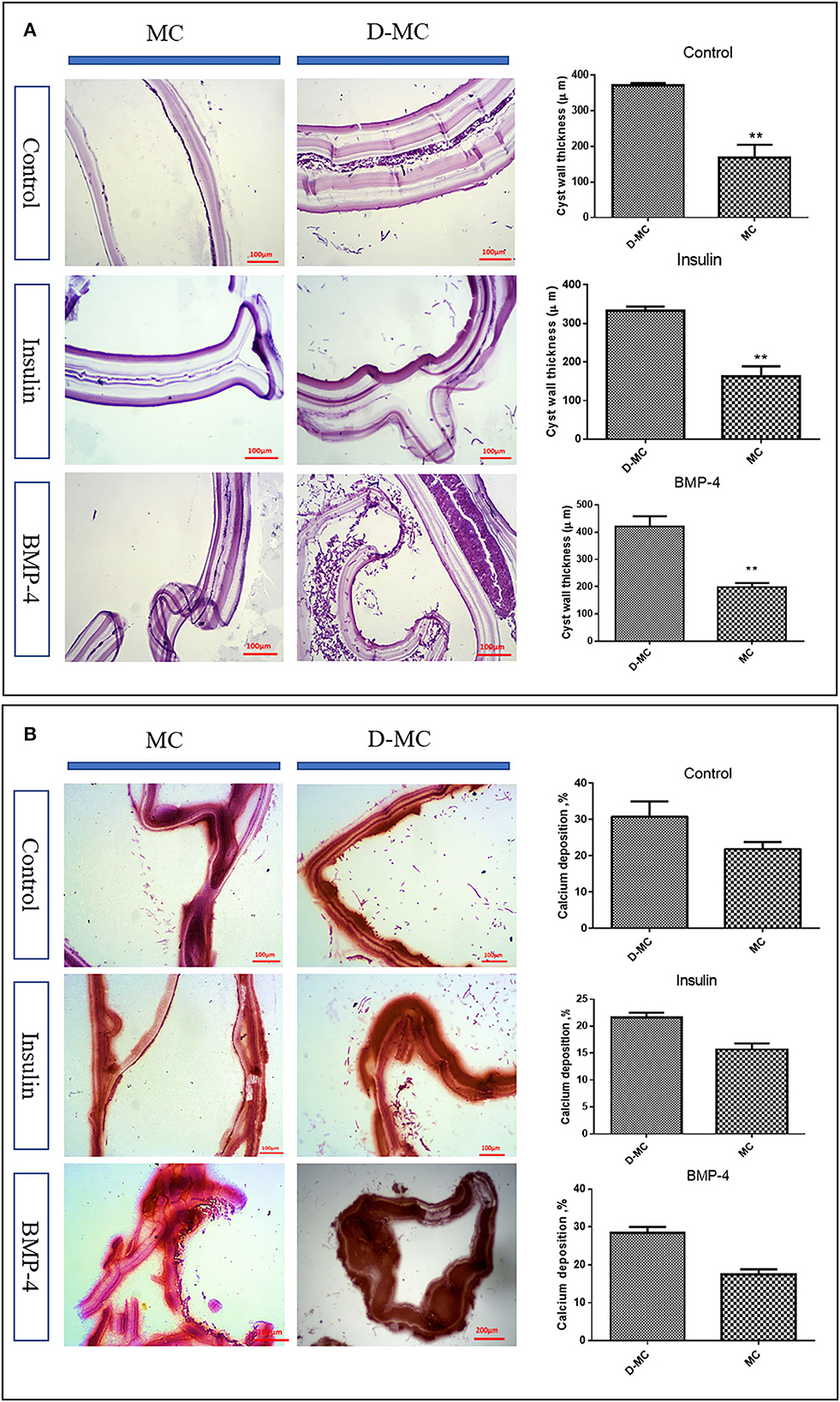 Figura 3. Cambios histológicos in vitro en los microquistes de Echinococcus granulosus tras el tratamiento con insulina y BMP-4. (A) Cambios en el espesor de la capa laminada (LL) de los microquistes de Echinococcus granulosus después del tratamiento con insulina y tinción con BMP-4, hematoxilina y eosina (H&E). MC: Microquiste; D-MC: Microquiste deformado. Las barras muestran la media ± desviación estándar (DE). **P < 0,005. (B) Cambios en la deposición de calcio en los microquistes de Echinococcus granulosus tratados con insulina y BMP-4, tinción con rojo de alizarina. MC: Microquiste; D-MC: Microquiste deformado.
Figura 3. Cambios histológicos in vitro en los microquistes de Echinococcus granulosus tras el tratamiento con insulina y BMP-4. (A) Cambios en el espesor de la capa laminada (LL) de los microquistes de Echinococcus granulosus después del tratamiento con insulina y tinción con BMP-4, hematoxilina y eosina (H&E). MC: Microquiste; D-MC: Microquiste deformado. Las barras muestran la media ± desviación estándar (DE). **P < 0,005. (B) Cambios en la deposición de calcio en los microquistes de Echinococcus granulosus tratados con insulina y BMP-4, tinción con rojo de alizarina. MC: Microquiste; D-MC: Microquiste deformado.
La comparación de IHQ en diferentes grupos mostró que la expresión de BAX es significativamente mayor en los microquistes deformados que en los normales. También se obtuvieron hallazgos similares en los grupos tratados con insulina y BMP-4, pero las expresiones de BAX en estos dos grupos fueron menores que en los parásitos control (Figura 4). El análisis IHQ de Bcl-2 indica una disminución de la expresión en los microquistes deformados en comparación con los microquistes intactos en todos los grupos experimentales. Cabe destacar que la expresión de Bcl-2 fue menor en los tratamientos con insulina y BMP-4 en comparación con el control (Figura 5).
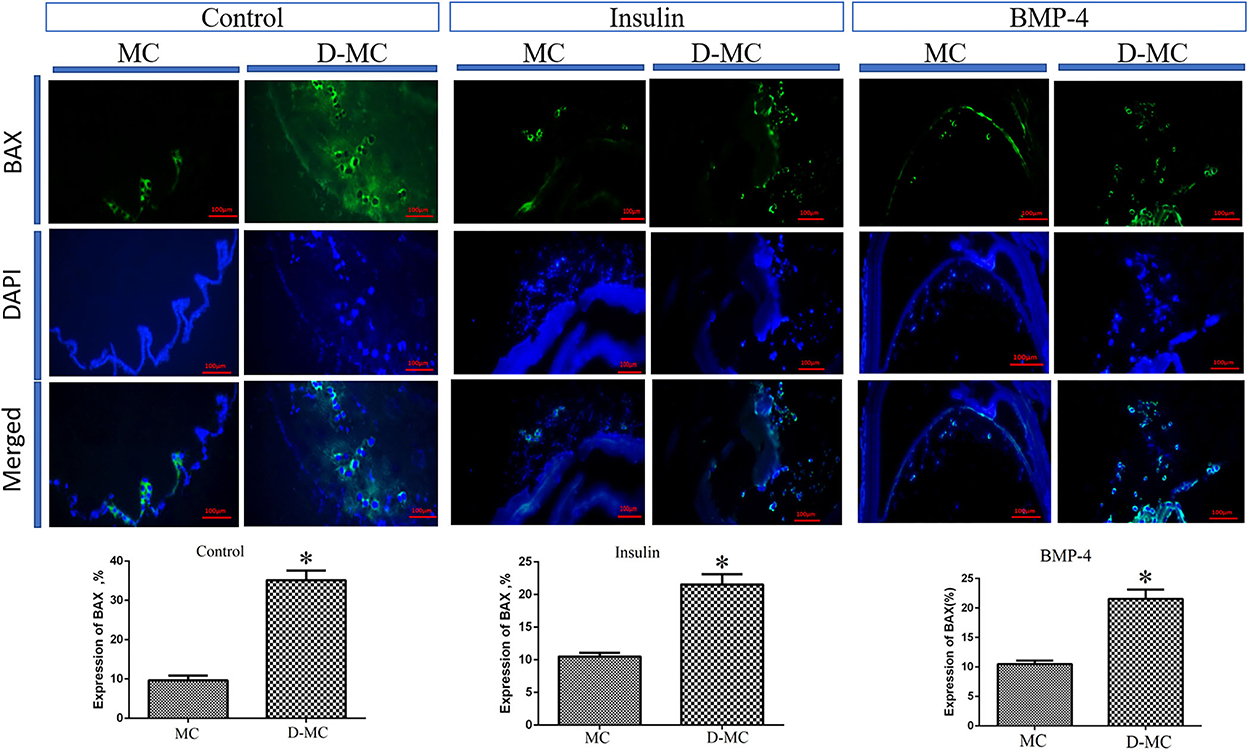 Figura 4. Cambios en la expresión de BAX en microquistes de Echinococcus granulosus tratados in vitro con insulina y BMP-4 en comparación con el control, tinción inmunohistoquímica. MC: Microquiste; D-MC: Microquiste deformado. (*P < 0,05).
Figura 4. Cambios en la expresión de BAX en microquistes de Echinococcus granulosus tratados in vitro con insulina y BMP-4 en comparación con el control, tinción inmunohistoquímica. MC: Microquiste; D-MC: Microquiste deformado. (*P < 0,05).
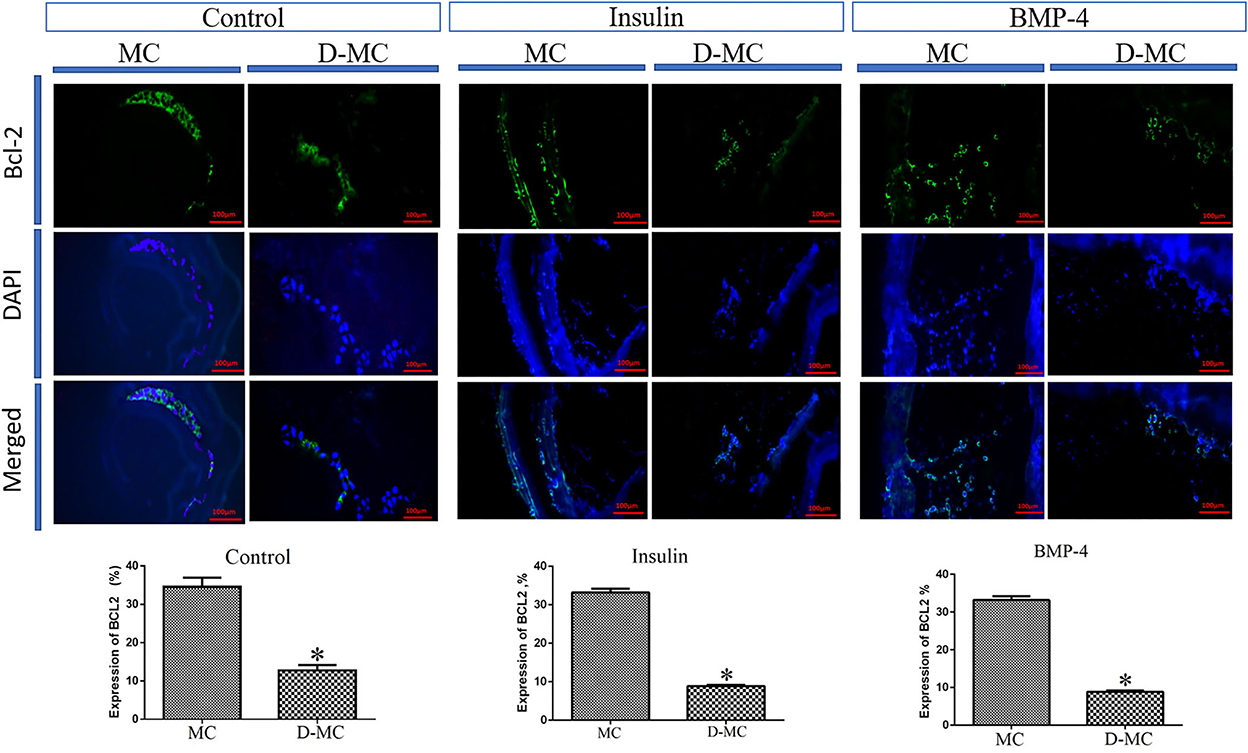 Figura 5. Cambios en la expresión de Bcl-2 en microquistes de Echinococcus granulosus tratados in vitro con insulina y BMP-4 en comparación con el control, tinción inmunohistoquímica. MC: Microquiste; D-MC: Microquiste deformado. (*P < 0,05).
Figura 5. Cambios en la expresión de Bcl-2 en microquistes de Echinococcus granulosus tratados in vitro con insulina y BMP-4 en comparación con el control, tinción inmunohistoquímica. MC: Microquiste; D-MC: Microquiste deformado. (*P < 0,05).
En la Figura 6 se muestran los perfiles de expresión de los cinco genes, incluyendo BAX, Bcl-2, TNF-α, Caspas-3 y Caspasa-8, implicados en los cambios apoptóticos en diferentes estadios de desarrollo in vitro de E. granulosus, en los grupos control, así como en los grupos de tratamiento con insulina y BMP-4.
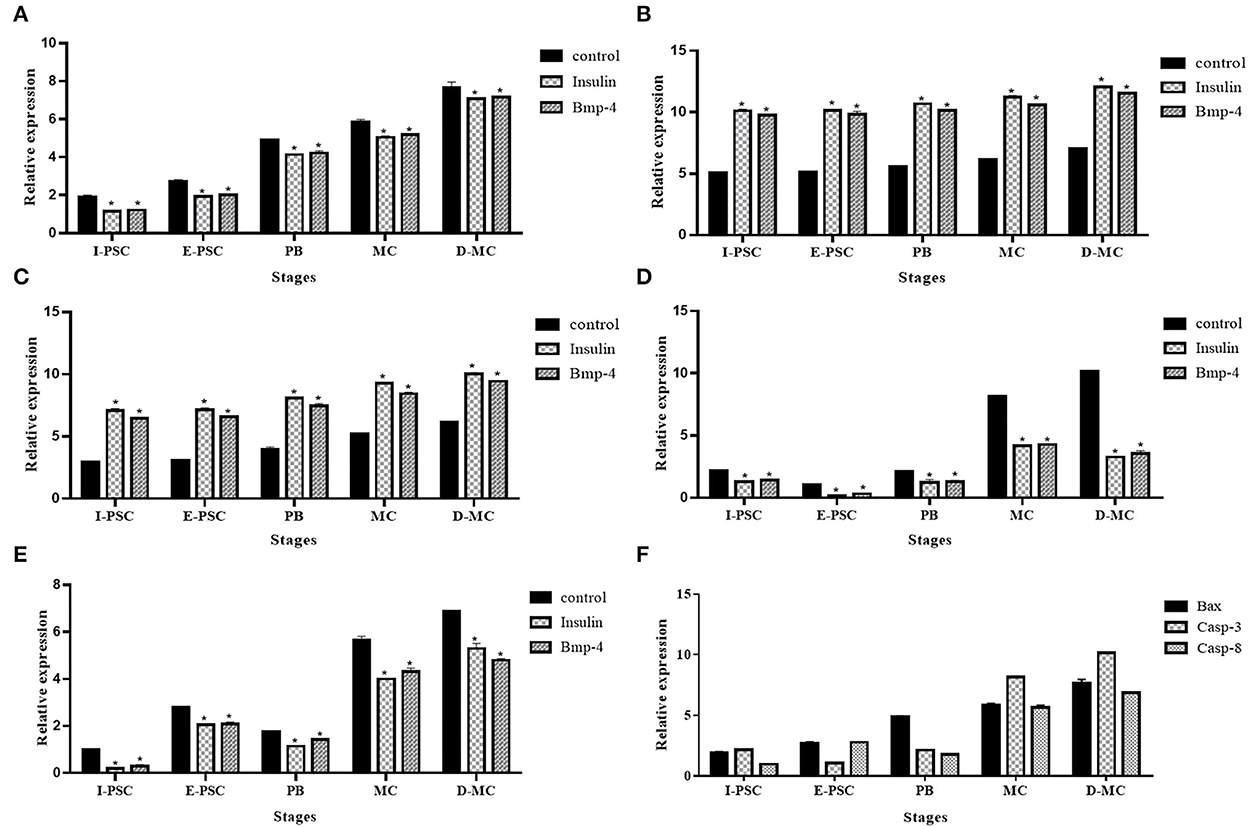 Figura 6. Perfil de expresión de cinco genes, (A) BAX, (B) Bcl-2, (C) Caspasa-3, (D) Caspasa-8, (E ) TNF-α, relacionados con la apoptosis en diferentes estadios de desarrollo in vitro de Echinococcus granulosus tratados con insulina y BMP-4 en comparación con el control mediante RT-qPCR. I-PSC: Protoscoleces invaginadas; E-PSC: protoscoleces evaginadas; PB: Vejiga posterior; MC: Microquiste; D-MC: Microquiste deformado. Las barras muestran la media ± la desviación estándar (DE) derivadas de experimentos duplicados. (F) genes pro-apoptosis en el grupo control (*P < 0,05).
Figura 6. Perfil de expresión de cinco genes, (A) BAX, (B) Bcl-2, (C) Caspasa-3, (D) Caspasa-8, (E ) TNF-α, relacionados con la apoptosis en diferentes estadios de desarrollo in vitro de Echinococcus granulosus tratados con insulina y BMP-4 en comparación con el control mediante RT-qPCR. I-PSC: Protoscoleces invaginadas; E-PSC: protoscoleces evaginadas; PB: Vejiga posterior; MC: Microquiste; D-MC: Microquiste deformado. Las barras muestran la media ± la desviación estándar (DE) derivadas de experimentos duplicados. (F) genes pro-apoptosis en el grupo control (*P < 0,05).
La expresión de BAX, Caspasa-3 y Caspasa-8 representó un aumento significativo en el grupo control en comparación con la insulina y BMP-4. Por el contrario, se observó una disminución significativa en la expresión de Bcl-2 y TNF-α en los controles en comparación con los grupos de insulina y BMP-4. Como se muestra en la Figura 6F, los microquistes deformados presentaron cambios apoptóticos significativos en comparación con otras etapas del desarrollo del parásito in vitro en los grupos control.
Los estudios de dinámica molecular indican que las BMP poseen una amplia gama de actividades biológicas en diferentes tejidos. Estas proteínas son miembros de la familia del factor de crecimiento transformante β (TGF-β), que se une a los receptores de serina-treonina quinasa tipo II y tipo I. Los resultados del blasto proteína-proteína mostraron que los receptores proteicos morfogenéticos óseos humanos tienen la mayor similitud con el receptor de activina tipo 2A del parásito con número de acceso KAH9286272.1. Por lo tanto, esta secuencia se utilizó para determinar la estructura 3D, el acoplamiento y las simulaciones MD.
El INSR tiene una estructura tridimensional sustancial y grande. Debido a la escasez de datos sobre la estructura de las proteínas en E. granulosus, la calidad de la predicción se vería muy alterada debido al tamaño de la proteína. Además, las simulaciones de dinámica molecular llevarían mucho tiempo y la probabilidad de atrapamiento en un mínimo local aumenta proporcionalmente. Así, el servidor TOPCONS se ha utilizado para la identificación de la parte extracelular del receptor de insulina. La predicción de consenso del servidor TOPCONS se utilizó como predicción final de la localización subcelular del receptor. De los 1.740 aminoácidos, 1.037 aminoácidos son extracelulares, 20 y 616 residuos son transmembrana e intracelulares, respectivamente. El servidor Robetta, una versión mejorada de alpha fold 2, se ha utilizado para predecir la estructura tridimensional de la parte extracelular del INSR. A continuación, se utilizó el servidor FG_MD para el paso de refinamiento de la estructura. La mejor de las cinco estructuras predichas tiene un factor de calidad global de 83,8552 (puntuación ERRAT); El 79,75% de los residuos han promediado una puntuación 3D-1D ≥0,2 (VERIFY 3D), una puntuación PROSA z de -11,18 y una puntuación MolProbity de 2,57. Los gráficos de Ramachandran de las proteínas se muestran en la Figura Suplementaria 1. En el caso de ACTR, se ha utilizado toda la secuencia de proteínas para modelar utilizando el servidor de modelos suizo, y la estructura final predicha ha logrado 94. 1176 puntuación ERRAT, 80,66% (Verify 3d), puntuación z de −8,55 (PROSA) y puntuación de molprobidad de 1,66.
La simulación de la primera MD de 20 ns, que se basa únicamente en las estructuras de los receptores, mostró que las estructuras predichas conservan una forma relativamente estable de acuerdo con el RMSD, representado en las Figuras 7A y B. Ambos receptores alcanzaron una meseta después de unos pocos ns, y el valor de RMSD permanece constante. Del mismo modo, para la mayoría de los residuos de aminoácidos del INSR, los valores de RMSF son <1 Angstrom (Figuras 7C, D) para la mayoría de los residuos; sin embargo, los residuos colocados en el bolsillo de atado tuvieron la mayor cantidad de fluctuaciones. Otro indicador de estabilidad es el radio de giro, que trata de cuantificar la tendencia de una proteína a la compacidad. El radio medio de giro para el INSR fue de 4,30 (IC del 95% de ± 0,0026); fue de 3,50 (IC del 95% de ± 0,0015), lo que en general denota la estabilidad de las estructuras receptoras (Figuras 7E, F). En el caso de las energías de interacción, los receptores mostraron una fuerte propensión a la interacción con sus ligandos correspondientes (Figuras 7G, H). La fluctuación de los enlaces de hidrógeno durante las simulaciones se representa en las Figuras 7I, J.
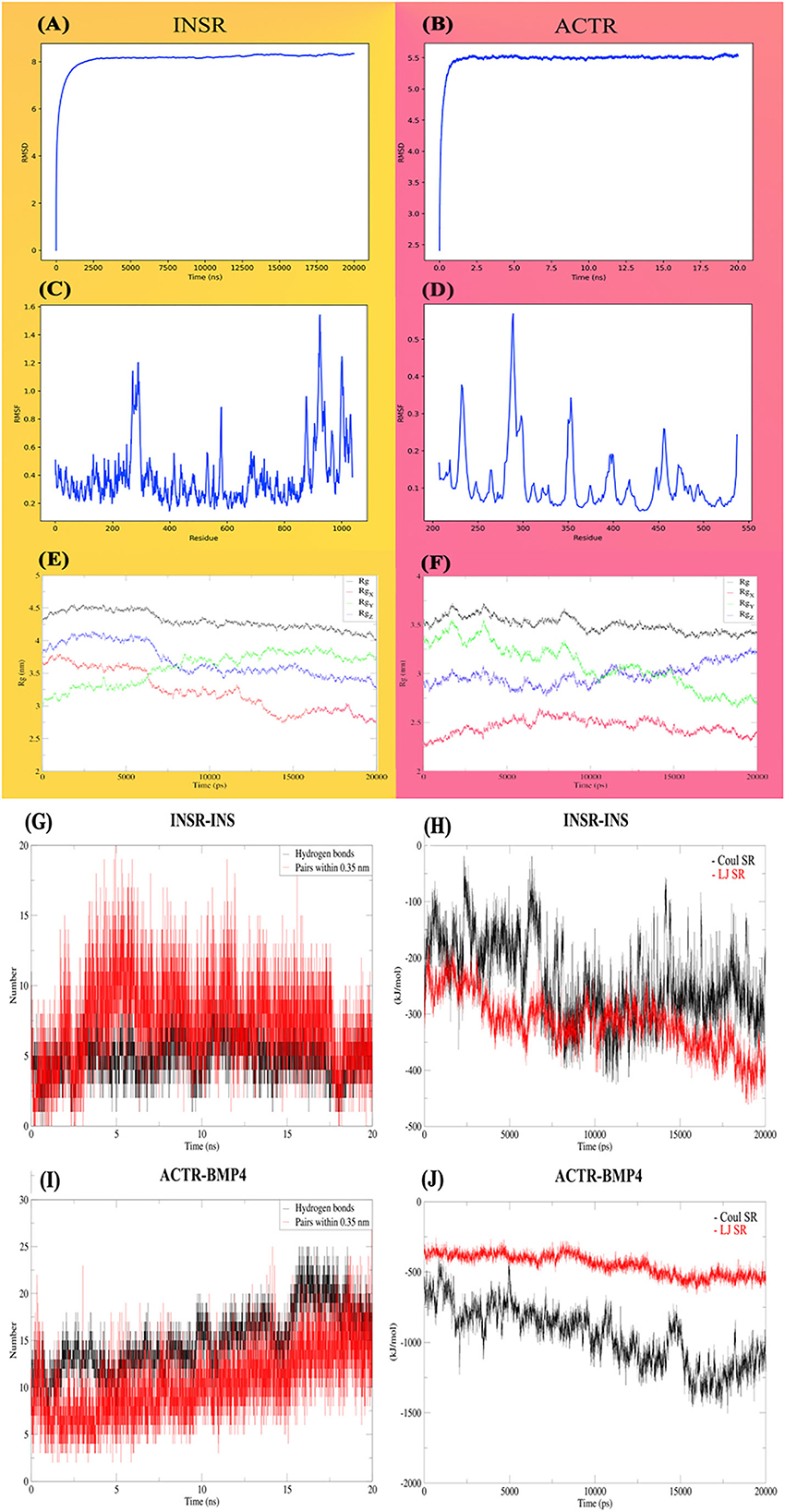 Figura 7. Análisis dinámico molecular de la estabilidad e interacciones de los receptores INSR y ACTR con sus correspondientes ligandos. Gráficos INSR y ACTR totales y alrededor de los ejes, RMSD (A, B), RMSF (C, D) y radio de giro (Rg) (E, F). Enlaces de hidrógeno (G, H) y energías de interacción (I, J), Coulomb, Lennard-Jones y energías de corto alcance.
Figura 7. Análisis dinámico molecular de la estabilidad e interacciones de los receptores INSR y ACTR con sus correspondientes ligandos. Gráficos INSR y ACTR totales y alrededor de los ejes, RMSD (A, B), RMSF (C, D) y radio de giro (Rg) (E, F). Enlaces de hidrógeno (G, H) y energías de interacción (I, J), Coulomb, Lennard-Jones y energías de corto alcance.
4. Discusión
Actualmente, nuestro conocimiento sobre la historia natural de la equinococosis quística y la evolución del quiste a lo largo del tiempo es limitado. En un contexto clínico, la Organización Mundial de la Salud clasificó los quistes hepáticos en 6 estadios, desde un único quiste hidatídico unilocular bien definido (CE1) hasta los quistes con membranas laminadas/germinales desprendidas (CE3a) y, finalmente, los quistes hidatídicos degenerados totalmente calcificados (CE5) (32). Los estudios han demostrado que los quistes de E. granulosus pueden sobrevivir en el hígado sin síntomas específicos durante años (33, 34). Sin embargo, todavía hay muchas preguntas sobre el proceso en el que se desarrollan estas etapas, cómo se transforma una etapa en otra, qué factores relacionados con el huésped o el medio ambiente afectan estos cambios y las características moleculares y ultraestructurales de este proceso tanto in vivo como in vitro. Se han llevado a cabo muchos estudios sobre el desarrollo bidireccional de E. granulosus en sistemas de cultivo mono y d-fásicos, sin embargo, nuestra comprensión sobre la historia natural de los microquistes en cultivo in vitro prolongado y los eventos moleculares durante este período es muy limitada.
Nuestros hallazgos sobre los marcadores moleculares e histológicos de apoptosis, calcificación y degeneración proporcionan evidencia significativa que sugiere que los microquistes cultivados in vitro pueden experimentar procesos similares a los que se han observado en la historia natural de los quistes hidatídicos en entornos in vivo, es decir, en humanos y ciertos huéspedes intermediarios. Los resultados de nuestro estudio mostraron que después de 84 días, la capa germinal de los microquistes se arrugó y comenzó a separarse de la capa laminada. Kern et al. demostraron que un porcentaje de los quistes hidatídicos experimentan cambios físicos espontáneos a lo largo del tiempo, incluida la separación de las membranas del quiste, la ruptura de quistes hijos y otros signos de degeneración y pérdida de viabilidad (33, 34). Además, nuestros hallazgos indican que la acumulación de calcio en los microquistes deformados en el día 105 del cultivo del parásito es mayor en comparación con los microquistes normales (Figura 3B). Los cambios significativos en la expresión de BAX y Bcl-2 en los microquistes deformados en comparación con los normales, sugieren procesos apoptóticos en el cultivo prolongado de microquistes in vitro. Por lo tanto, se podría suponer que los cambios en la calcificación del quiste hidatídico ocurren en ausencia de factores relacionados con el huésped.
La influencia de los factores de crecimiento también se muestra en este estudio. Nuestros hallazgos mostraron que la apoptosis y la deformación de los microquistes pueden retrasarse bajo la influencia de la insulina y BMP-4, lo que indica que los factores celulares y las hormonas del huésped pueden ayudar a aumentar la vida útil de los quistes hidatídicos. Los helmintos son organismos multicelulares que requieren comunicación de célula a célula a lo largo de su crecimiento y desarrollo. El evento de señalización celular determina el destino de una célula, organiza los tejidos, establece un plan corporal e inicia y mantiene el proceso de reproducción reproductiva (35). Las hormonas y citoquinas como la insulina y la BMP-4 desempeñan un papel importante en el desarrollo, la diferenciación y la apoptosis de los helmintos. Aunque el papel de la insulina y el BMP-4 ha sido ampliamente estudiado y bien caracterizado en varios parásitos helmintos, incluyendo E. multilocularis (15, 16, 23), Schistosoma mansoni (17, 18, 22, 36) y S. japonicum (19, 37), no hay datos publicados sobre el efecto de la insulina y BMP-4 en las propiedades biológicas de E. granulosus . En el presente estudio, investigamos los efectos de los factores de crecimiento, insulina y BMP-4, sobre el crecimiento y desarrollo de E. granulosus. En general, los grupos tratados con insulina y BMP-4 produjeron un mayor número de microquistes y PSC con vejiga posterior, mientras que no hubo diferencias significativas entre los grupos de insulina y BMP (Figuras 2A, B). Las vejigas posteriores aparecieron en el extremo posterior de algunos de los protoscoleces en todos los grupos. El material del que se componen estas vejigas posteriores llenas de líquido, parece ser continuo con el tegumento que cubre las regiones posteriores de los protoscoleces y puede crecer hasta alcanzar un tamaño relativamente grande. Como se muestra en la Figura 2, tanto los protoscoleces evaginados como los invaginados en medios monofásicos pueden convertirse en microquistes a través de las vejigas posteriores. Además, los hallazgos documentaron un mayor tamaño de los microquistes y un retraso en el proceso de apoptosis y envejecimiento de los microquistes. También demostramos que la deposición de calcio en los microquistes tratados con insulina y BMP-4 es menor que en los microquistes no tratados, lo que indica que el proceso de calcificación en los microquistes tratados con insulina y BMP-4 se ralentizó.
De acuerdo con nuestros datos, Hemer et al. encontraron un aumento de casi seis veces en la formación de vesículas de E. multilocularis después de 1 semana de incubación de células primarias con insulina. Además, documentaron un aumento del 50% en la formación de microquistes después de 3 semanas de cultivo in vitro de los protoscoleces con insulina (16). Además, otro estudio mostró que los EGF derivados del huésped pueden promover la proliferación de células germinativas en E. multilocularis y pueden interferir con la familia TGF-β/BMP en el metacestodo (38).
Nuestros hallazgos indican que el tratamiento con insulina y BMP-4 condujo a un aumento del tamaño promedio de los microquistes en comparación con los grupos control (Figura 2C). Otros estudios relacionaron los efectos de la insulina y la BMP con el metabolismo, el crecimiento y el desarrollo de la glucosa en otras especies de helmintos, incluyendo Mesocestoides corti (39) y Taenia crassiceps [(40, 41) #30]. Adalid-Peralta et al. demostraron que el TGF-β del huésped interactúa con los receptores TGF-β/BMP del parásito para mejorar el crecimiento de los metacestodos de Taenia crassiceps (41). En E. multilocularis (16) y S. mansoni (19) se ha demostrado que el uso de inhibidores de los receptores de insulina puede interrumpir el crecimiento y desarrollo del parásito. Los inhibidores indujeron efectos significativos en el proceso de rediferenciación de E. multilocularis protoscoleces hacia la etapa de metacestodo (16). En otro estudio se demostró que los inhibidores de RTK pueden inducir la apoptosis en S. mansoni, al inhibir el receptor de insulina y las tirosina quinasas (42). Los hallazgos de dinámica molecular de nuestro estudio apoyan en gran medida la hipótesis de que el parásito puede ser alimentado por factores de crecimiento humanos.
En el presente estudio, se realizó IHQ para evaluar el proceso de apoptosis en los microquistes normales, microquistes deformados y los microquistes tratados con insulina y BMP-4. Nuestros resultados mostraron una disminución significativa de BAX y un aumento de Bcl-2 en microquistes deformados, lo que es una indicación de disminución de la apoptosis en comparación con los grupos no tratados. Los hallazgos de IHQ están en línea con nuestros datos de RT-qPCR de la expresión de genes relacionados con la apoptosis, incluidos Caspasa-3, Caspasa-8, TNF-α, BAX y Bcl-2. Se puede entender claramente que los microquistes expuestos a insulina y BMP se ven menos afectados por los eventos apoptóticos, como lo revela el aumento de la expresión de los genes BAX, Caspasa-3 y Caspasa-8, así como la disminución de la expresión de TNF-α y Bcl-2 en los microquistes normales en comparación con los grupos de insulina y BMP (Figura 6). Se ha determinado que se produce un aumento en la expresión de ligandos inductores de apoptosis, caspasa 3 y fragmentación del ADN en la superficie de la capa germinal de los quistes infértiles en comparación con los quistes fértiles y los tejidos del huésped, lo que indica que los eventos apoptóticos pueden desempeñar un papel importante en la historia natural de la equinococosis quística (43, 44). Sin embargo, nuestro conocimiento es muy limitado sobre los eventos apoptóticos en E. granulosus durante el desarrollo in vitro, basado en un enfoque específico de la etapa a lo largo del tiempo durante más de 100 días. La mayoría de los estudios in vitro e in vivo solo han evaluado la apoptosis en los microquistes y protoscoleces después de la exposición a ciertos agentes quimioterapéuticos como dexametasona, praziquantel, sulfóxido de albendazol y nanocompuestos (45-49).
Cabe señalar que en el contexto in vivo la biología de la interacción huésped-parásito es más compleja, por lo tanto, la interpretación de los resultados de las observaciones in vitro debe hacerse con precaución. Se requieren más estudios sobre las interacciones huésped-parásito y los efectos de las hormonas y citocinas en el desarrollo de quistes de E. granulosus en diferentes huéspedes intermediarios a nivel de vías de señalización, insulina e inhibidores de BMP, otras clases de BMP y estudios a nivel de transcriptoma. También se requieren estudios experimentales para investigar los resultados del bloqueo de los receptores de insulina y BMP en el crecimiento y desarrollo de E. granulosus.
Los hallazgos del presente estudio proporcionan evidencias de calcificación de los microquistes de E. granulosus en un cultivo in vitro a largo plazo, como lo revela el aumento significativo de los eventos apoptóticos y los métodos de tinción específicos de calcificación. También el estudio concluye que la insulina y la BMP-4 retrasan el proceso de deformación de los microquistes, la apoptosis y la calcificación. Los resultados presentan implicaciones importantes para mejorar nuestro conocimiento sobre la naturaleza de la calcificación del quiste hidatídico en los huéspedes y proporcionan un potencial para el diseño y desarrollo de fármacos.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio están incluidas en el artículo/Material complementario, las consultas posteriores pueden dirigirse al autor correspondiente.
Contribuciones de los autores
AD, SM y MF: conceptualización, diseño del estudio, validación de datos y redacción: preparación del borrador original. AD y SM: curación de datos y experimentos de laboratorio. AD, AK, SM y MF: análisis de datos. AD, MR, AA y MF: dinámica molecular. MF: adquisición de fondos. AD, SM, MR, AA, MM, SD y MF: revisión y aprobación final del manuscrito. Todos los autores contribuyeron al artículo y aprobaron la versión enviada.
Financiación
El presente estudio contó con el apoyo financiero del Vicerrector de Investigación y Tecnología de la Universidad de Ciencias Médicas de Kerman, Subvención Nº 99000144.
Reconocimientos
Los autores desean agradecer a Behnam Ebrahimi, del Departamento de Obstetricia y Ginecología de University of Texas Health San Antonio, TX, por su valiosa ayuda técnica. Un agradecimiento especial a S. Nasibi y H. Kamyabi por su amable asistencia durante todo el estudio y al personal veterinario del matadero municipal por recoger materiales de quistes hidatídicos.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2022.1068602/full#supplementary-material
Referencias
1. Craig PS, McManus DP, Lightowlers MW, Chabalgoity JA, Garcia HH, Gavidia CM, et al. Prevención y control de la equinococosis quística. Lancet infecta Dis. (2007) 7:385–94. doi: 10.1016/S1473-3099(07)70134-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Deplazes P, Rinaldi L, Rojas CA, Torgerson P, Harandi M, Romig T, et al. Distribución global de la equinococosis alveolar y quística. Adv Parasitol. (2017) 95:315–493. doi: 10.1016/bs.apar.2016.11.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Thompson R. Biología y sistemática del equinococo. Adv Parasitol. (2017) 95:65–109. doi: 10.1016/bs.apar.2016.07.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Rogan M, Bodell A, Craig P. Inmunidad post-enquistamiento/establecida en la equinococosis quística: ¿es realmente tan simple? Parásitos Inmunológicos. (2015) 37:1–9. doi: 10.1111/pim.12149
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Smyth J. Estudios sobre la fisiología de la tenia: XI. Cultivo in vitro de Echinococcus granulosus desde el protoscólex hasta la etapa de estrobilado. Parasitología. (1967) 57:111–33. doi: 10.1017/S0031182000071936
6. Smyth J, Howkins A, Barton M. Factores que controlan la diferenciación del organismo hidatídico, Echinococcus granulosus, en estadios quísticos o estrobilares in vitro. Naturaleza. (1966) 211:1374–7. doi: 10.1038/2111374a0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Thompson R, Jenkins D. Echinococcus como sistema modelo: biología y epidemiología. Int J Parasitol. (2014) 44:865–77. doi: 10.1016/j.ijpara.2014.07.005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Brehm K, Koziol U. Interacciones Echinococcus-huésped a nivel celular y molecular. Adv Parasitol. (2017) 95:147–212. doi: 10.1016/bs.apar.2016.09.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Brehm K. El papel de los sistemas de señalización conservados evolutivamente en el desarrollo de Echinococcus multilocularis y la interacción huésped-parásito. Med Microbiol Immunol. (2010) 199:247–59. doi: 10.1007/s00430-010-0154-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Brehm K. Echinococcus multilocularis como modelo experimental en la investigación con células madre y la interacción molecular huésped-parásito. Parasitol. (2010) 137:537–55. doi: 10.1017/S0031182009991727
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Pires-daSilva A, Sommer RJ. La evolución de las vías de señalización en el desarrollo animal. Nat Rev Genet. (2003) 4:39–49. doi: 10.1038/NRG977
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Gems D, Partridge L. Señalización y envejecimiento de la insulina/IGF: ver el panorama general. Curr Opin Genet Dev. (2001) 11:287–92. doi: 10.1016/S0959-437X(00)00192-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Kaletsky R, Murphy CT. El papel de la señalización similar a la insulina/IGF en la longevidad y el envejecimiento de C. elegans. Dis Models Mech. (2010) 3:415–9. doi: 10.1242/dmm.001040
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Teleman AA. Mecanismos moleculares de regulación metabólica por insulina en Drosophila. Biochem J. (2010) 425:13–26. doi: 10.1042/BJ20091181
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Konrad C, Kroner A, Spiliotis M, Zavala-Góngora R, Brehm K. Identificación y caracterización molecular de un gen que codifica un miembro de la familia de receptores de insulina en Echinococcus multilocularis. Int J Parasitol. (2003) 33:301–12. doi: 10.1016/S0020-7519(02)00265-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Hemer S, Konrad C, Spiliotis M, Koziol U, Schaack D, Förster S, et al. La insulina del huésped estimula las vías de señalización de la insulina y el desarrollo larvario de Echinococcus multilocularisinsulina. BMC Biol. (2014) 12:1–22. doi: 10.1186/1741-7007-12-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Ahier A, Khayath N, Vicogne J, Dissous C. Receptores de insulina y captación de glucosa en el parásito humano Schistosoma mansoni. Parásito. (2008) 15:573–9. doi: 10.1051/parásito/2008154573
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Khayath N, Vicogne J, Ahier A, BenYounes A, Konrad C, Trolet J, et al. Diversificación de la familia de receptores de insulina en el parásito helmintos Schistosoma mansoni. FEBS J. (2007) 274:659–76. doi: 10.1111/j.1742-4658.2006.05610.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. You H, Zhang W, Jones MK, Gobert GN, Mulvenna J, Rees G, et al. Clonación y caracterización de receptores de insulina de Schistosoma japonicum. PLoS UNO. (2010) 5:e9868. doi: 10.1371/journal.pone.0009868
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Du X, Jones MK, Nawaratna SS, Ranasinghe S, Xiong C, Cai P, et al. La expresión génica en las etapas de desarrollo de Schistosoma japonicum proporciona más información sobre la importancia del péptido similar a la insulina Schistosom. Int J Mol Sci. (2019) 20:1565. doi: 10.3390/ijms20071565
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Xiao YT, Xiang LX, Shao JZ. Proteína morfogenética ósea. Biochem Biophys Res Commun. (2007) 362:550–3. doi: 10.1016/j.bbrc.2007.08.045
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Freitas TC, Jung E, Pearce EJ. Un homólogo de proteína morfogenética ósea en el gusano plano parásito, Schistosoma mansoni. Int J Parasitol. (2009) 39:281–7. doi: 10.1016/j.ijpara.2008.08.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Epping K, Brehm K. Echinococcus multilocularis: caracterización molecular de EmSmadE, un nuevo BR-Smad implicado en la señalización de TGF-β y BMP. Exp parasitol. (2011) 129:85–94. doi: 10.1016/j.exppara.2011.07.013
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Zavala-Góngora R, Kroner A, Bernthaler P, Knaus P, Brehm K, A. miembro de la familia de receptores del factor de crecimiento transformante-ß de Echinococcus multilocularis es activado por la proteína morfogenética ósea humana 2. Mol Biochem Parasitol. (2006) 146:265–71. doi: 10.1016/j.molbiopara.2005.12.011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Smyth J, Davies Z. Cultivo in vitro de la etapa estrobilar de Echinococcus granulosus (cepa de oveja): una revisión de los problemas básicos y los resultados. Int J Parasitol. (1974) 4:631–44. doi: 10.1016/0020-7519(74)90028-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Mousavi SM, Afgar A, Mohammadi MA, Mortezaei S, Sadeghi B, Harandi MF. El ARN interferente pequeño específico de calmodulina induce una supresión consistente de la expresión y cambios morfológicos en Echinococcus granulosus. Sci Rep. (2019) 9:1–9. DOI: 10.1038/s41598-019-40656-w
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Burry RW. Inmunocitoquímica. Medios de comunicación de Springer Sci Bus. (2009) 10:978–1. doi: 10.1007/978-1-4419-1304-3_1
28. Gregory CA, Gunn WG, Peister A, Prockop DJ. Un ensayo basado en rojo de alizarina de la mineralización por células adherentes en cultivo: comparación con la extracción con cloruro de cetilpiridinio. Bioquímica anal. (2004) 329:77–84. doi: 10.1016/j.ab.2004.02.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Faridi A, Mansouri M, Macchiaroli N, Afgar A, Mousavi SM, Rosenzvit MC, et al. Harandi, Perfil de microARN de los gusanos estrobilados de Echinococcus granulosus derivado de sistemas in vivo e in vitro mediante el uso de un enfoque de alto rendimiento. Parasitol Res. (2021) 120:3203–14.
30. Yan Y, Zhang D, Zhou P, Li B, Huang SY. HDOCK, un servidor web para el acoplamiento proteína-proteína y proteína-ADN/ARN basado en una estrategia híbrida. Ácidos nucleicos Res. (2017) 45:W365–W73. doi: 10.1093/nar/gkx407
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Abraham MJ, Murtola T, Schulz R, Páll S, Smith JC, Hess B, et al. GROMACS: Simulaciones moleculares de alto rendimiento a través del paralelismo multinivel de computadoras portátiles a supercomputadoras. SoftwareX. (2015) 1:19–25. doi: 10.1016/j.softx.2015.06.001
32. Grupo WIW. Clasificación internacional de las imágenes ecográficas en la equinococosis quística para su aplicación en entornos clínicos y epidemiológicos de campo. Acta Trop. (2003) 85:253–61. doi: 10.1016/S0001-706X(02)00223-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Infección por Kern P. Echinococcus granulosus: presentación clínica, tratamiento médico y evolución. Arco de Langenbeck Surg. (2003) 388:413–20. doi: 10.1007/s00423-003-0418-y
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Salomón N, Kachani M, Zeyhle E, Macpherson C. Evolución natural de la equinococosis quística en pacientes no tratados y tratados con albendazol. Acta Trop. (2017) 171:52–7. doi: 10.1016/j.actatropica.2017.03.018
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Castro GA. Helmintos: estructura, clasificación. trematodos de crecimiento y desarrollo. En:Barón S, , editor. Microbiología Médica. 4ª ed. Galveston, TX: Rama Médica de la Universidad de Texas en Galveston (1996).
36. Liu R, Zhao QP, Ye Q, Xiong T, Tang CL, Dong Hf, et al. Clonación y caracterización de una proteína morfogenética ósea homóloga de Schistosoma japonicum. Exp parasitol. (2013) 135:64–71. doi: 10.1016/j.exppara.2013.05.016
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Du X, McManus DP, Cai P, Hu W, You H. Identificación y caracterización funcional de un péptido similar a la insulina Schistosoma japonicum. Vectores parásitos. (2017) 10:1–12. doi: 10.1186/s13071-017-2095-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Cheng Z, Liu F, Li X, Dai M, Wu J, Guo X, et al. La vía de señalización EGFR/ERK mediada por EGF promueve la proliferación de células germinativas en Echinococcus multilocularis que contribuye al crecimiento y desarrollo de las larvas. PLoS negl trop dis. (2017) 11:E0005418. doi: 10.1371/journal.pntd.0005418
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Canclini L, Esteves A. Respuesta in vivo de Mesocestoides vogae a la insulina humana. Parasitología. (2009) 136:203–9. doi: 10.1017/S003118200800526X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Escobedo G, Romano M, Morales-Montor J. Efectos diferenciales in vitro de la insulina sobre Taenia crassiceps y Taenia solium cysticerci. J Helminthol. (2009) 83:403–12. doi: 10.1017/S0022149X09990265
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Adalid-Peralta L, Rosas G, Arce-Sillas A, Bobes RJ, Cárdenas G, Hernández M, et al. Efecto de la transformación del factor de crecimiento-β sobre Taenia solium y Taenia crassiceps cysticerci. (2017) 7:1–13. doi: 10.1038/s41598-017-12202-z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. Vanderstraete M, Gouignard N, Cailliau K, Morel M, Lancelot J, Bodart J-F, et al. Doble diana de los receptores de insulina y venus quinasa de Schistosoma mansoni para una nueva terapia antiesquistosoma. PLoS negl trop dis. (2013) 7:E2226. doi: 10.1371/journal.pntd.0002226
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Spotin A, Majdi MMA, Sankian M, Varasteh A. El estudio de los efectos bifuncionales apoptóticos en la relación entre el huésped y el parásito en la equinococosis quística: un nuevo enfoque para la supresión y supervivencia del quiste hidatídico. Parasitol Res. (2012) 110:1979–84. doi: 10.1007/s00436-011-2726-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Paredes R, Jiménez V, Cabrera G, Iragüen D, Galanti N. Apoptosis como posible mecanismo de infertilidad en quistes hidatídicos de Echinococcus granulosus. J Cell Biochem. (2007) 100:1200–9. doi: 10.1002/jcb.21108
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Hu H, Kang J, Chen R, Mamuti W, Wu G, Yuan W. Apoptosis inducida por fármacos de Echinococcus granulosus protoscoleces. Parasitol Res. (2011) 109:453–9. doi: 10.1007/s00436-011-2276-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
46. Xing G, Wang B, Lei Y, Liu C, Wang Z, Shi H, et al. Efecto in vitro del arsenito de sodio en Echinococcus granulosus protoscoleces. Mol Biochem Parasitol. (2016) 207:49–55. doi: 10.1016/j.molbiopara.2016.05.011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
47. Naseri M, Akbarzadeh A, Spotin A, Akbari NAR, Mahami-Oskouei M, Ahmadpour E. Actividades escolicidas y apoptóticas del sulfóxido de albendazol y el PLGA-PEG cargado con sulfóxido de albendazol como una nueva partícula nanopolimérica contra Echinococcus granulosus protoscoleces. Parasitol Res. (2016) 115:4595–603. doi: 10.1007/s00436-016-5250-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
48. Shi H, Lei Y, Wang B, Wang Z, Xing G, Lv H, et al. Efectos protoescolicidas del ácido quenodesoxicólico en protoscoleces de Echinococcus granulosus. Exp parasitol. (2016) 167:76–82. doi: 10.1016/j.exppara.2016.05.004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: degeneración, calcificación, apoptosis, factor de crecimiento, proteína morfogenética ósea (BMP), hidatidosis
Cita: Derakhshani A, Mousavi SM, Rezaei M, Afgar A, Keyhani AR, Mohammadi MA, Dabiri S y Fasihi Harandi M (2023) Historia natural del desarrollo de microquistes de Echinococcus granulosus en cultivo in vitro a largo plazo y cambios moleculares y morfológicos inducidos por insulina y BMP-4. Frente. Vet. Sci. 9:1068602. doi: 10.3389/fvets.2022.1068602
Recibido: 13 de octubre de 2022; Aceptado: 19 de diciembre de 2022;
Publicado: 09 Enero 2023.
Editado por:
Vikrant Sudan, Universidad de Ciencias Veterinarias y Animales Guru Angad Dev, India
Revisado por:
Bersissa Kumsa, Universidad de Addis Abeba, Etiopía
Siju Susan Jacob, Consejo Indio de Investigación Agrícola (ICAR), India
Peter Deplazes, Universidad de Zúrich, Suiza
Derechos de autor © 2023 Derakhshani, Mousavi, Rezaei, Afgar, Keyhani, Mohammadi, Dabiri y Fasihi Harandi. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Majid Fasihi Harandi,  fasihi@kmu.ac.ir
fasihi@kmu.ac.ir
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía