Evaluación de la calidad microbiana en el agua potable de las aves de corral en granjas de Austria
Evaluación de la calidad microbiana en el agua potable de las aves de corral en granjas de Austria
 Azra Mustedanagic1,2
Azra Mustedanagic1,2  Monika Matt3
Monika Matt3  Karin Weyermair4
Karin Weyermair4  Anna Schrattenecker2
Anna Schrattenecker2  Isabella Kubitza2
Isabella Kubitza2  Clair L. Firth5
Clair L. Firth5  Igor Loncaric6
Igor Loncaric6  Martín Wagner1,2
Martín Wagner1,2  Beatrix Stesl2*
Beatrix Stesl2*- 1FFoQSI GmbH-Centro de Competencia Austriaco para la Calidad, Seguridad e Innovación de Piensos y Alimentos, Tulln, Austria
- 2Unidad de Microbiología de los Alimentos, Instituto de Seguridad Alimentaria, Tecnología de los Alimentos y Salud Pública Veterinaria, Universidad de Medicina Veterinaria de Viena, Viena, Austria
- 3Departamento de Estadística y Epidemiología Analítica, Agencia Austriaca de Salud y Seguridad Alimentaria (AGES), Innsbruck, Austria
- 4Departamento de Estadística y Epidemiología Analítica, Agencia Austriaca de Salud y Seguridad Alimentaria (AGES), Graz (Austria)
- 5Unidad de Salud Pública Veterinaria y Epidemiología, Instituto de Seguridad Alimentaria, Tecnología de los Alimentos y Salud Pública Veterinaria, Universidad de Medicina Veterinaria de Viena, Viena, Austria
- 6Instituto de Microbiología, Departamento de Patobiología, Universidad de Medicina Veterinaria de Viena, Viena, Austria
La calidad del agua potable de las aves de corral tiene un efecto significativo en la salud y el rendimiento de los pollos de engorde. Este estudio llevó a cabo un análisis de los recuentos aeróbicos mesófilos (AMC), Enterobacteriaceae (EB), Pseudomonadaceae (PS) y examinó la presencia de Campylobacter spp. en muestras de agua recogidas de un total de 14 granjas en Austria, con una fuente de agua pública o privada. Se evaluó la eficacia de dos métodos de tratamiento de las líneas de agua: un tratamiento químico de las líneas de agua con 4.0 ppm de ClO2 (T1) y una sustancia química combinada (4,0 ppm de ClO activo2 y ácido peracético al 3,0%) y tratamiento mecánico (purga de las líneas de agua con una bomba de aire de alta presión; T2). Sin embargo, tanto el tratamiento T1 como el T2 no lograron reducir los recuentos de AMC por debajo del límite microbiano máximo aceptable de 4,0 log10 UFC/ml en muestras de agua. Además, no se observó una reducción significativa en los recuentos de EB y PS en las muestras de agua después del tratamiento de la línea de agua T1 o T2. Las muestras de agua mostraron un alto nivel de diversidad microbiana con 18 a 26 géneros diferentes. El género Pseudomonas se aisló con mayor frecuencia en todas las granjas avícolas, mientras que Campylobacter jejuni se identificó en una sola muestra recolectada antes del tratamiento de la línea de agua. El análisis de aislamientos reveló la presencia de patógenos oportunistas en las muestras de agua tanto antes (T1 43,1%, T2 30,9%) como después (T1 36,3%, T2 33,3%) del tratamiento de la línea de agua. Los patógenos oportunistas pertenecientes a géneros como Pseudomonas spp., Stenotrophomonas spp. y Ochrobactrum spp. se aislaron con mayor frecuencia del agua de bebida de las aves de corral. Estos aislados mostraron multirresistencia y fenotipos de resistencia a los antimicrobianos comúnmente utilizados en las granjas avícolas austriacas. Los hallazgos de este estudio enfatizan el riesgo potencial de exposición a patógenos oportunistas para las aves de corral y el personal, subrayando la importancia de un manejo eficiente de la línea de agua.
1 Introducción
Las aves de corral son una de las principales fuentes de producción de carne en todo el mundo (1). En 2020, se procesaron más de 97 millones de pollos en Austria, lo que representa 124.000 toneladas de carne de ave procesada (2). El agua potable es un nutriente vital para las aves de corral comerciales y tiene un impacto significativo en la salud de las aves de corral, el peso vivo, los índices de conversión alimenticia y el rendimiento general (3, 4). El consumo de agua de las aves de corral es aproximadamente el doble de la cantidad de alimento ingerido (5). La salud de las aves de corral y la ingesta de agua están directamente influenciadas por la calidad microbiana del agua (4, 6, 7).
En Europa, las normas de calidad del agua para el agua potable de las aves de corral se han adaptado a partir de las normas sobre la calidad del agua destinadas al consumo humano de agua potable (8), la Directiva 98/83/CE de la CE (Directiva sobre el agua potable [DWD] 9). De conformidad con el Reglamento austriaco sobre la higiene de las aves de corral (10), el agua potable utilizada para la producción avícola no debe superar un recuento mesófilo aeróbico total (AMC) de 2,0 log10 y 1.3 log10 unidades formadoras de colonias (UFC/ml) a 22°C y 37°C, respectivamente. En la actualidad, no existe ningún requisito legal para examinar la contaminación microbiana dentro de las líneas de agua potable (11). Por lo tanto, el mantenimiento de la higiene de la línea de agua es principalmente responsabilidad del productor avícola y, por lo general, se lleva a cabo entre los ciclos de producción (12). Las prácticas estándar de las líneas de agua implican la limpieza mecánica mediante el lavado de las líneas de agua, seguida de la desinfección oxidativa, principalmente mediante cloración o acidificantes (7, 12-14).
Si bien el tratamiento de las líneas de agua es un componente crucial de un programa de bioseguridad eficaz, su eficacia no garantiza la eliminación completa de los microorganismos dentro de las líneas de agua (15-17). Se han detectado Escherichia coli, Salmonella spp. y Campylobacter spp. en el agua potable de las aves de corral (7, 18). Se ha encontrado que las temperaturas elevadas y los bajos caudales de agua en los sistemas de tuberías de agua cerradas afectan negativamente la calidad del agua, como lo indican estudios previos (4, 12). Estas condiciones son favorables para la acumulación de sustancias orgánicas disueltas, minerales y partículas sólidas, que facilitan el crecimiento y promueven la formación de biopelículas. Entre las bacterias formadoras de biopelículas, principalmente Pseudomonas y Stenotrophomonas son responsables de la formación de biopelículas en las superficies de los bebederos de aves de corral (12). Las biopelículas pueden proporcionar una superficie favorable para la adhesión de patógenos oportunistas (OP), como Acinetobacter, Aeromonas, Citrobacter, Enterobacter y Klebsiella, cuyos miembros son habitantes naturales de los sistemas de plomería y están adaptados a la supervivencia en el agua potable (19). Aunque estas bacterias generalmente no son patógenas, algunas tienen el potencial de causar infecciones en aves de corral y trabajadores agrícolas susceptibles (20). Por lo tanto, el desprendimiento de biopelículas ricas en patógenos y OP y su contaminación del sistema hídrico presentan un riesgo significativo para la transmisión de estas bacterias a través del agua, lo que representa una amenaza potencial tanto para las aves de corral como para la salud humana. Además, la administración de medicamentos a las aves de corral a través del agua potable, que es una vía preferida, se ha relacionado con la presencia de bacterias multirresistentes (MDR) (21, 22).
La calidad microbiana del agua se evalúa con frecuencia en su fuente, pero las evaluaciones al final de las líneas de agua potable son poco frecuentes, a pesar de la posibilidad de variaciones sustanciales en la calidad microbiana entre la fuente y el punto final (12). Por lo tanto, el objetivo de este estudio fue evaluar la calidad microbiana de las muestras de agua recolectadas al final de un ciclo de producción de cinco a seis semanas y poco antes de la reposición para el ciclo de producción posterior, después del tratamiento de la línea de agua. Estudios previos han demostrado la presencia de patógenos como Campylobacter spp. en el agua de las aves de corral en granjas con suministro privado de agua en comparación con aquellas con suministro público (23, 24). Esto pone de relieve el papel fundamental del agua potable de las aves de corral como fuente potencial de infección por Campylobacter spp. en la granja (25, 26). La presencia de Campylobacter spp. en el agua potable de las granjas avícolas puede indicar fallas en la bioseguridad, fuente de agua contaminada, procedimientos de limpieza de tuberías de agua ineficaces y/o aplicados incorrectamente (11, 18). Por lo tanto, uno de nuestros objetivos fue evaluar la calidad microbiana del agua potable de las aves de corral en granjas con suministro de agua público o privado. Aplicamos métodos de referencia basados en ISO para evaluar la carga bacteriana y la presencia de Campylobacter spp. en el agua de bebida de las aves de corral, seguidos de la secuenciación parcial del ARNr 16S de los aislados bacterianos. A continuación, se determinaron los patrones de susceptibilidad a los antibióticos de los OP comúnmente aislados.
2 Materiales y métodos
2.1 Tratamiento de la línea de agua y recogida de muestras
Entre mayo de 2019 y agosto de 2020, veintiocho granjas avícolas que producían pollos de engorde para mataderos locales en Austria participaron voluntariamente en el estudio, algunas de las cuales tenían suministros de agua privados (n = 11) y otros públicos (n = 17). El período de engorde en las granjas avícolas participantes en Austria fue de cinco a seis semanas. Las granjas avícolas se dividieron en dos grupos distintos en función de si las granjas empleaban únicamente métodos de tratamiento de líneas de agua químicos (T1) o una combinación de químicos y mecánicos (T2). En la Figura 1 se presenta una visión general de las granjas avícolas incluidas en el estudio. La limpieza y el tratamiento de la línea de agua en las granjas avícolas fueron realizados por el granjero. Dado que la participación de las granjas avícolas en el estudio fue voluntaria, las granjas avícolas 6, 8, 9, 12 y 13 retiraron su participación después de la T1 y fueron sustituidas por las granjas avícolas 15-19 durante la T2. El estudio se llevó a cabo en colaboración con un laboratorio privado (HYGIENICUM GmbH, Graz, Austria), que impartió formación a los ganaderos participantes sobre los procedimientos de limpieza de las tuberías de agua que se aplicarán en las granjas avícolas.
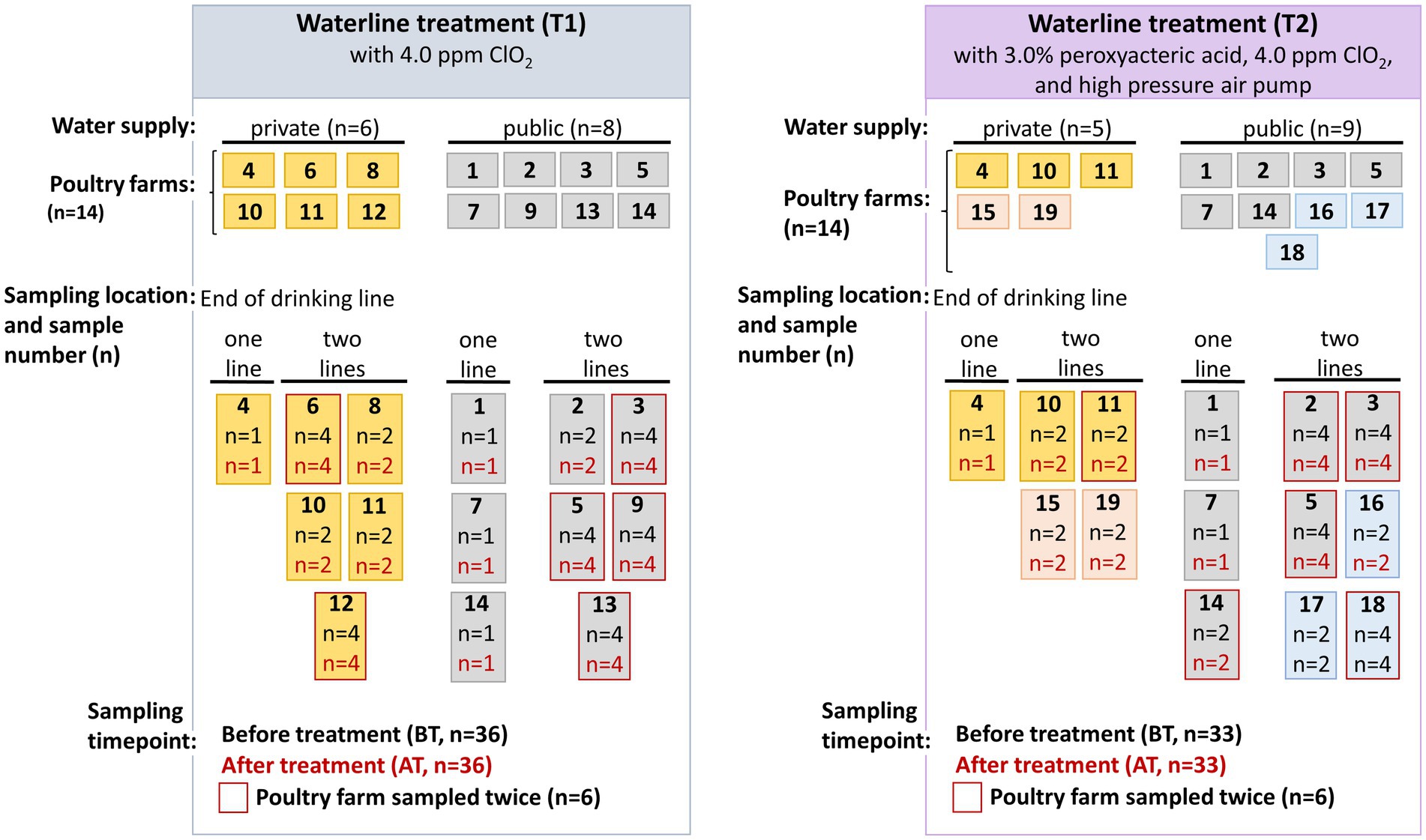 Figura 1. Una visión general del muestreo realizado en catorce granjas avícolas durante el tratamiento químico (T1) y combinado de la línea de agua química con mecánica (T2). Las granjas avícolas 6, 8, 9, 12 y 13 retiraron su participación después de T1 y fueron sustituidas por las granjas avícolas 15 y 19 (indicadas con color rosa) con suministro privado de agua, y 16-18 (indicado con color azul) con suministro público de agua durante el muestreo de la línea de agua T2.
Figura 1. Una visión general del muestreo realizado en catorce granjas avícolas durante el tratamiento químico (T1) y combinado de la línea de agua química con mecánica (T2). Las granjas avícolas 6, 8, 9, 12 y 13 retiraron su participación después de T1 y fueron sustituidas por las granjas avícolas 15 y 19 (indicadas con color rosa) con suministro privado de agua, y 16-18 (indicado con color azul) con suministro público de agua durante el muestreo de la línea de agua T2.
Durante el tratamiento de la línea de agua T1, las líneas de agua se drenaron y se llenaron con una solución disponible comercialmente cuyo principal componente desinfectante contenía 4.0 ppm de dióxido de cloro activo (ClO2) (Calgonit CD-K1/K2, Calvatis GmbH, Ladenburg, Alemania). La solución comercial se mantuvo en las líneas de agua durante 24 h. Mediciones de ClO libre2 En el interior no se obtuvieron las líneas de flotación. Posteriormente, las líneas de agua se lavaron con el agua de suministro mediante lavado continuo durante 10 min. En condiciones normales de funcionamiento. La línea de agua T2 se realizó mediante el bombeo continuo de un limpiador ácido que contenía ácido peroxiacético (PAA) al 3,0% y peróxido de hidrógeno (Calgonit DS 625, Calvatis GmbH, Ladenburg, Alemania) de forma continua durante 30 minutos utilizando una bomba de aire a alta presión. A continuación, las tuberías de agua se lavaron con el agua de suministro y se purgaron con una bomba de aire de alta presión hasta que no se vieran restos inorgánicos y orgánicos en el agua. Posteriormente, la desinfección de la línea de agua se realizó utilizando una solución de desinfección comercial que contenía 4,0 ppm de ClO activo2 solución (Calgonit CD-K1/K2) que se retuvo en las líneas de agua durante 24 h. Posteriormente, las líneas de agua se lavaron con agua de suministro mediante lavado durante 10 min. En condiciones normales de funcionamiento.
Las muestras de agua fueron recogidas por empleados del laboratorio privado, las muestras se tomaron de la boquilla final de la línea de agua potable dentro del gallinero vacío (HYGIENICUM GmbH, Graz, Austria). Se muestreó una línea de agua en cuatro y cinco granjas avícolas, mientras que dos líneas de agua (línea 1 y 2) se muestrearon en diez y nueve granjas avícolas durante los tratamientos de las líneas de agua T1 y T2 (Figura 1). Se eligieron dos puntos de tiempo de muestreo, a saber, antes del tratamiento (BT) al final del período de engorde de 5 a 6 semanas, y después del tratamiento de la línea de agua (AT) antes de la reposición del ciclo de producción posterior. Como se muestra en la Figura 1 y en la Tabla Suplementaria S1, en seis granjas avícolas durante el tratamiento de las líneas de agua T1 y T2, se recolectaron muestras de agua en dos intervalos de muestreo diferentes, mientras que otras granjas avícolas se muestrearon solo una vez. Además, en algunas granjas avícolas de algunas líneas de agua se recolectaron muestras duplicadas, mientras que en otras granjas avícolas solo se recolectó una sola muestra. Por lo tanto, en total se recolectaron 36 (T1) y 33 (T2) muestras de BT y AT correspondientes para el análisis microbiano en el presente estudio. Las muestras de agua fueron recogidas en frascos estériles de 500 ml por el laboratorio privado y transportadas inmediatamente al laboratorio a 4°C para su análisis microbiano.
2.2 Procesamiento de muestras y análisis microbiano
Antes del análisis, se centrifugaron 500 ml de muestras de agua a 8000 rpm durante 30 min a 4 °C (centrífuga Thermo Scientific, Sorvall Lynx 4000). Se descartaron todos menos 10 mL del sobrenadante, el resto se resuspendió con una pipeta serológica de 10 mL (Greiner Bio One, Frickenhausen, Alemania) y se agitó en vórtice durante 30 s.
El enriquecimiento selectivo y el aislamiento de Campylobacter se realizaron de acuerdo con la norma ISO 10272-1:2006 para la detección de Campylobacter spp. en productos alimenticios (27). Se transfirieron cinco mililitros del sobrenadante a 45 ml de caldo Bolton (Thermo Fisher Scientific Ltd., Hampshire, Reino Unido) suplementado con un 5% de sangre de caballo hemolizada (Oxoid Ltd., Hampshire, Reino Unido). El enriquecimiento del caldo Bolton se incubó hasta 48 h a 42 °C en condiciones microaeróbicas (10% CO2, 3% O2, 87% N2). Después de la incubación, el agar desoxicolato de cefoperazona modificado (mCCDA) (Oxoid Ltd) se inoculó mediante inoculación fraccionada en asa (10 μL) y se incubó a 42 °C durante 48 h en condiciones microaeróbicas. La cuantificación de los recuentos aeróbicos mesófilos (AMC), enterobacteriaceae (EB) y pseudomonadaceae (PS) se realizó de acuerdo con los métodos de referencia ISO (28, 29). Para la enumeración de AMC, EB y PS, se transfirieron 5 mL del sobrenadante resuspendido a 45 mL de agua de peptona tamponada (BPW) (Biokar Solabia diagnostics, Pantin Cedex, Francia). Posteriormente, se prepararon diluciones seriadas diez veces hasta la dilución 10−5 en BPW (Biokar Solabia diagnostics, Pantin Cedex, Francia). Los AMC se enumeraron en agar de soja triptocaseína con extracto de levadura al 0,6% (TSAYE) (Biokar Solabia diagnostics), mientras que EB y PS se enumeraron en agar glucosa biliar roja (VRBG) (Merck KGaA, Darmstadt, Alemania). Cada paso de dilución (100 μL) se sembró en medio de agar selectivo para la enumeración de los recuentos de AMC, EB y PS. Para dilución 10−1 el volumen de 1 mL se dividió (333 μL) en tres placas de agar por medio selectivo. Las placas de agar se incubaron a 30 °C (AMC) y 37 °C (EB, PS) aeróbicamente durante un máximo de 48 h. Los recuentos de EB y PS en agar VRGB se diferenciaron por su capacidad para fermentar glucosa, lo que dio lugar a colonias rosadas con o sin precipitación y colonias pálidas para PS. Los presuntos aislamientos de EB y PS se confirmaron mediante reacción de oxidasa (BioMerieux, Marcy I’Etoile, Francia). Los límites mínimo y máximo para la determinación de AMC, EB y PS en las muestras oscilaron entre 10 y 300 UFC.
La calidad microbiana de las muestras de agua antes (BT) y después del saneamiento (AT) se categorizó de acuerdo con la carga de AMC, EB y PS en dos niveles de contaminación, <4.0 log10 UFC/ml y registro de ≥4.010 UFC/ml según estudios existentes (4, 7, 12).
2.3 Aislamiento e identificación de aislados bacterianos y de Campylobacter spp.
Las morfologías de las colonias bacterianas predominantes se recogieron de cada muestra de agua para su posterior confirmación. Específicamente, se seleccionaron de 1 a 5 colonias de TSAYE (n = 224), VRBG (n = 206) y agar mCCDA (n = 41) y luego se subcultivaron en el medio respectivo. La lista de aislamientos se proporciona en la Tabla Suplementaria S1. Las colonias purificadas, que comprenden aislados de muestras de T1 BT (n = 123), muestras de T1 AT (n = 113), muestras de T2 BT (n = 139), muestras de T2 AT (n = 96) se almacenaron a -80 °C en caldo de infusión cerebro-corazón (diagnóstico Biokar Solabia) suplementado con glicerol al 25% (v/v) (Merck KgaA).
Para la extracción de ADN de aislados de Campylobacter spp., se resuspendió un bucle de 10 μL de material bacteriano en 100 μL de tampón Tris-HCl de 0,1 M pH 7 (Sigma Aldrich, St. Louis, MO, Estados Unidos) y se mezcló con 400 μL de resina Chelex® 100 (BioRad, Hercules, CA, Estados Unidos) (30). La suspensión bacteriana de resina Chelex® 100 se calentó a 100 °C durante 10 minutos en un calentador de bloque (Thermo Fischer Scientific Inc.), seguido de un breve paso de centrifugación a 15.000 ×g (centrífuga Eppendorf 5.425) durante 5 s. El sobrenadante (100 μL) se transfirió a un tubo de máxima recuperación (Corning Incorporated Life Sciences, Reynosa, México) y se almacenó a -20°C hasta su análisis. Campylobacter spp. se identificó mediante PCR múltiple dirigida a genes que incluyen el gen 23S rRNA específico del género conservado, el gen Campylobacter jejuni hippuricase (hipO) y el gen Campylobacter coli serina hidroximetiltransferasa (glyA), como se describió anteriormente (31). Brevemente, una sola mezcla de reacción (20 μL) contenía agua tratada con dietilpirocarbonato (DEPC) (Sigma Aldrich), 1× tampón PCR, 2 mM MgCl2, cebador directo e inverso de hipO de 500 nm, cebador directo e inverso de 1.000 glyA, cebador directo e inverso 200S de 23 nm, mezcla de dNTP de 200 μM, 1,5 U de ADN polimerasa de platino Taq (ADN polimerasa de platino Taq, sin DNA, Thermo Fisher Scientific Inc., Waltham, MA, Estados Unidos) y ADN™ genómico plantilla de 5 μL. La amplificación se realizó en termociclador T100™ (Bio-Rad, Hércules, CA, Estados Unidos). Las condiciones del ciclo de PCR incluyeron desnaturalización inicial a 94 °C durante 2 min, 30 ciclos de desnaturalización (94 °C durante 30 s), recocido de cebador (59 °C durante 30 s), elongación (72 °C durante 30 s) y elongación final (72 °C durante 7 min). La electroforesis en gel de los amplicones de PCR se realizó en un gel de agarosa al 1,5% que contenía un 0,5× tampón TrisBorateEDTA (TBE) (Sigma Aldrich, St. Louis, MO, Estados Unidos) y 3,5 μL de tinción en gel de ADN peqGREEN (VWR International, Radnor, Estados Unidos), a 120 V durante 30 min. Se aplicó el estándar de ADN Thermo Scientific GeneRuler™ 100 pb (Thermo Fisher Scientific™ Inc., Waltham, Estados Unidos) para la comparación de la longitud de los fragmentos. Para la extracción de ADN y la PCR múltiple se utilizaron los siguientes aislamientos de control: cepa DSM 4688 de C. jejuni y cepa DSM 4689 de C. coli, obtenidas de la Deutsche Sammlung von Mikroorganismen und Zellkulturen (DSMZ), Braunschweig, Alemania.
Para la extracción de ADN de aislados de TSAYE y VRBG, las células bacterianas se lisaron hirviendo la suspensión. Se volvió a suspender un bucle de 10 μl de material bacteriano en un tampón Tris-HCl de pH 100 de 0 μl de 1,7 m (Sigma Aldrich, St. Louis, MO, Estados Unidos), se agitó brevemente en vórtice y se calentó a 100 °C durante 15 min (calentador de bloque Thermo Scientific™, Thermo Fischer Scientific Inc.). A continuación, la suspensión se centrifugó durante 5 s a 15.000 ×g (Centrífuga Eppendorf 5.425, Hamburgo, Alemania) y el sobrenadante (70 μL) se transfirió a tubos de máxima recuperación (Corning Incorporated Life Sciences, Reynosa, México) y se almacenó a -20 °C hasta el análisis. Para la identificación de aislados bacterianos (n = 471) se realizó la amplificación parcial del gen 16S rRNA siguiendo los métodos de (32, 33), utilizando los pares de cebadores universales 616F (5’AGAGTTTGATYMTGGCTC3′) y 1492R (5’GGYTACCT TGTTACGACTT3′) (ambos Microsynth AG, Blagach, Suiza). Una sola reacción de PCR (45 μL) contenía 1× tampón de PCR, 2 mM de MgCl2, cebador directo e inverso de 200 nM, mezcla de dNTP de 250 μM, 2 U de ADN polimerasa de platino Taq (ADN polimerasa de platino Taq, sin ADN, Thermo Fisher Scientific Inc.) y 5 μL de ADN™ genómico plantilla. La amplificación del ADN se realizó en el termociclador T100™ (BioRad, Hercules, CA, Estados Unidos). Las condiciones cíclicas de la PCR incluyeron desnaturalización inicial a 95 °C durante 5 min, 35 ciclos de desnaturalización (94 °C durante 30 s), recocido de cebador (52 °C durante 30 s), elongación (72 °C durante 60 s) y elongación final (72 °C durante 7 min). Posteriormente, los amplicones de PCR se enviaron para su purificación y secuenciación a LGC Genomics (LGC Genomics GmbH, Berlín, Alemania). La electroforesis en gel de los amplicones de PCR se realizó en un gel de agarosa al 1,5 % que contenía un 0,5 × de tampón TrisBorateEDTA (TBE) (Sigma Aldrich, St. Louis, MO, Estados Unidos) y 3,5 μL de tinción en gel de ADN peqGREEN (VWR International, Radnor, Estados Unidos), a 120 V durante 30 min. Se aplicó el estándar de ADN Thermo Scientific GeneRuler™ 100 pb (Thermo Fisher Scientific™ Inc., Waltham, Estados Unidos) para la comparación de la longitud de los fragmentos. Los amplicones de PCR se secuenciaron utilizando un cebador 1492R (5’GGYTACCTTGTTACGACTT3′). La calidad de las secuencias de nucleótidos se evaluó mediante el uso de Finch TV 1.4.0 (34) y MEGA X (35). El algoritmo de la Herramienta Básica de Búsqueda de Alineación Local (BLAST) de nucleótidos bacterianos del Centro Nacional de Información Biotecnológica (NCBI)1 se utilizó para la asignación de taxonomía. Las secuencias se asignaron a nivel de género o especie de acuerdo con las mejores coincidencias y las similitudes más altas (longitud del fragmento de 1.040 a 1.120 pb, punto de corte de similitud ≥97,0%). Los datos parciales de la secuencia del gen ARNr de los aislados se depositaron en la base de datos GenBank con los números de acceso MZ642358 a MZ643011.2 La identificación posterior de patógenos oportunistas entre los aislados identificados se realizó utilizando la base de metadatos bacterianos BacDive (36) y la Lista de nombres procariotas con Standing in Nomenclature (LPSN) (37).
2.4 Pruebas de sensibilidad a los antimicrobianos
Los patógenos oportunistas con relevancia clínica aislados de muestras de agua durante el tratamiento de las líneas de agua T1 y T2 se sometieron a pruebas de susceptibilidad antimicrobiana (AST). El conjunto de aislados incluyó OP aislados con mayor frecuencia, como Pseudomonas spp. (n = 17), Ochrobactrum spp. (n = 4), Stenotrophomonas spp. (n = 3) y patógenos oportunistas humanos relevantes como Citrobacter spp. (n = 2), Enterobacter spp. (n = 2), Klebsiella spp. (n = 1) y Aeromonas spp. (n = 1).
Se realizó AST para un total de 30 aislamientos bacterianos utilizando Sensititre™ Avian AVIAN1F Vet AST Plate (ThermoFischer Scientific Inc., Waltham, MA, Estados Unidos), de acuerdo con las instrucciones del fabricante. Brevemente, se recogieron colonias individuales de cultivos frescos cultivados en TSAYE durante 24 h a 30 °C, suspendidas en agua estéril a una densidad óptica de 0,5 estándar McFarland (~ 108 UFC/ml). Se transfirieron volúmenes de 50 μl de la suspensión bacteriana a pocillos que contenían diferentes concentraciones de antimicrobianos liofilizados. Las placas se sellaron y se incubaron a 30 °C durante 24 a 48 h, tras lo cual se leyeron visualmente las concentraciones inhibitorias mínimas (CMI) y se definieron como la concentración más baja de un antibiótico determinado en la que no se observó crecimiento del organismo de ensayo. Se utilizó la cepa de E. coli ATCC 25922 como aislado de control de calidad interno. Los puntos de corte de la concentración inhibitoria mínima (CMI) y las definiciones de resistencia a múltiples fármacos (MDR; resistencia a dos o más clases de antibióticos) (38) se determinaron siguiendo los estándares proporcionados por los manuales del Instituto de Estándares Clínicos y de Laboratorio (CLSI) (39-41).
2.5 Análisis de datos
Se realizó un análisis descriptivo (media, mediana y desviación estándar) para los recuentos de AMC, EB y PS. La distribución normal de cada conjunto de datos (T1 y T2) se investigó mediante la prueba de Shapiro-Wilks. Debido a la distribución anormal de los datos, se calcularon los valores medianos de los recuentos de AMC, EB y PS. Se aplicó la prueba de suma de rangos de Wilcoxon-Mann-Whitney realizada como una prueba bilateral para identificar si había una diferencia significativa entre los recuentos medianos de AMC, EB y PS de las muestras de BT y AT. Se compararon las medianas de los recuentos de AMC, EB y PS en las muestras de TA para diferentes suministros de agua (públicos frente a privados), tratamientos de tuberías de agua (T1 frente a T2),10 transformación, utilizando la prueba de suma de rangos de Wilcoxon-Mann-Whitney. Los valores de p < 0,05 se consideraron estadísticamente significativos. Los análisis estadísticos se llevaron a cabo utilizando el paquete de software R para computación estadística.3
3 Resultados
3.1 Recuento aeróbico mesófilo, Enterobacteriaceae y Pseudomonadaceae en el agua potable de las aves de corral
Se evaluaron microbiológicamente noventa y nueve muestras de BT y sus correspondientes muestras de agua de AT, con un límite microbiano máximo aceptable de 4,0 log10 UFC/ml para los recuentos de AMC, EB y PS (Tabla 1). Debido a la distribución no normal de los datos, se utilizó la prueba de suma de rangos de Wilcoxon-Mann-Whitney para evaluar los valores medianos de los recuentos de AMC, EB y PS. No se observaron diferencias significativas (p ≥ 0,05) entre la mediana de los recuentos de AMC, EB y PS de las muestras de BT y AT después del tratamiento de la línea de agua T1 (Tabla 1). Además, no observamos ninguna diferencia significativa entre la mediana de los recuentos de AMC, EB y PS en granjas avícolas con suministro de agua privado y público. Entre las muestras de agua, la mediana más alta de los recuentos de AMC se observó en BT (5,9 ± 1,02 log10 UFC/ml, mediana ± MAD; MAD: mediana de la desviación absoluta) y AT (6,0 ± 1,17 log10 UFC/ml). Se observaron recuentos medianos de AMC más altos en las muestras de BT y AT en las granjas avícolas con un pozo privado que en aquellas con un suministro público de agua (Tabla 1). Los recuentos medianos más bajos se observaron para la EB tanto en BT (3,6 ± 2,13 log10 UFC/ml) y AT (2,3 ± 1,52 log10 UFC/ml). En las muestras de TA se observaron recuentos de EB medianos más altos en granjas avícolas con suministro público de agua. El PS resultó en la segunda mediana más alta, que se mantuvo sin cambios en BT (4,7 ± 1,44 log10 UFC/ml) y AT (4,7 ± 2,48 log10 UFC/ml). Se detectaron recuentos medianos de PS más altos en muestras de BT y AT en granjas avícolas con suministro público de agua.
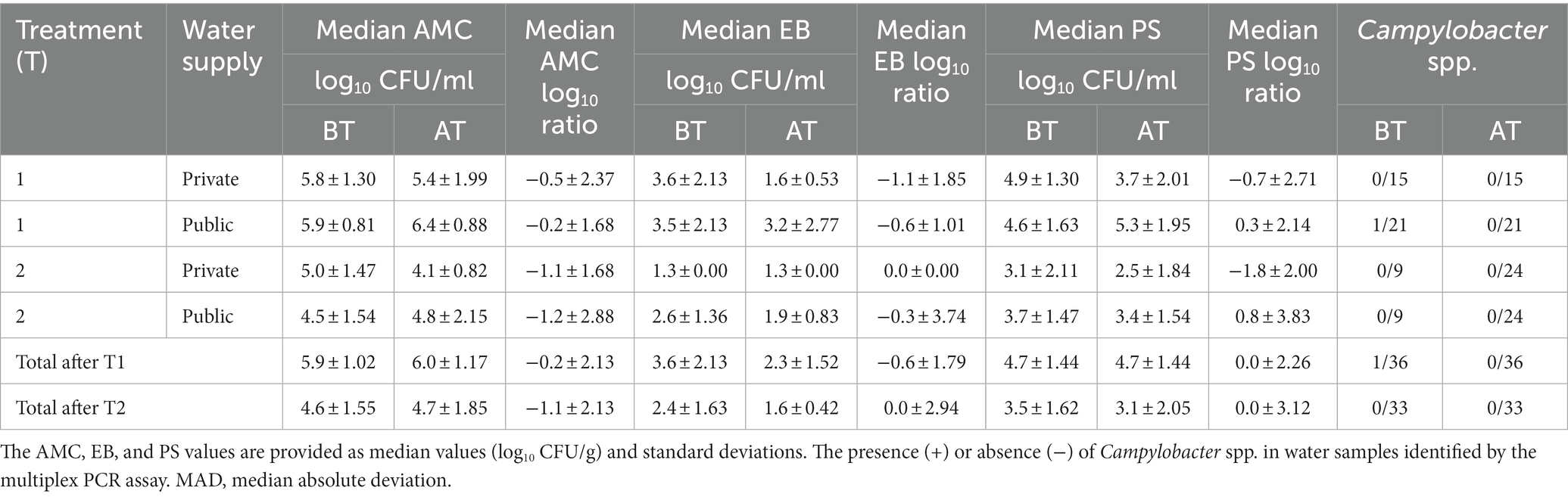 Tabla 1. La mediana del recuento aeróbico mesófilo (AMC), Enterobacteriaceae (EB) y Pseudomonadaceae (PS) en muestras de agua potable de aves de corral se determinó antes (BT) y después del tratamiento de la línea de flotación (AT) durante el tratamiento de la línea de agua T1 y T2 utilizando métodos dependientes del cultivo.
Tabla 1. La mediana del recuento aeróbico mesófilo (AMC), Enterobacteriaceae (EB) y Pseudomonadaceae (PS) en muestras de agua potable de aves de corral se determinó antes (BT) y después del tratamiento de la línea de flotación (AT) durante el tratamiento de la línea de agua T1 y T2 utilizando métodos dependientes del cultivo.
Después del tratamiento de la línea de agua T1, alto (>4.0 log10 UFC/ml) Los recuentos de AMC, EB y PS de las muestras de BT disminuyeron por debajo del límite microbiano máximo aceptable en las muestras de AT 8/36, 7/36 y 9/36, respectivamente (Tabla suplementaria S2). El AMC, EB y PS por debajo del límite microbiano se observaron en las muestras de 1/36, 18/36 y 7/36 BT y AT, respectivamente. Los recuentos de AMC, EB y PS por encima del límite microbiano máximo aceptable se observaron en las muestras de AT 27/36, 11/36 y 20/36, respectivamente, después del tratamiento con T1.
Durante el muestreo de la línea de agua T2, no se observaron diferencias significativas (p ≥ 0,05) en la mediana de los recuentos de AMC, EB y PS entre las muestras de BT y AT (Tabla 1). No se observaron diferencias significativas entre la mediana del recuento de AMC, EB y PS en granjas avícolas con suministro de agua público y privado. La mediana más alta de los recuentos de AMC se produjo tanto en la BT (4,6 ± 1,55 log10 UFC/ml) y AT (4,7 ± 1,85 log10 UFC/ml), seguido de los recuentos de PS en BT (3,5 ± 1,62 log10 UFC/ml) y AT (3,1 ± 2,05 log10 UFC/ml) Los recuentos más bajos se observaron en la mediana de los recuentos de EB de BT (2,4 ± 1,63 log10 UFC/ml) y AT (1,6 ± 0,42 log10 UFC/ml). Se detectaron recuentos medianos más altos de AMC, EB y PS en muestras de AT en granjas avícolas con suministro público de agua.
Después del tratamiento de la línea de agua T2, alto (>4.0 log10 UFC/ml) Los recuentos de AMC, EB y PS de las muestras de BT disminuyeron por debajo del límite microbiano máximo aceptable en las muestras de AT 8/33, 5/33 y 14/33, respectivamente (Tabla suplementaria S3). Los recuentos de AMC, EB y PS por debajo del límite microbiano se detectaron en 4/33, 25/33 y 10/33 muestras tanto en BT como en AT, respectivamente. Los recuentos de AMC, EB y PS se mantuvieron por encima del límite microbiano máximo aceptable en las muestras de AT 21/33, 3/33 y 9/33, respectivamente, después del tratamiento de la línea de agua T2.
El impacto del tratamiento de las líneas de agua T1 y T2 en el suministro de agua privado y público se evaluó mediante el cálculo del registro10 relación del registro de UFC10 recuentos detectados en muestras de agua BT y AT (Tabla 1). No hubo diferencias significativas (p ≥ 0,05) en log10 se observaron proporciones para los recuentos de AMC, EB y PS después del tratamiento de la línea de agua T1 y T2. El registro10 La relación no fue significativamente diferente (p ≥ 0.05) entre las granjas avícolas privadas y públicas después del tratamiento de la línea de agua T1 y T2. La mediana de los cocientes AMC, EB y PS después del tratamiento de la línea de flotación T1 fue de −0,2 ± 2,13, −0,6 ± 1,79 y 0,0 ± 2,26, respectivamente. El análisis de log10 Los cocientes después del tratamiento de la línea de flotación T2 dieron como resultado valores medianos de −1,1 ± 2,13 para AMC, 0,0 ± 2,94 para EB y 0,0 ± 3,12 para los recuentos de PS. A pesar de que log10 Las proporciones entre granjas avícolas con suministros de agua privados y públicos no fueron significativamente diferentes, observamos una mediana logarítmica más alta10 reducción de los recuentos de AMC, EB y PS en granjas avícolas con suministro privado de agua. Durante el tratamiento de la línea de agua T2, el logaritmo medio más alto10 se observó una reducción de los recuentos de AMC y EB en granjas avícolas con suministro público de agua, mientras que la mediana de logaritmo fue mayor10 Se observó una reducción de los recuentos de PS en granjas avícolas con suministro privado de agua.
De las 14 granjas avícolas evaluadas, cinco granjas exhibieron recuentos microbianos por debajo del límite microbiano aceptable (<4.0 log10 UFC/ml) después del tratamiento de la línea de agua T1 (Figuras 2A-C). De estas fincas, tres contaban con un suministro privado de agua, mientras que las dos restantes contaban con un suministro público de agua. En particular, la granja avícola 7, que tenía un suministro público de agua, exhibió un recuento de AMC por debajo del límite microbiano máximo aceptable tanto en la muestra de agua BT como en la correspondiente muestra de agua AT. Además, 11 granjas avícolas presentaron recuentos de EB por debajo del límite microbiano máximo aceptable. De estos, nueve granjas avícolas demostraron recuentos de EB por debajo del límite microbiano tanto en las muestras de BT como en las correspondientes de AT. Además, entre las 14 granjas avícolas examinadas, un total de ocho granjas avícolas exhibieron recuentos de PS por debajo del límite microbiano. De estos, cuatro granjas avícolas demostraron recuentos de PS por debajo del límite microbiano tanto en las muestras de BT como en las correspondientes de AT. Entre las granjas avícolas que se sometieron a dos muestreos, las granjas avícolas 12 y 13 exhibieron recuentos de AMC y PS que excedieron el límite microbiano en uno de los eventos de muestreo. Además, la granja avícola 12 demostró recuentos de EB por encima del límite microbiano en una de las dos ocasiones de muestreo.
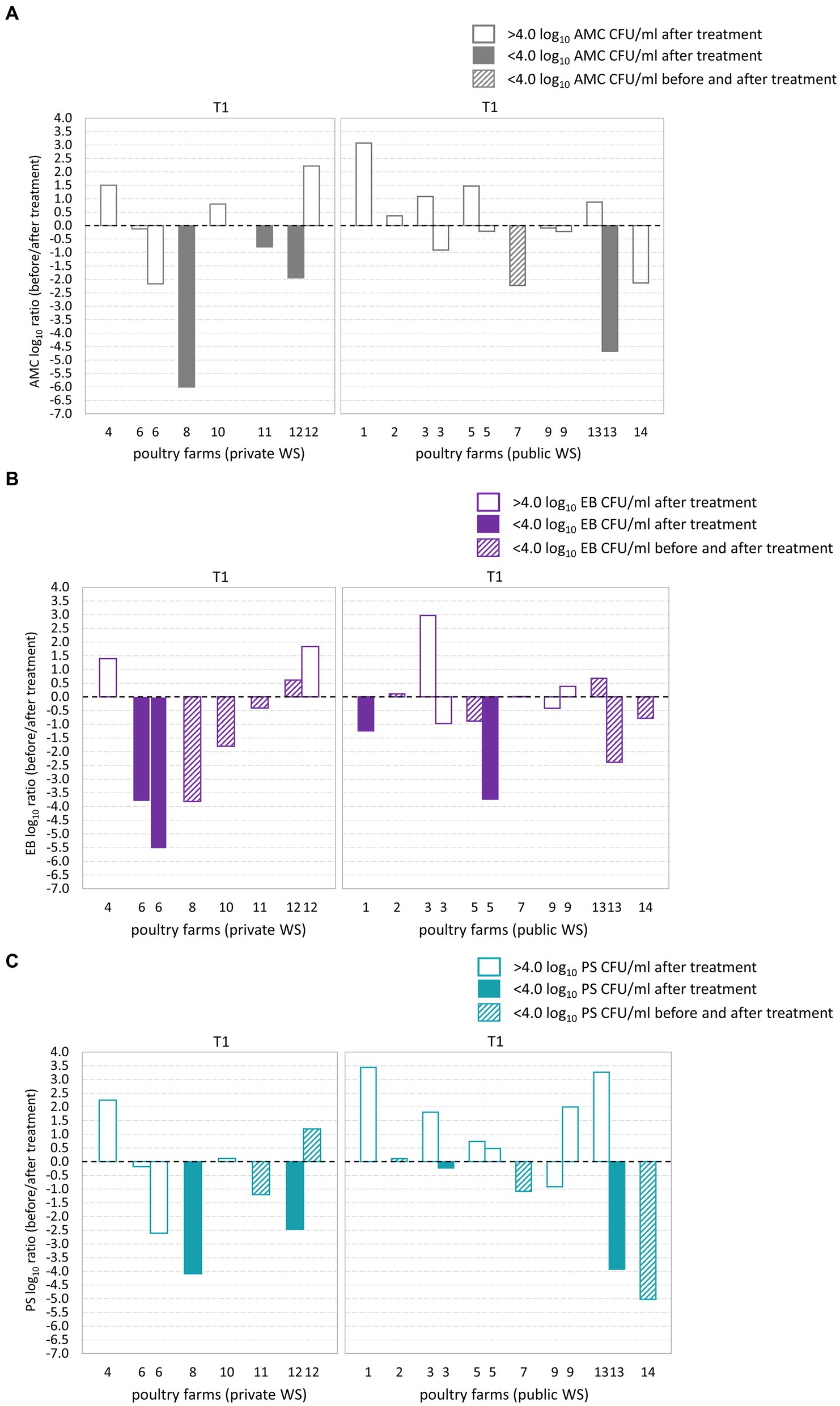 Figura 2. Registro10 transformó los cambios de plegado promedio (antes/después del tratamiento de la línea de flotación) obtenidos a partir de recuentos aeróbicos mesófilos (AMC) (A), Enterobacteriaceae (EB) (B) y Pseudomonadaceae (PS) (C) en el agua de bebida de las aves de corral. El eje x indica la comparación entre granjas avícolas con suministro de agua privado y público (WS) después del tratamiento de la línea de agua T1. El eje Y muestra el registro10 Relación de recuento de AMC, EB y PS. El registro10 La relación AMC, EB y PS no fue significativamente diferente entre las granjas avícolas con suministro de agua privado y público. No se observaron diferencias significativas en el logaritmo de AMC, EB y PS10 relación después del tratamiento de la línea de flotación T1 entre granjas avícolas con SW privadas y públicas.
Figura 2. Registro10 transformó los cambios de plegado promedio (antes/después del tratamiento de la línea de flotación) obtenidos a partir de recuentos aeróbicos mesófilos (AMC) (A), Enterobacteriaceae (EB) (B) y Pseudomonadaceae (PS) (C) en el agua de bebida de las aves de corral. El eje x indica la comparación entre granjas avícolas con suministro de agua privado y público (WS) después del tratamiento de la línea de agua T1. El eje Y muestra el registro10 Relación de recuento de AMC, EB y PS. El registro10 La relación AMC, EB y PS no fue significativamente diferente entre las granjas avícolas con suministro de agua privado y público. No se observaron diferencias significativas en el logaritmo de AMC, EB y PS10 relación después del tratamiento de la línea de flotación T1 entre granjas avícolas con SW privadas y públicas.
Durante el tratamiento de la línea de flotación T2, se observaron recuentos de AMC por debajo del límite microbiano en seis de las 14 granjas avícolas (Figuras 3A-C). De estos, dos granjas avícolas demostraron un recuento de AMC por debajo del límite microbiano tanto en las muestras de BT como en las correspondientes de AT (Figura 3B). Se observaron recuentos de EB por debajo del límite microbiano en 12 de las 14 granjas avícolas, y entre ellas, nueve granjas avícolas tenían recuentos de EB por debajo del límite microbiano tanto en las muestras de BT como en las correspondientes de AT. Del mismo modo, se observaron recuentos de PS por debajo del límite microbiano en diez de 14 granjas avícolas, y entre ellas, tres granjas avícolas demostraron recuentos de PS por debajo del límite microbiano en las muestras de BT y AT correspondientes. Entre las granjas avícolas sometidas a dos muestreos, la granja avícola 18 mostró recuentos de AMC, PS y EB por debajo del límite microbiano durante una de las ocasiones de muestreo. Sin embargo, después de un segundo muestreo, la carga de AMC en las muestras de agua superó el límite microbiano. En particular, los recuentos de PS y EB se mantuvieron por debajo del límite microbiano durante ambas ocasiones de muestreo.
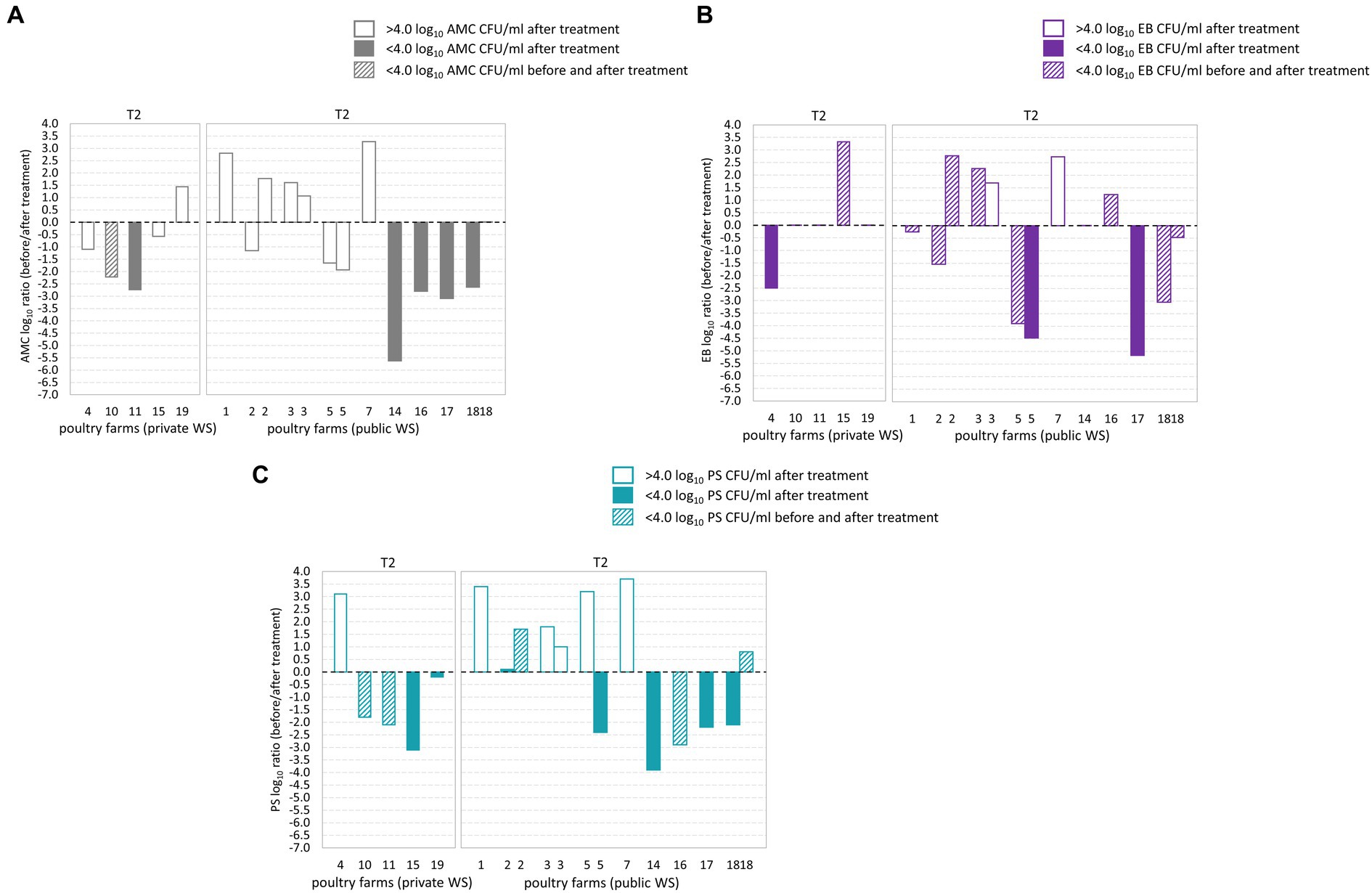 Figura 3. Registro10 transformó los cambios de plegado promedio (antes/después del tratamiento de la línea de flotación) obtenidos a partir de recuentos aeróbicos mesófilos (AMC) (A), Enterobacteriaceae (EB) (B) y Pseudomonadaceae (PS) (C) en el agua de bebida de las aves de corral. El eje x indica la comparación entre granjas avícolas con suministro de agua privado y público (WS) después del tratamiento de la línea de flotación T2. El eje Y muestra el registro10 Relación de recuento de AMC, EB y PS. El registro10 La relación AMC, EB y PS no fue significativamente diferente entre las granjas avícolas con suministro de agua privado y público. No se observaron diferencias significativas en el logaritmo de AMC, EB y PS10 relación después del tratamiento de la línea de flotación T2 entre granjas avícolas con SW privadas y públicas.
Figura 3. Registro10 transformó los cambios de plegado promedio (antes/después del tratamiento de la línea de flotación) obtenidos a partir de recuentos aeróbicos mesófilos (AMC) (A), Enterobacteriaceae (EB) (B) y Pseudomonadaceae (PS) (C) en el agua de bebida de las aves de corral. El eje x indica la comparación entre granjas avícolas con suministro de agua privado y público (WS) después del tratamiento de la línea de flotación T2. El eje Y muestra el registro10 Relación de recuento de AMC, EB y PS. El registro10 La relación AMC, EB y PS no fue significativamente diferente entre las granjas avícolas con suministro de agua privado y público. No se observaron diferencias significativas en el logaritmo de AMC, EB y PS10 relación después del tratamiento de la línea de flotación T2 entre granjas avícolas con SW privadas y públicas.
3.2 Identificación de aislados bacterianos en el agua de bebida de las aves de corral
La asignación taxonómica aislada se realizó mediante secuenciación parcial del gen 16S rRNA. En el presente estudio, las secuencias aisladas mostraron una similitud del ≥97,0% con la secuencia de referencia en la base de datos del NCBI. En las muestras de BT, 123 aislamientos correspondieron a 24 géneros y 55 especies, mientras que en las muestras de AT, los 113 aislamientos correspondieron a 22 géneros y 40 especies. Un análisis más detallado de los aislados bacterianos reveló que en las muestras de BT y AT, el 43,1% (n = 41 aislamientos) y el 36,3% (n = 53 aislamientos) de los aislados secuenciados se asignaron a OP, encontrados en las muestras 29/36 BT y 17/36 AT (Tabla 2). Los aislamientos de las muestras de BT contenían OP representada por 16 géneros y 19 especies, mientras que los aislados de las muestras de AT contenían OP representada por 12 géneros y 12 especies de OP. Además, C. jejuni se detectó mediante PCR multiplex en una sola muestra de agua BT de una granja avícola con suministro público de agua.
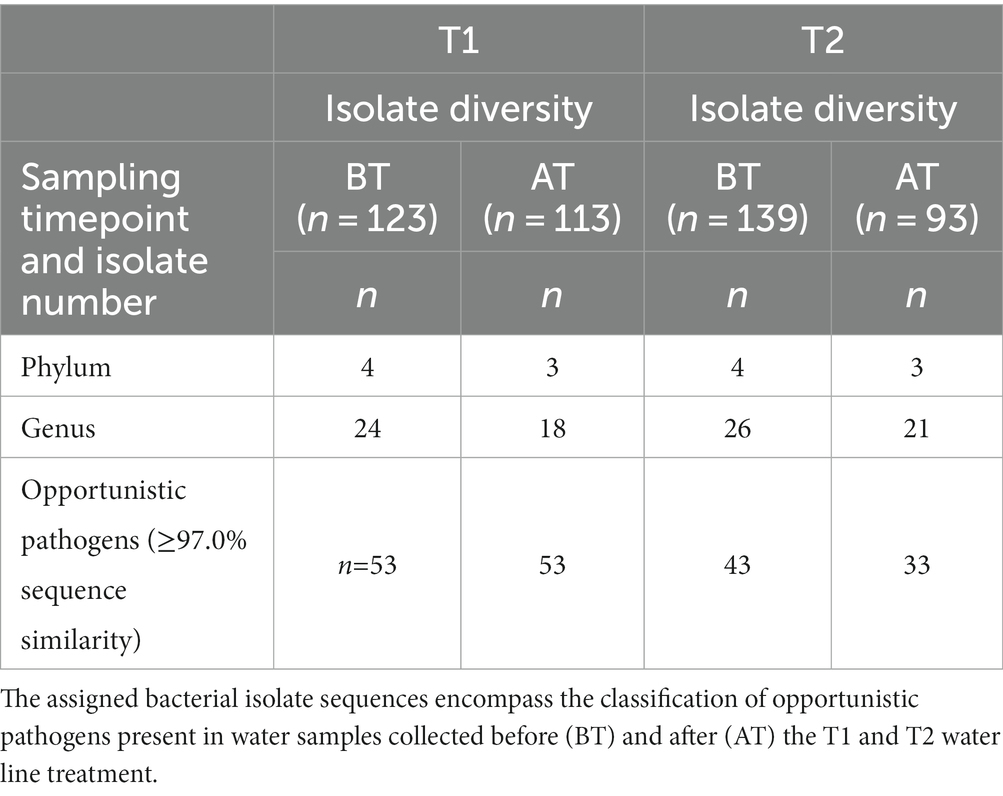 Tabla 2. Una visión general del número de secuencias aisladas asignadas a los diferentes filos y géneros utilizando un corte de similitud del ≥97,0% después de la secuenciación parcial del gen 16S rRNA.
Tabla 2. Una visión general del número de secuencias aisladas asignadas a los diferentes filos y géneros utilizando un corte de similitud del ≥97,0% después de la secuenciación parcial del gen 16S rRNA.
Durante el tratamiento de la línea de agua T2, 139 aislamientos en el BT correspondieron a 26 géneros y 46 especies, mientras que 96 aislamientos en las muestras de AT correspondieron a 21 géneros y 33 especies (Cuadro 2). Entre los aislados secuenciados, el 30,9% (n = 43 aislamientos) y el 33,3% (n = 33 aislamientos) correspondieron a OP, aislados de muestras 20/33 BT y 14/33 AT, respectivamente. El PO en las muestras de BT comprendió 10 géneros y 14 especies, mientras que el OP en las muestras de AT comprendió 11 géneros y 14 especies. No se detectó Campylobacter spp. en muestras de agua potable de aves de corral durante el tratamiento de la línea de agua T2.
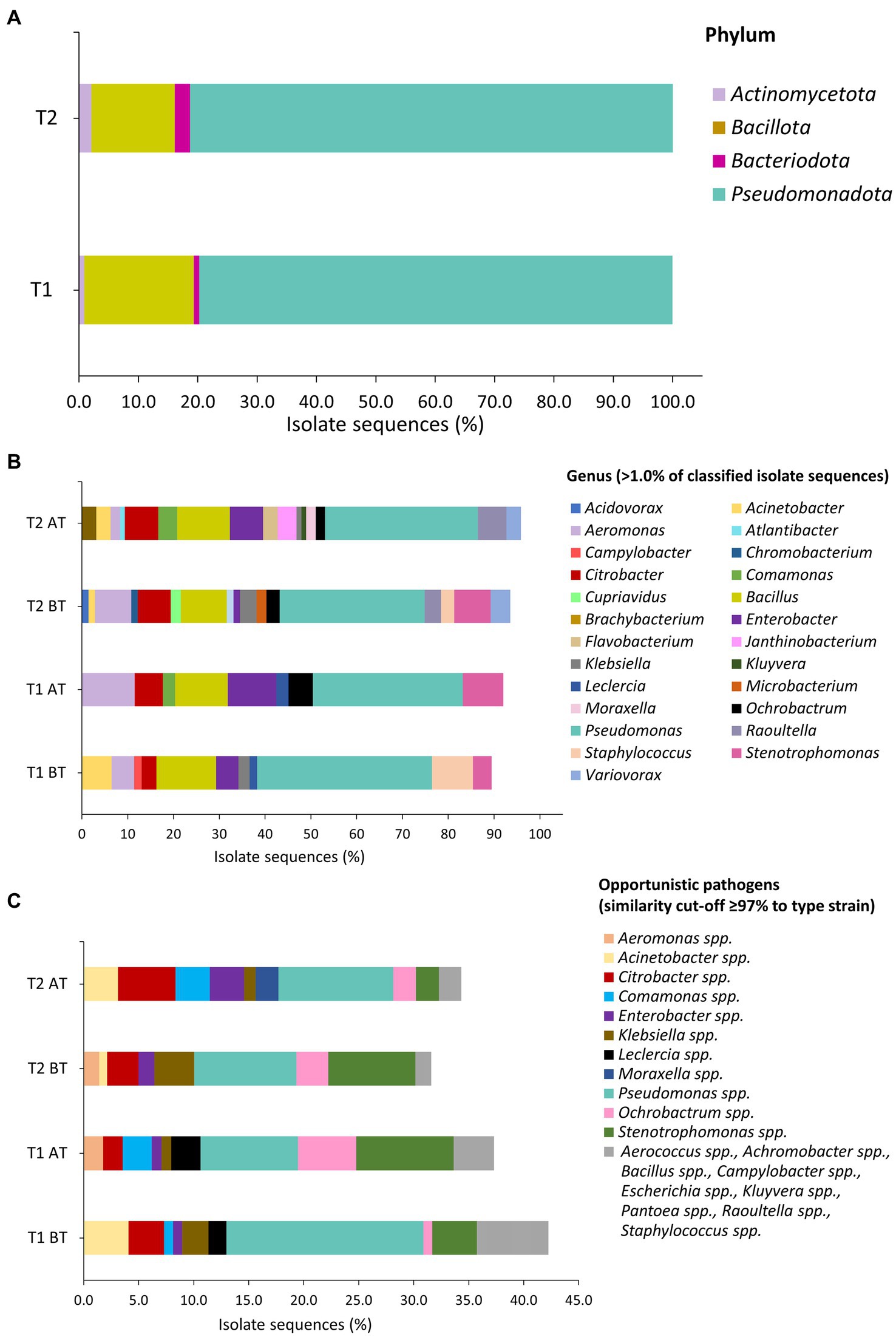
Las Figuras 4A, B representan la clasificación taxonómica de las secuencias aisladas asignadas a nivel de filo y género. Los filos predominantes en las muestras de BT y AT fueron Pseudomonadota, seguidos de Bacillota, Actinomycetota y Bacteroidota (Figura 4A). Los géneros frecuentemente aislados durante el tratamiento de la línea de agua T1 y T2 en muestras de BT y AT fueron Aeromonas, Bacillus, Citrobacter, Enterobacter, Pseudomonas y Stenotrophomonas (Figura 4B). Entre estos, Pseudomonas (BT 38,2%; AT 32.7%) y Bacillus (BT, 13.0%, AT, 11.5%) fueron los géneros más comúnmente observados durante el tratamiento de la línea de agua T1. Del mismo modo, durante el tratamiento de la línea de agua T2, Pseudomonas (BT, 31,7%; TA, 33,3%) y Bacilo (BT, 10,1%; AT, 11,5%) fueron géneros predominantes en las muestras de BT y AT. La Figura 4B muestra el porcentaje de identificación de otros géneros observados durante los tratamientos de las líneas de agua T1 y T2. La mayoría de los aislados secuenciados clasificados como OP en muestras de BT y AT durante el agua T1 y T2 pertenecían a Pseudomonas spp., seguido de Stenotrophomonas spp., Citrobacter spp., Ochrobactrum spp. y Acinetobacter spp. (Figura 4C). Además, se aislaron aislamientos de los géneros Enterobacter spp. y Klebsiella spp. durante el muestreo T1 y T2. Los aislados de Pseudomonas spp. identificados como OP fueron las secuencias bacterianas observadas con mayor frecuencia durante los aislamientos T1 (BT, 22/123; AT, 10/113 aislados) y T2 (BT, 13/139 aislados; AT, 10/96 aislados) muestreo.
Figura 4. Clasificación taxonómica de aislados basada en la secuenciación parcial del gen 16S rRNA en el nivel de filo (A), género (B) y patógenos oportunistas (C) en muestras de agua durante tratamientos de línea de flotación T1 y T2. Se aplicó un punto de corte de similitud de secuencia del ≥97,0% para la asignación de secuencias aisladas (fragmento de 1.040 a 1.120 pb) a la cepa tipo. (C) Las secuencias bacterianas que se aislaron de muestras de agua una o dos veces se indican con el color gris.
Antes y después del tratamiento de la línea de agua T1, se aisló Pseudomonas spp. de muestras de BT y AT en granjas avícolas 12/14 y 9/14, respectivamente (Tabla 3). Se detectaron secuencias aisladas de OP en muestras de BT de 11 de 14 granjas avícolas y en muestras de AT de 9 de 14 granjas avícolas. Entre los géneros frecuentemente observados antes y después del tratamiento con T2, el género Pseudomonas se aisló de las muestras de BT y AT en 12 de 14 granjas avícolas y 9 de 14 granjas avícolas, respectivamente (Tabla 4). Los PO se observaron en 10 de las 14 granjas avícolas en muestras de BT y en 9 de las 14 granjas avícolas en muestras de AT después del tratamiento de la línea de agua T2.
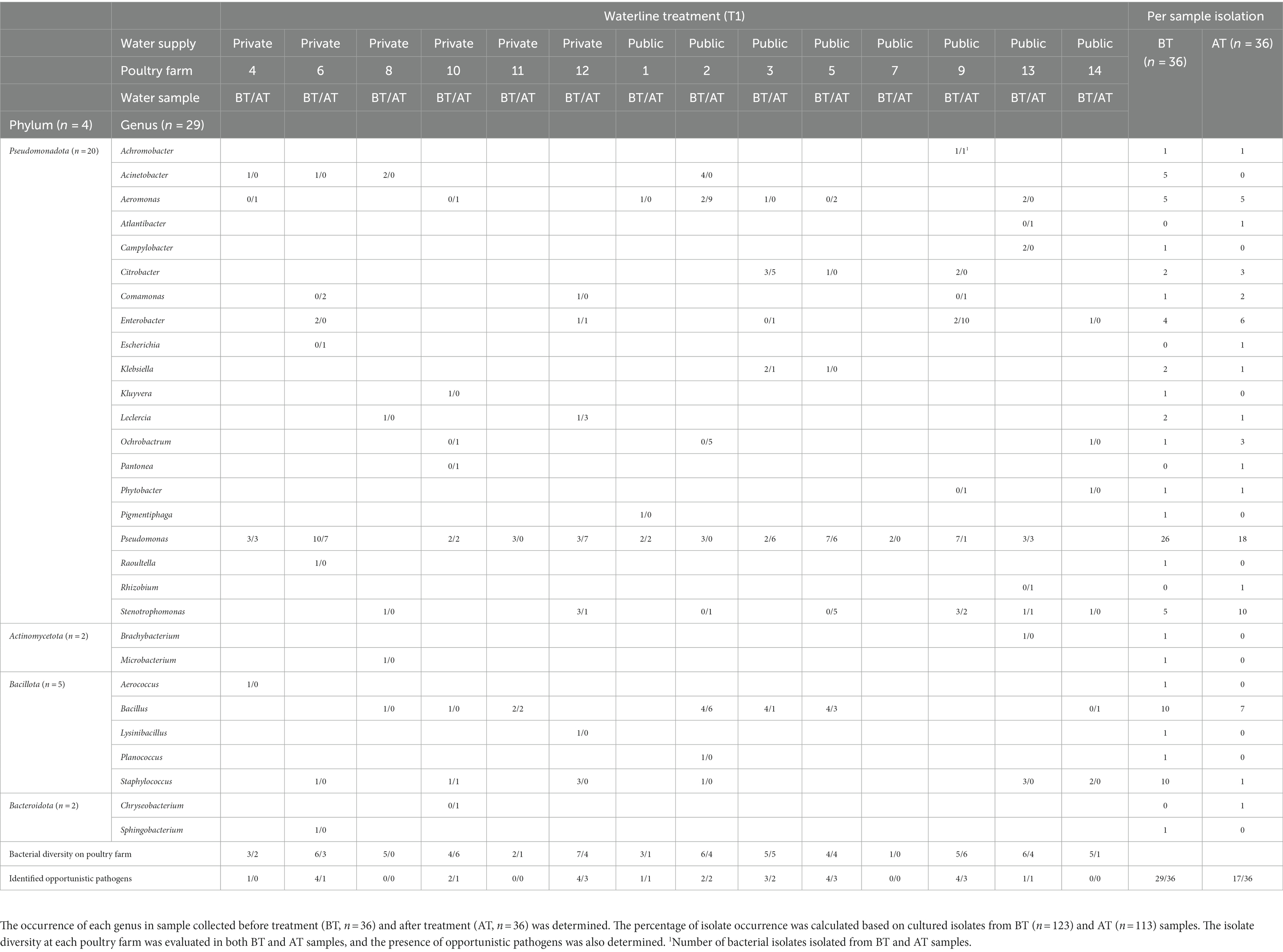 Tabla 3. La diversidad de aislados en muestras de agua potable de aves de corral se evaluó mediante secuenciación parcial del gen 16S rRNA de aislados cultivados recolectados durante el tratamiento químico de la línea de flotación con 4,0 ppm de ClO activo2 Tratamiento de la línea de flotación (T1) en granjas avícolas.
Tabla 3. La diversidad de aislados en muestras de agua potable de aves de corral se evaluó mediante secuenciación parcial del gen 16S rRNA de aislados cultivados recolectados durante el tratamiento químico de la línea de flotación con 4,0 ppm de ClO activo2 Tratamiento de la línea de flotación (T1) en granjas avícolas.
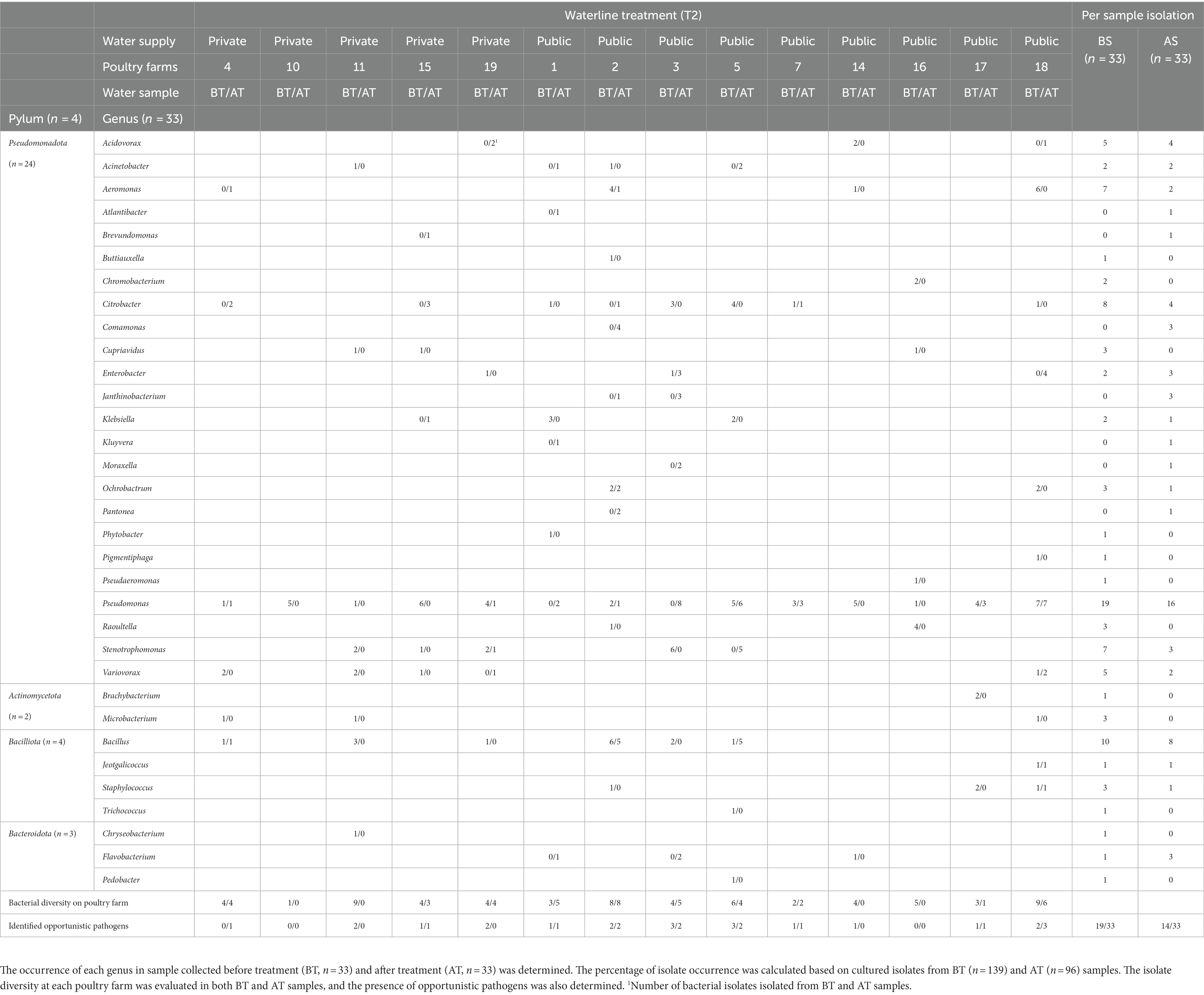 Tabla 4. La diversidad de aislados en muestras de agua potable de aves de corral se evaluó mediante la secuenciación parcial del gen 16S rRNA de aislados cultivados recolectados durante la combinación de productos químicos (ácido peroxiacético [PAA] al 3,0% y 4,0 ppm de ClO activo2) con tratamiento mecánico (purga de tuberías de agua con una bomba de aire de alta presión) (T2) en granjas avícolas.
Tabla 4. La diversidad de aislados en muestras de agua potable de aves de corral se evaluó mediante la secuenciación parcial del gen 16S rRNA de aislados cultivados recolectados durante la combinación de productos químicos (ácido peroxiacético [PAA] al 3,0% y 4,0 ppm de ClO activo2) con tratamiento mecánico (purga de tuberías de agua con una bomba de aire de alta presión) (T2) en granjas avícolas.
3.3 Patrones de susceptibilidad a los antibióticos de los aislados bacterianos obtenidos del agua de bebida de las aves de corral
Se evaluó la susceptibilidad de los aislados bacterianos recuperados de muestras de agua BT (n = 14) y AT (n = 16) durante los tratamientos de la línea de agua T1 y T2 a 18 agentes antibióticos comúnmente utilizados en la producción avícola utilizando placas de susceptibilidad Avian AVIAN1F Vet AST (Tabla 5). El objetivo era investigar la resistencia a los antimicrobianos en los aislados de OP aislados con mayor frecuencia, incluidos los aislados pertenecientes a Pseudomonas spp., Stenotrophomonas spp., Ochrobactrum spp., así como la resistencia a los antimicrobianos en OP específicos transmitidos por el agua importantes para la salud humana, como Aeromonas spp., Citrobacter spp., Enterobacter spp. y Klebsiella spp.
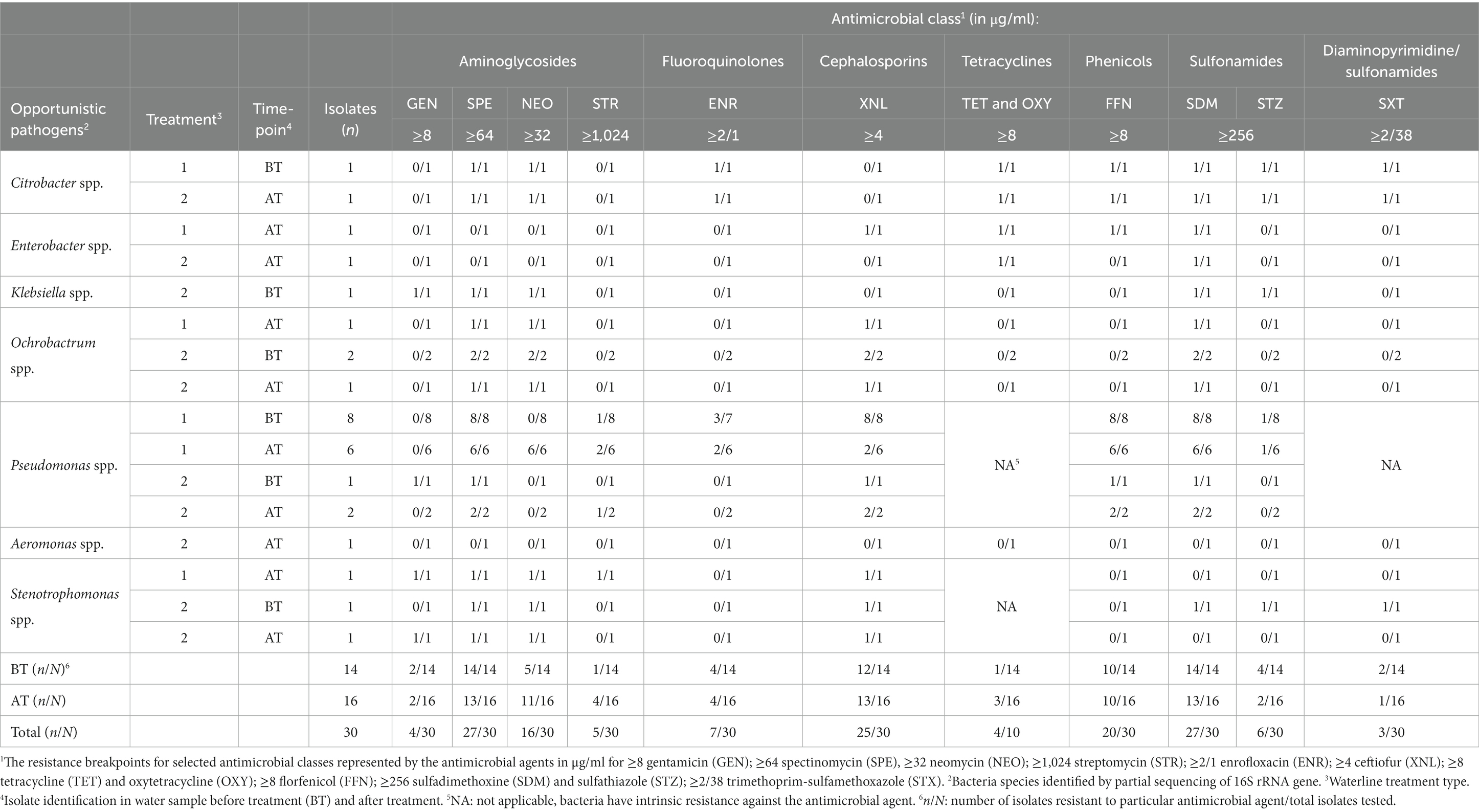 Tabla 5. Resistencia a los antimicrobianos entre los aislados bacterianos antes (BT) y después (AT) del tratamiento de la línea de flotación a un panel de antimicrobianos veterinarios comúnmente utilizados en la producción avícola.
Tabla 5. Resistencia a los antimicrobianos entre los aislados bacterianos antes (BT) y después (AT) del tratamiento de la línea de flotación a un panel de antimicrobianos veterinarios comúnmente utilizados en la producción avícola.
El nivel más alto de RAM se observó frente a la espectinomicina y la sulfadimetoxina (90,0%; 27/30 aislamientos cada uno), seguidos del ceftiofur (83,3%; 25/30 aislamientos), el florfenicol (66,6%; 20/30 aislamientos) y la neomicina (53,5%, 16/30 aislamientos). Además, algunos aislados fueron resistentes a enrofloxacino (23,3%; 13/30 aislamientos), trimetoprim-sulfametoxazol (23,1%; 3/13 aislamientos), sulfatiazol (20,0%; 6/30 aislamientos), estreptomicina (16,7%, 5/30 aislamientos), gentamicina (13,3%; 4/30 aislamientos) y trimetoprim-sulfametoxazol (10,0%, 3/30 aislamientos).
El MDR se exhibió entre los aislamientos de Pseudomonas spp., (17/17 aislados), y Stenotrophomonas spp. (1/3 aislados), Ochrobactrum spp. (4/4 aislados), Citrobacter spp. (2/2 aislados) y Enterobacter spp. (1/2 aislados). Todos los aislados de Pseudomonas spp. mostraron patrones de resistencia exhibiendo resistencia a un mínimo de cuatro y un máximo de ocho antibióticos. Los aislados de Stenotrophomonas spp. probados también demostraron patrones de resistencia a un mínimo de cuatro y un máximo de seis antibióticos. Todas las especies de Ochrobactrum analizadas fueron resistentes a cuatro antibióticos. Los aislados de Citrobacter spp. fueron resistentes a seis clases de antimicrobianos y nueve antibióticos diferentes. Los aislamientos de Enterobacter spp. mostraron patrones de resistencia a un mínimo de dos y un máximo de cuatro antibióticos. Los aislados de Klebsiella spp. fueron resistentes a cinco antibióticos, mientras que el aislado de Aeromonas spp. fue susceptible a todos los agentes antibióticos probados.
4 Discusión
Dotar a las aves de corral de un agua que cumpla con los más altos estándares de calidad es fundamental para garantizar la inocuidad y calidad de los productos derivados de estos animales. La presencia de altas cargas microbianas y biopelículas en las líneas de agua potable puede tener un efecto negativo en la salud y el rendimiento de las aves de corral (14). Además, cuando surgen problemas de salud dentro de una parvada de aves de corral, los antibióticos a menudo se administran a través del agua potable. Esta práctica aumenta el riesgo de resistencia a los antibióticos dentro de las granjas avícolas, lo que representa una amenaza potencial para la salud animal y humana (12).
Evaluamos la calidad microbiana del agua de bebida de las aves de corral al final de la línea de bebedero en función de los límites establecidos en estudios previos, donde los recuentos de AMC, EB y PS fueron inferiores a 4,0 log10 Las UFC/ml se consideraron aceptables (4, 7, 12). Al final del período de engorde, el AMC superó los límites aceptables en la mayoría de las granjas avícolas analizadas, observándose tendencias similares para los recuentos de PS. Sin embargo, la EB se mantuvo dentro de niveles aceptables en la mayoría de las explotaciones. Los factores ambientales, como la temperatura ambiente (±25 °C), los bajos caudales de agua, el tipo de instalación de tuberías y los aditivos para piensos (a menudo mezclados con glucosa) proporcionaron abundantes nutrientes para las bacterias, lo que contribuyó a una alta carga microbiana al final del período de engorde (42). Las granjas avícolas optan por clorar y/o acidificar sus sistemas de agua potable debido a la fácil aplicación, la rentabilidad y las amplias propiedades antimicrobianas de estos sistemas de tratamiento (12). Además, la limpieza mecánica ayuda a eliminar la biopelícula de las superficies dentro del sistema de agua potable. Sorprendentemente, el análisis del recuento en placa no mostró una reducción significativa de la carga microbiana (recuentos de AMC, EB y PS) en las muestras de AT después del tratamiento químico de la línea de agua (T1) o el tratamiento químico combinado con el tratamiento mecánico (T2). A diferencia de informes anteriores que asociaban granjas avícolas con un suministro privado de agua con cargas microbianas elevadas, no observamos diferencias significativas en la carga microbiana entre granjas avícolas con suministros de agua privados o públicos (43). Los recuentos microbianos observados en nuestro estudio fueron similares a los encontrados en las superficies dentro de los sistemas de agua potable de los gallineros, que generalmente estaban por encima de 6.0 log10 UFC (12). Esto sugiere una eficacia de desinfección limitada, probablemente debido a la baja concentración de desinfectante aplicado. A pesar de la limpieza mecánica y posterior desinfección, persistieron altos niveles de microorganismos en las líneas de agua, lo que indica que la concentración de desinfectante después del tratamiento mecánico fue insuficiente para eliminar la mayoría de los microorganismos. Sin embargo, nuestro estudio se centró únicamente en parámetros microbiológicos, pasando por alto factores vitales como la dureza del agua, el pH, la temperatura y el ClO libre2 residuos dentro de las líneas de agua. Esto limitó nuestra capacidad para evaluar exhaustivamente la eficiencia de la ClO activa de 4 ppm2 y 3% de PAA durante los tratamientos de la línea de agua. Estudios previos han puesto de manifiesto la limitada eficacia de las prácticas de desinfección de las tuberías de agua utilizando agentes oxidantes como el cloro o el peróxido de hidrógeno (12). Esta limitación se debe principalmente a que las concentraciones aplicadas son inferiores a las recomendadas por los proveedores, lo que está en consonancia con nuestras observaciones de alta carga microbiana en muestras de AT. Además, se observaron inconsistencias en las muestras de agua de TA entre las granjas avícolas que se muestrearon dos veces, lo que enfatiza la necesidad de controles frecuentes de la calidad del agua en un sistema cerrado. Incluso con la adición de concentraciones típicas de peróxido de hidrógeno (25-50 ppm) y cloro libre (2-5 ppm) al agua de bebida de las aves de corral durante el engorde, se observó la formación de biopelículas en el agua mínimamente contaminada (7). Por lo tanto, el monitoreo regular de la calidad microbiana del agua, combinado con un tratamiento constante de la línea de agua durante el período de engorde, es un aspecto crucial de los programas sólidos de bioseguridad en las granjas avícolas. Además, se ha observado que los contratistas especializados logran un tratamiento más eficaz de las líneas de agua en comparación con los agricultores (42, 44). Finalmente, Zou et al. (45) demostraron una reducción significativa de E. coli, Salmonella, Staphylococcus aureus y moho en el agua de bebida de las aves después del tratamiento con dicloroisocianurato de sodio, correlacionándose positivamente con la salud de las aves.
La presencia de una alta carga microbiana en las muestras de agua dio lugar a una amplia variedad taxonómica entre los aislados tanto en las muestras de BT como en las de AT, que oscilaban entre 18 y 26 géneros. Si bien las conclusiones taxonómicas definitivas requieren estudios más extensos, la presencia frecuente de géneros como Aeromonas, Bacillus, Citrobacter, Enterobacter, Pseudomonas y Stenotrophomonas, comúnmente asociados con aguas residuales y superficiales, subraya un mayor riesgo tanto para las aves de corral como para la salud humana en este estudio (19, 46). La identificación de géneros, incluyendo Pseudomonas, Stenotrophomonas, y Ochrobactrum, estuvo en línea con los aislamientos encontrados en las superficies del sistema de agua potable de las aves de corral (12). La mayoría de las bacterias identificadas encontradas en las granjas avícolas, independientemente de su suministro de agua, fueron OP, específicamente las pertenecientes a Pseudomonas spp., Stenotrophomonas spp. y Ochrobactrum spp. Los OP pertenecientes a Pseudomonas spp. están relacionados con infecciones secundarias tanto en aves de corral como en humanos. En las aves de corral, estas infecciones pueden manifestarse como septicemia, infecciones por lesiones cutáneas y neumonía hemorrágica (47). En humanos inmunocomprometidos, pueden provocar septicemia, neumonía e infecciones del tracto urinario (48). Estudios previos también han enfatizado un aumento de la tasa de mortalidad en aves de corral después de la infección por P. aeruginosa OP (49, 50). Un estudio previo demostró una mayor adhesión a superficies abióticas, invasión tisular a través de efectos citotóxicos, resistencia a 0,2 mg/mL de cloro y aumento de la resistencia a los antimicrobianos entre los aislados de P. aeruginosa del agua (51). Además, Stenotrophomonas maltophilia y Ochrobactrum intermedium son patógenos ambientales humanos emergentes que causan infecciones, principalmente en pacientes inmunocomprometidos (52). S. matophilia y P. aeruginosa a menudo se aíslan conjuntamente de los pulmones de los pacientes con fibrosis quística, y los hallazgos de investigaciones anteriores sugieren que S. maltophilia modula la virulencia de P. aeruginosa en una biopelícula multiespecie (53). Si bien se ha reconocido que S. maltophilia y O. intermedium causan infecciones en humanos inmunocomprometidos, aún no se ha informado de un vínculo establecido entre la calidad del agua y el desarrollo de enfermedades en la producción avícola que involucren a estas especies bacterianas. Sin embargo, las características notables de estas bacterias, como la resistencia a la desinfección y al calor, el crecimiento lento y la formación de biopelículas, enfatizan el riesgo potencial de infección de las aves de corral y los agricultores a través del contacto directo con el agua potable, junto con el riesgo de contaminación cruzada de los productos cárnicos de pollo durante el procesamiento posterior al sacrificio.
Durante el tratamiento de la línea de agua T1, se detectó C. jejuni en una muestra de agua recolectada antes del tratamiento de la línea de agua en una granja avícola con suministro público de agua, mientras que otras muestras analizadas dieron negativo. La detección de Campylobacter spp. en el agua depende de factores como el volumen de la muestra, el número de muestras y la concentración bacteriana (54, 55). Además, Campylobacter spp. puede entrar en un estado viable pero no cultivable (VBNC) bajo estrés ambiental, lo que podría dificultar el crecimiento en medios de cultivo convencionales debido a la actividad metabólica limitada (56). En consecuencia, Campylobacter spp. podría haber sido pasado por alto en otras muestras de agua analizadas debido a las limitaciones en el método de procesamiento. Estas limitaciones incluyen un pequeño volumen de muestra, la ausencia de filtración de muestras de agua y la posible presencia de Campylobacter spp. en el estado VBNC, que no se puede detectar utilizando los métodos basados en ISO utilizados en el estudio actual. Si bien este enfoque puede haber llevado a la pérdida de Campylobacter spp., nuestra evaluación de la carga bacteriana y la diversidad en las muestras de agua examinadas proporcionó una visión integral del contenido microbiano cuantitativo y cualitativo en el agua potable de las aves de corral. En particular, investigaciones anteriores enfatizan que una presencia significativa de Pseudomonas spp. en el agua potable de las aves de corral aumenta el riesgo de infección por Campylobacter spp., ya que los aislados de Campylobacter sp. de las aves de corral pueden persistir durante períodos prolongados dentro de las biopelículas de P. aeruginosa en el agua potable (57-59).
Estudios anteriores han establecido que las granjas avícolas son importantes reservorios de genes de resistencia a los antimicrobianos, lo que contribuye a la aparición de la resistencia a los antimicrobianos y a la dinámica de transmisión de las bacterias MDR en la interfaz humano-animal (60-62). Nuestros hallazgos se alinean con estas observaciones, revelando patrones de MDR en todos los aislados probados de aislados de Pseudomonas spp. y Ochrobactrum spp. de muestras de agua BT y AT. Además, una sola muestra de agua de Stenotrophomonas spp. de BT exhibió un patrón MDR. Los patrones consistentes de AMR observados en muestras de agua BT y AT se alinean con nuestras observaciones de tratamiento ineficaz de la línea de agua caracterizado por concentraciones limitadas de desinfectante que permiten la supervivencia y persistencia de las bacterias de AMR dentro de las líneas de agua. Los antimicrobianos permitidos para el tratamiento de aves de corral en Austria en el momento de este estudio incluyen enrofloxacina, doxiciclina, trimetoprimsulfametoxazol, ácido amoxicilinclavulánico, sulfato de colistina, tetraciclina y gentamicina (63-67). En el caso de los aislamientos que utilizamos en la AST, los autores no disponían de información o protocolos sobre el tratamiento actual o pasado de las aves de corral en estas granjas; por lo tanto, no fue posible realizar un análisis detallado de las posibles causas de la resistencia a los antimicrobianos en estos aislamientos. Los aislados de muestras de agua BT y AT exhibieron patrones de resistencia aumentados a la espectinomicina, sulfadimetoxina, ceftiofur, florfenicol y neomicina, probablemente atribuidos a su uso generalizado en el manejo de la salud avícola en las granjas. Esto plantea preocupaciones, ya que anteriormente se había informado de una elevada resistencia a la estreptomicina en aislados de E. coli de pollos de engorde en varios países de Europa, incluidos Polonia, Alemania, Gran Bretaña, Francia y España (68). Además, la resistencia a la estreptomicina y a la sulfadimetoxina se informó previamente en aislados de Salmonella spp. de granjas avícolas en Canadá y Estados Unidos (69-72). Además, estos aislados mostraron resistencia al ceftiofur y a la enrofloxacina, ambos reconocidos como antimicrobianos de importancia crítica de máxima prioridad por la Organización Mundial de la Salud (73). Esta resistencia a los antimicrobianos es motivo de preocupación, ya que puede transmitirse indirectamente a través de la transferencia horizontal de genes a E. coli, Salmonella spp., Campylobacter spp. y otros posibles patógenos avícolas y humanos. Heinemann et al. (42) informaron el aislamiento de bacterias productoras de betalactamasas de espectro extendido (BLEE) como P. aeruginosa, Enterobacter spp., Klebsiella spp. y Acinetobacter baumanni de las líneas de agua potable de las aves de corral y de los sistemas de rociadores. Las bacterias BLEE pueden hidrolizar cefalosporinas de espectro extendido, monobactámicos y penicilinas y, por lo tanto, conducir a una morbilidad y mortalidad elevadas, lo que complica aún más las opciones terapéuticas, particularmente entre las personas mayores e inmunodeprimidas (74-76). Los patrones de resistencia a la resistencia a los antimicrobianos observados en aislados de agua potable de aves de corral ponen de manifiesto el potencial de adquirir resistencia a los antimicrobianos a través de la medicación administrada en agua, lo que supone un riesgo y limita las opciones de tratamiento tanto en medicina veterinaria como humana (1, 42, 77-79).
El estudio enfatiza el desafío persistente de mantener la calidad microbiana en el agua potable de las aves de corral. La alta carga microbiana observada se atribuye a una microbiota establecida en el sistema de agua, resistente a las concentraciones subóptimas de desinfectante utilizadas durante la limpieza. Además, nuestros hallazgos sugieren que el tratamiento actual de las aves de corral y el uso de antibióticos pueden elevar la presencia de bacterias de la resistencia a los antimicrobianos en el agua potable debido a un manejo ineficiente. Abordar este problema requiere un monitoreo regular del agua, un tratamiento constante de las líneas de agua y una mejor educación de los agricultores. Mejorar la comprensión de los procesos biológicos en los sistemas de agua potable y la viabilidad de los microorganismos puede conducir a una mejor orientación sobre la salud del rebaño y la productividad agrícola. Identificar y mitigar los riesgos para la calidad del agua en las explotaciones, incluida la evaluación de las tecnologías de las líneas de agua que afectan a la microbiota en el agua potable y las tuberías de agua, es esencial para controlar la transmisión de patógenos y antibióticos en la producción avícola.
5 Conclusión
En conclusión, la mayoría de las granjas avícolas de Austria presentaban altas cargas microbianas en el agua potable, atribuidas en gran medida a prácticas inadecuadas de gestión de las líneas de agua, incluido el uso de concentraciones de desinfectante subóptimas y un tratamiento inconsistente. En particular, no se observaron diferencias significativas entre los tratamientos químicos y los tratamientos combinados de líneas de agua químicos y mecánicos. La microbiota prevalente en las aves de corral incluía Pseudomonas spp., Stenotrophomonas spp. y Ochrobactrum spp. Además, estos aislados de muestras de tratamiento de la línea de agua antes y después mostraron patrones de resistencia aumentados a los antimicrobianos de uso común para tratar infecciones bacterianas en aves de corral. Nuestros resultados subrayan la necesidad de que los estudios futuros consideren la gestión adecuada del suministro de agua en las granjas avícolas en términos del enfoque One Health, para proteger la salud pública y para concienciar a los ganaderos y veterinarios.
Declaración de disponibilidad de datos
Los conjuntos de datos presentados en este estudio se pueden encontrar en repositorios en línea. Los nombres de los repositorios y los números de acceso se pueden encontrar en el artículo/Material complementario.
Contribuciones de los autores
AM: Curación de datos, Redacción – borrador original, Investigación, Metodología, Software, Visualización. MM: Curación de datos, Metodología, Redacción, revisión y edición. KW: Curación de datos, metodología, redacción, revisión y edición. AS: Metodología, Redacción – revisión y edición, Investigación. IK: Investigación, Metodología, Redacción – revisión y edición. CF: Escritura – revisión y edición. IL: Análisis formal, Metodología, Redacción – revisión y edición. MW: Conceptualización, Redacción – revisión y edición. BS: Conceptualización, Curación de datos, Adquisición de fondos, Administración de proyectos, Recursos, Supervisión, Validación, Redacción – borrador original, Redacción – revisión y edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. El centro de competencia FFoQSI está financiado por los ministerios austriacos BMVIT, BMDW y las provincias austriacas de Baja Austria, Alta Austria y Viena en el marco de COMET – Centros de Competencia para Tecnologías Excelentes. El programa COMET está gestionado por la Agencia Austriaca de Promoción de la Investigación FFG.
Reconocimientos
Nos gustaría agradecer a Egon Singer y al equipo del laboratorio privado HYGIENICUM GmbH Graz por la organización del muestreo y la buena cooperación. Los autores desean reconocer y agradecer a Sonja Muri-Klinger. por su valiosa ayuda en el laboratorio. Además, estamos agradecidos por el cuidadoso aporte y revisión del texto manuscrito por parte de Patrick-Julian Mester.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1254442/full#supplementary-material
Notas
1. ^https://blast.ncbi.nlm.nih.gov/Blast.cgi
2. ^https://www.ncbi.nlm.nih.gov/genbank
3. ^www.r-project.org
Referencias
1. Savin, M, Alexander, J, Bierbaum, G, Hammerl, JA, Hembach, N, Schwartz, T, et al. Bacterias resistentes a los antibióticos, genes de resistencia a los antibióticos y residuos de antibióticos en las aguas residuales de un matadero de aves de corral después de tratamientos convencionales y avanzados. Sci Rep. (2021) 11:16622–11. doi: 10.1038/s41598-021-96169-y
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Oficina de Estadística de Austria. Hühnerproduktion 2021: Zahl der Bruteier Gestiegen, Mehr Schlachtungen; (2020). Disponible en: https://www.statistik.at/en/statistics/agriculture-and-forestry/animals-animal-production (consultado el 21 de marzo de 2023)
3. Rey, AJ. Calidad del agua y producción avícola. Poult Sci. (1996) 75:852–3. doi: 10.3382/PS.0750852
4. Maharjan, P, Clark, T, Kuenzel, C, Foy, MK, y Watkins, S. Monitoreo en granja del impacto del saneamiento del sistema de agua en los niveles microbianos en los suministros de agua de los galpones de pollos de engorde. J Appl Poult Res. (2016) 25:266–71. doi: 10.3382/JAPR/PFW010
5. Pesti, GM, Amato, SV y Minear, LR. Consumo de agua de pollos de engorde en condiciones comerciales. Poult Sci. (1985) 64:803–8. doi: 10.3382/ps.0640803
6. Lilliard, HS, y Thomson, JE. Eficacia del peróxido de hidrógeno como bactericida en el agua de enfriadores de aves de corral. J Ciencia de los alimentos. (1983) 48:125–6. doi: 10.1111/j.1365-2621.1983.tb14804.x
7. Maharjan, P, Huff, G, Zhang, W y Watkins, S. Efectos del saneamiento con cloro y peróxido de hidrógeno en agua con bajo contenido bacteriano en el modelo de formación de biopelículas de las líneas de agua de las naves de cría de aves de corral. Poult Sci. (2017) 96:2145–50. doi: 10.3382/PS/PEX009
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Reglamento (CE) n.º 178/2002 del Parlamento Europeo y del Consejo. de 28 de enero de 2002 por el que se establecen los principios y requisitos generales de la legislación alimentaria, se crea la Autoridad Europea de Seguridad Alimentaria y se fijan procedimientos relativos a la seguridad alimentaria; (2002). Disponible en: https://eur-lex.europa.eu/legal-content/EN/ALL/?uri=celex%3A32002R0178 (consultado el 10 de marzo de 2021)
9. Directiva 98/83/CE del Consejo. sobre la calidad de las aguas destinadas al consumo humano; (1998). Disponible en: https://leap.unep.org/countries/eu/national-legislation/council-directive-9883ec-quality-water-intended-human-consumption (consultado el 12 de marzo de 2021)
10. BGBl. II Nº 100/2007. Gesamte Rechtsvorschrift für Geflügelhygieneverordnung; (2007). Disponible en: https://www.ris.bka.gv.at/GeltendeFassung.wxe?Abfrage=Bundesnormen&Gesetzesnummer=20005323 (consultado el 19 de junio de 2023)
11. Di Martino, G, Piccirillo, A, Giacomelli, M, Comin, D, Gallina, A, Capello, K, et al. Calidad microbiológica, química y física del agua potable para pavos comerciales: un estudio transversal. Poult Sci. (2018) 97:2880–6. doi: 10.3382/ps/pey130
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Maes, S, Vackier, T, Nguyen Huu, S, Heyndrickx, M, Steenackers, H, Sampers, I, et al. Ocurrencia y caracterización de biofilms en sistemas de agua potable de naves de pollos de engorde. BMC Microbiol. (2019) 19:77–15. doi: 10.1186/s12866-019-1451-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Mateus-Vargas, RH, Kemper, N, Volkmann, N, Kietzmann, M, Meissner, J, y Schulz, J. ¿Campos electromagnéticos de baja frecuencia como alternativa para desinfectar el agua de los sistemas de bebederos en la producción avícola? PLoS Uno. (2019) 14:e0220302–17. doi: 10.1371/journal.pone.0220302
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Chispas, NHC. El papel del sistema de suministro de agua en la infección y el control de Campylobacter en pollos. Worlds Poult Sci J. (2009) 65:459–74. doi: 10.1017/S0043933909000324
15. Lehtola, MJ, Miettinen, IT, Lampola, T, Hirvonen, A, Vartiainen, T, y Martikainen, PJ. Los materiales de las tuberías modifican la eficacia de los desinfectantes en los sistemas de distribución de agua potable. Res. de Agua. (2005) 39:1962–71. doi: 10.1016/j.watres.2005.03.009
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Mathieu, L, Francius, G, El Zein, R, Angel, E, y Block, JC. Repoblación bacteriana de las paredes de las tuberías de agua potable después de la cloración. Bioincrustación. (2016) 32:925–34. doi: 10.1080/08927014.2016.1212989
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Trachoo, N, y Frank, JF. Eficacia de los desinfectantes químicos contra las biopelículas que contienen Campylobacter jejuni. J Food Prot. (2002) 65:1117–21. doi: 10.4315/0362-028X-65.7.1117
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Mantzios, T, Tsiouris, V, Kiskinis, K, Economou, V, Petridou, E, Tsitsos, A, et al. Investigación in vitro de la actividad antibacteriana de nueve desinfectantes comerciales de agua, acidificantes y mezclas de glicéridos contra las bacterias zoonóticas más importantes de las aves de corral. Patógenos. (2023) 12:381. doi: 10.3390/pathogens12030381
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Huang, K, Mao, Y, Zhao, F, Zhang, XX, Ju, F, Ye, L, et al. Bacterias de vida libre y patógenos bacterianos potenciales en plantas de tratamiento de aguas residuales. Aplicación Microbiol Biotechnol. (2018) 102:2455–64. doi: 10.1007/s00253-018-8796-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Falkinham, JO, Pruden, A y Edwards, M. Patógenos de plomería de premisa oportunista: patógenos cada vez más importantes en el agua potable. Patógenos. (2015) 4:373–86. doi: 10.3390/pathogens4020373
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Racewicz, P, Majewski, M, Biesiada, H, Nowaczewski, S, Wilczyński, J, Wystalska, D, et al. Prevalencia y caracterización de genes de resistencia a antimicrobianos e integrones de clase 1 y 2 en Escherichia coli multirresistente aislada de producción avícola. Sci Rep. (2022) 12:6062. doi: 10.1038/s41598-022-09996-y
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Vermeulen, B, De Backer, P, y Remon, JP. Administración de medicamentos a aves de corral. Adv Droga Deliv Rev. (2002) 54:795–803. doi: 10.1016/S0169-409X(02)00069-8
23. Jonsson, ME, Chriél, M, Norström, M, y Hofshagen, M. Efecto del clima y el entorno agrícola en la colonización de Campylobacter spp. en parvadas de pollos de engorde noruegos. Prev Vet Med. (2012) 107:95–104. doi: 10.1016/j.prevetmed.2012.05.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Lyngstad, TM, Jonsson, ME, Hofshagen, M, y Heier, BT. Factores de riesgo asociados con la presencia de especies de Campylobacter en parvadas de pollos de engorde noruegos. Poult Sci. (2008) 87:1987–94. doi: 10.3382/ps.2008-00132
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Sahin, O, Morishita, TY y Zhang, Q. Colonización por Campylobacter en aves de corral: fuentes de infección y modos de transmisión. Anim Health Res Rev. (2002) 3:95–105. doi: 10.1079/ahrr200244
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Shane, SM. Infección por Campylobacter en aves de corral comerciales. OIE Rev Sci Tech. (2000) 19:376–95. doi: 10.20506/rst.19.2.1224
27.ISO 10272-1:2006. Microbiología de los alimentos y de los piensos – Método horizontal para la detección y enumeración de Campylobacter spp. – Parte 1: Método de detección. Ginebra, Suiza: Organización Internacional de Normalización (2006).
28.ISO 4833-2:2013. Microbiología de la cadena trófica: Método horizontal para la enumeración de microorganismos—Parte 1: Recuento de colonias a 30° C mediante la técnica de la placa de vertido. Ginebra, Suiza: Organización Internacional de Normalización (2013).
29.ISO 21528-2:2017. Microbiología de la cadena trófica—Método horizontal para la detección y enumeración de enterobacterias—Parte 2: Técnica de recuento de colonias. Ginebra, Suiza: Organización Internacional de Normalización (2017).
30. Walsh, PS, Metzger, DA e Higuchi, R. Chelex 100 como medio para la extracción simple de ADN para la tipificación basada en PCR a partir de material forense. BioTécnicas. (1991) 54:134–9. doi: 10.2144/000114018
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Wang, G, Clark, CG, Taylor, TM, Pucknell, C, Barton, C, Price, L, et al. Ensayo de PCR múltiple de colonias para la identificación y diferenciación de Campylobacter jejuni, C. coli, C. lari, C. Upsaliensis y C. fetus subsp. fetus. Sociedad. (2002) 40:4744–7. doi: 10.1128/JCM.40.12.4744-4747.2002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Juretschko, S, Timmermann, G, Schmid, M, Schleifer, KH, Pommerening-Röser, A, Koops, HP, et al. Análisis molecular y convencional combinado de la diversidad de bacterias nitrificantes en lodos activados: Nitrosococcus mobilis y bacterias similares a Nitrospira como poblaciones dominantes. Appl Environ Microbiol. (1998) 64:3042–51. doi: 10.1128/AEM.64.8.3042-3051.1998
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Weisburg, WG, Graneros, SM, Pelletier, DA, y Lane, DJ. Amplificación de ADN ribosómico 16S para estudio filogenético. J Bacteriol. (1991) 173:697–703. doi: 10.1128/jb.173.2.697-703.1991
34. Geospiza Inc. Visor de cromatograma FinchTV 1.4.0; (2004). Disponible en: https://digitalworldbiology.com/FinchTV (consultado el 18 de diciembre de 2021)
35. Kumar, S, Stecher, G, Li, M, Knyaz, C y Tamura, K. MEGA X: análisis de genética evolutiva molecular a través de plataformas informáticas. Mol Biol Evol. (2018) 35:1547–9. DOI: 10.1093/molbev/msy096
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Reimer, LC, Sardà Carbasse, J, Koblitz, J, Ebeling, C, Podstawka, A, y Overmann, J. BacDive en 2022: la base de conocimientos para datos estandarizados de bacterias y arqueas. Ácidos nucleicos Res. (2022) 50:D741–6. doi: 10.1093/nar/gkab961
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Parte, AC, Carbasse, JS, Meier-Kolthoff, JP, Reimer, LC y Göker, M. La lista de nombres procariotas con nomenclatura permanente (LPSN) se traslada a la DSMZ. Int J Syst Evol Microbiol. (2020) 70:5607–12. doi: 10.1099/ijsem.0.004332
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Magiorakos, AP, Srinivasan, A, Carey, RB, Carmeli, Y, Falagas, ME, Giske, CG, et al. Bacterias multirresistentes, extensivamente resistentes a los fármacos y panrresistentes: una propuesta internacional de expertos para definiciones estándar provisionales de la resistencia adquirida. Clin Microbiol Infectar. (2012) 18:268–81. doi: 10.1111/j.1469-0691.2011.03570.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Instituto de Normas Clínicas y de Laboratorio (CLSI). Normas de rendimiento para las pruebas de susceptibilidad a la dilución y disco antimicrobiano para bacterias aisladas de animales. Suplemento CLSI VET01S. 5ª ed. Wayne, PA: Instituto de Estándares Clínicos y de Laboratorio (2020). Disponible en: http://clsivet.org/Login.aspx
40. Instituto de Estándares Clínicos y de Laboratorio (CLSI). VET01S Normas de rendimiento para discos antimicrobianos y pruebas de susceptibilidad a la dilución para bacterias aisladas de animales. Un suplemento informativo para aplicaciones globales desarrollado a través del Instituto de Estándares Clínicos y de Laboratorio Wayne, PA: Instituto de Estándares Clínicos y de Laboratorio (2015). Disponible en: https://clsi.org/
41. Instituto de Normas Clínicas y de Laboratorio (CLSI). Estándares de desempeño M100 para pruebas de susceptibilidad a los antimicrobianos Wayne, PA: Instituto de Estándares Clínicos y de Laboratorio (2021). Disponible en: https://clsi.org/standards/products/microbiology/documents/m100/
42. Heinemann, C, Leubner, CD, Savin, M, Sib, E, Schmithausen, RM y Steinhoff-Wagner, J. Nota de investigación: rastreo de vías de entrada y persistencia de bacterias patógenas facultativas y resistentes a los antibióticos en una granja comercial de pollos de engorde con problemas de salud sustanciales. Poult Sci. (2020) 99:5481–6. doi: 10.1016/J.PSJ.2020.08.050
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Hynds, PD, Misstear, BD y Gill, LW. Desarrollo de un modelo de susceptibilidad a la contaminación microbiana para fuentes privadas de agua subterránea doméstica. Recursos de agua Res. (2012) 48:1–13. doi: 10.1029/2012WR012492
44. Maertens, H, De Reu, K, Van Weyenberg, S, Van Coillie, E, Meyer, E, Meirhaeghe, V, et al. Evaluación de las puntuaciones del higienograma y de los datos relacionados obtenidos tras la limpieza y desinfección de los galpones avícolas de Flandes durante el período 2007 a 2014. Poult Sci. (2018) 97:620–7. doi: 10.3382/ps/pex327
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Zou, Q, Meng, W, Wang, C, Wang, T, Liu, X y Li, D. Dicloroisocianurato de sodio: mejora de la salud de los pollos de engorde mediante la reducción de los niveles microbianos dañinos en la línea de flotación. Front Vet Sci. (2023) 10:1234949. doi: 10.3389/fvets.2023.1234949
Resumen de PubMed | Texto completo de CrossRef | Google Académico
46. Wang, P, Chen, B, Yuan, R, Li, C y Li, Y. Características de la comunidad bacteriana acuática y los factores que influyen en un río urbano. Sci Total Environ. (2016) 569-570:382–9. doi: 10.1016/j.scitotenv.2016.06.130
Resumen de PubMed | Texto completo de CrossRef | Google Académico
47. Gong, Q, Ruan, MD, Niu, MF, Qin, CL, Hou, Y y Guo, JZ. Eficacia inmunitaria de vacunas de ADN basadas en genes oprL y oprF de Pseudomonas aeruginosa en pollos. Poult Sci. (2018) 97:4219–27. doi: 10.3382/PS/PEY307
Resumen de PubMed | Texto completo de CrossRef | Google Académico
48. Lyczak, JB, Cannon, CL, y Pier, GB. Establecimiento de la infección por Pseudomonas aeruginosa: lecciones de un oportunista versátil. Los microbios infectan. (2000) 2:1051–60. doi: 10.1016/S1286-4579(00)01259-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
49. Medts, GD, y Viaene, NJ. Infección por Pseudomonas aeruginosa en una granja de pollos de engorde. Pathol aviar. (1975) 4:233–7. doi: 10.1080/03079457509353870
Resumen de PubMed | Texto completo de CrossRef | Google Académico
50. Walker, SE, Sander, JE, Cline, JL y Helton, JS. Caracterización de aislados de Pseudomonas aeruginosa asociados a mortalidad en pollos de engorde. Avian Dis. (2002) 46:1045–50. doi: 10.1637/0005-2086(2002)046[1045:COPAIA]2.0.CO; 2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
51. Zamberlan da Silva, ME, Filho, IC, Endo, EH, Nakamura, CV, Ueda-Nakamura, T, y Filho, BPD. Caracterización de posibles marcadores de virulencia en Pseudomonas aeruginosa aislada de agua de bebida. Anton Leeuw Int J Gen Mol Microbiol. (2008) 93:323–34. doi: 10.1007/s10482-007-9209-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
52. Teyssier, C, Marchandin, H, Jean-Pierre, H, Diego, I, Darbas, H, Jeannot, JL, et al. Características moleculares y fenotípicas para la identificación de los patógenos oportunistas Ochrobactrum spp. J Med Microbiol. (2005) 54:945–53. doi: 10.1099/jmm.0.46116-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
53. Pompilio, A, Crocetta, V, De Nicola, S, Verginelli, F, Fiscarelli, E, Bonaventura, D, et al. Patogenicidad cooperativa en la fibrosis quística: Stenotrophomonas maltophilia modula la virulencia de Pseudomonas aeruginosa en biofilm mixto. Microbiol frontal. (2015) 6:1–13. doi: 10.3389/fmicb.2015.00951
Resumen de PubMed | Texto completo de CrossRef | Google Académico
54. Magajna, BA, y Schraft, H. Las células de biopelícula de Campylobacter jejuni se vuelven viables pero no cultivables (VBNC) en condiciones de bajo contenido de nutrientes a 4 °C más rápidamente que sus contrapartes planctónicas. Control de Alimentos. (2015) 50:45–50. doi: 10.1016/j.foodcont.2014.08.022
55. Strakova, N, Korena, K, Gelbicova, T, Kulich, P, y Karpiskova, R. Un método de cultivo rápido para la detección de Campylobacter en ambientes acuáticos. Int J Environ Res Salud Pública. (2021) 18:6098. doi: 10.3390/ijerph18116098
Resumen de PubMed | Texto completo de CrossRef | Google Académico
56. Lv, R, Wang, K, Feng, J, Heeney, DD, Liu, D y Lu, X. Detección y cuantificación de Campylobacter jejuni viable pero no cultivable. Microbiol frontal. (2020) 10:1–8. doi: 10.3389/fmicb.2019.02920
Resumen de PubMed | Texto completo de CrossRef | Google Académico
57. Cools, I, Uyttendaele, M, Caro, C, D’Haese, E, Nelis, HJ y Debevere, J. Supervivencia de cepas de Campylobacter jejuni de diferente origen en agua potable. J Appl Microbiol. (2003) 94:886–92. doi: 10.1046/j.1365-2672.2003.01916.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
58. Culotti, A, y Packman, AI. Pseudomonas aeruginosa facilita el crecimiento de Campylobacter jejuni en biopelículas en condiciones de flujo óxico. FEMS Microbiol Ecol. (2015) 91:136. doi: 10.1093/femsec/fiv136
Resumen de PubMed | Texto completo de CrossRef | Google Académico
59. Hanning, I, Jarquin, R, y Slavik, M. Campylobacter jejuni como colonizador secundario de biopelículas avícolas. J Appl Microbiol. (2008) 105:1199–208. doi: 10.1111/j.1365-2672.2008.03853.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
60. Aslam, B, Khurshid, M, Arshad, MI, Muzammil, S, Rasool, M, Yasmeen, N, et al. Resistencia a los antibióticos: una salud, una visión del mundo. Las células frontales infectan el microbiol. (2021) 11:771510. doi: 10.3389/fcimb.2021.771510
Resumen de PubMed | Texto completo de CrossRef | Google Académico
61. Huijbers, PMC, Blaak, H, De Jong, MCM, Graat, EAM, Vandenbroucke-Grauls, CMJE, y De Roda Husman, AM. Papel del medio ambiente en la transmisión de la resistencia a los antimicrobianos a los seres humanos: una revisión. Environ Sci Technol. (2015) 49:11993–2004. doi: 10.1021/acs.est.5b02566
62. Yang, Y, Ashworth, AJ, Willett, C, Cook, K, Upadhyay, A, Owens, PR, et al. Revisión de la resistencia, ecología, diseminación y mitigación a los antibióticos en el frente del sistema de aves de corral de pollos de engorde de EE. UU. Microbiol. (2019) 10:1–10. doi: 10.3389/fmicb.2019.02639
Resumen de PubMed | Texto completo de CrossRef | Google Académico
63. Agencia Austriaca de Salud y Seguridad Alimentaria GmbH. Antibiotika-Vertriebsmengen in der Veterinärmedizin; (2022). Disponible en: https://www.ages.at/tier/tierarzneimittel-hormone/antibiotika-vertriebsmengen-in-der-veterinaermedizin (consultado el 27 de septiembre de 2023)
64. BGBl. I Nr. 36/2008. Bundesgesetz, mit dem das Tierseuchengesetz, das Arzneiwareneinfuhrgesetz das Tierarzneimittelkontrollgesetz und das Rezeptpflichtgesetz Geändert Werden (Veterinärrechtsänderungsgesetz 2007); (2002). Disponible en: https://www.ris.bka.gv.at/eli/bgbl/I/2008/36/20080111 (Consultado el 17 de abril de 2023)
65. Griesbacher, A, Schließnig, H, Weber, S y Fuchs, K. Uso de antimicrobianos en parvadas de aves de corral en Austria entre 2013 y 2019. Rec. Veterinario (2021) 189:E508. DOI: 10.1002/VTR.508
Resumen de PubMed | Texto completo de CrossRef | Google Académico
66. BMASGK-74330/0008-IX/B/15/2018, AVN Nr. 2018/11a. Leitlinien für den Sorgfältigen Umgang mit Antibakteriell Wirksamen Tierarzneimitteln; (2018). Disponible en: https://www.ris.bka.gv.at/Dokumente/Avn/AVN_20181129_AVN_2018_11a_2/201811a_AntibiotokaLL_Beilage.pdfsig (consultado el 05 de marzo de 2023)
67. Qualitätsgeflügelvereinigung (QGV). Antibiotikareport 2022 der Österreichischen Qualitätsgeflügelvereinigung; (2022). Disponible en: https://www.qgv.at/allgemein/antibiotikareport-2022 (Consultado el 27 de septiembre de 2023)
68. Roth, N, Käsbohrer, A, Mayrhofer, S, Zitz, U, Hofacre, C, y Domig, KJ. La aplicación de antibióticos en la producción de pollos de engorde y la resistencia a los antibióticos resultante en Escherichia coli: una visión global. Poult Sci. (2019) 98:1791–804. doi: 10.3382/ps/pey539
Resumen de PubMed | Texto completo de CrossRef | Google Académico
69. Carson, C, Li, XZ, Agunos, A, Loest, D, Chapman, B, Finley, R, et al. Salmonella enterica serovar Heidelberg resistente a ceftiofur de origen avícola: un perfil de riesgo utilizando el marco del Codex. Epidemiol Infect. (2019) 147:E296. doi: 10.1017/S0950268819001778
Resumen de PubMed | Texto completo de CrossRef | Google Académico
70. Liljebjelke, KA, Hofacre, CL, White, DG, Ayers, S, Lee, MD y Maurer, JJ. Diversidad de fenotipos de resistencia a los antimicrobianos en Salmonella aislada de granjas avícolas comerciales. Front Vet Sci. (2017) 4:96. doi: 10.3389/fvets.2017.00096
Resumen de PubMed | Texto completo de CrossRef | Google Académico
71. Velásquez, CG, Macklin, KS, Kumar, S, Bailey, M, Ebner, PE, Oliver, HF, et al. Prevalencia y patrones de resistencia a los antimicrobianos de Salmonella aislada de granjas avícolas en el sureste de los Estados Unidos. Poult Sci. (2018) 97:2144–52. doi: 10.3382/ps/pex449
Resumen de PubMed | Texto completo de CrossRef | Google Académico
72. Organización Mundial de la Salud (OMS). Antimicrobianos de importancia crítica para la medicina humana. 6ª Revisión 2018. Ginebra, Suiza: Organización Mundial de la Salud (2019).
73. Aldeyab, MA, Harbarth, S, Vernaz, N, Kearney, MP, Scott, MG, Darwish Elhajji, FW, et al. El impacto del uso de antibióticos en la incidencia y el patrón de resistencia de las bacterias productoras de betalactamasas de espectro extendido en entornos de atención primaria y secundaria. Hno. J Clin Pharmacol. (2012) 74:171–9. doi: 10.1111/j.1365-2125.2011.04161.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
74. Lu, SY, Zhang, YL, Geng, SN, Li, TY, Ye, ZM, Zhang, DS, et al. Alta diversidad de bacterias productoras de betalactamasas de espectro extendido en un hábitat urbano de sedimentos fluviales. Appl Environ Microbiol. (2010) 76:5972–6. doi: 10.1128/AEM.00711-10
Resumen de PubMed | Texto completo de CrossRef | Google Académico
75. Slama, TG. Resistencia a antibióticos gramnegativos: hay un precio que pagar. Cuidado de críticos. (2008) 12:1–7. doi: 10.1186/ccXXXX
76. Ashbolt, Nueva Jersey. Contaminación microbiana del agua potable y de la salud humana por los sistemas de agua comunitarios. Curr Environ Health Rep. (2015) 2:95–106. doi: 10.1007/s40572-014-0037-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
77. Rilstone, V, Vignale, L, Craddock, J, Cushing, A, Filion, Y, y Champagne, P. El papel de los antibióticos y los metales pesados en el desarrollo, la promoción y la diseminación de la resistencia a los antimicrobianos en las biopelículas del agua potable. Quimiosfera. (2021) 282:131048. doi: 10.1016/j.chemosphere.2021.131048
Resumen de PubMed | Texto completo de CrossRef | Google Académico
78. Agunos, A, Léger, D y Carson, C. Revisión de la terapia antimicrobiana de enfermedades bacterianas seleccionadas en pollos de engorde en Canadá. ¿Puede Vet J. (2012) 53:1289–300.
79. Alfifi, A, Christensen, JP, Hounmanou, YMG, Sandberg, M y Dalsgaard, A. Caracterización de Escherichia coli y otras bacterias aisladas de pollos de engorde condenados en un matadero danés. Microbiol frontal. (2022) 13:1–13. doi: 10.3389/fmicb.2022.1020586
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: tratamiento de la línea de agua, patógenos oportunistas, salud avícola, Pseudomonas, susceptibilidad antimicrobiana
Cita: Mustedanagic A, Matt M, Weyermair K, Schrattenecker A, Kubitza I, Firth CL, Loncaric I, Wagner M y Stessl B (2023) Evaluación de la calidad microbiana en el agua potable de las aves de corral en las granjas de Austria. Frente. Vet. Sci. 10:1254442. doi: 10.3389/fvets.2023.1254442
Recibido: 14 de julio de 2023; Aceptado: 07 de noviembre de 2023;
Publicado: 22 Noviembre 2023.
Editado por:
Orhan Sahin, Universidad Estatal de Iowa, Estados Unidos
Revisado por:
Marwa Ibrahim Abd El-Hamid, Universidad de Zagazig, Egipto
Issmat I. Kassem, Universidad de Georgia, Estados Unidos
Derechos de autor © 2023 Mustedanagic, Matt, Weyermair, Schrattenecker, Kubitza, Firth, Loncaric, Wagner y Stessl. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Beatrix Stessl, Beatrix.Stessl@vetmeduni.ac.at
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía