Identificación de biomarcadores potenciales para el fallo de la barrera intestinal en pollos de engorde
Identificación de biomarcadores potenciales para el fallo de la barrera intestinal en pollos de engorde
- 1Novus International, Inc., St. Charles, MO, EE. UU.
- 2Departamento de Ciencias de la Aves, Universidad de Arkansas, Fayetteville, AR, EE. UU.
El objetivo del presente estudio era identificar posibles biomarcadores para el fallo de la barrera intestinal en los pollos. Un total de 144 pollos machos de pollos de enmiza Ross 308 se alojaron en 24 jaulas de batería con seis polluelos por jaula. Las jaulas se asignaron al azar a un grupo de control (CON) o a un grupo de fallas de barrera intestinal (GBF). Durante los primeros 13 días, las aves de los grupos CON o GBF recibieron una dieta común de inicio de maíz y soja. El día 14, los pollos CON se cambiaron a una dieta de productores de maíz, y los pollos de GBF se cambiaron a una dieta de productor de centeno-trigo y cebada. Además, el día 21, los pollos de GBF fueron desafiados por vía oral con una vacuna contra la coccidiosis. En los días 21 y 28, las aves se pesaban por jaula y se registró la ingesta de alimento para calcular la tasa de conversión de alimento. En el día 28, un pollo de cada jaula fue sacrificado para recoger muestras intestinales para el análisis morfométrico, sangre para el suero y raspaduras de la mucosa intestinal para la expresión génica. El rendimiento general y la eficiencia de la alimentación se vieron gravemente afectados (P < 0,05) por un modelo GBF en comparación con el grupo CON en los días 21 y 28. El duodeno de las aves GBF tenía vellosidades más anchas, una profundidad de cripta más larga y una relación de profundidad de cripta/altura de vísas más alta que las aves CON. Del mismo modo, las aves GBF tenían una mayor profundidad de cripta en yjunio y íleon en comparación con las aves CON. Los niveles de proteínas de endotoxina y α1-coproteína ácida (AGP) en el suero, así como los niveles de ARNm de interleucina (IL)-8, IL-1β, factor de crecimiento transformador (TGF)-β4 y proteína de unión a ácidos grasos (FABP) 6 aumentaron (P < 0,05) en Los resultados del presente estudio sugieren que la endotoxina sérica y la AGP, así como la expresión génica de FABP2, FABP6, ILP6, IL-1β, TGF-β4, occludina y MUC2 en la mucosa pueden funcionar como biomarcadores potenciales para la salud de la barrera intestinal en los pollos.
Introducción
La función de barrera es un aspecto crítico de la salud intestinal. El estrés oxidativo, la proteína poco digerible y la coccidiosis son algunos ejemplos que pueden causar el fallo de la barrera intestinal (1-5). Sin embargo, como consecuencia de la eliminación de los promotores del crecimiento antimicrobiano, han surgido nuevas enfermedades multifactoriales que causan enteritis y trastornos intestinales de origen desconocido en los pollos de enmbril, causando impactos negativos en la salud y el rendimiento (-6-9). Entre ellos, se ha informado de disbacteriosis, definida como la presencia de una microbiota cualitativa y/o cuantitativamente anormal en las partes proximales del intestino delgado, asociada con una reducción de digestibilidad de los nutrientes, función de barrera intestinal alterada, translocación bacteriana y respuestas inflamatorias (4, 5, 10). Sin embargo, más recientemente, la mala salud intestinal también se ha asociado con la codronecrosis bacteriana con osteomielitis en pollos y criadores de enmado (11 a-1). Como el órgano más grande del cuerpo, el intestino sirve como una barrera selectiva para absorber nutrientes y fluidos en el cuerpo, al tiempo que excluye las moléculas y patógenos indeseables (3, 14, 15). Por lo tanto, la función adecuada de la barrera intestinal es esencial para mantener una salud y un equilibrio óptimos en todo el cuerpo, y representa una línea clave de defensa contra los antígenos extraños del medio ambiente (16). La primera capa de barrera intestinal es la capa de moco extrínseca compuesta por una capa externa asociada con bacterias y una capa interna con altas concentraciones de IgA y mucina secretoras. La capa exterior está unida libremente al epitelio. La capa interna es adherente a la segunda capa de barrera intestinal, las células epiteliales intestinales (IEC). Los IEC son una sola capa de células epiteliales que separan la luz intestinal de la lámina propia subyacente (17-19). Estas células epiteliales deben ser capaces de regenerarse rápidamente en caso de daño tisular (14, 20, 21). Los enterocitos del epitelio apical son responsables de la absorción de nutrientes. Las uniones estrechas (TJ) sellan el espacio paracelular entre las células epiteliales adyacentes y regulan la permeabilidad de la barrera intestinal al prevenir la difusión de microorganismos y antígenos (22, 23). Dado que IEC es el tipo de célula principal que entra en contacto con el entorno externo, actúan como la primera línea de defensa del anfitrión. A pesar de su derivación no hematopoyética, la IEC representa un elemento central de la inmunidad innata dentro del tejido linfoide asociado al intestino, mostrando una amplia gama de funciones inmunes. De hecho, la IEC es capaz de reconocer patógenos a través de la expresión de receptores inmunes innatos, la liberación de moléculas antimicrobianas y la secreción de un gran número de hormonas, neurotransmisor, enzimas, así como citoquinas y quimiocinas que unen respuestas inmunes innatas y adaptativas (24-6). Por lo tanto, cualquier daño directo o indirecto en la IEC puede causar una ruptura en la barrera intestinal y, en consecuencia, la interrupción de la homeostasis inmune normal de la mucosa que potencialmente puede conducir a una inflamación intestinal y sistémica crónica incontrolada (27,28).
Varios investigadores han descrito las vías asociadas con la interrupción de las redes de proteínas que conectan las células epiteliales por mediadores inflamatorios, como hormonas, especies de radicales libres de oxígeno, enzimas, así como múltiples citocinas proinflamatorias (27, 29, 30). También se ha demostrado que la alimentación de la grasa oxidada/no conservada aumenta las tasas de rotación epitelial intestinal y aumenta la apoptosis en las puntas de los vilos en aves de corral y cerdos (31). Se ha demostrado que los polisacáridos no a la astardos (NSP), como los β-glucanos y los pentosanes, tienen una influencia perjudicial en la utilización de nutrientes en los engordedores al aumentar la viscosidad de la digesta y reducir la digestibilidad de los nutrientes (por ejemplo, grasa y proteínas) (32, 33), lo que podría Actualmente, no se han descrito biomarcadores como herramientas para evaluar la inflamación intestinal o el fallo de la barrera intestinal en pollos de enmado. El objetivo del presente estudio no era determinar los efectos individuales de los ingredientes de la dieta o el desafío de la coccidia en la salud intestinal, sino identificar posibles biomarcadores para el fracaso de la barrera intestinal. Por lo tanto, intentamos exacerbar el fracaso de la barrera intestinal alimentando una dieta alta de NSP que contiene centeno, trigo y cebada para inducir una alta viscosidad de digesta (4, 5) en combinación con una vacunación contra la coccidiosis de 2 veces para inducir un desafío de salud intestinal.
Materiales y métodos
Fuente animal y dietas
Un total de 144 pollos machos Ross 308 fueron alojados al azar en 24 jaulas de batería con seis polluelos por jaula en habitaciones controladas por el medio ambiente. Para evitar la contaminación cruzada de la vacuna contra la coccidiosis, las aves del grupo de control (CON) y del grupo de falla de barrera intestinal (GBF) se alojaron en dos habitaciones separadas pero idénticamente controladas. La temperatura se mantuvo a 34 °C durante los primeros 5 días y luego se redujo gradualmente de acuerdo con las prácticas normales de manejo, hasta que se logró una temperatura de 23 °C. Se proporcionó iluminación las 24 horas del día. Durante los primeros 13 días, las aves de los grupos CON o GBF recibieron una dieta de inicio común de maíz y soja (Tabla 1). El día 14, las aves del grupo CON se cambiaron a una dieta de maíz-soja (28 días) y el grupo GBF se cambió a la dieta de centeno-trigo-cebada (Tabla 1). Las dietas experimentales se formularon para aproximar los requisitos nutricionales de los pollos de engorde (34). El día 21, las aves en tratamiento con GBF fueron desafiadas por vía oral con 2 veces la dosis de la vacuna contra la coccidiosis AdventTM, una mezcla de Eimeria acervulina, Eimeria maxima y Eimeria tenella (Huvepharma Sofia, Bulgaria). Todos los procedimientos de investigación fueron revisados y aprobados por un veterinario con licencia y también siguieron los protocolos descritos anteriormente (5, 35), que fueron aprobados por la IACUC de la Universidad de Arkansas. Todos los estudios realizados por Novus International, Inc. están de acuerdo con los estándares de la Guía para el Cuidado y Uso de Animales Agrícolas en la Investigación y la Enseñanza (35).
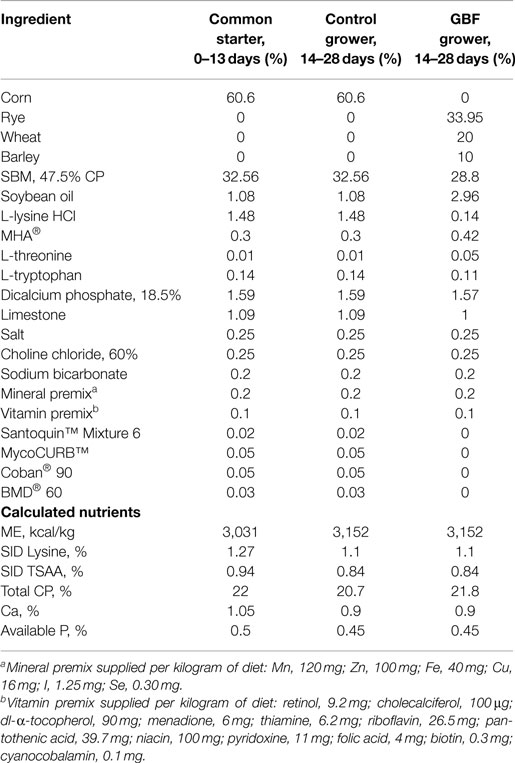 TABLA 1. COMPOSICIÓN DE INGREDIENTES Y CONTENIDO DE NUTRIENTES DE LAS DIETAS COMUNES, DE CONTROL Y DE FALLA DE BARRERA INTESTINAL (GBF), SEGÚN LO QUE SE MUESTRA.
TABLA 1. COMPOSICIÓN DE INGREDIENTES Y CONTENIDO DE NUTRIENTES DE LAS DIETAS COMUNES, DE CONTROL Y DE FALLA DE BARRERA INTESTINAL (GBF), SEGÚN LO QUE SE MUESTRA.
Diseño experimental
Los 144 pollos de día de graniza se asignaron al azar a uno de dos grupos; CON o GBF sobre la base del peso corporal inicial (BW). Cada tratamiento se comprendió de 12 réplicas de seis polluelos cada uno (n = 72/grupo). A los 21 y 28 días, se registraron la tasa de peso corporal, el aumento de peso corporal (BWG) y la ingesta de piensos (FI) en cada jaula para calcular la tasa de conversión de piensos (FCR).
Colección de muestras
A los 28 días de edad, un pollo de cada jaula fue sacrificado por asfixia de CO2 para la recolección de muestras. Se tomó una muestra de sangre de la punción cardíaca con una jeringa, se mantuvo a temperatura ambiente durante 3 horas para permitir la coagulación y se centrífuga (1.000 × g durante 15 minutos a 4 °C) para separar el suero. Después de la eutanasia, se recogió una sección de 1 cm de duodeno desde el centro del duodeno descendente; se recogió una sección de 1 cm de jejuno en el divertículo de Meckel; se recogió una sección de 1 cm de íleon 2 cm antes de la ceca. Todas las secciones intestinales se enjuagaron con un 10% de formalina tampón neutra y luego se fijaron en un volumen de 20 veces de formalina tampón neutra al 10%. Una sección de 10 cm de jejuno se enjuagó con solución salina tamponada con fosfato frío (pH 7.4) y se cortó para raspar la mucosa usando diapositivas de vidrio sin ARNse en tubos de 2 ml con 1 ml de ARNlater (Applied Biosystems, NY, EE. UU.). Los raspados de la mucosa se almacenaron a 4 °C durante 24 horas y luego a -20 °C hasta el aislamiento total del ARN.
Preparación de muestras histológicas y medición de la morfometría intestinal
Los segmentos intestinales se recortaron, procesaron e incrustaron en parafina. Se colocó una sección de 5 μm de cada muestra en una diapositiva de vidrio y se tiñó con hematoxilina y eosina para el examen y la medición de morfometría bajo el microscopio de luz Olympus utilizando el software de imágenes Olympus MicroSuiteTM (Center Valley, PA, EE. UU.). Se tomaron cinco mediciones replicadas para cada variable estudiada de cada muestra, y los valores medios se utilizaron en los análisis estadísticos. La altura de los vilos se midió desde la parte superior de las víboras hasta la parte superior de la submucosa. La profundidad de la cripta se midió desde la base hacia arriba hasta la región de transición entre la cripta y las viles. El ancho de los vilos se midió en el centro de cada vilirios, mientras que la relación cripta/villi se determinó como la relación entre la profundidad de la cripta y la altura de los vilirios (36).
Endotoxina sérica y determinación sérica de la proteína de fase aguda α1
La endotoxina se midió con un kit de endotoxina de pollo Elisa de Amsbio (Cambridge, MA, EE. UU.). La proteína de fase aguda, la glicoproteína α1ácido (AGP) se midió utilizando el kit de medición de la glicoproteína α1ácido de pollo del Instituto de Ecosistema Metabólico (Miyagi, Japón). La densidad óptica para ambos kits se determinó a 450 nm utilizando un BIO-TEK ELx800 (Instrumento BIO-TEK, Winooski, VT, EE. UU.).
Reacción en cadena de la polimerasa de transcripción inversa cuantitativa (qRT-PCR)
El ARN total se aisló de muestras de raspado de la mucosa utilizando el kit de aislamiento de ARN total de Clontech NucleoSpin® RNA II (Clontech Laboratories, Inc., CA, EE. UU.). Se utilizó un microgramo de ARN total, una mezcla de oligoelementos de 11 metros de Fluoresentric y una transcriptasa inversa M-MLV (Life Technologies, Grand Island, NY, EE. UU.) para sintetizar el ADNc de acuerdo con las instrucciones de los fabricantes. Los niveles relativos de ARNm de mcina 2 (MUC2), proteína de unión a ácidos grasos (FABP) 2, FABP6, interleucina (IL)-8, IL-1β, factor de crecimiento transformador (TGF)-β4, occludin, zonula occluden (ZO)-1, molécula de adhesión unionesional (JA Los resultados se expresaron como el nivel relativo al gen de limpieza correspondiente actina. Todos los cebadores se verificaron para comprobar la eficiencia y linealidad de la amplificación.
Análisis estadísticos
Todos los datos se probaron para su normalidad y se sometieron a ANOVA unidireccional como un diseño completamente aleatorizado utilizando el procedimiento GLM de SAS (37). Cada jaula se utilizó como unidad experimental para el análisis. El rendimiento del crecimiento, incluidos BW, BWG, FI y FCR, utilizó los datos promedio por jaula. Las mediciones morfométricas intestinales, la endotoxina sérica, la AGP y la qRT-PCR utilizaron mediciones individuales de un ave elegida al azar por jaula. Los datos se expresan como media ± SE.
Resultados
Rendimiento del crecimiento
Los resultados de los parámetros de rendimiento de crecimiento entre los grupos CON y GBF se resumen en la Tabla 3. BW, FI por ave, BWG y FCR a los 21 y 28 días de edad se redujeron drásticamente en los pollos GBF en comparación con los pollos CON (P < 0,05), lo que indica que el modelo GBF comprometió sustancialmente el rendimiento del crecimiento de los pollos.
 TABLA 3. PARÁMETROS DE RENDIMIENTO ENTRE LOS GRUPOS DE CULTIVADORES DE FALLA DE BARRERA INTESTINAL (GBF) DE CONTROL Y CONTROL.
TABLA 3. PARÁMETROS DE RENDIMIENTO ENTRE LOS GRUPOS DE CULTIVADORES DE FALLA DE BARRERA INTESTINAL (GBF) DE CONTROL Y CONTROL.
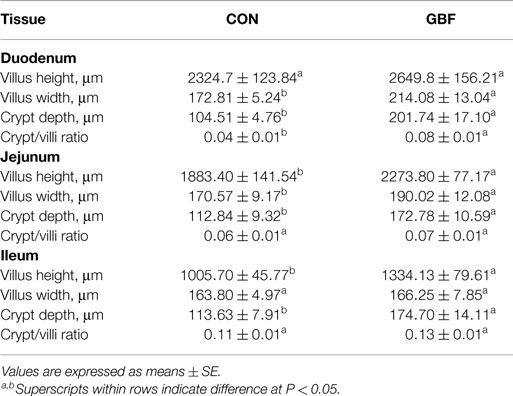
Análisis histomorfométrico
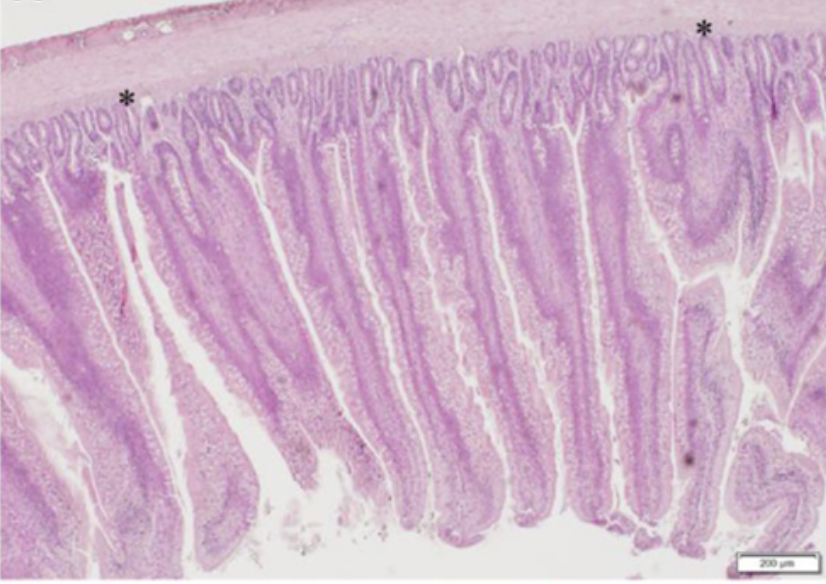
Los resultados del análisis histomorfométrico del duodeno, el jejuno y el tejido ileal entre las gallinas CON y GBF a los 28 días de edad se resumen en la Tabla 4. El duodeno, el jejuno y el íleon mostraron un aumento (P < 0,05) de la profundidad de la cripta (que se muestra como * en la Figura 1) en los pollos GBF en comparación con los pollos CON. Los pollos GBF también tenían vellosidades más anchas en el duodeno y el jejuno, y una mayor relación de cripta/villi en el duodeno en comparación con los pollos CON; sin embargo, la relación cripta/villi no fue diferente en el jejuno (P = 0,064) y el íleo (P = 0,208) porque El aumento de la profundidad de la cripta y/o la relación cripta/villi es una indicación de una mayor necesidad de proliferación celular para mantener una salud intestinal adecuada, lo que sugiere que el modelo GBF generó una barrera intestinal poco saludable.
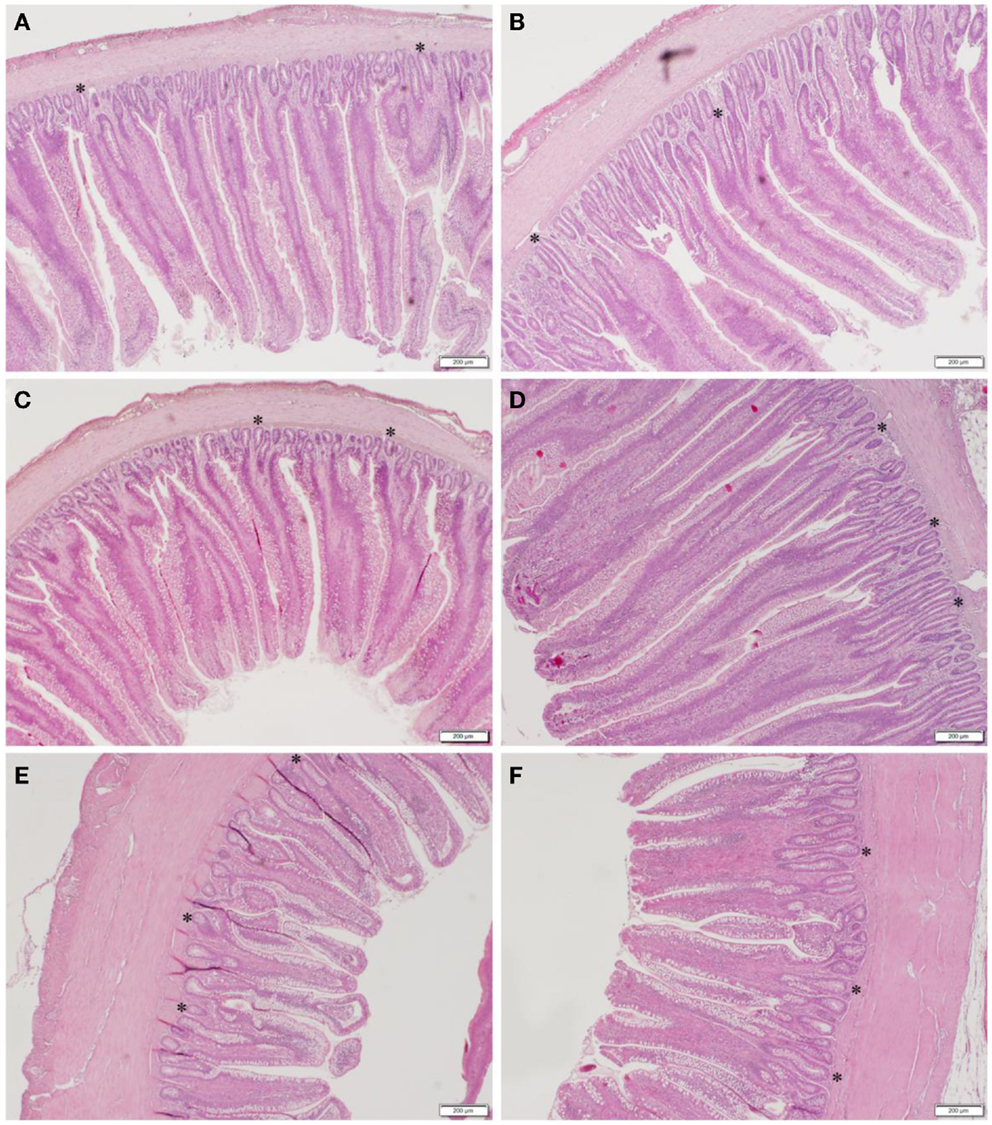 FIGURA 1. IMÁGENES REPRESENTATIVAS DE DUODENUM (A,B), JEJUNUM (C,D) E ILEUM (E,F) EN CONTROL (A,C,E) Y FALLA DE BARRERA INTESTINAL (B,D,F) GRUPOS DE POLLOS ENGORADOS A LOS 28 DÍAS DE EDAD. Los cifrados representativos se muestran como *.
FIGURA 1. IMÁGENES REPRESENTATIVAS DE DUODENUM (A,B), JEJUNUM (C,D) E ILEUM (E,F) EN CONTROL (A,C,E) Y FALLA DE BARRERA INTESTINAL (B,D,F) GRUPOS DE POLLOS ENGORADOS A LOS 28 DÍAS DE EDAD. Los cifrados representativos se muestran como *.
Endotoxina sérica y AGP
La Tabla 5 muestra la comparación de los niveles séricos de AGP y endotoxinas entre los grupos CON y GBF de pollos de enmado a los 28 días de edad. AGP, un marcador de inflamación sistémica, aumentó (P < 0,05) 3,8 veces en aves GBF en comparación con aves CON (Tabla 5), lo que sugiere que la inflamación sistémica estaba ocurriendo en aves GBF. La endotoxina, una toxina liberada por bacterias gramnegativas en el intestino, se aumentó (P < 0,05) en 2,1 veces en el suero de las aves GBF en comparación con las aves CON (Tabla 5), lo que sugiere que se translocó una mayor cantidad de endotoxina de la luz intestinal a la sangre.
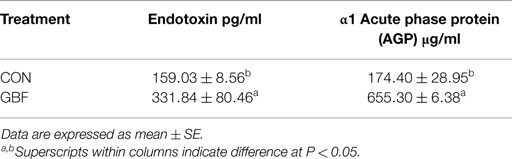 TABLA 5. COMPARACIÓN DE LOS VALORES DE ENDOTOXINA SÉRICA Y PROTEÍNA DE FASE AGUDA Α1 (AGP) ENTRE LOS GRUPOS DE CONTROL Y DE BARRERA INTESTINAL EN POLLOS A LOS 28 DÍAS DE EDAD.
TABLA 5. COMPARACIÓN DE LOS VALORES DE ENDOTOXINA SÉRICA Y PROTEÍNA DE FASE AGUDA Α1 (AGP) ENTRE LOS GRUPOS DE CONTROL Y DE BARRERA INTESTINAL EN POLLOS A LOS 28 DÍAS DE EDAD.
Expresión génica en la mucosa jejunal por qRT-PCR
Los niveles relativos de ARNm de los genes que posiblemente estén involucrados en la función de barrera intestinal y la inflamación en la mucosa jejunal de los pollos de engorderos a los 28 días de edad se muestran en la Tabla 6. Los niveles relativos de ARNm de IL-8, IL-1β, TGF-β4 y FABP6 aumentaron (P < 0,04) en 3-, 1,5-, 2,2- y 7-fold, respectivamente, en los pollos GBF en comparación con los pollos CON. Sin embargo, los niveles de ARNm de FABP2, oclus y MUC2 disminuyeron en un 34 % (P = 0,005), un 24 % (P = 0,107) y un 29 % (P = 0,088), respectivamente, en las aves GBF en comparación con las aves CON. Los niveles de ARNm de catenina, claudina 1, ZO1, JAM2, JAM3, IL-4, IL-6, TLR4, TLR2β y TNF-α no fueron diferentes (P > 0,1) entre los pollos CON y GBF (datos no mostrados).
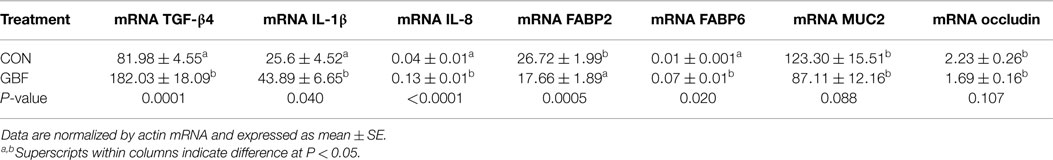 TABLA 6. NIVELES RELATIVOS DE ARNM DE GENES EN LA MUCOSA JEJUNAL ENTRE LOS GRUPOS DE CONTROL Y FALLA DE BARRERA INTESTINAL DE POLLOS A LA PARRILLA A LOS 28 DÍAS DE EDAD.
TABLA 6. NIVELES RELATIVOS DE ARNM DE GENES EN LA MUCOSA JEJUNAL ENTRE LOS GRUPOS DE CONTROL Y FALLA DE BARRERA INTESTINAL DE POLLOS A LA PARRILLA A LOS 28 DÍAS DE EDAD.
Discusión
Es bien sabido que la mala salud intestinal causa impactos negativos en la salud y el rendimiento del crecimiento de los pollos de enla en la industria avícola. Se ha informado que los granos alternativos, como el trigo, la cebada y el centeno que son ricos en NSP, causan una reducción significativa en el rendimiento (38-40). Se han descrito varios mecanismos de la acción de NSP sobre la absorción de nutrientes, incluido un aumento de la viscosidad de la digesta debido a la reducción de la digestibilidad, el engrosamiento de la capa mucosa mucosa intestinal, la apoptosis de células epiteliales y la inflamación causada por la disbacteriosis (10, 31,39). La avícola tiene pocas o ninguna enzima intrínseca capaz de hidrolizar estos NSP, por lo que las altas concentraciones de NSP en el trigo, la cebada o el centeno conducen a una reducción de la digestibilidad de los nutrientes. Los ingredientes de alimentación no digeridos en el intestino proporcionan nutrientes para el crecimiento excesivo de las bacterias en el intestino trasero, lo que conduce a la disbacteriosis. Las dietas altas en NSP también se han asociado con la enteritis necrótica, una enfermedad multifactorial causada por Clostridium perfringens que es probablemente la enfermedad bacteriana más importante en términos de implicaciones económicas en las gallinas de enmado (41). Las consecuencias nutricionales y económicas del aumento de una respuesta inflamatoria en las aves de corral están inversamente relacionadas con el BWG y el rendimiento general (42, 43). En el presente estudio, se utilizó una dieta de trigo-cebada y centeno en combinación con un desafío de coccidios para inducir el fracaso de la barrera intestinal en los pollos de enlachado. El rendimiento general del crecimiento y la eficiencia de la alimentación se redujeron gravemente con este modelo GBF. Estos resultados están de acuerdo con estudios anteriores de que las dietas altas de NSP comprometieron el rendimiento del crecimiento en pollos (4, 5, 44,45).
La morfometría del duodeno, el jejunio y el íleon en pollos CON y GBF a los 28 días de edad se midió bajo el microscopio para confirmar si la dieta de centeno, la cebada y el desafío del trigo y los coccidios generaron un fracaso de la barrera intestinal. Las aves GBF tenían una mayor profundidad de cripta que las aves CON en el duodeno, el jejuno y el íleon, y también una mayor relación de altura de cripta/villi en el duodeno que las aves CON. La profundidad de la cripta y la relación entre la profundidad de la cripta y la altura de los viillus son medidas de eficiencia porque el aumento de la profundidad de la cripta y/o la relación de cripta/villi indica una mayor necesidad de proliferación celular para mantener la integridad de la barrera intestinal (46-48). Además de la profundidad de la cripta más larga, el duodeno y el jejunio de las aves GBF también tenían vellosidades más amplias. Los vellosidades estrechas tienen un mayor área de absorción de nutrientes. La ampliación de los vilos indica menos área de absorción de nutrientes y probablemente también una mayor cantidad de proliferación y acumulación de tejido inmunitario asociado al intestino en el vilo, que es otra indicación de salud intestinal comprometida. El cambio estructural en las aves GBF confirmó que se estaba produciendo un fallo de la barrera intestinal en las aves GBF, lo que puede estar asociado con el bajo rendimiento en este estudio y es consistente con un estudio anterior (49).
El tracto gastrointestinal (GIT) es desafiado repetidamente por antígenos extraños y la mucosa intestinal debe tener la capacidad de restaurarse rápidamente en caso de daño tisular (50). El deterioro de esta frágil barrera conduce a la enteritis y otras enfermedades inflamatorias (9). La mucosa intestinal contiene diferentes tipos de células epiteliales con funciones específicas. IEC controla las poblaciones bacterianas asociadas a la superficie sin alterar el microbioma que son vitales para la salud del huésped (51), y desempeñan un papel esencial en el mantenimiento de la homeostasis intestinal y la función de barrera (52, 53). Como capa unicelular, IEC sirve como barrera protectora contra el medio ambiente externo y mantiene una defensa contra las toxinas y antígenos intraluminales, además de apoyar el transporte de nutrientes y agua (54). IEC están sellados por uniones adherentes (AJ) y TJ que están compuestas de cadherinas, claudinas, occludinas y JAM (29, 55-57). Tras una lesión, IEC se somete a un proceso de curación de heridas que depende de tres eventos celulares: restitución, proliferación y diferenciación (27). Estudios anteriores han demostrado que varios péptidos reguladores, incluidos los factores de crecimiento y las citocinas, son capaces de influir en la restauración de IEC dañado (58).
Las bacterias gramnegativas en el intestino liberan endotoxina durante el crecimiento, la división y la muerte, y la endotoxina luminal pueden translocalizarse a la circulación a través de dos vías: (1) transporte paracelular no específico a través de TJ de células epiteliales, y (2) transporte transcelular a través de los dominios de membrana de balsa lipídica y e TLR4 está involucrado en esta última ruta (60). La falta de diferencia en los niveles de ARNm de TLR4 entre las aves CON y GBF sugiere que la endotoxina probablemente no entró en circulación a través del transporte transcelular. Se ha informado de que los patógenos, como Escherichia coli o C. perfringens, así como sus toxinas elaboradas (por ejemplo, endotoxina o entertoxina) alteran la función de la TJ epitelial y la barrera intestinal (23). Se ha informado de que la mala integridad de la barrera intestinal o la apertura de TJ facilita el transporte paracelular de la endotoxina, lo que aumentará la secreción de citoquinas proinflamatorias y activará la respuesta inmune innata y adaptativa (61, 62). Las citocinas secretadas pueden entrar en la CEI a través del lado basolateral, lo que resulta en un mayor aumento de la inflamación, la interrupción de los complejos de TJ y un aumento del transporte de endotoxinas paracelulares (63). Curiosamente, había niveles detectables de endotoxina en los pollos CON, que en realidad no son el ruido de fondo detectado por el kit ELISA. En este estudio, los pollos CON eran mucho más saludables que los pollos GBF, la endotoxina en el suero de los pollos CON podría ser una difusión paracelular no específica de la endotoxina de la luz intestinal a la circulación. El aumento de los niveles de endotoxina en las aves de GBF indica que la falla de la barrera intestinal aumentó el transporte de la endotoxina de la luz intestinal a la circulación, lo que podría afectar negativamente aún más la integridad de TJ, como lo demuestra la disminución de los niveles de ARNm de occiludino en las aves de la GBF. Occludin, uno de los principales componentes de TJ, está involucrado en la regulación de la difusión intermembrana y la difusión paracelular de moléculas pequeñas (64). La oclusin está regulada en pacientes con enfermedad de Crohn y colitis ulcerosa, dos tipos comunes de enfermedad inflamatoria intestinal en humanos (57, 64), lo que sugiere el importante papel de la oclusluin en la salud intestinal. Sin embargo, no se detectaron diferencias entre las gallinas GBF y CON en la expresión de otros componentes de TJ, como claudin 1, ZO1, JAM2 y JAM3. Claudin 1 es un miembro de la proteína transmembrana de espacila múltiple llamada claudinas, una familia de proteínas con más de 20 miembros, JAM2 y JAM3 son proteínas transmembrana de una sola espa (51, 65, 66). ZO1 es una proteína de placa que actúa como adaptador para conectar las proteínas transmembranas al anillo de actmiosina perijunctional (23). Estos resultados indican que el modelo GBF deteriora la integridad de TJ al reducir la expresión de oclusina, lo que facilita el transporte de la endotoxina de la luz intestinal a la sangre para la circulación sistémica.
También se informó que la endotoxina aumenta la secreción de péptidos de saciedad, lo que reducirá la FI (20). La disminución del rendimiento del crecimiento en las aves GBF podría estar parcialmente asociada con el aumento del péptido de saciedad resultante de los niveles elevados de endotoxinas, aunque el péptido de saciedad no se midió en este estudio.
La glicoproteína α1-ácido, una proteína de fase aguda, se ha utilizado como marcador de la inflamación sistémica en aves de corral (67). El aumento de la AGP en las aves GBF confirma que la inflamación sistémica estaba ocurriendo en las aves GBF, lo que nos llevó a investigar el estado de inflamación local en el intestino. Se ha informado de que los cambios en la microbiota intestinal afectan negativamente la integridad de la barrera intestinal, lo que lleva a una mayor fuga de endotoxina y ácidos grasos, que pueden actuar sobre la TLR4 para activar la inflamación sistémica (68). La activación de los macrófagos a través de TLR es importante para la inflamación y la defensa del huésped contra los patógenos; sin embargo, estudios recientes sugieren que las moléculas no patógenas son capaces de inducir la inflamación a través de TLR2 y TLR4 (16, 69-71). La capacidad de detectar lesiones tisulares e iniciar mecanismos de reparación adecuados es indispensable para la supervivencia de todas las especies superiores. Un aspecto común de todos los tipos de lesiones, causadas por procesos infecciosos, físicos, químicos o inmunes, es un cambio de composición del entorno celular que conduce a la presencia de nuevos patrones moleculares. Estos patrones son reconocidos por un grupo de receptores llamados receptores de reconocimiento de patrones (PRR) y desencadenan respuestas específicas que promueven la restauración de la función tisular, incluida la inflamación y la cicatrización de heridas (20, 72). El reconocimiento de patógenos es fundamental para sobrevivir en un entorno esencialmente hostil que está lleno de microorganismos potencialmente infectivos. Los sistemas de detección de patrones moleculares característicos de los patógenos (patrones moleculares asociados a patógenos, PAMP) se desarrollan al principio de la evolución y están presentes en la mayoría de las especies, incluidas las plantas y los invertebrados (69). Como grupo de PRR altamente conservados, TLR señala la presencia de varios PAMP a los constituyentes celulares del inmune innato y adaptativo (69, 73), por lo tanto, actuando como guardianes para varios sistemas de respuesta altamente eficientes que regulan la homeostasis tisular y protegen al huésped después de una lesión aguda (60, 74). Tras la lesión, el epitelio intestinal se somete a un proceso de curación de heridas (69). Estudios recientes han revelado la activación de la TLR por la microbiota durante el proceso de curación (20). Además, varias citocinas, como TGF-α, TGF-β, IL-1β e IL-2, también se incrementan durante el proceso de curación (16, 75). En este estudio, los niveles de ARNm de TGF-β e IL-1β en los pollos GBF aumentaron, pero los niveles de ARNm de TLR4, TLR2β, TGF-α, IL-4 e IL-6 no fueron diferentes en comparación con los pollos CON. Estos resultados sugieren que la inflamación que se produjo en las aves GBF en este estudio probablemente no esté mediada por la vía TLR2 o TLR4. Sin embargo, en este estudio no se midieron los niveles de ARNm y proteína de TLR3, TLR4 y TLR3. Por lo tanto, no podemos excluir la posibilidad de que la vía TLR esté involucrada en la inflamación en las aves GBF. IL-1β es un importante mediador de la respuesta inflamatoria y está involucrado en una variedad de actividades celulares, incluida la proliferación celular, la diferenciación y la apoptosis (76). TGF-β, un mediador clave de la homeostasis inmune de la mucosa, media la producción de IgA, retiene linfocitos en el intestino y promueve la cicatrización de heridas del epitelio intestinal y la mucosa (75). TGF-β también promueve la proliferación de IEC a través de la activación de la quinasa extracelular regulada por señal (ERK) 1/ERK2 proteína quinasa activada por mitógeno durante la cicatrización de heridas (20). La IL-8 es secretado basolateralmente por el epitelio intestinal en respuesta a bacterias patógenas o citocinas inflamables específicas, y desencadena la migración de neutrófilos y la inflamación en el intestino (73). El aumento de la AGP sistémica y el TGF-β, IL-8 e IL-1β de la mucosa en las aves GBF indican que el modelo GBF aumentó la inflamación intestinal y activó la respuesta inmune innata intestinal y la curación de heridas.
Las mucinas son grandes glicoproteínas que cubren las superficies epiteliales del intestino y forman una capa de moco para proteger las células epiteliales del desafío de salud intestinal. Hay dos tipos principales de mucinas, unidas a la membrana y secretadas (77, 78). En los pollos (Gallus gallus), se han identificado tres mucinas transmembranas (MUC4, MUC13 y MUC16) y cuatro mucinas formadoras de gel (MUC6, MUC2, MUC5ac y MUC5b) (79). En los mamíferos, la MUC2, la mucina secretada por las células de la copa, es la mucina más abundante en el intestino, y se ha informado que su deficiencia aumenta la translocación bacteriana y la inflamación (18, 80). Los estudios evolutivos sugieren que las mucinas comparten un ancestro común, ya que sus estructuras de dominio están bien conservadas en los metazoanos (71, 81). Todas las mucinas (MUC) contienen al menos un dominio PTS, una región rica en prolina, treonina y serina (18, 82). Se ha informado que el pollo MUC2 es notablemente similar al humano y al ratón fuera del dominio central PTS, pero es muy divergente dentro de esta estructura repetitiva central (82, 83). Aunque las implicaciones fisiológicas y las asociaciones de enfermedades del MUC en varias superficies de la mucosa se entienden bien, todavía hay muchas preguntas sobre cómo y por qué la arquitectura génica de esta familia contribuye a diversas modificaciones de proteínas que muestran diversos efectos biológicos entre los metazoos en la salud y la enfermedad (18, 84–87). La expresión génica MUC2 se ha utilizado como marcador para la salud intestinal en aves de corral y otras especies (85, 88, 89). Por ejemplo, Li et al. encontraron que la suplementación con zinc en las dietas de los criadores mejoró la morfometría, aumentó el número de células de copas por vilo y la expresión génica de MUC2, y redujo los niveles de ARNm m de citocinas proinflamatorias, como IL-6 e IL-1β en el jejunio de su En el presente estudio, la expresión del gen MUC2 se redujo en un 29 % en las aves GBF en comparación con las aves CON, lo que sugiere que el modelo GBF redujo la protección de la capa de moco en el jejunio.
Los chaperones lipídicos intracelulares conocidos como FABP son un grupo de moléculas que coordinan la respuesta lipídica y el metabolismo en las células (90). Los FABP se encuentran en todas las especies, desde Drosophila melanogaster y Caenorhabditis elegans hasta ratones y humanos, lo que demuestra una fuerte conservación evolutiva (90). El metabolismo lipídico mediado por FABP está estrechamente vinculado a los procesos metabólicos e inflamatorios mediante la modulación de vías críticas sensibles a los lípidos en las células diana, especialmente los adipocitos y los macrófagos (90, 91). Hasta ahora se han identificado nueve FABP en el intestino, el hígado, el cerebro, el adiposo y el músculo, los órganos que muestran altas tasas de metabolismo lipídico, en los vertebrados (92, 93). El FABP intestinal, FABP2 y FABP6, se expresan a niveles altos en el intestino delgado y el íleon, respectivamente, y además de mediar el metabolismo lipídico, también están involucrados en condiciones inflamatorias intestinales al modular las vías críticas sensibles a los lípidos en los adipocitos y los macrófagos en humanos (94, 95 FABP2 está regulado a la baja en pacientes con lesión de la barrera intestinal inducida por isquemia/reperfusión (93), lo que sugiere el importante papel de FABP2 en la salud de la barrera intestinal. FABP2 se ha identificado como un marcador específico de la cantidad relativa de epitelio en humanos y cerdos (96). Se han identificado varios FABP (FABP1, FABP2, FABP6 y FABP10) que se expresan predominantemente en el tracto digestivo de los pollos (97, 98); sin embargo, queda mucho por determinar con respecto a su expresión y funciones biológicas en las aves de corral. FABP10 desempeña un papel hepático importante en respuesta al FI en el pollo (98). FABP2 está involucrado en la lipogénesis y el transporte de ácidos grasos, y desempeña un papel importante en el contenido de grasa abdominal en los pollos de engorde (98-100). En el presente estudio, el modelo GBF redujo la expresión génica FABP2, lo que sugiere que, al igual que el papel de FABP2 en la salud de la barrera intestinal humana, FABP2 se puede utilizar como un marcador de la función de la barrera intestinal en el pollo. La reducción de la expresión de FABP2 indica la pérdida del contenido de células epiteliales y la aparición de insuficiencia de la barrera intestinal en las aves GBF.
Recientemente se demostró que la proteína de unión a lípidos ileal (ILBP; gen humano FABP6) era necesaria para el transporte eficiente de ácidos biliares desde el lado apical al lado basolateral de los enterocitos en la porción distal del intestino murino (101). Los ácidos biliares son sintetizados por el hígado y liberados en la luz del intestino delgado a través de la bilis, y la mayoría de los ácidos biliares se recuperan en el extremo distal del intestino delgado y luego se devuelven al hígado para su reutilización (102). El ácido biliar ha surgido como importantes moléculas biológicas que emulsionan los lípidos y los nutrientes dietéticos liposolubles para facilitar su digestión y absorción (103, 104). Tiene una fuerte actividad antimicrobiana y, por lo tanto, está emergiendo como un factor huésped que regula la composición de la microbiota en el intestino (105, 106). Se informa que la reducción de los niveles de ácido biliar en el intestino está asociada con el crecimiento excesivo y la inflamación bacterianos (106). La inflamación intestinal en las aves de GBF puede haber dado lugar a niveles más bajos de ácidos biliares, que desafortunadamente no se midieron en este estudio. El aumento sustancial de FABP6 por cuatro veces en las aves GBF indica una alta demanda de ácidos biliares como antimicrobiano para promover la recuperación de la disbacteriosis y el fracaso de la barrera en el intestino de las aves GBF.
En conclusión, el propósito de este estudio no era determinar los efectos individuales de los ingredientes dietéticos o el desafío de los coccidios, sino más bien determinar los biomarcadores potenciales que se pueden utilizar para definir el fracaso de la barrera intestinal en estudios futuros. Intentamos exacerbar la falla de la barrera intestinal con las herramientas disponibles para nosotros, y los resultados obtenidos en el presente estudio sugieren que la combinación de una dieta alta de NSP y un desafío de los coccidios indujo la insuficiencia de la barrera intestinal y la inflamación en los pollos de enmparas de enmparas, caracterizadas el aumento de endotoxina y A Estos parámetros pueden utilizarse como posibles biomarcadores para la salud de la barrera intestinal en los pollos. Ahora que tenemos una mejor comprensión de qué biomarcadores son relevantes en los modelos de falla de barrera intestinal en pollos, se llevarán a cabo más estudios para evaluar los efectos de los enteropatógenos de pollo, diferentes ingredientes dietéticos o aditivos para piensos, como probióticos y prebióticos, en la función de barrera intestinal en pollos de engorde.
Declaración de conflicto de intereses
Los autores declaran que la investigación se llevó a cabo con el apoyo financiero de Novus International Inc. La mención de nombres comerciales o productos comerciales en este artículo tiene el único propósito de proporcionar información específica y no implica recomendaciones ni respaldo por parte de Novus International Inc.
Agradecimientos
Nos gustaría dar las gracias a Terra Wineman, Cindy Atwell y Beaver Wuelling por la asistencia técnica, y al Dr. Karen Wedekind para la lectura crítica del manuscrito. El estudio contó con el apoyo financiero de Novus International Inc.
Abreviaturas
AGP, glicoproteína α1-ácido; AJ, uniones adherentes; BW, peso corporal; BWG, aumento de peso corporal; CON, control; ERK, quinasa extracelular regulada por señal; FABP, proteína de unión a ácidos grasos; FCR, relación de conversión de piensos; FI, ingesta de piensos; GBF, fallo
Referencias
1. Williams R. Cocdiosis intercurrente y enteritis necrótica de los pollos: manejo racional e integrado de la enfermedad mediante el mantenimiento de la integridad intestinal. Avian Pathol (2005) 34:159-80. doi: 10.1080/03079450500112195
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
2. Sharma R, Tepas JJ III, Hudak ML, Mollitt DL, Wludyka PS, Teng R-J, et al. Barrera intestinal neonatal e insuficiencia de múltiples órganos: papel de la endotoxina y las citocinas proinflamatorias en la sepsis y la enterocolitis necrotizante. J Pediatr Surg (2007) 42:454–61. doi:10.1016/j.jpedsurg.2006.10.038
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
3. Pastorelli L, De Salvo C, Mercado JR, Vecchi M, Pizarro TT. Papel central de la barrera epitelial intestinal en la patogénesis de la inflamación intestinal crónica: lecciones aprendidas de los modelos animales y la genética humana. Front Immunol (2013) 4:280. doi:10.3389/fimmu.2013.00280
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
4. Latorre JD, Hernández-Velasco X, Kogut MH, Vicente JL, Wolfenden R, Wolfenden A, et al. Papel de un microbiano alimentado directamente por Bacillus subtilis en la viscosidad de la digesta, la translocación bacteriana y la mineralización ósea en los pulpos de pavo alimentados con una dieta a base de centeno. Front Vet Sci (2014)1:26. doi:10.3389/fvets.2014.00026
5. Tellez G, Latorre JD, Kuttappan VA, Kogut MH, Wolfenden A, Hernandez-Velasco X, et al. La utilización del centeno como fuente de energía afecta a la translocación bacteriana, la viscosidad intestinal, la composición de la microbiota y la mineralización ósea en los pollos de enmparas. Front Genet (2014)5:339. doi:10.3389/fgene.2014.00339
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
6. Dahiya J, Wilkie D, Van Kessel AG, Drew M. Posibles estrategias para controlar la enteritis necrótica en pollos de enmado en la era post-antibiótico. Anim Feed Sci Technol (2006) 129:60–88. doi:10.1016/j.anifeedsci.2005.12.003
7. Gholamiandehkordi AR, Timbermont L, Lanckriet A, Broeck WV, Pedersen K, Dewulf J, et al. Cuantificación de lesiones intestinales en un modelo de enteritis necrotótica subclínica.Avian Pathol (2007)36:375–82. doi:10.1080/03079450701589118
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
8. Castanon J. Historia del uso de antibióticos como promotores del crecimiento en los piensos de aves de corral europeas.Poult Sci (2007) 86:2466–71. doi:10.3382/ps.2007-00249
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
9. Yegani M, Korver D. Factores que afectan a la salud intestinal en las aves de corral. Poult Sci (2008) 87:2052–63. doi:10.3382/ps.2008-00091
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
10. Teirlynck E, Gussem M, Dewulf J, Haesebrouck F, Ducatelle R, Van Immerseel F. Evaluación morfométrica de la «disbacteriosis» en los enladores de enla. Avian Pathol (2011) 40:139–44. doi:10.1080/03079457.2010.543414
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
11. Wideman RF, Prisby RD. Alteraciones circulatorias óseas en el desarrollo de la condronecrosis bacteriana espontánea con osteomielitis: un modelo traslacional para la patogénesis de la necrosis de la cabeza femoral. Endocrinol frontal (Lausana) (2011) 3:183. doi:10.3389/fendo.2012.00183
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
12. Wideman R, Hamal K, Stark J, Blankenship J, Lester H, Mitchell K, et al. Un modelo de suelo de alambre para inducir cojeras en pollos de enmaña: evaluación de los probióticos como tratamiento profiláctico. Poult Sci (2012) 91:870–83. doi:10.3382/ps.2011-01907
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
13. Wideman R, Al-Rubaye A, Kwon Y, Blankenship J, Lester H, Mitchell K, et al. Administración profiláctica de una combinación de prebiótico y probiótico, o administración terapéutica de enrofloxacina, para reducir la incidencia de condrodocrosis bacteriana con osteomielitis en pollos de enmparas. Poult Sci (2015) 94:25-36. doi:10.3382/ps/peu025
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
14. Groschwitz KR, Hogan SP. Función de barrera intestinal: regulación molecular y patogénesis de enfermedades. J Allergy Clin Immunol (2009) 124:3–20. doi:10.1016/j.jaci.2009.05.038
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
15. Sharma R, Young C, Neu J. Modulación molecular de la barrera epitelial intestinal: contribución de la microbiota. J Biomed Biotechnol (2010) 2010:305879. doi:10.1155/2010/305879
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
16. Jeon MK, Klaus C, Kaemmerer E, Gassler N. Barrera intestinal: vías moleculares y modificadores. World J Gastrointest Pathophysiol (2013) 4:94–9. doi:10.4291/wjgp.v4.i4.94
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
17. Sakamoto K, Hirose H, Onizuka A, Hayashi M, Futamura N, Kawamura Y, et al. Estudio cuantitativo de los cambios en la morfología intestinal y el gel de moco en la nutrición parenteral total en ratas. J Surg Res (2000) 94:99–106. doi:10.1006/jsre.2000.5937
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
18. Kim YS, Ho SB. Células de copas intestinales y mucinas en la salud y la enfermedad: ideas y progresos recientes. Curr Gastroenterol Rep (2010) 12:319–30. doi:10.1007/s11894-010-0131-2
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
19. Johansson ME, Gustafsson JK, Sjöberg KE, Petersson J, Holm L, Sjövall H, et al. Las bacterias penetran en la capa interna de moco antes de la inflamación en el modelo de colitis con sulfato de dextrano.PLoS One (2010) 5:e12238. doi:10.1371/journal.pone.0012238
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
20. Iizuka M, Konno S. Sanación de heridas de las células epiteliales intestinales. World J Gastroenterol (2011)17:2161–71. doi:10.3748/wjg.v17.i17.2161
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
21. Audy J, Mathieu O, Belvis J, Tompkins T. Respuesta transcriptómica de las vías de señalización inmune en las células epiteliales intestinales expuestas a lipopolisacáridos, bacterias Gramnegativas o microbios potencialmente probióticos. Benef Microbes (2012) 3:273–86. doi:10.3920/BM2012.0027
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
22. Sander GR, Cummins AG, Powell BC. La rápida interrupción de la función de barrera intestinal por la gliadina implica una expresión alterada de las proteínas junctionales apicales. FEBS Lett (2005) 579:4851–5. doi:10.1016/j.febslet.2005.07.066
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
23. Ulluwishewa D, Anderson RC, McNabb WC, Moughan PJ, Wells JM, Roy NC. Regulación de la permeabilidad a la unión apretada por bacterias intestinales y componentes dietéticos. J Nutr (2011)141:769–76. doi:10.3945/jn.110.135657
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
24. Ballard ST, Hunter JH, Taylor AE. Regulación de la permeabilidad de unión estrecha durante la absorción de nutrientes a través del epitelio intestinal. Annu Rev Nutr (1995) 15:35-55. doi:10.1146/annurev.nutr.15.1.35
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
25. Alverdy J, Zaborina O, Wu L. El impacto del estrés y la nutrición en las interacciones bacteriano-óto en la superficie epitelial intestinal. Curr Opin Clin Nutr Metab Care (2005)8:205–9. doi:10.1097/00075197-200503000-00016
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
26. Edelblum KL, Turner JR. La unión estrecha en la enfermedad inflamatoria: interrupción de la comunicación. Curr Opin Pharmacol (2009) 9:715–20. doi:10.1016/j.coph.2009.06.022
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
27. Schulzke JD, Ploeger S, Amasheh M, Fromm A, Zeissig S, Troeger H, et al. Uniones estrechas epiteliales en la inflamación intestinal. Ann N Y Acad Sci (2009) 1165:294–300. doi:10.1111/j.1749-6632.2009.04062.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
28. Ilan Y. El intestino permeable y el hígado: un papel de la translocación bacteriana en la esteatohepatitis no alcohólica. World J Gastroenterol (2012) 18:2609-18. doi:10.3748/wjg.v18.i21.2609
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
29. Steed E, Balda MS, Matter K. Dinámica y funciones de las uniones estrechas. Trends Cell Biol (2010) 20:142–9. doi:10.1016/j.tcb.2009.12.002
30. Hu Y-J, Wang Y-D, Tan F-Q, Yang W-X. Regulación de la permeabilidad paracelular: factores y mecanismos. Mol Biol Rep (2013) 40:6123–42. doi:10.1007/s11033-013-2724-y
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
31. Dibner J, Atwell C, Kitchell M, Shermer W, Ivey F. Alimentación de grasas oxidadas a pollos de engorde y cerdos: efectos sobre la rotación de enterocitos, la proliferación de hepatocitos y el tejido linfoide asociado al intestino. Anim Feed Sci Technol (1996) 62:1-13. doi:10.1016/S0377-8401(96)01000-0
32. Friesen OD, Guenter W, Marquardt RR, Rotter BA. El efecto de la suplementación enzimática sobre la aparente energía metabolizable y la digestibilidad nutricional del trigo, la cebada, la avena y el centeno para el pollito joven de engorde. Poult Sci (1992) 71:1710–21. doi:10.3382/ps.0711710
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
33. Knudsen KE. Contenido de polisacáridos de fibra y no almidón y variación en los cultivos comunes utilizados en las dietas de los asados. Poult Sci (2014) 93:2380–93. doi:10.3382/ps.2014-03902
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
34. Consejo Nacional de Investigación. Requisitos nutricionales de la aves de corral. 9a ed. Washington, DC: National Academic Press (1994).
35. FASS. Guía para el cuidado y el uso de los animales agrícolas en la investigación y la enseñanza. 3a ed. Champaign, IL: Federación de Sociedades de Ciencias Animales (2010).
36. Biloni A, Quintana CF, Menconi A, Kallapura G, Latorre J, Pixley C, et al. Evaluación de los efectos de EarlyBird asociado con FloraMax-B11 sobre Salmonella Enteritidis, la morfología intestinal y el rendimiento de los pollos de enmado. Poult Sci (2013) 92:2337–46. doi:10.3382/ps.2013-03279
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
37. Instituto SAS Inc. Guía del usuario de SAS. Versión 9.1. Cary, Carolina del Norte: SAS Institute Inc. (2002).
38. Choct M, Hughes RJ, Trimble RP, Angkanaporn K, Annison G. Las enzimas degradantes de polisacáridos no de almidón aumentan el rendimiento de los pollos de enmparas alimentados con trigo de baja energía metabolizable aparente. J Nutr (1995) 125:485–92.
39. Murphy T, McCracken J, McCann M, George J, Bedford M. El rendimiento de la parrilla y la viscosidad in vivo están influenciados por una gama de xilanasas, que varían en capacidad para afectar la viscosidad del trigo in vitro. Br Poult Sci (2009) 50:716–24. doi:10.1080/00071660903389950
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
40. Kiarie E, Romero LF, Nyachoti CM. El papel de las enzimas de alimentación añadidas en la promoción de la salud intestinal en los cerdos y las aves de corral. Nutr Res Rev (2013) 26:71–88. doi:10.1017/S0954422413000048
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
41. Timbermont L, Haesebrouck F, Ducatelle R, Van Immerseel F. Entitis necrótica en pollos de enmilers: una revisión actualizada sobre la patogénesis. Avian Pathol (2011) 40:341–7. doi:10.1080/03079457.2011.590967
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
42. Van Leeuwen P, Mouwen J, Van Der Klis J, Verstegen M. Morfología de la superficie mucosa intestinal de los pollos enrería en relación con la edad, la formulación de la dieta, la microflora intestinal pequeña y el rendimiento. Br Poult Sci (2004) 45:41–8. doi:10.1080/00071660410001668842
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
43. Shirzadi H, Moravej H, Shivazad M. Influencia de las enzimas degradantes de polisacáridos no al almidón en el rendimiento de la carne y la viscosidad de la digesta jejunal en los pollos de enmnívoros alimentados con dieta a base de trigo/cebada. Afr J Biotechnol (2010) 9:1517-22.
44. Bedford M, Classen H, Campbell G. El efecto de la peletación, la sal y la pentosanasa sobre la viscosidad del contenido intestinal y el rendimiento de los pollos de engorde alimentados con centeno. Poult Sci (1991)70:1571–7. doi:10.3382/ps.0701571
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
45. Bedford M, Classen H. Un ensayo in vitro para predecir la viscosidad y el crecimiento intestinal de los pollos en pollos a la parrilla cuando se alimentan con dietas a base de centeno en presencia de enzimas exógenas. Poult Sci (1993)72:137–43. doi:10.3382/ps.0720137
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
46. Uni Z, Ganot S, Sklan D. Desarrollo posterior a la mucosa en el intestino delgado del asador.Poult Sci (1998) 77:75–82. doi:10.1093/ps/77.1.75
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
47. Awad W, Ghareeb K, Abdel-Raheem S, Böhm J. Efectos de la inclusión dietética de probióticos y sinbióticos en el rendimiento del crecimiento, los pesos de los órganos y la histomorfología intestinal de los pollos de engorde. Poult Sci (2009) 88:49–56. doi:10.3382/ps.2008-00244
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
48. Awad W, Ghareeb K, Böhm J. Evaluación de la eficacia de la inulina de la achicoria en la amelipa de la morfología intestinal y la modulación de las propiedades electrofisiológicas intestinales en los pollos de enmado. J Anim Physiol Anim Nutr (2011) 95:65-72. doi:10.1111/j.1439-0396.2010.00999.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
49. Ozdogan M, Topal E, Paksuz EP, Kirkan S. Efecto de los diferentes niveles de glicerol crudo en la morfología y algunas bacterias patógenas del intestino delgado en los pollos macho.Animal (2013) 8:36–42. doi:10.1017/S1751731113001833
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
50. Savage DC. Ecología microbiana del tracto gastrointestinal. Annu Rev Microbiol (1997)31:107–33. doi:10.1146/annurev.mi.31.100177.000543
51. Tellez G. Procariotas frente a eucariotas: ¿quién aloja a quién? Front Vet Sci (2014) 1:3. doi:10.3389/fvets.2014.00003
52. Sharma R, Tepas JJ III. Microecología, barrera epitelial intestinal y enterocolitis necrotizante.Pediatr Surg Int (2010) 26:11–21. doi:10.1007/s00383-009-2536-2
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
53. Lamprecht M, Frauwallner A. Ejercicio, disfunción de la barrera intestinal y suplementación probiótica. Med Sport Sci (2012) 59:47–56. doi:10.1159/000342169
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
54. Loehry C, Creamer B. Estructura tridimensional de la mucosa intestinal pequeña humana en salud y enfermedad. Gut (1969) 10:6–12. doi:10.1136/gut.10.1.6
55. Schneeberger EE, Lynch RD. Estructura, función y regulación de las uniones estrechas celulares. Am J Physiol (1992) 262:L647-61.
56. Matter K, Balda MS. Uniones estrechas epiteliales, expresión génica e interacción nucleo-junctional. J Cell Sci (2007) 120:1505–11. doi:10.1242/jcs.005975
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
57. Assimakopoulos SF, Papageorgiou I, Charonis A. Uniones estrechas de los enterocitos: desde moléculas hasta enfermedades. World J Gastrointest Pathophysiol (2011) 2:123–37. doi:10.4291/wjgp.v2.i6.123
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
58. Bethune MT, Khosla C. Paralelismos entre patógenos y péptidos del gluten en celiac sprue.PLoS Pathog (2008) 4:e34. doi:10.1371/journal.ppat.0040034
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
59. Awad W, Aschenbach J, Khayal B, Hess C, Hess M. Respuestas epiteliales intestinales a Salmonella enterica serovar Enteritidis: efectos sobre la permeabilidad intestinal y el transporte iónico.Polult Sci (2012) 91:2949–57. doi:10.3382/ps.2012-02448
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
60. Mollen KP, Anand RJ, Tsung A, Prince JM, Levy RM, Billiar TR. Paradigma emergente: receptor de 4 centinela de factura para la detección de daño tisular. Shock (2006) 26:430–7. doi:10.1097/01.shk.0000228797.41044.08
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
61. Steverink P, Salden H, Sturk A, Klein W, van der Velden M, Németh F. Evaluación de laboratorio y clínica de un ensayo de endotoxinas cromogénicas para caballos con trastornos intestinales agudos. Vet Q (1994) 16:117–21. doi:10.1080/01652176.1994.9694517
62. Senior J, Proudman C, Leuwer M, Carter S. Endotoxina plasmática en caballos presentada a un hospital de referencia equina: correlación con parámetros y resultados clínicos seleccionados. Equine Vet J (2011) 43:585–91. doi:10.1111/j.2042-3306.2010.00328.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
63. Heller F, Florian P, Bojarski C, Richter J, Christ M, Hillenbrand B, et al. La interleucina-13 es la citocina clave del efector Th2 en la colitis ulcerosa que afecta a las uniones estrechas epiteliales, la apoptosis y la restitución celular. Gastroenterología (2005) 129:550-64. doi:10.1016/j.gastro.2005.05.002
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
64. Saleh M, Elson CO. Enfermedad inflamatoria intestinal experimental: información sobre el diálogo anfitrión-microbiota. Inmunidad (2011) 34:293–302. doi:10.1016/j.immuni.2011.03.008
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
65. Al-Sadi R, Boivin M, Ma T. Mecanismo de modulación de citoquinas de la barrera de unión estrecha epitelial. Front Biosci (2009) 14:2765–8. doi:10.2741/3413
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
66. Wijtten PJ, van der Meulen J, Verstegen MW. Función de barrera intestinal y absorción en los cerdos después del destete: una revisión. Br J Nutr (2011) 105:967–81. doi:10.1017/S0007114510005660
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
67. Adler KL, Peng PH, Peng RK, Klasing KC. La cinética de los niveles de hemopexina y glicoproteína α1ácido inducidos por la inyección de agentes inflamatorios en pollos. Avian Dis (2001) 45(2):289–96. doi:10.2307/1592967
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
68. Velloso LA, Folli F, Saad MJ. TLR4 en la encrucijada de nutrientes, microbiota intestinal e inflamación metabólica. Endocr Rev (2015) 26:er20141100. doi:10.1210/er.2014-1100
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
69. Ozinsky A, Underhill DM, Fontenot JD, Hajjar AM, Smith KD, Wilson CB, et al. El repertorio para el reconocimiento de patrones de patógenos por el sistema inmunitario innato se define por la cooperación entre receptores de carga. Proc Natl Acad Sci U S A (2000) 97:13766–71. doi:10.1073/pnas.250476497
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
70. Kigerl KA, Lai W, Rivest S, Hart RP, Satoskar AR, Popovich PG. Los receptores de Toll-like (TLR)-2 y TLR-4 regulan la inflamación, la gliosis y la salvación de mielina después de una lesión de la médula espinal. J Neurochem (2007) 102:37-50. doi:10.1111/j.1471-4159.2007.04524.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
71. Kimbrell DA, Beutler B. La evolución y la genética de la inmunidad innata. Nat Rev Genet (2001) 2:256–67. doi:10.1038/35066006
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
72. Huebener P, Schwabe RF. Regulación de la cicatrización de heridas y la fibrosis orgánica mediante receptores similares a los de los peajes. Biochim Biophys Acta (2013) 1832:1005-17. doi:10.1016/j.bbadis.2012.11.017
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
73. Berkes J, Viswanathan V, Savkovic S, Hecht G. Respuestas epiteliales intestinales a los patógenos entéricos: efectos en la barrera de unión estrecha, el transporte de iones y la inflamación. Gut (2003)52:439–51. doi:10.1136/gut.52.3.439
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
74. Dasu MR, Ramirez SR, La TD, Gorouhi F, Nguyen C, Lin BR, et al. Conversación cruzada entre receptores adrenérgicos y de peaje en células madre mesenquimales humanas y queratinocitos: una receta para una cicatrización de heridas deteriorada. Células madre Transl Med (2014) 3:745. doi:10.5966/sctm.2013-0200
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
75. Konkel JE, Chen W. Actos de equilibrio: el papel del TGF-β en el sistema inmunológico de la mucosa. Tendencias Mol Med (2011) 17:668-76. doi:10.1016/j.molmed.2011.07.002
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
76. Ojeda MO, van’t Veer C, Fernandez Ortega CB, Araña Rosainz Mde J, Buurman WA. El extracto de leucocitos diilizables regula diferencialmente la producción de TNFα, IL-6 e IL-8 en leucocitos activados por componentes bacterianos y células endoteliales. Inflamm Res (2005)54:74–81. doi:10.1007/s00011-004-1326-5
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
77. Williams SJ, Wreschner DH, Tran M, Eyre HJ, Sutherland GR, McGuckin MA. Muc13, una nueva mucina de superficie celular humana expresada por células epiteliales y hemopoyéticas. J Biol Chem (2001) 276:18327–36. doi:10.1074/jbc.M008850200
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
78. Toribara N, Roberton A, Ho S, Kuo W, Gum E, Hicks J, et al. Mucina gástrica humana. Identificación de una especie única por clonación de expresión. J Biol Chem (1993) 268:5879–85.
79. Lang T, Hansson GC, Samuelsson T. Un inventario de los genes de la mucina en el genoma del pollo muestra que el dominio de la mucina de Muc13 está codificado por múltiples exones y que la ovomucina es parte de un lugar de mucinas formadoras de geles relacionados. BMC Genomics (2006) 7:386–95. doi:10.1186/1471-2164-7-197
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
80. Wei X, Yang Z, Rey FE, Ridaura VK, Davidson NO, Gordon JI, et al. La sintasa de ácidos grasos modula la función de barrera intestinal a través de la palmitoilación de la mucina 2.Micróbulo huésped celular (2012) 11:140–52. doi:10.1016/j.chom.2011.12.006
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
81. Lang T, Hansson GC, Samuelsson T. Las mucinas formadoras de gel aparecieron al principio de la evolución metazoaria. Proc Natl Acad Sci U S A (2007) 104:16209–14. doi:10.1073/pnas.0705984104
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
82. Jiang Z, Applegate TJ, Lossie AC. Clonación, anotación y expresión de desarrollo del gen intestinal MUC2 del pollo. PLoS One (2013) 8:e53781. doi:10.1371/journal.pone.0053781
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
83. Zhang Q, Eicher SD, Applegate TJ. Desarrollo de expresiones intestinales de mucina 2, IgA y receptores de Ig polimérico en pollos de enmiler y patos Pekin. Poult Sci (2015) 94(2):172-80. doi:10.3382/ps/peu064
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
84. Clark JA, Doelle SM, Halpern MD, Saunders TA, Holubec H, Dvorak K, et al. Fallo de la barrera intestinal durante la enterocolitis necrotizante experimental: efecto protector del tratamiento del EGF.Am J Physiol Gastrointest Liver Physiol (2006) 291:G938-49. doi:10.1152/ajpgi.00090.2006
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
85. Forder RE, Nattrass GS, Geier MS, Hughes RJ, Hynd PI. Análisis cuantitativos de genes asociados con la síntesis de mucinas de pollos de enmalta con enteritis necrótica inducida.Poult Sci (2012) 91:1335–41. doi:10.3382/ps.2011-02062
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
86. Liu D, Guo S, Guo Y. La suplementación con xilasa a una dieta a base de trigo alivió el deterioro de la barrera mucosa intestinal de los pollos de enmparas desafiados por Clostridium perfringens. Avian Pathol (2012) 41:291–8. doi:10.1080/03079457.2012.684089
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
87. Hollingsworth MA, Swanson BJ. Mucinas en el cáncer: protección y control de la superficie celular. Nat Rev Cancer (2004) 4:45-60. doi:10.1038/nrc1251
88. Dkhil MA, Delic D, Al-Quraishy S. Células de copa y expresión génica relacionada con la mucina en ratones infectados con Eimeria papillata. ScientificWorldJournal (2013) 2013:439865. doi:10.1155/2013/439865
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
89. Li C, Guo S, Gao J, Guo Y, Du E, Lv Z, et al. La dieta materna con alto contenido de zinc atenúa la inflamación intestinal al reducir la metilación del ADN y elevar la acetilación H3K9 en el promotor A20 de los polluelos de la descendencia. J Nutr Biochem (2015) 26(2):173–83. doi:10.1016/j.jnutbio.2014.10.005
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
90. Furuhashi M, Hotamisligil GS. Proteínas de unión a ácidos grasos: papel en las enfermedades metabólicas y potencial como objetivos de medicamentos. Nat Rev Drug Discov (2008) 7:489–503. doi:10.1038/nrd2589
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
91. Storch J, Corsico B. Las funciones y mecanismos emergentes de las proteínas de unión a ácidos grasos de los mamíferos. Annu Rev Nutr (2008) 28:73–95. doi:10.1146/annurev.nutr.27.061406.093710
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
92. Schaap FG, van der Vusse GJ, Glatz JF. Evolución de la familia de proteínas de unión a lípidos intracelulares en vertebrados. Mol Cell Biochem (2002) 239:69-77. doi:10.1023/A:1020519011939
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
93. Albala C, Santos JL, Cifuentes M, Villarroel AC, Lera L, Liberman C, et al. Polimorfismo intestinal FABP2 A54T: asociación con la resistencia a la insulina y la obesidad en mujeres.Obes Res (2004) 12:340-5. doi:10.1038/oby.2004.42
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
94. Levy E, Ménard D, Delvin E, Stan S, Mitchell G, Lambert M, et al. El polimorfismo en el codón 54 del gen FABP2 aumenta la absorción de grasa en los explantes intestinales humanos. J Biol Chem (2001) 276:39679–84. doi:10.1074/jbc.M105713200
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
95. Ohmachi T, Inoue H, Mimori K, Tanaka F, Sasaki A, Kanda T, et al. La proteína 6 de unión al ácido graso se sobreexpresa en el cáncer colorrectal. Clin Cancer Res (2006) 12:5090–5. doi:10.1158/1078-0432. CCR-05-2045
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
96. Schroyen M, Stinckens A, Verhelst R, Geens M, Cox E, Niewold T, et al. La susceptibilidad de los lechones a Escherichia coli enterotoxicagénica no está relacionada con la expresión de MUC13 y MUC20. Anim Genet (2012) 43:324–7. doi:10.1111/j.1365-2052.2011.02241.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
97. Zhang Q, Shi H, Liu W, Wang Y, Wang Q, Li H. Expresión diferencial de L-FABP y L-BABP entre pollos grasos y magros. Genet Mol Res (2013) 12:4192–206. doi:10.4238/2013. 7,5 de octubre
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
98. Hughes AL, Piontkivska H. Diversificación evolutiva de las proteínas de unión a los ácidos grasos de las aves. Gene (2011) 490:1–5. doi:10.1016/j.gene.2011.09.016
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
99. Hu G, Wang S, Tian J, Chu L, Li H. Efecto epistático entre el gen ACACA y FABP2 en los rasgos de grasa abdominal en los pollos de engorde. J Genet Genomics (2010) 37:505–12. doi:10.1016/S1673-8527(09)60070-9
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
100. Guo S, Liu D, Zhao X, Li C, Guo Y. La suplementación con xilasa de una dieta a base de trigo mejoró la digestión de nutrientes y la expresión del ARNm de los transportadores de nutrientes intestinales en pollos de enmparas de enmiler infectados con Clostridium perfringens. Poult Sci (2014) 93:94–103. doi:10.3382/ps.2013-03188
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
101. Praslickova D, Torchia EC, Sugiyama MG, Magrane EJ, Zwicker BL, Kolodzieyski L, et al. La proteína de unión a lípidos ileal es necesaria para la absorción y el transporte eficientes de ácidos biliares en la porción distal del intestino delgado murino. PLoS One (2012) 7:e50810. doi:10.1371/journal.pone.0050810
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
102. Zwicker BL, Agellon LB. Transporte y actividades biológicas de los ácidos biliares. Int J Biochem Cell Biol (2013) 45:1389–98. doi:10.1016/j.biocel.2013.04.012
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
103. Iritani N, Fukuda E, Ibamoto K. Efecto de la ingesta de grasa en la rotación de colesterol y la formación de ácidos biliares. J Nutr Sci Vitaminol (1977) 23:35–42. doi:10.3177/jnsv.23.35
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
104. Hofmann AF. Ácidos biliares: los buenos, los malos y los feos. Noticias Physiol Sci (1999) 14:24-9.
105. Yokota A, Fukiya S, Islam KB, Ooka T, Ogura Y, Hayashi T. ¿Es el ácido bilis un determinante de la microbiota intestinal en una dieta alta en grasas? Gut Microbes (2012) 3:455–9. doi:10.4161/gmic.21216
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
106. Ridlon JM, Kang DJ, Hylemon PB, Bajaj JS. Ácidos biliares y microbioma intestinal. Curr Opin Gastroenterol (2014) 30:332–8. doi:10.1097/MOG.0000000000000057
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Palabras clave: función de barrera intestinal, análisis morfométrico, endotoxina, AGP, expresión génica, biomarcador
Cita: Chen J, Tellez G, Richards JD y Escobar J (2015) Identificación de posibles biomarcadores para el fallo de la barrera intestinal en pollos de enlacha. Delante. Veterinario. Ciencia. 2:14. doi: 10.3389/fvets.2015.00014
Recibido: 19 de marzo de 2015; Aceptado: 08 de mayo de 2015;
Publicado: 26 de mayo de 2015
Editado por:
Michael Kogut, Servicio de Investigación Agrícola del USDA, EE. UU.
Revisado por:
Jason Kindrachuk, Instituto Nacional de Alergias y Enfermedades Infecciosas, EE. UU.
Wolfgang Ludwig Köster, Universidad de Saskatchewan, Canadá
Copyright: © 2015 Chen, Tellez, Richards y Escobar.
*Correspondencia: Juxing Chen, Novus International, Inc., 20 Research Park Drive, St. Charles, MO 63304, EE. UU., juxing.chen@novusint.com
Descargo de responsabilidad: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamación que pueda ser hecha por su fabricante no está garantizado o respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

 Jeffery Escobar
Jeffery Escobar