Imágenes de PET en modelos animales de la enfermedad de Alzheimer
Imágenes de PET en modelos animales de la enfermedad de Alzheimer
 Takuya Toyonaga,
Takuya Toyonaga,  Jie Tong, Yiyun Huang y Zhengxin Cai*
Jie Tong, Yiyun Huang y Zhengxin Cai*- Centro PET, Radiología, Facultad de Medicina de Yale, New Haven, CT, Estados Unidos
El desarrollo y la traducción exitosos de agentes de imagen de PET dirigidos a las placas β-amiloide y los enredos tau hiperfosforilados han permitido la detección in vivo de estas características de la enfermedad de Alzheimer (EA) antemortem. La PET amiloide y tau se han incorporado al esquema A/T/N para la caracterización de la EA y se han convertido en una parte integral de los ensayos clínicos en curso para detectar la inscripción de pacientes, probar los mecanismos de acción del medicamento y controlar los efectos terapéuticos. Mientras tanto, las imágenes preclínicas de PET en modelos animales de EA pueden proporcionar información de apoyo para los estudios mecanicistas. Con el reciente avance de las tecnologías de edición de genes y el desarrollo de modelos animales de EA, las imágenes preclínicas de PET en modelos de EA facilitarán aún más nuestra comprensión de la patogénesis/progresión de la EA y el desarrollo de nuevos tratamientos. En este estudio, revisamos el estado actual de la técnica en las imágenes preclínicas de PET utilizando modelos animales de EA y sugerimos futuras direcciones de investigación.
Introducción
La demencia es una categoría de enfermedades neurodegenerativas que afectan principalmente a la vida cotidiana de las personas mayores y se caracteriza por una pérdida progresiva de memoria, comunicación, resolución de problemas/pensamiento y habilidades motorsensoriales. Los tipos comunes de demencia incluyen la demencia vascular, la demencia frontotemporal, la demencia con cuerpos de Lewy y la enfermedad de Alzheimer (EA), que es el tipo más común y representa el 60-80 % de los casos generales de demencia (Asociación de Alzheimer, 2021). A nivel mundial, hay 350.000 nuevos casos de demencia de inicio temprano al año, y para 2050, se prevé que 107 millones de personas vivan con EA, de los cuales el 68 % residen en los países de ingresos bajos y medios (Global Burden of Disease Study).
Las características patológicas de la EA son las placas y oligómeros extracelulares que contienen β-amiloide (Aβ) y los enredos neurofibrilares intracelulares (NFT) que contienen tau. Las placas y los oligómeros interfieren con la comunicación neurona-neurona en las sinapsis, lo que conduce a la neurodegeneración. Los enredos de Tau bloquean el transporte de nutrientes y otras moléculas dentro de las neuronas, lo que contribuye a la muerte neuronal. Además, la placa Aβ y las proteínas tau pueden activar la microglía, que elimina estas proteínas tóxicas y células muertas, pero puede provocar inflamación crónica (Long y Holtzman, 2019). La atrofia, una disminución en el volumen cerebral debido a la pérdida de sinapsis, dendritas y cuerpos de células neuronales, es otro biomarcador para la progresión de la EA (Pini et al., 2016; Halliday, 2017). Además, la disminución del metabolismo de la glucosa compromete aún más la función del cerebro (Wang et al., 2016). La EA de inicio temprano familiar (FAD) se asocia con genes mutados como APP, PSEN1, PSEN2 y MAPT, que también aumentan significativamente el riesgo de EA de inicio tardío (LOAD) (Ryan y Rossor, 2010), mientras que la variante de la apolipoproteína E ε4 (APOEε4) (Kim et al Esta enfermedad de Alzheimer (DIAD) predominantemente hereditaria causada por mutaciones genéticas raras se asocian con un aumento de los niveles de Aβ y tau, una disminución del metabolismo de la glucosa y una atrofia cerebral de 10 a 20 años antes de que aparezcan los síntomas. Además, múltiples enzimas están asociadas con la EA, incluida la enzima de división APP 1 del sitio β (BACE1) (Das y Yan, 2017), la caspasa 3 (Rohn, 2010) y la catepsina aspartyl (Haque et al., 2008), entre otras.
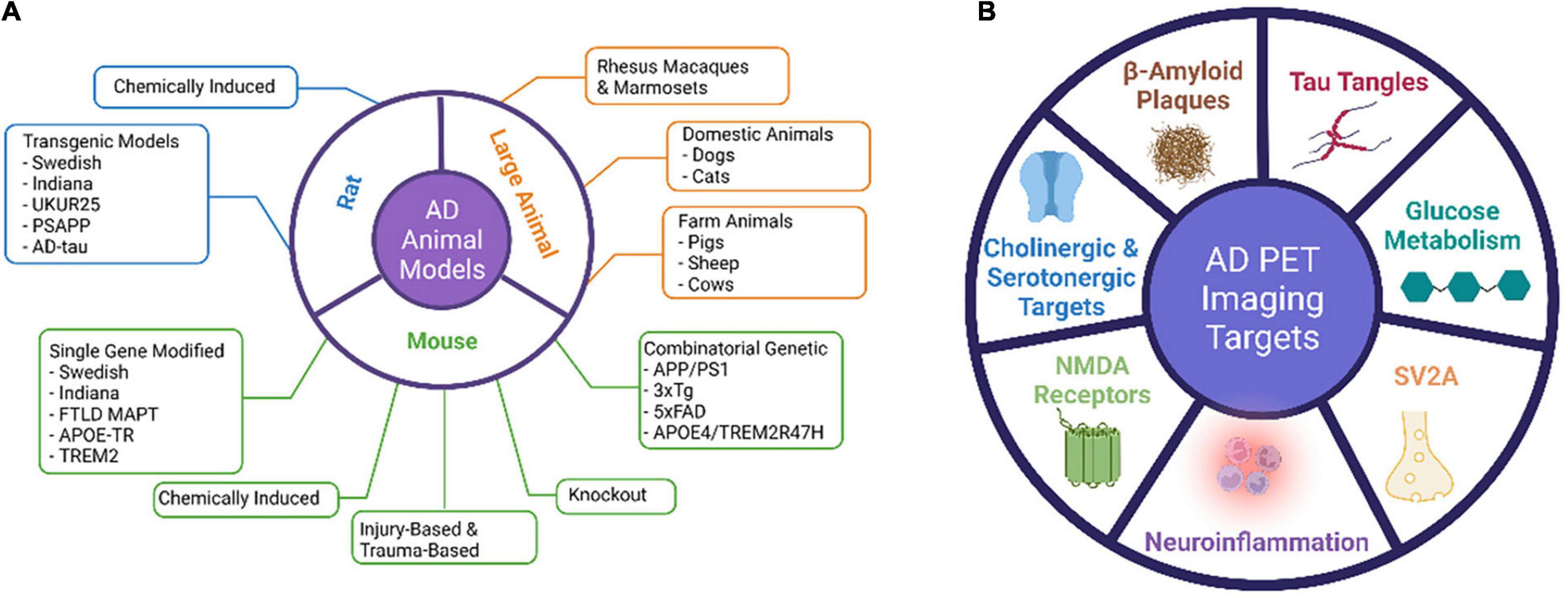
Los modelos animales de EA se han vuelto esenciales para estudiar la patogénesis y la progresión de la patología de la EA y para validar el mecanismo de acción de las nuevas terapias antes de la traducción a ensayos en humanos (Asociación de Alzheimer, 2021). Se han desarrollado muchos modelos animales para imitar los procesos fisiopatológicos y los mecanismos de progresión de la EA y para probar los métodos de tratamiento de prueba preclínica (Figura 1). Tanto los animales invertebrados como los vertebrados se han utilizado en el modelado del envejecimiento y ciertos aspectos de los procesos de EA, ya que los animales modificados genéticamente que recapitulan ciertos rasgos de la EA son necesarios para comprender los mecanismos patológicos y biológicos de la EA. Debido a que no ha habido un modelo de roedores que recapitule completamente la EA humana, los modelos de roedores se han utilizado principalmente para probar los mecanismos de acción para las intervenciones terapéuticas o para probar la especificidad de unión al objetivo de las sondas por imágenes. Un modelo animal de EA completamente caracterizado con fenotipos estables y un tiempo claro de inicio de la enfermedad puede ayudar en gran medida a abordar las preguntas científicas específicas.
Muchos métodos de neuroimagen, como la resonancia magnética (RM; estructural y funcional), la tomografía computarizada (TC) y la tomografía por emisión de positrones (PET), se han empleado cada vez más para evaluar la neurodegeneración de la EA. Las imágenes de PET utilizan trazadores radiomarcados para detectar y cuantificar los cambios cerebrales y metabólicos apuntando a biomarcadores específicos que están asociados con la EA. La PET de fluorodesoxiglucosa (FDG) detecta el metabolismo cerebral y el PET amiloide que cuantifica el depósito amiloide se ha desarrollado para comprender la patogénesis de la EA y controlar la progresión de la enfermedad y los efectos terapéuticos. Otros radiotraidores neuroespecíficos, asociados a la inflamación y al metabolismo están en desarrollo para estudios de EA. En este estudio, discutimos los modelos de animales AD que son relevantes en los estudios de imágenes AD PET y resumimos los trazadores de PET que se han probado en modelos animales AD y los hallazgos de estos estudios.
Modelos de animales AD
Modelos de ratón
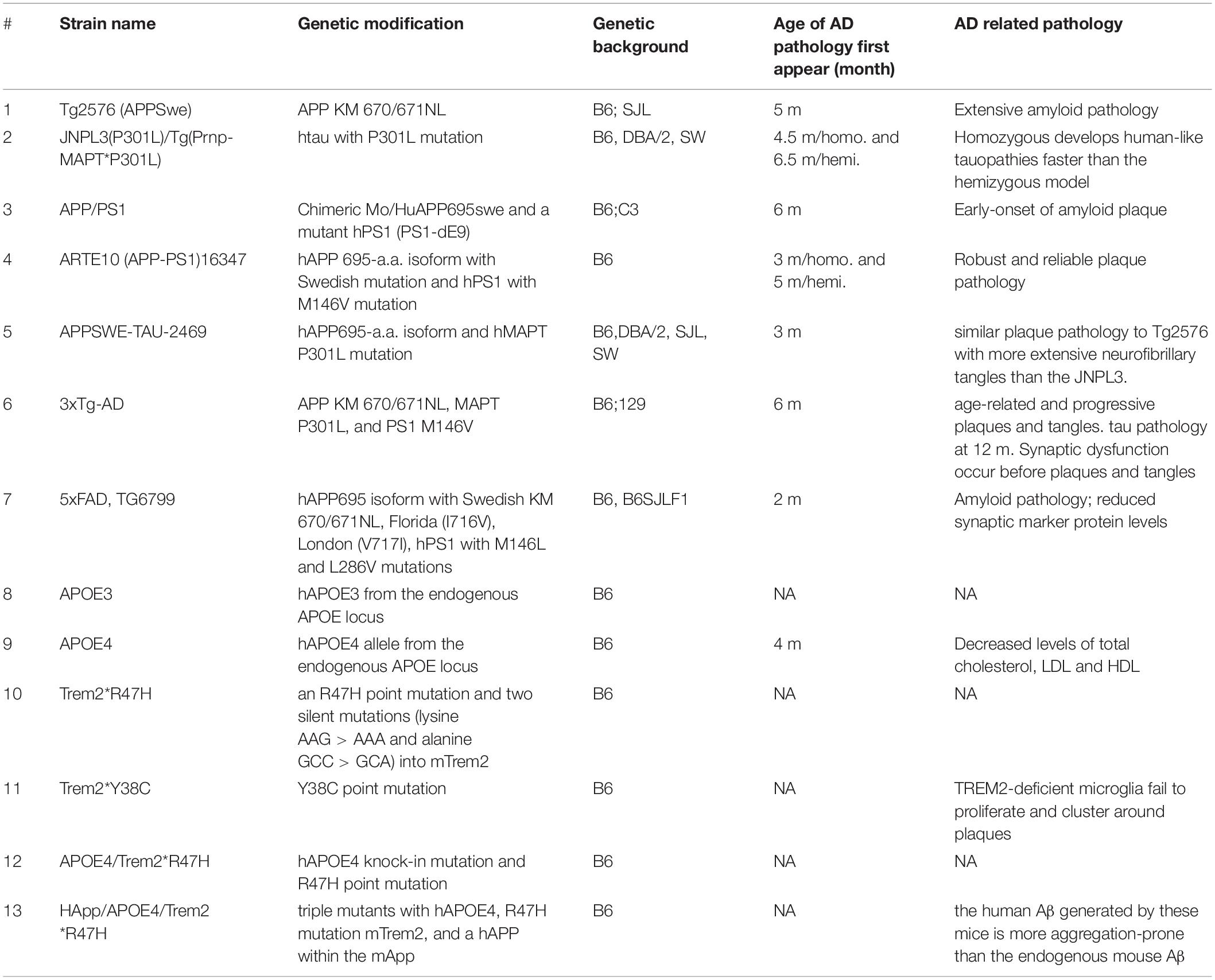
En el campo de las enfermedades neurodegenerativas, los ratones son los animales más utilizados por sus características biológicas que son similares a las de los humanos, la genética fácilmente manipulada para imitar las condiciones y enfermedades humanas, y una vida útil relativamente corta (1,5-2 años). Debido a que los ratones no desarrollan EA de forma natural, los ratones transgénicos se generan para recapitular ciertas características patológicas de la EA para adaptarse a las necesidades de investigación (Tabla 1). Los genes asociados con el inicio temprano de la EA han sido los principales objetivos de las manipulaciones transgénicas.
Ratones con las mutaciones familiares de APP V717F (Indiana) y K670N/671L (APPswe, sueco)
El primer modelo de ratón que desarrolla placas Aβ es APP (V717F), que desarrolla progresivamente depósitos Aβ positivos de tioflavina S extracelular, placas neuríticas, pérdida sináptica, astrocitosis y microgliosis (Games et al., 1995). Este modelo se puede utilizar para probar medicamentos terapéuticos dirigidos a la amiloidosis. La mutación APP sueca comúnmente estudiada (APPswe) K670N/M671L lleva un transgen que codifica la isoforma de ácido 695-amino de la proteína precursora Aβ humana que lleva la mutación sueca (Sturchler-Pierrat et al., 1997). Este modelo de ratón expresa altas concentraciones del mutante Aβ, desarrolla placas amiloides significativas y muestra déficits de memoria. Es útil para estudiar la expresión de APP, la formación de placas amiloides, el deterioro neuronal y la pérdida de memoria asociada con la EA, así como los descubrimientos de medicamentos. Recientemente, Xu et al. (2015) lograron la deposición amiloide utilizando genes murinos portadores de la mutación APPswe, lo que indica que los péptidos Aβ murinos pueden producir depósitos amiloides que se asemejan morfológicamente a los que se encuentran en la EA humana.
Ratones con la mutación familiar FTLD MAPT P301L o Tau humano
El primer ratón en desarrollo de NFT se logró expresando la mutación familiar FTLD MAPT P301L bajo el control del promotor de priones de ratón (Lewis et al., 2000). Allen et al. (2002) utilizaron el promotor Thy1.2 del ratón para alcanzar un aumento de 2 veces en la expresión del mutante FTLD-tau P301S en comparación con el tau endógeno, con NFT que se formaban a los 5 meses de edad. El primer modelo transgénico MAPT humano (ALZ7) con el promotor humano THY1.2 expresó solo un nivel bajo del gen transgénico, pero logró la deposición de tau hiperfosforilado en el dominio somatodendrítico (Gotz et al., 1995). El modelo rTg4510 utiliza un sistema de transactivador binario reversible para lograr un alto nivel de expresión de tau (13 veces) con P301L, lesiones similares a NFT, pérdida neuronal, deterioro cognitivo y atrofia cerebral en un período de tiempo anterior (Santacruz et al., 2005). Este ratón desarrolla agregaciones progresivas de tau intracelulares en las áreas corticomímbidas y atrofia del cerebro anterior. Los ratones Tau (hTau) humanos (Andorfer et al., 2003) se generaron cruzando ratones 8c que expresaban isoformas tau 3R y 4R humanas (Duff et al., 2000) con ratones tau knockout (KO) generados por la interrupción específica del exón uno en el gen MAPT (Tucker et al., 2001). Este modelo de ratón expresa las seis isoformas de hTau, pero carece de tau de ratón. Desarrolla una patología tau asociada a la edad que parece más grave en el neocortex y el hipocampo. No se encontró ninguna patología tau tanto en ratones 8c como en ratones tau KO. Recientemente, Saito et al. (2019) utilizaron un enfoque de recombinación homóloga para reemplazar todo el gen Mapt murino por el ortólogo humano para crear un modelo de ratón MAPT (KI) que exprese las seis isoformas tau presentes en los seres humanos. Cruzaron los ratones MAPT KI con ratones KI de aplicación individuales para generar los ratones APP/MAPT de doble entrada (dKI) que exhiben una mayor fosforilación tau que los ratones MAPT KI individuales (Saito et al., 2019).
Ratones de reemplazo APOE-Target (a ratones APOE-TR)
La familia APOE consta de tres isoformas: APOE2, APOE3 y APOE4, siendo APOE4 el mayor factor de riesgo genético para la EA (Kim et al., 2009). Ratones de reemplazo de objetivo APOE (A ratones APOE-TR), en los que la secuencia de codificación m-APOE se reemplaza por la de un alelo h-APOE, muestran alteraciones en el número y la estructura sináptica, la conectividad de red y el comportamiento basados en la isoforma APOE específica expresada (Ji et al., 2003; Wang Estos ratones exhiben diferencias específicas de isoformas en la fisiología lipídica y la función sináptica. Los ratones con h-APOE4 exhiben una patología de EA más temprana y más grave y una disminución de la memoria (Bour et al., 2008; Sun et al., 2017; Lewandowski et al., 2020).
Receptor desencadenante expresado en células mieloides 2 ratones modificado por genes
El receptor desencadenante expresado en las células mieloides 2 (TREM2) se expresa en microglía, y sus variantes genéticas R47H e Y38C están relacionadas con la EA, la demencia frontotemporal y la enfermedad de Nasu-Hakola, que es una aparición temprana de la demencia caracterizada por la patología de la materia blanca (Yaghmoor et al Mientras que la variante de Trem2 R47H está asociada en gran medida con la EA de inicio tardío, la variante Y38C de Trem2 está asociada con el desarrollo de demencia de inicio temprano (Jadhav et al., 2020). Tanto los ratones Trem2R47H como los Trem2Y38C se generaron utilizando la técnica CRISPR/Cas9 para introducir las mutaciones puntuales de Trem2R47H y Trem2Y38C. Los ratones homocigotos TREM2 R47H exhiben una nueva variante de empalme que resulta en una expresión parcial de ARNm y proteína en el cerebro (Xiang et al., 2018). Mientras que los ratones que albergaban el Trem2 Y38C mostraban niveles normales de expresión de TREM2, se observaron alteraciones en la expresión de genes neuronales y oligodendrocitos/mielina, junto con disminuciones regionales en los niveles de proteína sináptica, particularmente en el hipocampo (Jadhav et al., 2020).
Ratones APP/PS1
Además de los «modelos de un solo gen» descritos anteriormente, también se han introducido combinaciones de genes relacionados con la EA en ratones que utilizan tecnología transgénica. Estos modelos genéticos combinatorias presentan una mayor diversidad fenotípica y, por lo tanto, ofrecen más opciones para los estudios preclínicos. El modelo de ratón APP/PS1 se generó mediante la administración tanto del mutante APPswe (K595N/M596L) como del mutante ΔE9 de la presenilina 1 (PS1), que es un componente esencial de la γ-secretasa, la enzima responsable de la escisión de la APP. Las mutaciones en PS1 conducen a una herencia dominante del FAD de inicio temprano (Jankowsky et al., 2001). Los ratones desarrollan depósitos de Aβ en el cerebro a los 6-7 meses de edad, con hembras de 15 meses de edad que presentan un aumento de 5 veces (Aβ42) y 10 veces (Aβ40) en los depósitos de Aβ en el cerebelo en comparación con los machos (Jankowsky et al., 2004; Ordonez-
La cepa 3 × Tg
Aunque no hay informes de que las mutaciones de APP, PS1 y tau ocurran simultáneamente en humanos, la cepa 3 × Tg es el modelo más utilizado que presenta Aβ agregada y disfunción sináptica. Este modelo se crea coinyectando dos construcciones que expresan el tau mutante APPswe y P301L en ovocitos obtenidos de ratones KI PS1 M146V. Estos ratones transgénicos triples expresan APP mutante, PSEN2 y MAPT y muestran una acumulación de placas Aβ dependiente de la edad y patología neurofibrilar similar a la maraña, a partir de los 4 meses de edad (Grueninger et al., 2010).
La cepa FAD de 5 ×
La cepa 5 × FAD combina la mutación APPswe con las mutaciones de Florida (I716V) y Londres (V717I) de APP, así como las mutaciones M146L y L286V de PSEN1. Estos ratones muestran déficits cognitivos progresivos con varias características patológicas de la EA, como placas Aβ, gliosis, degeneración sináptica y pérdida neuronal, y desarrollan patología tau (Oakley et al., 2006).
El ratón APOE4/TREM2R47H
Esta cepa doble mutante lleva una mutación APOE4 en llamas humanizada y una mutación en el punto R47H generada por CRISPR/cas9 del gen Trem2. Esta cepa no produce ningún fenotipo grave, ni siquiera tarde en la vida, lo que permite una mejor comprensión del efecto de los factores de riesgo de EA en el contexto del envejecimiento (Kotredes et al., 2021).
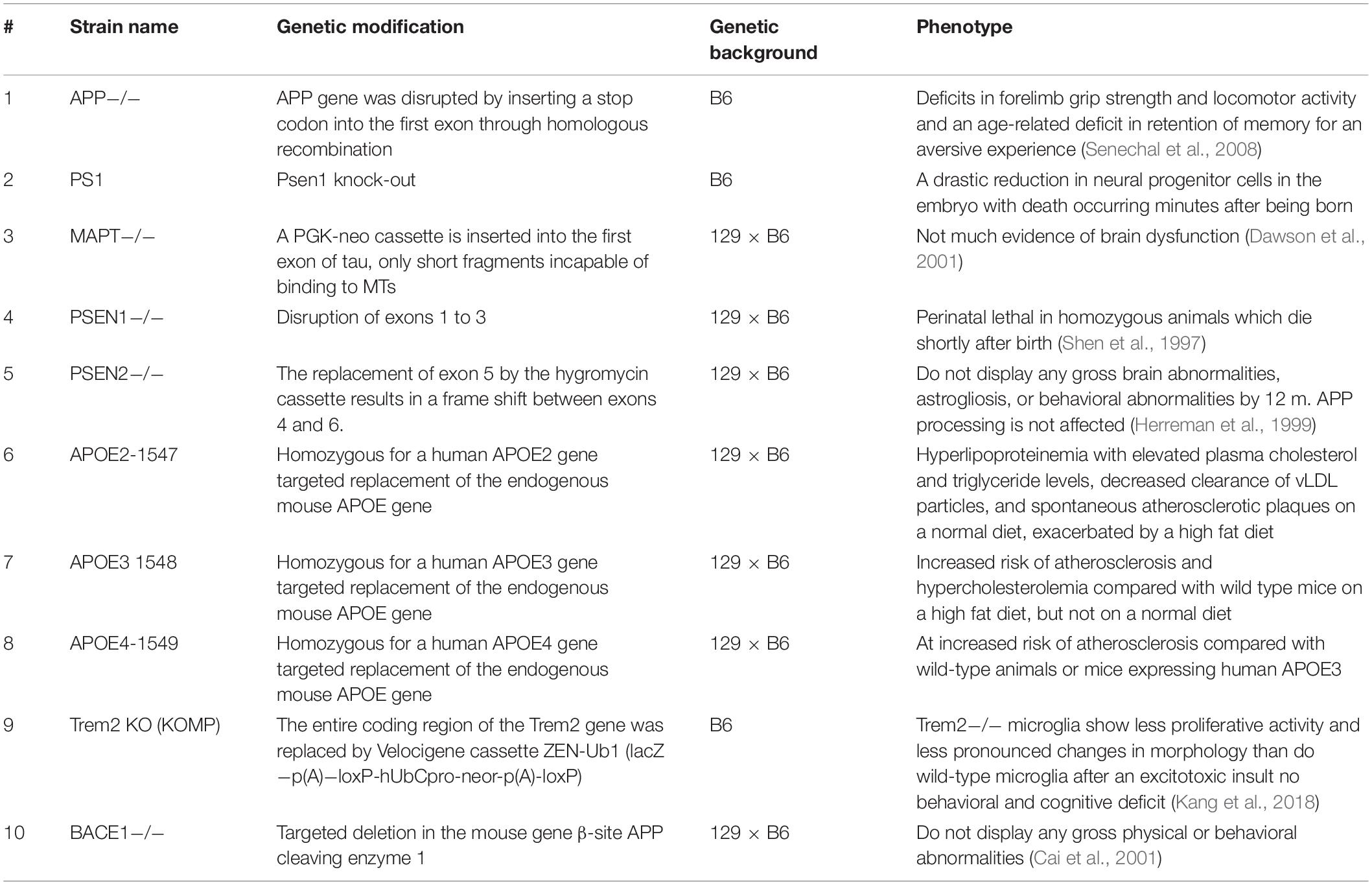
Ratones Knockout
Se generan varios ratones KO relacionados con la EA para comprender el papel fisiopatológico de las proteínas relacionadas con la EA, incluyendo APP, MAPT, BACE1, APOE, PSEN1, PSEN2 y Trem E (Tabla 2).
Los ratones APP KO muestran déficits en la fuerza de agarre del tala y la actividad locomotora y un déficit relacionado con la edad en la retención de la memoria para una experiencia aversiva (Senechal et al., 2008). Se ha informado de que los ratones MAPT KO muestran menos evidencia de disfunción cerebral (Harada et al., 1994; Dawson et al., 2001; Morris et al., 2011). Los ratones KO PSEN1 exhiben letalidad perinatal en animales homocigotos, que mueren poco después de nacer (Shen et al., 1997). Los ratones PSEN2 KO son viables y normales en crecimiento y tamaño y no muestran ninguna anomalía cerebral grave, astrogliosis o anomalía del comportamiento a los 12 meses de edad, y no tienen déficit en el procesamiento de APP (Herreman et al., 1999). Los ratones APOE KO muestran un mal aclaramiento de lipoproteínas con la posterior acumulación de partículas enriquecidas con éster de colesterol en la sangre (Piedrahita et al., 1992). El estado proinflamatorio sistémico de los ratones APOE KO también los convierte en buenos candidatos para estudiar los factores de riesgo de EA (Lo Sasso et al., 2016). Los ratones TREM KO no muestran déficit conductual y cognitivo (Kang et al., 2018). Los ratones BACE1 KO no muestran ninguna anomalía física o conductual grave (Cai et al., 2001).
Modelos de AD inducidos por productos químicos
Los modelos de la enfermedad de Alzheimer también se pueden generar por inducción química. Los agregados sintéticos de Aβ y tau se han inyectado por vía intraperitoneal para inducir amiloides cerebrales y tauopatía intracerebral (Gotz et al., 2001; Clavaguera et al., 2014). Inyección intracraneal de ácido okadaico, un inhibidor de la fosfatasa de la proteína, aumento de la fosforilación de tau y la agregación de proteínas en distintas regiones del cerebro (Baker y Gotz, 2016). La inyección intracraneal de agregados sintéticos de Aβ en ratones transgénicos tau P301L puede acelerar la formación de NFT (Peeraer et al., 2015). Los lisatos cerebrales tanto de ratones transgénicos como de pacientes con EA también inducen nucleación de la agregación de proteínas junto con proyecciones neuronales en ratones sanos o ratones con patología preexistente de EA (Bolmont et al., 2007; Clavaguera et al., 2009; He et al., 2018). El lipopolisacárido (LPS) actúa como un ligando del receptor 4 similar al Toll para activar la microglía para producir citocinas proinflamatorias como TNF-α, IL-1β, prostaglandina E2 (PGE2) y óxido nítrico (NO) en el sistema nervioso central (Heneka et al., 2015). La administración de LPS a los animales induce deterioro cognitivo (Shaw et al., 2001; Choi et al., 2012) y altos niveles de Aβ1-442 (Zhao et al., 2019).
Otros productos químicos utilizados para la inducción del deterioro cognitivo incluyen metales pesados (por ejemplo, aluminio, cobalto y tonel), escopolamina, etanol, colchicina, una excitotoxina, streptozotocina y azida de sodio, entre otros, y se han resumido bien en la revisión (More et al., 2016; Götz et al., 2018)
Modelos basados en lesiones y traumas
La lesión cerebral se asocia con niveles elevados de Aβ y fosforilación tau (Yu et al., 2012), pero no con la formación de placas y NFT. En ratones transgénicos hTau y 3xTg, la lesión cerebral acentúa el desarrollo de la patología tau y la acumulación de Aβ (Tran et al., 2011; Ojo et al., 2013).
Modelos AD de próxima generación
No hay ningún modelo de ratón AD que recapule todos los aspectos de la EA humana. Incluso con los altos niveles de proteína amiloide, los ratones todavía no muestran déficits cognitivos similares a los humanos. Las placas Aβ en ratones a menudo son difusas o exhiben menos fibrillas de reticulación, incluso cuando parecen condensadas. La patología tau también muestra una cierta diferencia con la de los humanos, con un amplio e incontrolable rango de niveles de expresión en algunos ratones modelo AD. Debido a que hay docenas de genes diferentes que están asociados con la EA, las diferentes combinaciones de mutaciones en estos genes, junto con diferentes estimuladores ambientales, contribuirán a cada caso único de EA (Naj y Schellenberg, 2017). Además, es más probable que los crías de ratones transgénicos transgénicos y salvajes de EA desarrollen pérdida de memoria, lo que indica que hay factores genéticos o ambientales asociados a AD que aún no se han aclarado, lo que impulsa los esfuerzos continuos por mejores modelos de ratones. En 2016, los NIH iniciaron el consorcio MODEL-AD para diseñar ratones con diferentes mutaciones genéticas asociadas con la EA de inicio temprano o tardío (model-ad.org).
Modelos de ratas
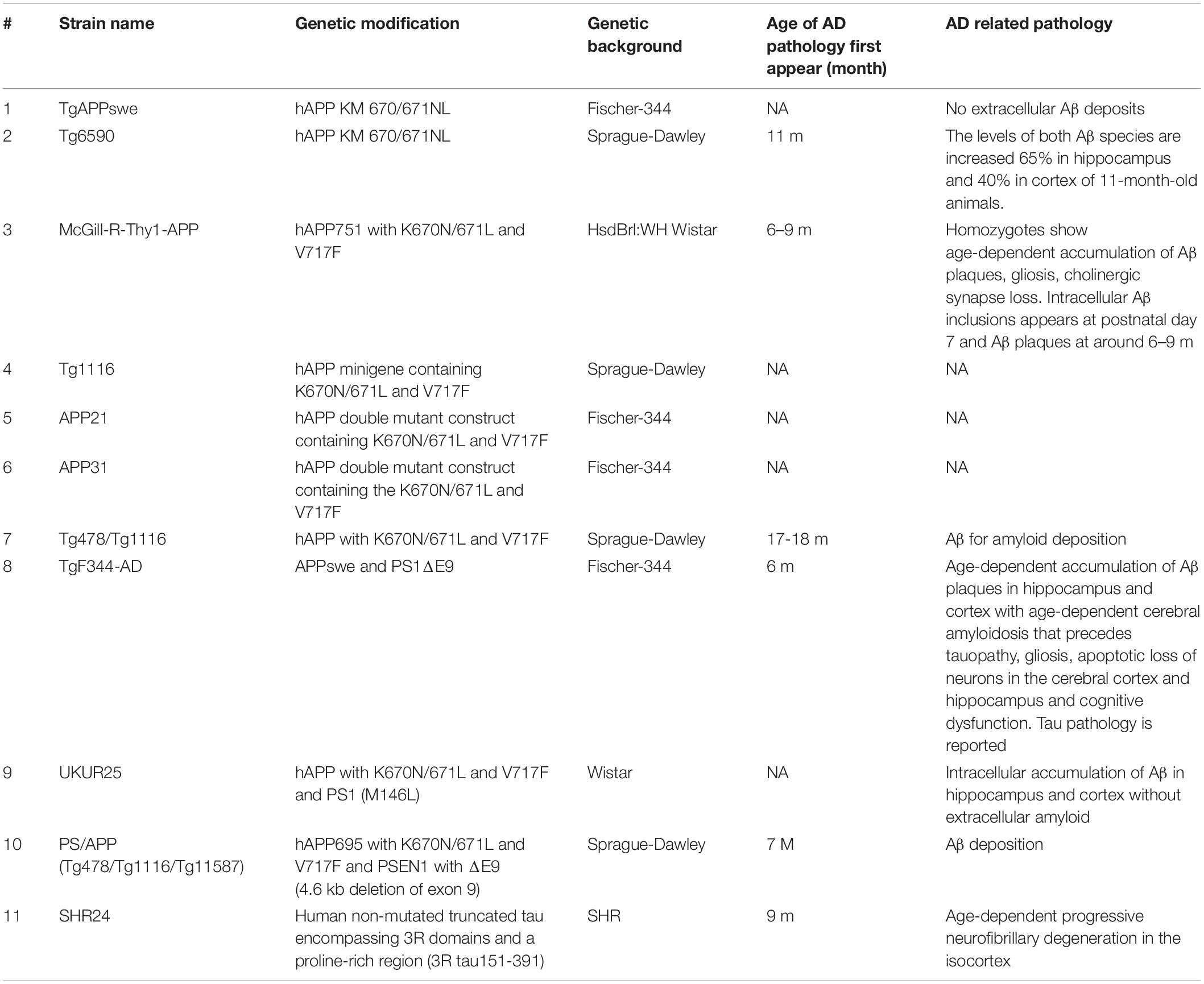
En comparación con los ratones, las ratas son más fáciles de manejar y tienen un tamaño cerebral más grande para facilitar la operación quirúrgica y el análisis de imágenes (Ellenbroek y Youn, 2016). Se han desarrollado modelos de EA de ratas genéticas tanto genéticas como no genéticas (Tabla 3). Sin embargo, a diferencia de los modelos transgénicos de ratones AD, no hay tantos modelos de ratas AD disponibles para la investigación científica y las ratas parecen ser más resistentes a la patología de la EA que los ratones (Charreau et al., 1996).
Modelos de ratas con las mutaciones familiares suecas e Indiana
Las ratas transgénicas de la APP parecen tener niveles de expresión más bajos del transgen de la APP que el modelo AD del ratón (Benedikz et al., 2009). TgAPPswe es la primera rata transgénica de APP que sobreexpresa la APP humana con mutación sueca (K670N y M671L) (Ruiz-Opazo et al., 2004), con solo un aumento del 56,8% en el nivel de expresión de ARNm de APP, un aumento del 21 % para Aβ42 y del 6% para Aβ No se encontró ninguna patología relacionada con la EA en estos animales hasta la edad de 18 meses. La rata Tg6590 generada por Fokesson et al. es otro modelo que lleva la APP humana con la mutación sueca. Los niveles de ambas especies de Aβ aumentan un 65 % en el hipocampo y un 40 % en la corteza de animales de 11 meses de edad. Las ratas muestran déficits de aprendizaje y memoria en el laberinto de agua de Morris a los 9 meses y un comportamiento espontáneo alterado medido en campo abierto (Kloskowska et al., 2010). El modelo de rata McGill-R-Thy1-APP expresó hAPP751 con las mutaciones suecas e Indiana, con inclusiones Aβ intracelulares detectadas ya en el día 7 y placas Aβ postnatal a los 6 a 9 meses de edad (Leon et al., 2010). Las ratas Tg1116 expresan un mini gen de APP humano que contiene las mutaciones familiares de la EA sueca y de Indiana (Flood et al., 2009). APP21 y APP31 expresan una construcción de doble mutante de APP humana que contiene las mutaciones AD suecas e Indiana impulsadas por el promotor de la ubiquitina-C. Se informa que el transgen APP se expresa en el cerebro, en células neuronales pero no gliales (Agca et al., 2008). Todavía no se han publicado estudios patológicos o de comportamiento. Las ratas dobles homocigotas Tg478/Tg1116 se generaron cruzando Tg478, que expresa la APP humana con la mutación sueca (Flood et al., 2009) y Tg1116. Las ratas producen niveles suficientes de Aβ para que la deposición de amiloide se produzca a la edad de 17 a 18 meses (Flood et al., 2009).
Ratas APPswe y PS1ΔE9/TgF344-AD
Las ratas TgF344-AD co-expresan transgenes APPswe y PS1ΔE9 y están presentes con amiloidosis cerebral dependiente de la edad que precede a la tauopatía, la gliosis, la pérdida apoptótica de neuronas en la corteza cerebral y el hipocampo, y la disfunción cognitiva (Cohen et al.,
Modelo de rata con las mutaciones familiares de APP V717F (Indiana) y APP sueca (APPswe) K670N/671L y PSEN1 humano con la mutación finlandesa M146L
Las ratas UKUR25 expresan APP humana que contiene las mutaciones suecas e Indiana (V717F) y PS1 mutada (M146L). La principal característica patológica fue una acumulación intracelular de Aβ en las neuronas del hipocampo y la corteza sin amiloide extracelular hasta los 24 meses de edad. Se encontró un deterioro leve en el aprendizaje de adquisición en ratas macho de 16 meses de edad, con un aumento en la fosforilación de tau en los sitios ERK2 de S396 y S404 (Echeverria et al., 2004a,b).
PSAPP (Tg478/Tg1116/Tg11587) Ratas
Las ratas modelo PSAPP expresan hAPP695 con las mutaciones suecas y de Londres (K670N/M671L y V717I, respectivamente) junto con PSEN1 que portan la mutación finlandesa (PS1, ΔE9) y desarrollan deposición de Aβ alrededor de los 7 meses de edad (Flood et al. Esta cepa se creó cruzando ratas Tg478/Tg1116 homocigotas dobles con Tg11587 que lleva un transgen PS-1 humano con la mutación familiar de EA M146V. Las ratas homocigotas producen niveles suficientes de Aβ para que la deposición de amiloide se produzca a los 7 meses de edad. La rata transgénica triple homocigótica, Tg478/Tg1116/Tg11587, también se ha llamado rata PSAPP. Se encontró que los depósitos amiloides compactos estaban asociados con microglía activada, astrocitos reactivos e inmunoreactividad taufosforada.
Modelo de rata AD-Tau
La sobreexpresión de los dominios 3R truncados no mutados humanos que abarcan el primer modelo de rata de degeneración neurofibrilar cortical progresiva (Filipcik et al., 2012). Esta rata transgénica expresa una forma truncada de la proteína tau humana (truncado en las posiciones de aminoácidos 151-391), que se encuentra en el cerebro de pacientes con EA esporádicos (Benedikz et al., 2009).
Modelos de ratas AD inducidas por productos químicos
Las sustancias químicas mencionadas anteriormente utilizadas para generar modelos de ratón AD también se pueden emplear en ratas para crear fenotipos de EA (More et al., 2016; Götz et al., 2018).
Modelos de AD de animales grandes
No se sabe que los primates no humanos como los macacos rhesus y los marmotas desarrollan EA, pero acumulan depósitos de Aβ y muestran tauopatía en sus cerebros de edad avanzada (Paspalas et al., 2018; Haque y Levey, 2019; Arnsten et al., 2021b; Datta et al., 2021; Leslie et La inyección intracraneal de Aβ42 y tiorphan, un inhibidor de la neprilisina que es responsable del aclaramiento de Aβ, se ha empleado para generar un modelo de EA en monos rhesus de mediana edad (16-17 años) (Li et al., 2010). Se encontró una acumulación intracelular significativa de Aβ en las neuronas de los ganglios basales, la corteza y el hipocampo, acompañada de atrofia y pérdida neuronal. Dos inyecciones de un virus adenoasociado que expresa una mutación de doble tau (AAV-P301L/S320F) en el hemisferio izquierdo de los monos rhesus dan lugar a una propagación de tau mal desplegada similar a la de los humanos. La propagación del tau va acompañada de una respuesta neuroinflamatoria robusta impulsada por TREM2 + microglia, con biomarcadores de inflamación y pérdida neuronal en el líquido cefalorraquídeo y el plasma (Beckman et al., 2021).
Otros animales grandes no primarios utilizados para el modelado de EA incluyen animales domésticos como perros y gatos, así como animales de granja como cerdos, ovejas y vacas. Los perros de edad avanzada desarrollan patología de la placa y angiopatía amiloide cerebral (Yu et al., 2011), así como un síndrome similar a la demencia que se asemeja a la EA humana (Prpar Mihevc y Majdic, 2019; Abey et al., 2021). Se han reportado disfunciones y enredos de Tau y asociados con el deterioro cognitivo (Yu et al., 2011; Schmidt et al., 2015; Smolek et al., 2016). Los gatos también desarrollan placas, enredos y atrofia cerebral junto con el deterioro cognitivo a medida que envejecen (Chambers et al., 2015; Fiock et al., 2020). Se han notificado dos modelos de cerdo transgénicos de EA utilizando minicerdos. El primero lleva un transgen hAPP con la mutación sueca impulsada por el promotor humano BDGFβ, lo que resulta en altos niveles de expresión de Aβ específica del cerebro (Kragh et al., 2009), y el segundo modelo de minipig lleva tres copias de un transgen que expresa la variante 695 de hAPP con la mutación sueca y un trans Se detectó acumulación intraneuronal de Aβ1-42 en dos cerdos: uno a los 10 meses y otro a los 18 meses. También se han observado patologías similares a la placa y la maraña después de una lesión cerebral traumática (TBI) en cerdos (Hoffe y Holahan, 2019). La patología de Tau y las placas Aβ también se han identificado en ovejas y cabras de edad avanzada (Braak et al., 1994).
Imágenes PET preclínicas en modelos animales AD
Imágenes de β-amiloide
El desarrollo y la validación del primer trazador de radio PET Aβ de su clase, el compuesto B ([11C]PIB o PIB) de Pittsburgh derivado de la T de tioflavina, fue un hito en la obtención de imágenes de EA. No solo permite la visualización y cuantificación directa in vivo de la placa Aβ en sujetos vivos (Klunk et al., 2004), sino que también allana el camino para el desarrollo y la aprobación por la FDA de su análogo etiquetado por 18F ([18F]flutemetamol), el derivado de stilbene [18F]florbetabeno y el derivado de la sLas características fluorescentes intrínsecas de estas sondas de imagen y sus análogos permiten la evaluación microscópica de su selectividad de unión y preferencia de unión a diferentes formas de placas Aβ y placas Aβ en diferentes lugares (por ejemplo, angiopatía parenquimatosa y amiloide cerebral, CAA) (Bacskai et al., 2003; Fodero-
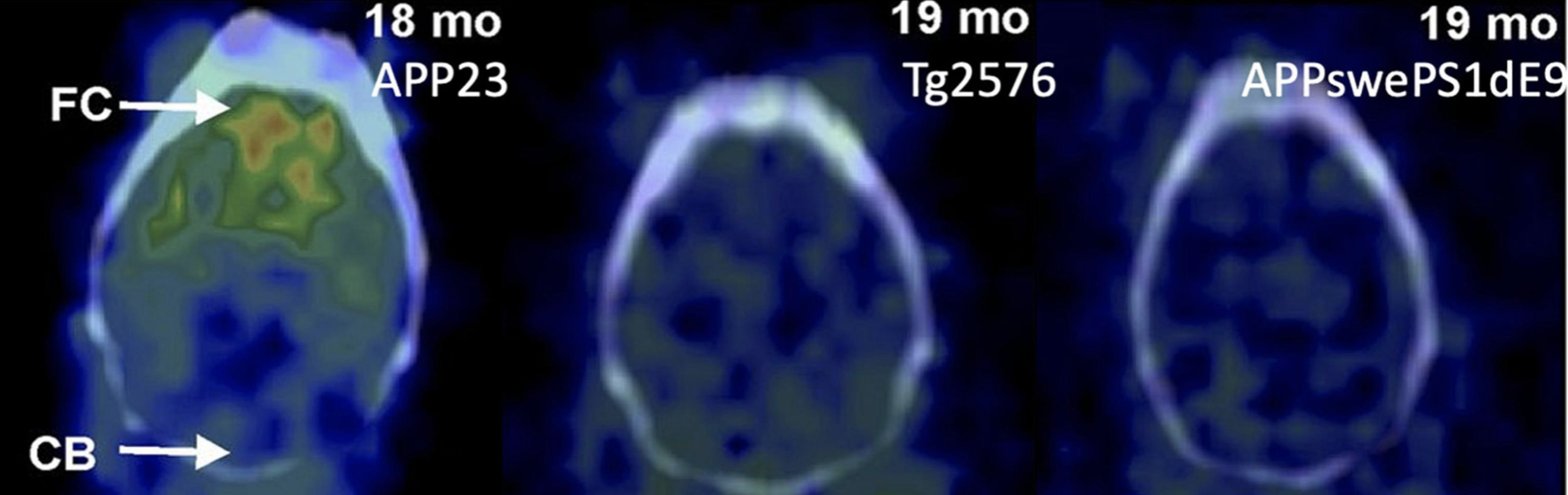
Muchos trazadores de imágenes Aβ se han evaluado utilizando múltiples modelos de animales de EA diferentes, principalmente en ratones de EA. El PIB se ha probado en ratones AD de APPswe, APP/PS1, 3 × Tg, 5 × FAD, Tg2576 y APP23 (Ni, 2021). Los informes iniciales sobre la unión al PIB en ratones Tg2576 y APP/PS1 a edades avanzadas fueron negativos, incluso con abundante patología Aβ (Klunk et al., 2005; Toyama et al., 2005); mientras que la unión al PIB en ratones APP23 fue positiva (Maeda S. et al., 2007). Estos datos llevaron a la hipótesis de que la escasez de sitios de unión de alta afinidad para el PIB en placas Aβ murinas requiere una actividad molar muy alta de PIB para obtener imágenes exitosas en modelos de AD murinos. Snellman et al. (2013) compararon la absorción de PIB longitudinalmente en los cerebros de múltiples modelos de ratones AD y encontraron una mayor absorción de PIB en la corteza de ratones APP23 en comparación con los controles de tipo salvaje y ninguna diferencia en los ratones APP/PS1 y Tg2576 con sus controles correspondientes, de acuerdo con los resultados anteriores de otros grupos (Figura 2 También compararon los patrones de tinción de tioflavina-T y encontraron que los ratones APP23 forman depósitos de Aβ humanos grandes y compactos, mientras que los ratones Tg2576 y los ratones APP/PS1 forman depósitos fibrilares dispersos. Los resultados sugieren que la unión al PIB depende en gran medida del modelo de EA y de la estructura fibrilar de orden superior asociada en lugar de simples hojas β. A nivel microscópico, las placas Aβ formadas en los cerebros de EA autosómico dominante de inicio temprano y EA esporádico tienen diferentes niveles de especies Aβ no fibrilares (Querol-Vilaseca et al., 2019), y los depósitos de Aβ en la EA familiar, la EA esporádica y la angiopatía amiloide cerebral manifiestan Una mayor comprensión de las interacciones de las sondas por imágenes con placas amiloides de diferentes formas ayudará con el desarrollo de sondas dirigidas a las diversas formas de proteínas Aβ mal dobladas en el cerebro (Biancalana y Koide, 2010).
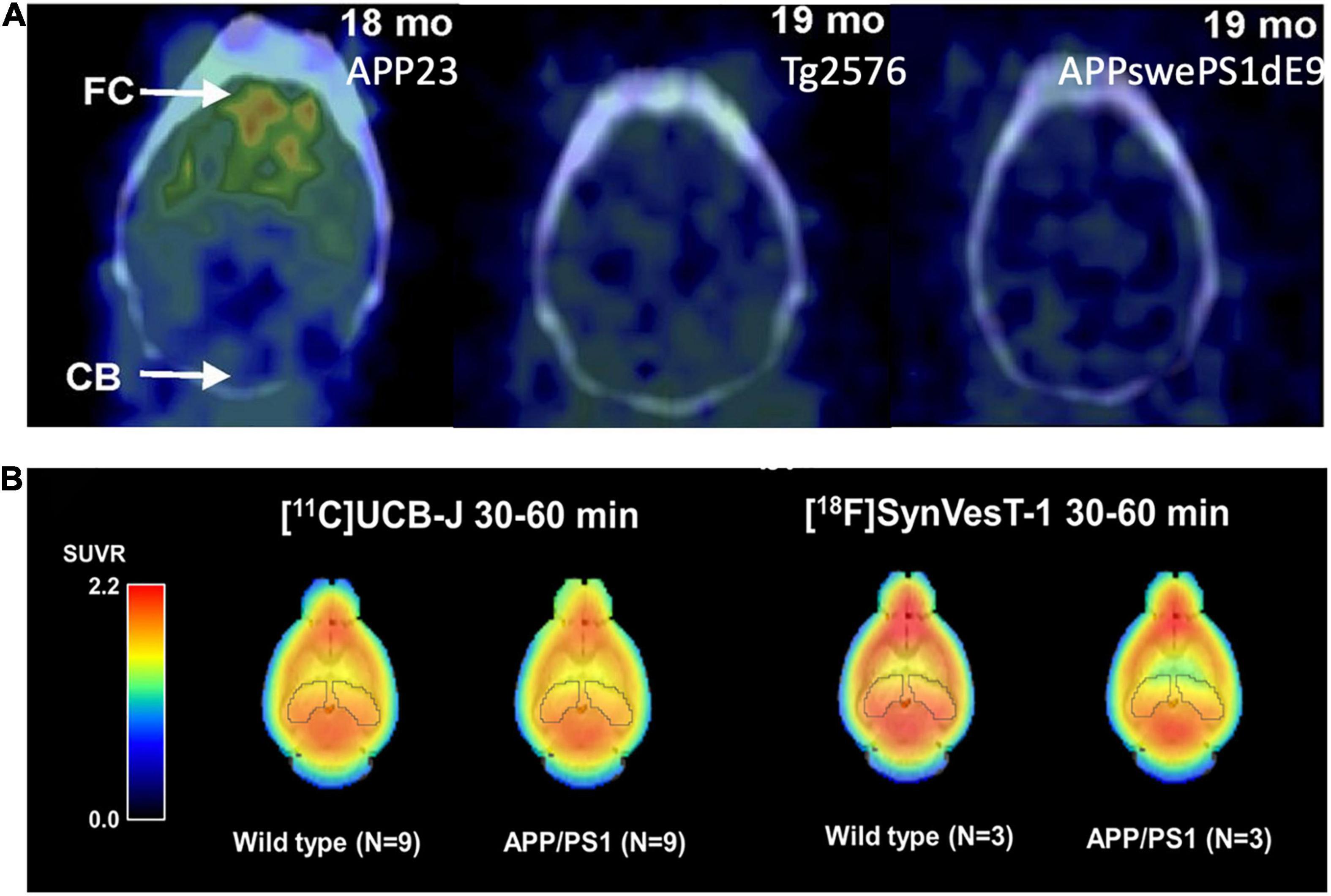 FIGURA 2. (A) [11C]La unión al PIB a los depósitos de Aβ varía según las cepas de ratón. APP23: Depósitos Aβ extensos; Tg2576: Depósitos Aβ leves; APP-swePS1dE9: Depósitos Aβ extensos. Esta figura fue adaptada y modificada de Snellman et al. J Nucl Med. 2013;54:1434-1441. (B) Adopción de los trazadores de PET SV2A [11C]UCB-J y [18F]SynVesT-1 en el cerebro de APP/PS1 y ratones de tipo salvaje. La absorción de ambos trazadores fue menor en el hipocampo de los ratones APP/PS1 en comparación con los controles de tipo salvaje.
FIGURA 2. (A) [11C]La unión al PIB a los depósitos de Aβ varía según las cepas de ratón. APP23: Depósitos Aβ extensos; Tg2576: Depósitos Aβ leves; APP-swePS1dE9: Depósitos Aβ extensos. Esta figura fue adaptada y modificada de Snellman et al. J Nucl Med. 2013;54:1434-1441. (B) Adopción de los trazadores de PET SV2A [11C]UCB-J y [18F]SynVesT-1 en el cerebro de APP/PS1 y ratones de tipo salvaje. La absorción de ambos trazadores fue menor en el hipocampo de los ratones APP/PS1 en comparación con los controles de tipo salvaje.
Una de las mayores ventajas de las imágenes PET de animales pequeños es el seguimiento longitudinal de la patogénesis y los efectos terapéuticos de los medicamentos experimentales. Esto fue demostrado por los estudios longitudinales de imágenes PET en modelos animales de EA (Maeda J. et al., 2007; Deleye et al., 2017; Snellman et al., 2017). Los desafíos en la obtención de imágenes de placas Aβ en modelos animales AD se deben a las diferentes formas de placas y patrones de disposición en diferentes modelos animales y a diferentes edades de los mismos animales (Snellman et al., 2013). Otros desafíos son la cuantificación de las señales de PET. Para el análisis cuantitativo de los datos de imágenes de Aβ PET humana, se eligió el cerebelo como región de referencia para generar relación de volumen de distribución (DVR) o relación de valor de absorción estandarizado (SUVR) debido a la falta de unión específica de PIB en el cerebelo humano (Lopresti et al., 2005; Price et al. Sin embargo, hay medicamentos eficaces emergentes dirigidos a otras vías patológicas y que no alteran los niveles de placa Aβ, por ejemplo, el inhibidor de Fyn y el modulador alostérico silencioso mGluR5 (SAM) (Kaufman et al., 2015; Haas et al., 2017). Por lo tanto, la evaluación objetiva de los efectos del tratamiento necesita diferentes biomarcadores de imagen que estén estrechamente relacionados con la recuperación sináptica/funcional en lugar de los niveles de placa Aβ. El consenso actual considera los oligómeros Aβ como la causa principal de la neurotoxicidad derivada de la amiloidosis anormal. Por lo tanto, el desarrollo de un agente de imagen dirigido a los oligómeros Aβ es muy deseable, aunque desafiante.
Se han desarrollado moléculas grandes, como anticuerpos, para imágenes de Aβ PET.Sehlin et al. (2016) y Fang et al. (2019) diseñaron los anticuerpos Aβ marcados con 124I[124I]mAb158 y Di-scFv [124I]3D6-8D3, respectivamente, para detectar el Aβ soluble en los modelos de ratón tg-ArcSwe (AβPP E693G) y sueco (A� Las imágenes de PET del cerebro muestran una correlación entre la señal de PET y los niveles de agregados Aβ solubles. Se informó de un aumento de SUVR de 2,2 a 3,5 en los cerebros de ratones AD en comparación con los cerebros de tipo salvaje. Las evaluaciones de otros trazadores de imágenes amiloides en modelos de EA se han resumido muy bien en una revisión reciente (Ni, 2021).
Imágenes de PET Tau
Dirigido a otro sello distintivo de la EA, el enredo neurofibrilar tau es un área extremadamente emocionante del desarrollo del trazador de PET. Tau es una proteína asociada a microtúbulos (MAP) enriquecida axonalmente que se acumula en la neocorteza temporal y parietal en los cerebros de EA (Hung et al., 2016; DeTure y Dickson, 2019). Tau existe como seis isoformas diferentes, que contienen 3 o 4 repeticiones de unión a microtúbulos (3R o 4R). La hiperfosforilación y la agregación de tau con diferentes repeticiones están involucradas en diferentes enfermedades neurodegenerativas, por ejemplo, AD (3R/4R), enfermedad de Pick (3R) y parálisis supranuclear progresiva (4R). Los estudios histopatológicos post mortem demostraron que las NFT son un mejor índice de gravedad y progresión de la enfermedad que Aβ para los pacientes con EA (Shoghi-Jadid et al., 2002). La patología de Tau aparece antes que la placa Aβ en el cerebro humano (Arnsten et al., 2021a). Las imágenes de Tau-PET permiten la detección de tauopatía y predicen altamente el deterioro cognitivo posterior tanto en individuos asintomáticos como sintomáticos (Leuzy et al., 2019; Wang y Edison, 2019; Beyer y Brendel, 2021).
Radioligandos Tau de primera generación
[18F]FDDNP es el primer trazador de PET que visualiza tanto las placas amiloides como los enredos tau en humanos vivos (Shin et al., 2011). Kuntner et al. (2009) compararon compañeros de camada salvaje de 13 a 15 meses de edad con ratones Tg2576 y no encontraron ninguna diferencia en la cinética cerebral regional y los valores de DVR. Más tarde, se desarrollaron y evaluaron en modelos humanos y ratones THK53, el llamado radioligand tau de primera generación, incluidos [18F] THK523, el primer trazador selectivo de tau (Okamura et al., 2005), y otros trazadores de la familia THK5105, [18F]THK5117, [18F]TH Fodero-Tavoletti et al. (2011) encontraron una mayor retención de [18F]THK523 en el cerebro de ratones rTg4510 en comparación con sus compañeros de camada de tipo salvaje o ratones APP/PS1 de 12 meses de edad. Brendel et al. (2016) investigaron [18F]THK5117 en ratones Tau-P301S (PS19) y ratones GSK-3β × Tau-P301L (biGT) bigénicos y encontraron un aumento del SUVR en el tronco encefálico de ratones P301S de edad avanzada y en las áreas entorrino/amigdaloides En un estudio separado, el mismo grupo realizó una comparación cara a cara de [18F]T807 y [18F]THK5117 en ratones Tau-P301S (P301S) (Brendel et al., 2018). La absorción [18F]T807 significativamente elevada que [18F]THK5117 en el tronco encefálico de ratones P301S fue evidente a los 6 meses, y esto aumentó aún más a los 9 meses. Por lo tanto, [18F]T807 parecía ser más sensible que [18F]THK5117 para detectar la patología de la tau en este modelo. Recientemente, se encontró que la señal de PET [18F]THK5351 se correlacionaba bien con los cambios histológicos y bioquímicos con los cambios en el deterioro motor, la memoria y el aprendizaje, en ratones tau P301S desde 8 meses a lo largo del tiempo (Moreno-Gonzalez et al., 2021).
Sin embargo, debido a la unión fuera del objetivo a la monoaminooxidasa-B (MAO-B), se considera que los trazadores de la familia THK tienen una utilidad limitada en las tauopatías por imágenes en la EA (Ng et al., 2017; Murugan et al., 2019; Bao et al., 2021).
[11C]PBB3 es un fenil- y piridinil-butadienil-benzotiazol pirado y se ha utilizado clínicamente para la detección in vivo de tauopatías en el cerebro humano. [11C]PBB3 se ha probado en el ratón rTG4510 (Ishikawa et al., 2018) y el modelo de ratón transgénico PS19 (que expresa la patología de tau 4R) (Maruyama et al., 2013). Ni et al. (2018) compararon [11C]PBB3 en los modelos PS19 y rTg4510 y encontraron un aumento de la unión in vivo en el neocortex y el hipocampo de ratones rTg4510. Por el contrario, la unión in vitro [11C]PBB3 se elevó en el tronco encefálico, pero no en el hipocampo de los ratones PS19. Se ha demostrado que [18F]PM-PBB3, un derivado etiquetado por 18F de [11C]PBB3, detecta depósitos significativos de tau medidos por SUVR en ratones rTg4510 a partir de los 6 meses de edad (Weng et al., 2020). Recientemente, McMurray et al. informaron de la síntesis de [11C]LM229 basada en la columna vertebral de PBB3. [11C]LM229 mostró una alta especificidad para la tau 4R agregada en las secciones cerebrales de ratones tau P301S y agregados tau humanos truncados 151-351 3R (SHR24) y 4R (SHR72) en secciones cerebrales de ratas transgénicas tau. Los estudios preliminares de PET con [11C]LM229 en ratones tau WT y transgénicos P310S confirmaron la penetración de BBB por el radiotrazador con la máxima absorción cerebral (%ID/g máx.; WT = 1,56, P301S = 2,3 %) en el primer minuto, seguido de un lavado durante el escáner de 90 minutos (McM
El radioligand tau de primera generación más estudiado [18F]flortaucipir ([18F] T-807 y [18F]AV-1451) no mostró ninguna retención diferente en el cerebro de los ratones transgénicos tau P301L en comparación con los ratones de tipo salvaje (Xia et al., 2013; Declercq et al., 2016), que se
Radioligandos Tau de segunda generación
Los radiotracers de segunda generación con una relación señal-ruido mejorada, menos fuera del objetivo y menor unión no específica ya están disponibles para la investigación de imágenes tau. Estos trazadores incluyen [18F]PI2620, [18F]MK6240, [18F]GTP1, [18F]RO-948 (RO6958948), [18F]JNJ311 (JNJ64349311) y [18F]JNJ-067 (JNJ-64326067). Se han llevado a cabo estudios preliminares en humanos y ratones sanos con resultados prometedores con respecto a la selectividad, afinidad y estabilidad de unión (Bao et al., 2021). Hasta ahora, estos trazadores no se han probado en modelos de animales AD.
Imágenes de PET del metabolismo de la glucosa
Brain [18F]FDG PET indica principalmente actividad sináptica. [18F] La absorción de FDG se correlaciona fuertemente en la autopsia con los niveles de la sinoptofisina de la proteína de la vesícula sináptica (Rocher et al., 2003). El grado y la extensión regional del hipometabolismo medido por [18F]FDG-PET se correlacionan aproximadamente con la gravedad general del deterioro cognitivo en la EA. Existe una estrecha correlación entre la acumulación regional de un trazador tau-PET ([18F]AV1451) y el hipometabolismo [18F]FDG (Rubinski et al., 2020). Junto con las imágenes amiloides, se ha aplicado [18F]FDG PET en múltiples modelos de roedores AD como APPswe (Tg2576), 5 × FAD, APP/PS1, 3 × Tg, Tg4-42, ratones TASTPM y ratas McGill-R-Thy1-APP (Waldron et al., 2015b; Bout Se encontraron diferentes resultados de PET [18F]FDG en ratones Tg2576. No se encontraron diferencias en el metabolismo de la glucosa cerebral en Tg2576 en comparación con los ratones WT en el estudio de Kunter (Kuntner et al., 2009), mientras que Luo et al. (2012) encontraron un aumento en la absorción de FDG en Tg2576 de 7 meses, y Coleman et al. (2017) informaron una reducción de la absorción de FDG Dos estudios separados de PET [18F]FDG con ratones APPPS1-21 de 12 meses de edad llegaron a la misma conclusión de que la absorción de FDG se redujo en el cerebro (Waldron et al., 2015a; Takkinen et al., 2017). Usando ratones APP/PS1, tanto Poisnel et al. (2012) como Li et al. (2016) mostraron un aumento del metabolismo de la glucosa dependiente de la edad. Además, los ratones PS2APP mostraron un aumento de la absorción de FDG [18F] a los 5 y 16 meses (Brendel et al., 2016) y se encontró que los ratones TASTPM tenían una disminución de la absorción de FDG a los 9 y 14 meses de edad (Waldron et al., 2015a, 2017; Deleye et al., 2016) Se notificaron resultados contradictorios en ratones 5xFAD, con Rojas et al. (2013) reportando un aumento de la absorción de [18F]FDG en 5xFAD de 11 meses, y Macdonald et al. (2014) mostrando una disminución de la absorción en ratones de 13 meses de edad. Sancheti et al. (2013) también informaron de una disminución de la absorción de FDG en ratones 3xTg.
Los estudios clínicos de imágenes de FDG PET han demostrado ser prometedores en la detección temprana de la EA, ya que la neurodegeneración en ciertas regiones del cerebro (predominar predominantemente temporal) se refleja en el hipometabolismo de la FDG (Cohen y Klunk, 2014), y el patrón de hipometabolismo podría servir como biomarcador predictivo para la Sin embargo, no ha habido un método adecuado para distinguir la señal FDG que contribuye la actividad neuronal y la activación de las células inmunitarias, y por lo tanto la señal PET FDG podría estar teóricamente influenciada por dos fuerzas opuestas, es decir, el hipometabolismo y la neuroinflamación, en ciertas etapas de la patogénesis y progresión de la EA Con el reciente desarrollo de métodos de imagen de PET para la densidad de sinapsis (ver sección «Inmagnamiento de PET de glicoproteína de vesícula sináptica 2A» para PET SV2A) y neuroinflamación (ver sección «Reimágenes de PET de neuroinflamación» para imágenes de PET de neuroinflamación), estamos en una Esto es relevante en los casos de pacientes con MCI que muestran una correlación positiva entre Aβ PET y FDG PET.
Imágenes de PET de la glicoproteína de vesícula sinagoga 2A
La glicoproteína 2A de vesícula sináptica se expresa ubicuidadmente en las neuronas del sistema nervioso central y se utiliza ampliamente como uno de los biomarcadores de densidad sináptica. La pérdida de sinapsis en el hipocampo y la corteza prefrontal está implicada como un evento patológico temprano en la EA antes de la aparición de placas Aβ y enredos tau y empeora cada vez más durante la progresión de la EA (Cai et al., 2019; Jackson et al., 2019).
[11C] El levetiracetam se desarrolló por primera vez, pero no se siguió en un estudio de imagen adicional (Cai et al., 2014). Sin embargo, alentó el desarrollo de ligandos SV2A con afinidades mucho más altas, incluyendo [11C]UCB-A (Estrada et al., 2016), [18F]UCB-H (Warnock et al., 2014; Bahri et al., 2017; Becker et al., 2017), y [11C]/[18F Entre estos, [11C]UCB-J exhibió una alta absorción cerebral, una cinética de unión tisular rápida y reversible y altas señales de unión específicas tanto en primates no humanos como en humanos (Finnema et al., 2016; Nabulsi et al., 2016). Más recientemente, [18F]SynVesT-1 (también conocido como [18F]SDM-8 (Li et al., 2019a) y [18F]MNI-1126 (Constantinescu et al., 2019) se desarrollan y evalúan en primates y humanos no humanos (Li et al., 2021; Naganawa et al., 2021 Usando ratones APP/PS1, Toyonaga et al. mostraron una disminución de la absorción [11C]UCB-J en comparación con los ratones WT, y el tratamiento con el inhibidor de la tirosinacinasa Fyn saracatinib revirtió este efecto (Toyonaga et al., 2019). Sadasivam et al. (2019, 2021) encontraron una señal [18F]SynVesT-1 más baja en todo el cerebro de ratones APP/PS1, en comparación con ratones de tipo salvaje (Figura 2B). Sin embargo, en un estudio que utilizó [11C]UCB-J en el modelo tg-ArcSwe y ratones de tipo salvaje, se encontró una diferencia pequeña pero no significativa (∼5%) entre los dos grupos, presumiblemente debido a la gran variabilidad entre animales (Xiong et al., 2021).
Imágenes de PET de neuroinflamación
La microglía son macrófagos en el cerebro que desempeñan un papel importante en la neuroinflamación en la EA. Las imágenes PET de biomarcadores de microglía proporcionan información sobre el curso temporal de la patología de la EA. Sin embargo, los diversos fenotipos de la microglía activada y sus diferentes funciones a lo largo de la trayectoria de la EA hacen que sea difícil desarrollar radiotracadores específicos para la neuroinflamación en la EA.
La proteína translocator de 18kDa (TSPO) ha sido ampliamente estudiada como biomarcador para la activación de microglial durante más de 20 años. Los primeros radiotracers tenían desventajas de baja penetrabilidad cerebral, baja afinidad de unión por TSPO, corta vida media del radioisótopo y sensibilidad de afinidad de unión a los polimorfismos genéticos (Zhou R. et al., 2021). [18F]DPA714 es uno de los radiosadores más recientes desarrollados para TSPO. [18F]DPA714 se evaluó en ratones APP/PS1 a diferentes meses para determinar el papel de la microglía en la patogénesis de la neuroinflamación de la EA (Hu et al., 2020). Se observó una mayor absorción de [18F]DPA714 en la corteza y el hipocampo de ratones AD de 12-13 y 15-16 meses de edad, pero no más jóvenes, en comparación con los ratones de control. Otro estudio longitudinal de PET en ratones APP23 utilizó [18F]GE180 para imágenes de TSPO y [11C]PIB para evaluar la deposición de amiloide en experimentos de autoradiografía ex vivo (Lopez-Picon et al., 2018). El modelo APP23 se eligió debido a la alta unión al PIB [11C] en el cerebro de los ratones modelo en comparación con otros modelos AD como APP/PS1. Se fotografiaron ratones AD con [18F]GE-180 a los 17, 20 y 26 meses de edad. La unión de [18F]GE-180 se estancó en las regiones de la corteza frontal y el hipocampo en la etapa temprana de la EA, pero la amiloidosis aumentó a lo largo de las últimas etapas de la EA (17-26 meses de edad). Por lo tanto, [18F]GE-180 parecía ser útil para rastrear TSPO/neuroinflamación en la EA en etapa temprana, pero no para monitorear la progresión de la enfermedad.
En comparación con el TSPO, la expresión del receptor del factor 1 estimulante de colonias (CSF1R) en el cerebro está predominantemente localizada a la microglía y baja en otros tipos de células. [11C]CPPC se desarrolló a partir de un potente inhibidor de CSF1R con un IC50 de 0,8 nM (Horti et al., 2019) y se evaluó en un modelo de ratón de APP que sobreexpresa de amiloidosis relacionada con AD con mutaciones suecas e Indiana (Melnikova et al., 2013). [11C]CPPC tuvo una absorción aproximadamente un 30 % más alta en la corteza de los ratones AD en comparación con los ratones de control a 40 minutos después de la inyección. También se observó una absorción significativamente mayor en el hipocampo y el cerebelo en los ratones AD. Además, se observó un aumento de la expresión de CSF1R después del tratamiento con LPS y alrededor del 50 % de unión específica de [11C]CPPC en ratones tratados con LPS en relación con los controles simulados. Los estudios de autoradiografía con [3H]CPPC demostraron la falta de especificidad de [3H]CPPC en los tejidos cerebrales de ratas Sprague-Dawley tratadas con LPS (Knight et al., 2021). En otro estudio, el rendimiento de las imágenes de [11C]CPPC se comparó con el de [11C]GW2580 en modelos de ratón de neuroinflamación aguda y crónica y un mono rhesus (Zhou X. et al., 2021). En WT vs. Los ratones APP-KI, [11C]GW2580 demostraron una mayor sensibilidad que [11C]CPPC, demostrado por un mayor aumento en la absorción de [11C]GW2580 en el neocorteza, el cerebro anterior y el estriado de los ratones APP-KI en comparación con el de WT según las mediciones de SUVR a 60-90 min. Los estudios de bloqueo en el mono mostraron una mayor especificidad para [11C]GW2580 sobre [11C]CPPC.
TREM2 es un biomarcador relativamente nuevo para la activación microglial. Los andamios de anticuerpos biespecíficos que se unen a la transferrina para entrar en el cerebro y a TREM2 se conjugaron químicamente y radiomarcaron con radioisótopos de vida relativamente más larga. Un ejemplo es el 124I-mAb1729-scFv8D3CL, que se evaluó en ratones AD transgénicos Arc-Swe (Meier et al., 2021). Mientras que las áreas bajo la curva (AUC) para 124I-mAb1729-scFv8D3CL a las 24-72 h después de la inyección fueron más altas en el caudado, la corteza, el tálamo y el hipocampo de los ratones AD en comparación con los ratones de control, no se observaron diferencias significativas en los SUV para los puntos de tiempo Sin embargo, los estudios de unión ex vivo a través de la autorradiografía con el trazador de radio mostraron diferencias significativas entre los modelos animales. La falta de una diferencia significativa in vivo se atribuyó entonces al aumento del tiempo de residencia en sangre de 124I-mAb1729-scFv8D3CL. Por lo tanto, es deseable el radiomarcado de fragmentos de anticuerpos más pequeños para abordar el problema farmacocinético lento.
Otro nuevo biomarcador para la EA es el receptor de canal iónico de tipo 7 con ligante P2X purinergico (P2X7R), que participa en el desencadenamiento de partes de los procesos neurodegenerativos de la EA. P2X7R activa la microglia en modelos de EA agudos (Sanz et al., 2009) y aumenta la producción de quimiocinas mediadas por el péptido Aβ en modelos crónicos de EA (Martin et al., 2019). [18F]JNJ-64413739 se evaluó en un modelo de neuroinflamación aguda en ratas. Se encontró que la absorción de [18F]JNJ-64413739 estaba elevada en el sitio tratado con LPS del cerebro de la rata en comparación con el hemisferio contralateral del cerebro tratado con PBS (Berdyyeva et al., 2019). Los biomarcadores de la neuroinflamación, como los niveles más altos de ARNm de P2X7R, TSPO y Aif1, se asociaron con el sitio tratado con LPS. Se reconoció que el tratamiento con LPS como modelo de neuroinflamación se considera extremo y que este nuevo trazador justifica la evaluación en modelos de roedores de EA y otras enfermedades neurodegenerativas. Otros trazadores de PET para P2X7R y otros biomarcadores de neuroinflamación son revisados por Zhou R. et al. (2021). Hasta ahora, el desarrollo de agentes de imagen de neuroinflamación se ha centrado en apuntar a la activación microglial, ignorando en gran medida los otros tipos de células gliales. Sería fundamental poder distinguir la activación microglial protectora en la EA temprana del fenotipo destructivo posterior para guiar el momento adecuado de los tratamientos antiinflamatorios.
Imágenes de PET de receptores NMDA
El glutamato es el principal neurotransmisor excitatorio en el cerebro y actúa sobre los receptores de glutamato ionotrópico (iGluR) y los receptores metabotrópicos de glutamato (mGluR) para regular la plasticidad sináptica. Los iGluR comprenden tres subfamilias: receptores de ácido α Tanto los iGluR como los mGluR están involucrados en fallos sinápticos en la EA (Avila et al., 2017; Foster et al., 2017; Wang y Reddy, 2017; Liu et al., 2019; Srivastava et al., 2020).
Se han desarrollado varios trazadores de imágenes para los receptores de glutamato. Hasta ahora, solo se ha evaluado el radiotracer mGluR5 [18F]FPEB en ratones 5 × FAD (Lee et al., 2019), ratones APP/PS1 (Varlow et al., 2020) y ratones Tg-ArcSwe (Fang et al., 2017), con resultados contradictorios: en comparación con animales de tipo salvajeShimojo et al. (2020) observaron que las señales de radiactividad derivadas del otro trazador mGluR5 (E)-[11C]ABP688 no se alteraron en relación con los controles a los 2 meses de edad en ratones rTg4510, pero luego disminuyeron gradualmente con el envejecimiento en paralelo con la atrofia cerebral progresiva.
Imágenes de PET de objetivos colinérgicos
El déficit en la neurotransmisión colinérgica es una característica fisiopatológica prominente en la EA. La pérdida dramática de neuronas colinérgicas ubicadas en el cerebro anterior basal aumentó los niveles del receptor de acetilcolina nicotínico α7 (α7nAChR) (Ikonomovic et al., 2009;Marutle et al., 2013) y una disminución de los niveles del receptor de acetilcolina muscarínico M Se han desarrollado los siguientes agentes de imagen PET para objetivos colinérgicos: 1) [11C]NS14492 (Ettrup et al., 2011), [11C](R)-MeQAA (Nishiyama et al., 2015), y [18F]ASEM (Gao et al., 2013) para α7 nAChR; Se encontró que la absorción del trazador α7 nAChR [11C](R)-MeQAA aumentó en monos viejos (Nishiyama et al., 2015), y se observó una menor absorción del otro trazador α7nAChR [18F]ASEM en ratas TgF334 en edad avanzada en comparación con rata No se observó ninguna diferencia en la absorción cerebral del trazador de esterasa de acetilcolina [11C]MP4A entre el APP23 y los ratones de tipo salvaje a los 10 y 13 meses de edad (Heneka et al., 2006).
Otros radiotracadores PET para AD
Se ha observado en la EA una expresión alterada del receptor 2 del cannabinoide endógeno (CB2), los receptores histaminargicos, los receptores sigma, los receptores de adenosina (receptores A1A y A2A) y las enzimas (BACE1, la caspasa 3, la catepsina aspartril y TrkB/C Estos proporcionan objetivos adicionales para el desarrollo de radiosadores de PET para imágenes de EA. Los radiotracers CB2 [11C]A-836339 se han probado en el modelo de ratón de neuroinflamación inducida por LPS y el modelo de ratón Appswe/PS1/dE9 (Horti et al., 2010), mientras que [18F]JHU94620 se ha probado en el modelo de ratón de neuroinflamación inducida por LPS Se han probado algunos trazadores dirigidos a la caspasa 3 y la astepsina aspartrílico en ratones modelo AD, y la mayoría de los trazadores se han probado principalmente en seres humanos.
Ha habido un gran interés en la obtención de imágenes de la BHE comprometida en modelos animales de amiloidosis y pacientes con EA, ya que hay evidencia de BHE dañada en las primeras etapas de la EA en pacientes y modelos animales. Las imágenes de PET de transportadores y receptores específicos expresados en el BBB fueron revisadas a fondo recientemente por Ni98.
Conclusión y perspectivas
Los modelos animales de la enfermedad de Alzheimer han desempeñado un papel esencial en el desarrollo de radiotrazadores de PET para obtener imágenes de un conjunto diverso de biomarcadores biológicos y patológicos en la EA (Tabla 4). A su vez, con trazadores de PET bien validados, la obtención de imágenes de PET permite el seguimiento longitudinal de fenotipos patológicos de EA en los mismos animales, aumentando el poder estadístico en los estudios mecanicistas de cambios fenotípicos y funcionales relacionados con la EA y facilitando el desarrollo de nuevas intervenciones a través del monitoreo de los efectos del tratamiento. Actualmente, no existe un modelo animal de AD perfecto que pueda recapitular completamente todas las características de la AD humana. Sin embargo, con el rápido desarrollo de las tecnologías biológicas moleculares y nuestra mejor comprensión de los factores de etiología de la EA humana, imaginamos que la generación de modelos animales más refinados con una proximidad más cercana a la patogénesis de la EA humana profundizará nuestra comprensión de esta devastadora enfermedad degenerativa, promoverá el desarrollo de biomarcadores para el diagnóstico precl
Actualmente, los radiotracadores de PET dirigidos a la placa Aβ, la patología tau, la densidad sináptica y la neuroinflamación se han probado en varios modelos principales de EA para detectar sus fenotipos patológicos relativamente prominentes y consistentes. Para recuperar las características más aproximadas del trazador en humanos, la selección adecuada de los modelos de EA es clave para el éxito del desarrollo del trazador, ya que las características neuropatológicas varían en función de los diferentes modelos animales de EA. La selección de un modelo de EA adecuado también es fundamental para los estudios longitudinales y mecanicistas de los tratamientos de EA y antiamiloide (Manook et al., 2012; Snellman et al., 2013, 2017). Un punto importante a tener en cuenta es que al elegir animales de EA para las imágenes PET, se debe presentar la correlación con las medidas de comportamiento, no solo las patologías de la EA, y el marco de tiempo para las imágenes también debe coincidir con los de la aparición de los fenotipos biológicos y las alteraciones conductuales relacionadas.
La principal ventaja de usar modelos de ratas de patologías de EA es su tamaño cerebral relativamente grande, que reduce los efectos de volumen parcial en el análisis cuantitativo de imágenes de PET (Toyonaga et al., 2022). Las ratas son más fáciles de manejar que las ratas, están menos estresadas por los humanos y producen resultados de pruebas de comportamiento más sólidos (Long y Holtzman, 2019). Además, las ratas APP/PS1 desarrollan patología tau en el cerebro, mientras que los ratones APP/PS1 con el mismo promotor carecen de patología tau, lo que indica que el transgen APP/PS1 en ratas produce una neuropatología más cercana a la de los humanos que en ratones (Pini et al., 2016).
La traducción y las imágenes clínicas de Aβ, tau y FDG de PET han transformado nuestra comprensión de la EA (Scheltens et al., 2021), han generado nuevos conocimientos (Aschenbrenner et al., 2018) y han abierto una vía para la detección temprana de la EA (Frisoni et al., 2017). Con el desarrollo de nuevos trazadores de imágenes de PET, esperamos obtener una comprensión más profunda de la EA a nivel sistémico y, con suerte, descubrir y validar nuevos objetivos de tratamiento más allá de Aβ y tau.
Contribuciones del autor
BC, ZC, YH y BM-N contribuyeron a la concepción y el diseño de la revisión. BC escribió el primer borrador del manuscrito. BC, BM-N y ZC escribieron secciones del manuscrito. ZC, BC e YH revisaron el manuscrito y aprobaron la versión final. BC, EB, TT y JT prepararon la figura y la tabla. Todos los autores contribuyeron a la revisión del manuscrito, leyeron y aprobaron la versión presentada.
Financiación
ZC recibió el apoyo de subvenciones de los Institutos Nacionales de Salud (NIH) R01AG058773, R01AG069921 y la Fundación Archer.
Descargo de responsabilidad del autor
Los contenidos son responsabilidad exclusiva de los autores y no representan necesariamente la opinión oficial de las agencias de financiación.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
Abey, A., Davies, D., Goldsbury, C., Buckland, M., Valenzuela, M. y Duncan, T. (2021). La distribución de la hiperfosforilación tau en la demencia canina se asemeja a la enfermedad de Alzheimer temprana y otras tauopatías. Patología cerebral. 31, 144-162. doi: 10.1111/bpa.12893
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Agca, C., Fritz, J. J., Walker, L. C., Levey, A. I., Chan, A. W., Lah, J. J., et al. (2008). Desarrollo de ratas transgénicas que producen proteína precursora de beta-amiloide humano como modelo para la enfermedad de Alzheimer: los genes transgénicos y APP endógenos están regulados específicamente por el tejido. BMC Neurosci. 9:28. doi: 10.1186/1471-2202-9-28
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Allen, B., Ingram, E., Takao, M., Smith, M. J., Jakes, R., Virdee, K., et al. (2002). Abundantes filamentos tau y neurodegeneración no apoptótica en ratones transgénicos que expresan proteína tau P301S humana. J. Neurosci. 22, 9340–9351. doi: 10.1523/JNEUROSCI.22-21-09340.2002
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Alzghool, O. M., Rokka, J., López-Picón, F. R., Snellman, A., Helin, J. S., Okamura, N., et al. (2021). (S)-[18F]THK5117 la absorción cerebral está asociada con placas Aβ y la enzima MAO-B en un modelo de ratón de la enfermedad de Alzheimer. Neurofarmacología 196:108676. doi: 10.1016/j.neuropharm.2021.108676
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Asociación de Alzheimer (2021). Datos y cifras de la enfermedad de Alzheimer de 2021. Demencia de Alzheimer. 17, 327-406. doi: 10.1002/alz.12328
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Andorfer, C., Kress, Y., Espinoza, M., de Silva, R., Tucker, K. L., Barde, Y. A., et al. (2003). Hiperfosforilación y agregación de tau en ratones que expresan isoformas de tau humanas normales. J. Neuroquímica. 86, 582-590. doi: 10.1046/j.1471-4159.2003.01879.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Arnsten, A. F. T., Datta, D., Del Tredici, K. y Braak, H. (2021a). Hipótesis: la patología tau es un factor iniciador de la enfermedad de Alzheimer esporádica. Demencia de Alzheimer. 17, 115-124. doi: 10.1002/alz.12192
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Arnsten, A. F. T., Datta, D. y Preuss, T. M. (2021b). Los estudios de primates no humanos que envejecen iluminan la etiología de la neuropatología similar al Alzheimer en estadio temprano: una perspectiva evolutiva. Am. J. Primatol. 83:e23254. doi: 10.1002/ajp.23254
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Aschenbrenner, A. J., Gordon, B. A., Benzinger, T. L. S., Morris, J. C., y Hassenstab, J. J. (2018). Influencia de la PET tau, PET amiloide y el volumen del hipocampo en la cognición en la enfermedad de Alzheimer. Neurología 91, e859-e866. doi: 10.1212/WNL.0000000000006075
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Avila, J., Llorens-Martin, M., Pallas-Bazarra, N., Bolos, M., Perea, J. R., Rodríguez-Matellan, A., y otros. (2017). Disminución cognitiva en el envejecimiento neuronal y la enfermedad de Alzheimer: papel de los receptores NMDA y las proteínas asociadas. Frente. Neurosci. 11:626. doi: 10.3389/fnins.2017.00626
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Bacskai, B. J., Hickey, G. A., Skoch, J., Kajdasz, S. T., Wang, Y., Huang, G. F., et al. (2003). Imágenes multifotones multidimensionales de entrada cerebral, unión amiloide y aclaramiento de un ligando beta amiloide en ratones transgénicos. Proc. Natl. Acad. Sci. EE. UU. 100, 12462–12467. doi: 10.1073/pnas.2034101100
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Bahri, M. A., Plenevaux, A., Aerts, J., Bastin, C., Becker, G., Mercier, J., et al. (2017). Medición de la proteína 2A de la vesícula sináptica cerebral con tomografía de emisión de positrones y [(18)F]UCB-H. Demencia de Alzheimer. 3, 481-486. doi: 10.1016/j.trci.2017.08.004
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Baker, S., y Gotz, J. (2016). Un insulto local del ácido okadaico en ratones de tipo salvaje induce la fosforilación tau y la agregación de proteínas en regiones cerebrales anatómicamente distintas.Acta Neuropathol. Commun. 4:32. doi: 10.1186/s40478-016-0300-0
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Baker, S. L., Provost, K., Thomas, W., Whitman, A. J., Janabi, M., Schmidt, M. E., et al. (2021). Evaluación del trazador de PET tau [18F]-JNJ-64326067-AAA en humanos. J. Cereb. Metab de flujo sanguíneo. 41, 3302–3313. doi: 10.1177/0271678X211031035
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Bao, W., Xie, F., Zuo, C., Guan, Y. y Huang, Y. H. P. E. T. (2021). Neuroimagen de la enfermedad de Alzheimer: radiotracadores y su utilidad en la investigación clínica. Frente. Neurociencias de envejecimiento. 13:624330. doi: 10.3389/fnagi.2021.624330
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Becker, G., Warnier, C., Serrano, M. E., Bahri, M. A., Mercier, J., Lemaire, C., et al. (2017). Caracterización farmacocinética de [(18)F]UCB-H PET radiofarmacéutico en el cerebro de rata. Mol. Pharm. 14, 2719-2725. doi: 10.1021/acs.molpharmaceut.7b00235
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Beckman, D., Chakrabarty, P., Ott, S., Dao, A., Zhou, E., Janssen, W. G., et al. (2021). Un novedoso modelo de mono rhesus basado en tau de la patogénesis del Alzheimer. Demencia de Alzheimer.17, 933-945. doi: 10.1002/alz.12318
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Benedikz, E., Kloskowska, E. y Winblad, B. (2009). La rata como modelo animal de la enfermedad de Alzheimer. J. Célula Mol. Med. 13, 1043-1042.
Berdyyeva, T., Xia, C., Taylor, N., He, Y., Chen, G., Huang, C., et al. (2019). Imágenes PET del canal de iones P2X7 con un trazador novedoso. Mol. Imágenes Biol. 21, 871-878. doi: 10.1007/s11307-018-01313-2
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Beyer, L. y Brendel, M. (2021). Imágenes de la patología tau en enfermedades neurodegenerativas: una actualización. Semin. Nucl. Med. 51, 253-263. doi: 10.1053/j.semnuclmed.2020.12.004
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Biancalana, M., y Koide, S. (2010). Mecanismo molecular de la unión de la tioflavina-T a las fibrillas amiloides. Biochim. Biophys. Acta 1804, 1405–1412. doi: 10.1016/j.bbapap.2010.04.001
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Bolmont, T., Clavaguera, F., Meyer-Luehmann, M., Herzig, M. C., Radde, R., Staufenbiel, M., et al. (2007). Inducción de la patología tau por infusión intracerebral de extracto cerebral que contiene amiloide beta y por deposición de amiloide beta en ratones transgénicos APP x Tau. Am. J. Pathol.171, 2012-2020. doi: 10.2353/ajpath.2007.070403
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Bour, A., Grootendorst, J., Vogel, E., Kelche, C., Dodart, J. C., Bales, K., et al. (2008). Los ratones humanos de reemplazo de apoE4 humano de mediana edad muestran déficits de retención en una amplia gama de tareas de memoria espacial. Behav. Respuesta cerebral. 193, 174-182. doi: 10.1016/j.bbr.2008.05.008
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Bouter, C. y Bouter, Y. (2019). (18)F-FDG-PET en modelos de ratón de la enfermedad de Alzheimer.Frente. Med. 6:71. doi: 10.3389/fmed.2019.00071
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Bouter, C., Henniges, P., Franke, T. N., Irwin, C., Sahlmann, C. O., Sichler, M. E., et al. (2018). (18)F-FDG-PET detecta cambios drásticos en el metabolismo cerebral en el modelo Tg4-42 de la enfermedad de Alzheimer. Frente. Neurociencias de envejecimiento. 10:425. doi: 10.3389/fnagi.2018.00425
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Braak, H., Braak, E. y Strothjohann, M. (1994). Proteína tau anormalmente fosforilada relacionada con la formación de enredos neurofibrilares e hilos neuropil en la corteza cerebral de ovejas y cabras. Neurosci. Lett. 171, 1–4. doi: 10.1016/0304-3940(94)90589-4
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Brendel, M., Jaworska, A., Probst, F., Overhoff, F., Korzhova, V., Lindner, S., et al. (2016). Imágenes de PET de animales pequeños de patología tau con 18F-THK5117 en 2 modelos de ratón transgénico.J. Nucl. Med. 57, 792-798. doi: 10.2967/jnumed.115.163493
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Brendel, M., Yousefi, B. H., Blume, T., Herz, M., Focke, C., Deussing, M., et al. (2018). Comparación de (18)F-T807 y (18)F-THK5117 PET en un modelo de ratón de patología tau. Frente. Neurociencias de envejecimiento. 10:174. doi: 10.3389/fnagi.2018.00174
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Cai, H., Wang, Y., McCarthy, D., Wen, H., Borchelt, D. R., Precio, D. L., et al. (2001). BACE1 es la principal betasecretasa para la generación de péptidos Abeta por las neuronas. Nat. Neurosci. 4, 233-234. doi: 10.1038/85064
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Cai, H. C., Mangner, T., Muzik, O. y Chugani, H. (2014). Radiosíntesis y evaluación preliminar de 11C-levetiracetam para imágenes PET de la expresión de SV2A. J. Nucl. Med. 55, 1152–1155. doi: 10.1021/ml500285t
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Cai, Z., Li, S., Matuskey, D., Nabulsi, N. y Huang, Y. (2019). Imágenes PET de densidad sináptica: una nueva herramienta para la investigación de enfermedades neuropsiquiátricas. Neurosci. Lett. 691, 44,50. doi: 10.1016/j.neulet.2018.07.038
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Chambers, J. K., Tokuda, T., Uchida, K., Ishii, R., Tatebe, H., Takahashi, E., et al. (2015). El gato doméstico como modelo animal natural de la enfermedad de Alzheimer. Acta Neuropathol. Commun. 3:78. doi: 10.1186/s40478-015-0258-3
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Chaney, A. M., López-Picon, F. R., Serriere, S., Wang, R., Bochicchio, D., Webb, S. D., et al. (2021). Disfunción neuroinflamatoria, colinérgica y de metabolitos prodromal detectada por PET y MRS en el modelo de rata transgénica TgF344-AD de EA: un estudio multimodal colaborativo. Teranosticos 11, 6644–6667. doi: 10.7150/thno.56059
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Charreau, B., Tesson, L., Soulillou, J. P., Pourcel, C. y Anegon, I. (1996). Transgénesis en ratas: aspectos técnicos y modelos. Transgen. Res. 5, 223-234. doi: 10.1007/BF01972876
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Chiaravalloti, A., Castellano, A. E., Ricci, M., Barbagallo, G., Sannino, P., Ursini, F., et al. (2018). Las imágenes acopladas con [18F]FBB y [18F]FDG en sujetos de EA muestran una asociación selectiva entre la carga amiloide y la disfunción cortical en el cerebro. Mol. Imágenes Biol. 20, 659-666. doi: 10.1007/s11307-018-1167-1
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Chiotis, K., Stenkrona, P., Almkvist, O., Stepanov, V., Ferreira, D., Arakawa, R., et al. (2018). Las imágenes de PET tau de doble trazo revelan diferentes objetivos moleculares para 11C-THK5351 y 11C-PBB3 en el cerebro de Alzheimer. Eur. J. Nucl. Med. Mol. Imágenes 45, 1605–1617. doi: 10.1007/s00259-018-4012-5
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Choi, D. Y., Lee, J. W., Lin, G., Lee, Y. K., Lee, Y. H., Choi, I. S., et al. (2012). Obovatol atenúa los deterioros de la memoria inducidos por LPS en ratones a través de la inhibición de la vía de señalización NF-kappaB. Neuroquímica. Int. 60, 68-77. doi: 10.1016/j.neuint.2011.11.005
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Chotipanich, C., Nivorn, M., Kunawudhi, A., Promteangtrong, C., Boonkawin, N., y Jantarato, A. (2020). Evaluación de ventanas de imágenes para imágenes de Tau PET utilizando 18F-PI2620 en individuos cognitivamente normales, deterioro cognitivo leve y pacientes con enfermedad de Alzheimer. Mol. Imágenes 19:1536012120947582. doi: 10.1177/1536012120947582
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Clavaguera, F., Bolmont, T., Crowther, R. A., Abramowski, D., Frank, S., Probst, A., et al. (2009). Transmisión y propagación de la tauopatía en el cerebro transgénico del ratón. Nat. Biol celular. 11, 909–913. doi: 10.1038/ncb1901
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Clavaguera, F., Hench, J., Lavenir, I., Schweighauser, G., Frank, S., Goedert, M., et al. (2014). La administración periférica de agregados tau desencadena la tauopatía intracerebral en ratones transgénicos. Acta Neuropathol. 127, 299-301. doi: 10.1007/s00401-013-1231-5
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Cohen, A. D., y Klunk, W. E. (2014). Detección temprana de la enfermedad de Alzheimer con PiB y FDG PET.Neurobiol. Dis. 72 (Pt A), 117-122. doi: 10.1016/j.nbd.2014.05.001
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Cohen, R. M., Rezai-Zadeh, K., Weitz, T. M., Rentsendorj, A., Gate, D., Spivak, I., et al. (2013). Una rata transgénica de Alzheimer con placas, patología tau, deterioro del comportamiento, aβ oligomérico y pérdida neuronal franca. J. Neurosci. 33, 6245-6256. doi: 10.1523/JNEUROSCI.3672-12.2013
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Coleman, R. A., Liang, C., Patel, R., Ali, S. y Mukherjee, J. (2017). Metabolismo del tejido adiposo cerebral y marrón en modelos transgénicos de ratones Tg2576 de la enfermedad de Alzheimer evaluados utilizando (18) imágenes PET F-FDG. Mol. Imágenes 16:1536012117704557. doi: 10.1177/1536012117704557
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Condello, C., Lemmin, T., Stohr, J., Nick, M., Wu, Y., Maxwell, A. M., et al. (2018). Heterogeneidad estructural y variabilidad intersujeto de Abeta en la enfermedad de Alzheimer familiar y esporádica.Proc. Natl. Acad. Sci. EE. UU. 115, E782–E791. doi: 10.1073/pnas.1714966115
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Constantinescu, C. C., Tresse, C., Zheng, M., Gouasmat, A., Carroll, V. M., Mistico, L., et al. (2019). Desarrollo e imágenes preclínicas in vivo de trazadores PET de proteína de vesícula sináptica 2A (SV2A) marcadas con flúor-18. Mol. Imágenes Biol. 21, 509-518. doi: 10.1007/s11307-018-1260-5
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Das, B., y Yan, R. (2017). Papel del BACE1 en la función sináptica del Alzheimer. Transl. Neurodegener. 6:23. doi: 10.1186/s40035-017-0093-5
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Datta, D., Leslie, S. N., Wang, M., Morozov, Y. M., Yang, S., Mentone, S., et al. (2021). Desregulación del calcio relacionada con la edad relacionada con la patología de la tau y el deterioro cognitivo en primates no humanos. Alzheimer. 17, 920-932. doi: 10.1002/alz.12325
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Dawson, H. N., Ferreira, A., Eyster, M. V., Ghoshal, N., Binder, L. Yo y Vitek, M. P. (2001). Inhibición de la maduración neuronal en las neuronas primarias del hipocampo de ratones con deficiencia de tau.J. Ciencia Celular. 114(Pt 6), 1179–1187. doi: 10.1242/jcs.114.6.1179
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Declercq, L., Celen, S., Lecina, J., Ahamed, M., Tousseyn, T., Moechars, D., et al. (2016). Comparación de nuevos candidatos de Tau PET-Tracer con [18F]T808 y [18F]T807. Mol. Imágenes 15:1536012115624920. doi: 10.1177/1536012115624920
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Deleye, S., Waldron, A. M., Richardson, J. C., Schmidt, M., Langlois, X., Stroobants, S., et al. (2016). Los efectos de los determinantes fisiológicos y metodológicos en las imágenes cerebrales de ratón 18F-FDG ejemplificados en un modelo de doble transgénico de alzheimer. Mol. Imágenes 15:1536012115624919. doi: 10.1177/1536012115624919
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Deleye, S., Waldron, A. M., Verhaeghe, J., Bottelbergs, A., Wyffels, L., Van Broeck, B., et al. (2017). Evaluación de las medidas de resultado de PET de animales pequeños para detectar la modificación de la enfermedad inducida por la inhibición del BACE en un modelo transgénico de ratón de la enfermedad de Alzheimer. J. Nucl. Med. 58, 1977-1983. doi: 10.2967/jnumed.116.187625
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
DeTure, M. A., y Dickson, D. W. (2019). El diagnóstico neuropatológico de la enfermedad de Alzheimer.Mol. Neurodegener. 14:32.
Duff, K., Knight, H., Refolo, L. M., Sanders, S., Yu, X., Picciano, M., et al. (2000). Caracterización de la patología en ratones transgénicos que sobreexpresan sobre los transgenes genómicos humanos y de ADNc tau. Neurobiol. Dis. 7, 87-98. doi: 10.1006/nbdi.1999.0279
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Dumanis, S. B., DiBattista, A. M., Miessau, M., Moussa, C. E., y Rebeck, G. W. (2013). El genotipo APOE afecta al compartimento presináptico de las terminales nerviosas glutamatérgicas. J. Neuroquímica.124, 4-14. doi: 10.1111/j.1471-4159.2012.07908.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Duyckaerts, C., Potier, M. C. y Delatour, B. (2008). Modelos de la enfermedad de Alzheimer y neuropatología humana: similitudes y diferencias. Acta Neuropathol. 115, 5–38. doi: 10.1007/s00401-007-0312-8
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Echeverria, V., Ducatenzeiler, A., Alhonen, L., Janne, J., Grant, S. M., Wandosell, F., et al. (2004a). Modelos transgénicos de ratas con un fenotipo de acumulación de Abeta intracelular en el hipocampo y la corteza. J. Alzheimer Dis. 6, 209-219. doi: 10.3233/jad-2004-6301
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Echeverria, V., Ducatenzeiler, A., Dowd, E., Janne, J., Grant, S. M., Szyf, M., et al. (2004b). Señalización alterada de la proteína quinasa activada por mitógeno, hiperfosforilación tau y disfunción leve del aprendizaje espacial en ratas transgénicas que expresan el péptido beta-amiloide intracelularmente en las neuronas hipocampo y corticales. Neurociencia 129, 583-592. doi: 10.1016/j.neuroscience.2004.07.036
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Ellenbroek, B., y Youn, J. (2016). Modelos de roedores en la investigación neurociencia: ¿es una carrera de ratas? Dis. Modelo. Mech. 9, 1097-1087. doi: 10.1242/dmm.026120
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Estrada, S., Lubberink, M., Thibblin, A., Sprycha, M., Buchanan, T., Mestdagh, N., et al. (2016). [(11)C]UCB-A, un nuevo trazador de PET para la proteína de vesícula sináptica 2A. Nucl. Med. Biol.43, 325-332. doi: 10.1016/j.nucmedbio.2016.03.004
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Ettrup, A., Mikkelsen, J. D., Lehel, S., Madsen, J., Nielsen, E. O., Palner, M., et al. (2011). 11C-NS14492 como un nuevo radioligando PET para imágenes de receptores de acetilcolina nicotínicos alfa7 cerebrales: evaluación in vivo y mediciones de ocupación de medicamentos. J. Nucl. Med. 52, 1449–1456. doi: 10.2967/jnumed.111.088815
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Fan, Z., Calsolaro, V., Atkinson, R. A., Femminella, G. D., Waldman, A., Buckley, C., et al. (2016). PET de flutriciclamida (18F-GE180): primer estudio de PET en humanos del nuevo marcador in vivo de tercera generación de proteína de translocalización humana. J. Nucl. Med. 57, 1753-1759. doi: 10.2967/jnumed.115.169078
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Fang, X. T., Eriksson, J., Antoni, G., Yngve, U., Cato, L., Lannfelt, L., et al. (2017). Cerebro mGluR5 en ratones con patología beta amiloide estudiados con imágenes in vivo [(11)C]ABP688 PET e inmunobloqueo ex vivo. Neurofarmacología 113 (Pt A), 293-300. doi: 10.1016/j.neuropharm.2016.10.009
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Fang, X. T., Hultqvist, G., Meier, S. R., Antoni, G., Sehlin, D. y Syvanen, S. (2019). Alta sensibilidad de detección con radioligando PET a base de anticuerpos para beta amiloide en el cerebro.Neuroimagen 184, 881-888. doi: 10.1016/j.neuroimage.2018.10.011
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Ferreira-Vieira, T. H., Guimaraes, I. M., Silva, F. R., y Ribeiro, F. M. (2016). Enfermedad de Alzheimer: dirigida al sistema colinérgico. Curr. Neurofarmaco. 14, 101-115.
Filipcik, P., Zilka, N., Bugos, O., Kucerak, J., Koson, P., Novak, P., et al. (2012). Primer modelo de rata transgénica que desarrolla enredos neurofibrilares corticales progresivos. Neurobiol. Envejecimiento 33, 1448–1456. doi: 10.1016/j.neurobiolaging.2010.10.015
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Finnema, S. J., Nabulsi, N. B., Eid, T., Detyniecki, K., Lin, S. F., Chen, M. K., et al. (2016). Imagen de la densidad sináptica en el cerebro humano vivo. Sci. Transl. Med. 8:348ra96. doi: 10.1126/scitranslmed.aaf6667
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Fiock, K. L., Smith, J. D., Crary, J. F., y Hefti, M. M. (2020). patología beta-amiloide y tau en el cerebro felino envejecido. J. Comp. Neurol. 528, 108-113. doi: 10.1002/cne.24741
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Inundación, D. G., Lin, Y. G., Lang, D. M., Trusko, S. P., Hirsch, J. D., Savage, M. J., et al. (2009). Un modelo transgénico de rata de Alzheimer con deposición de Abeta extracelular. Neurobiol. Envejecimiento 30, 1078-1090. doi: 10.1016/j.neurobiolaging.2007.10.006
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Fodero-Tavoletti, M. T., Brockschnieder, D., Villemagne, V. L., Martin, L., Connor, A. R., Thiele, A., et al. (2012). Caracterización in vitro de [18F]-florbetabeno, un radiotracer de imágenes Abeta. Nucl. Med. Biol. 39, 1024-1048. doi: 10.1016/j.nucmedbio.2012.03.001
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Fodero-Tavoletti, M. T., Okamura, N., Furumoto, S., Mulligan, R. S., Connor, A. R., McLean, C. A., et al. (2011). 18F-THK523: un novedoso ligando de imágenes tau in vivo para la enfermedad de Alzheimer. Cerebro 134 (Pt 4), 1098-1100. doi: 10.1093/cerebro/awr038
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Foster, T. C., Kyritsopoulos, C. y Kumar, A. (2017). Papel central de los receptores NMDA en el deterioro redox mediado de la función sináptica durante el envejecimiento y la enfermedad de Alzheimer. Behav. Respuesta cerebral. 322(Pt B), 223-232. doi: 10.1016/j.bbr.2016.05.012
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Frisoni, G. B., Boccardi, M., Barkhof, F., Blennow, K., Cappa, S., Chiotis, K., et al. (2017). Hoja de ruta estratégica para un diagnóstico precoz de la enfermedad de Alzheimer basado en biomarcadores.Lancet Neurol. 16, 661-676. doi: 10.1016/S1474-4422(17)30159-X
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Games, D., Adams, D., Alessandrini, R., Barbour, R., Berthelette, P., Blackwell, C., et al. (1995). Neuropatología de tipo Alzheimer en ratones transgénicos que sobreexpresan la proteína precursora de beta-amiloide V717F. Naturaleza 373, 523-527. doi: 10.1038/373523a0
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Gao, Y., Kellar, K. J., Yasuda, R. P., Tran, T., Xiao, Y., Dannals, R. F., et al. (2013). Derivados del dibenzotiofeno para imágenes tomografías de emisión de positrones de receptores de acetilcolina alfa7-nicotinico. J. Med. Química. 56, 7574-7589. doi: 10.1021/jm401184f
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Götz, J., Bodea, L. G. y Goedert, M. (2018). Modelos de roedores para la enfermedad de Alzheimer.Nat. Rev. Neurosci. 19, 583-598. doi: 10.1038/s41583-018-0054-8
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Gotz, J., Chen, F., van Dorpe, J. y Nitsch, R. M. (2001). Formación de enredos neurofibrilares en ratones transgénicos tau P301l inducidos por fibrillas Abeta 42. Ciencia 293, 1491–1495. doi: 10.1126/science.1062097
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Gotz, J., Probst, A., Spillantini, M. G., Schafer, T., Jakes, R., Burki, K., et al. (1995). Localización somatodendrítica e hiperfosforilación de la proteína tau en ratones transgénicos que expresan el isoforme tau del cerebro humano más largo. EMBO J. 14, 1304–1313. doi: 10.1002/j.1460-2075.1995.tb07116.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Grueninger, F., Bohrmann, B., Checo, C., Ballard, T. M., Frey, J. R., Weidensteiner, C., et al. (2010). La fosforilación de Tau en S422 se ve reforzada por Abeta en ratones transgénicos triples TauPS2APP. Neurobiol. Dis. 37, 294-306. doi: 10.1016/j.nbd.2009.09.004
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Guehl, N. J., Wooten, D. W., Yokell, D. L., Moon, S. H., Dhaynaut, M., Katz, S., et al. (2019). Evaluación de estrategias de modelado farmacocinético para la cuantificación in vivo de tau con el radiotrazador [18F]MK6240 en seres humanos. Eur. J. Nucl. Med. Mol. Imágenes 46, 2099–2111. doi: 10.1007/s00259-019-04419-z
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Haas, L. T., Salazar, S. V., Smith, L. M., Zhao, H. R., Cox, T. O., Herber, C. S., et al. (2017). La modulación alostérica silenciosa de mGluR5 mantiene la señalización de glutamato mientras rescata los fenotipos de ratón de Alzheimer. Representante de la celda. 20, 76-88. doi: 10.1016/j.celrep.2017.06.023
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Halliday, G. (2017). Patología y atrofia del hipocampo en la enfermedad de Alzheimer. Lancet Neurol. 16, 862–864. doi: 10.1016/S1474-4422(17)30343-5
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Haque, A., Banik, N. L., y Ray, S. K. (2008). Nuevas ideas sobre el papel de las catepsinas endolisómicas en la patogénesis de la enfermedad de Alzheimer: inhibidores de la cathepsina como potencial terapéutico.CNS Neurol. Desactivación. Objetivos de medicamentos 7, 270-277. doi: 10.2174/187152708784936653
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Haque, R. U. y Levey, A. I. (2019). Enfermedad de Alzheimer: una perspectiva clínica y futuras oportunidades de investigación de primates no humanos. Proc. Natl. Acad. Sci. EE. UU. 116, 26224-26229. doi: 10.1073/pnas.1912954116
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Harada, A., Oguchi, K., Okabe, S., Kuno, J., Terada, S., Ohshima, T., et al. (1994). Alteración de la organización de los microtúbulos en los axones de pequeño calibre de ratones que carecen de proteína tau. Naturaleza 369, 488-491. doi: 10.1038/369488a0
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Él, Z., Guo, J. L., McBride, J. D., Narasimhan, S., Kim, H., Changolkar, L., et al. (2018). Las placas beta amiloides mejoran las patologías con semillas tau del cerebro de Alzheimer al facilitar la agregación de la placa tau neurítica. Nat. Med. 24, 29-38. doi: 10.1038/nm.4443
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Heneka, M. T., Carson, M. J., El Khoury, J., Landreth, G. E., Brosseron, F., Feinstein, D. L., et al. (2015). Neuroinflamación en la enfermedad de Alzheimer. Lancet Neurol. 14, 388-405.
Heneka, M. T., Ramanathan, M., Jacobs, A. H., Dumitrescu-Ozimek, L., Bilkei-Gorzo, A., Debeir, T., et al. (2006). La degeneración de Locus ceruleus promueve la patogénesis del Alzheimer en ratones transgénicos de proteína precursora amiloide 23. J. Neurosci. 26, 1343–1354. doi: 10.1523/JNEUROSCI.4236-05.2006
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Herreman, A., Hartmann, D., Annaert, W., Saftig, P., Craessaerts, K., Serneels, L., et al. (1999). La deficiencia de prenilina 2 causa un fenotipo pulmonar leve y no cambios en el procesamiento de la proteína precursora amiloide, pero mejora el fenotipo letal embrionario de la deficiencia de presenilina 1. Proc. Natl. Acad. Sci. EE. UU. 96, 11872–11877. doi: 10.1073/pnas.96.21.11872
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Hoffe, B., y Holahan, M. R. (2019). El uso de cerdos como modelo traslacional para estudiar enfermedades neurodegenerativas. Frente. Physiol. 10:838. doi: 10.3389/fphys.2019.00838
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Horti, A. G., Gao, Y., Ravert, H. T., Finley, P., Valentine, H., Wong, D. F., et al. (2010). Síntesis y biodistribución de [11C]A-836339, un nuevo radioligando potencial para imágenes PET de receptores cannabinoides tipo 2 (CB2). Bioorg. Med. Química. 18, 5202–5207. doi: 10.1016/j.bmc.2010.05.058
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Horti, A. G., Gao, Y., Kuwabara, H., Wang, Y., Abazyan, S., Yasuda, R. P., et al. (2014). 18F-ASEM, un antagonista radiomarcado para la obtención de imágenes del receptor de acetilcolina α7-nicotinico con PET. J. Nucl. Med. 55, 672-677. doi: 10.2967/jnumed.113.132068
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Horti, A. G., Naik, R., Foss, C. A., Minn, I., Misheneva, V., Du, Y., et al. (2019). Imágenes PET de microglía apuntando al receptor de factor 1 que estimula la colonia de macrófagos (CSF1R). Proc. Natl. Acad. Sci. EE. UU. 116, 1686–1691. doi: 10.1073/pnas.1812155116
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Hu, W., Pan, D., Wang, Y., Bao, W., Zuo, C., Guan, Y., et al. (2020). Imágenes de PET para el monitoreo dinámico de la neuroinflamación en el uso del modelo de ratón APP/PS1. Frente. Neurosci. 14:810. doi: 10.3389/fnins.2020.00810
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Colgado, A. S., Liang, Y., Chow, T. C., Tang, H. C., Wu, S. L., Wai, M. S., et al. (2016). Taupe mutada, amiloide y neuroinflamación en la enfermedad de Alzheimer: una breve revisión. Prog. Histochem. Citochem. 51, 1–8. doi: 10.1016/j.proghi.2016.01.001
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Ikonomovic, M. D., Wecker, L., Abrahamson, E. E., Wuu, J., Counts, S. E., Ginsberg, S. D., et al. (2009). Receptor de acetilcolina nicotínico alfa7 cortical y niveles de beta-amiloide en la enfermedad de Alzheimer temprana.Arch. Neurol. 66, 646-651. doi: 10.1001/archneurol.2009.46
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Ishikawa, A., Tokunaga, M., Maeda, J., Minamihisamatsu, T., Shimojo, M., Takuwa, H., et al. (2018). Visualización in vivo de la acumulación de tau, activación microglial y atrofia cerebral en un modelo de ratón de tauopatía rTg4510. J. Alzheimer Dis. 61, 1037–1052. doi: 10.3233/JAD-170509
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Jackson, J., Jambrina, E., Li, J., Marston, H., Menzies, F., Phillips, K., et al. (2019). Dirigido a la sinapsis en la enfermedad de Alzheimer. Frente. Neurosci. 13:735. doi: 10.3389/fnins.2019.00735
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Jadhav, V. S., Lin, P. B. C., Pennington, T., Di Prisco, G. V., Jannu, A. J., Xu, G., et al. (2020). La mutación de Trem2 Y38C y la pérdida de Trem2 alteran las sinapsis neuronales en ratones adultos.Mol. Neurodegener. 15:62. doi: 10.1186/s13024-020-00409-0
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Jakobsen, J. E., Johansen, M. G., Schmidt, M., Liu, Y., Li, R., Callesen, H., et al. (2016). Expresión de las mutaciones de la enfermedad de Alzheimer AbetaPP695sw y PSEN1M146I en minicerdos de doble transgénico. J. Alzheimer Dis. 53, 1617–1630. doi: 10.3233/JAD-160408
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Jankowsky, J. L., Fadale, D. J., Anderson, J., Xu, G. M., Gonzales, V., Jenkins, N. A., et al. (2004). Las presenilinas mutantes elevan específicamente los niveles del péptido de beta-amiloide de 42 residuos in vivo: evidencia de aumento de una gamma secretasa específica de 42. Hum. Mol. Genet.13, 159-170. doi: 10.1093/hmg/ddh019
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Jankowsky, J. L., Slunt, H. H., Ratovitski, T., Jenkins, N. A., Copeland, N. G. y Borchelt, D. R. (2001). Coexpresión de múltiples transgenes en el SNC del ratón: una comparación de estrategias. Biomol. Eng. 17, 157-165. doi: 10.1016/s1389-0344(01)00067-3
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Ji, Y., Gong, Y., Gan, W., Beach, T., Holtzman, D. M. y Wisniewski, T. (2003). Regulación isoforma específica de la apolipolipoproteína E de la morfología de la columna dendrítica en ratones transgénicos de la apolipoproteína E y pacientes con enfermedad de Alzheimer. Neurociencia 122, 305-315. doi: 10.1016/j.neuroscience.2003.08.007
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Kang, S. S., Kurti, A., Baker, K. E., Liu, C. C., Colonna, M., Ulrich, J. D., et al. (2018). Análisis conductual y transcriptómico de ratones Trem2-null: no todos los ratones knockout son iguales. Hum. Mol. Genet. 27, 211-223. doi: 10.1093/hmg/ddx366
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Kaufman, A. C., Salazar, S. V., Haas, L. T., Yang, J., Kostylev, M. A., Jeng, A. T., et al. (2015). La inhibición de Fyn rescata la memoria establecida y la pérdida de sinapsis en ratones con Alzheimer.Ann. Neurol. 77, 953-971. doi: 10.1002/ana.24394
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Kim, J., Basak, J. M. y Holtzman, D. M. (2009). El papel de la apolipoproteína E en la enfermedad de Alzheimer. Neuron 63, 287-303.
Kloskowska, E., Pham, T. M., Nilsson, T., Zhu, S., Oberg, J., Codita, A., et al. (2010). Discapacidad cognitiva en el modelo de rata transgénica Tg6590 de la enfermedad de Alzheimer. J. Célula Mol. Med. 14, 1816–1823. doi: 10.1111/j.1582-4934.2009.00809.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Klunk, W. E., Engler, H., Nordberg, A., Wang, Y., Blomqvist, G., Holt, D. P., et al. (2004). Imágenes de amiloide cerebral en la enfermedad de Alzheimer con Pittsburgh Compound-B. Ann. Neurol. 55, 306–319. doi: 10.1002/ana.20009
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Klunk, W. E., Lopresti, B. J., Ikonomovic, M. D., Lefterov, I. M., Koldamova, R. P., Abrahamson, E. E., et al. (2005). La unión del trazador de tomografía por emisión de positrones del compuesto de Pittsburgh-B refleja la cantidad de amiloide beta en el cerebro de la enfermedad de Alzheimer, pero no en el cerebro transgénico del ratón. J. Neurosci. 25, 10598–10606. doi: 10.1523/JNEUROSCI.2990-05.2005
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Caballero, A. C., Varlow, C., Zi, T., Liang, S. H., Josephson, L., Schmidt, K., et al. (2021). Evaluación in vitro de [3 H]CPPC como una herramienta de radioligando para CSF-1R. ACS Chem. Neurosci. 12, 998–1006. doi: 10.1021/acschemneuro.0c00802
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Kotredes, K. P., Oblak, A., Pandey, R. S., Lin, P. B., Garceau, D., Williams, H., et al. (2021). Descubriendo los mecanismos de la enfermedad en un nuevo modelo de ratón que expresa APOEepsilon4 y Trem2*R47H humanizados. Frente. Neurociencias de envejecimiento. 13:735524. doi: 10.3389/fnagi.2021.735524
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Koutseff, A., Mittelhaeuser, C., Essabri, K., Auwerx, J. y Meziane, H. (2014). Impacto del polimorfismo de la apolipoproteína E, la edad y el sexo en la neurogénesis en ratones: ¿referencia fisiopatológica para la enfermedad de Alzheimer? Respuesta cerebral. 1542, 32-40. doi: 10.1016/j.brainres.2013.10.003
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Kragh, P. M., Nielsen, A. L., Li, J., Du, Y., Lin, L., Schmidt, M., et al. (2009). Los minicerdos hemicigotos producidos por inserción de genes aleatorias y clonación hecha a mano expresan la mutación dominante que causa la enfermedad de Alzheimer APPsw. Res transgénica. 18, 545-558. doi: 10.1007/s11248-009-9245-4
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Kuntner, C., Kesner, A. L., Bauer, M., Kremslehner, R., Wanek, T., Mandler, M., et al. (2009). Limitaciones de las imágenes de PET de animales pequeños con [18F]FDDNP y FDG para estudios cuantitativos en un modelo transgénico de ratón de la enfermedad de Alzheimer. Mol. Imágenes Biol. 11, 236-240. doi: 10.1007/s11307-009-0198-z
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Laforce, R. Jr., Soucy, J. P., Sellami, L., Dallaire-Théroux, C., Brunet, F., Bergeron, D., et al. (2018). Imágenes moleculares en la demencia: pasado, presente y futuro. Demencia de Alzheimer. 14, 1522-1552. doi: 10.1016/j.jalz.2018.06.2855
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Lee, M., Lee, H. J., Jeong, Y. J., Oh, S. J., Kang, K. J., Han, S. J., et al. (2019). Dependencia por edad de la disponibilidad de mGluR5 en ratones 5xFAD medidos por PET. Neurobiol. Envejecimiento 84, 208-216. doi: 10.1016/j.neurobiolaging.2019.08.006
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
León, W. C., Canneva, F., Partridge, V., Allard, S., Ferretti, M. T., DeWilde, A., et al. (2010). Un nuevo modelo de rata transgénica con una patología amiloide similar a la del Alzheimer muestra un deterioro cognitivo asociado al amiloide beta-intracelular pre-placa. J. Alzheimer Dis. 20, 113-126. doi: 10.3233/JAD-2010-1349
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Leslie, S. N., Kanyo, J., Datta, D., Wilson, R. S., Zeiss, C., Duque, A., et al. (2021). El análisis fosfoproteómico simple y de un solo disparo de tau estable al calor identifica los cambios relacionados con la edad en los niveles de pS235 y pS396-tau en primates no humanos. Frente. Neurociencias de envejecimiento. 13:767322. doi: 10.3389/fnagi.2021.767322
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Leuzy, A., Chiotis, K., Lemoine, L., Gillberg, P. G., Almkvist, O., Rodriguez-Vieitez, E., et al. (2019). Las imágenes de Tau PET en tauopatías neurodegenerativas son todavía un desafío. Mol. Psiquiatría 24, 112-1334. doi: 10.1038/s41380-018-0342-8
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Lewandowski, C. T., Weng, J. M. y LaDu, M. J. (2020). Patología de la enfermedad de Alzheimer en los modelos de ratones transgénicos APOE: quién, qué, cuándo, dónde, por qué y cómo. Neurobiol. Dis. 139:104811. doi: 10.1016/j.nbd.2020.104811
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Lewis, J., McGowan, E., Rockwood, J., Melrose, H., Nacharaju, P., Van Slegtenhorst, M., et al. (2000). Enredos neurofibrilares, amiotrofia y trastornos motores progresivos en ratones que expresan proteína tau mutante (P301L). Nat. Genet. 25, 402-405. doi: 10.1038/78078
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Li, S., Naganawa, M., Pracitto, R., Najafzadeh, S., Holden, D., Henry, S., et al. (2021). Evaluación de la reproducibilidad de prueba-reprueba de [(18)F]SynVesT-1, un nuevo trazador de radio para imágenes de PET de la glicoproteína de vesícula sináptica 2A. Eur. J. Nucl. Med. Mol. Imágenes 48, 1327–1338. doi: 10.1007/s00259-020-05149-3
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Li, S. Y., Cai, Z. X., Wu, X. A., Holden, D., Pracitto, R., Kapinos, M., et al. (2019a). Síntesis y evaluación in vivo de un nuevo radiotracer PET para la obtención de imágenes de la glicoproteína de vesícula sináptica 2A (SV2A) en primates no humanos. ACS Chem. Neurosci. 10, 1544–1554. doi: 10.1021/acschemneuro.8b00526
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Li, S. Y., Cai, Z. X., Zhang, W. J., Holden, D., Lin, S. F., Finnema, S. J., et al. (2019b). Síntesis y evaluación in vivo de [F-18]UCB-J para imágenes PET de la glicoproteína de vesícula sináptica 2A (SV2A). Eur. J. Nucl. Med. Mol. I 46, 1952-1965. doi: 10.1007/s00259-019-04357-w
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Li, W., Wu, Y., Min, F., Li, Z., Huang, J. y Huang, R. (2010). Un modelo de primate no humano de la enfermedad de Alzheimer generado por inyección intracraneal de amiloide beta42 y tiorphan.Metab. Brain Dis. 25, 277-284. doi: 10.1007/s11011-010-9207-9
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Li, X. Y., Hombres, W. W., Zhu, H., Lei, J. F., Zuo, F. X., Wang, Z. J., et al. (2016). Cambios específicos de la región de edad y el cerebro del trastorno metabólico de la glucosa, el aprendizaje y la disfunción de la memoria en la enfermedad de Alzheimer temprana evaluados en ratones transgénicos APP/PS1 que utilizan (18)F-FDG-PET. Int. J. Mol. Sci. 17:1707. doi: 10.3390/ijms17101707
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Liu, J., Chang, L., Song, Y., Li, H. y Wu, Y. (2019). El papel de los receptores NMDA en la enfermedad de Alzheimer. Frente. Neurosci. 13:43. doi: 10.3389/fnins.2019.00043
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Lo Sasso, G., Schlage, W. K., Boue, S., Veljkovic, E., Peitsch, M. C., y Hoeng, J. (2016). El modelo de ratón Apoe(-/-): un modelo adecuado para estudiar las enfermedades cardiovasculares y respiratorias en el contexto de la exposición al humo del cigarrillo y la reducción de los daños. J. Transl. Med. 14:146. doi: 10.1186/s12967-016-0901-1
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Long, J. M. y Holtzman, D. M. (2019). Enfermedad de Alzheimer: una actualización sobre la patobiología y las estrategias de tratamiento. Celda 179, 312-339. doi: 10.1016/j.cell.2019.09.001
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
López-Picon, F. R., Snellman, A., Eskola, O., Helin, S., Solin, O., Haaparanta-Solin, M., et al. (2018). La neuroinflamación aparece al principio de las imágenes de PET y luego se meseta en un modelo de ratón de la enfermedad de alzheimer. J. Nucl. Med. 59, 509-515. doi: 10.2967/jnumed.117.197608
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Lopresti, B. J., Klunk, W. E., Mathis, C. A., Hoge, J. A., Ziolko, S. K., Lu, X., et al. (2005). Cuantitativo simplificado de los estudios de PET de imágenes de amiloide del compuesto B de Pittsburgh: un análisis comparativo. J. Nucl. Med. 46, 1959-1972.
Luo, F., Rustay, N. R., Ebert, U., Hradil, V. P., Cole, T. B., Llano, D. A., et al. (2012). Caracterización de ratones Tg2576 de 7 y 19 meses de edad que utilizan imágenes multimodales in vivo: limitaciones como modelo tratable de la enfermedad de Alzheimer. Neurobiol. Envejecimiento 33, 933-944. doi: 10.1016/j.neurobiolaging.2010.08.005
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Macdonald, I. R., DeBay, D. R., Reid, G. A., O’Leary, T. P., Jollymore, C. T., Mawko, G., et al. (2014). Detección temprana de cambios en la absorción de glucosa cerebral en el ratón 5XFAD. Curr. Alzheimer Res. 11, 450–460. doi: 10.2174/1567205011666140505111354
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Maeda, J., Ji, B., Irie, T., Tomiyama, T., Maruyama, M., Okauchi, T., et al. (2007). Evaluación longitudinal y cuantitativa del tratamiento con amiloide, neuroinflamación y antiamiloide en un modelo de ratón vivo de la enfermedad de Alzheimer habilitado por la tomografía por emisión de positrones. J. Neurosci. 27, 10957–10968. doi: 10.1523/JNEUROSCI.0673-07.2007
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Maeda, S., Sahara, N., Saito, Y., Murayama, M., Yoshiike, Y., Kim, H., et al. (2007). Los oligomeros tau granulares como intermediarios de los filamentos tau. Bioquímica 46, 3856–3861. doi: 10.1021/bi061359o
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Manook, A., Yousefi, B. H., Willuweit, A., Platzer, S., Reder, S., Voss, A., et al. (2012). Imágenes de PET de animales pequeños de placas beta amiloide con [11C]PiB y su validación multimodal en un modelo de ratón APP/PS1 de la enfermedad de Alzheimer. PLoS One 7:e31310. doi: 10.1371/journal.pone.0031310
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Martin, E., Amar, M., Dalle, C., Youssef, I., Boucher, C., Le Duigou, C., et al. (2019). Nuevo papel del receptor P2X7 en un modelo de ratón de la enfermedad de Alzheimer. Mol. Psiquiatría 24, 108-125. doi: 10.1038/s41380-018-0108-3
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Marutle, A., Gillberg, P. G., Bergfors, A., Yu, W., Ni, R., Nennesmo, I., et al. (2013). (3) La radioutoradiografía H-deprenil y (3) H-PIB muestra diferentes distribuciones laminares de astrología y beta-amiloide fibrilar en el cerebro de Alzheimer. J. Neuroinflamm. 10:90. doi: 10.1186/1742-2094-10-90
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Maruyama, M., Shimada, H., Suhara, T., Shinotoh, H., Ji, B., Maeda, J., et al. (2013). Imágenes de patología tau en un modelo de ratón de tauopatía y en pacientes de Alzheimer en comparación con los controles normales. Neuron 79, 1094–1108. doi: 10.1016/j.neuron.2013.07.037
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
McMurray, L., Macdonald, J. A., Ramakrishnan, N. K., Zhao, Y., Williamson, D. W., Tietz, O., et al. (2021). Síntesis y evaluación de nuevas sondas para la patología de la tau con imágenes en modelos transgénicos de ratones y ratas. ACS Chem. Neurosci. 12, 1885-1893). doi: 10.1021/acschemneuro.0c00790
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Meier, S. R., Sehlin, D., Hultqvist, G. y Syvänen, S. (2021). Identificar los niveles de TREM2 cerebral en dos modelos de ratón de la enfermedad de Alzheimer. Mol. Imágenes Biol. 23, 665-675. doi: 10.1007/s11307-021-01591-3
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Melnikova, T., Fromholt, S., Kim, H., Lee, D., Xu, G., Price, A., et al. (2013). fenotipos patológicos y cognitivos reversibles en un modelo inducible de amiloidosis de Alzheimer. J. Neurosci. 33, 3765-3779. doi: 10.1523/JNEUROSCI.4251-12.2013
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Más, S. V., Kumar, H., Cho, D. Y., Yun, Y. S., y Choi, D. K. (2016). Modelos experimentales de aprendizaje y deterioro de la memoria inducidos por toxinas. Int. J. Mol. Sci. 17:1447. doi: 10.3390/ijms17091447
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Moreno-Gonzalez, I., Edwards, G. A. III, Hasan, O., Gamez, N., Schulz, J. E., Fernández-Valenzuela, J. J., et al. (2021). Evaluación longitudinal de la patología asociada a la tau mediante (18) imágenes de PET F-THK5351: un estudio histológico, bioquímico y de comportamiento. Diagnóstico 11:1874. doi: 10.3390/diagnostics11101874
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Morris, M., Maeda, S., Vossel, K. y Mucke, L. (2011). Las muchas caras de tau. Neuron 70, 410-426. doi: 10.1016/j.neuron.2011.04.009
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Murugan, N. A., Chiotis, K., Rodríguez-Vieitez, E., Lemoine, L., Agren, H. y Nordberg, A. (2019). Interacción cruzada de trazadores de PET tau con monoaminooxidasa B: evidencia de modelado in silico e imágenes in vivo. Eur. J. Nucl. Med. Mol. Imágenes 46, 1369–1382. doi: 10.1007/s00259-019-04305-8
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Nabulsi, N. B., Holden, D., Zheng, M. Q., Bois, F., Lin, S. F., Najafzadeh, S., et al. (2019). Evaluación de (11)C-LSN3172176 como un nuevo trazador de PET para la obtención de imágenes de receptores de acetilcolina muscarínico M1 en primates no humanos. J. Nucl. Med. 60, 1147–1153. doi: 10.2967/jnumed.118.222034
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Nabulsi, N. B., Mercier, J., Holden, D., Carre, S., Najafzadeh, S., Vandergeten, M. C., et al. (2016). Síntesis y evaluación preclínica de 11C-UCB-J como trazador de PET para obtener imágenes de la glicoproteína de vesícula sináptica 2A en el cerebro. J. Nucl. Med. 57, 777-784. doi: 10.2967/jnumed.115.168179
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Naganawa, M., Li, S., Nabulsi, N., Henry, S., Zheng, M. Q., Pracitto, R., et al. (2021). Primera evaluación en el ser humano de (18)F-SynVesT-1, un radioligando para imágenes de PET de la glicoproteína de vesícula sináptica 2A. J. Nucl. Med. 62, 561-567. doi: 10.2967/jnumed.120.249144
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Naj, A. C. y Schellenberg, G. D. (2017). Genética de la enfermedad de Alzheimer, C. Variantes genómicas, genes y vías de la enfermedad de Alzheimer: una visión general. Am. J. Med. Genet. B Neuropsiquiatra. Genet. 174, 5-6. doi: 10.1002/ajmg.b.32499
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Nakaizumi, K., Ouchi, Y., Terada, T., Yoshikawa, E., Kakimoto, A., Isobe, T., et al. (2018). Representación in vivo de la pérdida del receptor nicotínico α7 por deterioro cognitivo en la enfermedad de Alzheimer. J. Alzheimer Dis. 61, 1355–1365. doi: 10.3233/JAD-170591
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Neustadtl, A. L., Winston, C. N., Parsadanian, M., Main, B. S., Villapol, S., y Burns, M. P. (2017). La reducción del número de sinapsis excitatorias corticales en ratones APOE4 se asocia con un aumento de la actividad de la calcineurina. Neuroinforme 28, 618-624. doi: 10.1097/WNR.0000000000000811
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Ng, K. P., Pascoal, T. A., Mathotaarachchi, S., Therriault, J., Kang, M. S., Shin, M., et al. (2017). El inhibidor de la monoaminooxidasa B, selegilina, reduce la absorción de (18)F-THK5351 en el cerebro humano. Alzheimers Res. Ther. 9:25. doi: 10.1186/s13195-017-0253-y
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Ni, R. (2021). Tomografía por emisión de positrones en modelos animales de amiloidosis de la enfermedad de Alzheimer: implicaciones traslacionales. Productos farmacéuticos 14:1179. doi: 10.3390/ph14111179
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Ni, R., Ji, B., Ono, M., Sahara, N., Zhang, M. R., Aoki, I., et al. (2018). Comparaciones comparativas in vitro e in vivo de los depósitos de tautológicos y su asociación con la neurodegeneración en modelos de ratón tauopatía. J. Nucl. Med. 59, 960-966. doi: 10.2967/jnumed.117.201632
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Nishiyama, S., Ohba, H., Kanazawa, M., Kakiuchi, T. y Tsukada, H. (2015). Comparación de la unión al receptor nicotínico de acetilcolina alfa7, la deposición de amiloide beta y la función del complejo mitocondria-I en el cerebro vivo: un estudio de PET en monos de edad avanzada. Sinapsis 69, 475-483. doi: 10.1002/syn.21842
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Oakley, H., Cole, S. L., Logan, S., Maus, E., Shao, P., Craft, J., et al. (2006). Agregados de beta-amiloide intraneuronal, neurodegeneración y pérdida de neuronas en ratones transgénicos con cinco mutaciones familiares de la enfermedad de Alzheimer: factores potenciales en la formación de placa amiloide. J. Neurosci. 26, 10129–10140. doi: 10.1523/JNEUROSCI.1202-06.2006
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Ojo, J. O., Mouzon, B., Greenberg, M. B., Bachmeier, C., Mullan, M. y Crawford, F. (2013). La lesión cerebral traumática leve y repetitiva aumenta la patología tau y la activación glial en ratones hTau de edad avanzada.J. Neuropatógeno. Exp. Neurol. 72, 137–151. doi: 10.1097/NEN.0b013e3182814cdf
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Okamura, N., Furumoto, S., Fodero-Tavoletti, M. T., Mulligan, R. S., Harada, R., Yates, P., et al. (2014). Evaluación no invasiva de la patología neurofibrilar de la enfermedad de Alzheimer utilizando 18F-THK5105 PET.QARain 137, 1762-1771. doi: 10.1093/brain/awu064
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Okamura, N., Suemoto, T., Furumoto, S., Suzuki, M., Shimadzu, H., Akatsu, H., et al. (2005). Derivados de quinolina y benzimidazol: sondas candidatas para imágenes in vivo de patología tau en la enfermedad de Alzheimer. J. Neurosci. 25, 10857-10862. doi: 10.1523/JNEUROSCI.1738-05.2005
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Ordonez-Gutierrez, L., Fernández-Perez, I., Herrera, J. L., Anton, M., Benito-Cuesta, I., y Wandosell, F. (2016). Los ratones transgénicos AbetaPP/PS1 muestran diferencias sexuales en el cerebelo asociadas con el envejecimiento. J. Alzheimer Dis. 54, 645-656. doi: 10.3233/JAD-160572
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Paspalas, C. D., Carlyle, B. C., Leslie, S., Preuss, T. M., Crimins, J. L., Huttner, A. J., et al. (2018). El macaco rhesus envejecido manifiesta una patología similar a la enfermedad de la enfermedad de Alzheimer en estadio III/IV de Braak. Demencia de Alzheimer. 14, 680-691. doi: 10.1016/j.jalz.2017.11.005
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Peeraer, E., Bottelbergs, A., Van Kolen, K., Stancu, I. C., Vasconcelos, B., Mahieu, M., et al. (2015). La inyección intracerebral de fibrillas tau sintéticas preformadas inicia la tauopatía generalizada y la pérdida neuronal en el cerebro de ratones taugénicos. Neurobiol. Dis. 73, 83-95. doi: 10.1016/j.nbd.2014.08.032
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Piedrahita, J. A., Zhang, S. H., Hagaman, J. R., Oliver, P. M. y Maeda, N. (1992). Generación de ratones que llevan un gen mutante de la apolipoproteína E inactivado por un gen dirigido a células madre embrionarias. Proc. Natl. Acad. Sci. EE. UU. 89, 4471-4475. doi: 10.1073/pnas.89.10.4471
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Pini, L., Pievani, M., Bocchetta, M., Altomare, D., Bosco, P., Cavedo, E., et al. (2016). Atrofia cerebral en la enfermedad de Alzheimer y el envejecimiento. Envejecimiento Res. Rev. 30, 25-48. doi: 10.1016/j.arr.2016.01.002
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Poisnel, G., Herard, A. S., El Tannir El Tayara, N., Bourrin, E., Volk, A., Kober, F., et al. (2012). Aumento de la absorción regional de glucosa cerebral en un modelo APP/PS1 de la enfermedad de Alzheimer. Neurobiol. Envejecimiento 33, 1995-2005. doi: 10.1016/j.neurobiolaging.2011.09.026
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Precio, J. C., Klunk, W. E., Lopresti, B. J., Lu, X., Hoge, J. A., Ziolko, S. K., et al. (2005). Modelado cinético de la unión amiloide en humanos utilizando imágenes de PET y compuesto de Pittsburgh-B. J. Cereb. Metab de flujo sanguíneo. 25, 1528–1547. doi: 10.1038/sj.jcbfm.9600146
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Prpar Mihevc, S., y Majdic, G. (2019). Disfunción cognitiva canina y enfermedad de Alzheimer: ¿dos facetas de la misma enfermedad? Frente. Neurosci. 13:604. doi: 10.3389/fnins.2019.00604
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Querol-Vilaseca, M., Colom-Cadena, M., Pegueroles, J., Nuñez-Llaves, R., Luque-Cabecerans, J., Muñoz-Llahuna, L., et al. (2019). Estructura a nanoescala de placas amiloides-β en la enfermedad de Alzheimer.Sci. Rep. 9:5181.
Rabinovici, G. D., Furst, A. J., O’Neil, J. P., Racine, C. A., Mormino, E. C., Baker, S. L., et al. (2007). Imágenes de PET 11C-PIB en la enfermedad de Alzheimer y la degeneración lobar frontotemporal.Neurología 68, 1205–1212. doi: 10.1212/01.wnl.0000259035.98480.ed
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Rocher, A. B., Chapon, F., Blaizot, X., Baron, J. C. y Chavoix, C. (2003). La utilización de glucosa cerebral en estado de descanso medida por PET está directamente relacionada con los niveles regionales de sinaptofisina: un estudio en babuinos. Neuroimagen 20, 1894-1898). doi: 10.1016/j.neuroimage.2003.07.002
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Rodríguez-Vieitez, E., Leuzy, A., Chiotis, K., Saint-Aubert, L., Wall, A., y Nordberg, A. (2017). Comparabilidad de las imágenes de proxy de flujo sanguíneo [18F]THK5317 y [11C]PIB con la tomografía de emisión de positrones [18F]FDG en la enfermedad de Alzheimer. J. Cereb. Metab de flujo sanguíneo. 37, 740-749. doi: 10.1177/0271678X16645593
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Rohn, T. T. (2010). El papel de las caspasas en la enfermedad de Alzheimer; posibles nuevas oportunidades terapéuticas. Apoptosis 15, 1403–1409. doi: 10.1007/s10495-010-0463-2
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Rojas, S., Herance, J. R., Gispert, J. D., Abad, S., Torrent, E., Jiménez, X., et al. (2013). Evaluación in vivo de la deposición de amiloide y el metabolismo de la glucosa cerebral de ratones 5XFAD mediante tomografía por emisión de positrones. Neurobiol. Envejecimiento 34, 1790-1898). doi: 10.1016/j.neurobiolaging.2012.12.027
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Rowe, C. C., Krishnadas, N., Ackermann, U., Dore, V., Goh, R. Y. W., Guzman, R., et al. (2021). Imágenes de receptores muscarínicos cerebrales con (18)F-Fluorobencil-Dexetimida: una primera en un estudio en humanos. Psiquiatría Res. Neuroimagen 316, 111354. doi: 10.1016/j.pscychresns.2021.111354
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Rubinski, A., Franzmeier, N., Neitzel, J. y Ewers, M. (2020). Neuroimagen De La Enfermedad De Alzheimer, I. El hipermetabolismo de la FDG-PET se asocia con un mayor tau-PET en el deterioro cognitivo leve a niveles bajos de PET amiloide. Alzheimer Res. Ther. 12:133. doi: 10.1186/s13195-020-00702-6
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Ruiz-Opazo, N., Kosik, K. S., López, L. V., Bagamasbad, P., Ponce, L. R., y Herrera, V. L. (2004). Atenuación del aprendizaje y la memoria dependientes del hipocampo en ratas TgAPP transgénicaswe Fischer-344. Mol. Med. 10, 36-44. doi: 10.2119/2003-00044.herrera
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Ryan, N. S., y Rossor, M. N. (2010). Correlación de las mutaciones genéticas familiares de la enfermedad de Alzheimer con el fenotipo clínico. Biomark Med. 4, 99–112. doi: 10.2217/bmm.09.92
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Sadasivam, P., Fang, X. T., Toyonaga, T., Lee, S., Xu, Y., Zheng, M. P., et al. (2021). Cuantificación de la unión SV2A en el cerebro de roedores utilizando [(18)F]SynVesT-1 y PET Imaging. Mol. Imágenes Biol. 23, 372–381. doi: 10.1007/s11307-020-01567-9
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Sadasivam, P., Smith, L., Spurrier, J., Lee, S., Lindemann, M., Toyonaga, T., et al. (2019). El nuevo trazador de PET F-18-SDM-8 detecta eficazmente la reducción de la unión a SV2a en un modelo de roedores de la enfermedad de Alzheimer. J. Cerebr. Sangre F Met. 39, 97-97.
Saito, T., Mihira, N., Matsuba, Y., Sasaguri, H., Hashimoto, S., Narasimhan, S., et al. (2019). La humanización de todo el gen Mapt murino proporciona un modelo murino de propagación patológica de tau humana. J. Biol. Química. 294, 12754–12765. doi: 10.1074/jbc.RA119.009487
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Sala, A., Caprioglio, C., Santangelo, R., Vanoli, E. G., Iannaccone, S., Magnani, G., et al. (2020). Firmas metabólicas cerebrales en todo el espectro de la enfermedad de Alzheimer. Eur. J. Nucl. Med. Mol. Imágenes 47, 256-269. doi: 10.1007/s00259-019-04559-2
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Sanabria Bohórquez, S. S., Maøıìk, J., Ogasawara, A., Tinianow, J., Gill, H. S., Barret, O., et al. (2019). [18F]GTP1 (Genentech Tau Probe 1), un radioligando para detectar la patología del enredo neurofibrilar tau en la enfermedad de Alzheimer. Eur. J. Nucl. Med. Mol. Imágenes 46, 2077-2089. doi: 10.1007/s00259-019-04399-0
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Sancheti, H., Akopian, G., Yin, F., Brinton, R. D., Walsh, J. P., y Cadenas, E. (2013). Modulación dependiente de la edad de la plasticidad sináptica y efecto mimético de la insulina del ácido lipóbico en un modelo de ratón de la enfermedad de Alzheimer. PLoS One 8:e69830. doi: 10.1371/journal.pone.0069830
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Santacruz, K., Lewis, J., Spires, T., Paulson, J., Kotilinek, L., Ingelsson, M., et al. (2005). La supresión de Tau en un modelo de ratón neurodegenerativo mejora la función de la memoria. Ciencia 309, 476-481. doi: 10.1126/science.1113694
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Sanz, J. M., Chiozzi, P., Ferrari, D., Colaianna, M., Idzko, M., Falzoni, S., et al. (2009). La activación de la microglía por el amiloide {beta} requiere la expresión del receptor P2X7. J. Immunol. 182, 4378-4385. doi: 10.4049/jimmunol.0803612
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Scheltens, P., De Strooper, B., Kivipelto, M., Holstege, H., Chételat, G., Teunissen, C. E., et al. (2021). Enfermedad de Alzheimer. Lanceta 397, 1537-1590.
Schmidt, F., Boltze, J., Jager, C., Hofmann, S., Willems, N., Seeger, J., et al. (2015). Detección y cuantificación de betaamiloide, piroglutamil abeta y tau en caninos envejecidos. J. Neuropatógeno. Exp. Neurol. 74, 912–923. doi: 10.1097/NEN.0000000000000230
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Sehlin, D., Fang, X. T., Cato, L., Antoni, G., Lannfelt, L. y Syvanen, S. (2016). Imágenes PET basadas en anticuerpos de beta amiloide en modelos de ratón de la enfermedad de Alzheimer. Nat. Commun.7:10759. doi: 10.1038/ncomms10759
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Senechal, Y., Kelly, P. H. y Dev, K. K. (2008). Los ratones knockout de la proteína precursora amiloide muestran déficits dependientes de la edad en el aprendizaje de evitación pasiva. Behav. Respuesta cerebral. 186, 126-132. doi: 10.1016/j.bbr.2007.08.003
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Shaw, K. N., Commins, S. y O’Mara, S. M. (2001). El lipopolisacárido causa déficits en el aprendizaje espacial en el agua, pero no en la expresión de BDNF en el giro dentado de rata. Behav. Respuesta cerebral. 124, 47-54. doi: 10.1016/s0166-4328(01)00232-7
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Shen, J., Bronson, R. T., Chen, D. F., Xia, W., Selkoe, D. J. y Tonegawa, S. (1997). Defectos esqueléticos y del SNC en ratones con deficiencia de Presenilin-1. Celdas 89, 629–639. doi: 10.1016/s0092-8674(00)80244-5
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Shimojo, M., Takuwa, H., Takado, Y., Tokunaga, M., Tsukamoto, S., Minatohara, K., et al. (2020). Interrupción selectiva de las sinapsis inhibitorias que conduce a la hiperexcitabilidad neuronal en una etapa temprana de la patogénesis tau en un modelo de ratón. J. Neurosci. 40, 3491–3501. doi: 10.1523/JNEUROSCI.2880-19.2020
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Shin, J., Kepe, V., Barrio, J. R., y Small, G. W. (2011). Los méritos de las imágenes FDDNP-PET en la enfermedad de Alzheimer. J. Alzheimer Dis. 26, (Suplemento 3), 135-145. doi: 10.3233/JAD-2011-0008
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Shoghi-Jadid, K., Pequeño, G. W., Agdeppa, E. D., Kepe, V., Ercoli, L. M., Siddarth, P., et al. (2002). Localización de enredos neurofibrilares y placas beta-amiloide en el cerebro de pacientes vivos con enfermedad de Alzheimer. Am. J. Geriatr. Psiquiatría 10, 24-35. doi: 10.1097/00019442-200201000-00004
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Smolek, T., Madari, A., Farbakova, J., Kandrac, O., Jadhav, S., Cente, M., et al. (2016). La hiperfosforilación de Tau en los sinaptosomas y la neuroinflamación están asociadas con el deterioro cognitivo canino. J. Comp. Neurol. 524, 874-895. doi: 10.1002/cne.23877
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Snellman, A., López-Picon, F. R., Rokka, J., Salmona, M., Forloni, G., Scheinin, M., et al. (2013). Imágenes de amiloide longitudinal en el cerebro de ratón con 11C-PIB: comparación de los modelos de ratón APP23, Tg2576 y APPswe-PS1dE9 de la enfermedad de Alzheimer. J. Nucl. Med.54, 1434–1441. doi: 10.2967/jnumed.112.110163
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Snellman, A., Rokka, J., López-Picon, F. R., Helin, S., Re, F., Loyttyniemi, E., et al. (2017). Aplicabilidad de imágenes de microPET de [(11)C]PIB para el seguimiento in vivo de los efectos del tratamiento antiamiloide en el modelo de ratón APP23. Neurobiol. Envejecimiento 57, 84-94. doi: 10.1016/j.neurobiolaging.2017.05.008
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Srivastava, A., Das, B., Yao, A. N. Y., y Yan, R. P. (2020). Receptores metabotrópicos de glutamato en la disfunción sináptica de la enfermedad de Alzheimer: oportunidades terapéuticas y esperanza para el futuro. J. Alzheimer Dis. 78, 1345–1361. doi: 10.3233/JAD-201146
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Sturchler-Pierrat, C., Abramowski, D., Duke, M., Wiederhold, K. H., Mistl, C., Rothacher, S., et al. (1997). Dos modelos de ratón transgénicos de proteína precursora amiloide con patología similar a la enfermedad de Alzheimer. Proc. Natl. Acad. Sci. EE. UU. 94, 13287–13292. doi: 10.1073/pnas.94.24.13287
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Su, Y., Fu, J., Yu, J., Zhao, Q., Guan, Y., Zuo, C., et al. (2020). Imágenes de Tau PET con [18F]PM-PBB3 en demencia frontotemporal con mutación MAPT. J. Alzheimer. Dis. 76, 149-157. doi: 10.3233/JAD-200287
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Sun, G. Z., He, Y. C., Ma, X. K., Li, S. T., Chen, D. J., Gao, M., et al. (2017). Déficits sinápticos y de redes neuronales del hipocampal en ratones jóvenes que llevan el gen APOE4 humano. Neurociencia del SNC. Ther. 23, 748-758. doi: 10.1111/cns.12720
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Tai, L. M., Youmans, K. L., Jungbauer, L., Yu, C. y Ladu, M. J. (2011). Presentamos APOE humano en los modelos de ratón transgénicos abeta. Int. J. Alzheimer Dis. 2011:810981. doi: 10.4061/2011/810981
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Takkinen, J. S., López-Picon, F. R., Al Majidi, R., Eskola, O., Krzyczmonik, A., Keller, T., et al. (2017). Metabolismo de la energía cerebral y neuroinflamación en ratones APP/PS1-21 envejecidos utilizando imágenes longitudinales (18)F-F-FDG y (18)F-DPA-714 PET. J. Cereb. Metab de flujo sanguíneo. 37, 2870-2882. doi: 10.1177/0271678X16677990
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Tauber, C., Beaufils, É, Hommet, C., Ribeiro, M., Vercouillie, J., Vierron, E., et al. (2013). QARain [18F]FDDNP unión y metabolismo de la glucosa en sujetos sanos de edad avanzada y pacientes con enfermedad de Alzheimer. J. Alzheimer Dis. 36, 311-320. doi: 10.3233/JAD-122068
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Tong, L., Li, W., Lo, M. M., Gao, X., Wai, J. M., Rudd, M., et al. (2020). Descubrimiento de [(11)C]MK-6884: un agente de imagen de tomografía por emisión de positrones (PET) para el estudio de moduladores aloséricos positivos del receptor M4Muscarinic (PAM) en enfermedades neurodegenerativas. J. Med. Química. 63, 2411-2425. doi: 10.1021/acs.jmedchem.9b01406
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Toyama, H., Ye, D., Ichise, M., Liow, J. S., Cai, L., Jacobowitz, D., et al. (2005). Imágenes PET del cerebro con la sonda beta-amiloide, [11C]6-OH-BTA-1, en un modelo transgénico de ratón de la enfermedad de Alzheimer. Eur. J. Nucl. Med. Mol. Imágenes 32, 593–600. doi: 10.1007/s00259-005-1780-5
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Toyonaga, T., Fesharaki-Zadeh, A., Strittmatter, S. M., Carson, R. E., y Cai, Z. (2022). Imágenes PET de densidad sináptica: desafíos y oportunidades de la glicoproteína de vesícula sináptica 2A PET en imágenes de animales pequeños. Frente. Neurosci. 16:787404. doi: 10.3389/fnins.2022.787404
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Toyonaga, T., Smith, L. M., Finnema, S. J., Gallezot, J. D., Naganawa, M., Bini, J., et al. (2019). Las imágenes de densidad sináptica in vivo con (11)C-UCB-J detectan los efectos del tratamiento del saracatinib en un modelo de ratón de la enfermedad de alzheimer. J. Nucl. Med. 60, 1780–1786. doi: 10.2967/jnumed.118.223867
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Tran, H. T., LaFerla, F. M., Holtzman, D. M. y Brody, D. L. (2011). La lesión cerebral traumática por impacto cortical controlado en ratones 3xTg-AD causa acumulación aguda de mitoide beta intraaxonal y acelera de forma independiente el desarrollo de anomalías de tau. J. Neurosci. 31, 9513–9525. doi: 10.1523/JNEUROSCI.0858-11.2011
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Traynelis, S. F., Wollmuth, L. P., McBain, C. J., Menniti, F. S., Vance, K. M., Ogden, K. K., et al. (2010). Canales iónicos del receptor de glutamato: estructura, regulación y función. Pharmacol. Rev. 62, 405-496. doi: 10.1124/pr.109.002451
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Tucker, K. L., Meyer, M. y Barde, Y. A. (2001). Las neurotropinas son necesarias para el crecimiento nervioso durante el desarrollo. Nat. Neurosci. 4, 29-37. doi: 10.1038/82868
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Varlow, C., Murrell, E., Holland, J. P., Kassenbrock, A., Shannon, W., Liang, S. H., et al. (2020). Revisar la radiosíntesis de [(18)F]FPEB e imágenes preliminares de PET en un modelo de ratón de la enfermedad de Alzheimer. Moléculas 25:982. doi: 10.3390/moléculas25040982
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Waldron, A. M., Verhaeghe, J., Wyffels, L., Schmidt, M., Langlois, X., Van Der Linden, A., et al. (2015a). Comparación preclínica de los radioligandos amiloide-beta [(11)C]Pittsburgh compuesto B y [(18)F]florbetaben en modelos de ratón APPPS1-21 y BRI1-42 de edad avanzada de amiloidosis cerebral. Mol. Imágenes Biol. 17, 688-696. doi: 10.1007/s11307-015-0833-9
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Waldron, A. M., Wintmolders, C., Bottelbergs, A., Kelley, J. B., Schmidt, M. E., Stroobants, S., et al. (2015b). Neuroimagen molecular in vivo de la utilización de glucosa y su asociación con la carga beta de amiloide fibrilar en ratones APPPS1-21 de edad avanzada. Alzheimer Res. Ther. 7:76. doi: 10.1186/s13195-015-0158-6
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Waldron, A. M., Wyffels, L., Verhaeghe, J., Richardson, J. C., Schmidt, M., Stroobants, S., et al. (2017). Caracterización longitudinal de la absorción [18F]-FDG y [18F]-AV45 en el modelo de ratón TASTPM transgénico doble. J. Alzheimer Dis. 55, 1537–1548. doi: 10.3233/JAD-160760
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Wang, C., Wilson, W. A., Moore, S. D., Mace, B. E., Maeda, N., Schmechel, D. E., et al. (2005). Los ratones de reemplazo humanos dirigidos a apoE4 muestran déficits sinápticos en ausencia de neuropatología. Neurobiol. Dis. 18, 390-398. doi: 10.1016/j.nbd.2004.10.013
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Wang, H. F., Tan, L., Cao, L., Zhu, X. C., Jiang, T., Tan, M. S., et al. (2016). Neuroimagen de la enfermedad de Alzheimer, I. Aplicación de los criterios de diagnóstico del IWG-2 para la enfermedad de Alzheimer al ADNI. J. Alzheimer Dis. 51, 227-236. doi: 10.3233/JAD-150824
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Wang, R., y Reddy, P. H. (2017). Papel del glutamato y los receptores NMDA en la enfermedad de Alzheimer. J. Alzheimer Dis. 57, 1014-1048. doi: 10.3233/JAD-160763
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Wang, Y. T., y Edison, P. (2019). Imágenes de Tau en enfermedades neurodegenerativas mediante tomografía por emisión de positrones. Curr. Neurol. Neurosci. Rep. 19:45. doi: 10.1007/s11910-019-0962-7
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Warnock, G. I., Aerts, J., Bahri, M. A., Bretin, F., Lemaire, C., Giacomelli, F., et al. (2014). Evaluación de 18F-UCB-H como un nuevo trazador de PET para la proteína de vesícula sináptica 2A en el cerebro.J. Nucl. Med. 55, 1336–1341. doi: 10.2967/jnumed.113.136143
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Weng, C. C., Hsiao, I. T., Yang, Q. F., Yao, C. H., Tai, C. Y., Wu, M. F., et al. (2020). Caracterización de la absorción de (18)F-PM-PBB3 ((18)F-APN-1607) en el modelo de tauopatía de ratón rTg4510.Moléculas 25:1750. doi: 10.3390/moléculas25071750
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Wolfe, C. M., Fitz, N. F., Nam, K. N., Lefterov, I., y Koldamova, R. (2018). El papel de APOE y TREM2 en la comprensión y las perspectivas actuales de la enfermedad de Alzheimer. Int. J. Mol. Sci. 20:81. doi: 10.3390/ijms20010081
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Wong, D. F., Comley, R. A., Kuwabara, H., Rosenberg, P. B., Resnick, S. M., Ostrowitzki, S., et al. (2018). Caracterización de 3 nuevos radiofármacos tau, 11C-RO-963, 11C-RO-643 y 18F-RO-948, en controles sanos y en sujetos con Alzheimer. J. Nucl. Med. 59, 1869–1876. doi: 10.2967/jnumed.118.209916
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Xia, C. F., Arteaga, J., Chen, G., Gangadharmath, U., Gómez, L. F., Kasi, D., et al. (2013). [(18)F]T807, un nuevo agente de imágenes por tomografía por emisión de positrones tau para la enfermedad de Alzheimer. Demencia de Alzheimer. 9, 666-676. doi: 10.1016/j.jalz.2012.11.008
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Xiang, X., Piers, T. M., Wefers, B., Zhu, K., Mallach, A., Brunner, B., et al. (2018). La variante de riesgo de Alzheimer Trem2 R47H afecta al empalme y reduce el ARNm y las proteínas Trem2 en ratones, pero no en humanos. Mol. Neurodegener. 13:49. doi: 10.1186/s13024-018-0280-6
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Xiong, M., Roshanbin, S., Rokka, J., Schlein, E., Ingelsson, M., Sehlin, D., et al. (2021). Imágenes in vivo de densidad sináptica con [(11)C]UCB-J PET en dos modelos de ratón de enfermedad neurodegenerativa. Neuroimagen 239:118302. doi: 10.1016/j.neuroimagen.2021.118302
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Xu, G., Ran, Y., Fromholt, S. E., Fu, C., Yachnis, A. T., Golde, T. E., et al. (2015). La sobreproducción de Murine Abeta produce depósitos de amiloide de tipo Alzheimer difusos y compactos. Acta Neuropathol. Commun. 3:72. doi: 10.1186/s40478-015-0252-9
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Yaghmoor, F., Noorsaeed, A., Alsaggaf, S., Aljohani, W., Scholtzova, H., Boutajangout, A., et al. (2014). El papel de TREM2 en la enfermedad de Alzheimer y otros trastornos neurológicos. J. Alzheimer Dis. Parkinson. 4:160. doi: 10.4172/2161-0460.1000160
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Yamamoto, S., Nishiyama, S., Kawamata, M., Ohba, H., Wakuda, T., Takei, N., et al. (2011). Ocupación de receptores muscarínicos y deterioro cognitivo: un estudio de PET con [11C](+)3-MPB y escopolamina en monos conscientes. Neuropsicofarmacología 36, 1455–1465. doi: 10.1038/npp.2011.31
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Yi, J. H., Whitcomb, D. J., Park, S. J., Martínez-Perez, C., Barbati, S. A., Mitchell, S. J., et al. (2020). Disfunción del receptor de acetilcolina muscarínico M1 en patología moderada de la enfermedad de Alzheimer. Brain Commun. 2:fcaa058. doi: 10.1093/braincomms/fcaa058
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Yu, C. H., Song, G. S., Yhee, J. Y., Kim, J. H., Im, K. S., Nho, W. G., et al. (2011). Comparación histopatológica e inmunohistoquímica del cerebro de pacientes humanos con enfermedad de Alzheimer y el cerebro de perros de edad avanzada con disfunción cognitiva. J. Comp. Pathol. 145, 45-58. doi: 10.1016/j.jcpa.2010.11.004
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Yu, F., Zhang, Y. y Chuang, D. M. (2012). El litio reduce la sobreexpresión de BACE1, la acumulación de beta amiloide y los déficits de aprendizaje espacial en ratones con lesión cerebral traumática. J. Neurotrauma 29, 2342–2351. doi: 10.1089/neu.2012.2449
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Zeydan, B., Schwarz, C. G., Przybelski, S. A., Lesnick, T. G., Kremers, W. K., Senjem, M. L., et al. (2021). Comparación de la unión de la materia blanca 11 C-Pittsburgh compuesto-B y 18 F-flutemetamol en PET. J. Nucl. Med. doi: 10.2967/jnumed.121.263281 [Epub antes de la impresión].
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Zhao, J., Bi, W., Xiao, S., Lan, X., Cheng, X., Zhang, J., et al. (2019). La neuroinflamación inducida por el lipopolisacárido causa deterioro cognitivo en ratones. Sci. Rep. 9:5790. doi: 10.1038/s41598-019-42286-8
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Zheng, C., Holden, D., Zheng, M. P., Pracitto, R., Wilcox, K. C., Lindemann, M., et al. (2022). Un trazador de PET metabólicamente estable para la obtención de imágenes de la proteína de vesícula sináptica 2A: síntesis y caracterización preclínica de [18F]SDM-16. Eur. J. Nucl. Med. Mol. Imágenes 49, 1482–1496. doi: 10.1007/s00259-021-05597-5
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Zhou, R., Ji, B., Kong, Y., Qin, L., Ren, W., Guan, Y., et al. (2021). Imágenes de PET de neuroinflamación en la enfermedad de Alzheimer. Frente. Immunol. 12:739130. doi: 10.3389/fimmu.2021.739130
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Zhou, X., Ji, B., Seki, C., Nagai, Y., Minamimoto, T., Fujinaga, M., et al. (2021). Imágenes de PET del receptor de factor 1 que estimula la colonia: una comparación cara a cara de un nuevo radioligando. J. Cereb. Metab de flujo sanguíneo. 41, 2410–2422. doi: 10.1177/0271678X211004146
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Zhu, Y., Nwabuisi-Heath, E., Dumanis, S. B., Tai, L. M., Yu, C., Rebeck, G. W., et al. (2012). El genotipo APOE altera la activación glial y la pérdida de marcadores sinápticos en ratones. Glia 60, 559-569. doi: 10.1002/glia.22289
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Palabras clave: tomografía por emisión de positrones, enfermedad de Alzheimer, β-amiloide (Aβ), tau, neurodegeneración, SV2A, neuroinflamación, modelo animal
Cita: Chen B, Márquez-Nostra B, Belitzky E, Toyonaga T, Tong J, Huang Y y Cai Z (2022) Imágenes de PET en modelos animales de la enfermedad de Alzheimer. Frente. Neurosci. 16:872509. doi: 10.3389/fnins.2022.872509
Recibido: 09 de febrero de 2022; Aceptado: 25 de abril de 2022;
Publicado: 24 de mayo de 2022.
Editado por:
Ruiqing Ni, ETH Zürich, Suiza
Revisado por:
Nicolas Tournier, Commissariat à l’Energie Atomique et aux Energies Alternatives (CEA), Francia
Steven Liang, Hospital General de Massachusetts y Escuela de Medicina de Harvard, Estados Unidos
Copyright © 2022 Chen, Márquez-Nostra, Belitzky, Toyonaga, Tong, Huang y Cai. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución de Creative Commons (CC BY).
*Correspondencia: Zhengxin Cai, Jason.cai@yale.edu
Descargo de responsabilidad: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamación que pueda ser fabricado por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía