Impactos en la microbiota dérmica canina asociados con el baño repetido

Impactos en la microbiota dérmica canina asociados con el baño repetido
 Dakota Discepolo1°*
Dakota Discepolo1°*  Russell Kelley2°
Russell Kelley2°  Adrián Watson2°
Adrián Watson2°  Erin Perry1°
Erin Perry1°- 1°Departamento de Ciencia Animal, Alimentos y Nutrición, Southern Illinois University, Carbondale, IL, Estados Unidos
- 2°Royal Canin USA, Pet Heath Nutrition Center, Lewisburg, OH, Estados Unidos
Introducción: Los perros de trabajo operan rutinariamente en condiciones ambientales que pueden requerir un baño diario para eliminar contaminantes o suciedad. Se desconocen los impactos del baño frecuente o repetido en la microbiota dérmica canina. El objetivo de este estudio fue caracterizar los cambios en las poblaciones microbianas dérmicas caninas después de baños diarios repetidos.
Métodos: Los perros perdigueros de Labrador (n = 16) se bañaron diariamente con una solución diluida de detergente para platos (solución detergente al 1,6%) en el transcurso de 14 días. El ADN microbiano dérmico se recolectó a través de hisopos estériles (n = 142) tomados en los días 0, 7, 14, 16, 21, 28, 35, 42 y 49 y se analizó la diversidad alfa, la diversidad beta y la abundancia relativa para evaluar los cambios en la microbiota dérmica a través de la secuenciación de 16 s.
Resultados: Los resultados indican que el baño diario aumentó significativamente la diversidad de Shannon, Chao1 y varias variantes raras de secuencias de amplicones. Aunque típicamente reportado en mayor abundancia, la abundancia relativa disminuyó en los filos Actinobacteria, Firmicutes y Proteobacteria (p < 0,05).
Conclusión: El baño diario repetido con detergente diluido para platos redujo significativamente los taxones microbianos dérmicos sanos normales y creó cambios significativos en la microbiota dérmica de los caninos. La alteración de la microbiota dérmica canina puede causar impactos negativos en la salud dérmica canina y requerir más investigación.
1. Introducción
La investigación actual sobre la microbiota de la dermis canina se ha centrado en patologías como las alergias y la dermatitis atópica. Informes anteriores han caracterizado la abundancia relativa de taxones predominantes tanto en poblaciones sanas como enfermas (1-4). Varios estudios han reportado Proteobacteria, Firmicutes, Bacteroidetes y Actinobacteria en mayor abundancia (1-4). Muchos factores pueden afectar a la microbiota dérmica residente. Se ha informado que la dermatitis atópica causa cambios significativos en la composición microbiana (1, 5).
Los esfuerzos previos dirigidos a la identificación de los factores que afectan a la microbiota dérmica han informado que la variación individual es el mayor contribuyente al cambio microbiano (4). Otros factores incluyen la ubicación anatómica de la muestra y la raza. Además, la influencia dietética también se ha identificado como una fuente de impacto potencial en la microbiota dérmica (6). Otros factores que pueden ser perjudiciales para la microbiota dérmica incluyen tratamientos tópicos como el uso de limpiadores o detergentes.
Se ha informado que la exposición a detergentes es un factor que contribuye a la alteración de la microbiota dérmica en humanos, probablemente debido a la alteración del pH cutáneo (7-10). La irritación dérmica también se ha asociado con pH alterado (11, 12). Sin embargo, el impacto de los limpiadores y detergentes en la microbiota dérmica canina está actualmente infrarrepresentado en la literatura científica.
Aunque los cambios en los taxones dérmicos residentes pueden ser de consecuencia para el canino, también hay efectos potenciales para sus homólogos humanos. Informes anteriores han demostrado que los humanos en contacto con caninos desarrollan microbiota dérmica e intestinal compartida (13-15). Los caninos y otras mascotas domésticas pueden actuar como un fómito y se ha informado que portan bacterias patógenas, incluido el estafilococo (16-19). S. pseudintermedius, un residente de la microbiota dérmica canina, puede colonizar la piel humana potencialmente causando infección (17). La incidencia de la infección en humanos no es bien conocida, ya que con frecuencia se asume que la infección es S. aureus, que en algunos casos también puede transmitirse de canino a humano (20). Además, cepas específicas de S. pseudintermedius, así como S. aureus, son resistentes a múltiples fármacos, lo que complica el tratamiento (18, 20). Por lo tanto, los factores que aumentan la abundancia de estos patógenos potenciales aumentan los riesgos para la salud y deben evitarse. Los patógenos que colonizan el microbioma dérmico presentan riesgos potenciales para los manipuladores humanos.
Los caninos que trabajan con frecuencia viven y viajan muy cerca de sus manipuladores y equipos, lo que aumenta el potencial de propagación de bacterias patógenas en caso de ser colonizadas. Además, el manejo canino de trabajo incluye el uso frecuente de detergente como parte de los protocolos de descontaminación requeridos debido a la alta probabilidad de exposición a contaminantes en áreas de despliegue como sitios de desastre (21) o entornos urbanos (22, 23). Esta recomendación, sin embargo, no considera que los caninos de búsqueda y rescate (SAR) pueden desplegarse en sitios de desastre por hasta catorce días consecutivos que requieren descontaminación diaria. Las evaluaciones previas de los caninos desplegados que respondieron a los deslizamientos de tierra de Oso, Washington informaron irritación de la piel en caninos descontaminados diariamente con un detergente para platos dentro de los 3 días (24). Es posible que estos procedimientos de descontaminación puedan dar lugar a cambios en la microbiota dérmica, que con frecuencia se asocia con irritación dérmica. Los síntomas reportados disminuyeron después del cese del uso de detergente.
Se necesitan datos para aclarar los impactos del uso diario de detergente en la microbiota dérmica, así como su capacidad de recuperación una vez que el baño ha cesado. Por lo tanto, el objetivo de este trabajo es identificar los cambios en la microbiota dérmica asociados con la descontaminación diaria utilizando un detergente para platos y caracterizar la recuperación de la microbiota dérmica después del cese de la descontaminación.
2. Materiales y métodos
2.1. Animales y tratamientos
Esta investigación fue aprobada por el Comité Institucional de Cuidado y Uso de Animales de la Universidad del Sur de Illinois (15-032), así como por el comité de ética de Royal Canin. Para este estudio se utilizaron perros perdigueros de labrador (n = 16) de una colonia de investigación. Los perros perdigueros de labrador fueron seleccionados ya que son una raza popular de trabajo y mascota. Los criterios de exclusión incluyeron el uso de medicamentos como antibióticos, antecedentes de alergias y antecedentes de afecciones dermatológicas. Los caninos fueron alojados en su entorno de perrera residente con dos caninos por pista interior / exterior. Todos los caninos estaban al día con el control mensual regular de parásitos, así como con las vacunas estándar. Las instalaciones fueron equipadas con un equipo veterinario in situ en caso de cualquier molestia o enfermedad en la población de estudio. Un canino desarrolló dermatitis atópica el día 14 en el punto de la cadera y, de acuerdo con las pautas de IACUC y las recomendaciones del equipo veterinario, fue retirado de las pruebas adicionales para continuar el tratamiento. Los caninos fueron alimentados con una dieta a base de pollo que fue formulada para cumplir o exceder los requisitos de NRC con 21% de proteína y un mínimo de 10% de grasa cruda. Los caninos tuvieron un mínimo de 90 días de aclimatación a la dieta antes del inicio del estudio.
Todos los caninos recibieron descontaminación simulada una vez al día durante 14 días consecutivos. El protocolo del estudio se adaptó a partir de recomendaciones publicadas anteriormente sobre métodos de descontaminación canina (25). La descontaminación fue llevada a cabo por técnicos capacitados con ajustes controlados de temperatura del agua (aproximadamente 36 ° C), orden de lavado, presión de lavado y tiempos de enjuague. La descontaminación comenzó con la saturación total del cuerpo utilizando una boquilla de pulverización que aplicaba agua desde la base del cuello hasta la punta de la cola. Se aplicaron 16 onzas de solución diluida de detergente para platos (detergente para platos Dawn, Proctor & Gamble, Cincinnati, OH; 59 ml diluidos de detergente a 3.7 L de agua) uniformemente en los hombros, la espalda, la caja torácica, el pecho, el área abdominal y las piernas. Los hombros, la espalda, el lado izquierdo, el lado derecho, el pecho y el área abdominal del canino fueron masajeados hasta obtener espuma. La anatomía dorsal y ventral recibió un masaje de espuma durante 2 minutos en cada área. Las piernas fueron enjabonadas y lavadas durante 30 s cada una. Cada canino fue enjuagado hasta que no quedaban residuos jabonosos (aproximadamente 4-5 min). Los caninos se secaron con toalla usando dos toallas limpias separadas. El pelaje canino quedó húmedo pero no saturado. Todas las toallas eran 100% algodón y de idéntica marca y serie de modelos (Towelhub, Atlanta, GA).®®
2.2. Recopilación de datos y evaluaciones visuales
Los hisopos dérmicos y las evaluaciones visuales fueron recolectados en los días 0, 7, 14, 21, 28, 35, 42 y 49 por un solo técnico capacitado. La recolección el día 0 ocurrió antes del comienzo de la descontaminación. Los hisopos de microbiota dérmica se tomaron de un 3cm2° área en el punto de la cadera derecha utilizando el sistema de recolección de hisopos y preservación total de ADN de Norgen Biotechnology (Ontario, Canadá) que utiliza 30 s de contacto con la piel con rotación continua. De acuerdo con las recomendaciones del fabricante, los sitios de recolección se afeitaron con una cuchilla # 40 (Oster, Boca Raton, FL) siguiendo la dirección del crecimiento del cabello antes de cada recolección de datos. El día 16 se añadió una colección adicional de microbiota dérmica para observar los cambios 48 h después de la última descontaminación.
Las evaluaciones de la puntuación de la salud de la piel fueron realizadas por dos técnicos capacitados (ver Material suplementario 1). El brillo del pelaje, la condición del pelaje, la caspa de la espalda y la caspa corporal se calificaron como adaptadas de trabajos publicados anteriormente (11, 26, 27). Todas las evaluaciones visuales se realizaron en una escala de 0 a 4 (de menor a mayor) con incrementos de medio punto aceptables.
2.3. Análisis de la microbiota
El ADN microbiano de hisopos se extrajo en la Universidad del Sur de Illinois utilizando el kit de aislamiento de ADN de microbiota Norgen (Ontario, Canadá). El ADN aislado se presentó para la secuenciación de próxima generación (Diversigen Inc.) a través de la tubería de secuenciación de amplicones 16S. Las bajas concentraciones de ADN resultaron en la eliminación de 8 muestras. Por lo tanto, los datos reportados aquí incluyen 134 muestras microbianas dérmicas. Las variables de interés incluyen diferencias asociadas con el día de estudio, el brillo del pelaje, la condición del pelaje, la caspa corporal y la caspa de la espalda.
2.4. Análisis de la diversidad alfa
El análisis de la diversidad alfa de la microbiota dérmica canina se llevó a cabo utilizando variantes de secuencia de amplicón (ASV). Los ASV raros, presentes en menos del 10% de las muestras, se eliminaron de la tabla de ASV, lo que resultó en un total de 1,530 ASV. Se calcularon tres métricas diferentes de diversidad alfa, Shannon, Chao1 y ASV observadas, a partir de la tabla de recuento de ASV filtrada enrarecida a la profundidad de secuenciación mínima utilizando el paquete vegano en R. Para determinar si el baño diario afecta la diversidad alfa, se utilizó un modelo mixto lineal que incluía el día como efecto fijo y la identidad del perro como efecto aleatorio [diversidad alfa ~ día + (1|nombre del perro)]. Además, se construyó un modelo mixto lineal que incluye puntuaciones de día, piel y pelaje, y su interacción como efectos fijos y la identidad del perro como un efecto aleatorio [diversidad alfa ~ día * variable + (1 | nombre del perro)] y se utilizó para identificar cualquier efecto de confusión en el baño diario.
2.5. Análisis de diversidad beta
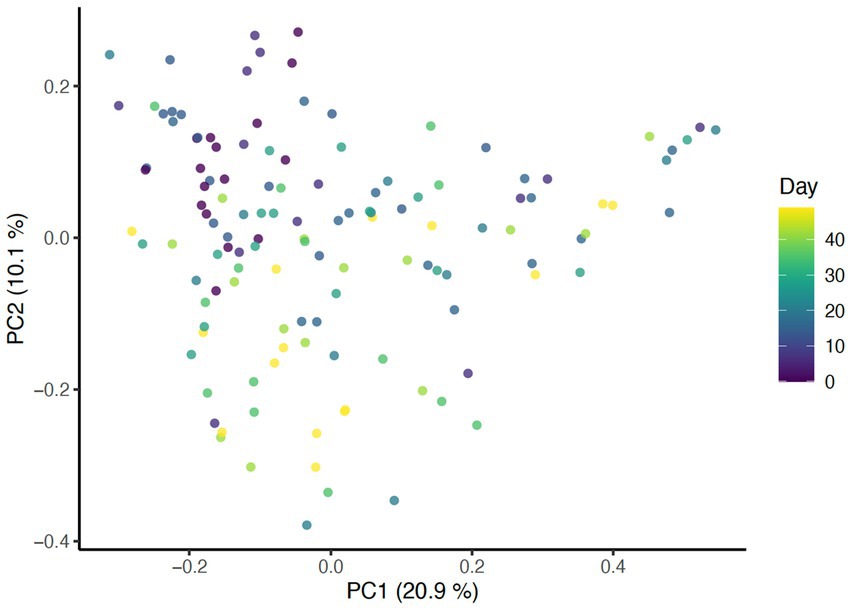
El análisis de la diversidad beta se llevó a cabo utilizando tres métodos de distancia diferentes: Bray-Curtis, UniFrac no ponderado (considera solo la ausencia de presencia) y UniFrac ponderado (explica la abundancia de taxones). Para determinar el impacto del día de estudio en la diversidad beta, se generó un gráfico de Análisis de Coordenadas Principales (PCoA) que incluye todas las muestras coloreadas por días (Figura 1) Además, se utilizó la función envfit del paquete vegano en R para evaluar los cambios en la diversidad beta a lo largo de los días de estudio, así como los efectos asociados con las puntuaciones de condición de la piel y el pelaje (Figura 2).
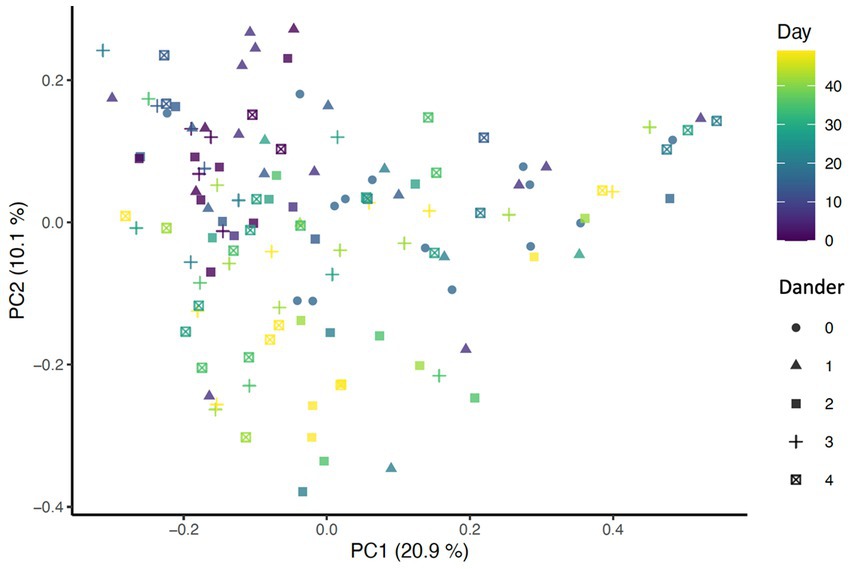 Figura 2. PCoA de la distancia Bray-Curtis coloreada por día (p = 0,001, R2° = 0,27) y moldeado por la puntuación de la caspa (p = 0,025, R2° = 0,0708).
Figura 2. PCoA de la distancia Bray-Curtis coloreada por día (p = 0,001, R2° = 0,27) y moldeado por la puntuación de la caspa (p = 0,025, R2° = 0,0708).
2.6. Abundancia diferencial
Se realizaron análisis de abundancia diferencial en todos los niveles taxonómicos, incluidos Filo, Orden, Familia, Género, ASV. Para tener en cuenta la composicionalidad de los datos de la microbiota, los recuentos brutos de taxones se transformaron en distribuciones de abundancia transformadas por Centered Log Ratio (CLR) utilizando el muestreo de Monte-Carlo (MC) (N = 20 instancias) como se implementó en el paquete ALDEx2 R. Para evaluar los cambios en la abundancia de taxones relacionados con el baño diario, se creó un modelo mixto lineal que incluye el día como efecto fijo y la identidad del perro como un efecto aleatorio para cada taxón en cada instancia de MC de abundancias transformadas en CLR: taxón ~ día + (1|nombre del perro). Además, se construyó un modelo mixto lineal que incluía puntuaciones de día, piel y pelaje, y su interacción como efectos fijos e identidad del perro como un efecto aleatorio [taxón ~ día * variable + (1|nombre del perro)] y se utilizó para identificar cualquier efecto de confusión en el baño diario.
El valor bruto de ps se recogió dentro de cada instancia de MC y se corrigió para pruebas de hipótesis múltiples (prueba de múltiples taxones) utilizando el método de Benjamini-Hochberg (BH). El valor promedio esperado de p en todas las instancias de MC se calculó para los valores p brutos y corregidos de BH y se informó como resultado final. Para cualquier taxón significativo, se generaron diagramas de dispersión de abundancia de taxones transformados por CLR a lo largo del tiempo con una línea lisa superpuesta de regresión LOESS. Además, si un taxón se asoció significativamente con una evaluación visual, se crearon diagramas de caja / gráficos de tiras de esa variable (Figura 3).
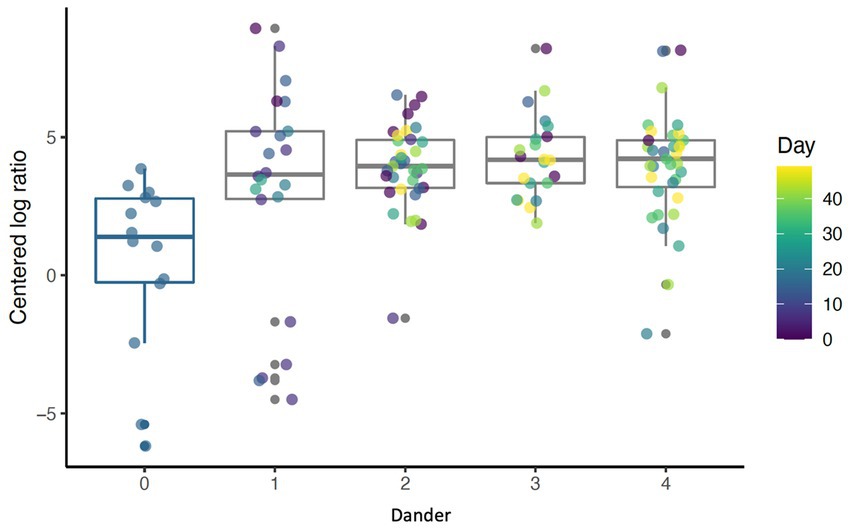 Figura 3. Diagrama de caja que muestra la abundancia de cianobacterias para diferentes niveles de caspa trasera (p < 0,001) por día (p = 0,69).
Figura 3. Diagrama de caja que muestra la abundancia de cianobacterias para diferentes niveles de caspa trasera (p < 0,001) por día (p = 0,69).
3. Resultados
3.1. Diversidad alfa
Los resultados muestran que el baño diario aumentó la diversidad de Shannon (p < 0,001), Chao1 (p < 0,001) y el número de ASV observados (p < 0,001) a lo largo del estudio (Figura 4). La diversidad alfa para cada medida alcanzó su punto máximo en el día 35. La condición del pelaje afectó el índice Chao1 (p = 0,018). Chao1, que mide la riqueza de las muestras, aumentó en la puntuación más baja de la condición del pelaje (puntuación = 1). Esto revela una relación inversa entre la riqueza de especies de la microbiota dérmica y la puntuación de la condición del pelaje. Además, la caspa del pelaje impactó a Chao 1 (p = 0.039) con Chao 1 más bajo en la puntuación de caspa de 1 y más alta con una puntuación de 2 (Figura 5). A medida que aumentaban los puntajes de caspa y aumentaba la riqueza de especies, pero a medida que mejoraba la condición del pelaje (y aumentaban los puntajes), la riqueza disminuía. La condición del pelaje y los cambios en la caspa de la espalda no interactuaron con los cambios asociados con los cambios del día del estudio.
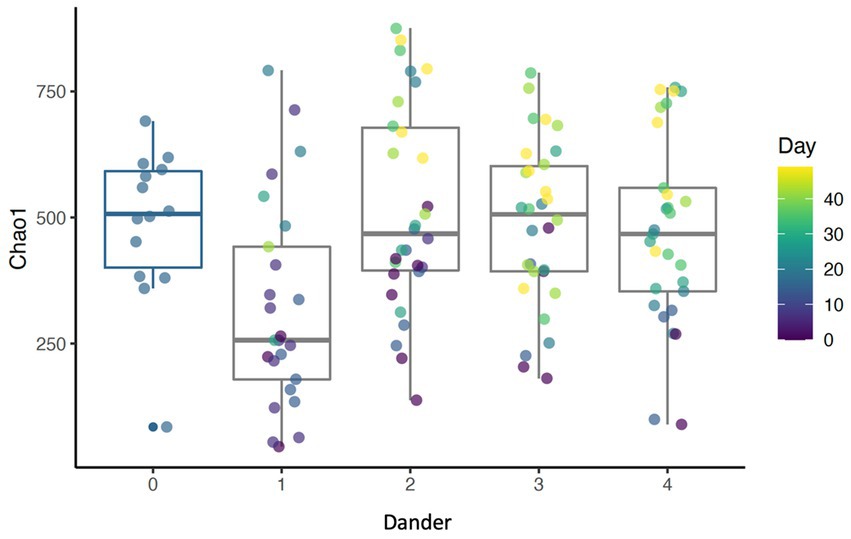 Figura 5. Diagrama de caja que muestra el índice Chao1 para diferentes niveles de caspa trasera (p = 0.0389).
Figura 5. Diagrama de caja que muestra el índice Chao1 para diferentes niveles de caspa trasera (p = 0.0389).
3.2. Diversidad beta
La presencia de taxones se vio afectada por el baño diario, ya que las distancias UniFrac no ponderadas fueron significativamente diferentes entre días (p = 0,001, R2° = 0,27). Como era de esperar, las muestras del mismo perro mostraron mayor similitud en comparación con las muestras de otros perros (p = 0,001, R2° = 0,31) (Figura 6). Cuando se consideró la abundancia de taxones, las distancias ponderadas de UniFrac no se vieron afectadas por el día (p = 0,851, R2° = 0,00266) pero permanecieron agrupados por perro (p = 0,001, R2° = 0,345). Estos datos indican que la abundancia de taxones no se vio afectada por el baño diario, solo la presencia o ausencia de taxones específicos.
También se encontraron asociaciones significativas entre las métricas de diversidad beta y la condición del pelaje, el brillo del pelaje y la caspa de la espalda, lo que indica que cada variable contribuyó a las diferencias entre las muestras. Usando la distancia de Bray-Curtis, la condición del pelaje (p = 0.052), el brillo del pelaje (p = 0.004) y la caspa de la espalda (p = 0.025) (Figura 2) se asociaron con cambios en la composición de la microbiota dérmica. Al controlar estas variables dentro del modelo estadístico, la diferencia en la composición microbiana entre días permaneció significativa (p = 0,001, R2° = 0,27) (Figura 1), En consecuencia, los efectos de la distancia de Bray-Curtis parecen ser independientes de cualquier efecto relacionado con el día de estudio.
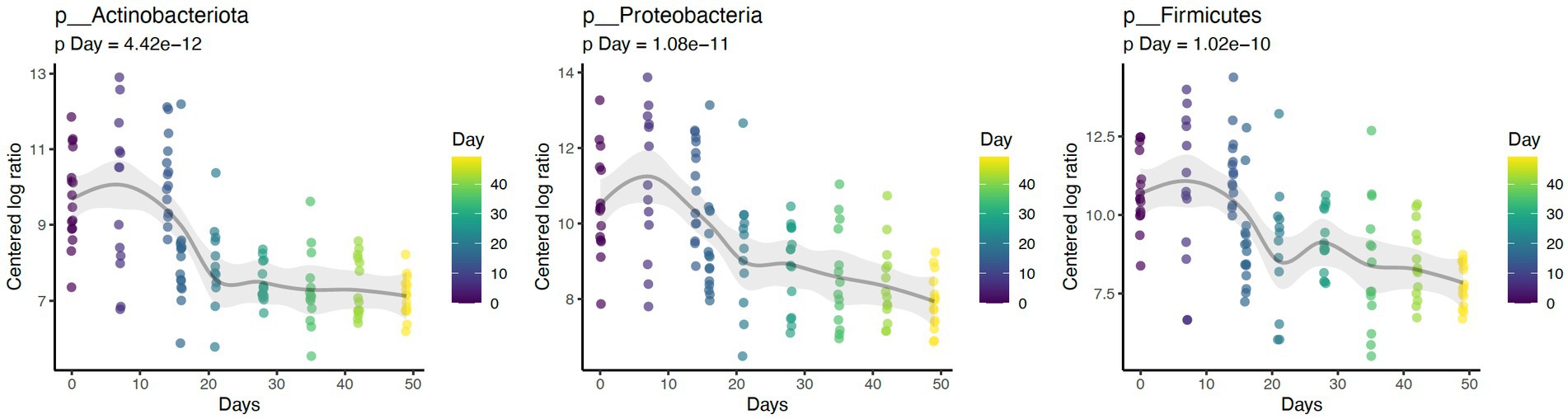
3.3. Abundancia diferencial
El baño diario disminuyó significativamente la abundancia relativa de bacterias comúnmente predominantes, incluyendo Actinobacteria (p < 0,001), Firmicutes (p < 0,001) y Proteobacteria (p < 0,001) (Figura 7). Además, la abundancia de 60 taxones a nivel de género cambió significativamente por el baño diario. Los 25 más abundantes se muestran en un mapa de calor (Figura 8). Las cianobacterias se relacionaron significativamente con la caspa (p < 0,001) pero no con el día (p = 0,69). Además, no hubo interacción para los cambios en las cianobacterias para el día y las puntuaciones de la caspa (p = 0,856). Sin embargo, es importante tener en cuenta que la abundancia de cianobacterias aumentó con el aumento de las puntuaciones de caspa (Figura 3).
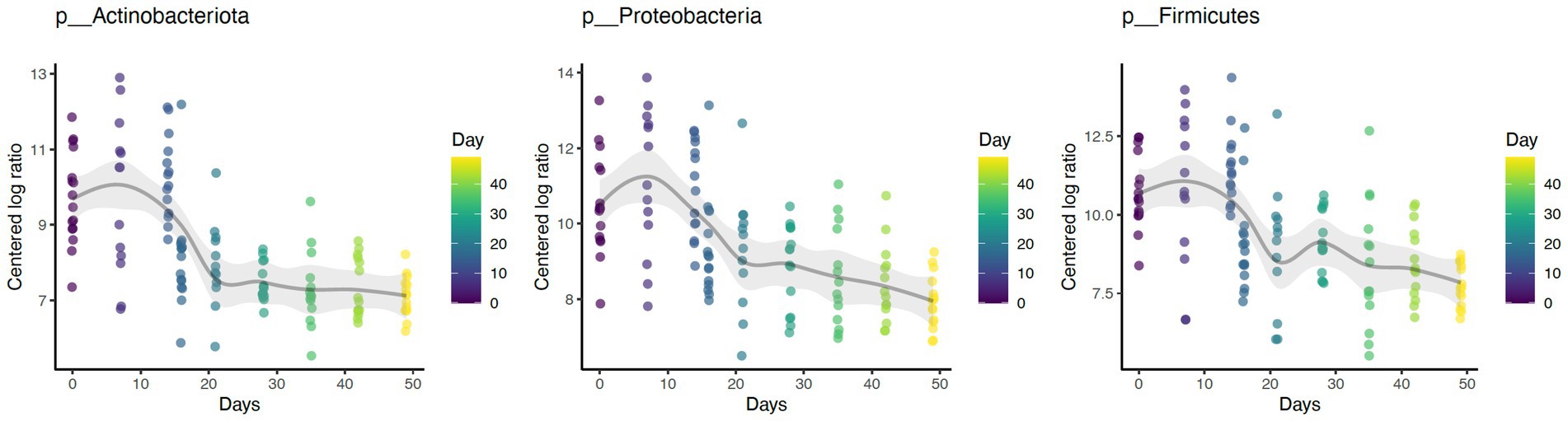 Figura 7. El baño diario disminuyó la abundancia de taxones Actinobacteria (p < 0,001), Firmicutes (p < 0,001) y Proteobacteria (p < 0,001) a nivel de Phylum.
Figura 7. El baño diario disminuyó la abundancia de taxones Actinobacteria (p < 0,001), Firmicutes (p < 0,001) y Proteobacteria (p < 0,001) a nivel de Phylum.
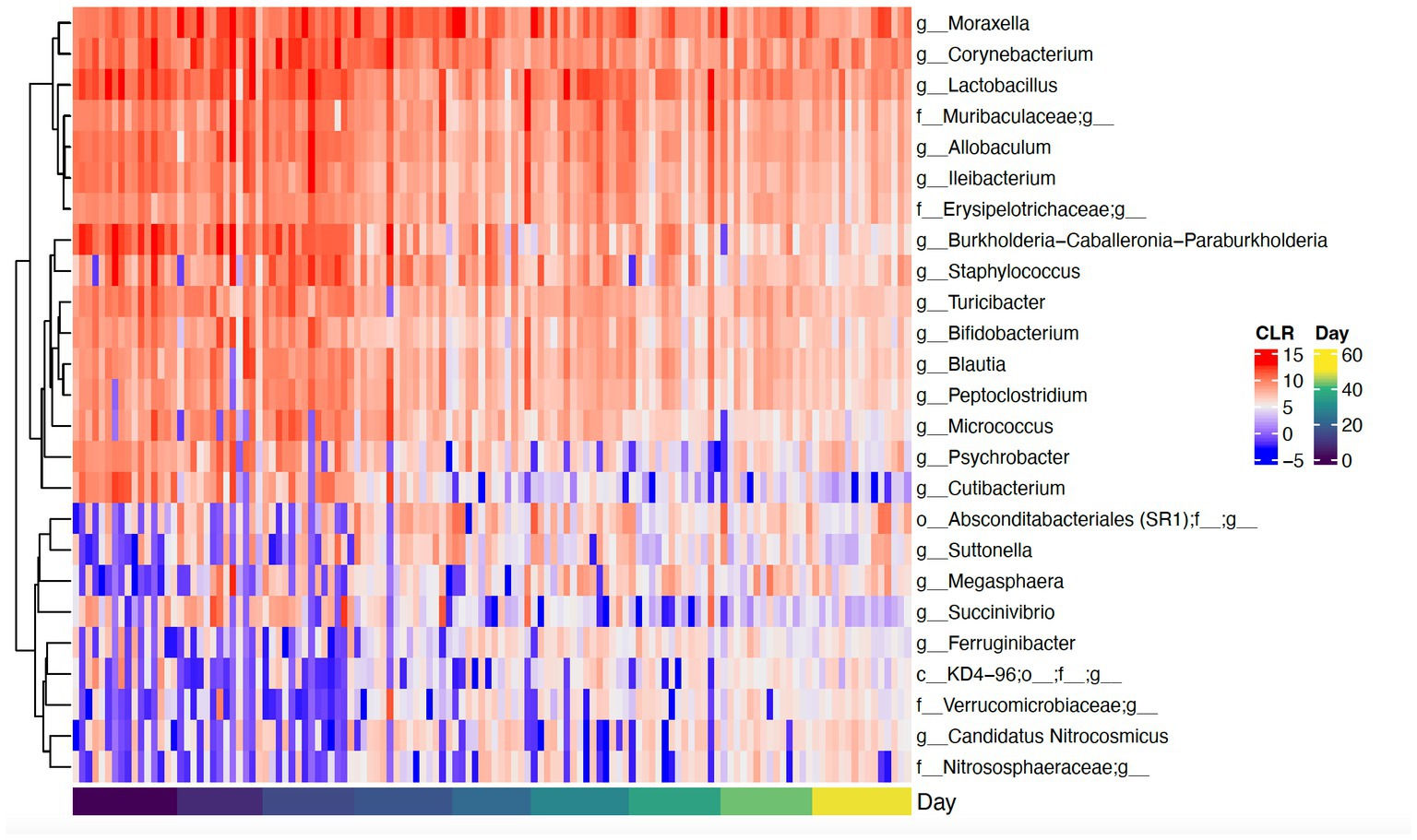 Figura 8. Mapa de calor que muestra abundancias transformadas por CLR de los 25 géneros más abundantes que cambiaron significativamente con el tiempo. Si un género no está clasificado, su nivel taxonómico más alto se muestra en el mapa de calor.
Figura 8. Mapa de calor que muestra abundancias transformadas por CLR de los 25 géneros más abundantes que cambiaron significativamente con el tiempo. Si un género no está clasificado, su nivel taxonómico más alto se muestra en el mapa de calor.
4. Discusión
Una mejor comprensión de la microbiota dérmica canina es un área importante de investigación y es un componente crucial de la salud dérmica canina. Los informes anteriores de los taxones presentes se han centrado en organismos asociados con estados de enfermedad como la dermatitis atópica (EA) (5). Si bien las recomendaciones de descontaminación anteriores han incluido el uso de detergente para platos o un limpiador alcalino para caninos que trabajan y reciben descontaminación diariamente (25), los datos presentados aquí desafían esas recomendaciones. Además, esto está respaldado por la irritación de la piel documentada después de la descontaminación diaria con detergente para platos en perros durante un despliegue (24). Los datos presentados aquí proporcionan evidencia adicional con respecto a los cambios en la composición microbiana dérmica asociados con recomendaciones previas para el uso de detergente para platos.
Los estudios de microbiota dérmica en caninos que experimentan EA han reportado diferencias clave entre las poblaciones de caninos con piel sana y las poblaciones de caninos con EA (1, 3, 5, 28). En general, los caninos que están sanos y los caninos con EA tienen los mismos taxones generales presentes, pero la abundancia de esos taxones difiere según el estado de salud (1, 3). Se informa que los caninos de estos estudios tienen filos predominantes que incluyen Proteobacteria, Firmicutes, Actinobacteria, Bacteroidetes y nivel de cianobacterias (1, 2, 4). Sin embargo, se informaron hallazgos contradictorios en caninos que sufrían de EA con un número general menor de taxones observados presentes que los perros sanos (2). Estas diferencias pueden explicarse por diferentes tipos de pelaje, ubicaciones anatómicas o diferentes razas de población de estudio. Sin embargo, los estudios previos coinciden consistentemente en que la abundancia relativa está asociada con la EA y algunos taxones clave se vuelven más abundantes en comparación con los controles sanos.
Similar a trabajos anteriores, este estudio identificó Proteobacteria, Firmicutes y Actinobacteriota como los filos dominantes (1, 2, 4). El estudio diario del baño afectó la composición microbiana, ya que las distancias UniFrac no ponderadas se agruparon significativamente a lo largo del día del estudio. Además, el baño diario aumentó significativamente la diversidad de Shannon, Chao1 y el número de ASV observados. Estos resultados indican que la riqueza de especies, así como la abundancia de esas especies, difirieron a lo largo del estudio, y se observaron mayores impactos durante el baño del período de baño activo. La diversidad aumentó después de dejar de bañarse y continuó durante toda la línea de tiempo del estudio, pero no pudo volver a las medidas de referencia. Estos resultados pueden indicar una mayor riqueza de especies, así como una mayor abundancia de esas especies en el microbioma dérmico provocado por el baño repetido con solución de detergente para platos.
Es interesante observar que, según las tendencias de los resultados presentados, las medidas más bajas de diversidad alfa se observaron el día 7. Esta tendencia puede indicar que los impactos negativos a los taxones residentes ya habían ocurrido después de una sola semana de descontaminación diaria con una solución detergente para platos muy diluida. Sin embargo, se requieren pruebas adicionales para comprender mejor la velocidad a la que la microbiota dérmica se ve comprometida y a la que también puede recuperarse.
Los cambios reportados en la diversidad alfa fueron acompañados por cambios en la abundancia relativa de la microbiota dérmica más predominante durante el baño diario repetitivo, con disminuciones en la abundancia de estos taxones por debajo de las mediciones basales originales a lo largo del estudio. Estos hallazgos, junto con los cambios en los índices de diversidad alfa, confirman que el baño en serie tuvo impactos duraderos en los taxones dérmicos de los caninos. Sin embargo, actualmente se desconoce si estos cambios son beneficiosos o no. Es posible que el tratamiento de baño haya disminuido la abundancia de los taxones más dominantes, lo que permite a los taxones no residentes utilizar más recursos y aumentar su presencia. Esta teoría puede ser apoyada por disminuciones en la diversidad alfa observadas en el día 7. Los filos predominantes en este estudio (Proteobacteria, Firmicutes y Actinobacteriota) alcanzaron su punto máximo en abundancia a los 7 días, después de lo cual su abundancia disminuyó, lo que podría dar lugar a una mayor riqueza de especies. El aumento de la riqueza puede no ser beneficioso en todos los casos. Es posible que estos cambios puedan conducir a dermatitis atópica como se sugirió anteriormente (1-3). Además, existe un posible riesgo asociado con el aumento de la colonización de patógenos zoonóticos presentes en el ambiente donde el canino puede vivir y/o trabajar.
No está claro a partir de estudios previos si los cambios en la presencia y abundancia de taxones son el resultado de la enfermedad dérmica a través de la disminución de la disponibilidad de nutrientes (agua y lípidos) o por la integridad de la barrera dérmica alterada. Sin embargo, los autores han concluido que los cambios en el perfil microbiano son una indicación de cambios en la salud dérmica (29, 30). El trabajo adicional debería identificar mejor la relación entre la microbiota dérmica, la enfermedad de la piel y la disfunción de la barrera a través de mediciones como la pérdida de agua transepidérmica (TEWL) y el pH cutáneo (31, 32).
Varios estudios mencionados anteriormente han encontrado que el aumento de la abundancia en Staphylococcus se asocia principalmente con AD en caninos (2, 3, 5). Los datos presentados aquí demuestran un aumento significativo en la abundancia de Staphylococcus que alcanza su punto máximo durante el tiempo de baño en serie y luego cae por debajo de los valores de referencia cuando cesa el baño diario. Este hallazgo puede indicar que el baño diario repetitivo de los perros con detergente para platos aumenta el riesgo de EA o infección. El aumento del riesgo puede ser el resultado de una mayor exposición a la humedad en la piel, así como los efectos limpiadores del pH dérmico que pueden facilitar un ambiente preferencial para que Staphylococcus prospere. Aunque este trabajo no informa más allá del género, si estas especies de Staphylococcus aumentadas son patógenos potenciales como S. pseudintermedius o S. aureus, los hallazgos podrían indicar un mayor riesgo para los manipuladores y compañeros de equipo. El trabajo futuro debe identificar si los cambios en Stapylococcus por especies asociadas con baños repetitivos dan lugar a patógenos zoonóticos como se describe.
Estudios anteriores han identificado una posible relación entre las puntuaciones de la condición del pelaje y la caspa con la salud de la piel (27, 33, 34). Los hallazgos presentados aquí proporcionan evidencia adicional de la relación entre la microbiota dérmica y la condición del pelaje y la caspa. Estos hallazgos son novedosos y ofrecen más evidencia de que la microbiota dérmica desempeña un papel crucial en la salud dérmica. Además, estos datos sugieren que la asociación entre las características visuales y la microbiota dérmica se basa en cambios significativos en la diversidad beta utilizando las distancias de Bray-Curtis. Estas diferencias indican que las evaluaciones visuales representaron una cantidad significativa de la diferencia entre las muestras cuando se toma en consideración tanto la presencia de los taxones como la abundancia relativa. Los valores de diversidad alfa de la riqueza de especies (Chao 1) fueron significativamente diferentes según la condición del pelaje además de la caspa. Esto indica que a medida que la caspa se hace más evidente (las puntuaciones aumentaron) la riqueza de especies disminuyó, pero a medida que la condición del pelaje mejoró (y las puntuaciones aumentaron) la riqueza de especies disminuyó. Estos son hallazgos contradictorios; Sin embargo, es posible que el aumento de la producción de lípidos como parte de la curación dérmica haya tenido un efecto sobre la condición del pelaje (35). Por último, la abundancia de varios taxones individuales cambió junto con las evaluaciones visuales. Un ejemplo es el cambio en las cianobacterias en relación con la caspa. La abundancia de cianobacterias aumentó a medida que aumentaba la puntuación de la caspa. El aumento de la abundancia de cianobacterias es de particular preocupación debido a las citotoxinas (carcinógenos conocidos) que se crean como metabolitos secundarios (36). La investigación adicional debe examinar los cambios individuales en los taxones y las posibles relaciones con los cambios en el pelaje y la salud dérmica.
Es evidente que la descontaminación en serie de los caninos en este estudio condujo a cambios duraderos en la microbiota dérmica de los caninos. Trabajos anteriores han demostrado que la microbiota dérmica se extiende más allá de la superficie de la epidermis hacia la dermis (37) y, por lo tanto, los trabajos futuros sobre prácticas de descontaminación y baño deben investigar los efectos de la microbiota dérmica más allá de la superficie de la epidermis. Otros estudios han observado que la composición y abundancia de los taxones puede ser alterada por la ubicación anatómica. El trabajo futuro también debe tomar muestras de varias anatomías para identificar posibles diferencias (1).
Aunque se desconoce la naturaleza completa de la relación entre la microbiota dérmica y la salud dérmica, los cambios en la microbiota dérmica asociados con la aparición de caspa es otro hallazgo que parece apoyar una estrecha relación. También es importante tener en cuenta que el limpiador utilizado en los protocolos de descontaminación empleados para este estudio es más diluido que el utilizado típicamente en el campo. El detergente para platos utilizado en el campo generalmente no está diluido y, por lo tanto, puede causar daños aún mayores. Por lo tanto, el trabajo futuro debe buscar limpiadores alternativos efectivos y / o métodos que estén aprobados para uso veterinario que puedan tener efectos disminuidos en la barrera dérmica y la microbiota del canino.
5. Conclusión
El baño repetitivo con detergente para platos altamente diluido para simular prácticas de descontaminación tuvo un impacto significativo en la microbiota residente en la piel canina. De estos cambios hay un aumento en Staphylococcus, que se ha asociado previamente con dermatitis atópica (2, 3, 5) y del cual algunas cepas pueden implicar la salud humana (19, 20). Aunque el detergente para platos utilizado para los protocolos de descontaminación fue extremadamente diluido en comparación con la aplicación típica sin diluir comúnmente utilizada en el campo, los procedimientos afectaron a algunos de los taxones más prominentes de la microbiota dérmica canina sin recuperación a la abundancia basal dentro de los 35 días posteriores al baño final. Las tendencias de estos cambios en las métricas de diversidad alfa alcanzaron un mínimo en el día 7, que fue solo la mitad de la serie de baño, correspondiente a la mitad del tiempo de despliegue canino SAR estándar. Si estas prácticas se utilizan en el campo durante todo el tiempo de despliegue de 14 días, se espera que los caninos experimenten interrupciones similares, si no más graves, en la microbiota dérmica. También es posible que los efectos se vean después de 7 días, sin embargo, se necesita más trabajo para explorar más a fondo este hallazgo.
Además, estos datos revelan una relación hasta ahora inexplorada entre los cambios en la microbiota y la condición del pelaje y las puntuaciones de la caspa. Estas asociaciones apoyan que es posible que los cambios en la microbiota dérmica se puedan observar visualmente a través de cambios en las evaluaciones de la condición de la caspa y el pelaje.
6. Limitaciones del estudio
Como el estudio se estaba llevando a cabo en la primavera de 2020, la pandemia de COVID 19 resultó en la falta de acceso a una población de estudio más grande debido a las limitaciones de viaje para los técnicos del estudio. Otras limitaciones incluyen la falta de métodos basados en el cultivo y la falta de control de la población descontaminada solo con agua. El trabajo futuro debe probar los efectos de la descontaminación solo con agua, utilizar razas comúnmente utilizadas en disciplinas de trabajo, incluidos perros de servicio y terapia, e incluir análisis microbianos de varias regiones anatómicas para capturar una imagen más completa de todo el entorno dérmico y los impactos asociados con el baño.
Declaración de disponibilidad de datos
Los datos presentados en el estudio se pueden encontrar en el repositorio en línea Figshare. Figshare doi: 10.6084/m9.figshare.23403308 se puede encontrar en https://figshare.com/projects/Impacts_to_canine_dermal_microbiota_associated_with_repeated_bathing/169451.
Declaración ética
El estudio en animales fue revisado y aprobado por el Comité Institucional de Cuidado y Uso de Animales de la Universidad del Sur de Illinois (15-032) y el comité de ética de Royal Canin.
Contribuciones del autor
DD participó en el diseño del estudio, la recolección de datos, el análisis de datos, el análisis estadístico y la preparación del manuscrito. RK participó en el diseño del estudio, la recolección de datos, el análisis estadístico y la revisión de manuscritos. EP supervisó todos los aspectos. AW participó en el diseño del estudio y en la preparación y revisión del manuscrito. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Financiación
Todos los fondos del estudio fueron proporcionados por Royal Canin SAS, 650 Av. de la Petite Camargue, 30470 Aimargues, Francia.
Reconocimientos
Los autores declaran que este estudio recibió fondos de Royal Canin SAS, Aimargues, Francia. El financiador tuvo la siguiente participación en el estudio: los autores RK y AW fueron empleados por Royal Canin SAS durante el estudio y proporcionaron instalaciones y equipos para su uso durante el estudio.
Conflicto de intereses
RK y AW fueron empleados de Royal Canin SAS.
Los autores restantes declaran que la investigación se realizó en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1204159/full#supplementary-material
Referencias
1. Apostolopoulos, N, Glaeser, SP, Bagwe, R, Janssen, S, Mayer, U, Ewers, C, et al. Descripción y comparación de la microbiota de la piel y del canal auditivo de perros pastores alemanes no alérgicos y alérgicos mediante secuenciación de próxima generación. PLoS One. (2021) 16:E0250695–22. doi: 10.1371/journal.pone.0250695
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Hoffmann, AR, Patterson, AP, Diesel, A, Lawhon, SD, Ly, HJ, Steiner, M, et al. El microbioma de la piel en perros sanos y alérgicos. PLoS One. (2014) 9:E83197. doi: 10.1371/journal.pone.003197
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Bradley, CW, Morris, DO, Rankin, SC, Cain, CL, Misic, AM, Houser, T, et al. Evaluación longitudinal del microbioma cutáneo y asociación con microambiente y tratamiento en dermatitis atópica canina. J Investig Dermatol. (2016) 136:1182–90. doi: 10.1016/j.jid.2016.01.023
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Cuscó, A, Sánchez, A, Altet, L, Ferrer, L, Francino, O, Yeoman, CJ, et al. Las firmas individuales definen la composición y variabilidad de la microbiota de la piel canina. Front Vet Sci. (2017) 4:1–12. DOI: 10.3389/FVETS.2017.00006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Chermprapai, S, Ederveen, THA, Broere, F, Broens, EM, Schlotter, YM, van Schalkwijk, S, et al. El microbioma bacteriano y fúngico de la piel de perros sanos y perros con dermatitis atópica y el impacto de la terapia antimicrobiana tópica, un estudio exploratorio. Veterinario Microbiol. (2019) 229:90–9. doi: 10.1016/j.vetmic.2018.12.022
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Leverett, K, Manjarín, R, Laird, E, Valtierra, D, Santiago-Rodriguez, TM, Donadelli, R, et al. El consumo de alimentos frescos aumenta la diversidad del microbioma y promueve cambios en la composición de bacterias en la piel de los perros en comparación con los alimentos secos. Animales. (2022) 12:1881. doi: 10.3390/ani12151881
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Korting, HC, y Braun-Falco, O. El efecto de los detergentes en el pH de la piel y sus consecuencias. Clin Dermatol. (1996) 14:23–7. doi: 10.1016/0738-081X(95)00104-N
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Korting, HC, Kober, M, y Marcus Mueller, OB-F. Influencia de lavados repetidos con jabón y detergentes sintéticos sobre el pH y la flora residente de la piel de frente y antebrazo. Acta Derm Venereol. (1987) 67:41–7.
9. Korting, HC, Lukacs, A, Vogt, N, Urban, J, Ehret, W, and Ruckdeschel, G. Influence of the pH-value on the growth of Staphylococcus epidermidis, Staphylococcus aureus and Propionibacterium acnes in continuous culture. Int J Hyg Environ Med. (1992) 193:78–90.
10. Korting, HC, Hubner, K, Greiner, K, Hamm, G, y Braun-Falco, O. Diferencias en el pH de la superficie de la piel y la microflora bacteriana debido a la aplicación a largo plazo de preparaciones detergentes sintéticas de pH 5.5 y pH 7.0. Resultados de un ensayo cruzado en voluntarios sanos. Acta Derm Venereol. (1990) 70:429–31. DOI: 10.2340/0001555570429431
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Baranda, L, González-Amaro, R, Torres-Alvarez, B, Alvarez, C, and Ramírez, V. Correlation between pH and irritant effect of cleansers marketed for dry skin. Int J Dermatol. (2002) 41:494–9. doi: 10.1046/j.1365-4362.2002.01555.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Schmid-Wendtner, MH, y Korting, HC. El pH de la superficie de la piel y su impacto en la función de barrera. Skin Pharmacol Physiol. (2006) 19:296–302. DOI: 10.1159/000094670
13. Wetzels, SU, Strachan, CR, Conrady, B, Wagner, M, Burgener, IA, Virányi, Z, et al. Los lobos, los perros y los humanos en contacto regular pueden afectar mutuamente la microbiota de la piel del otro. Sci Rep. (2021) 11:17106–12. DOI: 10.1038/S41598-021-96160-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Misic, AM, Davis, MF, Tyldsley, AS, Hodkinson, BP, Tolomeo, P, Hu, B, et al. La microbiota compartida de humanos y animales de compañía evaluada a partir de sitios de transporte de Staphylococcus. Microbioma. (2015) 3:2. DOI: 10.1186/S40168-014-0052-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Kates, AE, Jarrett, O, Skarlupka, JH, Sethi, A, Duster, M, Watson, L, et al. Propiedad de mascotas en el hogar y diversidad microbiana de la microbiota intestinal humana. Las células frontales infectan microbiol. (2020) 10:73. DOI: 10.3389/fcimb.2020.00073
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Stull, JW, Brophy, J y Weese, JS. Reducir el riesgo de infecciones zoonóticas asociadas a mascotas. CMAJ. (2015) 187:736–43. doi: 10.1503/cmaj.141020
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Carroll, KC, Burnham, CAD y Westblade, LF. De los caninos a los humanos: importancia clínica del Staphylococcus pseudintermedius. PLoS Pathog. (2021) 17:E1009961. doi: 10.1371/journal.ppat.1009961
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Latronico, F, Moodley, A, Nielsen, SS, and Guardabassi, L. Enhanced adherence of methicillin-resistant Staphylococcus pseudintermedius sequence type 71 to canine and human corneocytes. Vet Res. (2014) 45:70. doi: 10.1186/1297-9716-45-70
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Tanner, MA, Everett, CL y Youvan, DC. Evidencia filogenética molecular para la transmisión zoonótica no invasiva de Staphylococcus intermedius de una mascota canina a un humano. J Clin Microbiol. (2000) 38:1628–31. doi: 10.1128/JCM.38.4.1628-1631.2000
20. Morris, DO, Lautenbach, E, Zaoutis, T, Leckerman, K, Edelstein, PH, and Rankin, SC. Potential for pet animals to harbor methicillin-resistant Staphylococcus aureus when resident with human MRSA patients. Zoonosis Salud Pública. (2012) 59:286–93. doi: 10.1111/j.1863-2378.2011.01448.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Gwaltney-brant, SM, Murphy, LA, Wismer, TA, y Albretsen, JC. Riesgos toxicológicos generales de medicina y riesgos para perros de búsqueda y rescate que responden a desastres urbanos. J Am Vet Med Assoc. (2003) 222:292–5. doi: 10.2460/javma.2003.222.292
22. Yeh, PJ, Simon, DM, Millar, JA, Alexander, HF, y Franklin, D. Una diversidad de Staphylococcus spp. resistentes a los antibióticos en un sistema de transporte público. Osong Public Health Res Perspect. (2011) 2:202–9. doi: 10.1016/j.phrp.2011.11.047
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Conceição, T, Diamantino, F, Coelho, C, De Lencastre, H, and Aires-de-Sousa, M. Contamination of public buses with MRSA in Lisbon, Portugal: a possible transmission route of major MRSA clones within the community. PLoS One. (2013) 8:1–7. doi: 10.1371/journal.pone.0077812
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Gordon, LE. Lesiones y enfermedades entre perros de búsqueda y recuperación y búsqueda y rescate certificados por la Agencia Federal para el Manejo de Emergencias desplegados en Oso, Washington, después del deslizamiento de tierra de la ruta estatal 22 del 2014 de marzo de 530. J Am Vet Med Assoc. (2015) 247:901–8. doi: 10.2460/javma.247.8.901
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Gordon, L. Canine decontamination: guidelines for emergency, gross, and technical decontamination of the urban search and rescue canine. J Vet Behav. (2009) 4:248–9. doi: 10.1016/j.jveb.2009.05.023
26. Grammer-West, NY, Fitzpatrick, JE, Jackson, RL, Horton, H, y Damiano, MA. Comparación de la irritación de los líquidos para lavar platos a mano con métodos modificados de prueba de parche. J Am Acad Dermatol. (1996) 35:258–60. doi: 10.1016/S0190-9622(96)90344-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Turner, GA, Hoptroff, M, and Harding, CR. Disfunción del estrato córneo en la caspa. Int J Cosmet Sci. (2012) 34:298–306. doi: 10.1111/j.1468-2494.2012.00723.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Rodriguez-Campos, S, Rostaher, A, Zwickl, L, Fischer, N, Brodard, I, Vidal, S, et al. Impacto de la microbiota cutánea de los primeros años de vida en el desarrollo de dermatitis atópica canina en una cohorte de nacimiento de raza de alto riesgo. Sci Rep. (2020) 10:1044–14. DOI: 10.1038/S41598-020-57798-X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Meason-Smith, C, Diesel, A, Patterson, AP, Older, CE, Mansell, JM, Suchodolski, JS, et al. ¿Qué vive en la piel de tu perro? Caracterización de la micobiota cutánea canina y disbiosis fúngica en dermatitis alérgica canina. FEMS Microbiol Ecol. (2015) 91:1–12. DOI: 10.1093/femsec/FIV139
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Santoro, D, Marsella, R, Pucheu-Haston, CM, Eisenschenk, MNC, Nuttall, T, and Bizikova, P. Review: pathogenesis of canine atopic dermatitis: skin barrier and host-micro-organism interaction. Veterinario Dermatol. (2015) 26:84–E25. DOI: 10.1111/VDE.12197
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Kikuchi, K, Asano, M, Tagami, H, Kato, M, and Aiba, S. Comparison of the measuring efficacy of transepidermal water loss of a reasonable priced, portable closed-chamber system device H4500 with that of rather expensive and conventional devices such as Tewameter and Vapometer®®. Skin Res Technol. (2017) 23:597–601. doi: 10.1111/srt.12377
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Matouskek, JL, y Karen, LC. Una revisión comparativa del pH cutáneo. Veterinario Dermatol. (2002) 13:293–300. doi: 10.1046/j.1365-3164.2002.00312.x
33. Johnson, LN, Heinze, CR, Linder, DE, y Freeman, LM. Evaluación de declaraciones de marketing, ingredientes y perfiles nutricionales de dietas de venta libre comercializadas para la salud de la piel y el pelaje. J Am Vet Med Assoc. (2015) 246:1334–8. doi: 10.2460/javma.246.12.1334
34. Kirby, NA, Hester, SL, Rees, CA, Kennis, RA, Zoran, DL y Bauer, JE. Lípidos de la superficie de la piel y condición del pelaje de la piel y el pelo en perros alimentados con dietas de grasa total aumentadas que contienen ácidos grasos poliinsaturados. J Anim Physiol Anim Nutr (Berl). (2009) 93:505–11. doi: 10.1111/j.1439-0396.2008.00832.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Grubauer, G, Feingold, KR, y Elias, PM. Relación de la lipogénesis epidérmica con la función de barrera cutánea. J Lipid Res. (1987) 28:746–52. doi: 10.1016/s0022-2275(20)38670-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Backović, DD, Tokodi, N, Nikolin, B, y Svirčev, Z. Cyanobacteria – enemigo insidioso de la piel? J Salud del agua. (2020) 18:314–30. DOI: 10.2166/WH.2020.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. García-Fonticoba, R, Ferrer, L, Francino, O, y Cuscó, A. La microbiota de la superficie, la dermis y el tejido subcutáneo de la piel del perro. Microbioma Anim. (2020) 2:34. DOI: 10.1186/S42523-020-00050-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: perro de trabajo, descontaminación, microbiota dérmica, canino, baño
Cita: Discepolo D, Kelley R, Watson A y Perry E (2023) Impactos en la microbiota dérmica canina asociada con el baño repetido. Frente. Vet. Sci. 10:1204159. doi: 10.3389/fvets.2023.1204159
Recibido: 11 de abril de 2023; Aprobado: 18 de julio de 2023;
Publicado: 09 agosto 2023.
Editado por:
Katarina Nenadović, Universidad de Belgrado, Serbia
Revisado por:
Janice Lauren Baker, Grupo Táctico Veterinario, Estados Unidos
Nemanja Zdravkovic, Instituto Científico Veterinario de Serbia, Serbia
Derechos de autor © 2023 Discepolo, Kelley, Watson y Perry. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Dakota Discepolo, Dakota.discepolo@siu.edu
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía