Investigación sobre la regulación de los rasgos de producción por microbiota gastrointestinal en vacas

Avances en la investigación sobre la regulación de los rasgos de producción por microbiota gastrointestinal en vacas lecheras
 Lily Liu1*
Lily Liu1*  Peifu Wu1
Peifu Wu1  Aiwei Guo1
Aiwei Guo1  Yajin Yang1
Yajin Yang1  Fenfen Chen1
Fenfen Chen1  Qin Zhang2,3
Qin Zhang2,3- 1Facultad de Ciencias de la Vida, Universidad Forestal del Suroeste, Kunming, China
- 2Facultad de Ciencia y Tecnología Animal, Universidad Agrícola de China, Beijing, China
- 3Facultad de Ciencia y Tecnología Animal, Universidad Agrícola de Shandong, Tai’an, China
La composición y abundancia de microorganismos en el tracto gastrointestinal de las vacas son complejas y extensas, y desempeñan un papel crucial en la regulación de la digestión y absorción de nutrientes, el mantenimiento de la estabilidad del tracto digestivo y la promoción de la producción y la salud del huésped. La fermentación llevada a cabo por estos microorganismos en el tracto gastrointestinal es fundamental para la salud y la productividad de las vacas. Los microorganismos del rumen producen la mayoría de las enzimas necesarias para descomponer los sustratos de alimentación, como celulosa, proteínas, lípidos y otros materiales vegetales, a través de la fermentación. Este proceso proporciona sustratos del metabolismo energético que satisfacen aproximadamente el 70% de los requisitos energéticos del huésped para las actividades fisiológicas. Los microorganismos intestinales descomponen principalmente la celulosa que es difícil de digerir en el rumen, proporcionando así calor y energía a los huéspedes. Además, tienen un impacto en la salud y la productividad del huésped a través de su papel en la función inmune. Comprender la composición y función de la microbiota intestinal de la vaca puede ayudar a regular los rasgos de cría del ganado lechero y mejorar su estado de salud. Como resultado, se ha convertido en un tema de investigación popular en la cría de ganado lechero. Este artículo proporciona una revisión de la composición, estructura, características fisiológicas y efectos fisiológicos de la microbiota intestinal de la vaca, sirviendo como base teórica para futuros estudios que tienen como objetivo utilizar la microbiota intestinal para la cría de ganado lechero o mejorar los rasgos de producción. También puede servir como referencia para la investigación sobre la microbiota intestinal de otros rumiantes.
1. Introducción
El tracto gastrointestinal, el principal órgano responsable de la digestión, absorción, secreción y función inmune en rumiantes como las vacas, alberga una población microbiana rica y diversa. La comunidad microbiana, que coexiste con el huésped y sufre cambios basados en el estado fisiológico del huésped, desempeña un papel vital en varios aspectos de la nutrición, el metabolismo y la función inmune del huésped (1). A pesar del volumen relativamente pequeño de la microbiota gastrointestinal, su número total supera los 100 billones, ejerciendo una influencia significativa en la salud general y la fisiología del huésped (2). La composición y estructura del microbio intestinal son cruciales para mantener la estabilidad y funcionalidad del sistema gastrointestinal del huésped. La fermentación microbiana en el tracto gastrointestinal de la vaca sirve como base para la producción de rumiantes y es un factor clave que permite a las vacas convertir alimentos de baja calidad en leche y carne de alta calidad. Este intrincado ecosistema consiste en diversos microorganismos, incluyendo bacterias, protozoos y hongos.
Actualmente, las bacterias son las más estudiadas dentro de la microbiota intestinal de la vaca. Estas bacterias juegan un papel vital en la digestión de materiales vegetales al producir enzimas que descomponen la fibra en ácidos grasos volátiles (AGV), proteínas, vitaminas y otros nutrientes. Estos metabolitos contribuyen a los requerimientos nutricionales de las vacas e influyen en los procesos metabólicos que finalmente afectan los rasgos de productividad (3, 4). Además, estas bacterias están involucradas en la conversión de energía, la absorción de nutrientes e incluso participan en procesos de inflamación y deposición de tejidos que afectan las actividades generales de la vida de las vacas (5). Estudios recientes han revelado que los cambios en la cantidad y abundancia de la microbiota intestinal de la vaca ocurren con la edad y la variación en la ingesta de alimento. Estos cambios juegan un papel crucial en la guía de la digestión de nutrientes, la absorción y la respuesta de inmunidad dentro del cuerpo de la vaca (6-9).
Por ejemplo, la relación Firmicutes/Bacteroidetes en el tracto gastrointestinal de la vaca (GIT) muestra una correlación positiva con el rendimiento de grasa láctea. Las variaciones en el cambio de abundancia de los microbios GIT están asociadas con genes relacionados con la producción de grasa láctea, lo que indica una estrecha relación entre los rasgos de rendimiento lácteo y los microbios GIT (10). Además, se han observado correlaciones significativas entre los niveles de expresión de genes relacionados con el metabolismo lipídico y los genes inmunes de la mucosa intestinal con microbios GIT, destacando el papel esencial de estos microbios como «órganos secretores» que contribuyen al equilibrio energético interno y la regulación inmune (11). La estructura comunitaria de la microbiota intestinal de la vaca es el resultado de la coevolución entre procariotas y eucariotas. Comprender las características fisiológicas y las funciones de la microbiota intestinal de las vacas es crucial para comprender su papel fundamental en la producción y la salud, lo que la convierte en un tema candente en campos de investigación como la cría lechera, la nutrición y la reproducción. Sin embargo, los mecanismos reguladores que rigen la microbiota intestinal de la vaca aún no se comprenden completamente. Esta revisión tiene como objetivo resumir las características y los efectos fisiológicos de la microbiota intestinal de la vaca, proporcionando una base teórica para estudios adicionales sobre la utilización de microorganismos gastrointestinales en la cría de ganado lechero y la mejora de la productividad. También sirve como una referencia valiosa para la investigación sobre comunidades microbianas gastrointestinales en otros rumiantes.
2. Estructura del tracto gastrointestinal de la vaca.
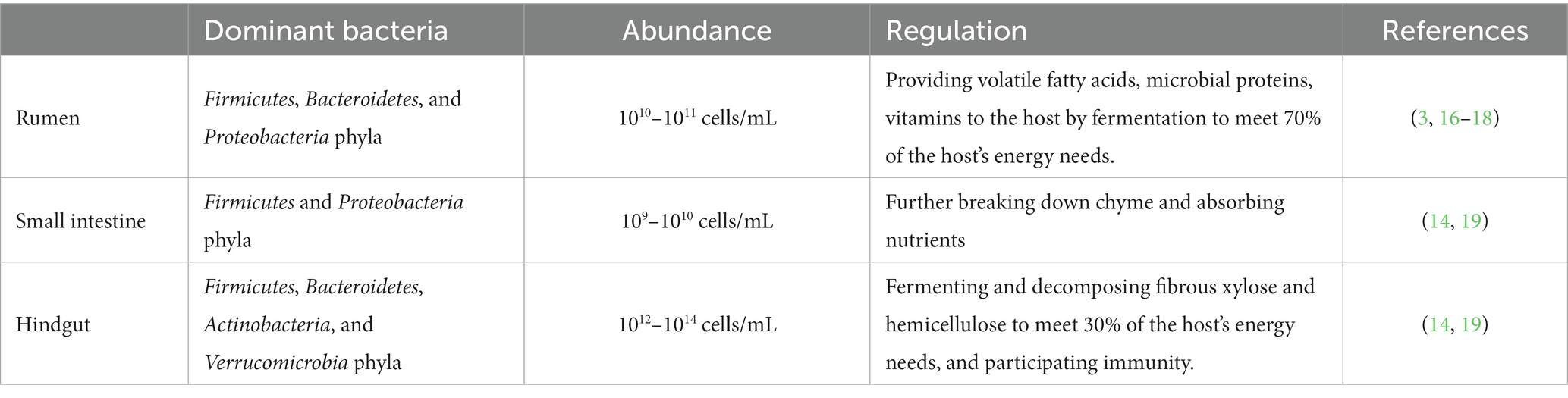
El tracto gastrointestinal de una vaca consta de varias partes, incluyendo el estómago, el duodeno, el yeyuno, el íleon, el ciego y el recto. El estómago de una vaca tiene cuatro cámaras: rumen, retículo, omaso y abomaso (también conocido como el estómago verdadero). El rumen es la cámara más grande, comprende aproximadamente el 80% del volumen total del estómago, y posee una gran capacidad y un ecosistema microbiano complejo (12). El intestino delgado en las vacas está compuesto por el duodeno, el yeyuno y el íleon, con una longitud promedio de 7-8 m en vacas adultas. Por otro lado, el intestino posterior consiste en el ciego, el colon y el recto, con una longitud promedio de 5-5.6 m en vacas adultas (13). El proceso de digestión en las vacas comienza en el rumen, seguido por el retículo, el omaso y el abomaso. En el rumen, la fermentación microbiana y la acción mecánica ayudan a descomponer la fibra cruda en nutrientes fácilmente absorbibles. El retículo y el omaso ayudan en una mayor digestión y absorción. El abomaso, considerado el estómago verdadero, digiere principalmente las proteínas de los alimentos parcialmente digeridos (quimo). A medida que el quimo entra en el duodeno, sufre una descomposición adicional por las enzimas digestivas liberadas por el páncreas, así como por la acción del jugo biliar. El intestino delgado, particularmente el duodeno, el yeyuno y el íleon, es responsable de la absorción de nutrientes, facilitada por la presencia de vellosidades que aumentan el área de superficie de la pared intestinal, mejorando la capacidad de absorción de nutrientes. Cualquier residuo de alimento restante se mueve hacia el intestino posterior, específicamente el ciego, donde tiene lugar la fermentación microbiana adicional. El producto final, las heces, se excreta a través del recto (14, 15).
3. Composición y características de los microbios en el tracto gastrointestinal de las vacas.
Los microorganismos son ubicuos en los ambientes donde residen los animales, siempre y cuando existan condiciones nutricionales adecuadas para su crecimiento. Las superficies expuestas al ambiente externo, como la piel, la cavidad oral, el tracto gastrointestinal, el sistema respiratorio y el sistema reproductivo, albergan comunidades microbianas. Entre estos, el tracto gastrointestinal proporciona un ambiente particularmente favorable para la colonización microbiana debido a la disponibilidad de nutrientes. El número de microbios presentes en el tracto gastrointestinal es notablemente alto, exhibiendo una amplia diversidad genética.
Los estudios han revelado que la microbiota gastrointestinal de las vacas comprende más de 1.800 géneros y 40.000 especies de bacterias, con un número total de bacterias que alcanza miles de millones. Estos números son 10-100 veces más altos que los números de la célula huésped. Además, el número de genes plásmidos transportados por estos microbios es aproximadamente 150 veces mayor que el número de genes encontrados en los huéspedes (1, 2, 10). Los microbios colonizan varias regiones a lo largo de toda la estructura del tracto gastrointestinal de la vaca, trabajando sinérgicamente para degradar la fibra en el alimento. Producen ácidos grasos volátiles, proteínas, vitaminas y otras sustancias que cumplen con los requerimientos nutricionales del huésped nutricional.
El rumen de una vaca adulta puede tener un volumen de hasta 180 L y contiene aproximadamente 1010~1011 bacterias/ml, 106 ~ 108 arqueas/ml, 104 ~ 106 protozoos/ml y 103 ~ 106 hongos/ml (3, 16). Entre estos microorganismos, las bacterias son las más abundantes en el rumen y se pueden clasificar en cuatro subgrupos: bacterias en fase líquida, bacterias en fase sólida, bacterias adherentes epiteliales del rumen y bacterias asociadas a eucariotas. Los estudios han demostrado que el rumen exhibe la mayor diversidad de especies bacterianas en comparación con otras partes del sistema digestivo, con un total de 47 géneros, incluidos 16 géneros ruminales específicos. Los filos dominantes en el rumen son Firmicutes, Bacteroidetes, y Prevotella, Fibrobacter y Succinivibrio son los principales géneros (17, 18).
A medida que el proceso digestivo progresa desde el rumen hasta el intestino delgado y luego el intestino posterior, el nivel de acidez disminuye gradualmente, acompañado de una reducción en el contenido de oxígeno, lo que resulta en un aumento tanto en la cantidad como en la abundancia de microbiota intestinal. En el intestino delgado y el intestino posterior, las bacterias son los microorganismos predominantes en la microbiota intestinal de la vaca. El intestino delgado contiene aproximadamente 109–1010 bacterias/ml, siendo Firmicutes y Proteobacteria los filos dominantes. En el intestino posterior, puede haber aproximadamente 1012 ~ 1014 bacterias/mL, con Firmicutes, Bacteroidetes, Actinobacteria y Verrucomicrobia como filos dominantes. Además, la abundancia relativa de estos filos bacterianos en el intestino delgado y el intestino posterior es mayor que en el rumen (14, 19) (como se muestra en la Tabla 1).
Numerosos estudios han puesto de relieve diferencias claras en las comunidades microbianas que se encuentran en el rumen, el intestino delgado y el intestino posterior de las vacas lecheras (5, 10, 20). Se ha demostrado que estas diferencias tienen un impacto directo en la función inmune y los rasgos de producción en las vacas (21, 22). Por lo tanto, la composición de la microbiota intestinal de la vaca juega un papel crucial en la determinación de su estado de salud y rasgos de producción. Investigar los patrones de variación y explorar las interacciones entre la microbiota intestinal de la vaca y los huéspedes se ha convertido en un área prominente y activa de investigación en los campos de la cría de ganado y la nutrición.
4. Funciones fisiológicas de los microorganismos gastrointestinales de las vacas
A medida que avanza la investigación sobre microorganismos gastrointestinales en animales, ha habido un cambio en el enfoque de los cambios en la composición, abundancia y diversidad a la comprensión de sus funciones biológicas. Los estudios han revelado que los microorganismos gastrointestinales en las vacas poseen una amplia gama de capacidades metabólicas y diversas funciones biológicas. Mantienen una relación simbiótica con la mucosa gastrointestinal del huésped y dependen de los componentes dietéticos y arrojan células epiteliales como fuentes de nutrición (5, 23). Estos microorganismos realizan principalmente funciones metabólicas como la absorción y conversión de ácidos grasos y aminoácidos. También juegan un papel protector y defensivo al reducir la absorción de sustancias tóxicas y prevenir la invasión de bacterias o patógenos dañinos. Además, tienen una función estructural en la regulación de la inmunidad del huésped a través de interacciones con la mucosa gastrointestinal, actuando como una barrera intestinal (1, 16).
4.1. Funciones nutricionales y metabólicas de la microbiota ruminal en vacas lecheras
Las vacas lecheras y otros rumiantes poseen una capacidad impresionante para convertir alimentos fibrosos de baja calidad en leche y productos cárnicos de alta calidad. Esta notable hazaña es posible, en gran parte, gracias a la microbiota ruminal (como se muestra en la Tabla 2).
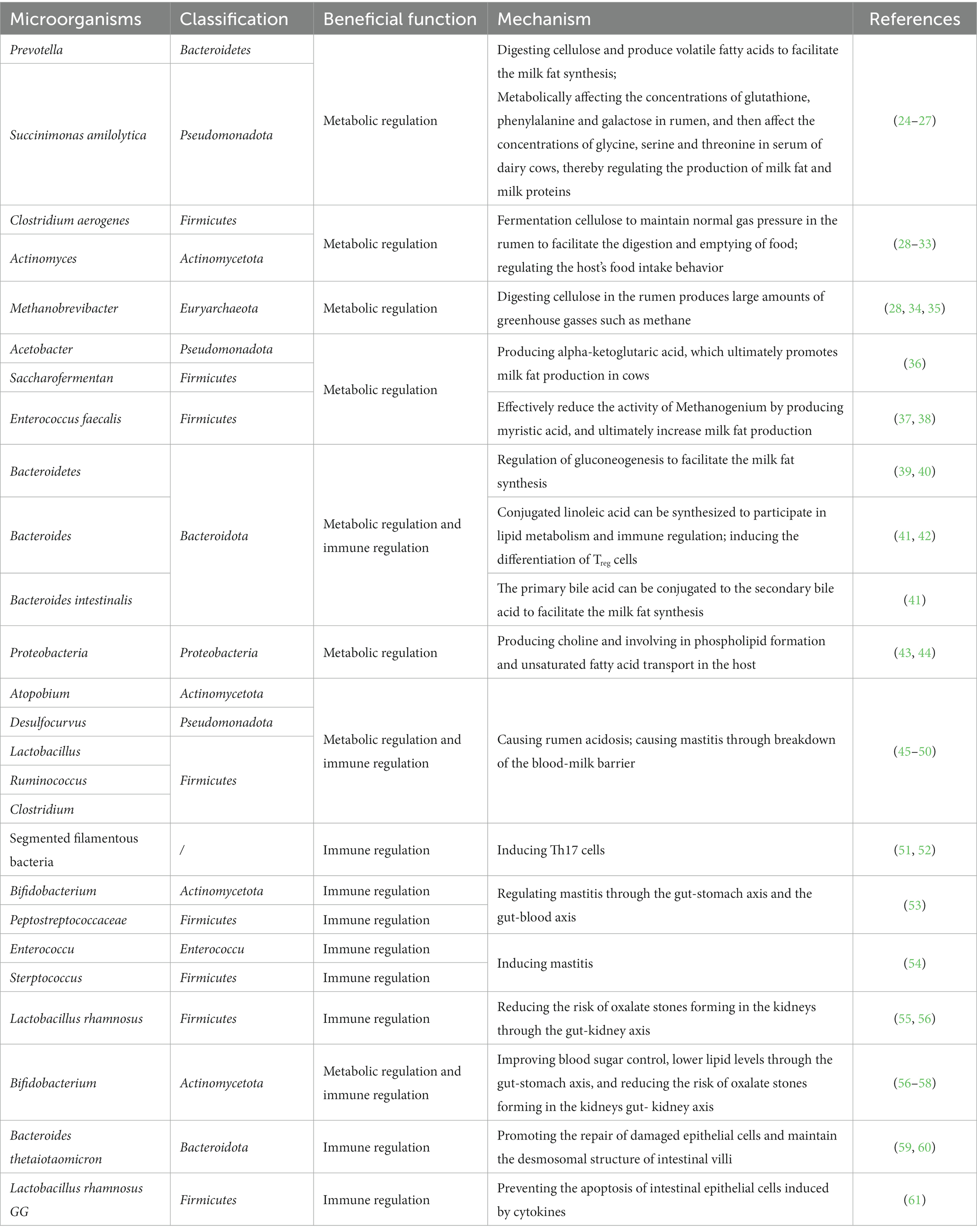 Tabla 2. Las funciones de los microorganismos gastrointestinales de la vaca en la producción y la salud.
Tabla 2. Las funciones de los microorganismos gastrointestinales de la vaca en la producción y la salud.
4.1.1. Microbiota ruminal
La fermentación de microorganismos en el rumen es la base de la producción de vacas lecheras. Estos microorganismos mantienen una relación sinérgica y simbiótica, proporcionando colectivamente la mayoría de las enzimas necesarias para descomponer los sustratos de alimentación. A través de la fermentación, degradan la celulosa, las proteínas y los lípidos en la alimentación de las plantas, produciendo ácidos grasos volátiles (AGV), proteínas microbianas y vitaminas como nutrientes para el huésped. Estos nutrientes sirven como sustratos para el metabolismo energético, satisfacen el 70% de las necesidades energéticas del huésped para actividades fisiológicas (62). Los estudios han demostrado que en las vacas con mayores tasas de conversión alimenticia, la diversidad y abundancia de microorganismos ruminales son menores, pero hay más bacterias que degradan la fibra. Por otro lado, las vacas con tasas de conversión alimenticia más bajas exhiben una mayor diversidad y abundancia de microorganismos, particularmente aquellos que producen gas (28, 29). Por ejemplo, Prevotella y Succinimonas amilolytica son relativamente abundantes en vacas con mayores tasas de conversión alimenticia. Estos microorganismos exhiben fuertes funciones de digestión de celulosa en las actividades enzimáticas de digestión de carbohidratos, lo que lleva a concentraciones más altas de AGV. Los ácidos grasos de cadena corta entran en el intestino delgado donde son emulsionados por la bilis y sintetizados en triglicéridos en las células de la mucosa intestinal. Luego se transportan al torrente sanguíneo en forma de quilomicrones, lipoproteínas de muy baja densidad, lipoproteínas de baja densidad y lipoproteínas de alta densidad. Después de la descomposición enzimática a través de las paredes capilares, se convierten en ácidos grasos libres y glicerol que son absorbidos por la glándula mamaria (25, 26). Dentro de las células epiteliales mamarias, una serie de enzimas actúan sobre ellas para volver a sintetizar los triglicéridos combinándolos con glicerol. Luego se incorporan al citoplasma como gotas de lípidos, combinadas con lipoproteínas como los fosfolípidos, y forman glóbulos de grasa láctea. Estos glóbulos son secretados extracelularmente a través de la secreción apocrina y entran en la leche, contribuyendo a la formación de grasa láctea (27). Además, estos microorganismos pueden regular potencialmente la expresión de genes clave en las células epiteliales del rumen, mejorando la digestión de la celulosa y la absorción y el metabolismo de nutrientes como los AGV. En última instancia, esto influye en el metabolismo de las grasas y la síntesis de componentes de la leche, como la grasa de la leche y la proteína de la leche, en las células epiteliales mamarias (27). En vacas con tasas de conversión alimenticia más bajas, microorganismos como Clostridium aerogenes, Actinomyces y Methanobrevibacter tienen mayor abundancia en el rumen. Estos microorganismos utilizan la fermentación de celulosa para producir gas, manteniendo la presión normal del gas en el rumen para promover la digestión y el vaciado de los alimentos. Sin embargo, Methanobrevibacter, que es más abundante en este contexto, produce una cantidad significativa de metano y otros gases de efecto invernadero a través de la digestión de la celulosa en el rumen. Esto no solo reduce las tasas de conversión alimenticia, sino que también tiene un impacto negativo en el cambio climático global (28, 34, 35). Estos hallazgos demuestran que los microorganismos del rumen pueden afectar la tasa de conversión alimenticia y, en consecuencia, los rasgos de producción del ganado vacuno de carne o lechero a través de sus funciones de metabolismo nutricional.
Además, los microorganismos ruminales pueden producir un gran número de metabolitos de moléculas pequeñas, que desempeñan un papel crucial en la transmisión de información microbiana y participan directamente en el metabolismo nutricional, los mecanismos transcripcionales y la epigenética del huésped, lo que permite la comunicación entre la microbiota y las células huésped (63). Los estudios han encontrado que los microorganismos del rumen pueden sintetizar ácidos grasos, particularmente ácidos grasos poliinsaturados. Estos ácidos grasos poliinsaturados entran en el intestino delgado en forma de fosfolípidos, formando fosfolípidos microbianos. Al aumentar la proporción de fosfolípidos microbianos en el intestino delgado, el contenido de ácidos grasos insaturados en la leche puede mejorarse significativamente, abordando así el menor contenido de ácidos grasos insaturados en algunas muestras de leche (64). Prevotella y Succinimonas amilolytica en el rumen pueden influir en las concentraciones de sustancias como el glutatión, la fenilalanina y la lactosa, afectando así las concentraciones de metabolitos como la glicina, la serina y la treonina en el suero de vaca, regulando en última instancia la síntesis de grasa láctea (24). Ciertos géneros de bacterias de cadena corta en el rumen pueden producir metionina, que promueve que Acetobacter y Saccharofermentans produzcan más alfa-cetoglutarato, lo que en última instancia facilita la síntesis de grasa láctea (36). Enterococcus faecalis puede reducir eficazmente la actividad del metanogenio en el rumen mediante la producción de ácido cinámico, lo que resulta en una disminución de la conversión de energía a gas metano, una mejor eficiencia de conversión alimenticia y una mayor producción de grasa láctea (38). Se han observado hallazgos similares en otros animales rumiantes, donde las bacterias del rumen pueden regular la gluconeogénesis mediante la modulación del metabolismo de los ácidos biliares. También pueden promover la excreción de colesterol metabolizando las sales biliares, regulando así la concentración de triglicéridos en la sangre (39, 40). En consecuencia, un número creciente de estudios están tratando de identificar microorganismos específicos o sus metabolitos en el rumen de las vacas lecheras para mejorar significativamente los rasgos de producción. Además, también se está explorando la alimentación de dietas y aditivos específicos para mejorar la abundancia de microorganismos beneficiosos en el rumen.
4.1.2. Microorganismos intestinales
La comunidad microbiana en el tracto intestinal de la vaca, como un componente relativamente independiente, participa principalmente en el metabolismo de los nutrientes del huésped a través de la producción de calor y las funciones metabólicas. La digestión de los alimentos en el rumen de la vaca forma quimo, que tiene un alto contenido de agua y baja resistencia a la transferencia de masa. Debido a la rápida frecuencia del peristaltismo en el intestino delgado, el quimo permanece por un corto tiempo en el intestino delgado. Sin embargo, cuando llega al intestino grueso, el vaciado de los residuos de alimentos se produce a un ritmo más lento en comparación con el intestino delgado, ya que el área transversal del intestino grueso es aproximadamente cuatro veces más grande. Esto proporciona tiempo suficiente para la fermentación y descomposición de los nutrientes que quedan en el quimo por la comunidad microbiana en el intestino posterior. Aunque el quimo es fermentado y digerido principalmente por los microbios en el rumen y el intestino delgado, ciertos componentes como la celulosa no digerible requieren la acción de los microbios del intestino posterior para la digestión. Los estudios han demostrado que aproximadamente el 30% de la fibrosa, la xilosa y la hemicelulosa se fermentan y descomponen en el intestino posterior, lo que indica que los procesos de fermentación en el intestino posterior siguen siendo una fuente de energía esencial para las vacas (65). Los estudios también han encontrado que la comunidad microbiana en el contenido de colon o heces de los rumiantes puede utilizar los residuos de alimentos no digeridos en el tracto intestinal para producir aproximadamente la mitad de la energía que necesita el huésped (30). Además, el número de enzimas metabólicas producidas por los microbios intestinales es mucho mayor que las producidas por los tejidos del huésped, como el hígado. Por ejemplo, las bacterias de los filos Bacteroidetes, Firmicutes, Proteobacteria y Actinobacteria, pueden descomponer la semicelulosa, que no puede ser digerida por el rumen de la vaca, y producir ácidos grasos de cadena corta que son absorbidos por la mucosa intestinal y sirven como sustratos para el metabolismo energético. Estos ácidos grasos de cadena corta se transportan a través de la sangre a varios órganos, proporcionando energía (30). Además, estos ácidos grasos de cadena corta pueden estimular la secreción de péptidos intestinales y participar en la regulación del metabolismo energético (66). Las bacterias Bacteroidetes contienen varias glicosiltransferasas, glucósidos hidrolasas y polisacáridos liasas, que son enzimas esenciales para el metabolismo de los carbohidratos en las vacas (67). Además, las bacterias Bacteroidetes pueden sintetizar ácido linoleico conjugado, que participa en el metabolismo de los lípidos y la regulación inmune. Bacteroides intestinalis puede convertir los ácidos biliares primarios en ácidos biliares secundarios a medida que se reabsorben y entran en las vías del metabolismo de los lípidos a través de quilomicrones (41). Las proteasas expresadas por los microbios intestinales también pueden trabajar junto con las proteasas del huésped para regular el metabolismo y la conversión de proteínas (68).
Además, la microbiota intestinal puede participar en el metabolismo de los nutrientes del huésped mediante la producción de un gran número de metabolitos de moléculas pequeñas. Por ejemplo, las bacterias de los filos Bacteroidetes, Firmicutes, Proteobacteria y Actinobacteria producen ácidos grasos de cadena corta, lipopolisacáridos y peptidoglicanos, que no solo participan directamente en el metabolismo del huésped sino que también regulan el comportamiento de ingesta de alimentos a través del eje intestino-cerebro-suprarrenal, produciendo glucagón pancreático, hormona del crecimiento y grelina (30-33). La bacteria Firmicutes puede producir carnitina, que activa la formación de tejido adiposo marrón y tejido adiposo beige en el huésped a través de la circulación, participando en el metabolismo de los lípidos (37). Las bacterias actinobacterias pueden producir colina, que participa en la formación de fosfolípidos y el transporte de ácidos grasos insaturados en el huésped (43). Estudios relevantes también han encontrado que los altos niveles de colina pueden aumentar la sensibilidad de la síntesis de grasa láctea en las vacas (44). Estas funciones del metabolismo nutricional de la microbiota intestinal desempeñan un papel dominante, especialmente en el desarrollo ruminal de terneros jóvenes, destacando la importancia de la función metabólica nutricional de la microbiota intestinal de la vaca junto con la microbiota ruminal.
4.2. Función inmunorreguladora de la microbiota gastrointestinal en vacas lecheras
La mucosa del tracto gastrointestinal de la vaca consiste en la capa epitelial, la lámina propia y la capa muscular. El sistema inmunitario gastrointestinal incluye tejido linfoide asociado al tracto gastrointestinal, células T efectoras, células T reguladoras, células B productoras de IgA y linfocitos intrínsecos en la lámina propia. Entre ellos, la lámina propia contiene más células inmunes como células B, células T, células plasmáticas y monocitos / macrófagos que cualquier otro tejido, lo que les permite responder a la invasión de miles de millones de bacterias por el cuerpo (69). En particular, la microbiota intestinal en el intestino posterior está directamente relacionada con el establecimiento y la homeostasis inmune del sistema inmune del huésped, lo que hace que el tracto gastrointestinal sea uno de los órganos inmunes periféricos más grandes del cuerpo y una parte importante del sistema inmunológico general (70). La comunidad microbiana en el tracto gastrointestinal, mientras participa en el metabolismo de los nutrientes del huésped, también desempeña un papel protector y defensivo al regular la inmunidad del huésped y mantener la barrera intestinal. Por ejemplo, la microbiota en el rumen de la vaca puede producir ácidos grasos volátiles a través de la fermentación para el metabolismo energético del huésped. Sin embargo, la alimentación con dietas altas en concentrados puede aumentar la abundancia relativa de ciertas bacterias como Atopobium, Desulfocurvus y Lactobacillus, al tiempo que aumenta la presencia de compuestos tóxicos como endotoxinas, histamina y acetato de etilo, lo que lleva a la acidosis ruminal. Además, los lactobacilos, rumenococos (Ruminococcus) y clostridios (Clostridium) en el rumen pueden expresar hidrolasa de sales biliares y producir sustancias como sales de acetato y lipopolisacáridos. Estas sustancias pueden alterar la barrera sangre-leche y provocar mastitis, afectando los rasgos de producción de los animales rumiantes (45-47).
La microbiota intestinal, como el ecosistema microbiano más grande y complejo en el cuerpo del huésped, juega un papel crucial en cerrar la brecha entre la dieta y el huésped. Puede regular las respuestas inmunes innatas y adaptativas del sistema inmune intestinal del huésped. Por ejemplo, en comparación con los ratones libres de gérmenes, los ratones libres de patógenos específicos (SPF) tienen tejidos linfoides más maduros, así como un mayor número de células Th17 en el intestino delgado, células T reguladoras (Treg) en el colon y linfocitos intraepiteliales (IEL) con receptores de células T αβ. Estas células inmunes contribuyen a la tolerancia inmune (51). El trasplante de bacterias filamentosas segmentadas (SFB) en intestinos de ratón puede inducir eficazmente la activación de las células Th17 (52), mientras que el trasplante de Clostridium o Bacteroides puede inducir aún más la diferenciación de las células Treg en el colon (42). La microbiota intestinal también puede promover la diferenciación de las células B en células plasmáticas, lo que lleva a una mayor secreción de IgA. Estimula las células epiteliales intestinales para secretar péptidos antimicrobianos e induce a las células caliciformes a liberar moco, defendiéndose así contra la invasión de microorganismos patógenos exógenos (71). Además, varias células linfoides innatas en los intestinos pueden ser estimuladas por la microbiota y sus metabolitos para producir interleucinas. Por ejemplo, los ácidos grasos de cadena corta pueden inducir la producción de IL-18 por las células epiteliales intestinales, promover que las células dendríticas tolerogénicas expresen IL-10 y mejorar aún más la liberación de péptidos antimicrobianos por las células epiteliales intestinales, manteniendo así el equilibrio de las comunidades microbianas intestinales y protegiendo contra la invasión de patógenos exógenos (72, 73). Después de que la hipótesis «intestino-mamario» fue propuesta por Arroyo et al., sugiriendo que los microorganismos en los intestinos podrían ingresar a los ganglios linfáticos mesentéricos y transferirse a las glándulas mamarias (74), una cantidad creciente de investigación ha demostrado el impacto de la microbiota intestinal en varios aspectos de la salud, el metabolismo y las enfermedades del huésped a través de ejes como el eje intestino-cerebro, eje intestino-estómago, eje intestino-hígado y eje intestino-páncreas (75–77). Por ejemplo, Young et al. encontraron un pequeño número de unidades taxonómicas operativas (OTU) pertenecientes a bacterias ruminales, Bifidobacterium y Peptostreptococcaceae en las heces, células lácteas y leucocitos sanguíneos de vacas (53). Ma et al. descubrieron que tanto la microbiota fecal como la microbiota de la leche de vacas con mastitis mostraron niveles más altos de Enterococcus, Streptococcus y Staphylococcus y niveles más bajos de Lactobacillus (54). Cuando la microbiota fecal de vacas con mastitis se trasplantó en ratones libres de gérmenes, los ratones también desarrollaron mastitis (48). Por otro lado, los acetatos y butiratos producidos por Firmicutes pueden reducir la gravedad de la mastitis inducida por Staphylococcus aureus al alterar la barrera sangre-leche (49). Lactobacillus rhamnosus puede aliviar la activación inflamatoria NLRP3 inducida por Escherichia coli e inhibir la apoptosis celular oxidativa mediada por racimo y las respuestas inflamatorias (55). Además, Hu et al. encontraron que los ácidos grasos de cadena corta producidos por Firmicutes y BacteLos roides en el intestino de la vaca pueden evitar que los lipopolisacáridos producidos en el rumen entren en el torrente sanguíneo y el tejido mamario, protegiendo así la función de lactancia de la glándula mamaria (50). Bifidobacterium puede mejorar la digestión, mejorar el control de la glucosa en sangre y reducir los niveles de lípidos a través del eje intestino-estómago (57, 58). Los factores secretados por la microbiota intestinal, como GLP-1, grelina y 5-HT, pueden regular el equilibrio metabólico de la glucosa en sangre en el huésped al influir en la función de las células α/β del páncreas, apoyando la teoría del eje intestino-páncreas (78). Las bacterias intestinales como Lactobacillus y Bifidobacterium pueden reducir la producción de oxalato durante la fermentación de carbohidratos y el metabolismo bacteriano, disminuyendo así el riesgo de formación de cálculos de oxalato renal, lo que demuestra la regulación del eje intestino-riñón (56). Además, la microbiota intestinal puede ejercer efectos inmunes al participar en el metabolismo de otras sustancias. Por ejemplo, pueden eliminar la porción glicosilada de polifenoles para producir metabolitos activos, que ingresan al torrente sanguíneo y llegan a tejidos u órganos distantes para ejercer efectos inmunomoduladores (79).
4.3. Función de defensa de los microorganismos gastrointestinales en vacas
La microbiota gastrointestinal en las vacas lecheras juega un papel importante en el mantenimiento de la integridad de la estructura y función gastrointestinal, así como la estructura mucosa. En particular, una gran cantidad de moco se adhiere a la mucosa gastrointestinal, lo que ayuda a equilibrar la relación entre la microbiota y el huésped. Por ejemplo, una sobreabundancia de bacterias gramnegativas en el rumen puede conducir a una fermentación anormal y una producción excesiva de lactato. Además, la membrana externa de las bacterias gramnegativas consiste principalmente en lipopolisacáridos (LPS). La acumulación de lactato y LPS puede dañar las células epiteliales del rumen, causando acidosis ruminal, y también permite que sustancias nocivas entren en el torrente sanguíneo, lo que lleva a la mastitis en las vacas lecheras (11). Además, un estudio realizado por Zhong et al. comparando la microbiota ruminal y del intestino posterior de vacas lecheras en diferentes condiciones de salud de la ubre encontró que la microbiota y los metabolitos del intestino posterior estaban más estrechamente asociados con la salud de la ubre que la microbiota ruminal (21).
La investigación ha demostrado que los microbios en el intestino posterior pueden promover la secreción de mucina, aumentar el grosor de la capa de moco y proporcionar más sitios adhesivos para las bacterias beneficiosas, fortaleciendo así la función de barrera que inhibe la invasión de varias bacterias patógenas. Por ejemplo, los microbios del intestino posterior pueden regular la transcripción del gen de la angiogenina-3 (Ang-3) para promover el desarrollo de la estructura de la mucosa intestinal (80). Bacteroides thetaiotaomicron no solo puede promover la expresión de fucosa en la superficie de las células epiteliales intestinales (59), lo que facilita la reparación de las células epiteliales dañadas, sino que también induce la expresión de la pequeña proteína 2A rica en prolina (SPRR2A), rica en prolina, en las células epiteliales intestinales para mantener la estructura de las microvellosidades epiteliales intestinales y los desmosomas (60). Lactobacillus rhamnosus GG puede producir proteínas solubles que inhiben eficazmente la apoptosis inducida por citoquinas de las células epiteliales intestinales (61).
Además, varios transportadores de aminoácidos presentes en la pared celular de las bacterias gastrointestinales pueden transportar aminoácidos desde la luz intestinal a las células bacterianas, donde se convierten en moléculas de señalización y péptidos antimicrobianos para participar en los procesos de defensa gastrointestinal del huésped. Por ejemplo, la histidina descarboxilasa codificada por el gen hdcA en bacterias puede convertir la L-histidina en histamina, lo que inhibe eficazmente la invasión de varias bacterias patógenas (81). Además, las enzimas expresadas por la microbiota intestinal no solo pueden metabolizar carbohidratos, aminoácidos y lípidos, sino también descomponer sustancias tóxicas. Por ejemplo, la microbiota intestinal contiene abundante citocromo soluble P450 (CYP450), que desempeña un papel defensivo al metabolizar los xenobióticos (82).
5. Prácticas de alimentación para modular la microbiota gastrointestinal y mejorar la producción y la salud de las vacas lecheras
Los animales rumiantes, incluidas las vacas, dependen principalmente de la fibra como su principal fuente de alimento. Por lo tanto, proporcionar a las vacas alimentos ricos en fibra, como forraje y heno con alto contenido de fibra, puede suministrar los sustratos y la energía requeridos por las bacterias gastrointestinales beneficiosas, promoviendo el crecimiento y la reproducción de microorganismos beneficiosos. La alimentación de ensilaje y alimentos fermentados ácidos, como el ensilaje de maíz, el maíz tratado con ácido acético y la alfalfa fermentada, crea un ambiente ácido necesario para el crecimiento de bacterias de ácido láctico y otros microorganismos beneficiosos. Sin embargo, es importante tener en cuenta que la alimentación con alto contenido de fibra también puede estimular la producción de bacterias productoras de metano, lo que resulta en una disminución de la eficiencia alimentaria. Por el contrario, una dieta alta en concentrado o acidez puede disminuir el pH en el tracto gastrointestinal de la vaca, lo que puede causar acidosis ruminal subaguda (SARA) (83).
Por lo tanto, un número creciente de estudios han intentado mejorar el crecimiento y la actividad metabólica de las bacterias beneficiosas en el tracto gastrointestinal mediante la adición de probióticos como Lactobacillus y Saccharomyces a la alimentación de la vaca o agua potable. Esto promueve la interacción entre los probióticos y la microbiota intestinal, estimulando el crecimiento y la actividad metabólica de las bacterias beneficiosas (84, 85). Además, los componentes del alimento ricos en fibras prebióticas, como la inulina (86), los fructooligosacáridos (87) y los xilooligosacáridos (88), proporcionan la energía y los sustratos necesarios para los microorganismos beneficiosos. Se ha descubierto que los extractos de diente de león (89), madreselva (90), algas marinas (91) y otros poseen propiedades antibacterianas y antiinflamatorias, ejerciendo una influencia positiva en la microbiota intestinal. Además, la adición de inhibidores como el 3-nitrooxipropanol (3-NOP) a la dieta puede suprimir la producción de gases de efecto invernadero, incluido el metano, al inhibir la metil-coenzima M reductasa (MCR) y mejorar la eficiencia de la alimentación (92). Otro enfoque implica eliminar protozoos que coexisten con metanógenos, interrumpiendo así la transferencia de hidrógeno entre especies y reduciendo la producción de gas metano (86, 93). Estas medidas no solo no afectan a la producción de leche, sino que también pueden mejorar el contenido de grasa láctea (94). Estos resultados observados proporcionan evidencia directa para la programación de la microbiota ruminal de las vacas a través de intervenciones dietéticas o selección de genes.
6. Conclusión
Con los continuos avances en biotecnología y tecnologías ómicas, se han estudiado ampliamente varios factores que regulan los rasgos de producción del ganado y las aves de corral (95-98), y la modulación eficiente de la microbiota gastrointestinal en vacas lecheras para los rasgos de producción y la salud inmunológica es incuestionable. Esta revisión resume la relación entre la microbiota gastrointestinal de las vacas lecheras y los rasgos de producción y salud del huésped. Se sabe que la cantidad de microbiota gastrointestinal en las vacas lecheras supera a la de las células huésped y los genes en varios órdenes de magnitud. Estos microorganismos pueden metabolizar diversas sustancias como la celulosa y los polisacáridos, proporcionando abundantes enzimas para mejorar la función metabólica de las vacas lecheras. También producen una variedad de metabolitos, incluidas vitaminas, para satisfacer las necesidades nutricionales e inmunes de las vacas, lo que les permite convertir alimentos de baja calidad en carne y productos lácteos de alta calidad. Además, estos microorganismos proporcionan un espacio amortiguador equilibrado y coordinado en el entorno gastrointestinal complejo. Este equilibrio no solo mantiene la abundancia y diversidad de bacterias beneficiosas dentro de rangos apropiados, sino que también proporciona funciones defensivas como la descomposición de sustancias nocivas y el mantenimiento de la estructura gastrointestinal, evitando el crecimiento excesivo y la invasión de bacterias patógenas. Por lo tanto, estudiar la dinámica de la microbiota gastrointestinal y su interdependencia con el huésped se ha convertido en un tema candente en los campos de la cría de ganado lechero, la nutrición y la reproducción.
Aunque en las últimas dos décadas (99-105) se han logrado avances significativos en la comprensión de la microbiota gastrointestinal del ganado y las aves de corral, incluidas las vacas lecheras, todavía faltan pruebas que demuestren fuertes relaciones causales entre la microbiota intestinal y los rasgos de producción del huésped, especialmente en términos de la funcionalidad de la microbiota del intestino posterior en rumiantes, que aún se encuentra en sus primeras etapas de investigación. Actualmente, los estudios sobre microbiota, ya sea basados en el rumen o en el intestino posterior, a menudo se basan en análisis de correlación después de agruparlos en función de las diferencias en el rendimiento de producción o los indicadores inmunes. Sin embargo, a menudo hay una falta de relevancia biológica clara, lo que dificulta el establecimiento de relaciones causales entre estos microorganismos y los rasgos diferenciales. Además, a pesar de nuestra estrategia de búsqueda integral, es posible que algunos estudios importantes, en particular los publicados después de la revisión, no se hayan incluido, lo que da lugar a limitaciones en la revisión. Por lo tanto, en futuras investigaciones en profundidad, además de evitar nuestras limitaciones, es necesario cambiar el enfoque del estudio de la asociación entre microorganismos y rasgos del huésped hacia la investigación de relaciones y mecanismos causales, identificando en última instancia microorganismos y vías microbianas que pueden regular positivamente los rasgos de producción del huésped y el rendimiento inmunológico.
Contribuciones del autor
LL y QZ: conceptualización. LL, PW, AG, YY, FC y QZ: investigación y supervisión. LL: redacción: preparación del borrador original, administración del proyecto y adquisición de fondos. LL y PW: redacción: revisión y edición. Todos los autores han leído y aceptado la versión publicada del manuscrito.
Financiación
Este trabajo fue apoyado por la Fundación Nacional de Ciencias Naturales de China (Subvención No. 31902152), el Proyecto de Talento Juvenil «Talento Xingdiano» de la provincia de Yunnan, el Fondo de Investigación Científica de la Universidad Forestal del Suroeste (Subvención No. 112119) y el Fondo del Proyecto de Investigación Científica del Departamento Provincial de Educación de Yunnan (Subvención No. 2018JS333).
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Bickhart, DM, y Weimer, PJ. Revisión del simposio: las interacciones entre el microbio huésped y el rumen pueden aprovecharse para mejorar la productividad de las vacas lecheras. J Dairy Sci. (2018) 101:7680–9. DOI: 10.3168/JDS.2017-13328
2. Pitta, DW, Indugu, N, Baker, L, Vecchiarelli, B, y Attwood, G. Revisión del simposio: comprensión de las interacciones dieta-microbio para mejorar la productividad de las vacas lecheras. J Dairy Sci. (2018) 101:7661–79. DOI: 10.3168/JDS.2017-13858
3. Na, SW y Guan, LL. Comprender el papel de las interacciones epiteliales huésped-microbio ruminal en la eficiencia de la alimentación del ganado. Anim Nutr. (2022) 10:41–53. doi: 10.1016/j.aninu.2022.04.002
4. Cammack, KM, Austin, KJ, Lamberson, WR, Conant, GC y Cunningham, HC. SIMPOSIO DE NUTRICIÓN DE RUMIANTES: pequeño pero poderoso: el papel de los microbios ruminales en la producción ganadera. J Anim Sci. (2018) 96:4481. doi: 10.1093/jas/sky331
5. Immig, I. El rumen y el intestino posterior como fuente de metanogénesis de rumiantes. Environ Monit Assess. (1996) 42:57–72. doi: 10.1007/BF00394042
6. Dewanckele, L, Toral, PG, Vlaeminck, B, and Fievez, V. Revisión invitada: papel de los intermedios de biohidrogenación ruminal y microbios ruminales en la depresión de grasa láctea inducida por la dieta: una actualización. J Dairy Sci. (2020) 103:7655–81. DOI: 10.3168/JDS.2019-17662
7. Gargallo, S, Ferret, A, and Calsamiglia, S. Estimating degradation of individual essential amino acids in fish meal and blood meal by rumen microbios in a dual-flow continuo-culture system. J Dairy Sci. (2020) 103:6209–17. DOI: 10.3168/JDS.2019-17279
8. Amanullah, SM, Kim, DH, Paradhipta, DHV, Lee, HJ, Joo, YH, Lee, SS, et al. Efectos de la suplementación con ácidos grasos esenciales sobre los índices de fermentación in vitro, gases de efecto invernadero, microbios y perfiles de ácidos grasos en el rumen. Microbiol frontal. (2021) 12:637220. DOI: 10.3389/fmicb.2021.637220
9. Matthews, C, Crispie, F, Lewis, E, Reid, M, O’Toole, PW, y Cotter, PD. El microbioma ruminal: una consideración crucial para optimizar la producción de leche y carne y la eficiencia de utilización de nitrógeno. Microbios intestinales. (2019) 10:115–32. doi: 10.1080/19490976.2018.1505176
10. O’Hara, E, Neves, ALA, Song, Y, y Guan, LL. El papel del microbioma intestinal en la producción y la salud del ganado: ¿conductor o pasajero? Annu Rev Anim Biosci. (2020) 8:199–220. doi: 10.1146/annurev-animal-021419-083952
11. Monteiro, HF, y Faciola, AP. Acidosis ruminal, cambios bacterianos y lipopolisacáridos. J Anim Sci. (2020) 98:skaa248. doi: 10.1093/jas/skaa248
12. Olijhoek, DW, Hellwing, ALF, Noel, SJ, Lund, P, Larsen, M, Weisbjerg, MR, et al. Alimentación de hasta un 91% de concentrado a vacas lecheras Holstein y Jersey: efectos sobre la emisión entérica de metano, la fermentación ruminal y la comunidad bacteriana, la digestibilidad, la producción y el comportamiento alimentario. J Dairy Sci. (2022) 105:9523–41. DOI: 10.3168/JDS.2021-21676
13. van Gastelen, S, Dijkstra, J, Nichols, K, and Bannink, A. Abomasal infusion of ground corn and ammonium chloride in early-lactating Holstein-Friesian dairy cows to induce hindgut and metabolic acidosis. J Dairy Sci. (2021) 104:4174–91. DOI: 10.3168/JDS.2020-19300
14. Abeyta, MA, Horst, EA, Mayorga, EJ, Goetz, BM, al-Qaisi, M, McCarthy, CS, et al. Efectos de la acidosis del intestino posterior sobre el metabolismo, la inflamación y la producción en vacas lecheras que consumen una dieta de lactancia estándar. J Dairy Sci. (2023) 106:1429–40. DOI: 10.3168/JDS.2022-22303
15. Plaizier, JC, Li, S, Tun, HM y Khafipour, E. Los modelos nutricionales de acidosis ruminal subaguda inducida experimentalmente (SARA) difieren en su impacto en las comunidades bacterianas del rumen y del intestino posterior en vacas lecheras. Microbiol frontal. (2017) 7:2128. DOI: 10.3389/fmicb.2016.02128
16. Zhu, X, Liu, B, Xiao, J, Guo, M, Zhao, S, Hu, M, et al. Efectos de diferentes dietas de forraje sobre el rendimiento de engorde, la calidad de la carne, la composición de ácidos grasos y el microbio ruminal en novillos. Nutr delantero. (2022) 9:885069. doi: 10.3389/fnut.2022.885069
17. Kim, SH, Ramos, SC, Valencia, RA, Cho, YI, and Lee, SS. Estrés por calor: efectos sobre los microbios del rumen y la fisiología del huésped, y estrategias para aliviar los impactos negativos en las vacas lecheras lactantes. Microbiol frontal. (2022) 13:804562. DOI: 10.3389/fmicb.2022.804562
18. Wang, YL, Wang, WK, Wu, QC y Yang, HJ. La liberación y catabolismo del ácido ferúlico en la pared celular de la planta por microbios ruminales: una revisión. Anim Nutr. (2022) 9:335–44. doi: 10.1016/j.aninu.2022.02.003
19. Bach, A, Aris, A, Vidal, M, Fabregas, F, and Terre, M. Influence of milk processing temperature on growth performance, nitrogen retention, and hindgut’s inflammatory status and bacterial populations in a ternf model. J Dairy Res. (2017) 84:355–9. doi: 10.1017/S0022029917000401
20. Neubauer, V, Petri, RM, Humer, E, Kröger, I, Reisinger, N, Baumgartner, W, et al. La dieta rica en almidón indujo acidosis ruminal y disbiosis del intestino posterior en vacas lecheras de diferentes lactancias. Animales. (2020) 10:1727. DOI: 10.3390/ANI10101727
21. Zhong, Y, Xue, MY, Sun, HZ, Valencak, TG, Guan, LL y Liu, J. Las bacterias del rumen y del intestino posterior son indicadores potenciales de mastitis de vacas lecheras Holstein de lactancia media. Microorganismos. (2020) 8:2042. doi: 10.3390/microorganismos8122042
22. Moller, PD. Desaparición de ácidos grasos de cadena larga en el intestino posterior de las vacas lecheras. Acta Vet Scand Suppl. (1989) 86:222–4.
23. Krause, DO, Nagaraja, TG, Wright, AD, and Callaway, TR. Revisión invitada por la Junta: microbiología ruminal: liderando el camino en ecología microbiana. J Anim Sci. (2013) 91:331–41. doi: 10.2527/jas.2012-5567
24. Xue, MY, Sun, HZ, Wu, XH, Liu, JX y Guan, LL. Multi-omics revela que el microbioma ruminal y su metaboloma junto con el metaboloma huésped contribuyen al rendimiento individualizado de la vaca lechera. Microbioma. (2020) 8:64. DOI: 10.1186/S40168-020-00819-8
25. Bionaz, M, y Loor, JJ. Gene networks driving bovine milk fat synthesis during the lactation cycle. BMC Genómica. (2008) 9:366. DOI: 10.1186/1471-2164-9-366
26. Liu, LL, Guo, AW, Wu, PF, Chen, FF, Yang, YJ, and Zhang, Q. Regulation of VPS28 gene knockdown on the milk fat synthesis in Chinese Holstein dairy. Yi Chuan. (2018) 40:1092–100. doi: 10.16288/j.yczz.18-134
27. Xue, MY, Wu, JJ, Xie, YY, Zhu, SL, Zhong, YF, Liu, JX, et al. Investigación de la utilización de fibra en el rumen de vacas lecheras basada en genomas ensamblados con metagenoma y secuenciación de ARN unicelular. Microbioma. (2022) 10:11. DOI: 10.1186/S40168-021-01211-W
28. Li, F, y Guan, LL. El perfil metatranscriptómico revela vínculos entre el microbioma ruminal activo y la eficiencia alimenticia en ganado de carne. Aplicación Environ Microbiol. (2017) 83:E00061-17. doi: 10.1128/AEM.00061-17
29. Roehe, R, Dewhurst, RJ, Duthie, CA, Rooke, JA, McKain, N, Ross, DW, et al. La variación genética del huésped bovino influye en la producción de metano microbiano ruminal con el mejor criterio de selección para la baja emisión de metano y la alimentación eficiente de los huéspedes convertidores en función de la abundancia de genes metagenómicos. PLoS Genet. (2016) 12:E1005846. doi: 10.1371/journal.pgen.1005846
30. Duarte, ME, y Kim, SW. Microbiota intestinal y su interacción con la salud intestinal en cerdos de cría. Nutrición animal. (2022) 8:169–84. doi: 10.1016/j.aninu.2021.05.001
31. Bugda Gwilt, K, González, DP, Olliffe, N, Oller, H, Hoffing, R, Puzan, M, et al. Acciones de aminas traza en el eje cerebro-intestino-microbioma a través del receptor 1 asociado a aminas traza (TAAR1). Célula Mol Neurobiol. (2020) 40:191–201. DOI: 10.1007/S10571-019-00772-7
32. Ho, KJ, Ramirez, JL, Kulkarni, R, Harris, KG, Helenowski, I, Xiong, L, et al. Metabolitos plasmáticos derivados de microbios intestinales asociados con enfermedad arterial periférica y eventos cardíacos adversos mayores. Microorganismos. (2022) 10:2065. doi: 10.3390/microorganismos10102065
33. Cao, Y, Aquino-Martinez, R, Hutchison, E, Allayee, H, Lusis, AJ y Rey, FE. Papel de los metabolitos derivados de microbios intestinales en enfermedades cardiometabólicas: enfoque basado en sistemas. Mol Metab. (2022) 64:101557. doi: 10.1016/j.molmet.2022.101557
34. Ahmad, AA, Zhang, J, Liang, Z, du, M, Yang, Y, Zheng, J, et al. Variaciones dependientes de la edad en la comunidad bacteriana ruminal del ganado mongol desde el destete hasta la edad adulta. BMC Microbiol. (2022) 22:213. DOI: 10.1186/S12866-022-02627-6
35. Kim, YH, Kimura, A, Sugino, T, and Sato, S. Parturition and postpartum dietary change altered ruminal pH and the predicted functions of rumen bacterial communities but did alter the bacterial composition in Holstein cows. Front Vet Sci. (2022) 9:948545. DOI: 10.3389/FVETS.2022.948545
36. Gu, F, Liang, S, Zhu, S, Liu, J y Sun, HZ. Las multiómicas revelaron los efectos de la metionina protegida del rumen en el perfil nutricional de la leche en vacas lecheras. Comida Res Int. (2021) 149:110682. doi: 10.1016/j.foodres.2021.110682
37. Quan, LH, Zhang, C, Dong, M, Jiang, J, Xu, H, Yan, C, et al. El ácido miristoleico producido por los enterococos reduce la obesidad a través de la activación del tejido adiposo marrón. Intestino. (2020) 69:1239–47. DOI: 10.1136/GuTJNL-2019-319114
38. Odongo, NE, Or-Rashid, MM, Kebreab, E, France, J, y McBride, BW. Efecto de la suplementación de ácido mirístico en raciones de vacas lecheras sobre la metanogénesis ruminal y el perfil de ácidos grasos en la leche. J Dairy Sci. (2007) 90:1851–8. DOI: 10.3168/JDS.2006-541
39. Pereira, GV, Abdel-Hamid, AM, Dutta, S, D’Alessandro-Gabazza, CN, Wefers, D, Farris, JA, et al. Degradación de arabinoxilanos complejos por Bacteroidetes colónicos humanos. Nat Commun. (2021) 12:459. DOI: 10.1038/S41467-020-20737-5
40. Cai, J, Sun, L, y Gonzalez, FJ. Ácidos biliares derivados de la microbiota intestinal en la inmunidad intestinal, la inflamación y la tumorigénesis. Microbio huésped celular. (2022) 30:289–300. doi: 10.1016/j.chom.2022.02.004
41. Fukiya, S, Arata, M, Kawashima, H, Yoshida, D, Kaneko, M, Minamida, K, et al. Conversión de ácido cólico y ácido quenodesoxicólico en sus derivados 7-oxo por Bacteroides intestinalis AM-1 aislados de heces humanas. FEMS Microbiol Lett. (2009) 293:263–70. doi: 10.1111/j.1574-6968.2009.01531.x
42. Toubal, A, Kiaf, B, Beaudoin, L, Cagninacci, L, Rhimi, M, Fruchet, B, et al. Las células T invariantes asociadas a la mucosa promueven la inflamación y la disbiosis intestinal que conducen a la disfunción metabólica durante la obesidad. Nat Commun. (2020) 11:3755. DOI: 10.1038/S41467-020-17307-0
43. Zeisel, SH. Colina: necesaria para el desarrollo normal de la memoria. J Am Coll Nutr. (2000) 19:528S–31S. doi: 10.1080/07315724.2000.10718976
44. Elek, P, Newbold, JR, Gaal, T, Wagner, L, and Husveth, F. Effects of rumen-protected choline supplementation on milk production and choline supply of periparturient dairy cows. Animal. (2008) 2:1595–601. doi: 10.1017/S1751731108002917
45. Hu, H, Shao, W, Liu, Q, Liu, N, Wang, Q, Xu, J, et al. La microbiota intestinal promueve la formación de cálculos biliares de colesterol mediante la modulación de la composición de ácidos biliares y la secreción de colesterol biliar. Nat Commun. (2022) 13:252. DOI: 10.1038/S41467-021-27758-8
46. Cholewińska, P, Wołoszyńska, M, Michalak, M, Czyż, K, Rant, W, Smoliński, J, et al. Influencia de factores seleccionados en los filos Firmicutes, Bacteroidetes y Lactobacillaceae en el tracto digestivo de las ovejas. Sci Rep. (2021) 11:23801. DOI: 10.1038/S41598-021-03207-W
47. Hu, X, Li, S, Mu, R, Guo, J, Zhao, C, Cao, Y, et al. La microbiota ruminal contribuye al desarrollo de mastitis en vacas lecheras. Microbiol Spect. (2022) 10:E0251221. doi: 10.1128/spectrum.02512-21
48. Ma, C, Sun, Z, Zeng, B, Huang, S, Zhao, J, Zhang, Y, et al. Los trasplantes fecales de vaca a ratón sugieren que el microbioma intestinal es una de las causas de la mastitis. Microbioma. (2018) 6:200. DOI: 10.1186/S40168-018-0578-1
49. Hu, X, Guo, J, Zhao, C, Jiang, P, Maimai, T, Yanyi, L, et al. La microbiota intestinal contribuye al desarrollo de mastitis inducida por Staphylococcus aureus en ratones. ISME J. (2020) 14:1897–910. DOI: 10.1038/S41396-020-0651-1
50. He, C, Shan, Y, and Song, W. Targeting gut microbiota as a possible therapy for diabetes. Nutr Res. (2015) 35:361–7. doi: 10.1016/j.nutres.2015.03.002
51. Verdu, EF, Galipeau, HJ, y Jabri, B. Novel players in coeliac disease pathogenesis: role of the gut microbiota. Nat Rev Gastroenterol Hepatol. (2015) 12:497–506. doi: 10.1038/nrgastro.2015.90
52. Wang, Y, Yin, Y, Chen, X, Zhao, Y, Wu, Y, Li, Y, et al. Inducción de células Th17 intestinales por flagelinas a partir de bacterias filamentosas segmentadas. Frente Immunol. (2019) 10:2750. doi: 10.3389/fimmu.2019.02750
53. Young, W, Hine, BC, Wallace, OA, Callaghan, M, and Bibiloni, R. Transfer of intestinal bacterial components to mammary secretions in the cow. PeerJ. (2015) 3:e888. doi: 10.7717/peerj.888
54. Ma, C, Zhao, J, Xi, X, Ding, J, Wang, H, Zhang, H, et al. La mastitis bovina puede estar asociada con la privación de Lactobacillus intestinal. Microbios benéficos. (2016) 7:95–102. doi: 10.3920/BM2015.0048
55. Li, Y, Zhu, Y, Chu, B, Liu, N, Chen, S, and Wang, J. Lactobacillus rhamnosus GR-1 previene la apoptosis inducida por Escherichia coli a través de la mitofagia mediada por PINK1/parkina en la mastitis bovina. Frente Immunol. (2021) 12:715098. doi: 10.3389/fimmu.2021.715098
56. Yang, T, Richards, EM, Pepine, CJ y Raizada, MK. La microbiota intestinal y el eje cerebro-intestino-riñón en la hipertensión y la enfermedad renal crónica. Nat Rev Nephrol. (2018) 14:442–56. DOI: 10.1038/S41581-018-0018-2
57. Scheithauer, TP, Dallinga-Thie, GM, de Vos, WM, Nieuwdorp, M, y van Raalte, DH. Causalidad de la microbiota del intestino delgado y grueso en la regulación del peso y la resistencia a la insulina. Mol Metab. (2016) 5:759–70. doi: 10.1016/j.molmet.2016.06.002
58. Assad, BM, Savi, DC, Biscaia, SMP, Mayrhofer, BF, Iantas, J, Mews, M, et al. Las Actinobacterias endófitas de Hymenachne amplexicaulis del humedal del Pantanal brasileño producen compuestos con actividades antibacterianas y antitumorales. Microbiol Res. (2021) 248:126768. doi: 10.1016/j.micres.2021.126768
59. Hooper, LV, y Gordon, JI. Relaciones comensales huésped-bacteria en el intestino. Ciencia. (2001) 292:1115–8. doi: 10.1126/science.1058709
60. Lutgendorff, F, Akkermans, LM, y Soderholm, JD. El papel de la microbiota y los probióticos en el daño gastrointestinal inducido por el estrés. Curr Mol Med. (2008) 8:282–98. DOI: 10.2174/156652408784533779
61. Yan, F, Cao, H, Cover, TL, Washington, MK, Shi, Y, Liu, LS, et al. La administración específica de colon de una proteína soluble derivada de probióticos mejora la inflamación intestinal en ratones a través de un mecanismo dependiente de EGFR. J Clin Invest. (2011) 121:2242–53. doi: 10.1172/JCI44031
62. Rabee, AE, Younan, BR, Kewan, KZ, Sabra, EA, and Lamara, M. Modulation of rumen bacterial community and feed utilization in camel and sheep using combined supplementation of live yeast and microalgae. Sci Rep. (2022) 12:12990. DOI: 10.1038/S41598-022-16988-5
63. Luu, M, y Visekruna, A. Microbial metabolites: novel therapeutic tools for boosting cancer therapies. Tendencias Cell Biol. (2021) 31:873–5. doi: 10.1016/j.tcb.2021.08.005
64. Hassan, FU, Arshad, MA, Ebeid, HM, Rehman, MSU, Khan, MS, Shahid, S, et al. Los aditivos fitogénicos pueden modular el microbioma ruminal para mediar la cinética de fermentación y la metanogénesis mediante la explotación de la interacción dieta-microbio. Front Vet Sci. (2020) 7:575801. DOI: 10.3389/fvets.2020.575801
65. Zhu, H, Yang, M, Loor, JJ, Elolimy, A, Li, L, Xu, C, et al. Análisis de las rutas de transferencia del microbioma vaca-ternero y la diversidad del microbioma en el intestino posterior del ternero lechero Holstein recién nacido. Nutr delantero. (2021) 8:736270. doi: 10.3389/fnut.2021.736270
66. Nishida, A, Miyamoto, J, Shimizu, H, and Kimura, I. Gut microbial short-chain fatty acids-mediated olfactory receptor 78 stimulation promote anorexigenic gut gut hormone peptide YY secretion in ratones. Biochem Biophys Res Commun. (2021) 557:48–54. doi: 10.1016/j.bbrc.2021.03.167
67. Pinnell, LJ, Reyes, AA, Wolfe, CA, Weinroth, MD, Metcalf, JL, Delmore, RJ, et al. Bacteroidetes y Firmicutes impulsan la diversidad microbiana diferente y la composición de la comunidad entre los microambientes en el rumen bovino. Front Vet Sci. (2022) 9:897996. DOI: 10.3389/FVETS.2022.897996
68. Fawad, JA, Luzader, DH, Hanson, GF, Moutinho, TJ Jr, McKinney, CA, Mitchell, PG, et al. La inhibición de la histona desacetilasa por los ácidos grasos de cadena corta generados por microbios intestinales arrastra los ritmos circadianos epiteliales intestinales. Gastroenterología. (2022) 163:1377–1390.e11. doi: 10.1053/j.gastro.2022.07.051
69. Bain, CC, y Cerovic, V. Interacciones de la microbiota con el sistema inmune de la mucosa. Inmunología. (2020) 159:1–3. doi: 10.1111/imm.13159
70. Scheuring, I, Rasmussen, JA, Bozzi, D, y Limborg, MT. Un modelo estratégico de un sistema huésped-microbio-microbio revela la importancia de una respuesta inmune conjunta huésped-microbio para combatir la disbiosis intestinal inducida por el estrés. Microbiol frontal. (2022) 13:912806. DOI: 10.3389/fmicb.2022.912806
71. Wang, L, Wang, S, Zhang, Q, He, C, Fu, C y Wei, Q. El papel de la microbiota intestinal en la salud y las enfermedades cardiovasculares. Mol Biomed. (2022) 3:30. DOI: 10.1186/S43556-022-00091-2
72. En nombre de la Escuela de Estudios Avanzados de la Federación Europea de Cefalea (EHF-SAS)Arzani, M, Jahromi, SR, Ghorbani, Z, Vahabizad, F, Martelletti, P, et al. Gut-brain Axis and migraine headache: a comprehensive review. J dolor de cabeza. (2020) 21:15. doi: 10.1186/s10194-020-1078-9,
73. Mishima, Y, Oka, A, Liu, B, Herzog, JW, Eun, CS, Fan, TJ, et al. La microbiota mantiene la homeostasis colónica activando la señalización TLR2/MyD88/PI3K en las células B reguladoras productoras de IL-10. J Clin Invest. (2019) 129:3702–16. doi: 10.1172/JCI93820
74. Arroyo, R, Martín, V, Maldonado, A, Jiménez, E, Fernández, L, y Rodríguez, JM. Tratamiento de la mastitis infecciosa durante la lactancia: antibióticos versus administración oral de lactobacilos aislados de la leche materna. Clin infectar dis. (2010) 50:1551–8. doi: 10.1086/652763
75. Zhernakova, A, Kurilshikov, A, Bonder, MJ, Tigchelaar, EF, Schirmer, M, Vatanen, T, et al. El análisis metagenómico basado en la población revela marcadores para la composición y diversidad del microbioma intestinal. Ciencia. (2016) 352:565–9. doi: 10.1126/science.aad3369
76. Ding, JH, Jin, Z, Yang, XX, Lou, J, Shan, WX, Hu, YX, et al. Papel de la microbiota intestinal a través del eje intestino-hígado-cerebro en las enfermedades digestivas. Mundo J Gastroenterol. (2020) 26:6141–62. doi: 10.3748/wjg.v26.i40.6141
77. Socała, K, Doboszewska, U, Szopa, A, Serefko, A, Włodarczyk, M, Zielińska, A, et al. El papel del eje microbiota-intestino-cerebro en los trastornos neuropsiquiátricos y neurológicos. Farmacol Res. (2021) 172:105840. doi: 10.1016/j.phrs.2021.105840
78. Svegliati-Baroni, G, Patricio, B, Lioci, G, Macedo, MP, and Gastaldelli, A. Gut-pancreas-liver Axis as a target for treatment of NAFLD/NASH. Int J Mol Sci. (2020) 21:5820. DOI: 10.3390/IJMS21165820
79. Marin, L, Miguelez, EM, Villar, CJ, y Lombo, F. Bioavailability of dietary polyphenols and gut microbiota metabolism: antimicrobial properties. Biomed Res Int. (2015) 2015:905215. doi: 10.1155/2015/905215
80. Stappenbeck, TS, Hooper, LV, y Gordon, JI. Regulación del desarrollo de la angiogénesis intestinal por microbios indígenas a través de células de Paneth. Proc Natl Acad Sci U S A. (2002) 99:15451–5. doi: 10.1073/pnas.202604299
81. Thomas, CM, Hong, T, van Pijkeren, JP, Hemarajata, P, Trinh, DV, Hu, W, et al. La histamina derivada del probiótico Lactobacillus reuteri suprime el TNF a través de la modulación de la señalización PKA y ERK. PLoS One. (2012) 7:E31951. doi: 10.1371/journal.pone.0031951
82. Guengerich, FP, Waterman, MR, y Egli, M. Información estructural reciente sobre la función del citocromo P450. Tendencias Pharmacol Sci. (2016) 37:625–40. doi: 10.1016/j.tips.2016.05.006
83. Plaizier, JC, Krause, DO, Gozho, GN y McBride, BW. Acidosis ruminal subaguda en vacas lecheras: las causas fisiológicas, incidencia y consecuencias. Veterinario J. (2008) 176:21–31. doi: 10.1016/j.tvjl.2007.12.016
84. Nair, J, Huaxin, N, Andrada, E, Yang, HE, Chevaux, E, Drouin, P, et al. Efectos de la inoculación del ensilaje de maíz con Lactobacillus hilgardii y Lactobacillus buchneri sobre la calidad del ensilaje, la estabilidad aeróbica, la digestibilidad de nutrientes y el rendimiento de crecimiento del ganado de carne en crecimiento. J Anim Sci. (2020) 98:skaa267. doi: 10.1093/jas/skaa267
85. Darabighane, B, Salem, AZM, Mirzaei Aghjehgheshlagh, F, Mahdavi, A, Zarei, A, Elghandour, MMMY, et al. Eficiencia ambiental de Saccharomyces cerevisiae en la producción de metano en ganado lechero y de carne a través de un metanálisis. Environ Sci Pollut Res Int. (2019) 26:3651–8. DOI: 10.1007/S11356-018-3878-X
86. Wang, Y, Nan, X, Zhao, Y, Jiang, L, Wang, H, Zhang, F, et al. La suplementación dietética de inulina mejora la mastitis subclínica a través de la regulación de la comunidad microbiana ruminal y los metabolitos en vacas lecheras. Microbiol Spectr. (2021) 9:E0010521. doi: 10.1128/Spectrum.00105-21
87. Teramura, M, Nakai, T, Itoh, M, Sato, T, Ohtani, M, Kawashima, C, et al. Comunicación corta: El anhídrido III de difructosa promueve la absorción de calcio del duodeno en el ganado. J Dairy Sci. (2015) 98:2533–8. DOI: 10.3168/JDS.2014-9004
88. Takizawa, S, Asano, R, Fukuda, Y, Baba, Y, Tada, C, and Nakai, Y. Shifts in xylanases and the microbial community associated with xylan biodegradation during treatment with rumen fluid. Microbio Biotechnol. (2022) 15:1729–43. doi: 10.1111/1751-7915.13988
89. Sun, Y, Wu, Y, Wang, Z, Chen, J, Yang, Y, and Dong, G. Dandelion extract aliviated lipopolysaccharide-induced oxidative stress through the Nrf2 pathway in bovine mammary epithelial cells. Toxinas. (2020) 12:496. doi: 10.3390/toxinas12080496
90. Ma, FT, Shan, Q, Jin, YH, Gao, D, Li, HY, Chang, MN, et al. Efecto del extracto de Lonicera japonica sobre el rendimiento de la lactancia, el estado antioxidante y la función endocrina e inmune en vacas lecheras de lactancia media estresadas por calor. J Dairy Sci. (2020) 103:10074–82. DOI: 10.3168/JDS.2020-18504
91. Knapp, JR, Laur, GL, Vadas, PA, Weiss, WP y Tricarico, JM. Revisión invitada: metano entérico en la producción de ganado lechero: cuantificación de las oportunidades y el impacto de la reducción de emisiones. J Dairy Sci. (2014) 97:3231–61. DOI: 10.3168/JDS.2013-7234
92. Qin, WZ, Li, CY, Kim, JK, Ju, JG, and Song, MK. Effects of defaunation on fermentation characteristics and methane production by rumen microbios in vitro when incubated with stmidy feed sources. Asiático Aust J Anim Sci. (2012) 25:1381–8. doi: 10.5713/ajas.2012.12240
93. Newbold, CJ, de la Fuente, G, Belanche, A, Ramos-Morales, E, y McEwan, NR. El papel de los protozoos ciliados en el rumen. Microbiol frontal. (2015) 6:1313. DOI: 10.3389/fmicb.2015.01313
94. Lopes, JC, de Matos, LF, Harper, MT, Giallongo, F, Oh, J, Gruen, D, et al. Efecto del 3-nitrooxipropanol sobre las emisiones de metano e hidrógeno, la firma isotópica de metano y la fermentación ruminal en vacas lecheras. J Dairy Sci. (2016) 99:5335–44. DOI: 10.3168/JDS.2015-10832
95. Zhang, S, Yao, Z, Li, X, Zhang, Z, Liu, X, Yang, P, et al. Evaluación de la diversidad genómica y firmas de selección en ganado Pinan utilizando datos de secuenciación del genoma completo. BMC Genómica. (2022) 23:460. DOI: 10.1186/S12864-022-08645-Y
96. Li, M, Tian, S, Jin, L, Zhou, G, Li, Y, Zhang, Y, et al. Los análisis genómicos identifican distintos patrones de selección en cerdos domesticados y jabalíes tibetanos. Nat Genet. (2013) 45:1431–8. doi: 10.1038/ng.2811
97. Yuan, C, Lu, Z, Guo, T, Yue, Y, Wang, X, Wang, T, et al. Un análisis global de CNV en poblaciones indígenas chinas de ovejas de lana fina utilizando la resecuenciación del genoma completo. BMC Genómica. (2021) 22:78. DOI: 10.1186/S12864-021-07387-7
98. Shi, S, Shao, D, Yang, L, Liang, Q, Han, W, Xue, Q, et al. Los análisis del genoma completo revelan nuevos genes asociados con la adaptación de los pollos a ambientes tropicales y fríos. J Adv Res. (2023) 47:13–25. doi: 10.1016/j.jare.2022.07.005
99. Zhang, Q, Zhang, S, Wu, S, Madsen, MH, and Shi, S. Supplementing the early diet of broilers with soy protein concentrate can improve intestinal development and enhance short-chain fatty acid producing microbios and short-chain fatty acids, especially butyric acid. J Anim Sci Biotechnol. (2022) 13:97. DOI: 10.1186/S40104-022-00749-5
100. Zhang, S, Zhong, G, Shao, D, Wang, Q, Hu, Y, Wu, T, et al. La suplementación dietética con Bacillus subtilis promueve el rendimiento de crecimiento de los pollos de engorde al alterar la comunidad microbiana dominante. Poult Sci. (2021) 100:100935. doi: 10.1016/j.psj.2020.12.032
101. Zhenxin, W, Dan, S, Shu, WU, Zhigang, S, and Shourong, S. Heat stress-induced intestinal barrier damage and dimethylglycine alleviates through improving the metabolism function of microbiota gut brain axis. Ecotoxicol Environ Saf. (2022) 244:114053. doi: 10.1016/j.ecoenv.2022.114053
102. Shu, W, Zhang, Q, Cong, G, Xiao, Y, Shen, Y, Zhang, S, et al. El probiótico Escherichia coli Nissle 1917 protege a los pollitos del daño causado por la colonización de Salmonella enterica serovar enteritidis. Anim Nutr. (2023). doi: 10.1016/j.aninu.2023.06.001
103. Martínez-Fernández, G, Abecia, L, Arco, A, Cantalapiedra-Hijar, G, Martín-García, AI, Molina-Alcaide, E, et al. Efectos del propionato de etilo-3-nitrooxi y 3-nitrooxipropanol en la fermentación ruminal, la abundancia microbiana y las emisiones de metano en ovejas. J Dairy Sci. (2014) 97:3790–9. DOI: 10.3168/JDS.2013-7398
104. Romero-Pérez, A, Okine, EK, McGinn, SM, Guan, LL, Oba, M, Duval, SM, et al. Reducción sostenida en la producción de metano a partir de la adición a largo plazo de 3-nitrooxipropanol a una dieta de ganado de carne1. J Anim Sci. (2015) 93:1780–91. doi: 10.2527/jas.2014-8726
Palabras clave: vacas lecheras, rasgos de producción, salud, microbiota ruminal, microbiota intestinal
Cita: Liu L, Wu P, Guo A, Yang Y, Chen F y Zhang Q (2023) Progreso de la investigación sobre la regulación de los rasgos de producción por la microbiota gastrointestinal en vacas lecheras. Frente. Vet. Sci. 10:1206346. doi: 10.3389/fvets.2023.1206346
Recibido: 15 de abril de 2023; Aprobado: 20 de julio de 2023;
Publicado: 01 agosto 2023.
Editado por:
Shourong Shi, Academia China de Ciencias Agrícolas, China
Revisado por:
Muhammad Zahoor, Universidad de Agricultura Dera Ismail Khan, Pakistán
Xianrui Zheng, Universidad Agrícola de Anhui, China
Derechos de autor © 2023 Liu, Wu, Guo, Yang, Chen y Zhang. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Lily Liu, liulily0518@163.com
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía