Investigación sobre la seguridad y las respuestas serológicas provocadas por la administración de vacunas intranasales vivas
Investigación sobre la seguridad y las respuestas serológicas provocadas por la administración de vacunas intranasales vivas contra el virus del herpes bovino tipo 1, el virus respiratorio sincitial bovino y la parainfluenza tipo 3 en terneros predestetados
 Anna Flynn1,2
Anna Flynn1,2  Catherine McAloon2
Catherine McAloon2  Katie Sugrue1
Katie Sugrue1  Ricki Fitzgerald1
Ricki Fitzgerald1  Cara Sheridan3
Cara Sheridan3  Bosco Cowley3
Bosco Cowley3  Conor McAloon2
Conor McAloon2  Emer Kennedy1*
Emer Kennedy1*- 1Teagasc, Centro de Investigación e Innovación de Animales y Pastizales, Fermoy, Irlanda
- 2Facultad de Medicina Veterinaria, University College Dublin, Dublín, Irlanda
- 3MSD Animal Health, Dublín, Irlanda
A pesar de que la neumonía sigue siendo una de las principales causas de mortalidad y morbilidad en terneros predestetados, se sabe relativamente poco sobre los efectos de la administración simultánea de vacunas intranasales contra el virus de la neumonía, especialmente en terneros con altos niveles de anticuerpos de origen materno. El objetivo de este estudio fue utilizar una cohorte de 40 terneros y machos hembras y machos lecheros y de vacuno lechero (27 hembras y 13 machos) para determinar las respuestas serológicas a la administración simultánea a las 3 semanas de edad (22 ± 4,85 días) de dos vacunas intranasales (IN) disponibles comercialmente para los virus: virus respiratorio sincitial bovino (BRSV), virus del herpes bovino 1 (BoHV-1), y el virus de la parainfluenza-3 (PI3-V). Los grupos de estudio fueron los siguientes: (i) Bovilis IBR Marker Live only® (IO), (ii) Bovilis INtranasal RSP Live only (RPO), (iii) vacunación concurrente con Bovilis IBR Marker Live y Bovilis Intranasal RSP Live®®® (CV), y (iv) un grupo control de terneros no vacunados (CONT). Se midió la respuesta serológica de los terneros después de la vacunación, las puntuaciones clínicas de salud, la temperatura rectal y el peso. Los datos fueron analizados en SAS mediante modelos mixtos y regresión logística. Los terneros CV tuvieron una ganancia de peso diaria promedio (GMD) de 0,74 (±0,02) kg, que fue similar a la CONT (0,77 ± 0,02 kg). A pesar de que no hubo diferencias significativas en los niveles de anticuerpos entre los grupos de estudio 3 semanas después de la vacunación, después de la administración de inyecciones parenterales posteriores en forma de Bovilis Bovipast RSP® (antígenos; BRSV inactivado, PI3-V inactivado, Mannheimia haemolytica inactivado) y Bovilis IBR Marker Live®, los niveles de anticuerpos de BRSV y PI3-V aumentaron en los grupos de estudio CV y RPO. La vacunación simultánea no dio lugar a un aumento de la fiebre ni a diferencias en las puntuaciones de salud en comparación con la CONT.
Introducción
La enfermedad respiratoria bovina (ERB) es una de las principales causas de morbilidad y mortalidad en el ganado bovino en todo el mundo (1, 2). Neumonía es el término general utilizado para describir las infecciones respiratorias que causan inflamación del tejido pulmonar y las vías respiratorias (3). En Irlanda, la neumonía sigue siendo la principal causa de muerte en terneros de entre 1 y 12 meses de edad y la segunda causa más frecuente de muerte en animales de menos de un mes de edad (4). Si bien el verdadero alcance de los casos de neumonía subclínica en las granjas aún se desconoce en gran medida, algunos estudios han encontrado que la prevalencia de casos puede ser tan alta como el 67% (5). La enfermedad respiratoria bovina a menudo se desarrolla como resultado de una infección sinérgica, que comprende patógenos bacterianos y virales. Entre los virus más comúnmente asociados con la neumonía se encuentran el virus respiratorio sincitial bovino (BRSV), la parainfluenza tipo 3 (PI3-V), el coronavirus bovino y el virus del herpes bovino tipo 1 (BoHV-1), que causan rinotraqueítis infecciosa bovina (IBR) (6, 7). En los terneros, incluso los episodios de ERB no mortales tienen ramificaciones de por vida en la función pulmonar y la productividad animal (8-10).
En el caso de las novillas lecheras, experimentar un episodio clínico de neumonía en el ternero se ha asociado con un aumento de la edad al primer parto (11), así como con una menor probabilidad de completar su primera lactancia (12); Incluso si las novillas completan esta primera lactancia, su producción de leche puede reducirse (11-13). En el ganado vacuno, el rendimiento del crecimiento se ve afectado por la BRD, el peso final de la canal es menor y los días hasta el final aumentan después de la recuperación de la BRD (14-16). Con una prevalencia tan alta, es comprensible que el tratamiento de la neumonía sea responsable de una gran proporción del uso de antimicrobianos en la cría de terneros (17-20). Este uso a menudo metafiláctico de antibióticos es un tema de creciente preocupación pública, ya que se sabe que el uso de antibióticos metafilácticos contribuye a la aparición de bacterias resistentes a los antibióticos (21, 22). La vacunación, en combinación con la mejora de las prácticas de cría y manejo de los animales, es una herramienta clave que debe emplearse para reducir la dependencia de los antimicrobianos limitando la propagación de la enfermedad de los animales (23-26).
Los estudios han encontrado que los terneros de carne son particularmente susceptibles a la ERB durante eventos estresantes como el período posterior al destete o después del transporte (27). Mientras que en las vaquillas lecheras, las prácticas de manejo como el régimen de alimentación con leche y el alojamiento de los terneros se han identificado como influencias potenciales para el desarrollo de la ERB (1). En ambos sistemas, la administración de inmunidad inducida por la vacuna a los terneros antes del destete presenta un desafío. La vacunación del ternero neonatal, aunque a menudo se recomienda, puede ser limitada en su eficacia (28, 29), lo que se debe a que, frente a altos niveles de anticuerpos de origen materno (MDA), un antígeno se ve comprometido en su capacidad para inducir el desarrollo de inmunidad específica al virus en cuestión debido al efecto protector de enmascaramiento de los MDA. citoquinas y células transferidas de la madre a la cría en el calostro (23, 28, 29). Al nacer, los terneros son agammaglobulinémicos y, por lo tanto, dependen completamente de esta inmunidad pasiva para activar y regular sus respuestas inmunitarias para combatir las infecciones (30). Como tal, es crucial que los terneros sean alimentados con calostro con una concentración de inmunoglobulinas lo suficientemente alta para garantizar una transferencia pasiva adecuada y protegerlos de infecciones como la ERB. También se sabe que existe un mayor riesgo de desarrollo de enfermedades infecciosas, incluida la ERB, en terneros de entre 2 y 4 semanas de edad a medida que disminuye la inmunidad pasiva derivada de la madre, y varias revisiones han sugerido que la vacunación intranasal (IN) ofrece una estrategia potencial para anular el efecto de enmascaramiento de la MDA (28, 31, 32).
En los rebaños con antecedentes de neumonía, a menudo se recomienda que los terneros sean vacunados contra el BRSV/PI3-V y/o el IBR (BoHV-1) en su primer año de vida, y estas vacunas pueden ser virus vivos atenuados o inactivados (muertos). Se postula que las vacunas vivas administradas por vía intranasal son más adecuadas que las vacunas parentales sacrificadas para su administración a terneros neonatos, ya que se cree que las vacunas vivas inducen una inmunidad mucosa localizada, incluso frente a anticuerpos derivados de la madre. Se especula que es una práctica común en las granjas administrar varias vacunas vivas contra la neumonía IN juntas, probablemente para facilitar el manejo de los animales. Sin embargo, esta práctica actualmente no está autorizada, ya que hay una escasez de conocimiento sobre los efectos de administrar estas vacunas intranasales contra la neumonía al mismo tiempo. Por lo tanto, es conveniente que se investiguen más a fondo los efectos de la vacunación contra la IN de los neonatos (10). Los estudios sobre la respuesta serológica a las vacunas IN para la neumonía en terneros jóvenes con altos niveles de MDA también son algo limitados, lo que puede deberse a que históricamente la mayoría de las evaluaciones iniciales de la eficacia de la vacuna se llevaron a cabo en terneros privados de calostro o seronegativos (33, 34). Los resultados de los estudios que se han llevado a cabo hasta la fecha sobre la vacunación contra la IN en terneros seropositivos han demostrado que puede no dar lugar a la seroconversión, sino que puede inducir un efecto protector localizado en las mucosas del tracto respiratorio (35-37).
El objetivo de nuestro estudio fue determinar la respuesta serológica provocada frente a MDAs tras la administración concurrente, a las 3 semanas de edad, de dos vacunas IN disponibles comercialmente, Bovilis IBR Marker Live y Bovilis®® INtranasal RSP® Live, para los virus BoHV-1 y BRSV y PI3-V, respectivamente. También se buscó investigar si la vacunación concurrente tuvo algún efecto sobre el aumento de peso diario promedio de los terneros. La primera hipótesis de este estudio es que la vacunación concurrente provocará una respuesta serológica detectable similar a la administración individual de la vacuna a los 21 días después del parto de la vacuna. Por último, también planteamos la hipótesis de que la vacunación concurrente no afectará a las tasas de crecimiento de los terneros.
Materiales y métodos
Declaración ética
La aprobación ética para completar el estudio fue otorgada por el Comité de Ética Animal de Teagasc (TAEC2020-278), y la Autoridad Reguladora de Productos Sanitarios otorgó una licencia (Número de licencia de ensayo de campo clínico: CT10452/002).
Grupos de estudio y mediciones
Este estudio se llevó a cabo en la granja Teagasc Dairygold, Kilworth, Co. Cork, Irlanda. Ochenta y seis terneros nacidos entre el 7 y el 22 de febrero de 2021 fueron sometidos a muestras de sangre para obtener los niveles de anticuerpos contra BoHV-1, BRSV y PI3-V. En el estudio se incluyeron terneros alimentados con calostro para probar las respuestas a la vacuna frente a los anticuerpos derivados de la madre. De esta cohorte, se seleccionaron los 40 terneros con los niveles más bajos de anticuerpos de origen materno para los virus BoHV-1 (Rango = 144,88-156,60 ± 2,69 SP), BRSV (Rango = 35,83-108,72 ± 16,02% Pos) y PI3-V (Rango = 23,50-99,75 ± 13,69 c S/P) para su inclusión en los grupos de estudio. Como el ensayo se llevó a cabo en un rebaño de una granja de investigación lechera, los protocolos de vacunación previa al parto, el manejo del calostro y la bioseguridad de la granja fueron extremadamente estrictos, lo que podría resultar en una mayor transferencia pasiva de anticuerpos maternos a los terneros que la que se lograría en las granjas comerciales. Por lo tanto, para representar mejor el estado inmunológico de los terneros típico del rebaño nacional irlandés, se eligieron 40 terneros con los niveles más bajos de anticuerpos de origen materno en la granja. Los cálculos del tamaño de la muestra se realizaron en función de la diferencia esperada en los resultados serológicos entre los grupos experimentales. Estas diferencias esperadas se identificaron para BRSV (±47,9% Pos), PI3-V (±47 c S/P) y BoHV-1 (±30,5 SP) con base en los datos generados por Barry et al., con valores de terneros de 1 a 3 meses de edad (38). Se consideró que diez terneros por grupo de estudio proporcionaban suficiente potencia para todas las pruebas de anticuerpos contra el virus. Estas crías (N = 40, 27 hembras y 13 machos) fueron bloqueadas en función del peso al nacer (33,5 ± 7,09 kg), la fecha de nacimiento (14 de febrero de 2021 ± 4,85 días) y los niveles de anticuerpos de origen materno específicos contra BoHV-1, BRSV y PI3-V. Luego, los animales se distribuyeron aleatoriamente en cuatro grupos de estudio, cada uno de los cuales contenía 10 terneros. Los terneros se criaron a partir de sementales lecheros y de carne, y la cohorte total consistió en 30 terneros lecheros [Holstein-Friesian (HF), Jersey (JE) y Jersey Holstein-Friesian Cross (HF x Jersey) y 10 terneros de carne lechera (HF x Belgian-Blue) (BBX), HF x Aberdeen-Angus (AAX), HF x Charolaise (CHX), HF x Limousine (LMX)].
Las cuatro Comisiones de Estudio fueron las siguientes:
1. Vacunado con Bovilis IBR Marker Live® (IO).
2. Vacunados con Bovilis INtranasal RSP Live® (RPO).
3. Vacunados simultáneamente con Bovilis INtranasal RSP Live y Bovilis IBR Marker Live®® (CV).
4. Control no vacunado: administrado con diluyente para Bovilis INtranasal RSP Live y Bovilis IBR Marker® Live® (CONT).
Durante el período de observación del estudio, los responsables de la cría diaria de los terneros estaban ciegos a las vacunas administradas a cada grupo, y esto solo lo sabía un organismo imparcial y el veterinario que administraba las dosis. No se administraron otras vacunas a los grupos dentro de un período de 14 días antes o después de cada vacunación para evitar cualquier atribución errónea de posibles efectos secundarios. Los terneros que requirieron tratamiento veterinario individual con antibióticos o antiinflamatorios fueron retirados del ensayo.
Vacunación
Todos los terneros fueron vacunados por un veterinario durante una sola visita a una edad promedio de 22 ± 4,9 días. Las vacunas IN consistieron en el virus o virus vivos atenuados modificados liofilizados (MLV) con un diluyente. Los principios activos contenidos en las vacunas Bovilis INtranasal RSP Live y Bovilis IBR Marker Live®® fueron virus respiratorio sincitial bovino vivo (BRSV), cepa Jencine-2013: 5,0-7,0 log10 a una dosis infecciosa de cultivo de tejidos del 50% (TCID50), virus vivo de la parainfluenza bovina tipo 3 (PIV-3), cepa INT2-2013: 4,8-7,0 log10 TCID50, y herpesvirus bovino vivo tipo 1 (BHV-1), cepa GK/D (gE ̄): 105.7–107.0 TCID50, respectivamente. Estas vacunas se almacenaron a una temperatura de entre 2 y 8 °C antes de su uso. Inmediatamente antes de la administración, las vacunas se reconstituyeron mediante la transferencia del disolvente al vial con el liofilizado utilizando una jeringa y una aguja y luego se volvieron a suspender agitando. Se utilizaron pistolas automáticas de vacunación (MSD Animal Health, Irlanda) para administrar una dosis única de 2 ml (1 ml en cada fosa nasal) a los terneros. El dispositivo se calibró utilizando un diluyente y se cambiaron sus boquillas entre cada animal. El grupo CV recibió ambas vacunas de esta manera, por separado e inmediatamente después de la otra. A los CONT se les administraron los diluyentes tanto para Bovilis INtranasal RSP Live como para Bovilis IBR Marker Live®®, administrados de la misma manera que se describió anteriormente como placebo.
Ochenta días después de la vacunación inicial de IN, todos los terneros inscritos en el estudio recibieron vacunas parenterales para los tres virus, que consistieron en una dosis intramuscular de 2 ml de Bovilis IBR Marker® Live y adicionalmente una dosis de 5 ml de Bovilis Bovipast RSP®, por vía subcutánea. Esta dosis de 5 ml de Bovilis Bovipast RSP® contenía virus respiratorio sincitial bovino inactivado, cepa EV908 104.7–105.45 en TCID50, virus de la parainfluenza-3 inactivado, cepa SF-4 Reisinger 103.54–104.85 TCID50, Mannheimia haemolytica A1 inactivada, cepa M4/1 104.24–105.0 y los adyuvantes hidróxido de aluminio B (37,5 mg), quil A (saponina) 0,189-0,791 mg y el excipiente tiomersal: 0,032-0,058 mg. Estas vacunas parentales se administraron con el fin de evaluar la respuesta de los diferentes grupos de estudio a una vacunación de refuerzo posterior.
Toma de muestras de sangre y análisis de anticuerpos ELISA
A los terneros se les tomó una muestra de sangre a través de una vena yugular; Se extrajeron muestras de 10 mL con una aguja de 20 g en un tubo vacutainer que no contenía coagulantes ni conservantes (ambos BD, Vaud, Suiza). A los terneros se les tomó una muestra de sangre 5 días antes de la vacunación contra la IN (Día -5), luego nuevamente el día de la vacunación contra la IN (Día 0), por tercera vez 3 semanas después de la vacunación IN (Día 21) y por última vez 2 semanas después de la administración de la vacuna parenteral (Día 94). Después de la recolección, todas las muestras de sangre se refrigeraron entre 1 °C y 5 °C y se transportaron inmediatamente a un laboratorio comercial para su análisis (Enfer Scientific, ULC Newhall, Naas Co. Kildare). El suero sanguíneo se utilizó para determinar los niveles de anticuerpos específicos para cada uno de los virus. Los valores de anticuerpos específicos contra BoHV-1, PI3-V y BRSV se determinaron utilizando kits de prueba de ELISA indirecta disponibles en el mercado, y el suero se diluyó de acuerdo con las instrucciones del fabricante del kit. Los kits de prueba utilizados fueron IDEXX IBR Individual Ab Test, IDEXX PI-3 Ab Test (ambos IDEXX Europe B.V, Países Bajos) y SVANOVIR® BRSV-Ab (SVANOVIR INDICAL AB, Suecia). La densidad óptica de las muestras se leyó a 450 nm con un lector de absorbancia Tecan Sunrise®, y luego se utilizó el software Magellan para definir los valores de control positivos y negativos de acuerdo con una curva estándar (Tecan Trading AG, Suiza). Las unidades semicuantitativas basadas en la absorbancia de la densidad óptica corregida se expresaron como S/P % (muestra a relación positiva) para IBR, %P (porcentaje positivo) para BRSV y c S/P % (muestra corregida a relación positiva) para PI3-V.
Estas unidades de densidad óptica (OD) de ELISA se calcularon a partir de las lecturas de OD de acuerdo con las siguientes fórmulas de los manuales de instrucciones del kit de prueba.
Puntuación de salud
La salud de los terneros se evaluó durante 9 días continuos, durante 3 días antes de la vacunación contra la IN y durante 6 días después de la vacunación con la IN. A los terneros se les volvió a puntuar la salud durante 3 días después de la vacunación parenteral en el día 80. Estas puntuaciones de salud se tomaron de acuerdo con un sistema modificado de puntuación de la salud de los terneros ideado por Barry et al. (38, 39). Esta puntuación implicó una evaluación exhaustiva del estado de salud de cada animal, que incluyó observaciones detalladas de la frecuencia respiratoria, la tos, la limpieza fecal, las características del ombligo y del tracto urogenital, la secreción nasal y ocular, la posición de las orejas, la movilidad, la deshidratación y el comportamiento, el interés en el entorno y la temperatura rectal. Los terneros fueron puntuados de cero a tres en cada uno de estos aspectos de la salud, donde cero representaba normal y tres representaba el más gravemente afectado. Los terneros fueron puntuados a la misma hora todos los días, una hora después de la alimentación matutina. Tras el cese de la puntuación de salud, los animales fueron monitoreados diariamente entre las comidas para detectar cualquier cambio en el comportamiento o anomalías, incluida la evidencia de mala forma, mala frugalidad, diarrea, secreción nasal u ocular o reducción en la ingesta de leche.
Además de la puntuación de salud, todos los animales fueron observados diariamente para detectar signos de mala salud, y los episodios de enfermedad fueron registrados y tratados según fuera necesario por el gerente de la granja/veterinario. A lo largo del estudio, los episodios de diarrea nutricional e infecciosa se trataron con terapia de rehidratación oral.
Tres terneros fueron retirados del estudio después de una intervención veterinaria por enfermedades gastrointestinales, no relacionadas con el agrupamiento de vacunas.
Pesas para pantorrillas
Todos los terneros se pesaron semanalmente durante la duración del estudio (TruTest XR 3000, Tru-test Limited, Auckland, Nueva Zelanda).
Ganadería
Todos los terneros fueron retirados de su madre dentro de 1 h después del nacimiento. A continuación, los terneros se pesaron, se etiquetaron y se trasladaron a corrales individuales. Antes de la alimentación, todo el calostro recolectado se analizó con un refractómetro Brix (HI 96801, Hanna Instruments, Woonsocket, RI). Solo se administró calostro con un valor de >22% Brix, equivalente a >50 mg/mL de IgG (40), a los terneros. Los terneros fueron alimentados con 3 L de calostro dentro de la hora siguiente al nacimiento de una sola madre, no necesariamente la suya (41). Esto se administró como una alimentación a través del biberón y la tetina, con un tubo estomacal que se usaba solo si un ternero se negaba a beber el calostro voluntariamente.
Los terneros permanecieron en corrales individuales durante 2 días y recibieron cuatro tomas adicionales de leche de transición. Después de esto, los terneros fueron trasladados a un corral grupal general de aproximadamente 20 terneros en el galpón principal para terneros. Una vez aleatorizados, los 40 terneros experimentales seleccionados fueron trasladados a sus corrales grupales. Estos corrales se diseñaron para garantizar que los terneros no tuvieran espacio aéreo compartido o contacto nariz con nariz con animales de los otros grupos de estudio. Se colocaron tabiques divisorios de hormigón sólido y corrales vacíos alternos para garantizar que cada uno de los grupos de estudio se mantuviera a una distancia mínima de 5 m para evitar la posible propagación de las cepas vivas de la vacuna a los grupos de estudio alternativos. Los corrales se cubrieron con paja a una profundidad de 15 cm, y la paja se rellenó diariamente y se limpió por completo cada 3 días. Cada ternero tenía un espacio mínimo de 1,7 m2 con una zona de alimentación adicional al aire libre. La ventilación era pasiva en los establos de terneros. Se utilizaron registradores de datos Tiny Tag para registrar la temperatura atmosférica y la humedad relativa (Gemini Data Loggers Ltd., Reino Unido).
Todos los terneros fueron alimentados con 3 L dos veces al día (6 L/día) con un 26% de proteína cruda sustituto de leche (Volac Heiferlac Instant, Volac, Hertfordshire, Reino Unido), que se mezcló a una tasa de reconstitución del 15% a través de 10 comederos compartimentados con pezones (JFC Manufacturing, Tuam Co. Galway, Irlanda). Para evitar la propagación de las cepas vivas del virus de la vacuna a través de la saliva entre los grupos de estudio, cada grupo tenía un comedero de leche compartimentado separado de 10 pezones. Los terneros fueron destetados gradualmente, simultáneamente, durante un período de 10 días y fueron completamente destetados a una edad promedio de 11,7 (±0,68) semanas.
Los terneros tenían acceso a agua ad libitum y concentrados (18% de proteína bruta, ingredientes; cebada, harina de soja, pulpa de remolacha azucarera, granos de destilería, harina de colza y maíz; Lápices de inicio para terneros Sweet Start, Southern Milling, Cork, Irlanda). Al destete, todos los terneros consumían >1 kg de concentrados al día. Después del destete, se cambiaron los terneros concentrados ofrecidos (17% de proteína bruta, ingredientes; cebada, grano seco de destilería, maíz, pulpa de remolacha azucarera, harina de colza, avena, cáscaras de soja, palmiste, harina de soja (frijol) Super Calf Rearer Nuts, Southern Milling, Cork, Irlanda).
Los protocolos de bioseguridad incluían la desinfección de botas y ropa y el cambio de guantes al moverse entre corrales. Tres semanas después de la vacunación, los terneros fueron retirados de sus respectivos corrales de aislamiento grupal y alojados juntos. Después de 2 semanas, los terneros fueron trasladados al exterior a pastar como un solo grupo y permanecieron separados de otros animales en la granja hasta el final del estudio.
Análisis estadístico
Todos los análisis de datos se realizaron con SAS (2013) versión 9.4 (SAS Institute Inc., Cary, NC, USA). El ternero fue considerado como la unidad experimental. La normalidad se evaluó mediante PROC UNIVARIATE. Se encontró que las variables dependientes siguen un patrón de distribución normal. Debido a la amplia gama de pesos al nacer en los datos, los pesos al nacer se centraron por clase de raza (leche o carne de vacuno). Se utilizó un modelo mixto (PROC MIXED) para determinar si el grupo tenía un efecto sobre los datos de peso y los valores unitarios de ELISA OD para IBR, BRSV y PI3-V. Se examinaron las medias de mínimos cuadrados y las interacciones entre las variables significativas en cada modelo mixto. Se incluyeron como variables categóricas el grupo de estudio, la clase de raza, el sexo y el tiempo transcurrido desde la vacunación contra la IN. Los modelos finales para los datos de peso y los valores unitarios de ELISA OD comprendieron la interacción entre el grupo de estudio y el tiempo transcurrido desde la vacunación, además de la clase de raza (lechera o vacuno lechero) anidada dentro del grupo de estudio. Los pesos centrados al nacer de los terneros, la semana de nacimiento, la edad de vacunación (en días) y el sexo se consideraron efectos fijos. Los niveles basales de anticuerpos contra el virus de los terneros en el día −5 para cada uno de los virus analizados se incluyeron como covariables en los modelos unitarios ELISA OD. El ternero se incluyó como efecto aleatorio y el tiempo transcurrido desde la vacunación como medida repetida. El ajuste de Tukey se incluyó para tener en cuenta el tamaño desigual de los grupos después de los retiros del estudio. Para todos los análisis, la significación se declaró con un valor de p de <0,05.
Se utilizó el procedimiento de frecuencia (PROC FREQ) para reportar la distribución no normal de las variables categóricas relacionadas con la puntuación de salud respiratoria. Para crear datos binarios para el análisis, las categorías de puntuación de salud se condensaron en una puntuación general de signos de neumonía acumulativa. Los parámetros de salud respiratoria que se puntuaron y agruparon en esta puntuación agregada de signos de neumonía fueron la tos, la puntuación respiratoria, el comportamiento, los ojos y la secreción ocular, la posición de la oreja, la secreción nasal, la movilidad y el interés por el entorno. Cada ternero se clasificó como si hubiera mostrado o no estos signos de neumonía agregados, lo que significa que un ternero mostraba signos de gravedad de 1 o más (de la escala de cuatro puntos; 0, 1, 2, 3) para dos o más parámetros de salud respiratoria o mostraba signos de gravedad superiores a 2 para un parámetro de salud respiratoria individual. Para examinar el efecto del grupo de estudio sobre la temperatura rectal, los datos también se clasificaron en baja (<38,5 °C), normal (≥38,5 °C – ≤ 39,5 °C) y fiebre (>39,5 °C).
Se utilizó PROC LOGISTIC para construir un modelo de regresión logística multinomial para determinar la asociación entre los grupos de estudio, el sexo, la clasificación de la raza, la temperatura rectal categorizada, la edad en días al momento de la vacunación y la puntuación agregada de los signos de neumonía. Los controles se designaron como la categoría de referencia para el grupo de estudio, las hembras como la categoría de referencia para el sexo y los lácteos como la categoría de referencia para la clase de raza. A la temperatura rectal variable continua se le asignó una puntuación unitaria de 0,5 °C, y también se incluyó en el modelo la edad del ternero en el momento de la vacunación. La probabilidad modelada fue que mostrar dos o más signos de neumonía >1 (binario, sí/no) y mostrar 1 signo de neumonía >2 era igual a 1. La probabilidad de eventos de salud se reportó como odds ratios (DO), con intervalos de confianza (IC) del 95%.
Resultados
Condiciones ambientales
La temperatura promedio en los galpones de terneros durante todo el período de alojamiento fue de 9.3 ± 4.01°C; La humedad relativa promedio fue de 81.3 ± 14.03%. La temperatura máxima del aire en los establos de terneros fue de 23,6 °C, la temperatura mínima del aire fue de -1,0 °C. La humedad relativa mínima y máxima fueron de 27 y 100%, respectivamente.
Puntuaciones de salud
De acuerdo con las puntuaciones de salud, no se observaron reacciones adversas después de la vacunación simultánea (Tabla 1), el CV no era más propenso a exhibir los signos de neumonía agrupados estadísticamente que el CONT (OR = 0,975, IC = 0,534-1,779).
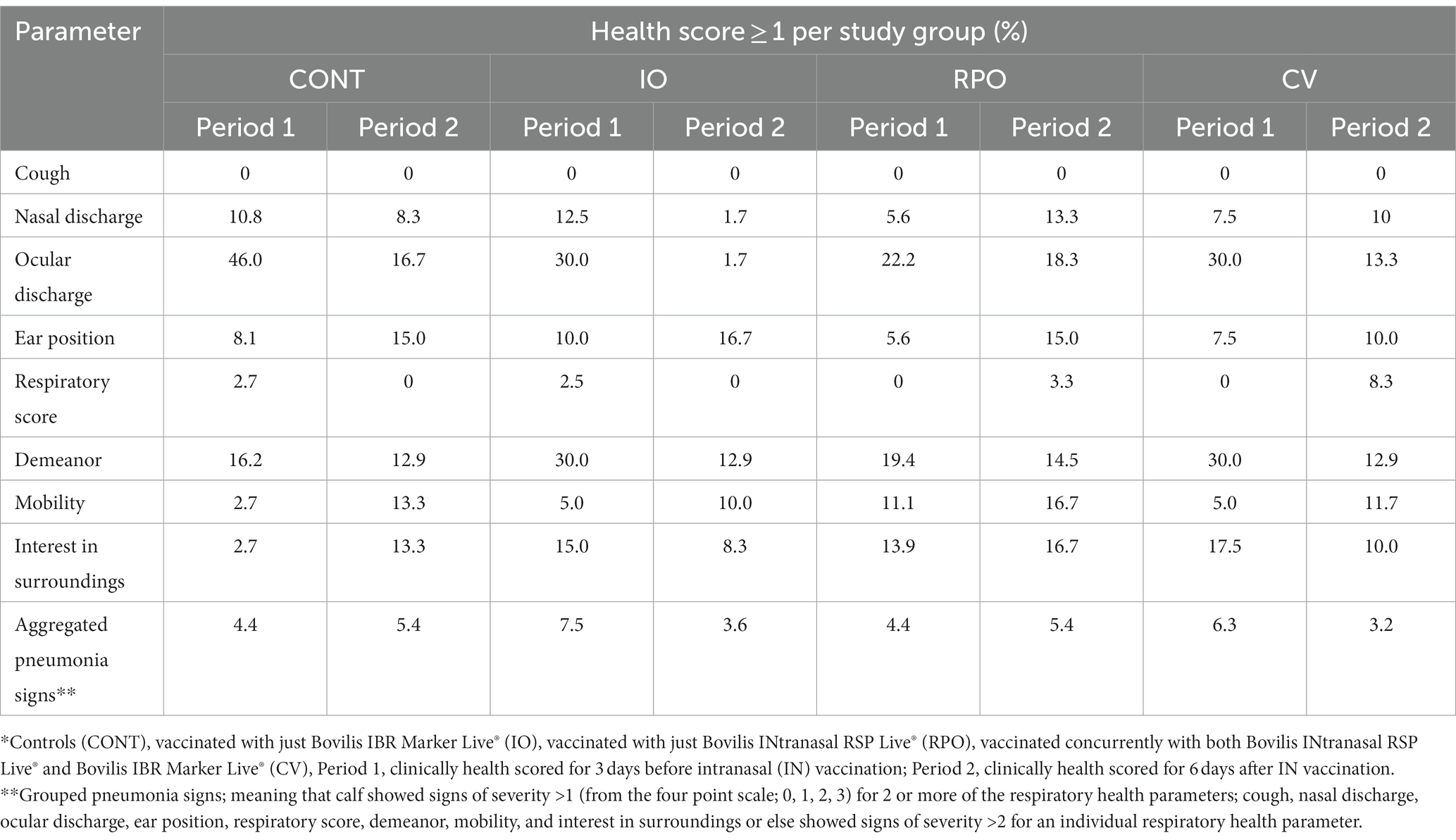 Tabla 1. Frecuencias de distribución (%) de las puntuaciones individuales y agrupadas de los factores de salud para cada grupo de estudio los días previos y posteriores a la vacunación con IN*.
Tabla 1. Frecuencias de distribución (%) de las puntuaciones individuales y agrupadas de los factores de salud para cada grupo de estudio los días previos y posteriores a la vacunación con IN*.
Temperatura rectal
El grupo de estudio no tuvo un efecto significativo sobre la temperatura rectal (p = 0,676), aunque se encontró que el método de administración de la vacuna afectó la probabilidad de que se presentara fiebre. Si bien la vacunación IN no aumentó la probabilidad de que un ternero tuviera fiebre (OR = 1,189; IC = 0,700-1,994), los terneros post-parto parenteral tuvieron 5,9 (IC = 3,610-9,752) veces más probabilidades de tener una temperatura > 39,5 °C (p < 0,0001) que después de la vacunación.
Pesos y ganancias medias diarias
El grupo de estudio tuvo un efecto significativo en las ganancias medias diarias (GMA) (p = 0,031; Tabla 2) desde la semana 3 hasta la semana 18 después de la vacunación, pero no hubo diferencia en los GMD (kg) entre los terneros CV y los CONT en ningún momento (Tabla 2).
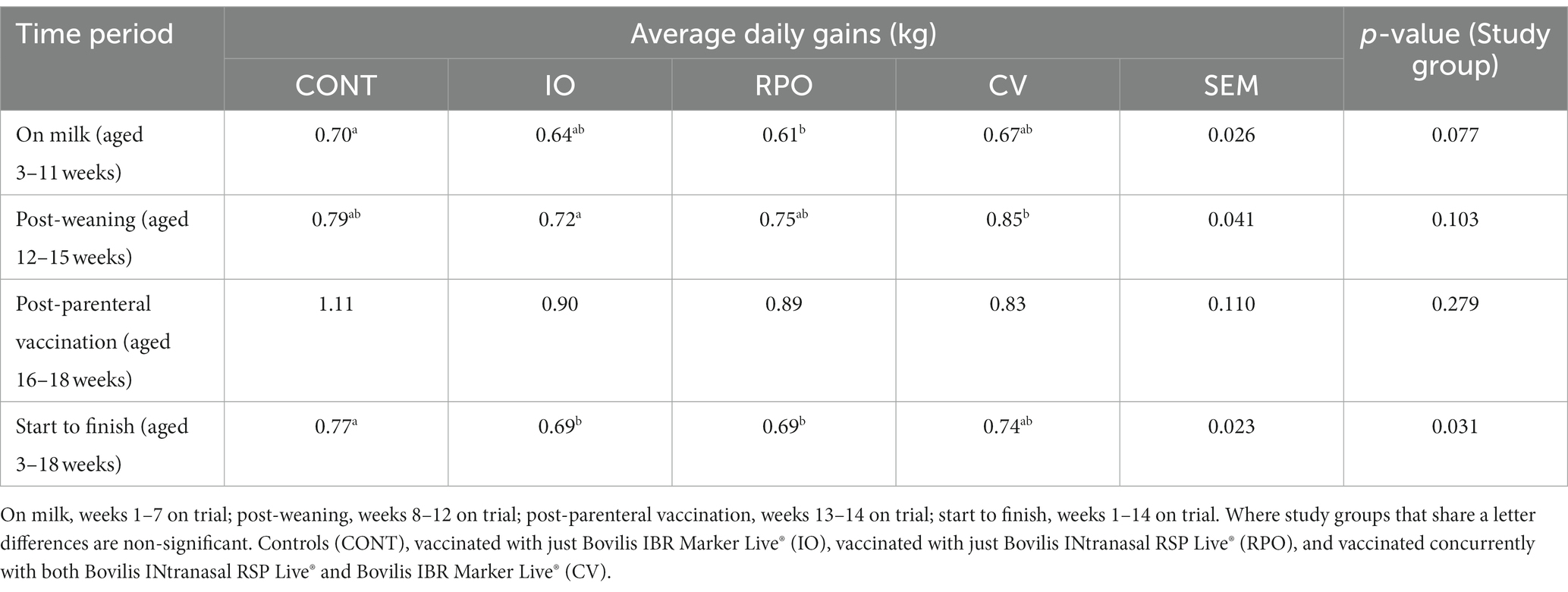 Tabla 2. Ganancia diaria promedio ajustada (kg) para cada grupo de estudio por períodos de tiempo, con la media de error estándar (SEM) en todos los grupos de estudio.
Tabla 2. Ganancia diaria promedio ajustada (kg) para cada grupo de estudio por períodos de tiempo, con la media de error estándar (SEM) en todos los grupos de estudio.
Sin embargo, los terneros CONT ganaron más peso que los terneros IO y RPO, que fueron similares (Tabla 2). Durante el período previo al destete, la RPO ganó en promedio 0,09 (±0,026) kg menos por día que la CONT (Tabla 2). La IO post-destete ganó 0,13 (± 0,041) kg menos por día que la CV (Tabla 2).
Hubo un efecto significativo de la interacción del grupo de estudio por semana sobre el peso del ternero (p = 0,026; Figura 1). Sin embargo, los terneros CV tuvieron un peso similar al de los terneros CONT a lo largo del estudio (p = 0,632; Figura 1).
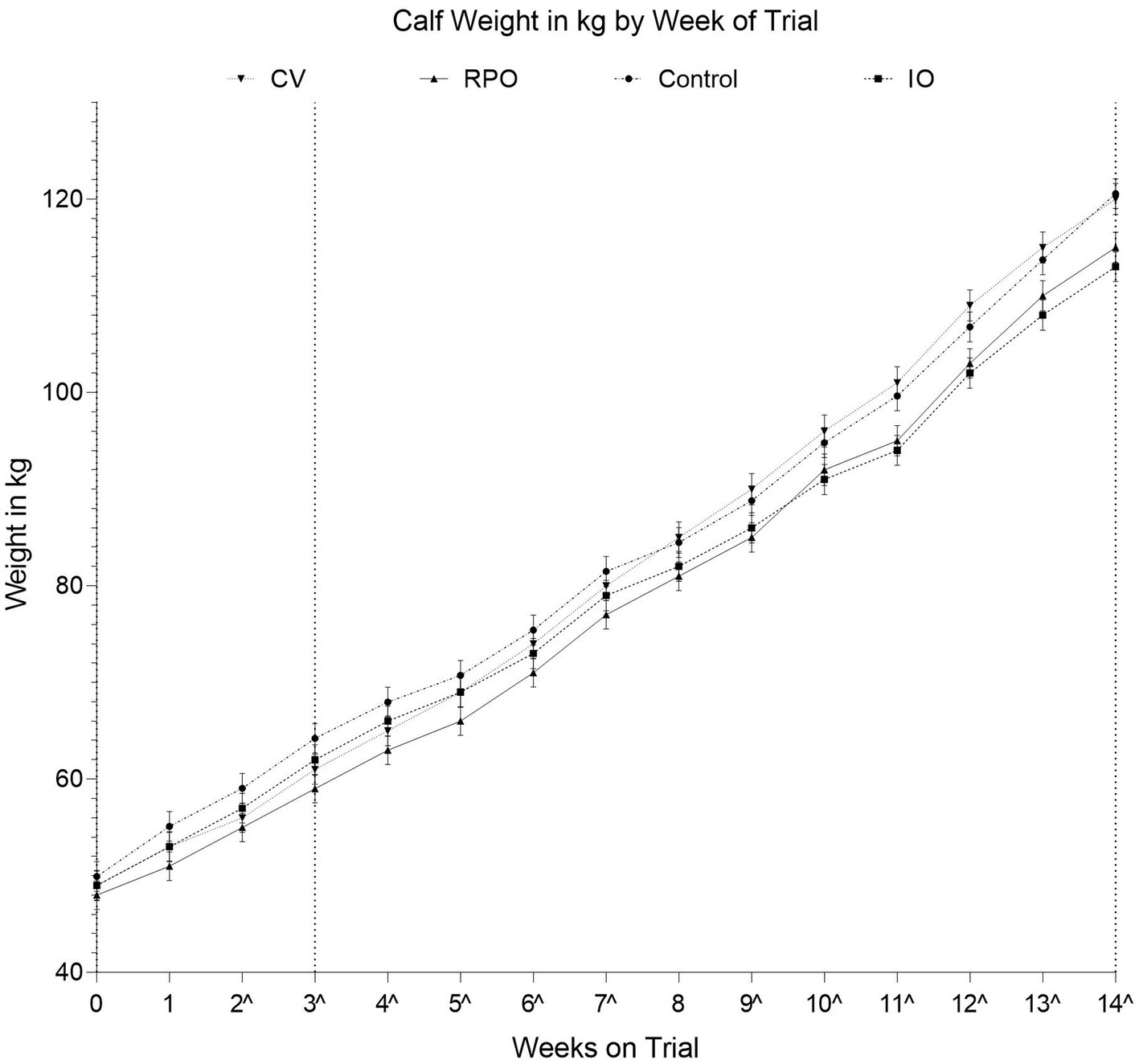 Figura 1. Ponderaciones promedio ajustadas para cada grupo de vacunación por número de semanas en el ensayo, los terneros tenían tres semanas de edad (22 ± 4,9 días de edad) el día de la vacunación con IN; Controles (CONT), vacunados solo con Bovilis IBR Marker Live (IO), vacunados solo con Bovilis INtranasal RSP Live (RPO), vacunados simultáneamente con Bovilis INtranasal RSP Live y Bovilis IBR Marker Live (CV). La línea discontinua en el eje x indica cada evento de muestreo de sangre posterior a la vacunación, ^ indica las semanas en las que los grupos fueron significativamente diferentes.
Figura 1. Ponderaciones promedio ajustadas para cada grupo de vacunación por número de semanas en el ensayo, los terneros tenían tres semanas de edad (22 ± 4,9 días de edad) el día de la vacunación con IN; Controles (CONT), vacunados solo con Bovilis IBR Marker Live (IO), vacunados solo con Bovilis INtranasal RSP Live (RPO), vacunados simultáneamente con Bovilis INtranasal RSP Live y Bovilis IBR Marker Live (CV). La línea discontinua en el eje x indica cada evento de muestreo de sangre posterior a la vacunación, ^ indica las semanas en las que los grupos fueron significativamente diferentes.
Anticuerpos específicos contra el virus
El grupo de estudio tuvo un efecto significativo en los niveles de anticuerpos contra PI3-V (p = 0,003). Si bien inicialmente no hubo diferencias significativas entre los grupos de estudio en los niveles de anticuerpos para PI3-V en el día 21 (p > 0,05), para el día 94, los terneros RPO y CV tenían anticuerpos PI3-V significativamente más altos que IO y CONT (p < 0,05; Figura 2). El grupo de estudio no fue significativo para los anticuerpos contra el BRSV a lo largo de la duración del estudio (p = 0,640), pero en el día 94, el CV tenía anticuerpos contra el BRSV significativamente más altos que el CONT (p = 0,0,011; Figura 2). Los terneros vacunados por vía intranasal contra BRSV y PI3-V a las 3 semanas de edad (RPO y CV) mostraron una mayor respuesta a ambos virus después de la vacunación parenteral contra BRSV/PI3-V en comparación con CONT e IO, que fueron similares (Figura 2).
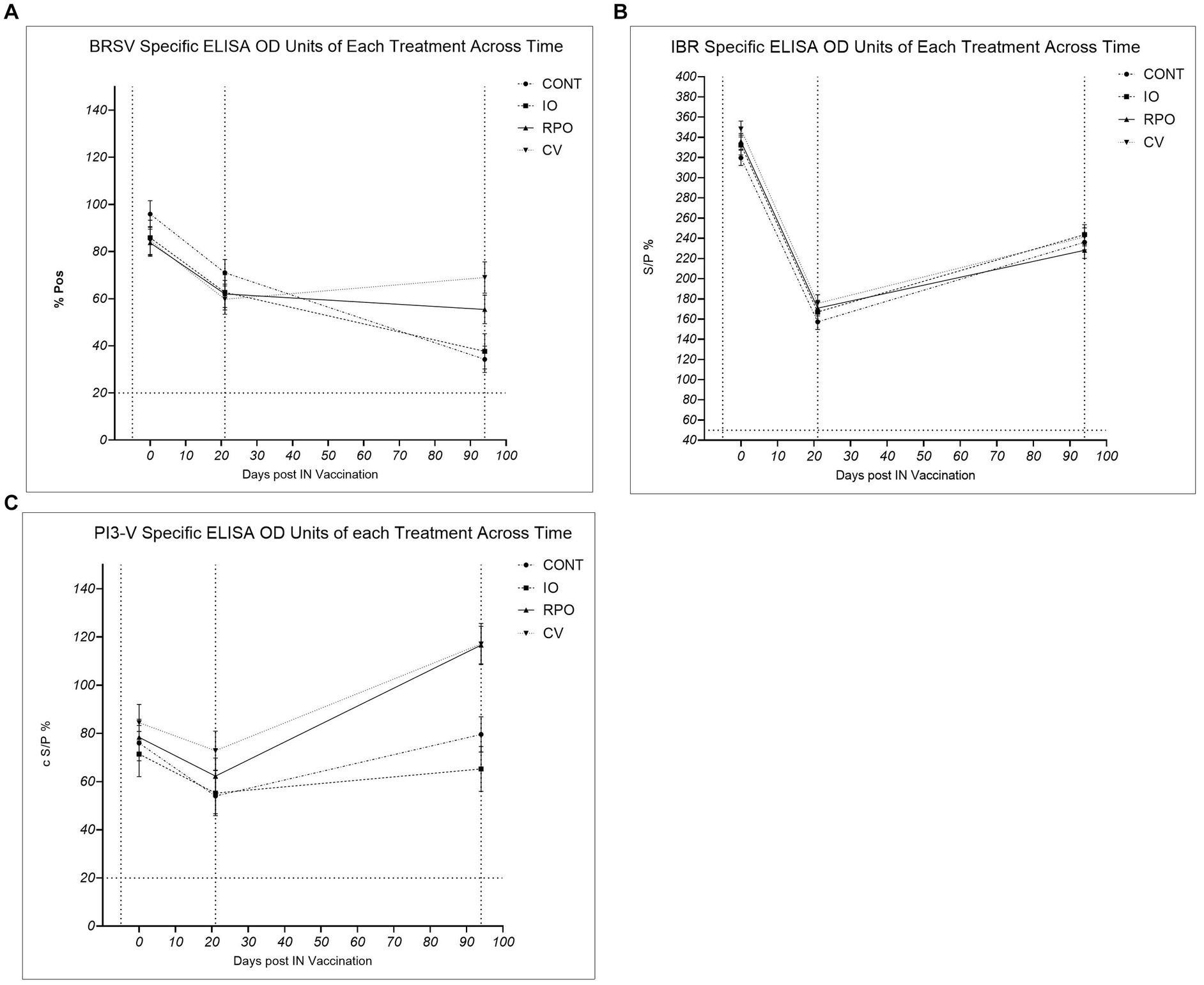 Figura 2. Virus del herpes bovino tipo 1 (IBR), parainfluenza tipo 3 (P13-V) y virus respiratorio sincitial bovino (BRSV), controles (CONT), vacunados solo con Bovilis IBR Marker Live (IO), vacunados solo con Bovilis INtranasal RSP Live (RPO), vacunados simultáneamente con Bovilis INtranasal RSP Live y Bovilis IBR Marker Live®®®® (CV). * c S/P % ≥ 20 = Positivo, ** % P ≥ 10 = Positivo, *** % S/P > 50 = Positivo. La línea discontinua en el eje x indica cada evento de muestreo de sangre en el día -5, el día 21 y el día 94, la línea discontinua en el eje y para el umbral de seropositividad. (A) BRSV %Pos *: Porcentaje de positividad corregido para anticuerpos contra BRSV en cada evento de muestreo de sangre ajustado del grupo de vacunación ± EE. (B) IBR ** S/P %: Promedio ajustado de la muestra de anticuerpos de SE del grupo ± SE a la proporción positiva de anticuerpos IBR (BoHV-1) en cada evento de sangre. (C) PI3-V c S/P %*: Promedio ajustado del grupo de vacunación ± muestra corregida por SE a la proporción positiva de anticuerpos P13-V en cada evento de muestreo de sangre.
Figura 2. Virus del herpes bovino tipo 1 (IBR), parainfluenza tipo 3 (P13-V) y virus respiratorio sincitial bovino (BRSV), controles (CONT), vacunados solo con Bovilis IBR Marker Live (IO), vacunados solo con Bovilis INtranasal RSP Live (RPO), vacunados simultáneamente con Bovilis INtranasal RSP Live y Bovilis IBR Marker Live®®®® (CV). * c S/P % ≥ 20 = Positivo, ** % P ≥ 10 = Positivo, *** % S/P > 50 = Positivo. La línea discontinua en el eje x indica cada evento de muestreo de sangre en el día -5, el día 21 y el día 94, la línea discontinua en el eje y para el umbral de seropositividad. (A) BRSV %Pos *: Porcentaje de positividad corregido para anticuerpos contra BRSV en cada evento de muestreo de sangre ajustado del grupo de vacunación ± EE. (B) IBR ** S/P %: Promedio ajustado de la muestra de anticuerpos de SE del grupo ± SE a la proporción positiva de anticuerpos IBR (BoHV-1) en cada evento de sangre. (C) PI3-V c S/P %*: Promedio ajustado del grupo de vacunación ± muestra corregida por SE a la proporción positiva de anticuerpos P13-V en cada evento de muestreo de sangre.
El grupo de estudio no tuvo un efecto significativo en los niveles de anticuerpos contra el BoHV-1 después de la vacunación IN o parenteral (Figura 2; p = 0,172). Debido a los altos niveles de anticuerpos específicos contra el BoHV-1 en el día 0, también se realizaron pruebas posteriores de IBR gE en los sueros del día -5 y el día 0. En el día 0, se confirmó la presencia de anticuerpos contra el virus BoHV-1 de tipo salvaje en sueros de terneros; los niveles de anticuerpos IBR gE tampoco mostraron diferencias significativas entre los grupos de estudio para los anticuerpos de tipo salvaje en el día -5 (p = 0,574) o el día 0 (p = 0,217).
Discusión
Respuesta serológica
No se aceptó la segunda hipótesis de que la vacunación concurrente provocaría una respuesta serológica detectable similar a la administración individual de la vacuna a los 21 días después del parto de la IN, y las vacunas no alteraron los niveles de anticuerpos en los terneros a las 3 semanas después de la IN. Se ha observado previamente que la vacunación frente a anticuerpos derivados de la madre puede no evocar una respuesta serológica, pero puede inducir una respuesta amnésica tras una exposición posterior al antígeno (36). No hubo diferencias significativas entre los grupos de estudio para ninguno de los tres virus en el día 21. Los niveles generales de anticuerpos disminuyeron para cada uno de los virus en todos los grupos de estudio, pero esta reducción de anticuerpos está en línea con las tasas observadas de tasas naturales de descomposición de anticuerpos de calostro de origen materno observadas por Kirkpatrick et al. (42). Es probable que la presencia de anticuerpos de origen materno enmascarara cualquier aparición detectable de respuestas serológicas a las vacunas IN; Sin embargo, los estudios han demostrado que las vacunas intranasales pueden asociarse con la regulación positiva de genes que conducen a la inducción de vías inmunitarias celulares innatas y específicas (43). La protección conferida por los anticuerpos maternos es algo contraria al desarrollo de una respuesta inmunitaria adaptativa a través de la vacunación, ya que los MDA pueden unirse a las partículas del virus, bloqueando el desarrollo de la expansión clonal de las células B por parte del propio sistema inmunitario de los terneros. Kirkpatrick et al. encontraron que estos anticuerpos derivados de la madre pueden persistir hasta 200 días para el BRSV, > 65 días para BoHV-1 y > 183 días para PI3-V. Barry et al. también encontraron que IBR, BRSV y PI3-V derivados del calostro persistieron durante varios meses (41, 42).
Los hallazgos del ELISA llevado a cabo no son del todo únicos, y varios otros estudios han observado que las vacunaciones de terneros frente a altos niveles de MDA a menudo no logran inducir una respuesta serológica, pero el sistema inmunológico de los terneros jóvenes puede mostrar un efecto amnésico al volver a encontrarse con las partículas del virus (23, 44). En nuestro estudio, esto se observó como una aparente respuesta «preparada» a la vacunación parenteral con BRSV y PI3-V en los terneros que habían recibido una vacuna IN previa (RPO y CV), lo que se debe a que las vacunas intranasales vivas probablemente provocan primero una respuesta no humoral predominantemente mediada por células (23, 28). Sin embargo, se observó una respuesta inmunitaria humoral en el día 94 cuando se observó una respuesta mejorada o «preparada» a las vacunas parenterales BRSV y PI3-V en los grupos de estudio CV y RPO. De manera crucial, estos niveles de anticuerpos para BRSV y PI3-V no fueron significativamente diferentes entre el RPO y el CV.
El estado inmunitario «preparado» observado en el día 94 en CV y RPO indica que la vacunación intranasal puso en marcha una respuesta inmunitaria innata en cascada al MLV en el lugar de la infección. Al reconocer una partícula de virus, el sistema inmunitario del huésped producirá una serie de quimiocinas y citocinas de señalización (45). Es posible que esta respuesta en cascada no dé lugar a un cambio serológico detectable; Sin embargo, un estudio previo demostró cómo es suficiente para superar un desafío de enfermedad (36). En este experimento y en otros, indujo mejores respuestas a una dosis de vacuna parenteral (46). Es posible que la señalización inmunitaria de las mucosas no confiera inmunidad a largo plazo, pero potencialmente protege a los terneros de la infección antes de que tengan la edad suficiente para desarrollar una respuesta inmunitaria sostenida o para construir una memoria inmunológica establecida a través de una segunda vacunación. Hay una serie de estudios que se han llevado a cabo en otros mamíferos que han demostrado cómo la influencia de los anticuerpos maternos puede perjudicar el desarrollo de las respuestas humorales, pero puede actuar para mejorar el desarrollo de la inmunidad y la señalización mediadas por células (35, 47, 48). Una posible explicación de cómo los terneros no mostraron una respuesta serológica 3 semanas después de la vacunación se debe a la influencia enmascaradora de los anticuerpos derivados de la madre. Esta capacidad de los anticuerpos derivados del calostro para limitar la eficacia de la vacunación intranasal está bien documentada (36). Otro estudio de metodología similar realizado por Palomares et al. que implicó la vacunación intranasal de terneros contra BoHV-1, BRSV y PI3-V, seguido de la administración de refuerzos parenterales o IN, encontró de manera similar que se producirá una respuesta de anticuerpos amnésicos a la vacunación con IN después de la administración de refuerzo parenteral; Curiosamente, el estudio también encontró que la vacunación subcutánea de refuerzo indujo títulos de anticuerpos específicos contra el BRSV y una concentración de IgA significativamente mayores en comparación con los terneros que no recibieron vacunación previa contra el virus de la inmunobrilidad (49). Sobre la base de estos hallazgos y los hallazgos del estudio actual, parecería que la administración de una vacuna IN al neonato seguida de un refuerzo parenteral puede ser la estrategia de vacunación más efectiva contra BoHV-1, BRSV y PI3-V.
Una estrategia alternativa que a veces se sugiere para intentar superar el efecto de enmascaramiento observado en terneros con títulos altos de MDA es vacunar al ternero inmediatamente después del nacimiento antes de que los anticuerpos del calostro se absorban y puedan surtir efecto sobre los antígenos derivados de la vacuna. Sin embargo, un estudio de 2023 realizado por Martínez et al. encontró que los terneros vacunados por vía intranasal al nacer con una vacuna MLV BRSV mostraron respuestas similares a los controles después de un desafío posterior de la enfermedad (50). Sugerir esta práctica no es beneficioso. La vacunación intranasal varias semanas después del calostro seguida de un refuerzo parenteral después del destete posterior puede proporcionar una mejor protección, mientras que un estudio de 2012 realizado por Hill et al. encontró que vacunar a los terneros por vía intranasal a los 0 días y luego nuevamente a los 35 días de edad con una vacuna MLV contra el virus del herpes bovino 1, el virus de la diarrea viral bovina 1 y el virus de la diarrea viral bovina 2 indujo la producción de IgA (46). Tal vez se justifique un estudio para investigar más a fondo el momento más óptimo de administración de la vacunación contra la IN al ternero neonatal y debería ser un tema de investigación adicional.
Los terneros de este estudio tenían altos niveles iniciales de inmunoglobulinas a los virus en cuestión, lo que probablemente se deba a que recibieron calostro de alta calidad, superior al 22% en el refractómetro Brix, equivalente a 50 mg/mL (40, 51). Un buen manejo del calostro es una piedra angular de la cría de terneros, siempre debe priorizarse para garantizar una protección óptima contra enfermedades infecciosas en el ternero joven, independientemente del plan de vacunación o el estado de la enfermedad del rebaño (39, 41).
Curiosamente, los niveles de anticuerpos IBR se mantuvieron similares en todos los grupos de estudio en las semanas posteriores a la vacunación con IN e incluso en el día 94, es decir, después de la administración de la vacuna parenteral. El programa de vacunación IBR del rebaño del que se seleccionaron los terneros incluidos en el experimento implicó vacunar a las madres en promedio 4 semanas antes del parto, lo que puede explicar en parte los altos niveles de anticuerpos observados en los terneros en el día 0. Además, nuestra posterior repetición de las pruebas de sueros de terneros para BoHV-1 gE reveló que los anticuerpos contra el virus IBR de tipo salvaje también estaban presentes en los sueros de terneros en el día 0. Por lo tanto, es probable que los anticuerpos BoHV-1 de tipo salvaje presentes en el calostro fueran de niveles lo suficientemente altos como para enmascarar cualquier respuesta a las vacunas intranasales de IBR administradas a los terneros IO y CV. En este tipo de rebaños con infección circulante, se recomienda que los animales jóvenes sean vacunados antes de ingresar al rebaño maduro. Si bien la vacunación intranasal no siempre permite una fuerte respuesta humoral o de células T, sí garantiza la administración dirigida del antígeno a la superficie mucosa, lo que se cree que confiere protección directamente en el sitio de entrada del patógeno (52).
La vacunación intranasal también puede desempeñar un papel adicional en la preparación de los terneros para una segunda vacunación parenteral, ayudando a inducir una mejor respuesta humoral endógena a medida que los anticuerpos derivados de la madre se desintegran. La capacidad de las vacunas intranasales para inducir también esta inmunidad mucosa es una de sus principales ventajas para su uso en animales jóvenes. Woolums et al. encontraron que la vacunación IN contra el BRSV con MLV resultó en un aumento de los niveles de IFN-γ (una citocina de señalización inmune clave) después de un desafío inducido con BRSV (37). Si bien este ensayo no contenía ningún componente de desafío para verificar la eficacia de la vacuna, otro estudio de vacunas IN con una metodología similar mostró que las vacunas IN MLV pueden desencadenar respuestas inmunitarias innatas localizadas en la mucosa (31). Postularíamos que las pruebas adicionales de moduladores inflamatorios, por ejemplo, IFN-α e IFN-γ, pueden haber revelado una respuesta inmune innata detectable a las vacunas IN (37, 53, 54).
Efecto de la vacunación en el aumento de peso medio diario
No se rechazó la hipótesis de que la vacunación CV no tendría ningún efecto sobre el peso, mientras que inicialmente se podría haber esperado que la vacunación resultaría en una mejora del aumento de peso al reducir la infección asociada con el mal ahorro. Las ganancias medias diarias fueron las mismas en CV y CONT. Por lo tanto, tanto los GMD medios CV como los CONT cumplieron con el objetivo recomendado de 0,70 kg/día para la ganancia de peso diaria promedio antes del destete en terneros lecheros y de carne lechera (55, 56). Los terneros IO y RPO ganaron significativamente menos peso que los CONT. Este es un hallazgo interesante, ya que sugeriría que la vacunación simultánea no tuvo ningún efecto sobre el aumento de peso, pero que la vacunación con la vacuna para BoHV-1 o BRSV/PI3-V sola puede haber resultado en peores rendimientos de crecimiento. La razón de esta diferencia sigue sin estar clara y tal vez justifique una mayor investigación. Varios otros estudios también han encontrado que la vacunación contra el virus de la neumonía en terneros puede no resultar en un mejor aumento de peso en los terneros (57-59). Es posible que los episodios de diarrea leve que, en todos los grupos de tratamiento durante el ensayo, también fueran en parte responsables de estas tasas de crecimiento generalmente bajas. Además, dado que se retiraron tres terneros del estudio (dos animales del grupo CONT y uno del grupo RPO), antes de completarlo debido a enfermedades gastrointestinales no relacionadas, también es posible que el experimento tuviera poca potencia, lo que significa que cualquier diferencia potencial en el aumento de peso no observada se debió a la reducción del tamaño de los grupos. Si bien este estudio ha demostrado que el desafío inicial de los virus de la vacuna viva modificada puede haber afectado el aumento de peso de los terneros a corto plazo, tal vez valga la pena sopesar esto con los riesgos para el bienestar y el rendimiento de los animales que pueden plantearse a través de la aparición de una infección aguda, si los animales van a permanecer ingenuos y contraer los virus.
Está bien documentado que los brotes de enfermedades respiratorias tienen implicaciones a largo plazo en el rendimiento de los animales. También se ha sugerido que la neumonía subclínica es a menudo una causa subyacente de mala conducta tanto en animales lecheros como de carne (60). No alcanzar los pesos objetivo tiene implicaciones a largo plazo en la fertilidad de las vaquillas y el rendimiento de la producción (13, 61). La mala salud, por supuesto, reduce el aumento de peso de los terneros, tanto directamente a través de la carga metabólica de combatir una infección, ya sea aguda o crónica, como indirectamente, ya que la aparición sintomática reducirá el concentrado de terneros y la ingesta de leche. Los estudios post-mortem también pueden encontrar que muchos animales que han experimentado neumonía en la cría presentarán lesiones en el momento del sacrificio, lo que sugiere una infección crónica de por vida. La vacunación de los animales jóvenes podría ofrecer un efecto protector contra el desarrollo de este estado de retraso en el crecimiento debido a una infección persistente.
Signos de neumonía
Se encontró que los terneros vacunados simultáneamente no tenían más probabilidades de mostrar signos de neumonía en los días posteriores a la vacunación que los CONT. Los resultados de la temperatura rectal también mostraron que los terneros no experimentaron una respuesta febril a las vacunas intranasales. Si bien este estudio involucró un tamaño de muestra pequeño de 10 terneros, en una sola granja, no se observaron efectos adversos después de la vacunación. La ausencia de diferencias significativas en las puntuaciones de salud, los signos de neumonía y las temperaturas rectales sugeriría que es probable que sea seguro administrar Bovilis IBR Marker Live solo® y Bovilis Intranasal RSP Live simultáneamente®.
Implicaciones futuras
La vacunación intranasal concurrente dio lugar a una respuesta exitosa de «cebado» a la exposición posterior a los antígenos BRSV y PI3-V. Este «cebado» quedó demostrado por las respuestas antigénicas anamnésicas observadas tras la administración de una vacuna parenteral posterior. Este es un hallazgo importante, ya que se relaciona directamente con los terneros vacunados frente a los MDA. Si los ensayos para autorizar la eficacia de la vacuna se llevan a cabo en terneros seronegativos privados de calostro, no son directamente aplicables a las prácticas en las granjas, ya que los terneros que reciben calostro estarán sujetos a esta interferencia de los MDA. Sin embargo, los hallazgos de este estudio sugieren que la vacunación IN puede ser efectiva para preparar a los terneros para una mejor respuesta serológica a una inyección parental y que la administración de ambas vacunas simultáneamente es probablemente segura. El hallazgo también sugiere que ambas vacunas intranasales podrían administrarse simultáneamente de manera segura a partir de las 3 semanas de edad, una consideración importante para la facilidad de manejo de los animales y, además, si un granjero/veterinario opta por vacunar ante un brote si se desconocen los agentes virales causantes de un brote infeccioso.
El objetivo de un programa de vacunación no es solo reducir la propagación de la enfermedad, sino también limitar críticamente la diseminación viral en animales ya infectados (62, 63). Se recomienda, por ejemplo, que las novillas de reemplazo lechero se sometan a un plan de vacunación en su primer año de vida para evitar ingresar al rebaño sin antecedentes a los virus que ya circulan en el rebaño de vacas maduras. Si las novillas contraen estos virus, ya sea cuando son terneros jóvenes o cuando ingresan al rebaño de ordeño, puede conducir a una reducción de la producción de leche. La vacunación intranasal puede ser crucial para reducir la dependencia de los antimicrobianos en el tratamiento de las infecciones respiratorias, siendo la neumonía una de las principales razones para su uso en terneros predestetados (18, 62). Dado que estudios recientes han aislado Mannheimia haemolytica multirresistente de ganado vacuno de alto riesgo después de la metafilaxis antimicrobiana, es importante que los ganaderos y veterinarios empleen estrategias para limitar esta dependencia de los antimicrobianos (64). La vacunación, cuando se combina con un manejo optimizado del calostro, la nutrición y el alojamiento, debería actuar para reducir la incidencia de infecciones respiratorias en terneros predestetados.
Conclusión
Los resultados de este ensayo de campo sugieren que los terneros vacunados por vía intranasal mediante la administración simultánea de IBR Marker Live y Bovilis INtranasal RSP Live®® a las 3 semanas de edad pueden desarrollar una respuesta amnésica a los antígenos BRSV y PI3-V. Esta respuesta de «cebado» se observó después de una segunda exposición a los antígenos del virus en una vacunación parenteral a las 15 semanas de edad, lo que indica que la vacunación intranasal seguida de la vacunación parental mejoró la inmunidad al BRSV y PI3-V en terneros lecheros y de carne lechera predestetados en comparación con los terneros CONT a los que solo se les administró una vacunación parental diferida. Además, podría dar lugar a una mayor eficacia de las vacunas parentales contra la neumonía administradas posteriormente.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, previa solicitud.
Declaración ética
El estudio en animales fue aprobado por el Comité de Ética Animal de Teagasc (TAEC2020-278), y la Autoridad Reguladora de Productos Sanitarios otorgó una licencia (Número de licencia de ensayo clínico de campo: CT10452/002). El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
AF: Análisis formal, Investigación, Metodología, Redacción – borrador original, Curación de datos, Administración de proyectos. CaM: Conceptualización, Metodología, Supervisión, Redacción – revisión y edición. KS: Metodología, Administración de proyectos, Recursos, Redacción – revisión y edición. RF: Administración de proyectos, Recursos, Redacción, revisión y edición. CS: Metodología, Redacción – revisión y edición. BC: Metodología, Obtención de fondos, Redacción, revisión y edición. CoM: Supervisión, Redacción – revisión y edición. EK: Conceptualización, Curación de datos, Análisis formal, Obtención de fondos, Investigación, Metodología, Administración de proyectos, Recursos, Visualización de supervisión, Redacción – revisión y edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Esta investigación fue financiada por la Fundación de Ciencias de Irlanda (SFI) y el Departamento de Agricultura, Alimentación y Marina en nombre del Gobierno de Irlanda bajo el número de subvención [16/RC/3835]—VistaMilk.
Reconocimientos
Los autores agradecen a sus colegas de MSD Animal Health por su contribución en la preparación del manuscrito.
Conflicto de intereses
Entre los coautores se encuentran empleados de MSD Animal Health, la empresa que comercializa las vacunas que se utilizaron en el estudio que se presenta en este documento. No tenían ningún papel en la recopilación, el análisis o la interpretación de los datos. Colaboraron en el diseño del estudio, en la aleatorización de los animales y en la revisión del manuscrito. Los individuos responsables de la recolección de datos fueron ciegos en cuanto a los grupos de tratamiento durante la fase de recolección de datos del experimento.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Dubrovsky, SA, van Eenennaam, AL, Karle, BM, Rossitto, PV, Lehenbauer, TW y Aly, SS. Enfermedad respiratoria bovina (BRD) específica de la causa y mortalidad general en terneros predestetados en lecherías de California: el estudio BRD 10K. J Lácteos Sci. (2019) 102:7320–8. doi: 10.3168/jds.2018-15463
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Taylor, JD, Fulton, RW, Lehenbauer, TW, Step, DL y Confer, AW. La epidemiología de la enfermedad respiratoria bovina: ¿cuál es la evidencia de los factores predisponentes? ¿Puede Vet J. (2010) 51:1351–9.
3. Panciera, RJ, y Confer, AW. Patogenia y patología de la neumonía bovina. Veterinario Clin. (2010) 26:191–214. doi: 10.1016/j.cvfa.2010.04.001
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Departamento de Agricultura, Alimentación y Marina de Irlanda, Instituto de Agroalimentación y Biociencias, Irlanda del Norte. (2021). Disponible en: http://www.animalhealthsurveillance.agriculture.gov.ie/
5. Ollivett, TL y Buczinski, S. Uso de la ecografía en la granja para la enfermedad respiratoria bovina. Veterinario Clin. (2016) 32:19–35. doi: 10.1016/j.cvfa.2015.09.001
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Ellis, JA. Actualización sobre la patogénesis viral en la ERB. Anim Health Res Rev. (2009) 10:149–53. doi: 10.1017/S146625230999020X
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Gaudino, M, Nagamine, B, Ducatez, MF y Meyer, G. Comprensión de los mecanismos de las coinfecciones virales y bacterianas en la enfermedad respiratoria bovina: una revisión exhaustiva de la literatura de la evidencia experimental. Res. Veterinaria. (2022) 53:70. doi: 10.1186/s13567-022-01086-1
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Blakebrough-Hall, C, McMeniman, JP, y González, LA. Una evaluación de los efectos económicos de la enfermedad respiratoria bovina sobre el rendimiento de los animales, las características de la canal y los resultados económicos en el ganado de engorde definido mediante cuatro métodos de diagnóstico de BRD. J Anim Sci. (2020) 98:skaa005. doi: 10.1093/jas/skaa005
9. Cuevas-Gómez, I, McGee, M, Sánchez, JM, O’Riordan, E, Byrne, N, McDaneld, T, et al. Asociación entre signos respiratorios clínicos, lesiones pulmonares detectadas por ecografía torácica y rendimiento de crecimiento en terneros lecheros predestetados. Ir Vet J. (2021) 74:1–9. doi: 10.1186/s13620-021-00187-1
10. McGill, JL, y Sacco, RE. La inmunología de la enfermedad respiratoria bovina: avances recientes. Vet Clin North Am Food Anim Pract. (2020) 36:333–48. doi: 10.1016/j.cvfa.2020.03.002
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. van der Fels-Klerx, HJ, Saatkamp, HW, Verhoeff, J, y Dijkhuizen, AA. Efectos de la enfermedad respiratoria bovina sobre la productividad de las novillas lecheras cuantificados por expertos. Livest Prod Sci. (2002) 75:157–66. doi: 10.1016/S0301-6226(01)00311-6
12. Bach, A. Asociaciones entre varios aspectos del desarrollo de las vaquillas y la supervivencia de las vacas lecheras hasta la segunda lactancia. J Lácteos Sci. (2011) 94:1052–7. doi: 10.3168/jds.2010-3633
13. Dunn, TR, Ollivett, TL, Renaud, DL, Leslie, KE, LeBlanc, SJ, Duffield, TF, et al. El efecto de la consolidación pulmonar, determinada por ecografía, en la producción de leche de la primera lactancia en terneros lecheros Holstein. J Lácteos Sci. (2018) 101:5404–10. doi: 10.3168/jds.2017-13870
14. Delabouglise, A, James, A, Valarcher, JF, Hagglünd, S, Raboisson, D, y Rushton, J. Vinculación de la epidemiología de la enfermedad y la productividad del ganado: el caso de la enfermedad respiratoria bovina en Francia. PLoS Uno. (2017) 12:e0189090. doi: 10.1371/journal.pone.0189090
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Fernández, M, Ferreras, MC, Giráldez, FJ, Benavides, J, y Pérez, V. Importancia en la producción de lesiones por enfermedad respiratoria bovina en bovinos de carne sacrificados. Animales. (2020) 10:1770. doi: 10.3390/ani10101770
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Wilson, BK, Step, DL, Maxwell, CL, Gifford, CA, Richards, CJ y Krehbiel, CR. Efecto de la enfermedad respiratoria bovina durante el período de recepción sobre el rendimiento de engorde de novillos, la eficiencia, las características de la canal y los puntajes pulmonares. Prof. Anim Sci. (2017) 33:24–36. doi: 10.15232/pas.2016-01554
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Bokma, J, Boone, R, Deprez, P, y Pardon, B. Factores de riesgo para el uso de antimicrobianos en terneros y su asociación con la mortalidad. J Lácteos Sci. (2019) 102:607–18. doi: 10.3168/jds.2018-15211
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Kuipers, A, Koops, WJ y Wemmenhove, H. Uso de antibióticos en rebaños lecheros en los Países Bajos de 2005 a 2012. J Lácteos Sci. (2016) 99:1632–48. doi: 10.3168/jds.2014-8428
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Pardon, B, Catry, B, Dewulf, J, Persoons, D, Hostens, M, de Bleecker, K, et al. Estudio prospectivo sobre el uso cuantitativo y cualitativo de antimicrobianos y antiinflamatorios en terneros de ternera blanca. J Quimiotera antimicrobiana. (2012) 67:1027–38. doi: 10.1093/jac/dkr570
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Sawant, AA, Sordillo, LM, y Jayarao, BM. Una encuesta sobre el uso de antibióticos en rebaños lecheros en Pensilvania. J Lácteos Sci. (2005) 88:2991–9. doi: 10.3168/jds. S0022-0302(05)72979-9
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Mathew, AG, Cissell, R y Liamthong, S. Resistencia a los antibióticos en bacterias asociadas con animales destinados a la alimentación: una perspectiva de los Estados Unidos sobre la producción ganadera. Pathog Dis. (2007) 4:115–33. doi: 10.1089/fpd.2006.0066
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. van Boeckel, TP, Brower, C, Gilbert, M, Grenfell, BT, Levin, SA, Robinson, TP, et al. Tendencias mundiales en el uso de antimicrobianos en animales destinados a la alimentación. Proc Natl Acad Sci. (2015) 112:5649–54. doi: 10.1073/pnas.1503141112
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. Chamorro, MF, Woolums, A, y Walz, PH. Vacunación de terneros contra virus respiratorios comunes frente a anticuerpos de origen materno (IFOMA). Anim Health Res Rev. (2016) 17:79–84. doi: 10.1017/S1466252316000013
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Fulton, RW. Investigación sobre enfermedades respiratorias bovinas (1983-2009). Anim Health Res Rev. (2009) 10:131–9. doi: 10.1017/S146625230999017X
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Urban-Chmiel, R, y Grooms, D. Prevención y control de las enfermedades respiratorias bovinas. J Ciencia Ganadera. (2012) 3:27–36.
26. Woolums, A.R. Vacunación de terneros. En American Association of Bovine Practitioners Actas de la conferencia anual. Vancouver, Columbia Británica: Frontier Printers, Inc. (2007).
27. Smith, DR. Factores de riesgo de enfermedad respiratoria bovina en ganado vacuno. Anim Health Res Rev. (2020) 21:149–52. doi: 10.1017/S1466252320000110
Resumen de PubMed | Texto completo de Crossref | Google Académico
28. Chase, CC, Hurley, DJ, y Reber, AJ. Desarrollo inmunitario neonatal en el ternero y su impacto en la respuesta a la vacuna. Vet Clin N Am Food Anim Pract. (2008) 24:87–104. doi: 10.1016/j.cvfa.2007.11.001
Resumen de PubMed | Texto completo de Crossref | Google Académico
29. Persecución, CCL. Estrategias aceptables de vacunación de terneros jóvenes: ¿qué, cuándo y cómo? Las clínicas veterinarias de América del Norte. Anim Práctica de Alimentos. (2022) 38:17–37. doi: 10.1016/j.cvfa.2021.11.002
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Barrington, GM, y Parish, SM. Inmunología neonatal bovina. Vet Clin N Am Food Anim Pract. (2001) 17:463–76. doi: 10.1016/s0749-0720(15)30001-3
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Chamorro, MF, y Palomares, RA. Vacunación contra patógenos virales contra enfermedades respiratorias bovinas: vacunas de antígenos vivos modificados versus inactivados, intranasales versus parenterales, ¿cuál es la evidencia? Veterinario Clin Comida Anim Pract. (2020) 36:461–72. doi: 10.1016/j.cvfa.2020.03.006
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. Cortese, VS. Inmunología neonatal. Vet Clin N Am Food Anim Pract. (2009) 25:221–7. doi: 10.1016/j.cvfa.2008.10.003
33. Bryson, G, Adair, BM, McNulty, MS, McAliskey, M, Bradford, HEL, Allan, GM, et al. Estudios sobre la eficacia de la vacunación intranasal para la prevención de la neumonía por el virus de la parainfluenza tipo 3 inducida experimentalmente en terneros. Rec. Veterinario (1999) 145:33–9. doi: 10.1136/vr.145.2.33
Resumen de PubMed | Texto completo de Crossref | Google Académico
34. Vangeel, I, Antonis, AFG, Fluess, M, Riegler, L, Peters, AR, y Harmeyer, SS. Eficacia de una vacuna intranasal modificada contra el virus respiratorio sincitial bovino en terneros de 3 semanas de edad desafiados experimentalmente con BRSV. Veterinario J. (2007) 174:627–35. doi: 10.1016/j.tvjl.2006.10.013
Resumen de PubMed | Texto completo de Crossref | Google Académico
35. Meganck, V, Opsomer, G, Piepers, S, Cox, E y Goddeeris, BM. Los leucocitos calostros maternos parecen mejorar la respuesta de recuerdo mediada por células, pero inhiben la respuesta de recuerdo humoral en terneros vacunados prime-boost. J Reprod Immunol. (2016) 113:68–75. doi: 10.1016/j.jri.2015.11.004
Resumen de PubMed | Texto completo de Crossref | Google Académico
36. Windeyer, MC y Gamsjäger, L. Vacunación de terneros frente a anticuerpos maternos: desafíos y oportunidades. Veterinario Clin Comida Anim Pract. (2019) 35:557–73. doi: 10.1016/j.cvfa.2019.07.004
Resumen de PubMed | Texto completo de Crossref | Google Académico
37. Woolums, AR, Brown, CC, Brown, JC Jr, Cole, DJ, Scott, MA, Williams, SM, et al. Efectos de una dosis intranasal única de la vacuna contra el virus respiratorio sincitial bovino vivo modificado sobre la resistencia al desafío viral posterior en terneros. Am J Vet Res. (2004) 65:363–72. doi: 10.2460/ajvr.2004.65.363
Resumen de PubMed | Texto completo de Crossref | Google Académico
38. Barry, J, Kennedy, E, Sayers, R, De Boer, IJM, y Bokkers, EAM. Desarrollo de un protocolo de evaluación del bienestar de los terneros lecheros desde el nacimiento hasta el destete. Evaluación del bienestar de los terneros que alimentan con calostro. (2019) 28:331–344. doi: 10.7120/09627286.28.3.331
39. Barry, J, Bokkers, EAM, Berry, DP, de Boer, IJM, McClure, J y Kennedy, E. Asociaciones entre el manejo del calostro, la inmunidad pasiva, las prácticas de higiene relacionadas con los terneros y las tasas de mortalidad en terneros lecheros antes del destete. J Lácteos Sci. (2019) 102:10266–76. doi: 10.3168/jds.2019-16815
Resumen de PubMed | Texto completo de Crossref | Google Académico
40. Bielmann, V, Gillan, J, Perkins, NR, Skidmore, AL, Godden, S, y Leslie, KE. Evaluación de instrumentos de refractometría brix para la medición de la calidad del calostro en ganado lechero. J Lácteos Sci. (2010) 93:3713–21. doi: 10.3168/jds.2009-2943
Resumen de PubMed | Texto completo de Crossref | Google Académico
41. Barry, J, Bokkers, EAM, Sayers, R, Murphy, JP, de Boer, IJM y Kennedy, E. Efecto de la alimentación con calostro de una sola madre o combinado en la inmunidad de origen materno en terneros lecheros. J Lácteos Sci. (2022) 105:560–71. doi: 10.3168/jds.2021-20343
Resumen de PubMed | Texto completo de Crossref | Google Académico
42. Kirkpatrick, J, Fulton, RW, Burge, LJ, DuBois, WR y Payton, M. Inmunidad transferida pasivamente en terneros recién nacidos, tasa de decaimiento de anticuerpos y efecto en la vacunación posterior con vacuna de virus vivo modificado. Práctica bovina. (2019) 35:47–55. doi: 10.21423/bovine-vol35no1p47-55
43. Nuijten, P, Cleton, N, van der Loop, J, Makoschey, B, Pulskens, W, y Vertenten, G. Activación temprana de la inmunidad innata y de vías inmunitarias celulares específicas después de la vacunación con una vacuna viral intranasal viva y el desafío con el virus de la parainfluenza bovina tipo 3. Vacuna. (2022) 10:104. doi: 10.3390/vaccines10010104
Resumen de PubMed | Texto completo de Crossref | Google Académico
44. Menanteau-Horta, A, Ames, TR, Johnson, DW, y Meiske, JC. Efecto de los anticuerpos maternos sobre la vacunación con vacunas contra la rinotraqueítis infecciosa bovina y la diarrea por virus bovino. Can J Comp Med. (1985) 49:10–4.
45. Firth, MA, Shewen, PE, y Hodgins, DC. Componentes pasivos y activos de las defensas inmunitarias innatas neonatales. Anim Health Res Rev. (2005) 6:143–58. doi: 10.1079/AHR2005107
Resumen de PubMed | Texto completo de Crossref | Google Académico
46. Hill, KL, Hunsaker, BD, Townsend, HG, van Drunen Littel-van den Hurk, S, y Griebel, PJ. Respuesta inmunitaria de la mucosa en terneros Holstein recién nacidos que tenían anticuerpos de origen materno y fueron vacunados con una vacuna intranasal multivalente de virus vivos modificados. J Am Vet Med Assoc. (2012) 240:1231–40. doi: 10.2460/javma.240.10.1231
47. Williams, PP. Efectos inmunomoduladores de los leucocitos calostros maternos intestinales absorbidos por cerdos neonatos. Can J Vet Res. (1993) 57:1–8.
48. Tuboly, S, Bernáth, S, Glávits, R, Kovács, A, y Megyeri, Z. Absorción intestinal de linfocitos calostrales en corderos recién nacidos y su papel en el desarrollo del estado inmunológico. Acta Vet Hung. (1995) 43:105–15.
49. Palomares, RA, Bittar, JHJ, Woolums, AR, Hoyos-Jaramillo, A, Hurley, DJ, Saliki, JT, et al. Comparación de la respuesta inmunitaria tras la vacunación subcutánea versus intranasal de refuerzo de virus vivos modificados contra la enfermedad respiratoria bovina en terneros de carne predestete que habían recibido la vacunación primaria por vía intranasal. Veterinario Inmunol Inmunopatíaco. (2021) 237:110254. doi: 10.1016/j.vetimm.2021.110254
Resumen de PubMed | Texto completo de Crossref | Google Académico
50. Martínez, DA, Chamorro, MF, Passler, T, Huber, L, Walz, PH, Thoresen, M, et al. Respuestas de anticuerpos locales y sistémicos en terneros de carne vacunados con una vacuna contra el virus respiratorio sincitial bovino (BRSV) de virus vivo modificado al nacer después de la infección por BRSV. Veterinaria Sci. (2023) 10:20. doi: 10.3390/vetsci10010020
51. Buczinski, S, Fecteau, G, Chigerwe, M, y Vandeweerd, JM. Precisión diagnóstica del refractómetro y el refractómetro brix para evaluar el fracaso de la transferencia pasiva en terneros: protocolo para una revisión sistemática y metaanálisis. Anim Health Res Rev. (2016) 17:3–8. doi: 10.1017/S1466252316000074
52. Correa, VA, Portilho, AI, y De Gaspari, E. Vacunas, adyuvantes y factores clave para la respuesta inmune de las mucosas. Inmunología. (2022) 167:124–38. doi: 10.1111/imm.13526
Resumen de PubMed | Texto completo de Crossref | Google Académico
53. Kimman, T, Westenbrink, F y Straver, P. Preparación para las respuestas de memoria de anticuerpos locales y sistémicos al virus respiratorio sincitial bovino: efecto de la cantidad de virus, replicación del virus, vía de administración y anticuerpos maternos. Veterinario Inmunol Inmunopatíaco. (1989) 22:145–60. doi: 10.1016/0165-2427(89)90057-3
Resumen de PubMed | Texto completo de Crossref | Google Académico
54. Midla, LT, Hill, KL, van Engen, NK, Edmonds, M, Renter, DG, Streeter, MN, et al. Respuestas inmunitarias innatas y adquiridas de terneros Holstein neonatos alimentados con calostro después de la vacunación intranasal con dos vacunas de virus vivos modificados disponibles en el mercado. J Am Vet Med Assoc. (2021) 258:1119–29. doi: 10.2460/javma.258.10.1119
Resumen de PubMed | Texto completo de Crossref | Google Académico
55. Teagasc. Manual de Teagasc Beef. (2016). Autoridad de Desarrollo Agrícola y Alimentario de Teagasc.
56. Teagasc. Manual de cría de terneros de Teagasc. Autoridad de Desarrollo Agrícola y Alimentario de Teagasc. (2017).
57. Cho, YS, Lee, HS, Lim, SK, Joo, YS, Kim, JM y Kim, JH. Pruebas de seguridad y eficacia de una nueva vacuna respiratoria bacteriana bovina multivalente compuesta por cinco bacterinas y dos inmunógenos. J Vet Med Sci. (2008) 70:959–64. doi: 10.1292/jvms.70.959
Resumen de PubMed | Texto completo de Crossref | Google Académico
58. Lorenz, I, Earley, B, Gilmore, J, Hogan, I, Kennedy, E y más, SJ. Salud del ternero desde el nacimiento hasta el destete. III. Alojamiento y manejo de la neumonía del ternero. Ir Vet J. (2011) 64:14. doi: 10.1186/2046-0481-64-14
Resumen de PubMed | Texto completo de Crossref | Google Académico
59. Windeyer, MC, Leslie, KE, Godden, SM, Hodgins, DC, Lissemore, KD y LeBlanc, SJ. Los efectos de la vacunación viral de terneras lecheras sobre la incidencia de enfermedades respiratorias, mortalidad y crecimiento. J Lácteos Sci. (2012) 95:6731–9. doi: 10.3168/jds.2012-5828
Resumen de PubMed | Texto completo de Crossref | Google Académico
60. Griffin, D. El monstruo que no vemos: la ERB subclínica en el ganado vacuno. Anim Health Res Rev. (2014) 15:138–41. doi: 10.1017/S1466252314000255
Resumen de PubMed | Texto completo de Crossref | Google Académico
61. Archbold, H, Shalloo, L, Kennedy, E, Pierce, KM y Buckley, F. Influencia de la edad, el peso corporal y la puntuación de la condición corporal antes de la fecha de inicio del apareamiento en la tasa puberal de novillas solteras Holstein-Frisonas e implicaciones para el rendimiento y la rentabilidad posteriores de las vacas. Animal. (2012) 6:1143–51. doi: 10.1017/S1751731111002692
Resumen de PubMed | Texto completo de Crossref | Google Académico
62. Potter, A, Gerdts, V, y den Hurk, SD L-v. Vacunas veterinarias: ¿alternativas a los antibióticos? Anim Health Res Rev. (2008) 9:187–99. doi: 10.1017/S1466252308001606
63. Sherwin, G, y Down, P. Inmunología de terneros y el papel de las vacunas en terneros lecheros. En Pract. (2018) 40:102–14. doi: 10.1136/inp.k952
64. Woolums, AR, Karisch, BB, Frye, JG, Epperson, W, Smith, DR, John Blanton, FA Jr, et al. Mannheimia haemolytica multirresistente aislada de ganado vacuno de alto riesgo después de la metafilaxis antimicrobiana y el tratamiento de la enfermedad respiratoria bovina. Microbiol veterinario. (2018) 221:143–52. doi: 10.1016/j.vetmic.2018.06.005
Palabras clave: BRD, neumonía bovina, vacunación, anticuerpos de origen materno
Cita: Flynn A, McAloon C, Sugrue K, Fitzgerald R, Sheridan C, Cowley B, McAloon C y Kennedy E (2024) Investigación sobre la seguridad y las respuestas serológicas provocadas por la administración de vacunas intranasales vivas para el virus del herpes bovino tipo 1, el virus respiratorio sincitial bovino y la parainfluenza tipo 3 en terneros predestetados. Frente. Vet. Sci. 11:1283013. doi: 10.3389/fvets.2024.1283013
Recibido: 25 de agosto de 2023; Aceptado: 23 de enero de 2024;
Publicado: 23 de febrero de 2024.
Editado por:
Qiuhong Wang, Universidad Estatal de Ohio, Estados Unidos
Revisado por:
Mihaela Niculae, Universidad de Ciencias Agrícolas y Medicina Veterinaria de Cluj-Napoca, Rumania Amelia
Woolums, Universidad Estatal de Mississippi, Estados Unidos
Derechos de autor © 2024 Flynn, McAloon, Sugrue, Fitzgerald, Sheridan, Cowley, McAloon y Kennedy. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Emer Kennedy, Emer.Kennedy@teagasc.ie
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía



