La administración adenoviral de moléculas coestimuladoras ovinas OX40L o CD70 solubles mejora las respuestas inmunes adaptativas a un antígeno modelo en ovejas

La administración adenoviral de moléculas coestimuladoras ovinas OX40L o CD70 solubles mejora las respuestas inmunes adaptativas a un antígeno modelo en ovejas
 José M. Rojas1,
José M. Rojas1,  Carolina Mancho2,
Carolina Mancho2,  Andrés Louloudes-Lázaro1,
Andrés Louloudes-Lázaro1,  Daniel Rodríguez-Martín1,
Daniel Rodríguez-Martín1,  Miguel Avia1,
Miguel Avia1,  Santiago Moreno3,
Santiago Moreno3,  Noemí Sevilla1 y
Noemí Sevilla1 y  Verónica Martín1*
Verónica Martín1*- 1Centro de Investigación en Sanidad Animal, Instituto Nacional de Investigación y Tecnología Agraria y Alimentaria, Consejo Superior de Investigaciones Científicas (CISA-INIA-CSIC), Madrid, España
- 2Departamento de Investigación Agroambiental, Instituto Madrileño de Investigación y Desarrollo Rural, Agrario y Alimentario (IMIDRA), Madrid, España
- 3Departamento de Producción Animal, Instituto Madrileño de Investigación y Desarrollo Rural, Agrario y Alimentario (IMIDRA), Madrid, España
La superfamilia de factores de necrosis tumoral OX40L y CD70 y sus receptores son ejes de señalización coestimuladores críticos para la activación adecuada de células T y B en humanos y ratones. En este trabajo inoculamos grupos de ovejas con adenovirus humano recombinante tipo 5 (Ad) que expresan Ovis aries (Oa)OX40L u Oa CD70 o un vector adenoviral control para determinar si podían mejorar la respuesta inmune al antígeno modelo OVA. Se obtuvieron PBMC y muestras de suero para el análisis de la respuesta inmune adaptativa a OVA en los días 0, 15, 30 y 90 después de la inoculación (pi). Las respuestas de recuerdo a OVA se evaluaron en los días 7 y 30 después de la segunda inoculación de antígeno (pb) en el día 90. La administración de estas moléculas inmunomoduladoras no indujo estimulación inespecífica de PBMC. Mientras que la administración de OaOX40L aumentó principalmente TNF-α e IL-4 en PBMC en el día 15 pi concomitantemente con un ligero aumento en el título de anticuerpos y el número de células productoras de IFN-γ, detectamos mayores efectos sobre la inmunidad adaptativa después de la administración de OaCD70. La inoculación Ad Oa CD70 mejoró los títulos de anticuerpos contra OVA en los días 30 y 90 pi, y aumentó el recuento de células B secretoras de IgG específicasanti-OVAen comparación con el control. Además, se detectó una mayor producción de IFN-γ en los días 7 pi, 7 pb y 30 pb en PBMC de este grupo. El análisis fenotípico de la activación de células T mostró un aumento en las células T CD8 efectoras (CD8 CD62L CD27) en el día 15 pi en el grupo AdOaCD70, concurrente con una disminución en las células activadas tempranas (CD8 CD62L CD27). Además, las respuestas de las células T anti-OVA CD8 aumentaron a 7 pb en el grupo AdOaCD70. Por lo tanto, la administración de CD70 adOapodría promover la diferenciación del efector de las células T CD8 y la actividad a largo plazo. En este trabajo caracterizamos el potencial adyuvante in vivo sobre la respuesta inmune humoral y celular de Oa OX40L y OaCD70 entregada por vectores de adenovirus no replicativos utilizando el antígeno modelo OVA. Presentamos datos que destacan la potencia de estas moléculas como adyuvante de vacunas veterinarias.++––+–+++
Introducción
El propósito final de la vacunación es generar una protección potente y duradera contra las enfermedades. Los enfoques tradicionales de vacunación a menudo se consideraron exitosos en el control de patógenos en función de su capacidad para inducir anticuerpos neutralizantes. Sin embargo, ahora hay cada vez más pruebas de que la activación de las células T es un requisito para lograr el éxito a largo plazo de cualquier vacuna. Idealmente, la activación de células T con antígenos virales debería promover una expansión robusta de las células T precursoras naïve, su diferenciación a células efectoras y la supervivencia en el tiempo de estas células efectoras específicas del virus como células T de memoria de alta frecuencia para que se logre una vigilancia óptima contra infecciones posteriores. Las células T, además de llevar a cabo mecanismos efectores como la citotoxicidad, modulan la respuesta inmune a través de mecanismos auxiliares que tienen como objetivo erradicar el patógeno. La activación óptima de células T es un proceso complejo que implica el reconocimiento de antígenos en moléculas MHC y señales coestimuladoras secundarias proporcionadas por diferentes moléculas (ligandos) que impulsan la activación y supervivencia de la célula T específica de antígeno (Lafferty et al., 1983; Mueller y otros, 1989). Por lo tanto, el uso de ligandos inmunoestimulantes en combinación con un antígeno de vacuna tiene el potencial de mejorar la vacunación.
Los receptores y ligandos de la familia de los factores de necrosis tumoral (TNF) son clave para controlar la coestimulación de muchos tipos de reacciones inmunes reguladas por la ayuda de las células T (Croft, 2003), como la diferenciación de las células de memoria o la activación de las células plasmáticas secretoras de anticuerpos (Bishop y Hostager, 2001). Las interacciones coestimuladoras entre miembros de la superfamilia de receptores TNF (R)/TNF, como las que se encuentran entre CD27/CD70 u OX40/OX40L, están involucradas en estos procesos, dirigiendo la activación, proliferación y mantenimiento de linfocitos durante la respuesta inmune antiviral (Duttagupta et al., 2009; Wortzman et al., 2013). Por lo tanto, estos emparejamientos TNFR / TNF podrían dirigirse a promover respuestas inmunes celulares inducidas por la vacunación.
OX40L se expresa en la superficie de las células presentadoras de antígeno (Godfrey et al., 1994; Al-Shamkhani et al., 1996), como las células dendríticas convencionales (DC) (Ohshima et al., 1997), 24-48 horas después de la exposición a linfopoyetina del estroma tímico, CD40L o agonistas del receptor tipo Toll (TLR) (Ito et al., 2005; Krause et al., 2009). OX40L señala después del compromiso con su receptor, OX40 (también conocido como CD134 o TNFRSF4), que se expresa predominantemente, pero no exclusivamente, en las células T activadas. Esta interacción controla la expansión robusta de las células T precursoras ingenuas, su diferenciación a células efectoras y su supervivencia como células de memoria (Fu et al., 2020). Después de esta primera interacción, las células T activadas que expresan OX40 pueden abandonar las CD e interactuar con otras células que expresan OX40L durante la fase efectora de la respuesta inmune, como las células T CD4 activadas (Soroosh et al., 2006), las células B (Linton et al., 2003), las células asesinas de la naturaleza (NK), las células NKT, los neutrófilos, los monocitos, los miocitos, las células endoteliales o los mastocitos que provocan una activación efectora multicanal mediada por células T. La unión de OX40L da como resultado la trimerización de OX40, el reclutamiento de TRAF 2, 3 y 5, y la señalización a través de la vía NF-κB, que permite la entrada de RelA y p50 en el núcleo. Esta señalización de emparejamiento también participa en la activación del receptor de células T a través de las vías fosfatidilo-inositol-3 quinasa (PI3K) (Weinberg et al., 2004; Croft, 2010). El emparejamiento OX40/OX40L no solo participa directamente en la expansión y supervivencia de las células T, sino que también determina indirectamente el conjunto de citoquinas producidas, generando así un sesgo en la respuesta T que depende del contexto. Además, este eje coestimulador también activa las células T CD8 durante las infecciones virales y altera la actividad y diferenciación de las células T reguladoras (Treg).++
Las vías canónicas y alternativas NF-κB también se activan por la interacción de otro par de moléculas de la superfamilia TNF (Akiba et al., 1998), CD70/CD27. El ligando CD70 (también llamado TNFSF7) (Grant et al., 2017), expresado transitoriamente en células dendríticas maduras (mDC), células B y T activadas por antígeno y células NK, señala a través de su receptor, CD27 expresado constitutivamente en células T naïve, γδ T y poblaciones de células B y T de memoria y subconjuntos de células NK. La expresión constitutiva de CD27 en células T ingenuas sugiere un encendido más temprano durante los procesos de cebado que la señalización OX40 que requiere estimulación TCR para expresarse (1998; Gramaglia y otros, 2000; Rogers y otros, 2001; Bansal-Pakala y otros, 2004). La activación de CD27 es importante para el progreso de la inmunidad adaptativa de larga duración, ya que está involucrada en la promoción de la formación de células B plasmáticas, la producción de IgG y la diferenciación de células de memoria a través de la activación de células T (Kobata et al., 1995). La señalización de CD27 también es importante para la expansión de las células T naïve específicas de antígeno y su mantenimiento como células de memoria (Hendriks et al., 2000).
El uso de estos TNF/TNFR como adyuvantes en la vacunación clásica se ha propuesto debido a su participación en las respuestas inmunes contra las infecciones virales (Duttagupta et al., 2009; Gupta et al., 2013). En un modelo murino de vacuna de ADN VIH-1, las formas secretadas de OX40L y CD70 mejoraron las respuestas inmunes celulares y humorales (Kanagavelu et al., 2012). El compromiso de las formas de ligando solubles de OX40L y CD70 en los linfocitos activados tiene, por lo tanto, el potencial de mejorar las respuestas de las células T y B específicas del antígeno.
La mayoría de las enfermedades importantes que afectan a los rumiantes, como la fiebre aftosa, la peste de pequeños rumiantes, la lengua azul o las enfermedades zoonóticas como la fiebre del valle del rift (Díaz-San Segundo et al., 2017; Faburay y otros, 2017; Kumar y otros, 2017; van Rijn, 2019), se identifican como objetivos para la vacunación. Por lo tanto, mejorar los procedimientos de vacunación actuales podría ser beneficioso para controlar estas enfermedades. Hemos caracterizado previamente la actividad y el papel de los ejes de señalización OX40/OX40L y CD27/CD70 en ovinos. Nuestros datos mostraron que el CD27 ovino se expresa en la mayoría de las células T CD4 y CD8 circulantes y en un subconjunto de células CD335 NK, mientras que está presente en niveles bajos en las células B circulantes (Rojas et al., 2020). Adicionalmente, generamos dos adenovirus recombinantes, AdOX40L y AdCD70 que expresan moléculas solubles OX40L y CD70 de ovinos [Ovis aries (Oa)], respectivamente, que permiten la activación de estas rutas de señalización coestimuladoras de la superfamilia TNFR en ovejas (Rojas et al., 2020). La capacidad de las formas ovinas solubles OX40L y CD70 para activar las células que expresan su receptor afín y estimular las respuestas de las células T ovinas se demostró en células de cultivo, lo que apunta a su uso potencial como adyuvante para estrategias de vacunación en rumiantes.+++
Los vectores adenovirales son vehículos eficaces de entrega de genes extraños in vivo (Crystal, 2014; Rojas et al., 2014a; Martín et al., 2015). Los adenovirus humanos no replicativos recombinantes están especialmente indicados para su uso en el ámbito veterinario ya que evitan problemas derivados de la inmunidad preexistente del huésped. Además, estos vectores tienen varias ventajas, como baja toxicidad, seguridad, fácil manejo y distribución, y la capacidad de transducir especies hospedadoras de gran alcance (Rojas et al., 2019).
En este trabajo caracterizamos el potencial adyuvante in vivo sobre la respuesta inmune humoral y celular de Oa OX40L y OaCD70 entregada por vectores de adenovirus no replicativos utilizando el antígeno modelo OVA. Presentamos datos que destacan la potencia de estas moléculas como adyuvante de vacunas veterinarias.
Materiales y métodos
Células y virus
Las células Vero (ATCC CCL-81) y las células HEK293 (ATCC CRL-1573) se cultivaron en el medio esencial mínimo de Dulbecco (DMEM, Gibco, Dublín, Irlanda), suplementadas con 10% de suero fetal bovino (FBS) (Sigma-Aldrich, Saint Louis, MO, EUA), 2 mM de L-glutamina, 1% 100x aminoácidos no esenciales (AANE), 1 mM de piruvato de sodio y 100 U/ml de penicilina/100 μg/ml de estreptomicina (todos de Thermofisher Scientific, Waltham, MA, Estados Unidos). Las existencias finales de los adenovirus recombinantes AdOX40L, AdCD70 y AdDsRed se purificaron y titularon después de rondas secuenciales de crecimiento en células HEK293 utilizando protocolos estándar como se describió anteriormente (Rojas et al., 2020) y se almacenaron a -70 ° C hasta su uso.
El procedimiento para obtener adenovirus recombinantes se ha descrito en detalle antes (Rojas et al., 2020).
Diseño experimental
Tres grupos de 7 ovejas hembras de raza «Rubia del Molar» de un año de edad (21 ovejas en total) fueron inoculadas por vía intramuscular con 108 unidades infecciosas (UI) de adenovirus recombinante que expresan Oa OX40L u OaCD70, o el vector adenoviral control AdDsRed, respectivamente, en el momento de la inmunización con OVAde 20 mg/oveja y sangraron en los días 0, 15, 30 y 90 después de la inoculación (D0, D15, D30, 3MD0). Las respuestas de recuerdo a OVA se evaluaron inoculando la misma cantidad de antígeno tres meses después (3MD0), y se obtuvieron muestras de sangre en los días 7 y 30 después de la segunda inoculación de OVA (3MD7 y 3MD30). Se obtuvieron PBMC y muestras de suero para el análisis de la inmunidad adaptativa inducida a OVA y se obtuvieron como se describe en (Rojas et al., 2014b; Rodríguez-Martín et al., 2021). Las ovejas fueron alojadas en la Granja Experimental «La Chimenea» (IMIDRA) en excelentes condiciones de bienestar animal. No se observaron signos anormales en ningún animal durante el tiempo experimental.
Detección de anticuerpos específicos OVA
Detección específica de ELISA anti-OVA IgG e IgM
Los anticuerpos contra OVA se detectaron utilizando placas ELISA (Maxisorp; Nunc) recubierto durante 1 h a temperatura ambiente con 100 μL/pocillo de OVA de 20 μg/mL (Sigma-Aldrich, Saint Louis, MO, USA) en tampón carbonato 0,1 M (pH 9,6). Se añadieron diluciones seriadas de sueros de ovejas inoculadas a las placas y se incubaron durante 1 h a temperatura ambiente, después de bloquear con tampón de bloqueo (PBS con 0,05% (vol/vol) Tween-20 y 4% (pt/vol) leche desnatada) durante 1 h a temperatura ambiente y lavado cinco veces con 1% (vol/vol) Tween-20 en PBS. La presencia de IgG o IgM específica de OVA se detectó utilizando una IgG secundaria anti-oveja de burro conjugada con HRP (1/2.000; Serotec, Corston Bath, Reino Unido) o conejo anti-ovejas IgM también conjugado con HRP (1/20.000; Bethyl, Montgomery, Texas, Estados Unidos). Después de lavar 10 veces con Tween-1 al 20% (vol/vol) en PBS, la señal se desarrolló utilizando TMB Liquid Substrate System (Sigma-Aldrich, Saint Louis, MO, EUA) y la reacción se detuvo con ácido sulfúrico 3 M antes de la lectura. El OD se determinó a 450 nm en un lector de placas ELISA FLUOstar Omega (BMG Labtech, Ortenberg, Alemania). Todas las mediciones de IgG/IgM se realizaron por triplicado, y los ensayos solo se consideraron válidos cuando los SD estaban por debajo del 10% del promedio. La unión de IgG/IgM a OVA se consideró positiva solo cuando la OD obtenida fue al menos el doble de la OD obtenida con el suero preinmune de la misma oveja.
Cuantificación de células B secretoras de IgG anti-OVA-específicas por ELISPOT
Las placas MSIPS4510 (Millipore, Merck, Darmstadt, Alemania) se activaron utilizando etanol estéril al 35% (vol/vol) durante 1 min, y después de un lavado a fondo con agua estéril, se incubaron durante la noche a 4 °C con OVA de 20 μg / ml (Sigma-Aldrich, Saint Louis, MO, EUA) en tampón de carbonato de 0,1 M, pH 9,6. Las placas se bloquearon con PBS que contenía 4% (peso / vol) de leche desnatada en polvo durante 2 h a 37 ° C. Los PBMC frescos se suspendieron en 5×106 células/ml y diluciones 1:2 se realizaron en medio RPMI (suplementado con L-glutamina, piruvato de sodio de 1 mM, 25 mM de Hepes, aminoácidos no esenciales y FBS inactivado al 10% (vol/vol)) hasta una concentración de 1×105 células/ml; 100 μL/pocillo de cada suspensión celular (por triplicado) se incubaron durante la noche a 37°C, 5% (vol/vol) de CO2. Después de desechar las células y lavarlas con PBS, las membranas se incubaron con IgG anti-oveja conjugada a HRP (Serotec, Corston Bath, Reino Unido) durante 3 h a temperatura ambiente. Después de cinco lavados en PBS, las membranas se desarrollaron utilizando sustrato de 3,3′,5,5′- tetrametilbemzidina (TMB) (Mabtech, Suecia). Una vez que se formaron manchas, la membrana se lavó con abundante agua destilada y se dejó secar en la oscuridad. Los resultados se expresaron como el número de células antígeno-específicas (ASC) por 106 PBMCs.
Detección de secreción específica de IFN-γ T frente al OVA por ELISPOT
Los ensayos ELISPOT de IFN-γ ovinos se realizaron utilizando placas MSIPS4510 (Millipore, Merck, Darmstadt, Alemania). Las membranas se activaron utilizando etanol estéril al 35% durante 1 min, y después de un lavado exhaustivo con agua estéril, se incubaron durante la noche a 4 °C con 5 μg / ml de anticuerpos anti-IFN-γ bovino (MT17.1, Mabtech, Suecia). Las placas se bloquearon en RPMI (suplementado con glutamina, Na+-piruvato, HEPES, aminoácidos no esenciales, antibióticos y FBS al 10%) durante 2 h a temperatura ambiente. Las PBMC de ovejas se colocaron a una densidad de 2–3×105 células por pocillo e incubadas con óvulos de 20μg/mL, medio PBMC como control negativo o Concanavalin-A (Con-A) (1,25 μg/ml) como control positivo durante 48 h a 37°C, 5% CO2. Después de desechar las células y lavarlas con PBS, las membranas se incubaron con anticuerpo anti-IFN-γ bovino marcado con biotina (MT307-biotina, Mabtech, Suecia) diluido a 0,25 μg/ml en PBS +0,5% FCS durante 2 h. Después de 5 lavados en PBS, las membranas se incubaron durante 1 h con estreptavidina conjugada a fosfatasa alcalina (ExtrAvidin-AP, Sigma-Aldrich, Saint Louis, MO, USA) diluida 1:10.000 en PBS+ 0,5% FBS. Las membranas se lavaron minuciosamente primero en PBS y luego en agua destilada antes de que se desarrollaran las reacciones de ensayo ELISPOT utilizando Sigma FAST BCIP/NBT (Sigma-Aldrich, Saint Louis, MO, EUA). Una vez que se formaron manchas, las membranas se lavaron con abundante agua destilada y se dejaron secar al aire en la oscuridad. Todos los cultivos se realizaron por triplicado y los ensayos ELISPOT se consideraron válidos solo cuando los recuentos puntuales promedio fueron inferiores a 25 para cultivos control y desviaciones estándar en pozos positivos por debajo del 15% de los recuentos promedio.
Tinción intracelular de citoquinas y citometría de flujo
Para caracterizar las poblaciones de PBMC durante el transcurso del experimento, se utilizaron los siguientes anticuerpos: antiovino CD4 (clon 44.38), CD8 (clon 38.65) y WC1 (clon 19.19) (todos de Biorad, Madrid, España); anti-humano CD14 (clon TÜK4), CD16 (clon KD1) (ambos de Biorad, Madrid, España) y CD27 (clon LG3. A10) (Biolegend, San Diego, CA, EUA); y marcador de células B antibovinas (clon BAQ44A) (KingFisher Biotech, Minnesota, USA) y CD62L (clon CC32) (Biorad, Madrid, España). Las células se marcaron como se describe en (Rodríguez-Martín et al., 2021). Para evaluar la producción de IFN-γ, las PBMC se dejaron sin estimular como control o se estimularon con OVA de 10 μg / ml durante 6 horas. Como control positivo, las PBMC fueron estimuladas con 1,25 μg/mL de concanavalina-A (ConA) (Sigma-Aldrich, Saint Louis, MO, EUA) durante 3 horas. Brefeldin-A (5μg/mL) (Biolegend, San Diego, CA, USA) se añadió en las últimas 3 h de incubación. Las células se marcaron como se describe en (Rojas et al., 2014b; Rojas et al., 2017b) con anticuerpos anti-sheep-CD4-FITC (clon 44.38), anti-sheep-CD8-PE (clon 38.65) y anti-bovino-IFN-γ-Alexa 647 (clon CC302) (todos de Bio-Rad, Madrid, España). El kit BD Cytofix/Cytoperm (BD Biosciences, NJ, USA) se utilizó para la fijación y permeabilización celular de acuerdo con el protocolo del fabricante. Las células muertas se excluyeron del análisis mediante tinción con el marcador de viabilidad Live-Dead Fixable Near-IR (Thermofisher Scientific, Waltham, MA, EUA). Las muestras se adquirieron en un citómetro de flujo FACSCalibur o FACSCelestaSorp (Becton Dickinson, NJ, EUA) y los datos se analizaron con el software FlowJo (Tree Star Inc.). Se midió el porcentaje de células IFN-γ dentro del compartimento de células T CD4 o CD8 y los datos se presentaron como producción de IFN-γ por encima del fondo de células no estimuladas (IFN-γ neto). La estrategia de acceso para eventos IFN-γ se detalla en la Figura suplementaria 1. Se utilizaron controles de isotipo y fluorescencia menos un canal para la estrategia de compuerta.++++
Extracción de ARN y qRT-PCR
El ARN de PBMC se extrajo utilizando la solución reactiva TRIzol (Thermofisher Scientific, Waltham, MA, EUA) y el ADNc generado por transcripción inversa utilizando cebadores oligo dT con transcriptasa inversa SuperScript III (Invitrogen, Thermofisher Scientific, Waltham, MA, EUA). Los niveles de transcripción de TNF-α, IL-12, IL-10, IL-1β, IL-4, IL-6 e IL-2 se evaluaron mediante PCR en tiempo real realizadas en un instrumento Light Cycler 480 System (Roche, Merck, Darmstadt, Alemania) en un Light Cycler 480 SYBR Green I Master Reagents (Roche, Merck, Darmstadt, Alemania) utilizando cebadores y condiciones de RT-qPCR detalladas en la Tabla Suplementaria 1. La expresión génica se normalizó a la expresión génica de ARN de β-actina, y los niveles de expresión relativos se calcularon utilizando el 2-ΔΔCT método (Winer et al., 1999; Schmittgen y otros, 2000). Se determinó una curva de fusión para cada lectura de fluorescencia de PCR, cada grado entre 60 y 95 ° C, para garantizar que solo se hubiera amplificado un solo producto.
Análisis estadísticos
El manejo de datos y análisis estadísticos se realizó utilizando el software Prism 6.0 (GraphPad Software Inc. San Diego, CA, EUA). Las pruebas estadísticas utilizadas para comparar datos se indican en las leyendas de las figuras.
Resultados
Caracterización de PBMCs
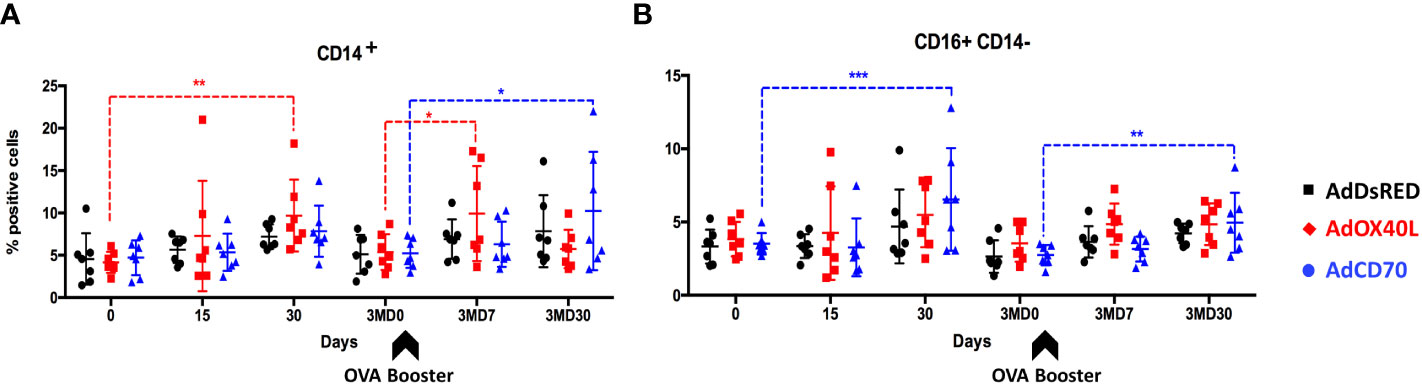
Para determinar si la administración de estas moléculas coestimuladoras podría producir una expansión inespecífica de las poblaciones de PBMC, evaluamos mediante citometría de flujo los cambios en el porcentaje de células CD4, CD8, WC1, marcador de células B, CD14 y CD14 CD16 (células NK) en PBMC obtenidas de los tres grupos de ovejas inoculadas en el transcurso del experimento. La administración de AdOX40L y AdCD70 no desencadena una expansión inespecífica de PBMC en poblaciones de marcadores de células CD4, CD8, WC1 o B (Figura complementaria 2). Sin embargo, las células CD14 (monocitos) (Figura 1A) aumentaron significativamente después de la exposición al antígeno en el grupo AdOX40L en el día 30 y en el día 7 después del refuerzo (3MD7), mientras que también se detectó un aumento significativo en los monocitos en 3MD30 en el grupo AdCD70 en comparación con el valor basal (D0 o 3MD0). También observamos un aumento significativo en las células CD16CD14 (supuestamente células NK) en el grupo AdCD70 30 días después de la exposición al antígeno en D30 y 3MD30 (Figura 1B). A pesar de estas diferencias en los monocitos y las células NK, la administración de AdCD70 y AdOX40L no pareció inducir una estimulación drástica inespecífica de los linfocitos.+++++–+++++++–
FIGURA 1 Se detecta un ligero aumento de monocitos periféricos y células NK después de la administración de AdOX40L y AdCD70. AdDsRed, AdOX40L o AdCD70 se administraron en el momento de la inmunización con OVA en tres grupos diferentes de ovejas. Las PBMC se obtuvieron en diferentes puntos temporales: día 0 (inmunización), D15, D30, 3MD0 (antes de la inoculación de refuerzo con OVA), 3MD7 (es decir, 7 días después del refuerzo) y 3MD30 (es decir, 30 días después del refuerzo); y porcentajes de (A) CD14+ (monocitos) y (B) CD16+ CD14- (células NK) PBMC evaluados por citometría de flujo. Las puntas de flecha denotan inoculaciones de refuerzo OVA en el día 90 (3MD0). *p < 0,05; **p < 0,01; p < 0,001 (ANOVA bidireccional con la prueba posterior de Dunnett).
Esto se confirmó aún más cuando evaluamos los números de PBMC en ovejas que recibieron inoculaciones AdOX40L o AdCD70. Los números de PBMC fueron similares en los tres grupos, lo que indica que AdOX40L o AdCD70 no indujeron una expansión inespecífica de PBMC. Cabe destacar que se observó un aumento en el PBMC total en 2 ovejas que recibieron AdOX40L después de la inoculación de refuerzo OVA a 3MD7, lo que podría representar la expansión de los linfocitos anti-OVA (Figura 2). La inoculación global de AdOX40L o AdCD70 parece segura, ya que no se produjo ninguna indicación de expansión inespecífica de linfocitos in vivo y las ovejas no mostraron ningún signo clínico adverso a la administración durante todo el experimento.
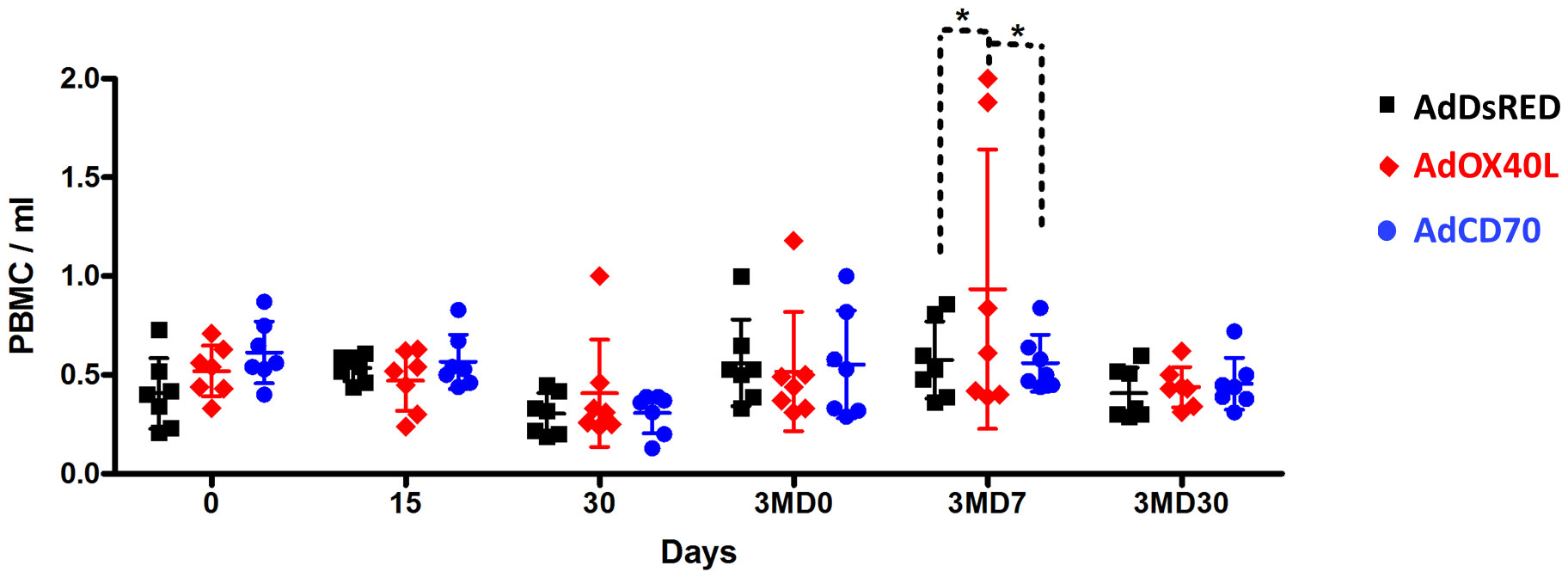 FIGURA 2 AdOX40L o AdCD70 no produjeron expansión PBMC inespecífica. Las PBMC se aislaron en los días 0, 15, 30, 90 (pre-impulso con OVA), 3MD7 (7 días después del aumento) y 3MD30 (30 días después del aumento) y se contaron. Se representan gráficos PBMC/ml de sangre para cada grupo de inmunización OVA (AdDsRed, Ad Oa OX40L o AdOaCD70). *p < 0.05 ANOVA bidireccional con la prueba posterior de Bonferroni.
FIGURA 2 AdOX40L o AdCD70 no produjeron expansión PBMC inespecífica. Las PBMC se aislaron en los días 0, 15, 30, 90 (pre-impulso con OVA), 3MD7 (7 días después del aumento) y 3MD30 (30 días después del aumento) y se contaron. Se representan gráficos PBMC/ml de sangre para cada grupo de inmunización OVA (AdDsRed, Ad Oa OX40L o AdOaCD70). *p < 0.05 ANOVA bidireccional con la prueba posterior de Bonferroni.
OaCD70 aumentó la producción de anticuerpos específicos contra OVA
Para determinar la contribución de las moléculas coestimuladoras OaOX40L y OaCD70 a la inmunidad humoral inducida al antígeno OVA clásico, tres grupos de ovejas (n = 7) fueron inoculados y sangrados como se describe en M&M con adenovirus humano recombinante (Ad) que expresa cualquiera de estas dos moléculas (AdOX40L o AdCD70) o ninguna (AdDsRed) concomitantemente con el antígeno OVA. La producción de IgG específicas de OVA se midió en el suero de ovejas inoculadas en los días 0 (D0), 15 (D15), 30 (D30) y 90 (3MD0) después de la primera inoculación (pi) y en los días 7 (3MD7) y 30 (3MD30) después del refuerzo de OVA (pb). Se detectaron IgG anti-OVA después de la primera inoculación en D15 y D30 en todos los grupos con valores más altos en los grupos inoculados coestimuladores que en el grupo control con diferencias estadísticamente significativas entre el grupo coestimulado con OaCD70 y las ovejas control en D30 (Figura 3A). Tres meses después de la inmunización, los valores de IgG anti-OVA no fueron detectables en el grupo control, mientras que los niveles bajos de anticuerpos se mantuvieron en ambos grupos de ovejas coestimuladas, con diferencias significativas entre el grupo inoculado de OaCD70 y el control (Figura 3A). Se detectaron niveles más altos en IgG anti-OVA, en los días 3MD7 y 3MD30, en comparación con los obtenidos después de la primera inoculación después de la inoculación de refuerzo en todos los grupos, alcanzando los valores más altos en el día 3MD7. En este punto temporal, se encontraron valores similares en los grupos control y Coestimulados OaOX40L u OaCD70. Los valores de IgG disminuyeron al día 3MD30, pero persistieron por encima de los valores de la primera inmunización con cantidades ligeramente mayores en el grupo inoculado OaCD70 (Figura 3A). También evaluamos la presencia de anticuerpos anti-OVA secretores de células B en los diferentes puntos temporales (Figura 3B). Las células anti-OVA B circulantes pudieron detectarse en todos los grupos desde el día 15 después de la inmunización y persistieron durante todo el experimento. Su número aumentó en la circulación después de la inoculación de refuerzo en los tres grupos en el día 3MD7, y de manera similar a los niveles de IgG anti-OVA, posteriormente disminuyó en el día 3MD30. Es importante destacar que la disminución de estas células B secretoras de Ab específicas anti-OVA se redujo en el grupo coestimulado con OaCD70 en comparación con el control, ya que se detectó un número significativamente mayor de células B anti-OVA en este grupo coestimulado en este punto de tiempo tardío (Figura 3B). Tomados en conjunto, estos datos indican que la administración de OaCD70 con un antígeno inmunizante podría mejorar los títulos de anticuerpos contra el antígeno y la supervivencia de las células B específicas del antígeno.
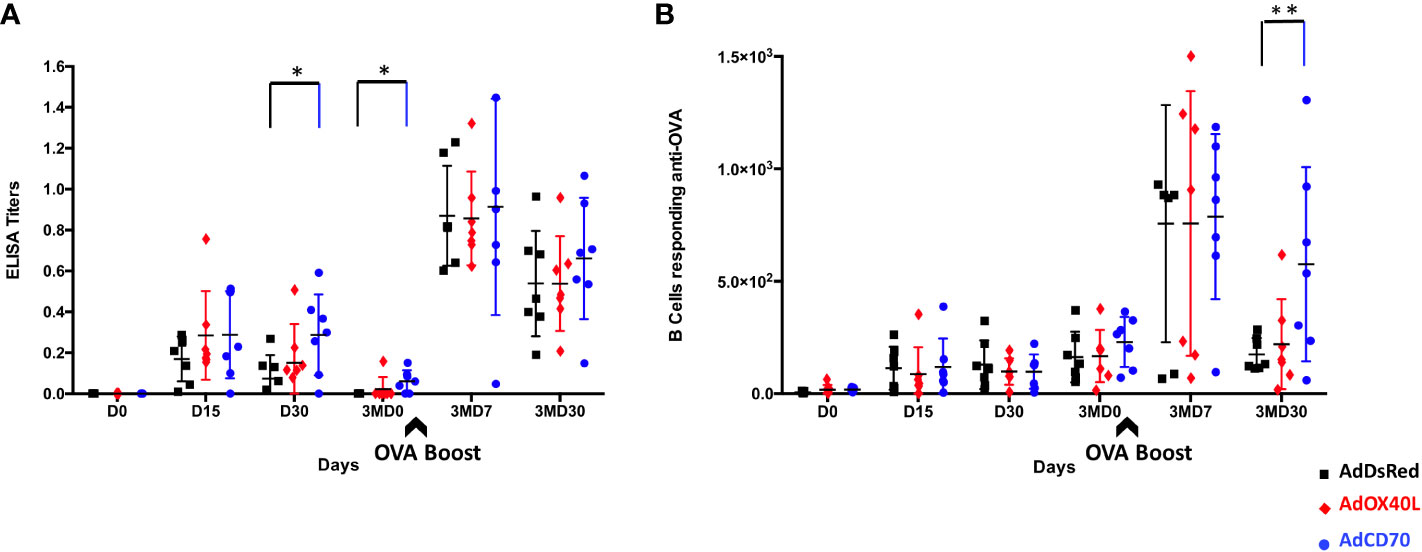 FIGURA 3 Producción de anticuerpos específicos OVA en ovejas inoculadas. (A) Detección de anticuerpos anti-OVA-específicos mediante ensayo ELISA. La inoculación con OVA concomitantemente con adenovirus recombinante que expresa las proteínas Oa OX40L u OaCD70 induce IgG específica de OVAen ovinos. Los grupos (n = 7) de ovejas fueron inoculados por vía intramuscular con OVA simultáneamente con el vector control AdDsRed (negro), AdOX40L (rojo) o AdCD70 (azul), respectivamente, al día 0; y 3 meses después (3MD0) potenciado solo con OVA (indicado por la flecha). En los puntos de tiempo indicados, las muestras de suero obtenidas se analizaron para IgG específica de OVA mediante ELISA utilizando placas recubiertas de OVA. Los datos se presentan como OD leído a 450nm IgG título para cada animal. *p < ovejas inoculadas con AdCD0 de 05,30 días y 3MD0 frente a ovejas inoculadas con AdDsRed los mismos días, respectivamente (ANOVA unidireccional). (B) Detección de células B secretoras de IgG específicas anti-OVA-OVA mediante ensayo ELISPOT. Las PBMC de ovejas inoculadas con AdDsRed (negro), AdOX70L (rojo) o AdCD40 (azul) y OVA se aislaron en los diferentes puntos de tiempo mostrados y se cultivaron durante 70 h en placas recubiertas de OVA. El número de células B productoras de IgG anti-OVA se evaluó mediante diluciones seriadas en un ensayo ELISPOT. Los resultados se expresan como el número de células antígeno-específicas (ASC) por 486 células en cada grupo de tratamiento. Siempre se incluyó un control positivo de PBMCs activados con LPS de 25 μg/ml (Sigma) para validar el ensayo ELISPOT. **p < 0.005 ANOVA bidireccional con la prueba posterior de Dunnett. La flecha negra (3MD0) denota el refuerzo OVA en todos los animales.
FIGURA 3 Producción de anticuerpos específicos OVA en ovejas inoculadas. (A) Detección de anticuerpos anti-OVA-específicos mediante ensayo ELISA. La inoculación con OVA concomitantemente con adenovirus recombinante que expresa las proteínas Oa OX40L u OaCD70 induce IgG específica de OVAen ovinos. Los grupos (n = 7) de ovejas fueron inoculados por vía intramuscular con OVA simultáneamente con el vector control AdDsRed (negro), AdOX40L (rojo) o AdCD70 (azul), respectivamente, al día 0; y 3 meses después (3MD0) potenciado solo con OVA (indicado por la flecha). En los puntos de tiempo indicados, las muestras de suero obtenidas se analizaron para IgG específica de OVA mediante ELISA utilizando placas recubiertas de OVA. Los datos se presentan como OD leído a 450nm IgG título para cada animal. *p < ovejas inoculadas con AdCD0 de 05,30 días y 3MD0 frente a ovejas inoculadas con AdDsRed los mismos días, respectivamente (ANOVA unidireccional). (B) Detección de células B secretoras de IgG específicas anti-OVA-OVA mediante ensayo ELISPOT. Las PBMC de ovejas inoculadas con AdDsRed (negro), AdOX70L (rojo) o AdCD40 (azul) y OVA se aislaron en los diferentes puntos de tiempo mostrados y se cultivaron durante 70 h en placas recubiertas de OVA. El número de células B productoras de IgG anti-OVA se evaluó mediante diluciones seriadas en un ensayo ELISPOT. Los resultados se expresan como el número de células antígeno-específicas (ASC) por 486 células en cada grupo de tratamiento. Siempre se incluyó un control positivo de PBMCs activados con LPS de 25 μg/ml (Sigma) para validar el ensayo ELISPOT. **p < 0.005 ANOVA bidireccional con la prueba posterior de Dunnett. La flecha negra (3MD0) denota el refuerzo OVA en todos los animales.
OaCD70 mejora las respuestas de las células T contra OVA
A continuación, evaluamos el efecto de las moléculas OaOX40L y OaCD70 en las respuestas de células T específicas de OVA en ovejas. Las PBMC de ovejas inmunizadas obtenidas en los diferentes puntos temporales se analizaron para determinar la producción de IFN-γ medida en ensayos ELISPOT (Figura 4). Se detectó una producción específica de IFN-γ a OVA en D15 después de la inmunización en todas las ovejas con recuentos promedio más altos en grupos de ovejas coestimuladas (Oarojo OX40L: número medio de células formadoras de puntos (SFC) de IFN-γ para 106 PBMC=43,92; azul OaCD70: número medio de IFN-γ SFC/106 PBMC=73,57) que en el grupo control (negro DsRed: número medio de IFN-γ SFC/106 PBMC =30,43). Curiosamente, el grupo inoculado con AdCD70 mostró el mayor número de células T productoras de IFN-γ en los días D15, 3MD7 con diferencias estadísticamente significativas en comparación con el grupo control en el día 3MD30 (Figura 4).
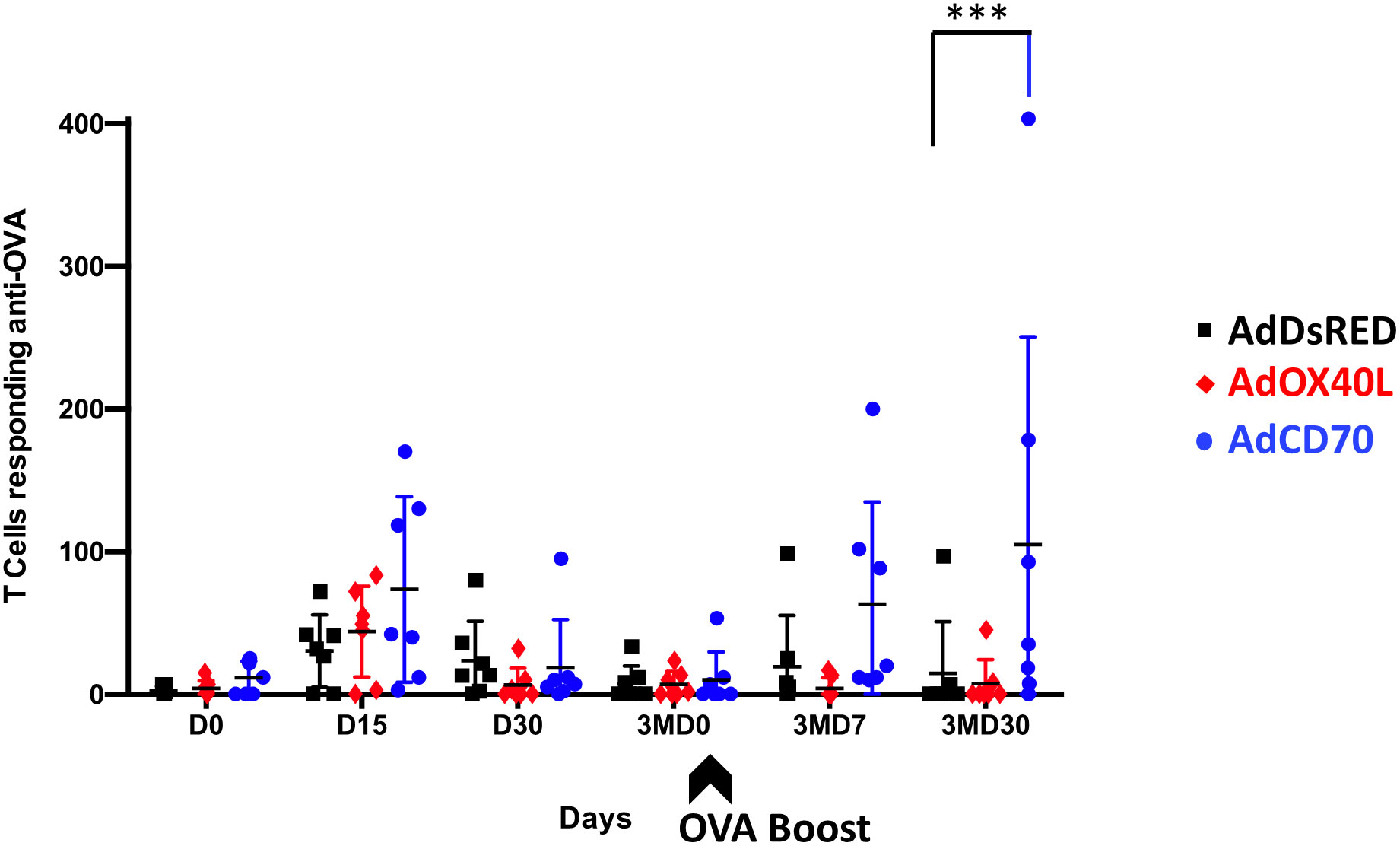 FIGURA 4 Producción específica de IFN-γ a OVA en PBMCs de los tres grupos de ovinos inoculados detectados por ensayo ELISPOT. Las PBMC de ovejas inoculadas con el vector control AdDsRed (negro), AdOX40L (rojo) o AdCD70 (azul) se aislaron en diferentes momentos (ejes x) y se cultivaron durante 48 h en presencia de OVA. La producción de IFN-γ se midió mediante un ensayo ELISPOT. Los datos se presentan como puntos promedio (± SEM) de IFN-γ por encima del fondo para 106 células en cada grupo de tratamiento. Siempre se incluyó un control positivo de PBMCs activados con Con-A (Sigma) de 1,25 μg/ml para validar el ensayo ELISPOT. p < 0.001 ANOVA bidireccional con post-prueba de Dunnett. La flecha negra (3MD0) denota el refuerzo OVA en todos los animales.
FIGURA 4 Producción específica de IFN-γ a OVA en PBMCs de los tres grupos de ovinos inoculados detectados por ensayo ELISPOT. Las PBMC de ovejas inoculadas con el vector control AdDsRed (negro), AdOX40L (rojo) o AdCD70 (azul) se aislaron en diferentes momentos (ejes x) y se cultivaron durante 48 h en presencia de OVA. La producción de IFN-γ se midió mediante un ensayo ELISPOT. Los datos se presentan como puntos promedio (± SEM) de IFN-γ por encima del fondo para 106 células en cada grupo de tratamiento. Siempre se incluyó un control positivo de PBMCs activados con Con-A (Sigma) de 1,25 μg/ml para validar el ensayo ELISPOT. p < 0.001 ANOVA bidireccional con post-prueba de Dunnett. La flecha negra (3MD0) denota el refuerzo OVA en todos los animales.
Para caracterizar aún más la respuesta de las células T a OVA, realizamos tinción intracelular de IFN-γ para células T CD4 y CD8 específicas de antígeno en el día 15 después de la inmunización (D15) y en el día 7 después del refuerzo (3MD7) (Figura 5). Se detectó baja frecuencia de linfocitos T CD4 productores de IFN-γ específicos de OVA en todos los grupos en ambos puntos temporales, sin diferencias significativas entre los grupos (Figuras 5A-C). No se detectaron diferencias entre los grupos en el porcentaje de células T CD8 productor γ as de IFN específicas de OVA en el día 15 después de la inmunización (Figuras 5D, E). No obstante, 7 días después de la vacunación de refuerzo, la frecuencia de células T CD8 productor γ as de IFN específicas de OVA aumentó estadísticamente en el grupo coestimulado de OaCD70 en comparación con el grupo AdDsRed. La frecuencia de estas células también aumentó ligeramente en el grupo OaOX40L, aunque esto no alcanzó significación estadística. Estos datos indican que OaCD70 podría mejorar la reactivación de las células T CD8.++++++
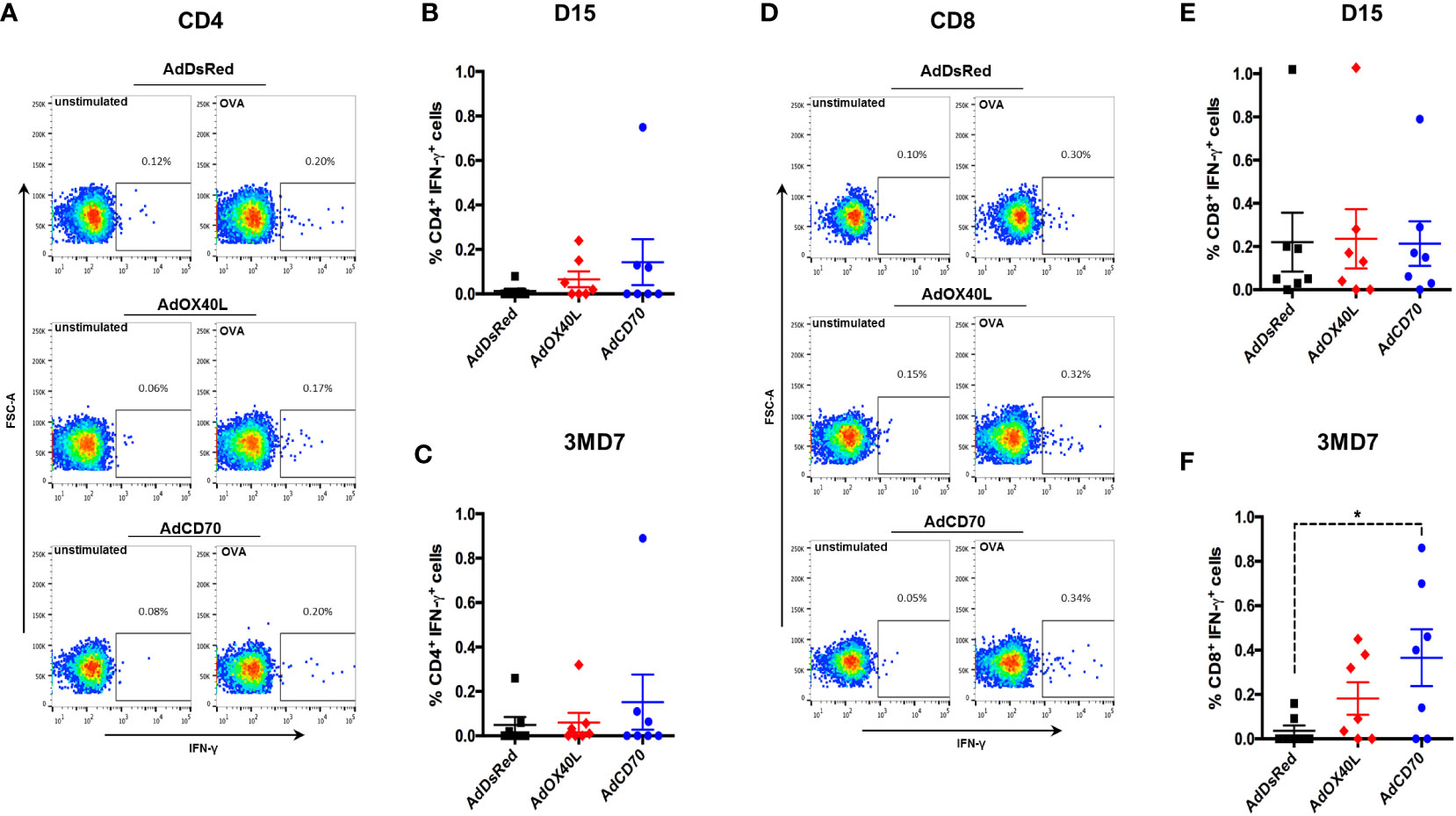 FIGURA 5 AdCD70 aumenta las respuestas de recuerdo de células T CD8 a OVA. Las PBMC se estimularon con OVA o se dejaron sin estimular como control durante 6 horas. Brefeldin-A se agregó en las últimas 3 horas de incubación para bloquear la secreción de IFN-γ. Las PBMC se tiñeron superficialmente con anticuerpos anti-CD4 y anti-CD8, fijadas y permeabilizadas y posteriormente teñidas para IFN-γ intracelular. Se utilizó un marcador NIR vivo-muerto reparable para excluir las células muertas del análisis. (A) Diagramas de puntos representativos para la producción de IFN-γ de células T CD4 en control (no estimulado) y estimulado por OVA en ovejas inoculadas con AdDsRed, AdOX40L o AdCD70 en el día 15 después de la inmunización con OVA. Producción neta media (± SEM) de IFN-γ en (B) día 15 después de la inmunización y (C) día 7 después del refuerzo OVA (3MD7) en células T CD4. (D) Diagramas de puntos representativos para la producción de IFN-γ de células T CD8 en control (no estimulado) y estimulado por OVA en ovejas inoculadas con AdDsRed, AdOX40L o AdCD70 en el día 15 después de la inmunización con OVA. Producción neta media (± SEM) de IFN-γ a (E) día 15 después de la inmunización y (F) día 7 después del refuerzo de OVA (3MD7) en células T CD8. * p < 0,05; (ANOVA unidireccional con la prueba posterior al LSD de Fisher).+++++
FIGURA 5 AdCD70 aumenta las respuestas de recuerdo de células T CD8 a OVA. Las PBMC se estimularon con OVA o se dejaron sin estimular como control durante 6 horas. Brefeldin-A se agregó en las últimas 3 horas de incubación para bloquear la secreción de IFN-γ. Las PBMC se tiñeron superficialmente con anticuerpos anti-CD4 y anti-CD8, fijadas y permeabilizadas y posteriormente teñidas para IFN-γ intracelular. Se utilizó un marcador NIR vivo-muerto reparable para excluir las células muertas del análisis. (A) Diagramas de puntos representativos para la producción de IFN-γ de células T CD4 en control (no estimulado) y estimulado por OVA en ovejas inoculadas con AdDsRed, AdOX40L o AdCD70 en el día 15 después de la inmunización con OVA. Producción neta media (± SEM) de IFN-γ en (B) día 15 después de la inmunización y (C) día 7 después del refuerzo OVA (3MD7) en células T CD4. (D) Diagramas de puntos representativos para la producción de IFN-γ de células T CD8 en control (no estimulado) y estimulado por OVA en ovejas inoculadas con AdDsRed, AdOX40L o AdCD70 en el día 15 después de la inmunización con OVA. Producción neta media (± SEM) de IFN-γ a (E) día 15 después de la inmunización y (F) día 7 después del refuerzo de OVA (3MD7) en células T CD8. * p < 0,05; (ANOVA unidireccional con la prueba posterior al LSD de Fisher).+++++
También evaluamos el estado de activación de las células T CD4 y CD8 a lo largo del tiempo. Con este fin, se analizó la expresión del marcador de activación CD62L (que se pierde con la activación) y el marcador de activación/memoria CD27 (que se expresa en células de memoria naïve y en activación temprana, pero regulado a la baja en células T efectoras) en células T CD4 y CD8 obtenidas de ovejas inmunizadas OVA en los días 0, 15, 30, 3MD0 (pre-booster con OVA), 3MD7 (7 días después del booster) y 3MD30 (30 días post booster) para cada grupo. Se detectó una reducción significativa en las células CD8 CD62L CD27 en el grupo OaCD70 en el día 15 en comparación con el día 0 (Figura 6A). Concomitante a esta reducción, se detectó un aumento de las células CD8 CD62L CD27 (Figura 6B) aunque esto no alcanzó significación estadística. Estos cambios sugieren que AdCD70 induce un aumento en las células T CD8 efectoras (CD8 CD62L CD27) que resulta en una disminución del número de células activadas tempranamente (CD8 CD62L CD27). No se detectaron diferencias significativas en las células CD4 activadas, ni en las células CD8 CD62L (Figura complementaria 3). Tomados en conjunto, estos datos indican que la administración de OaCD70 con OVA podría mejorar la diferenciación efectora de células T CD8 y las respuestas de recuerdo.+++++–++––++––+–+++++
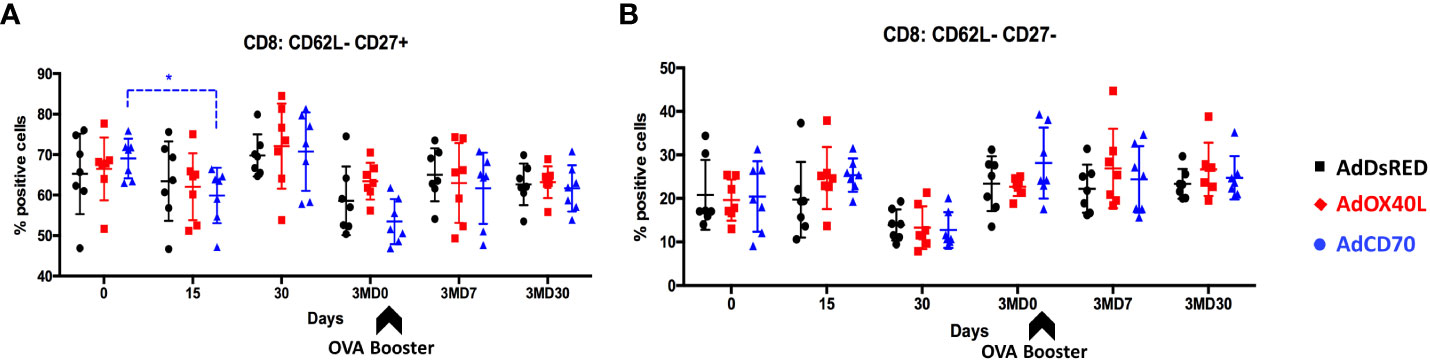 FIGURA 6 La administración de AdCD70 aumenta las células efectoras T CD8 en el día 15 después de la inoculación. AdDsRed, AdOX40L o AdCD70 se administraron en el momento de la inmunización con OVA en tres grupos diferentes de ovejas. Las PBMC se obtuvieron en diferentes puntos temporales: día 0 (inmunización), D15, D30, 3MD0 (antes de la inoculación de refuerzo con OVA), 3MD7 (es decir, 7 días después del refuerzo) y 3MD30 (es decir, 30 días después del refuerzo); y porcentajes de (A) CD8: CD62LCD27 y (B) CD8: células CD62LCD27 en PBMC evaluadas por citometría de flujo. Las puntas de flecha denotan inoculaciones de refuerzo OVA en el día 90 (3MD0). * p < 0,05; (ANOVA bidireccional con la prueba posterior de Dunnett).++–++––
FIGURA 6 La administración de AdCD70 aumenta las células efectoras T CD8 en el día 15 después de la inoculación. AdDsRed, AdOX40L o AdCD70 se administraron en el momento de la inmunización con OVA en tres grupos diferentes de ovejas. Las PBMC se obtuvieron en diferentes puntos temporales: día 0 (inmunización), D15, D30, 3MD0 (antes de la inoculación de refuerzo con OVA), 3MD7 (es decir, 7 días después del refuerzo) y 3MD30 (es decir, 30 días después del refuerzo); y porcentajes de (A) CD8: CD62LCD27 y (B) CD8: células CD62LCD27 en PBMC evaluadas por citometría de flujo. Las puntas de flecha denotan inoculaciones de refuerzo OVA en el día 90 (3MD0). * p < 0,05; (ANOVA bidireccional con la prueba posterior de Dunnett).++–++––
Perfil de expresión de citoquinas tras coestimulación con Oa OX40L u OaCD70
Para ampliar el análisis de la funcionalidad de estas moléculas y sus efectos en la respuesta inmune, evaluamos la inducción de varias citoquinas mediante qRT-PCR en PBMCs obtenidas de los tres grupos de ovejas en los días 0, 15 y 3MD7 (Figura 7). No se observaron diferencias entre los grupos con 3MD7. En el día 15 pi, las ovejas inoculadas con OaOX40L sobreexpresaron TNF-α con significación estadística en comparación con DsRed inocularon ovejas, mientras que la expresión de IL-12 también se incrementó aunque no alcanzó significación estadística. Las ovejas inoculadas con OaCD70 mostraron un aumento significativo de IL-12 en comparación con las ovejas control en D15. Ambas moléculas adyuvantes indujeron una disminución estadísticamente significativa de IL-1β en D15 después de la inoculación. IL-10 mostró una disminución significativa en el grupo OaOX40L de ovejas en D15. Todas las citoquinas analizadas experimentaron una disminución de D15 a D7 después del refuerzo (3MD7) con la excepción de IL-2, que aumentó ligeramente de D15 al día 3MD7 en todos los grupos. Este aumento de IL-2 en el grupo de OaCD70 podría estar relacionado con el aumento de la actividad de las células T anti-OVA detectada en este punto de tiempo (Figura 5). En general, parece que la administración de Oa OX40L y OaCD70 puede influir en el perfil de citoquinas expresadas de PBMC, con un aumento de algunas citoquinas proinflamatorias como TNF-α o lacitoquina Th1 IL-12.
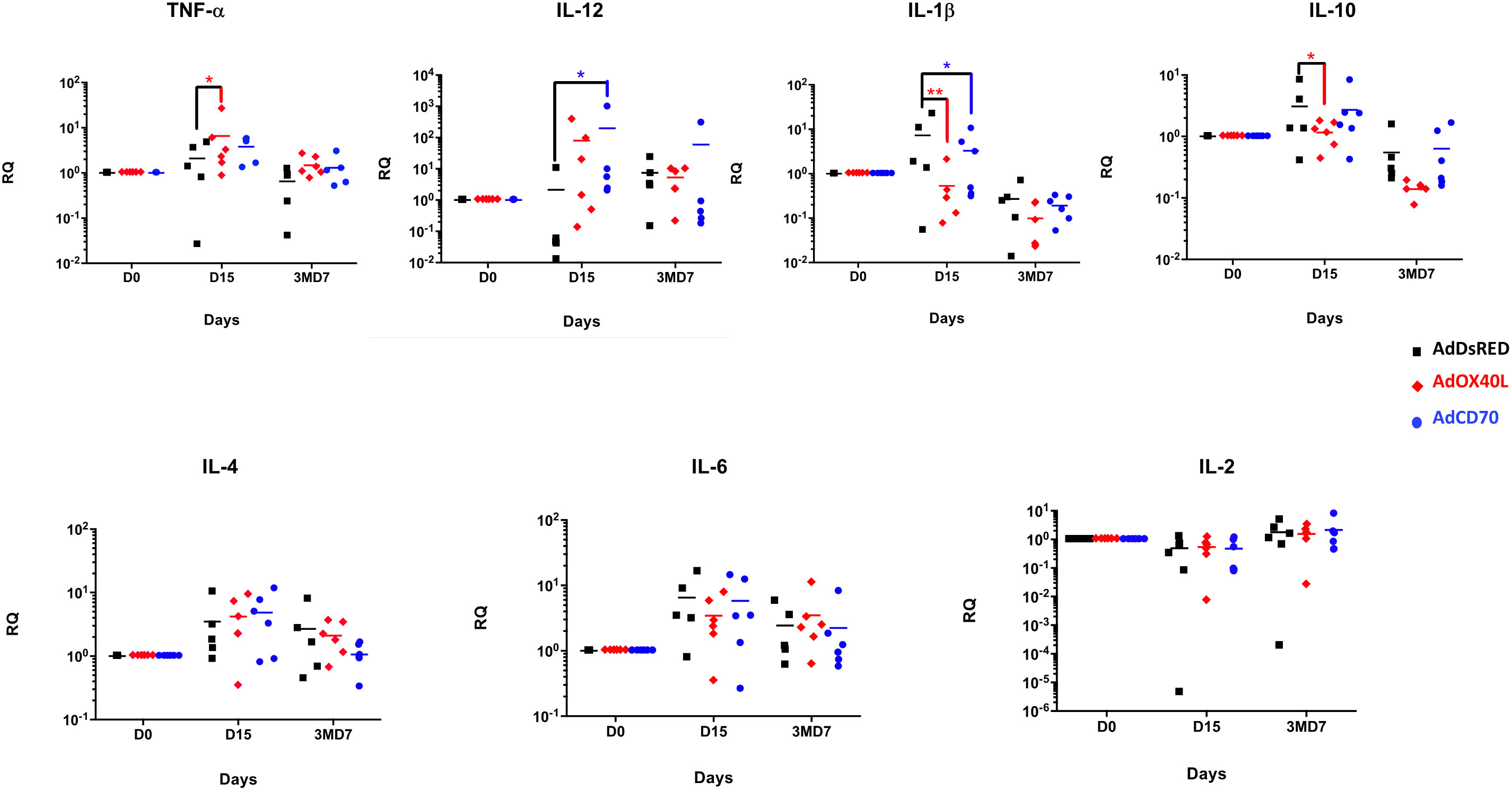 FIGURA 7 Análisis de la expresión de genes de citoquinas mediante qRT-PCR en PBMCs ovinos. La expresión génica de citoquinas a partir de ARN total aislado de PBMCs obtenidas en los días D15 y 3MD7 de los tres grupos de ovejas se midió mediante PCR cuantitativa en tiempo real (qRT-PCR). Cada muestra individual se analizó por duplicado. Los niveles relativos de expresión del ARNm de citoquinas se determinaron mediante análisis de ciclo umbral comparativo (TC), utilizando como referencia la expresión de ARNm de β-actina (control interno). El análisis estadístico se realizó mediante la prueba ANOVA de dos vías: *p < 0,05. Cantidad relativa de ARN (RQ) = 2 -ΔΔCT.
FIGURA 7 Análisis de la expresión de genes de citoquinas mediante qRT-PCR en PBMCs ovinos. La expresión génica de citoquinas a partir de ARN total aislado de PBMCs obtenidas en los días D15 y 3MD7 de los tres grupos de ovejas se midió mediante PCR cuantitativa en tiempo real (qRT-PCR). Cada muestra individual se analizó por duplicado. Los niveles relativos de expresión del ARNm de citoquinas se determinaron mediante análisis de ciclo umbral comparativo (TC), utilizando como referencia la expresión de ARNm de β-actina (control interno). El análisis estadístico se realizó mediante la prueba ANOVA de dos vías: *p < 0,05. Cantidad relativa de ARN (RQ) = 2 -ΔΔCT.
Discusión
Los inmunomoduladores tienen el potencial de aumentar las respuestas inmunes del huésped, aumentando así la efectividad de las vacunas. La inclusión de inmunomoduladores en las formulaciones de vacunas puede ser un enfoque atractivo en el caso de vacunas subóptimas. Aquí informamos la generación de adenovirus humanos recombinantes no replicativos que expresan OaOX40L u OaCD70 para ser utilizados como inmunomoduladores. Trabajos previos en nuestro laboratorio demostraron que los ejes de señalización coestimuladores representados por OX40L-OX40 y CD70-CD27 están conservados y funcionales en las especies ovinas y que los ligandos recombinantes obtenidos pueden provocar efectivamente actividad biológica (Rojas et al., 2020). En este informe evaluamos si dirigirse a estas moléculas in vivo en ovejas podría desarrollar respuestas de células B y T de calidad a la vacunación.
La manipulación in vivo de las vías coestimuladoras debe hacerse con cuidado, como se ejemplifica con el ensayo clínico de fase 1 utilizando un anticuerpo monoclonal superagonista anti-CD28 que desencadenó una tormenta de citoquinas en voluntarios (Suntharalingam et al., 2006). A diferencia de la vía CD28, que es fundamental para la activación de las células T, los ejes OX40/OX40L y CD27/CD70 están bastante involucrados en la modulación de las respuestas de las células T y B y en el desarrollo de las células de memoria. Por lo tanto, es poco probable que su manipulación desencadene respuestas sistémicas. De hecho, encontramos in vitro que OaOX40L y OaCD70 solo mejoraron la inducción de IFN-γ de células T CD4 y CD8 en respuesta a la activación de ConA mitogénicos (Rojas et al., 2020). Los datos de los presentes experimentos in vivo confirman que la administración de OaOX40L y OaCD70 a través de vectores adenovirales recombinantes no desencadena eventos de toxicidad aguda en ovejas, ya que no se observaron efectos adversos tras la administración y los recuentos de PBMC no se alteraron significativamente durante todo el experimento. No obstante, debe tenerse en cuenta que estos ligandos diseñados para interactuar con Oa OX40 u Oa CD27 pueden ejercer efectos biológicos adicionales al reducir la disponibilidad del objetivo y, por lo tanto, evitar la señalización inversa a través de Oa OX40L u OaCD70.++
Se detectó un aumento de monocitos (CD14) 30 días después de la inoculación combinada de OAOX40L y OVA y 7 días después del refuerzo de OVA (Figura 1). Se sabe que el eje OX40 / OX40L afecta el diálogo monocitos-células T (Sun et al., 2018). La administración soluble de OX40 promueve la infiltración inflamatoria de monocitos en un modelo de enfermedad hepática inflamatoria. Se observó un efecto inverso en ratones deficientes en OX40, lo que indica que la interacción entre OX40 en células T activadas y OX40L en monocitos fue fundamental para la enfermedad inflamatoria (Sun et al., 2018). Por lo tanto, la administración de OX40L podría promover indirectamente la expansión de monocitos inflamatorios al aumentar el número de células T que expresan OX40. En nuestro caso, solo detectamos la expansión de las células CD14 30 días después de la exposición al antígeno y 7 días después de la reexposición. También detectamos expansión de células NK tras la administración de OaOX40L 30 días después de la inoculación de refuerzo. Es poco probable que en estos últimos puntos de tiempo la expresión de OaOX40L recombinante todavía esté presente en los animales (Whittington et al., 1998). Estos efectos tardíos sobre el número de monocitos y células NK podrían ser un efecto indirecto de la administración de OaOX40L e indicar la contribución de estas células en la fase de contracción de la inmunidad adaptativa una vez que se elimina el antígeno (Pallmer y Oxenius, 2016; Gordon y Plüddemann, 2018). En general, la administración de OaOX40L u OaCD70 a través del adenovirus parece ser un enfoque seguro para dirigirse a estos ejes de señalización in vivo. Sin embargo, sería interesante en futuros trabajos evaluar el efecto de estas moléculas coestimuladoras sobre la inmunidad innata.++
Se sabe que OX40 controla el número de células T efectoras durante las respuestas inmunes primarias o secundarias, así como la frecuencia de las células de memoria que se generan [revisado en (Weinberg et al., 2004; Croft, 2010)]. Debido a la relevancia de estas características para la vacunación, la ligadura OX40 se ha propuesto como una potente estrategia adyuvante. Por ejemplo, se encontró que OX40 es crítico para el desarrollo de respuestas de células T CD8 contra epítopos dominantes y subdominantes, así como para la generación de células de memoria en la infección por el virus vaccinia en ratones (Salek-Ardakani et al., 2008). Además, la activación de la señalización de OX40 por un anticuerpo agonista durante la vacunación peptídica contra el virus vaccinia proporcionó una mayor actividad de las células efectoras y de memoria, lo que permite una protección completa contra una dosis respiratoria letal del virus (Salek-Ardakani et al., 2011). Detectamos un ligero aumento en la respuesta de las células CD8T 7 días después del impulso en ovejas inoculadas Oa OX40L en comparación con el control, lo que podría indicar que en algunosindividuos la administración de Oa OX40L mejoró la funcionalidad de la memoria de las células T CD8 anti-OVA. No obstante, es necesario seguir trabajando para confirmar esta observación.+++
Más notablemente, OaOX40L alteró el perfil de citoquinas expresado por PBMC en el día 15pi en comparación con el grupo control. El aumento de la expresión de TNF-α e IL-12 después de la administración de OaOX40L indica la activación de una respuesta inmune Th1 (Figura 7). Esta función ha sido atribuida a la interacción OX40/OX40L en varios informes (Arestides et al., 2002; Fu et al., 2020; Gajdasik et al., 2020). Coincidiendo con el aumento de esta citoquina polarizadora Th1, también detectamos una reducción estadística en los niveles de la citoquina reguladora IL-10 (Rojas et al., 2017a) lo que podría indicar que la administración de OaOX40L está promoviendo el desarrollo de una respuesta inmune productiva. Será necesario seguir trabajando para aclarar estas conclusiones.
Varias hipótesis podrían explicar los efectos inmunomoduladores moderados de OaOX40L sobre la respuesta OVA. Una hipótesis es que las acciones OX40 se omiten debido a la señal proporcionada al TCR por el antígeno OVA. La magnitud del insulto antigénico afecta la señalización a través de OX40 (Gramaglia et al., 2000), y OVA es un potente inmunógeno. Por lo tanto, la ligadura OX40 puede no ser crítica para el desarrollo de respuestas inmunes adaptativas adecuadas a OVA. El uso de antígenos subóptimos podría ser un mejor enfoque para detectar diferencias en las respuestas inmunes por las vías de coestimulación OX40L. Alternativamente, el impacto limitado de la administración de OaOX40L podría deberse al hecho de que la expresión de OX40 en las células T requiere el reconocimiento de antígenos. Por lo tanto, la administración simultánea de OaOX40L con antígeno puede no ser ideal para activar de manera óptima esta vía coestimuladora. Se requerirá más trabajo para definir con mayor precisión el impacto in vivo de la administración de OaOX40L en la inmunidad adaptativa.
El par TNFR-TNF CD27-CD70 tiene funciones coestimuladoras similares al par OX40-OX40L (Ohshima et al., 1997; Krause et al., 2009). En humanos, CD70 es capaz de inducir la proliferación in vitro y la producción de citoquinas de células T αβ y γδ (deBarros et al., 2011; Polak et al., 2012; Mahnke et al., 2013; Ramakrishna et al., 2015). Por ejemplo, el compromiso de CD27 puede impulsar la activación de las células T CD8 en la piel en ausencia de ayuda de las células T CD4 (Polak et al., 2012), probablemente debido a su expresión constitutiva en células T ingenuas. Nuestros datos indicaron que la coestimulación de Oa CD70 mejora las respuestas primarias y de recuerdo a OVA. Los valores más altos de IFN-γ se detectaron en este grupo, mostrando una activación estadísticamente significativa de la respuesta de memoria en el día 30 después del impulso (Figura 4). La naturaleza de estas células secretoras de IFN-γ es principalmente de células T CD8 (Figura 5). También detectamos un aumento de linfocitos T CD8 efectores en el día 15pi (Figura 6), lo que podría sugerir que OaCD70 está promoviendo la diferenciación completa de estas células. Por lo tanto, parece que, en línea con su función en otras especies, OaCD70 puede mejorar las respuestas in vivo de las células T CD8. Sin embargo, no se detectaron efectos significativos en el compartimento de células T CD4 utilizando OVA como antígeno. Los efectos de OaCD70 en este compartimento de células T pueden estar enmascarados por la alta inmunogenicidad de OVA.++++++
En humanos, CD27 también se expresa en las células B de memoria y su ligadura en las células B por CD70 es responsable, entre otras cosas, de la diferenciación de las células plasmáticas (Klein et al., 1998; Jacquot, 2000). OaLa coestimulación de CD70 condujo a un aumento y prolongado de los títulos de anticuerpos contra OVA (Figura 3). También parece que las células B se activaron más fácilmente al volver a exponerse al antígeno. OaPor lo tanto, la administración de CD70 tiene el potencial de mejorar las respuestas de anticuerpos a los antígenos. El siguiente paso sería determinar si las funcionalidades de los anticuerpos, como los títulos de anticuerpos de neutralización, pueden mejorarse mediante la administración de OaCD70.
OaLa administración de CD70 también alteró la respuesta de citoquinas de PBMC a OVA en el día 15pi. Detectamos un aumento en la citoquina promotora de Th1 IL-12 tras la coestimulación de OaCD70 en comparación con el grupo control en el día 15pi (Figura 7B). Aunque otros autores han detectado que la señalización a través de CD27 provoca un aumento en la expresión de IL-2 (Matter et al., 2008), los valores en ovejas estimuladas con OaCD70 no fueron significativos en el día 15pi. Esto podría deberse al tiempo de análisis, ya que el aumento en el ARNm de IL-2 generalmente se detecta dentro de las 4 horas posteriores a la interacción CD27-CD70 (Peperzak et al., 2010). Sin embargo, detectamos un ligero aumento en los niveles de IL-2 en el día 7pb en el grupo de OaCD70, que coincidió con el aumento de la respuesta de las células T CD8 a OVA. Este aumento de IL-2 podría reflejar la reactivación de las células de memoria CD8 (CD27 y CD45RA) (Mahnke et al., 2013) en el momento analizado. La regulación a la baja en ovejas coestimuladas con OaCD70 de la citoquina proinflamatoria IL-1β (Figura 7C), producida principalmente por monocitos, células dendríticas y macrófagos tisulares (Garlanda et al., 2013), en comparación con las ovejas inoculadas AdDsRed, podría restringir su señalización aguas abajo en la transcripción mediada por NF-κB de citoquinas proinflamatorias y, en última instancia, podría limitar el inicio de la inflamación (Tulotta y Ottewell, 2018). En general, parece que la administración de Oa CD70 desencadenauna compleja red de producción de citoquinas en PBMC que requerirá más trabajo para caracterizarla completamente.+++–
Nuestros datos indican que la administración de OaCD70 con el antígeno inmunizante podría mejorar los títulos de anticuerpos contra el antígeno y prolongar la presencia de anticuerpos en la periferia. Además, OaCD70 mejoró las respuestas de recuerdo de células T CD8 al antígeno y aumentó en PBMC la expresión de la citoquina polarizadora Th1 IL-12. OaPor lo tanto, la administración concomitante de CD70 con el antígeno inmunizante parece mejorar la inmunidad celular y humoral. Para desarrollar vacunas eficaces contra patógenos se debe generar una combinación de inmunoglobulinas y linfocitos T CD8 de memoria de larga duración. Los receptores y ligandos de la familia TNF juegan un papel importante en el control de la activación de linfocitos y la supervivencia durante la inmunidad viral. Por lo tanto, la activación de estas vías coestimuladoras podría resultar atractiva en medicina veterinaria. El presente trabajo amplía nuestra comprensión de los emparejamientos OX40-OX40L y CD27-CD70 en ovejas. La activación de estas vías coestimuladoras utilizando un adenovirus recombinante como sistema de administración no produjo toxicidad aguda in vivo y mejoró en cierta medida la inmunidad adaptativa al antígeno modelo OVA. Sin embargo, se requiere más trabajo para diseccionar los efectos de estas moléculas en las ovejas. En última instancia, el uso de señales coestimuladoras proporcionadas por estos TNF-TNFR podría ayudar a mejorar los protocolos de vacunación.++
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo/Material Suplementario. Las consultas adicionales pueden dirigirse al autor correspondiente.
Declaración ética
El estudio en animales fue revisado y aprobado con las recomendaciones de las directrices del Código de métodos y consideraciones de bienestar en la investigación conductual con animales (Directiva 86/609CE; RD1201/2005) y se hicieron todos los esfuerzos para minimizar el sufrimiento. Los experimentos fueron aprobados por el Comité de Ética de la Experimentación con Animales (CEEA) (Número de permiso: 10/142792.9/12) del Instituto Nacional de Investigación y Tecnología Agraria y Alimentaria (INIA) y la Comisión de Ética Estatal de Bienestar Animal (Número de permiso: CBS2012/06 y PROEX 228/14). Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones del autor
JR, NS y VM diseñaron los experimentos. VM dirigió el trabajo. CM, JR, VM y SM recolectaron las muestras en la granja experimental. DR-M, MA, AL-L, JR y VM realizaron los experimentos. NS, JR y VM escribieron el manuscrito. Todos los autores contribuyeron al artículo, leyeron y aprobaron la versión presentada.
Financiación
Este trabajo fue financiado por AGL2015-64290R, RTI2018-094616-B-100 y PID2021-124872OB-I00 del Ministerio de Ciencia (España), subvención S2018/BAA-4370-PLATESA2 de la Comunidad de Madrid (Fondo Europeo de Desarrollo Regional, FEDER).
Reconocimientos
Los autores desean agradecer al Dr. Alejo por las útiles discusiones y a todos los miembros de la Granja Experimental «La Chimenea» (IMIDRA) por su inestimable ayuda con los animales.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fcimb.2022.1010873/full#supplementary-material
Figura complementaria 1 | Estrategia de gating para la determinación de IFN-γ en linfocitos T CD4+ y CD8+. Las PBMC fueron estimuladas con OVA o no estimuladas como control durante 6 horas. Brefeldin-A se agregó en las últimas 3 horas de incubación para bloquear la secreción de IFN-γ. Las PBMC se tiñeron superficialmente con anticuerpos anti-CD4 y anti-CD8, fijadas y permeabilizadas y posteriormente teñidas para IFN-γ intracelular. Se utilizó un marcador NIR vivo-muerto reparable para excluir las células muertas del análisis. La activación linfocitaria se realizó mediante los parámetros FSC-A y SSC-A, y los eventos dobles se excluyeron mediante FSC-A y FSC-H. Se utilizó tinción NIR de muertos vivos para excluir las células muertas. La activación de eventos CD4 y CD8 se realizó en células vivas, y los eventos de IFN-γ se determinaron dentro de estas puertas. Se realizaron controles apropiados de isotipo y fluorescencia menos un canal para el ajuste de la puerta.+++
Figura complementaria 2 | La administración de AdOX40 y AdCD70 no desencadena la estimulación inespecífica de células CD4+, CD8+, WC1+ y B. AdDsRed, AdOX40L o AdCD70 se administraron en el momento de la inmunización con OVA. Las PBMC se obtuvieron en diferentes puntos temporales: día 0 (D0) (inmunización), D15, D30, 3MD0 (antes de la inoculación de refuerzo con OVA), 3MD7 (es decir, 7 días después del refuerzo) y 3MD30 (es decir, 30 días después del refuerzo); y porcentajes de (A) CD4, (B) CD8, (C) WC1, (D) marcador de células B, células en PBMC evaluadas por citometría de flujo. Las puntas de flecha denotan inoculaciones de refuerzo OVA en el día 90 (3MD0). No se detectaron diferencias estadísticas en los porcentajes de células en PBMC entre los regímenes de administración de adenovirus recombinantes cuando se compararon en el mismo día (ANOVA bidireccional con la prueba posterior de Dunnett).++++
Figura complementaria 3 | La administración de AdOX40L y AdCD70 no desencadenó la activación inespecífica de células T CD4+ o CD8+. Tres grupos de ovejas fueron inmunizadas con OVA, como antígeno modelo, y recibieron concomitantemente una inoculación de AdDsRed (como control), AdOX40L o AdCD70. La expresión del marcador de activación CD62L (que se pierde con la activación) y el marcador de activación/memoria CD27 (que se expresa en células de memoria naïve y en activación temprana, pero regulado a la baja en células T efectoras) se analizó en células T CD4 (A-D) y (E-F) obtenidas de ovejas inmunizadas con OVA en los días 8, 0, 15, 30 (pre-booster con OVA), 90MD3 (7 días después del refuerzo) y 7MD3 (30 días después del refuerzo) para cada grupo.++
Referencias
Akiba, H., Nakano, H., Nishinaka, S., Shindo, M., Kobata, T., Atsuta, M., et al. (1998). CD27, un miembro de la superfamilia de receptores del factor de necrosis tumoral, activa NF-κB y la proteína quinasa activada por estrés/c-jun n-terminal quinasa a través de TRAF2, TRAF5 y quinasa inductora de NF-κB. J. Biol. Chem. 273, 13353–13358. DOI: 10.1074/JBC.273.21.13353
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Al-Shamkhani, A., Birkeland, M. L., Puklavec, M., Brown, M. H., James, W., Barclay, A. N. (1996). OX40 se expresa diferencialmente en células T activadas de rata y ratón y es el único receptor para el ligando OX40. Eur. J. Immunol. 26, 1695–1699. doi: 10.1002/eji.1830260805
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Arestides, R. S. S., He, H., Westlake, R. M., Chen, A. I., Sharpe, A. H., Perkins, D. L., et al. (2002). La molécula coestimuladora OX40L es crítica para las respuestas Th1 y Th2 en la inflamación alérgica. Eur. J. Immunol. 32, 2874–2880. doi: 10.1002/1521-4141(2002010)32:10<2874::AID-IMMU2874>3.0.CO;2-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Bansal-Pakala, P., Halteman, B. S., Cheng, M. H.-Y., Croft, M. (2004). Coestimulación de las respuestas de los linfocitos T CD8 por OX40. J. Immunol. 172, 4821–4825. doi: 10.4049/jimmunol.172.8.4821
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Obispo, G. A., Hostager, B. S. (2001). Mecanismos moleculares de señalización de CD40. Arq. Immunol. Ther. (Warsz) 49, 129–137.
Croft, M. (2003). Coestimulación de linfocitos T por OX40, 4-1BB y CD27. Factor de crecimiento de citoquinas Rev. 14, 265–273. doi: 10.1016/S1359-6101(03)00025-X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Croft, M. (2010). Control de la inmunidad por la molécula relacionada con TNFR OX40 (CD134). Annu. Rev. Immunol. 28, 57–78. doi: 10.1146/annurev-immunol-030409-101243
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Cristal, R. G. (2014). Adenovirus: El primer vector eficaz de entrega de genes in vivo. Hum. Gene Ther. 25, 3–11. doi: 10.1089/hum.2013.2527
Resumen de PubMed | Texto completo de CrossRef | Google Académico
deBarros, A., Chaves-Ferreira, M., D’Orey, F., Ribot, J. C., Silva-Santos, B. (2011). Las interacciones CD70-CD27 proporcionan señales de supervivencia y proliferativas que regulan la activación impulsada por el receptor de células T de los linfocitos de sangre periférica γδ humana. Eur. J. Immunol. 41, 195–201. doi: 10.1002/eji.201040905
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Diaz-San Segundo, F., Medina, G. N., Stenfeldt, C., Arzt, J., de los Santos, T. (2017). Vacunas contra la fiebre aftosa. Veterinario Microbiol. 206, 102–112. doi: 10.1016/j.vetmic.2016.12.018
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Duttagupta, P. A., Boesteanu, A. C., Katsikis, P. D. (2009). Señales de coestimulación para las células T CD8+ de memoria durante infecciones virales. Immunol. 29, 469–486. doi: 10.1615/critrevimmunol.v29.i6.20
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Faburay, B., LaBeaud, A. D., McVey, D. S., Wilson, W. C., Richt, J. A. (2017). Estado actual del desarrollo de la vacuna contra la fiebre del Valle del Rift. Vacunas. 5, 29. doi: 10.3390/vaccines5030029
Fu, Y., Lin, Q., Zhang, Z., Zhang, L. (2020). Estrategias terapéuticas para la molécula coestimuladora OX40 en la inmunidad mediada por células T. Acta Pharm. Sin. B. 10, 414–433. doi: 10.1016/j.apsb.2019.08.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Gajdasik, D. W., Gaspal, F., Halford, E. E., Fiancette, R., Dutton, E. E., Willis, C., et al. (2020). Las respuestas Th1 in vivo requieren la provisión específica de OX40L dictada por señales ambientales. Nat. Commun. 11, 3421. DOI: 10.1038/S41467-020-17293-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Garlanda, C., Dinarello, C. A., Mantovani, A. (2013). La familia de la interleucina-1: Regreso al futuro. Inmunidad. 39, 1003–1018. doi: 10.1016/j.immuni.2013.11.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Godfrey, W. R., Fagnoni, F. F., Harara, M. A., Buck, D., Engleman, E. G. (1994). Identificación de un ligando ox-40 humano, un coestimulador de células t CD4+ con homología al factor de necrosis tumoral. J. Exp. Med. 180, 757–762. DOI: 10.1084/JEM.180.2.757
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Gordon, S., Plüddemann, A. (2018). Aclaramiento de macrófagos de células apoptóticas: una evaluación crítica. Frente. Immunol. 9. DOI: 10.3389/fimmu.2018.00127
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Gramaglia, I., Jember, A., Pippig, S. D., Weinberg, A. D., Killeen, N., Croft, M. (2000). El receptor coestimulador OX40 determina el desarrollo de la memoria CD4 mediante la regulación de la expansión clonal primaria. J. Immunol. 165, 3043–3050. doi: 10.4049/jimmunol.165.6.3043
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Gramaglia, I., Weinberg, A. D., Lemon, M., Croft, M. (1998). Ligando Ox-40: una potente molécula coestimuladora para mantener las respuestas primarias de las células T CD4. J. Immunol. 161, 6510–6517.
Grant, E. J., Nüssing, S., Sant, S., Clemens, E. B., Kedzierska, K. (2017). El papel de CD27 en la inmunidad antiviral de las células T. Curr. Opinar. Virol. 22, 77–88. doi: 10.1016/j.coviro.2016.12.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Gupta, S., Termini, J. M., Kanagavelu, S., Stone, G. W. (2013). Diseño de adyuvantes vacunales que incorporan ligandos de la superfamilia TNF e imitadores moleculares de la superfamilia TNF. Immunol. Res. 57, 303–310. DOI: 10.1007/S12026-013-8443-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Hendriks, J., Gravestein, L. A., Tesselaar, K., Van Lier, R. A. W., Schumacher, T. N. M., Borst, J. (2000). CD27 es necesario para la generación y el mantenimiento a largo plazo de la inmunidad de las células T. Nat. Immunol. 1, 433–440. DOI: 10.1038/80877
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Ito, T., Wang, Y. H., Duramad, O., Hori, T., Delespesse, G. J., Watanabe, N., et al. (2005). Las células dendríticas activadas por TSLP inducen una respuesta inflamatoria de células T auxiliares tipo 2 a través del ligando OX40. J. Exp. Med. 202, 1213–1223. DOI: 10.1084/JEM.20051135
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Jacquot, S. (2000). Las interacciones CD27/CD70 regulan la diferenciación de células B dependientes de T. Immunol. Res. 21, 23–30. doi: 10.1385/IR:21:1:23
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Kanagavelu, S. K., Snarsky, V., Termini, J. M., Gupta, S., Barzee, S., Wright, J. A., et al. (2012). Los adyuvantes solubles del ligando multitrimérico de la superfamilia TNF mejoran las respuestas inmunes a una vacuna de ADN gag del VIH-1. Vacuna 30, 691–702. doi: 10.1016/j.vaccine.2011.11.088
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Klein, U., Rajewsky, K., Küppers, R. (1998). Las células B de sangre periférica de inmunoglobulina humana (Ig)M+IgD+ que expresan el antígeno de superficie celular CD27 portan genes de región variable mutados somáticamente: CD27 como marcador general de células b con mutación somática (memoria). J. Exp. Med. 188, 1679–1689. DOI: 10.1084/JEM.188.9.1679
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Kobata, T., Jacquot, S., Kozlowski, S., Agematsu, K., Schlossman, S. F., Morimoto, C. (1995). Las interacciones CD27-CD70 regulan la activación de las células B por las células T. Proc. Natl. Acad. Sci. U. S. A. 92, 11249–11253. doi: 10.1073/pnas.92.24.11249
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Krause, P., Bruckner, M., Uermösi, C., Singer, E., Groettrup, M., Legler, D. F. (2009). La prostaglandina e2 mejora la proliferación de células T al inducir las moléculas coestimuladoras OX40L, CD70 y 4-1BBL en las células dendríticas. Sangre. 113, 2451–2460. doi: 10.1182/blood-2008-05-157123
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Kumar, N., Barua, S., Riyesh, T., Tripathi, B. N. (2017). Avances en las vacunas contra la peste de los pequeños rumiantes. Veterinario Microbiol. 206, 91–101. doi: 10.1016/j.vetmic.2017.01.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Lafferty, K. J., Prowse, S. J., Simeonovic, C. J., Warren, H. S. (1983). Inmunobiología del trasplante de tejidos: un retorno al concepto de leucocitos pasajeros. Annu. Rev. Immunol. 1, 143–173. doi: 10.1146/annurev.iy.01.040183.001043
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Linton, P. J., Bautista, B., Biederman, E., Bradley, E. S., Harbertson, J., Kondrack, R. M., et al. (2003). La coestimulación a través de OX40L expresada por las células b es suficiente para determinar el grado de expansión de las células CD4 primarias y la secreción de citoquinas TH2 in vivo. J. Exp. Med. 197, 875–883. DOI: 10.1084/JEM.20021290
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Mahnke, Y. D., Brodie, T. M., Sallusto, F., Roederer, M., Lugli, E. (2013). El quién es quién de la diferenciación de células T: subconjuntos de células T de memoria humana. Eur. J. Immunol. 43, 2797–2809. doi: 10.1002/eji.201343751
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Martín, V., Pascual, E., Avia, M., Peña, L., Valcárcel, F., Sevilla, N. (2015). La eficacia protectora en ovejas de las vacunas vectorizadas por adenovirus contra el virus de la lengua azul se asocia con respuestas específicas de células T. PloS One 10, 1–20. doi: 10.1371/journal.pone.0143273
Matter, M. S., Claus, C., Ochsenbein, A. F. (2008). Las células T CD4+ ayudan a mejorar la memoria de las células T CD8+ mediante la expresión retenida de CD27. Eur. J. Immunol. 38, 1847–1856. doi: 10.1002/eji.200737824
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Mueller, D. L., Jenkins, M. K., Schwartz, R. H. (1989). Expansión clonal versus inactivación clonal funcional: Una vía de señalización coestimuladora determina el resultado de la ocupación del receptor de antígeno de células T. Annu. Rev. Immunol. 7, 445–480. doi: 10.1146/annurev.iy.07.040189.002305
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Ohshima, Y., Tanaka, Y., Tozawa, H., Takahashi, Y., Maliszewski, C., Delespesse, G. (1997). Expresión y función del ligando OX40 en células dendríticas humanas. J. Immunol. 159, 3838–3848.
Pallmer, K., Oxenius, A. (2016). Reconocimiento y regulación de células T por células NK. Frente. Immunol. 7. DOI: 10.3389/fimmu.2016.00251
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Peperzak, V., Xiao, Y., Veraar, E. A. M., Borst, J. (2010) CD27 mantiene la supervivencia de CTL en tejido no linfoide infectado por virus en ratones al inducir la producción autocrina de IL-2. J. Clin. Invertir. 120, 168–178. doi: 10.1172/JCI40178
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Polak, M. E., Newell, L., Taraban, V. Y., Pickard, C., Healy, E., Friedmann, P. S., et al. (2012). La interacción CD70-CD27 aumenta la activación de las células T CD8 por las células epidérmicas de Langerhans humanas. J. Invertir. Dermatol. 132, 1636–1644. DOI: 10.1038/JID.2012.26
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Ramakrishna, V., Sundarapandiyan, K., Zhao, B., Bylesjo, M., Marsh, H. C., Keler, T. (2015). Caracterización de la respuesta de las células T humanas a la coestimulación in vitro de CD27 con varlilumab. J. Immunother. Cáncer. 3, 37. DOI: 10.1186/S40425-015-0080-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Rodríguez-Martín, D., Rojas, J. M., Macchi, F., Franceschi, V., Russo, L., Sevilla, N., et al. (2021). La inmunización con el vector basado en el herpesvirus bovino 4 que administra la proteína PPRV-h protege a las ovejas del desafío del VPRP. Frente. Immunol. 12. DOI: 10.3389/fimmu.2021.705539
Rogers, P. R., Song, J., Gramaglia, I., Killeen, N., Croft, M. (2001). OX40 promueve la expresión de bcl-xL y bcl-2 y es esencial para la supervivencia a largo plazo de las células T CD4. Inmunidad. 15, 445–455. doi: 10.1016/S1074-7613(01)00191-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Rojas, J. M., Alejo, A., Avia, J. M., Rodríguez-Martín, D., Sánchez, C., Alcamí, A., et al. (2020). Activación de la señalización coestimuladora ox40 y CD27 en ovinos mediante ligandos ovinos recombinantes. Vacunas. 8, 333. doi: 10.3390/vaccines8020333
Rojas, J. M., Avia, M., Martín, V., Sevilla, N. (2017a). IL-10: Una citocina multifuncional en infecciones virales. J. Immunol. Res. 6104054. doi: 10.1155/2017/6104054
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Rojas, J. M., Avia, M., Pascual, E., Sevilla, N., Martín, V. (2017b). La vacunación con adenovirus recombinantes que expresan proteínas peste des petits rumiants virus-f o -h provoca respuestas de células T a los epítopos que surgen durante la infección por PPRV. Vet. 48, 79. DOI: 10.1186/S13567-017-0482-X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Rojas, J. M., Moreno, H., Valcárcel, F., Peña, L., Sevilla, N., Martín, V. (2014a). La vacunación con adenovirus recombinantes que expresan las proteínas f o h del virus de la peste de pequeños rumiantes supera la inmunosupresión viral e induce inmunidad protectora contra el desafío del VPPESTE de pequeños rumiantes en ovinos. PloS One 9, e101226. doi: 10.1371/journal.pone.0101226
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Rojas, J. M., Peña, L., Martín, V., Sevilla, N. (2014b). Los epítopos de células T ovinas y murinas de la proteína no estructural 1 (NS1) del serotipo 8 del virus de la lengua azul (BTV-8) se comparten entre los serotipos virales. Vet. 45, 30. doi: 10.1186/1297-9716-45-30
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Rojas, J. M., Sevilla, N., Martín, V. (2019). «Adenovirus as tools in animal health», en Adenoviruses (Londres, Reino Unido: IntechOpen Limited). doi: 10.5772/intechopen.79132
Salek-Ardakani, S., Moutaftsi, M., Crotty, S., Sette, A., Croft, M. (2008). OX40 impulsa las células T CD8 protectoras específicas del virus vaccinia. J. Immunol. 181, 7969–7976. doi: 10.4049/jimmunol.181.11.7969
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Salek-Ardakani, S., Moutaftsi, M., Sette, A., Croft, M. (2011). Dirigirse a OX40 promueve las poblaciones de células T CD8 de memoria residentes en los pulmones que protegen contra la infección por poxvirus respiratorio. J. Virol. 85, 9051–9059. DOI: 10.1128/JVI.00619-11
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Schmittgen, T. D., Zakrajsek, B. A., Mills, A. G., Gorn, V., Singer, M. J., Reed, M. W. (2000). Reacción cuantitativa en cadena de la polimerasa con transcripción inversa para estudiar la desintegración del ARNm: comparación de métodos de punto final y en tiempo real. Anal. Bioquímica. 285, 194–204. DOI: 10.1006/abio.2000.4753
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Soroosh, P., Ine, S., Sugamura, K., Ishii, N. (2006). La interacción del ligando OX40-OX40 a través del contacto entre las células T y las células T contribuye a la longevidad de las células T CD4. J. Immunol. 176, 5975–5987. doi: 10.4049/jimmunol.176.10.5975
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Sun, G., Jin, H., Zhang, C., Meng, H., Zhao, X., Wei, D., et al. (2018). OX40 regula la inmunidad innata y adaptativa y promueve la esteatohepatitis no alcohólica. Representante de Cell 25, 3786–3799. doi: 10.1016/j.celrep.2018.12.006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Suntharalingam, G., Perry, M. R., Ward, S., Brett, S. J., Castello-Cortes, A., Brunner, M. D., et al. (2006). Tormenta de citoquinas en un ensayo de fase 1 del anticuerpo monoclonal anti-CD28 TGN1412. N. Ingl. J. Med. 355, 1018–1028. DOI: 10.1056/NEJMOA063842
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Tulotta, C., Ottewell, P. (2018). El papel de IL-1B en la metástasis ósea del cáncer de mama. Endocrino. Rela. Cáncer. 25, R421–R434. doi: 10.1530/ERC-17-0309
Resumen de PubMed | Texto completo de CrossRef | Google Académico
van Rijn, P. A. (2019). Perspectivas de vacunas de próxima generación para la fiebre catarral ovina. Frente. Vet. Sci. 6. DOI: 10.3389/FVETS.2019.00407
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Weinberg, A. D., Evans, D. E., Thalhofer, C., Shi, T., Prell, R. A. (2004). La generación de memoria de células T: una revisión que describe los eventos moleculares y celulares después del compromiso OX40 (CD134). J. Leukoc. Biol. 75, 962–972. DOI: 10.1189/JLB.1103586
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Whittington, H. A., Ashworth, L. J., Hawkins, R. E. (1998). Suministro adenoviral recombinante para la expresión in vivo de proteínas de fusión de anticuerpos scFv. Gen Ther. 5, 770–777. doi: 10.1038/sj.gt.3300685
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Winer, J., Jung, C. K. S., Shackel, I., Williams, P. M. (1999). Desarrollo y validación de la reacción en cadena cuantitativa de la polimerasa con transcriptasa inversa en tiempo real para la monitorización de la expresión génica en miocitos cardíacos in vitro. Anal. Bioquímica. 270, 41–49. doi: 10.1006/abio.1999.4085
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Wortzman, M. E., Clouthier, D. L., Mcpherson, A. J., Lin, G. H. Y., Watts, T. H. (2013). El papel contextual de los miembros de la familia TNFR en el control de las infecciones virales de las células T CD8 +. Immunol. Rev. 255, 125–148. DOI: 10.1111/IMR.12086
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Cita: Rojas JM, Mancho C, Louloudes-Lázaro A, Rodríguez-Martín D, Avia M, Moreno S, Sevilla N y Martín V (2022) La administración adenoviral de moléculas coestimuladoras ovinas OX40L o CD70 solubles mejora las respuestas inmunes adaptativas a un antígeno modelo en ovejas. Frente. Celda. Infecta. Microbiol. 12:1010873. doi: 10.3389/fcimb.2022.1010873
Recibido: 03 Agosto 2022; Aprobado: 05 Septiembre 2022;
Publicado: 23 de septiembre de 2022.
Editado por:
Tonya Michelle Colpitts, Moderna Therapeutics, Estados Unidos
Revisado por:
Gisselle N. Medina, Servicio de Investigación Agrícola, (USDA), Estados Unidos Naomi Taus, USDA ARS ADRU, Estados Unidos
Copyright © 2022 Rojas, Mancho, Louloudes-Lázaro, Rodríguez-Martín, Avia, Moreno, Sevilla y Martín. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Verónica Martín, veronica.martin@inia.csis.es
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía