La administración de β-hidroxibutirato mejora la lesión hepática y la anomalía metabólica en lechones
 La administración de β-hidroxibutirato mejora la lesión hepática y la anomalía metabólica en lechones con retraso de crecimiento postnatal
La administración de β-hidroxibutirato mejora la lesión hepática y la anomalía metabólica en lechones con retraso de crecimiento postnatal
 Chengming Wang1,2†
Chengming Wang1,2†  Nan Wang1,2†
Nan Wang1,2†  Yuankun Deng1,2
Yuankun Deng1,2  Andong Zha1,2
Andong Zha1,2  Junyao Li1,2
Junyao Li1,2  Bie Tan1,2
Bie Tan1,2  Ming Qi1,2*
Ming Qi1,2*  Jing Wang1,2*
Jing Wang1,2*  Yulong Yin1,2,3
Yulong Yin1,2,3- 1Facultad de Ciencia y Tecnología Animal, Universidad Agrícola de Hunan, Changsha, Hunan, China
- 2Laboratorio Yuelushan, Changsha, Hunan, China
- 3Instituto de la Industria Agrícola Circular de Yunnan, Puer, Yunnan, China
El metabolismo energético hepático anormal limita el crecimiento y desarrollo de los lechones. Planteamos la hipótesis de que el β-hidroxibutirato (BHB) podría mejorar el rendimiento del crecimiento de los lechones al mantener la homeostasis calórica hepática. Se realizó un seguimiento de un total de 30 camadas de lechones recién nacidos, y se seleccionaron 30 lechones con retraso del crecimiento posnatal (PGR) y 40 lechones sanos para tratarlos con solución salina normal con o sin BHB (25 mg/kg/días) a los 7 días de edad. A la edad de 42 días, se sacrificaron 8 lechones de cada grupo y se colectó suero e hígado. En comparación con los lechones sanos del grupo control, los lechones PGR mostraron un menor peso corporal (PC) y peso hepático (p < 0,05), y mostraron lesión hepática y mayor respuesta inflamatoria. Los contenidos de BHB sérico y hepático fueron menores (p < 0,05), y la expresión génica relacionada con la producción de cuerpos cetónicos hepáticos se reguló a la baja en los lechones PGR (p < 0,05). Mientras que el tratamiento con BHB aumentó los niveles de BH en peso y en suero, pero disminuyó los niveles hepáticos de BBH en lechones PGR (p < 0,05). El BHB alivió la lesión hepática al inhibir la apoptosis y la inflamación en el hígado de lechones PGR (p < 0,05). En comparación con los lechones sanos del grupo control, el contenido de glucógeno hepático y el nivel sérico de triglicéridos de los lechones PGR aumentaron (p < 0,05), la expresión génica del gen de la gluconeogénesis hepática y del gen de la lipogénesis aumentaron (p < 0,05) y el nivel de NAD hepático disminuyó (p < 0,05). La suplementación con BHB aumentó los niveles de ATP en suero e hígado (p < 0,05), mientras que disminuyó los niveles séricos de glucosa, colesterol, triglicéridos y colesterol de lipoproteínas de alta densidad y el metabolismo de la glucosa y los lípidos en el hígado de lechones PGR (p < 0,05). Por lo tanto, el tratamiento con BHB podría aliviar la lesión hepática y la inflamación, y mejorar el metabolismo energético hepático mediante la regulación del metabolismo de la glucosa y los lípidos, mejorando así el rendimiento del crecimiento de los lechones PGR.+
1. Introducción
El retraso del crecimiento (TG) es cuando un individuo crece significativamente más lento que un individuo sano, acompañado de trastornos metabólicos, inflamación sistémica o disbiosis intestinal, que generalmente ocurren en las primeras etapas de la vida (1). El retraso del crecimiento se puede dividir en dos categorías: retraso del crecimiento intrauterino (RCIU) y retraso del crecimiento posnatal (PGR). En los mamíferos, la incidencia de RCIU es alta en múltiples animales, como los cerdos, y entre el 15 y el 20% de los lechones recién nacidos pesan menos de 1,1 kg (2). Los lechones PGR se definen como lechones con peso normal al nacer, mientras que el peso corporal durante el crecimiento y desarrollo postnatal es inferior al 70% del peso promedio de los lechones sanos en el mismo período, y no hay traumatismos evidentes (3). La incidencia de lechones PGR durante la lactancia y después del destete es de aproximadamente 10-30 y 5% respectivamente, lo que restringe seriamente la eficiencia de la cría (4). Normalmente, el RCIU es causado principalmente por la disminución del flujo sanguíneo y el suministro insuficiente de nutrientes que son inducidos por trastornos uterino-placentarios durante el embarazo materno, lo que resulta en un retraso en el crecimiento y desarrollo del feto o sus órganos (5). La PGR se debe al deterioro de la función de barrera intestinal y al desequilibrio de los microorganismos intestinales después del nacimiento que desencadenó una disminución en la capacidad de absorción de nutrientes intestinales, lo que indujo el lento crecimiento y desarrollo de los lechones recién nacidos (6). Curiosamente, nuestra prueba de rastreo de lechones (desde el nacimiento hasta los 60 días de edad) encontró que algunos lechones IUGR fueron capaces de desarrollar un crecimiento de recuperación al destete, cuyo peso corporal superaba a los lechones PGR (datos no publicados). Nuestros estudios anteriores mostraron que los lechones PGR tienen una absorción nutricional desregulada y un metabolismo energético aberrante (6-9), lo que sugiere que aumentar la utilización de nutrientes y mantener el equilibrio del metabolismo energético podría mejorar la inhibición del crecimiento de los lechones PGR.
El hígado sirve como un modulador clave en la homeostasis metabólica de la nutrición que involucra el almacenamiento de energía, el metabolismo de los xenobióticos y la actividad de desintoxicación (10). Los estudios han demostrado que el metabolismo de los nutrientes en el hígado de los lechones con RCIU es anormal, lo que inevitablemente perjudica la función hepática (5, 11). Anteriormente observamos una disminución de la vía de señalización del receptor gamma activado por proliferadores de peroxisomas (PPARγ) y un deterioro en la utilización de glucosa en el intestino delgado de los lechones PGR en comparación con los de los lechones sanos (7). Estas consideraciones plantearon la posibilidad de que exista un metabolismo energético hepático deficiente en los lechones PGR y que la mediación del metabolismo energético podría promover su rendimiento vegetativo. Los cuerpos cetónicos, especialmente el β-hidroxibutirato (BHB), se sintetizan en el hígado a partir del acetil-CoA derivado principalmente de la oxidación de ácidos grasos. En caso de deficiencia nutricional, el BHB puede utilizarse como fuente de energía alternativa para mantener la homeostasis calórica (12). Mientras tanto, el BHB también actúa como una molécula de señalización para modular la lipólisis, el estrés oxidativo y la neuroprotección. Los estudios han encontrado que los ratones con insuficiencia cetogénica y alimentados con una dieta alta en grasas exhiben un metabolismo hepático anormal de la glucosa hepática y los lípidos para inducir disfunción mitocondrial y lesión hepática (13). El BHB podría prevenir la lesión por isquemia-reperfusión hepática y el estrés oxidativo mediante la regulación positiva de FOXO1 y HO-1, y reducir la respuesta inflamatoria y la muerte celular apoptótica mediante la regulación negativa del inflamasoma NF-κB y NLRP3 (14, 15). Además, el BHB mejora el estrés del retículo endoplásmico mediante la activación de la AMPK e inhibe la NLRP3 (16-18).
Por lo tanto, planteamos la hipótesis de que la suplementación con BHB exógeno podría mejorar el rendimiento del crecimiento de los lechones PGR mediante la regulación del metabolismo energético del hígado. Se determinó el efecto de la suplementación con BHB sobre la morfología hepática, la respuesta inflamatoria hepática y el metabolismo energético en lechones sanos o PGR.
2. Materiales y métodos
Todos los animales utilizados en este estudio son manejados de manera humanitaria de acuerdo con las pautas chinas de bienestar animal. El plan experimental fue aprobado por el Comité de Protección y Utilización de Animales de la Universidad Agrícola de Hunan (Changsha, China; 2.021.042).
2.1. Diseño animal y experimental
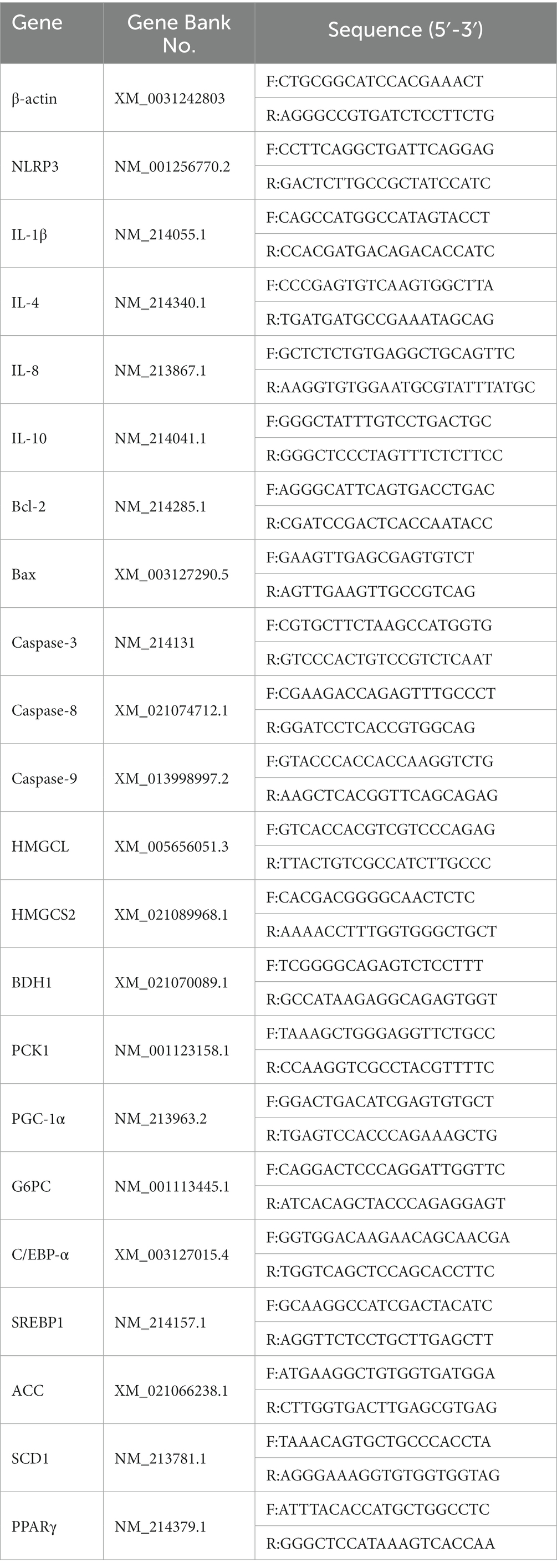
Se registraron 30 camadas de lechones recién nacidos con paridad similar (3ª ~ 5ª paridad) y antecedentes genéticos (alrededor de 12 lechones por camada). Todos los lechones son amamantados normalmente. La alimentación de la cerda y el lechón, el agua potable y el entorno de alimentación se llevan a cabo de acuerdo con las normas de funcionamiento de la granja de la empresa. Todos los lechones recién nacidos están marcados con defectos en las orejas. Se registró el peso al nacer de los lechones recién nacidos y se definió como lechones IUGR según el peso al nacer inferior a 1,1 kg (2). A los 7 días de edad, los lechones PGR se definieron de acuerdo con el estándar de aquellos cuyo peso corporal era inferior al 70% del peso promedio de los lechones sanos y no había trauma evidente (8). Cuarenta lechones sanos normales y treinta lechones PGR se dividieron aleatoriamente en 4 grupos: grupo control, grupo BHB, grupo PGR y grupo PGR + BHB. Los lechones del grupo control y PGR fueron alimentados diariamente con 5 mL de solución salina (0,9%) a partir de los 7 días de edad, los lechones del grupo BHB y del grupo PGR + BHB mientras se alimentaban con solución de BHB disuelta en solución salina de 5 mL (25 mg/kg/día, el peso corporal se calculó de acuerdo con el peso promedio por semana). A la edad de 42 días, se seleccionaron aleatoriamente 8 lechones de cada grupo para el muestreo de sacrificio. El peso corporal de los lechones se muestra en la Tabla 1.
2.2. Recogida de muestras
Después de 12 h de ayuno, a todos los lechones se les recogió la sangre de la vena cava anterior en los vasos sanguíneos que contenían heparina sódica. Se centrifugaron 3.000 g a temperatura ambiente durante 10 min y se almacenaron en el frigorífico a -80 °C. Después de recolectar la sangre, se tomó el hígado para pesarlo y luego las secciones hepáticas (aproximadamente 1 cm2) y las muestras de hígado (alrededor de 5 g) se enjuagaron bien con PBS frío (PH 7,4) para eliminar la contaminación de la sangre. Los cortes de hígado se fijaron rápidamente en paraformaldehído al 4% y se prepararon para su inclusión y corte para la tinción de hematoxilina-eosina (HE) y periodato-Schaefer (PAS). Las muestras de hígado se congelaron rápidamente en nitrógeno líquido y se almacenaron a -80 °C para su posterior análisis. Todas las muestras se recogieron dentro de los 15 minutos posteriores a la ejecución.
2.3. Análisis de los índices bioquímicos séricos
Los índices bioquímicos séricos, incluidos los triglicéridos (TG), el colesterol (CT), el colesterol de lipoproteínas de alta densidad (HDL-C), el colesterol de lipoproteínas de baja densidad (LDL-C) y la glucosa (GLU) se detectaron mediante el analizador bioquímico automático BS-200 (BeckmanCX4, Beckman Coulter Inc.). El kit específico se compró a Shanghai Kehua Bio-Engineering Co., Ltd.
2.4. Determinación de la actividad de las transaminasas y del contenido de BHB en plasma e hígado
Las actividades de la aspartato aminotransferasa (AST) y la alanina aminotransferasa (ALT) en plasma e hígado se determinaron mediante un kit comercial (Beijing Solarbio Science & Technology Co., Ltd.). El contenido de BHB en suero se detectó mediante un ensayo de inmunoabsorción enzimática de cerdo (Shanghai Fanke industrial Co., Ltd.), y el contenido de BHB en el hígado se detectó mediante kits de ensayo colorimétrico de β-hidroxibutirato (Cayman Inc., Estados Unidos) de acuerdo con las instrucciones del fabricante.
2.5. Determinación de citoquinas inflamatorias en hígado
Las muestras hepáticas se homogeneizaron en PBS frío. El homogeneizado hepático se tomó y centrifugó a 4°C durante 12.000 g 10 min. El sobrenadante fue recolectado para su posterior detección. Las concentraciones de interleucina-1β (IL-1β), interleucina-10 (IL-10), factor de necrosis tumoral α (TNF-α) e interferón-γ (IFN-γ) se detectaron mediante un kit de ensayo de inmunoabsorción enzimática (CSB-E06782p, CSB-E06779p, CSB-E16980p, CSB-E06794p, CUSABIO, https://www.cusabio.com/). Los resultados finales se normalizaron con la concentración total de proteína en cada muestra, y la concentración de proteína se detectó mediante el kit de determinación de la concentración de proteína BCA (Beyotime Biotech. Inc.).
2.6. Determinación del índice de metabolismo energético del hígado
El contenido de trifosfato de adenosina (ATP) (Jiangsu Meimian Industrial Co., Ltd., Yancheng, China) se detectó mediante un kit de ensayo de inmunoabsorción ligado a enzimas en cerdos. Los contenidos de coenzima I oxidada (NAD) y coenzima I reducida (NADH) se determinaron de acuerdo con las instrucciones de funcionamiento de los kits correspondientes (Beyotime Biotech. Inc.). Los resultados finales se normalizaron con la concentración total de proteína en cada muestra.+
2.7. Análisis inversos cuantitativos
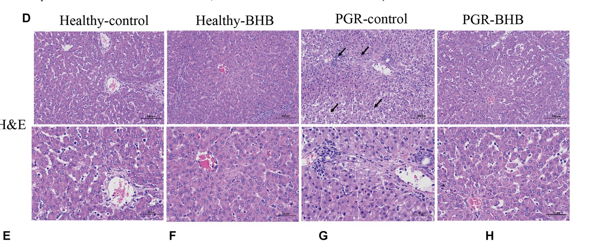
De acuerdo con los principios de diseño de imprimación, se utilizó el software primer premier 6.0 para diseñar imprimaciones, que fueron sintetizadas por Beijing Tsingke Biotech Co., Ltd. La secuencia del cebador se muestra en la Tabla 2. El reactivo TRIZOL (Invitrogen, Carlsbad, CA, Estados Unidos) extrajo el ARN total del hígado. La integridad, calidad y pureza del ARN de las muestras se determinaron mediante electroforesis en gel de agarosa al 1% y analizador automático de ácidos nucleicos/proteínas. Utilizando el kit de premezcla de transcripción inversa Evo M-MLV (AG11728, Accurate Biotechnology (Hunan) Co., Ltd., Chang Sha, China) transcribió de forma inversa el ARN en ADNc. Consulte las instrucciones del kit de qPCR premezclado SYBR Green Pro Taq HS (AG11701, Accurate Biotechnology (Hunan) Co., Ltd., Chang Sha, China), utilizando un instrumento de PCR cuantitativa fluorescente (LightCycler®480 Real-Time PCR System, Roche, Suiza) para la detección de PCR cuantitativa de fluorescencia en tiempo real. El experimento se llevó a cabo con un sistema de reacción de 10 μL, y cada reacción se repitió tres veces. Refiérase a Qi Ming et al. para el procedimiento de reacción (8). β-actina fue el gen interno de referencia, y 2-ΔΔCt se utilizó para calcular la expresión relativa del ARNm del gen diana.
2.8. Análisis estadístico
Todos los datos de este estudio se obtienen mediante el uso de Excel 2019 después de la finalización preliminar. Todos los análisis estadísticos se realizaron mediante ANOVA de una vía utilizando el programa SPSS 20.0 (SPSS Inc., Chicago, IL, Estados Unidos). Las diferencias entre los tratamientos se evaluaron mediante la prueba de Turquía. Todos los datos se expresan como la media ± el error estándar (SEM) de la media. P < 0,05 indica que existe una diferencia significativa entre los dos grupos.
3. Resultados
3.1. Efecto del BHB sobre la morfología hepática y la inflamación hepática de lechones PGR
El peso corporal (PC) y el peso hepático absoluto de los lechones PGR fueron significativamente menores que los de los lechones sanos emparejados por edad (p < 0,05) (Tabla 1 y Figura 1A). La administración de BHB aumentó significativamente el peso corporal y absoluto del hígado de los lechones sanos y de los lechones PGR (p < 0,05) (Tabla 1 y Figura 1A), pero no tuvo un efecto significativo sobre el peso relativo del hígado (p > 0,05) (Figura 1B).
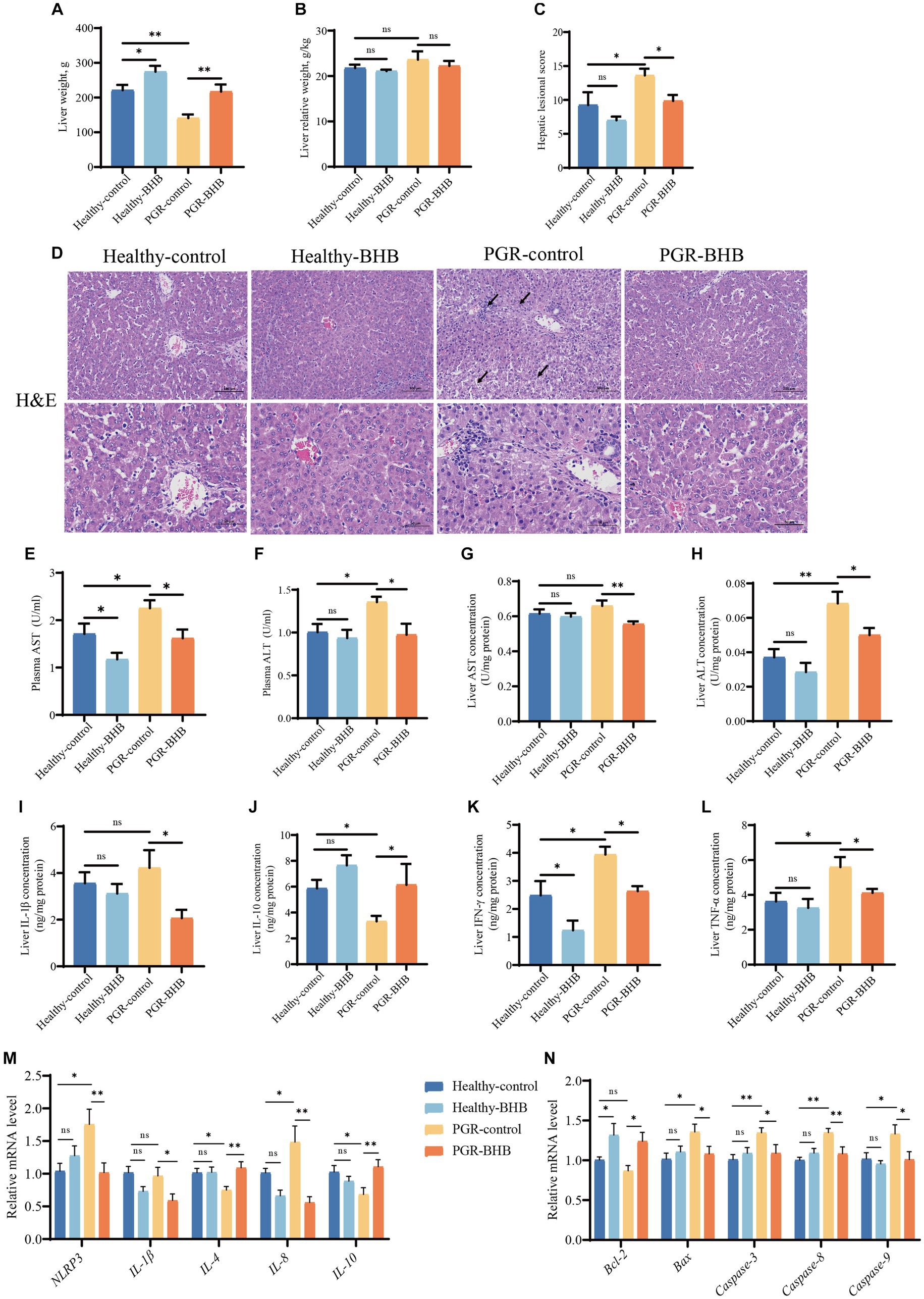 Figura 1. Efecto del BHB sobre la morfología hepática y la función de los lechones PGR. (A) Peso hepático, (B) peso relativo hepático, (C,D) imágenes representativas de tinción de H&E y puntuación lesionada en el hígado, (E,F) actividad plasmática de AST y ALT, (G,H) concentración hepática de AST y ALT, (I-L) concentración hepática de IL-1β, IL-10, IFN-γ y TNF-α, (M,N) expresión hepática de ARNm de NLRP3, IL-1β, IL-4, IL-8, IL-10, Bcl-2, Bax, Caspasa-3, Caspasa-8 y Caspasa-9. BHB: β-hidroxibutirato; PGR: retraso del crecimiento postnatal; AST: aspartato aminotransferasa; ALT: alanina aminotransferasa; IL-1β, interleucina-1β; IL-10: interleucina-10; TNF-α, factor de necrosis tumoral α; IFN-γ, interferón-γ; NLRP3: receptor similar a NOD dominio 3 de pirina; Bcl-2: linfoma de células B 2; Bax: proteína X asociada a Bcl-2; Caspasa-3, cisteína-aspártico proteasa 3; Caspasa-8, cisteína-ácido aspártico proteasa 8, Caspasa-9, cisteína-ácido aspártico proteasa 9. Los datos se presentaron como media ± SEM (n = 8). Diferentes letras minúsculas indicaron diferencias significativas entre los grupos comparados (p < 0,05).
Figura 1. Efecto del BHB sobre la morfología hepática y la función de los lechones PGR. (A) Peso hepático, (B) peso relativo hepático, (C,D) imágenes representativas de tinción de H&E y puntuación lesionada en el hígado, (E,F) actividad plasmática de AST y ALT, (G,H) concentración hepática de AST y ALT, (I-L) concentración hepática de IL-1β, IL-10, IFN-γ y TNF-α, (M,N) expresión hepática de ARNm de NLRP3, IL-1β, IL-4, IL-8, IL-10, Bcl-2, Bax, Caspasa-3, Caspasa-8 y Caspasa-9. BHB: β-hidroxibutirato; PGR: retraso del crecimiento postnatal; AST: aspartato aminotransferasa; ALT: alanina aminotransferasa; IL-1β, interleucina-1β; IL-10: interleucina-10; TNF-α, factor de necrosis tumoral α; IFN-γ, interferón-γ; NLRP3: receptor similar a NOD dominio 3 de pirina; Bcl-2: linfoma de células B 2; Bax: proteína X asociada a Bcl-2; Caspasa-3, cisteína-aspártico proteasa 3; Caspasa-8, cisteína-ácido aspártico proteasa 8, Caspasa-9, cisteína-ácido aspártico proteasa 9. Los datos se presentaron como media ± SEM (n = 8). Diferentes letras minúsculas indicaron diferencias significativas entre los grupos comparados (p < 0,05).
La morfología hepática se mostró en la Figura 1D, se observó necrosis de células de la vena porta, fragmentación nuclear, vacuolización de macrófagos, trastorno de la médula hepatocitaria, infiltración de células inflamatorias y degeneración acuosa de hepatocitos en los lechones PGR. Mientras que la administración de BHB en lechones PGR podría aliviar su lesión hepática (p < 0,05) (Figuras 1C,D). Las actividades de ALT y AST en plasma y el contenido de ALT en el tejido hepático de los lechones control PGR fueron significativamente mayores que las de los lechones control sanos (p < 0,05) (Figuras 1E-H). En comparación con el grupo control de PGR, el BHB disminuyó los niveles de AST y ALT en el plasma y el hígado de los lechones PGR, mientras que el BHB disminuyó los niveles plasmáticos de AST de los lechones sanos en comparación con el grupo de control sano (p < 0,05) (Figuras 1E-H). Mientras tanto, el grupo control de PGR mostró mayores concentraciones de IFN-γ y TNF-α, así como niveles de expresión de ARNm de NLRP3 e IL-8 en el hígado, pero niveles más bajos de concentración hepática de IL-10 y niveles de expresión de ARNm de IL-4, IL-10 en comparación con el grupo de control sano (p < 0.05) (Figuras 1I-M). El tratamiento con BHB en lechones sanos disminuyó la concentración hepática de IFN-γ en comparación con el grupo control sano (p < 0,05) (Figura 1K), mientras que el tratamiento con BHB en lechones PGR disminuyó significativamente las concentraciones de IL-1β, IFN-γ y TNF-α, así como los niveles de expresión de ARNm de NLRP3, IL-1β e IL-8 en el hígado (p < 0,05) (Figuras 1I-M). En comparación con el grupo control de PGR, el tratamiento con BHB en lechones PGR también mostró concentraciones más altas de IL-10 y niveles de ARNm de IL-4, IL-10 en el hígado (p < 0,05) (Figuras 1I-M). Además, las expresiones relativas de ARNm de Bax, Caspasa-3, Caspasa-8 y Caspasa-9 en el hígado de lechones control con PGR se regularon significativamente al alza (p < 0.05) (Figura 1N). En comparación con los lechones control sanos, la suplementación con BHB aumentó las expresiones relativas de ARNm de Bcl-2 (p < 0,05), mientras que en comparación con los lechones control de PGR, la suplementación con BHB disminuyó los niveles de expresión de ARNm de Bax, Caspasa-3, Caspasa-8 y Caspasa-9, pero aumentó los niveles de ARNm de Bcl-2 en el hígado (p < 0,05) (Figura 1N).
3.2. Cambios en el metabolismo del BHB en el hígado y el suero de los lechones
Los niveles de BHB en el suero y el hígado de los lechones control PGR fueron significativamente más bajos que los de los lechones control sanos (p < 0,05) (Figuras 2A, B). En comparación con el grupo control PGR, la suplementación con BHB aumentó el nivel sérico de BHB y redujo el contenido de BHB hepático de los lechones PGR (p < 0,05), mientras que la suplementación con BHB redujo el contenido de BHB hepático de los lechones sanos en comparación con el grupo control sano (p < 0,05) (Figuras 2A, B). Al mismo tiempo, el nivel de expresión del ARNm de HMGCS2 en el hígado del grupo control de PGR fue significativamente menor que el del grupo control sano (p < 0,05) (Figura 2C). En comparación con el grupo control de PGR, la suplementación con BHB aumentó los niveles de expresión de HMGCS2 y ARNm de HMGCL en el hígado de lechones PGR, y disminuyó el nivel de expresión de ARNm de BDH1 (p < 0,05) (Figuras 2C-E). Mientras que la suplementación con BHB disminuyó el nivel de expresión del ARNm de BDH1 en el hígado de lechones sanos en comparación con el grupo control sano (p < 0,05) (Figuras 2C-E).
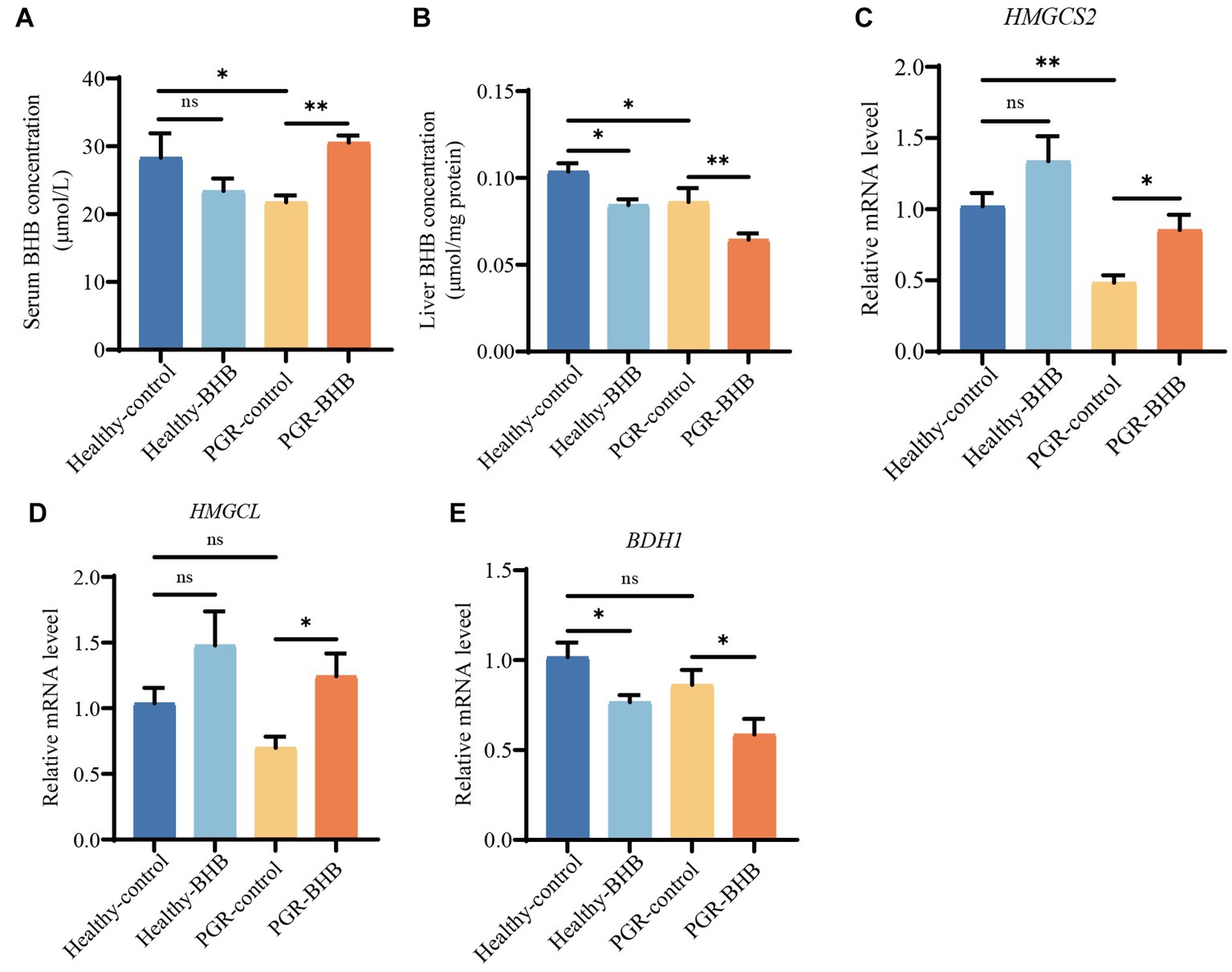 Figura 2. Metabolismo del hígado y suero del BHB en lechones. (A) Concentración sérica de BHB. (B) Concentración hepática de BHB. (C-E) Expresión hepática de ARNm de HMGCS2, HMGCL y BDH1. BHB: β-hidroxibutirato; PGR: retraso del crecimiento postnatal; HNGCS2, 3-hidroxi-3-metilglutaril-CoA sintasa 2; HMGCL: 3-hidroxi-3-metilglutaril-CoA liasa; BDH1, 3-hidroxibutirato deshidrogenasa 1. Los datos se presentaron como media ± SEM (n = 8). Diferentes letras minúsculas indicaron diferencias significativas entre los grupos comparados (p < 0,05).
Figura 2. Metabolismo del hígado y suero del BHB en lechones. (A) Concentración sérica de BHB. (B) Concentración hepática de BHB. (C-E) Expresión hepática de ARNm de HMGCS2, HMGCL y BDH1. BHB: β-hidroxibutirato; PGR: retraso del crecimiento postnatal; HNGCS2, 3-hidroxi-3-metilglutaril-CoA sintasa 2; HMGCL: 3-hidroxi-3-metilglutaril-CoA liasa; BDH1, 3-hidroxibutirato deshidrogenasa 1. Los datos se presentaron como media ± SEM (n = 8). Diferentes letras minúsculas indicaron diferencias significativas entre los grupos comparados (p < 0,05).
3.3. Efecto del BHB sobre el nivel energético de los lechones PGR
En comparación con los lechones sanos del grupo control, la suplementación con BHB aumentó los niveles séricos de ATP de los lechones sanos (p < 0,05) (Figura 3A), mientras que la suplementación con BHB aumentó los niveles séricos de ATP y el contenido de ATP hepático de los lechones PGR en comparación con los lechones del grupo control PGR (p < 0,05) (Figuras 3A, B). Además, el contenido de NAD hepático de los lechones en el grupo control de PGR fue significativamente menor que en el grupo de control sano (p < 0,05) (Figura 3C). En comparación con los lechones sanos del grupo control, la suplementación con BHB disminuyó el contenido de NAD hepático y NADH de los lechones sanos (p < 0,05), mientras que en comparación con los lechones del grupo control PGR, la suplementación con BHB disminuyó el contenido de NADH hepático de los lechones PGR (p < 0,05), pero no tuvo un efecto significativo sobre el NAD/NADH (p > 0,05) (Figuras 3C-E).+++
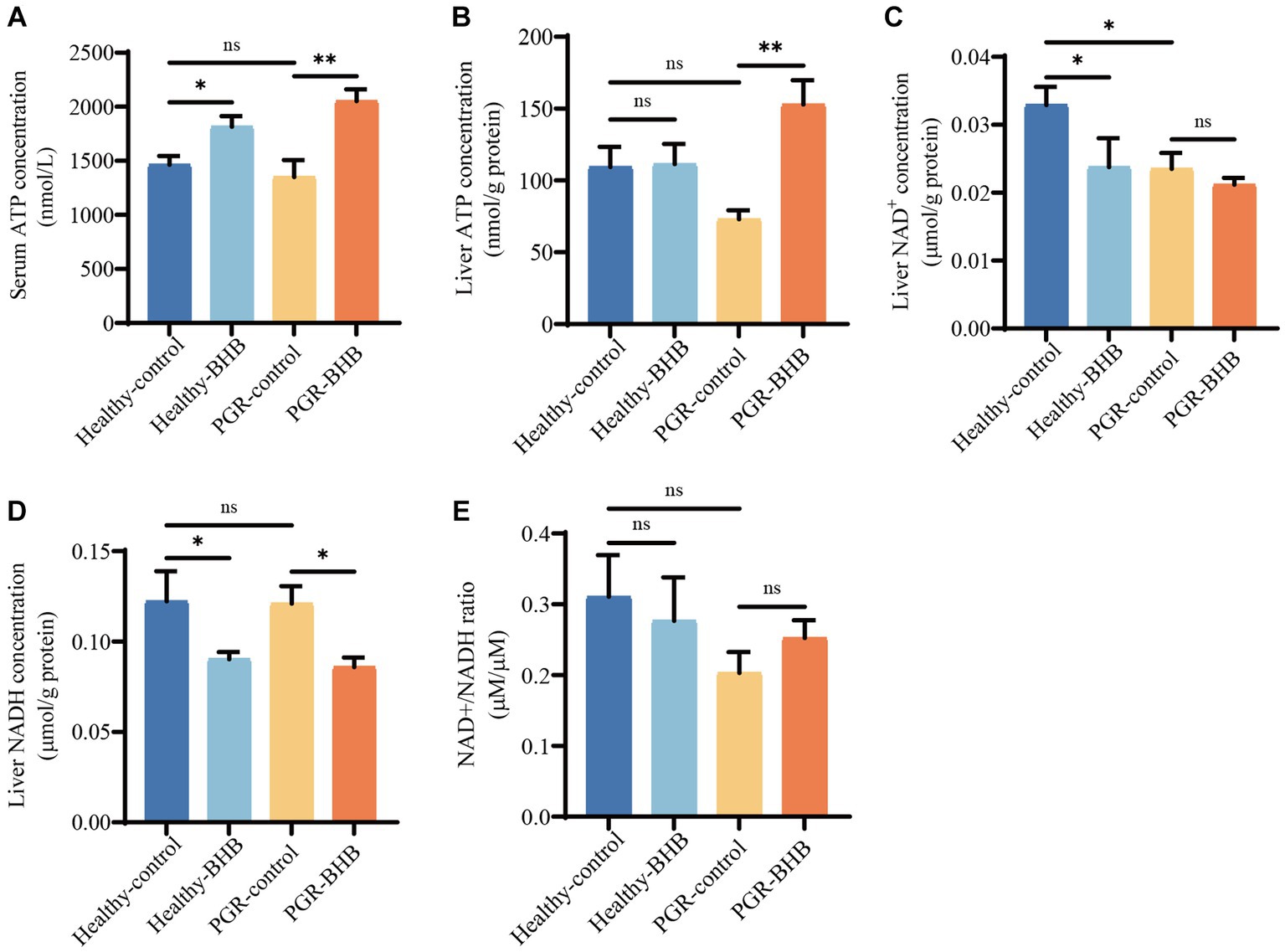 Figura 3. Efecto del BHB sobre el estado energético de lechones PGR. (A) Concentración sérica de ATP. (B) Concentración hepática de ATP. (C-E) Concentración hepática de NAD y NADH. BHB: β-hidroxibutirato; PGR: retraso del crecimiento postnatal; ATP, trifosfato de adenosina, NAD, coenzima I oxidada; NADH: coenzima I reducida. Los datos se presentaron como media ± SEM (n = 8). Diferentes letras minúsculas indicaron diferencias significativas entre los grupos comparados (p < 0,05).++
Figura 3. Efecto del BHB sobre el estado energético de lechones PGR. (A) Concentración sérica de ATP. (B) Concentración hepática de ATP. (C-E) Concentración hepática de NAD y NADH. BHB: β-hidroxibutirato; PGR: retraso del crecimiento postnatal; ATP, trifosfato de adenosina, NAD, coenzima I oxidada; NADH: coenzima I reducida. Los datos se presentaron como media ± SEM (n = 8). Diferentes letras minúsculas indicaron diferencias significativas entre los grupos comparados (p < 0,05).++
3.4. Efecto del BHB sobre el metabolismo de la glucosa hepática en lechones PGR
En comparación con los lechones sanos del grupo control, el contenido de glucógeno hepático de los lechones en el grupo control PGR aumentó (p < 0,05) (Figuras 4A-D). La suplementación con BHB redujo significativamente los niveles de glucosa en sangre y el contenido de glucógeno hepático en lechones sanos y lechones PGR (p < 0,05) (Figuras 4A-D) (p < 0,05) (Figuras 4A-D). En comparación con los lechones sanos del grupo de control, los niveles de expresión de ARNm de los genes relacionados con la gluconeogénesis PGC-1α y G6PC en el hígado de los lechones PGR aumentaron (p < 0,05) (Figuras 4E-G). Mientras que la suplementación con BHB aumentó significativamente los niveles de expresión de ARNm de PCK1 y disminuyó los niveles de expresión de ARNm de PGC-1α y G6PC en el hígado de lechones PGR (p < 0,05) (Figuras 4E-G).
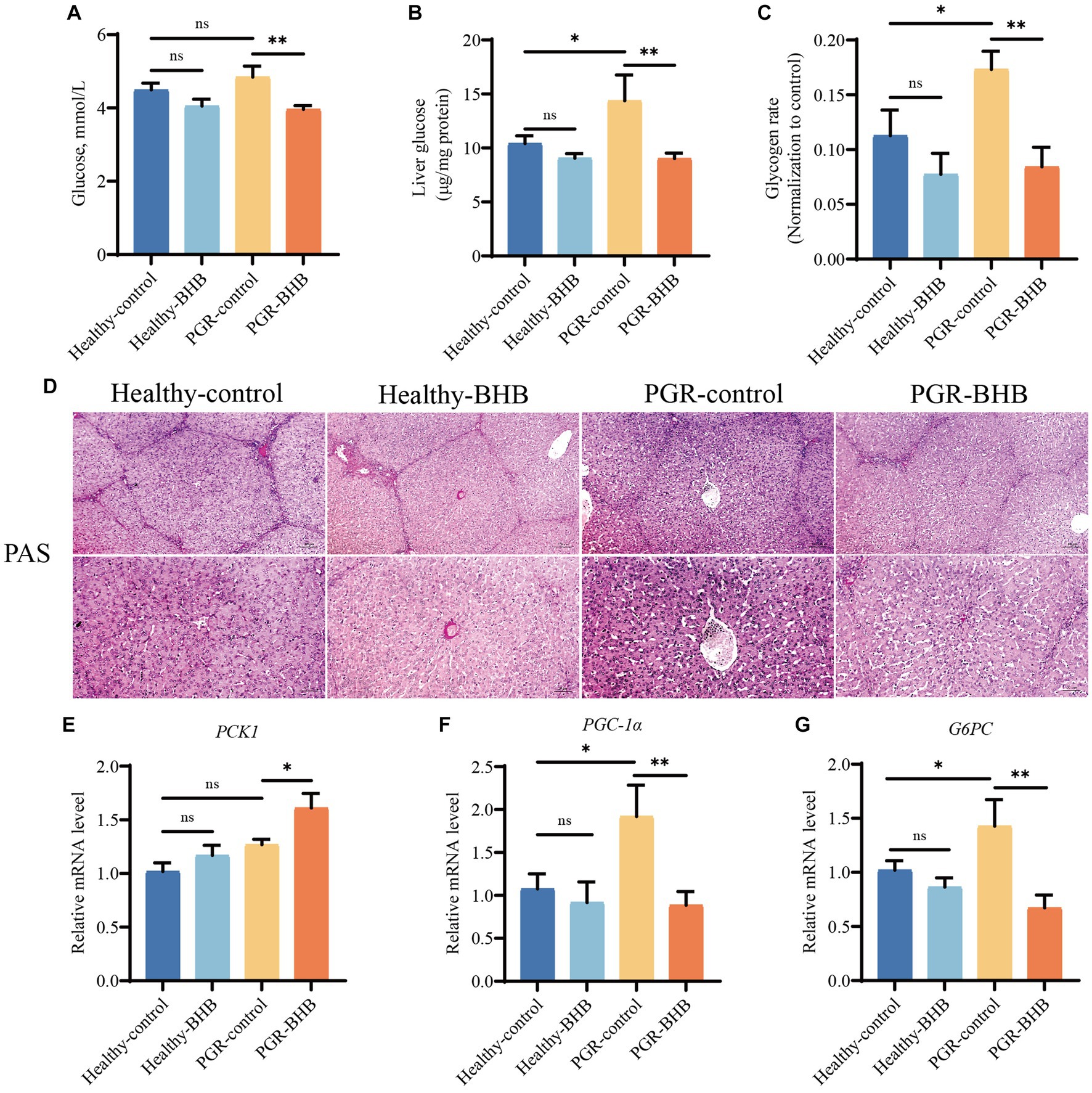 Figura 4. Efecto del BHB sobre el metabolismo de la glucosa hepática en lechones PGR. (A) Nivel de azúcar en la sangre. (B) Concentración hepática de glucosa. (C,D) Imágenes representativas de la tinción de PAS y la puntuación lesionada en el hígado. (E–G) Expresión hepática de ARNm de PCK1, PGC-1α y G6PC. BHB: β-hidroxibutirato; PGR: retraso del crecimiento postnatal; PCK1: fosfoenolpiruvato carboxiquinasa 1; PGC-1α: coactivador gamma del receptor gamma activado por el proliferador de peroxisomas 1-alfa; G6PC: Glucosa-6-fosfatasa. Los datos se presentaron como media ± SEM (n = 8). Diferentes letras minúsculas indicaron diferencias significativas entre los grupos comparados (p < 0,05).
Figura 4. Efecto del BHB sobre el metabolismo de la glucosa hepática en lechones PGR. (A) Nivel de azúcar en la sangre. (B) Concentración hepática de glucosa. (C,D) Imágenes representativas de la tinción de PAS y la puntuación lesionada en el hígado. (E–G) Expresión hepática de ARNm de PCK1, PGC-1α y G6PC. BHB: β-hidroxibutirato; PGR: retraso del crecimiento postnatal; PCK1: fosfoenolpiruvato carboxiquinasa 1; PGC-1α: coactivador gamma del receptor gamma activado por el proliferador de peroxisomas 1-alfa; G6PC: Glucosa-6-fosfatasa. Los datos se presentaron como media ± SEM (n = 8). Diferentes letras minúsculas indicaron diferencias significativas entre los grupos comparados (p < 0,05).
3.5. Efecto del BHB sobre el metabolismo de los lípidos hepáticos en lechones PGR
Los niveles séricos de TG de los lechones en el grupo control de PGR fueron significativamente más altos que los del grupo de control sano (p < 0,05) (Figuras 5A-D). En comparación con el grupo control de PGR, la suplementación con BHB disminuyó las concentraciones séricas de TC, TG y HDL-C de los lechones PGR (p < 0,05) (Figuras 5A-D). Mientras que la suplementación con BHB disminuyó las concentraciones séricas de TG y HDL-C de lechones sanos en comparación con el grupo control sano (p < 0,05) (Figuras 5A-D). En comparación con el grupo control sano, los niveles de expresión de ARNm de C/EPP-α, SCD1 y PPARγ en el hígado de los lechones del grupo control PGR aumentaron (p < 0,05) (Figura 5E). Por su parte, la suplementación con BHB disminuyó los niveles de expresión de ARNm de C/EBP-α, SREBP1, SCD1 y PPARγ en el hígado de lechones sanos y PGR (p < 0,05) (Figura 5E).
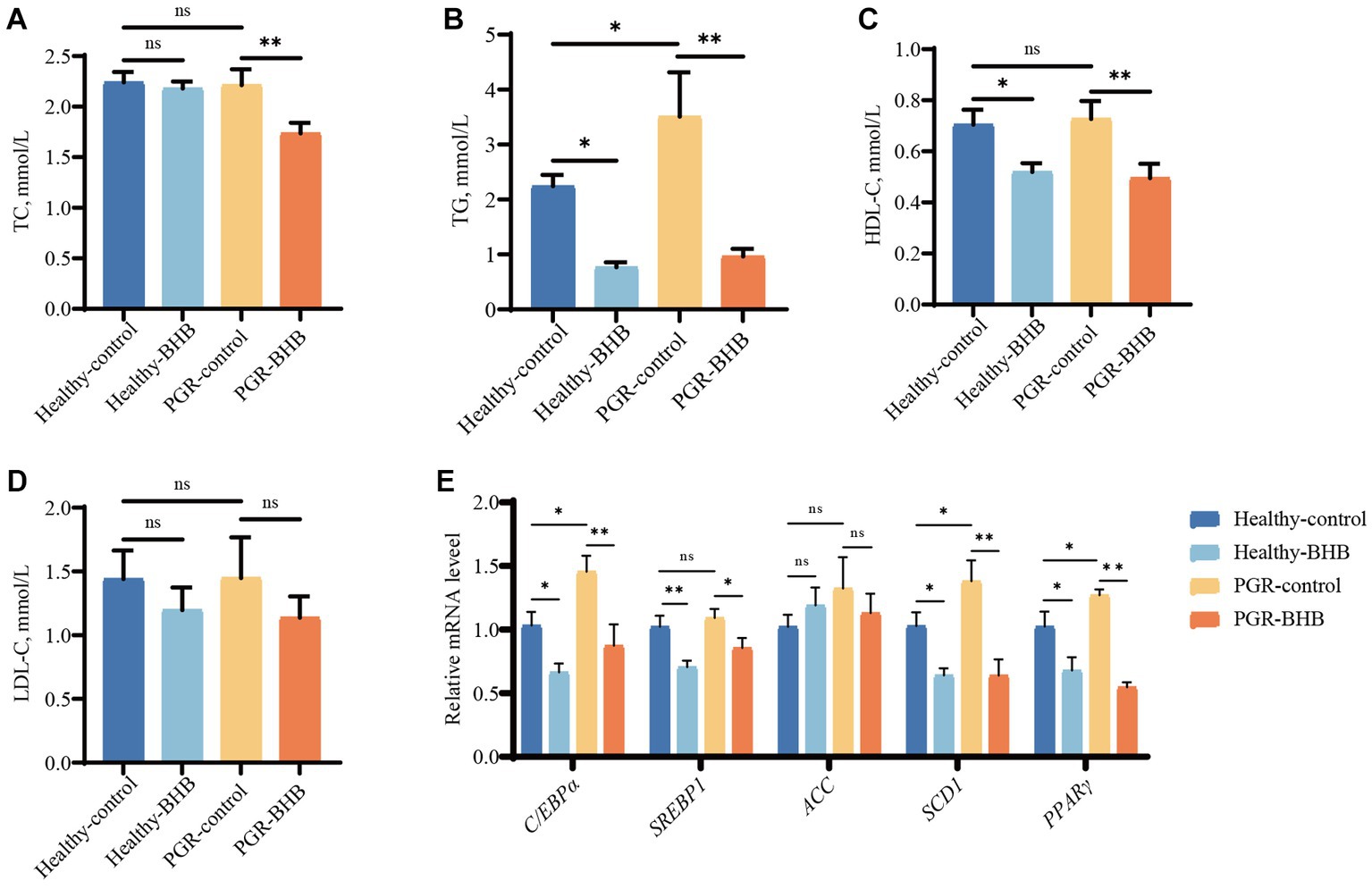 Figura 5. Efecto del BHB sobre el metabolismo de los lípidos hepáticos en lechones PGR. (A-D) Parámetros bioquímicos séricos; (E) expresión hepática de ARNm de C/EBP-α, SREBP1, ACC, SCD1 y PPARγ. BHB: β-hidroxibutirato; PGR: retraso del crecimiento postnatal; C/EBP-α, CCAAT/proteína de unión al potenciador α; SREBP1: proteína 1 de unión a elementos reguladores de esteroles; ACC: acetil-CoA carboxilasa; SCD1: Estearoil-CoA desaturasa 1; PPARγ: Receptor activado por proliferador de peroxisomas γ. Los datos se presentaron como media ± SEM (n = 8). Diferentes letras minúsculas indicaron diferencias significativas entre los grupos comparados (p < 0,05).
Figura 5. Efecto del BHB sobre el metabolismo de los lípidos hepáticos en lechones PGR. (A-D) Parámetros bioquímicos séricos; (E) expresión hepática de ARNm de C/EBP-α, SREBP1, ACC, SCD1 y PPARγ. BHB: β-hidroxibutirato; PGR: retraso del crecimiento postnatal; C/EBP-α, CCAAT/proteína de unión al potenciador α; SREBP1: proteína 1 de unión a elementos reguladores de esteroles; ACC: acetil-CoA carboxilasa; SCD1: Estearoil-CoA desaturasa 1; PPARγ: Receptor activado por proliferador de peroxisomas γ. Los datos se presentaron como media ± SEM (n = 8). Diferentes letras minúsculas indicaron diferencias significativas entre los grupos comparados (p < 0,05).
4. Discusión
La GR es la causa principal de la alta morbilidad y mortalidad en lactantes y niños pequeños. Los niños con GR tienen más probabilidades de sufrir enfermedades metabólicas e infecciones por patógenos (1). La PGR ocurre en el 10 al 30% de los lechones en la industria porcina, lo que conduce a una disminución en la utilización de alimentos y un aumento en la mortalidad, lo que afecta seriamente la eficiencia de la industria porcina.
Algunos estudios han encontrado que, en comparación con sus contrapartes sanas, la PGR muestra un rendimiento de crecimiento deficiente y un menor peso de los órganos (8, 19). De acuerdo con los resultados de este estudio, se encontró que el peso corporal y el peso hepático de los lechones PGR fueron menores que los de los lechones sanos de la misma edad. El BHB es un compuesto orgánico soluble en agua derivado de los lípidos, que se magnifica de manera más significativa en las condiciones fisiológicas de baja utilización de carbohidratos (es decir, hambre), ayuno prolongado o dieta cetogénica (20). La suplementación dietética con dosis bajas de BHB puede mejorar eficazmente el rendimiento del crecimiento y el desarrollo de los órganos de las cabras destetadas precozmente (21). De hecho, el BHB aumentó el peso corporal de los lechones PGR y mejoró la lesión hepática y las respuestas inflamatorias en el estudio actual. La ALT y la AST se consideran indicadores sensibles de lesión hepática y, por lo general, se expresan solo en los hepatocitos. Cuando el hígado está dañado, se liberan en el torrente sanguíneo. En este estudio, las actividades de AST y ALT en plasma y el contenido de ALT en el hígado de lechones PGR aumentaron, lo que indica daño hepático en lechones PGR, lo que fue consistente con los resultados de otros estudiosos (5, 8, 11). Los cuerpos inflamatorios NLRP3 son una amplia gama de sensores para patrones moleculares relacionados con el riesgo, que pueden ser activados por muchos tipos de patógenos o señales de peligro (22). Las citocinas proinflamatorias (incluidas la IL-1β, la IL-6 y la IL-8) son necesarias para iniciar una respuesta inflamatoria durante la infección (8). Los lechones PGR mostraron niveles más altos de IFN-γ y TNF-α, así como niveles de ARNm de IL-8 en este estudio, lo que sugiere que esos lechones podrían tener una inflamación hepática más alta que los lechones sanos. El tratamiento con BHB podría aliviar las respuestas inflamatorias, evidenciadas por una menor concentración de citocinas proinflamatorias y expresiones de ARNm, y un aumento de los niveles de citocinas antiinflamatorias en el hígado. Consistentemente, Yun-Hee Youm et al. demuestran que el BHB puede promover efectos antiinflamatorios, regular la inflamación al inhibir la activación de los cuerpos inflamatorios NLRP3, reducir la producción posterior de citoquinas proinflamatorias IL-1β e IL-8, y prevenir enfermedades inflamatorias mediadas por NLRP3 (14, 17, 18). Mientras tanto, la activación inflamatoria excesiva podría estar relacionada con la apoptosis desregulada (23). Es bien sabido que la Caspasa-3 y la Bcl-2 son los ejecutores e inhibidores de la apoptosis, respectivamente. Bcl-2 es una proteína antiapoptótica que puede proteger a las células de la apoptosis, mientras que las proteínas proapoptóticas como Bax promueven la muerte celular programada (24, 25). Los estudios han demostrado que el BHB podría reducir la apoptosis inducida por la isquemia-reperfusión hepática y la provocación con paraquat (14, 26). También encontramos que la expresión del gen anti-apoptosis Bcl-2 aumentó y la expresión de los genes pro-apoptosis Bax, Caspasa-3, Caspasa-8 y Caspasa-9 disminuyó en el hígado de lechones PGR alimentados con BHB exógeno.
La dieta cetogénica (KD) y los suplementos de cetonas exógenas (EKS) pueden aumentar la concentración de BHB en sangre (27-30). Se observó un aumento de los niveles séricos de BHB en los lechones PGR alimentados con BHB, mientras que sus niveles hepáticos de BHB disminuyeron. Este resultado podría explicarse por el sistema de regulación de retroalimentación de los cuerpos cetónicos. La síntesis de cuerpos cetónicos en la matriz mitocondrial del hígado comienza con ácidos grasos β-acetil-CoA oxidados. La hidroximetilglutaril-CoA sintetasa mitocondrial (HMGCS2) condensa acetil-CoA con acetoacetil-CoA para formar HMG-CoA, que luego es liberada por la HMG-CoA liasa (HMGCL). La mayor parte del acetoacetato es metabolizado por la β-hidroxibutirato deshidrogenasa (BDH1) a BHB y la actividad de BDH1 es proporcional a la relación ACAC/BHB en circulación (12, 31). La condensación de acetil-CoA y acetoacetil-CoA a HMG-CoA depende principalmente del HMGCS2 mitocondrial, que es un paso limitante de la velocidad en la síntesis de cuerpos cetónicos (31). En el presente estudio, los niveles de ARNm de HMGCS2 y HMGCL aumentaron con el tratamiento con BHB en lechones PGR, mientras que la expresión del ARNm de BDH1 se inhibió. Se da a entender que la suplementación con BHB puede alterar la relación ACAC/BHB en circulación, inhibiendo así la actividad de BDH1 y conduciendo a una disminución en el contenido de BHB en el hígado.
El nivel de cetonas hepáticas está fuertemente relacionado con el metabolismo de la glucosa y los lípidos, que desempeña un papel importante en el mantenimiento del equilibrio energético (32). El ATP es la principal fuente de energía para mantener las respuestas fisiológicas celulares (33). Cada vez hay más pruebas de que la deficiencia de ATP está asociada con el desarrollo de trastornos del metabolismo de los lípidos de la glucosa hepática (34, 35). Claramente, restaurar la síntesis de ATP en el hígado puede ser una estrategia terapéutica potencial para el tratamiento de trastornos metabólicos. Algunos estudios han encontrado que la concentración de ATP en el hígado de los lechones con RCIU y en el yeyuno de los lechones de bajo peso al nacer está significativamente disminuida (36, 37), pero no encontramos una disminución en el hígado de los lechones con RPG. Esto puede estar relacionado con la formación adquirida de lechones PGR. Además, encontramos que la administración de BHB aumentó la cantidad de ATP en el hígado y la sangre de los lechones PGR, lo que es consistente con el informe de Motohisa Suzuki et al. (38) de que el BHB puede mantener niveles altos de ATP. La glucosa es el principal sustrato energético para el metabolismo oxidativo fetal. En este estudio, la producción de glucógeno hepático aumentó y la expresión génica gluconeogénica se reguló al alza en lechones PGR, lo que fue consistente con informes previos en IUGR (39-41). Estas anomalías en el metabolismo de la glucosa pueden ser causadas por la resistencia a la insulina (41). Al mismo tiempo, la producción insuficiente de cetogénico en el hígado puede conducir a una hiperglucemia leve y a un aumento de la gluconeogénesis hepática en ratones adultos (13), por lo que el aumento de la producción de glucógeno hepático y la regulación positiva del gen gluconeogénico en los lechones PGR también pueden ser causados por una producción insuficiente de cetogénicos. La suplementación con los precursores cetogénicos ácido pantoténico y cisteína normalizó la gluconeogénesis hepática en ratones que carecían de producción cetogénica (13). Nuestro estudio también encontró que la suplementación con BHB no solo puede aumentar el nivel de cuerpos cetónicos de los lechones PGR, sino que también inhibe la gluconeogénesis hepática y reduce el contenido de glucógeno hepático y la concentración de glucosa en sangre. De acuerdo con nuestro estudio, Csilla Ari et al. también encontraron que el BHB podría inhibir la señal de gluconeogénesis en el hígado y reducir la utilización de glucógeno hepático para reducir los niveles de glucosa en sangre (28, 30, 42-45). El TC y el TG son dos marcadores clave para reflejar los lípidos circulantes en sangre, que son los pasos clave en la regulación de la síntesis fetal y el catabolismo lipídico. Los estudios han demostrado que el metabolismo nutricional anormal ocurre en el hígado de los fetos con RCIU, como la síntesis anormal de ácidos grasos y la oxidación de lípidos (46, 47). En este estudio, se incrementó el nivel sérico de TG de los lechones PGR, y se aumentaron las expresiones de genes clave de lipogénesis hepática C/EBP-α, SCD1 y PPARγ, lo que fue consistente con los hallazgos de Chen et al. (41) en ratones IUGR. Esta elevación anormal de lípidos y acumulación de lípidos hepáticos puede deberse a la resistencia hepática a la insulina (41). Sin embargo, la ingesta de BHB exógeno redujo significativamente los lípidos circulantes de los lechones PGR, incluyendo CT, TG y HDL-C, lo que fue consistente con los resultados de estudios previos (28, 48, 49). Al mismo tiempo, el BHB puede inhibir la expresión de las sintetasas de ácidos grasos hepáticos SREBP1, ACC y SCD1, regulando así la acumulación de lípidos hepáticos (50, 51), lo que es consistente con los resultados de este estudio.
En resumen, nuestros resultados mostraron que los lechones PGR tenían una lesión hepática e inflamación. La suplementación exógena de BHB podría aumentar el nivel de BHB en sangre y regular la respuesta inflamatoria, así como el metabolismo energético en el hígado de los lechones PGR. Estos hallazgos proporcionan una nueva intervención potencial para mejorar el daño hepático y la disfunción en lechones PGR, mientras que el mecanismo subyacente debe investigarse más a fondo.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio están incluidas en el artículo/material complementario, las consultas adicionales pueden dirigirse a los autores correspondientes.
Declaración ética
Los estudios en animales fueron aprobados por todos los animales utilizados en este estudio y se manejan de manera humanitaria de acuerdo con las pautas chinas de bienestar animal. El plan experimental fue aprobado por el Comité de Protección y Utilización de Animales de la Universidad Agrícola de Hunan (Changsha, China; 2021042). Los estudios se llevaron a cabo de acuerdo con la legislación local y los requisitos institucionales. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
CW: Conceptualización, Curación de datos, Análisis formal, Redacción – borrador original. NW: Conceptualización, Análisis formal, Escritura – borrador original. YD: Metodología, Visualización, Escritura – borrador original. AZ: Metodología, Visualización, Escritura – borrador original. JL: Metodología, Visualización, Escritura – borrador original. BT: Conceptualización, Obtención de Fondos, Administración de Proyectos, Redacción, Revisión y Edición. MQ: Conceptualización, Obtención de Fondos, Administración de Proyectos, Redacción, Revisión y Edición. JW: Conceptualización, Redacción – revisión y edición, Adquisición de fondos, Adquisición de fondos. YY: Conceptualización, Obtención de fondos, Redacción – revisión y edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este trabajo contó con el apoyo del Programa Nacional de Investigación y Desarrollo Clave (2021YFD1300401), la Fundación Nacional de Ciencias Naturales de China (32102571), la Fundación Juventud Excelente de la Provincia de Hunan (2022JJ20027), el Proyecto Principal de Ciencia y Tecnología de la Provincia de Yunnan (202202AE090032), el Sistema de Investigación Agrícola de China del Ministerio de Hacienda y MARA.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Publisher’s note
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Qi, M, Tan, B, Wang, J, Liao, S, Deng, Y, Ji, P, et al. El eje microbiota-intestino-cerebro: una nueva diana terapéutica nutricional para el retraso del crecimiento. Crit Rev Food Sci Nutr. (2021) 62:4867–92. doi: 10.1080/10408398.2021.1879004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Wu, G, Bazer, FW, Wallace, JM y Spencer, TE. Revisión invitada por la Junta Directiva: retraso del crecimiento intrauterino: implicaciones para las ciencias animales1. J Anim Sci. (2006) 84:2316–37. doi: 10.2527/jas.2006-156
3. Knauer, MT, y Hostetler, CE. Análisis de la productividad de la industria porcina de EE. UU., 2005 a 2010. J Salud Porcina Prod. (2013) 21:248–52.
4. Patience, JF, Rossoni-Serao, MC, y Gutierrez, NA. Una revisión de la eficiencia alimenticia en cerdos: biología y aplicación. J Anim Sci Biotechnol. (2015) 6:33. doi: 10.1186/s40104-015-0031-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Zhang, H, Chen, Y, Chen, Y, Ji, S, Jia, P, Xu, J, et al. El pterostilbeno atenúa la lesión hepática y el estrés oxidativo en lechones de destete retardados en el crecimiento intrauterino. Nutrición. (2021) 81:110940. doi: 10.1016/j.nut.2020.110940
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Qi, M, Tan, B, Wang, J, Liao, S, Li, J, Cui, Z, et al. El retraso del crecimiento postnatal se asocia con el deterioro de la función de barrera de la mucosa intestinal utilizando un modelo porcino. J Cell Physiol. (2021) 236:2631–48. doi: 10.1002/jcp.30028
7. Qi, M, Tan, B, Wang, J, Li, J, Liao, S, Yan, J, et al. El análisis del transcriptoma del intestino delgado reveló cambios en los genes implicados en la nutrición, el metabolismo y las respuestas inmunitarias en lechones con retraso en el crecimiento. J Anim Sci. (2019) 97:3795–808. doi: 10.1093/jas/skz205
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Qi, M, Tan, B, Wang, J, Liao, S, Li, J, Liu, Y, et al. Retraso del crecimiento postnatal asociado con alteración de los perfiles hormonales intestinales, la función inmunitaria y antioxidante en los cerdos. Endocrinol frontal. (2019) 10. doi: 10.3389/fendo.2019.00660
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Qi, M, Wang, J, Tan, B, Liao, S, Long, C y Yin, Y. El retraso del crecimiento postnatal se asocia con la disfunción mitocondrial de la mucosa intestinal y el estado energético aberrante en lechones. J Cell Mol Med. (2020) 24:10100–11. doi: 10.1111/jcmm.15621
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Robinson, MW, Harmon, C y O’Farrelly, C. Inmunología hepática y su papel en la inflamación y la homeostasis. Cell Mol Immunol. (2016) 13:267–76. doi: 10.1038/cmi.2016.3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Liu, C, Lin, G, Wang, X, Wang, T, Wu, G, Li, D, et al. La restricción del crecimiento intrauterino altera el proteoma hepático en cerdos fetales. J Nutr Biochem. (2013) 24:954–9. doi: 10.1016/j.jnutbio.2012.06.016
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Puchalska, P, y Crawford, Pensilvania. Funciones multidimensionales de los cuerpos cetónicos en el metabolismo del combustible, la señalización y la terapéutica. Célula Metab. (2017) 25:262–84. doi: 10.1016/j.cmet.2016.12.022
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Cotter, DG, Ercal, B, Huang, X, Leid, JM, d’Avignon, DA, Graham, MJ, et al. La cetogénesis previene la lesión del hígado graso inducida por la dieta y la hiperglucemia. J Clin Investig. (2014) 124:5175–90. doi: 10.1172/jci76388
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Miyauchi, T, Uchida, Y, Kadono, K, Hirao, H, Kawasoe, J, Watanabe, T, et al. La regulación positiva de FOXO1 y la reducción de la inflamación por el ácido β-hidroxibutírico son beneficios esenciales de la restricción de la dieta contra la lesión hepática. Proc Natl Acad Sci. (2019) 116:13533–42. doi: 10.1073/pnas.1820282116
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Pawlak, M, Baugé, E, Lalloyer, F, Lefebvre, P y Staels, B. La terapia corporal con cetonas protege de la lipotoxicidad y la insuficiencia hepática aguda tras la deficiencia de Pparα. Mol Endocrinol. (2015) 29:1134–43. doi: 10.1210/me.2014-1383
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Bae, HR, Kim, DH, Park, MH, Lee, B, Kim, MJ, Lee, EK, et al. El beta-hidroxibutirato suprime la formación de inflamasomas al mejorar el estrés del retículo endoplásmico a través de la activación de AMPK. Oncotarget. (2016) 7:66444–54. doi: 10.18632/oncotarget.12119
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Youm, Y-H, Nguyen, KY, Grant, RW, Goldberg, EL, Bodogai, M, Kim, D, et al. El metabolito de la cetona β-hidroxibutirato bloquea la enfermedad inflamatoria mediada por el inflamasoma NLRP3. Nat Med. (2015) 21:263–9. doi: 10.1038/nm.3804
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Goldberg, EL, Asher, JL, Molony, RD, Shaw, AC, Zeiss, CJ, Wang, C, et al. El beta-hidroxibutirato desactiva el inflamasoma NLRP3 de neutrófilos para aliviar los brotes de gota. Rep. de Célula (2017) 18:2077–87. doi: 10.1016/j.celrep.2017.02.004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Hu, R, Wang, Z, Peng, Q, Zou, H, Wang, H, Yu, X, et al. Efectos de la administración de GHRP-2 y cisteamina sobre el rendimiento del crecimiento, la hormona del eje somatotrópico y la deposición de proteínas musculares en yaks (Bos grunniens) con retraso del crecimiento. PLoS Uno. (2016) 11. doi: 10.1371/journal.pone.0149461
20. Evans, M, McClure, TS, Koutnik, AP y Egan, B. Suplementos de cetonas exógenas en contextos atléticos: pasado, presente y futuro. Medicina Deportiva. (2022) 52:25–67. doi: 10.1007/s40279-022-01756-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Abdelsattar, MM, Vargas-Bello-Pérez, E, Zhuang, Y, Fu, Y y Zhang, N. Impacto de la suplementación dietética con ácido beta-hidroxibutírico en el rendimiento, la digestibilidad de los nutrientes, el desarrollo de órganos y los indicadores de estrés sérico en cabras destetadas tempranamente. Anim Nutr. (2022) 9:16–22. doi: 10.1016/j.aninu.2021.11.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Chakraborty, S, Galla, S, Cheng, X, Yeo, J-Y, Mell, B, Singh, V, et al. El metabolito sensible a la sal, el β-hidroxibutirato, atenúa la hipertensión. Rep. de Célula (2018) 25:677–89.e4. doi: 10.1016/j.celrep.2018.09.058
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Qi, M, Wang, N, Xiao, Y, Deng, Y, Zha, A, Tan, B, et al. El ácido elágico mejora la lesión hepática inducida por el paraquat asociada con un mejor perfil microbiano intestinal. Contaminación ambiental. (2022) 293:118572. doi: 10.1016/j.envpol.2021.118572
24. Chin, AC, Flynn, AN, Fedwick, JP y Buret, AG. El papel de la caspasa-3 en la disrupción mediada por lipopolisacáridos de las uniones estrechas epiteliales intestinales. Can J Physiol Pharmacol. (2006) 84:1043–50. doi: 10.1139/y06-056
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Schenk, RL, Strasser, A y Dewson, G. BCL-2: Largo y sinuoso camino desde el descubrimiento hasta el objetivo terapéutico. Biochem Biophys Res Commun. (2017) 482:459–69. doi: 10.1016/j.bbrc.2016.10.100
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Wei, T, Tian, W, Liu, F y Xie, G. Efectos protectores del β-hidroxibutirato exógeno sobre la toxicidad del paraquat en el riñón de rata. Biochem Biophys Res Commun. (2014) 447:666–71. doi: 10.1016/j.bbrc.2014.04.074
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Kovács, Z, D’Agostino, DP, Diamond, D, Kindy, MS, Rogers, C y Ari, C. Potencial terapéutico de la cetosis inducida por suplementos de cetonas exógenas en el tratamiento de trastornos psiquiátricos: revisión de la literatura actual. Fronteras. Psiquiatría. (2019) 10. doi: 10.3389/fpsyt.2019.00363
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Kesl, SL, Poff, AM, Ward, NP, Fiorelli, TN, Ari, C, Van Putten, AJ, et al. Efectos de la suplementación con cetonas exógenas sobre los niveles de cetonas, glucosa, triglicéridos y lipoproteínas en sangre en ratas Sprague-Dawley. Nutr Metab. (2016) 13:9. doi: 10.1186/s12986-016-0069-y
29. Shaw, DM, Merien, F, Braakhuis, A, Maunder, E y Dulson, DK. Suplementación con cetonas exógenas y cetoadaptación para el rendimiento de resistencia: desenredando los efectos de dos estados metabólicos distintos. Medicina Deportiva. (2019) 50:641–56. doi: 10.1007/s40279-019-01246-y
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Falkenhain, K, Daraei, A, Forbes, SC, y Little, JP. Efectos de la suplementación con cetonas exógenas sobre la glucosa en sangre: una revisión sistemática y metaanálisis. Adv Nutr. (2022) 13:1697–714. doi: 10.1093/advances/nmac036
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Newman, JC y Verdin, E. Cuerpos cetónicos como metabolitos de señalización. Tendencias Endocrinol Metab. (2014) 25:42–52. doi: 10.1016/j.tem.2013.09.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Qi, M, Wang, J, Be, T, Li, J, Liao, S, Liu, Y, et al. La suplementación con glutamina, glutamato y aspartato en la dieta mejora el metabolismo de los lípidos hepáticos en lechones post-destete. Animal. Nutrición. (2020) 6:124–9. doi: 10.1016/j.aninu.2019.12.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Brad, AM, Bormann, CL, Swain, JE, Durkin, RE, Johnson, AE, Clifford, AL, et al. Contenido de glutatión y trifosfato de adenosina de ovocitos porcinos madurados in vivo e in vitro. Mol Reprod Dev. (2003) 64:492–8. doi: 10.1002/mrd.10254
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Veech, RL. Las implicaciones terapéuticas de los cuerpos cetónicos: los efectos de los cuerpos cetónicos en condiciones patológicas: cetosis, dieta cetogénica, estados redox, resistencia a la insulina y metabolismo mitocondrial. Prostaglandinas Leukot Essent Ácidos grasos. (2004) 70:309–19. doi: 10.1016/j.plefa.2003.09.007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Sato, K, Kashiwaya, Y, Keon, CA, Tsuchiya, N, King, MT, Radda, GK, et al. Insulina, cuerpos cetónicos y transducción de energía mitocondrial. FASEB J. (1995) 9:651–8. doi: 10.1096/fasebj.9.8.7768357
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Liu, J, Yu, B, Mao, X, He, J, Yu, J, Zheng, P, et al. Efectos del retraso del crecimiento intrauterino y la suplementación materna con ácido fólico sobre la función mitocondrial hepática y la expresión génica en lechones. Arch Anim Nutr. (2012) 66:357–71. doi: 10.1080/1745039x.2012.710084
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Zhang, H, Zheng, P, Chen, D, Yu, B, He, J, Mao, X, et al. La suplementación dietética con arginina mejora las funciones mitocondriales intestinales en lechones de bajo peso al nacer, pero no en lechones de peso normal al nacer. Antioxidantes. (2021) 10. doi: 10.3390/antiox10121995
38. Suzuki, M, Suzuki, M, Sato, K, Dohi, S, Sato, T, Matsuura, A, et al. Efecto del beta-hidroxibutirato, un agente que mejora la función cerebral, sobre la hipoxia, anoxia e isquemia cerebral en ratones y ratas. Jpn J Pharmacol. (2001) 87:143–50. doi: 10.1254/jjp.87.143
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Thorn, SR, Regnault, TRH, Brown, LD, Rozance, PJ, Keng, J, Roper, M, et al. La restricción del crecimiento intrauterino aumenta la capacidad gluconeogénica hepática fetal y reduce el inicio de la traducción del ácido ribonucleico mensajero y la detección de nutrientes en el hígado fetal y el músculo esquelético. Endocrinología. (2009) 150:3021–30. doi: 10.1210/en.2008-1789
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Jones, AK, Brown, LD, Rozance, PJ, Serkova, NJ, Hay, WW Jr, Friedman, JE, et al. Efectos diferenciales de la restricción del crecimiento intrauterino y un pinzamiento hiperinsulinémico-isoglucémico sobre las vías metabólicas y la acción de la insulina en el hígado fetal. Am J Phys Regul Integr Comp Phys. (2019) 316:R427–40. doi: 10.1152/ajpregu.00359.2018
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Chen, D, Wang, Y-y, Li, S-p, Zhao, H-m, Jiang, F-j, Wu, Y-x, et al. La suplementación materna con propionato mejora la alteración metabólica de la glucosa y los lípidos en la restricción del crecimiento fetal inducida por hipoxia. Funct. de alimentos. (2022) 13:10724–36. doi: 10.1039/d2fo01481e
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. Schlumbohm, C, y Harmeyer, J. La hipercetonemia altera el metabolismo de la glucosa en ovejas preñadas y no preñadas. J Lácteos Sci. (2004) 87:350–8. doi: 10.3168/jds. S0022-0302(04)73174-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Mikkelsen, KH, Seifert, T, Secher, NH, Grøndal, T y van Hall, G. Cuerpo cetónico sistémico, cerebral y esquelético y metabolismo energético durante la hiper-D-β-hidroxibutiratimemia aguda en hombres sanos post-absorción. J Clin Endocrinol Metabol. (2015) 100:636–43. doi: 10.1210/jc.2014-2608
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Ari, M, Koutnik, G, Rogers, P, et al. Las cetonas exógenas reducen el nivel de glucosa en sangre en modelos de roedores descansados y ejercitados. Nutrientes. (2019) 11:2330. doi: 10.3390/nu11102330
45. Poff, AM, Koutnik, AP y Egan, B. Cetosis nutricional con dietas cetogénicas o cetonas exógenas: características, convergencia y divergencia. Curr Sports Med Rep. (2020) 19:251–9. doi: 10.1249/jsr.0000000000000732
46. Hribal, ML, He, J, Dong, L, Xu, W, Bai, K, Lu, C, et al. La suplementación dietética con tributirina atenúa la resistencia a la insulina y el metabolismo anormal de los lípidos en lechones lactantes con retraso del crecimiento intrauterino. PLoS Uno. (2015) 10. doi: 10.1371/journal.pone.0136848
47. Mortensen, OH, Olsen, HL, Frandsen, L, Nielsen, PE, Nielsen, FC, Grunnet, N, et al. La restricción de proteínas gestacionales en ratones tiene efectos pronunciados sobre la expresión génica en el hígado y el músculo esquelético de la descendencia recién nacida. Pediatr Res. (2010) 67:47–53. doi: 10.1203/PDR.0b013e3181c4735c
Resumen de PubMed | Texto completo de CrossRef | Google Académico
48. Liu, Y, Bharmal, SH, Kimita, W y Petrov, MS. Efecto de la cetosis aguda en el perfil lipídico en la prediabetes: hallazgos de un ensayo controlado aleatorizado cruzado. Cardiovasc Diabetol. (2022) 21. doi: 10.1186/s12933-022-01571-z
49. Stubbs, BJ, Cox, PJ, Evans, RD, Santer, P, Miller, JJ, Faull, OK, et al. Sobre el metabolismo de cetonas exógenas en humanos. Fisiola delantera. (2017) 8. doi: 10.3389/fphys.2017.00848
Resumen de PubMed | Texto completo de CrossRef | Google Académico
50. Kennedy, AR, Pissios, P, Otu, H, Xue, B, Asakura, K, Furukawa, N, et al. Una dieta cetogénica alta en grasas induce un estado metabólico único en ratones. Am J Physiol Endocrinol Metab. (2007) 292:E1724-39. doi: 10.1152/ajpendo.00717.2006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
51. Badman, MK, Kennedy, AR, Adams, AC, Pissios, P, y Maratos-Flier, E. Una dieta cetogénica muy baja en carbohidratos mejora la tolerancia a la glucosa en ratones Ob/Ob independientemente de la pérdida de peso. Am J Physiol Endocrinol Metab. (2009) 297:E1197–204. doi: 10.1152/ajpendo.00357.2009
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: β-hidroxibutirato, lesión hepática, lípidos, retraso del crecimiento postnatal, lechones
Cita: Wang CM, Wang N, Deng YK, Zha AD, Li JY, Tan B, Qi M, Wang J y Yin YL (2023) La administración de β-hidroxibutirato mejora la lesión hepática y la anomalía metabólica en lechones con retraso de crecimiento posnatal. Frente. Vet. Sci. 10:1294095. doi: 10.3389/fvets.2023.1294095
Recibido: 14 de septiembre de 2023; Aceptado: 23 de octubre de 2023;
Publicado: 03 Noviembre 2023.
Editado por:
Tao Wang, Universidad Agrícola de Jilin, China
Revisado por:
Shugui Zheng, Universidad Agrícola de Shenyang, China Shuting Cao, Academia de Ciencias Agrícolas de Guangdong, China
Derechos de autor © 2023 Wang, Wang, Deng, Zha, Li, Tan, Qi, Wang y Yin. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Ming Qi, qmcharisma@sina.com; Jing Wang, jingwang023@hunau.edu.cn
†Estos autores han contribuido igualmente a este trabajo
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía