La administración oral de Eimeria acervulina transfectada secuencialmente con dos copias del gen VP2
La administración oral de Eimeria acervulina transfectada secuencialmente con dos copias del gen VP2 induce inmunidad contra el virus de la bursitis infecciosa en pollos
 Qingbin Guo1,2
Qingbin Guo1,2  Ying Yu2
Ying Yu2  Jingxia Suo2
Jingxia Suo2  Xinming Tang3
Xinming Tang3  Sixin Zhang2
Sixin Zhang2  Colin Crouch4
Colin Crouch4  Beth Bruton4
Beth Bruton4  Ian Tarpey4
Ian Tarpey4  Xianyong Liu2
Xianyong Liu2  Guanghui Zhao1*
Guanghui Zhao1*  Xun Suo2*
Xun Suo2*- 1Facultad de Medicina Veterinaria, Universidad del Noroeste A&F, Xianyang, China
- 2Laboratorio Nacional de Protozoos Animales y Facultad de Medicina Veterinaria, Universidad Agrícola de China, Pekín, China
- 3Laboratorio Clave de Prevención y Control de Riesgos de Bioseguridad Animal (Norte) de MARA, Instituto de Ciencia Animal, Academia China de Ciencias Agrícolas, Beijing, China
- 4MSD Animal Health, Milton Keynes, Reino Unido
La coccidiosis del pollo causada por Eimeria spp. puede ocurrir en casi todas las granjas avícolas, causando enormes pérdidas económicas a la industria. Se han reportado casos de parásitos Eimeria manipulados genéticamente como vector vacunal para administrar antígenos virales. En nuestro estudio preliminar, la E. acervulina transgénica que expresa un gen VP2 (Ea-VP2) del virus de la bursitis infecciosa (IBDV) demostró una protección parcial contra la infección por IBDV. Para mejorar las respuestas inmunitarias, nos propusimos aumentar el número de copias del gen VP2 en E. acervulina transgénica. En este estudio, utilizamos un nuevo vector plásmido portador de un gen VP2 fusionado con tres etiquetas de bandera y un gen reportero fluorescente rojo (mCherry). El vector se introdujo en esporozoítos de Ea-VP2 a través de la nucleofección, lo que condujo a la generación de Ea-2VP2. El análisis posterior reveló una notable escalada en la tasa de fluorescencia, aumentando del 0,11 al 95,1% después de cuatro pasadas consecutivas facilitadas por la clasificación celular activada por fluorescente. La verificación mediante PCR, Western blot e inmunofluorescencia confirmó la construcción exitosa de la población Ea-2VP2. A pesar de una fecundidad más baja en comparación con E. acervulina de tipo salvaje, Ea-2VP2 mantuvo la inmunogenicidad. Nuestra investigación creó efectivamente una cepa transgénica de E. acervulina transfectada secuencialmente con dos copias del gen VP2 del IBDV. Esta modificación dio lugar a un aumento de la respuesta inmunitaria humoral después de la inmunización primaria en pollos. Además, demostró un grado de protección dentro de la bursa contra la infección por IBDV. Los estudios futuros se centrarán en mejorar aún más los niveles de respuesta inmunitaria.
1 Introducción
La coccidiosis del pollo es una enfermedad entérica y causa más de 10.400 millones de libras esterlinas (según los precios de 2016) de coste económico a la industria avícola a nivel mundial cada año (1). Las vacunas vivas actuales contra los coccidiales son fiables para inducir una respuesta inmunitaria eficaz y duradera para la prevención y el control de la coccidiosis del pollo (2, 3). Las vacunas vivas anticoccidiales pueden administrarse a través del agua potable y los piensos (4). Sin embargo, las vacunas vivas contra los coccidiales son específicas de cada especie o incluso de cada cepa, por lo que las vacunas anticoccidiales eficaces deben incluir múltiples especies o cepas de Eimeria y deben producirse de forma independiente en pollos, lo que requiere más refinamientos (4, 5).
El patógeno es un protozoo unicelular eucariota perteneciente al género Eimeria (6). Los parásitos Eimeria tienen 14 cromosomas con una longitud de ADN de 42 a 72 Mbp, que codifican de 6.000 a 9.000 proteínas en todas las etapas de desarrollo (7). Hasta el momento, se han identificado claramente 10 especies de coccidios de pollo, incluyendo E. acervulina, E. tenella, E. maxima, E. mitis, E. necatrix, E. brunetti, E. praecox, E. lata, E. nagambie y E. zaria (8). Entre estos, E. acervulina es altamente prevalente pero tiene una patogenicidad moderada (9). Un esporozoíto de Eimeria puede producir 1.000 merozoítos por ciclo, repitiéndose de dos a cuatro veces en el huésped del pollo, lo que lleva a un rápido aumento en el número de ooquistes (10). Los coccidios de pollo son altamente inmunogénicos, y su infección primaria desencadena inmunidad protectora contra infecciones posteriores por parásitos homólogos (11). Además, los coccidios de pollo ingresan a las células huésped con la ayuda de su proteína micronema, lo que provoca fácilmente respuestas inmunitarias a las proteínas virales transportadas tras la administración oral, mostrando un mayor potencial como vector de administración de vacunas orales (12, 13).
Con los continuos avances en bioinformática y manipulación genética, los parásitos Eimeria han sido considerados un vector para expresar antígenos exógenos (14). Los resultados de la investigación indican que una población transgénica de E. tenella que expresa el antígeno CjaA de Campylobacter jejuni (E. tenella-CjaA), después de una o varias vacunaciones orales con E. tenella-CjaA, proporciona tasas de protección inmunitaria del 91 y el 86% contra los desafíos posteriores de C. jejuni, y estas tasas son significativamente más altas en comparación con los grupos no vacunados y vacunados con E. tenella de tipo salvaje en pollos (15). Además, la inoculación oral con E. tenella transgénica que expresa dos genes de antígeno de Eimeria maxima (EmIMP1 o EmAMA1) puede reducir significativamente la producción de ooquistes después del desafío con E. maxima (16, 17). En una investigación separada, E. tenella se utilizó como vector que expresaba antígenos virales del virus de la bursitis infecciosa (IBDV) o del virus de la laringotraqueítis infecciosa (ILTV), pero la detección de anticuerpos a través de Western blot solo tuvo éxito cuando se utilizó suero de baja dilución (13).
El IBDV instiga una enfermedad inmunosupresora crítica, que resulta letal para los pollos de 3 a 6 semanas al destruir los linfocitos B inmaduros y disminuir las capacidades inmunitarias (18-20). El genoma del IBDV comprende dos segmentos de ARN bicatenario (dsRNA), A y B, que albergan cinco genes: VP1, VP2, VP3, VP4 y VP5 (21, 22). VP2, que constituye la cápside, sirve como objetivo principal para los anticuerpos neutralizantes antivirales (23). Se han utilizado varios sistemas de expresión para producir la proteína VP2, como la levadura y los lactobacilos (24, 25). En nuestra investigación preliminar, la E. acervulina transgénica que expresa un solo VP2 fue capaz de inducir una respuesta inmune (26). Sin embargo, la mejora de los niveles de respuesta inmunitaria sigue siendo imprescindible para un control eficaz del IBDV.
En este estudio, planteamos la hipótesis de que el aumento del número de antígenos heterólogos en E. acervulina transgénica podría mejorar la respuesta inmune protectora. Para abordar la hipótesis, construimos un nuevo plásmido, que incluye un gen VP2 y un gen reportero fluorescente rojo (mCherry), y luego transfectamos con el plásmido en los esporozoítos que han sido transfectados de manera estable un plásmido portador de un gen VP2 con un gen reportero fluorescente amarillo mejorado (EYFP). Posteriormente, realizamos una serie de experimentos para identificar la expresión del gen exógeno VP2 en la transgénica E. acervulina y estudiamos el estado de desarrollo endógeno, la fecundidad y la inmunogenicidad. Además, se detectó la respuesta inmune humoral y se evaluó la protección frente a la patología en la bursa causada por el IBDV.
2 Materiales y métodos
2.1 Animales, parásitos y cultivos celulares
Se compraron pollos libres de patógenos específicos (SPF), de 1 semana de edad, a Boehringer Ingelheim Biotech Limited (Beijing, China). Los pollos de engorde Arbor Acres (AA), de 1 a 6 semanas de edad, se compraron a Arbor Acres Poultry Breeding (Beijing, China). Todos los pollos se mantuvieron en aisladores específicos para aves de corral y se alimentaron con agua y alimento libres de coccidios.
La cepa silvestre de E. acervulina (Ea-WT) Beijing provino de nuestro laboratorio en la Universidad Agrícola de China. También se mantuvo la expresión transgénica de E. acervulina con un solo gen VP2 del IBDV (Ea-VP2), y los genes VP2 y microneme 2 de los genes de E. acervulina (EaMic2) se unieron genéticamente a través de un enlazador flexible de glicina-serina (L14) (26). Los ooquistes se recolectaron de las heces, se pasaron, se esporularon y se purificaron de acuerdo con los procedimientos y métodos previos (27).
Se adquirieron células de fibroblastos del prepucio humano (HFF) de la American Type Culture Collection (ATCC) y se cultivaron en el medio Modified Eagle Medium (DMEM) de Dulbecco con suero fetal bovino (10% v/v) y estreptomicina-penicilina 1000 U en una incubadora de cultivo celular con 5% de CO2 a 37°C.
2.2 Construcción de plásmidos y transfección estable de Eimeria acervulina
Se construyó un nuevo plásmido, pMic-VP2-flag-mCherry-Actin, basado en plásmidos anteriores construidos en nuestro laboratorio. La secuencia del fragmento VP2 del IBDV fue amablemente proporcionada por MSD Animal Health, optimizada por codones y sintetizada por Beijing Tsingke Biotechnology Co. Ltd. Los genes VP2 y EaMic2 se vincularon genéticamente con tres etiquetas de bandera a través de L14. El gen reportero fluorescente rojo (mCherry) con etiquetas ty se unió mediante un péptido teschiovirus-1 2A porcino (P2A, 66 pb) (28). Estos elementos fueron regulados por un micronemo 2 promotor de E. tenella (EtMic2), como Ea-VP2. El plásmido de ADN circular se construyó utilizando un kit de clonación sin costuras (TransGen Biotech, China) y luego se linealizó utilizando la enzima de restricción Hind III HF (Figura 1A). Como se muestra en la Tabla Suplementaria 1, los cebadores se utilizan para la clonación de las diferentes regiones del plásmido.
 Figura 1. Construcción de E. acervulina transgénica transfectada secuencialmente con dos copias del gen VP2 del IBDV (Ea-2VP2). (A) Esquema o diagrama del vector de expresión linealizado por la enzima de restricción Hind III HF. (B) El Ea-2VP2 transfectado estable expresa EYFP y mCherry en un ooquiste esporulado. (C) El ADN genómico de Ea-2VP2 se amplificó con los cebadores VP2 y mCherry, dando un producto de 1.359 pb y 708 pb, y el ADN genómico de Ea-WT y Ea-VP2 se utilizaron como controles. (D) Análisis de Western blot de la expresión de la proteína fusionada con la bandera EaMic2-VP2 en Ea-2VP2. Se utilizó el anticuerpo monoclonal 1804 (1:2000) de ratón como anticuerpo primario, y las proteínas solubles de Ea-WT y Ea-VP2 como controles negativos. (E) Patrones de localización celular de VP2 en los esporozoítos de Ea-2VP2 por IFA. Se utilizó el anticuerpo monoclonal 1804 (1:200) de ratón como anticuerpo primario, y los esporozoítos de Ea-WT y Ea-VP2 se utilizaron como control. Los núcleos se tiñeron con hoechst. Barra = 10 μm.
Figura 1. Construcción de E. acervulina transgénica transfectada secuencialmente con dos copias del gen VP2 del IBDV (Ea-2VP2). (A) Esquema o diagrama del vector de expresión linealizado por la enzima de restricción Hind III HF. (B) El Ea-2VP2 transfectado estable expresa EYFP y mCherry en un ooquiste esporulado. (C) El ADN genómico de Ea-2VP2 se amplificó con los cebadores VP2 y mCherry, dando un producto de 1.359 pb y 708 pb, y el ADN genómico de Ea-WT y Ea-VP2 se utilizaron como controles. (D) Análisis de Western blot de la expresión de la proteína fusionada con la bandera EaMic2-VP2 en Ea-2VP2. Se utilizó el anticuerpo monoclonal 1804 (1:2000) de ratón como anticuerpo primario, y las proteínas solubles de Ea-WT y Ea-VP2 como controles negativos. (E) Patrones de localización celular de VP2 en los esporozoítos de Ea-2VP2 por IFA. Se utilizó el anticuerpo monoclonal 1804 (1:200) de ratón como anticuerpo primario, y los esporozoítos de Ea-WT y Ea-VP2 se utilizaron como control. Los núcleos se tiñeron con hoechst. Barra = 10 μm.
Para la transfección estable de E. acervulina, se transfectaron 10 μL de plásmido de ADN linealizado y 5 μL de Hind III HF en 1 × 107 esporozoítos de Ea-VP2 mediante transfección nuclear mediada por enzimas de restricción (Programa U-033, AMAXA, Suiza) (29). Luego, los esporozoítos se inyectaron en cuatro pollos de 3 semanas de edad a través de la vena del ala, y los ooquistes se recolectaron en las heces de los días 5 a 8 después de la inoculación. Los ooquistes transfectados que expresaban con éxito EYFP y mCherry se seleccionaron mediante clasificación celular activada por fluorescencia (FACS) (DakoCytomation, Fort Collins, CO), y luego se inocularon por vía oral en pollos libres de coccidios para su paso a la selección de parásitos transfectados. Los ooquistes purificados se almacenaron en KCr al 2,5%2O7 a 4°C.
2.3 Identificación genómica del ADN de Eimeria acervulina transgénica
El ADN genómico se extrajo de ooquistes transgénicos esporulados de acuerdo con la descripción anterior (29). Los pares de cebadores de PCR (secuencias de cebadores directos e inversos) dirigidos a los genes VP2 y mCherry fueron VP2-F/VP2-R y mCherry-F/mCherry-R (Tabla suplementaria 2). Los genes VP2 y mCherry se amplificaron utilizando el ADN genómico total anterior como plantillas. Los productos de PCR se confirmaron mediante secuenciación de ADN. Se utilizaron muestras de ADN genómico de Ea-VP2 y Ea-WT como controles.
2.4 Análisis de Western blot
La proteína se extrajo de ooquistes transgénicos esporulados como se describió anteriormente (30). La proteína soluble se separó mediante electroforesis en gel de dodecil sulfato de sodio-poliacrilamida (SDS-PAGE) y se electrotransfirió a membranas de difluoruro de polivinilideno (PVDF). La proteína de fusión (EaMic2-VP2-flag) se detectó utilizando el anticuerpo monoclonal 1804 anti-flag de ratón comercial (dilución 1:2000) sondeado en membranas de PVDF a 37 °C durante 1 h. La detección se llevó a cabo con un anticuerpo secundario anti-ratón de cabra marcado con enzimas (dilución 1:2000) sondeado a 37°C durante 1 h. Se utilizó como referencia interna la gliceraldehído-3-fosfato deshidrogenasa (GAPDH) de E. acervulina. Se aplicó una solución de quimioluminiscencia mejorada a las membranas de PVDF y luego se colocó en el instrumento Tanon para su desarrollo. El peso molecular teórico de la proteína diana contiene VP2 (49,83 kDa), EaMIC2 (32,23 kDa) y tres etiquetas bandera (2,42 kDa). Se utilizaron proteínas de Ea-VP2 y Ea-WT como controles.
2.5 Ensayo de inmunofluorescencia indirecta
Para validar la localización de la proteína VP2 en los esporozoítos transgénicos Ea-2VP2, las células HFF se infectaron con 1 × 106 esporozoítos de Ea-2VP2 en incubadora de cultivo celular durante 6 h. Brevemente, los esporozoítos se fijaron en paraformaldehído al 4% durante 1 h a 37°C y luego se permeabilizaron con Triton X-100 al 0,25% durante 20 min, seguido de un bloqueo con albúmina sérica bovina (BSA) al 3% durante 15 min. Se utilizó monoclonal anti-bandera de ratón (1:200) como anticuerpo primario para detectar la proteína de fusión (bandera EaMic2-VP2), seguido de IgG anti-ratón de cabra conjugada con FITC (1:200) como anticuerpo secundario a 37 °C durante 1 h. Después de teñir los núcleos con Hoechst 33258, los portaobjetos se sellaron con medios de montaje antidecoloración y se observaron con un microscopio fluorescente (IX71, Olympus). Se utilizaron esporozoítos de Ea-VP2 y Ea-WT como controles.
2.6 H&E e inmunofluorescencia tisular
Se muestreó el duodeno de pollos con FPS de 1 semana de edad durante 48-120 h con un intervalo de 12 h después de la infección con 5 × 105 EA-2VP2. Los duodenos muestreados se fijaron en formalina tamponada neutra al 4% durante 48 h, se incluyeron en parafina y se tiñeron con hematoxilina y eosina (H&E). La tinción de H&E y las secciones de tejido se prepararon para la inmunofluorescencia tisular como se describió anteriormente (31). Brevemente, las secciones de tejido deben desparafinarse primero con xileno y lavarse en diluciones seriadas de etanol, luego reparar el antígeno, inmediatamente después de lo cual los portaobjetos se agregaron con BSA al 3% en el círculo y se cubrió el tejido de manera uniforme para bloquear la unión inespecífica a temperatura ambiente durante 30 minutos. Se utilizó monoclonal anti-bandera de ratón (1:200) como anticuerpo primario para detectar la proteína de fusión (bandera EaMic2-VP2), seguido de IgG anti-ratón de cabra conjugada con FITC (1:200) como anticuerpo secundario durante 1 h. Los núcleos se tiñeron con DAPI durante 7 min, y luego se observaron los portaobjetos con un microscopio fluorescente.
2.7 Medición de la fecundidad e inmunogenicidad de Ea-2VP2
Tres grupos de tres pollos SPF de 1 semana de edad fueron enjaulados individualmente en aisladores específicos para aves de corral e inoculados por vía oral con 500 ooquistes recién esporulados de Ea-2VP2, Ea-VP2 y Ea-WT, respectivamente. Los ooquistes se recogieron de las heces y se contaron mediante una cámara McMaster con un intervalo de 24 h, desde los días 3 hasta los 14 después de la inoculación (DPI). Los pollos de los tres grupos fueron desafiados oralmente con 5.000 ooquistes recién esporulados de Ea-WT en el día 14. Posteriormente, se recolectaron ooquistes en las heces de los días 5 a 7 post-desafío (CPD); el grupo Ea-VP2 y el grupo Ea-WT sirvieron como controles.
2.8 Inmunizaciones y experimento de desafío
Los pollos SPF de siete días de edad se dividieron aleatoriamente en 6 grupos (20 pollos por grupo) (Tabla suplementaria 3). El esquema de inmunización y la recolección de muestras se mostraron en un eje de tiempo (Figura 2). Se diseñaron el grupo de control no inmunizado y no desafiado (UUC), el grupo de control no inmunizado y desafiado (UCC), el grupo de vacuna comercial (una vacuna cuádruple, que contiene la proteína rVP2 del IBDV) (vacuna), el grupo Ea-WT, el grupo Ea-VP2 y el grupo Ea-2VP2. La inmunización primaria se administró a los 7 días de edad; el grupo vacunal se administró por vía intramuscular con la dosis prescrita (300 μL/por pollo); los grupos Ea-WT, Ea-VP2 y Ea-2VP2 fueron inoculados cada uno con 2 × 104 ooquistes recién esporulados. La inmunización secundaria se realizó a los 21 días de edad; los grupos Ea-WT, Ea-VP2 y Ea-2VP2 fueron inoculados cada uno con 5 × 105 ooquistes recién esporulados, respectivamente. A los 35 días de edad, a excepción del grupo UUC, el resto de los grupos fueron desafiados con la cepa IBDV B87 100 veces mayor según lo prescrito.
 Figura 2. Procedimientos para inmunizaciones, desafíos y muestreo de tejidos durante experimentos con animales. A los 7 y 21 días de edad, los pollos SPF recibieron inmunización primaria oral e inmunización secundaria, respectivamente. Las inmunizaciones se llevaron a cabo dos veces a intervalos de 2 semanas. El día 14, después de la inmunización secundaria, los pollos fueron desafiados con la cepa B87 de IBDV 100 veces mayor según lo prescrito, excepto para el grupo UUC. Se recolectaron muestras de suero a los 7, 21, 35 y 42 días de edad. Se tomaron cinco pollos al azar de cada grupo a los 39 y 42 días de edad para examinar la bursa.
Figura 2. Procedimientos para inmunizaciones, desafíos y muestreo de tejidos durante experimentos con animales. A los 7 y 21 días de edad, los pollos SPF recibieron inmunización primaria oral e inmunización secundaria, respectivamente. Las inmunizaciones se llevaron a cabo dos veces a intervalos de 2 semanas. El día 14, después de la inmunización secundaria, los pollos fueron desafiados con la cepa B87 de IBDV 100 veces mayor según lo prescrito, excepto para el grupo UUC. Se recolectaron muestras de suero a los 7, 21, 35 y 42 días de edad. Se tomaron cinco pollos al azar de cada grupo a los 39 y 42 días de edad para examinar la bursa.
2.9 Ensayo de inmunoabsorción enzimática (ELISA)
Para las pruebas serológicas, la sangre se recolectó a los 7, 21, 35 y 42 días de edad (Figura 2). La sangre se incubó a 37 °C durante 1 h, luego se transfirió a 4 °C durante 2 h, y el suero se recolectó después de la centrifugación a 5000 rpm durante 10 min y se almacenó a -20 °C hasta su uso posterior. La presencia de anticuerpos séricos contra el antígeno VP2 del IBDV se detectó utilizando un ProFLOK comercial™ Kit de prueba de anticuerpos IBD Plus (Zoetis, China). Cuando el título de anticuerpos fue de >999, se consideró positivo de acuerdo con las instrucciones del kit de prueba.
2.10 Protección contra el desafío del IBDV
Se seleccionaron cinco pollos al azar de cada grupo y se pesaron a los 39 y 42 días de edad. Luego, se les practicó la eutanasia y se les diseccionó para la bursa. La bursa de los pollos se fijó en formalina tamponada neutra al 4% durante 48 h, se embebió en parafina y se tiñó con hematoxilina y eosina (H&E). La tinción de H&E se llevó a cabo como se describió anteriormente (31). La atrofia de la bursa se evaluó en pollos utilizando el índice de peso corporal de la bursa: (BBIX), y el BBIX por debajo de 0,70 se consideró atrofia de la bursa (32). Las secciones de H&E del tejido patológico de la bursa se registraron utilizando la puntuación histopatológica de la lesión de la bursa (HBLS) cuando los valores de HBLS no mayores que 1 (sin lesiones o lesiones menores) se definieron como libres de ataque del IBDV (33).
2.11 Análisis estadístico
El análisis estadístico se realizó mediante análisis de varianza de una vía (ANOVA) y la prueba de comparación múltiple de Tukey con GraphPad Prism 8.3.0 (GraphPad Software). Un valor de p de <0,05 se consideró estadísticamente significativo entre los diferentes grupos. Todos los datos se presentaron como media ± desviación estándar (DE).
3 Resultados
3.1 Construcción de una variante transgénica de Eimeria acervulina transfectada secuencialmente con dos copias del gen VP2 (Ea-2VP2)
Para construir una E. acervulina transgénica transfectada secuencialmente con dos copias del gen VP2, utilizamos el Ea-VP2, que portaba el gen VP2 y el gen del reportero fluorescente amarillo mejorado (EYFP). Construimos un nuevo plásmido de casete de expresión única, pMic-VP2-flag-mCherry-ACT (Figura 1A), en el que un gen VP2 y un gen reportero fluorescente rojo (mCherry) fueron regulados por un promotor de microneme 2 de E. tenella. Después de la nucleofección del Ea-VP2, se detectaron EYFP y mCherry en un ooquiste transgénico in vitro mediante un microscopio confocal (Figura 1B). Inicialmente, obtuvimos una población positiva con solo un 0,11% que expresaba los genes mCherry y EYFP en la primera generación de paso. Luego, después de cuatro pases continuos en pollos seguidos de selección con FACS, la población de fluorescencia dual alcanzó el >95% y se mantuvo estable sin ninguna selección adicional (Tabla 1).
Para determinar si establecimos una población transgénica estable de Ea-2VP2, utilizamos PCR con cebadores específicos dirigidos a los genes VP2 y mCherry. Esta PCR arrojó productos del tamaño esperado utilizando el ADN genómico de ooquistes esporulados (Figura 1C). Utilizamos un ensayo Western blot para detectar la expresión del gen VP2 en la etapa de ooquistes esporulados, como se muestra en la Figura 1D, una banda específica en la línea Ea-2VP2 que es consistente con los tamaños de la proteína bandera EaMic2-VP2. Los resultados del ensayo de inmunofluorescencia indirecta (IFA) evidenciaron además que la proteína VP2 se expresó y localizó en el citoplasma de Ea-2VP2 (Figura 1E). Teniendo en cuenta estos datos en conjunto, obtuvimos con éxito una población de E. acervulina transfectada secuencialmente con dos copias del gen VP2 del IBDV con reporteros de fluorescencia duales, EYFP y mCherry.
3.2 Expresión constante del gen VP2 a través de la etapa de desarrollo endógeno
Para detectar la expresión del gen VP2 en la etapa de desarrollo endógeno de Ea-2VP2 en pollos, diseccionamos el duodeno de pollitos infectados con 5 × 105 Ea-2VP2 con un intervalo de 12 h y se observaron las secciones tisulares H&E y las secciones de inmunofluorescencia tisular del duodeno. Como se muestra en la Figura 3A y en la Figura 1 suplementaria, la etapa de desarrollo se detectó dentro de una vacuola parasitófora (PV). Los esquizontes de primera generación se detectaron en la cripta 48 h post-inoculación (p.i.), y los merozoítos y gametocitos se detectaron en las vellosidades del duodeno de 60 h a 120 h p.i., respectivamente. También se detectó la expresión de la bandera EaMic2-VP2 en los merozoítos y gametocitos de Ea-2VP2, que fue en respuesta al anticuerpo de la marca bandera específica en las secciones de inmunofluorescencia tisular (Figura 3B). Estos resultados indicaron que el gen VP2 se expresaba continuamente a lo largo de la etapa de desarrollo endógeno.
 Figura 3. Expresión de VP2 en la etapa endógena de Ea-2VP2 en el duodeno. (A) Tinción de H&E del duodeno de 48 a 120 h después de la inoculación. Barra = 20 μm. (B) Inmunofluorescencia del duodeno de 48 a 120 h después de la inoculación. Se utilizaron anticuerpos primarios y secundarios monoclonales anti-bandera de ratón (1:200) y anti-ratón anti-ratón conjugados con FITC (1:200). Los núcleos se tiñeron con DAPI. Barra = 20 μm.
Figura 3. Expresión de VP2 en la etapa endógena de Ea-2VP2 en el duodeno. (A) Tinción de H&E del duodeno de 48 a 120 h después de la inoculación. Barra = 20 μm. (B) Inmunofluorescencia del duodeno de 48 a 120 h después de la inoculación. Se utilizaron anticuerpos primarios y secundarios monoclonales anti-bandera de ratón (1:200) y anti-ratón anti-ratón conjugados con FITC (1:200). Los núcleos se tiñeron con DAPI. Barra = 20 μm.
3.3 Reproducción del transgénico Ea-2VP2
Para determinar la caracterización biológica de la producción de ooquistes y la inmunogenicidad, se investigó la dinámica de excreción de ooquistes, el DPI total de salida de ooquistes y el DPC. Como se muestra en la Figura 4A, la dinámica de excreción de ooquistes de Ea-2VP2 transgénico fue similar a la de E. acervulina de tipo salvaje (Ea-WT), con un pico que se produjo el día 6 p.i. La producción total de ooquistes por pollo inoculado con Ea-2VP2 fue significativamente menor que la de aquellos con Ea-WT durante 5-7 DPI (p < 0,05), que se redujo a dos tercios en relación con el grupo Ea-WT (Figura 4B). La DPC total de salida de ooquistes de Ea-2VP2 fue similar a la de Ea-WT, en la que casi no se descargaron ooquistes durante 5-7 DPC (Figura 4B). Estos resultados indicaron que Ea-2VP2 tuvo menos reproductividad que Ea-WT, pero mantuvo su alta inmunogenicidad frente al desafío de E. acervulina de tipo salvaje.
 Figura 4. Caracterización biológica de Ea-2VP2. (A) La dinámica de salida de ooquistes de Ea-2VP2 se midió cada 24 h desde los días 3 hasta los 14 después de la infección (DPI), n = 3. (B) La producción total de ooquistes se midió entre los días 5 y 7 días después de la infección y los días posteriores a la provocación (DPC), n = 3. (p < 0,0001).****
Figura 4. Caracterización biológica de Ea-2VP2. (A) La dinámica de salida de ooquistes de Ea-2VP2 se midió cada 24 h desde los días 3 hasta los 14 después de la infección (DPI), n = 3. (B) La producción total de ooquistes se midió entre los días 5 y 7 días después de la infección y los días posteriores a la provocación (DPC), n = 3. (p < 0,0001).****
3.4 Ea-2VP2 indujo respuestas inmunes humorales primarias más altas que Ea-VP2
Para detectar los niveles de respuesta inmune humoral después de la inmunización oral, obtuvimos muestras de suero para verificar la respuesta inmune humoral específica con sangre recolectada de la vena subalar de los pollos después del procedimiento (Figura 2). Los títulos de anticuerpos específicos se muestran en la Figura 5. Los títulos medios de anticuerpos del grupo Ea-2VP2 fueron significativamente más altos que los del grupo Ea-VP2 en el día 14 después de la inmunización primaria, y los títulos medios de anticuerpos de los grupos se mantuvieron en 1.125 y 501, respectivamente (p < 0,05). No hubo diferencias significativas entre el grupo Ea-2VP2 y el grupo Ea-VP2 en el día 14 de inmunización postsecundaria y en el día 7 después de la provocación con la cepa B87 de IBDV de 100 veces. Los títulos medios de anticuerpos del grupo Ea-WT fueron significativamente menores que los del grupo Ea-2VP2 después de dos inmunizaciones, que fue de 0 (p < 0,05). La inmunización oral de pollos con parásitos transgénicos fue capaz de inducir una respuesta humoral específica en algunos individuos, pero no en todos (Figura 5). Los resultados anteriores indicaron que el aumento del número de copias del gen VP2 expresado podría inducir una mayor respuesta inmune humoral primaria.
 Figura 5. Detección de títulos de anticuerpos contra el IBDV mediante ELISA. Se recogieron muestras de suero para detectar títulos de anticuerpos utilizando un kit comercial de prueba de anticuerpos contra el IBDV (Zoetis, China) a los 7, 21, 35 y 42 días de edad. Variación en el número de muestras de suero debido al estado sanitario de los pollos, n = 7-20 pollos por grupo por punto de tiempo (ns: no significativo; p < 0,01; p < 0,0001).******
Figura 5. Detección de títulos de anticuerpos contra el IBDV mediante ELISA. Se recogieron muestras de suero para detectar títulos de anticuerpos utilizando un kit comercial de prueba de anticuerpos contra el IBDV (Zoetis, China) a los 7, 21, 35 y 42 días de edad. Variación en el número de muestras de suero debido al estado sanitario de los pollos, n = 7-20 pollos por grupo por punto de tiempo (ns: no significativo; p < 0,01; p < 0,0001).******
3.5 Eficacia protectora de Ea-2VP2 en el tejido bursal frente al IBDV
Para investigar la eficacia protectora del Ea-2VP2, seleccionamos aleatoriamente cinco pollos vacunados de cada grupo y los pesamos a los 39 y 42 días de edad después del desafío. Luego, los pollos fueron sacrificados y diseccionados para la bursa. Se calculó la bursa: BBIX y el score histopatológico de la lesión bursal (HBLS) para analizar la extensión de la atrofia de la bursa y las lesiones histopatológicas. Como se muestra en las Figuras 6A, B, todos los pollos vacunados con Ea-2VP2 mostraron un valor de HBLS de 1. Entre los cinco pollos entre los grupos Ea-VP2 y Ea-WT, un pollo y dos pollos mostraron lesiones bursales leves (HBLS 2), respectivamente. Entre los cinco pollos de cada grupo, solo el grupo Ea-WT tuvo un pollo con un valor de BBIX inferior a 0,70 en 39 días. El grupo Ea-WT tuvo cuatro pollos con un valor de BBIX inferior a 0,70, mientras que el grupo Ea-VP2 y el grupo Ea-2VP2 tuvieron dos pollos con un valor de BBIX inferior a 0,70 42 días después del desafío, respectivamente. Los resultados anteriores indicaron que las inmunizaciones con Ea-2VP2 parecieron proporcionar un cierto grado de protección contra el daño de la bursa causado por la infección por IBDV.
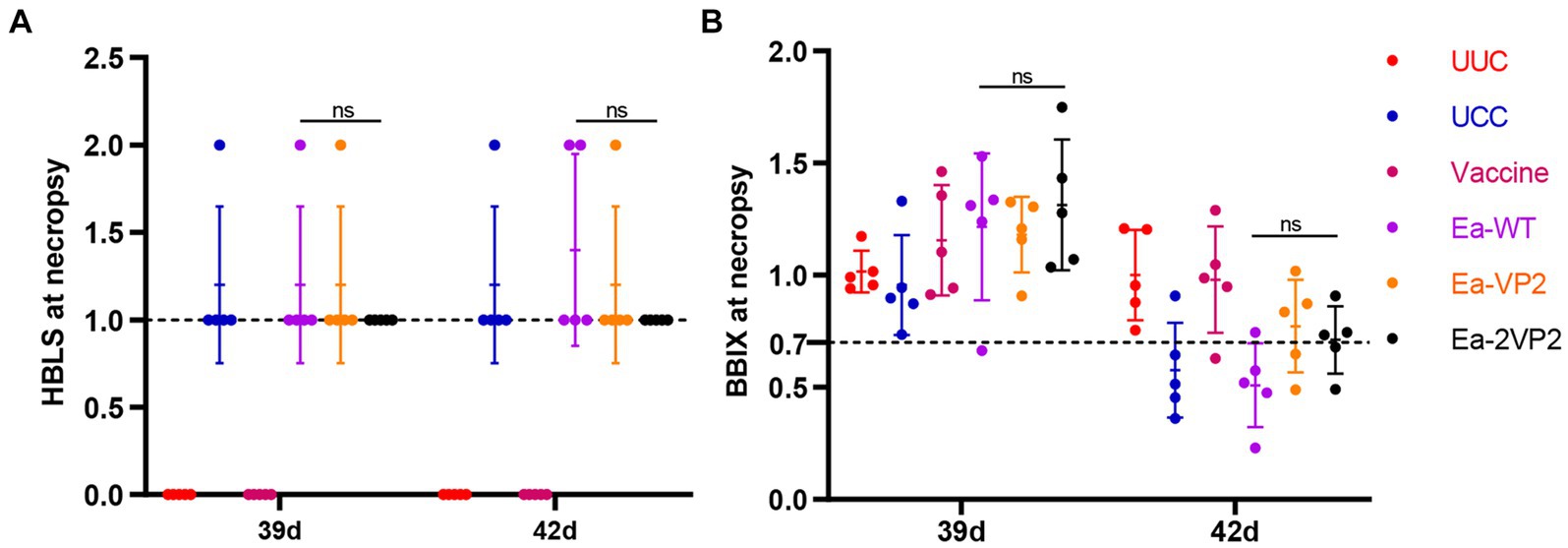 Figura 6. Eficacia protectora de Ea-2VP2 transfectado frente a la infección por IBDV. (A) La puntuación histopatológica de la lesión bursal (HBLS) de los pollos a los 39 y 42 días de edad. 0, sin lesiones; 1, lesiones menores; 2, lesiones foliculares dispersas. Cuando HBLS ≤1, protegido; HBLS >1, desprotegido. n = 5. (B) Los valores de la bursa: índice de peso corporal (BBIX) de los pollos a los 39 y 42 días de edad, y el BBIX por debajo de 0,70 se consideraron atrofia de la bursa. n = 5. ns, no significativo.
Figura 6. Eficacia protectora de Ea-2VP2 transfectado frente a la infección por IBDV. (A) La puntuación histopatológica de la lesión bursal (HBLS) de los pollos a los 39 y 42 días de edad. 0, sin lesiones; 1, lesiones menores; 2, lesiones foliculares dispersas. Cuando HBLS ≤1, protegido; HBLS >1, desprotegido. n = 5. (B) Los valores de la bursa: índice de peso corporal (BBIX) de los pollos a los 39 y 42 días de edad, y el BBIX por debajo de 0,70 se consideraron atrofia de la bursa. n = 5. ns, no significativo.
4 Discusión
En esta investigación, establecimos con éxito una población transgénica estable de E. acervulina transfectada secuencialmente con dos copias del gen VP2 del IBDV conocido como Ea-2VP2. La inmunización oral de pollos con estos parásitos transgénicos recién construidos demostró una respuesta inmune humoral primaria más alta contra el IBDV en ciertos individuos, aunque todavía no más alta que la vacuna comercial y no universalmente. Nuestra investigación reveló que Ea-2VP2 expresaba constantemente el gen VP2 a lo largo de la etapa de desarrollo endógeno en pollos. El Ea-2VP2 produjo menos ooquistes que el tipo salvaje, y casi ningún ooquiste fue dado de alta después del desafío, lo que indica el mantenimiento de su inmunogenicidad frente a la infección por Ea-WT. La inmunización con Ea-2VP2 mostró potencial para proteger el tejido bursal en pollos infectados con IBDV. Además, las poblaciones transgénicas utilizadas para las inmunizaciones mostraron estabilidad tanto en la retención como en la expresión de los genes exógenos.
En particular, la inmunización oral de parásitos transgénicos demostró la capacidad de preparar la inmunidad, como lo demuestra el hecho de que el grupo Ea-2VP2 exhibió títulos de anticuerpos más concentrados en comparación con el grupo Ea-VP2, tanto después de la inmunización primaria como secundaria, con un efecto más pronunciado después de la provocación (Figura 5). Si bien el aumento del número de copias de los genes VP2 en E. acervulina transgénica parecía un enfoque prometedor para provocar una mayor respuesta inmune en pollos, los niveles de anticuerpos específicos no aumentaron el doble como se anticipó. Especulamos que esto puede estar relacionado con la proporción de proteína VP2 en la E. acervulina transgénica, que puede ser detectada por el sistema inmune. El grado en que el contenido de la proteína VP2 aumenta proporcionalmente con el número de copias en E. acervulina transgénica aún no se ha probado en estudios posteriores.
Estudios previos han indicado que la localización de VP2 afecta a la respuesta inmunitaria específica: la VP2 localizada en micronemas mostró una inmunogenicidad más fuerte que la VP2 localizada en la superficie (26). Liu et al. construyeron E. tenella transgénica que expresaba la proteína monómera M2 del virus de la influenza aviar que no podía provocar respuestas inmunitarias (30). Además, Zhang et al. construyeron una línea transgénica de E. acervulina que expresa 12 copias de M2e, y la respuesta inmune no fue significativamente diferente del grupo control (9). Por lo tanto, la localización de la expresión del inmunógeno puede ser responsable. El estudio actual ha detectado anticuerpos contra la proteína VP2 mediante ELISA. Sin embargo, las inmunizaciones realizadas no se ajustaron a las dosis prescritas para las vacunas de Eimeria. Existen varios sistemas de expresión para expresar el gen VP2. El sistema eucariota, que facilita el correcto plegamiento de las proteínas debido a la dependencia conformacional de los epítopos antigénicos, hace que la proteína VP2 expresada sea más inmunogénica en comparación con el sistema procariota (34). La correplicación y la coexpresión del gen VP2 con vectores virales en el huésped estimulan una respuesta inmune contra ambos virus. Por ejemplo, en una evaluación comparativa del vector del herpesvirus del pavo (HVT)-EII con otras vacunas contra el IBDV muy virulento (vvIBDV) en pollos de engorde, la vacuna del vector HVT-IBD demostró una mayor seguridad y proporcionó una protección superior contra el desafío del vvIBDV (35). La inserción del gen VP2 en el locus del gen US2 del virus de la enfermedad de Marek (MDV) proporcionó una protección completa contra el IBDV y el desafío del MDV (31). Los genomas más grandes de Eimeria acomodan la inserción y expresión de múltiples antígenos extraños en contraste con los vectores virales (13). Además, los parásitos transgénicos de Eimeria pueden administrarse por vía oral sin incurrir en costes de producción adicionales para la administración de sus antígenos, y también se consideran seguros para la producción de carne, ya que no dejan residuos derivados de los fármacos anticoccidiales (36). A pesar de demostrar el potencial del sistema de expresión de Eimeria para estimular la respuesta inmunitaria humoral, la mejora de la respuesta inmunitaria a los antígenos heterólogos de patógenos sigue siendo un reto.
En las últimas dos décadas, a pesar del exitoso desarrollo de una plataforma de transfección transitoria y estable en parásitos de Eimeria, su incapacidad para completar todo el ciclo de vida y cultivar continuamente in vitro plantea obstáculos para su manipulación genética (37). En la actualidad, el sistema de selección utilizado para aumentar la tasa de fluorescencia de parásitos transgénicos implica principalmente una combinación de FACS y selección de fármacos in vivo, debido a la baja eficiencia de transfección (9).
El principal reto en el desarrollo de Eimeria como vector vacunal radica en mejorar la respuesta inmunitaria a los antígenos heterólogos de patógenos. Se han propuesto varias estrategias para este propósito, que incluyen, entre otras: (I) aumentar la expresión de antígenos heterólogos mediante el aumento del número de copias de genes o la utilización de un promotor más potente en casetes de expresión única o múltiple (38); (II) aumentar la probabilidad de captura de genes heterólogos por parte de las células presentadoras de antígenos a través de la fusión con citocinas, otros adyuvantes moleculares u optimización de la ubicación del antígeno (39, 40); (III) modificar la estructura de la proteína exógena en parásitos transgénicos de Eimeria para formar partículas similares a virus (VLP) (41); y (IV) insertar o integrar con precisión antígenos exógenos en el antígeno inmunodominante de Eimeria utilizando la herramienta de tecnología CRISPR/Cas9 (42, 43).
Sin embargo, nuestra detección actual no revela niveles de anticuerpos neutralizantes ni respuestas inmunitarias celulares, que aún están en curso. Además, sigue siendo necesario investigar los posibles efectos sinérgicos entre los antígenos procedentes del virus y los parásitos Eimeria para la inducción de la respuesta inmunitaria. Es de gran importancia para el desarrollo de E. acervulina transgénica como vacuna de vectores vivos. En resumen, queda un largo y difícil camino por delante para explotar plenamente el potencial de los parásitos Eimeria para construir un vector vacunal eficaz.
5 Conclusión
Hemos logrado un paso significativo al establecer una transfección estable en una población de E. acervulina transfectada secuencialmente con dos copias del gen VP2 del IBDV con EYFP y mCherry reportero >95%. Esta transfección exitosa condujo a una mejora de las respuestas inmunitarias primarias en los pollos. Nuestros hallazgos apoyan fuertemente la idea de que el aumento del número de genes exógenos representa una estrategia prometedora para el desarrollo de parásitos transgénicos de Eimeria que sirvan como vector de entrega de antígenos virales.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio están incluidas en el artículo/Material complementario, las consultas adicionales pueden dirigirse a los autores correspondientes.
Declaración ética
El estudio en animales fue aprobado por el Comité Institucional de Cuidado y Uso de Animales de la Universidad Agrícola de China. El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
QG: Escritura – borrador original. YY: Curación de datos, redacción, revisión y edición. JS: Curación de datos, redacción, revisión y edición. XT: Curación de datos, administración de proyectos, supervisión, redacción, revisión y edición. SZ: Curación de datos, redacción, revisión y edición. CC: Supervisión, Redacción – revisión y edición. BB: Supervisión, Redacción – revisión y edición. IT: Supervisión, Redacción, revisión y edición. XL: Curación de datos, administración de proyectos, supervisión, redacción, revisión y edición. GZ: Redacción – revisión y edición, supervisión. XS: Administración de proyectos, redacción, revisión y edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este estudio contó con el apoyo de la Fundación Nacional de Ciencias Naturales de China (31330076 y 31572507).
Reconocimientos
Los autores agradecen al núcleo de citometría de flujo del Centro Nacional de Ciencias de las Proteínas de la Universidad de Pekín, en particular a Liying Du y Yinghua Guo, por su ayuda técnica. Nos sentimos agradecidos al Dr. HCR Wang por su revisión crítica científica y textual de este informe.
Conflicto de intereses
CC, BB e IT fueron empleados por la empresa MSD Animal Health UK Ltd.
Los autores declaran que este estudio recibió financiación de MSD Animal Health UK ltd. El financiador tuvo la siguiente participación en el estudio: la decisión de presentarlo para su publicación.
El resto de los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un potencial conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2024.1367912/full#supplementary-material
FIGURA COMPLEMENTARIA 1
Tinción de H&E del duodeno de 48 a 120 h después de la inoculación, bar = 100 μm.
Referencias
1. Blake, DP, Knox, J, Dehaeck, B, Huntington, B, Rathinam, T, Ravipati, V, et al. Recálculo del costo de la coccidiosis en pollos. Res. Veterinaria. (2020) 51:115. doi: 10.1186/s13567-020-00837-2
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Gaghan, C, Adams, D, Mohammed, J, Crespo, R, Livingston, K, y Kulkarni, RR. Caracterización de las respuestas inmunitarias inducidas por la vacuna contra la coccidiosis en pollos de engorde. Vacuna. (2022) 40:3893–902. doi: 10.1016/j.vaccine.2022.05.043
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Zaheer, T, Abbas, RZ, Imran, M, Abbas, A, Butt, A, Aslam, S, et al. Vacunas contra la coccidiosis del pollo con especial referencia a la década anterior: avances, retos y oportunidades. Parasitol Res. (2022) 121:2749–63. doi: 10.1007/s00436-022-07612-6
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Attree, E, Sánchez-Arsuaga, G, Jones, M, Xia, D, Marugan-Hernández, V, Blake, D, et al. Control de los agentes causales de la coccidiosis en pollos domésticos; Una mirada al pasado y consideraciones para el futuro. CABI Agric Biosci. (2021) 2:37. doi: 10.1186/s43170-021-00056-5
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Blake, DP, y Tomley, FM. Asegurar la producción avícola del siempre presente desafío de Eimeria. Tendencias Parasitol. (2014) 30:12–9. doi: 10.1016/j.pt.2013.10.003
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Blake, DP, Worthing, K y Jenkins, MC. Explorando los genomas de Eimeria para comprender la biología de poblaciones: progreso reciente y oportunidades futuras. Genes. (2020) 11:1103. doi: 10.3390/genes11091103
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Olajide, JS, Qu, Z, Yang, S, Oyelade, OJ y Cai, J. Proteínas de Eimeria: orden en medio del desorden. Vectores parásitos. (2022) 15:38. doi: 10.1186/s13071-022-05159-0
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Jaramillo-Ortiz, JM, Burrell, C, Adeyemi, O, Werling, D, y Blake, DP. Primera detección y caracterización de Eimeria zaria en pollos europeos. Parasitol veterinario. (2023) 324:110068. doi: 10.1016/j.vetpar.2023.110068
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Zhang, S, Tang, X, Wang, S, Shi, F, Duan, C, Bi, F, et al. Establecimiento de Eimeria acervulina recombinante que expresa multicopias de M2e derivadas del virus de la influenza aviar H9N2. Vacunas. (2021) 9:791. doi: 10.3390/vacunas9070791
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Lee, Y, Lu, M y Lillehoj, HS. Coccidiosis: avances recientes en la inmunidad del huésped y alternativas a las estrategias antibióticas. Vacunas. (2022) 10:215. doi: 10.3390/vacunas10020215
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Min, W, Kim, WH, Lillehoj, EP, y Lillehoj, HS. Avances recientes en la inmunidad del huésped a la coccidiosis aviar: citoquinas de la familia IL-17 como centinelas de la mucosa intestinal. Dev Comp Immunol. (2013) 41:418–28. doi: 10.1016/j.dci.2013.04.003
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Huang, J, Zhang, Z, Li, M, Song, X, Yan, R, Xu, L, et al. Protección inmunitaria de microneme 7 (EmMIC7) frente al desafío de Eimeria maxima en pollos. Pathol aviar. (2015) 44:392–400. doi: 10.1080/03079457.2015.1071780
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Marugan-Hernández, V, Berberecho, C, Macdonald, S, Pegg, E, Crouch, C, Blake, DP, et al. Las proteínas virales expresadas en el parásito protozoario Eimeria tenella son detectadas por el sistema inmunitario de los pollos. Vectores parásitos. (2016) 9:463. doi: 10.1186/s13071-016-1756-2
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Yan, W, Liu, X, Shi, T, Hao, L, Tomley, FM y Suo, X. Transfección estable de Eimeria tenella: expresión constitutiva de la molécula YFP-YFP a lo largo del ciclo de vida. Int J Parasitol. (2009) 39:109–17. doi: 10.1016/j.ijpara.2008.06.013
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Clark, JD, Oakes, RD, Redhead, K, Crouch, CF, Francis, MJ, Tomley, FM, et al. Parásitos de especies de Eimeria como nuevos vectores de administración de vacunas: inmunidad protectora anti-Campylobacter jejuni inducida por CjaA administrada por Eimeria tenella. Vacuna. (2012) 30:2683–8. doi: 10.1016/j.vaccine.2012.02.002
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Tang, X, Liu, X, Yin, G, Suo, J, Tao, G, Zhang, S, et al. Un nuevo modelo de administración de vacunas del apicomplejo Eimeria tenella que expresa el antígeno Eimeria maxima protege a los pollos contra la infección de los dos parásitos. Frente Immunol. (2018) 8:1982. doi: 10.3389/fimmu.2017.01982
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Pastor-Fernández, I, Kim, S, Billington, K, Bumstead, J, Marugán-Hernández, V, Küster, T, et al. Desarrollo de vacunas de protección cruzada vectorizadas por Eimeria basadas en antígenos de membrana apical. Int J Parasitol. (2018) 48:505–18. doi: 10.1016/j.ijpara.2018.01.003
18. Trapp, J y Rautenschlein, S. Interferencias del virus de la bursitis infecciosa con las células inmunitarias del huésped: ¿qué sabemos? Pathol aviar. (2022) 51:303–16. doi: 10.1080/03079457.2022.2080641
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Yang, H y Ye, C. Enfoques de genética inversa para el desarrollo de vacunas vivas atenuadas del virus de la enfermedad infecciosa de la bursa. Curr Opin Virol. (2020) 44:139–44. doi: 10.1016/j.coviro.2020.08.001
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. El-Aried, TA, Mansour, SMG, ElBakrey, RM, N Ismail, AE y Eid AAM,. Virus de la bursitis infecciosa: perspectivas epidemiológicas moleculares e impacto en la eficacia de la vacuna contra los virus de la gripe aviar y de la enfermedad de Newcastle. Avian Dis. (2019) 63:606–18. doi: 10.1637/aviandiseases-D-19-00086
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Chen, C, Qin, Y, Qian, K, Shao, H, Ye, J y Qin, A. HSC70 es necesario para la infección por el virus de la bursitis infecciosa (IBDV) en las células DF-1. Virol J. (2020) 17:65. doi: 10.1186/s12985-020-01333-x
22. Ganguly, B, y Rastogi, SK. Modelado estructural y funcional de la proteína viral 5 del virus de la bursitis infecciosa. Virus Res. (2018) 247:55–60. doi: 10.1016/j.virusres.2018.01.017
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. Asfor, AS, Reddy, VRAP, Nazki, S, Urbaniec, J, Brodrick, AJ, y Broadbent, AJ. Modelización de la deriva antigénica del virus de la bursitis infecciosa (IBDV) in vitro. Virus. (2022) 15:130. doi: 10.3390/v15010130
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Arnold, M, Durairaj, V, Mundt, E, Schulze, K, Breunig, KD y Behrens, SE. Vacunación protectora contra el virus de la bursitis infecciosa con levadura Kluyveromyces lactis recombinante entera que expresa la subunidad viral VP2. PLoS Uno. (2012) 7:e42870. doi: 10.1371/journal.pone.0042870
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Maqsood, I, Shi, W, Wang, L, Wang, X, Han, B, Zhao, H, et al. Inmunogenicidad y eficacia protectora del Lactobacillus plantarum recombinante administrado por vía oral que expresa la proteína VP2 contra el IBDV en pollo. J Appl Microbiol. (2018) 125:1670–81. doi: 10.1111/jam.14073
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Yu, Y, Tang, X, Duan, C, Suo, J, Crouch, C, Zhang, S, et al. La VP2 localizada por microneme en Eimeria acervulina provoca una inmunidad protectora eficaz contra el virus de la bursitis infecciosa. Infectar a Immun. (2024) 92:e0045623. doi: 10.1128/iai.00456-23
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Long, PL, Millard, BJ, Joyner, LP y Norton, CC. Guía de las técnicas de laboratorio utilizadas en el estudio y diagnóstico de la coccidiosis aviar. Folia Vet Lat. (1976) 6:201–17.
28. Tang, X, Liu, X, Tao, G, Qin, M, Yin, G, Suo, J, et al. El péptido 2A «autoescindido» del teschovirus-1 porcino media la escisión de proteínas fluorescentes duales en Eimeria tenella transgénica. Res. Veterinaria. (2016) 47:68. doi: 10.1186/s13567-016-0351-z
29. Liu, X, Shi, T, Ren, H, Su, H, Yan, W y Suo, X. La transfección mediada por enzimas de restricción mejoró la eficiencia de la transfección in vitro en el parásito apicomplejo Eimeria tenella. Mol Biochem Parasitol. (2008) 161:72–5. doi: 10.1016/j.molbiopara.2008.06.006
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Liu, X, Zou, J, Yin, G, Su, H, Huang, X, Li, J, et al. Desarrollo de líneas transgénicas de Eimeria tenella que expresan la proteína fluorescente amarilla mejorada con M2e (M2e-EYFP). Parasitol veterinario. (2013) 193:1–7. doi: 10.1016/j.vetpar.2012.12.019
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Tian, Y, Xu, J, Li, Y, Zhao, R, Du, S, Lv, C, et al. El microARN-31 reduce la señalización inflamatoria y promueve la regeneración en el epitelio del colon, y la administración de imitadores en microesferas reduce la colitis en ratones. Gastroenterología. (2019) 156:2281–2296.e6. doi: 10.1053/j.gastro.2019.02.023
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. Li, K, Liu, Y, Liu, C, Gao, L, Zhang, Y, Cui, H, et al. El virus recombinante de la enfermedad de Marek tipo 1 proporciona una protección completa contra los virus muy virulentos de la enfermedad de Marek y la enfermedad infecciosa de la bursita en pollos. Sci Rep. (2016) 6:39263. doi: 10.1038/srep39263
Resumen de PubMed | Texto completo de Crossref | Google Académico
33. Li, K, Gao, L, Gao, H, Qi, X, Gao, Y, Qin, L, et al. La optimización de codones y el elemento regulador postranscripcional del virus de la hepatitis de la marmota mejoran las respuestas inmunitarias de las vacunas de ADN contra el virus de la bursitis infecciosa en pollos. Virus Res. (2013) 175:120–7. doi: 10.1016/j.virusres.2013.04.010
Resumen de PubMed | Texto completo de Crossref | Google Académico
34. Martínez-Torrecuadrada, JL, Saubi, N, Pagès-Manté, A, Castón, JR, Espuña, E, y Casal, JI. Eficacia dependiente de la estructura de las vacunas recombinantes contra el virus de la bursitis infecciosa (IBDV). Vacuna. (2003) 21:3342–50. DOI: 10.1016/S0264-410X(02)00804-6
Resumen de PubMed | Texto completo de Crossref | Google Académico
35. Sedeik, ME, El-Shall, NA, Awad, AM, Abd El-Hack, ME, Alowaimer, AN, y Swelum, AA. Evaluación comparativa de vacunas de vectores HVT-EII, inmunocomplejos y EII vivas contra vvIBDV en pollos de engorde comerciales con altos anticuerpos de origen materno. Animales. (2019) 9:72. doi: 10.3390/ani9030072
Resumen de PubMed | Texto completo de Crossref | Google Académico
36. Fatoba, AJ, y Adeleke, MA. Parásito transgénico Eimeria: una posible estrategia de control de la coccidiosis de pollo. Acta Trop. (2020) 205:105417. doi: 10.1016/j.actatropica.2020.105417
Resumen de PubMed | Texto completo de Crossref | Google Académico
37. Tang, X, Liu, X y Suo, X. Hacia un diseño innovador y una aplicación de Eimeria recombinante como vector vacunal. Infectar a Immun. (2020) 88:e00861-19. doi: 10.1128/IAI.00861-19
Resumen de PubMed | Texto completo de Crossref | Google Académico
38. Yin, G, Liu, X, Zou, J, Huang, X y Suo, X. Coexpresión de genes reporteros en el patógeno generalizado Eimeria tenella utilizando una estrategia de vector de expresión de doble casete. Int J Parasitol. (2011) 41:813–6. doi: 10.1016/j.ijpara.2011.04.001
39. Li, Z, Tang, X, Suo, J, Qin, M, Yin, G, Liu, X, et al. La Eimeria mitis transgénica que expresa interleucina 2 de pollo estimuló una mayor respuesta inmunitaria celular en los pollos en comparación con los parásitos de tipo salvaje. Microbiol frontal. (2015) 6:533. doi: 10.3389/fmicb.2015.00533
Resumen de PubMed | Texto completo de Crossref | Google Académico
40. Tang, X, Wang, C, Liang, L, Hu, D, Zhang, S, Duan, C, et al. La coinmunización con dos líneas recombinantes de Eimeria tenella que expresan antígenos inmunoprotectores de E. maxima provoca una mayor protección contra la infección por E. maxima. Vectores parásitos. (2019) 12:347. doi: 10.1186/s13071-019-3605-6
Resumen de PubMed | Texto completo de Crossref | Google Académico
41. Mohsen, MO, y Bachmann, MF. Vacunología de partículas similares a virus, desde el laboratorio hasta la cabecera del paciente. Cell Mol Immunol. (2022) 19:993–1011. doi: 10.1038/s41423-022-00897-8
Resumen de PubMed | Texto completo de Crossref | Google Académico
42. Hu, D, Tang, X, Ben Mamoun, C, Wang, C, Wang, S, Gu, X, et al. Edición eficiente de un solo gen y de una familia de genes en el parásito apicomplejo Eimeria tenella utilizando CRISPR-Cas9. Frente Bioeng Biotechnol. (2020) 8:128. doi: 10.3389/fbioe.2020.00128
Resumen de PubMed | Texto completo de Crossref | Google Académico
43. Tang, X, Suo, J, Liang, L, Duan, C, Hu, D, Gu, X, et al. Modificación genética del protozoo Eimeria tenella mediante el sistema CRISPR/Cas9. Res. Veterinaria. (2020) 51:41. doi: 10.1186/s13567-020-00766-0
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: pollo, coccidios, vector de entrega, manipulación genética, antígeno viral
Cita: Guo Q, Yu Y, Suo J, Tang X, Zhang S, Crouch C, Bruton B, Tarpey I, Liu X, Zhao G y Suo X (2024) La administración oral de Eimeria acervulina transfectada secuencialmente con dos copias del gen VP2 induce inmunidad contra el virus de la bursitis infecciosa en pollos. Frente. Vet. Sci. 11:1367912. doi: 10.3389/fvets.2024.1367912
Recibido: 09 de enero de 2024; Aceptado: 12 de marzo de 2024;
Publicado: 10 abril 2024.
Editado por:
Damer Blake, Real Colegio de Veterinaria, Reino Unido
Revisado por:
Matthew Adekunle Adeleke, Universidad de KwaZulu-Natal, Sudáfrica
Virginia Marugan-Hernández, Royal Veterinary College, Reino Unido
Derechos de autor © 2024 Guo, Yu, Suo, Tang, Zhang, Crouch, Bruton, Tarpey, Liu, Zhao y Suo. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY). S
*Correspondencia: Guanghui Zhao, zgh083@nwsuaf.edu.cn; Xun Suo, suoxun@cau.edu.cn
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía