La cecropina AD reduce la carga viral y la respuesta inflamatoria contra el virus de la influenza aviar H9N2 en pollos
La cecropina AD reduce la carga viral y la respuesta inflamatoria contra el virus de la influenza aviar H9N2 en pollos
 Apuntando a Zhang†
Apuntando a Zhang†  Zhenyi Liu†
Zhenyi Liu†  Yan Zhi
Yan Zhi  Xinping Zhao
Xinping Zhao  Mengze Du
Mengze Du  Qian Zhang
Qian Zhang  Tao Zhang
Tao Zhang  Ge Hu*
Ge Hu*- Facultad de Ciencia y Tecnología Animal, Universidad de Agricultura de Pekín, Pekín, China
Introducción: Este estudio se centra en evaluar la eficacia terapéutica de la cecropina AD, un péptido antimicrobiano, contra el virus de la influenza aviar (AIV) H9N2 en pollos. Dado el impacto global del virus de la influenza aviar H9N2 en la salud de las aves de corral, es crucial identificar tratamientos efectivos.
Métodos: Para evaluar el impacto de la cecropina AD, realizamos experimentos in vivo con 108 pollos de 5 semanas de edad divididos en grupos de control, infectados y varios grupos de tratamiento en función de los niveles de dosis de cecropina AD (alta, media y baja). Las metodologías incluyeron pruebas de hemaglutinación (HA) para títulos virales, examen histopatológico y tinción con azul de toluidina (TB) para patología pulmonar, PCR en tiempo real para detección viral y ensayos de inmunoabsorción enzimática para medir los niveles séricos de marcadores inflamatorios.
Resultados: Los hallazgos revelaron que la cecropina AD redujo sustancialmente la patología pulmonar y la carga viral, especialmente a dosis más altas, comparándose favorablemente con los efectos observados de los tratamientos convencionales. Además, la cecropina AD moduló eficazmente la actividad de los mastocitos y los niveles de marcadores inflamatorios como IL-6, TNF-α, IFN-γ y 5-HT, lo que indica su potencial para disminuir la inflamación y la propagación viral.
Discusión: La cecropina AD presenta un potencial significativo como tratamiento alternativo para el virus H9N2 AIV en pollos, como lo demuestra su capacidad para disminuir el daño pulmonar, disminuir la presencia viral y ajustar las respuestas inmunitarias. Esto posiciona a la cecropina AD como un candidato prometedor para una mayor exploración en el manejo de las infecciones por el virus de la influenza aviar H9N2 en aves de corral.
1 Introducción
El subtipo H9N2 del virus de la influenza aviar (AIV), una influenza aviar de baja patogenicidad (LPAI, por sus siglas en inglés), representa una amenaza significativa para la industria avícola mundial. Si bien no suele causar mortalidad masiva, afecta negativamente la productividad de las aves de corral y puede allanar el camino para infecciones secundarias por patógenos oportunistas como Escherichia coli (1). La creciente resistencia a los medicamentos antivirales convencionales, junto con sus efectos secundarios adversos y el potencial de residuos nocivos, subraya la necesidad urgente de enfoques de tratamiento innovadores (2). Además, la eficacia de las vacunas existentes contra el virus del virus de la influenza aviar contra el virus H9N2 se está viendo socavada por la variación antigénica viral (3), lo que pone de relieve las limitaciones de las estrategias actuales en el manejo de este virus.
En la patogénesis de la influenza aviar, en particular del subtipo H9N2, las respuestas inflamatorias desempeñan un papel fundamental. Las citocinas TNF-α e IL-6, junto con el interferón-γ (IFN-γ), son cruciales en la modulación de estas respuestas. El TNF-α es conocido por sus potentes actividades proinflamatorias, incluida la activación de macrófagos y linfocitos, que son esenciales para combatir las infecciones virales. Sin embargo, su sobreproducción puede provocar efectos perjudiciales como lesiones tisulares y respuestas inmunitarias desreguladas (4). Curiosamente, los estudios indican que la producción de TNF-α e IL-6 pueden regularse negativamente entre sí, lo que sugiere una compleja interacción en el control de la respuesta inmunitaria (5). En el caso de la gripe aviar A/H7N9, por ejemplo, los niveles elevados de IL-6 y otras citocinas proinflamatorias se han asociado con lesiones pulmonares graves y un aclaramiento viral menos eficaz, lo que pone de manifiesto su contribución a la patogénesis (6). De manera similar, se ha demostrado que el IFN-γ, aunque comúnmente se eleva después de la infección por el virus de la influenza, suprime la función protectora de las células linfoides innatas del grupo II (ILC2), lo que podría exacerbar la infección. Esto apunta a un papel matizado del IFN-γ en la patogénesis de la gripe, donde su regulación podría ser un objetivo clave para la terapia posterior a la infección (7). Los mastocitos (MC) y el 5-HT también contribuyen significativamente al panorama inflamatorio y al control del daño tisular durante la infección (8). Reconociendo el papel crucial de las respuestas inflamatorias en la patogénesis de la influenza aviar H9N2, es esencial enfocar estos procesos para un tratamiento eficaz.
La cecropina AD, representante de los péptidos antimicrobianos (AMP), presenta un enfoque novedoso. No solo ejerce efectos antivirales directos, sino que también modula potencialmente las respuestas inflamatorias. Esta doble función posiciona a los AMP, conocidos por su actividad antimicrobiana de amplio espectro, baja toxicidad y menor riesgo de resistencia a los medicamentos (9, 10), como candidatos prometedores en la búsqueda de tratamientos innovadores, particularmente a la luz de la eficacia limitada de los medicamentos antivirales y las vacunas existentes. Entre los AMP, los péptidos derivados de insectos como las cecropinas y las defensinas son los más diversos y ampliamente aplicados (11). Los insectos utilizan respuestas inmunitarias únicas para defenderse de los patógenos microbianos, gracias a su gran diversidad y formidables mecanismos de defensa. La cecropina, el primer AMP derivado de insectos, se descubrió mediante la inducción de pupas de polilla de la seda con E. coli y Serratia marcescens, marcando un hito importante en la investigación del AMP (12, 13). La cecropina AD, un péptido híbrido derivado de la cecropina A y la cecropina D (14), está a la vanguardia de nuestro estudio debido a sus notables actividades antimicrobianas, antivirales y antitumorales sin efectos citotóxicos (15, 16). Su eficacia contra diversos patógenos, incluida una eficacia antimicrobiana superior en comparación con sus componentes individuales, lo posiciona como una alternativa prometedora y de bajo riesgo para el tratamiento de enfermedades avícolas (17). Este estudio tiene como objetivo específico investigar el potencial terapéutico de la cecropina AD en el tratamiento del virus H9N2 AIV en pollos, explorando una nueva vía en el manejo de la influenza aviar. Nuestra hipótesis es que la cecropina AD puede reducir eficazmente la carga viral y mitigar los síntomas asociados con la infección por H9N2. Para probar esta hipótesis, examinaremos cortes de tejido pulmonar, evaluaremos los índices pulmonares y mediremos las cargas virales, el número de mastocitos (MC) y la degranulación, así como los cambios en los principales factores inflamatorios. A través de esta investigación, aspiramos a proporcionar datos teóricos cruciales sobre la acción antiviral de los AMP de cecropina y ofrecer información para desarrollar nuevos medicamentos antigripales, que podrían ser fundamentales para abordar los desafíos planteados por el virus de la influenza aviar H9N2 en la industria avícola.
2 Materiales y métodos
2.1 Aprobación ética y consentimiento para participar
Todo el trabajo con animales en este estudio cumplió con los estándares mínimos de bienestar animal descritos en los Principios Rectores Internacionales para la Investigación Biomédica con Animales (en https://grants.nih.gov/grants/olaw/Guiding_Principles_2012.pdf). El manejo de las aves se realizó de acuerdo con los Lineamientos del Comité de Cuidado y Uso de Animales y aprobado por el Instituto de Zootecnia y Medicina Veterinaria (Número de permiso: BUA2022070). Se hicieron todos los esfuerzos para aliviar el sufrimiento de los animales y mejorar su calidad de vida.
2.2 Preparación de materiales y animales
En este estudio, se adquirieron 108 pollos SPF White Leghorn de 5 semanas de edad de Beijing Boehringer Ingelheim Vetsuisse Ltd. La cecropina AD (Q/DXN 063-2021), un compuesto clave en investigación, se obtuvo de Viteling Antibiotic-Free Breeding Technology (China). Además, utilizamos cápsulas de fosfato de oseltamivir como agente de control positivo de la medicina occidental. Estos se obtuvieron de Yichang East Sunshine Changjiang Pharmaceutical Co., Ltd. El estudio experimental también incluyó el subtipo H9N2 del virus de la influenza aviar de baja patogenicidad (LPAIV), identificado por los números de acceso FJ499463-FJ499470 del GenBank, obtenido de la Universidad Agrícola de China y propagado en huevos de gallina embrionados con SPF de 11 días de edad.
2.3 Diseño experimental y administración de fármacos
Después de una semana de aclimatación, los pollos se distribuyeron en seis grupos: tres grupos de dosis de cecropina AD (10 mg/ave/día, 20 mg/ave/día y 40 mg/ave/día), un grupo de control del virus, un grupo de control en blanco y un grupo de control positivo tratado con fosfato de oseltamivir (0,39 mg/ave/día). Cada grupo estaba compuesto por 18 pollos y se alojó en unidades separadas dentro de un aviario SPF, lo que garantizó el acceso ininterrumpido a alimento y agua. Las dosis de cecropina AD, fosfato de oseltamivir y el virus H9N2 AIV se determinaron cuidadosamente con base en experimentos preliminares realizados en nuestro laboratorio. Estos estudios preliminares fueron fundamentales para optimizar los efectos terapéuticos y la seguridad, asegurando que la dosis del virus pudiera inducir una enfermedad significativa pero no letal en los pollos.
Durante la fase de infección, se administró el virus H9N2 AIV a los grupos experimentales. El virus, cultivado en la cavidad alantoidea de huevos embrionados, se administró en una dosis de 0,2 mL por pollo, utilizando gotas nasales y oculares. El grupo control negativo recibió el mismo volumen de solución salina fisiológica de manera similar. Tres días después de la infección, se inició el tratamiento con las dosis designadas de cecropina AD para los respectivos grupos y fosfato de oseltamivir para el grupo de control farmacéutico. Al mismo tiempo, al virus y a los grupos de control negativo se les administró el mismo volumen de solución salina fisiológica diariamente.
A lo largo del experimento, se monitorearon de cerca los parámetros fisiológicos y conductuales de los pollos, incluido el estado de alerta, el peso, la ingesta de alimento, la respiración y el movimiento, para evaluar los efectos de los tratamientos y la infección.
2.4 Recogida de muestras y procedimiento
Tres, seis y nueve días después de la infección, se seleccionaron al azar cinco pollos de cada grupo para su análisis. En estricto cumplimiento de las normas éticas para la investigación con animales, estos pollos seleccionados fueron sacrificados humanamente, seguidos de observaciones de patología anatómica. Posteriormente, se recolectaron y pesaron muestras de tejidos y órganos. En particular, para el propósito de este estudio, los coeficientes pulmonares se calcularon utilizando el peso de un solo pulmón (unilateral), lo que refleja las prácticas estándar en la investigación histopatológica aviar. Después de pesar el pulmón unilateral, los tejidos se enjuagaron con solución salina fisiológica y se conservaron en una solución de poliformaldehído al 10% para su posterior análisis histológico, mientras que las muestras de tejido pulmonar restantes se almacenaron a -80 °C para extracciones de ARN total y proteínas.
Para el cálculo del coeficiente pulmonar (CL), nos adherimos meticulosamente a la siguiente fórmula, asegurando la precisión en nuestras mediciones:
2.5 Análisis histológico y evaluación de mastocitos en tejidos pulmonares
Las muestras de tejido pulmonar de los pollos se fijaron en una solución de formaldehído al 4% durante 4 h y posteriormente se cortaron en 0,5 cm3 trozos, seguido de un enjuague de 3 a 4 horas. Luego, el tejido se sometió a un proceso de deshidratación que involucró un lavado con agua de una hora e inmersiones graduadas en etanol (30 minutos en alcohol al 75%, 20 minutos en etanol al 80%, seguido de 20 minutos en etanol al 95%, con el paso de etanol al 95% repetido cuatro veces). Después del secado, las muestras se limpiaron en una mezcla de xileno y etanol, se incrustaron en cera y se seccionaron en capas delgadas de 4 a 6 micras para su examen histológico. Las secciones se desparafinaron mediante baños de xileno e inmersiones en etanol, se enjuagaron con agua destilada y se tiñeron con hematoxilina y eosina (H&E) para la histología general.
Para la visualización de mastocitos, las secciones se sometieron a tinción con azul de toluidina después de la acidificación con ácido clorhídrico durante 10 min y un enjuague completo. Se aplicó una solución de azul de toluidina durante 40 min, seguido de enjuague y secado al aire. A continuación, las secciones se sellaron en portaobjetos de vidrio con resina neutra y se etiquetaron para su análisis.
Los mastocitos se cuantificaron utilizando el sistema de análisis de imágenes Case Viewer, y la tasa de degranulación se calculó como el número de mastocitos desgranulados dividido por el recuento total de mastocitos, multiplicado por el 100%. Este proceso facilitó una comparación detallada de los cambios patológicos en los tejidos pulmonares en varios puntos temporales, proporcionando información sobre la respuesta inflamatoria dentro de los tejidos pulmonares.
2.6 Extracción de ARN total de tejido pulmonar y PCR cuantitativa en tiempo real
El ARN total se extrajo de 30-50 mg de tejido pulmonar de pollo utilizando el reactivo TRIzol (Takara, Dalian, China), según las pautas proporcionadas en las instrucciones del fabricante (18). Inicialmente, el tejido pulmonar se molió hasta convertirlo en un polvo blanco grisáceo en un mortero con nitrógeno líquido. La concentración y la pureza del ARN extraído se determinaron utilizando un espectrofotómetro Nanodrop 2000C (Thermo Fisher Scientific, Waltham, MA, Estados Unidos), asegurando una adecuada relación de absorbancia A260/280. La síntesis de ADNc se llevó a cabo utilizando el kit de reactivos PrimeScript RT (Takara, Dalian, China). Se realizaron análisis cuantitativos de PCR (qPCR) en el sistema de detección de PCR en tiempo real CFX96 (Bio-Rad, Hercules, CA, Estados Unidos), con las siguientes condiciones de ciclo térmico: una desnaturalización inicial a 95 °C durante 2 min, seguida de 40 ciclos de desnaturalización a 95 °C durante 10 s y recocido/extensión a una temperatura especificada durante 30 s, acompañada de adquisición de señales de fluorescencia (como se detalla en la Tabla 1). El análisis de la curva de fusión se llevó a cabo dentro de un rango de temperatura de 65 a 95 °C. Las eficiencias de amplificación de los genes diana se mantuvieron entre el 95 y el 105%. La mezcla de reacción de qPCR comprendió 10 μL TB GreenTM Premezcla (Takara), 0,4 μL de cada cebador directo e inverso, 1,5 μL de ADNc y 7,7 μL de agua desionizada libre de DNasa/RNasa (Tiangen, Pekín, China). Todas las muestras se analizaron por triplicado, con valores de umbral de ciclo (Ct) normalizados frente a los niveles de expresión de β-actina. Los niveles relativos de ARNm se cuantificaron mediante el método 2−ΔΔCt (19).
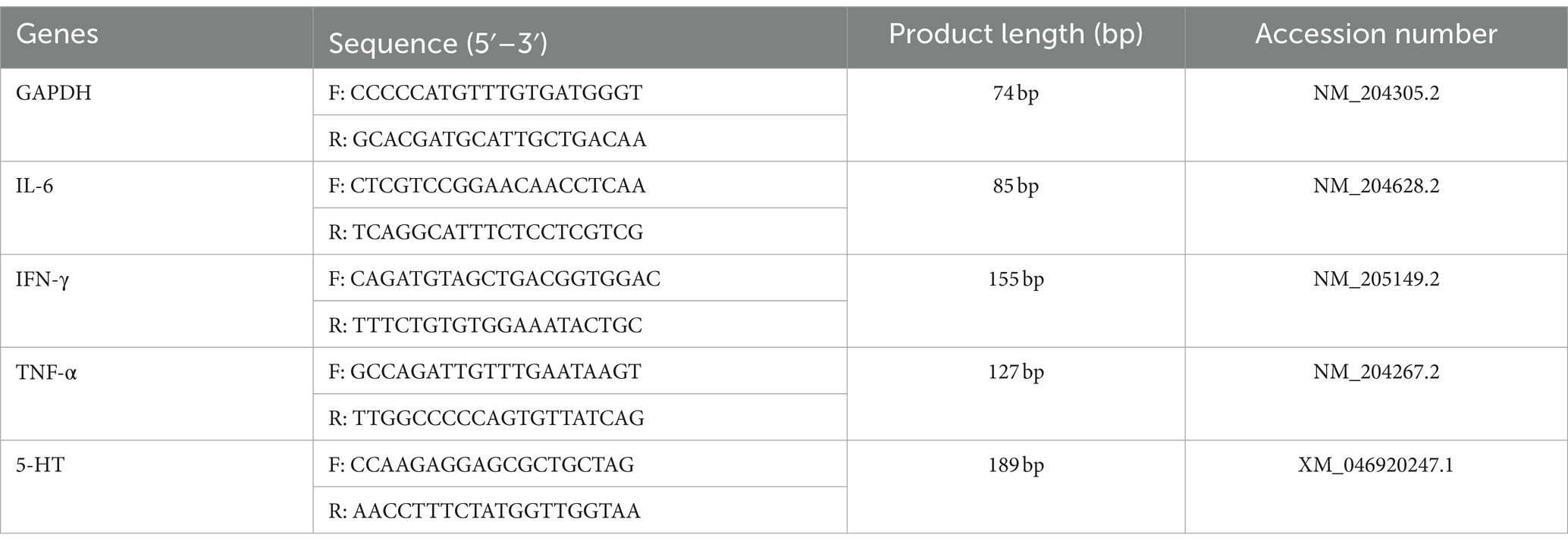 Tabla 1. Imprimadores utilizados para la reacción en cadena de la polimerasa cuantitativa en tiempo real (qRT-PCR).
Tabla 1. Imprimadores utilizados para la reacción en cadena de la polimerasa cuantitativa en tiempo real (qRT-PCR).
2.7 Análisis estadístico
Los datos se analizaron mediante análisis de varianza de una vía (ANOVA) con GraphPad Prism versión 8.3 (GraphPad Software Inc., San Diego, CA) y SPSS 20 (SPSS Inc., Chicago, IL, Estados Unidos). Los resultados experimentales se presentan como media ± desviación estándar (DE). Se aplicó la prueba post hoc de Tukey para realizar comparaciones por pares entre los grupos de tratamiento. Se utilizó la ecuación ΔCt = valor medio del gen diana − valor medio del gen de referencia interno, con ΔΔCt = ΔCt − valor medio del grupo control. Un valor de p inferior a 0,05 se consideró estadísticamente significativo.
3 Resultados
3.1 Efectos de la infección por influenza aviar H9N2 y el tratamiento con cecropina AD sobre el peso corporal
Después de la infección con la influenza aviar H9N2, los pollos mostraron síntomas que incluían plumas erizadas, letargo y cambios en la ingesta de agua y alimento. Tras el tratamiento con EAC, se observó una mejoría gradual. Después de la infección por el virus, la tasa y la cantidad de aumento de peso en el grupo del virus fueron significativamente más bajas que en el grupo de control en blanco (p < 0,001). Después del tratamiento con EAC, el problema del aumento de peso lento se alivió gradualmente, mostrando un efecto dependiente de la dosis. Se observaron diferencias significativas en el grupo de dosis alta de EAC y en el grupo de control positivo en comparación con el grupo infectado por el virus (p < 0,001, Figura 1A).
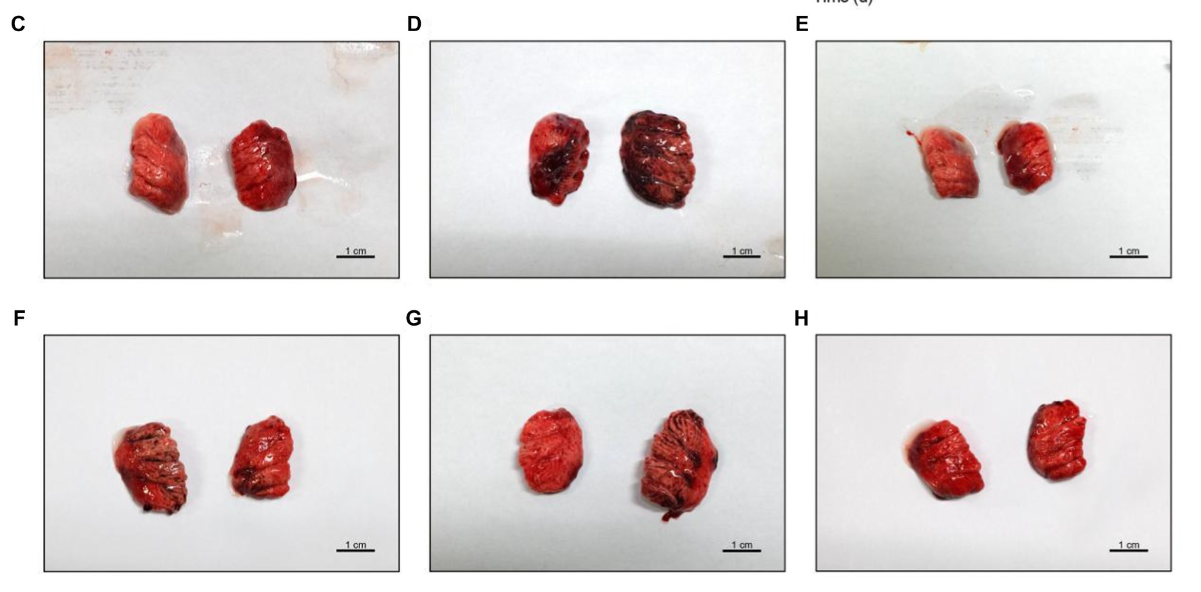
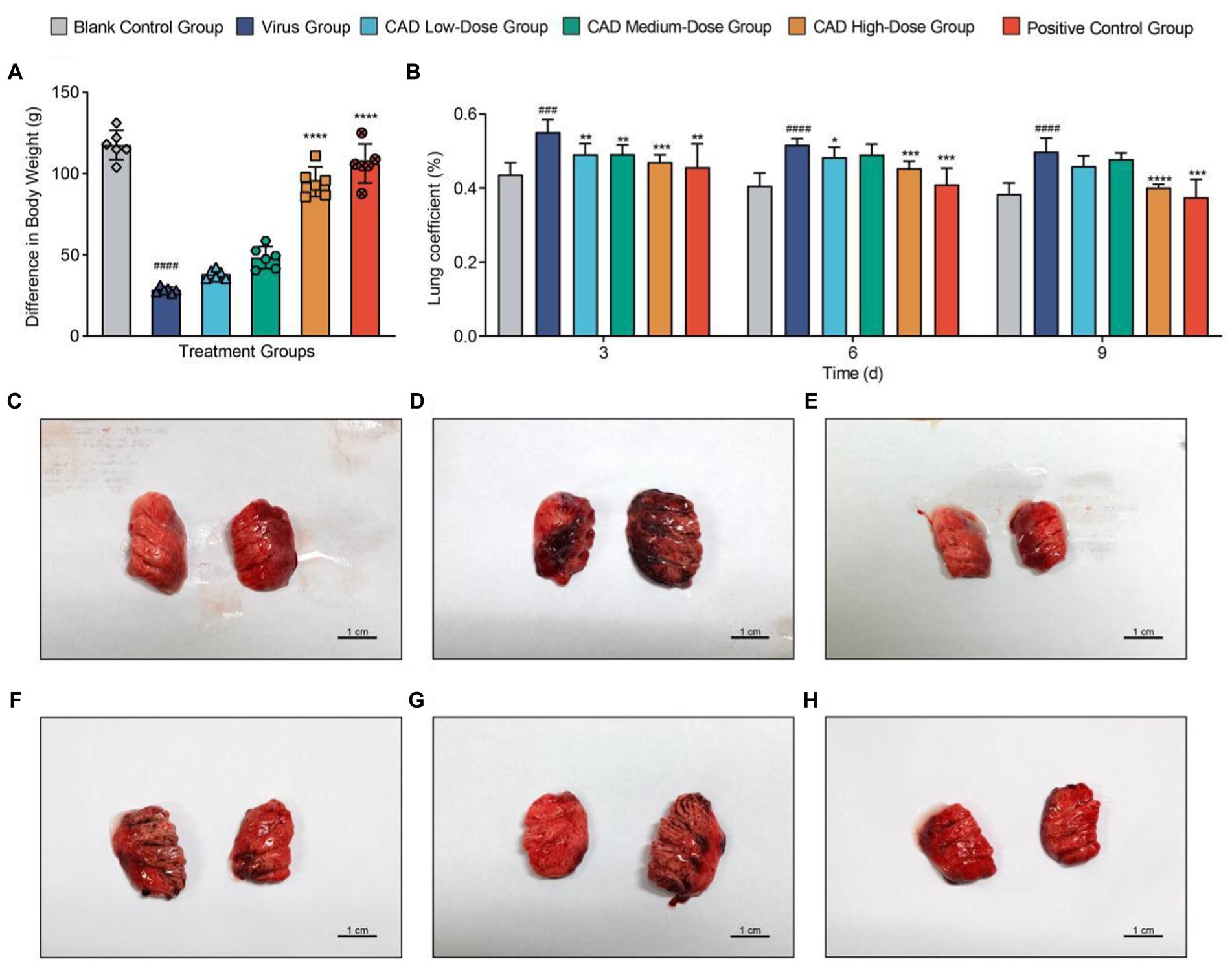 Figura 1. Tendencias del peso corporal y patología pulmonar en pollos después de la infección por el virus de la influenza aviar H9N2 y el tratamiento con EAC. (A) Gráfico de barras que representa los cambios en el peso corporal de los pollos en diferentes grupos experimentales, que ilustra el impacto de la infección por H9N2 y el posterior tratamiento con cecropina AD en las tasas de crecimiento. (B) Gráfico de barras múltiples que muestra los coeficientes pulmonares a los 3, 6 y 9 días después de la infección en todos los grupos. (C-H) Examen histológico de los tejidos pulmonares de seis grupos de estudio, que revela la extensión de la congestión pulmonar y los cambios estructurales después de la infección por H9N2 y el tratamiento. La congestión, la presencia de moco y los infiltrados inflamatorios se evidencian con mayor claridad a lo largo del tratamiento, con reducciones significativas de la patología en los grupos de dosis alta y control positivo de cecropina AD. Los experimentos se realizaron por triplicado y se muestra la media ± De (n = 3 o 6). Los valores de p se determinaron mediante ANOVA unidireccional no paramétrico. En comparación con el grupo de virus, p < 0,05, p < 0,01, p < 0,005 y p < 0,001. En comparación con el grupo control, p < 0,05, p < 0,01, p < 0,005 y p < 0,005.**********##########
Figura 1. Tendencias del peso corporal y patología pulmonar en pollos después de la infección por el virus de la influenza aviar H9N2 y el tratamiento con EAC. (A) Gráfico de barras que representa los cambios en el peso corporal de los pollos en diferentes grupos experimentales, que ilustra el impacto de la infección por H9N2 y el posterior tratamiento con cecropina AD en las tasas de crecimiento. (B) Gráfico de barras múltiples que muestra los coeficientes pulmonares a los 3, 6 y 9 días después de la infección en todos los grupos. (C-H) Examen histológico de los tejidos pulmonares de seis grupos de estudio, que revela la extensión de la congestión pulmonar y los cambios estructurales después de la infección por H9N2 y el tratamiento. La congestión, la presencia de moco y los infiltrados inflamatorios se evidencian con mayor claridad a lo largo del tratamiento, con reducciones significativas de la patología en los grupos de dosis alta y control positivo de cecropina AD. Los experimentos se realizaron por triplicado y se muestra la media ± De (n = 3 o 6). Los valores de p se determinaron mediante ANOVA unidireccional no paramétrico. En comparación con el grupo de virus, p < 0,05, p < 0,01, p < 0,005 y p < 0,001. En comparación con el grupo control, p < 0,05, p < 0,01, p < 0,005 y p < 0,005.**********##########
3.2 Observaciones de anatomía patológica
Las disecciones revelaron congestión y mucosidad significativas en los pulmones y la tráquea de los pollos infectados con influenza aviar H9N2 (Figuras 1C-H). Además, algunos pollos mostraron una reducción en el tamaño del timo, derrame pericárdico y congestión hepática. El análisis del coeficiente pulmonar indicó un aumento significativo en el grupo virus en comparación con el grupo control (p < 0,005). El tratamiento con cecropina AD y la medicina occidental condujeron a reducciones de las lesiones pulmonares y el edema en diversos grados. Después de 3, 6 y 9 días de tratamiento, el coeficiente pulmonar en el grupo de cecropina AD a dosis altas y en el grupo de control positivo tratado con medicina occidental fue significativamente menor que en el grupo de virus (p < 0,005, Figura 1B).
3.3 Observaciones de anatomía patológica en tejidos pulmonares
Como se muestra en la Figura 2, 3 días después de la infección, los pulmones de los pollos infectados con H9N2 mostraron una patología significativa, incluyendo paredes alveolares engrosadas y agrupación irregular de glóbulos rojos, indicativo de congestión y estasis. La infiltración de células inflamatorias fue extensa en el intersticio alveolar, intensificándose con el aumento del título viral.
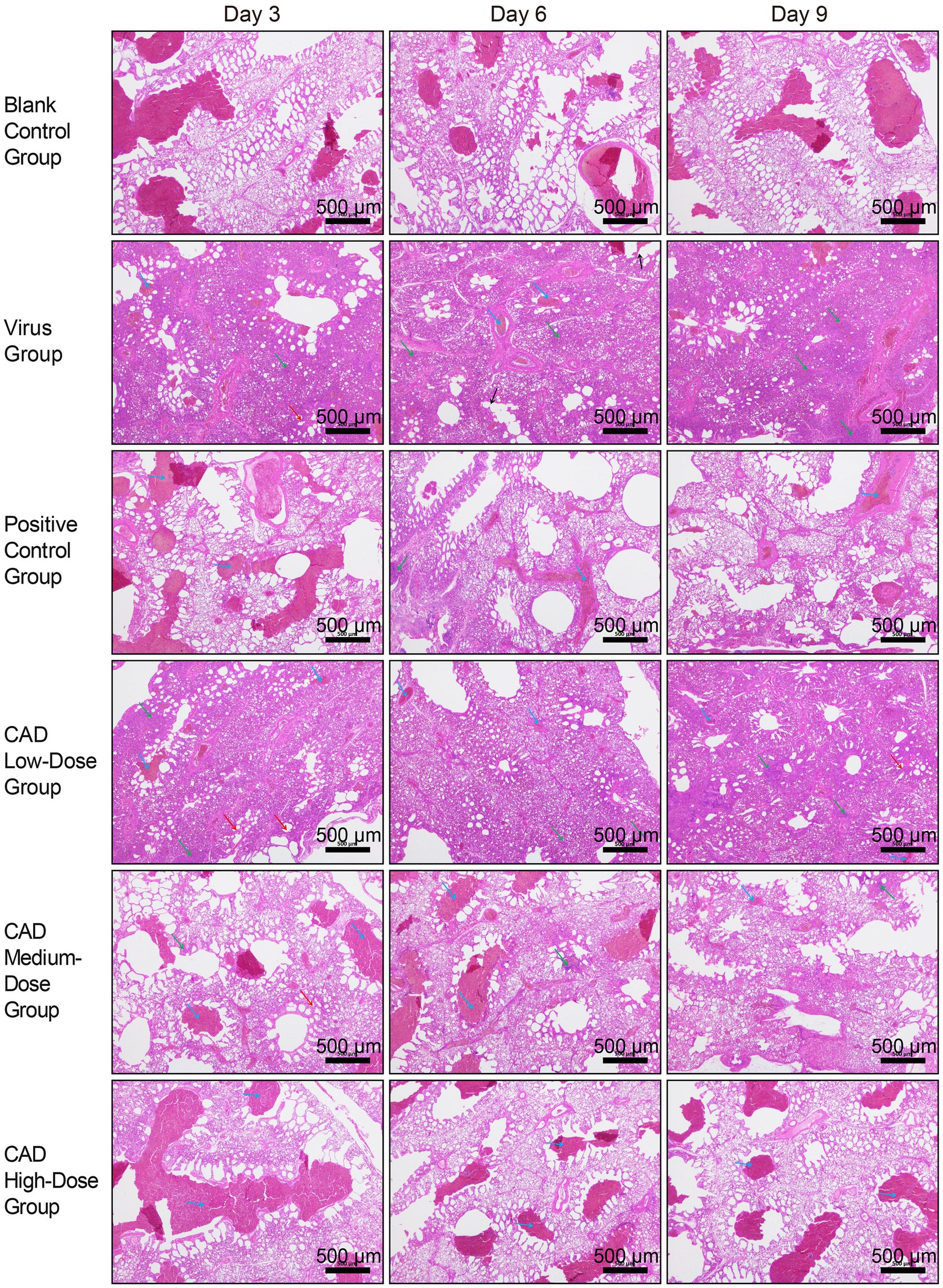 Figura 2. Análisis histopatológico de los tejidos pulmonares en pollos después de la infección por el virus H9N2 y el tratamiento con EAC (40×). Las designaciones de los grupos, anotadas en el margen izquierdo de cada fila, de arriba a abajo, incluyen el grupo de control en blanco, el grupo de virus, el grupo de control positivo y los grupos tratados con cecropina AD en dosis bajas, medias y altas. Los puntos de tiempo posteriores a la infección, indicados en la parte superior de cada columna, son el día 3, el día 6 y el día 9, respectivamente. Barra de escala = 500 μm. Las anotaciones dentro de la imagen se indican con flechas de diferentes colores para resaltar características histopatológicas específicas: las flechas azules apuntan a áreas de congestión y estasis; las flechas verdes indican infiltración celular inflamatoria; las flechas rojas marcan el engrosamiento de las paredes alveolares; y las flechas negras denotan la ruptura de los tabiques alveolares.
Figura 2. Análisis histopatológico de los tejidos pulmonares en pollos después de la infección por el virus H9N2 y el tratamiento con EAC (40×). Las designaciones de los grupos, anotadas en el margen izquierdo de cada fila, de arriba a abajo, incluyen el grupo de control en blanco, el grupo de virus, el grupo de control positivo y los grupos tratados con cecropina AD en dosis bajas, medias y altas. Los puntos de tiempo posteriores a la infección, indicados en la parte superior de cada columna, son el día 3, el día 6 y el día 9, respectivamente. Barra de escala = 500 μm. Las anotaciones dentro de la imagen se indican con flechas de diferentes colores para resaltar características histopatológicas específicas: las flechas azules apuntan a áreas de congestión y estasis; las flechas verdes indican infiltración celular inflamatoria; las flechas rojas marcan el engrosamiento de las paredes alveolares; y las flechas negras denotan la ruptura de los tabiques alveolares.
Para el día 6, la morfología del tejido pulmonar en el grupo del virus mostró una alteración más grave, con fragmentación de los tabiques alveolares y recuentos altos de glóbulos rojos, lo que refleja un empeoramiento de la congestión y la estasis. Las respuestas inflamatorias se intensificaron, marcadas por un aumento de neutrófilos, linfocitos y leucocitos en el intersticio alveolar.
En el día 9, la condición pulmonar mejoró ligeramente en comparación con el día 6, con una mejor integridad de los bronquiolos y los alvéolos y una reducción del daño del tabique alveolar. Sin embargo, persistió la respuesta inflamatoria grave, con una extensa infiltración de células inflamatorias en los tabiques alveolares.
A lo largo de los 3, 6 y 9 días posteriores al tratamiento, el grupo del virus mostró consistentemente congestión pulmonar, estasis, paredes alveolares engrosadas y una extensa infiltración de células inflamatorias, aunque con cierta relajación de los síntomas en el día 9. Los grupos de cecropina AD y medicina occidental mostraron cambios patológicos similares, pero en un grado significativamente menor que el grupo de virus. El grupo de dosis bajas de cecropina AD mostró el daño pulmonar más grave entre los grupos de dosis, mientras que el grupo de dosis alta demostró una mejor salud pulmonar.
3.4 Expresión viral en tejidos pulmonares post-tratamiento con cecropina AD
Después de 3, 6 y 9 días de tratamiento, el grupo de cecropina AD a dosis altas mostró un título de hemaglutinación profundamente más bajo en los homogeneizados del tejido pulmonar en comparación con el grupo de virus (p < 0,01), sin que se observaran diferencias significativas en comparación con el grupo de medicina occidental (p > 0,05) (Figura 3A). El tratamiento con cecropina AD redujo significativamente la expresión viral dentro de los tejidos pulmonares. Después de 3, 6 y 9 días de tratamiento, los grupos de dosis baja, media y alta mostraron niveles virales significativamente reducidos en comparación con el grupo del virus (p < 0,01). Por el contrario, el grupo de dosis altas de cecropina AD después de 3 días, así como las dosis medias y altas después de 6 y 9 días, demostraron niveles de expresión viral comparables a los tratados con medicina occidental (Figura 3B), lo que indica la eficacia de la cecropina AD en la disminución de la carga viral en los tejidos pulmonares.
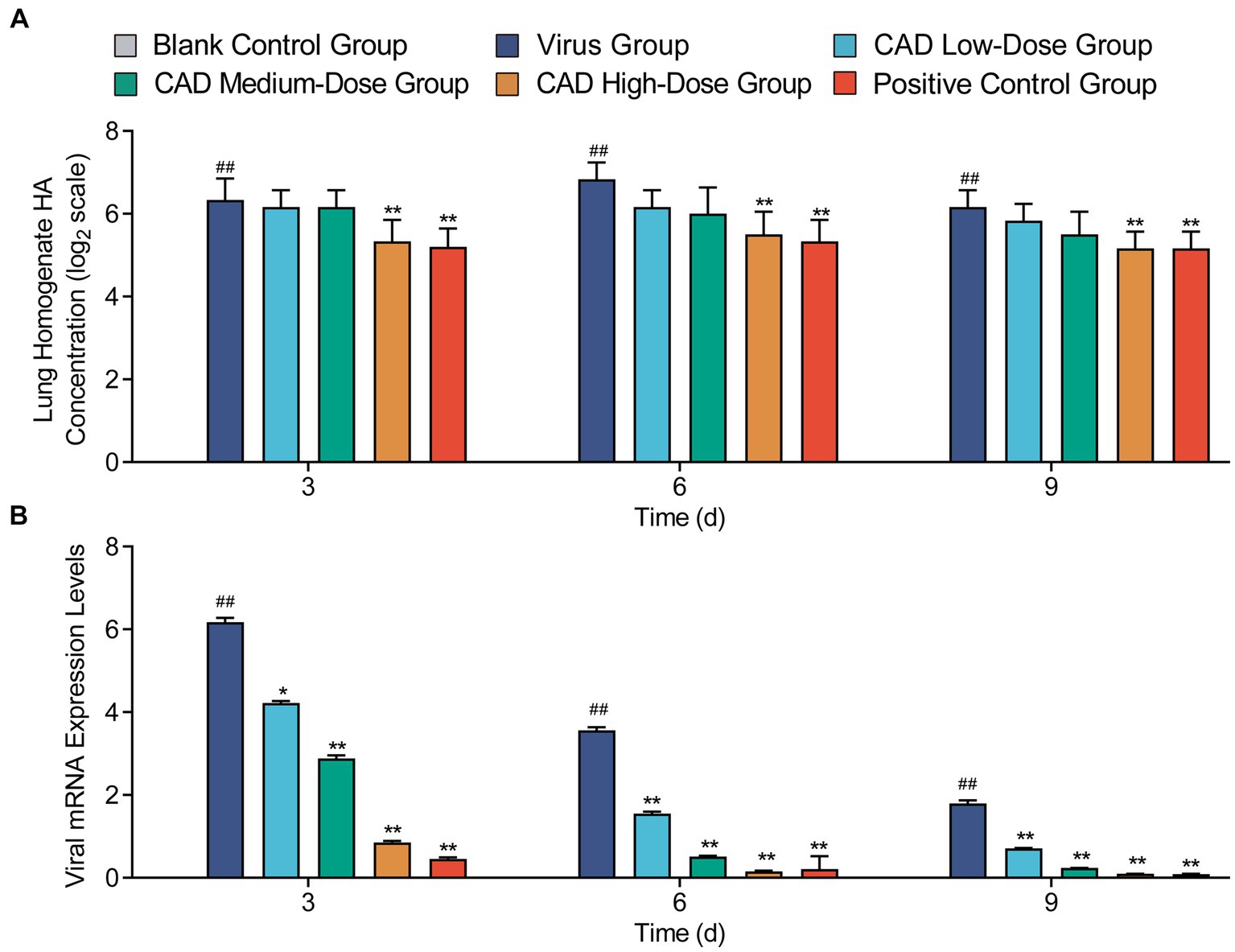 Figura 3. Título de hemaglutinación y expresión viral en tejidos pulmonares después de la infección por el virus H9N2 y el tratamiento con EAC. (A) Un gráfico que muestra el título de hemaglutinación en el tejido pulmonar homogeneiza en varios grupos. (B) Un gráfico que muestra los niveles de expresión viral en los tejidos pulmonares después del tratamiento. Los experimentos se realizaron por triplicado y se muestra la media ± S.D. (n = 3). Los valores de p se determinaron mediante ANOVA unidireccional no paramétrico. En comparación con el grupo de virus, p < 0,05 y p < 0,01. En comparación con el grupo control, p < 0,05 y p < 0,01.***###
Figura 3. Título de hemaglutinación y expresión viral en tejidos pulmonares después de la infección por el virus H9N2 y el tratamiento con EAC. (A) Un gráfico que muestra el título de hemaglutinación en el tejido pulmonar homogeneiza en varios grupos. (B) Un gráfico que muestra los niveles de expresión viral en los tejidos pulmonares después del tratamiento. Los experimentos se realizaron por triplicado y se muestra la media ± S.D. (n = 3). Los valores de p se determinaron mediante ANOVA unidireccional no paramétrico. En comparación con el grupo de virus, p < 0,05 y p < 0,01. En comparación con el grupo control, p < 0,05 y p < 0,01.***###
3.5 Observaciones de mastocitos en tejido pulmonar de pollo después del tratamiento con cecropina AD
Después de la tinción con azul de toluidina (TB), se identificaron claramente mastocitos (MC) en los tejidos pulmonares de pollo, con una concentración notable de MC observada alrededor de las áreas traqueales, como se destaca con las flechas negras en la Figura 4. Esta observación indica un patrón de distribución específico en respuesta a la infección, con mastocitos que se agregan de manera prominente en regiones que probablemente se vean afectadas por la actividad viral. Las imágenes sirven como una representación visual de las variaciones en la concentración y la actividad de MC en diferentes grupos experimentales y puntos temporales, ilustrando tanto la distribución espacial como la respuesta fisiológica de estas células al virus de la influenza aviar H9N2.
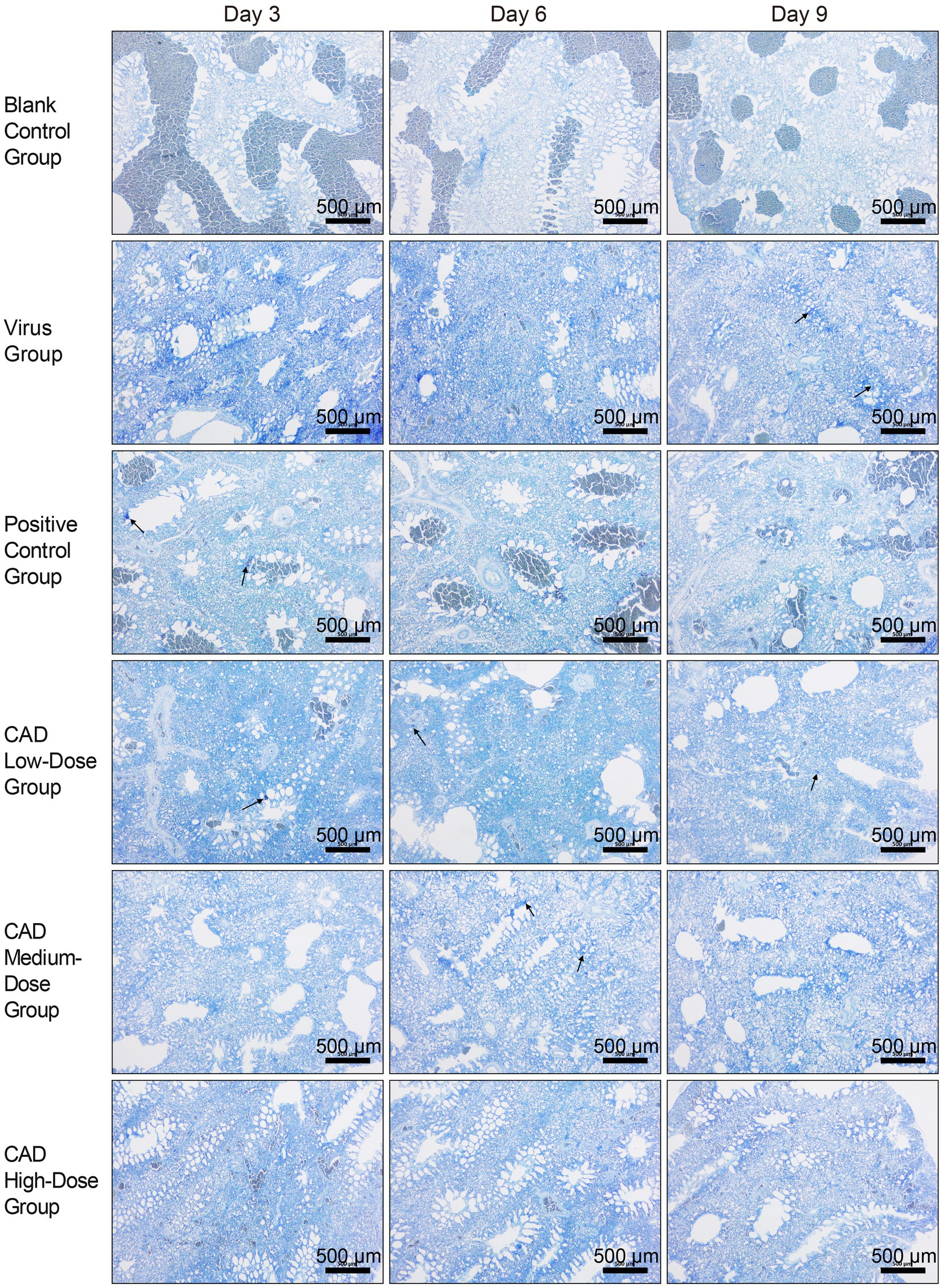 Figura 4. Infección por el virus de la influenza aviar H9N2 y tratamiento de la enfermedad coronaria: secciones de parafina teñidas con azul de toluidina de tejidos pulmonares de pollo (40×). Las designaciones de los grupos, anotadas en el margen izquierdo de cada fila, de arriba a abajo, incluyen el grupo de control en blanco, el grupo de virus, el grupo de control positivo y los grupos tratados con cecropina AD en dosis bajas, medias y altas. Los puntos de tiempo posteriores a la infección, indicados en la parte superior de cada columna, son el día 3, el día 6 y el día 9, respectivamente. Barra de escala = 500 μm.
Figura 4. Infección por el virus de la influenza aviar H9N2 y tratamiento de la enfermedad coronaria: secciones de parafina teñidas con azul de toluidina de tejidos pulmonares de pollo (40×). Las designaciones de los grupos, anotadas en el margen izquierdo de cada fila, de arriba a abajo, incluyen el grupo de control en blanco, el grupo de virus, el grupo de control positivo y los grupos tratados con cecropina AD en dosis bajas, medias y altas. Los puntos de tiempo posteriores a la infección, indicados en la parte superior de cada columna, son el día 3, el día 6 y el día 9, respectivamente. Barra de escala = 500 μm.
Además, el examen detallado de estas secciones teñidas con mayor aumento reveló evidencia de degranulación de mastocitos, un proceso indicativo de una respuesta inmune activa a la infección. La degranulación, caracterizada por la liberación de gránulos de los mastocitos, fue evidente en áreas con altas concentraciones de MC, particularmente en las proximidades de las regiones traqueales. Este proceso de degranulación, aunque no se capta con el aumento inicial, subraya el papel dinámico de los mastocitos en la mediación de las respuestas inflamatorias dentro de los tejidos pulmonares.
El tratamiento con cecropina AD afectó significativamente el número y la tasa de degranulación de los mastocitos (MC). Como se muestra en la Figura 5, en comparación con el grupo control, hubo un aumento significativo en el número de MC y su tasa de degranulación después de la infección viral (p < 0,01). Después de 3, 6 y 9 días de tratamiento, el grupo de cecropina AD en dosis altas mostró recuentos de MC notablemente más bajos en comparación con el grupo de virus (p < 0,05), lo que coincide con los resultados observados en el grupo de medicina occidental (Figura 5A). Además, tanto las dosis medias como las altas de cecropina AD demostraron una reducción de las tasas de degranulación de MC después de 6 y 9 días de tratamiento (p < 0,05), observándose una marcada disminución en el grupo de dosis alta en el día 9 (p < 0,01). Estos cambios fueron similares a los observados en el grupo de medicina occidental (Figura 5B).
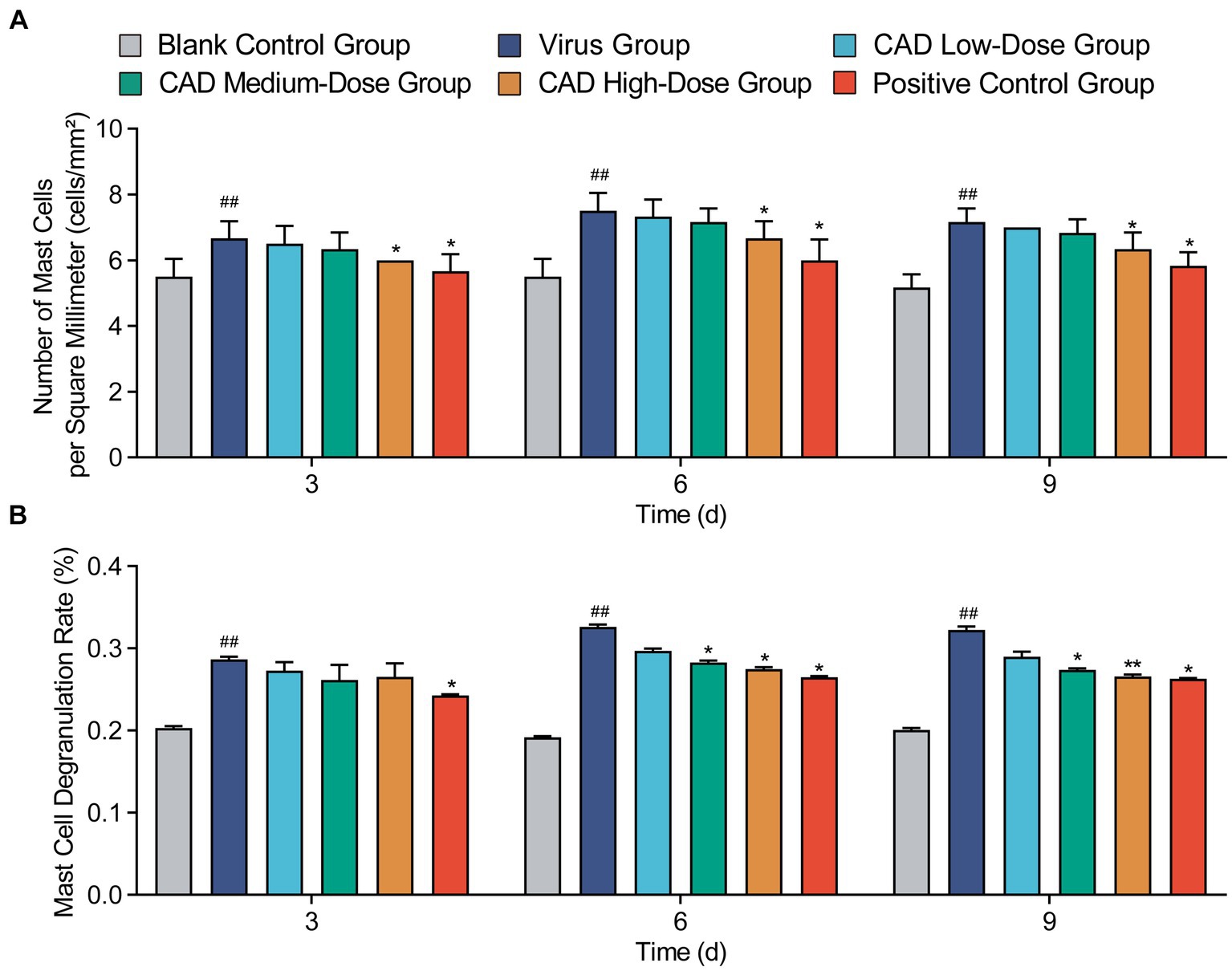 Figura 5. Variaciones en los recuentos de mastocitos y las tasas de degranulación en los tejidos pulmonares después de la infección por el virus H9N2 y el tratamiento con EAC. (A) El recuento de mastocitos (MC) en los tejidos pulmonares de pollos en diferentes grupos. (B) La tasa de degranulación de los mastocitos (MC) en los tejidos pulmonares de los pollos en varios grupos. Los experimentos se realizaron por triplicado y se muestra la media ± De (n = 6). Los valores de p se determinaron mediante ANOVA unidireccional no paramétrico. En comparación con el grupo de virus, p < 0,05 y p < 0,01. En comparación con el grupo control, p < 0,05 y p < 0,01.***###
Figura 5. Variaciones en los recuentos de mastocitos y las tasas de degranulación en los tejidos pulmonares después de la infección por el virus H9N2 y el tratamiento con EAC. (A) El recuento de mastocitos (MC) en los tejidos pulmonares de pollos en diferentes grupos. (B) La tasa de degranulación de los mastocitos (MC) en los tejidos pulmonares de los pollos en varios grupos. Los experimentos se realizaron por triplicado y se muestra la media ± De (n = 6). Los valores de p se determinaron mediante ANOVA unidireccional no paramétrico. En comparación con el grupo de virus, p < 0,05 y p < 0,01. En comparación con el grupo control, p < 0,05 y p < 0,01.***###
3.6 Supresión de la expresión del factor inflamatorio en pulmones de pollo con cecropina
El tratamiento con cecropina AD influyó notablemente en los niveles de varios factores inflamatorios clave en los pulmones de pollo. Tanto las dosis medias como las altas redujeron significativamente los niveles de IL-6 después de 6 y 9 días de tratamiento en comparación con el grupo del virus (p < 0,01), y la dosis media mostró una eficacia similar a la de la medicina occidental (p > 0,05, Figura 6A). En todas las dosis, la cecropina AD disminuyó sustancialmente los niveles de TNF-α después de 3, 6 y 9 días de tratamiento (p < 0,01), y la dosis alta logró resultados comparables a los de la medicina occidental (p > 0,05, Figura 6B). En particular, la dosis alta de cecropina AD redujo significativamente los niveles de IFN-γ después de 3 días de tratamiento, a la par con el grupo de medicina occidental (p > 0,05, Figura 6C). Además, las dosis altas y medias de cecropina AD fueron efectivas para reducir significativamente los niveles de 5-HT después de 3, 6 y 9 días (p < 0,01), y la dosis alta reflejó la eficacia de la medicina occidental (p > 0,05, Figura 6D).
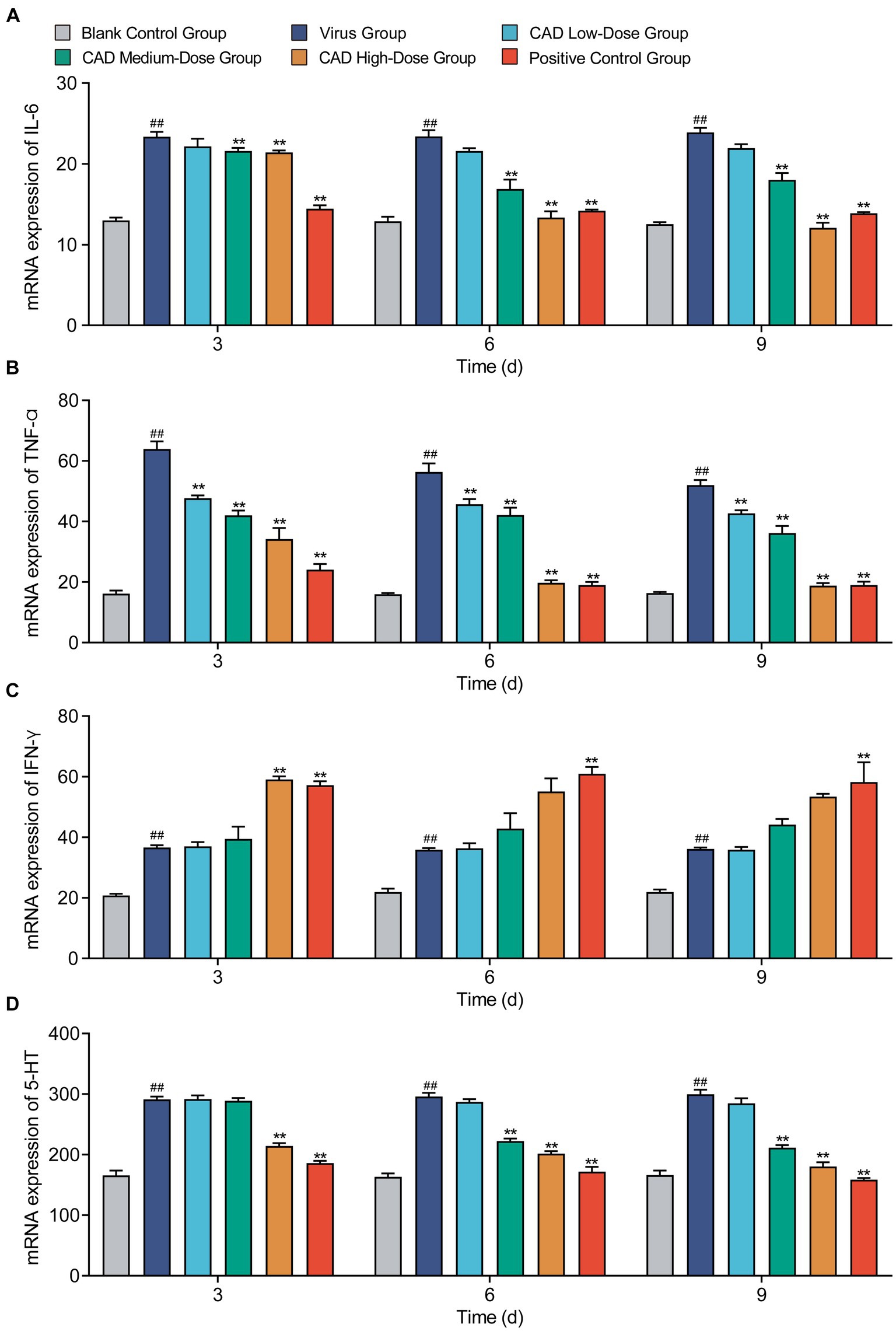 Figura 6. Cambios en los niveles de citocinas después de la infección por el virus H9N2 y el tratamiento con EAC. (A-D) Variaciones en los niveles de IL-6 (A), IFN-α (B), IFN-γ (C) y 5-HT (D) en diferentes grupos de tratamiento a lo largo del tiempo. Los experimentos se realizaron por triplicado y se muestra la media ± S.D. (n = 6). Los valores de p se determinaron mediante ANOVA unidireccional no paramétrico. En comparación con el grupo de virus, p < 0,05 y p < 0,01. En comparación con el grupo control, p < 0,05 y p < 0,01.***###
Figura 6. Cambios en los niveles de citocinas después de la infección por el virus H9N2 y el tratamiento con EAC. (A-D) Variaciones en los niveles de IL-6 (A), IFN-α (B), IFN-γ (C) y 5-HT (D) en diferentes grupos de tratamiento a lo largo del tiempo. Los experimentos se realizaron por triplicado y se muestra la media ± S.D. (n = 6). Los valores de p se determinaron mediante ANOVA unidireccional no paramétrico. En comparación con el grupo de virus, p < 0,05 y p < 0,01. En comparación con el grupo control, p < 0,05 y p < 0,01.***###
4 Discusión
La investigación de nuestro estudio sobre la eficacia de la EAC contra el virus de la influenza aviar (AIV) H9N2 en pollos corrobora y amplía la investigación existente sobre péptidos antivirales. Observamos una reducción significativa de la patología pulmonar y de la carga viral en los grupos tratados con EAC, haciéndose eco de los hallazgos anteriores y destacando el potencial de la EAC en el tratamiento de las infecciones virales respiratorias (20). La disminución dependiente de la dosis en la replicación viral en los tejidos pulmonares es especialmente relevante dada la rápida tasa de mutación del virus H9N2 AIV, que plantea desafíos para los tratamientos convencionales. Además, la modulación de marcadores inflamatorios clave, como la IL-6 y el TNF-α (21), en nuestro estudio se alinea con los efectos antiinflamatorios documentados de péptidos similares (22). Estos hallazgos respaldan el potencial terapéutico de la EAC en el manejo de la inflamación inducida por virus y se suman a la evidencia que respalda los péptidos antimicrobianos como alternativas a las terapias antivirales tradicionales (23, 24), especialmente en el contexto de la creciente resistencia a los medicamentos y las preocupaciones de seguridad.
Nuestra investigación en profundidad de los mecanismos de la cecropina AD (CAD) contra el virus de la influenza aviar (AIV) H9N2 delinea su enfoque multifacético. La reducción significativa observada en la carga viral, particularmente con dosis más altas, implica la eficacia de la EAC en la interrupción de las estructuras virales o en la obstaculización de la replicación (25). Además, el papel de la EAC en la atenuación de la patología pulmonar y la disminución de las citoquinas inflamatorias subraya su capacidad para modular las respuestas inmunitarias (16, 26). Esta doble funcionalidad, que equilibra hábilmente las acciones antivirales e inmunomoduladoras, es esencial en el manejo de infecciones en las que la inflamación excesiva es perjudicial. Nuestro estudio destaca además la importancia de la optimización de la dosis en la aplicación terapéutica de la CAD, evidenciada por los pronunciados efectos dependientes de la dosis. La dosificación precisa es clave para lograr un equilibrio terapéutico óptimo, especialmente en la industria avícola, donde la seguridad y la eficacia del tratamiento son de suma importancia (27). La versatilidad del CAD en la reducción de la replicación viral y la modulación de las respuestas inflamatorias lo convierte en un agente potencial para aplicaciones más amplias en la salud de las aves de corral y posiblemente en la terapéutica humana (25).
Esta investigación sobre la eficacia de la cecropina AD (CAD) contra el virus de la influenza aviar (AIV) H9N2 en pollos ofrece información crucial para el manejo de la salud de las aves de corral y consideraciones de salud pública más amplias. El notable impacto de la EAC en la reducción de la carga viral, el alivio de la patología pulmonar y la modulación de las respuestas inflamatorias subraya su potencial como una intervención eficaz contra las enfermedades aviares. La importancia de estos hallazgos se vuelve particularmente pertinente a la luz de los desafíos actuales en el manejo de los brotes de AIV, que tienen importantes ramificaciones económicas y sanitarias para el sector avícola. El papel de CAD en la disminución del impacto económico de las infecciones por AIV y en la mejora de la salud general de las aves de corral es encomiable. Más allá de la salud de las aves, las implicaciones de este estudio se extienden a un contexto más amplio. Las propiedades antivirales y antiinflamatorias de la enfermedad coronaria subrayan el potencial de los péptidos antimicrobianos para tratar diversas infecciones virales, particularmente en medio de las preocupaciones sobre las cepas resistentes a los medicamentos y la búsqueda de agentes antivirales seguros y efectivos. Las futuras vías de investigación que justifican la exploración incluyen profundizar en los mecanismos de acción de CAD, su perfil de seguridad y el potencial para el desarrollo de resistencia. En resumen, nuestros hallazgos contribuyen al creciente cuerpo de evidencia que respalda el uso de péptidos antimicrobianos como la enfermedad coronaria en el manejo de infecciones virales, ofreciendo una nueva estrategia de doble acción contra la replicación viral y la inflamación para aplicaciones terapéuticas más amplias. Sin embargo, nuestro estudio no está exento de limitaciones. Si bien centrarse en los pollos proporciona datos iniciales valiosos, restringe la aplicabilidad de los hallazgos a otras especies. Es posible que los entornos de laboratorio controlados no imiten por completo los entornos naturales en los que prevalece la VIA. El tamaño de la muestra, adecuado para investigaciones preliminares, requiere una ampliación en estudios posteriores para mejorar la robustez. Además, aún no se han abordado los efectos a largo plazo y el posible desarrollo de resistencia contra la CAD, que son aspectos críticos para comprender su eficacia duradera y utilidad práctica. Los estudios futuros deberían ampliar el alcance para incluir diversas especies de aves y ensayos de campo, lo que permitiría una evaluación más completa de la eficacia de la CAD. Investigar el papel de la CAD en escenarios de coinfección, comunes en entornos avícolas, y dilucidar sus mecanismos moleculares son vitales para optimizar su aplicación y desarrollar formulaciones mejoradas. Además, la exploración de la aplicación de CAD en la medicina humana, especialmente para los virus respiratorios, presenta una vía fascinante para la investigación. Nuestro estudio sienta las bases para una mayor exploración del papel de la cecropina AD como agente antiviral, con el objetivo de aprovechar al máximo sus capacidades en el manejo de infecciones virales tanto en contextos veterinarios como potencialmente humanos.
5 Conclusión
Nuestro estudio destaca el importante papel de la cecropina AD en la mitigación del daño pulmonar y el edema pulmonar causados por el virus de la influenza aviar (AIV) H9N2 en pollos. La cecropina AD inhibe eficazmente la replicación del virus H9N2 AIV en los pulmones y modula las citocinas séricas clave, como la IL-6, el TNF-α, el IFN-γ y el 5-HT. Esta modulación da como resultado una reducción notable de la respuesta inflamatoria, lo que conduce a un efecto antiviral significativo. Estos hallazgos demuestran el potencial de la cecropina AD para preservar la salud respiratoria en las especies aviares, mostrando su eficacia como medida terapéutica y potencialmente preventiva contra las infecciones respiratorias virales.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo/material complementario, las consultas adicionales pueden dirigirse al autor correspondiente.
Declaración ética
El estudio en animales fue aprobado por el Instituto de Ganadería y Medicina Veterinaria (número de permiso: BUA2022070). El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
TaiZ: Investigación, Visualización, Escritura – borrador original. ZL: Curación de datos, visualización, escritura – borrador original. YZ: Curación de datos, Análisis formal, Redacción – revisión y edición, Visualización. XZ: Curación de datos, análisis formal, redacción, revisión y edición. MD: Administración de proyectos, Supervisión, Redacción, revisión y edición. QZ: Administración de proyectos, supervisión, redacción, revisión y edición. TaoZ: Adquisición de fondos, administración de proyectos, supervisión, redacción, revisión y edición. GH: Obtención de fondos, administración de proyectos, supervisión, redacción, revisión y edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este estudio contó con el apoyo del Programa Nova de Beijing (Nº 20220484226, China) y la Fundación Nacional de Ciencias Naturales de China (Nº 32273050, China).
Reconocimientos
Los autores desean agradecer a todos los pacientes y médicos que participaron en este estudio por su cooperación.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Jaleel, S, Younus, M, Idrees, A, Arshad, M, Khan, AU, Ehtisham-Ul-Haque, S, et al. Alteraciones patológicas en el sistema respiratorio durante la coinfección con el virus de la influenza aviar de baja patogenicidad (H9N2) y Escherichia Coli en pollos de engorde. J Vet Res. (2017) 61:253–8. doi: 10.1515/jvetres-2017-0035
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Arbi, M, Larbi, I, Nsiri, J, Behi, IE, Rejeb, A, Miled, K, et al. Inhibición de la infección por el virus de la influenza aviar H9N2 por hexapéptidos antivirales que se dirigen a la unión viral a las células epiteliales. Virus Res. (2022) 313:198745. doi: 10.1016/j.virusres.2022.198745
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Peacock, T, Reddy, K, James, J, Adamiak, B, Barclay, W, Shelton, H, et al. El mapeo antigénico de un virus de influenza aviar H9N2 revela dos sitios antigénicos discretos y un nuevo mecanismo de escape inmunológico. Sci Rep. (2016) 6:18745. doi: 10.1038/srep18745
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Li, W, Liu, Q, Shi, J, Xu, X y Xu, J. El papel del TNF-α en la regulación del destino y la reprogramación funcional de las células madre mesenquimales en un microambiente inflamatorio. Frente Immunol. (2023) 14:1074863. doi: 10.3389/fimmu.2023.1074863
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Yiminand Kohanawa, M . Un efecto regulador del equilibrio entre TNF-alfa e IL-6 en la respuesta granulomatosa e inflamatoria a la infección por Rhodococcus aurantiacus en ratones. J Immunol. (2006) 177:642–50. doi: 10.4049/jimmunol.177.1.642
6. Zhao, G, Liu, C, Kou, Z, Gao, T, Pan, T, Wu, X, et al. Diferencias en la patogenicidad y las respuestas inflamatorias inducidas por la infección por el virus de la influenza aviar A/H7N9 en modelos de ratón BALB/c y C57BL/6. PLoS Uno. (2014) 9:E92987. doi: 10.1371/journal.pone.0092987
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Califano, D, Furuya, Y, Roberts, S, Avram, D, Mckenzie, ANJ, y Metzger, DW. El IFN-γ aumenta la susceptibilidad a la infección por influenza A a través de la supresión de las células linfoides innatas del grupo II. Inmunol. Mucosa. (2018) 11:209–19. doi: 10.1038/mi.2017.41
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Graham, AC, Hilmer, KM, Zickovich, JM y Obar, JJ. La respuesta inflamatoria de los mastocitos durante la infección por el virus de la influenza A está mediada por la infección activa y la señalización RIG-I. J Immunol. (2013) 190:4676–84. doi: 10.4049/jimmunol.1202096
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Mookherjee, N, Anderson, MA, Haagsman, HP, y Davidson, DJ. Péptidos antimicrobianos de defensa del huésped: funciones y potencial clínico. Nat Rev Droga Discov. (2020) 19:311–32. doi: 10.1038/s41573-019-0058-8
10. Peng, J, Mishra, B, Khader, R, Felix, L y Mylonakis, E. Nuevos péptidos derivados de la cecropina-4 contra Staphylococcus aureus resistente a la meticilina. Antibióticos. (2021) 10:36. doi: 10.3390/antibióticos10010036
11. Wu, Q, Patočka, J y Kuča, K. Péptidos antimicrobianos de insectos, una mini revisión. Toxinas. (2018) 10:461. doi: 10.3390/toxinas10110461
12. Boman, HG, Nilsson-Faye, I, Paul, K y Rasmuson, T Jr. Inmunidad a los insectos. I. Características de una reacción antibacteriana libre de células inducible en hemolinfa de pupas de Samia cynthia. Infectar a Immun. (1974) 10:136–45. DOI: 10.1128/iai.10.1.136-145.1974
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Faye, I, Pye, A, Rasmuson, T, Boman, HG, y Boman, IA. Inmunidad a los insectos. 11. Inducción simultánea de actividad antibacteriana y síntesis selectiva de algunas proteínas de hemolinfa en pupas en diapausa de Hyalophora cecropia y Samia cynthia. Infectar a Immun. (1975) 12:1426–38. doi: 10.1128/iai.12.6.1426-1438.1975
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Wang, M, Lin, J, Sun, Q, Zheng, K, Ma, Y y Wang, J. Diseño, expresión y caracterización de un nuevo péptido derivado de la cecropina A con alta actividad antibacteriana. Aplicación Microbiol Biotechnol. (2019) 103:1765–75. doi: 10.1007/s00253-018-09592-z
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Wang, J, Ma, K, Ruan, M, Wang, Y, Li, Y, Fu, YV, et al. Un nuevo péptido derivado de la cecropina B con propiedades antibacterianas y potenciales antiinflamatorias. PeerJ. (2018) 6:e5369. doi: 10.7717/peerj.5369
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Zhai, Z, Zhang, F, Cao, R, Ni, X, Xin, Z, Deng, J, et al. La cecropina A alivia la inflamación mediante la modulación de la microbiota intestinal de ratones C57BL/6 con EII inducida por DSS. Microbiol frontal. (2019) 10:1595. doi: 10.3389/fmicb.2019.01595
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Zhi, Y, Li, T, Li, Y, Zhang, T, Du, M, Zhang, Q, et al. Papel protector de Cecropin AD contra la lesión de la mucosa intestinal inducida por LPS en pollos. Frente Immunol. (2023) 14:1290182. doi: 10.3389/fimmu.2023.1290182
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Amevor, FK, Cui, Z, Ning, Z, Du, X, Jin, N, Shu, G, et al. Efectos sinérgicos de la quercetina y la vitamina E en la producción de huevos, la calidad de los huevos y la inmunidad en gallinas reproductoras envejecidas. Poult Sci. (2021) 100:101481. doi: 10.1016/j.psj.2021.101481
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Livak, KJ, y Schmittgen, TD. Análisis de los datos relativos de expresión génica mediante PCR cuantitativa en tiempo real y los 2−ΔΔCT método. Métodos. (2001) 25:402–8. doi: 10.1006/meth.2001.1262
20. Hiemstra, PS, Amatngalim, GD, van der Does, AM y Taube, C. Péptidos antimicrobianos y defensas pulmonares innatas: papel en enfermedades pulmonares infecciosas y no infecciosas y aplicaciones terapéuticas. Pecho. (2016) 149:545–51. doi: 10.1378/chest.15-1353
21. Wang, T y He, C. TNF-α e IL-6: el vínculo entre el sistema inmunológico y el óseo. Curr Drug Targets. (2020) 21:213–27. doi: 10.2174/1389450120666190821161259
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Rima, M, Rima, M, Fajloun, Z, Sabatier, JM, Bechinger, B y Naas, T. Péptidos antimicrobianos: una potente alternativa a los antibióticos. Antibióticos. (2021) 10:1095. doi: 10.3390/antibióticos10091095
23. Chaudhary, S, y Mahfouz, MM. Cultivo molecular de péptidos antimicrobianos. Nat Rev Bioeng. (2023) 2:3–5. doi: 10.1038/s44222-023-00149-y
24. Freitas, ED, Bataglioli, RA, Oshodi, J y Beppu, MM. Péptidos antimicrobianos y su posible aplicación en agentes de recubrimiento antivirales. Coloides Surf B. (2022) 217:112693. doi: 10.1016/j.colsurfb.2022.112693
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Rajik, M, Jahanshiri, F, Omar, AR, Ideris, A, Hassan, SS y Yusoff, K. Identificación y caracterización de un nuevo péptido antiviral contra el virus de la gripe aviar H9N2. Virol J. (2009) 6:74. doi: 10.1186/1743-422X-6-74
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Lin, J, Xia, J, Chen, YT, Zhang, KY, Zeng, Y y Yang, Q. El virus de la influenza aviar H9N2 mejora las respuestas inmunitarias de los BMDC al regular a la baja miR29c. Vacuna. (2017) 35:729–37. doi: 10.1016/j.vaccine.2016.12.054
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Zhang, N, Zhou, M, Yan, X, Liu, J, Yuan, S, Yang, H, et al. Integración farmacocinética y farmacodinámica de tilmicosina frente a Mycoplasma gallisepticum en el sitio de infección diana en pollos. Front Vet Sci. (2022) 9:952599. doi: 10.3389/fvets.2022.952599
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: Virus de la influenza aviar H9N2, cecropina AD, salud pulmonar, modulación de la respuesta inmunitaria, inhibición viral
Cita: Zhang T, Liu Z, Zhi Y, Zhao X, Du M, Zhang Q, Zhang T y Hu G (2024) La cecropina AD reduce la carga viral y la respuesta inflamatoria contra el virus de la influenza aviar H9N2 en pollos. Frente. Vet. Sci. 11:1369863. doi: 10.3389/fvets.2024.1369863
Recibido: 13 de enero de 2024; Aceptado: 14 de marzo de 2024;
Publicado: 28 Marzo 2024.
Editado por:
Kun Li, Universidad Agrícola de Nanjing, China
Revisado por:
Liwei Guo, Universidad de Yangtsé, China
Ilias Giannenas, Universidad Aristóteles de Tesalónica, Grecia
Guangjun Wang, Academia China de Ciencias Médicas Chinas, China
Derechos de autor © 2024 Zhang, Liu, Zhi, Zhao, Du, Zhang, Zhang y Hu. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY). S
*Correspondencia: Ge Hu, bnhuge@126.com
†Estos autores han contribuido igualmente a este trabajo
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía