La colonización intestinal con Campylobacter jejuni afecta a la microbiota intestinal de los pollos

La colonización intestinal con Campylobacter jejuni afecta a la composición de la microbiota intestinal de los pollos de engorde, pero no es inhibida por la ingesta diaria de Lactiplantibacillus plantarum
 Eliška Valečková1*
Eliška Valečková1*  Li Sol1
Li Sol1  Helen Wang2
Helen Wang2  Faruk Dube3
Faruk Dube3  Emma Ivarsson1
Emma Ivarsson1  Kamyar Mogodiniyai Kasmaei1
Kamyar Mogodiniyai Kasmaei1  Patrik Ellström4
Patrik Ellström4  Muro de Helena1
Muro de Helena1- 1Departamento de Nutrición y Gestión Animal, Universidad Sueca de Ciencias Agrícolas, Uppsala, Suecia
- 2Departamento de Bioquímica Médica y Microbiología, Universidad de Uppsala, Uppsala, Suecia
- 3Departamento de Ciencias Biomédicas y Salud Pública Veterinaria, Universidad Sueca de Ciencias Agrícolas, Uppsala, Suecia
- 4Departamento de Ciencias Médicas, Centro de Ciencias de la Zoonosis, Universidad de Uppsala, Uppsala, Suecia
Introducción: Los lactobacilos pueden prevenir la colonización de pollos de engorde con Campylobacter spp. y otras bacterias zoonóticas gramnegativas a través de la producción de ácido láctico y la modulación de la microbiota intestinal. Este estudio evaluó los efectos de la ingesta diaria de Lactiplantibacillus plantarum 256 (LP256) sobre las cargas de Campylobacter jejuni (C. jejuni) en ceca y heces de pollos de engorde desafiados por C. jejuni, junto con los cambios en la microbiota intestinal.
Métodos: Se realizaron dos experimentos utilizando los pollos de engorde Ross 308 (R-308; Experimento 1) durante 42 días y pollos de engorde Rowan Ranger (RR; Experimento 2) durante 63 días. La cepa LP256 se administró a través de ensilaje inoculado con LP256 o suplementación directa en el agua potable. Al mismo tiempo, se probó el heno como forraje similar al ensilaje pero sin ningún inóculo. Las cargas de C. jejuni en materia fecal y contenido cecal se determinaron mediante recuentos en placa y qPCR, respectivamente. La microbiota cecal, en respuesta a los tratamientos y al desafío, se evaluó mediante secuenciación de ARNr 16S.
Resultados y discusión: Los resultados del cultivo mostraron una reducción significativa en la colonización por C. jejuni (2,01 log) en el tratamiento de ensilaje en comparación con el control a 1 dpi (día después de la infección) en el Experimento 1. Sin embargo, no se observó ningún efecto del tratamiento sobre C. jejuni al final del experimento. En el Experimento 2, no se encontró que los efectos del tratamiento sobre la colonización por C. jejuni fueran estadísticamente significativos. La comparación de la carga de colonización en el pico de infección (3 dpi) con la del final del ensayo (32 dpi) reveló una reducción significativa de C. jejuni en todos los grupos, independientemente del tratamiento. La dinámica de colonización de C. jejuni en las muestras cecal analizadas por qPCR no mostró diferencias entre ninguno de los tratamientos en el Experimento 1 o 2. En ambos experimentos, no se observaron efectos del tratamiento sobre la microbiota cecal. Sin embargo, se observaron cambios proporcionales en la composición bacteriana después del desafío de C. jejuni, lo que sugiere que la colonización afectó a la microbiota intestinal. En general, la ingesta diaria de LP256 no fue efectiva para reducir la colonización por C. jejuni en ninguno de los tipos de pollos de engorde al final del período de cría y no causó ningún cambio significativo en la composición de la microbiota cecal de las aves.
1. Introducción
Se cree que la ceca tiene un papel importante en la salud intestinal y el rendimiento de las aves de engorde. Sin embargo, su papel en el mantenimiento de la salud intestinal y la modulación de la microbiota intestinal aún no se comprende completamente. Como el hábitat microbiano más densamente colonizado en pollos de engorde, su densidad microbiana se estima en 1011–1012 células bacterianas por gramo (Rinttilä y Apajalahti, 2013). La descripción y comprensión de las comunidades microbianas intestinales y sus interacciones son esenciales para el desarrollo de aditivos para piensos y cambios en la dieta para mejorar la salud, el rendimiento y el bienestar de los pollos de engorde (Sugiharto, 2016). Una amplia variedad de suplementos alimenticios, como prebióticos, probióticos y ácidos orgánicos, se centran en la estabilización de la microbiota intestinal para asegurar la salud intestinal (Yang et al., 2009).
Los probióticos son microbios naturales que benefician a su huésped fundamentalmente a través de su acción en el tracto gastrointestinal (Abd El-Hack et al., 2020). Las especies probióticas de una sola cepa, incluidas, entre otras, especies de Bifidobacterium, Bacillus, Enterococcus, Streptococcus y Lactobacillus, han mostrado previamente efectos positivos en el rendimiento de los pollos de engorde, la modulación del microbioma intestinal y la inhibición de patógenos a través de diferentes principios, es decir, exclusión competitiva, producción de ácidos orgánicos o producción de compuestos antimicrobianos (Neal-McKinney et al., 2012; Prabhurajeshwar y Chandrakanth, 2019; Krysiak et al., 2021). Además, se ha demostrado que los probióticos ayudan a mantener la homeostasis microbiana, evitando así la colonización por patógenos, y pueden suprimir la colonización por Campylobacter (Di Marcantonio et al., 2022).
La campilobacteriosis es la zoonosis más comúnmente reportada en la Unión Europea (UE), donde los productos de pollos de engorde son una fuente común de infección debido a un tratamiento térmico insuficiente o contaminación cruzada. Según la Autoridad Europea de Seguridad Alimentaria (EFSA), el 58% de las infecciones humanas por Campylobacter jejuni (C. jejuni) están asociadas con carne de pollo de engorde (EFSA, 2020). Se ha demostrado que los piensos para aves de corral con pH bajo y un alto número de bacterias del ácido láctico (LAB) reducen la susceptibilidad a la colonización por Campylobacter en pollos de engorde (Heres et al., 2003). Este efecto podría explicarse por los principios de inhibición de patógenos mencionados anteriormente.
Aunque la prevalencia de Campylobacter en la producción de pollos de engorde convencionales en Suecia es actualmente baja, el problema sigue estando en la producción orgánica. En 2021, el 5% de los lotes convencionales probados fueron positivos para Campylobacter en el sacrificio, mientras que en la producción orgánica, el 33% de las parvadas analizadas fueron positivas (Asociación Sueca de Carne de Aves de Corral, 2021). La mayor frecuencia en este último se debe al acceso a reservorios al aire libre de Campylobacter, ya que todas las aves de corral ecológicas de la UE deben tener la oportunidad de pasar tiempo al aire libre (Reglamento (CE) 889/2008 de la Comisión, 2008). Además, las aves de corral orgánicas deben tener acceso diario al forraje donde se proporciona ensilaje en algunas granjas de pollos de engorde orgánicos (Crawley, 2015).
Este estudio tuvo como objetivo investigar los efectos de la ingesta diaria de Lactiplantibacillus plantarum cepa 256 (L. plantarum 256; LP256) sobre la carga de C. jejuni en el ciego y las heces de los pollos de engorde, junto con los cambios en su microbiota intestinal. En la agricultura orgánica, el ensilaje se puede suministrar como forraje a los pollos de engorde y, por lo tanto, evaluamos la eficiencia de proporcionar LP256 tanto a través del ensilaje inoculado con la cepa como a través de la suplementación directa en el agua potable. Al mismo tiempo, se probó el impacto del heno como forraje similar al ensilaje pero sin ningún inóculo. Los efectos de los tratamientos se evaluaron en pollos de engorde de crecimiento lento (aves utilizadas en la producción orgánica) y de crecimiento rápido (producción convencional) en dos ensayos separados bajo el desafío de C. jejuni.
2. Materiales y métodos
2.1. Diseño experimental y vivienda
El entorno experimental fue descrito previamente en detalle por Valečková et al. (2020); A continuación se presenta una breve descripción. Se realizaron dos experimentos simultáneamente en el Centro Sueco de Investigación Ganadera de la Universidad Sueca de Ciencias Agrícolas, con la aprobación del comité de ética animal de la región de Uppsala (número de aprobación 5.8.18-16271/2017). Los experimentos se realizaron utilizando pollos de engorde de rápido crecimiento Ross 308 (R-308), utilizados en la producción convencional en Suecia, y los pollos de engorde Rowan Ranger (RR), con un crecimiento más lento preferido en, por ejemplo, la producción de pollos de engorde orgánicos. En el Experimento 1, se utilizaron un total de 160 pollos de engorde R-308 de un día sin sexar para el experimento de 42 días (6 semanas), que se considera un período normal de crecimiento para las cepas de rápido crecimiento en la UE. En el Experimento 2, se utilizaron un total de 160 pollos de engorde RR de un día sin sexar (también conocidos como «pollos de engorde de crecimiento lento») en el experimento 63-d (9 semanas) correspondiente a la edad a la que este tipo de pollos de engorde generalmente se sacrifica en sistemas de producción orgánica en Suecia. En cada estudio, los pollos de engorde se distribuyeron aleatoriamente en grupos de ocho individuos en 20 corrales criados con cuatro tratamientos dietéticos y cinco réplicas de plumas para cada tratamiento, dispuestas en un diseño de bloque aleatorio. En ambos estudios, se eligieron dos pollos de engorde al azar por corral como aves focales, representantes de toda la población de corrales. Los focales se utilizaron más tarde para la recolección de excrementos fecales para la cuantificación de C. jejuni mediante cultivo en placa de agar y al final del experimento para el muestreo del contenido de cecal para un ensayo cuantitativo de reacción en cadena de la polimerasa (qPCR) en tiempo real para cuantificar las cargas de C. jejuni y para el análisis de la microbiota realizado mediante secuenciación de ARNr 16S.
Los experimentos se realizaron en paralelo durante el invierno en un establo aislado equipado con las instalaciones para el control automático de la temperatura y la luz. Cada corral tenía un piso cubierto por virutas de madera fresca y estaba equipado con un alimentador de metal y un bebedero de campana de 3 litros.
2.2. Dietas experimentales
Las especificaciones detalladas de la dieta y la preservación del forraje se establecen en Valečková et al. (2020). En resumen, se proporcionaron alimento fresco y agua (incluidos los tratamientos) directamente después de la llegada de los pollos de engorde y se suministraron diariamente. Todas las dietas experimentales se basaron en piensos compuestos orgánicos (13 MJ/kg de energía metabolizable y 230 g/kg de proteína bruta MS) y se estimó la necesidad diaria de pellets en todos los grupos de tratamiento (en función de los objetivos de rendimiento de producción) para garantizar la provisión ad libitum. Los pollos de engorde se asignaron a cuatro grupos de tratamiento diferentes: ensilaje, heno, LP256 o control. El tratamiento con heno se incluyó en el estudio como forraje similar al ensilaje pero sin ningún inóculo. Las dietas experimentales de ensilaje y heno se compusieron como raciones mixtas totales (TMR) que contenían 85% de pellets y 15% de forraje respectivo (sobre una base de MS). Además, el LP256 y los grupos de control recibieron el alimento compuesto orgánico peletizado (sin forraje proporcionado). El grupo LP256 tenía agua potable inoculada con L. plantarum 256 (107 UFC/ml).
La hierba de segundo corte, con una composición de siembra de 70% de timoteo y 30% festuca de pradera, se utilizó para la producción de forrajes. El ensilaje se inoculó con L. plantarum cepa 256 durante el empacado, proporcionando una concentración de inóculo de 108 UFC por gramo de materia fresca. Las pacas de heno se hicieron sin inóculo. Después de 3 meses de almacenamiento, las pacas se abrieron por separado, se cortaron y luego se molieron a partículas de 0,5-1 cm. El forraje se envasó al vacío (1 kg por bolsa) y las bolsas se almacenaron a una temperatura inferior a 0 ° C para mantener una calidad de alimentación similar a lo largo de los experimentos. La enumeración de laboratorio epífita en ensilaje se realizó por duplicados mensualmente (enero, febrero y marzo) durante el período de prueba y el pH del jugo de ensilaje se midió antes de los ensayos.
2.3. Cepas bacterianas y condiciones de cultivo
Las cepas bacterianas utilizadas en este estudio incluyen L. plantarum 256 y Campylobacter jejuni #65. La cepa de L. plantarum (también conocida como L. plantarum NC7, Cosby et al., 1989) se utilizó previamente en nuestros experimentos in vitro y demostró entre otros laboratorios obtener el mejor efecto inhibitorio contra C. jejuni # 65 (datos no publicados). El aislado de L. plantarum cepa 256 se almacenó a – 80 °C en caldo Luria Bertani (LB) con 20% de glicerol. Se propagó en caldo De Man, Rogosa y Sharpe durante 24 h a 37 °C para la preparación de ensilaje y como probiótico profiláctico en el estudio. C. jejuni #65 (ST-104, en ST-21 CC; aislado de un pollo de engorde en el Reino Unido 2006) se cultivó en caldo Brucella a 42°C en condiciones microaeróbicas (85% N2, 10% CO2, 5% O2) durante 24 h. Después de 24 h de incubación, se utilizó la densidad óptica a 405 nm y los recuentos de placas para determinar la dosis de infección utilizada en el desafío de C. jejuni.
2.4. Colonización y cuantificación por Campylobacter jejuni
Para investigar los efectos de los tratamientos de L. plantarum en la colonización por C. jejuni de la ceca de los pollos de engorde, todas las aves fueron desafiadas oralmente (también denominadas «infectadas») a los 22 días de edad en el Experimento 1 y 29 días de edad (correspondiente a las 4 semanas de edad en las que los pollos de engorde orgánicos en Suecia deben tener acceso a un ambiente al aire libre) en el Experimento 2 (Figura 1). El día del reto, 0,5 L de agua con 106 Se proporcionó UFC/ml de la cepa #65 de C. jejuni en el bebedero de campana de cada pluma. El agua inoculada se administró durante 3 h y la viabilidad de C. jejuni en el agua se determinó mediante recuentos de colonias en placas de agar sangre al inicio y al final del desafío.
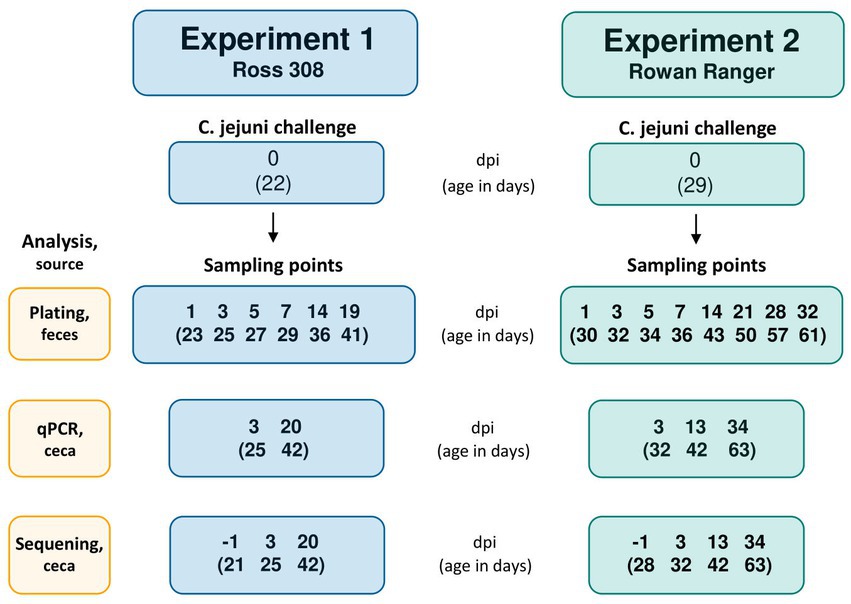 Figura 1. Diagrama de flujo con la ocasión del desafío Campylobacter jejuni y siguientes puntos de muestreo en el Experimento 1 (R-308) y el Experimento 2 (RR). La ocasión de desafío y los puntos de muestreo se presentan como días después de la infección (dpi), con la edad correspondiente de las aves (en días) indicada entre paréntesis.
Figura 1. Diagrama de flujo con la ocasión del desafío Campylobacter jejuni y siguientes puntos de muestreo en el Experimento 1 (R-308) y el Experimento 2 (RR). La ocasión de desafío y los puntos de muestreo se presentan como días después de la infección (dpi), con la edad correspondiente de las aves (en días) indicada entre paréntesis.
El patrón de colonización de C. jejuni fue monitoreado durante 19 días y 32 días para R-308 y RR, respectivamente, por cultivo fecal y recuentos de colonias en placas de agar Charcole Cefoperazone Deoxycholate (mCCDA) modificadas. Para el muestreo fecal fresco, se colocaron dos aves focales de cada corral individualmente en cajas de plástico. Se utilizaron bucles de plástico estériles para la recolección de excrementos del fondo de la caja. Se recolectaron muestras fecales de todos los corrales 1 día antes del desafío con C. jejuni, para verificar que los pollos de engorde eran Campylobacter negativos antes del desafío. Cien mg de excrementos fecales frescos de las aves focales en cada corral se recolectaron en medio de 1 ml de LB suplementado con glicerol al 20% en 1, 3, 5, 7, 14 y 19 días después de la infección (dpi) en el Experimento 1 y 1, 3, 5, 7, 14, 21, 28 y 32 dpi en el Experimento 2 (Figura 1). Los tubos se transportaron directamente en hielo al laboratorio para su análisis. Las muestras fueron vortexed y centrifugadas (100 × g durante 15 s) para granular materia fecal cruda. A continuación, se retiraron 100 μL y se diluyeron en serie en una serie de dilución de 10 veces. Posteriormente, se colocaron 100 μL en mCCDA y se incubaron durante 26 h a 42 °C en condiciones microaeróbicas (Campygen, Thermo Fisher). Después de la incubación, las colonias se contaron en la placa correspondiente a la dilución que dio aproximadamente 100 UFC por placa. Los datos de recuentos de placas sin procesar se proporcionan en la Figura Suplementaria 1 (Experimento 1) y la Figura Suplementaria 2 (Experimento 2).
2.5. Recogida de muestras cecales
En ambos experimentos, un ave aleatoria por jaula fue sacrificada 1 día antes de la infección (−1 dpi) y 3 días después de la infección (3 dpi) mediante una inyección intravenosa de pentobarbital de sodio a través de la vena del ala; la edad de las aves correspondiente a los dpi mencionados se indica en la Figura 1. El contenido de cecal se muestreó con un procedimiento aséptico en microtubos de tapón de rosca de 2,0 ml (Sarstedt AG & Co, Alemania) y se colocó en nitrógeno líquido (seguido de almacenamiento a – 80 ° C hasta su análisis). A los 42 días de edad, todas las aves focales en el Experimento 1 (20 dpi), y un ave aleatoria en cada réplica en el Experimento 2 (13 dpi) fueron sacrificadas y muestreadas. Experimento 2 aves focales fueron sacrificadas a los 63 días de edad (34 dpi) seguido de muestreo cecal como se describió anteriormente. Las muestras se analizaron mediante un ensayo de qPCR para evaluar la colonización por C. jejuni y la composición microbiana del contenido de cecal se investigó mediante la secuenciación del amplicón 16S rRNA.
2.6. Extracción de ADN y cuantificación de Campylobacter jejuni basada en qPCR
Para la cuantificación de la carga de C. jejuni en el ciego de pollos de engorde mediante qPCR, se desarrolló una curva estándar como referencia para el análisis del procedimiento (Tabla complementaria 1). Las colonias bacterianas de C. jejuni #65 de un cultivo de mCCDA incubado de 36 h se suspendieron en 300 μL de solución salina tamponada con fosfato (PBS). La suspensión se vórtice brevemente y se dividió en duplicados de 100 μL, y se diluyó en una serie de 10 veces de PBS para UFC contando con placas mCCDA e incubada en condiciones microaeróbicas durante 24 h a 42 ° C.
Simultáneamente, se extrajeron otros 100 μL replicados para el análisis de ADN y qPCR. La muestra se mezcló con 200 mg de perlas de zirconia/sílice de 0,1 mm (productos Biospec, Bartlesville, EE.UU.) y 900 μL de tampón de lisis ASL (Qiagen, Alemania), brevemente vórtice, e incubado a 95°C durante 5 min para lisar las células, seguido de colocación inmediata en hielo durante 10 min. A continuación, la muestra se batió con cuentas en el homogeneizador de muestras Precellys24 (Bertin Technologies, Montigny-le-Bretonneux, Francia) a 8000 rpm durante 2 × 60 s con una pausa de 30 s para alterar mecánicamente las paredes celulares bacterianas. Siguió la centrifugación de la muestra a 2500 x g durante 1 minuto, y se retiraron 200 μL del sobrenadante en el tubo de muestra junto con 20 μL de proteinasa K para la extracción de ADN. La extracción se realizó en un instrumento EZ1 Advanced XL (Qiagen, Alemania) de acuerdo con las instrucciones del fabricante. El extracto se diluyó en una serie de 10 veces de agua libre de nucleasas y se utilizó como plantilla en la PCR en tiempo real para generar una curva estándar.
Se realizó una PCR en tiempo real dirigida al gen d65_1178, específica para C. jejuni Strain #65 y su ST tipo ST-104 (ST-21 CC) utilizando un par de cebadores adaptados de Atterby et al. (2018). La PCR se realizó en un termociclador táctil CFX96 Optics Module C1000 (Bio-Rad Laboratories, USA). La mezcla de reacción contenía: 1 x SsoAdvanced Universal SYBR Green Supermix, 0,3 μL de cebador delantero e inverso cada uno, y 1 μL de la plantilla. Las reacciones se realizaron por triplicado. Los parámetros de amplificación fueron los siguientes; 98 °C durante 3 min, 40 ciclos de 98 °C durante 15 s y 63 °C durante 60 s y seguidos de una curva de fusión que oscila entre 65 y 95 °C como comprobación de la especificidad del ensayo. Los datos de qPCR generados se analizaron en el software Bio-Rad CFX Manager 3.1 (Bio-Rad Laboratories, EE. UU.) y Microsoft Excel. Los datos brutos de qPCR se proporcionan en la Figura Suplementaria 3 (Experimento 1) y la Figura Suplementaria 4 (Experimento 2). La eficiencia de amplificación de la reacción de PCR fue del 76% con R2 de 0,9996.
Todas las muestras de cecal siguieron el mismo procedimiento de extracción de ADN previo al tratamiento que la suspensión de C. jejuni #65, con modificaciones menores previas al tratamiento. Modificaciones incluidas; 400 μL de tampón de lisis ASL, añadido a la muestra y vórtice brevemente para homogeneizar. Luego, se utilizaron 120 μL de la muestra en pasos posteriores. Los extractos de ADN de muestra se analizaron mediante qPCR y secuenciación. Para la cuantificación, los extractos de ADN se ejecutaron en qPCR junto con un extracto de ADN estándar (C. jejuni # 65). Los valores de TC obtenidos de las ejecuciones de muestra se compararon con los del estándar y se transformaron en UFC utilizando la ecuación de curva estándar generada. La UFC generada se multiplicó por cinco para compensar una dilución cinco veces mayor de la muestra realizada durante el pretratamiento, una dilución no realizada en la suspensión estándar. La cuantificación final se expresó en UFC/ml mediante la multiplicación de 10.
2.7. Secuenciación del ARNr 16S
Se secuenciaron ciento cuarenta extractos de ADN de muestras cecales utilizando la plataforma de secuenciación Illumina Miseq PE 250 en Novogene Bioinformatics Technology Co., Ltd. (Beijing, China). Las regiones V16-V3 del gen 4S rRNA se amplificaron utilizando el conjunto de cebadores Illumina 341F (CCTAYGGGRBGCASCAG) y 806R (GGACTACNNGGGTATCTAAT) con un código de barras. Todos los ADN plantilla se normalizaron a la misma concentración. Las reacciones de PCR se realizaron con Phusion® High-Fidelity PCR Master Mix (New England Biolabs, USA). Los productos de PCR se separaron por electroforesis en gel de agarosa al 2%, se purificaron con un kit de extracción de gel Qiagen (Qiagen, Alemania) y se agruparon en concentraciones iguales. Las bibliotecas de secuenciación se generaron utilizando NEBNext Ultra DNA Library Prep Kit (Illumina, EE. UU.) siguiendo las recomendaciones del fabricante, y se agregaron códigos de índice. La calidad de la biblioteca se evaluó en el fluorómetro Qubit 2.0 (Thermo Fisher Scientific, EE.UU.) y el sistema Bioanalyzer 2100 (Agilent Technologies, EE.UU.).
2.8. Secuenciación
Los datos de secuenciación sin procesar se cargaron en la base de datos del Centro Nacional de Información Biotecnológica (NCBI) con el número de acceso PRJNA876811. El procesamiento de datos bioinformáticos fue realizado por Quantitative Insights into Microbial Ecology 2 – QIIME2 (versión 2020.2.0) (Bolyen et al., 2019). El código de barras y la secuencia de cebador de las lecturas demultiplexadas sin procesar fueron recortadas y procesadas por DADA2 para eliminar el ruido y desreplicar las lecturas, fusionar las lecturas de pares finales y eliminar quimeras (Callahan et al., 2016). La longitud de truncamiento de 221 pb se utilizó para las lecturas hacia adelante y hacia atrás. El árbol filogenético se construyó utilizando la alineación FastTree y MAFFT (Katoh et al., 2002; Price et al., 2010). El conjunto de datos SILVA SSU Ref NR 99132 se recortó primero a la región de cebador correspondiente y se entrenó como clasificador de taxonomía classify-sklearn (Pedregosa et al., 2012; Quast et al., 2013; Bokulich et al., 2018). Posteriormente, a las variantes de secuencia de amplicón (ASV) se les asignó taxonomía utilizando el clasificador resultante. Después del recorte y el filtrado de calidad, la secuenciación del gen 16S rRNA produjo un total de 4.539.867 secuencias de 140 muestras. La tabla ASV se enrareció de acuerdo con las lecturas mínimas por muestra (es decir, 21,377 lecturas) (Weiss et al., 2017). La matriz de distancia UniFrac generalizada (alfa = 0,5) y la rarefacción alfa se generaron utilizando el complemento de diversidad QIIME2 (Chen et al., 2012; Bolyen et al., 2019).
2.9. Análisis estadístico
Los datos generados a partir de recuentos de placas y qPCR de ambos experimentos se organizaron en Microsoft Corporation (2018) y se analizaron estadísticamente en SAS versión 9.4 (SAS Institute Inc, 2013). Los datos de recubrimiento se representan gráficamente como gráficos de panel de dispersión que muestran los recuentos bacterianos como log (UFC/ml) y los datos de qPCR como un gráfico de caja; los gráficos se generaron con R y el paquete ggplot2 (Wickham, 2016; Equipo central de R, 2021). Los datos de los experimentos 1 y 2 fueron tratados por el mismo patrón.
Los análisis estadísticos de los datos de recuento de placas fecales se realizaron con un modelo lineal de efectos mixtos (procedimiento mixto Proc en SAS) debido a la estructura de medidas repetidas de los datos. El modelo incluyó el tratamiento, los días posteriores a la infección (dpi) y sus interacciones como factores fijos y la pluma como factor aleatorio. Para tener en cuenta la estructura repetida cuando se realizaron varias observaciones en las mismas aves (focales) a diferentes dpi, incluimos un término de error con una matriz de covarianza no estructurada. Se realizaron pruebas post-hoc para comparar la carga de C. jejuni (log UFC/ml) a dpi individuales entre los grupos de tratamiento, así como para comparar todos los dpi dentro de cada tratamiento. Para comparar las cargas de C. jejuni durante todo el período de desafío entre cuatro grupos de tratamiento, los datos de recuento en placa se expresaron como la media de todas las muestras de dpi observadas dentro de un tratamiento (media de colonización). Los datos de qPCR se analizaron con el mismo modelo lineal de efectos mixtos y en el mismo patrón que los datos de placa. Sin embargo, la pluma como factor aleatorio y la estructura repetida se eliminaron del modelo ya que solo se analizó una muestra de cecal por pluma. Se inspeccionaron las gráficas de residuos para garantizar que los residuos se distribuyeran aproximadamente normalmente con variaciones iguales para todos los modelos. Los resultados se consideran significativos si p < 0,05.
Para la microbiota cecal, los análisis de diversidad se realizaron con el complemento q2-diversity. La tabla ASV enrarecida se utilizó para calcular el número de ASV observados. La prueba de rango de Kruskal-Wallis con corrección de Benjamini y Hochberg (B-H) se utilizó para observar diferencias estadísticas en un número de ASV observados entre grupos (es decir, dpi y tratamiento, Kruskal y Wallis, 1952; Benjamini y Hochberg, 1995). Se utilizó el análisis de coordenadas principales para visualizar la diferencia en la composición microbiana basada en las distancias generalizadas de UniFrac. Se realizó una prueba de análisis multivariado permutacional de varianza (PERMANOVA) de la matriz de distancia UniFrac generalizada con corrección (B-H) para evaluar la diferencia entre los grupos (Anderson, 2001). Para identificar taxones bacterianos que diferían en abundancia entre grupos, realizamos un análisis de composición de microbiomas (ANCOM) (Mandal et al., 2015).
3. Resultados
3.1. Mayor concentración de BAL y pH más bajo en el ensilaje que en el heno
La enumeración mensual de LAB durante el período del experimento reveló que el ensilaje contenía 8.0, 7.4 y 7.2 log UFC/g de LAB, respectivamente, mientras que los niveles de heno eran 5.0, 3.8 y 3.0 log UFC/g. En consecuencia, el ensilaje contenía concentraciones de BAL ≥3 × 10 log (UFC/g) más altas que el heno y se observó una disminución gradual de las concentraciones de BAL en ambas materias. La medición del pH del ensilaje justo antes del experimento mostró pH 4.4, mientras que el heno mostró pH 6.2.
3.2. Colonización por Campylobacter jejuni afectada por el tratamiento con ensilaje y heno en R-308 pero no en RR según lo determinado por cultivo, sin efectos significativos del tratamiento determinados por qPCR
Los resultados del cultivo revelaron la negatividad de Campylobacter jejuni en todas las aves antes de la infección y la colonización exitosa de C. jejuni en ambos tipos de pollos de engorde después del desafío. En ambos experimentos, las cargas de C. jejuni alcanzaron su punto máximo dentro de los 3 días posteriores al desafío y, a partir de entonces, la intensidad de la colonización tuvo una tendencia decreciente con el tiempo.
En R-308, se observó un efecto general significativo del tratamiento (p = 0,023). Específicamente, se observó una media de colonización por C. jejuni significativamente menor en los grupos de ensilaje (p = 0,010) y heno (p = 0,013) en comparación con el control (Figura 2). A 1 dpi, la colonización en el grupo de ensilaje fue significativamente menor (2,01 logs) en comparación con el grupo control (p = 0,039). Sin embargo, al final del experimento (19 dpi), no hubo diferencia significativa en la colonización entre ninguno de los tratamientos. No se observó ningún efecto significativo del tratamiento LP256 (proporcionado directamente a través del agua potable) sobre las cargas de C. jejuni. Una comparación de la colonización por C. jejuni dentro de cada tratamiento a 1 y 19 dpi (inicio y final del período de colonización) no reveló diferencias significativas en la carga bacteriana (UFC/ml). Lo mismo ocurrió con la comparación de colonización entre los 3 dpi (supuesto pico de carga de C. jejuni) y 19 dpi.
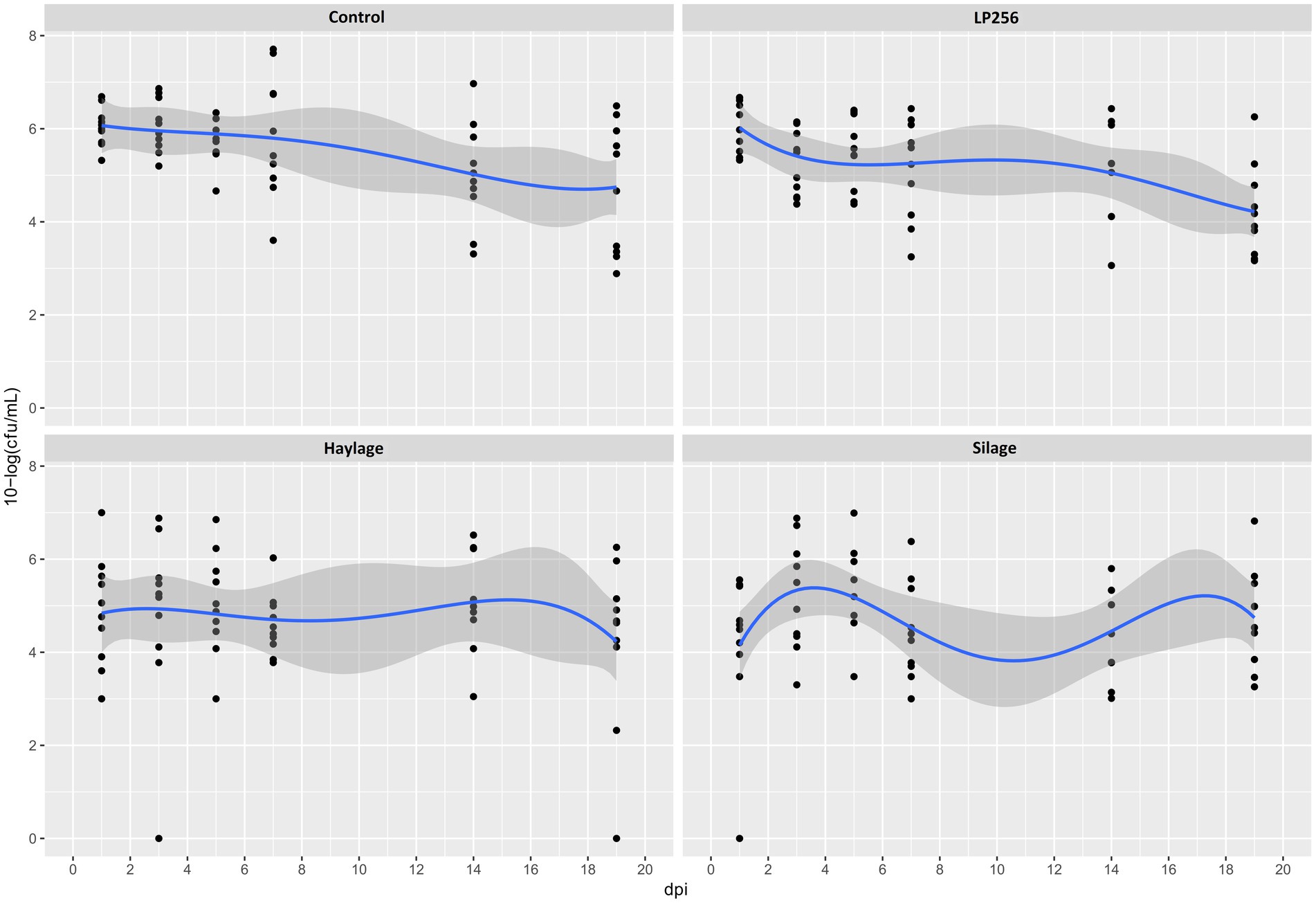 Figura 2. Patrones de colonización basados en el cultivo de C. jejuni en cuatro grupos de tratamiento dietético en el Experimento 1. Los puntos negros (puntos de datos) representan 10 log (UFC/ml) en muestras fecales individuales en un día determinado después de la infección (dpi). La línea azul es una curva suave que representa la tendencia de colonización basada en la media 10-log (UFC/ml) en cada tratamiento con una banda de confianza del 95%.
Figura 2. Patrones de colonización basados en el cultivo de C. jejuni en cuatro grupos de tratamiento dietético en el Experimento 1. Los puntos negros (puntos de datos) representan 10 log (UFC/ml) en muestras fecales individuales en un día determinado después de la infección (dpi). La línea azul es una curva suave que representa la tendencia de colonización basada en la media 10-log (UFC/ml) en cada tratamiento con una banda de confianza del 95%.
Según lo determinado por qPCR (Figura 3), las cargas de C. jejuni en ceca a 3 dpi (25 días de edad) o 20 dpi (42 días de edad) no se vieron afectadas significativamente por los tratamientos dietéticos en R-308. Una comparación de la colonización por C. jejuni dentro del tratamiento reveló un patrón decreciente entre 3 dpi y 20 dpi. Sin embargo, las diferencias en C. jejuni UFC/ml no fueron estadísticamente significativas.
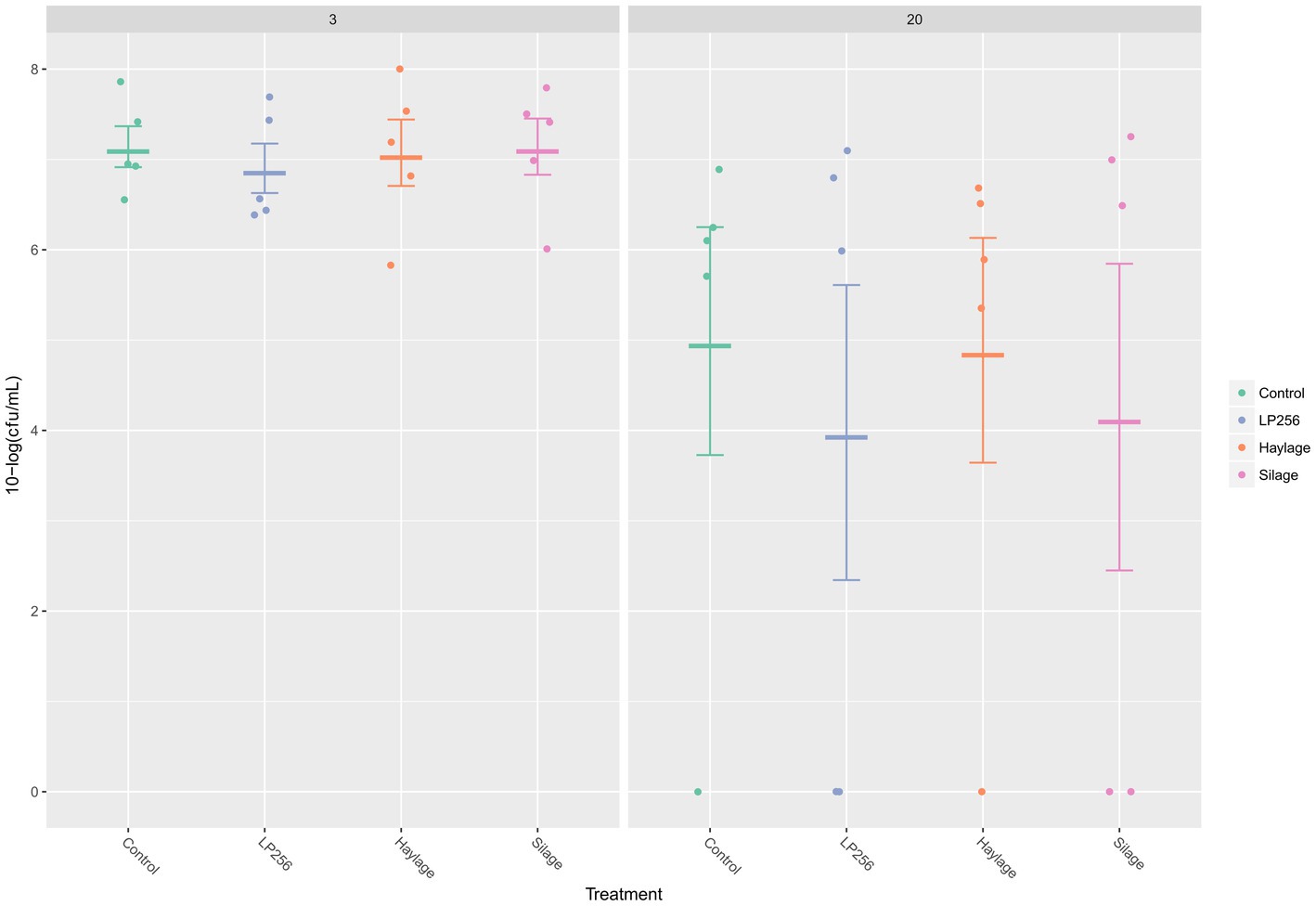 Figura 3. Dinámica de colonización cuantitativa basada en PCR de C. jejuni en los cuatro grupos de tratamiento dietético a los 3 y 20 días después de la infección (dpi) en el Experimento 1. Los puntos representan la carga de C. jejuni (10 log UFC/ml) en muestras cecales individuales y las barras de línea representan la media de 10 log UFC/ml con desviación estándar.
Figura 3. Dinámica de colonización cuantitativa basada en PCR de C. jejuni en los cuatro grupos de tratamiento dietético a los 3 y 20 días después de la infección (dpi) en el Experimento 1. Los puntos representan la carga de C. jejuni (10 log UFC/ml) en muestras cecales individuales y las barras de línea representan la media de 10 log UFC/ml con desviación estándar.
No se observó un efecto significativo de los tratamientos sobre las cargas de C. jejuni en el RR determinado por cultivo (Figura 4). Sin embargo, la comparación de colonización entre el inicio del período de infección (1 dpi) y el final del ensayo (32 dpi) dentro de cada tratamiento reveló cambios significativos con reducciones medias en C. jejuni de 2,65 y 2,46 10-log (UFC/ml) para LP256 y heno, respectivamente (p = 0,006 y p = 0,017, respectivamente). La comparación de colonización entre el supuesto pico de carga bacteriana (3 dpi) y el final del ensayo (32 dpi) mostró una reducción significativa de C. jejuni en todos los grupos de tratamiento; p = 0,002, p = 0,001, p = 0,001 y p = 0,001 para el control, LP256, grupo de heno y ensilaje, respectivamente.
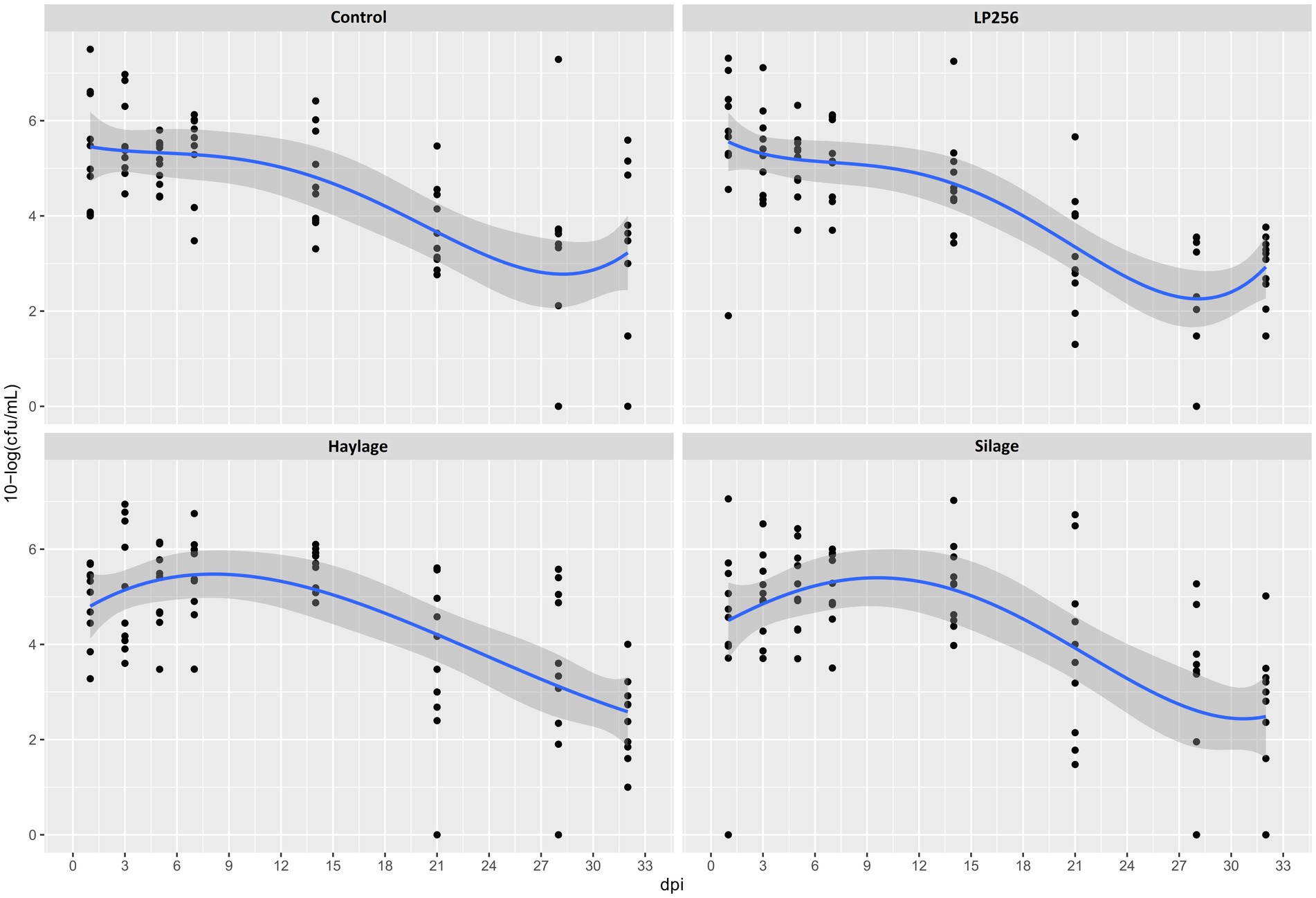 Figura 4. Patrones de colonización basados en el cultivo de C. jejuni en cuatro grupos de tratamiento dietético en el Experimento 2. Los puntos negros (puntos de datos) representan 10 log (UFC/ml) en muestras fecales individuales en un día determinado después de la infección (dpi). La línea azul es una curva suave que representa la tendencia de colonización basada en la media 10-log (UFC/ml) en cada tratamiento con una banda de confianza del 95%.
Figura 4. Patrones de colonización basados en el cultivo de C. jejuni en cuatro grupos de tratamiento dietético en el Experimento 2. Los puntos negros (puntos de datos) representan 10 log (UFC/ml) en muestras fecales individuales en un día determinado después de la infección (dpi). La línea azul es una curva suave que representa la tendencia de colonización basada en la media 10-log (UFC/ml) en cada tratamiento con una banda de confianza del 95%.
A 3, 13 o 34 dpi, no se observaron efectos significativos del tratamiento sobre las cargas de ceca C. jejuni en RR según lo determinado por qPRC (Figura 5). La comparación de las cargas de C. jejuni entre el supuesto pico de colonización bacteriana (3 dpi; 34 días de edad) y el final del ensayo (34 dpi; 63 días de edad) reveló reducciones significativas en el control, LP256 y el grupo de heno (p = 0,001, p = 0,001 y p = 0,024, respectivamente). Una comparación entre la colonización por C. jejuni cecal a 13 dpi (42 días de edad) y 34 dpi para cada tratamiento mostró reducciones significativas de C. jejuni en los grupos control, LP256 y ensilaje (p = 0,001, p = 0,032 y p = 0,014 , respectivamente).
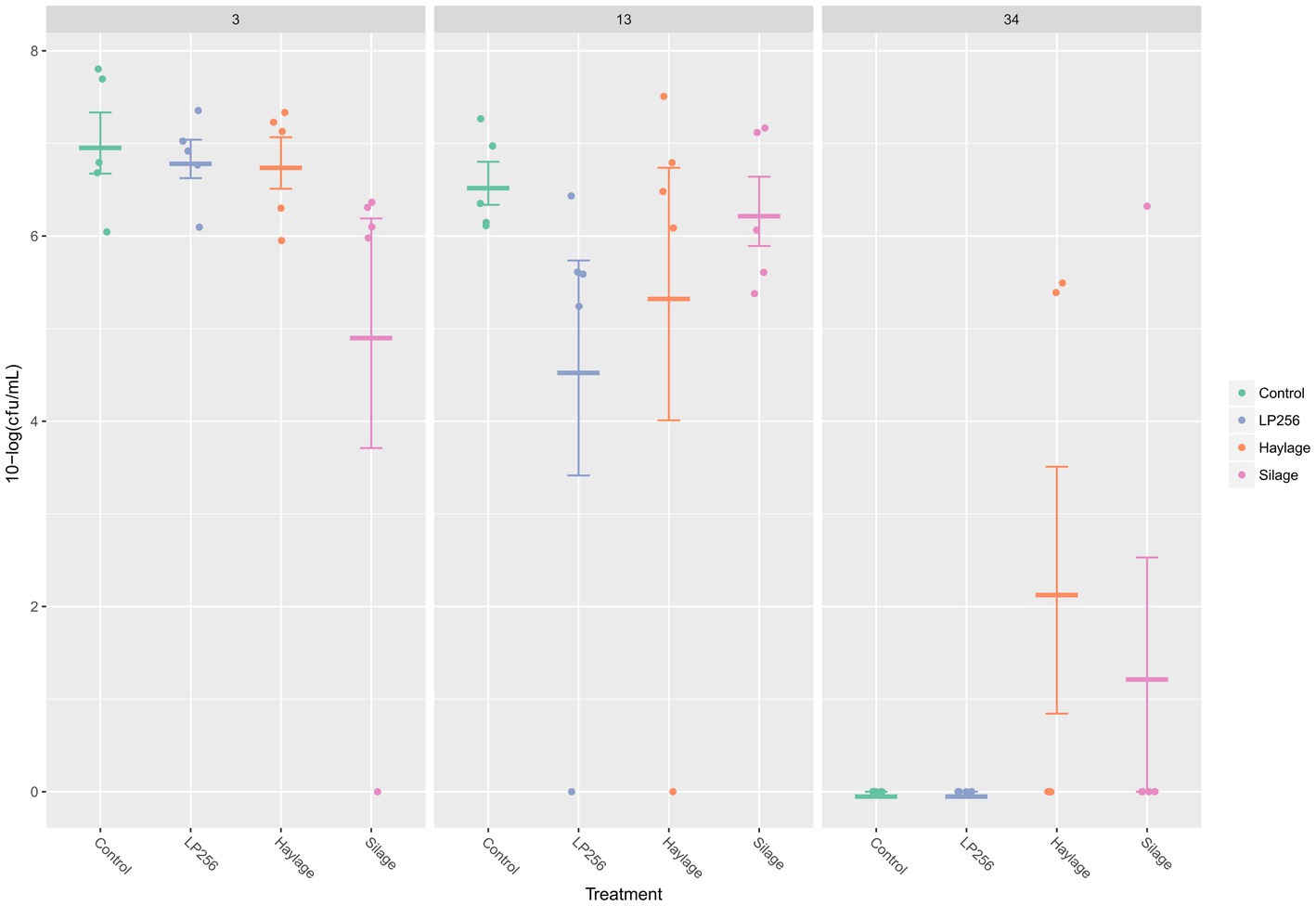 Figura 5. Dinámica cuantitativa de colonización basada en PCR de C. jejuni en los cuatro grupos de tratamiento dietético a los 3, 13 y 34 días después de la infección (dpi) en el Experimento 2. Los puntos representan la carga de C. jejuni (10 log UFC/ml) en muestras cecales individuales y las barras de línea representan la media de 10 log UFC/ml con desviación estándar.
Figura 5. Dinámica cuantitativa de colonización basada en PCR de C. jejuni en los cuatro grupos de tratamiento dietético a los 3, 13 y 34 días después de la infección (dpi) en el Experimento 2. Los puntos representan la carga de C. jejuni (10 log UFC/ml) en muestras cecales individuales y las barras de línea representan la media de 10 log UFC/ml con desviación estándar.
3.3. Firmicutes y Bacteroidota dominaron tanto la microbiota cecal R-308 como la RR, con cambios significativos observados en sus abundancias relativas tras el desafío Campylobacter
La caracterización de la composición de la microbiota cecal antes y después del desafío de C. jejuni en los experimentos 1 y 2 se realizó mediante secuenciación de amplicones de ARNr 16S. Se analizaron un total de 140 muestras y se identificaron en total 675 variantes de secuencia de amplicón (ASV), que representan 122 géneros taxonómicos, 52 familias, 33 órdenes, 13 clases y 5 filos. Las curvas de rarefacción de los ASV observados revelaron suficiente profundidad de secuenciación para capturar la riqueza de especies en todos los puntos de tiempo probados en el Experimento 1 (Figura Suplementaria 5) y el Experimento 2 (Figura Suplementaria 6).
En detalle, se observaron 619 ASV, que representan 109 géneros taxonómicos y 5 filos en el Experimento 1. Los resultados del análisis de coordenadas principales (PCoA) se muestran en la Figura 6 para visualizar la variación de la microbiota cecal entre diferentes días después de la infección. Se observaron diferencias significativas en la composición de la microbiota intestinal entre diferentes dpi (p = 0,001), mientras que no se encontró un efecto claro de los tratamientos alimentarios sobre la composición de la microbiota cecal; por lo tanto, los tratamientos se agruparon para un análisis adicional.
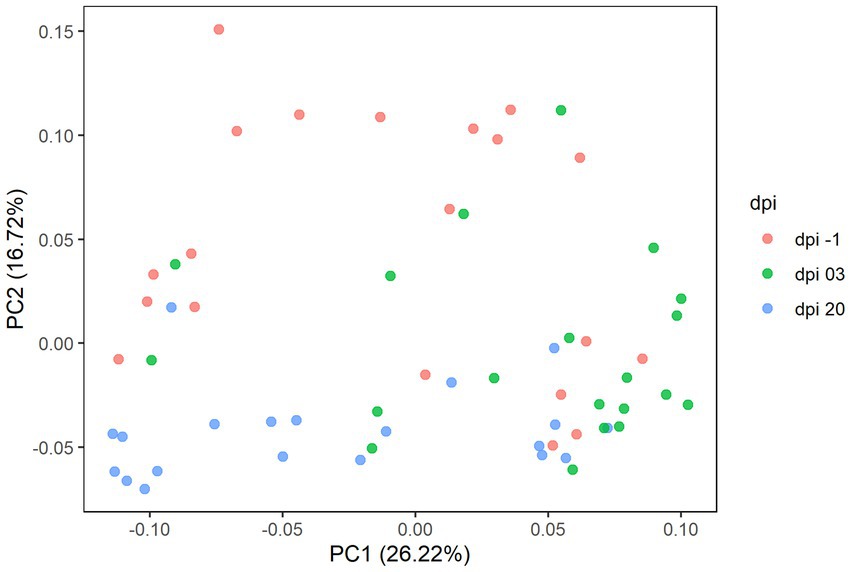 Figura 6. Gráfico de análisis de coordenadas principales (PCoA) que muestra las diferencias en la diversidad beta basadas en distancias generalizadas de UniFrac entre muestras a −1, 3 y 20 días después de la infección (dpi); representadas por 20 muestras cecales, respectivamente, para R-308. El dpi −1 está representado por muestras antes de la infección.
Figura 6. Gráfico de análisis de coordenadas principales (PCoA) que muestra las diferencias en la diversidad beta basadas en distancias generalizadas de UniFrac entre muestras a −1, 3 y 20 días después de la infección (dpi); representadas por 20 muestras cecales, respectivamente, para R-308. El dpi −1 está representado por muestras antes de la infección.
A nivel de filo, Firmicutes y Bacteroidota comprendieron más del 97,5% de la abundancia relativa (AR) de las bacterias en todos los grupos de tratamiento a -1, 3 y 20 dpi, lo que sugiere que eran los principales componentes de la microbiota cecal (Figura 7). Dado que los diferentes tratamientos dietéticos no tuvieron influencia en la composición de la microbiota intestinal, los tratamientos se agruparon y se investigaron los cambios entre los diferentes días posteriores a la infección. Se observaron cambios en la AR a nivel de filo después del desafío de Campylobacter; una disminución temporal en la AR del filo Firmicutes (la media de AR a -1, 3 y 20 dpi fue de 84,2, 74,7 y 85,4% respectivamente) fue sustituida por un aumento significativo correspondiente en Bacteroidota (la media de AR a -1, 3 y 20 dpi fue de 14,5, 23,7 y 13,4%, respectivamente). La AR del filo Proteobacteria disminuyó a 3 dpi y volvió a un nivel similar al de antes del desafío de C. jejuni a 20 dpi (la media de AR a -1, 3 y 20 dpi fue de 1,3, 0,7 y 1,1% respectivamente). Se observó un aumento significativo en la AR de los filos Campilobacterota a 3 dpi (la media de Campilobacterota a −1, 3 y 20 dpi fue de 0,01, 0,9 y 0,1% respectivamente). La AR de Actinobacteriota varió de 0,02 a 0,04%.
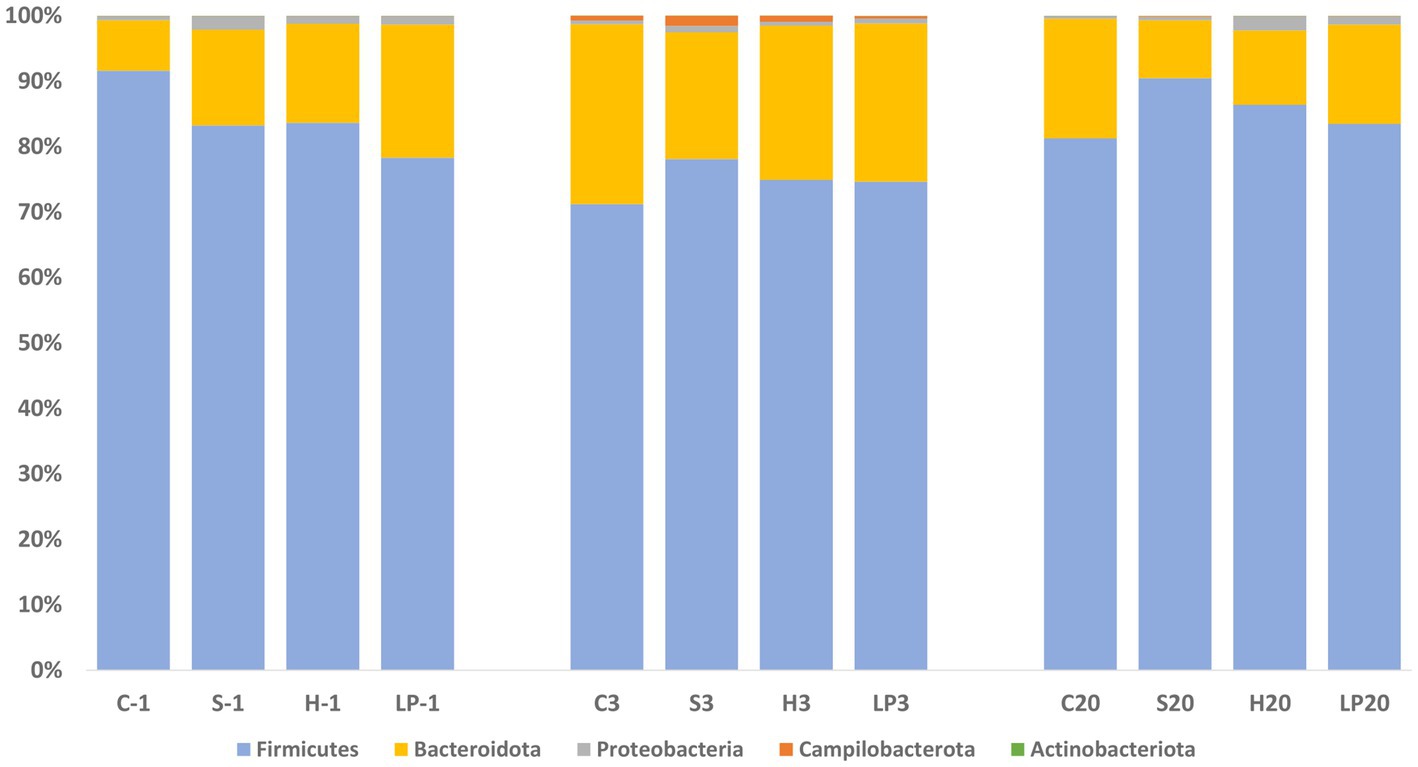 Figura 7. Abundancia relativa a nivel de filo (%) de microbiota cecal de pollos de engorde en el Experimento 1 (R-308) en cada tratamiento y días posteriores a la infección (dpi): −1, 3 y 20. Los grupos de tratamiento mostrados son los siguientes: tratamiento dietético y dpi. C: alimentación de control; S, dieta basada en 85% de pellets y 15% de ensilaje; H, dieta basada en 85% de pellets y 15% de heno; LP, alimento de control y agua inoculada con 107 UFC/ml de L. plantarum viable 256.
Figura 7. Abundancia relativa a nivel de filo (%) de microbiota cecal de pollos de engorde en el Experimento 1 (R-308) en cada tratamiento y días posteriores a la infección (dpi): −1, 3 y 20. Los grupos de tratamiento mostrados son los siguientes: tratamiento dietético y dpi. C: alimentación de control; S, dieta basada en 85% de pellets y 15% de ensilaje; H, dieta basada en 85% de pellets y 15% de heno; LP, alimento de control y agua inoculada con 107 UFC/ml de L. plantarum viable 256.
A nivel de género, los 25 géneros principales (Tabla 1) constituyeron el 89% del grupo total de lecturas de secuenciación. El género Campylobacter fue agregado como el género 26 debido al interés de este estudio. A continuación se describen los principales cambios en la AR a nivel de género entre diferentes dpi: el género Bacteroides fue el más dominante en la microbiota cecal a -1 dpi y claramente el más dominante después del desafío de C. jejuni (3 dpi). A partir de entonces, se observó una disminución considerable en beneficio de otros géneros a 20 dpi (Tabla 1). Clostridium UCG-014 y Ruminococcaceae no cultivadas aumentaron continuamente en AR a lo largo de los puntos de muestreo; donde Clostridia UCG-014 se convirtió en el género más abundante a 20 dpi. Se observó una disminución significativa en la AR del duodécimo género más abundante Lactobacillus después del desafío de C. jejuni a 3 dpi. Sin embargo, a 20 dpi la AR de este género alcanzó niveles más altos que antes del desafío de C. jejuni. En los géneros Clostridia vadinBB60 y Lachnospiraceae no clasificadas, apareció una disminución de la AR a 3 dpi y se mantuvo en un nivel similar a 20 dpi. La AR de los géneros Faecalibacterium (el segundo género bacteriano más dominante en la eca de pollos de engorde), Eisenbergiella, Subdoligranulum y Escherichia-Shigella disminuyó después del desafío de C. jejuni (3 dpi) pero finalmente, se observó un aumento en los cuatro géneros a 20 dpi. Como era de esperar, la AR del género Campylobacter aumentó significativamente después del desafío (3 dpi) pero había disminuido a 20 dpi. Aunque se pudieron observar tendencias generales claras en la AR media de diferentes géneros durante el experimento como se describió anteriormente, hubo altas variaciones individuales en la composición de la microbiota cecal de las aves dentro del mismo grupo de tratamiento en cada punto de tiempo de infección (dpi).
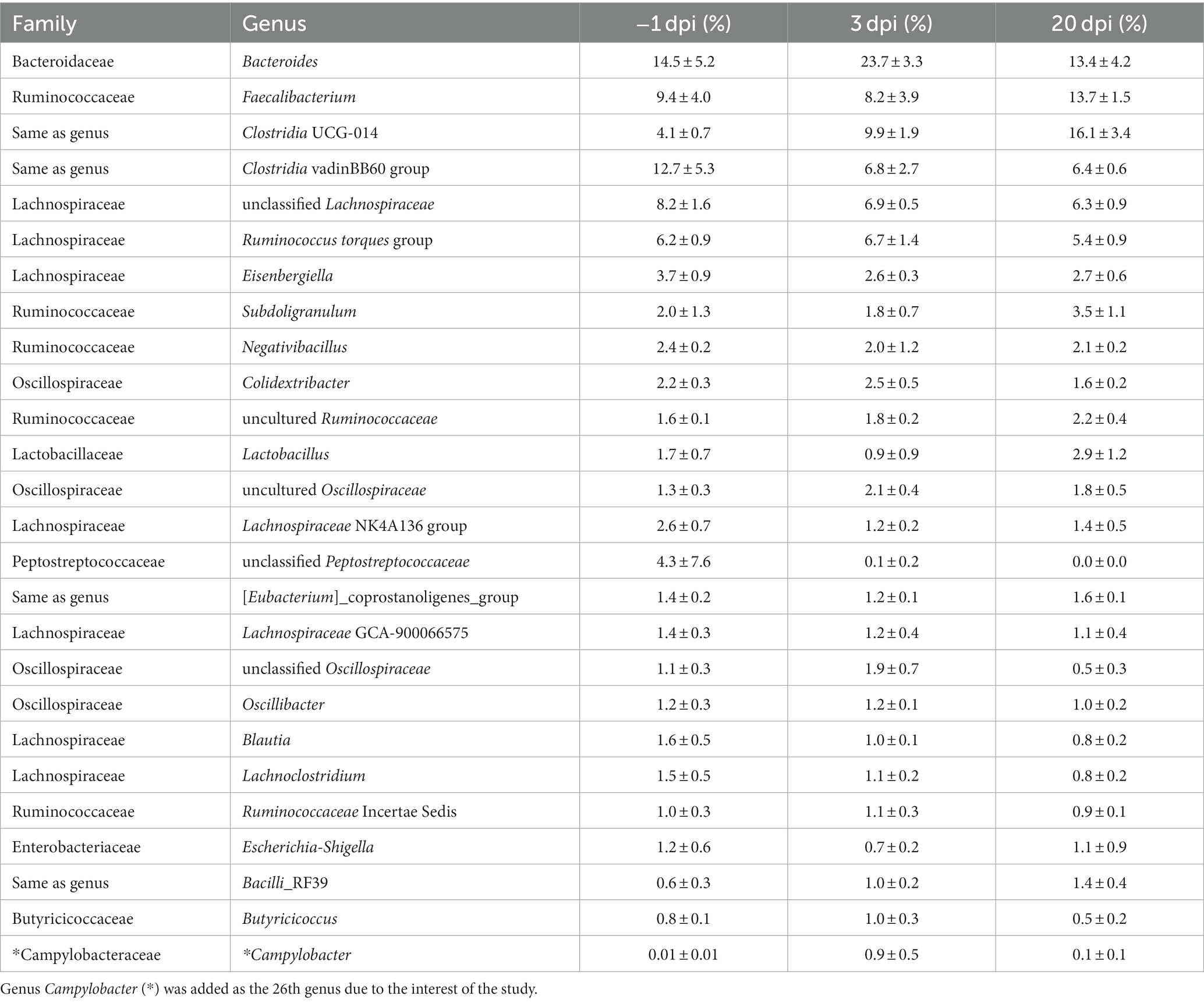 Tabla 1. La media y la DE de la abundancia relativa (%) de los 25 géneros principales de microbiota cecal de pollos de engorde en cada día después de la infección (dpi) en el Experimento 1.
Tabla 1. La media y la DE de la abundancia relativa (%) de los 25 géneros principales de microbiota cecal de pollos de engorde en cada día después de la infección (dpi) en el Experimento 1.
En el Experimento 2, los resultados de la secuenciación comprendieron 671 ASV, que representan 121 géneros taxonómicos y 5 filos. Los resultados del análisis de coordenadas principales se presentan en la gráfica PCoA (Figura 8), donde se observaron diferencias significativas en la composición de la microbiota (p = 0,001), mientras que no se encontró un efecto claro de los tratamientos alimentarios.
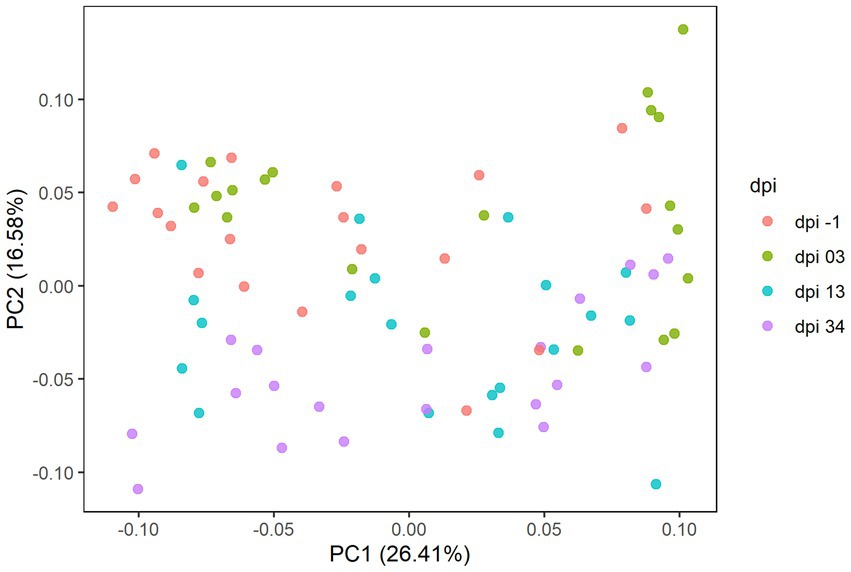 Figura 8. Gráfica de análisis de coordenadas principales (PCoA) que muestra diferencias en la diversidad beta basada en distancias generalizadas de UniFrac entre muestras a -1, 3, 13 y 34 días después de la infección (dpi); representado por 20 muestras, respectivamente, para RR. El dpi −1 está representado por muestras antes de la infección.
Figura 8. Gráfica de análisis de coordenadas principales (PCoA) que muestra diferencias en la diversidad beta basada en distancias generalizadas de UniFrac entre muestras a -1, 3, 13 y 34 días después de la infección (dpi); representado por 20 muestras, respectivamente, para RR. El dpi −1 está representado por muestras antes de la infección.
Como se ve en el Experimento 1, la composición de la microbiota cecal a nivel de filo estuvo dominada por Firmicutes y Bacteroidota también en el Experimento 2; representando en conjunto al menos el 92,2% de las bacterias en todos los grupos de tratamiento (Figura 9) a -1, 3, 13 y 34 dpi. Se observaron cambios proporcionales en la AR después del desafío de C. jejuni (dpi 3) por un aumento del filo Firmicutes (la media de AR a −1, 3, 13 y 34 dpi fue de 70,6, 84,5, 80,1 y 81,8% respectivamente) con una disminución concomitante del grupo taxonómico Bacteroidota (la media de AR a −1, 3, 13 y 34 dpi fue de 26,9, 13,6, 18,5 y 17,0% respectivamente). Esto contrastó con el patrón inverso observado en el Experimento 1. La AR del filo Proteobacteria disminuyó después de la infección (3 dpi), se mantuvo en un nivel similar a 13 dpi, y finalmente aumentó de nuevo a 34 dpi; la media de AR a -1, 3, 13 y 34 dpi fue de 2,4, 1,6, 1,3 y 2,1%, respectivamente. Se observó un aumento significativo de la AR del filo Campilobacterota a 3 dpi; la media de AR a -1, 3, 13 y 34 dpi fue de 0,01, 0,3, 0,1 y 0,01%, respectivamente. La AR del filo Actinobacteriota aumentó continuamente a lo largo del experimento, oscilando entre 0,03 y 0,09%.
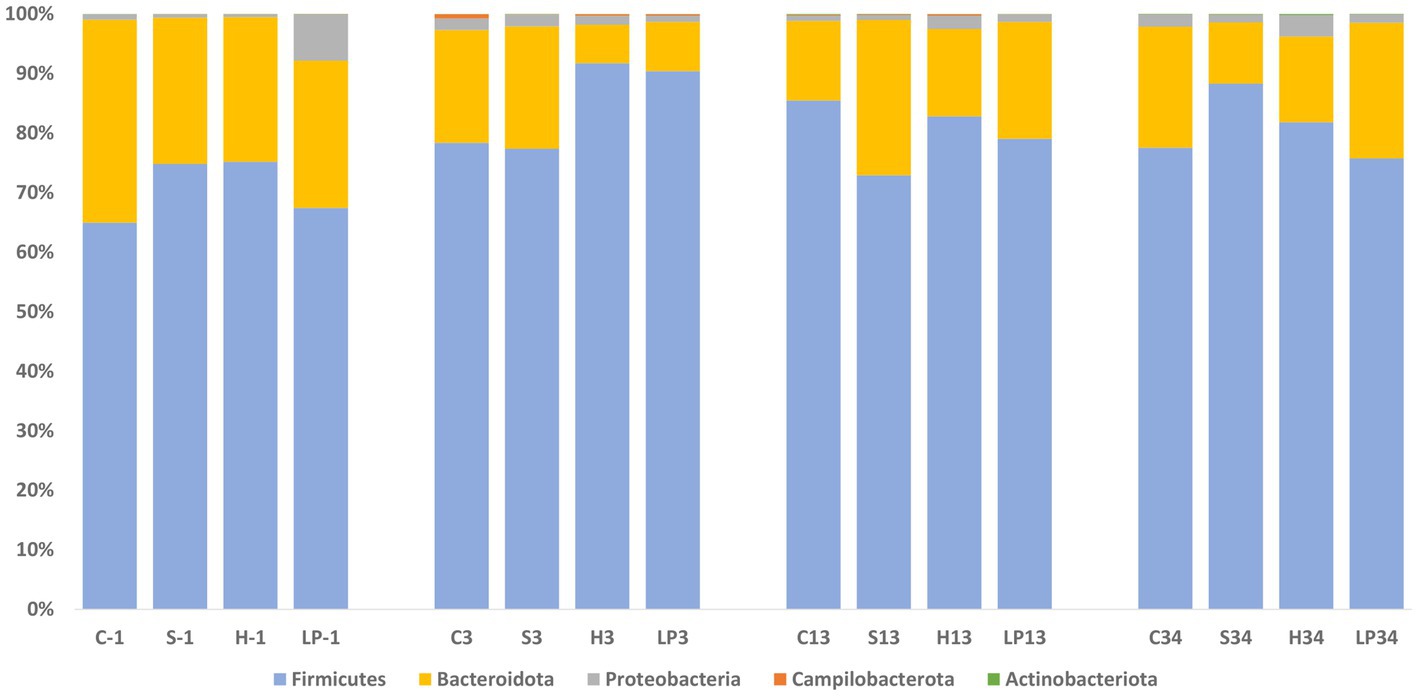 Figura 9. Abundancia relativa del filo (%) de microbiota cecal de pollos de engorde en el Experimento 2 (RR) en cada tratamiento y días posteriores a la infección (dpi): −1, 3, 13 y 34. Los grupos de tratamiento mostrados son los siguientes: tratamiento dietético y dpi. C: alimentación de control; S, dieta basada en 85% de pellets y 15% de ensilaje; H, dieta basada en 85% de pellets y 15% de heno; LP, alimento de control y agua inoculada con 107 UFC/ml de L. plantarum viable 256.
Figura 9. Abundancia relativa del filo (%) de microbiota cecal de pollos de engorde en el Experimento 2 (RR) en cada tratamiento y días posteriores a la infección (dpi): −1, 3, 13 y 34. Los grupos de tratamiento mostrados son los siguientes: tratamiento dietético y dpi. C: alimentación de control; S, dieta basada en 85% de pellets y 15% de ensilaje; H, dieta basada en 85% de pellets y 15% de heno; LP, alimento de control y agua inoculada con 107 UFC/ml de L. plantarum viable 256.
Los 25 géneros principales (Tabla 2) constituyeron el 91% del grupo total de lecturas de secuenciación. El género Campylobacter fue agregado como el género 26 debido al interés del estudio. A continuación se describen las tendencias en abundancia relativa a nivel de género durante el período experimental: Faecalibacterium fue el segundo género más abundante a -1 dpi, el más abundante después del desafío de C. jejuni (3 dpi), y claramente el más abundante a 13 y 34 dpi. Bacteroides dominó la microbiota cecal a -1 dpi. A pesar de una disminución considerable después del desafío de C. jejuni, el género fue el segundo más dominante a 3, 13 y 34 dpi. La AR de los géneros Clostridia UCG-014, grupo Ruminococcus torques y Ruminococcaceae no cultivadas alcanzó su punto máximo a 3 dpi, y posteriormente disminuyó gradualmente a 13 y 34 dpi. El género Lactobacillus fue la novena bacteria más abundante presente en la ceca y su AR aumentó en todos los puntos de muestreo. La abundancia relativa de los géneros no clasificados Lachnospiraceae y Subdoligranulum aumentó a 3 dpi, disminuyó a 13 dpi, y se mantuvo en un nivel similar a 34 dpi. En el grupo del género Clostridia vadinBB60, se observó una disminución continua de la AR en todos los puntos de muestreo. Escherichia-Shigella disminuyó después del desafío y se mantuvo en el mismo nivel a 13 dpi; A partir de entonces se observó un aumento al final del ensayo. La AR de Campylobacter aumentó significativamente después de la infección (3 dpi) y disminuyó a 13 y 34 dpi. Como se observó en el Experimento 1, también se observó una alta variación individual en la composición de la microbiota cecal de las aves en el Experimento 2.
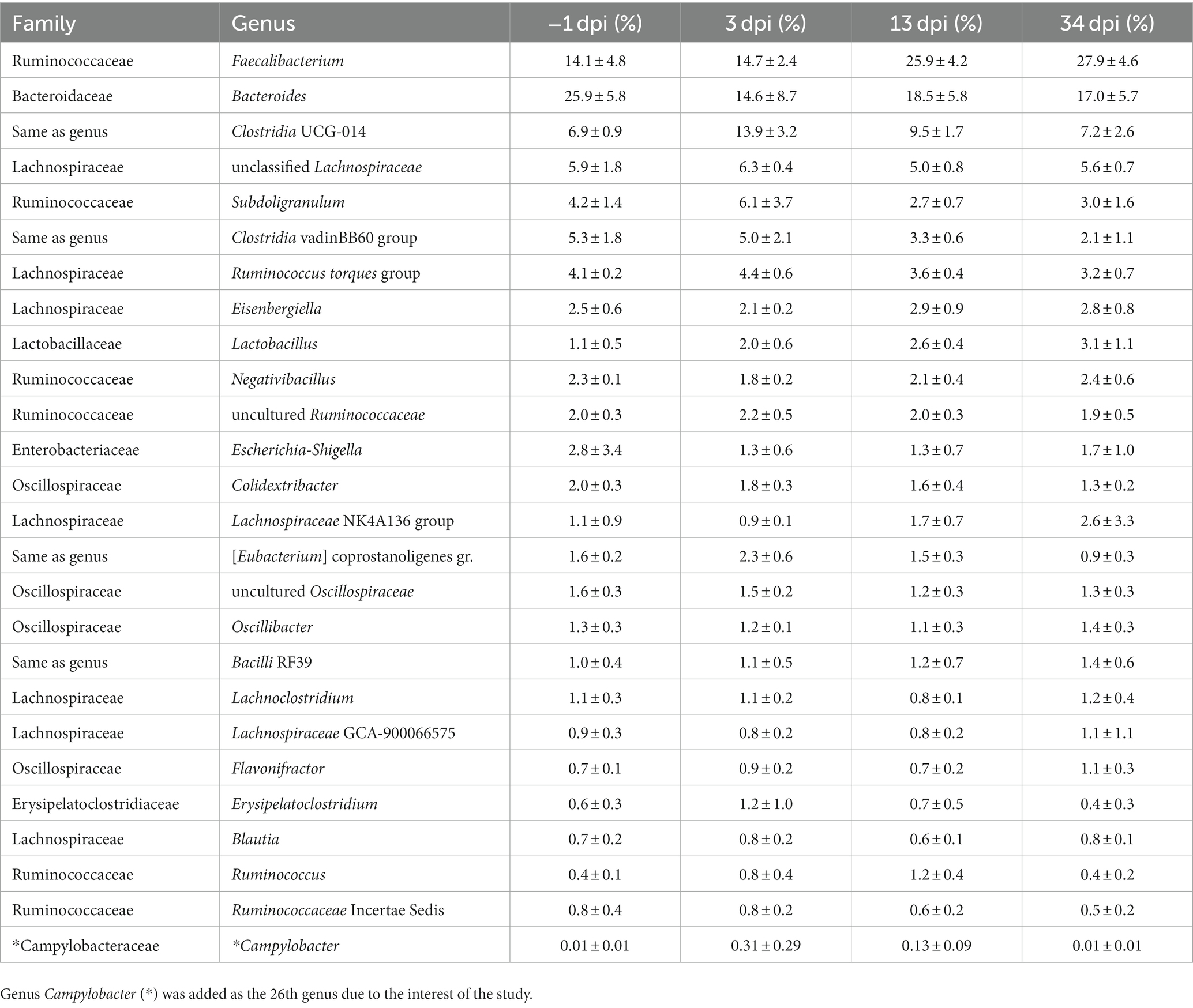 Tabla 2. La media y la DE de la abundancia relativa (%) de los 25 géneros principales de microbiota cecal de pollos de engorde en cada día después de la infección (dpi) en el Experimento 2.
Tabla 2. La media y la DE de la abundancia relativa (%) de los 25 géneros principales de microbiota cecal de pollos de engorde en cada día después de la infección (dpi) en el Experimento 2.
4. Discusión
Estudios anteriores han demostrado que los probióticos pueden modular la microbiota gastrointestinal de los pollos de engorde, proporcionar efectos beneficiosos para la salud y aumentar la resistencia de las aves a los patógenos (Pourabedin y Zhao, 2015). En particular, se ha demostrado que las BAL proporcionan efectos inhibitorios sobre la colonización por C. jejuni, y los aditivos para piensos que contienen tales bacterias podrían ser un enfoque prometedor para reducir la aparición de Campylobacter spp. en la producción primaria (Guyard-Nicodème et al., 2016). Aunque algunos estudios han reportado efectos prometedores, existen desafíos relacionados con el almacenamiento, la distribución y los medios racionalmente factibles de administración de dichos probióticos a los pollos de engorde (Krysiak et al., 2021). En este estudio, evaluamos la posibilidad de proporcionar BAL mediante la inclusión de ensilaje de hierba inoculado con la cepa Lactiplantibacillus plantarum 256 en la alimentación diaria del pollo de engorde. De acuerdo con el Reglamento (CE) 889/2008 (2008) de la Comisión, todas las aves mantenidas en entornos ecológicos en la UE deben tener acceso diario al forraje, siendo el ensilaje de hierba una de las opciones permitidas. Con este requisito en mente, buscamos investigar si el ensilaje puede servir como un componente de la dieta con el potencial de reducir C. jejuni en los intestinos de los pollos de engorde. Además, para evaluar si el efecto potencial fue causado por L. plantarum 256 en sí, también probamos la provisión directa de esta cepa a través del agua potable.
Nuestros resultados de los recuentos de colonias después del cultivo en placa de agar para R-308 (Experimento 1) mostraron una colonización media más baja de C. jejuni en los grupos de tratamiento de ensilaje y heno y una colonización significativamente menor de C. jejuni (2 logs) en el grupo de ensilaje en comparación con el control 1 día después del desafío. Sin embargo, este efecto no duró y no se observaron diferencias en la colonización entre los grupos de tratamiento al final del período de experimento. Este resultado sugiere que el ensilaje y, en cierta medida, el heno podrían tener un efecto inhibitorio contra las bajas cargas de C. jejuni ingeridas en el R-308, pero claramente no podrían proteger a los pollos de engorde de la colonización por C. jejuni. No se pudo observar un efecto inhibitorio inicial similar en el RR, donde no se observaron diferencias en las cargas de C. jejuni entre los grupos de tratamiento en el Experimento 2. El alto contenido de LAB y el bajo pH en los alimentos fermentados se han reportado previamente como atributos prometedores del alimento para reducir la susceptibilidad de los pollos de engorde Ross 308 a la colonización de Campylobacter spp. (Heres et al., 2004). En el estudio actual, los recuentos de bacterias del ácido láctico en el forraje ensilado y la evaluación del pH revelaron que el ensilaje contenía concentraciones de LAB notablemente más altas y un pH más bajo en comparación con el heno. Esto puede explicar en parte por qué las cargas de C. jejuni al comienzo del desafío en el Experimento 1 fueron significativamente más bajas en el grupo de ensilaje en comparación con el control, mientras que solo se observó una reducción moderada (no significativa) en el tratamiento con heno.
Los ensayos in vivo que investigan el efecto del ensilaje en la colonización por C. jejuni son actualmente raros. Un estudio publicado por Ranjitkar et al. (2016) no mostró diferencias significativas en la carga de C. jejuni entre los grupos de tratamiento provistos de diferentes niveles de ensilaje de maíz de grano engarzado en las dietas (reemplazo del 15 y 30% del alimento peletizado con ensilaje de maíz) en comparación con el control. Esta discrepancia en los resultados puede explicarse por diferencias en el tipo de ensilaje, los niveles de consumo o por los efectos del tipo de pollos de engorde y la edad. El tipo y la edad de los pollos de engorde también son explicaciones probables de por qué se observó la reducción de las cargas de C. jejuni al comienzo del Experimento 1 en el R-308, mientras que no se observó ningún efecto en el RR en el Experimento 2. Es bien sabido que las aves de crecimiento rápido tienen una mayor ingesta de alimento que las de crecimiento lento (Quentin et al., 2004; Sarica et al., 2020; Jong et al., 2021). Por esa razón, fue de interés probar los efectos del ensilaje tanto en pollos de engorde de crecimiento rápido como lento. Por lo tanto, dado que se observó una ingesta numéricamente mayor de proporciones mixtas totales, que contienen forraje como ensilaje y heno, en Ross 308 en comparación con las aves Rowan Ranger (Valečková et al., 2020), es posible que el efecto inhibitorio del ensilaje sobre la colonización por C. jejuni visto al comienzo del Experimento 1 estuviera relacionado con el nivel de consumo diario de forraje.
No se observó un efecto significativo del tratamiento sobre la reducción de C. jejuni en heces o ceca cuando Lactiplantibacillus plantarum 256 se proporcionó directamente en el agua potable al R-308 o RR, ni por recuento en placa ni por qPCR. Esto sugiere que aunque los extractos de ensilaje inoculados con esta cepa podrían inhibir el crecimiento de C. jejuni in vitro (datos no publicados), la presencia de esta cepa en el tracto intestinal del pollo de engorde a nivel de administración (107 UFC/mL) utilizado en este estudio no pudo inhibir eficazmente la colonización por C. jejuni. Esto podría estar relacionado tanto con la dosis como con la cepa utilizada. En un estudio realizado por Arsi et al. (2015), 26 aislados de LAB con la mayor actividad inhibitoria in vitro se probaron más a fondo en un ensayo de pollos de engorde donde las aves fueron desafiadas con 104 CFU C. jejuni en una suspensión de 100 μL de caldo de sal de triptona. Solo 3 de estos 26 aislamientos demostraron una reducción en los recuentos de Campylobacter (aproximadamente 1-2 log) en comparación con el control. Se sabe que los resultados de los ensayos in vitro no siempre se traducen en resultados comparables en entornos in vivo, debido a las diferencias en la composición final del suplemento probiótico, su dosis y patrón de aplicación, las condiciones de ensayo y, por lo tanto, los diferentes resultados de la actividad probiótica. Además, los estudios in vitro no tienen en cuenta la variabilidad y complejidad del entorno gastrointestinal de las aves y su interacción con probióticos y cepas de Campylobacter (Smialek et al., 2021). Sin embargo, los efectos inhibitorios sobre C. jejuni in vivo después de la administración directa de Lactiplantibacillus spp. se han demostrado en varios estudios. Por ejemplo, Saint-Cyr et al. (2017) mostraron que los pollos de engorde de Ross tratados con sonda oral de Lactobacillus salivarius SMXD51 (107 UFC) a las 24 h después de la eclosión mostró una reducción significativa en las cargas de C. jejuni presentes en el intestino a los 14 días de edad (0,82 logs) y 35 días de edad (2,81 logs) en comparación con el control. Además, Neal-McKinney et al. (2012) informaron que Lactobacillus crispatus JCM 5810 administrado a pollos de engorde por sonda oral (108 UFC) en el día de la eclosión y 4 días después de la eclosión fue un organismo de exclusión competitiva eficaz para C. jejuni, lo que resultó en una reducción en el número total de pollos de engorde colonizados por C. jejuni y una menor carga microbiana a los 21 días después de la eclosión.
En ambos experimentos en este estudio, las cargas de C. jejuni en las heces alcanzaron su punto máximo al comienzo del desafío, después de lo cual se observó una disminución con el tiempo. Esto está de acuerdo con hallazgos anteriores, por ejemplo, Achen et al. (1998) encontraron que el 70% de los pollos de engorde estaban derramando C. jejuni dentro de las 48 h posteriores a la infección artificial, y se observó una disminución constante en la excreción fecal después de la tercera semana después de la infección; a las 6 semanas después de la infección, solo el 38% de las aves estaban derramando C. jejuni en sus heces. En el estudio actual, la disminución de las cargas de C. jejuni con el tiempo fue más prominente en el Experimento 2 (en el RR), donde la comparación entre el pico de la carga bacteriana de C. jejuni a 3 dpi y el del final del desafío a 34 dpi, mostró una reducción significativa de C. jejuni en todos los grupos de tratamiento. Sin embargo, esto probablemente se debió al hecho de que en el Experimento 2, la colonización de C. jejuni después del desafío fue monitoreada durante 2 semanas más que en el Experimento 1.
Las cargas de Campylobacter jejuni en muestras cecales de ambos experimentos se cuantificaron mediante un ensayo de qPCR. La comparación entre las muestras cecales analizadas por qPCR y las muestras fecales analizadas por recuento de placas reveló un mayor número de C. jejuni en muestras cecales en ambos experimentos, consistente con estudios previos (Berrang et al., 2000; Rudi y otros, 2004). Sin embargo, en algunos casos, las cargas de C. jejuni en muestras cecales estaban por debajo del límite de detección de la qPCR, a pesar de que los cultivos fecales eran positivos para C. jejuni. Esta inconsistencia puede atribuirse a la menor sensibilidad de nuestra qPCR, cuyo límite de detección fue de 3,3 × 105 UFC/g (Apéndice 3) y es probablemente la razón de la reducción significativa de C. jejuni observada en el Experimento 2 cuando se compararon diferentes puntos de tiempo de infección (3 dpi a 34 dpi y 13 dpi a 34 dpi). De acuerdo con los hallazgos de los recuentos de colonias de C. jejuni de muestras fecales (excepto la observación en los tratamientos de forraje en el Experimento 1), no hubo efectos significativos de los tratamientos dietéticos sobre las cargas de C. jejuni cecal en ninguno de los dos experimentos. Del mismo modo, no hubo una reducción significativa en las cargas de C. jejuni cecal entre 3 dpi y el final del Experimento 1, pero se observó una reducción significativa al final del Experimento 2 en LP256, heno y grupos de ensilaje. Esta reducción pareció ser independiente del tratamiento, consistente con nuestros resultados basados en el cultivo de muestras fecales.
El tracto digestivo de los pollos de engorde está colonizado por una amplia variedad de especies bacterianas, siendo el ciego el sitio microbiano más densamente colonizado y estudiado del intestino (Pourabedin y Zhao, 2015). En general, el filo principal en la microbiota cecal de pollos de engorde es Firmicutes, seguido de dos filos menos abundantes, Bacteroidota y Proteobacteria (Oakley et al., 2014; Kers et al., 2018). Esto se refleja en nuestros resultados actuales de la secuenciación del amplicón Illumina 16S de muestras cecales en diferentes puntos de tiempo de infección a lo largo de los dos experimentos, donde Firmicutes fue el filo más abundante, seguido por el filo Bacteroidota. Se observaron menores abundancias relativas de Proteobacteria, Campilobacterota (como resultado del desafío de C. jejuni) y Actinobacteriota. Antes del desafío de C. jejuni (−1 dpi), se observó una menor abundancia relativa de Bacteroidota en todos los grupos de tratamiento en R-308, que su AR en RR. Según los resultados de estudios previos de Connerton et al. (2018) y Richards et al. (2019), esta diferencia podría deberse al tipo de pollos de engorde utilizados, pero también a las diferentes edades de las aves en la exposición a C. jejuni, ya que las aves RR en el Experimento 2 fueron desafiadas 7 días después que el R-308 en el Experimento 1. Actinobacteria y Proteobacteria juntas representaron menos del 2 y 2.5% en muestras cecales R-308 y RR, respectivamente, lo que se alinea con su representación habitual de alrededor del 2 al 3% en la microbiota cecal total de pollos de engorde (Rychlik, 2020).
No hubo efectos significativos de los diferentes tratamientos de alimentación en la composición de la microbiota cecal del pollo de engorde en ninguno de los dos tipos diferentes de pollos de engorde. Sin embargo, se observaron varios cambios distintos en la abundancia relativa relacionados con el desafío de C. jejuni tanto a nivel de filo como de género. En el Experimento 1, una disminución en la AR de Firmicutes apareció en el R-308 después del desafío de C. jejuni, que fue acompañada por un aumento paralelo en la AR de Bacteroidota. En el Experimento 2, se observó lo contrario. Estudios previos han reportado cambios en la abundancia de Bacteroidota relacionados con interacciones con Campylobacter, donde, por ejemplo, se encontró una AR elevada de Bacteroidetes en pollos de engorde positivos para Campylobacter (Sofka et al., 2015), de acuerdo con nuestras observaciones a 3 dpi en R-308. Curiosamente, se observó la correlación opuesta en un estudio de Sakaridis et al. (2018) donde se encontró la elevada abundancia de Firmicutes y la disminución de los niveles de Bacteroidetes en pollos de engorde con altos recuentos de Campylobacter, en línea con nuestras observaciones en RR después del desafío de C. jejuni. Esto muestra la complejidad de las interacciones de la microbiota intestinal, donde un estímulo (desafío de C. jejuni en este caso) puede tener efectos opuestos sobre la composición de la microbiota en dos tipos diferentes de pollos de engorde.
En ambos experimentos en este estudio, las cargas de C. jejuni en las heces alcanzaron su punto máximo al comienzo del desafío, después de lo cual se observó una disminución con el tiempo. Esto está de acuerdo con hallazgos anteriores, por ejemplo, Achen et al. (1998) encontraron que el 70% de los pollos de engorde estaban derramando C. jejuni dentro de las 48 h posteriores a la infección artificial, y se observó una disminución constante en la excreción fecal después de la tercera semana después de la infección; a las 6 semanas después de la infección, solo el 38% de las aves estaban derramando C. jejuni en sus heces. En el estudio actual, la disminución de las cargas de C. jejuni con el tiempo fue más prominente en el Experimento 2 (en el RR), donde la comparación entre el pico de la carga bacteriana de C. jejuni a 3 dpi y el del final del desafío a 34 dpi, mostró una reducción significativa de C. jejuni en todos los grupos de tratamiento. Sin embargo, esto probablemente se debió al hecho de que en el Experimento 2, la colonización de C. jejuni después del desafío fue monitoreada durante 2 semanas más que en el Experimento 1.
Las cargas de Campylobacter jejuni en muestras cecales de ambos experimentos se cuantificaron mediante un ensayo de qPCR. La comparación entre las muestras cecales analizadas por qPCR y las muestras fecales analizadas por recuento de placas reveló un mayor número de C. jejuni en muestras cecales en ambos experimentos, consistente con estudios previos (Berrang et al., 2000; Rudi y otros, 2004). Sin embargo, en algunos casos, las cargas de C. jejuni en muestras cecales estaban por debajo del límite de detección de la qPCR, a pesar de que los cultivos fecales eran positivos para C. jejuni. Esta inconsistencia puede atribuirse a la menor sensibilidad de nuestra qPCR, cuyo límite de detección fue de 3,3 × 105 UFC/g (Apéndice 3) y es probablemente la razón de la reducción significativa de C. jejuni observada en el Experimento 2 cuando se compararon diferentes puntos de tiempo de infección (3 dpi a 34 dpi y 13 dpi a 34 dpi). De acuerdo con los hallazgos de los recuentos de colonias de C. jejuni de muestras fecales (excepto la observación en los tratamientos de forraje en el Experimento 1), no hubo efectos significativos de los tratamientos dietéticos sobre las cargas de C. jejuni cecal en ninguno de los dos experimentos. Del mismo modo, no hubo una reducción significativa en las cargas de C. jejuni cecal entre 3 dpi y el final del Experimento 1, pero se observó una reducción significativa al final del Experimento 2 en LP256, heno y grupos de ensilaje. Esta reducción pareció ser independiente del tratamiento, consistente con nuestros resultados basados en el cultivo de muestras fecales.
El tracto digestivo de los pollos de engorde está colonizado por una amplia variedad de especies bacterianas, siendo el ciego el sitio microbiano más densamente colonizado y estudiado del intestino (Pourabedin y Zhao, 2015). En general, el filo principal en la microbiota cecal de pollos de engorde es Firmicutes, seguido de dos filos menos abundantes, Bacteroidota y Proteobacteria (Oakley et al., 2014; Kers et al., 2018). Esto se refleja en nuestros resultados actuales de la secuenciación del amplicón Illumina 16S de muestras cecales en diferentes puntos de tiempo de infección a lo largo de los dos experimentos, donde Firmicutes fue el filo más abundante, seguido por el filo Bacteroidota. Se observaron menores abundancias relativas de Proteobacteria, Campilobacterota (como resultado del desafío de C. jejuni) y Actinobacteriota. Antes del desafío de C. jejuni (−1 dpi), se observó una menor abundancia relativa de Bacteroidota en todos los grupos de tratamiento en R-308, que su AR en RR. Según los resultados de estudios previos de Connerton et al. (2018) y Richards et al. (2019), esta diferencia podría deberse al tipo de pollos de engorde utilizados, pero también a las diferentes edades de las aves en la exposición a C. jejuni, ya que las aves RR en el Experimento 2 fueron desafiadas 7 días después que el R-308 en el Experimento 1. Actinobacteria y Proteobacteria juntas representaron menos del 2 y 2.5% en muestras cecales R-308 y RR, respectivamente, lo que se alinea con su representación habitual de alrededor del 2 al 3% en la microbiota cecal total de pollos de engorde (Rychlik, 2020).
No hubo efectos significativos de los diferentes tratamientos de alimentación en la composición de la microbiota cecal del pollo de engorde en ninguno de los dos tipos diferentes de pollos de engorde. Sin embargo, se observaron varios cambios distintos en la abundancia relativa relacionados con el desafío de C. jejuni tanto a nivel de filo como de género. En el Experimento 1, una disminución en la AR de Firmicutes apareció en el R-308 después del desafío de C. jejuni, que fue acompañada por un aumento paralelo en la AR de Bacteroidota. En el Experimento 2, se observó lo contrario. Estudios previos han reportado cambios en la abundancia de Bacteroidota relacionados con interacciones con Campylobacter, donde, por ejemplo, se encontró una AR elevada de Bacteroidetes en pollos de engorde positivos para Campylobacter (Sofka et al., 2015), de acuerdo con nuestras observaciones a 3 dpi en R-308. Curiosamente, se observó la correlación opuesta en un estudio de Sakaridis et al. (2018) donde se encontró la elevada abundancia de Firmicutes y la disminución de los niveles de Bacteroidetes en pollos de engorde con altos recuentos de Campylobacter, en línea con nuestras observaciones en RR después del desafío de C. jejuni. Esto muestra la complejidad de las interacciones de la microbiota intestinal, donde un estímulo (desafío de C. jejuni en este caso) puede tener efectos opuestos sobre la composición de la microbiota en dos tipos diferentes de pollos de engorde.
En ambos experimentos, el filo predominante Firmicutes consistió principalmente en la clase Clostridia representada por los géneros Faecalibacterium, Clostridia UCG-014, Clostridia vadinBB60 y Lachnospiraceae no clasificadas, con otras bacterias pertenecientes a las familias Lachnosporaceae y Ruminococcaceae en porcentajes más bajos. El filo Bacteroidota, por otro lado, consistía en el único género Bacteroides. Este género es capaz de producir ácidos grasos de cadena corta, compuestos que contribuyen a mantener la integridad de la mucosa, la inmunidad y la salud de los pollos de engorde (Ali et al., 2022). El género más dominante en el filo Proteobacteria fue la facultativamente anaeróbica Escherichia-Shigella, cuya abundancia disminuyó después del desafío de C. jejuni. Esto contrastaba con el género Clostridia UCG-014, cuya abundancia relativa aumentó después del desafío de C. jejuni. Hallazgos similares fueron reportados por Awad et al. (2016), donde los pollos de engorde Ross 14 de 308 días de edad fueron desafiados con 1 × 108 CFU de C. jejuni NCTC 12744. En ese estudio, la colonización por C. jejuni se asoció con una alteración de la microbiota intestinal con aves infectadas que tenían una abundancia significativamente menor de Escherichia coli, mientras que el nivel de Clostridium spp. fue mayor en aves infectadas en comparación con las no infectadas. Sin embargo, cabe señalar que la mayor abundancia de Clostridium spp. inducido después del desafío de C. jejuni no fue sencillo en el presente estudio, ya que se observó una disminución concomitante en la abundancia relativa del grupo Clostridia vadinBB60. En particular, 23 de los 25 géneros principales se observaron comúnmente tanto en R-308 como en RR. A pesar de este hecho, se observó una alta variación individual en la composición de la microbiota cecal de las aves dentro del mismo tipo de pollos de engorde, grupo de tratamiento y en el mismo punto de tiempo de infección en relación con el desafío de C. jejuni. Esto está de acuerdo con un estudio previo en el que se informó de una gran variación de la microbiota individual entre animales dentro de un solo grupo uniformemente derivado y tratado, bajo condiciones experimentales altamente controladas (Stanley et al., 2014). Los autores de ese estudio especulan que las razones probables de esta variación son la falta de exposición a las bacterias obtenidas por la madre y la sensibilidad a la colonización por bacterias ambientales en los criaderos.
Nuestro objetivo con este estudio fue comparar diferentes estrategias para administrar BAL con el fin de aumentar su contenido en el intestino de los pollos de engorde y crear un ambiente desfavorable para Campylobacter. La abundancia relativa del género Lactobacillus en ambos experimentos fue relativamente alta, la duodécima bacteria más abundante en el intestino en el experimento 1 y la novena más abundante en el experimento 2. Sin embargo, ni la adición de LAB de ensilaje (incluyendo Lactiplantibacillus plantarum 256) ni L. plantarum 256 suplementado en agua afectó la abundancia relativa de Lactobacillus en ceca de pollos de engorde en comparación con las aves control que no recibieron ningún LAB. Por lo tanto, especulamos que la inhibición inicial del crecimiento de C. jejuni en heces observada en el grupo de ensilaje en el Experimento 1, puede ser dependiente del pH en lugar de debido a la presencia de LAB. En contraste, se observó un posible efecto de la colonización por C. jejuni en la abundancia de Lactobacillus en los datos de secuenciación, donde la abundancia relativa del género Lactobacillus disminuyó después del desafío de C. jejuni en el Experimento 1, independientemente del tratamiento. Con el posible impacto de la menor abundancia de C. jejuni con el tiempo después del desafío, la mayor presencia de Lactobacillus se observó a 20 dpi. Curiosamente, un vínculo entre los géneros Lactobacillus y Campylobacter ha sido previamente reportado por Sofka et al. (2015), donde se encontró que las BAL eran significativamente más altas, en el recuento total de colonias culturales, en muestras negativas para Campylobacter de parvadas de pollos de engorde en comparación con las positivas para Campylobacter. Sin embargo, la misma correlación no se observó en el Experimento 2, donde la abundancia relativa del género Lactobacillus aumentó después del desafío de C. jejuni, y su abundancia aumentó con el tiempo después de la infección, independientemente de los tratamientos. Además, incluso si el género Lactobacillus tenía a -1 dpi una abundancia relativamente alta en RR ceca en el grupo de ensilaje y LP256 en comparación con el control (no significativo), no se observó ningún efecto de su presencia sobre las cargas de Campylobacter después de la infección.
A pesar del hecho de que todas las aves analizadas fueron cultivo negativo para Campylobacter el día antes de la infección (-1 dpi), observamos inesperadamente una abundancia relativa del 0,01% del género Campylobacter en ambos experimentos a -1 dpi. Debido a que la misma presencia menor de este género se observó en muestras de -1 dpi en ambos experimentos, aunque las aves fueron muestreadas con 1 semana de diferencia, y no se detectó C. jejuni por cultivo, es muy poco probable que las variantes de la secuencia del amplicón 16S reflejen la presencia real de C. jejuni. Si C. jejuni hubiera estado presente en el establo antes del desafío, el nivel de abundancia detectado por la secuenciación del amplicón 16S probablemente diferiría entre los experimentos 1 y 2. Además, la abundancia de C. jejuni habría sido mayor ya que está bien establecido que después de la infección, los pollos de engorde acumulan rápidamente un alto número de C. jejuni en el contenido cecal dentro de los 3 días (Shanker et al., 1990). Por lo tanto, asumimos que se ha producido contaminación en la extracción de ADN.
En conclusión, el presente estudio muestra que el ensilaje de gramíneas inoculado con L. plantarum 256 (proporcionado como TMR) o agua suplementada con LP256 no son intervenciones efectivas contra la colonización por C. jejuni en pollos de engorde R-308 o RR. Sin embargo, las reducciones menores en C. jejuni observadas a 1 dpi en muestras fecales de R-308 sugieren que este enfoque aún podría explorarse y optimizarse para obtener mejores efectos. Sin embargo, debe tenerse en cuenta que debido a la expresión ufc/g, la reducción de la carga de C. jejuni en un grupo puede estar artificialmente sesgada en comparación con los otros grupos.
La optimización adicional podría implicar un cambio de un ensilaje a base de pasto a un ensilaje a base de trigo, ya que es probable que este último sea más apetecible para las aves y, por lo tanto, resulte en una mayor cantidad de LAB consumida. Esto podría inducir una mayor colonización intestinal y un efecto inhibitorio más fuerte sobre C. jejuni. Sin embargo, se necesita más investigación para confirmar esta hipótesis, junto con la evaluación de los niveles de inclusión de ensilaje a base de trigo en el rendimiento del pollo de engorde. Es evidente a partir de este trabajo que la presencia de C. jejuni, así como el tipo y la edad de los pollos de engorde, tuvieron efectos mucho mayores en la composición de la microbiota cecal que los diferentes aditivos para piensos.
Declaración de disponibilidad de datos
Los datos presentados en el estudio están depositados en el repositorio del NCBI, número de acceso PRJNA876811, https://www.ncbi.nlm.nih.gov/bioproject/PRJNA876811.
Declaración ética
El estudio en animales fue revisado y aprobado por el Comité de Ética de Uppsala para la Investigación Animal, Uppsala, Suecia. Protocolo número 5.8.18-16271/2017.
Contribuciones del autor
HWall, EI, KK y PE obtuvieron la financiación y diseñaron los experimentos, con HWall como líder del proyecto. EV, HWall, EI, PE, HWang y FD obtuvieron muestras durante el estudio. EV analizó, interpretó y compiló los datos. LS realizó el análisis bioinformático. FD y HWang realizaron el recubrimiento, la extracción de ADN y el análisis de qPCR. EV escribió la mayor parte del manuscrito, y PE y LS algunas partes. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Financiación
Este trabajo fue apoyado por el SLU EkoForsk, Universidad Sueca de Ciencias Agrícolas (2016.4.1-742-10).
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fmicb.2023.1205797/full#supplementary-material
Referencias
Abd El-Hack, M. E., El-Saadony, M. T., Shafi, M. E., Qattan, S. Y. A., Batiha, G. E., Khafaga, A. F., et al. (2020). Probióticos en la alimentación de aves de corral: una revisión exhaustiva. J. Anim. Physiol. Anim. Nutr. 104, 1835–1850. DOI: 10.1111/JPN.13454
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Achen, M., Morishita, T. Y. y Ley, E. C. (1998). Derramamiento y colonización de Campylobacter jejuni en pollos de engorde desde el día de la eclosión hasta la edad de sacrificio. Avian Dis. 42, 732–737. DOI: 10.2307/1592708
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Ali, Q., Ma, S., La, S., Guo, Z., Liu, B., Gao, Z., et al. (2022). Ácidos grasos microbianos de cadena corta: un puente entre las fibras dietéticas y la salud intestinal de las aves de corral: una revisión. Anim. Biosci. 35, 1461–1478. DOI: 10.5713/AB.21.0562
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Anderson, M. J. (2001). Un nuevo método para el análisis multivariado no paramétrico de varianza. Austral Ecol. 26, 32–46. doi: 10.1111/j.1442-9993.2001.01070.pp.x
Arsi, K., Donoghue, A., Wooming, A., Blore, P. y Donoghue, D. (2015). La eficacia de combinaciones probióticos y prebióticas seleccionadas en la reducción de la colonización de Campylobacter en pollos de engorde. J. Appl. Poult. 24, 327–334. DOI: 10.3382/japr/pfv032
Atterby, C., Mourkas, E., Méric, G., Pascoe, B., Wang, H., Waldenström, J., et al. (2018). El potencial de la fuente de aislamiento para predecir la colonización en huéspedes aviares: un estudio de caso en cepas de Campylobacter jejuni de tres especies de aves. Frente. Microbiol. 9:591. doi: 10.3389/fmicb.2018.00591
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Awad, W. A., Mann, E., Dzieciol, M., Hess, C., Schmitz-Esser, S., Wagner, M., et al. (2016). Diferencias relacionadas con la edad en el microbioma intestinal luminal y asociado a la mucosa de pollos de engorde y cambios asociados con la infección por Campylobacter jejuni. Frente. Celda. Infecta. Microbiol. 6:154. doi: 10.3389/fcimb.2016.00154
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Benjamini, Y., y Hochberg, Y. (1995). Controlar la tasa de descubrimiento falso: un enfoque práctico y poderoso para múltiples pruebas. J. R. Stat. Soc. Ser. B 57, 289–300. doi: 10.1111/j.2517-6161.1995.tb02031.x
Berrang, M. E., Buhr, R. J. y Cason, J. A. (2000). Recuperación de Campylobacter de órganos externos e internos de canales comerciales de pollos de engorde antes de escaldar. Poult. Sci. 79, 286–290. doi: 10.1093/ps/79.2.286
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Bokulich, N. A., Kaehler, B. D., Rideout, J. R., Dillon, M., Bolyen, E., Knight, R., et al. (2018). Optimización de la clasificación taxonómica de secuencias de amplicones de genes marcadores con el complemento q2-feature-classifier de QIIME 2. Microbioma 6:90. DOI: 10.1186/S40168-018-0470-Z
Bolyen, E., Rideout, J. R., Dillon, M. R., Bokulich, N. A., Abnet, C. C., Al-Ghalith, G. A., et al. (2019). Ciencia de datos de microbiomas reproducible, interactiva, escalable y extensible utilizando QIIME 2. Nat. Biotechnol. 37, 852–857. DOI: 10.1038/S41587-019-0209-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Callahan, B. J., McMurdie, P. J., Rosen, M. J., Han, A. W., Johnson, A. J. y Holmes, S. P. (2016). DADA2: inferencia de muestras de alta resolución a partir de datos de amplicones Illumina. Métodos 13, 581–583. DOI: 10.1038/NMETH.3869
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Chen, J., Bittinger, K., Charlson, E. S., Hoffmann, C., Lewis, J., Wu, G. D., et al. (2012). Asociar la composición del microbioma con covariables ambientales utilizando distancias UniFrac generalizadas. Bioinformática 28, 2106–2113. DOI: 10.1093/bioinformatics/BTS342
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Reglamento (CE) n.º 889/2008 de la Comisión. (2008). No 889/2008, de 5 de septiembre de 2008, por el que se establecen disposiciones de aplicación del Reglamento (CE) no 834/2007 del Consejo sobre producción y etiquetado de los productos ecológicos, en lo que respecta a la producción ecológica, su etiquetado y su control. Disponible en: https://eur-lex.europa.eu/ (consultado el 06 de marzo de 2023).
Connerton, P., Flaujac Lafontaine, G., O’Kane, P., Ghaffar, N., Cummings, N., Smith, D., et al. (2018). El efecto del momento de la exposición a Campylobacter jejuni en el microbioma intestinal y las respuestas inflamatorias de pollos de engorde. Microbioma 6:88. DOI: 10.1186/S40168-018-0477-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Cosby, W. M., Axelsson, L. T. y Dobrogosz, W. J. (1989). Transposición de Tn917 en Lactobacillus plantarum utilizando el plásmido altamente sensible a la temperatura pTV1Ts como vector. Plásmido 22, 236–243. doi: 10.1016/0147-619x(89)90006-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Crawley, K. (2015). Cumpliendo dietas avícolas 100% orgánicas: forraje y forrajeo de la gama. Disponible en: https://orgprints.org/id/eprint/28090/7/28090.pdf (consultado el 27 de marzo de 2023).
Di Marcantonio, L., Marotta, F., Vulpiani, M. P., Sonntag, Q., Iannetti, L., Janowicz, A., et al. (2022). Investigación de la microbiota cecal en granjas avícolas de engorde y sus posibles relaciones con el bienestar animal. Res. Vet. 144, 115–125. doi: 10.1016/j.rvsc.2022.01.020
Resumen de PubMed | Texto completo de CrossRef | Google Académico
EFSA (2020). Actualización y revisión de las opciones de control para Campylobacter en pollos de engorde en producción primaria. EFSA J. 18:E06090. doi: 10.2903/j.efsa.2020.6090
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Guyard-Nicodème, M., Keita, A., Quesne, S., Amelot, M., Poezevara, T., Le Berre, B., et al. (2016). Eficacia de los aditivos alimentarios contra Campylobacter en pollos de engorde vivos durante todo el período de cría. Poult. Sci. 95, 298–305. DOI: 10.3382/ps/pev303
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Heres, L., Engel, B., Urlings, H. A., Wagenaar, J. A. y van Knapen, F. (2004). Efecto de la alimentación acidificada sobre la susceptibilidad de pollos de engorde a la infección intestinal por Campylobacter y Salmonella. Veterinario Microbiol. 99, 259–267. doi: 10.1016/j.vetmic.2003.12.008
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Heres, L., Engel, B., Van Knapen, F., Wagenaar, J. A. y Urlings, B. A. (2003). Efecto del alimento fermentado sobre la susceptibilidad a la colonización por Campylobacter jejuni en pollos de engorde con y sin inoculación concurrente de Salmonella enteritidis. Int. J. Food Microbiol. 87, 75–86. doi: 10.1016/s0168-1605(03)00055-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Jong, I. C., Blaauw, X. E., van der Eijk, J. A. J., Souza da Silva, C., van Krimpen, M. M., Molenaar, R., et al. (2021). Proporcionar enriquecimientos ambientales afecta la actividad y el rendimiento, pero no la salud de las piernas en pollos de engorde de crecimiento rápido y más lento. Appl. Anim. Behav. Sci. 241:105375. doi: 10.1016/j.applanim.2021.105375
Katoh, K., Misawa, K., Kuma, K. y Miyata, T. (2002). MAFFT: un método novedoso para la alineación rápida de secuencias múltiples basado en la transformada rápida de Fourier. Ácidos nucleicos res. 30, 3059–3066. doi: 10.1093/nar/gkf436
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Kers, J. G., Velkers, F. C., Fischer, E. A. J., Hermes, G. D. A., Stegeman, J. A. y Smidt, H. (2018). Huésped y factores ambientales que afectan a la microbiota intestinal en pollos. Frente. Microbiol. 9:235. doi: 10.3389/fmicb.2018.00235
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Kruskal, W. H., y Wallis, W. A. (1952). Uso de rangos en el análisis de varianza de un criterio. J. Am. Stat. Assoc. 47, 583–621. DOI: 10.2307/2280779
Krysiak, K., Konkol, D. y Korczyński, M. (2021). Visión general del uso de probióticos en la producción avícola. Animales 11:1620. DOI: 10.3390/ANI11061620
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Mandal, S., Van Treuren, W., White, R. A., Eggesbø, M., Knight, R. y Peddada, S. D. (2015). Análisis de la composición de los microbiomas: un método novedoso para estudiar la composición microbiana. Microb. Ecol. Health Dis. 26:27663. doi: 10.3402/mehd.v26.27663
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Neal-McKinney, J. M., Lu, X., Duong, T., Larson, C. L., Call, D. R., Shah, D. H., et al. (2012). La producción de ácidos orgánicos por lactobacilos probióticos se puede utilizar para reducir la carga de patógenos en las aves de corral. PLoS One 7:e43928. doi: 10.1371/journal.pone.0043928
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Oakley, B. B., Lillehoj, H. S., Kogut, M. H., Kim, W. K., Maurer, J. J., Pedroso, A., et al. (2014). El microbioma gastrointestinal del pollo. FEMS Microbiol. Lett. 360, 100–112. doi: 10.1111/1574-6968.12608
Pedregosa, F., Varoquaux, G., Gramfort, A., Michel, V., Thirion, B., Grisel, O., et al. (2012). Scikit-learn: aprendizaje automático en python. J. Mach. Aprender. Res. 12, 2825–2830. doi: 10.48550/arXiv.1201.0490
Pourabedin, M. y Zhao, X. (2015). Prebióticos y microbiota intestinal en pollos. FEMS Microbiol. Lett. 362:FNV122. doi: 10.1093/femsle/fnv122
Prabhurajeshwar, C. y Chandrakanth, K. (2019). Evaluación in vitro de las propiedades antimicrobianas y sus sustancias frente a bacterias patógenas mediante cepas probióticas de Lactobacilos aisladas de yogur comercial. Clin. Nutr. Exp. 23, 97–115. doi: 10.1016/j.yclnex.2018.10.001
Price, M. N., Dehal, P. S. y Arkin, A. P. (2010). FastTree 2 – árboles de máxima verosimilitud aproximada para alineaciones grandes. PLoS One 5:e9490. doi: 10.1371/journal.pone.0009490
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Quast, C., Pruesse, E., Yilmaz, P., Gerken, J., Schweer, T., Yarza, P., et al. (2013). El proyecto de base de datos de genes de ARN ribosómico SILVA: procesamiento de datos mejorado y herramientas basadas en la web. Ácidos nucleicos res. 41, D590–D596. doi: 10.1093/nar/gks1219
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Quentin, M., Bouvarel, I., y Picard, M. (2004). Efectos a corto y largo plazo de la forma de alimento en pollos de engorde de crecimiento rápido y lento. J. Appl. Poult. 13, 540–548. DOI: 10.1093/JAP/13.4.540
Equipo central de R (2021). R: Un lenguaje y entorno para la computación estadística. R Foundation for Statistical Computing: Viena, Austria.
Ranjitkar, S., Lawley, B., Tannock, G. y Engberg, R. M. (2016). Sucesión bacteriana en el tracto gastrointestinal de pollos de engorde. Aplicación. Entorno. Microbiol. 82, 2399–2410. doi: 10.1128/AEM.02549-15
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Richards, P., Fothergill, J., Bernardeau, M. y Wigley, P. (2019). Desarrollo de la microbiota cecal en tres razas de pollos de engorde. Frente. Vet. Sci. 6:201. doi: 10.3389/fvets.2019.00201
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Rinttilä, T. y Apajalahti, J. (2013). Microbiota intestinal y metabolitos: implicaciones para la salud y el rendimiento de los pollos de engorde. J. Appl. Poultry Res. 22, 647–658. DOI: 10.3382/japr.2013-00742
Rudi, K., Høidal, H. K., Katla, T., Johansen, B. K., Nordal, J. y Jakobsen, K. S. (2004). Cuantificación directa por PCR en tiempo real de Campylobacter jejuni en muestras fecales y cecales de pollo mediante concentración celular integrada y purificación de ADN. Aplicación. Entorno. Microbiol. 70, 790–797. DOI: 10.1128/AEM.70.2.790-797.2004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Rychlik, I. (2020). Composición y función de la microbiota intestinal del pollo. Animales 10:103. doi: 10.3390/ani10010103
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Saint-Cyr, M. J., Haddad, N., Taminiau, B., Poezevara, T., Quesne, S., Amelot, M., et al. (2017). Uso de la cepa probiótica potencial Lactobacillus salivarius SMXD51 para controlar Campylobacter jejuni en pollos de engorde. Int. J. Food Microbiol. 247, 9–17. doi: 10.1016/j.ijfoodmicro.2016.07.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Sakaridis, I., Ellis, R. J., Cawthraw, S. A., van Vliet, A. H. M., Stekel, D. J., Penell, J., et al. (2018). Investigar la asociación entre los microbiomas cecales de pollos de engorde y la carga de Campylobacter. Frente. Microbiol. 9:927. doi: 10.3389/fmicb.2018.00927
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Sarica, M., Yamak, U., Boz, M., Erensoy, K., Cilavdaroğlu, E. y Noubandiguim, M. (2020). Rendimiento de pollos de engorde de crecimiento rápido, medio y lento en sistemas de producción en interiores y en libertad. South Afr. J. Anim. 49, 1127–1138. doi: 10.4314/sajas.v49i6.16
SAS Institute Inc. (2013). Guía de procedimientos base SAS® 9.4: procedimientos estadísticos. Cary, NC: SAS Institute Inc.
Shanker, S., Lee, A., y Sorrell, T. C. (1990). Transmisión horizontal de Campylobacter jejuni entre pollos de engorde: estudios experimentales. Epidemiol. Infecta. 104, 101–110. doi: 10.1017/s0950268800054571
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Smialek, M., Joanna, K. y Koncicki, A. (2021). El uso de probióticos en la reducción de la prevalencia de Campylobacter spp. en aves de corral. Animales 11:1355. DOI: 10.3390/ANI11051355
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Sofka, D., Pfeifer, A., Gleiss, B., Paulsen, P. y Hilbert, F. (2015). Cambios en la flora intestinal de pollos de engorde por colonización con Campylobacter jejuni. Berl. Ronzar. Tierarztl. Wochenschr. 128, 104–110. DOI: 10.2376/0005-9366-128-104
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Stanley, D., Geier, M. S., Hughes, R. J., Denman, S. E. y Moore, R. J. (2014). Desarrollo de microbiota altamente variable en el tracto gastrointestinal del pollo. PLoS One 8:e84290. doi: 10.1371/journal.pone.0084290
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Sugiharto, S. (2016). Papel de los nutracéuticos en la salud intestinal y el rendimiento de crecimiento de las aves de corral. J. Saudi Soc. Agric. Sci. 15, 99–111. doi: 10.1016/j.jssas.2014.06.001
Asociación Sueca de Carne de Aves de Corral (2021). Årsrapport 2020. Disponible en: https://svenskfagel.se/wp-content/uploads/2022/03/arsrapport-2021-popular-slutgiltig-campylobacter.pdf (consultado el 10 de febrero de 2023).
Valečková, E., Ivarsson, E., Ellström, P., Wang, H., Mogodiniyai Kasmaei, K. y Wall, H. (2020). Ensilaje y heno como forraje en pollos de engorde de crecimiento lento y rápido: efectos sobre el rendimiento en aves infectadas con Campylobacter jejuni. Fr. Poult. Sci. 61, 433–441. doi: 10.1080/00071668.2020.1736515
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Weiss, S., Xu, Z. Z., Peddada, S., Amir, A., Bittinger, K., Gonzalez, A., et al. (2017). Las estrategias de normalización y abundancia diferencial microbiana dependen de las características de los datos. Microbioma 5:27. DOI: 10.1186/S40168-017-0237-Y
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Wickham, H (2016). ggplot2: gráficos elegantes para el análisis de datos. Springer-Verlag: Nueva York.
Palabras clave: Lactobacillus plantarum, Campylobacter jejuni, pollos de engorde, microbiota intestinal, qPCR, secuenciación
Cita: Valečková E, Sun L, Wang H, Dube F, Ivarsson E, Kasmaei KM, Ellström P y Wall H (2023) La colonización intestinal con Campylobacter jejuni afecta la composición de la microbiota intestinal de pollos de engorde, pero no es inhibida por la ingesta diaria de Lactiplantibacillus plantarum. Frente. Microbiol. 14:1205797. doi: 10.3389/fmicb.2023.1205797
Recibido: 14 de abril de 2023; Aprobado: 12 de julio de 2023;
Publicado: 28 julio 2023.
Editado por:
Rebeca Martín, INRAE Centre Jouy-en-Josas, Francia
Revisado por:
Anand Kumar, Laboratorio Nacional de Los Álamos (DOE), Estados Unidos
Viera Karaffová, Universidad de Medicina Veterinaria y Farmacia en Košice, Eslovaquia
Derechos de autor © 2023 Valečková, Sun, Wang, Dube, Ivarsson, Kasmaei, Ellström y Wall. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Eliška Valečková, eliska.valeckova@slu.se
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

