La interleucina-7 mejora el desarrollo in vitro
 La interleucina-7 mejora el desarrollo in vitro y la calidad del blastocisto en embriones partenogenéticos porcinos
La interleucina-7 mejora el desarrollo in vitro y la calidad del blastocisto en embriones partenogenéticos porcinos
 DongjinOh1,2
DongjinOh1,2  Hyerin Choi1,2
Hyerin Choi1,2  Mirae Kim1,2
Mirae Kim1,2  Lian Cai1,2,3
Lian Cai1,2,3  Joohyeong Lee1,2
Joohyeong Lee1,2  Ali Jawad1,2
Ali Jawad1,2  Sohee Kim1,2
Sohee Kim1,2  Haomiao Zheng1,2
Haomiao Zheng1,2  Gabsang Lee4
Gabsang Lee4  Yubyeol Jeon5*
Yubyeol Jeon5*  Sang-Hwan Hyun1,2,3*
Sang-Hwan Hyun1,2,3*- 1Laboratorio de Embriología Veterinaria y Biotecnología (VETEMBIO), Centro Médico Veterinario y Facultad de Medicina Veterinaria, Universidad Nacional de Chungbuk, Cheongju, Corea del Sur
- 2Instituto de Células Madre y Medicina Regenerativa (ISCRM), Universidad Nacional Chungbuk, Cheongju, Corea del Sur
- 3Escuela de Graduados de Bioseguridad y Protección Veterinaria, Universidad Nacional Chungbuk, Cheongju, Corea del Sur
- 4Departamento de Neurología, Instituto de Ingeniería Celular, Facultad de Medicina, Johns Hopkins Medicine, Baltimore, ML, Estados Unidos
- 5Laboratorio de Teriogenología y Biotecnología Reproductiva, Facultad de Medicina Veterinaria, Universidad Nacional de Jeonbuk, Iksan, Corea del Sur
La interleucina-7 (IL-7), un factor vital que afecta el desarrollo, la proliferación y la supervivencia celular, juega un papel importante en la maduración de los ovocitos. Sin embargo, su papel en el desarrollo embrionario sigue siendo desconocido. Por lo tanto, en este estudio, nuestro objetivo fue investigar los efectos de la suplementación con IL-7 en el cultivo in vitro (VCI) de embriones porcinos después de la activación partenogenética (PA) en función de características como la escisión, la tasa de formación de blastocistos, los niveles de glutatión intracelular (GSH) y especies reactivas de oxígeno (ROS) en embriones hendidos, el número total de células, la tasa de apoptosis y la especificación del linaje celular en blastocistos. La inmunofluorescencia reveló que IL-7 y su receptor, IL-7Rα (IL-7R) localizados en el citoplasma de embriones de partenote porcino. Al complementar el medio IVC (PZM5) con varias concentraciones de IL-7, se determinó una concentración óptima que mejoró el desarrollo embrionario, promovió el GSH intracelular y disminuyó los niveles de ROS en la etapa de escisión durante la VCI del embrión porcino. La investigación de los patrones de expresión de ARNm a través de qRT-PCR sugirió que la IL-7 posiblemente regulaba la eliminación del ARNm materno y la activación del genoma cigótico. Además, la suplementación con IL-7 redujo la apoptosis de blastocistos, mejoró la expresión del marcador de masa celular interna SOX2 y fosforiló los niveles de STAT5 en los blastocistos. Además, alteró los patrones de transcripción de los genes que regulan la apoptosis, la señalización de IL-7 y el desarrollo. Por lo tanto, demostramos la localización de IL-7 e IL-7R en embriones preimplantacionales porcinos in vitro por primera vez. Además, sugerimos que la suplementación con IL-7 se puede emplear para mejorar el desarrollo embrionario y la calidad del blastocisto en función de la activación de las transcripciones de genes que están involucrados en la competencia del desarrollo y la señalización de IL-7 durante el desarrollo in vitro del embrión porcino después de la AP.
Introducción
Las tecnologías de reproducción asistida (ART), como la fertilización in vitro (FIV) y la criopreservación de embriones, facilitan la concepción en animales domésticos con problemas de fertilidad. La transferencia de embriones es el paso más crítico en la FIV, y su tasa de éxito depende de varios factores, incluida la calidad del embrión y la técnica utilizada (1). En la ganadería y la medicina veterinaria, la industria porcina es considerablemente importante, siendo la gestión de la productividad porcina un aspecto clave en esta última categoría. Dado que la preservación de los recursos genéticos en cerdos reproductores y el comercio internacional de embriones fertilizados se han vuelto activos, el uso de TAR como el cultivo in vitro (IVC) y la criopreservación de embriones fertilizados derivados de cerdos reproductores ha aumentado rápidamente (2, 3).
Los cerdos sirven como modelos útiles en varias áreas de investigación, como la biotecnología reproductiva, la transgénesis y la biomedicina. También pueden servir como donantes de órganos adecuados en medicina regenerativa y modelos de enfermedades humanas debido a las similitudes genéticas, anatómicas y fisiológicas entre ellos y los humanos (4, 5). Por ejemplo, las células madre embrionarias (ESC) derivadas de blastocistos de cerdo son herramientas poderosas para estudios preliminares sobre enfermedades humanas (6), y para obtener ESC de blastocistos cultivados in vitro, la calidad del blastocisto es un factor importante a tener en cuenta.
En varios estudios, se han agregado varios componentes, como antioxidantes, factores de crecimiento y hormonas, al medio de cultivo de embriones para aumentar la probabilidad de obtener embriones de alta calidad in vitro (7-9). Específicamente, las citoquinas actúan como reguladores de la fisiología ovárica, creando un ambiente embrionario inmunopermisivo que fomenta la gametogénesis, la fertilización, el desarrollo embrionario temprano, la eclosión e implantación de blastocistos y el crecimiento fetal (10-14). El papel reproductivo de las interleucinas (IL) como citocinas se ha demostrado en varios estudios. Por ejemplo, los IL como IL-1β, IL-6 e IL-8 interactúan con los ovocitos y sus células somáticas circundantes durante la foliculogénesis (15). Aunque se han identificado varias familias de IL, sus roles funcionales en el desarrollo embrionario aún no se han aclarado suficientemente.
La IL-7, que es miembro de la superfamilia IL-2, desempeña un papel esencial en la supervivencia y el desarrollo de las células T y B del sistema inmunitario (16). Además, señala al unirse al complejo receptor de IL-7, que comprende IL-7Rα (IL-7R) y el receptor de citoquinas común de cadena γ (IL-2RG) (17). También regula las señales antiapoptóticas y proliferativas a través de las vías Janus quinasa-signal transductor y activador de la transcripción (JAK-STAT) y fosfoinositida 3-quinasa (PI3K). Además, modula a los miembros de la familia del linfoma de células B 2 (BCL2) (18). En el sistema reproductivo, se ha detectado IL-7 tanto en el líquido folicular humano (19, 20) como en el porcino (FF) (21), y se han descrito sus funciones funcionales en los ovocitos y las células somáticas circundantes en varias especies (22). Además, se ha observado que el tratamiento con IL-7 modula la fosforilación de las proteínas AKT y STAT5 e inhibe la apoptosis en células de la granulosa de rata (23). Sin embargo, el papel funcional de IL-7 en el desarrollo embrionario de animales domésticos sigue siendo desconocido y requiere más investigación.
En el presente estudio, para aclarar el papel funcional de IL-7 durante la VCI embrionaria, primero investigamos la presencia de proteínas IL-7 e IL-7R en embriones porcinos preimplantacionales mediante inmunotinción. Posteriormente, exploramos los efectos de la suplementación con IL-7 durante la VCI sobre el desarrollo embrionario, los niveles de glutatión intracelular (GSH), los niveles de especies reactivas de oxígeno (ROS) y la apoptosis en embriones de partenote porcino cultivados in vitro. Los niveles de expresión de ARNm de genes específicos en la escisión derivada de la activación partenogenética (PA) y blastocistos tratados con IL-7 se examinaron mediante reacción en cadena de la polimerasa con transcriptasa inversa cuantitativa (qRT-PCR). Finalmente, la expresión del marcador de masa celular interna (ICM) (SOX2) y STAT5 fosforilada (pSTAT5), que están relacionados con la señalización de IL-7, se confirmaron mediante inmunotinción. Creemos que nuestro estudio aporta información importante que puede utilizarse para mejorar la calidad del blastocisto porcino durante la VCI.
Materiales y métodos
Productos químicos y reactivos
La IL-7 humana recombinante fue comprada a PeproTech (Londres, Reino Unido). A menos que se indique lo contrario, todos los productos químicos y reactivos utilizados en este estudio se obtuvieron de Sigma-Aldrich (St. Louis, MO, EUA).
Recolección de ovocitos y maduración in vitro
Los ovarios porcinos se recogieron de un matadero local y se transportaron al laboratorio en 1 h en solución de NaCl al 0,9% (v/v) a 37°C. En el laboratorio, los ovarios se lavaron dos veces con solución de NaCl al 0,9% (v/v) y, posteriormente, se recuperaron complejos cúmulo-ovocitos (AOC) de folículos de tamaño mediano (3-7 mm de diámetro) (24) utilizando una aguja de calibre 18 y una jeringa desechable de 10 ml y se recogieron en tubos cónicos de 15 ml. Los AOC se lavaron con medio Tyrode’s tamponado con HEPES que contenía alcohol polivinílico al 0,05% (p/v) (TLH-PVA). Luego, se cultivaron 50-60 AOC con capas de células cúmulos compactas y citoplasma granulado uniformemente en una placa de cuatro pocillos (Nunc, Roskilde y Dinamarca) que contenía 500 μL de medio IVM, que consistía en TCM-199 (Invitrogen Corporation, Carlsbad, CA, EUA) suplementado con 0.6 mM de cisteína, 0.91 mM de piruvato de sodio, 10 ng / ml de factor de crecimiento epidérmico, 75 μg / ml de kanamicina, 1 μg / ml de insulina, y 10% (v/v) de FF porcino. El proceso de GIV se llevó a cabo durante un período de 42 h. Esto fue seguido por la incubación de los AOC con 10 UI/mL de gonadotropina coriónica equina y 10 UI/mL de gonadotropina coriónica humana a 39°C en un 5% de CO humidificado2 atmósfera primero durante 22 h, después de lo cual los AOC se transfirieron a un medio IVM libre de hormonas y luego se incubaron durante las 20 h restantes.
Activación partenogenética y cultivo in vitro de embriones porcinos
La AF se realizó de acuerdo con un protocolo previamente reportado (25). Brevemente, después de la MIV, se obtuvieron ovocitos en estadio metafase II (MII) mediante pipeteo mecánico que encerraba células cúmulos en presencia de hialuronidasa al 0,1% durante 1 min. Después de lavar dos veces con la solución de activación (solución de manitol de 280 mM que contiene 0,01 mM de CaCl2 y 0,05 mM MgCl2), los ovocitos MII se activaron en 2 mL de la misma solución con dos pulsos eléctricos directos de 120 V/mm durante 60 μs, utilizando un generador de fusión celular (LF101; NepaGene, Chiba, Japón). Posteriormente, los ovocitos se cultivaron en el medio IVC (medio cigoto porcino 5; PZM5) (26) que contiene 5 μg/ml de citocalasina B durante 4 h en atmósfera humidificada de 5% de CO2, 5% O2, y 95% N2. Luego, los embriones activados eléctricamente se lavaron tres veces en gotitas de medio IVC (30 μL) y se incubaron en las mismas gotitas (10 embriones por gota) cubiertas con aceite mineral. La AF se realizó el día 0. Los embriones se trasladaron a gotitas frescas 48 (día 2) y 96 h (día 4) después de la AF. En el día 2, las tasas de escisión embrionaria se analizaron en cinco categorías (embriones de 1, 2-3, 4-5, 6-8 células y embriones fragmentados). El día 7, el desarrollo embrionario se evaluó cuantitativamente determinando las tasas de escisión y formación de blastocisto en tres grupos, de acuerdo con la morfología del blastocisto (temprano, expandido y eclosionado). Durante todo el período de la IVC, se agregó IL-7 a los medios de la IVC en concentraciones de 0 (control), 0.1, 1, 10 y 100 ng / ml.
Medición de los niveles intracelulares de GSH y ROS
Los niveles intracelulares de GSH y ROS se midieron utilizando un método previamente informado (27). Los embriones en etapa de 4 a 5 células en cada grupo fueron muestreados el día 2 para hacer estas mediciones. CellTracker Blue 4-clorometil-6,8-difluoro-7-hidroxicumarina (CMF)2HC; Invitrogen) y diacetato de 2’7′-diclorodihidrofluoresceína (H2DCFDA; Invitrogen) se utilizaron para medir los niveles intracelulares de GSH (fluorescencia azul) y ROS (fluorescencia verde) en el citoplasma embrionario. En resumen, los embriones se transfirieron a un medio TLH-PVA que contenía 10 μM de CMF2HC o H2DCFDA y teñido en la oscuridad durante 30 y 10 min, respectivamente. Posteriormente, los embriones se lavaron tres veces con TLH-PVA y se transfirieron a gotitas de 8 μL de TLH-PVA. Los niveles de GSH y ROS se obtuvieron imágenes utilizando un microscopio de fluorescencia (TE300; Nikon, Tokio, Japón) con filtros UV (370 nm para GSH y 460 nm para ROS). Finalmente, se utilizó Adobe Photoshop 2021 para analizar la intensidad de fluorescencia de cada embrión, que se normalizó a la del grupo control.
Ensayo de etiquetado de extremo de nick dUTP mediado por desoxinucleotidiltransferasa terminal
Los blastocistos se tiñeron con TUNEL para determinar el número de células apoptóticas utilizando un kit de detección de muerte celular in situ (Roche, Mannheim, Alemania), de acuerdo con un método previamente informado (28). El día 7, los blastocistos derivados del medio IVC se trataron con 0, 0,1, 1, 10 y 100 ng/mL de IL-7, se lavaron tres veces en PBS-PVA (PVS) al 0,1% y se fijaron en paraformaldehído al 4% en PBS durante 30 min a 25°C (temperatura ambiente; RT). En el siguiente paso, los blastocistos se lavaron dos veces en PVS al 0,1% con Tween 0 al 1,20% y Triton X-0 al 01,100% (v/v) y se permeabilizaron con TritonX-0 al 3,100% en PBS durante 1 h a 37°C. Finalmente, el ensayo TUNEL se realizó utilizando trifosfato de desoxiuridina conjugado con fluoresceína (dUTP) y desoxinucleotidiltransferasa terminal (Roche, Mannheim, Alemania) durante 1 h 30 min a 37°C. Después de lavar dos veces en PVS al 0,1%, los blastocistos se contrastaron con 5 μg/mL Hoechst-33342 durante 10 min en RT para visualizar los núcleos.
Reacción en cadena de la polimerasa con transcripción inversa cuantitativa
La expresión del ARNm se analizó mediante qRT-PCR para 19 genes específicos asociados con diferentes funciones, como genes relacionados con la apoptosis: BCL2 associated X (BAX), BCL2 like 1 (BCL2L1), caspasa-3 (CASP3) y leucemia mieloide celular 1 (MCL1); genes relacionados con la señalización de IL-7: subunidad reguladora de fosfoinositida-3-quinasa 1 (PIK3R1), AKT serina/treonina quinasa 1 (AKT1) y quinasa regulada extracelular 1/2 (ERK1/2; también conocida como MAPK3/1); genes relacionados con el desarrollo embrionario: antígeno nuclear de células proliferantes (PCNA), POU clase 5 homeobox 1 (OCT4), NANOG, homeobox 2 de tipo caudal (CDX2) y proteína de unión a GATA 6 (GATA6); genes de efecto materno (MEGs): dominio KH que contiene 3 like (KHDC3L; Filia), nucleofosmina/nucleoplasmina 2 (NPM2) y detención del cigoto 1 (ZAR1); genes relacionados con la activación del genoma cigótico (ZGA): miembro 34 (SLC2A34) de la familia de portadores de solutos 2, pluripotencia del desarrollo asociada 2 (DPPA2) y factor de iniciación de la traducción eucariota 1A (EIF1A). Todas las secuencias de cebadores se enumeran en la Tabla Suplementaria 1.
El día 2, los embriones y blastocistos se lavaron tres veces con PVS y se tomaron muestras a -80 ° C antes del experimento. La extracción de ARN se realizó utilizando el reactivo TRIzol (TaKaRa Bio, Inc., Otsu, Shiga, Japón), de acuerdo con el protocolo del fabricante. Luego, el ARN extraído (1 μg de ARN total) se convirtió en ADN complementario (ADNc) utilizando SuperScript IV VILO Master Mix (Thermo Fisher Scientific, MA, EUA). Finalmente, se utilizó el ADNc sintetizado, 2× SYBR Premix Ex Taq (TaKaRa Bio, Inc.) y 5 pmol de cebadores específicos (Macrogen, Inc., Seúl, República de Corea) para qRT-PCR. La expresión de ARNm se analizó utilizando el sistema de detección de PCR en tiempo real CFX96 Touch (Bio-Rad, Hercules, CA, EUA). Los parámetros de ciclismo fueron los siguientes: 95 ° C durante 5 min, seguido de 40 ciclos de 95 ° C durante 15 s, 56 ° C durante 15 s y 72 ° C durante 30 s. La cuantificación relativa se realizó comparando el ciclo umbral (Ct) a intensidad de fluorescencia constante. La expresión relativa de ARNm (R) se calculó utilizando la ecuación R = 2−[ΔCtsample−ΔCtcontrol] (29). Los valores de R se normalizaron a los de RN18S en los blastocistos de cada grupo.
Inmunofluorescencia
La inmunofluorescencia se realizó de acuerdo con los métodos de Yoon et al. (8), con algunas modificaciones. Brevemente, los ovocitos y embriones MII se fijaron con paraformaldehído al 4% en PBS durante 30 min en RT, se permeabilizaron en Triton X-0 al 5,100% durante 1 h en RT y se lavaron dos veces con PVS al 0,1%. Los ovocitos o embriones MII fueron tratados con Image-iT™ FX Signal Enhancer (Invitrogen, Carlsbad, CA, EUA) durante 30 min en RT y bloqueados en PBS con 3% BSA y 0,05% Tween 20, durante 1 h 30 min en RT. Las muestras se incubaron durante la noche a 4 °C con los siguientes anticuerpos primarios: anti-IL-7 de conejo (ab 175380, dilución 1:50 en solución de bloqueo; Abcam, Cambridge, Reino Unido), conejo anti-IL-7R (ab 180521, 1:100; Abcam), ratón anti-SOX2 (sc-365823, 1:100; Santa Cruz Biotechnology, Santa Cruz, CA, EUA), y ratón anti-fosfo-STAT5 (ab 106095, 1:25; Abcam). Al día siguiente, las muestras se lavaron tres veces durante 5 min con 0,1% Tween 20 y Triton X-0 al 01,100% en PVS al 0,1% (TTVS) en RT y luego se incubaron con los anticuerpos secundarios apropiados: cabra anti-ratón IgG (H + L) Alexa FluorTM 488 (A11029, 1:200; Invitrogen Corporation, Carlsbad, CA, USA), burro anti-conejo IgG (H + L) Alexa FluorTM 594 (A21207, 1:400; Invitrogen) durante 2 h en RT. Después de lavar tres veces en TTVS, las muestras se contrastaron con Hoechst-33342 durante 10 min y se montaron en portaobjetos de vidrio en un medio de montaje anti-decoloración (Molecular Probes, Inc., Eugene, OR, USA). Las muestras teñidas se analizaron utilizando un microscopio de epifluorescencia (TE300; Nikon) con filtros UV. Las células SOX2 positivas se examinaron específicamente en blastocistos con más de 30 células el día 7.
Análisis estadístico
El análisis estadístico se realizó con SPSS 21.0 (SPSS Inc., Chicago, IL, USA). Los experimentos se realizaron al menos por triplicado a menos que se indique lo contrario. Además, los resultados se presentaron como la media ± SEM. Los datos porcentuales (tasas de escisión y formación de blastocistos) y los datos promedio (niveles intracelulares de GSH y ROS en la escisión, ensayo TUNEL en blastocistos, niveles relativos de expresión génica y análisis cuantitativo en inmunofluorescencia) se analizaron mediante análisis unidireccional de varianza o prueba t de Student. La significación estadística se estableció en p < 0,05.
Resultados
Localización de proteínas IL-7 e IL-7R en embriones preimplantacionales porcinos
Para identificar las ubicaciones de IL-7 e IL-7R en ovocitos y embriones porcinos en cada etapa, recolectamos ovocitos MII después de la MIV y tomamos muestras de embriones y blastocistos de 2, 4 y 8 células a las 24, 48, 72 y 168 h después de la AF, respectivamente. La localización de las proteínas IL-7 e IL-7R durante el desarrollo preimplantacional se investigó mediante inmunofluorescencia. Tanto IL-7 como IL-7R se expresaron en ovocitos MII (Figura 1A). Además, estas proteínas se observaron en los embriones en estadio de 2, 4 y 8 células (Figuras 1B-D). También se encontró que la IL-7 y su receptor estaban localizados en el citoplasma hasta el estadio de blastocisto (Figura 1E).
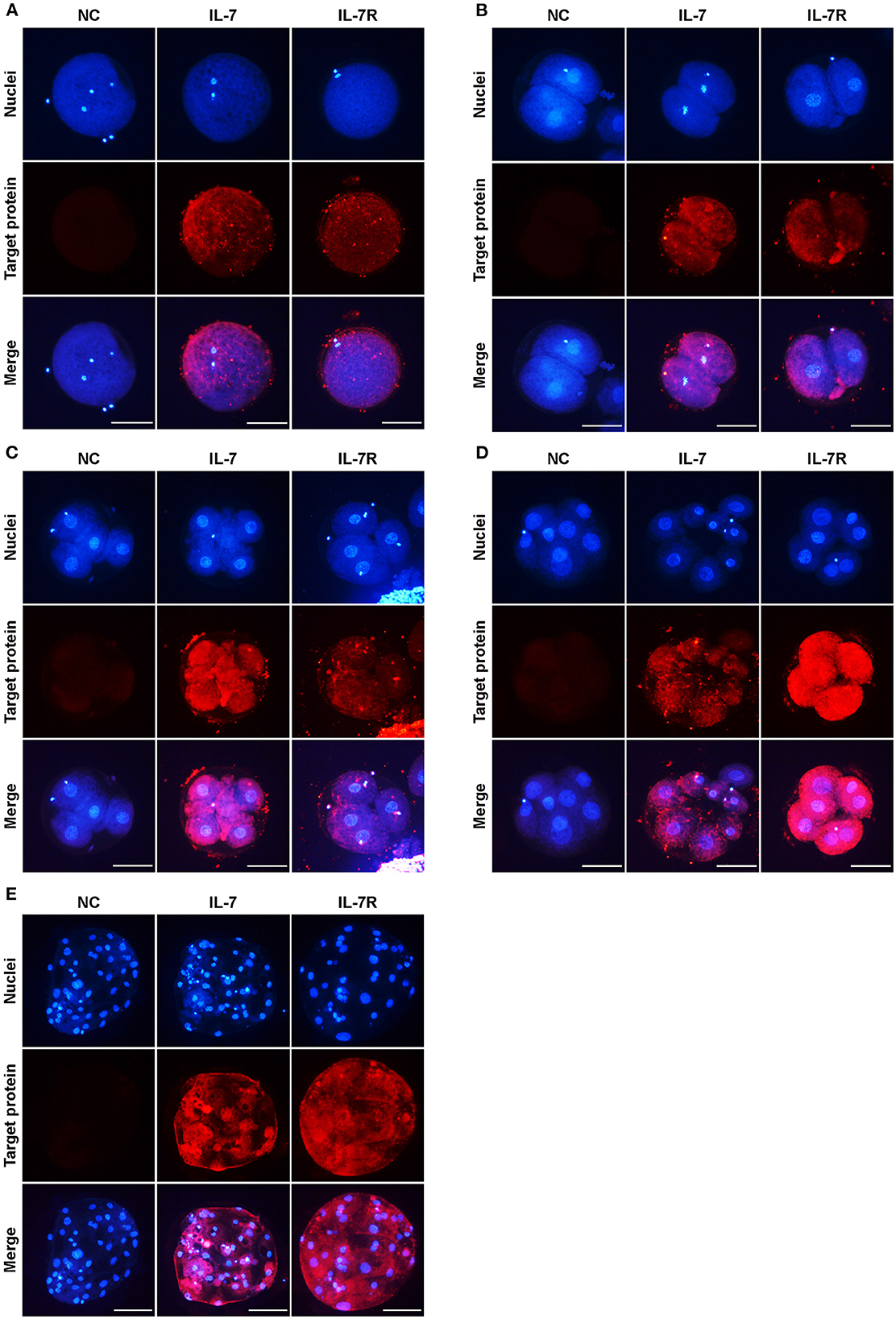 Figura 1. Localización de IL-7 e IL-7R en embriones porcinos preimplantacionales. Los ovocitos porcinos en la etapa metafase II (MII) (A) y los embriones en las etapas 2- (B), 4- (C), 8 células (D) y blastocisto (E) recolectados a las 0, 24, 48, 72 y 168 h después de PA, respectivamente, se tiñeron con anticuerpos contra IL-7 e IL-7R. Barra de escala: 100 μm.
Figura 1. Localización de IL-7 e IL-7R en embriones porcinos preimplantacionales. Los ovocitos porcinos en la etapa metafase II (MII) (A) y los embriones en las etapas 2- (B), 4- (C), 8 células (D) y blastocisto (E) recolectados a las 0, 24, 48, 72 y 168 h después de PA, respectivamente, se tiñeron con anticuerpos contra IL-7 e IL-7R. Barra de escala: 100 μm.
Efectos de la suplementación con IL-7 durante la VCI en el desarrollo embrionario porcino después de PA
Agregamos IL-7 en varias concentraciones durante la VCI para determinar su concentración óptima para el desarrollo embrionario porcino después de la AF. Las tasas de escisión aumentaron significativamente (p < 0,05) en los grupos tratados con IL-10 de 100 y 7 ng/ml en comparación con el grupo control (Tabla 1 y Figura 2). Además, las tasas de formación de blastocisto fueron significativamente mayores (p < 0,05) en el grupo tratado con 10 ng/mL IL-7 que en el grupo control. Los patrones de escisión en el día 2 también revelaron que las tasas de embriones fragmentados fueron significativamente menores (p < 0,05) en los grupos tratados con IL-1 de 10 y 7 ng/ml que en el grupo control (Figura 2B).
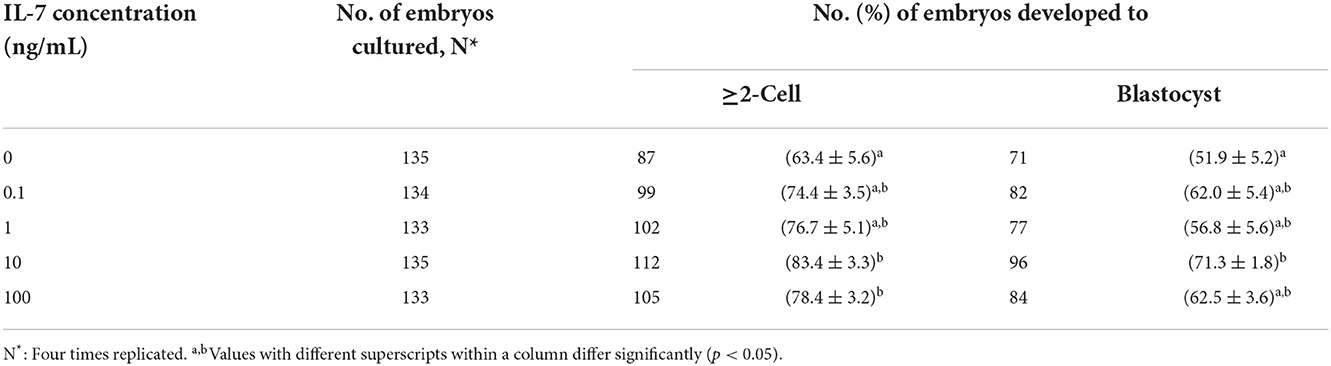 Tabla 1. Efecto de la suplementación con IL-7 durante la VCI en el desarrollo embrionario después de la AP.
Tabla 1. Efecto de la suplementación con IL-7 durante la VCI en el desarrollo embrionario después de la AP.
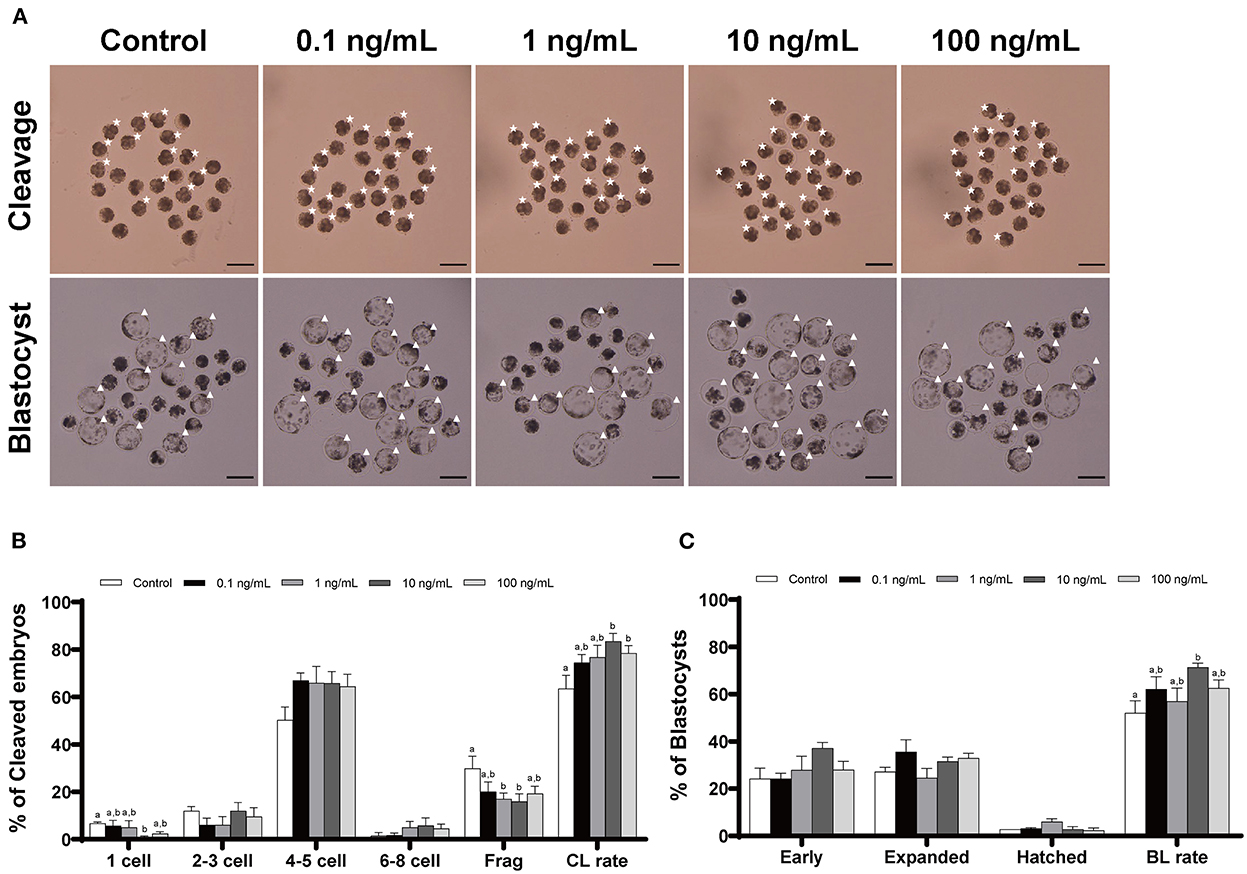 Figura 2. Efecto de la suplementación con IL-7 durante la VCI sobre los patrones de escisión y formación de blastocisto de embriones de PA. (A) Imagen representativa de la morfología de embriones escindidos y blastocistos de cada grupo después de la AF. Asterisco, embrión escindido; Triángulo, blastocisto. Barra de escala: 200 μm. El patrón de escisión (B) y la tasa de formación de blastocisto (C) de los embriones de PA. Dentro de cada punto final, las barras con diferentes letras (a, b) indican diferencias significativas (p < 0,05) a varias concentraciones de IL-7. Fragmentación, fragmentación; CL: escote; BL: blastocisto. Las tasas de escisión y formación de blastocisto se evaluaron el día 2 y 7 después de la AF, respectivamente. Para todos los gráficos, los valores representan la media ± SEM. El experimento fue replicado cuatro veces.
Figura 2. Efecto de la suplementación con IL-7 durante la VCI sobre los patrones de escisión y formación de blastocisto de embriones de PA. (A) Imagen representativa de la morfología de embriones escindidos y blastocistos de cada grupo después de la AF. Asterisco, embrión escindido; Triángulo, blastocisto. Barra de escala: 200 μm. El patrón de escisión (B) y la tasa de formación de blastocisto (C) de los embriones de PA. Dentro de cada punto final, las barras con diferentes letras (a, b) indican diferencias significativas (p < 0,05) a varias concentraciones de IL-7. Fragmentación, fragmentación; CL: escote; BL: blastocisto. Las tasas de escisión y formación de blastocisto se evaluaron el día 2 y 7 después de la AF, respectivamente. Para todos los gráficos, los valores representan la media ± SEM. El experimento fue replicado cuatro veces.
Effects of IL-7 supplementation during IVC on intracellular levels of GSH and ROS in cleaved embryos
Para examinar el efecto de IL-7 sobre el estrés oxidativo, analizamos los niveles intracelulares de GSH y ROS en embriones de 4 células el día 2 después de PA (Figura 3). Los grupos de tratamiento con IL-1 de 10 y 7 ng/ml mostraron niveles de GSH intracelular significativamente más altos (p < 0,05) que el grupo control. Además, los embriones en el grupo de tratamiento con IL-10 de 7 ng / ml mostraron niveles de ROS intracelular significativamente más bajos (p < 0.05) que los del grupo de control.
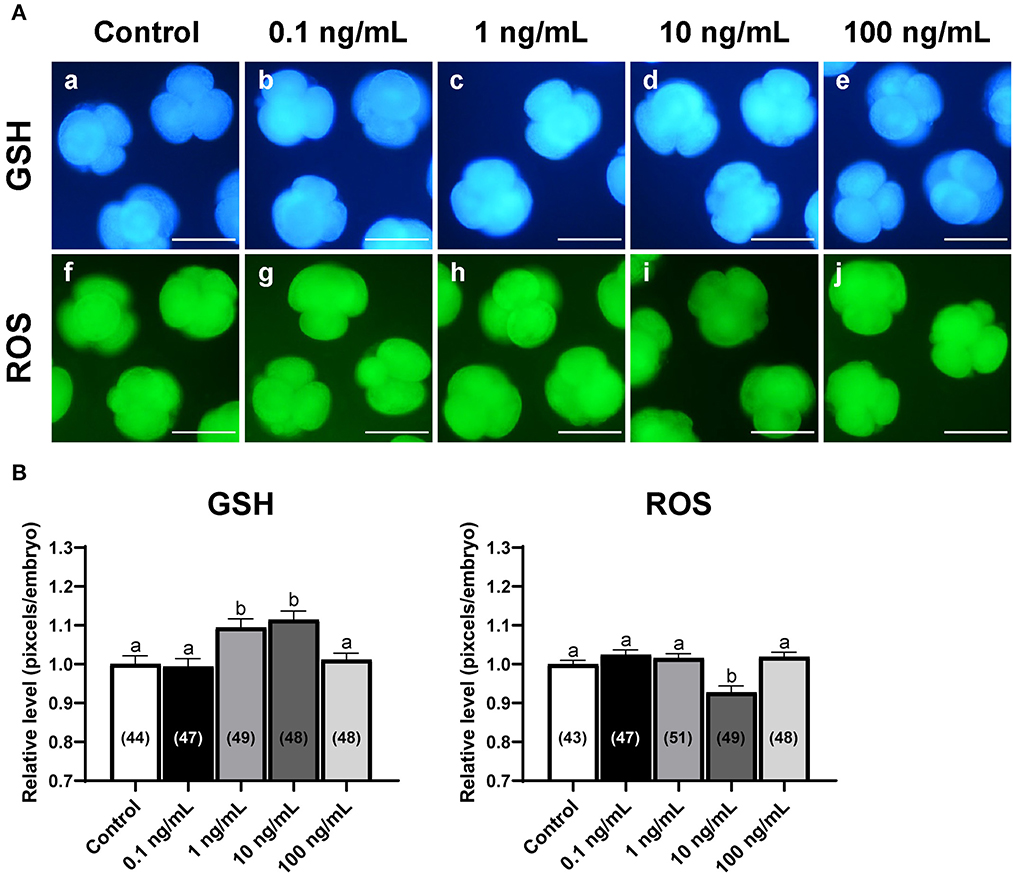 Figura 3. Fotomicrografías de epifluorescencia de embriones de 4 células derivados de PA con diversas concentraciones de suplementación con IL-7 durante la VCI durante 2 días. (A) Los embriones fueron teñidos con Cell Tracker Blue (a-e) y H2DCFDA (f-j) para detectar niveles intracelulares de glutatión (GSH) y especies reactivas de oxígeno (ROS), respectivamente. Barra de escala: 100 μm. (B) Los niveles relativos de niveles intracelulares de GSH y ROS dentro de embriones porcinos cultivados in vitro tratados con IL-7 durante la VCI. El número de embriones examinados en cada grupo experimental se muestra entre paréntesis. Dentro de cada punto final, las barras con diferentes letras (a, b) son significativamente diferentes (p < 0.05) para cada grupo. Para todos los gráficos, los valores representan la media ± SEM. El experimento fue replicado cuatro veces.
Figura 3. Fotomicrografías de epifluorescencia de embriones de 4 células derivados de PA con diversas concentraciones de suplementación con IL-7 durante la VCI durante 2 días. (A) Los embriones fueron teñidos con Cell Tracker Blue (a-e) y H2DCFDA (f-j) para detectar niveles intracelulares de glutatión (GSH) y especies reactivas de oxígeno (ROS), respectivamente. Barra de escala: 100 μm. (B) Los niveles relativos de niveles intracelulares de GSH y ROS dentro de embriones porcinos cultivados in vitro tratados con IL-7 durante la VCI. El número de embriones examinados en cada grupo experimental se muestra entre paréntesis. Dentro de cada punto final, las barras con diferentes letras (a, b) son significativamente diferentes (p < 0.05) para cada grupo. Para todos los gráficos, los valores representan la media ± SEM. El experimento fue replicado cuatro veces.
Efectos de la suplementación con IL-7 durante la VCI sobre el número total de células y la apoptosis en blastocistos
Se contó el número total de células y núcleos apoptóticos para investigar la calidad de los blastocistos porcinos tratados con IL-7. La suplementación de los medios IVC con IL-7 no influyó en el número total de núcleos en comparación con el del grupo control (Figuras 4A, B). Sin embargo, el número de núcleos apoptóticos y el índice apoptótico se redujeron significativamente (p < 0,05) en los blastocistos tratados con IL-1 de 10 y 7 ng/mL en comparación con los del control (Figuras 4A, C, D).
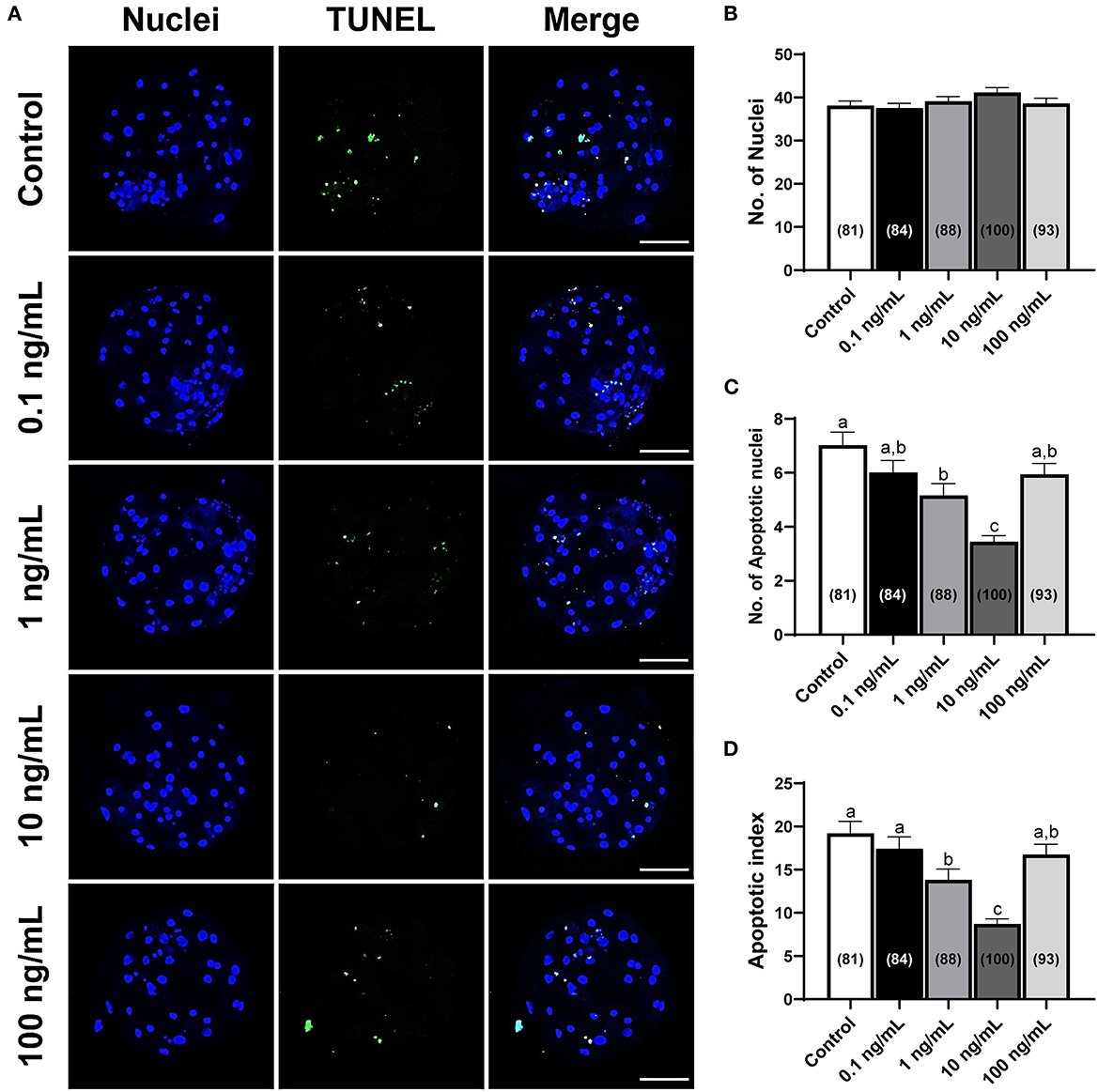 Figura 4. Número total de células y núcleos apoptóticos en blastocistos derivados de PA expuestos a diversas concentraciones de suplementos de IL-7 durante la VCI durante 7 días. (A) Imágenes representativas de microscopía confocal de barrido láser (200×) de blastocistos de PA porcino marcados con Hoechst 33342 (núcleos totales, azul) y TUNEL (núcleos apoptóticos, verde) después de la VCI. Barra de escala: 100 μm. (B-D) Cuantificación del número total y apoptótico de células, e índice apoptótico en los grupos indicados. El número de embriones examinados en cada grupo experimental se muestra entre paréntesis. Dentro de cada punto final, las barras con letras diferentes (a-c) son significativamente diferentes (p < 0.05) para cada grupo. Para todos los gráficos, los valores representan la media ± SEM. El experimento fue replicado cuatro veces.
Figura 4. Número total de células y núcleos apoptóticos en blastocistos derivados de PA expuestos a diversas concentraciones de suplementos de IL-7 durante la VCI durante 7 días. (A) Imágenes representativas de microscopía confocal de barrido láser (200×) de blastocistos de PA porcino marcados con Hoechst 33342 (núcleos totales, azul) y TUNEL (núcleos apoptóticos, verde) después de la VCI. Barra de escala: 100 μm. (B-D) Cuantificación del número total y apoptótico de células, e índice apoptótico en los grupos indicados. El número de embriones examinados en cada grupo experimental se muestra entre paréntesis. Dentro de cada punto final, las barras con letras diferentes (a-c) son significativamente diferentes (p < 0.05) para cada grupo. Para todos los gráficos, los valores representan la media ± SEM. El experimento fue replicado cuatro veces.
Efectos de la suplementación con IL-7 durante la VCI sobre los niveles de expresión génica en embriones escindidos y blastocistos
Después de determinar que la concentración óptima de suplementación con IL-7 durante el período de IVC era de 10 ng / ml, realizamos experimentos posteriores de IVC utilizando 10 ng / ml de IL-7. Para determinar el mecanismo del aumento observado en la eficiencia del desarrollo embrionario tras la suplementación con IL-7, se analizaron los niveles de transcripción en embriones y blastocistos del día 2 mediante qRT-PCR. Así, observamos que en el grupo tratado con IL-7 en relación con el grupo control, el nivel de ARNm del gen proapoptótico, BAX disminuyó significativamente (p < 0,001), mientras que el del gen antiapoptótico, MCL1 aumentó significativamente (p < 0,05) (Figura 5A). Los niveles de expresión de los genes asociados con la señalización de IL-7, incluidos PIK3R1, AKT1 y ERK1, no fueron significativamente diferentes entre los grupos de suplementación con IL-7 y control. Sin embargo, los niveles de ERK2 fueron significativamente más altos (p < 0,05) para el grupo suplementado con IL-7 en relación con el grupo control (Figura 5B). Además, los embriones tratados con IL-7 mostraron niveles de transcripción NANOG significativamente más altos (p < 0,05) que los embriones control (Figura 5C).
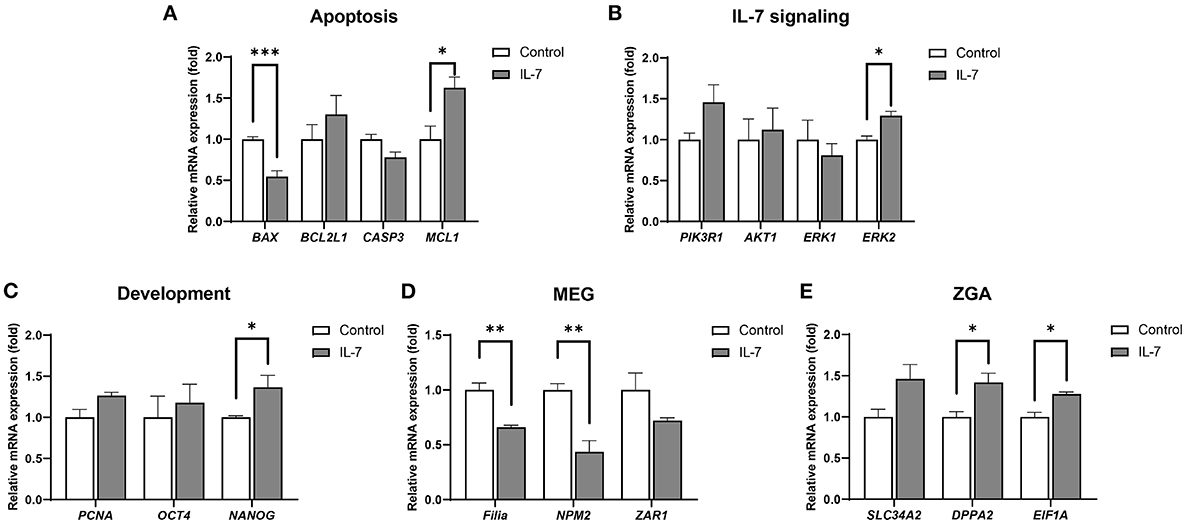 Figura 5. Niveles relativos de expresión de ARNm de genes asociados con apoptosis, señalización de IL-7, desarrollo, genes de efecto materno (MEG) y activación del genoma cigótico (ZGA) en embriones del día 7 tratados con IL-2. Los niveles de expresión de ARNm de (A) genes relacionados con la apoptosis (BAX, BCL2L1, CASP3 y MCL1), (B) genes relacionados con la señalización de IL-7 (PIK3R1, AKT1, ERK1 y ERK2), (C) genes relacionados con el desarrollo (PCNA, OCT4 y NANOG), (D) MEG (Filia, NPM2 y ZAR1) y (E) genes relacionados con ZGA (SLC34A2, DPPA2 y EIF1A ) en embriones de día 2 del grupo control y 10 ng/ml de IL-7 del grupo. Los datos se normalizaron al gen RN18S. Los asteriscos indican significación estadística (*p < 0,05, **p < 0,01 y ***p < 0,001). Para todos los gráficos, el valor representa la media ± SEM. Los experimentos fueron replicados tres o cuatro veces.
Figura 5. Niveles relativos de expresión de ARNm de genes asociados con apoptosis, señalización de IL-7, desarrollo, genes de efecto materno (MEG) y activación del genoma cigótico (ZGA) en embriones del día 7 tratados con IL-2. Los niveles de expresión de ARNm de (A) genes relacionados con la apoptosis (BAX, BCL2L1, CASP3 y MCL1), (B) genes relacionados con la señalización de IL-7 (PIK3R1, AKT1, ERK1 y ERK2), (C) genes relacionados con el desarrollo (PCNA, OCT4 y NANOG), (D) MEG (Filia, NPM2 y ZAR1) y (E) genes relacionados con ZGA (SLC34A2, DPPA2 y EIF1A ) en embriones de día 2 del grupo control y 10 ng/ml de IL-7 del grupo. Los datos se normalizaron al gen RN18S. Los asteriscos indican significación estadística (*p < 0,05, **p < 0,01 y ***p < 0,001). Para todos los gráficos, el valor representa la media ± SEM. Los experimentos fueron replicados tres o cuatro veces.
Un estudio previo reveló que el ZGA porcino ocurre en la etapa de 4 células (30). También se ha informado que durante la transición materno-cigótica (MZT), la perturbación en la degradación de los ARN maternos y ZGA puede conducir a la detención embrionaria, lo que indica la importancia de estos procesos (31). Por lo tanto, investigamos si la IL-7 está involucrada en el aclaramiento materno del ARNm y el ZGA mediante la detección de los niveles de ARNm de MEG (Filia, NPM2 y ZAR1) y genes relacionados con ZGA (SLC34A2, DPPA2 y EIF1A). En comparación con el grupo control, los niveles de transcripción de Filia y NPM2 fueron significativamente más bajos (p < 0,01) después del tratamiento con IL-7 (Figura 5D). Por el contrario, los niveles de expresión de ARNm de DPPA2 y EIF1A aumentaron significativamente (p < 0,05) el día 2 después de que los embriones fueron tratados con IL-7 (Figura 5E).
Además, los blastocistos tratados con IL-7 mostraron significativamente (p < 0,05) MCL1 más alto y niveles de BAX más bajos que los embriones control (Figura 6A). Además, entre los genes relacionados con la señalización de IL-7, los niveles de expresión de PI3KR1, AKT1 y ERK2 aumentaron significativamente en los blastocistos tratados con IL-7 en comparación con los del grupo control (Figura 6B). También observamos que los niveles de expresión de genes relacionados con el desarrollo embrionario, OCT4 y NANOG, aumentaron significativamente (p < 0,01 y p < 0,05, respectivamente), mientras que los de CDX2, GATA6 y PCNA no mostraron ninguna diferencia significativa entre el grupo control y el grupo de tratamiento con IL-7 (Figura 6C).
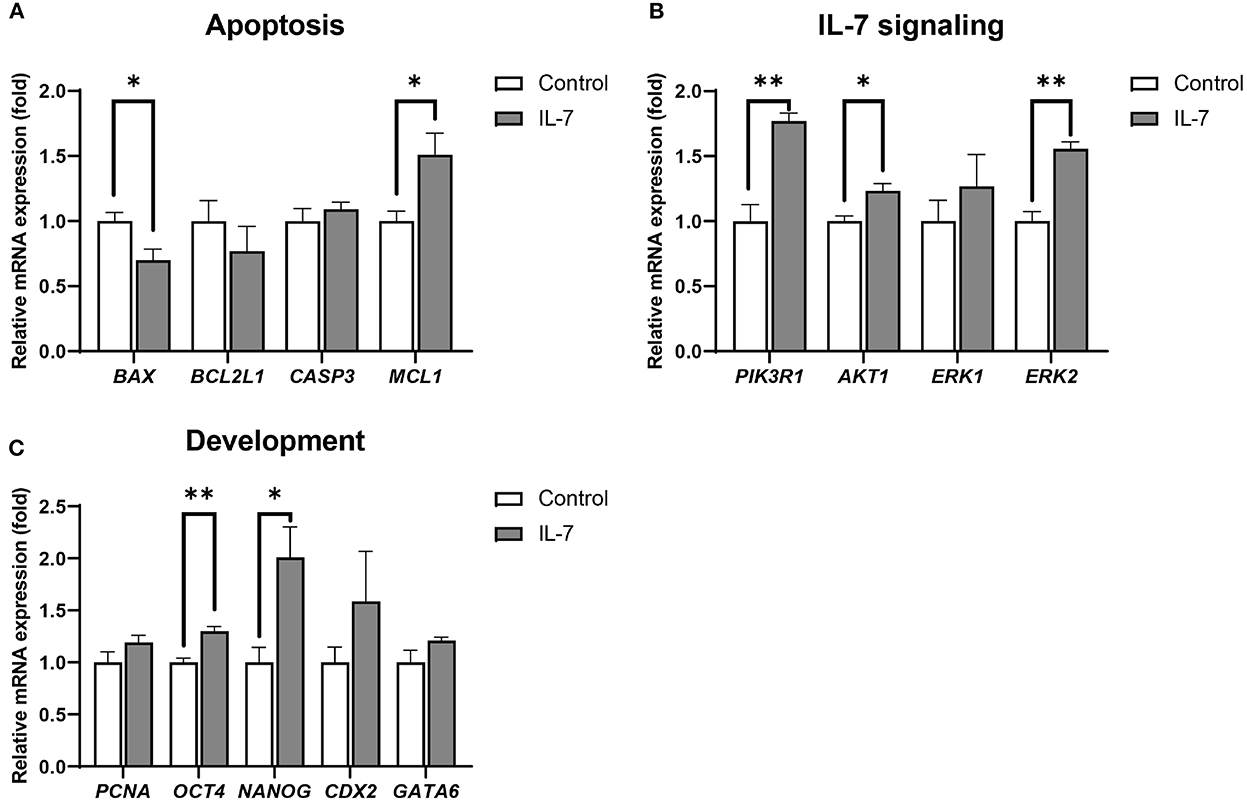 Figura 6. Niveles relativos de expresión de ARNm de genes asociados con apoptosis, señalización de IL-7 y desarrollo en blastocistos tratados con IL-7. Los niveles de expresión de ARNm de (A) genes relacionados con la apoptosis (BAX, BCL2L1, CASP3 y MCL1), (B) genes relacionados con la señalización de IL-7 (PIK3R1, AKT1, ERK1 y ERK2) y (C) genes relacionados con el desarrollo (PCNA, OCT4, NANOG, CDX2 y GATA6) en blastocistos del grupo de control y 10 ng / ml de IL-7 del grupo. Los datos se normalizaron a la expresión del gen RN18S. Los asteriscos indican significación estadística (*p < 0,05 y **p < 0,01). Para todos los gráficos, el valor representa la media ± SEM. Los experimentos fueron replicados tres o cuatro veces.
Figura 6. Niveles relativos de expresión de ARNm de genes asociados con apoptosis, señalización de IL-7 y desarrollo en blastocistos tratados con IL-7. Los niveles de expresión de ARNm de (A) genes relacionados con la apoptosis (BAX, BCL2L1, CASP3 y MCL1), (B) genes relacionados con la señalización de IL-7 (PIK3R1, AKT1, ERK1 y ERK2) y (C) genes relacionados con el desarrollo (PCNA, OCT4, NANOG, CDX2 y GATA6) en blastocistos del grupo de control y 10 ng / ml de IL-7 del grupo. Los datos se normalizaron a la expresión del gen RN18S. Los asteriscos indican significación estadística (*p < 0,05 y **p < 0,01). Para todos los gráficos, el valor representa la media ± SEM. Los experimentos fueron replicados tres o cuatro veces.
Efectos de la suplementación con IL-7 durante la VCI sobre la expresión de pSTAT5 y la proporción de ICM de blastocistos
IL-7 activa la vía JAK / STAT, que cuando se estimula conduce a la fosforilación de STAT5 en timocitos y células de la granulosa (32, 33). Por lo tanto, para determinar si la suplementación con IL-7 durante la VCI estimuló la vía JAK / STAT en la etapa de blastocisto porcino, examinamos la expresión de la proteína pSTAT5 a través de inmunofluorescencia. El nivel de proteína pSTAT5 aumentó significativamente (p < 0,01) en los blastocistos tratados con IL-7 en comparación con el control (Figura 7).
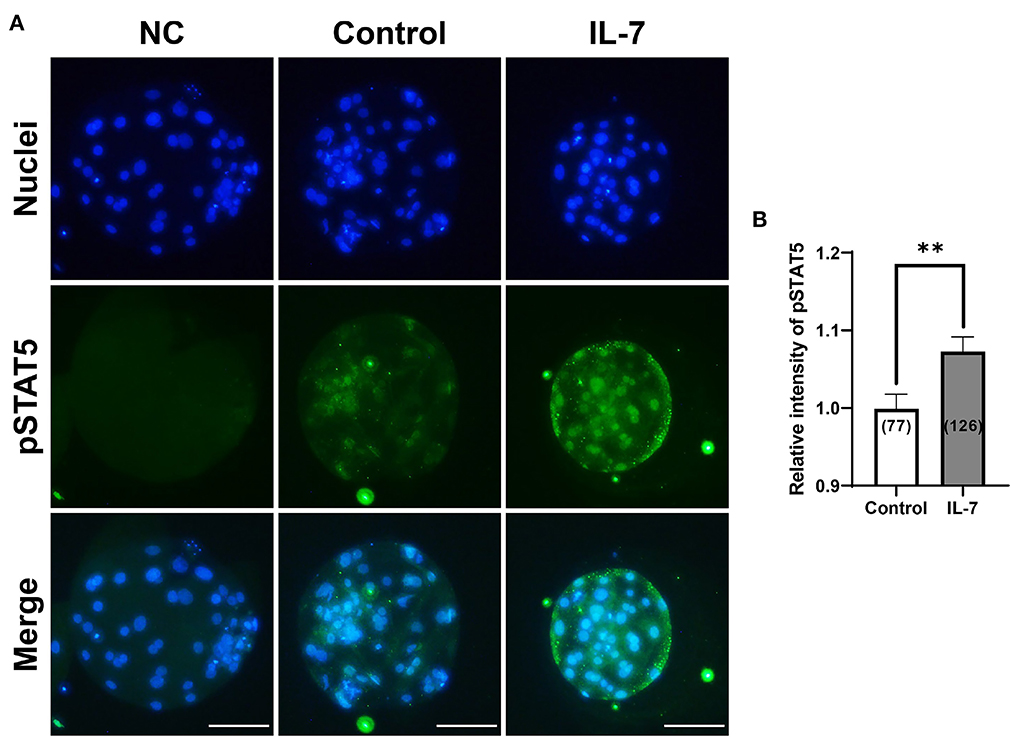 Figura 7. Efecto de la suplementación con IL-7 durante la VCI sobre la expresión fosforilada de STAT5 (pSTAT5) de blastocistos después de PA. (A) Imágenes representativas de inmunofluorescencia (200×) de blastocistos del partenote porcino marcados con Hoechst 33342 (núcleos totales, azul) y pSTAT5 (verde) después de la VCI. NC: control negativo. Barra de escala: 100 μm. (B) Cuantificación de la intensidad relativa de pSTAT5 en los grupos indicados. El número de blastocistos examinados en cada grupo experimental se muestra entre paréntesis. Los asteriscos indican significación estadística (**p < 0,01). Para el gráfico, los valores representan la media ± SEM. El experimento fue replicado cuatro veces.
Figura 7. Efecto de la suplementación con IL-7 durante la VCI sobre la expresión fosforilada de STAT5 (pSTAT5) de blastocistos después de PA. (A) Imágenes representativas de inmunofluorescencia (200×) de blastocistos del partenote porcino marcados con Hoechst 33342 (núcleos totales, azul) y pSTAT5 (verde) después de la VCI. NC: control negativo. Barra de escala: 100 μm. (B) Cuantificación de la intensidad relativa de pSTAT5 en los grupos indicados. El número de blastocistos examinados en cada grupo experimental se muestra entre paréntesis. Los asteriscos indican significación estadística (**p < 0,01). Para el gráfico, los valores representan la media ± SEM. El experimento fue replicado cuatro veces.
Según qRT-PCR, los blastocistos tratados con IL-7 mostraron niveles significativamente mayores para el marcador epiblasto, NANOG, pero no para el marcador trofoectodermo, CDX2. Además, planteamos la hipótesis de que la suplementación con IL-7 afecta el desarrollo de ICM durante la segregación del linaje en blastocistos porcinos. Por lo tanto, los blastocistos se tiñeron para SOX2, un marcador fiel de ICM (34), para determinar el efecto de IL-7 en el número de células ICM (Figura 8). La suplementación con IL-7 durante el período de la VCI no afectó el número total de células (Figura 8B). Sin embargo, los embriones tratados con IL-7 se convirtieron en blastocistos con un número significativamente mayor (p < 0,001) de células SOX2+ en comparación con el control (4 células en IL-7 vs. 2,4 células en controles) (Figura 8C). La relación ICM también mejoró significativamente (p < 0,001) en ~1,7 veces en blastocistos porcinos tratados con IL-7 (10,3% en IL-7 vs. 5,9% en control) (Figura 8D).
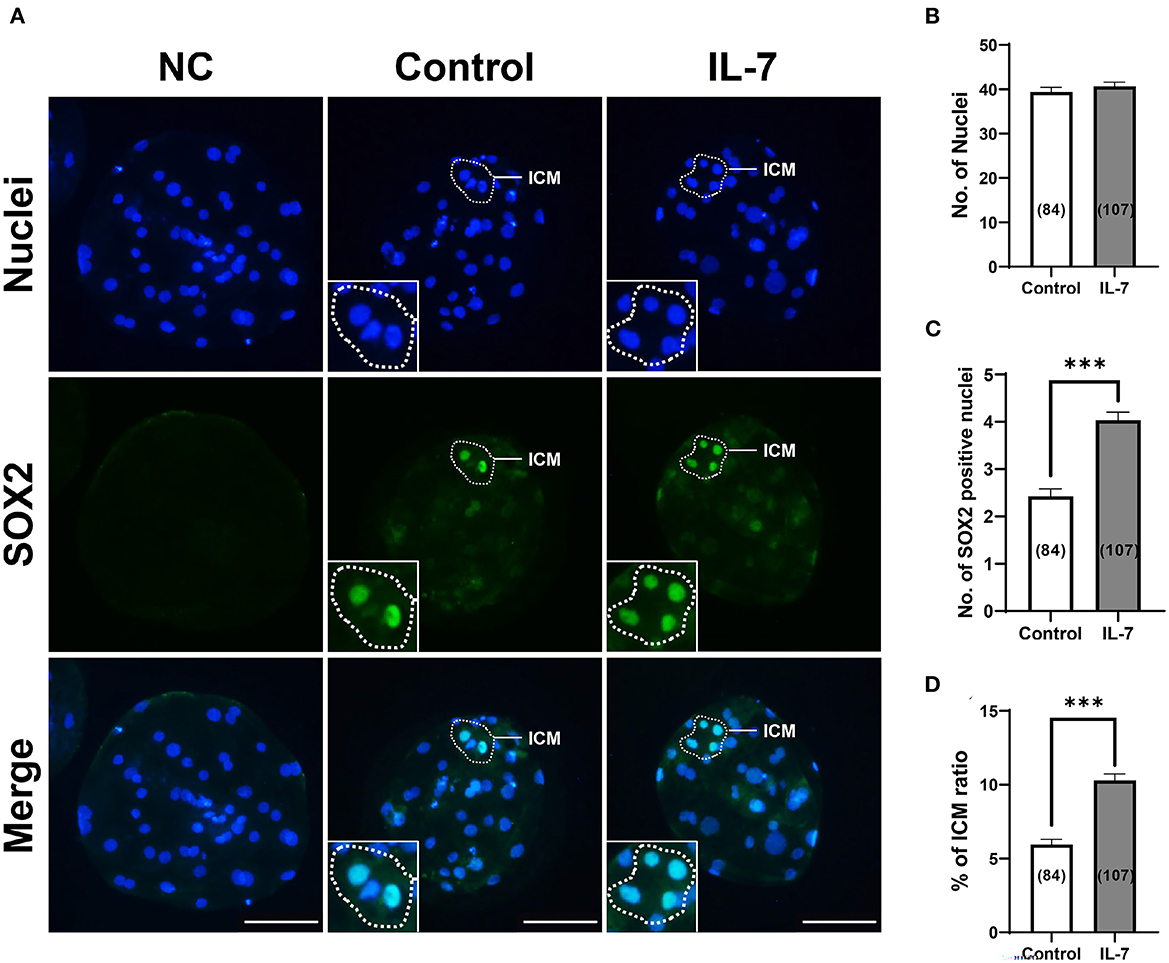 Figura 8. Efectos de la suplementación con IL-7 durante la VCI sobre la especificación de la masa celular interna (MCI) de blastocistos después de la AP. (A) Imágenes representativas de inmunofluorescencia (200×) de blastocistos de partenote porcino marcados con Hoechst 33342 (núcleos totales, azul) y SOX2 (marcador ICM, verde) después de la VCI. NC: control negativo. Barra de escala: 100 μm. (B-D) Cuantificación del total, números celulares SOX2 positivos y relación ICM en los grupos indicados. El número de embriones examinados en cada grupo experimental se muestra entre paréntesis. Los asteriscos indican significación estadística (***p < 0,001). Para todos los gráficos, los valores representan la media ± SEM. El experimento fue replicado cuatro veces.
Figura 8. Efectos de la suplementación con IL-7 durante la VCI sobre la especificación de la masa celular interna (MCI) de blastocistos después de la AP. (A) Imágenes representativas de inmunofluorescencia (200×) de blastocistos de partenote porcino marcados con Hoechst 33342 (núcleos totales, azul) y SOX2 (marcador ICM, verde) después de la VCI. NC: control negativo. Barra de escala: 100 μm. (B-D) Cuantificación del total, números celulares SOX2 positivos y relación ICM en los grupos indicados. El número de embriones examinados en cada grupo experimental se muestra entre paréntesis. Los asteriscos indican significación estadística (***p < 0,001). Para todos los gráficos, los valores representan la media ± SEM. El experimento fue replicado cuatro veces.
Discusión
En este estudio, examinamos la expresión de la proteína IL-7, así como la de su receptor, IL-7R en embriones porcinos preimplantacionales. Además, demostramos la concentración óptima de IL-7 en un experimento de cultivo embrionario in vitro, que aumentó la velocidad de escisión y formación de blastocisto mediante la regulación de la apoptosis, la señalización de IL-7 y los genes relacionados con el desarrollo. Además, demostramos que la suplementación con IL-7 redujo los niveles de ROS, así como los niveles de transcripción de los genes relacionados con MEG. También mejoró los niveles de GSH y los niveles de expresión de ARNm de genes relacionados con ZGA en embriones escindidos. Además, la suplementación con IL-7 también mejoró la expresión de la proteína pSTAT5 y el marcador ICM, SOX2, lo que sugiere que este es un mecanismo por el cual la señalización de IL-7 modula el desarrollo de embriones porcinos in vitro.
Se cree que el desarrollo embrionario temprano en animales domésticos ocurre en el útero después de la implantación de blastocisto después de la fertilización (35). Varios estudios también han demostrado que las citocinas, como las IL, los factores estimulantes de colonias, los factores de crecimiento transformante y los factores de necrosis tumoral, son importantes para el desarrollo embrionario temprano y la implantación (14, 36, 37). Aunque existen varios tipos de IL, hay información limitada sobre el papel de la IL-7 en el desarrollo embrionario preimplantacional. En un estudio con ratones, la expresión del ARNm de IL-7 varió en diferentes etapas del desarrollo embrionario (38). Recientemente, también se informó que IL-7 e IL-15, que pertenecen a la misma superfamilia IL-2, muestran una expresión génica altamente aumentada en los tejidos reproductivos porcinos en comparación con otras citoquinas de tipo IL (39). De acuerdo con este hallazgo previamente informado, detectamos IL-7 y su receptor IL-7R en embriones preimplantacionales porcinos. Por lo tanto, la IL-7 probablemente juega un papel importante en el desarrollo embrionario porcino.
Además, otro estudio previo mostró que la expresión de IL-7, un factor secretado por ovocitos que media las señales de ovocitos a células somáticas, se activó considerablemente por progresión meiótica. La IL-7 también se identificó como un candidato potencial para las pruebas de detección de la calidad de los ovocitos (22). Recientemente también, se demostró que la IL-7 mejora la maduración de los ovocitos y el potencial de desarrollo a través de la regulación de genes relacionados con la apoptosis cuando se administra dentro de un sistema de MIV para ovejas (40) y cerdos (21). Por lo tanto, especulamos que IL-7 posiblemente juega un papel similar en la VCI porcina, y en este sentido, nuestros resultados demostraron que el tratamiento con IL-7 favoreció el desarrollo in vitro de embriones preimplantacionales porcinos después de AF y redujo la fragmentación en embriones del día 2. Además, se redujo el número de células apoptóticas y se aumentaron los niveles de proteína pSTAT5 en blastocistos tratados con IL-7. Según se informa, el STAT5 fosforilado inducido por IL-7 se transloca al núcleo, donde regula la expresión de varios genes involucrados en la prevención de la apoptosis (41-43). Además, en el desarrollo linfoide, IL-7 mejoró la supervivencia de timocitos inmaduros y células T maduras al aumentar el nivel de la proteína antiapoptótica MCL1, inhibiendo así la activación de BAX y BAK (44). Consistentemente, nuestros resultados mostraron que los niveles de expresión de ARNm de MCL1 aumentaron significativamente, mientras que los de BAX disminuyeron tanto en embriones tratados con IL-7 día 2 como en blastocistos, lo que sugiere que IL-7 mejora el desarrollo in vitro de embriones porcinos al evitar que sufran apoptosis. Sin embargo, se necesitan más estudios para evaluar los niveles de proteína de estos genes relacionados con la apoptosis y la vía IL-7 / STAT5 en la VCI porcina.
El desarrollo embrionario temprano de los animales domésticos está regulado principalmente por el ARNm materno y las proteínas. Posteriormente, los transcritos depositados por la madre se degradan progresivamente durante el MZT, y esto se acompaña de ZGA (45). También se observó que los defectos de ZGA conducen a la eliminación anormal de los ARNm maternos durante el proceso MZT humano, retrasando así el desarrollo embrionario (46). Por lo tanto, ZGA juega un papel importante en el desarrollo embrionario temprano (47). Los resultados de los análisis qRT-PCR en este estudio mostraron que los embriones del día 2 tratados con IL-7 mostraron una mayor degradación del ARNm materno (Filia y NPM2), mientras que los niveles de expresión de ARNm de los genes relacionados con ZGA (DPPA2 y EIF1A) mejoraron. Además, los niveles de transcripción de NANOG fueron significativamente más altos en los embriones del día 2 tratados con IL-7 que en el grupo control. Los resultados de un estudio previo mostraron que Nanog y Pou5f1 (OCT4) regulan la expresión de ZGA en el pez cebra (48). Esta observación indicó que la IL-7 desempeña un papel importante en el desarrollo embrionario porcino mediante la modulación del aclaramiento del ARNm materno y el ZGA.
En animales domésticos, el estrés oxidativo durante el desarrollo preimplantacional puede conducir a la detención del desarrollo en el momento de ZGA o apoptosis de blastocisto (49). De hecho, el estrés oxidativo exógeno y endógeno durante la manipulación in vitro del embrión contribuye a la detención del desarrollo (50). Aunque la liberación de ROS debido al estrés oxidativo se considera un producto oxidativo no deseado, se pueden utilizar pequeñas cantidades de ROS en vías de señalización fisiológica en embriones (51). También se ha observado que una concentración moderada de IL-7 durante la MIV aumenta los niveles de ROS en ovocitos ovinos (40). En uno de nuestros estudios previos, realizamos un experimento utilizando un sistema de MIV porcina para determinar si el tratamiento con IL-7 regula el estrés oxidativo (21). De acuerdo con los resultados del presente estudio, observamos que la suplementación con IL-7 durante la VCI porcina aumentó los niveles intracelulares de GSH y redujo los niveles de ROS en embriones de 4 células, provocando ZGA. En embriones de mamíferos, se ha observado un aumento de los niveles de ROS en ZGA, que es sensible al estrés oxidativo durante el desarrollo embrionario (49, 52). Además, este pico en el nivel de ROS durante ZGA indicó que las defensas oxidantes pueden agotarse en el MZT y deben reponerse mediante la expresión génica cigótica (53). En conjunto, nuestros resultados en este estudio sugirieron que la IL-7 reduce el estrés oxidativo mediante la regulación de genes relacionados con ZGA durante la MZT porcina.
En los animales domésticos, dos eventos principales resultan en la segregación del linaje durante el desarrollo preimplantacional. Primero, durante la etapa de mórula compactada, se forma el trofoectodermo. Esto a su vez está involucrado en la formación de placenta e ICM, que se convierte en la estructura definitiva del feto y puede producir ESC. En segundo lugar, la MCI se divide en el epiblasto y el endodermo primitivo (54). Los avances recientes en la transcriptómica de blastómero único han facilitado la elucidación de las vías de señalización involucradas en la especificación del linaje de embriones preimplantacionales en mamíferos (30, 55-58). Según se informa, CDX2 es un marcador trofoectodérmico en ratones, humanos y cerdos (54, 59), y OCT4, un gen de pluripotencia central, se expresa en todos los embriones preimplantacionales. Además, el marcador de epiblastos, NANOG, y el marcador de hipoblastos, GATA6, se co-expresan en la MCI de blastocistos tempranos porcinos (55, 56). En el presente estudio, mostramos que en blastocistos, la suplementación con IL-7 mejoró significativamente la expresión de ARNm de OCT4 y NANOG, pero no del ARNm de CDX2 o GATA6. Estos genes relacionados con la pluripotencia están regulados a través de una vía indirecta que involucra otras citoquinas de tipo IL (60, 61). Sin embargo, no hay informes que demuestren que la IL-7 regula los genes de pluripotencia. Por lo tanto, se necesitan estudios adicionales para verificar estos hallazgos.
Según se informa, IL-7 activa la JAK / STAT, PI3K / Akt y la proteína quinasa activada por mitógenos / quinasa regulada por señal extracelular (MAPK / ERK; MEK) en células T normales y células de leucemia linfoblástica aguda de células T (33, 62–64). De acuerdo con estos estudios previos, nuestros resultados también mostraron un aumento de la expresión de la proteína pSTAT5, así como la regulación positiva de los genes relacionados con la vía PI3K / Akt y ERK2 en blastocistos tratados con IL-7. La vía PI3K/Akt desempeña un papel funcional en los embriones preimplantacionales, y su inhibición influye en el desarrollo hasta la etapa de blastocisto en embriones murinos, bovinos y porcinos (65-67). Además, la activación de la señalización de ERK juega un papel esencial en la diferenciación de ICM en blastocistos murinos (68). La función de estas vías se mejora en la MCI de los blastocistos porcinos y puede afectar el número de células de la MCI cuando se interrumpe por inhibidores específicos de la vía (55, 56). Del mismo modo, nuestros resultados mostraron que el tratamiento con IL-7 mejoró el número de células ICM y la proporción de ICM de blastocistos, lo que sugiere que IL-7 mejora la calidad del blastocisto al activar la señalización de IL-7 durante el desarrollo embrionario porcino. De acuerdo con los resultados informados anteriormente, se observó un aumento en el número de células ICM cuando también se administraron otros tipos de IL durante el período de VCI (69-72). No obstante, se requieren más estudios para determinar el papel exacto de IL-7 en el desarrollo de ICM porcina.
Conclusión
En este estudio, demostramos, por primera vez, la localización de IL-7 e IL-7R en embriones porcinos preimplantacionales. Específicamente, nuestros resultados mostraron que la IL-7 y su receptor están involucrados en el desarrollo embrionario porcino y que la suplementación con IL-7 en la VCI porcina mejora el desarrollo de los embriones de partenote porcino a través de la regulación del efecto antiapoptótico, el aclaramiento del ARNm materno y el ZGA. Además, observamos que la suplementación con IL-7 mejoró la calidad del blastocisto al modular la transcripción de genes relacionados con el desarrollo y la señalización de IL-7 y al aumentar el número de células SOX2+ y la proporción de ICM durante el desarrollo del embrión de PA porcino in vitro. En este estudio, nos centramos en el efecto de IL-7 en el desarrollo embrionario porcino utilizando solo embriones de PA, excluyendo los factores homólogos masculinos que pueden causar problemas, como la polispermia. Sin embargo, dado que en realidad hay muchas diferencias mecanicistas entre PA y embriones derivados de FIV, se requieren más estudios que utilicen embriones derivados de la FIV o de transferencia nuclear de células somáticas. Nuestros hallazgos, principalmente, proporcionan nuevos conocimientos sobre los efectos de IL-7 en el desarrollo embrionario y pueden contribuir a la mejora de los sistemas IVC porcinos y tecnologías relacionadas.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo / Material complementario, las consultas adicionales pueden dirigirse a los autores correspondientes.
Contribuciones del autor
DO, YJ y S-HH: conceptualización, validación, preparación de borradores originales y revisión y edición de escritos. DO, HC, MK, LC, JL, GL y YJ: metodología. DO, HC, MK, LC, JL, AJ, SK y HZ: investigación. DO, HC, MK, LC, JL y GL: análisis formal. S-HH: adquisición de fondos. Todos los autores han leído y aceptado la versión publicada del manuscrito.
Financiación
Este trabajo fue apoyado, en parte, por una subvención de la Fundación Nacional de Investigación (NRF) de Corea Beca financiada por el Gobierno de Corea (Número de subvención 2020R1A2C2008276) el Instituto Coreano de Planificación y Evaluación de Tecnología en Alimentación, Agricultura, Silvicultura y Pesca (IPET) a través del Programa de Desarrollo Tecnológico de la Industria Agrobiológica (Número de subvención 318016-5), el Programa de Tecnologías de Convergencia de Agricultura, Alimentación y Asuntos Rurales para Educar a Líderes Globales Creativos (Número de Subvención) 320005-4), financiado por el Ministerio de Agricultura, Alimentación y Asuntos Rurales (MAFRA), el Programa del Centro Global de Investigación y Desarrollo (GRDC) a través del NRF financiado por el Ministerio de Educación, Ciencia y Tecnología (Número de subvención 2017K1A4A3014959), y el Programa de Laboratorio de Investigación Básica (Número de subvención 2022R1A4A1025557) a través del NRF de Corea, financiado por el Ministerio de Ciencia y TIC, República de Corea.
Reconocimientos
Los autores agradecen a Suin Lee y Eun-Jeong Kim por su apoyo técnico, incluido el muestreo de ovarios.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2022.1052856/full#supplementary-material
Referencias
1. Hansen PJ. Tecnologías de reproducción asistida actuales y futuras para animales de granja mamíferos. En:Lamb GC, DiLorenzo N, editores. Tecnologías reproductivas actuales y futuras y producción mundial de alimentos. Nueva York, NY: Springer Nueva York (2014). págs. 1–22. doi: 10.1007/978-1-4614-8887-3_1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Knox RV. Impacto de las tecnologías de reproducción porcina en la producción porcina y mundial de alimentos. En:Lamb GC, DiLorenzo N, , editores. Tecnologías reproductivas actuales y futuras y producción mundial de alimentos. Nueva York, NY: Springer (2014). págs. 131–60. doi: 10.1007/978-1-4614-8887-3_7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Hall V, Hinrichs K, Lazzari G, Betts D, Hyttel P. Desarrollo embrionario temprano, tecnologías de reproducción asistida y biología de células madre pluripotentes en mamíferos domésticos. Veterinario J. (2013) 197:128–42. doi: 10.1016/j.tvjl.2013.05.026
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Hryhorowicz M, Zeyland J, Słomski R, Lipiński D. Cerdos modificados genéticamente como donantes de órganos para xenotrasplantes. Mol Biotechnol. (2017) 59:435–44. DOI: 10.1007/S12033-017-0024-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Evers MM, Miniarikova J, Juhas S, Vallès A, Bohuslavova B, Juhasova J, et al. La terapia génica Aav5-Mihtt demuestra una amplia distribución y una fuerte reducción de la huntingtina mutante humana en un modelo de minicerdo de la enfermedad de Huntington. Mol Ther. (2018) 26:2163–77. doi: 10.1016/j.ymthe.2018.06.021
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Hall V. Células madre embrionarias porcinas: una posible fuente de terapia de reemplazo celular. (2008) 4:275–82. DOI: 10.1007/S12015-008-9040-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Hu J, Cheng D, Gao X, Bao J, Ma X, Wang H. La vitamina C mejora el desarrollo in vitro de embriones preimplantacionales porcinos al reducir el estrés oxidativo. Reprod Domest Anim. (2012) 47:873–9. doi: 10.1111/j.1439-0531.2011.01982.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Yoon JD, Hwang S-U, Kim M, Lee G, Jeon Y, Hyun S-H. GDF8 mejora la expresión de SOX2 y el número total de células de blastocisto en el desarrollo embrionario de FIV porcina. Teriogenología. (2019) 129:70–6. doi: 10.1016/j.theriogenology.2019.02.007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Liang S, Jin Y-X, Yuan B, Zhang J-B, Kim N-H. La melatonina mejora la competencia de desarrollo de los embriones de transferencia nuclear de células somáticas porcinas al prevenir el daño del ADN inducido por el estrés oxidativo. (2017) 7:11114. doi: 10.1038/s41598-017-11161-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Pangas SA. Factores de crecimiento en el desarrollo ovárico. Semin Reprod Med. (2007) 25:225–34. DOI: 10.1055/S-2007-980216
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Orsi NM, Tribe RM. Cytokine networks and the regulation of uterine function in pregnancy and parturition. J Neuroendocrinol. (2008) 20:462–9. doi: 10.1111/j.1365-2826.2008.01668.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Knight PG, Glister C. Miembros de la superfamilia TGF-beta y desarrollo del folículo ovárico. Reproducción. (2006) 132:191–206. doi: 10.1530/rep.1.01074
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Forbes K, Westwood M. Regulación del factor de crecimiento materno del desarrollo placentario humano y el crecimiento fetal. J Endocrinol. (2010) 207:1–16. doi: 10.1677/JOE-10-0174
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Seshagiri PB, Vani V, Madhulika P. Cytokines and blastocyst hatching. Am J Reprod Immunol. (2016) 75:208–17. doi: 10.1111/aji.12464
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Field SL, Dasgupta T, Cummings M, Orsi NM. Citoquinas en foliculogénesis ovárica, maduración de ovocitos y luteinización. Mol Reprod Dev. (2014) 81:284–314. DOI: 10.1002/MRD.22285
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Fry TJ, Mackall CL. Las múltiples caras de la IL-7: desde la linfopoyesis hasta el mantenimiento de las células T periféricas. J Immunol. (2005) 174:6571–6. doi: 10.4049/jimmunol.174.11.6571
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Kittipatarin C, Khaled AR. Interlinking interleukin-7. Citoquinas. (2007) 39:75–83. doi: 10.1016/j.cyto.2007.07.183
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Mackall CL, Fry TJ, Gress RE. Aprovechar la biología de IL-7 para aplicación terapéutica. Nat Rev Immunol. (2011) 11:330–42. DOI: 10.1038/NRI2970
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Ostanin A, Aizikovich B, Aizikovich I, Kozhin AY, Chernykh E. Papel de las citoquinas en la regulación de la función reproductiva. Bull Exp Biol Med. (2007) 143:75–9. DOI: 10.1007/S10517-007-0021-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Niu Z, Ye Y, Xia L, Feng Y, Zhang A. Follicular fluid cytokine composition and oocyte quality of polycystic ovary syndrome patients with metabolic syndrome under in vitro fertilization. Citoquinas. (2017) 91:180–6. doi: 10.1016/j.cyto.2016.12.020
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Oh D, Lee J, Kim E, Hwang S-U, Yoon J-D, Cai L, et al. Efecto de la interleucina-7 sobre la maduración in vitro de complejos cúmulo-ovocitos porcinos y posterior potencial de desarrollo tras la activación partenogenética. Animales. (2021) 11:741. doi: 10.3390/ani11030741
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Cakmak H, Franciosi F, Zamah AM, Cedars MI, Conti M. La secreción dinámica durante la reentrada meiótica integra la función de las células del ovocito y del cúmulo. Proc Natl Acad Sci U S A. (2016) 113:2424–9. doi: 10.1073/pnas.1519990113
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Cheng Y, Yata A, Klein C, Cho J-H, Deguchi M, Hsueh AJ. La interleucina 7 expresada por ovocitos suprime la apoptosis de las células de la granulosa y promueve la maduración de los ovocitos en ratas. Biol Reprod. (2011) 84:707–14. doi: 10.1095/biolreprod.110.086504
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Kwak S-S, Yoon JD, Cheong S-A, Jeon Y, Lee E, Hyun S-H. El nuevo sistema de maduración in vitro de ovocitos porcinos más cortos (18 h) utilizando folículos de ≥8 mm derivados de complejos cúmulo-ovocitos. Teriogenología. (2014) 81:291–301. doi: 10.1016/j.theriogenology.2013.09.028
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Kim M, Hwang S-U, Yoon JD, Lee J, Kim E, Cai L, et al. Efectos beneficiosos de la suplementación con neurotrofina-4 durante la maduración in vitro de complejos cúmulo-ovocitos porcinos y posterior desarrollo embrionario tras activación partenogenética. Front Vet Sci. (2021) 8:779298. DOI: 10.3389/FVETS.2021.779298
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Yoshioka K, Suzuki C, Onishi A. Sistema definido para la producción in vitro de embriones porcinos utilizando un único medio básico. J Reprod Dev. (2008) 54:208–13. DOI: 10.1262/JRD.20001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Choi H, Lee J, Yoon JD, Hwang S-U, Cai L, Kim M, et al. El efecto de la suplementación con cobre sobre la maduración in vitro de complejos cúmulo-ovocitos porcinos y la posterior competencia de desarrollo después de la activación partenogenética. Teriogenología. (2021) 164:84–92. doi: 10.1016/j.theriogenology.2021.01.009
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Cai L, Jeong YW, Jin YX, Lee JY, Jeong YI, Hwang KC, et al. Efectos del tratamiento con factor estimulante de colonias de granulocitos recombinantes humanos durante el cultivo in vitro en embriones preimplantacionales porcinos. PLoS ONE. (2020) 15:E0230247. doi: 10.1371/journal.pone.0230247
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Livak KJ, Schmittgen TD. Análisis de datos relativos de expresión génica mediante PCR cuantitativa en tiempo real y el método 2(-Delta Delta C(T)). Métodos. (2001) 25:402–8. doi: 10.1006/meth.2001.1262
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Cao S, Han J, Wu J, Li Q, Liu S, Zhang W, et al. Redes específicas de regulación génica durante el desarrollo preimplantacional del embrión porcino revelado por la secuenciación profunda. BMC Genom. (2014) 15:4. doi: 10.1186/1471-2164-15-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Schier AF. La transición materno-cigótica: muerte y nacimiento de ARN. Ciencia. (2007) 316:406–7. doi: 10.1126/science.1140693
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Luo Y, Alexander M, Gadina M, O’Shea JJ, Meylan F, Schwartz DM, et al. Señalización en la enfermedad humana: de los síndromes genéticos a la inhibición clínica. J Alergia Clin Immunol. (2021) 148:911–25. doi: 10.1016/j.jaci.2021.08.004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Johnson SE, Shah N, Bajer AA, LeBien TW. IL-7 activa la vía fosfatidilinositol 3-quinasa/AKT en timocitos humanos normales, pero no en precursores normales de células B humanas. J Immunol. (2008) 180:8109–17. doi: 10.4049/jimmunol.180.12.8109
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Liu S, Bou G, Sun R, Guo S, Xue B, Wei R, et al. Sox2 es el marcador fiel de pluripotencia en cerdo: evidencia de estudios embrionarios. Dev Dyn. (2015) 244:619–27. doi: 10.1002/dvdy.24248
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Oestrup O, Hall V, Petkov S, Wolf X, Hyldig S, Hyttel P. Del cigoto a la implantación: dinámica morfológica y molecular durante el desarrollo embrionario en el cerdo. Reprod Domest Anim. (2009) 44:39–49. doi: 10.1111/j.1439-0531.2009.01482.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Zolti M, Ben-Rafael Z, Meirom R, Shemesh M, Bider D, Mashiach S, et al. Afectación de citoquinas en ovocitos y embriones tempranos. Esterilidad fertilizante. (1991) 56:265–72. doi: 10.1016/S0015-0282(16)54483-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Guzeloglu-Kayisli O, Kayisli UA, Taylor HS, editores. El papel de los factores de crecimiento y citoquinas durante la implantación: interacciones endocrinas y paracrinas. Semin Reprod Med. (2009) 27:62–79. doi: 10.1055/s-0028-1108011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Gerwin N, Jia G-Q, Kulbacki R, Gutierrez-Ramos JC. Expresión génica de interleucina en el desarrollo preimplantacional de ratones. Dev Immunol. (1995) 4:169–79. DOI: 10.1155/1995/26830
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Liu X, Hao Y, Li Z, Zhou J, Zhu H, Bu G, et al. Las citoquinas maternas CXCL12, VEGFA y WNT5A promueven la maduración de los ovocitos porcinos mediante la activación de MAPK y la inhibición canónica de WNT. Front Cell Dev Biol. (2020) 8:578. DOI: 10.3389/FCELL.2020.00578
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Javvaji PK, Dhali A, Francis JR, Kolte AP, Mech A, Sathish L, et al. La interleucina-7 mejora la maduración in vitro de los complejos cúmulo-ovocitos ovinos de una manera dependiente de la dosis. Citoquinas. (2019) 113:296–304. doi: 10.1016/j.cyto.2018.07.025
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Ribeiro D, Melão A, van Boxtel R, Santos CI, Silva A, Silva MC, et al. STAT5 es esencial para la viabilidad, el crecimiento y la proliferación mediados por IL-7 de células leucémicas linfoblásticas. Sangre Adv. (2018) 2:2199–213. doi: 10.1182/bloodadvances.2018021063
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. Yao Z, Cui Y, Watford WT, Bream JH, Yamaoka K, Hissong BD, et al. Stat5a/b son esenciales para el desarrollo y diferenciación linfoide normal. Proc Natl Acad Sci U S A. (2006) 103:1000–5. DOI: 10.1073/PNAS.0507350103
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Barata JT, Cardoso AA, Nadler LM, Boussiotis VA. La interleucina-7 promueve la supervivencia y la progresión del ciclo celular de las células de leucemia linfoblástica aguda de células T mediante la regulación a la baja del inhibidor de la quinasa dependiente de ciclina p27 (kip1). Sangre. (2001) 98:1524–31. doi: 10.1182/sangre. V98.5.1524
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Opferman JT, Letai A, Beard C, Sorcinelli MD, Ong CC, Korsmeyer SJ. El desarrollo y mantenimiento de linfocitos B y T requiere MCL-1 antiapoptótico. Naturaleza. (2003) 426:671–6. doi: 10.1038/nature02067
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Tadros W, Lipshitz HD. La transición materno-cigótica: una obra en dos actos. Desarrollo. (2009) 136:3033–42. doi: 10.1242/dev.033183
Resumen de PubMed | Texto completo de CrossRef | Google Académico
46. Sha Q-Q, Zheng W, Wu Y-W, Li S, Guo L, Zhang S, et al. Dinámica y relevancia clínica del aclaramiento materno de ARNm durante la transición de ovocitos a embriones en humanos. Nat Commun. (2020) 11:4917. DOI: 10.1038/S41467-020-18680-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
47. Schulz KN, Harrison MM. Mecanismos que regulan la activación del genoma cigótico. Nat Rev Genet. (2019) 20:221–34. DOI: 10.1038/S41576-018-0087-X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
48. Lee MT, Bonneau AR, Takacs CM, Bazzini AA, DiVito KR, Fleming ES, et al. Nanog, Pou5f1 y SoxB1 activan la expresión génica cigótica durante la transición materna a cigótica. Naturaleza. (2013) 503:360–4. doi: 10.1038/nature12632
Resumen de PubMed | Texto completo de CrossRef | Google Académico
49. Betts D, Madan P. Permanent embryo arrest: molecular and cellular concepts. Mol Hum Reprod. (2008) 14:445–53. doi: 10.1093/molehr/gan035
Resumen de PubMed | Texto completo de CrossRef | Google Académico
50. Ye R, Xu S, Liu Y, Pang L, Lian X, Zhong Y, et al. Efecto protector de icariin en el desarrollo de embriones de ratón preimplantacionales contra la lesión oxidativa inducida por peróxido de hidrógeno. Oxid Med Cell Longev. (2017) 2017:2704532. DOI: 10.1155/2017/2704532
Resumen de PubMed | Texto completo de CrossRef | Google Académico
51. Covarrubias L, Hernández-García D, Schnabel D, Salas-Vidal E, Castro-Obregón S. Function of reactive oxygen species during animal development: passive or active? Dev Biol. (2008) 320:1–11. doi: 10.1016/j.ydbio.2008.04.041
Resumen de PubMed | Texto completo de CrossRef | Google Académico
52. Guerin P, El Mouatassim S, Menezo Y. Estrés oxidativo y protección contra especies reactivas de oxígeno en el embrión preimplantacional y sus alrededores. Actualización de Hum Reprod. (2001) 7:175–89. doi: 10.1093/humupd/7.2.175
Resumen de PubMed | Texto completo de CrossRef | Google Académico
53. Dumollard R, Carroll J, Duchen MR, Campbell K, Swann K, editores. Función mitocondrial y estado redox en embriones de mamíferos. Semin Cell Dev Biol. (2009) 20:346–53. doi: 10.1016/j.semcdb.2008.12.013
Resumen de PubMed | Texto completo de CrossRef | Google Académico
54. Kuijk EW, Du Puy L, Van Tol HT, Oei CH, Haagsman HP, Colenbrander B, et al. Diferencias en la segregación temprana del linaje entre mamíferos. Dev Dyn. (2008) 237:918–27. doi: 10.1002/dvdy.21480
Resumen de PubMed | Texto completo de CrossRef | Google Académico
55. Kong Q, Yang X, Zhang H, Liu S, Zhao J, Zhang J, et al. Especificación del linaje y pluripotencia revelada por análisis del transcriptoma desde el ovocito hasta el blastocisto en cerdo. FASEB J. (2020) 34:691–705. doi: 10.1096/fj.201901818RR
Resumen de PubMed | Texto completo de CrossRef | Google Académico
56. Ramos-Ibeas P, Sang F, Zhu Q, Tang WW, Withey S, Klisch D, et al. Pluripotencia y dinámica del cromosoma X revelada en embriones pregastrulados de cerdo mediante análisis de células individuales. Nat Commun. (2019) 10:500. doi: 10.1038/s41467-019-08387-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
57. Wei Q, Li R, Zhong L, Mu H, Zhang S, Yue L, et al. Especificación de linaje revelada por análisis de expresión génica unicelular en embriones preimplantacionales porcinos. Biol Reprod. (2018) 99:283–92. doi: 10.1093/biolre/ioy062
Resumen de PubMed | Texto completo de CrossRef | Google Académico
58. Boroviak T, Loos R, Lombard P, Okahara J, Behr R, Sasaki E, et al. El perfil específico del linaje delinea la aparición y progresión de la pluripotencia ingenua en la embriogénesis de mamíferos. Célula de desarrollo. (2015) 35:366–82. doi: 10.1016/j.devcel.2015.10.011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
59. Nakamura T, Okamoto I, Sasaki K, Yabuta Y, Iwatani C, Tsuchiya H, et al. Una coordenada de desarrollo de la pluripotencia entre ratones, monos y humanos. Naturaleza. (2016) 537:57–62. doi: 10.1038/nature19096
Resumen de PubMed | Texto completo de CrossRef | Google Académico
60. Do DV, Ueda J, Messerschmidt DM, Lorthongpanich C, Zhou Y, Feng B, et al. Una vía genética y de desarrollo desde STAT3 hasta el circuito OCT4-NANOG es esencial para el mantenimiento de los linajes de ICM in vivo. Genes Dev. (2013) 27:1378–90. doi: 10.1101/gad.221176.113
Resumen de PubMed | Texto completo de CrossRef | Google Académico
61. Kim S-Y, Kang JW, Song X, Kim BK, Yoo YD, Kwon YT, et al. Papel de la vía IL-6-JAK1-STAT3-Oct-4 en la conversión de células cancerosas no madre en células madre cancerosas. Señal celular. (2013) 25:961–9. doi: 10.1016/j.cellsig.2013.01.007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
62. Jiang Q, Li WQ, Aiello FB, Mazzucchelli R, Asefa B, Khaled AR, et al. Biología celular de IL-7, una linfotófina clave. (2005) 16:513–33. doi: 10.1016/j.cytogfr.2005.05.004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
63. Lali FV, Crawley J, McCulloch DA, Foxwell BM. Se requiere una activación tardía y prolongada de la vía fosfatidilinositol 3-quinasa para la proliferación de células T. J Immunol. (2004) 172:3527–34. doi: 10.4049/jimmunol.172.6.3527
Resumen de PubMed | Texto completo de CrossRef | Google Académico
64. Palmer MJ, Mahajan VS, Trajman LC, Irvine DJ, Lauffenburger DA, Chen J. Interleukin-7 receptor signaling network: an integrated systems perspective. Célula Mol Immunol. (2008) 5:79–89. DOI: 10.1038/CMI.2008.10
Resumen de PubMed | Texto completo de CrossRef | Google Académico
65. Riley JK, Carayannopoulos MO, Wyman AH, Chi M, Ratajczak CK, Moley KH. La vía PI3K/Akt está presente y es funcional en el embrión de ratón preimplantacional. Dev Biol. (2005) 284:377–86. doi: 10.1016/j.ydbio.2005.05.033
Resumen de PubMed | Texto completo de CrossRef | Google Académico
66. Jeong P-S, Yoon S-B, Choi S-A, Song B-S, Kim J-S, Sim B-W, et al. Iloprost apoya el desarrollo temprano de embriones porcinos producidos in vitro a través de la activación de la vía de señalización fosfatidilinositol 3-quinasa/AKT. Reprod Fertil Dev. (2017) 29:1306–18. DOI: 10.1071/RD15391
Resumen de PubMed | Texto completo de CrossRef | Google Académico
67. Ashry M, Rajput SK, Folger JK, Knott JG, Hemeida NA, Kandil OM, et al. Papel funcional de la señalización de AKT en el desarrollo embrionario temprano bovino: posible vínculo con las acciones embriotróficas de la folistatina. Reprod Biol Endocrinol. (2018) 16:1. doi: 10.1186/s12958-017-0318-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
68. Azami T, Bassalert C, Allègre N, Valverde Estrella L, Pouchin P, Ema M, et al. Regulación de la vía de señalización ERK en el blastocisto de ratón en desarrollo. Desarrollo. (2019) 146:DEV177139. doi: 10.1242/dev.177139
Resumen de PubMed | Texto completo de CrossRef | Google Académico
69. Shen X-H, Cui X-S, Lee S-H, Kim N-H. La interleucina-6 mejora el desarrollo del partenote porcino in vitro, a través de la vía de señalización IL-6/Stat3. J Reprod Dev. (2012) 58:453–60. DOI: 10.1262/JRD.2012-015
Resumen de PubMed | Texto completo de CrossRef | Google Académico
70. Wooldridge LK, Johnson SE, Cockrum RR, Ealy AD. La interleucina-6 requiere JAK para estimular la expansión de la masa celular interna en embriones bovinos. Reproducción. (2019) 158:303–12. doi: 10.1530/REP-19-0286
Resumen de PubMed | Texto completo de CrossRef | Google Académico
71. Kelley RL, Gardner DK. La adición de interleucina-6 al cultivo embrionario de ratón aumenta el número de células de blastocisto e influye en la proporción de masa celular interna a trofoectodermo. Clin Exp Reprod Med. (2017) 44:119–25. doi: 10.5653/cerm.2017.44.3.119
Resumen de PubMed | Texto completo de CrossRef | Google Académico
72. Wooldridge LK, Ealy AD. La interleucina-6 aumenta el número de masas celulares internas en embriones bovinos. BMC Dev Biol. (2019) 19:2. DOI: 10.1186/S12861-019-0182-Z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: interleucina-7, cerdo, desarrollo embrionario, cultivo in vitro, activación partenogenética
Cita: Oh D, Choi H, Kim M, Cai L, Lee J, Jawad A, Kim S, Zheng H, Lee G, Jeon Y y Hyun S-H (2022) La interleucina-7 mejora el desarrollo in vitro y la calidad del blastocisto en embriones partenogenéticos porcinos. Frente. Vet. Sci. 9:1052856. doi: 10.3389/fvets.2022.1052856
Recibido: 24 de septiembre de 2022; Aprobado: 24 de noviembre de 2022;
Publicado: 08 diciembre 2022.
Editado por:
Sebastián Demyda-Peyrás, Universidad Nacional de La Plata, Argentina
Revisado por:
Rolando Pasquariello, Universidad de Milán, Italia
Xiaoyun He, Instituto de Ciencias Animales (CAAS), China
Derechos de autor © 2022 Oh, Choi, Kim, Cai, Lee, Jawad, Kim, Zheng, Lee, Jeon y Hyun. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Yubyeol Jeon, ybjeon@jbnu.ac.kr; Sang-Hwan Hyun, shhyun@cbu.ac.kr
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

