La metabolómica revela biomarcadores de preñez temprana en cerdas: un enfoque diagnóstico no invasivo
La metabolómica revela biomarcadores de preñez temprana en cerdas: un enfoque diagnóstico no invasivo
 Yujun Ren1
Yujun Ren1  Qingze Zhang1
Qingze Zhang1  Fan He1
Fan He1  Menfan Qi1
Menfan Qi1  Binbin Fu1
Binbin Fu1  Huapeng Zhang1
Huapeng Zhang1  Tao Huang1,2*
Tao Huang1,2*- 1Facultad de Ciencia y Tecnología Animal, Universidad de Shihezi, Shihezi, China
- 2Centro de Investigación de Tecnología de Ingeniería de Cría de Cerdos de Xinjiang, Xinjiang Tecon Husbandry S&T Co. Ltd, Changji, China
En un esfuerzo por mejorar el manejo reproductivo y reducir los períodos no productivos en la cría de cerdos, este estudio presenta un enfoque metabolómico novedoso y no invasivo para la identificación de biomarcadores de preñez temprana en cerdas. Utilizando un enfoque metabolómico no dirigido con análisis de espectrometría de masas, examinamos muestras de saliva de cerdas de control preñadas (n = 6) y no preñadas (n = 6, inseminadas artificialmente con espermatozoides no viables). Nuestro análisis reveló 286 metabolitos expresados diferencialmente, de los cuales 152 estaban regulados al alza y 134 a la baja en el grupo de gestantes. Entre estos, tres metabolitos, a saber, el ácido hiodesoxicólico, la 2′-desoxiguanosina y la timidina, surgieron como posibles biomarcadores del embarazo temprano. Estos biomarcadores se evaluaron más a fondo mediante la cuantificación y cualificación dirigida de LC-MS/MS, acompañada de un análisis de la curva ROC. El estudio confirmó que el ácido hiodesoxicólico y la 2′-desoxiguanosina son biomarcadores prometedores para la detección temprana de preñez, lo que ofrece potencial para su futura implementación en entornos de producción porcina. Esta investigación establece una base teórica sólida para el desarrollo de técnicas innovadoras de diagnóstico molecular y explora nuevas vías para el mejoramiento genético molecular y el diagnóstico no invasivo, mejorando en última instancia la fertilidad y la productividad en los rebaños de cerdas.
1 Introducción
La industria porcina se está intensificando y ampliando, con un enfoque en la reducción de días no productivos para las cerdas y la minimización de los costos de reproducción. El diagnóstico gestacional precoz es crucial para optimizar el manejo reproductivo, pero las técnicas actuales tienen limitaciones (1-3). Sin embargo, encontrar una estrategia eficaz para reducir los intervalos entre nacimientos y disminuir los días no productivos sigue siendo un desafío para la industria (4-6). El diagnóstico precoz de la gestación desempeña un papel crucial en la optimización del manejo reproductivo de las cerdas y contribuye favorablemente a la expansión de alta calidad de las operaciones de cría de cerdos (7).
Las técnicas disponibles actualmente para el diagnóstico de preñez en cerdas tienen varias limitaciones. Por ejemplo, el diagnóstico basado en la ecografía es propenso a la variabilidad de la precisión y la interpretación en función del usuario (8). Los métodos centrados en los rasgos externos, como la detección del abdomen y el agrandamiento de la ubre, a menudo presentan capacidades diagnósticas tardías (9). Los métodos de identificación basados en hormonas pueden dar lugar ocasionalmente a confusiones de «falso celo» en un pequeño porcentaje de cerdas, lo que conduce a errores de diagnóstico (10). Además, confiar en la detección de verracos para la identificación del retorno al celo puede aumentar inadvertidamente el riesgo de transmisión de enfermedades malignas (11). En la actualidad, la ecografía B se utiliza habitualmente para el diagnóstico de la preñez de las cerdas, tanto a nivel nacional como internacional (11). Sin embargo, este método no es efectivo para detectar el embarazo durante el ciclo inicial de celo (21 días) después de la inseminación artificial, lo que lleva a un aumento de los días no productivos (12).
En los últimos años, ha habido un creciente interés en la utilización de biomarcadores salivales como herramienta diagnóstica debido a las ventajas que ofrecen sobre los métodos tradicionales (13). La recolección de saliva no es invasiva, es de fácil acceso y menos estresante para los animales en comparación con otros métodos de recolección de muestras, como la sangre o la orina (14). Además, la saliva contiene una amplia gama de biomoléculas, incluidos los metabolitos, que pueden proporcionar información valiosa sobre el estado fisiológico y metabólico de un individuo (15).
El objetivo general de esta investigación es identificar biomarcadores para el diagnóstico precoz de la gestación en cerdas y evaluar su aplicabilidad en entornos de producción. Esto con la expectativa de mejorar significativamente la eficiencia de la detección de preñez en cerdas, abordar desafíos clave en la producción y fomentar el desarrollo eficiente y sostenible de la industria porcina.
2 Materiales y métodos
Todos los experimentos con animales se llevaron a cabo bajo un protocolo aprobado por el Comité de Ética Médica, Primer Hospital Afiliado, Facultad de Medicina, Universidad de Shihezi (2014-073-01, 5 de marzo de 2014).
2.1 Muestras
2.1.1 Manipulación de animales de laboratorio
En este estudio se inscribieron treinta cerdas binarias grandes de × Yorkshire, emparejadas por edad de crecimiento, paridad, condición corporal y estado de parto. Todas las cerdas gozaban de buena salud y no tenían enfermedades genéticas. La temperatura del criadero se mantuvo entre 18 y 25 °C, con una humedad del 50 a 55 %. La estrategia de producción empleó un sistema all-in, all-out, y las cerdas fueron alimentadas con alimento completo y manejadas diariamente de acuerdo con las regulaciones de la industria. En el experimento, se asignaron aleatoriamente 12 cerdas para la investigación metabolómica no dirigida, con 6 designadas como grupo experimental y las 6 restantes como grupo control. Las otras 18 cerdas sirvieron como grupo de validación para estudios metabolómicos dirigidos. Después del destete, la identificación del celo se realizó dos veces al día, a las 10:00 AM y a las 4:00 PM, utilizando verracos para la estimulación del celo. Se utilizó el reflejo de pie de las cerdas para determinar su estado de celo, y se realizó inseminación artificial el día de la detección del celo, definido como el día 0 de gestación. La inseminación artificial se realizó tres veces a intervalos de 12 h. En el grupo experimental se siguieron procedimientos regulares para introducir espermatozoides viables, mientras que en el grupo control se utilizó semen sin espermatozoides viables [Las muestras de semen se trataron sumergiendo los recipientes en un baño de agua mantenido a 95°C durante 30 min para asegurar la inactivación de los espermatozoides. Después del tratamiento, el análisis microscópico confirmó la ausencia de espermatozoides viables, garantizando así la capacidad no fecundante del semen utilizado en el grupo control (16)]. A los 18 días después de la inseminación artificial, los verracos se utilizaron nuevamente para la estimulación del celo para determinar si las cerdas volvían al celo. A los 25 y 35 días post-inseminación artificial, se confirmó la preñez en las cerdas mediante ecógrafo veterinario B.
2.1.2 Proceso de recogida de muestras
Se utilizaron gasas estériles desgrasadas como estímulo para inducir el comportamiento de masticación en las cerdas. Posteriormente, se recolectó la gasa bien masticada y se extrajo la saliva apretándola en un tubo centrífugo. El tubo de centrífuga había sido pretratado con alta temperatura y presión y se selló con una bolsa autosellante. Una vez obtenida la muestra, se sometió a centrifugación a 3000 revoluciones por minuto durante 10 min. Después de la centrifugación, el sobrenadante, que representa la porción líquida por encima del sedimento, se transfirió cuidadosamente a un tubo de criopreservación de 5 ml. Para evitar la degradación, el tubo de criopreservación se colocó en nitrógeno líquido para su preservación. Las muestras conservadas se transportaron al laboratorio y se almacenaron a una temperatura de -80 °C hasta su posterior análisis.
2.2 Análisis metabolómicos no dirigidos
2.2.1 Pretratamiento de experimentos metabolómicos no dirigidos
El procedimiento experimental se llevó a cabo de la siguiente manera: se pasó 1 mL de la muestra a través de una columna de extracción en fase sólida (SPE) y se recolectaron 3 mL de eluido de metanol. A continuación, el eluido se secó con un instrumento de soplado de nitrógeno. Posteriormente, se añadieron al extracto seco 300 μL de una mezcla de metanol y agua (con una relación de volumen de 4:1) que contenía L-2-clorofenilalanina a una concentración de 4 μg/mL. La mezcla se agitó en vórtice durante 1 min y luego se sometió a ultrasonidos en un baño de agua helada durante 10 min. A continuación, la muestra se dejó inalterada a -40 °C durante 30 min y posteriormente se centrifugó a 13.000 rpm durante 10 min a 4 °C. Un total de 150 μL del sobrenadante de la tercera extracción se pipeteó y pasó a través de un filtro de 0,22 μm antes de ser transferido a un vial de inyección de LC. A continuación, el vial se almacenó en un frigorífico a -80 °C para su posterior análisis. El mismo proceso se repitió para las muestras de control de calidad, que se prepararon mezclando volúmenes iguales de extractos de muestras del grupo de embarazo y del grupo de no embarazo.
2.2.2 Condiciones de análisis de la metabolómica no dirigida por cromatografía líquida y espectrometría de masas
Condiciones cromatográficas: Se utilizó ACQUITY UPLC HSS T3 con columna (100 mm × 2,1 mm, 1,8 mmm); la temperatura de la columna se mantuvo en 45°C; las fases móviles fueron A-agua (que contiene 0,1% de ácido fórmico) y B-acetonitrilo; el caudal se mantuvo en 0,35 mL/min; el volumen de inyección fue de 2 μL.
Condiciones de espectrometría de masas: la fuente de iones fue ESI; Para la adquisición de señales se utilizaron los modos de barrido de iones positivos y negativos.
2.3 Elaboración de perfiles metabolómicos específicos
2.3.1 Pretratamiento de la muestra
Después de descongelar las muestras, se sometieron a vórtice durante 10 s y se mezclaron completamente. A continuación, 50 μL de las muestras se transfirieron a tubos de centrífuga numerados de 1,5 mL y se almacenaron inmediatamente a -80 °C. Posteriormente, se añadieron 250 μL de una solución de extracción de acetonitrilo-metanol al 20% a cada tubo. Las muestras se sometieron a vórtice durante 3 min y se centrifugaron a 12.000 r/min durante 10 min a 4°C. El sobrenadante resultante se aspiró cuidadosamente y se transfirió a otro tubo de centrífuga numerado de 1,5 ml, que luego se colocó en un refrigerador a -20 ° C durante 30 minutos. A continuación, se extrajeron 250 μL del sobrenadante en otro tubo de centrífuga y se centrifugaron durante 30 min a -20 °C, seguido de una centrifugación adicional a 12.000 r/min y 4 °C durante 10 min. Del sobrenadante resultante, se pasaron 180 μL a través de una placa de precipitación de proteínas para su análisis, y el sobrenadante restante se almacenó a -20 °C en el refrigerador.
2.3.2 Condiciones de adquisición de cromatografía y espectrometría de masas
La instrumentación de adquisición de datos consistió principalmente en cromatografía líquida de ultra rendimiento (UPLC) (ExionLC™ AD)1 y Espectrometría de Masas en Tándem (MS/MS) (QTRAP® 6.500+, véase la nota de pie de página 1). El método T3 en condiciones de fase líquida incluye principalmente: Columna cromatográfica: Columna ACQUITY UPLC HSS T3 C18 de Waters (1,8 μm, 100 mm × 2,1 mm de diámetro interior); Fase móvil: Fase A, agua ultrapura (que contiene 0,05% de ácido fórmico); fase B, acetonitrilo (que contiene 0,05% de ácido fórmico); Caudal de 0,35 mL/min; temperatura de la columna de 40°C; volumen de inyección de 2 μL; Elución en gradiente: relación A/B de 0 min de 95:5 (V/V), relación A/B de 8 min de 5:95 (V/V), relación A/B de 9,5 min de 5:95 (V/V), relación A/B de 9,6 min de 95:5 (V/V), relación A/B de 12 min de 95:5 (V/V).
El método de amida en condiciones de fase líquida incluye principalmente: Columna cromatográfica: Columna de amida ACQUITY UPLC BEH (1,7 μm, 100 mm × 2,1 mm de diámetro interior); Fase móvil: Fase A, agua ultrapura (acetato de amonio 10 mM, amoníaco al 0,3%); Fase B, 90% acetonitrilo/agua (V/V); Caudal de 0,40 mL/min; temperatura de la columna de 40°C; volumen de inyección de 2 μL; Elución en gradiente: relación A/B de 0-1,2 min de 5:95 (V/V), relación A/B de 8 min de 30:70 (V/V), relación A/B de 9,0-11 min de 50:50 (V/V), relación A/B de 11,1–15 min de 5:95 (V/V).
Las condiciones de espectrometría de masas incluyen principalmente: temperatura de ionización por electrospray (ESI) de 550 °C, voltaje de espectrometría de masas de 5.500 V en modo de iones positivos, voltaje de espectrometría de masas de −4.500 V en modo de iones negativos, presión de gas de cortina (CUR) de 35 psi. En el Q-Trap 6.500+, los pares de iones se escanean y detectan en función del potencial de desagrupamiento (DP) optimizado y la energía de colisión (CE).
2.4 Análisis estadístico
En este estudio, se utilizó el Análisis de Componentes Principales (ACP) no supervisado para analizar la distribución general y la estabilidad de los datos tanto en el grupo de embarazo como en el de no embarazo. El parámetro primario del modelo PCA fue R2X. El gráfico de puntuación de PCA, con t [1] en el eje x y t [2] en el eje y, representa las puntuaciones proyectadas de cada muestra en los dos primeros componentes principales, PC1 y PC2, respectivamente. Este enfoque permite una evaluación exhaustiva de los datos sin suposiciones previas ni sesgos. Después de aplicar PCA sin supervisión, los metabolitos candidatos se seleccionaron en función de sus patrones de expresión y confianza. Se utilizaron como medida de confianza los valores de la Variable Importante en la Proyección (VIP), que indican la importancia de cada metabolito en la proyección. Los metabolitos con valores altos de VIP se consideraron más confiables y se analizaron más a fondo en los pasos posteriores. A continuación, se exploraron los metabolitos diferenciales identificados en el análisis para determinar su posible implicación en los análisis de vías y señalización. Este paso proporciona información sobre los mecanismos biológicos subyacentes asociados con el embarazo y el no embarazo.
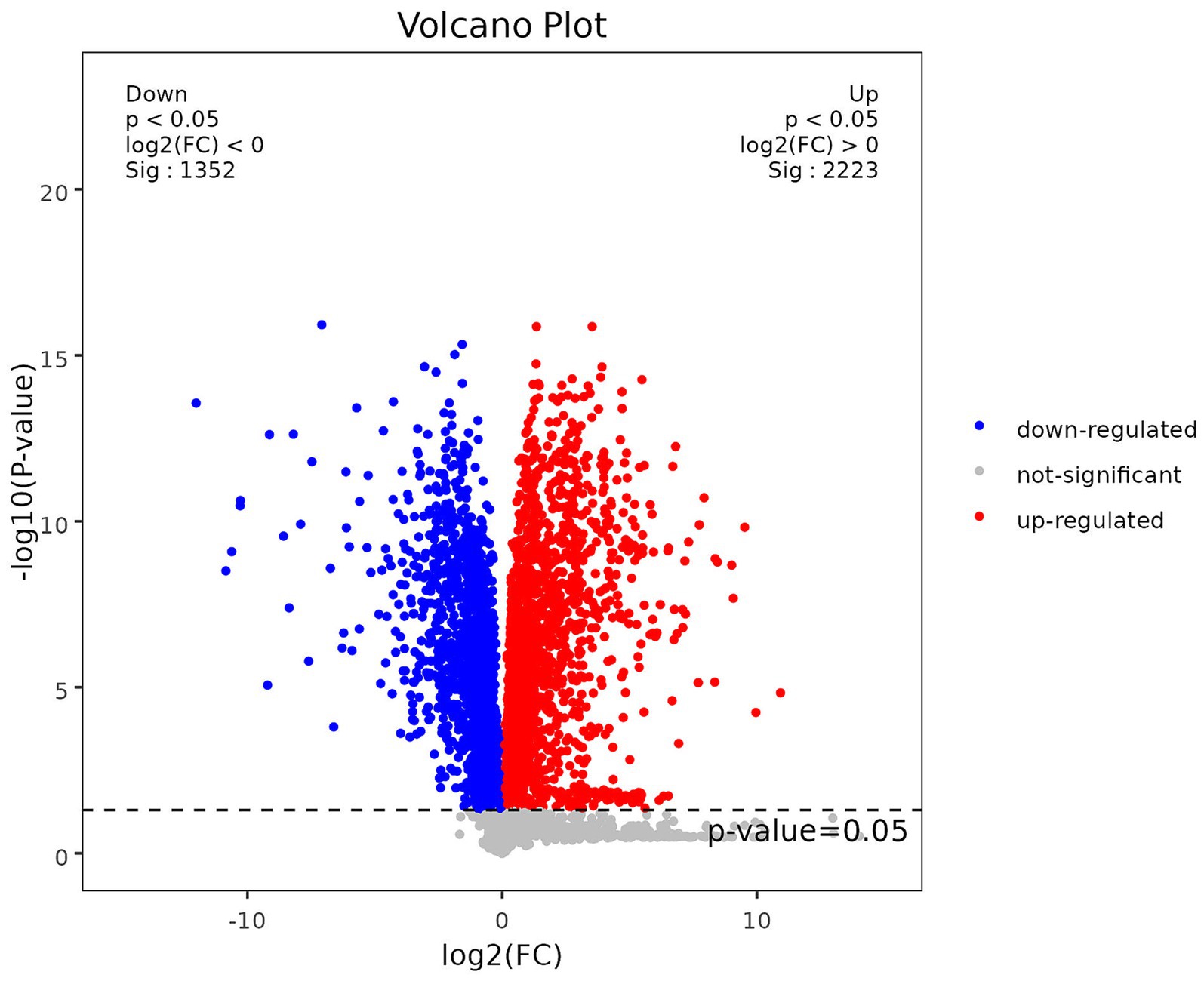
Para confirmar la significación estadística de las diferencias observadas entre los grupos de embarazo y no embarazo, se realizaron pruebas t. La variabilidad entre grupos, revelada por las pruebas t, apoya la validez de las diferencias observadas. Se utilizó un diagrama volcánico para la visualización de los valores de p y los valores de cambio de pliegue (FC). El eje x representa los valores de cambio de plegamiento transformado log2 (log2FC) derivados de la comparación entre dos grupos, mientras que el eje y representa el logaritmo negativo (base 10) de los valores p (−log10 [valor p]). Los puntos de datos coloreados en rojo indican metabolitos con un valor p inferior a 0,05 y un FC superior a 1, lo que significa una regulación positiva estadísticamente significativa de estos metabolitos. Los puntos de datos en azul denotan metabolitos con un valor p inferior a 0,05 y un FC inferior a 1, lo que indica una regulación negativa estadísticamente significativa. Con el fin de evaluar el rendimiento diagnóstico de los metabolitos identificados y su combinación como biomarcadores, se realizó un análisis de las características operativas del receptor (ROC). Las curvas ROC proporcionan una representación gráfica de la sensibilidad y especificidad de las pruebas diagnósticas. El AUC, una medida resumida de la precisión diagnóstica global, se calculó a partir de la curva ROC.
3 Resultados
Las cerdas que participaron en el estudio de metabolismo no objetivo fueron evaluadas mediante ultrasonido los días 25 y 35 después de la cría. En el grupo de inseminación normal, se encontró que todas las cerdas estaban preñadas, mientras que en el grupo control, ninguna de las cerdas estaba preñada. En el estudio de metabolismo dirigido, las cerdas fueron examinadas por ultrasonido los días 25 y 35 después del apareamiento. De las cerdas examinadas, se determinó que 5 no estaban preñadas, mientras que se confirmó que 12 estaban preñadas.
3.1 Basado en los resultados metabolómicos no dirigidos de LC-MS
3.1.1 Análisis de control de calidad
Para evaluar la estabilidad del sistema de espectrometría de masas, empleamos el método PCA. Los gráficos del modelo PCA, derivados de la validación cruzada de 7 veces, se presentan en la Figura 1A. Se observa que las muestras de control de calidad están estrechamente agrupadas en el modelo PCA, lo que es una fuerte indicación de la consistencia de la detección instrumental a lo largo del proceso experimental. Este patrón de agrupamiento sugiere que el sistema de espectrometría de masas mantuvo un alto nivel de estabilidad, lo cual es crucial para obtener resultados precisos y reproducibles.
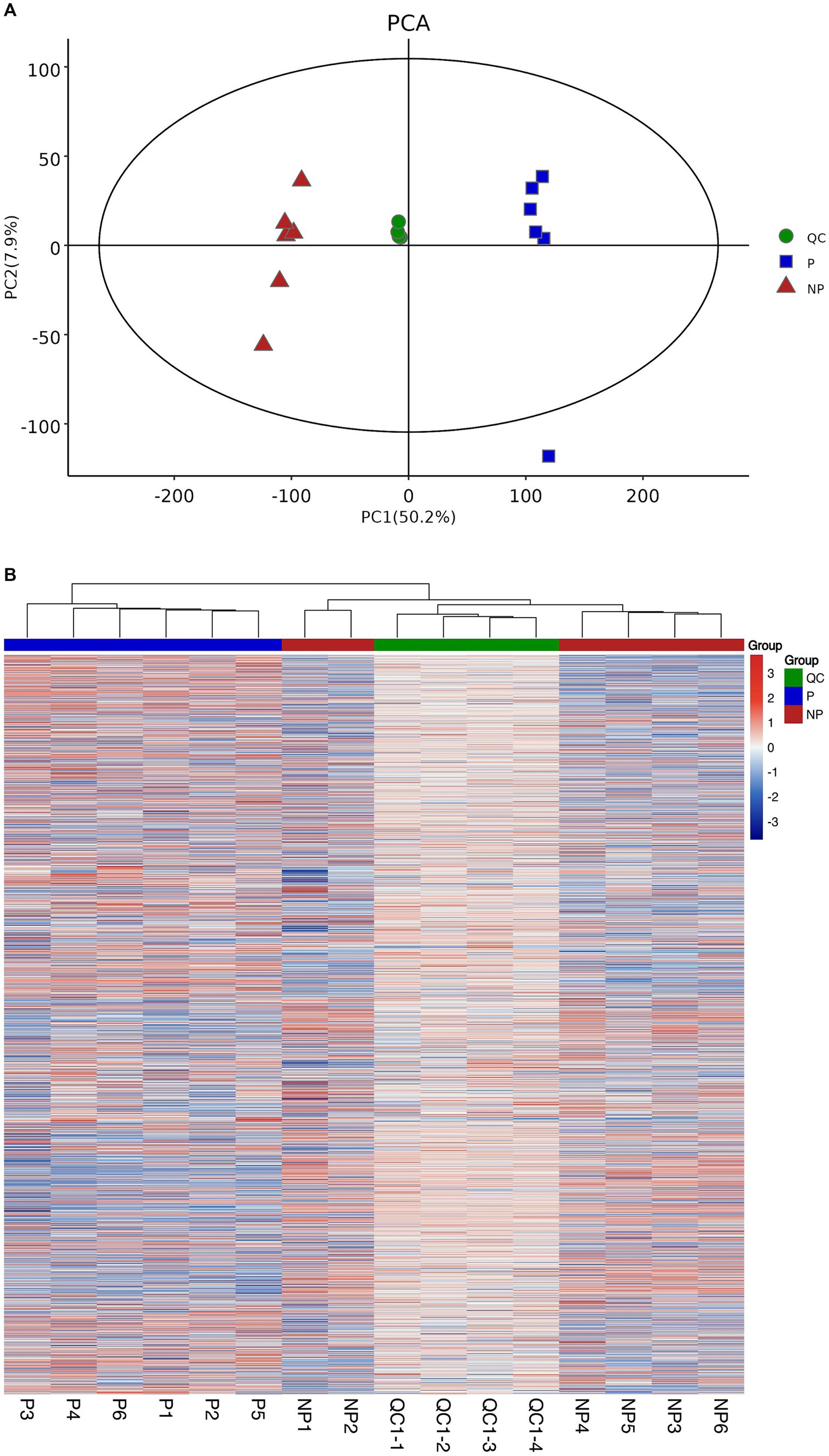 Figura 1. Análisis de control de calidad de muestras. (A) Gráfico de las puntuaciones de la ACP para los grupos de embarazo, no embarazo y control de calidad. (B) Mapa de calor de agrupación de grupos de embarazo, no embarazo y control de calidad.
Figura 1. Análisis de control de calidad de muestras. (A) Gráfico de las puntuaciones de la ACP para los grupos de embarazo, no embarazo y control de calidad. (B) Mapa de calor de agrupación de grupos de embarazo, no embarazo y control de calidad.
Además, para dilucidar la relación entre las muestras de control de calidad y las muestras restantes, así como para reforzar la estabilidad de las muestras de control de calidad, se realizó un análisis de conglomerados jerárquico sobre todas las expresiones de metabolitos. El dendrograma resultante de este análisis se muestra en la Figura 1B, donde se muestra claramente que las muestras de control de calidad son consistentes entre sí, lo que valida aún más su fiabilidad.
3.1.2 Análisis diferencial de metabolitos
Con el fin de cuantificar el número de metabolitos diferenciales en cada grupo de comparación, se contó el número de metabolitos diferenciales. Se identificaron un total de 286 metabolitos diferenciales, de los cuales 152 estaban regulados al alza y 134 a la baja en comparación con el grupo de control. Para analizar visualmente los valores p y FC de los metabolitos obtenidos del análisis de espectrometría de masas, se empleó un diagrama volcánico para examinar los metabolitos diferenciales, como se ilustra en la Figura 2.
Para profundizar en las implicaciones biológicas de los metabolitos diferenciales, realizamos un análisis de la vía KEGG (Kyoto Encyclopedia of Genes and Genomes), como se ilustra en la Figura 3A. El análisis de enriquecimiento puso de manifiesto que los metabolitos expresados diferencialmente se asociaron principalmente con vías como la vía de señalización de los esfingolípidos, el metabolismo de los esfingolípidos y el metabolismo del ácido linoleico. Al integrar los resultados del análisis de enriquecimiento con los valores de VIP de los metabolitos, identificamos tres biomarcadores potenciales para el diagnóstico de preñez de cerdas: ácido hiodesoxicólico, 2′-desoxiguanosina y timidina. Estos metabolitos se eligieron en función de sus niveles de expresión significativos y su papel potencial en los procesos biológicos relacionados con el embarazo. Para investigar más a fondo los niveles de expresión de los biomarcadores identificados, generamos diagramas de caja para cada uno, como se muestra en las Figuras 3B-D. Los diagramas de caja proporcionan una vista detallada de la distribución de los niveles de metabolitos, incluida la mediana, los cuartiles y los valores atípicos, lo cual es esencial para evaluar el potencial de estos biomarcadores con fines diagnósticos.
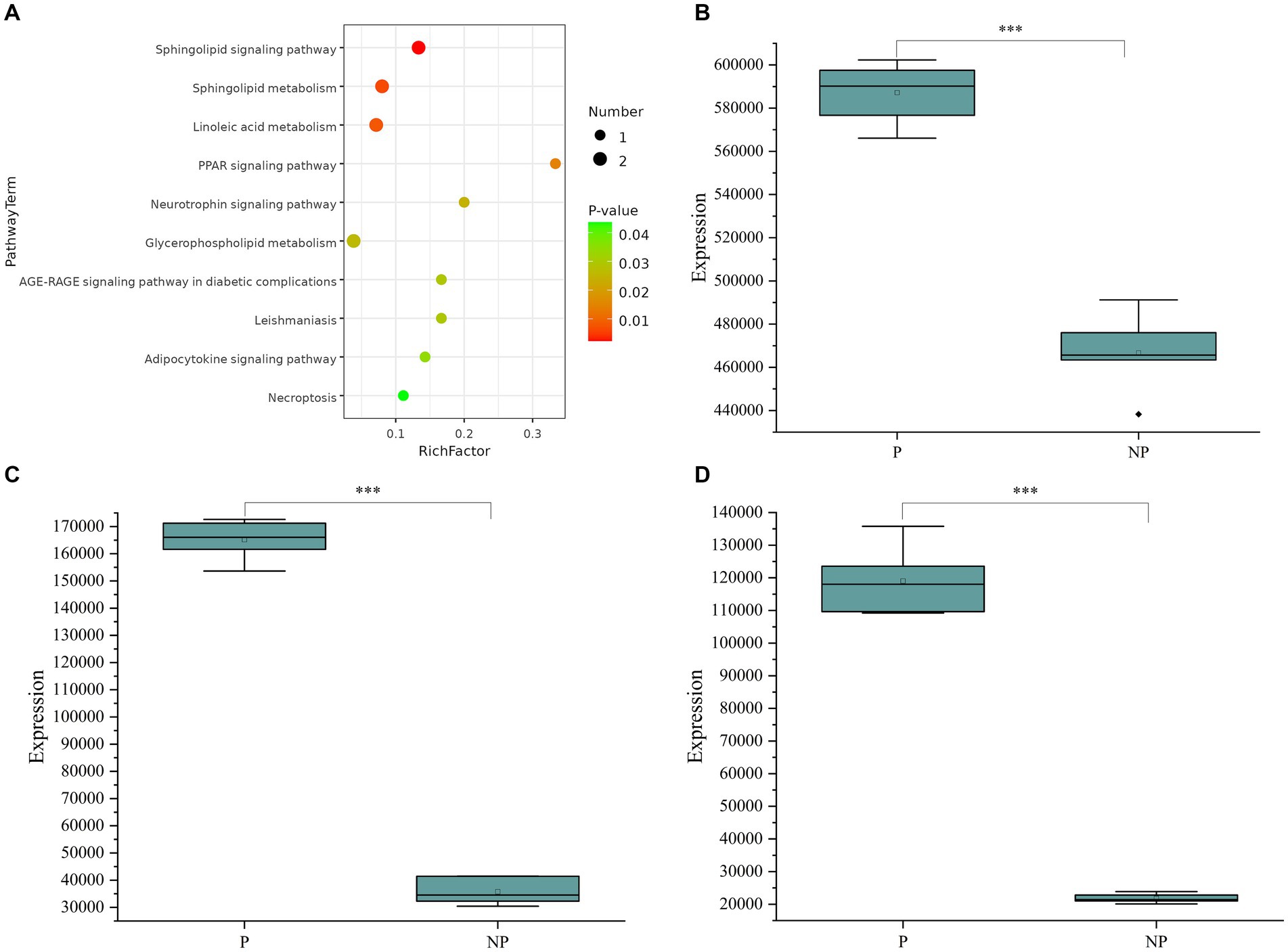 Figura 3. (A) Gráfico de burbujas de la vía metabólica. (B) Diagrama de caja de la expresión de ácido hiodesoxicólico en cerdas gestantes y no gestantes. (C) Diagrama de caja de la expresión de 2′-desoxiguanosina en cerdas gestantes y no gestantes. (D) Diagrama de caja de la expresión de timidina en cerdas gestantes y no gestantes. Los datos (n = 12) se analizaron mediante la prueba t de Student. *P < 0,05, **P < 0,01, ***P < 0,001.
Figura 3. (A) Gráfico de burbujas de la vía metabólica. (B) Diagrama de caja de la expresión de ácido hiodesoxicólico en cerdas gestantes y no gestantes. (C) Diagrama de caja de la expresión de 2′-desoxiguanosina en cerdas gestantes y no gestantes. (D) Diagrama de caja de la expresión de timidina en cerdas gestantes y no gestantes. Los datos (n = 12) se analizaron mediante la prueba t de Student. *P < 0,05, **P < 0,01, ***P < 0,001.
3.2 Basado en los resultados metabolómicos dirigidos a LC-MS/MS
3.2.1 Análisis de control de calidad
La estabilidad de la señal de espectrometría de masas se evaluó mediante el análisis del flujo iónico total para la detección de metabolitos. Un alto grado de superposición de curvas en el tiempo de retención y la intensidad de pico indica que el sistema de espectrometría de masas mantuvo una buena estabilidad de la señal incluso cuando se detectó la misma muestra en diferentes puntos de tiempo. Esta consistencia en la detección de señales es crucial para garantizar la fiabilidad y la reproducibilidad del perfil de metabolitos, como se muestra en la Figura 4A.
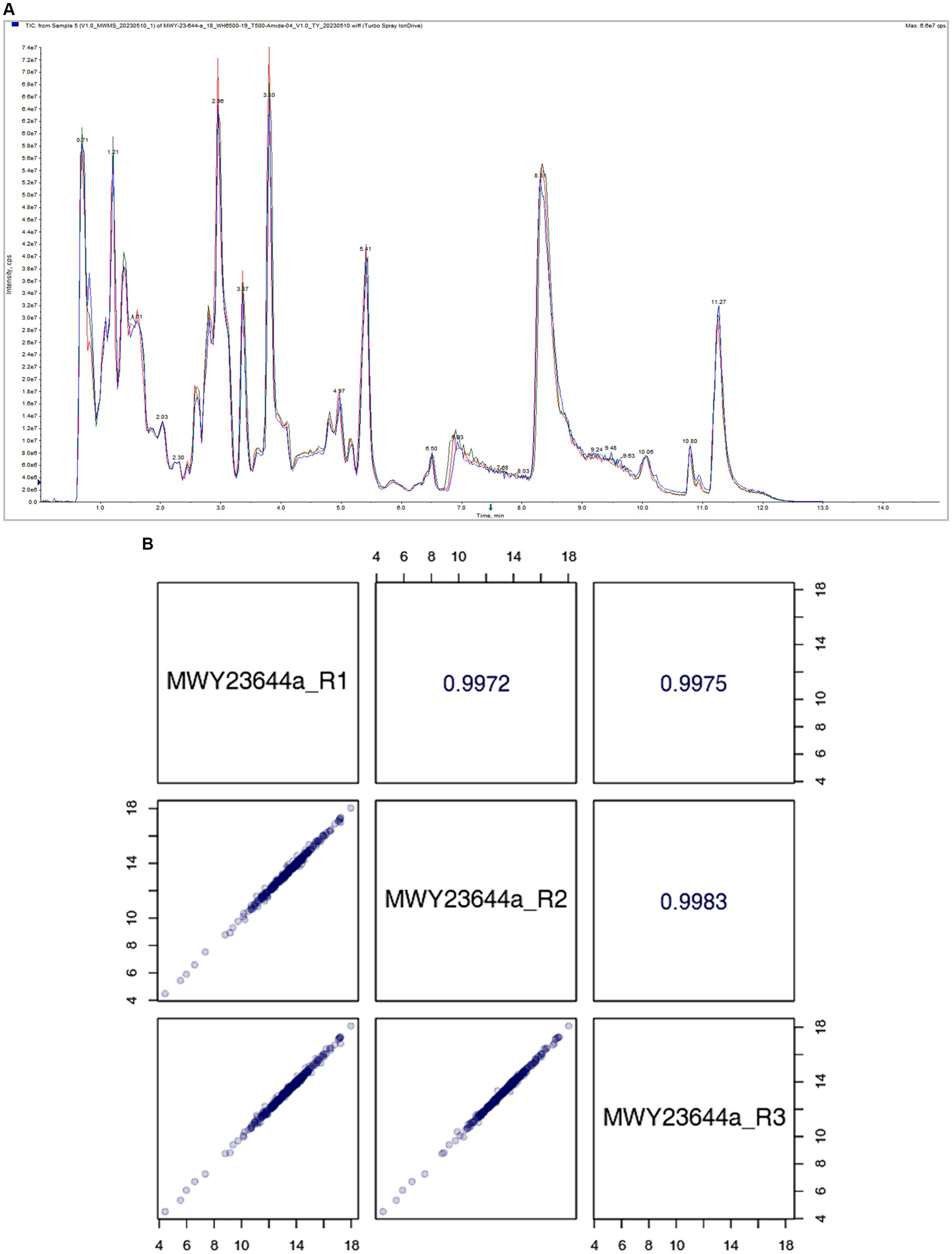 Figura 4. a) Cromatograma iónico total. (B) Análisis de correlación de muestras de control de calidad (QC).
Figura 4. a) Cromatograma iónico total. (B) Análisis de correlación de muestras de control de calidad (QC).
El diagrama de dispersión de correlación en el cuadrado diagonal inferior izquierdo de la Figura 4B representa el contenido de metabolitos de cada punto, con las coordenadas horizontales y verticales correspondientes a los niveles de metabolitos detectados en las muestras de control de calidad. La estrecha correlación entre el contenido de metabolitos a lo largo de múltiples corridas indica la precisión y consistencia del sistema de espectrometría de masas en la detección y cuantificación de metabolitos. El cuadrado diagonal superior derecho de la Figura 4B muestra el coeficiente de correlación para la muestra de control de calidad correspondiente. Un coeficiente de correlación alto significa una fuerte concordancia entre las mediciones repetidas, lo que refuerza aún más la fiabilidad de los datos de espectrometría de masas.
3.2.2 Análisis de la eficacia diagnóstica de los biomarcadores de cribado
En este estudio, evaluamos la efectividad diagnóstica de tres biomarcadores potenciales, ácido hiodesoxicólico, 2′-desoxiguanosina y timidina, para detectar la preñez en cerdas. Estos biomarcadores se analizaron cuantitativamente mediante una plataforma de detección de cromatografía líquida-espectrometría de masas en tándem (LC-MS/MS), y se compararon sus concentraciones en muestras de saliva de cerdas gestantes y no gestantes.
Un. El diagrama de caja de la Figura 5A muestra las concentraciones de ácido hiodesoxicólico en muestras de saliva. Se observó una diferencia significativa en los niveles de este metabolito entre los grupos de embarazadas y no embarazadas, con valores de p menores a 0,05, lo que indica su potencial como biomarcador diagnóstico del embarazo.
B. De manera similar, la Figura 5B presenta el diagrama de caja para las concentraciones de 2′-desoxiguanosina. El análisis reveló una diferencia significativa en los niveles de este biomarcador entre los dos grupos, lo que respalda aún más su papel potencial en el diagnóstico del embarazo.
C. El diagrama de caja de la Figura 5C ilustra las concentraciones de timidina en la saliva. También se observó una diferencia significativa para este metabolito entre cerdas gestantes y no gestantes, lo que sugiere su utilidad como biomarcador para detectar la gestación.
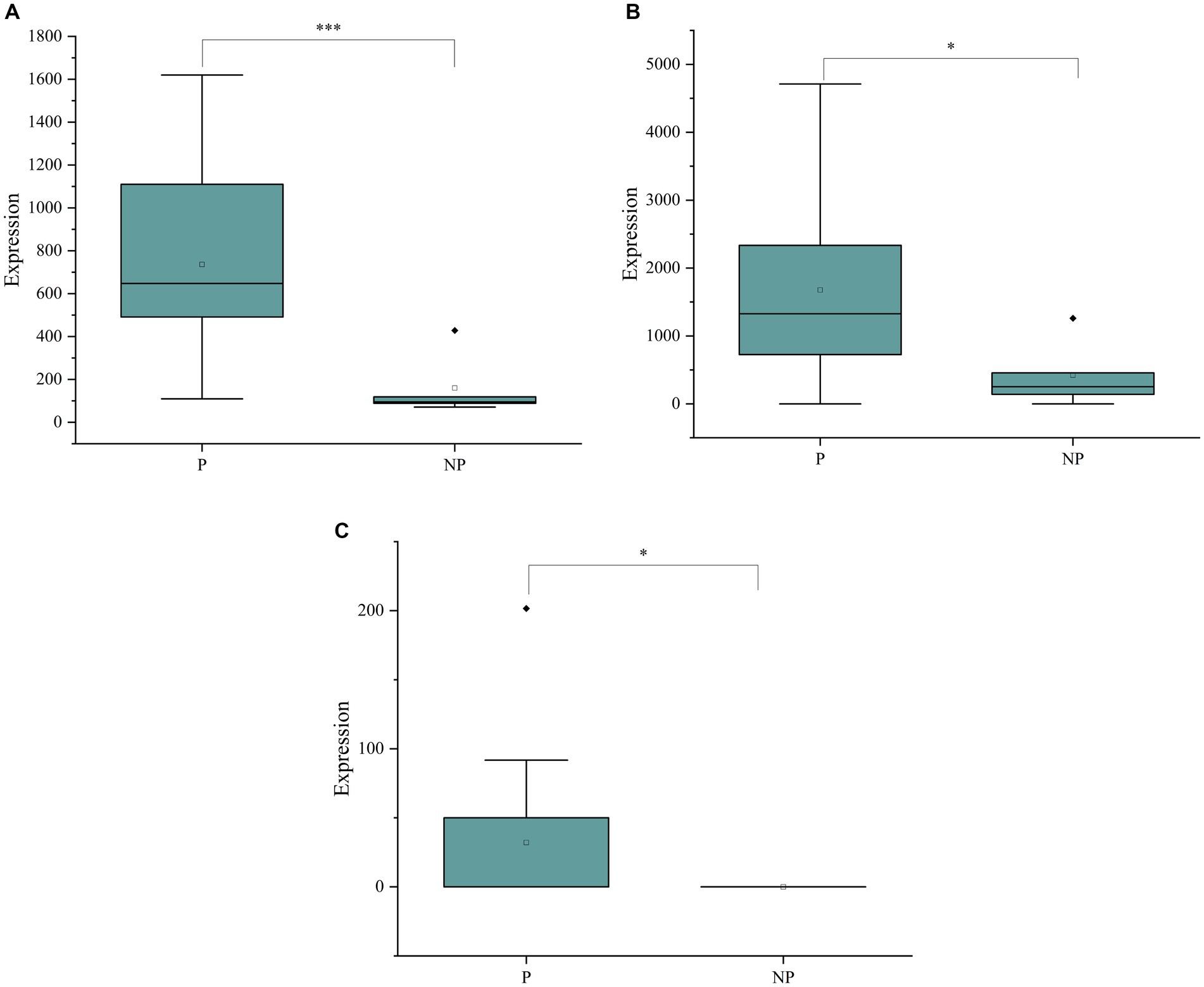 Figura 5. (A) Diagramas de caja de las concentraciones de ácido hiodesoxicólico en la saliva de cerdas gestantes y no gestantes. (B) Diagramas de caja de las concentraciones de 2′-desoxiguanosina en la saliva de cerdas gestantes y no gestantes. (C) Diagramas de caja de las concentraciones de timidina en la saliva de cerdas gestantes y no gestantes.
Figura 5. (A) Diagramas de caja de las concentraciones de ácido hiodesoxicólico en la saliva de cerdas gestantes y no gestantes. (B) Diagramas de caja de las concentraciones de 2′-desoxiguanosina en la saliva de cerdas gestantes y no gestantes. (C) Diagramas de caja de las concentraciones de timidina en la saliva de cerdas gestantes y no gestantes.
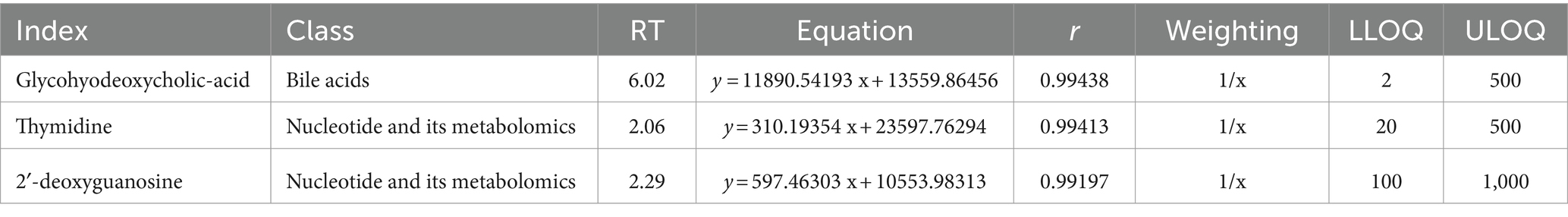
Para asegurar la precisión de la detección de biomarcadores, se generaron curvas estándar, cuyas ecuaciones lineales se detallan en la Tabla 1. Estas curvas son esenciales para la cuantificación de los biomarcadores y la validación del ensayo. Las diferencias significativas en los niveles de estos metabolitos entre los grupos de embarazadas y no embarazadas, confirmadas por el análisis de la prueba t, subrayan el potencial del ácido hiodesoxicólico, la 2′-desoxiguanosina y la timidina como biomarcadores diagnósticos. Los datos detallados de la curva estándar validan aún más la robustez de la plataforma de detección LC-MS/MS utilizada en este estudio.
3.3 Rendimiento del modelo de diagnóstico precoz del embarazo
El modelo de diagnóstico precoz del embarazo desarrollado en este estudio se evaluó mediante curvas de características operativas del receptor (ROC), una herramienta estándar para evaluar el rendimiento diagnóstico de los biomarcadores. El área bajo la curva (AUC) es una métrica clave para evaluar la capacidad diagnóstica de los biomarcadores, con valores más altos de AUC que indican un rendimiento diagnóstico superior.
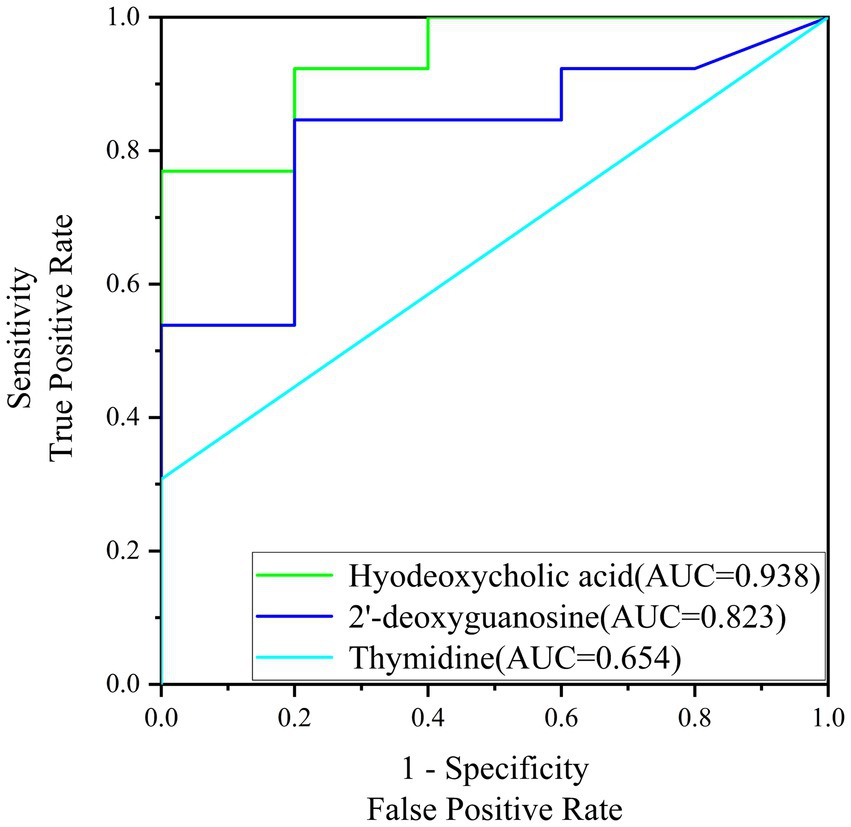
En la Figura 6 se presentan las curvas ROC para los biomarcadores de cribado en este estudio. Para el ácido hiodesoxicólico, se determinó que el AUC era de 0,938, lo que es indicativo de su fuerte valor diagnóstico y sugiere un alto potencial de aplicación práctica en el diagnóstico y la terapéutica. Este alto valor de AUC refleja la capacidad del biomarcador para distinguir con precisión entre cerdas gestantes y no gestantes con un alto grado de sensibilidad y especificidad. Del mismo modo, la 2′-desoxiguanosina exhibió un AUC de 0,823, que, aunque inferior al ácido hiodesoxicólico, sigue indicando un valor diagnóstico significativo. Este valor sugiere que la 2′-desoxiguanosina podría ser un biomarcador útil para el diagnóstico precoz del embarazo, contribuyendo al desarrollo de herramientas diagnósticas con buena precisión. Sin embargo, la timidina mostró un AUC diagnóstico más bajo, de 0,654, lo que sugiere que su potencial diagnóstico es menos robusto en comparación con los otros dos biomarcadores. A pesar de ello, puede ofrecer cierto valor en combinación con otros biomarcadores como parte de una prueba de panel para la detección precoz del embarazo. En conclusión, el análisis de la curva ROC demuestra el potencial diagnóstico del ácido hiodesoxicólico y la 2′-desoxiguanosina como biomarcadores para el diagnóstico precoz de la preñez en cerdas.
4 Discusión
El estudio actual ha aprovechado con éxito el potencial no invasivo de la metabolómica salival para identificar biomarcadores clave en cerdas preñadas tempranas. Nuestro enfoque no solo ha proporcionado una perspectiva novedosa sobre el manejo reproductivo de los cerdos, sino que también ha sentado las bases para futuras técnicas de diagnóstico molecular. El uso de la saliva como muestra biológica es ventajoso debido a su naturaleza mínimamente invasiva, la facilidad de recolección y los datos metabólicos completos que ofrece (17-20). La rica vascularización de las glándulas salivales facilita un intercambio eficiente de metabolitos, lo que convierte a la saliva en una matriz ideal para reflejar los cambios metabólicos sistémicos (19, 20).
A través de nuestro análisis metabolómico no dirigido, identificamos 286 metabolitos expresados diferencialmente, con ácido hiodesoxicólico y 2′-desoxiguanosina mostrando una expresión diferencial significativa y una alta precisión diagnóstica como posibles biomarcadores para el embarazo temprano. La validación de estos biomarcadores mediante LC-MS/MS confirmó su alto valor diagnóstico, lo que se espera que contribuya a un cambio de paradigma en las estrategias de manejo reproductivo de la industria porcina.
Nuestros hallazgos están en línea con otros estudios que han utilizado la metabolómica salival para detectar cambios en las vías metabólicas asociadas con diversas condiciones fisiológicas (10, 21-23). En el contexto de la reproducción porcina, el desarrollo de biomarcadores de preñez temprana es de suma importancia. Los métodos tradicionales, como las imágenes de ultrasonido en tiempo real (RTU, por sus siglas en inglés), están limitados por sus limitaciones de tiempo y la necesidad de equipos especializados y experiencia (7, 24, 25). Por el contrario, nuestro enfoque metabolómico no invasivo ofrece una alternativa prometedora que puede implementarse más temprano en el período de gestación, lo que podría reducir los días no productivos y mejorar el manejo del rebaño.
Los altos valores de AUC para el ácido hiodesoxicólico (0,938) y la 2′-desoxiguanosina (0,823) subrayan su potencial como biomarcadores robustos para la detección temprana del embarazo. El ácido hiodesoxicólico, en particular, ha sido reconocido por su papel en el metabolismo de los lípidos, y su regulación positiva puede reflejar los ajustes metabólicos asociados con el embarazo temprano (26, 27). En el contexto del diagnóstico precoz de la gestación en cerdas, nuestro estudio ha identificado niveles elevados de ácido hiodesoxicólico en la saliva de las preñadas, lo que presenta una perspectiva novedosa para los enfoques diagnósticos no invasivos. La regulación positiva de la 2′-desoxiguanosina durante el embarazo temprano puede reflejar el aumento de la demanda de nucleótidos necesarios para la rápida proliferación y crecimiento celular que se produce en las primeras etapas del desarrollo embrionario. La 2′-desoxiguanosina, un análogo de nucleósido, es conocida por su papel en el metabolismo de los ácidos nucleicos y se ha implicado en varios procesos biológicos, incluida la replicación y reparación del ADN, que es parte integral del metabolismo de los ácidos nucleicos, sugiere una conexión entre los cambios metabólicos gestacionales tempranos y los requisitos de nucleótidos para el desarrollo embrionario (28-30). Sin embargo, aún no se han dilucidado los mecanismos precisos que subyacen a la asociación entre el ácido hiodesoxicólico y los niveles de 2′-desoxiguanosina y la preñez temprana en las cerdas. La investigación futura debe centrarse en el análisis funcional de este biomarcador dentro del panorama metabólico más amplio, así como en la validación de su eficacia diagnóstica en diferentes razas y bajo diversas condiciones ambientales. Además, el potencial del ácido hiodesoxicólico y la 2′-desoxiguanosina como indicador pronóstico de los resultados del embarazo, como el tamaño de la camada y la salud, justifica una mayor investigación.
A pesar de los resultados prometedores, existen limitaciones en nuestro estudio que requieren más investigación. En primer lugar, el tamaño de la muestra fue relativamente pequeño, lo que puede limitar la generalización de nuestros hallazgos. Los estudios futuros deben incluir un mayor número de cerdas para validar los biomarcadores identificados. En segundo lugar, si bien la saliva ha sido el foco de nuestro estudio, sería beneficioso explorar otras muestras biológicas como sangre u orina para corroborar la fiabilidad de estos metabolitos como marcadores de embarazo (31). En tercer lugar, las funciones biológicas de estos metabolitos durante el embarazo y su potencial como indicadores pronósticos de los resultados del embarazo requieren más investigación, incorporando potencialmente datos de expresión génica y proteómica (32, 33).
En conclusión, nuestro estudio representa un importante paso adelante en el desarrollo de técnicas diagnósticas innovadoras y no invasivas para la detección precoz de la gestación en cerdas. Los biomarcadores identificados, el ácido hiodesoxicólico y la 2′-desoxiguanosina, son prometedores para mejorar las prácticas de manejo reproductivo y, en última instancia, mejorar la productividad y el bienestar en las operaciones de cría de cerdos. La investigación futura debería centrarse en validar estos biomarcadores en cohortes más grandes y explorar sus roles funcionales en el contexto de la gestación, allanando el camino para su aplicación práctica en la industria porcina.
5 Conclusión
En esta investigación, hemos empleado hábilmente la metabolómica para identificar nuevos biomarcadores para la detección temprana de la preñez en cerdas, centrándonos en el ácido hiodesoxicólico y la 2′-desoxiguanosina. Aprovechando la saliva como sustrato no invasivo, hemos desentrañado un perfil metabólico completo, ofreciendo información innovadora sobre el manejo reproductivo de los cerdos. La incorporación prospectiva de estos biomarcadores en las evaluaciones rutinarias de salud puede instigar un cambio transformador en las estrategias reproductivas. Estos avances tienen el potencial de aumentar notablemente la productividad y conferir beneficios económicos sustanciales a los productores, alineándose con la búsqueda de la industria de soluciones sofisticadas de optimización de la producción.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
Los estudios en animales fueron aprobados por el Comité de Ética Médica del Primer Hospital Afiliado de la Facultad de Medicina de la Universidad de Shihezi. Los estudios se llevaron a cabo de acuerdo con la legislación local y los requisitos institucionales. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
YR: Conceptualización, Curación de datos, Análisis formal, Investigación, Metodología, Administración de proyectos, Software, Supervisión, Validación, Visualización, Redacción – borrador original, Redacción – revisión y edición. QZ: Redacción – revisión y edición, curación de datos, análisis formal. FH: Redacción – revisión y edición, Investigación, Recursos, Validación. MQ: Investigación, Validación, Redacción – revisión y edición, Recursos. BF: Curación de datos, redacción, revisión y edición. HZ: Redacción – revisión y edición, curación de datos. TH: Obtención de fondos, Metodología, Administración de proyectos, Redacción, revisión y edición.
Financiación
El/los autor/es declaran/n que se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este estudio contó con el apoyo del Programa de Talentos de Tianshan para Jóvenes Científicos e Innovadores Tecnológicos Destacados (Fondo del proyecto: 2022TSYCCX0047), el «Proyecto de Talentos Superiores» de la Séptima División, Ciudad del Río Huyang: Identificación y Aplicación de Biomarcadores en el Fluido Porcino de Gestación Temprana (Fondo del proyecto: QS2023010) y la Fundación Nacional de Ciencias Naturales (Fondo del proyecto: 31960645).
Reconocimientos
Los autores expresan su gratitud a OEBiotech por la prestación de apoyo técnico en espectrometría de masas y por su ayuda en el análisis de datos.
Conflicto de intereses
TH fue empleado de Xinjiang Tecon Husbandry S&T Co. Ltd.
El resto de los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un potencial conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Notas
1. ^https://sciex.com.cn/
Referencias
1. Wang, G, Wang, J, Chen, S y Zhao, CE. Selección de integración vertical de la cadena de la industria porcina china bajo la peste porcina africana – desde la perspectiva de un suministro estable de cerdos. PLoS Uno. (2023) 18:e0280626. doi: 10.1371/journal.pone.0280626
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Zhao, Q, Tao, C, Pan, J, Wei, Q, Zhu, Z, Wang, L, et al. El pretratamiento con gonadotropina coriónica equina 15 días antes de la inseminación artificial a tiempo fijo mejora el rendimiento reproductivo de las primerizas de reemplazo. Animal. (2021) 15:100406. doi: 10.1016/j.animal.2021.100406
3. Koketsu, Y, e Iida, R. Análisis de datos de granja para los componentes de rendimiento de por vida de las cerdas y sus predictores en rebaños de cría. Gestión de la Salud Porcina. (2020) 6:24. doi: 10.1186/s40813-020-00163-1
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Zhou, C, Cai, G, Meng, F, Xu, Z, He, Y, Hu, Q, et al. Identificación de secuenciación profunda de biomarcadores de microARN en exosomas séricos para la preñez temprana de cerdos. Frente Genet. (2020) 11:536. doi: 10.3389/fgene.2020.00536
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Tani, S, Piñeiro, C, y Koketsu, Y. Las granjas de alto rendimiento explotan el potencial reproductivo de las cerdas de alto y bajo prolífico mejor que las granjas de bajo rendimiento. Gestión de la Salud Porcina. (2018) 4:15. doi: 10.1186/s40813-018-0091-8
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Koketsu, Y, Tani, S, e Iida, R. Factores para mejorar el rendimiento reproductivo de las cerdas y la productividad del rebaño en rebaños de cría comercial. Gestión de la Salud Porcina. (2017) 3:1. doi: 10.1186/s40813-016-0049-7
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Gokuldas, PP, Shinde, KR, Naik, S, Sahu, AR, Singh, SK y Chakurkar, EB. Evaluación de la precisión diagnóstica y la eficacia de las imágenes ecográficas transabdominales en tiempo real para el diagnóstico de preñez en cerdas reproductoras sometidas a un manejo intensivo. Trop Anim Salud Prod. (2023) 55:239. doi: 10.1007/s11250-023-03649-6
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Williams, SI, Piñeyro, P, y de la Sota, RL. Precisión del diagnóstico de preñez en porcinos mediante ecografía. ¿Puede Vet J. (2008) 49:269–73.
9. Chae, JW, Choi, YH, Lee, JN, Park, HJ, Jeong, YD, Cho, ES, et al. Un método inteligente para el diagnóstico de preñez en cerdas reproductoras según algoritmos de ecografía. J Anim Sci Technol. (2023) 65:365–76. doi: 10.5187/jast.2022.e107
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Liu, X, Schwarz, T, Murawski, M, Tayade, C, Kridli, R, Prieto Granados, AM, et al. Revisión de las mediciones de las concentraciones circulantes de progesterona y sulfato de estrona como herramienta diagnóstica y pronóstica en el embarazo porcino. Domest Anim Endocrinol. (2020) 71:106402. doi: 10.1016/j.domaniend.2019.106402
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Am-in, N, Tantasuparuk, W, y Techakumphu, M. Comparación de la inseminación artificial con el apareamiento natural en granjas de pequeños agricultores en Tailandia, y los efectos de la estimulación del verraco y la distancia de entrega de semen en el rendimiento reproductivo de las cerdas. Trop Anim Salud Prod. (2010) 42:921–4. doi: 10.1007/s11250-009-9508-3
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Tani, S, Piñeiro, C, y Koketsu, Y. Características y factores de riesgo de las hembras reproductoras reproductoras severas y su rendimiento a lo largo de la vida en rebaños de cría comercial. Gestión de la Salud Porcina. (2017) 3:12. doi: 10.1186/s40813-017-0059-0
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Khijmatgar, S, Yong, J, Rübsamen, N, Lorusso, F, Rai, P, Cenzato, N, et al. Biomarcadores salivales para la detección precoz del carcinoma oral de células escamosas (OSCC) y del carcinoma de células escamosas de cabeza/cuello (HNSCC): una revisión sistemática y metanálisis en red. Jpn Dent Sci Rev. (2024) 60:32–9. doi: 10.1016/j.jdsr.2023.10.003
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Kumar, P, Gupta, S, y Das, BC. La saliva como posible biopsia líquida no invasiva para el diagnóstico/pronóstico precoz y fácil del cáncer de cabeza y cuello. Trad. Oncol. (2024) 40:101827. doi: 10.1016/j.tranon.2023.101827
15. Kashyap, B, Hyvärinen, E, Laitinen, I, y Kullaa, AM. Metabolómica salival en pacientes con liquen plano oral: un estudio preliminar basado en espectroscopia de RMN. Clin Oral Investig. (2024) 28:103. doi: 10.1007/s00784-023-05389-1
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Chao, SB, Guo, L, Ou, XH, Luo, M, Wang, B, Schatten, H, et al. Espermatozoides calentados: efectos sobre el desarrollo embrionario y la epigenética. Hum Reprod. (2012) 27:1016–24. doi: 10.1093/humrep/des005
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Jiang, X, Chen, X, Wang, T, Li, Y, Pan, A y Wu, J. Nanocables verticales de silicio modificados con polímeros perfluorados como sustrato de ionización por desorción láser de ruido ultrabajo para el perfil de metabolitos salivales. Talanta. (2021) 225:122022. doi: 10.1016/j.talanta.2020.122022
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Kajiwara, N, Kakihana, M, Maeda, J, Kaneko, M, Ota, S, Enomoto, A, et al. Biomarcadores metabolómicos salivales para la detección no invasiva del cáncer de pulmón. Cáncer Sci. (2024) 28. doi: 10.1111/cas.16112
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Li, Y, Guan, C, Liu, C, Li, Z y Han, G. Diagnóstico de enfermedades y análisis de aplicación de polímeros impresos molecularmente (MIP) en la detección de saliva. Talanta. (2024) 269:125394. doi: 10.1016/j.talanta.2023.125394
20. Ciurli, A, Mohammed, Y, Ammon, C, Derks, RJE, Olivier-Jiménez, D, Ducarmon, QR, et al. Metaboloma resuelto espacial y temporalmente de la cavidad oral humana. iCiencia. (2024) 27:108884. doi: 10.1016/j.isci.2024.108884
21. Moreau, C, El Habnouni, C, Lecron, JC, Morel, F, Delwail, A, Le Gall-Ianotto, C, et al. El metaboloma salival indica un cambio en el metabolismo de la tirosina en pacientes con síndrome de boca ardiente: un estudio prospectivo de casos y controles. Dolor. (2023) 164:E144–56. doi: 10.1097/j.pain.000000000000002733
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Goudet, G, Nadal-Desbarats, L, Douet, C, Savoie, J, Staub, C, Venturi, E, et al. Análisis del metaboloma salival y urinario para la identificación de biomarcadores relacionados con la prepubertad en porcinos. Animal. (2019) 13:760–70. doi: 10.1017/S1751731118002161
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. Fletcher, L, Akhtar, N, Zhan, X, Jafarikia, M, Sullivan, BP, Huber, LA, et al. Identificación de biomarcadores metabólicos salivales, urinarios y séricos candidatos para el alto potencial de camada en cerdas (Sus scrofa). Meta. (2022) 12:1045. doi: 10.3390/metabo12111045
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Ohtaki, T, Moriyoshi, M, Nakada, K, Nakao, T y Kawata, K. Radioinmunoensayo de sulfato de estrona en saliva en cerdas gestantes. J Vet Med Sci. (1997) 59:759–63. doi: 10.1292/jvms.59.759
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Kousenidis, K, Giantsis, IA, Karageorgiou, E y Avdi, M. Modelado numérico de ultrasonografía porcina para el diagnóstico de la gestación y la predicción del tamaño de la camada. Int J Biol Biomed Ing. (2021) 15:29–35. doi: 10.46300/91011.2021.15.5
26. Pan, J, Wu, J, Zhang, S, Wang, K, Ji, G, Zhou, W, et al. La metabolómica dirigida reveló los mecanismos subyacentes al papel de la cápsula de Liansu en la mejora de la dispepsia funcional. J Etnofarmaco. (2024) 321:117568. doi: 10.1016/j.jep.2023.117568
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Wang, P, Chen, Q, Yuan, P, Lin, S, Chen, H, Li, R, et al. Microbiota intestinal implicada en la desulfatación de los metabolitos sulfatados de la progesterona: una posible vía de regulación de la homeostasis de los ácidos biliares maternos durante el embarazo. Microbiol frontal. (2022) 13:1023623. doi: 10.3389/fmicb.2022.1023623
Resumen de PubMed | Texto completo de Crossref | Google Académico
28. Díaz-García, H, Vilchis-Gil, J, Castro-Cerritos, KV, Rivera-Susunaga, E, Klünder-Klünder, M, Granados-Riverón, T, et al. Asociación entre la dieta materna, el tabaquismo y el genotipo MTHFR 677C/T de la placenta y la metilación global del ADN placentario. Placenta. (2024) 146:17–24. doi: 10.1016/j.placenta.2023.12.017
Resumen de PubMed | Texto completo de Crossref | Google Académico
29. Kaczmarek, MM, Najmula, J, Guzewska, MM y Przygrodzka, E. MiRNAs en el período periimplantacional: contribución a la comunicación embrio-materna en cerdos. Int J Mol Sci. (2020) 21:2229. doi: 10.3390/ijms21062229
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Del Gobbo, GF, Konwar, C, y Robinson, WP. La importancia del genoma placentario y el metiloma en la salud fetal y materna. Hum Genet. (2020) 139:1183–96. DOI: 10.1007/s00439-019-02058-w
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Lamy, E, y Mau, M. La proteómica de la saliva como una herramienta emergente y no invasiva para estudiar la fisiología, la nutrición y las enfermedades del ganado. J Proteoma. (2012) 75:4251–8. doi: 10.1016/j.jprot.2012.05.007
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. López-Martínez, MJ, Lamy, E, Cerón, JJ, Ayala, I, Contreras-Aguilar, MD, Henriksen, IH, et al. Cambios en el proteoma salival analizados por gel-proteómica en caballos diagnosticados de síndrome de úlcera gástrica equina (EGUS) en el momento del diagnóstico y después de un tratamiento exitoso. Res Vet Sci. (2024) 167:105112. doi: 10.1016/j.rvsc.2023.105112
Resumen de PubMed | Texto completo de Crossref | Google Académico
33. Pavithran, S, Murugan, M, Mannu, J, Yogendra, K, Balasubramani, V, Sanivarapu, H, et al. Identificación de proteínas salivales del pulgón del caupí Aphis craccivora mediante análisis de transcriptoma y LC-MS/MS. Bioquímico de insectos Mol Biol. (2024) 165:104060. doi: 10.1016/j.ibmb.2023.104060
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: diagnóstico precoz de gestación, metabolómica, cerdas, saliva, biomarcador, LC-MS/MS
Cita: Ren Y, Zhang Q, He F, Qi M, Fu B, Zhang H y Huang T (2024) La metabolómica revela biomarcadores de preñez temprana en cerdas: un enfoque de diagnóstico no invasivo. Frente. Vet. Sci. 11:1396492. doi: 10.3389/fvets.2024.1396492
Recibido: 05 de marzo de 2024; Aceptado: 16 de abril de 2024;
Publicado: 25 de abril de 2024.
Editado por:
Emilio A. Martínez, Universidad de Murcia, España
Revisado por:
Inmaculada Parrilla, Universidad de Murcia, España
Alberto Muñoz, Universidad de Zagreb, Croacia
Derechos de autor © 2024 Ren, Zhang, He, Qi, Fu, Zhang y Huang. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Tao Huang, taohuang100@sina.com
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía