La vacunación con adenovirus recombinantes que expresan las subunidades del virus de la lengua azul VP7 y VP2 proporciona protección contra el desafío del virus heterólogo
La vacunación con adenovirus recombinantes que expresan las subunidades del virus de la lengua azul VP7 y VP2 proporciona protección contra el desafío del virus heterólogo
Por 


- Centro de Investigación en Sanidad Animal (CISA-INIA), Instituto Nacional de Investigación y Tecnología Agraria y Alimentaria, Madrid, España
El virus de la lengua azul (BTV) es el agente causante de una enfermedad que afecta a los rumiantes domésticos y salvajes y conduce a pérdidas económicas críticas. BTV es un arbovirus de la familia Reoviridae que normalmente se transmite por la picadura de mosquitos infectados de Culicoides. BTV posee múltiples serotipos (se han descrito hasta 28), y la inmunidad a un serotipo ofrece poca protección cruzada a otros serotipos. Por lo tanto, el diseño de vacunas que proporcionan protección a través de múltiples serotipos es muy deseable para controlar esta enfermedad. Anteriormente informamos que un serotipo 5 (Ad5) de adenovirus humano defectuoso de replicación recombinante que expresa la proteína del núcleo interno VP7 del serotipo 8 de BTV (Ad5VP7-8) indujo respuestas de las células T y proporcionó protección. En el presente trabajo, evaluamos como vacuna BTV la combinación de Ad5VP7-8 con otro Ad5 recombinante que expresa la proteína central externa VP2 de BTV-1 (Ad5VP2-1). La combinación de Ad5VP2-1 y Ad5VP7-8 protegió contra el desafío homólogo de BTV (BTV-1 y BTV-8) y parcialmente contra el BTV-4 heterólogo en un modelo murino. Se detectó inmunoglobulina G (IgG) anti-BTV reactiva cruzada en animales inmunizados, pero no se obtuvieron títulos significativos de anticuerpos neutralizantes. La inmunización con Ad5VP7-8 indujo respuestas de las células T que reconocieron los tres serotipos probados en este estudio y prepararon linfocitos T citotóxicos específicos para VP7. Este estudio confirma además que la orientación del determinante antigénico compartido por varios serotipos de BTV que utilizan inmunidad celular podría ayudar a desarrollar vacunas multiserotipo BTV.
Introducción
La lengua azul (BT) es una enfermedad de notificación obligatoria a la OIE (Organización Mundial de Sanidad Animal) que afecta a los rumiantes domésticos y salvajes y causa importantes pérdidas económicas (1). BT afecta más gravemente al ganado ovino, ya que las infecciones en el ganado y las cabras a menudo son subclínicas. Sin embargo, la viremia está presente en animales infectados subclínicamente, y se cree que esto actúa como un reservorio de la enfermedad (2). El virus de la lengua azul (BTV), el agente causante de esta enfermedad, es un arbovirus que generalmente se transmite por la picadura de los mosquitos de Culicoides (1). BTV (familia: Reoviridae; género: Orbivirus) tiene un virus del genoma de ARN de doble cadena (dsARN) que consta de 10 segmentos que codifican para 7 proteínas estructurales (VP1-VP7) y al menos 4 proteínas no estructurales (NS1-NS4) (3-5). BT se consideraba tradicionalmente una enfermedad subtropical con incursiones ocasionales en el sur de Europa. Sin embargo, la redistribución del vector competente Culicoides imicola a través de la cuenca mediterránea, así como el descubrimiento de que las especies autóctonas de Culicoides también pueden albergar y transmitir el virus durante el invierno, han indicado que la enfermedad ahora puede considerarse endémica en Europa (6-9). Las infecciones por BTV producen pirexia, pérdida de apetito, depresión y pérdida de producción de leche en animales lactantes (9). La transmisión transplacentaria puede ocurrir incluso en casos subclínicos, y esto puede conducir a malformaciones fetales y abortos (10). Por lo tanto, el impacto económico de BTV es considerable y requiere campañas de vacunación para mantener los brotes bajo control.
La vacunación, la restricción del movimiento de los animales y el control de la población de vectores son los principales medios de mitigación de la TVB. La vacunación BTV hoy en día utiliza vacunas antivirus inactivadas, que a pesar de su eficacia no proporcionan protección entre serotipos (11, 12). Hasta la fecha se han notificado hasta 28 serotipos diferentes de BTV (13), y es probable que la protección cruzada de los serotipos sea limitada (14). Esto implica que en los territorios donde circulan múltiples serotipos de BTV, el ganado requerirá múltiples inmunizaciones para protegerse contra cada uno de estos serotipos. Además, estas vacunas tradicionales no pueden diferenciar a los animales infectados de los vacunados [el llamado enfoque Diferenciación de los animales infectados de los vacunados (DIVA)], que como consecuencia restringe el movimiento de los animales desde las áreas afectadas hacia las regiones libres de BTV. Por lo tanto, existe la necesidad de desarrollar vacunas DIVA que puedan proteger contra múltiples serotipos de BTV.
Entre estas estrategias de vacunación alternativas, el uso de vectores de virus recombinantes defectuosos de replicación que expresan la proteína BTV ha demostrado ser prometedor en los modelos murinos y en el huésped natural (15, 16). La proteína de la cápside externa altamente variable VP2 contiene los principales determinantes antigénicos para neutralizar los anticuerpos que se utilizan para definir los serotipos del virus (17, 18). Aunque la vacunación con esta subunidad puede inducir protección (19, 20), es poco probable que induzca una potente inmunidad de serotipo cruzado por sí sola. El uso de proteínas BTV más conservadas en formulaciones de vacunas recombinantes, como VP7 o NS1 que contiene epítopos de células T (21, 22), ya ha demostrado ser prometedor en proporcionar algún grado de protección contra los serotipos (23-26). Aunque los correlatos inmunitarios de las protecciones de BTV tienen que estar completamente definidos, es probable que dependan de una combinación de inmunidad celular y humoral (27-30). La inmunidad a la BTV puede ocurrir en ausencia de anticuerpos neutralizantes (27, 30), lo que muestra que la inducción de las respuestas de las células T es deseable para la protección de la BTV. En este aspecto, las vacunas BTV deben tener como objetivo inducir anticuerpos neutralizantes específicos del serotipo y la inmunidad celular a los epítopos expresados en varios serotipos de BTV.
Las vacunas recombinantes basadas en adenovirus son buenos inductores de la inmunidad celular porque se logra una alta expresión transgénica intracelular (31). La vacunación basada en la expresión de proteínas virales inmunogénicas en estos vectores recombinantes ha mostrado resultados prometedores en medicina veterinaria, induciendo, por ejemplo, la protección contra los rumiantes del peste des Petits o la fiebre aftosa en los huéspedes naturales (32, 33). El uso de un vector de adenovirus humano también puede ser ventajoso en medicina veterinaria, ya que no debe haber inmunidad previa que pueda mitigar la administración de antígenos en el huésped del animal (31). Anteriormente hemos informado de la protección homóloga en el huésped natural con serotipo 5 (Ad5) de adenovirus humano recombinante defectuoso por replicación que expresó VP2 y VP7 de BTV-8 [Ad5VP2-8 y Ad5VP7-8, respectivamente; (25)]. La protección parcial se logró en ausencia de anticuerpos neutralizantes, pero se detectó una fuerte respuesta de células T CD8+ anti-BTV al vacunarse con Ad5VP7-8. Basándonos en esta observación, evaluamos en este estudio si la vacunación con Ad5VP7-8 podría combinarse con la inmunización con otros vectores de Ad5 que expresan VP2 de diferentes serotipos para proporcionar protección multiserotipos. Nos centramos nuestro enfoque en los serotipos de BTV que circulan actualmente en España y los países vecinos (BTV-1, BTV-4 y BTV-8).
En el presente trabajo, mostramos que la vacunación de ratones knockout para el receptor de interferón (IFN)-I [receptor de interferón-α/β (IFNAR-/-)] con vectores Ad5 que expresan VP2 del serotipo 1 y VP7 del serotipo 8 no solo puede proteger contra el desafío de BTV homólogo (es decir, BTV-1 y BTV-8) pero también proporciona protección parcial contra el desafío de BTV-4 heterólogo.
Materiales y métodos
Declaración ética
Todos los experimentos con animales se llevaron a cabo en una instalación de aislamiento segura de enfermedades (BSL3) en el Centro de Investigación en Sanidad Animal (CISA), en estricta conformidad con las recomendaciones de las directrices del Código de Métodos y Consideraciones de Bienestar en la Investigación del Comportamiento con Animales (Directiva 86/609EC; RD1201/2005), y se hicieron todos los esfuerzos para minimizar el Los experimentos fueron aprobados por el Comité de Ética de los Experimentos con Animales del SpanishInstituto Nacional de Investigación y Tecnología Agraría y Alimentaria (INIA) y el Comité Nacional de Bienestar Animal (PROEX 032/19).
Líneas celulares y virus
Todas las líneas celulares se cultivaron en condiciones estándar de cultivo de tejidos (37 °C, 5 % CO2). Las células del riñón de hámster bebé (BHK-21; ATCC CCL-10, ATCC, Manassas, VA, EE. UU.) y Vero (ATCC CCL-81) se cultivaron en el medio Eagle modificado de Dulbecco (DMEM), suplementado con suero bovino fetal (FBS) al 5 %. Las células del riñón embrionario humano (HEK)293 (ATCC CRL-1573) se cultivaron en DMEM, complementadas con un 10% de FBS. Células mutagénicas RBL-5 (linfoma T) anti-H-2 de la variante seleccionada (RMA/S) (a propósito proporcionadas por el Dr. McArdle; Universidad de Nottingham Trent, Nottingham, Reino Unido) se cultivaron en Roswell Park Memorial Institute Medium (RPMI), complementado con un 10 % de FBS. Las reservas de BTV se obtuvieron mediante la infección de las células BHK en la multiplicidad de infección (MOI) 0,1 y se titerizaron en el medio de agar semisólido utilizando células Vero como se describió anteriormente (22, 34,35). En el presente trabajo se utilizaron los siguientes aislados de BTV: BTV-1 (RSArrrr/01); BTV-4 (España/2004/02); y BTV-8 (NET2006/04). La inactivación de BTV se realizó con etilenoimina binaria (BEI) recién preparada, como se describió anteriormente (22).
Replicación – Producción defectuosa de adenovirus
La producción de Ad5DsRed y Ad5VP7-8 se ha descrito en otra parte (25). Para generar los adenovirus defectuosos de replicación Ad5LacZ y Ad5VP2-1, se utilizó el Adeno-XSystem 3 de Clontech (Mountain View, CA, EE. UU.). En pocas palabras, el marco de lectura abierto para el gen LacZ y el gen VP2 de BTV-1 se amplificaron mediante PCR y rescripción inversa (RT)-PCR, respectivamente, y se clonaron con el sistema de clonación HD en fusión en el vector de aceptación p-AdenoX-ZsGreen1 (Clontech). Con los clones recombinantes correctos generados y linealizados con PacI, las células HEK293 (que proporcionan la función de replicación intrans E1) se transfectaron para generar los adenovirus defectuosos de replicación Ad5LacZ y Ad5VP2-1. Tanto Ad5LacZ como Ad5VP2-1 contenían un casete de expresión para la proteína fluorescente ZsGreen1 insertada en la región E3 de la columna vertebral adenoviral. Los virus recombinantes se amplificaron, purificaron y titulaban utilizando los protocolos estándar y los kits comerciales (Clontech) como se describe en Martin et al. (25). Las existencias adenovirales empleadas en el presente trabajo tenían los siguientes títulos: Ad5DsRed: 6 × 109 UI/ml; Ad5LacZ: 6 × 1010 UI/ml; Ad5VP7-8: 6 × 109 UI/ml; y Ad5VP2-1: 1 × 1011 UI/ml. Las diluciones para las inoculaciones se realizaron en solución salina tamponada con fosfato (PBS).
Producción de sueros policlonales anti-VP2-1
El suero de conejo hiperinmune anti-VP2-1 se obtuvo mediante dos o tres inmunizaciones con Ad5VP2-1 en un intervalo de 3 semanas. La presencia de inmunoglobulina G (IgG) anti-VP2-1 se evaluó mediante ELISA utilizando BTV-1 como antígeno. El suero de dos conejos inmunizados se agló, se inactivó por calor (56 °C, 30 min) y se adsorberó contra los lisatos de células Vero transferidos a las membranas de fluoruro de polivinilideno (PVDF). La especificidad policlonal del conejo anti-VP2-1 se confirmó en estudios de inmunofluorescencia y se comparó con los sueros tratados de manera similar (inactivación y adsorción del calor) de los mismos conejos antes de la inmunización (sés previos a la inmunización).
Inmunofluorescencia y microscopía confocal
Las células Vero se cultivaron en cubreobjetos e infectadas en MOI 1 con Ad5DsRed o Ad5VP2-1 durante 48 h. Luego, las células se fijaron en un 4% de paraformaldehído (PFA) durante 20 minutos a temperatura ambiente, se lavaron en PBS, se permeabilizaron durante 10 minutos en PBS + 0,05% de tritón X-100, y se bloqueó la unión inespecífica con el Diluyente de anticuerpos Dako (Dako/Agil Los cubreobjetos se incubaron durante la noche a 4 °C con sueros anti-VP2-1 (o sueros preinmunes como control) diluidos en el Diluyente de anticuerpos Dako. El anticuerpo secundario anti-Rabbit IgG conjugado con Alexa Fluor 647 (Thermo Fisher Scientific, Waltham, MA, EE. UU.) diluido en el Diluyente de anticuerpos Dako se utilizó para evaluar la unión de anticuerpos anti-VP2-1 (45 minutos a temperatura ambiente). Los ácidos nucleicos se contraintieron con 4′,6-diamidino-2-fenilindol (DAPI; Sigma-Aldrich, St. Louis, MO, EE. UU.) en PBS, y cubreobjetos montados en el soporte de montaje prolongado (Thermo Fisher Scientific, Waltham, MA, EE. UU.). Los cubreobjetos se mancharon con DAPI antes de montarlos con Prolong Mounting Medium. Se utilizaron las siguientes líneas láser para la adquisición de imágenes de los fluoroforos utilizados en estos experimentos: DAPI 405 nm; GFP 488 nm; DsRed 561 nm; y Alexa Fluor 647 (es decir, VP2-1) 633 nm. La adquisición se realizó secuencialmente a partir del fluoróforo de baja energía (Alexa Fluor 647) y terminando con el de alta energía (DAPI). Las imágenes se capturaron con un objetivo ×63 utilizando un microscopio confocal LSM 880 (Zeiss, Jena, Alemania). El software ImageJ (Institutos Nacionales de Salud de EE. UU., Bethesda, MD, EE. UU.) se utilizó para el análisis de imágenes.
Western Blot
El análisis de Western blot se realizó como se describe en Mulens-Arias et al. (36) y Avia et al. (37). En pocas palabras, las células Vero se infectaron o infectaron con Ad5DsRed, Ad5LacZ, Ad5VP7-8 o Ad5VP2-1 en MOI 1 durante 48 horas. Se obtuvieron lisados celulares, se resolvieron en electroforesis en gel de poliacrilamida de dodecil sulfato de sodio (SDS-PAGE) y se transfirieron a membranas PVDF. Las membranas fueron sondeadas con sueros policlonales anti-VP2-1 o anticuerpo anti-Gceraldehído 3-fosfato deshidrogenasa (GAPDH) (#G8795; Sigma-Aldrich, St. Louis, MO, EE. UU.), la unión de anticuerpos reveló con anticuerpos secundarios anti-raí o anti-conejo IgG conjugados con peroxidasa de rábano picante (HRP) (ambos de GE Healthcare, Chicago, IL, EE. UU.), y banda de proteínas visualizada por quimioluminiscencia (ECL Plus, Thermo Fisher Scientific,
Experimentos in vivo con el modelo murino de infección por BTV
Las hembras (7-8 semanas de edad) con el receptor IFN-α/β [IFNAR(−/−)] (38) con un fondo genético C57BL/6 se alojaron en grupos de cuatro a seis ratones por jaula (834 cm2 de superficie y 19 cm de altura) en las instalaciones para animales de CISA-INIA. La ropa de cama estaba provista de un mínimo de 2 cm de profundidad. Los ratones fueron inmunizados por vía intramuscular (im) dos veces (en un intervalo de 2 semanas) con 50 μl de 108 unidades infecciosas (UI) de Ad5VP2-1; Ad5VP7-8; Ad5VP2-1 + Ad5VP7-8 (108 UI para cada constructo); o Ad5DsRed + Ad5LacZ (108 Para evaluar la eficacia de la vacunación, los ratones fueron desafiados por vía subcutánea con 103 PFU de BTV-1, BTV-4 o BTV-8 dos semanas después de la última inmunización. El cálculo de potencia se utilizó para determinar el tamaño del grupo para estos experimentos (39). Todos los grupos analizados para determinar la eficacia de la vacuna contenían de 6 a 12 ratones. Para confirmar la potencia de vacunación homóloga Ad5VP2-1, los ratones inmunizados con los cuatro regímenes descritos anteriormente (cuatro ratones por grupo) fueron desafiados con una dosis más baja de BTV-1 infecciosa (102 PFU). Los ratones desafiados fueron monitoreados diariamente para detectar signos de enfermedad y pérdida de peso a partir de las 24 horas después de la infección y hasta el día 11. Los ratones fueron sacrificados para detener el dolor o la angustia de acuerdo con los criterios de valoración humanos de nuestros protocolos animales. El método de eutanasia utilizado fue una sobredosis de anestesia inhalante (isofluorano) y dislocación cervical.
Preparación de espalcitos y ensayos de punto absorbente inmunológico vinculado a la enzima IFN-γ (ELISPOT)
Para evaluar las respuestas de las células T, los ratones vacunados de cada grupo [Ad5DsRed + Ad5LacZ (n = 4); Ad5VP2-1 (n = 5); Ad5VP7-8 (n = 6); y Ad5VP2-1 + Ad5VP7-8 (n = 7)] fueron sacrificados 7 días después de la inmunización del refuerzo, y los (21, 22). Los esplenocitos se cultivaron en RMPI suplementado con un 10% de FBS (Sigma-Aldrich, St. Louis, MO, EE. UU.) + 4 mM L-glutamina + 10 mM de ácido 4-(2-hidroxietil)-1-piperazineetanosulfónico (HEPES) + 1% × 100 aminoácidos no esenciales + 1 mM de piruvato de sodio + 100 U/ml de penicilina/100 μg/ml de estreptomicina Los ensayos de Murine ELISPOT se realizaron utilizando la placa MSIPS4510 (Millipore Corp., Billerica, MA, EE. UU.) y como se describe en Rojas et al.(22). El anticuerpo de captura IFN-γ anti-ratón (clona XMG1.2, utilizado a 10 μg/ml) y anticuerpo anti-ratón de detección IFN-γ de biotina (clone R46A2, utilizado a 5 μg/ml) (ambos de BioLegend, San Diego, CA, EE. UU Los esplenocitos (2 × 105 por pozo) se estimularon con BTV-1, BTV-4 o BTV-8 inactivados por el BEI (equivalente a 104 PFU antes de la inactivación/bien); o simulacro de lysate BHK como control. Después de 24 horas de incubación con los estímulos, se revelaron manchas IFN-γ. Concanavalin-A (1,25 μg/ml) se utilizó como control positivo. Todos los cultivos se realizaron en triplicados o cuadruplicados, y los ensayos de ELISPOT se consideraron válidos solo cuando los recuentos de puntos IFN-γ en los pozos de control eran <20. Se utilizó un lector de placas ELISPOT (AID GmbH, Strassberg, Alemania) para cuantificar los puntos IFN-γ.
Ensayos de citotoxicidad basados en la citometría de flujo y estimulación de esplendorocitos in vitro
Los esplenocitos (3-5 × 106/bien en placas de 24 pocillos) de animales inmunizados fueron estimulados in vitro con el péptido VP7(283) [VP7(283-291) TAILNRTTL; 10 μg/ml] durante 6 días y se utilizaron como células efectoras en ensayos de citotoxicidad basados en Las células RMA/S singénicas pulsadas como se describió anteriormente (40) con 10 μg/ml de péptido relevante VP7(283) o péptido irrelevante NS1(152) [NS1(152–160) GQIVNPTFI] de BTV [conocido que provoca respuestas de las células T en ratones IFNAR(−/� Las células diana se etiquetaron con el tinte PKH67 como se describe en Rojas et al. (41), y la citotoxicidad se realizó como se describió anteriormente en Rojas et al. (42). La estrategia de ata y salida se ha descrito en Rojas et al. (42, 43). La muerte de las células diana se evaluó con tinción de yoduro de propidio (PI). Se incluyó la muerte espontánea y máxima celular (medida por la adición de 0,2 % de saponina) para todas las células diana. La lisis celular específica se midió utilizando la siguiente fórmula: % de lisis específica = (% células diana PI+ – % de muerte espontánea de las células diana)/(% de muerte máxima de las células diana – % de muerte espontánea de las células diana) ×100. Las muestras se adquirieron en un citómetro de flujo FACScalibur (BDbiosciences, San José, CA, EE. UU.), y el análisis se realizó utilizando el software FlowJo (BDbiosciences, San José, CA, EE. UU.).
Preparación sérica y detección de IgG anti-BTV en ratones inmunizados mediante ELISA
Los sueros de ratones inmunizados se obtuvieron antes de la inmunización (día 0) y 10 días después de la inmunización de refuerzo. Los sueros de ratones que sobrevivieron al desafío infeccioso de la TVB se obtuvieron el día 15 después del desafío. Todos los sueros se inactivaron por calor (56 °C, 30 minutos) antes de su uso en ensayos de ELISA o seroneutralización. El ELISA para la IgG anti-BTV se basó en informes anteriores (33). Brevemente, las placas ELISA (Nunc MaxiSorp, Thermo Fisher Scientific, Waltham, MA, EE. UU.) se cubrieron con el equivalente a 104 PFU/pozo de BTV-1, BTV-4 o BTV-8 en PBS durante la noche a 4 °C. Las placas se lavaron con PBS-T (PBS + 0,1 % Tween), se bloquearon con PBS-T + 5% de leche desnatada durante 1 hora a temperatura ambiente, y las diluciones séricas en serie (en PBS-T + 2 % de leche desnatada) se incubaron durante 2 horas a temperatura ambiente. Luego se lavó en placas en PBS-T, y se detectó la unión a IgG con un anticuerpo secundario IgG anti-ratón conjugado con HRP (Bethyl Laboratories, Inc., Montgomery, TX, EE. UU.) diluido en PBS-T + 2% de leche desnatada y revelado con sustrato de 3,3′, La densidad óptica se leyó a 450 nm (OD450 nm) en un lector de placas FluoSTAR Omega ELISA (BMG Labtech, Ortenberg, Alemania) después de detener la reacción colorimétrica con ácido sulfúrico 3N. El título IgG se expresa como el valor recíproco utilizando una regresión lineal de las diluciones de suero para las que la lectura de OD450 nm en la dilución del suero inmunitario alcanza el doble de la lectura de OD450 nm en el suero preinmune del mismo animal como se describió anteriormente (33). Los valores de dilución negativos recibieron un valor de 1 para la representación gráfica.
Ensayos de seroneutralización del virus de la lengua azul
Los ensayos de seroneutralización de BTV se realizaron como se describió anteriormente (25, 44). En pocas palabras, los serotipos de BTV 1, 4 u 8 (de 100 PFU) se incubaron con diluciones séricas en serie (a partir de 1:50 y hasta 1:800) durante 1 h a 37 °C en placas de 96 pocillos.Luego se añadieron células Vero (2 × 104/bien) y se cultivaron durante 4-5 días hasta que se detectó un efecto citopático completo (ECP) en los pozos de control negativos. Luego, las células se fijaron con un 2 % de paraformaldehído y se visualizaron mediante tinción de violeta cristalina. Los títulos de seroneutralización se calcularon como la dilución sérica recíproca en la que se observó <50 % de CPE en las células Vero.
Análisis estadístico
Se realizó un análisis estadístico utilizando el software Graphpad Prism (San Diego, CA, EE. UU.). Las pruebas estadísticas utilizadas para evaluar la significación en los experimentos se mencionan en las leyendas de las figuras. Los niveles de significación se definieron como *p < 0,05,**p < 0,01 y ***p < 0,001.
Resultados
Construcción de un adenovirus recombinante que expresa la subunidad VP2 del serotipo 1 de BTV (Ad5VP2-1)
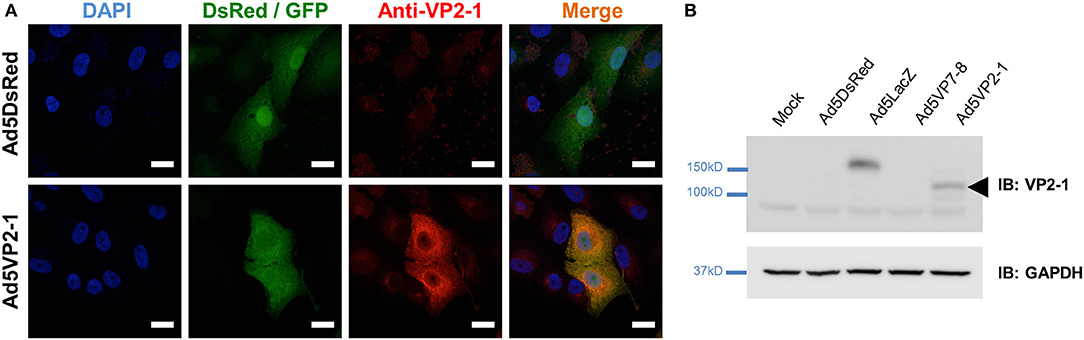
Se produjo un Ad5 que expresa la subunidad VP2 de la cápside viral externa de BTV-1 (Ad5VP2-1) para evaluar su potencia como vacuna BTV. El VP2 ORF de BTV-1 fue amplificado por RT-PCR del extracto de ARN viral y clonado en p-AdenoX-ZsGreen1 por el Sistema Clontech InFusion (ver sección Materiales y métodos). La presencia de inserción se confirmó mediante la digestión de la enzima de restricción, la secuenciación y la RT-PCR. Para detectar la expresión de proteínas VP2-1 en las células, producimos un suero policlonal de conejo utilizando los sueros hiperinmunes agrupados de dos conejos inmunizados con Ad5VP2-1. El suero inmunológico anti-VP2-1 podía reconocer las células infectadas por Ad5VP2-1, mientras que el suero preinmune no se unía a estas células (Figura Suplementaria 1), lo que demuestra la especificidad del suero inmunitario. Los estudios de inmunofluorescencia confirmaron la expresión de VP2-1 en células infectadas por Ad5VP2-1 (Figura 1A). La expresión de VP2-1 se detectó en células Vero infectadas por Ad5VP2-1, pero no en las células infectadas por Ad5LacZ/Ad5DsRed. El análisis de Western blot confirmó la expresión de VP2-1 en lisados de células Vero de células infectadas por Ad5VP2-1 (Figura 1B). Se detectó una banda de proteínas con el peso molecular predicho para VP2 en células infectadas por Ad5VP2-1, pero no en células infectadas con simulacro o células infectadas con Ad5DsRed, Ad5LacZ- o Ad5VP7-8. Estos datos demuestran que la proteína VP2-1 se expresa en células infectadas por Ad5VP2-1, lo que indica que Ad5VP2-1 podría usarse para estudios de vacunación. La generación de los otros adenovirus recombinantes utilizados en el presente trabajo se ha informado en otros lugares (25, 45).
FIGURA 1. La proteína VP2-1 se expresa en células Vero infectadas con Ad5VP2-1.( A) Imágenes confocales de inmunofluorescencia representativas de células Vero infectadas con Ad5DsRed o Ad5VP2-1 (MOI 1) y teñidas con suero de conejo policlonal anti-VP2-1 (mostrado en rojo). Las proteínas fluorescentes Reporter expresadas por las construcciones Ad5DsRed (DsRed) o Ad5VP2-1 (GFP) se muestran en verde. 4′,6-Diamidino-2-fenilindol (DAPI) se utilizó para contrarrestar los ácidos nucleicos (azul). Barra de escala = 20 μm.( B) Western blot de células Vero simuladas infectadas o infectadas con Ad5DsRed, Ad5LacZ, Ad5VP7-8 o Ad5VP2-1. Las membranas PVDF fueron inmunoprobadas (IB) con sueros de conejo policlonales anti-VP2-1 o anticuerpo anti-GAPDH (como control de carga de muestras). La punta de flecha indica la presencia de VP2-1 en las células infectadas por Ad5VP2-1 al peso molecular predicho de la proteína.
La vacunación con Ad5VP2-1 y Ad5VP7-8 proporciona protección contra los desafíos de BTV-1, BTV-4 y BTV-8
El trabajo anterior de nuestro grupo ha indicado que la vacunación con una combinación de adenovirus recombinantes defectuosos de replicación que expresan la proteína de la cápside externa altamente variable VP2 y la proteína de la cápside interna más conservada VP7 de BTV-8 protegida contra el desafío del virus homólogo en ratones y ovejas (25). Queríamos evaluar en un modelo murino de infección por BTV si la combinación de la inmunización contra VP2 de un serotipo (en el presente trabajo serotipo 1) con la inmunización contra VP7 de un serotipo diferente (en el presente trabajo serotipo 8) podría proteger contra los desafíos homólogos (es decir, BTV-1 y BTV-8) y heterológicos Por lo tanto, vacunamos a los ratones IFNAR(-/−) con Ad5VP2-1 solo, Ad5VP7-8 solo; una combinación de Ad5VP2-1 y Ad5VP7-8; o, como control, una combinación de Ad5DsRed y Ad5LacZ y desafiamos a cada grupo de vacunación con BTV-1, BTV-4 o La combinación de la vacunación Ad5VP2-1 y Ad5VP7-8 confirió protección contra el desafío BTV-1 (Figura 2A) con tasas de supervivencia del 90 %. La vacunación con Ad5VP2-1 solo produjo un retraso en el inicio de la enfermedad contra la BTV-1. La vacunación con Ad5VP7-8 retrasó el inicio de la enfermedad (una mediana de supervivencia de 8 días para el grupo de la vacuna Ad5VP7-8 frente a una mediana de supervivencia de 6 días para el grupo Ad5DsRed + Ad5LacZ) y proporcionó una protección muy limitada (sobrevivencia del ≈17 %) contra BTV-1. Dado que la infección por BTV en ratones IFNAR(-/−) conduce a la pérdida de apetito, pesamos los ratones diariamente como sustitutos de la progresión de la enfermedad (Figura 2B). Los datos de pérdida de peso confirmaron que la vacunación con Ad5VP2-1 y Ad5VP7-8 retrasó el inicio de la enfermedad BTV-1. La combinación de ambas vacunas contra el adenovirus redujo aún más la pérdida de peso, pero no la abolió por completo, lo que indica que los ratones IFNAR(−/−) todavía desarrollaron la enfermedad. Para evaluar si la vacunación con Ad5VP2-1 solo podría proteger contra la infección por BTV-1, desafiamos a los ratones con 102 PFU BTV-1 en lugar de 103 PFU utilizados en los experimentos anteriores (Figura complementaria 2). La vacunación con Ad5VP2-1 podría proteger al 50 % de los ratones con esta dosis más baja de desafío BTV-1 que muestra que Ad5VP2-1 puede provocar inmunidad protectora. La inmunización con Ad5VP7-8 podría proteger al 100 % de los ratones contra esta dosis de desafío BTV-1.
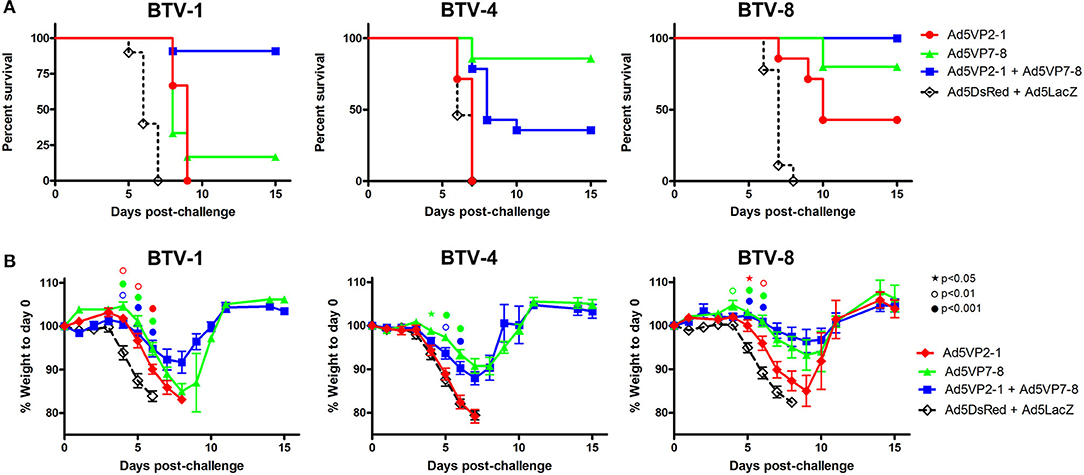 FIGURA 2. La inmunización Ad5VP2-1 y Ad5VP7-8 confiere protección contra los desafíos autólogos y heterólogos de la BTV. Los ratones IFNAR(−/−) fueron inmunizados con Ad5VP2-1, Ad5VP7-8, Ad5VP2-1 + AdV5P7-8, o con Ad5DsRed + Ad5LacZ como control y desafiados con 1.000 PFU de BTV-1, BTV-4 o BTV-8. (A) Gráficos de supervivencia para cada grupo de inmunización después del desafío de BTV (serotipo indicado arriba en los gráficos de supervivencia). (B) El peso del ratón después del desafío ( % medio del peso previo al desafío ± SEM) se traza para cada grupo inmunizado después del desafío del serotipo BTV (indicado en los gráficos anteriores). La comparación estadística se realizó hasta el día 6 con un grupo intacto de animales. ⋆p < 0,05; °p < 0,01; •p < 0,001; el color del símbolo se refiere al grupo de inmunización (rojo, Ad5VP2-1; verde, Ad5VP7-8; y azul, Ad5VP2-1 + Ad5VP7-8); ANOVA unidireccional con Ad5DsRed + Ad5LacZ).
FIGURA 2. La inmunización Ad5VP2-1 y Ad5VP7-8 confiere protección contra los desafíos autólogos y heterólogos de la BTV. Los ratones IFNAR(−/−) fueron inmunizados con Ad5VP2-1, Ad5VP7-8, Ad5VP2-1 + AdV5P7-8, o con Ad5DsRed + Ad5LacZ como control y desafiados con 1.000 PFU de BTV-1, BTV-4 o BTV-8. (A) Gráficos de supervivencia para cada grupo de inmunización después del desafío de BTV (serotipo indicado arriba en los gráficos de supervivencia). (B) El peso del ratón después del desafío ( % medio del peso previo al desafío ± SEM) se traza para cada grupo inmunizado después del desafío del serotipo BTV (indicado en los gráficos anteriores). La comparación estadística se realizó hasta el día 6 con un grupo intacto de animales. ⋆p < 0,05; °p < 0,01; •p < 0,001; el color del símbolo se refiere al grupo de inmunización (rojo, Ad5VP2-1; verde, Ad5VP7-8; y azul, Ad5VP2-1 + Ad5VP7-8); ANOVA unidireccional con Ad5DsRed + Ad5LacZ).
El objetivo del trabajo presentado aquí también fue evaluar la potencia protectora a través de varios serotipos de BTV para combinar la vacunación de vectores de Ad5 que expresan la variable de serotipo VP2 con un vector de Ad5 que expresa el VP7 más conservado, que es una fuente de epítopos de células T compartida por múltiples serotipos de BTV Por lo tanto, evaluamos la protección en ratones vacunados contra BTV-8, que expresa un VP2 heterólogo pero un VP7 homólogo (Figura 2). Como se informó anteriormente (25), la vacunación con Ad5VP7-8 se protegió contra el desafío de BTV-8. La adición de Ad5VP2-1 también parece mejorar ligeramente la protección contra BTV-8. La vacunación con Ad5VP2-1 solo también proporcionó protección parcial contra BTV-8, lo que indica que la protección parcial del serotipo cruzado podría lograrse con este constructo adenoviral (Figura 2A). Los datos de pérdida de peso confirmaron los datos de supervivencia de BTV-8 (Figura 2B). Por lo tanto, la vacunación Ad5VP2-1 parece ofrecer cierta protección contra el desafío BTV-8 y, combinada con Ad5VP7-8, confirieron tasas de supervivencia del 100 %.
También evaluamos la protección contra el desafío con el serotipo heterólogo BTV-4. Como se predijo, la vacunación Ad5VP2-1 no protegía contra el desafío BTV-4. Aproximadamente el 40 % de los ratones vacunados con una combinación de Ad5VP2-1 y Ad5VP7-8 sobrevivieron al desafío BTV-4, mientras que la vacunación con Ad5VP7-8 solo dio lugar a una tasa de supervivencia del ≈85% (Figura 2A). Los datos de pérdida de peso confirmaron datos de supervivencia de BTV-4 (Figura 2B). Por lo tanto, parece que la vacunación con Ad5VP7-8 proporciona una protección parcial sustancial contra el desafío con BTV-4 heterólogo.
La inmunización Ad5VP2-1 y Ad5VP7-8 produce IgG anti-BTV reactiva cruzada, pero no provoca anticuerpos seroneutralizantes
A continuación, queríamos identificar algunos de los factores inmunitarios inducidos por la vacunación que se correlacionaban con la protección BTV en este modelo murino. La presencia de IgG específica para los diferentes serotipos de BTV utilizados para el desafío in vivo se evaluó utilizando los sueros de animales inmunizados (Figura 3). La inmunización con Ad5VP2-1 y AdVP7-8 provocó la producción de IgG que podía reconocer los tres serotipos de BTV. La combinación de Ad5VP2-1 y Ad5VP7-8 parece mejorar la cantidad de IgG anti-BTV presente en los sueros de ratones inmunizados. La cantidad de IgG anti-BTV reactiva cruzada detectada en los sueros de ratones supervivientes aumentó después del desafío BTV. Por lo tanto, la presencia de IgG anti-BTV capaz de reconocer los tres serotipos de BTV después de la vacunación podría representar una de las bases inmunológicas a través de las cuales se está produciendo in vivo la protección contra los serotipos.
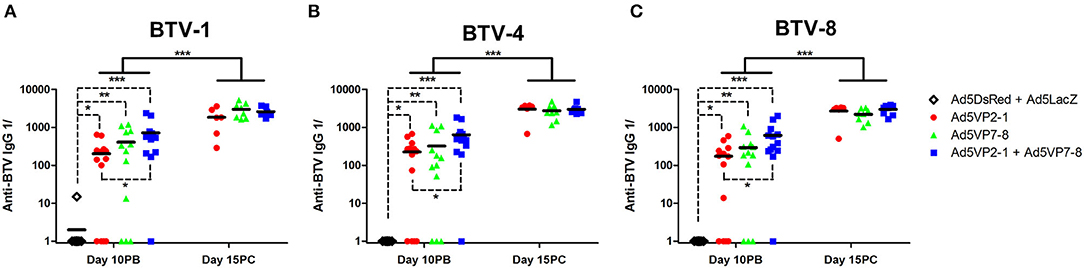 FIGURA 3. La inmunización con Ad5VP2-1 y Ad5VP7-8 produce IgG anti-BTV que reconoce los serotipos heterogéneos de BTV. La presencia de IgG anti-BTV específica para (A) BTV-1, (B) BTV-4 y (C) BTV-8 en los sueros de ratones inmunizados se evaluó mediante ELISA el día 10 después del refuerzo (día 10PB; n = 12–14/grupo) y el día 15 después del desafío en ratones sobrevivientes (día 15PC; Los datos se presentan como la dilución recíproca (anti-BTV IgG 1/) necesaria para lograr una absorbancia 2 veces doble para el suero ingenuo. *p < 0,05; **p < 0,01; ***p < 0,001 [ANOVA unidireccional con la prueba posterior de Dunn (Ad5DsRed + Ad5LacZ vs. Ad5VP2-1; Ad5VP7-8; o Ad5VP2-1 + Ad5VP7-8); pruebas t no emparejadas (día 10PB frente al día 15PC en los grupos Ad5VP2-1; Ad5VP7-8; y Ad5VP2-1 + Ad5VP7-8)].
FIGURA 3. La inmunización con Ad5VP2-1 y Ad5VP7-8 produce IgG anti-BTV que reconoce los serotipos heterogéneos de BTV. La presencia de IgG anti-BTV específica para (A) BTV-1, (B) BTV-4 y (C) BTV-8 en los sueros de ratones inmunizados se evaluó mediante ELISA el día 10 después del refuerzo (día 10PB; n = 12–14/grupo) y el día 15 después del desafío en ratones sobrevivientes (día 15PC; Los datos se presentan como la dilución recíproca (anti-BTV IgG 1/) necesaria para lograr una absorbancia 2 veces doble para el suero ingenuo. *p < 0,05; **p < 0,01; ***p < 0,001 [ANOVA unidireccional con la prueba posterior de Dunn (Ad5DsRed + Ad5LacZ vs. Ad5VP2-1; Ad5VP7-8; o Ad5VP2-1 + Ad5VP7-8); pruebas t no emparejadas (día 10PB frente al día 15PC en los grupos Ad5VP2-1; Ad5VP7-8; y Ad5VP2-1 + Ad5VP7-8)].
Sin embargo, la presencia de anticuerpos neutralizantes se acepta generalmente como una mejor correlación con la protección en BTV que la presencia de IgG anti-BTV. Por lo tanto, evaluamos la presencia de anticuerpos neutralizantes en los sueros de ratones inmunizados (Figura 4A). Ninguno de los regímenes de vacunación indujo niveles significativos de anticuerpos neutralizantes en el día 10 de inmunización posterior al refuerzo. De hecho, solo se detectaron anticuerpos neutralizantes en los ratones que sobrevivieron al desafío. Sorprendentemente, estos anticuerpos neutralizantes provocados durante el desafío de BTV solo inhibieron la infección de BTV en el serotipo que se utilizó para el desafío in vivo (Figura 4B) y, por lo tanto, mostraron poca o ninguna reacción cruzada entre los serotipos. Esto indica que las respuestas de anticuerpos neutralizantes se activan principalmente después del desafío y, por lo tanto, es poco probable que expliquen la protección cruzada observada en el experimento in vivo.
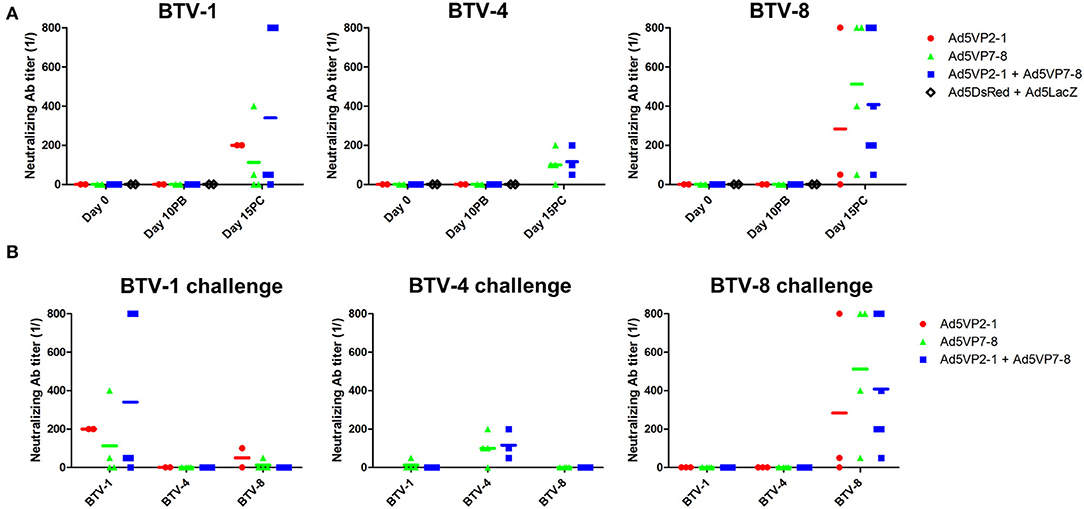 FIGURA 4. La inmunización con Ad5VP2-1 y Ad5VP7-8 no produce niveles significativos de anticuerpos neutralizantes de BTV. (A) Se utilizó BTV-1,−4 o 8-8 (100 PFU) preincubado con sueros diluidos para infectar las células Vero y evaluar la presencia de anticuerpos neutralizantes de BTV. En estos experimentos se utilizaron sueros obtenidos antes de la inmunización (día 0) a los 10 días después de la vacunación de refuerzo (día 10PB) y a los 15 días después del desafío de la BTV (día 15PC) en ratones sobrevivientes (n = 2-6/grupo). Los datos se presentan como la dilución recíproca en la que se observó <50 % de efecto citopático completo (ECP). (B) La presencia de anticuerpos neutralizantes que son reactivas cruzadas a otros serotipos de BTV en los sueros de ratones que sobrevivieron al desafío se evaluó utilizando los sueros del día 15 después del desafío. El serotipo especificado por encima de la trama indica el desafío recibido por los ratones, mientras que el eje x muestra el serotipo BTV utilizado para la seroneutralización.
FIGURA 4. La inmunización con Ad5VP2-1 y Ad5VP7-8 no produce niveles significativos de anticuerpos neutralizantes de BTV. (A) Se utilizó BTV-1,−4 o 8-8 (100 PFU) preincubado con sueros diluidos para infectar las células Vero y evaluar la presencia de anticuerpos neutralizantes de BTV. En estos experimentos se utilizaron sueros obtenidos antes de la inmunización (día 0) a los 10 días después de la vacunación de refuerzo (día 10PB) y a los 15 días después del desafío de la BTV (día 15PC) en ratones sobrevivientes (n = 2-6/grupo). Los datos se presentan como la dilución recíproca en la que se observó <50 % de efecto citopático completo (ECP). (B) La presencia de anticuerpos neutralizantes que son reactivas cruzadas a otros serotipos de BTV en los sueros de ratones que sobrevivieron al desafío se evaluó utilizando los sueros del día 15 después del desafío. El serotipo especificado por encima de la trama indica el desafío recibido por los ratones, mientras que el eje x muestra el serotipo BTV utilizado para la seroneutralización.
La inmunización con Ad5VP2-1 y Ad5VP7-8 induce respuestas de células T contra BTV-1, BTV-4 y BTV-8 y activa los linfocitos T citotóxicos anti-VP7
Basándonos en la observación de que las respuestas de las células T podrían proporcionar al menos una protección parcial contra el desafío heterogéneo de la TVB (28), y que los vectores adenovirales son excelentes para preparar las respuestas de las células T contra su transgen (31), nuestro objetivo era evaluar la respuesta celular inducida por nuestro régimen de vacunación. Primero evaluamos la producción de IFN-γ contra BTV-1, BTV-4 y BTV-8 inactivados por el BEI en esplenocitos obtenidos de ratones inmunizados después de la vacunación de refuerzo (Figura 5). No se detectó ninguna producción específica de IFN-γ en BTV-1, BTV-4 o BTV-8 en el grupo de control (Ad5DsRed + Ad5LacZ). La inmunización con Ad5VP2-1 indujo la activación de los esplenocitos productores de IFN-γ contra BTV-1, pero no contra BTV-4 o BTV-8. Por lo tanto, la inmunización con Ad5VP2-1 parece provocar respuestas de las células T principalmente contra la BTV-1. También se detectó una respuesta específica de IFN-γ a BTV-1 en esplenocitos obtenidos de ratones inmunizados con Ad5VP7-8. Finalmente, la combinación de respuestas IFN-γ inducidas por la vacunación Ad5VP2-1 y Ad5VP7-8 contra BTV-1, BTV-4 y BTV-8. Por lo tanto, parece que la vacunación con Ad5VP2-1 y particularmente con Ad5VP7-8 puede provocar respuestas de células T que reconozcan múltiples serotipos de BTV.
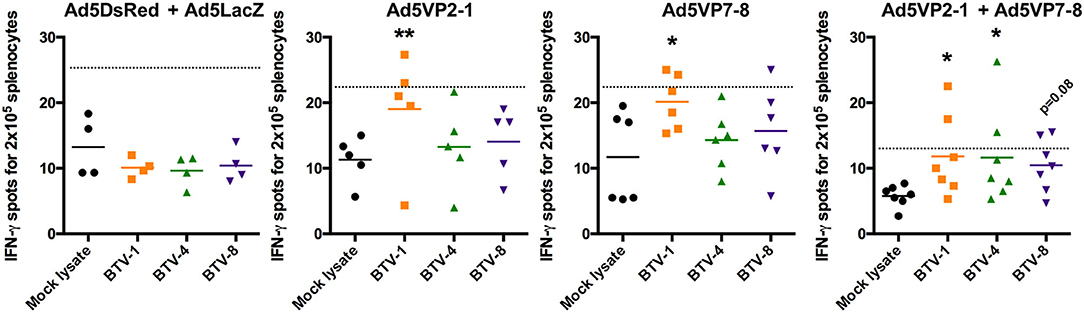 FIGURA 5. La inmunización con Ad5VP2-1 y Ad5VP7-8 induce respuestas de células T contra serotipos de BTV homólogos y heterólogos. Los ensayos IFN-γ ELISPOT de esplenocitos de Ad5VP2-1, Ad5VP7-8, Ad5VP2-1 + Ad5VP7-8, o Ad5DsRed + Ad5LacZ inmunizaron IFNAR(−/−) en cultivo con BTV-1,-4 o−8 inactivados, Se presentan manchas medias de IFN-γ para 2 × 105 esplenocitos obtenidos de ratones inmunizados. *p < 0,05; **p < 0,01; ANOVA unidireccional con la prueba posterior de Dunnett (BTV-1, BTV-4 o BTV-8 vs. lysato simulado). La línea punteada indica el doble de la media de puntos IFN-γ en los esplenocitos simulados estimulados por el lysato.
FIGURA 5. La inmunización con Ad5VP2-1 y Ad5VP7-8 induce respuestas de células T contra serotipos de BTV homólogos y heterólogos. Los ensayos IFN-γ ELISPOT de esplenocitos de Ad5VP2-1, Ad5VP7-8, Ad5VP2-1 + Ad5VP7-8, o Ad5DsRed + Ad5LacZ inmunizaron IFNAR(−/−) en cultivo con BTV-1,-4 o−8 inactivados, Se presentan manchas medias de IFN-γ para 2 × 105 esplenocitos obtenidos de ratones inmunizados. *p < 0,05; **p < 0,01; ANOVA unidireccional con la prueba posterior de Dunnett (BTV-1, BTV-4 o BTV-8 vs. lysato simulado). La línea punteada indica el doble de la media de puntos IFN-γ en los esplenocitos simulados estimulados por el lysato.
Para confirmar aún más la existencia de mecanismos efectores de células T capaces de dirigirse a múltiples serotipos de BTV, evaluamos la presencia de linfocitos T citotóxicos (CTL) anti-BTV en ratones vacunados (Figura 6). Varios epítopos de células T específicos de BTV para VP7 y NS1 se han descrito en ratones IFNAR(−/−) (21, 22, 26), ya que estas proteínas virales se encuentran entre las más conservadas en BTV. Elegimos el péptido VP7(283) para evaluar las respuestas de CTL inducidas por la vacunación Ad5VP7-8, ya que su secuencia se conserva en los tres serotipos utilizados aquí. El péptido NS1(152), conocido por provocar también respuestas de CTL (22, 26), fue elegido como un péptido irrelevante en este contexto. La vacuna Ad5VP7-8 ingió CTL capaz de lystar específicamente las células diana pulsadas con péptido VP7(283) (Figura 6). Del mismo modo, la combinación de Ad5VP2-1 y Ad5VP7-8 también preparó CTL contra VP7(283). La vacunación con Ad5VP2-1 solo o la combinación de Ad5DsRed y Ad5LacZ no fue capaz de producir respuestas CTL anti-VP7(283). En general, parece que la vacunación con Ad5VP7-8 puede provocar respuestas anti-BTV CTL contra péptidos que se conservan en los tres serotipos utilizados en el presente trabajo. Por lo tanto, estas células podrían ser uno de los mecanismos efectores que confieren protección a múltiples serotipos de BTV.
 FIGURA 6. La inmunización Ad5VP7-8 induce linfocitos T citotóxicos (CTL) contra el péptido VP7(283). Los esplenocitos de ratones inmunizados se restimularon in vitro con el péptido VP7(283) y se utilizaron como células efectoras en ensayos de citotoxicidad basados en citometría de flujo. Las células RMA/S pulsadas con péptido VP7(283) o péptido irrelevante NS1(152) se etiquetaron con tinte PKH67 y se utilizaron en las células objetivo. Se utilizó la tinción de yoduro de propidio (PI) para evaluar la muerte celular. (A) Ejemplos de trama de puntos de muerte espontánea y máxima de las células diana. (B) Ejemplos de gráficos de puntos de muerte celular objetivo RMA/S pulsada por péptido en cocultivos con esplenocitos obtenidos de ratones inmunizados Ad5DsRed + Ad5LacZ, Ad5VP2-1, Ad5VP7-8 o Ad5VP2-1 + Ad5VP7-8. (C) Porcentaje (media ± SD) de lisis específica de las células diana inducida por esplenocitos de Ad5DsRed + Ad5LacZ (n = 3), Ad5VP2-1 (n = 4), Ad5VP7-8 (n = 6), o Ad5VP2-1 + Ad5VP7-8 (n = 5) ratones inmun VP7(283)].
FIGURA 6. La inmunización Ad5VP7-8 induce linfocitos T citotóxicos (CTL) contra el péptido VP7(283). Los esplenocitos de ratones inmunizados se restimularon in vitro con el péptido VP7(283) y se utilizaron como células efectoras en ensayos de citotoxicidad basados en citometría de flujo. Las células RMA/S pulsadas con péptido VP7(283) o péptido irrelevante NS1(152) se etiquetaron con tinte PKH67 y se utilizaron en las células objetivo. Se utilizó la tinción de yoduro de propidio (PI) para evaluar la muerte celular. (A) Ejemplos de trama de puntos de muerte espontánea y máxima de las células diana. (B) Ejemplos de gráficos de puntos de muerte celular objetivo RMA/S pulsada por péptido en cocultivos con esplenocitos obtenidos de ratones inmunizados Ad5DsRed + Ad5LacZ, Ad5VP2-1, Ad5VP7-8 o Ad5VP2-1 + Ad5VP7-8. (C) Porcentaje (media ± SD) de lisis específica de las células diana inducida por esplenocitos de Ad5DsRed + Ad5LacZ (n = 3), Ad5VP2-1 (n = 4), Ad5VP7-8 (n = 6), o Ad5VP2-1 + Ad5VP7-8 (n = 5) ratones inmun VP7(283)].
Discusión
En el presente trabajo, nuestro objetivo fue evaluar el potencial de los vectores adenovirales defectuosos de replicación que expresan la proteína de la cápside externa variable BTV VP2 y la proteína de la cápside interna más conservada VP7 como vacuna contra múltiples serotipos de BTV. El trabajo anterior mostró que esta combinación de vacunas a base de adenovirus protegía contra el desafío del virus homólogo en un modelo murino y en el huésped natural (25). En este trabajo, mostramos que una formulación heteróloga (es decir, la entrega de VP2 de un serotipo con VP7 de un serotipo diferente) puede proporcionar protección contra varios serotipos. Esta combinación de vectores adenovirales protegió contra el desafío de los serotipos de BTV utilizados para producir los vectores de la vacuna adenoviral, y de manera más intrigante contra un desafío heterólogo de BTV.
El desarrollo de vacunas BTV capaces de proporcionar protección multiserotipo es uno de los principales hitos a alcanzar en el campo de la vacunación BTV. Actualmente, la mayoría de las estrategias de vacunación, y por extensión para la TVB en el campo, dependen de vacunas de virus inactivadas que solo protegen contra un serotipo específico de la TVB. Esto implica que cuando un nuevo serotipo comienza a circular en un territorio, es necesaria una nueva campaña de vacunación para proporcionar protección al ganado. Nuestros datos indican que la entrega de proteínas capsida de BTV a través de un vector adenoviral podría ayudar a obtener una inmunidad más amplia contra la BTV que las vacunas convencionales. Además, la plataforma adenoviral descrita aquí podría implementarse como una vacuna DIVA. De hecho, mostramos que la vacunación con Ad5VP7-8 provocó respuestas de CTL al péptido inmunogénico VP7(283), pero no a NS1(152), un epítopo de CTL inmunodominante de una proteína no estructural BTV (26). Esto implica que Ad5VP2-1 y Ad5VP7-8 podrían considerarse vacunas DIVA después de establecer pruebas DIVA que diferencian la inmunidad contra las proteínas estructurales de BTV, como VP2 o VP7, y de la inmunidad contra las proteínas no estructurales, como NS1, que solo se desencadenarían después de una infección viral.
A pesar de inocular a todos los ratones con las mismas cantidades de PFU (103) para cada serotipo, se observaron diferencias en la cinética de la infección. Por ejemplo, en los grupos de control Ad5DsRed + Ad5LacZ, la pérdida de peso comenzó en el día 4 después del desafío para BTV-1 y BTV-4 y en el día 5 después del desafío para BTV-8. Los ratones de control infectados por BTV-1 también mostraron una enfermedad respiratoria más grave que con BTV-4 o BTV-8, que alcanzaron los criterios de punto final antes del punto final de pérdida de peso >20%. Las diferencias en la virulencia de la cepa son frecuentes en la infección por BTV y son multifactoriales (47-49). Por ejemplo, la cepa BTV-8 responsable del brote de 2006 en el norte de Europa mostró un aumento de los signos clínicos en el ganado en comparación con otros serotipos de BTV (50). Las diferencias en la cinética de infección se deben probablemente a la diferencia en la virulencia de los tres serotipos utilizados en el presente estudio.
La combinación de Ad5VP2-1 y Ad5VP7-8 proporcionó una protección parcial contra los desafíos heterólogos. Nuestros datos indican que esto se debió principalmente a la inmunidad a VP7 inducida por la vacuna. Más específicamente, detectamos la producción específica de IFN-γ contra los antígenos BTV y la generación de CTL contra un péptido inmunogénico VP7 en los esplenocitos de los ratones vacunados con AdVP7-8. La vacunación con Ad5VP2-1 y Ad5VP7-8 también generó IgG capaz de reconocer diferentes serotipos de BTV, pero no se detectaron títulos significativos de anticuerpos neutralizantes de BTV después de la inmunización. La presencia de IgG específica para el VP7 más conservado se utiliza a menudo en el diagnóstico para identificar la seroconversión de BTV en rebaño, mientras que se emplean anticuerpos neutralizantes al VP2 altamente variable para definir los serotipos de BTV (9). La presencia de IgG reactiva cruzada no solo se observó en el régimen de vacunación que incluía Ad5VP7-8, sino también en ratones vacunados con Ad5VP2-1. Por lo tanto, la inmunización con Ad5VP2-1 parece inducir IgG reactiva cruzada que reconoce múltiples serotipos de BTV pero no pueden neutralizar la infección. Es posible que estos Igs-G se eleven contra regiones conservadas de VP2 entre los serotipos que no son determinantes neutralizantes, pero que aún podrían afectar a la replicación viral. Esto podría contribuir a los efectos protectores heterólogos contra el BTV-8 que proporcionó la inmunización con Ad5VP2-1. La relevancia inmunológica de este hallazgo aún no está clara, y se requerirá más trabajo para evaluar mejor el papel de estas IgG anti-BTV dirigidas a VP2. En general, parece que desencadenar la inmunidad celular contra VP7 sería útil para proporcionar inmunidad contra múltiples serotipos de una manera similar a como se ha descrito la inmunidad a NS1 para proporcionar protección multiserotipos en ratones IFNAR(-/−) (26). De hecho, la alineación de la secuencia de VP7 de las cepas BTV utilizadas en el presente trabajo mostró el alto grado de conservación de la proteína entre serotipos (Figura Suplementaria 3). Sin embargo, es poco probable que la administración efectiva de VP7 como vacuna sea suficiente para inducir una protección heteróloga completa, como lo ilustran Bouet-Cararo et al. (51). Descubrieron que la inmunización con VP7 utilizando un adenovirus canino replicativo y defectuoso solo proporcionaba protección homóloga parcial y no en las ovejas. La combinación de VP7 con otras proteínas BTV probablemente mejorará la eficacia de la vacuna. Por ejemplo, una estrategia de impulso principal del virus de la vacuna modificado recombinante de ADN Ankara (rMVA) utilizando la expresión de BTV-4 VP2, VP7 y NS1 condujo a una protección heteróloga contra BTV-1 y BTV-8 en ratones IFNAR(-/−) (52). Sin embargo, en este sistema, la combinación de la expresión VP2 y VP7 mostró solo alrededor del 30 % de protección contra desafíos homólogos. Sin embargo, la inclusión de NS1 en el régimen de vacunación aumentó la protección hasta un 100 %. Esta combinación de antígenos BTV también tuvo éxito en la inducción de la protección heterogénea de BTV utilizando microesferas de reovirus aviar como sistema de administración (19). Por lo tanto, comprender los requisitos mínimos de antígeno BTV para la protección de los multiserotipos sigue siendo difícil de alcanzar, pero por nuestro trabajo y otros, parece que estas formulaciones probablemente deberían incluir VP7. También detectamos inmunidad celular a la BTV en ratones inmunizados con Ad5VP2-1, lo que podría contribuir a la inmunidad contra la BTV. La combinación de la vacunación Ad5VP2-1 y Ad5VP7-8 parece mejorar la terapia en los casos de desafío BTV-1 y BTV-8 en comparación con la vacunación con cualquiera de los adenovirus solos. Sin embargo, en el caso del desafío BTV-4, parece que esta combinación tiene un impacto negativo en los efectos terapéuticos proporcionados por la vacuna Ad5VP7-8. De hecho, la vacuna Ad5VP2-1 no tuvo efectos protectores en la infección por BTV-4. La alineación de la secuencia de proteínas VP2 entre los tres serotipos mostró una mayor homología entre las proteínas VP2 de BTV-1 y BTV-8 que de BTV-4 (Figura Suplementaria 3). Podría ser que la inmunidad celular inducida por Ad5VP2-1 en el caso del desafío BTV-4 «diluye» la inmunidad celular proporcionada por Ad5VP7-8 debido a la presencia de epítopos de células T inmunodominantes en VP2. La inmunodominancia es un mecanismo inmunitario multifactorial diseñado para afinar las respuestas de las células T hacia epítopos más abundantes y/o mejor presentados (53, 54). Durante las respuestas de las células T, las células T específicas del antígeno compiten por los factores de crecimiento, un mecanismo que favorece la expansión de las células T que reciben una fuerte señalización a través de su TCR en detrimento de las células T que solo recibieron una activación moderada (55-58). En algunos casos, esto puede limitar la eficacia de la respuesta de las células T, ya que puede reducir el espectro de las células T que responden a un antígeno en particular. Es previsible que esto ocurra más si las células T específicas de dos antígenos diferentes compiten simultáneamente por los mismos factores de crecimiento. Por lo tanto, la respuesta de las células T inducida por la inmunización Ad5VP2-1 podría estar limitando las respuestas de las células T a VP7 en nuestro entorno experimental. En el caso del desafío BTV-1 y BTV-8, esto no tuvo efectos perjudiciales en la protección, ya que la vacunación con Ad5VP2-1 tuvo efectos protectores por sí sola, pero en el caso del desafío heterólogo BTV-4, la eficacia terapéutica de AdVP7-8 parece disminuir debido a las respuestas a Ad5VP2-1. Esta es una consideración importante para el régimen de vacunación que podría resolverse, por ejemplo, alternando la vacunación con antígenos para que se produzca una competencia mínima de epítopo.
En cuanto a la mayoría de las respuestas inmunitarias antivirales, es probable que la protección contra la BTV dependa de una combinación de inmunidad celular y humoral. Los componentes celulares y humorales de la inmunidad han demostrado ser importantes para la protección de la BTV en el huésped natural (28, 29), aunque la protección puede ocurrir en ausencia de anticuerpos neutralizantes (27, 30). Las vacunas recombinantes a base de adenovirus son buenos inductores de la inmunidad celular (31); sin embargo, pueden no ser óptimas para la inducción de respuestas humorales en nuestro entorno experimental. Nuestros datos indican que, a pesar de inducir IgG que reconoce todos los serotipos de BTV, Ad5VP2-1 no produjo títulos significativos de anticuerpos neutralizantes de BTV. Sin embargo, se detectaron anticuerpos neutralizantes en los ratones que sobrevivieron al desafío de la BTV, lo que indica que estos podrían ser importantes para la protección en este modelo murino. Se podría estudiar la alteración de la vía a través de la cual el sistema inmunitario detecta el antígeno para mejorar la producción de anticuerpos neutralizantes con la vacuna basada en adenovirus. Las formas solubles de antígenos tienen más probabilidades de dar lugar a respuestas de anticuerpos, como lo ejemplifican las vacunas antivirus inactivadas que a menudo desencadenan buenas respuestas de anticuerpos, pero que generalmente son malos inductores de la inmunidad celular debido a la falta de replicación intracelular (59-61). La entrega de proteínas solubles por el vector adenoviral es factible (62-64) y podría implementarse para promover la inmunidad humoral a un antígeno soluble. En general, parece que la comprensión de la inmunidad se correlaciona con la protección de la enfermedad es fundamental para mejorar el diseño de la vacuna en BTV y en otras enfermedades infecciosas.
Aquí describimos un enfoque de vacunación basado en adenovirus para la BTV que proporciona protección multiserotipo. Los vectores adenovirales tienen múltiples beneficios como estrategias de vacunación alternativas. Son relativamente fáciles de manipular y se pueden obtener títulos altos de vacuna estable. Son eficaces en la administración de antígenos y proporcionan un efecto adyuvante que promueve una inmunidad adaptativa duradera. Además, se ha demostrado su seguridad para uso veterinario (65), y se ha aprobado una vacuna basada en adenovirus para la fiebre aftosa en los EE. UU. en casos de emergencia. Por lo tanto, la combinación de vectores de adenovirus que expresan proteínas de la cápside VP2 y VP7 de BTV podría representar una estrategia interesante para mejorar la inmunidad de reacción cruzada contra la BTV. La construcción Ad5VP7-8 parece particularmente prometedora para proporcionar una inmunidad protectora basal entre los serotipos de BTV. Aunque queda mucho trabajo por hacer para optimizar los regímenes de vacunación, el presente estudio destaca el potencial inmunogénico de las estrategias basadas en adenovirus para el desarrollo de vacunas DIVA en BTV.
Declaración de disponibilidad de datos
Los autores pondrán a disposición los datos sin procesar que respaldan las conclusiones de este artículo, sin reservas indebidas.
Declaración ética
El estudio sobre animales fue revisado y aprobado por el Comité de Ética de los Experimentos con Animales del Instituto Nacional de Investigación y Tecnología Agraría y Alimentaria (INIA) y el Comité Nacional de Bienestar Animal (PROEX 032/19).
Contribuciones del autor
JR, VM y NS diseñaron los experimentos y dirigieron el trabajo. JR, DB-M, MA y VM realizaron los experimentos. JR y VM escribieron el manuscrito. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Financiación
Este trabajo fue financiado por las subvenciones AGL2015-64290R y RTI2018-094616-B-100 del Ministerio de Ciencia (España), la subvención VetBioNet INFRAIA-731014 de la EU-H2020 y la subvención S2018/BAA-4370-PLATESA2 de la Comunidad de Madrid (Fondo Europeo de Desarrollo Regional, FEDER). MA fue financiado por una subvención de FPI (BES-2013-066406).
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Agradecimientos
Los autores desean dar las gracias al Dr. Ana Villa para ayuda técnica en microscopía confocal, y todos los miembros del laboratorio de Nuevas Estrategias para el Control de Patógenos Relevantes en Sanidad Animal para asistencia técnica y discusiones útiles.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2021.645561/full#supplementary-material
Referencias
2. Coetzee P, Stokstad M, Venter EH, Myrmel M, Van Vuuren M. Lengua azul: una perspectiva histórica y epidemiológica con énfasis en Sudáfrica. Virol J. (2012) 9:198. doi: 10.1186/1743-422x-9-198
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
3. Roy P. Proteínas y partículas del virus de la lengua azul y su papel en la entrada, ensamblaje y liberación del virus. Adv Virus Res. (2005) 64:69-123. doi: 10.1016/S0065-3527(05)64004-3
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
4. Ratinier M, Caporale M, Golder M, Franzoni G, Allan K, Nunes SF, et al. Identificación y caracterización de una nueva proteína no estructural del virus de la lengua azul. PLoS Pathog. (2011) 7:e1002477. doi: 10.1371/journal.ppat.1002477
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
5. Stewart M, Hardy A, Barry G, Pinto RM, Caporale M, Melzi E, et al. Caracterización de un segundo marco de lectura abierto en el segmento 10 del genoma del virus de la lengua azul. J Gen Virol. (2015) 96:3280–93. doi: 10.1099/jgv.0.000267
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
6. Turner J, Bowers RG, Baylis M. Modelización de la transmisión del virus de la lengua azul entre granjas utilizando movimientos de animales y vectores. Representante de ciencia ficción (2012) 2:319. doi: 10.1038/srep00319
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
7. Zientara S, Sánchez-Vizcaino JM. Control de la lengua azul en Europa. Veterinario Microbiol. (2013) 165:33–7. doi: 10.1016/j.vetmic.2013.01.010
8. Jacquet S, Huber K, Pages N, Talavera S, Burgin LE, Carpenter S, et al. Expansión del rango del vector de lengua azul, Culicoides imicola, en la Francia continental, probablemente debido a raros eventos de transporte eólico. Representante de ciencia ficción (2016) 6:27247. doi: 10.1038/srep27247
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
9. Rojas JM, Rodríguez-Martín D, Martín V, Sevilla N. Diagnóstico del virus de la lengua azul en rumiantes domésticos: perspectivas actuales. Veterinario Médico. (2019) 10:17-27. doi: 10.2147/vmrr.S163804
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
10. van der Sluijs MT, de Smit AJ, Moormann RJ. Transmisión vectorial independiente del virus de la lengua azul transmitida por vectores. Crit Rev Microbiol. (2016) 42:57–64. doi: 10.3109/1040841x.2013.879850
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
11. Hamers C, Galleau S, Chery R, Blanchet M, Besancon L, Cariou C, et al. Uso de la vacuna inactivada contra el virus de la lengua azul serotipo 8 contra la detección virulenta en ovejas y ganado. Veterinario Rec. (2009) 165:369-73. doi: 10.1136/vr.165.13.369
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
12. Szmaragd C, Wilson AJ, Carpenter S, Wood JL, Mellor PS, Gubbins S. La propagación del serotipo 8 del virus de la fiebre catarral ovina en Gran Bretaña y su control mediante la vacunación. PLoS ONE. (2010) 5:e9353. doi: 10.1371/journal.pone.0009353
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
13. Bumbarov V, Golender N, Jenckel M, Wernike K, Beer M, Khinich E, et al. Caracterización del serotipo 28 del virus de la lengua azul. Transbound Emerg Dis. (2020) 67:171–82. doi: 10.1111/tbed.13338
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
14. Breard E, Belbis G, Viarouge C, Nomikou K, Haegeman A, De Clercq K, et al. Evaluación de las respuestas inmunitarias adaptativas y la protección heteróloga inducida por las vacunas inactivadas contra el virus de la lengua azul. Vacuna. (2015) 33:512–8. doi: 10.1016/j.vaccine.2014.11.053
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
15. Calvo-Pinilla E, Castillo-Olivares J, Jabbar T, Ortego J, de la Poza F, Marín-López A. Vacunas recombinantes contra el virus de la fiebre azul. Virus Res. (2014) 182:78–86. doi: 10.1016/j.virusres.2013.11.013
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
16. Ranjan K, Prasad M, Brar B, Lambe U, Kumar R, Ghosh M, et al. Vacuna contra el virus de la lengua azul: enfoque convencional a moderno. Acta Virol. (2019) 63:3–18. doi: 10.4149/av_2019_109
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
17. White JR, Eaton BT. La conformación de la proteína VP2 del virus de la lengua azul (BTV) determina la participación en la neutralización del virus de los epítopos altamente conservados dentro del serogrupo BTV. J Gen Virol. (1990) 71(Pt 6):1325-32. doi: 10.1099/0022-1317-71-6-1325
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
18. Maan S, Maan NS, Samuel AR, Rao S, Attoui H, Mertens PP. Análisis y comparaciones filogenéticas de genes VP2 de longitud completa de los 24 serotipos del virus de la lengua azul. J Gen Virol. (2007) 88(Pt 2):621–30. doi: 10.1099/vir.0.82456-0
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
19. Marín-López A, Otero-Romero I, de la Poza F, Menaya-Vargas R, Calvo-Pinilla E, Benavente J, et al. Las proteínas VP2, VP7 y NS1 del virus de la lengua azul dirigidas en las microesferas de reovirus aviar muNS-Mi provocan una respuesta inmune protectora en ratones IFNAR(−/−). Res antiviral. (2014) 110:42-51. doi: 10.1016/j.antiviral.2014.07.008
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
20. Legisa DM, Perez Aguirreburualde MS, Gonzalez FN, Marin-Lopez A, Ruiz V, Wigdorovitz A, et al. Una vacuna experimental de subunidad basada en la proteína 4 VP2 del virus de la lengua azul fusionada con un anticuerpo de cadena única de células que presentan antígenos provoca respuestas inmunes celulares y humorales en ganado, cobayas y ratones IFNAR(−/−). Vacuna. (2015) 33:2614–9. doi: 10.1016/j.vaccine.2015.03.067
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
21. Rojas JM, Rodriguez-Calvo T, Pena L, Sevilla N. Las respuestas de las células T al virus de la lengua azul se dirigen contra los epítopos de células T CD4+ y CD8+ múltiples e idénticos de la proteína central VP7 en ratones y ovejas. Vacuna. (2011) 29:6848–57. doi: 10.1016/j.vaccine.2011.07.061
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
22. Rojas JM, Pena L, Martin V, Sevilla N. Los epítopos de células T ovino y murinos de la proteína no estructural 1 (NS1) del serotipo 8 del virus de la lengua azul (BTV-8) se comparten entre los serotipos virales. Res del veterinario. (2014) 45:30. doi: 10.1186/1297-9716-45-30
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
23. Wade-Evans AM, Romero CH, Mellor P, Takamatsu H, Anderson J, Thevasagayam J, et al. La expresión de la principal proteína estructural central (VP7) del virus de la lengua azul, por un virus de la capripía recombinante, proporciona una protección parcial de las ovejas contra un desafío virulento del virus de la lengua azul. Virología. (1996) 220:227-31. doi: 10.1006/viro.1996.0306
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
24. Anderson J, Hägglund S, Bréard E, Riou M, Zohari S, Comtet L, et al. Fuerte protección inducida por una vacuna experimental de subunidad DIVA contra el serotipo 8 del virus de la lengua azul en el ganado.Vacuna. (2014) 32:6614–21. doi: 10.1016/j.vaccine.2014.09.066
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
25. Martin V, Pascual E, Avia M, Pena L, Valcarcel F, Sevilla N. La eficacia protectora en ovejas de las vacunas vectores de adenovirus contra el virus de la fiebre catarral ovina se asocia con respuestas específicas de las células T. PLoS ONE. (2015) 10:e0143273. doi: 10.1371/journal.pone.0143273
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
26. Marín-López A, Calvo-Pinilla E, Barriales D, Lorenzo G, Brun A, Anguita J, et al. Las respuestas de las células T CD8 a un epítopo inmunodominante dentro de la proteína no estructural NS1 proporcionan una amplia inmunoprotección contra el virus de la lengua azul en ratones IFNAR(-/−). J Virol. (2018) 92:e00938-18. doi: 10.1128/jvi.00938-18
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
27. Stott JL, Osburn BI, Barber TL. El estado actual de la investigación sobre una vacuna experimental contra el virus de la lengua azul inactivada. Proc Annu Meet U S Anim Health Assoc. (1979) 55-62.
28. Jeggo MH, Wardley RC, Brownlie J. Un estudio del papel de la inmunidad mediada por células en la infección por el virus de la lengua azul en ovejas, utilizando técnicas de transferencia de adopción celular. Inmunología. (1984) 52:403-10.
29. Jeggo MH, Wardley RC, Taylor WP. Papel del anticuerpo neutralizante en la inmunidad pasiva a la infección por la lengua azul. Res Vet Sci. (1984) 36:81–6.
30. Stott JL, Barber TL, Osburn BI. Respuesta inmunológica de las ovejas al virus de la lengua azul inactivado y virulento. Am J Vet Res. (1985) 46:1043–9.
31. Rojas JM, Sevilla N, Martin V. Los adenovirus como herramientas en la salud animal. En: Desheva Y, editores. Adenovirus. Londres: IntechOpen (2018). doi: 10.5772/intechopen.79132
32. Moraes MP, Mayr GA, Mason PW, Grubman MJ. Protección temprana contra el desafío homólogo después de una sola dosis de adenovirus humano tipo 5 defectuoso de replicación que expresa proteínas capsida de la cepa A24 del virus de la fiebre aftosa (FMDV). Vacuna. (2002) 20:1631–9. doi: 10.1016/s0264-410x(01)00483-2
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
33. Rojas JM, Moreno H, Valcarcel F, Pena L, Sevilla N, Martin V. La vacunación con adenovirus recombinantes que expresan las proteínas F o H del virus de los rumiantes peste des petits supera la inmunosupresión viral e induce inmunidad protectora contra el desafío de PPRV en ovejas. PLoS ONE. (2014) 9:e101226. doi: 10.1371/journal.pone.0101226
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
34. Calvo-Pinilla E, Rodriguez-Calvo T, Anguita J, Sevilla N, Ortego J. Establecimiento de un modelo de infección por el virus de la lengua azul en ratones que tienen deficiencia en el receptor de interferón alfa/beta. PLoS ONE. (2009) 4:e5171. doi: 10.1371/journal.pone.0005171
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
35. Rodríguez-Calvo T, Rojas JM, Martin V, Sevilla N. El interferón tipo I limita la capacidad del virus de la lengua azul para infectar a los precursores hematopoyéticos y las células dendríticas in vitro e in vivo. J Virol. (2014) 88:859–67. doi: 10.1128/jvi.02697-13
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
36. Mulens-Arias V, Rojas JM, Pérez-Yague S, Morales Mdel P, Barber DF. El SPION recubierto de polietileno etilomina exhibe posibles propiedades antimetastásicas intrínsecas que inhiben la migración y la invasión de las células tumorales pancreáticas. J Release Control. (2015) 216:78–92. doi: 10.1016/j.jconrel.2015.08.009
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
37. Avia M, Rojas JM, Miorin L, Pascual E, Van Rijn PA, Martín V, et al. Degradación autofágica inducida por el virus de STAT2 como mecanismo para el bloqueo de la señalización del interferón. EMBO Rep. (2019) 20:e48766. doi: 10.15252/embr.201948766
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
38. Müller U, Steinhoff U, Reis LF, Hemmi S, Pavlovic J, Zinkernagel RM, et al. Función funcional de los interferones de tipo I y tipo II en la defensa antiviral. Ciencia. (1994) 264:1918-21. doi: 10.1126/ciencia.8009221
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
39. Charan J, Kantharia ND. ¿Cómo calcular el tamaño de la muestra en estudios con animales? J Pharmacol Pharmacother. (2013) 4:303–6. doi: 10.4103/0976-500x.119726
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
40. Macchi F, Rojas JM, Verna AE, Sevilla N, Franceschi V, Tebaldi G, et al. El vector bovino basado en el herpesvirus 4 que entrega el virus de los rumiantes peste des petits hemaglutinina ORF induce tanto anticuerpos neutralizantes como respuestas de células T citotóxicas. Inmunol Frontal. (2018) 9:421. doi: 10.3389/fimmu.2018.00421
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
41. Rojas JM, Spada R, Sanz-Ortega L, Morillas L, Mejias R, Mulens-Arias V, et al. La deficiencia reguladora de la subunidad beta PI3K p85 no afecta a la diferenciación de las células NK y aumenta la activación mediada por NKG2D. J Leukoc Biol. (2016) 100:1285–96. doi: 10.1189/jlb.1A1215-541RR
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
42. Rojas JM, Avia M, Pascual E, Sevilla N, Martin V. La vacunación con adenovirus recombinante que expresa las proteínas del virus de los pequeños rumiantes-F o -H provoca respuestas de las células T a los epítopos que surgen durante la infección por PPRV. Res del veterinario. (2017) 48:79. doi: 10.1186/s13567-017-0482-x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
43. Rojas JM, Rodríguez-Martín D, Avia M, Martín V, Sevilla N. La fusión del virus de los rumiantes de Peste des petits y las proteínas de hemaglutinina desencadenan la citotoxicidad mediada por células dependientes de anticuerpos en las células infectadas. Inmunol Frontal. (2018) 9:3172. doi: 10.3389/fimmu.2018.03172
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
44. Matsuo E, Celma CC, Boyce M, Viarouge C, Sailleau C, Dubois E, et al. Generación de vacunas basadas en virus defectuosos en la replicación que confieren protección completa a las ovejas contra el desafío virulento del virus de la lengua azul. J Virol. (2011) 85:10213-21. doi: 10.1128/JVI.05412-11
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
45. Rojas JM, Moreno H, García A, Ramírez JC, Sevilla N, Martin V. Dos vectores de la vacuna adenoviral defectuosos por replicación para la inducción de respuestas inmunitarias al VRPP. Vacuna. (2014) 32:393–400. doi: 10.1016/j.vaccine.2013.11.033
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
46. Rojas JM, Rodríguez-Calvo T, Sevilla N. Las respuestas de las células T al virus de la lengua azul producen un estrechamiento del repertorio de células T. Res del veterinario. (2017) 48:38. doi: 10.1186/s13567-017-0444-3
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
47. Caporale M, Wash R, Pini A, Savini G, Franchi P, Golder M, et al. Determinantes de la virulencia del virus de la fiebre catarral ovina en modelos murinos de enfermedades. J Virol. (2011) 85:11479–89. doi: 10.1128/jvi.05226-11
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
48. Celma CC, Bhattacharya B, Eschbaumer M, Wernike K, Beer M, Roy P. Estudio de patogenicidad en ovejas utilizando virus reasortantes de la lengua azul basados en la genética inversa. Veterinario Microbiol. (2014) 174:139-47. doi: 10.1016/j.vetmic.2014.09.012
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
49. Janowicz A, Caporale M, Shaw A, Gulletta S, Di Gialleonardo L, Ratinier M, et al. Múltiples segmentos del genoma determinan la virulencia del serotipo 8 del virus de la lengua azul. J Virol. (2015) 89:5238–49. doi: 10.1128/jvi.00395-15
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
50. Elbers AR, Backx A, Meroc E, Gerbier G, Staubach C, Hendrickx G, et al. Observaciones de campo durante la epidemia de serotipo 8 de la fiebre catarral ovina en 2006. I. Detección de los primeros brotes y signos clínicos en ovejas y ganado en Bélgica, Francia y los Países Bajos. Anterior Vet Med. (2008) 87:21-30. doi: 10.1016/j.prevetmed.2008.06.004
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
51. Bouet-Cararo C, Contreras V, Caruso A, Top S, Szelechowski M, Bergeron C, et al. Expresión de VP7, un antígeno específico del grupo del virus de la lengua azul por vectores virales: análisis de las respuestas inmunitarias inducidas y evaluación del potencial protector en ovejas. PLoS ONE. (2014) 9:e111605. doi: 10.1371/journal.pone.0111605
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
52. Calvo-Pinilla E, Navasa N, Anguita J, Ortego J. Protección multiserotipo provocada por una estrategia combinatoria de vacunación prime-boost contra el virus de la fiebre catarral ovina. PLoS ONE. (2012) 7:e34735. doi: 10.1371/journal.pone.0034735
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
53. Chen W, Antón LC, Bennink JR, Yewdell JW. Diseccionar las causas multifactoriales de la inmunodominancia en las respuestas de las células T restringidas de clase I a los virus. Inmunidad. (2000) 12:83–93. doi: 10.1016/s1074-7613(00)80161-2
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
54. Yewdell JW. Confrontando la complejidad: inmunodominancia del mundo real en las respuestas antivirales de las células T CD8+. Inmunidad. (2006) 25:533–43. doi: 10.1016/j.immuni.2006.09.005
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
55. Butz EA, Bevan MJ. Expansión masiva de las células T CD8+ específicas del antígeno durante una infección aguda por el virus. Inmunidad. (1998) 8:167-75. doi: 10.1016/s1074-7613(00)80469-0
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
56. Sandberg JK, Grufman P, Wolpert EZ, Franksson L, Chambers BJ, Kärre K. Superdominancia entre los epítopos inmunodominantes restringidos con H-2Kb y reversión por administración de antígenos mediados por células dendríticas. J Immunol. (1998) 160:3163–9.
57. Wolpert EZ, Grufman P, Sandberg JK, Tegnesjö A, Kärre K. Inmunodominancia en la respuesta CTL contra antígenos de histocompatibilidad menores: interferencia entre las células T que responden, en lugar de con la presentación de epítopos. J Immunol. (1998) 161:4499–505.
58. Grufman P, Wolpert EZ, Sandberg JK, Kärre K. Competencia de células T para la célula que presenta antígenos como modelo de inmunodominancia en la respuesta citotóxica de linfocitos T contra antígenos de histocompatibilidad menores. Eur J Immunol. (1999) 29:2197–204. doi: 10.1002/(SICI)1521-4141(199907)29:07<2197::AID-IMMU2197>3.0. CO;2-B
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
59. Bachmann MF, Kündig TM, Kalberer CP, Hengartner H, Zinkernagel RM. La inactivación de la formalina del virus de la estomatitis vesicular afecta a las respuestas de las células B independientes de las células T, pero no a las T. J Virol. (1993) 67:3917-22.
60. Lambert PH, Liu M, Siegrist CA. ¿Pueden las vacunas exitosas enseñarnos cómo inducir respuestas inmunitarias protectoras eficientes? Nat Med. (2005) 11:S54–62. doi: 10.1038/nm1216
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
61. Honke N, Shaabani N, Cadeddu G, Sorg UR, Zhang DE, Trilling M, et al. La replicación viral forzada activa la inmunidad adaptativa y es esencial para el control de un virus citopático. Nat Immunol. (2011) 13:51–7. doi: 10.1038/ni.2169
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
62. Moraes MP, de Los Santos T, Koster M, Turecek T, Wang H, Andreyev VG, et al. Mejora de la actividad antiviral contra el virus de la fiebre aftosa mediante una combinación de interferones porcinos de tipo I y II. J Virol. (2007) 81:7124-35. doi: 10.1128/jvi.02775-06
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
63. Martin V, Pascual E, Avia M, Rangel G, de Molina A, Alejo A, et al. Un adenovirus recombinante que expresa el interferón ovino tau previene la letalidad inducida por el virus de la gripe en ratones. J Virol. (2016) 90:373-88. doi: 10.1128/jvi.03258-15
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
64. Rojas JM, Alejo A, Avia JM, Rodríguez-Martín D, Sánchez C, Alcamí A, et al. Activación de la señalización comulatoria OX40 y CD27 en ovejas a través de ligandos ovinos recombinantes. Vacunas.(2020) 8:333. doi: 10.3390/vacunas8020333
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
65. Barrera J, Brake DA, Kamicker BJ, Purcell C, Kaptur R Jr, Schieber T, et al. Perfil de seguridad de una vacuna de subunidad del virus de la fiebre aftosa con vectores de adenovirus humanos con deficiencia de replicación en el ganado. Transbound Emerg Dis. (2018) 65:447–55. doi: 10.1111/tbed.12724
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Palabras clave: vacuna, orbivirus, células T, linfocitos T citotóxicos, ratones IFNAR(−/−)
Cita: Rojas JM, Barba-Moreno D, Avia M, Sevilla N y Martín V (2021) Vacunación con adenovirus recombinantes que expresan las subunidades del virus de la lengua azul VP7 y VP2 proporciona protección contra el desafío del virus heterólogo. Frente. Veterinario. Sci. 8:645561. doi: 10.3389/fvets.2021.645561
Editado por:
Fuxiao Liu, Universidad Agrícola de Qingdao, China
Revisado por:
Stéphan Zientara, Agence Nationale de Sécurité Sanitaire de l’Alimentation, de l’Environnement et du Travail (ANSES), France
Lázaro Gil, Hospital de San Miguel, Canadá
Bernard Klonjkowski, INRA École Nationale Vétérinaire d’Alfort (ENVA), Francia
Copyright © 2021 Rojas, Barba-Moreno, Avia, Sevilla y Martín.
*Correspondencia: Verónica Martín, verónica.martin@inia.es; José Manuel Rojas, rojas.jose@inia.es
Descargo de responsabilidad: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamación que pueda ser fabricado por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía