Linfangioma pericárdico cavernoso múltiple (linfangiomatosis pericárdica) en un halcón peregrino cautivo
 Relato de caso: Linfangioma pericárdico cavernoso múltiple (linfangiomatosis pericárdica) en un halcón peregrino cautivo (Falco peregrinus brookei))
Relato de caso: Linfangioma pericárdico cavernoso múltiple (linfangiomatosis pericárdica) en un halcón peregrino cautivo (Falco peregrinus brookei))
 José Espinosa1
José Espinosa1 M. Carmen Ferreras1
M. Carmen Ferreras1 David García2
David García2 Raquel Vallejo1
Raquel Vallejo1 Valentín Pérez1*
Valentín Pérez1*- 1Departamento de Sanidad Animal, Facultad de Veterinaria, Instituto de Ganadería de Montaña (CSIC-ULE), Universidad de León, León, España
- 2Falco Iberia S.L., León, España
Una hembra de halcón peregrino (Falco peregrinus brookei) de 12 años de edad, de un criadero privado de aves rapaces que presentaba una buena condición corporal, murió repentinamente sin mostrar síntomas previos. En la necropsia, en la cavidad celómica, se observaron múltiples estructuras quísticas demarcadas por una delgada pared transparente y llenas de un contenido seroso. Se adhirieron firmemente a la parte craneal del epicardio y los tejidos adyacentes y ocuparon toda el área torácica de la cavidad celómica. Microscópicamente, emergiendo simultáneamente de varias áreas el epicardio, se observaron múltiples canales irregulares y espacios quísticos, revestidos por una sola capa de células endoteliales y separados por septos fibrovasculares que contienen tejido muscular liso. El examen inmunohistoquímico reveló que las células endoteliales neoplásicas inmunomarcadas positivamente para el antígeno relacionado con el factor VIII marcador panendotelial, pero inmunoteñidas negativas para citoqueratinas (PCK26), mientras que se detectó una fuerte positividad para la actina del músculo α liso sarcomérico (α-SMA) en las paredes quísticas. Con base en los hallazgos morfológicos e inmunohistoquímicos, las lesiones se determinaron como consistentes con un linfangioma pericárdico cavernoso múltiple, o linfangiomatosis pericárdica, una neoplasia vascular rara. El animal también mostró una perihepatitis crónica difusa, un área necrótica en el hígado y focos de metaplasia cartilaginosa y calcificación en la aorta y la vena cava. La revisión de la literatura, particularmente sobre la epidemiología del linfangioma, demostró la rareza de este tumor en las diferentes especies animales y en esta localización, particularmente en aves, siendo el primer reporte de este tipo de tumor en un halcón peregrino.
Fondo
El creciente interés por la fauna silvestre está detrás del aumento del número de notificaciones de diferentes patologías que afectan a estas especies, lo que está llevando a la medicina veterinaria a ampliar el abanico de conocimientos clínico-patológicos en este ámbito. Sin embargo, en la actualidad, la información disponible sigue siendo muy limitada en comparación con las especies domésticas. En el caso específico de las condiciones neoplásicas de las aves silvestres, los estudios sobre su naturaleza y frecuencia son escasos y se sabe poco sobre su etiología, patogénesis o comportamiento biológico. Además, el número de estudios recientes y actualizados es muy limitado y los disponibles se centran principalmente en aves de compañía o aviarias (por ejemplo, aves psitácidas), con el resultado de que la incidencia de neoplasia es mayor en estas especies aviares en comparación con el resto (1-6). En contraste, en las aves rapaces, los tumores se consideran relativamente raros. En todo el mundo, se han reportado neoplasias en más de 40 especies de las familias Accipitridae, Falconidae, Strigidae y Cathartidae, y se ha descrito una amplia variedad de tumores (7-12). A pesar de ello, se dispone de datos limitados en relación con la prevalencia de neoplasia, la especie, el sexo o la predisposición a la edad. La nomenclatura tumoral es inconsistente y la etiología, la oncogénesis y el comportamiento biológico son básicamente desconocidos. Además, se considera que la información incluida en dichos informes no corresponde a la prevalencia real de neoplasia en estas especies debido a la marcada escasez de casos documentados en la literatura. En las últimas décadas, el número de aves rapaces mantenidas en cautiverio a largo plazo, para la cría con fines de conservación o para la actividad de cetrería, ha aumentado considerablemente. Una mayor longevidad, endogamia o exposición a carcinógenos ambientales o nutricionales (13) puede aumentar el riesgo de desarrollar neoplasias, incluidos los tipos de tumores no registrados hasta el momento. Este hecho permitirá mejorar la comprensión y documentación de estas condiciones patológicas en estas especies. En esta línea, este estudio describe los principales hallazgos patológicos e inmunohistoquímicos de un linfangioma pericárdico multifocal (linfangiomatosis pericárdica) en un halcón peregrino cautivo (Falco peregrinus brookei) de 12 años de edad, una patología vasoformativa rara de naturaleza neoplásica que, según el conocimiento de los autores, no ha sido reportada hasta la fecha en aves y está poco documentada en otras especies animales.
Historia clínica
Una hembra de halcón peregrino cautivo de 12 años fue remitida en enero de 2020 al Servicio de Diagnóstico Patológico de la Facultad de Ciencias Veterinarias de la Universidad de León, España, para determinar la posible causa de la muerte. El ave quedó impresa en su dueño y formó parte de un programa de cría en cautividad desde que tenía 2 años. El animal murió repentinamente sin mostrar signos clínicos obvios, aparte de una pérdida de vocalización justo antes de la muerte, y fue sometido inmediatamente a necropsia. El animal había mostrado un fracaso reproductivo después de la última inseminación artificial. La alimentación se basó en pollitos y codornices descongelados de 1 día de edad, sin suplementos alimenticios adicionales. El animal mostró una muy buena condición corporal en el momento de la muerte, con un peso corporal in vivo de 980 gr. Dada la rapidez del proceso, no se realizaron análisis hematológicos y bioquímicos previos, ni otros ensayos clínicos.
Post-Mortem Diagnóstico
Necropsia y hallazgos macroscópicos
En la necropsia, se notó la presencia de abundante grasa subcutánea y tamaños apropiados de los músculos esqueléticos, que parecían normales. En la cavidad celómica, se observó abundante contenido serohemorrágico libre turbio (50 mL), que coagulaba fácilmente al contacto con el aire, así como la presencia de coágulos de fibrina. El hígado estaba agrandado y mostraba una cápsula engrosada y áspera, firmemente adherida al parénquima. Un área de 2,5 cm de diámetro de material necrótico caseoso verdoso, rodeado por una cápsula fibrosa delgada, estaba presente adherida focalmente a la cápsula hepática. En la cavidad celómica, se observaron múltiples estructuras quísticas, de 0,3 cm a 2 cm de diámetro, delimitadas por una pared delgada pero fácilmente separadas entre sí, y con contenido seroso, claro y transparente (Figura 1A). Estos quistes formaron una sola masa que se adhirió fuertemente al epicardio y estructuras adyacentes, dificultando su separación del corazón y los vasos relacionados (Figura 1B). La masa quística se extendía hasta la bifurcación de la tráquea y ocupaba toda el área torácica de la cavidad celómica. Entre estas cavidades quísticas, se observaron abundantes hebras de color blanco amarillento de un material ligeramente elástico, consistente con fibrina. Los pulmones estaban ligeramente congestionados y el corazón parecía normal, sin alteraciones en el tamaño de las cámaras cardíacas o en las válvulas. No se detectaron otras lesiones macroscópicas en el resto de los órganos. Se recogieron muestras de tejido representativas de las lesiones y del resto de órganos, para su examen histopatológico.
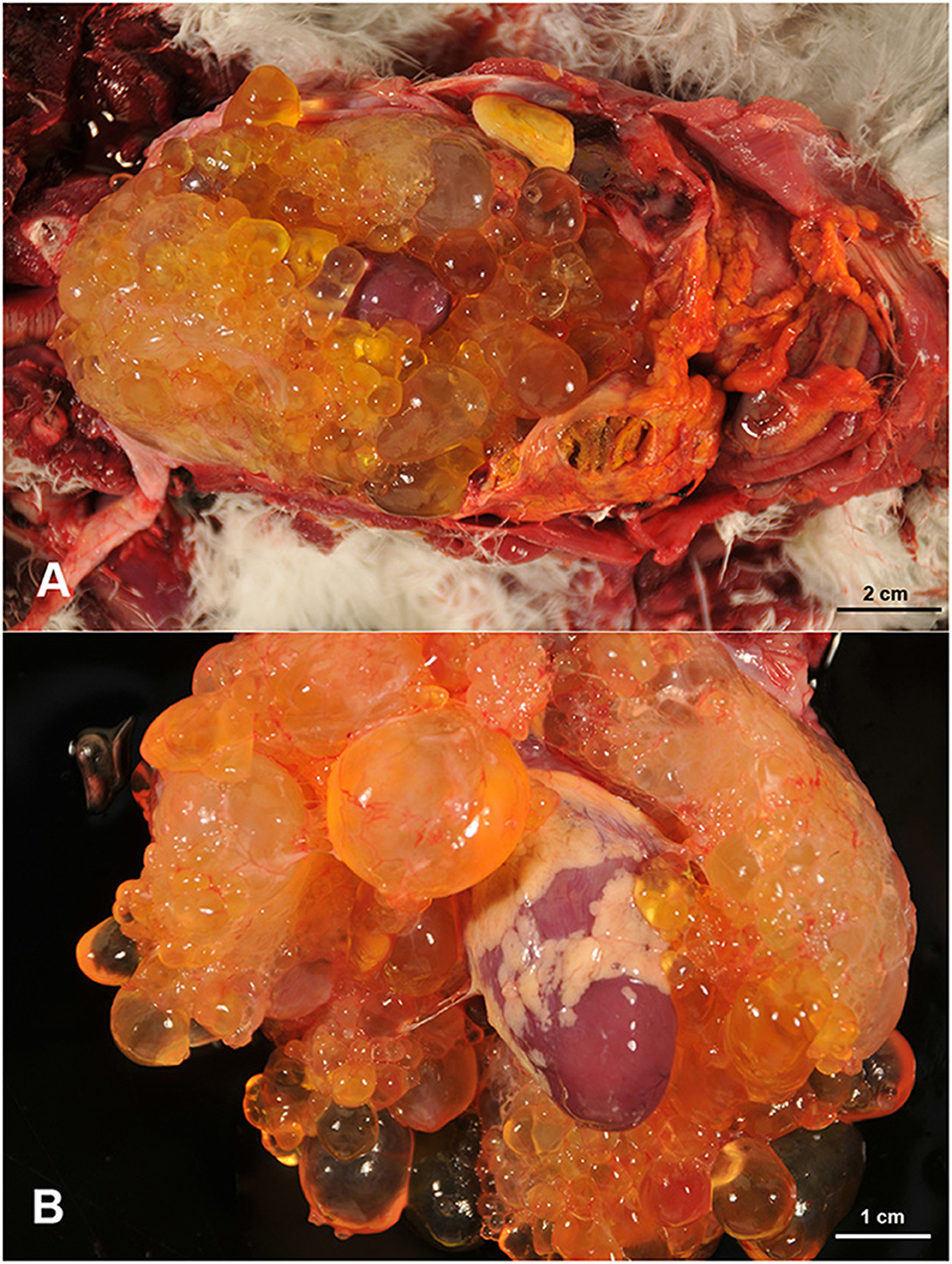 FIGURA 1. Múltiples cavidades quísticas, llenas de un líquido claro, están ocupando el área torácica de la cavidad celómica con presencia de coágulos de fibrina libre (A). Estas estructuras quísticas engullen el corazón y están firmemente unidas al epicardio (B).
FIGURA 1. Múltiples cavidades quísticas, llenas de un líquido claro, están ocupando el área torácica de la cavidad celómica con presencia de coágulos de fibrina libre (A). Estas estructuras quísticas engullen el corazón y están firmemente unidas al epicardio (B).
Estudios histopatológicos e inmunohistoquímicos
Las muestras de tejido fijadas en formalina tamponada al 10% se procesaron rutinariamente a través de una serie de alcohol graduado y xileno, antes de ser incrustadas en cera de parafina. De cada muestra se obtuvieron secciones de tejido de 2,5 μm de espesor y se tiñeron con hematoxilina y eosina (H&E) de Harris. Se realizaron tinciones adicionales, incluyendo tinciones periódicas de ácido-Schiff (PAS), tricrómica de Masson o tinciones de Gram y Ziehl-Neelsen. Además, dos frotis directos, junto con otros dos hechos del líquido extraído de las cavidades celómicas después de la centrifugación y la recolección de sedimentos, se fijaron en metanol, se tiñeron con el método de May-Grünwald Giemsa y se montaron para el examen citológico.
Para caracterizar las lesiones, se realizaron pruebas inmunohistoquímicas a partir de secciones de las estructuras quísticas observadas en la cavidad celómica. Anticuerpos contra la α-actina anti músculo liso (α-SMA) (Monoclonal; Clon 1A4; 1:100, tecnologías Dako-Agilent, Santa Clara, EE.UU.), citoqueratinas (monoclonales; Clon PCK26; 1:100, Dako-Agilent), antígeno relacionado con el factor VIII (policlonal; 1:100; Dako-Agilent), y el gen homeobox relacionado con Prospero-1 (Prox-1) (Monoclonal; Clon 5G10; 1:100, Thermo Fisher Scientific, Massachusetts, EE. UU.). Los fabricantes habían informado, a través de una revisión verificada del cliente, que los diferentes anticuerpos mostraban reactividad cruzada en secciones de tejidos aviares fijados en formalina (pollo); Sin embargo, no pudieron garantizar esta reactividad en especies aviares distintas del pollo. La recuperación de antígenos mediada por calor se realizó mediante el sistema PT Link, utilizando las soluciones de recuperación diana de pH 9,0 y pH 6,0 (Dako-Agilent) durante 20 min a 96 °C para α-SMA y antígeno relacionado con el factor VIII, respectivamente, y una solución de recuperación de antígeno tripsina (Abcam, Cambridge, Reino Unido) durante 15 min a 37 °C en el caso del anticuerpo citoqueratina. Para el anticuerpo Prox-1, se probaron diferentes protocolos de desenmascaramiento, incluido el uso de soluciones de recuperación de antígenos pH 6.0 y 9.0 y tripsina, como se mencionó anteriormente. Después de la desparafinización, la rehidratación y el secado, las secciones se sumergieron en un 3% H®®®®®®2O2 en solución de metanol durante 30 min a temperatura ambiente y oscuridad para bloquear la peroxidasa endógena. El inmunomarcaje se realizó utilizando un kit listo para usar EnVision System (Dako-Agilent) donde los portaobjetos se incubaron durante 40 minutos a temperatura ambiente. Después del lavado dos veces en PBS, se determinó la localización de anticuerpos utilizando 3,3-diaminobencidina (Dako-Agilent) como sustrato cromogénico para la peroxidasa. Finalmente, los portaobjetos se contrastaron con hematoxilina de Harris. Se utilizaron inmunoglobulinas apropiadas emparejadas con especies e isotipos como control. Estos incluyeron secciones con un control de isotipo para el anticuerpo primario y la omisión del anticuerpo primario. Como controles positivos, se utilizaron las mismas secciones examinadas para determinar el pH óptimo de dilución e incubación de anticuerpos e incluyeron varios tejidos normales de pollos sanos.®®®
Hallazgos histopatológicos
Las secciones de la masa quística revelaron la presencia de múltiples espacios cavernosos o macroquísticos irregulares, consistentes con múltiples canales linfáticos dilatados, separados por septos estromales fibrovasculares delgados a moderadamente gruesos, donde la presencia de células fusiformes separadas por una matriz eosinofílica, vasos sanguíneos de diferentes tamaños y un infiltrado inflamatorio multifocal, leve, compuesto de linfocitos, células plasmáticas y ocasionalmente células espumosas, (Figura 2A). Estos espacios estaban revestidos por una sola capa de células endoteliales que presentaban pleomorfismo leve, con forma celular aplanada, escaso citoplasma homogéneo basófilo y núcleos ovalados a triangulares, ubicados centralmente, en su mayoría hipercromáticos (Figura 2B). Estas cavidades se llenaban con frecuencia con un líquido pálido, ligeramente eosinofílico con la presencia ocasional de células desprendidas. Todos los componentes celulares estaban generalmente bien diferenciados y carecían de atipia celular o presencia de figuras mitóticas. Se determinó que el origen de estas estructuras quísticas era el epicardio donde, histológicamente, se observaron vasos linfáticos similares de tamaño más reducido, derivados multifocalmente de esta capa (Figura 2C). Mediante la tinción PAS, se observó la ausencia de una membrana basal lineal bien definida y se detectó la presencia de una capa muscular subendotelial mediante la tinción tricrómica de Masson. El examen inmunohistoquímico reveló que las células endoteliales neoplásicas expresaban el antígeno relacionado con el factor VIII marcador panendotelial (Figura 3A) pero carecían de inmunorreactividad para la citoqueratina, mientras que se observó un fuerte inmunomarcaje positivo a α-SMA en células localizadas en los septos, consistente con la presencia de una capa de músculo liso en la pared quística (Figura 3B). Con base en estos hallazgos, se realizó un diagnóstico final de linfangioma pericárdico cavernoso múltiple, o linfangiomatosis pericárdica diseminada. No se encontró inmunomarcaje para el anticuerpo Prox-1 en las células endoteliales que recubrían los espacios quísticos, ni en ninguna de las estructuras linfáticas del resto de los tejidos normales del ave afectada, en todos los ensayos inmunohistoquímicos realizados. Mientras tanto, secciones de tejido de pollo normal mostraron inmunotinción positiva contra Prox-1 en estructuras de revestimiento celular consistentes con vasos linfáticos.
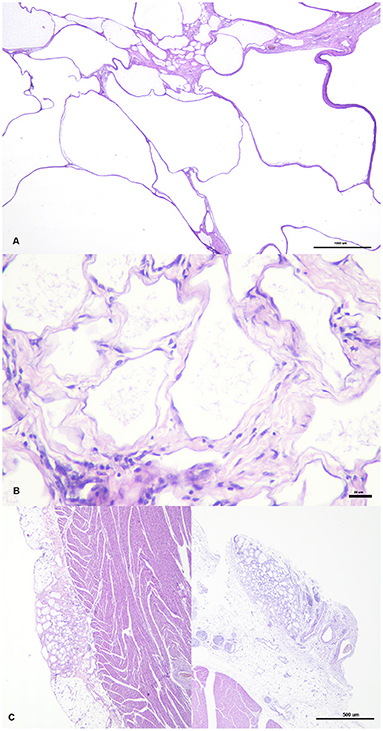 FIGURA 2. Las estructuras quísticas tienen diferente tamaño y están separadas por septos de grosor variable (A). Están revestidos por células endoteliales rodeadas de tejido fibrovascular, donde se ven células fusiformes y agregados ocasionales de linfocitos y células plasmáticas (B). Dos focos o proliferación de vasos linfáticos, que surgen del epicardio, simultáneamente en dos puntos diferentes se pueden ver en las imágenes izquierda y derecha (C).
FIGURA 2. Las estructuras quísticas tienen diferente tamaño y están separadas por septos de grosor variable (A). Están revestidos por células endoteliales rodeadas de tejido fibrovascular, donde se ven células fusiformes y agregados ocasionales de linfocitos y células plasmáticas (B). Dos focos o proliferación de vasos linfáticos, que surgen del epicardio, simultáneamente en dos puntos diferentes se pueden ver en las imágenes izquierda y derecha (C).
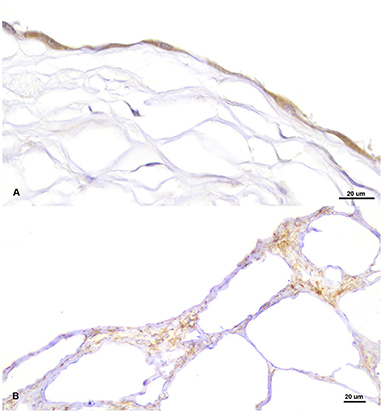 FIGURA 3. Inmunomarcaje positivo para el antígeno relacionado con el factor VIII del marcador panendotelial en las células endoteliales que recubren las cavidades quísticas (A) y para la actina del músculo liso (α-SMA) en el tabique que separa los quistes (B).
FIGURA 3. Inmunomarcaje positivo para el antígeno relacionado con el factor VIII del marcador panendotelial en las células endoteliales que recubren las cavidades quísticas (A) y para la actina del músculo liso (α-SMA) en el tabique que separa los quistes (B).
La arteria aórtica y la vena cava craneal mostraron áreas focales de degeneración de las células musculares lisas, con apariencia vacuolada, a nivel de la túnica media, interrupción moderada de las láminas elásticas y presencia de focos de calcificación y áreas de metaplasia cartilaginosa. En la pared de algunos bronquios también había áreas de mineralización y metaplasia cartilaginosa, así como proliferación de tejido mixoide entre las capas bronquiales. Se observaron corrus amilácea mineralizados en algunos folículos tiroideos. El foco caseoso y verdoso observado groseramente en el hígado estaba formado por un área de necrosis caseosa que afectaba al parénquima hepático, rodeada por un infiltrado inflamatorio compuesto por heterófilos, macrófagos espumosos, células gigantes de tipo cuerpo extraño y cristales de colesterol. Además, este órgano mostró una perihepatitis difusa moderada donde linfocitos, células plasmáticas y heterófilos fueron infiltrando la cápsula hepática, junto con focos inflamatorios multifocales de heterófilos dispersos en el parénquima hepático. No se observaron bacterias después de las tinciones de Gram o Ziehl-Neelsen. No se detectaron cambios microscópicos notables en el resto de los órganos.
El líquido extraído de las cavidades celómicas se caracterizó citológicamente por presentar baja celularidad, buena preservación celular y la existencia de una cantidad muy baja de sangre. Sólo se observaron células mesoteliales en diferentes etapas de activación, caracterizadas por núcleos redondos centrales y citoplasma azulado moderado, o la existencia de citoplasma vacuolado más abundante y un núcleo excéntrico, lo que llevó al diagnóstico de un trasudado modificado. No se observó atipia celular u otras características citológicas compatibles con neoplasia, ni la presencia de bacterias en ninguno de los frotis evaluados.
Revisión y discusión
Los tumores de los vasos linfáticos son raros en humanos y animales domésticos, pero particularmente en aves, ya que, aunque tienen canales linfáticos, estos están menos desarrollados que los de los mamíferos (14). Después de revisar la literatura disponible, solo se han reportado tres casos de linfangiomas aviares, y ninguno de ellos fue similar en términos de su ubicación anatómica y características clínicas (2, 15, 16). Además, en el resto de especies animales no hemos encontrado referencias respecto a los linfangiomas con origen pericárdico (ver Tabla 1).
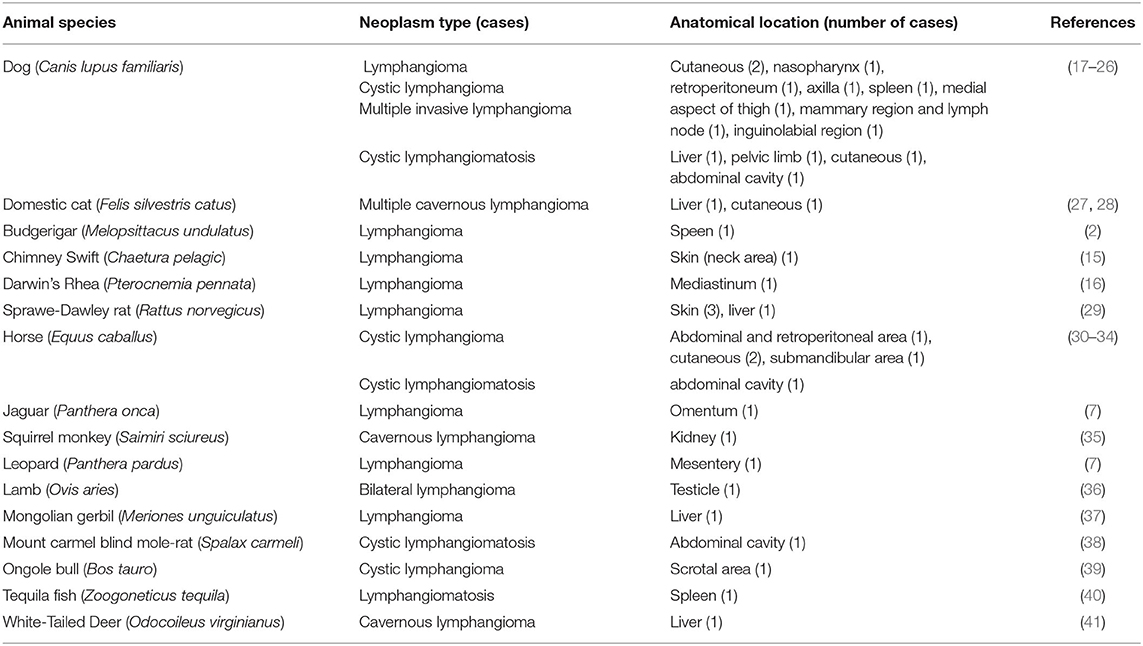 TABLA 1. Número de casos de tumores benignos de vasos linfáticos (linfangiomas y linfangiomatosis) en las diferentes especies animales, distintas de los humanos, reportados en la literatura.
TABLA 1. Número de casos de tumores benignos de vasos linfáticos (linfangiomas y linfangiomatosis) en las diferentes especies animales, distintas de los humanos, reportados en la literatura.
Los linfangiomas, como lesión aislada, son tumores benignos y de crecimiento lento del sistema linfático y se consideran malformaciones derivadas del secuestro de tejido linfático que no se comunican con el sistema linfático (42, 43). Tradicionalmente, los linfangiomas se han clasificado según su apariencia histológica en capilares, cavernosos y quísticos (44). En el presente caso, la lesión reportada se caracterizó histológicamente por un aspecto cavernoso debido a la presencia de canales linfáticos ampliamente dilatados, con capas adventicias fibrovasculares, así como por su ubicación intratorácica dentro de la cavidad celómica. Por otro lado, el término linfangiomatosis se utiliza para describir la presencia de múltiples linfangiomas que afectan los tejidos blandos o los órganos parenquimatosos de manera difusa o multifocal (42, 45). La presencia de múltiples linfangiomas cavernosos, que surgen multifocalmente de diferentes áreas pericárdicas, fue consistente con la condición reportada en este caso.
Faltan conocimientos básicos que puedan ayudar a explicar la etiología de estas lesiones linfáticas. En general, se acepta que la causa principal es una falla congénita del sistema linfático para conectarse con, o separarse de, el sistema venoso, o una gemación anormal de tejido linfático de la vena cardinal (46, 47). Sin embargo, en humanos, se ha observado que existen estímulos que pueden desencadenar la proliferación de células endoteliales linfáticas neoplásicas, como infecciones, traumatismos, inflamación crónica u obstrucción (48, 49). En las aves, algunos tipos de neoplasias vasoformativas surgen como secuelas de algunas infecciones virales como la leucosis aviar (11, 16). En el presente caso, la etiología de la linfangiomatosis pericárdica reportada es desconocida y no podemos concluir, a partir de los resultados patológicos, si se trata de un proceso congénito o adquirido. Se encontró un área de necrosis hepática y la presencia de focos inflamatorios en el parénquima hepático, para lo cual no se pudieron determinar sus causas exactas. Sin embargo, parece poco probable que esta lesión haya desencadenado el desarrollo de linfangiomas pericárdicos debido a su localización hepática y su carácter subagudo. Por otro lado, no se puede descartar por completo un origen congénito a pesar de la edad adulta del ave. Los linfangiomas intratorácicos pueden permanecer asintomáticos durante muchos años y solo se hicieron evidentes cuando aparecen signos clínicos derivados de la compresión de estructuras vitales (40, 50). En este caso, una insuficiencia cardíaca aguda secundaria a la acción mecánica de la gran masa multiquística podría ser la principal causa de muerte. Además, la gran cantidad de líquido libre en las cavidades celómicas es consistente con trastornos hidrostáticos asociados con una insuficiencia cardíaca progresiva.
Por otro lado, se observaron cambios degenerativos caracterizados por la fragmentación y ruptura de las fibras elásticas, junto con focos de calcificaciones distróficas y metaplasia cartilaginosa, en la túnica media de la arteria aórtica y la vena cava craneal. Estos cambios se han asociado con aterosclerosis, principalmente en especies de psitácida y aves rapaces cautivas (51, 52); Sin embargo, en este caso, no se encontraron cambios histológicos consistentes con esta condición. Otras causas como la deficiencia de cobre o la hipertensión también se han asociado con estos cambios degenerativos (53, 54). En este caso, no se evaluaron los niveles de cobre y la existencia de alteraciones en el flujo sanguíneo. No se pudo descartar el efecto mecánico de las masas quísticas sobre los grandes vasos del corazón que podrían haber contribuido a la aparición de estas lesiones de la pared del vaso.
Los linfangiomas deben distinguirse de otras lesiones quísticas vasculares como el mesotelioma multiquístico, el hemangioendotelioma o el linfangiosarcoma. Todos ellos son tumores vasoformativos raros y difíciles de diferenciar debido a las similitudes en sus hallazgos macroscópicos e histológicos; Por lo tanto, los estudios inmunohistoquímicos son necesarios para su diagnóstico diferencial. Como en este caso, los linfangiomas se caracterizan por la presencia de células endoteliales con inmunorreactividad para el antígeno relacionado con el factor VIII del marcador endotelial y carecen de expresión de citoqueratina, particularmente citoqueratina 5 y 6 (reconocida por el anticuerpo empleado), junto con la falta de una lámina basal claramente identificada y la existencia de una capa de músculo liso en la pared quística, como lo demuestra el inmunomarcaje positivo para α-SMA. Estos hallazgos se pueden utilizar para diferenciar el linfangioma de los mesoteliomas multiquísticos o los hemangioendoteliomas (55–57). El marcador Prox-1 se probó ya que se informa que se expresa por endotelio linfático (58, 59). Sin embargo, los estudios basales en aves son muy escasos (58), sin resultados previos en aves rapaces. En nuestro caso, no se observó inmunomarcaje positivo en ninguno de los tejidos linfáticos del ave afectada, aunque se detectó en tejidos de pollo utilizados como controles positivos, llegando a la conclusión de que el marcador utilizado no muestra inmunorreactividad en los tejidos del halcón peregrino. Por lo tanto, todos los hallazgos histológicos e inmunohistoquímicos apoyan el diagnóstico de linfangioma. Este tumor y linfangiosarcoma sólo difieren en su grado de pleomorfismo celular y actividad mitótica. En el presente caso, las células neoplásicas eran ligeramente pleomórficas y no se observaron figuras mitóticas, características altamente consistentes con un linfangioma.
En conclusión, este parece ser el primer informe de un linfangioma pericárdico cavernoso múltiple o linfangiomatosis pericárdica en un halcón peregrino. Este caso es de importancia adicional debido a la escasez de informes de esta condición a nivel del corazón, no solo en aves, sino también en otros mamíferos, incluido el hombre. En la actualidad, se siguen notificando pocos casos de neoplasias en aves rapaces, por lo que se debe hacer todo lo posible para enviar muestras sospechosas procedentes de aves cautivas o de vida libre para su investigación patológica y, posteriormente, mejorar la comprensión de la prevalencia de enfermedades neoplásicas en las diferentes especies aviares.
Declaración de disponibilidad de datos
Las contribuciones originales generadas para este estudio se incluyen en el artículo / Material complementario, las consultas adicionales pueden dirigirse al autor / s correspondiente.
Declaración ética
No se requirió revisión ética y aprobación para el estudio con animales porque los procedimientos se realizaron en un animal a petición del propietario (Falco Iberia S. L.). El estudio se llevó a cabo sobre la base de la situación clínica, requerida por el propietario del animal. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones del autor
JE y VP contribuyeron a la redacción del manuscrito y la revisión de la literatura. JE, MF, RV y VP contribuyeron para la necropsia y el examen histopatológico, la interpretación y la descripción de los resultados histopatológicos e inmunohistoquímicos. DG fue responsable del seguimiento del caso y de la presentación del animal a la necropsia. Todos los autores discutieron los resultados y comentaron el manuscrito.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Reconocimientos
Los autores desean agradecer la colaboración del personal del Departamento de Sanidad Animal de la Universidad de León y agradecerles su ayuda en los análisis de laboratorio, especialmente a Eva Martín de Valmaseda. Los autores agradecieron a la empresa Falco Iberia S.L. la derivación del halcón al Servicio de Diagnóstico Patológico de la Facultad de Ciencias Veterinarias de León. El apoyo técnico brindado por Marta Silva y Julio Benavides también fue agradecido. RV fue apoyado por un contrato predoctoral del Ministerio de Educación español. JE recibió un contrato postdoctoral Juan de la Cierva-Formación (FJC2019-042422-I) del Ministerio de Ciencia e Innovación.
Referencias
2. Petrak ML, Gilmore CE. Neoplasmas. En: Petrak ML, editor. Enfermedades de las aves de jaula y aviario. 2ª ed. Filadelfia: Lea & Febiger Londres: Bailiiere. Tindall y Cassell (1982). págs. 606–37.
3. Playa JE. Enfermedades de los periquitos y otras aves de jaula. Una encuesta de hallazgos postmortem. Veterinario Rec. (1962) 74:63–8.
4. Blackmore DK. El enfoque clínico de los tumores en aves de jaula: la patología y la incidencia de la neoplasia en aves de jaula. J Small Anim Pract. (1966) 7:217–23. doi: 10.1111/j.1748-5827.1966.tb04435.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Reavill DR. Tumores de aves de compañía. Veterinario Clin Exot Anim. (2004) 7:537–60. doi: 10.1016/j.cvex.2004.04.008
6. Castro PF, Fantoni DT, Miranda BC, Matera JM. Prevalencia de enfermedades neoplásicas en aves de compañía referidas para procedimientos quirúrgicos. Veterinario Med Int. (2016) 2016:1–7. DOI: 10.1155/2016/4096801
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Ratcliffe HL. Incidencia y naturaleza de los tumores en mamíferos y aves silvestres en cautiverio. Am J Cancer Res. (1933) 17:116–35. doi: 10.1158/ajc.1933.116
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Keymer IF. Enfermedades de las aves rapaces. Veterinario Rec. (1972) 90:579–94. DOI: 10.1136/VR.90.21.579
9. Reece RL. Observaciones sobre neoplasias naturales en aves en el estado de Victoria, Australia. Pathol aviar. (1992) 21:3–32. DOI: 10.1080/03079459208418815
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Effron M, Griner L, Benirschke K. Nature and rate of neoplasia found in captive wild mammals, birds, and reptiles at necropsy. J Natl Cancer Inst. (1977) 59:185–98. DOI: 10.1093/JNCI/59.1.185
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Forbes NS, Cooper JE, Higgins RJ. Neoplasias en aves rapaces. En: Lumeij JT, Remple JD, Redig PT, Lierz M, Cooper JE, editores. Raptor Biomedicina III. Lake Worth, Florida: Red de Educación Zoológica (2000). págs. 127–46.
12. Cooper JE. Aves rapaces: salud y enfermedad. 3ª ed. Oxford: Blackwell Science (2008). págs. 200–1.
13. Latimer KS. Oncología. En: Ritchie BW, Harrison GJ, Harrison LR, editores. Medicina Aviar: Principios y Aplicación. Lake Worth, Florida: Wingers Publishing (1994). págs. 640–72.
14. Wilting J, Aref Y, Huang R, Tomarev SI, Schweigerer L, Christ B, et al. Doble origen de los linfáticos aviares. Dev Biol. (2006) 292:165–73. doi: 10.1016/j.ydbio.2005.12.043
15. Dickinson JC. Vencejo de chimenea con linfangioma benigno. Alca. (1941) 58:581–81. doi: 10.2307/4078662
16. Hubbard GB, Schmidt RE, Fletcher KC. Neoplasia en animales de zoológico. J Zoo Anim Med. (1983) 14:33–40. DOI: 10.2307/20094627
18. Stambaugh JE, Harvey CE, Goldschmidt MH. Linfangioma en cuatro perros. J Am Vet Med Assoc. (1978) 173:759–61
19. Yamagami T, Takemura N, Washizu T, Komori S, Amasaki H, Washizu T. Linfangiomatosis hepática en un perro joven. J Vet Med Sci. (2002) 64:743–45. DOI: 10.1292/JVMS.64.743
20. Belanger MC, Mikaelian I, Girard, C, Daminet, S. Linfangiomas múltiples invasivos en un perro joven. J Am Anim Hosp Assoc. (1999) 35:507–9. doi: 10.5326/15473317-35-6-507
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Berry WL, Nesbit JW, Pearson J. Linfangiomatosis de la extremidad pélvica en un perro maltés. J Small Anim Pract. (1996) 37:340–43. doi: 10.1111/j.1748-5827.1996.tb02405.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Woods JP, Johnstone IB, Bienzle D, Balson G, Gartley CJ. Linfangioma concurrente, trombocitopenia inmunomediada y enfermedad de von Willebrand en un perro. J Am Anim Hosp Assoc. (1995) 31:70–6. doi: 10.5326/15473317-31-1-70
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Maeda S, Fujino Y, Tamamoto C, Suzuki S, Fujita A, Takahashi M, et al. Linfangiomatosis de la piel sistémica en un perro viejo. J Vet Med Sci. (2013) 75:187–90. DOI: 10.1292/JVMS.12-0321
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Oui H, Lamm C, Stiver S, William B, Know SY, Bae Y, et al. Linfangiomatosis congénita y un quiste de duplicación entérica en un perro joven. J Small Anim Pract. (2014) 55:379–82. DOI: 10.1111/JSAP.12208
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Ramírez GA, Sánchez-Salguero X, Molín J. Linfangioma quístico primario del bazo en un perro adulto. J Comp Pathol. (2020) 178:22–26. doi: 10.1016/j.jcpa.2020.06.006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Sato Y. Linfangioma pedunculado cutáneo en un perro. J Small Anim Pract. (2021). DOI: 10.1111/JSAP.13301. [Epub antes de imprimir].
27. Lawler DF, Evans RH. Linfangioma cavernoso hepático múltiple en un gato macho de edad avanzada. J Comp Pathol. (1993) 109:83–7. doi: 10.1016/S0021-9975(08)80242-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Santos S, Faísca P. Linfangioma cutáneo felino: informe del caso. RECIL. (2012) 5:73–6. Disponible en línea en: https://revistas.ulusofona.pt/index.php/rlcmv/article/view/3021
29. Mackenzie WI, Gardner FM. Comparación de neoplasias en seis fuentes de ratas. J Natl Cancer Inst. (1973) 50:1345. doi: 10.1093/jnci/50.5.1243
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Turk JR, Gallina AM, Liu IM. Linfangioma quístico en un potro. J Am Vet Med Assoc. (1979) 174:1228–30.
31. Gehlen H, Wohlsein P. Linfangioma cutáneo en una yegua joven de raza estándar. Veterinario equino J. (2000) 32:86–8. doi: 10.2746/042516400777612017
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Junginger J, Rötting A, Staszyk C, Kramer K, Hewicker-Trautwein M. Identification of equine cutaneous lymphangioma by application of a lymphatic endothelial cell marker. J Comp Pathol. (2010) 143:57–60. doi: 10.1016/j.jcpa.2009.11.005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Hoepp NC, Kim DY, Berent LM, Reed SK. ¿Cuál es su diagnóstico? Líquido que rodea una masa submandibular de un caballo. Veterinario Clin Pathol. (2013) 42:531–32. DOI: 10.1111/vcp.12078
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Savage VL, Cudmore LA, Russell CM, Railton DI, Begg AP, Collins NM, et al. Linfangiomatosis quística intraabdominal en un potro pura sangre. Veterinario Equino Educ. (2018) 30:403–8. doi: 10.1111/eve.12685
35. King CS, Streett JW, Brownstein DG. Linfangioma cavernoso en un mono ardilla. Laboratorio Anim. Sci. (1993) 43:252–54.
36. Brown P, Smith K, Bazely K, Glover M, Barr F. Bilateral lymphangiomatous testicular lesions in a lamb. Reprod Domest Anim. (2008) 43:246–48. doi: 10.1111/j.1439-0531.2006.00841.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Vincent AL, Porter DD, Ash LR. Lesiones espontáneas y parásitos del jerbo mongol, Meriones unguiculatus. Lab Anim Sci. (1975) 25:711–22.
38. Sós E, Molnár V, Gál J, Németh A, Perge E, Lajos Z, et al. Tiflitis y linfangiomatosis quística abdominal en una rata topo ciega del Monte Carmelo (Nannospalax (ehrenbergi) carmeli). J Zoo Wildl Med. (2012) 43:416–20. doi: 10.1638/2011-0201.1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Kumar RS, Veena P, Devarathnam J, Amaravati P, Sudarshan LS. Manejo quirúrgico de un caso raro de linfangioma escrotal en toro ongole. J Adv Vet Res. (2014) 4:85–7.
40. Romanucci M, Arbuatti A, Defourny SVP, Della Salda L. Deformidades físicas congénitas múltiples, compatibles con la vida en asociación con linfangiomatosis esplénica en el tequila Zoogoneticus (Webb & Miller, 1998). J Coast Life Med. (2017) 5:1–3. doi: 10.12980/jclm.5.2017J6-280
41. Chute HL, Chamberlain DM. Linfangioma en el venado de cola blanca, Odocoileus virginianus. J Mamífero. (1956) 37:552–54. doi: 10.2307/1376664
42. Faul JL, Berry GJ, Colby TV, Ruoss SJ, Walter MB, Rosen GD, et al. Linfangiomas torácicos, linfangiectasia, linfangiomatosis y síndrome de displasia linfática. Am J Respir Crit Care Med. (2000) 161:1037–46. doi: 10.1164/ajrccm.161.3.9904056
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Blei F. Linfangiomatosis: resumen clínico. Linfmata Res Biol. (2011) 9:185–90. DOI: 10.1089/LRB.2011.0020
44. Mentzel T, Kutzner H. Tumores del vaso linfático de la piel y tejidos blandos. Der Pathologe. (2002) 23:118–27. DOI: 10.1007/S00292-001-0498-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Weiss SW, Goldblum JR, Enzinger FM. Tumores de vasos linfáticos. En: Weiss SW, Goldblum JR, editores. Tumores de tejidos blandos de Enzinger y Weiss. 4ª ed. Filadelfia, PA, EE.UU.: Elsevier Health Sciences (2001). págs. 966–9.
46. Perkins JA, Manning SC, Tempero RM, Cunningham MJ, Edmonds JL Jr., Hoffer FA, et al. Malformaciones linfáticas: investigaciones celulares y clínicas actuales. Otorrinolaringol Cabeza Cuello Quirúrgico. (2010) 142:789–94. doi: 10.1016/j.otohns.2010.02.025
Resumen de PubMed | Texto completo de CrossRef | Google Académico
47. Zheng W, Aspelund A, Alitalo K. Factores linfáticos, mecanismos y aplicaciones. J Clin Invest. (2014) 124:878–87. doi: 10.1172/JCI71603
48. Wiegand S, Eivazi B, Barth PJ, Von Rautenfeld DB, Folz BJ, Mandic R, et al. Patogénesis de los linfangiomas. Arco de Virchows. (2008). 453:1–8. DOI: 10.1007/S00428-008-0611-Z
49. Rockson SG. Causas y consecuencias de la enfermedad linfática. Ann N y Acad Sci. (2010) 1207:E2–6. doi: 10.1111/j.1749-6632.2010.05804.x
50. Carlson KC, Parnassus WN, Klatt EC. Linfangiomatosis torácica. Archiv Pathol Lab Med. (1987) 111:475–77.
51. Jones MP. Enfermedades vasculares en aves rapaces. J Exot Pet Med. (2013). 22:348–57. doi: 10.1053/j.jepm.2013.10.012
52. Bavelaar FJ, Beynen AC. Atherosclerosis in parrots. Una revisión. Veterinario Q. (2004) 26:50–60. doi: 10.1080/01652176.2004.9695168
Resumen de PubMed | Texto completo de CrossRef | Google Académico
53. Byers PH. Trastornos de la biosíntesis y estructura del colágeno. En: Scriver CR, Beaudet al, Sly WS, Valle D, editores. Las bases metabólicas y moleculares de la enfermedad hereditaria. 7ª ed. Nueva York, NY: McGraw-Hill (1995). p. 4029–77.
54. Mitchell RN, Halushka MK. Vasos sanguíneos. En: Cotran RS, Kumar V, Robbin SL, Schoen FJ, editores. Bases patológicas de la enfermedad. Filadelfia, PA: ELSEVIER. (2020). págs. 485–27.
55. Nagata H, Yonemura Y, Canbay E, Ishibashi H, Narita M, Mike M, et al. Diferenciación de un gran linfangioma quístico abdominal del mesotelioma multiquístico: informe de un caso. Sur Hoy. (2014) 44:1367–70. DOI: 10.1007/S00595-013-0654-X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
56. Rossi G, Galosi L, Berardi S, Piano MA, Robino P, Rose T, et al. Neck Kaposiform haemangioendothelioma in a Fischer’s agapornis fischeri. Res Vet Sci. (2016) 106:112–5. doi: 10.1016/j.rvsc.2016.03.018
Resumen de PubMed | Texto completo de CrossRef | Google Académico
57. Wigle JT, Harvey N, Detmar M, Lagutina I, Grosveld G, Gunn MD, et al. Un papel esencial para Prox1 en la inducción del fenotipo de células endoteliales linfáticas. EMBO J. (2002) 21:1505–13. doi: 10.1093/emboj/21.7.1505
Resumen de PubMed | Texto completo de CrossRef | Google Académico
58. Kato S, Shimoda H, Ji RC, Miura M. Linfangiogénesis y expresión de moléculas específicas como marcadores de células endoteliales linfáticas. Anat Sci Int. (2006) 81:71–83. doi: 10.1111/j.1447-073X.2006.00142.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
59. Álvarez-Hernán G, Hernández-Núñez I, Rico-Leo EM, Marzal A, de Mera-Rodríguez JA, Rodríguez-León J, et al. Diferenciación retiniana en una especie de ave altricial, Taeniopygia guttata: un estudio inmunohistoquímico. Exp Eye Res. (2020) 190:107869. doi: 10.1016/j.exer.2019.107869
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Cita: Espinosa J, Ferreras MC, García D, Vallejo R y Pérez V (2021) Case Report: Multiple Cavernous Pericardial Lymphangioma (Pericardial Lymphangiomatosis) in a Captive Peregrine Falcon (Falco peregrinus brookei). Frente. Vet. Sci. 8:662157. DOI: 10.3389/FVETS.2021.662157
Recibido: 31 de enero de 2021; Aprobado: 15 de marzo de 2021;
Publicado: 14 de abril de 2021.
Editado por:
Gustavo A. Ramírez Rivero, Universitat de Lleida, España
Revisado por:
Alejandro Suarez-Bonnet, Royal Veterinary College (RVC), Reino Unido
Valeria Grieco, Universidad de Milán, Italia
Copyright © 2021 Espinosa, Ferreras, García, Vallejo y Pérez. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Valentín Pérez, valentin.perez@unileon.es
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

